Соединение антрапиридона и композиция пурпурных чернил на водной основе - RU2281944C2
Код документа: RU2281944C2
Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новому соединению класса антрапиридонов и к композиции пурпурных чернил на водной основе.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Для способа печати с использованием струйного принтера были разработаны разнообразные способы впрыскивания чернил, и любой из этих способов включает образование капелек чернил с целью осаждения их на различных регистрирующих материалах (таких как бумага, пленка, ткань) для печати. Способ печати с использованием струйного принтера быстро распространялся в последние годы и будет распространяться и в будущем, поскольку при этом способе не возникает механического шума благодаря использованию системы, в которой регистрирующая головка не контактирует с регистрирующим материалом, и поскольку этот способ имеет преимущества, состоящие в том, что принтер имеет меньшие размеры, работает с высокой скоростью и легко обеспечивает цветную печать. Для печати при помощи струйного принтера изобразительной или символьной информации, представленной в цвете на цветном дисплее компьютера, информацию обычно печатают в соответствии с субтрактивным смешением цветов чернилами четырех первичных цветов, а именно - желтого (Ж), пурпурного (П), голубого (Г) и черного (Ч). Чтобы изображение, представленное на ЭЛТ-дисплее (электронно-лучевой трубке) посредством аддитивного смешения таких цветов, как красный (К), зеленый (3), синий (С), было воспроизводимо и как более точно печаталось с использованием субтрактивного смешения цветов, желательно, чтобы используемые красители, особенно красители для Ж, П и Г чернил, имели цветовые тона, близкие к соответствующим стандартам Ж, П и Г цветов и яркости. Кроме того, необходимо, чтобы результирующая композиция чернил была стабильна при длительном хранении, и чтобы результирующее печатное изображение имело высокую оптическую плотность и превосходную устойчивость, в том числе водостойкость, светостойкость, газостойкость и т.д.
Струйные принтеры все шире используются в широком ассортименте - от небольших, предназначенных для автоматизации конторского труда, до больших, предназначенных для промышленного использования. Поэтому предъявляются все более жесткие требования к стойкости печатного изображения, прежде всего - к водостойкости и светостойкости. Водостойкость значительно повышается при нанесении на лист бумаги совместно с ПВА-смолой неорганических микрочастиц, таких как пористый диоксид кремния, катионный полимер, золь оксида алюминия или особые керамики, которые могут адсорбировать краситель из чернил. Для сохранения печатных материалов, таких как фотографии, в хорошем состоянии желательно дополнительное улучшение качества, например - влагостойкость. Однако светостойкость еще не была повышена путем использования всех общепринятых процедур. Среди тетрахроматических цветов - Ж, П, Г и Ч - существует особенно много красителей пурпурного цвета, которые по своей природе имеют слабую светостойкость, и повышение ее является важной проблемой, требующей решения.
Типичными видами химической структуры пурпурных красителей, используемых в водорастворимых чернилах для струйной печати, являются структуры ксантенового типа, описанные в выложенных патентных заявках JP №89811/1979, JP №60053/1996 и JP №143798/1996, и структуры азо-типа с Н-кислотой, описанные в выложенных патентных заявках JP №62652/1986, JP №156168/1987, JP №203970/1991, JP №157698/1995 и в патенте JP №78190/1995. Ксантеновый тип, несомненно, превосходен с точки зрения цветового тона и яркости, но имеет очень плохую светостойкость. Азо-тип с Н-кислотой хорош с точки зрения цветового тона и водостойкости, но имеет плохую светостойкость и яркость. Например, как описано в выложенной патентной заявке JP №203970/1991, были разработаны некоторые пурпурные красители этого типа, превосходные с точки зрения яркости и светостойкости, но все еще уступающие по светостойкости красителям других оттенков, например - желтым красителям и голубым красителям, представленным соединениями типа фталоцианина меди.
В последнее время широкое распространение получили цифровые фотокамеры, растет вероятность печати фотографий в домашних условиях. Однако существует проблема изменения цвета фотографий во время хранения из-за присутствия в воздухе газа-окислителя.
Альтернативно для получения пурпурных красителей, превосходных с точки зрения яркости и светостойкости, была предложена химическая структура антрапиридонового типа, описанная в выложенных патентных заявках JP №74173/1984, JP №16171/1990, JP №109464/2000, JP №169776/200, но она еще не проявила удовлетворительных свойств в отношении оттенка, яркости, светостойкости, водостойкости, газостойкости и стабильности в растворах.
Задачей настоящего изобретения является создание пурпурных чернил, имеющих оттенок и яркость, подходящие для струйной печати, и позволяющих получить печатное изображение с высокой устойчивостью, а именно - светостойкостью, газостойкостью и влагостойкостью, и подходящего для таких чернил красителя.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Для решения поставленной задачи авторы настоящего изобретения провели тщательное исследование, в результате которого оно было создано. А именно, настоящее изобретение состоит в следующем.
(1) Новое антрапиридоновое соединение (соединение класса антрапиридонов), представленное следующей формулой (14):
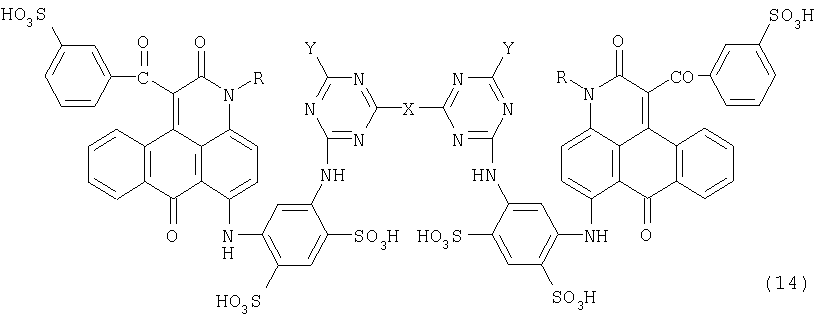
где R обозначает атом водорода, алкильную группу, низшую гидроксиалкильную группу, циклогексильную группу, моно- или диалкиламиноалкильную группу или низшую цианалкильную группу;
Y обозначает атом хлора, гидроксильную группу, аминогруппу, моно- или диалкиламиногруппу (которая может быть замещена заместителем, выбранным из группы, состоящей из сульфокислотной группы, карбоксильной группы и гидроксильной группы, на алкильной группе), аралкиламиногруппу, циклоалкиламиногруппу, алкоксигруппу, феноксигруппу (которая может быть замещена заместителем, выбранным из группы, состоящей из сульфокислотной группы, карбоксильной группы, ацетиламиногруппы, аминогруппы и гидроксильной группы, на бензольном кольце), анилиновую группу (которая может быть замещена одним или двумя заместителями, выбранными из группы, состоящей из сульфокислотной группы и карбоксильной группы), нафтиламиногруппу (где нафтильная группа может быть замещена сульфокислотной группой) или моно- или диалкиламиноалкиламиногруппу;
Х обозначает соединительную группу;
или его соль;
(2) Новое антрапиридоновое соединение, представленное следующей формулой (1):

где R и Y обозначают то же, что указано для приведенной выше формулы (14);
или его соль;
(3) Новое антрапиридоновое соединение, представленное следующей формулой (15):
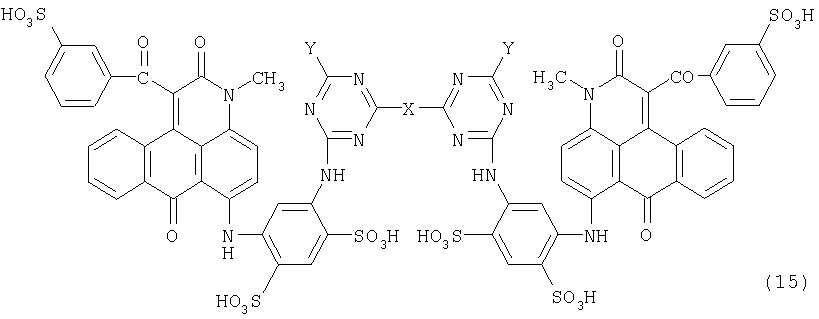
где Y обозначает атом хлора, гидроксильную группу, аминогруппу, алкиламиногруппу, диалкиламиногруппу, аралкиламиногруппу, цикпоалкиламиногруппу, алкоксигруппу, феноксигруппу (которая может быть замещена заместителем, выбранным из группы, состоящей из сульфокислотной группы, карбоксильной группы, ацетиламиногруппы, аминогруппы и гидроксильной группы), сульфокислотную группу, моно- или диалкиламиногруппу, имеющую карбоксильную группу или гидроксильную группу, анилиновую группу (которая может быть замещена одним или двумя заместителями, выбранными из группы, состоящей из сульфокислотной группы и карбоксильной группы), нафтиламиногруппу (где нафтильная группа может быть замещена сульфокислотной группой) или моно- или диалкиламиноалкиламиногруппу;
Х обозначает соединительную группу;
или его соль;
(4) Новое антрапиридоновое соединение по приведенному выше пункту (3), представленное следующей формулой (2):

где Y обозначает то же, что указано для приведенной выше формулы (15);
или его соль;
(5) Новое антрапиридоновое соединение или его соль по любому из приведенных выше пунктов (1)-(4), где Y является гидроксильной группой или аминогруппой;
(6) Новое антрапиридоновое соединение или его соль по любому из приведенных выше пунктов (1)-(4), где Y является аминогруппой;
(7) Новое антрапиридоновое соединение или его соль по любому из приведенных выше пунктов (1)-(4), где Y является аминогруппой, а соединительная группа Х является диаминоалкиленовой группой;
(8) Новое антрапиридоновое соединение или его соль по любому из приведенных выше пунктов (1)-(4), где Y является аминогруппой, а соединительная группа Х является диаминофениленовой группой, которая может быть замещена;
(9) Новое антрапиридоновое соединение или его соль по любому из приведенных выше пунктов (1)-(4), где Y является атомом хлора или аминогруппой, а соединительная группа Х является диаминодициклогексилметановой группой, которая может иметь заместитель на циклогексильном кольце;
(10) Новое антрапиридоновое соединение, представленное следующей формулой (3):

или его соль;
(11) Новое антрапиридоновое соединение, представленное следующей формулой (4):

или его соль;
(12) Новое антрапиридоновое соединение, представленное следующей формулой (5):

или его соль;
(13) Новое антрапиридоновое соединение, представленное следующей формулой (16):

или его соль;
(14) Новое антрапиридоновое соединение, представленное следующей формулой (17):

или его соль;
(15) Композиция пурпурных чернил на водной основе, отличающаяся тем, что она содержит в качестве красителя антрапиридоновое соединение или его соль согласно любому из приведенных выше пунктов (1)-(14);
(16) Композиция пурпурных чернил на водной основе согласно приведенному выше пункту (15), содержащая водорастворимый органический растворитель;
(17) Композиция пурпурных чернил на водной основе согласно любому из приведенных выше пунктов (15) или (16), содержащая неорганическую соль в количестве 1 мас.% или менее;
(18) Композиция пурпурных чернил на водной основе согласно любому из приведенных выше пунктов (15)-(17), которая предназначена для струйной печати;
(19) Способ струйной печати, характеризующийся тем, что в качестве чернил используется композиция пурпурных чернил на водной основе согласно любому из приведенных выше пунктов (15)-(18), в котором капли чернил выбрасываются в ответ на сигналы регистратора для печати на регистрирующем материале;
(20) Способ струйной печати согласно приведенному выше пункту (19), в котором регистрирующим материалом является лист для передачи информации;
(21) Контейнер, содержащий композицию пурпурных чернил на водной основе согласно любому из приведенных выше пунктов (15)-(18);
(22) Струйный принтер, содержащий контейнер согласно приведенному выше пункту(21);
(23) Окрашенное изделие, содержащее антрапиридоновое соединение или его соль согласно любому из приведенных выше пунктов (1)-(14);
(24) Антрапиридоновое соединение, представленное формулой (6):
где R обозначает то же, что указано для формулы (1),

(25) Композиция пурпурных чернил на водной основе согласно приведенному выше пункту (15), отличающаяся тем, что указанная композиция содержит неорганическую соль, имеет содержание красителя, равное 1 мас.% или меньшее, и, кроме того, содержит водорастворимый органический растворитель;
(26) Антрапиридоновое соединение или его соль согласно любому из приведенных выше пунктов (1)-(4), в котором соединительная группа Х отображается формулами:
-N(H)m(-A-)n N(H)n,- или -O-А-О-,
где А является двухвалентным углеводородным остатком, содержащим от 1 до 20 атомов углерода и, необязательно, содержащим атом азота, атом кислорода или атом серы;
n означает число, равное 1 или 2;
m означает число, равное 1 или 0, причем если n равно 1, m равно 1; если n равно 2, m равно 0.
СВЕДЕНИЯ. ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ
ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Новое антрапиридоновое соединение согласно настоящему изобретению представлено приведенной выше формулой (14). Характерным примером такого соединения является соединение, представленное приведенной выше формулой (1).
При использовании в данной работе термин «алкил» означает то, что обычно определяется как «алкил» без каких-либо ограничений. Предпочтительно он включает, если специально не указано иное, алкильную группу, содержащую от 1 до 10 атомов углерода, более предпочтительно он включает низшую алкильную группу, содержащую от 1 до 4 атомов углерода. В случае алкоксильной группы и аралкильной группы термин «алкил» означает то же самое.
Примеры алкильной группы для радикала R в формуле (14), (1) и тому подобных включают (С1-С4)-алкильные группы, например - метильную, этильную, n-пропильную и n-бутильную. Примеры алкильной группы для низшей гидроксиалкильной группы и низшей цианалкильной группы в радикале R включают этильную группу и пропильную группу, предпочтительно - этильную группу. Примеры алкиламиногруппы для радикала Y включают (С1-С8)-алкиламиногруппу, например - метиламиногруппу, этиламиногруппу, бутиламиногруппу и 2-этилгексиламиногруппу. Примеры диалкиламиногруппы включают (С1-С8)-диалкиламиногруппу, например - диэтиламиногруппу, дибутиламиногруппу и дигексиламиногруппу. Примеры аралкиламиногруппы включают фенил-(С1-С6)-алкиламиногруппу, например - бензиламиногруппу, фенэтиламиногруппу и фенилпропиламиногруппу. Примеры циклоалкиламиногруппы включают цикло(С5-С7)алкиламиногруппу, например - цикпогексиламиногруппу и циклопентиламиногруппу. Примеры алкоксигруппы включают (С1-С4)-алкоксигруппу, например - метоксигруппу, этоксигруппу, п-пропоксигруппу, изопропоксигруппу и бутоксигруппу. Примеры алкильной группы в алкиламиногруппе, содержащей сульфокислотную группу или карбоксильную группу, включают (С1-С4)-алкильную группу, например - метильную группу, этильную группу, п-пропильную группу и n-бутильную группу.
В радикале Y примеры феноксигрупп, которые могут быть замещены заместителем, выбранным из группы, состоящей из сульфокислотной группы, карбоксильной группы, ацетиламиногруппы, аминогруппы и гидроксильной группы, включают, например, 4-сульфофеноксигруппу, 4-карбоксифеноксигруппу, 4-ацетиламинофеноксигруппу, 4-аминофеноксигруппу и 4-гидроксифеноксигруппу.
В радикале Y примеры алкиламиногруппы, содержащей сульфокислотную группу или карбоксигруппу, включают 2-сульфоэтиламиногруппу, карбоксиметиламиногруппу, 2-карбоксиэтиламиногруппу, 1-карбоксиэтиламиногруппу, 1,2-дикарбоксиэтиламиногруппу или ди(карбоксиметил)аминогруппу. Примеры алкиламиногруппы, содержащей гидроксильную группу, включают, например, гидроксиэтиламиногруппу и дигидроксиэтиламиногруппу.
В радикале Y примеры анилиновой группы, которая может быть замещена одним или двумя заместителями, выбранными из группы, состоящей из сульфокислотной группы и карбоксильной группы, включают, например, 2, 5-дисульфоанилиногруппу, 3-сульфоанилиногруппу, 2-сульфоанилиногруппу, 4-сульфоанилиногруппу, 2-карбокси-4-сульфоанилиногруппу и 2-карбокси-5-сульфоанилиногруппу.
В радикале Y примеры нафтиламиногруппы, которая может быть замещена сульфокислотной группой, включают, например, 3,6,8-трисульфо-1-нафтиламиногруппу, 4,6,8-трисульфо-2-нафтиламиногруппу, 3,6, 8-трисульфо-2-нафтиламиногруппу и 4,8-дисульфо-2-нафтиламиногруппу.
Соединительная группа Х является двухвалентной группой, содержащей атом азота или атом кислорода в качестве участков связывания на обоих концах С1-С20-углеводородного остатка, который может содержать атом азота, атом кислорода или атом серы. Примеры такой группы включают группу, отображаемую формулами -N(H)m(-A-)nN(H)m- или -O-А-О-,
где А - двухвалентный углеводородный остаток, содержащий от 1 до 20 атомов углерода, который может содержать атом азота, атом кислорода или атом серы; n означает число, равное 1 или 2; m означает число, равное 0 или 1; если n равно 1, m равно 1; если п равно 2, m равно 0.
Примеры указанных двухвалентных углеводородных остатков, содержащих от 1 до 20 атомов углерода, включают:
двухвалентную алифатическую группу, содержащую от 1 до 15 атомов углерода и, по выбору, содержащую от 1 до 2 гетероатомов, таких как атом азота, атом кислорода или атом серы;
двухвалентную ароматическую группу, содержащую от 3 до 10 атомов углерода, предпочтительно содержащую от 5 до 10 атомов углерода, и, по выбору, содержащую от 1 до 3 гетероатомов, таких как атом азота, атом кислорода или атом серы; и
двухвалентную группу, образованную путем объединения указанных алифатической и ароматической групп.
Такие группы могут по выбору включать заместители, например - сульфокислотную группу, карбоксильную группу, аминогруппу и низшую алкильную группу, если указанный остаток является ароматической группой.
Примеры указанных алифатических групп включают C1-C6-полиметилены, которые могут быть замещены низшими алкильными группами, например - метилен, диметилен (этилен), триметилен (пропилен), 2-метилтриметилен (2-метилпропилен), тетраметилен (бутилен) и гексаметилен; C5 -C7 циклоалкилены, например - циклопентан-1,2- или 1,3-диил, циклогексан-1,2-, -1,3- или -1,4-диил и циклопентандиил; алифатические группы, состоящие из низшей алкиленовой группы и С5-С7 алифатического кольца (по выбору замещенного низшими алкильными группами), например - метиленциклогексан-1,4-диилметилен (-CH2-С6Н10-СН2-), метилендициклогександиил (-С6Н10-CH2-С6Н10-), метиленбис(метилциклогександиил) {-С6Н10(СН3)-СН2-С6Н10(СН3)-} и циклогександиилдиметилен (-СН2-С6Н10-СН2-); и C1-C7 алифатические группы, содержащие гетероатомы, например - метиленоксиметилен (-СН2-O-СН2-), бис(диметилен)аминогруппа (-C2H4-NH-C2H4-), метилентиометилен (-CH2-S-CH2-) и оксидициклогександиил (-С6Н10-О-С6Н10-).
Примеры двухвалентных ароматических групп могут включать ароматические группы, содержащие от 6 до 10 атомов углерода, например - фенилен (-C6H4-), нафтилен (-С10Н6-).
Двухвалентные группы, образованные посредством комбинации вышеописанных алифатических и ароматических групп, могут включать, например, ксилилен (-СН2-С6Н14-СН2-).
Более предпочтительные примеры указанных остатков А включают диметилен, гексаметилен, 1,3-ксилилен, метилендицикпогексан-4,1-диил, метиленбис(2-метилциклогексан-4,1-диил) и циклогексан-1, 3-диил-диметилен.
Примеры соединительной группы Х включают диаминоалкиленовую группу, например - 1,2-диаминоэтиленовую группу (-NH-CH2-CH2-NH-), 1, 4-диаминобутиленовую группу (-NH-C4H8-NH-) и 1,6-диаминогексиленовую группу (-NH-C6H12-NH-); диаминофениленовую группу, например - 1,4-пиперазиндиильную группу (-NC4Н8N-), 1,4-диаминофениленовую группу (-NH-C6H4-p-NH-) и 1,3-диаминофениленовую группу (-NH-C6H4-m-NH-); замещенную диаминофениленовую группу, например - 4-сульфо-1,3-диаминофениленовую группу {-NH-С6H4(р-SO3Н)-m-NH-} и 5-карбокси-1,3-диаминофениленовую группу; 1, 3-диаминоксилиленовую группу (-NH-СН2-С6Н4-m-СН2-NH-); 1,4-диаминоксилиленовую группу (-NH-CH2-C6H4-p-CH2-NH-); 4,4'-диамино-2-сульфо-дифениламиногруппу {-NH-С6Н4(m-SO3Н)-NH-C6H4-p-NH-}; 4,4'-диаминодициклогексилметановую группу (-NH-С6Н10-4-СН2-С6Н10-4'-NH-); 4,4'-диамино-3,3'-диметилдициклогексилметановую группу {-NH-С6Н10(З-СН3)-4-CH2-C6 H10(3'-CH3)-4'-NH-}; 1,3-бис(аминометил)циклогексановую группу (-NH-CH2-C6H10-3-CH2-NH-); диоксизамещенную алкиленовую группу, например - диоксиэтиленовую группу (-O-СН2-СН2-O-), 1,4-диоксибутиленовую группу (-O-С4Н8-O-), 2,2'-диоксиэтилэфирную группу (-O-СН2-СН2-O-СН2-СН2-O-); 1,4-диоксифениленовую группу (-O-С6Н4-р-O-); 1,3-диоксифениленовую группу (-O-С6Н4-m-O-); 4, 4'-диоксифенилэфирную группу (-O-С6Н4-р-O-С6Н4-р-O-); 4,4'-диоксифенилентиоэфирную группу (-O-C6H4-p-S-C6H4 -p-O-); 2,5- и 2,6-норборнандиаминогруппы; 1,4-диоксиметилциклогексиленовую группу (-O-СН2-С6Н10-4-СН2-O-) и подобные. Кроме того, примеры групп, отображаемых формулой -N(H)m(-A-)nN(H)m-, где n=2, a m=0, включают, например, указанный 1,4-пиперазиндиил (-NC4Н8N-).
Примерами предпочтительных комбинаций R, Y и Х являются, например, такие, где R является атомом водорода или метильной группой; Y является атомом хлора, гидроксильной группой или аминогруппой; Х является диаминоэтиленовой группой, 1,4-пиперазиндиильной группой, 1,3-диаминоксилиленовой группой, 4,4'-диаминоциклогексилметановой группой, 4,4'-диамино-3,3'-диметилдициклогексил-метановой группой, 1, 3-бис(аминометил)циклогексановой группой или подобными.
Примеры новых антрапиридоновых соединений согласно настоящему изобретению, представленных приведенной выше формулой (1), приведены в Таблице 1. В Таблице 1 диаминоэтилен означает 1,2-диаминоэтиленовую группу (-NH-CH2CH2-NH-). Ph обозначает фенильную группу. Аналогично, например, PhO обозначает феноксигруппу, NHPh обозначает анилиновую группу и т.д. NHPh(p-SO3H) обозначает 4-сульфоанилиногруппу (р-SO3Н означает, что сульфокислота присутствует на фенильной группе в пара-положении), NHPh(COOH)2(3,5) обозначает 3,5-дикарбоксианилиногруппу, где Ph(COOH)2(3,5) означает, что фенильная группа замещена карбоксильными группами в положениях 3 и 5; таким же образом изображены другие группы. Нафтил означает нафтильную группу, NH-2нафтил(SO3Н)3(3,6,8) означает 3,6,8-трисульфо-2-нафтиламиногруппу, NH(циклогексил) означает циклогексиламиногруппу.
Чтобы получить соединение, представленное формулой (1), имеющее аминогруппы на обоих концах соединительной группы X, проводили реакцию 2 молей соединения, представленного формулой (6), с 2-2,4 молями 2,4,6-трихлор-S-триазина (хлористого цианурина) в воде при рН 3-7 при 5-35°С в течение 2-8 часов с получением первого конденсата, представленного формулой (7):

после чего проводили реакцию этого конденсата с 1 молем диаминового соединения, имеющего приведенную ниже формулу (8):

где А является соединительной группой, такой как двухвалентный C1-C20углеводородный остаток, который может содержать атом азота, атом кислорода или атом серы; n равно 1 или 2, m равно 1 или 0; если n равно 1, m равно 1; если n равно 2, m равно 0; предпочтительные примеры А включают C1-C6 полиметилен, который может быть замещен следующими заместителями: фенилен, ксилилен, метилендициклогександиил, метилен-бис(метилциклогександиил) и циклогександиил-диметилен, более предпочтительно - диметилен, гексаметилен, 1,3-ксилилен, метилендициклогексан-4,1-диил, метиленбис(2-метилциклогексан)-4,1-диил, циклогексан-1,3-диил-диметилен;
при рН 4-10 при 5-90°С в течение от 10 минут до 5 часов с получением второго конденсата, представленного формулой (9), где Y является атомом хлора, а обе стороны соединительной группы Х являются аминогруппами.

Кроме того, можно получить соединение, в котором группа -NH-A-NH- из формулы (9) заменена на группу -N(-A-)2N-, если использовать соединение, представленное формулой HN(-A-)2NH (в формуле (8) n=2, m=0), например - пиперидин. Далее либо гидролизовали второй конденсат при рН 9-12 при 70-90°С в течение 1-5 часов, либо проводили его реакцию с аммиаком, соответствующими аминами, фонолами, нафтолами или спиртами, например - метанолом, при рН 8-10 и при 90-100° С в течение 3-8 часов с получением третьего конденсата, представленного формулой (10), где радикал Y отличался от атома хлора.

Кроме того, можно получить соединение, в котором группа -NH-A-NH- из формулы (10) заменена на группу -N(-А-)2N-; если использовать соединение, представленное формулой HN(-А-)2NH в формуле (8). Порядок конденсации можно определить в зависимости от реакционной способности родственных соединений, и он не ограничен приведенным выше.
Предпочтительные примеры антрапиридоновых соединений согласно настоящему изобретению, представленных приведенной выше формулой (10), включая соединения, многие из которых уже показаны в Таблице 1, показаны в Таблице 1а.
Вместо диаминового соединения с приведенной выше формулой (8) стандартной реакции конденсации подвергали гликолевое соединение, представленное следующей формулой:
НО-А-ОН,
где А обозначает то же, что и выше, с получением соединения, в котором -NH-A-NH- в формуле (9) заменено на -O-А-О-. Таким же образом можно получить соединение, в котором соединительная группа -NH-A-NH- формулы (10) заменена на -O-А-О-.
Соединение, полученное таким образом, существует в виде свободной кислоты или ее соли. В настоящем изобретении может быть использована свободная кислота или ее соль. Соль может быть использована в виде соли щелочного металла, соли щелочно-земельного металла, соли алкиламина, соли алканоламина или соли аммония. Предпочтительные соли включают соли щелочных металлов, такие как соли натрия, соли калия и соли лития; соли алканоламинов, такие как соль моноэтаноламина, соль диэтаноламина, соль триэтаноламина, соль моноизопропаноламина, соль диизопропаноламина и соль триизопропаноламина, и соль аммония. Перед получением вещества добавляют, например, хлорид натрия к реакционному раствору указанного третьего конденсата и таким образом высаливают вещество, и фильтруют раствор с получением натриевой соли в виде влажного фильтровального осадка, который снова растворяют в воде с последующим добавлением хлористоводородной кислоты для доведения рН до 1-2. Осажденные кристаллы фильтруют с получением свободной кислоты (которая может частично содержать натриевую соль). При перемешивании свободной кислоты в виде влажного фильтровального осадка в воде добавляют, например, гидроокись калия, гидроокись лития или водный раствор аммиака для получения щелочного раствора с целью получения соответственно соли калия, соли лития или соли аммония.
Соединение с формулой (6) можно получить в ходе следующего процесса:
проводят реакцию 1 моля антрахинонового соединения, имеющего приведенную ниже формулу (11):

в которой R означает то же, что указано выше;
с 1,1-3 молями этилбензоилацетата в полярном растворителе, например - в ксилоле, в присутствии основного соединения, например - карбоната натрия, при 130-180°С в течение 5-15 часов с получением соединения со следующей формулой (12):

где R означает то же, что указано выше.
Затем проводят реакцию 1 моля соединения с формулой (12) с 1-5 молями метаминоацетанилида в непротонном полярном органическом растворителе, например - в N, N-диметилформамиде, в присутствии основания, например - карбоната натрия, и медного катализатора, например - ацетата меди, при 110-150°С в течение 2-6 часов в виде реакции Ульмана с получением конденсата, имеющего следующую формулу (13):

где R означает то же, что указано выше.
Соединение с формулой (13) последовательно сульфонируют и гидролизуют ацетиламиногруппу с целью удаления ацетильной группы с использованием 8-15% дымящей серной кислоты при 50-120°С с получением антрапиридонового соединения с общей формулой (6):

где R означает то же, что указано для формулы (1).
Композиция пурпурных чернил на водной основе согласно настоящему изобретению может быть получена посредством растворения соединения, представленного формулой (1) или (2), или его соли в воде или водном растворителе (содержащем воду водорастворимом органическом растворителе (включающем солюбилизатор), который будет описан позже). Предпочтительный рН чернил примерно равен 6-11. Для использования в струйном принтере предпочтительно использовать композицию чернил на водной основе, красящий компонент которой содержит как можно меньшее количество неорганического материала, например - хлоридов или сульфатов положительного иона металла. Например, общее содержание хлорида натрия и сульфата натрия в красящем компоненте составляет 1 мас.% или менее от общего количества красящего компонента. Чтобы получить красящий компонент согласно настоящему изобретению, содержащий малое количество неорганической соли, достаточно повторить обессоливающую обработку, например, традиционным способом, таким как мембранный обратный осмос, или посредством перемешивания сухого продукта или влажного фильтровального осадка согласно настоящему изобретению в растворителе, являющемся смесью метанола и воды, с последующим фильтрованием и сушкой.
Композицию чернил на водной основе согласно настоящему изобретению приготавливают с использованием воды в качестве среды, содержащей соединение согласно настоящему изобретению или его соль, предпочтительно - в концентрации от 0,1 до 20 мас.%, более предпочтительно - от 1 до 10 мас.%, еще более предпочтительно - от 2 до 8 мас.%. Композиция чернил на водной основе согласно настоящему изобретению может также содержать водорастворимый органический растворитель в количестве 0-30 мас.% и регуляторы свойств чернил в количестве 0-5 мас.%. Остаток составляет вода.
Композицию чернил на водной основе согласно настоящему изобретению приготавливают путем добавления соединения согласно настоящему изобретению или его соли и, если это необходимо, водорастворимого органического растворителя и регуляторов свойств чернил в очищенную воду, например - в дистиллированную воду, и смешивания компонентов между собой. Альтернативно, соединение согласно настоящему изобретению или его соль можно добавить в смесь воды, указанного водорастворимого органического растворителя и регуляторов свойств чернил для растворения. Результирующую композицию чернил можно, если это необходимо, профильтровать для удаления из композиции загрязнений.
Подходящие водорастворимые органические растворители включают C1-C4алканолы, такие как метанол, этанол, пропанол, изопропанол, бутанол, изобутанол, вторичный бутанол и третичный бутанол; карбоксильные амиды, такие как N,N-диметилформамид и N,N-диметилацетамид; лактамы, такие как N-метилпирролидин-2-он; циклические производные мочевины, такие как 1,3-диметилимидазолидин-2-он или 1,3-диметилгексагидропиримид-2-он; кетоны или кетоспирты, такие как ацетон, метилэтилкетон и 2-метил-2-гидроксипентан-4-он; простые эфиры, такие как тетрагидрофуран и диоксан; моно-, олиго- или полиалкиленгликоли или тиогликоли, содержащие С2-С6 алкиленовые мономеры, такие как этиленгликоль, 1,2- или 1,3-пропиленгликоль, 1,2- или 1, 4-бутиленгликоль, 1,6-гексиленгликоль, диэтиленгликоль, триэтиленгликоль, дипропиленгликоль, тиодигликоль, полиэтиленгликоль и полипропиленгликоль; полиолы (триолы), такие как глицерин и гексан-1,2, 6-триол; C1-C4 алкиловые эфиры многоатомных спиртов, такие как монометиловый эфир этиленгликоля, моноэтиловый эфир этиленгликоля, монометиловый эфир диэтиленгликоля, моноэтиловый эфир диэтиленгликоля, монометиловый эфир триэтиленгликоля, моноэтиловый эфир триэтиленгликоля; у-бутиролактон и диметилсульфоксид. Эти органические растворители могут быть использованы в комбинациях по два или более.
Предпочтительные примеры органических растворителей, смешивающихся с водой, включают N-метилпирролидин-2-он и моно-, ди- или триалкиленгликоли, содержащие С2-С6 алкиленовые мономеры, более предпочтительно - моно-, ди- или триэтиленгликоль, дипропиленгликоль и диметилсульфоксид. Кроме того, предпочтительно используемыми являются N-метилпирролидин-2-он, диэтиленгликоль и диметилсульфоксид.
Регуляторы свойств чернил, которые используются для получения водного раствора, содержащего соединение согласно настоящему изобретению (красящий компонент), с желаемыми свойствами чернил, включают консервант, регулятор рН, хелатирующий агент, средство для профилактики ржавчины, водорастворимое вещество, поглощающее ультрафиолетовое излучение, водорастворимое полимерное соединение, средство для растворения красителя и поверхностно-активное вещество. Консерванты включают дегидроацетат натрия, сорбат натрия, 2-пиридинтиол-1-оксид натрия, бензоат натрия и пентахлорфенол натрия. Регуляторы рН включают любые вещества, которые могут регулировать рН чернил, предпочтительно - в диапазоне от 6 до 11, не оказывая неблагоприятного эффекта на приготовление чернил. Примерами являются алканоламины, такие как диэтаноламин и триэтаноламин; гидроокиси щелочных металлов, такие как гидроокись лития, гидроокись натрия и гидроокись калия; гидроокись аммония; или карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия и карбонат калия. Хелатирующие реагенты включают этилендиаминтетраацетат натрия, нитрилтриацетат натрия, гидроксиэтилендиаминтриацетат натрия, диэтилентриаминпентаацетат натрия и урамилдиацетат натрия. Средства для профилактики ржавчины включают кислые гипосульфитные соли, тиосульфат натрия, тиогликолят аммония, нитрит диизопропиламмония, тетранитрат пентаэритритола и нитрит дициклогексиламмония. Примеры растворителя красителя включают, например, ε-капролактам, мочевину и этиленкарбонат. Примеры поверхностно-активных веществ включают обычные анионные, катинонные и неионные поверхностно-активные вещества.
Регистрирующие материалы, используемые для струйной печати согласно настоящему изобретению, включают листы для передачи информации, например - бумагу, пленку, волокна и кожу. Предпочтительно, чтобы поверхность листа для передачи информации была обработана, а практически - чтобы на основной материал был нанесен слой, воспринимающий чернила. Слой, воспринимающий чернила, может быть получен, например, посредством импрегнирования или нанесения на указанный основной материал покрытия из катионного полимера или посредством нанесения мелких неорганических частиц, способных адсорбировать краситель из чернил, например - пористого диоксида кремния, золя оксида алюминия и специальной керамики, совместно с гидрофильным полимером, таким как поливиниловый спирт или поливинилпирролидон, на поверхность указанного основного материала. Листы, имеющие слой, воспринимающий чернила, обычно называют специальной бумагой (пленкой) для струйной печати или глянцевой бумагой (пленкой), и они имеются в продаже, например, под названием Pictorico (производства Asahi Glass КК), бумаги Color BJ, листовой фотопленки Color BJ Photofilm (производства Canon КК), специальной бумаги Color Image Jet (производства Sharp КК), специальной супертонкой глянцевой бумаги (производства Seiko Epson КК) и Pictafine (производства Hitachi Maxell КК). Конечно же, может быть использована и чистая бумага, не имеющая слоя, воспринимающего чернила.
Предпочтительными волокнами являются целлюлозное волокно или полиамидное волокно, например - нейлон, шелк и шерсть в виде нетканого материала или ткани. Композицию чернил согласно настоящему изобретению наносят, предпочтительно - с помощью струйного принтера, на волокно с последующей фиксацией влажной тепловой обработкой (например, при примерно 80-120°С) или сухой тепловой обработкой (например, при примерно 150-180°С), так что краситель может быть зафиксирован внутри волокна с получением окрашенного изделия, имеющего превосходное качество с точки зрения яркости, светостойкости и устойчивости к отмыванию.
Контейнер согласно настоящему изобретению удерживает указанную композицию пурпурных чернил на водной основе в контейнере. Струйный принтер согласно настоящему изобретению оборудован контейнером согласно настоящему изобретению, содержащим композицию пурпурных чернил на водной основе, на держателе для контейнера для чернил. Окрашенное изделие согласно настоящему изобретению окрашено новым антрапиридоновым соединением, представленным формулой (1) или (2), или его солью, предпочтительно - указанной композицией пурпурных чернил на водной основе.
Композиция чернил на водной основе согласно настоящему изобретению может дать яркий и почти идеальный пурпурный цвет, и поэтому, если она используется совместно с желтыми или голубыми чернилами, она может дать широкий диапазон цветовых тонов в видимом диапазоне. Кроме того, при использовании с существующими желтыми, голубыми или черными чернилами, обладающими превосходной светостойкостью и водостойкостью, композиция может дать печатный продукт с превосходным качеством с точки зрения светостойкости, водостойкости и газостойкости.
ОПИСАНИЕ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение будет описано ниже более подробно со ссылкой на Примеры. «Часть» и «%» в описании относятся к массе, если не указано иное.
Пример 1
(1) К 360 частям ксилола последовательно при перемешивании добавляли 94,8 частей соединения, представленного формулой (11) (R=CH3), 3,0 части карбоната натрия и 144,0 части этилбензоилацетата с последующим повышением температуры. Проводили реакцию в растворе при 140-150°С в течение 8 часов, образовавшиеся во время реакции этанол и воду удаляли посредством азеотропной перегонки с ксилолом для завершения реакции. Последовательно охлаждали осадок, добавляли 240 частей метанола, перемешивали при 30°С в течение 30 минут, фильтровали, промывали 360 частями метанола и сушили с получением 124,8 частей соединения с формулой (12) (R=СН3).
(2) К 300,0 частям N,N-диметилформамида последовательно при перемешивании добавляли 88,8 частей соединения с формулой (12) (R=СН3), 75,0 частей метаминоацетанилида, 24,0 части ацетата меди моногидрата и 12,8 частей карбоната натрия с последующим повышением температуры. Проводили реакцию в растворе при 120-130°С в течение 3 часов. Последовательно охлаждали до примерно 50°С, добавляли 120 частей метанола, перемешивали в течение 30 минут, фильтровали, промывали 500 частями метанола, затем промывали горячей водой при 80°С и сушили с получением 79,2 частей соединения с формулой (13) (R=CH3) в виде синевато-красных кристаллов.
(3) К 178,5 частям 96,6%-ной серной кислоты при перемешивании и водяном охлаждении добавляли 271,5 частей 26,5% дымящей серной кислоты для получения 450 частей 10%-ной дымящей серной кислоты. В течение 30 минут при водяном охлаждении добавляли 77,0 частей соединения с формулой (13) (R=CH3) с последующим повышением температуры. Проводили реакцию в растворе при 90-100°С в течение 2 часов. Затем к 1000 частям воды при температуре таяния льда добавляли полученный ранее сульфонированный раствор, поддерживая температуру смеси на уровне 40°С или ниже посредством добавления льда. Добавляли воду до получения 1500 частей раствора, затем фильтровали раствор с целью удаления нерастворимых веществ. К фильтрату добавляли горячую воду до получения 2250 частей раствора, затем добавляли 450 частей хлорида натрия при перемешивании в течение 2 часов при 50-60°С, а затем отфильтровывали кристаллический осадок. Полученный влажный фильтровальный осадок нагревали и перемешивали с 1500 частями метанола, затем нагревали с обратным холодильником в течение 1 часа. После охлаждения до 40°С раствор фильтровали, затем промывали 300 частями метанола и сушили с получением 93,0 частей соединения с формулой (6) (R=СНз) в виде красных кристаллов. (Степень чистоты 78,4% по результатам диазоанализа).
(4) К 100 частям воды при температуре таяния льда добавляли 0,3 части Lipal ОН (торговое название анионного поверхностно-активного вещества производства Lion KK) с получением раствора. К раствору добавляли 2,7 части хлористого цианурина, затем перемешивали в течение 30 мин. К раствору добавляли 11,9 частей соединения с формулой (6), полученного, как описано в предыдущем пункте (3) (чистота 78,4%), при 8-10°С, затем по каплям добавляли 10%-ный водный раствор гидроокиси натрия для поддержания рН, равного 3-4, в течение 4 часов при температуре 25-30°С для проведения первой реакции конденсации, затем фильтровали для удаления нерастворимого вещества с получением реакционного раствора, содержавшего соединение с формулой (7) (R=СН3).
(5) К реакционному раствору, полученному в соответствии с пунктом (4) выше и содержавшему соединение с формулой (7) (R=СН3), добавляли 0,4 части этилендиамина, после чего добавляли воду для получения 200 частей раствора с последующим повышением температуры и добавлением по каплям 10%-ного водного раствора гидроокиси натрия при 60-70°С для поддержания рН в диапазоне от 5,0 до 5,5 в течение 1 часа для проведения второй реакции конденсации с получением раствора, содержавшего соединение с формулой (9) (R=СН3, А = этиленовая группа).
(6) К реакционному раствору, полученному в соответствии с пунктом (5) выше и содержащему соединение с формулой (9) (R=СН3, А = этиленовая группа), добавляли 20 частей 28%-ного водного раствора аммиака с последующим повышением температуры. Проводили реакцию в растворе в течение 2 часов при 90-95°С. После завершения реакции добавляли воду до получения 300 частей реакционного раствора, в который добавляли концентрированную HCl, поддерживая температуру на уровне 50-55°С, для поддержания рН, равного 2, а затем добавляли 70 частей хлорида натрия и перемешивали при той же температуре. Через 1 час отфильтровывали кристаллы с получением соединения с формулой (10) (R=CH3, A = этиленовая группа, Y=NH2) в виде влажного красного фильтровального осадка.
(7) Влажный фильтровальный осадок, полученный в соответствии с вышеизложенным пунктом (6), добавляли к 250 частям метанола, затем нагревали до 60-65°С и перемешивали в течение 1 часа, фильтровали, промывали метанолом и сушили с получением 6,5 частей соединения с формулой (10) (R=CH3, A = этиленовая группа, Y=NH2) в виде красных кристаллов. λmax: 528,6 нм (в воде).
Пример 2
(1) К реакционному раствору, содержащему соединение с формулой (7) (R=СН3), полученное в соответствии с пунктами (1)-(4) Примера 1, добавляли 0,9 частей метаксилилендиамина, далее добавляли воду, доводя количество раствора до 200 частей, с последующим повышением температуры и добавлением по каплям 10%-ного водного раствора гидроокиси натрия при 50-60°С для поддержания рН в диапазоне от 5,7 до 6,3 в течение часа для проведения второй реакции конденсации с получением раствора, содержащего соединение с формулой (9) (R=СН3, А = метаксилиленовая группа).
(2) К реакционному раствору, полученному в соответствии с пунктом (1) выше, добавляли 20 частей 28%-ного водного раствора аммиака с последующим повышением температуры. Проводили реакцию в растворе при 90-95°С в течение 2 часов. После завершения реакции добавляли воду, доводя количество реакционного раствора до 300 частей, в раствор добавляли концентрированную HCl, поддерживая температуру на уровне 50-55°С, для доведения рН до 2, затем добавляли 35 частей хлорида натрия и перемешивали при той же температуре. Через 1 час отфильтровывали кристаллы с получением соединения с формулой (10) (R=СН3, А = метаксилиленовая группа, Y=NH2) в виде влажного красного фильтровального осадка.
(3) Влажный фильтровальный осадок, полученный в соответствии с пунктом (2) выше, добавляли к 250 частям метанола с последующим нагреванием до 60-65°С и перемешиванием в течение 1 часа, фильтровали, промывали метанолом и сушили с получением 9,2 частей соединения с формулой (10) (R=CH3, A = метаксилиленовая группа, Y=NH2) (Соединение №7) в виде красных кристаллов. λmax: 537,8 нм (в воде).
Пример 3
(1) К 50 частям воды при температуре таяния льда добавляли 0,3 части Lipal ОН с получением раствора. К раствору добавляли 2,7 части хлористого цианурина и перемешивали в течение 30 минут. К раствору добавляли 11,9 частей соединения с формулой (6) (чистота 78,4%), полученного в соответствии с Примером 1 (3) выше, при 8-10°С, далее по каплям добавляли 10%-ный водный раствор гидроокиси натрия при 25-30°С для поддержания рН на уровне 3-4 в течение 4 часов для проведения первой реакции конденсации и фильтровали с целью удаления нерастворимых веществ с получением реакционного раствора, содержащего соединение с формулой (7) (R=CH3).
(2) Реакционный раствор, полученный в соответствии с пунктом (1) выше и содержащий соединение с формулой (7) (R=СН3), охлаждали до 10-15°С, а затем добавляли к нему по каплям 10%-ный водный раствор гидроокиси натрия для доведения рН до 10. К реакционному раствору добавляли 1,8 части 28%-ного водного раствора аммиака. Проводили реакцию в растворе при 10-15°С в течение 2 часов, а затем - при 25-30°С в течение 1 часа с получением соединения, содержавшего продукты второй конденсации.
(3) Реакционный раствор, полученный в соответствии с пунктом (2) выше и содержащий продукты второй конденсации, нагревали до 90°С, а затем добавляли в него 1,3 части 4,4'-диаминодициклогексилметана с последующим добавлением по каплям 10%-ного водного раствора гидроокиси натрия при 85-90°С для поддержания рН на уровне 9,0-9,3 в течение 1 часа для протекания реакции. Затем к реакционному раствору добавляли воду для получения 200 частей раствора, в который добавляли концентрированную HCl, поддерживая температуру на уровне 50-55°С, для доведения рН до 0,1 или ниже. Через 10 минут кристаллы отфильтровывали с получением соединения с формулой (10) (R=СН3, А = дициклогексилметан-4,4'-диильная группа, Y=NH2) в виде красного влажного фильтровального осадка.
(4) Влажный фильтровальный осадок, полученный в соответствии с пунктом (3) выше, добавляли к 250 частям метанола с последующим нагреванием до 60-65°С и перемешиванием в течение 1 часа. Кристаллы отфильтровывали, промывали метанолом и сушили с получением 9, 9 частей соединения с формулой (10) (R=CH3, A = дициклогексилметан-4,4'-диильная группа, Y=NH2) (Соединение №20) в виде красных кристаллов. λmax: 536,5 нм (в воде).
Пример 4
(1) К реакционному раствору, содержащему соединение с формулой (7) (R=CH3), полученное в соответствии с пунктами (1)-(4) Примера 1, добавляли 1,4 части 4, 4'-диамино-3,3'-диметилдициклогексилметана, а затем добавляли воду для получения 200 частей раствора, после чего повышали температуру и по каплям добавляли 10%-ный водный раствор гидроокиси натрия при 50-60°С для поддержания рН в диапазоне от 5,7 до 6,3 в течение 2 часов для протекания второй реакции конденсации с получением раствора, содержавшего соединение с формулой (9) (R=СН3, A = 3,3'-диметилдициклогексилметан-4,4'-диильная группа).
(2) К реакционному раствору, полученному в соответствии с вышеуказанным пунктом (1), добавляли 20 частей 28%-ного водного раствора аммиака с последующим повышением температуры. Реакцию в растворе проводили при 90-95°С в течение 2 часов. После завершения реакции добавляли воду, чтобы довести количество реакционной смеси до 300 частей, затем в реакционную смесь добавляли концентрированную HCl, поддерживая температуру в диапазоне 50-55°С, чтобы довести рН до 2, затем добавляли 35 частей хлорида натрия и перемешивали при той же температуре. Через 1 час отфильтровывали кристаллы с получением соединения с формулой (10) (R=СН3, А=3,3'-диметилдициклогексилметан-4,4'-диильная группа, Y=NH2) в виде влажного красного фильтровального осадка.
(3) Влажный осадок, полученный в соответствии с указанным пунктом (2), добавляли к 250 частям метанола, после чего нагревали смесь до 60-65°С и перемешивали в течение 1 часа. Кристаллы отфильтровывали, промывали метанолом и сушили с получением 8,1 частей соединения с формулой (10) (R=СН3, А=3, 3'-диметилдициклогексилметан-4,4'-диильная группа, Y=NH2) (Соединение №19) в виде красных кристаллов. λmax: 536,2 нм (в воде).
Пример 5
(А) Приготовление чернил
Все композиции пурпурных чернил на водной основе для струйной печати получали посредством приготовления жидкости, содержавшей антрапиридоновые соединения (красящие компоненты), полученные соответственно в Примерах 1 и 2, которая имела состав, указанный в Таблице 2, приведенной ниже, с последующим фильтрованием ее через мембранный фильтр с порами с диаметром 0,45 мкм. В качестве воды использовали воду, пропущенную через ионообменную смолу. Для получения общего количества композиции чернил, равного 100 частям, и рН в диапазоне 8-10 добавляли воду и гидроксид аммония.
(Б) Струйная печать
С помощью струйного принтера (торговое название: BJS-630, производитель Canon KK) была выполнена струйная печать на двух типах регистрирующей бумаги:
Профессиональной Фотобумаге (PR-101, производства Canon KK) и Фотобумаге РМ (глянцевой) (производства Seiko-Epson KK). (Далее в этой работе PR означает Профессиональную Фотобумагу; РМ означает Фотобумагу РМ).
(В) Оценка печатного изображения
(1) Оценка цветового тона
Цветовой тон и яркость печатного изображения: Бумага с печатным изображением была подвергнута оценке цвета с помощью колориметра (GRETAG SPM50, производства GRETAG Со.) для расчета значений L*, а*, b*. Цветовой тон оценивали путем сравнения с образцом стандартного пурпурного цвета в Japan Color от JNC (Японская ассоциация производителей печатного оборудования), а яркость оценивали по значению, рассчитанному по формуле: С*=((а*)2+(b*)2)1/2.
Цветовой тон образца стандартного пурпурного цвета в Japan Color от INC показан в Таблице 3.
Бумага: Стандартная бумага Japan Color
(2) Испытание на светостойкость
Прибор Xenon Weather Meter (производства Atlas Co. Ltd) был использован для облучения печатных изображений при 24°С и 60%-ной относительной влажности в течение 50 часов. Цветовая разность (ÄЕ) между изображениями до и после испытания была измерена с помощью вышеописанной системы цветоразличения. Результаты показаны в Таблице 4.
(3) Испытание на стойкость к газообразному озону
Кусок регистрирующей бумаги с отпечатанным на нем изображением помещали в прибор Ozone Weather Meter (производства Suga Testing Machine Co.) для испытания и выдерживали при 40°С и концентрации озона, равной 4 промилле, в течение 10 часов. Измеряли цветовую разность (АЕ) между изображениями до и после испытания. Результаты приведены в Таблице 4.
(4) Испытание на влагостойкость
Кусок регистрирующей бумаги с отпечатанным на нем изображением помещали в камеру с постоянной температурой и влажностью на 72 часа при 50°С и относительной влажности 90%.
Выцветание оценивали, сравнивая изображения до и после испытания, посредством визуальной оценки в соответствии с тремя следующими стандартами:
О - видимого выцветания нет
▲ - небольшое видимое выцветание
Х - большое видимое выцветание
Результаты приведены в Таблице 4.
Результаты испытаний печатных изображений на цветовой тон, яркость, светостойкость, устойчивость к газообразному озону и влагостойкость представлены в Таблице 4, где Пример оценки 1 демонстрирует результаты оценки композиции чернил, изготовленной из соединения, полученного в Примере 1, а Пример оценки 2 демонстрирует результаты оценки композиции чернил, изготовленной из соединения, полученного в Примере 2. Кроме того, Таблица 4 включает также Сравнительный пример 1, который демонстрирует результат оценки при использовании антрапиридонового соединения (Соединение 4), описанного в Примере 2 из выложенной патентной заявки JP №109464/2000, и Сравнительный пример 2, который демонстрирует результат оценки при использовании антрапиридонового соединения (Соединение с формулой (1)), описанного в Примере синтеза 1 из выложенной патентной заявки JP №169776/2000.
Примеры испытаний 3,4
Струйная печать была выполнена с использованием чернил, изготовленных такими же способами, как описано в пунктах (А) и (Б) выше, с использованием антрапиридоновых соединений, полученных соответственно в Примерах 3 и 4. Печатные изображения оценивали так же, как описано в пункте (В) выше, за исключением того, что определение цвета проводили на Gretag Macbeth SpectroEye. Пример оценки 3 демонстрирует результат оценки композиции чернил, изготовленной с использованием соединения, полученного в Примере 3, а Пример оценки 4 демонстрирует результат оценки композиции чернил, изготовленной с использованием соединения, полученного в Примере 4. Результаты испытаний на цветовой тон, яркость, светостойкость, устойчивость к озону и влагостойкость печатных изображений, полученных с использованием композиций пурпурных чернил на водной основе в Примерах оценки 3 и 4 приведены в Таблице 5 ниже.
Антрапиридоновое соединение согласно настоящему изобретению пригодно для использования в качестве красителя для струйной печати, так как значения цветового тона и яркости близки к значениям стандартных пурпурных красителей JNC. Кроме того, значение С* выше, чем у стандартных пурпурных красителей JNC, и аналогично выше яркость. Изделие согласно настоящему изобретению, имеющее меньшие значения ÄЕ, чем значения в сравнительных примерах, могут быть оценены как пурпурные красители с высокой светостойкостью. Значение устойчивости к озону изделия согласно настоящему изобретению, имеющего меньшие значения ÄЕ, чем значения в сравнительных примерах, демонстрирует значительное повышение способности выдерживать действие газообразного озона. Проявляя лучшую влагостойкость, чем пурпурный краситель в сравнительном примере 2, антрапиридоновое соединение согласно настоящему изобретению вследствие этого признается исключительно хорошо подходящим для изготовления пурпурных чернил для струйной печати, имеющих повышенную влагостойкость и одновременно сохраняющих высокую водостойкость.
Антрапиридоновое соединение согласно настоящему изобретению в целом превосходит соединение из сравнительных примеров 1 или 2 и проявляет высокое качество на всех средах (регистрирующих материалах). Кроме того, красители для струйной печати, полученные в Примерах 1-4, имеющие растворимость в воде порядка 100 г/л и более в щелочных условиях (рН 8-9), можно легко использовать, так как они имеют широкий диапазон применений, так что на их основе можно приготовить стабильные чернила с высокой концентрацией красителя.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Новое антрапиридоновое соединение согласно настоящему изобретению обладает превосходной растворимостью в воде, стабильно в растворе при хранении и характеризуется хорошей способностью к фильтрации через мембранный фильтр в процессе производства композиции чернил. Соединение в высшей степени безопасно для живых существ. Кроме того, композиция чернил согласно настоящему изобретению с использованием нового антрапиридонового соединения не образует кристаллического осадка после длительного хранения, не изменяет свойства и цвет, так что она обладает хорошей устойчивостью при хранении. Композиция чернил согласно настоящему изобретению при использовании в качестве пурпурных чернил для струйной печати может обеспечить печатные продукты с превосходным уровнем светостойкости, устойчивости к действию озона и влагостойкости. Композиция может также обеспечить яркую печатную поверхность и идеальный пурпурный цвет. Композиция, при использовании совместно с желтыми или голубыми чернилами, может обеспечить широкий диапазон цветовых тонов в видимом диапазоне. Поэтому композиция чернил согласно настоящему изобретению исключительно хорошо пригодна для применения в качестве пурпурных чернил для струйной печати.
Реферат
Описываются соединения антрапиридона общей формулы

где R-C1-4-алкил;
Y - аминогруппа;
Х - NH-A-NH-, где А - C1-6 полиметилен, ксилилен, дициклогексилметилен, возможно замещенный на циклогексиле метилом, или их соли и водная композиция пурпурных чернил на их основе.
Пурпурные чернила, содержащие указанные соединения антрапиридона, обладают цветовыми тонами и яркостью, подходящими для струйной печати, и дают изображения, обладающие превосходной стойкостью по отношению к свету, газу, воде. 2 н. и 11 з.п., 6 табл.
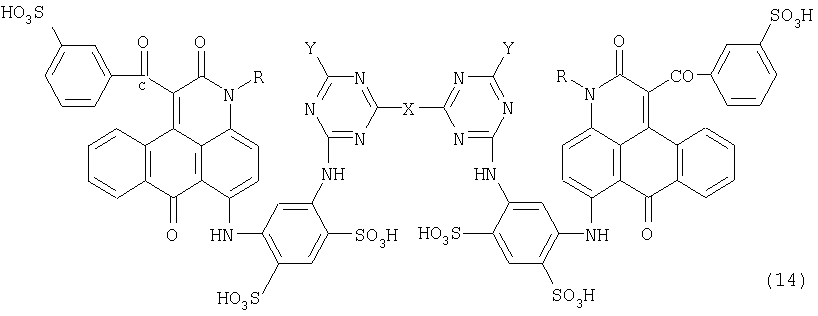
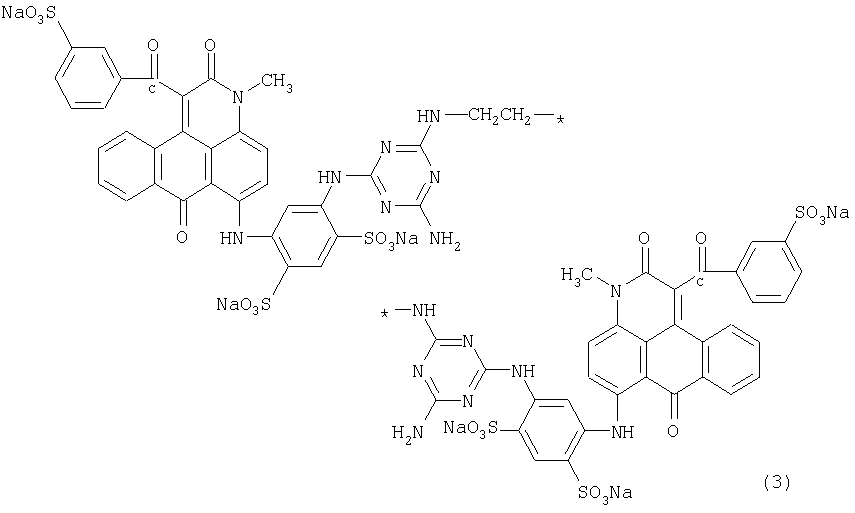
Формула







Комментарии