Новые производные хинуклидина и медицинские композиции, содержащие их - RU2143432C1
Код документа: RU2143432C1
Чертежи



























Описание
Изобретение относится к лекарственным средствам, особенно к производным хинуклидина или их солям, или четвертичным аммониевым солям, обладающим антагонистической активностью по отношению к мускариновым рецепторам, а также к фармацевтическим композициям, содержащим такие соединения.
Проводились и проводятся исследования мускариновых рецепторов, и известно, что соединения, обладающие антагонистической активностью по отношению к мускариновым рецепторам, вызывают расширение бронхов, подавление или супрессию желудочно-кишечной двигательной активности, подавление кислотной секреции, сухость во рту, мидриаз (расширение зрачка), подавление сокращения мочевого пузыря, гипогидроз, тахикардию или подобные явления. Известно, что мускариновый рецептор включает по крайней мере три подтипа. Рецептор М1 существует главным образом в головном мозге или аналогичных, рецептор М2 - в сердце или аналогичных и рецептор М3 - в гладких мышцах или тканях желез.
Ряд таких соединений, обладающих антагонистической активностью по отношению к мускариновым рецепторам, уже известен, и типичным примером является, например, атропин ("The Merck Index, 11-th edition", стр. 138). Однако, атропин антагонизирует M1-, М2- и М3- рецепторы неселективно, так что его трудно использовать для лечения конкретного заболевания. В последние годы в связи с прогрессом изучения субтипов мускариновых рецепторов исследовались соединения, обладающие селективными антагонистическими видами активности против M1-, М2- или М3 - рецептора (не прошедшая экспертизу опубликованная английская патентная заявка N 2249093, не прошедшая экспертизу опубликованная японская патентная заявка (кокаи) 1-131145, и не прошедшая экспертизу опубликованная японская патентная заявка (кокаи) 3-133980). Существует потребность в соединениях, обладающих селективной антагонистической активностью среди указанных трех субтипов против мускаринового М3-рецептора и свободных от побочных эффектов в отношении сердца, являющихся результатом действия М2-рецептора.
В
нерассмотренной
опубликованной
японской патентной заявке (кокаи) 62-252764 описывается соединение, представленное следующей общей формулой:

в которой L представляет NH или О;
X и Y каждый независимо представляет атом водорода или C1-6 с алкильную группу, или они могут быть объединены вместе, образуя связь;
R1 и R2 каждый независимо представляет атом водорода, С1-6 алкильную группу...;
R3 и R4 каждый независимо представляет атом водорода, атом галогена, CF3, C1-6 алкильную группу..., фенильную группу, амино группу, которая может быть необязательно N- замещенной одной или двумя группами, выбранными из фенильной, С1-6 алкильной групп, или может быть необязательно N -дизамещенной С6-8 полиэтиленом...;
Z представляет группу

или аналогичные;
p=1 или 2; и q=1-3.
Соединение, описанное в приведенной выше патентной литературе, раскрывается как 5-НТ антагонист, и ничего не говорится об антагонистической активности их в отношении мускаринового рецептора. Вышеуказанное соединение, совершенно ясно, отличается от соединений согласно настоящему изобретению по фармакологическому действию.
Изобретатели настоящей заявки провели обширное изучение соединений, обладающих антагонистической активностью в отношении описанного выше мускаринового М3- рецептора. В результате изобретатели создали новые производные хинуклидина, имеющие основной скелет, отличный от скелета общепринятого соединения, и нашли, что такие соединения проявляют превосходную селективную антагонистическую активность против мускаринового М3 -рецептора, завершив в результате настоящее изобретение.
Таким образом, настоящее изобретение относится к производным хинонуклидина, представленным следующей общей формулой (I); их солям или четвертичным аммониевым солям; и к фармацевтическим композициям, включающим указанные соединения и их соли и фармацевтически приемлемые носители, особенно к антагонистам мускаринового М3-рецептора.

(символы в указанной формуле имеют следующие значения: Кольцо А (обозначенное в структурной формуле как "Ring А"); арильная группа, циклоалкильная группа, циклоалкенильная группа, гетероарильная группа, имеющая 1-4 гетеро атома, выбранных из группы, состоящей из атома кислорода, азота и серы, или 5- - 7-членная насыщенная гетероциклическая группа, где указанное кольцо может быть замещено необязательным заместителем;
X: одинарная связь или метиленовая группа;
R: атом галогена, гидроксильная группа, низшая алкокси группа, карбоксильная группа, низшая алкоксикарбонильная группа, низшая ацильная группа, меркапто группа, низшая алкилтиогруппа, сульфонильная группа, низшая алкилсульфонильная группа, сульфинильная группа, низшая алкилсульфинильная группа, сульфонамидо группа, низшая алкансульфонамидо группа, карбамоильная группа, тиокарбамоильная группа, моно- или ди-низшая алкилкарбамоильная группа, нитро группа, циано группа, амино группа, моно- или ди-низшая алкиламино группа, метилендиокси группа, этилендиокси группа или низшая алкильная группа, которая может быть замещена атомом галогена, гидроксильной группой, низшей алкокси группой, амино группой или моно- или динизшей алкиламино группой;
l= 0 или 1,
m= 0 или 1,2,3,
n= 1 или 2, далее здесь указанное выше применимо аналогичным образом).
Среди
соединений (1) настоящего изобретения особенно
предпочтительными соединениями являются производные
хинуклидина,
в которых кольцо А
представляет арильную группу, циклоалкильную группу,
циклоалкенильную группу, гетероарильную группу, имеющую 1-4
гетероатома, выбранных из группы, состоящей из атомов
кислорода,
азота и серы, или
5- - 7- членную насыщенную гетероциклическую группу,
в которой кольцо может быть замещено заместителями,
выбранными из группы, состоящей из атомов галогена,
гидроксильных групп,
низших алкокси групп,
карбоксильных групп, низших алкокси-карбонильных
групп, низших ацильных групп, меркапто групп, низших
алкилтио групп, сульфонильных групп, низших
алкил-сульфонильных групп,
сульфинильных, низших
алкилсульфинильных, сульфонамидо групп, низших
алкансульфонамидо групп, карбамоильных групп,
тиокарбамоильных групп, моно- или ди-низших
алкилкарбамоильных групп, нитро групп,
циано групп, амино групп,
моно- или ди-низших алкиламино групп,
метилендиокси, этилендиокси, и низших алкильных
групп, которые могут быть замещены атомами
галогена, гидроксильными, низшими алкокси,
амино группами или
моно- или ди-низшими алкиламино группами, и
их соли или четвертичные аммониевые соли;
производные хинуклидина, в которых m
представляет атом галогена, низшую алкильную
группу, гидроксильную
группу, низшую алкокси группу, нитро
группу, циано группу, амино группу или моно- или
ди-низшую алкиламино группу, и кольцо А
представляет арильную группу, циклоалкильную группу,
циклоалкенильную
группу, 5- или 6-членную
моноциклическую гетероарильную группу, имеющую 1-4 гетеро
атома, выбранных из группы, состоящей из
атомов кислорода, азота и серы, или 5- - 7-членную
насыщенную
гетероциклическую группу, в которой
такое кольцо может быть замещено заместителями, выбранными
из атома галогена, низшей алкильной
группы, гидроксильной группы, низшей алкокси группы,
нитро группы,
циано группы, амино группы или
моно- или ди-низшей алкиламино группы, и их соли или
четвертичные аммониевые соли;
производные хинуклидина, в которых m представляет О, и кольцо
А представляет
арильную группу,
циклоалкильную группу или циклоалкенильную группу, которая может
быть замещена атомами галогена, низшими
алкильными группами, гидроксильными группами или низшими
алкокси группами, или
5- или
6-членную моноциклическую гетероарильную группу, имеющую 1-4 гетеро
атома, выбранных из группы, состоящей из
атомов кислорода, азота и серы, и их соли или четвертичные
аммониевые соли;
производные хинуклидина, в которых кольцо А представляет фенильную
группу, которая может быть замещена атомом
галогена или низшей алкильной группой, циклоалькильную группу,
пиридильную группу,
фурильную группу или тиенильную группу, и их соли пли четвертичные
аммониевые соли;
производные
хинуклидина, в которых X представляет одинарную связь, и их соли или
четвертичные
аммониевые
соли;
производные хинуклидина, в которых n представляет 2
и их соли или четвертичные аммониевые
соли.
Настоящее изобретение предоставляет также антагонисты мускаринового М3-рецептора, которые включают производные хинуклидина (I) или их соли или четвертичные аммониевые соли, то есть соединение (I) настоящего изобретения и фармацевтически приемлемые носители, предпочтительно, агенты для предотвращения (профилактики) и/или лечения мочевых заболеваний (например, нейрогенной поллакиурии, нейрогенного мочевого пузыря, ночного энуреза, нестабильного мочевого пузыря, цистоспазма и хронического цистита), или респираторных заболеваний (например, хронических обструктивных болезней легких, хронического бронхита, астмы и ринита).
Ниже соединение (I) настоящего изобретения будет описано подробно.
Отличие от обычного антагониста мускаринового М3 рецептора, соединение (I) настоящего изобретения в структурном отношении характеризуется тем, что оно имеет в качестве основного скелета тетрагидроизохинолиновый скелет (Iа) или изоиндолиновый скелет (Ib), имеющий хинуклидинилоксикарбонильную группу, и др., связанную с атомом азота в кольце, как показано ниже.

Кроме того, соединение (I) настоящего изобретения характеризуется тем, что оно имеет кольцо А, то есть циклическую группу, выбранную из арильной группы, циклоалкильной группы, циклоалкенильной группы, гетероарильной группы, имеющей 1-4 гетеро атома, выбранных из группы, состоящей из атомов кислорода, азота и серы, или 5- - 7-членной насыщенной гетероциклической группы в 1 положении тетрагидроизохинолина или изоиндолина, присоединенную через X.
Если не отмечается иное, термин "низший", используемый в определении общей формулы в данном описании, обозначает линейную или разветвленную углеродную цепь, имеющую 1-6 атомов углерода. Соответственно, "низшая алкильная группа" обозначает линейную или разветвленную алкильную группу, имеющую 1-6 атомов углерода. Конфетные примеры включают метильную, этильную, пропильную, изопропильную, бутильную, изобутильную, втор-бутильную, трет- бутильную, пентильную, изопентильную, неопентильную, трет- пентильную, 1-метилбутильную, 2-метилбутильную, 1, 2-диметилпропильную, гексильную, изогексильную, 1-метилпентильную, 2-метилпентильную, 3-метилпентильную, 1,1-диметилбутильную, 1, 2-диметилбутильную, 2,2- диметилбутильную, 1,3-диметилбутильную, 2, 3-диметилбутильную, 3,3- диметилбутильную, 1-этилбутильную, 2-этилбутильную, 1,1,2- триметилпропильную, 1,2,2-триметилпропильную, 1-этил-1- метилпропильную и 1-этил-2-метилпропильнум группы. Среди этих групп предпочтительны алкильные группы, имеющие 1-4 атома углерода, такие как метильная, этильная, пропильная, изопропильная и бутильная группы, и более предпочтительной является метильная группа.
"Арильная группа" означает ароматические углеводородные группы и предпочтительно арильные группы, имеющие 6-14 атомов углерода. Конкретные примеры включают фенильную, нафтильную, инденильную, антрильную и фенантрильную группы, и более предпочтительной является фенильная группа.
Примеры "циклоалкильной группы" включают группы, имеющие 3-8 углеродных атомов, такие как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Среди этих групп предпочитаются циклопропильная, циклобутильная, циклопентильная и циклогексильная группы, и более предпочтительна циклогексильная группа.
Примеры "циклоалкенильной группы" включают группы, имеющие 3-8 атомов углерода, такие как 1-циклопропенил, 2-циклопропенил, 1-циклобутенил, 2-циклобутенил, 1-циклопентил, 2-циклопентенил, 3-циклопентенил, 1-циклогексенил, 2-циклогексенил, 3-циклогексенил, 1-циклогептенил, 2-цикло-гептенил, 3-циклогептенил, 4-циклогептенил, 1-циклооктенил, 2-циклооктенил, 3-циклооктенил, 4-циклооктенил, 2,4-циклопентадиенил, 2,5-циклогексадиенил, 2, 4-циклогептадиенил и 2,6-циклогептадиенил.
"Гетероарильная группа, содержащая 1-4 гетеро атома, выбранных из группы, состоящей из атомов кислорода, азота и серы" означает 5- или 6-членную гетероарильную группу, которая может быть сконденсирована с бензольным кольцом. Конкретные примеры ее включают 5- или 6-членные моноциклические гетероарильные группы, содержащие 1-4 гетеро атома, выбранных из группы, состоящий из атомов кислорода, азота и серы, такие как фурильная, тиенильная, пирролильная, имидазолильная, пиразолильная, триазолильная, тетразолильная, изотиазолильная, изоксазолильная, пиридильная, пиразинильная, пиримидинильная и пиридазинильная группы; и 5- или 6-членные гетероарильные группы, сконденсированные с бензольным кольцом, такие как индолильная, индазолильная, индолизинильная, хинолильная, хиназолинильная, хинолизинильная, хиноксалинильная, циннолинильная, бензимидазолильная, бензофуранильная, дигидробензофуранильная, бензоизоксазолильная, бензооксазолильная, бензотиазолильная и бензотиенильные группы.
Среди этих групп предпочтительными являются 5- или 6-членные моноциклические гетероарильные группы, содержащие 1-4 гетеро атома, выбранных из группы, состоящей из атомов кислорода, азота и серы, и более предпочтительны фурильная, тиенильная и пиридильная группы.
"5- - 7-членная насыщенная гетероциклическая группа" означает 5-, 6- или 7-членную насыщенную гетероциклическую группу, содержащую 1-2 атома кислорода, азота и/или серы. Конкретные примеры включают пирролидинильную, имидазолидинильную, пиперидинильную, пиперазинильную и морфолинильную группы.
"Арильная группа", "циклоалкильная группа", "циклоалкенильная группа", "гетероарильная группа, содержащая 1-4 гетеро атома, выбранных из группы, состоящей из атомов кислорода, азота и серы", "5- или 6-членная моноциклическая гетероарильная группа, содержащая 1-4 гетеро атома, выбранных из группы, состоящей из атомов кислорода, азота и серы", или "5- - 7-членная насыщенная гетероциклическая группа" в качестве группы А может быть замещена необязательными заместителями. Число заместителей не ограничивается одним и может быть и большим. Любая группа, которая может замещать такое кольцо, может применяться в качестве необязательного заместителя. Предпочтительные примеры их включают атом галогена, гидроксильную группу, низшую алкокси группу, карбоксильную группу, низшую алкоксикарбонильную группу, низшую ацильную группу, меркапто группу, низшую алкилтио группу, сульфонильную группу, низшую алкилсульфонильную группу, сульфинильную, низшую алкилсульфинильную, сульфонамидо группу, низшую алкансульфонамидо группу, карбамоильную группу, тиокарбамоильную группу, моно- или ди-низшую алкил-карбамоильную группу, нитро группу, циано группу, амино группу, моно- или ди- низшую алкиламино группу, метилендиокси, этилендиокси, и низшую алкильную группу, которая может быть замещена атомом галогена, гидроксильной, низшей алкоксильной группой, амино группой или моно- или ди-низшей алкиламино группой; более предпочтительными являются атом галогена, низшая алкильная группа, гидроксильная группа, низшая алкокси группа, нитро группа, циано группа и моно- или ди-низшая алкиламино группа; еще более предпочитаются атом галогена, низшая алкильная группа, гидроксильная группа и низшая алкокси группа; и особенно предпочтительными являются атом галогена и низшая алкильная группа.
Примеры атомов галогена включают фтор, хлор, бром и иод. Когда заместителем является атом галогена, число заместителей не имеет особых ограничений. Когда заместителями являются два или более атомов галогена, возможно любое сочетание указанных выше атомов. Примеры замещенных атомом галогена низших алкильных групп включают фторметил, хлорметил, бромметил, иодметил, 1-фторэтил, 1-хлорэтил, 1-бромэтил, 2- хлорэтил, 2-бромэтил, дихлорметил, трифторметил, трихлорметил, трибромметил, трииодметил и дихлорбромметил. Среди данных групп предпочитается трифторметильная группа.
Примеры "низшей алкокси группы" включают метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси, пентилокси (амилокси), изопентилокси, трет-пентилокси, неопентилокси, 2-метилбутокси, 1,2-диметилпропокси, 1-этилпропокси и гексилокси. Среди этих групп предпочитаются низшие алкокси группы, содержащие алкильную группу, имеющую 1-4 атома углерода, такие как метокси, этокси, пропокси и бутокси, и более предпочтительными являются метокси и этокси группы.
Примеры низшей алкоксикарбонильной группы включают метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, изобутоксикарбонил, втор- бутоксикарбонил, трет-бутоксикарбонил, пентилокси (амилокси) карбонил, изопентилоксикарбонил, трет-пентилоксикарбонил, неопентилоксикарбонил, 2-метилбутоксикарбонил, 1,2-диметилпропоксикарбонил, 1-этилпропоксикарбонил и гексилоксикарбонил.
Примеры "низшей ацильной группы" включают формил, ацетил, пропионил, бутирил, валерил и пивалоил, и предпочтительными являются формил, ацетил и пропионил.
"Низшая алкилтио группа" означает меркапто группу, в которой атом водорода замещен приведенной выше в качестве примера алкильной группой, такую как метилтио, этилтио, пропилтио, изопропилтио, бутилтио, пентилтио и гексилтио группы.
Примеры "низшей алкилсульфонильной группы" включают метилсульфонил, этилсульфонил, пропилсульфонил, изопропилсульфонил, бутилсульфонил, пентилсульфонил и гексилсульфонил.
Примеры "низшей алкилсульфинильной группы" включают метилсульфинил, этилсульфинил, пропилсульфинил, изопропилсульфинил, бутилсульфинил, пентилсульфинил и гексилсульфинил.
Примеры "низшей алкансульфонамидо группы" включают метансульфонамидо, этансульфонамидо, пропансульфонамидо, изопропансульфонамидо, бутансульфонамидо, пентансульфонамидо и гексансульфонамидо.
"Моно- или ди-низшая алкилкарбамоильная группа" означает карбамоильную группу, в которой один или два атома водорода замещены приведенной выше в качестве примера низшей алкильной группой (или группами), такую как метилкарбамоильная, этилкарбамоильная, пропилкарбамоильная и диметилкарбамомильная группы.
"Моно- или ди-низшая алкиламино группа" обозначает амино группу, в которой один или два атома водорода замещены приведенными выше в качестве примера алкильными группами, такую как метиламино, этиламино, пропиламино, диметиламино, диэтиламино и дипропиламино группы.
Термин "низшая алкильная группа, которая может быть замещена атомом галогена, гидроксильной группой, низшей алкокси группой, амино группой или моно- или ди-низшей алкиламино группой", означает низшую алкильную группу, в которой, по крайней мере, один атом водорода необязательно замещен атомом галогена, гидроксильной группой, низшей алкокси группой, амино группой или моно- или ди-низшей алкиламино группой. Низшая алкильная группа, замещенная атомом галогена, является такой, как описана в приведенном выше описании с учетом описанных атомов галогена.
Соединение (I) настоящего изобретения содержит хинуклидинильную группу. Атом азота хинуклидинильной группы может образовывать оксид

Термин "низший алкенил", используемый здесь, обозначает линейную или разветвленную алкенильную группу, имеющую 2-6 атомов углерода, такую как винил, пропенил, бутенил, метилпропенил, диметилвинил, пентенил, метилбутенил, диметилпропенил, этилпропенил, гексенил, диметилбутенил и метилпентенил. Среди этих групп предпочитается пропенильная группа.
"Низшая алкинильная группа" обозначает линейную или разветвленную алкинильную группу, имеющую 2-6 атомов углерода, такую как этинильная, пропинильная, бутинильная, метилпропинильная, пентинильная, метилбутинильная и гексинильная группы. Среди этих групп предпочтительными являются алкинильные группы, имеющие 2-3 атома углерода, такие как этинил и пропинил.
Анион для четвертичной аммониевой соли не имеет особых ограничений, и примеры его включают ионы атомов галогена, трифлат (трифторметилсульфонат), тозилат (толуолсульфонат) и мезилат (метилсульфонат), предпочтительно ионы атомов галогена, т.е. галогенидные ионы (например, хлоридный ион, бромидный ион, иодидный ион и трииодидный ион). Примеры других анионов включают такие анионы, как нитратный ион, сульфатный, фосфатный и карбонатный ионы, карбоксилаты, такие как формиат (HCOO-), ацетат (CH3COO-), пропионат, оксалат и малонат, и аминокислотные анионы, такие как глютаминат. Среди галогенидных ионов предпочитаются бромидный и иодидный ионы. Между прочим, анион может превращаться в предпочитаемый анион в зависимости от необходимости с помощью обычной ионообменной реакции.
Соединение (I) настоящего изобретения содержит асимметрический атом углерода, так что ввиду этого существуют его оптические изомеры. В дополнение к сказанному, некоторые из соединений изобретения имеют стереоизомеры или таутомеры. Настоящее изобретение охватывает также диастереомеры и энантиомеры, получаемые с помощью разделения указанных изомеров, также как и их смеси.
Некоторые из соединений (I) настоящего изобретения могут образовывать соли с кислотами, а также описанные выше четвертичные аммониевые соли с хинуклидинильной группой. Примеры таких солей включают кислотно-аддитивные соли с минеральной кислотой, такой как хлористоводородная кислота, бромистоводородная, иодистоводородная, серная, азотная или фосфорная кислота; и соли с органическими кислотами, такими как муравьиная кислота, уксусная, пропионовая, щавелевая, малоновая, янтарная, фумаровая, малеиновая, молочная, яблочная, лимонная, винная, угольная, пикриновая кислоты, метансульфоновая кислота, этансульфоновая (или этансульфо) кислота или глутаминовая кислота. Соединения (I) настоящего изобретения охватывают также гидраты, сольваты с этанолом или аналогичными, и вещества в виде любых полиморфных кристаллов.
(Процесс
Получения)
Соединение (I)
настоящего изобретения
может быть получено в соответствии с различными процессами. Типичные процессы получения поясняются
ниже.
Первый способ
получения

(в приведенной выше формуле Q1 представляет уходящую группу, которая является благоприятной для настоящей реакции, и кольцо A, R, X, m и n имеют те же значения, что определены выше. Далее ниже в данном описании аналогично применимо то же самое).
Данная реакция осуществляется с помощью перемешивания соединения, представленного общей формулой (II), и хинуклидинола, представленного общей формулой (III), в количестве, соответствующем данной реакции, в инертном растворителе при комнатной температуре или при нагревании.
Уходящая группа Q1 включает, например, атом галогена, низшую алкокси группу, фенокси группу и имидазолильную группу.
Примеры инертных растворителей включают диметилформамид (DMF или ДМФ), диметилацетамид, тетрагидрофуран (TGF или ТГФ), диоксан, диметоксиэтан, диэтоксиэтан, бензол, толуол и ксилол и смеси указанных растворителей.
Предпочтительно добавлять основание (например, натрий, гидрид натрия, метилат натрия и этилат натрия) для того, чтобы ускорить данную реакцию.
Второй
способ получения

(где кольцо A, R, X, m, n и Q1 имеют те же значения, что определены выше).
Данная реакция осуществляется с помощью перемешивания соединения, представленного общей формулой (IV), и соединения, представленного общей формулой (V), в описанном выше инертном растворителе, при комнатной температуре или при нагревании.
Предпочтительно добавлять основание (например, натрий, гидрид натрия, метилат натрия, этилат натрия, триэтиламин и пиридин) для того, чтобы ускорять данную реакцию.
(Другие способы получения)
Среди соединений настоящего
изобретения, в которых атом азота хинуклидинильной
группы образует окись или оксид или четвертичную аммониевую соль, могут получаться с помощью образования N-оксида или N-алкилирования третичного
соединения из соединений настоящего изобретения.
Реакция образования N-оксида может осуществляться с помощью реакции окисления общепринятым способом, более конкретно, с помощью перемешивания третичного аминового соединения из соединений настоящего изобретения и соответствующего количества или избыточного количества окисляющего агента в инертном растворителе, таком как хлороформ, дихлорметан или дихлорэтан, спирт, такой как метанол или этанол, или вода, или в смеси указанных растворителей, при охлаждении или при комнатной температуре, или в некоторых случаях, при нагревании. Примеры окисляющих агентов включают органические надкислоты, такие как м-хлорнадбензойная кислота, периодат натрия и перекись водорода.
Реакция N -алкилирования может осуществляться в соответствии с обычной реакцией N - алкилирования, более конкретно, с помощью перемешивания третичного аминового соединения из соединений настоящего изобретения и соответствующего количества алкилирующего агента, в инертном растворителе, таком как диметилформамид, хлороформ, бензол, 2- бутанон, ацетон или тетрагидрофуран, при охлаждении или при комнатной температуре, или, в некоторых случаях, при нагревании.
Примеры алкилирующих агентов включают низшие алкилгалогениды, низшие алкилтрифторметансульфонаты, низшие алкил п- толуолсульфонаты и низшие алкил-метансульфонаты, предпочтительно, низшие алкилгалогениды.
Для получения соединений настоящего изобретения иногда необходимо защищать функциональные группы. В таком случае дополнительно осуществляется общепринятым способом введение соответствующей защитной группы и операция по снятию защиты.
Соединение настоящего изобретения, полученное таким образом, предоставляется, как оно есть, в свободной форме, или после того, как оно подвергается обработке для образования соли общепринятым способом, выделяется и очищается в виде его соли. Выделение и очистка осуществляются с помощью обычных химических приемов, таких как экстракция, концентрирование, выпаривание, кристаллизация, фильтрование, перекристаллизация или различные приемы хроматографии.
Соединение настоящего изобретения имеет сродство и селективность к мускариновому М3 - рецептору и, как антагонист М3 - рецептора, оно полезно в качестве средства для предотвращения или профилактики или лечения разнообразных заболеваний, связанных с М3 - рецептором, особенно мочевых болезней, таких как недержание мочи или поллакиурия при нейрогенной поллакиурии, нейрогенный мочевой пузырь, ночной энурез, нестабильный мочевой пузырь, цистоспазм или хронический цистит; респираторных заболеваний, таких как хронические обструктивные легочные заболевания, хронический бронхит, астма или ринит; или болезней пищеварения, таких как синдром раздраженного кишечника, спастический колит или дивертикулит.
В частности, соединение настоящего изобретения имеет высокую селективность к М3-рецептору, существующему в гладкой мышце или тканях желез, по сравнению с М2-рецептором, существующим в сердце или аналогичных органах, так что он в высокой степени полезен в качестве антагониста М3- рецептора, проявляющего меньше побочных эффектов в отношении сердца или др., особенно в качестве агента или средства для профилактики или лечения моченедержания, поллакиурии, хронических обструктивных легочных заболеваний, хронического бронхита, астмы или ринита.
Сродство и антагонизм соединения настоящего изобретения по отношению к указанному мускариновому рецептору подтверждалось с помощью следующих испытаний.
Испытание на
связывание мускаринового рецептора (ин
витро)
а. Приготовление
мембран
У самцов
крыс Wistar
(Япония SLC) иссекались
сердце и поднижнечелюстные слюнные (субмандибулярные) железы,
смешивались с 20 мМ буфером HEPES (pH 7.5,
который далее будет сокращенно
называться "HEPES буфер",
содержащим 5-кратный объем 100 мМ
хлористого натрия, и добавлялся 10 мМ хлорид магния с
последующей гомогенизацией при охлаждении льдом.
Получающаяся смесь фильтровалась
через марлю с последующим
ультрацентрифугированием при 50000
х g и 4oC в течение 10 минут. Полученный
осадок суспендировался в HEPES буфере. Получающаяся в
результате суспензия хранилась
при -80oC и
предоставлялась для испытания после
расплавления при использовании.
b.
Испытание на связывание мускаринового M2
-рецептора
Испытание
проводилось в соответствии с
методом Doods et al. (J.PharmacoL
Exp, Ther. , 242, 257-262, 1987) с некоторыми
видоизменениями. Образец сердечной мембраны, [3H]
- хинуклидинилбензилат и
испытуемое соединение
инкубировались в 0.5 мл HEPES буфера при
25oC в течение 45 минут с последующим
фильтрованием с отсасыванием через стеклянный фильтр (Whatman
GF/B). Фильтр промывался
три раза 5 мл порциями
HEPES буфера. Радиоактивность [3H]- хинуклидинилбензилата, адсорбированного
на фильтре, измерялась с помощью жидкостного сцинтилляционного
счетчика. В данном случае
добавлением 1 мкМ
атропина измерялось неспецифическое
связывание рецептора. Связывание соединением
настоящего изобретения мускаринового М2-рецептора определялось
по вычисленной константе
диссоциации (Ki), согласно методике Chen
u Prusoff (Biochem. Pharmacol. 22, 3099, 1973),
на основе концентрации (IC50) испытуемого соединения, при
которой ингибировалось 50%
связывания [3H]-хинуклидинилбензилата,
т.е. меченого лиганда.
c.
Испытание на связывание мускаринового М3 - рецептора
Испытание на связывание
мускаринового М3
- рецептора осуществлялось по
способу, аналогичному описанному выше
испытанию на связывание мускаринового М2 - рецептора, за исключением
того, что в качестве
образца мембраны
использовалась поднижнечелюстная слюнная
железа, а в качестве меченого лиганда
использовался [3H]-N-метилскополамин.
Результаты: Соединение (1) настоящего изобретения показало величину Ki от 10-8 до 10-10 в случае М3 - рецептора, что говорит о том, что сродство к М3 - рецептору, по крайней мере, в 10 раз выше, чем к М2 - рецептору.
Испытание на антагонизм к
мускариновым рецепторам (ин виво)
а. Испытание на ритмическое
сокращение мочевого пузыря на
крысах.
Самка крыс Wistar (130-200 г) подвергалась анестезии уретаном (1.0 г/кг подкожно (п.к.)) с последующим перевязыванием мочеточника со стороны почки. Уретральному катетеру давали возможность оставаться в мочевом пузыре, и через катетер в мочевой пузырь инъецировалось около 1.0 мл физиологического раствора для того, чтобы вызвать ритмическое сокращение мочевого пузыря. Измерялось внутривезикулярное давление с помощью датчика давления. После того, как ритмическое сокращение продолжало оставаться стабильным в течение, по крайней мере, 5 минут, испытуемое соединение кумулятивно вводилось из внешней яремной вены. Спустя 5-10 минут измерялось внутривезикулярное давление. Степень ингибирования сокращения мочевого пузыря определялась в сравнении с сокращением мочевого пузыря перед введением испытуемого соединения, и доза испытуемого соединения, требуемая для 30% ингибирования сокращения мочевого пузыря до введения, обозначалась как ED30.
В результате данного испытания соединение изобретения показало хорошее значение ED30.
b. Испытание на выделение слюны у крыс
Самца
крысы Wistar (160
- 190 г) подвергали анестезии
уретаном
(0.8 г/кг интраперитонально и.п.), и вводилось испытуемое
соединение (контрольной группе: растворитель). Через 15 минут вводилось 0.8 мкмол/кг
оксотреморина. В
каждом случае лекарство
вводилось
через бедренную артерию. Слюна, выделявшаяся в течение 5
минут после введения оксотреморина, собиралась и взвешивалась. Степень ингибирования
определялась в
сравнении с количеством слюны в
контрольной группе, и доза испытуемого соединения, необходимая
для 50% ингибирования слюноотделения в контрольной группе, обозначалась как ID50
.
В результате испытания величина ID50 в испытании с атропином как сравнительным соединением была по существу той же, что и величина ED30, полученная выше при испытании на ритмическое сокращение мочевого пузыря у крыс, при этом величина ID50 соединения согласно изобретению была, по крайней мере, в 5 раз выше, как и описанная выше величина ED30, что говорило о том, что соединение настоящего изобретения оказывало относительно слабое действие на слюноотделение.
c. Испытание на брадикардию на крысах
Испытание
проводилось в соответствии
с
методом Doods et al. (J.Pharmacol. Exp. Ther., 242, 257-262, 1987).
Самца крысы Wistar (250-350 г) подвергали анестезии пентобарбитал-натрием (50 мг/кг и.п.). Область
шеи
иссекалась с
последующим
выделением правого и левого блуждающих нервов. После того, как в
трахею вставлялась канюля для обеспечения прохода воздуха, вставлялась палочка из нержавеющей стали, и
спинной
мозг
разрушался. В
условиях искусственного дыхания (10 см3/кг и 50
раз/минуту) ректальная температура поддерживалась при 37.5oC, и контролировалась частота сердечных
сокращений в
участке сонной
артерии. В бедренной артерии фиксировалась помещаемая
внутрь игла, через которую вводилось лекарство. После разрушения спинного мозга крысе давали возможность оставаться
в течение
15
минут для
достижения равновесия с последующим введением атенолола
(10 мг/кг). После установления равновесия в течение дополнительных 15 минут вводилось испытуемое соединение. Спустя
пятнадцать
минут
вводился
кумулятивно оксотреморин, с помощью чего измерялось
уменьшение частоты сердечных сокращений. Количество испытуемого соединения, требуемое для 10-кратного сдвига вправо
кривой
доза-ответ в
контрольной
группе, обозначалось как DR10.
Результаты: Соединение (I) настоящего изобретения проявляло достаточно низкую активность против брадикардии, и не наблюдалось никакой брадикардии при введении количества порядка нескольких мг/кг.
В результате описанного выше испытания (ин витро) на связывание мускариновых рецепторов было найдено, что соединение (I) настоящего изобретения показало селективность и высокое сродство в отношении М3 - рецептора. Даже при испытании (ин виво) на антагонизм в отношении мускариновых рецепторов соединение настоящего изобретения показало хорошую активность в отношении мускаринового М3 - рецептора и низкую активность в отношении брадикардии, которая связана с мускариновым М2 - рецептором. Соответственно, было найдено, что соединение (I) настоящего изобретения имеет селективную антагонистическую активность против мускаринового М3 - рецептора, и, кроме того, оно проявляет меньше побочных эффектов, таких как сухость во рту, по сравнению с общепринятым анти-холинергическим агентом.
Фармацевтическая композиция, содержащая одно или более соединений настоящего изобретения и их солей, приготавливается с использованием обычного фармацевтически приемлемого носителя.
Согласно настоящему изобретению введение фармацевтической композиции может осуществляться или перорально, или парентерально в форме инъекций, медицинских свечей, трансдермальных агентов, ингаляционных средств или внутривезикулярной инъекции.
Доза определяется в каждом случае произвольно с учетом состояния, возраста, пола и аналогичных факторов пациента, которому вводится лечебное средство. При пероральном введении суточная доза может обычно находиться в интервале примерно от 0.01 мг/кг до 100 мг/кг для взрослых. Она вводится один раз или в виде 2-4 порций. Когда с учетом состояния пациента применяется внутривенное введение, суточная доза может обычно варьировать примерно от 0.001 мг/кг до 10 мг/кг для взрослого пациента, в виде одной или множества порций в день.
Примеры фармацевтических носителей включают нетоксичные твердые или жидкие фармацевтические вещества.
Примеры твердых композиций для перорального введения включают таблетки, пилюли, капсулы, порошки и гранулы или аналогичные. В таких твердых композициях одно или более активных веществ смешаны с по крайней мере одним инертным разбавителем, таким как лактоза, маннит, глюкоза, гидроксипропилцеллюлоза, микрокристаллическая целлюлоза, крахмал, поливинилпирролидон, агар, пектин, метасиликат магния или алюминат магния. В композицию можно вводить добавки иные, чем указанные выше инертные разбавители, например, смазочные агенты, такие как стеарат магния, дезинтеграторы, такие как целлюлозакальцийгликолят, стабилизаторы, такие как лактоза, средства, способствующие солюбилизации, такие как глютаминовая кислота или аспарагиновая кислота, обычным образом. Таблетки или пилюли могут необязательно покрываться сахаром или пленкой из желудочного или энтерического вещества, такого как сахароза, желатин, гидроксипропилцеллюлоза или фталат гидроксипропилметилцеллюлозы.
Примеры жидких композиций для перорального введения включают фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры, которые содержат обычно применяемый инертный разбавитель, такой как очищенная вода или этанол. В дополнение к такому инертному разбавителю композиция может также содержать смачивающий агент, подсластитель, вкусовой агент, ароматизирующий агент и/или антисептик.
Инъекционный препарат для парентерального введения или назначения согласно настоящему изобретению включает стерильный водный или неводный раствор, суспензию или эмульсию. Примеры водных растворов и суспензий включают дистиллированную воду и физиологический раствор для инъекций. Примеры не растворимых в воде растворов или суспензий включают этиленгликоль, полипропиленгликоль, полиэтиленгликоль, растительные масла, такие как масло какао, оливковое масло или кунжутное масло, спирты, такие как этанол, аравийскую камедь и "Полисольват 80" (торговое наименование). Такая композиция может дополнительно содержать агент изотоничности, антисептический агент, смачивающий агент, эмульгирующий, диспергирующий агент, стабилизатор (например, лактозу) и/или агент, способствующий солюбилизации (например, глютаминовую кислоту, аспарагиновую кислоту). Композиции стерилизуются, например, фильтрованием через задерживающий бактерии фильтр, включением стабилизатора или облучением. Альтернативно, стерильная твердая композиция, которая получена заранее, растворяется в стерильной воде или стерильном инъекционном растворителе для использования.
Лучшие способы осуществления изобретения
Настоящее
изобретение далее
будет описано здесь с дальнейшими
подробностями с помощью нижеследующих примеров. Однако, соединения настоящего
изобретения не следует рассматривать как ограниченные
соединениями,
которые описаны в
примерах, они охватывают все
соединения, представленные приведенной выше формулой (I), и соли, гидраты,
сольваты, геометрические и оптические изомеры и любые
полиморфные формы
соединения (I).
Кстати, исходные соединения для соединений настоящего изобретения включают новые соединения, и примеры получения таких исходных соединений описаны ниже в виде ссылочных примеров.
Ссылочный пример 1
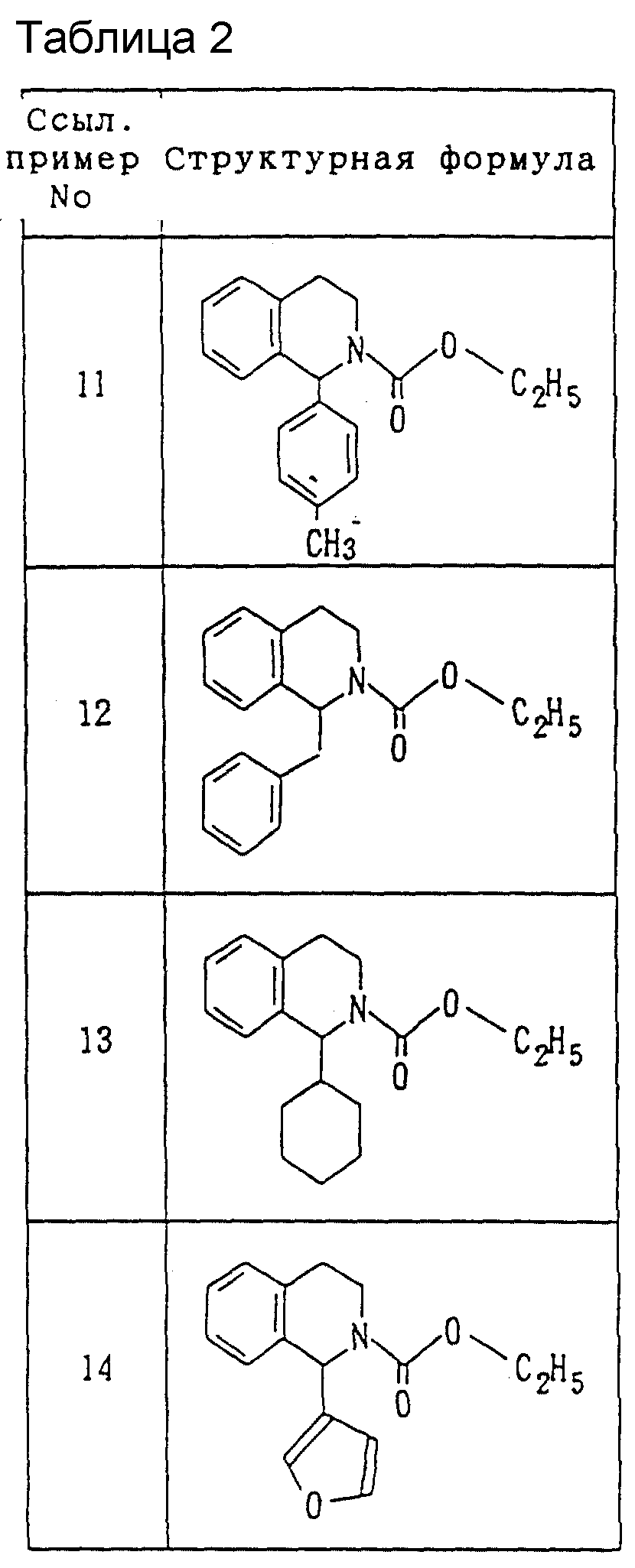
К раствору в 130 мл дихлорметана, содержащему 6.28 г 1-фенил-1,2,3,
4-тетрагидроизохинолина и 3.34 г триэтиламина, при
охлаждении льдом
по каплям добавляется 3.1
мл этилхлорформиата с последующим
перемешиванием на протяжении ночи при комнатной температуре.
Реакционный раствор промывается последовательно водой, 1
норм. соляной кислоты,
водой и солевым
раствором, а затем сушится над безводным
сульфатом натрия. Растворитель удаляется при пониженном
давлении, посредством чего получается 10.58 г этил 1-фенил-1,2,
3,
4-тетрагидро-2- изохинолинкарбоксилата в виде бледно-желтого масла. Спектр
инфракрасного поглощения νмакс
(чистый ) см-1: 1700, 1430, 1296, 1230, 1122.
Спектр ядерно-магнитного резонанса (CDCl3, TMS (TMC)) внутренний
стандарт)
δ: 1.29 (3H, т. , J=
7.3 Гц), 2.75-3.45 (3H, м.), 3.90-4.40 (1H, м.), 4.21 (2H, KB.,J= 7.3 Гц),
6.38 (1H, с.), 6.95-7.45 (9H, м.).
По способу, аналогичному способу ссылочного примера 1, были получены соединения следующих ниже ссылочных примеров 2-14.
Ссылочный
пример 2
Метил 1-фенил-2-изоиндолинкарбоксилат
Исходные
соединения: 1-фенилизоиндолин,
метилхлорформиат
Спектр инфракрасного поглощения νмакс (KBr)
см-2: 1708, 1460, 1376, 1100.
Спектр ядерно-магнитного
резонанса (CDCl3
, ТМС внутренний стандарт)
δ: 3.60, 3.72 (3H, с. х 2), 4.89, 4.96 (2H,
с.
х 2),
5.94, 6.03 (IH, c.x 2), 6.95-7.10 (1H, м.), 7.15-7.35 (8H, м.).
Ссылочный пример 3
Этил 1- (4-пиридил)-1, 2, 3, 4-тетрагидро-2-изохинолин карбоксилат
Исходное
соединение: 1-(4-пиридил)-1, 2,3,4-тетрагидроизохинолин
Свойства:
бледно желтое масло
Масс-анализ (m/z. El): 282 (М+)
Спектр ядерно-магнитного
резонанса
(CDCl3, ТМС внутренний стандарт)
δ: 1.29 (3H, т., J= 7.1
Гц), 2.60-3.45 (3H, м.),
3.85- 4.20 (1H, м.), 4.22 (2H, кв. , J= 7.1 Гц), 6.31 (1H, с.), 7.14 (2H, дд.,
J= 4.4,
1.5
Гц), 7.17-7.26 (4H, м.), 8.51 (2H, дд., J= 4.4, 1.5 Гц).
Ссылочный
пример 4
Этил
1,2,3,4-тетрагидро-1-(2-тиенил)-2-изохинолинкарбоксилат
Исходное
соединение: 1,
2,3,
4-тетрагидро-1-(2-тиенил) изохинолин
Свойства: бледно-желтое масло
Масс-анализ (m/z.
El): 287 (М+)
Спектр ядерно-магнитного резонанса
(CDCl3, ТМС
внутренний стандарт)
δ: 1.32 (3H, т. , J= 7.3 Гц), 2.65-3.60 (3H, м.),
4.00-4.30 (1H,
м.), 4.23 (2H, кв., J= 7.3 Гц), 6.53 (1H, с.), 6.70-6.95 (2H, м.),
7.15-7.30 (5H, м.).
Ссылочный пример 5
Этил 1,2,3,
4-тетрагидро-1-(3-тиенил)-2-изохинолинкарбоксилат
Исходное соединение: 1,2,3,4-тетрагидро-1-(3-тиенил)изохинолин
Свойства: оранжевое
масло
Масс-анализ (m/z, FAB): 288
- (М+ + 1)
Спектр ядерно-магнитного
резонанса (CDCl3, ТМС внутренний стандарт)
δ:
1.23-1.3 (3H, м.), 2.7-2.8
(1H, м.), 2.9-3.0 (1H, м.), 3.1-3.3 (1H, м.),
3.9-4.2 (3H, м.), 6.2-6.4 (1H, м.), 6.83 (1H, с.),
6.95-7.26 (6H, м.).
Ссылочный пример 6
Этил
1- (2-фурил)-1,2,3,
4-тетрагидро-2-изохинолинкарбоксилат
Исходное
соединение: 1- (2-фурил)-1,2,3,
4-тетрагидроизохинолин
Масс-анализ (m/z, E1): 271 (М+)
Спектр
ядерно-магнитного
резонанса (CDCl3, ТМС внутренний стандарт)
δ: 1.30 (3H, т. ,
J=6.5 Гц), 2.75-2.85 (1H, м.), 2.90- 3.10 (1H, м.), 3.20-3.50 (1H, м.), 4.05-4.35 (4H, м.),
6.00 (1H, с.),
6.20-6.45 (2H, м.), 7.15-7.25 (4H, м.), 7.33 (1H, с.).
Ссылочный пример
7
(1S)-Этил 1-фенил-1,2,3,4-тетрагидро- 2-изохинолинкарбоксилат
Исходное
соединение:
(1S)-1-фенил- 1,2,3,4-тетрагидроизохинолин
Элементный анализ
(для C18
H19NO2)
Вычислено: C (%) 76.84 H (%) 6.81 N (%) 4.98
Найдено: C (%)
76.53 H (%) 6.82 N (%) 4.93
Удельное оптическое вращение
[α] :
199.2 (С = 1.03,
CHCl3)
Масс-анализ (m/z FAB): 282 (М+
+ 1)
Ссылочный пример 8
(1R)-Этил 1-фенил-1,2,3,4-тетрагидро-2- изохинолинкарбоксилат
Исходное
соединение: (1R)-1-фенил-1,2,3,4- тетрагидроизохинолин
Элементный
анализ (для
C18H19NO2)
Вычислено: C (%) 76.84; H (%) 6.81; N (%) 4.98;
Найдено: C (%) 76.64; H (%) 6.82; N (%) 4.99.
Удельное
оптическое
вращение [α]
Масс-анализ (m/z.
El): 281
(M+)
Ссылочный пример 9
Этил 1-(4-хлорфенил)-1,2,3,
4-тетрагидро-2-изохинолинкарбоксилат
Исходное соединение: 1-(4-хлорфенил)-1,2,3,
4-тетрагидроизохинолин
Свойства: бледно-желтое масло
Масс-анализ (m/z, E1): 315 (М+)
Спектр ядерно-магнитного резонанса (CDClC3, ТМС внутренний
стандарт)
δ:
1.29 (3H, т., J=7.0 Гц), 2.70-3.52 (3H,м.), 4.00- 4.30 (1H, м.), 4.20 (2H, кв.,
J=7.0 Гц), 6.35 (1H, с.), 7.05- 7.35 (8H, м.)
Ссылочный пример 10
Этил
1-(4-фторфенил)-1,2,3,
4- тетрагидро-2-изохинолинкарбоксилат
Исходное соединение: 1-(4-фторфенил)-1,
2,
3,4-тетрагидроизохинолин
Свойства: бледно-желтое масло
Масс-анализ (m/z,
FAB): 300 (М+ + 1)
Спектр ядерно-магнитного резонанса (CDCl3, ТМС
внутренний
стандарт)
δ: 1.30 (3H, т., J=8.9 Гц), 2.75(1H, дд., J=12.5, 3.4, Гц),
2.9-3.1 (1H, м.),
3.1-3.3 (1H, м.), 4.0-4.3 (3H, м.), 6.2-6.4 (1H, м.), 6.93-7.03 (3H, м. ),
7.16-7.24 (5H,
м.).
Ссылочный пример 11
Этил 1,2,3,
4-тетрагидро-1-(4-толил)-2-изохинолинкарбоксилат
Исходное соединение: 1,2,3,4-тетрагидро-1-(4- толил)изохинолин,
Масс-анализ (m/z. El): 295 (М+)
Спектр
ядерно-магнитного резонанса (CDCI3, ТМС внутренний стандарт)
δ: 1.20-1.35 (3H, м.), 2.30 (3H, с.),
2.70-2.80 (1H,
м.), 2.90-3.10 (1H, м. ), 3.23 (1H, т., J= 10.0 Гц),
3.95-4.30 (3H, м.), 6.29, 6.41 (1H, шир. с, х 2), 7.00-7.25 (8H, м.).
Ссылочный пример 12
Этил
1-бензил-1,2,3,
4-тетрагидро-2- изохинолинкарбоксилат
Исходное
соединение: 1-бензил-1,2,3,4- тетрагидроизохинолин
Свойства: бледно-желтое масло
Масс-анализ (m/z, FAB): 296
(М+
+
1)
Спектр ядерно-магнитного резонанса
(CDCl3, ТМС внутренний стандарт)
δ: 1.02, 1.23 (3H, т. х 2, J= 7.1 Гц), 2.63-3.20 (4H, м.), 3.30-3.50 (1H,
м. ), 3.75-4.25
(3H, м.), 5.27, 5.38 (1H, т.х 2, J= 6.8 Гц),
6.85-7.28 (9H,
м.).
Ссылочный пример 13
Этил 1-циклогексил-1,2,3,4-тетрагидро-2-изохинолинкарбоксилат
Исходное
соединение: 1-циклогексил-1,2,3,
4-тетрагидроизохинолин
Свойства: желтое масло
Масс-анализ (m/z, FAB): 288 (М+ + 1)
Спектр ядерно-магнитного резонанса
(CDCl3 ТМС внутренний
стандарт)
δ: 0.70-2.00 (11,
м.), 1.26 (3H, т., J=7.3 Гц), 2.89 (2H, т., J- 7.1 Гц), 3.25-4.20 (2H, м.), 4.14 (2H, кв., J =7.1 Гц), 4.65-4.95 (1H, м.),
7.00-7.30
(4H, м.).
Ссылочный пример 14
Этил
1-(3-фурил)-1,2,3,4- тетрагидро-2-изохинолинкарбоксилат
Исходное соединение: 1-(3-фурил)-1,2,3,
4-тетрагидроизохинолин
Свойства: желтое
масло
Масс-анализ (m/z. El): 271
(М+)
Спектр ядерно-магнитного резонанса (CDCl3, ТМС внутренний стандарт)
δ: 1.31 (3H, т.,
J=7.0 Гц),
2.55- 3.40 (3H, м.), 3.90- 4.30 (1H, м.), 4.22 (2H,
кв., J=7,0 Гц), 6.20-6.45 (2H, м.), 6.95-7.40 (6H, м.).
Химические структурные формулы соединений, полученных в ссылочных примерах 1-14, показаны в таблицах 1 и 2.
Пример 1. К раствору в 30 мл толуола, содержащему 0.70 г этил 1-фенил-1,2,3, 4-тетрагидроизохинолин-2- карбоксилата и 0.41 г 3-хинуклидинола, добавлялось 0.03 г гидрида натрия (60%). Получающаяся смесь перемешивалась при 140oC в течение 2 суток при удалении образовавшегося этанола. Реакционная смесь охлаждалась до комнатной температуры, добавлялся солевой раствор, и смесь экстрагировалась этилацетатом. Органический слой сушился над безводным сульфатом натрия, и растворитель удалялся при пониженном давлении. Получающийся остаток очищался с помощью хроматографии на силикагельной колонке (хлороформ: метанол = 10:1 ---> хлороформ:метанол:28% водный аммиак = 10:1: 0.1), давая 0.11 г 3-хинуклидинил 1-фенил-1,2,3,4-тетрагидро-2- изохинолинкарбоксилата в виде желтого масла. Получающееся в результате масло растворялось в 10 мл этанола с последующим добавлением 27 мг щавелевой кислоты. Затем растворитель удалялся при пониженном давлении. Получающееся твердое вещество перекристаллизовывалось из изопропанола и изопропилового эфира, с помощью чего получалось 0.08 г монооксалата 3-хинуклидинил 1- фенил-1,2,3,4-тетрагидро-2-изохинолинкарбоксилата в виде бесцветных кристаллов.
Точка плавления: 122-124oC
(i-PrOH-:-Рr2O)
Элементный
анализ (для C25H28N2O6•0.75H2O)
Вычислено: С(%) 64.43, H(%) 6.38, N(%) 6.01
Найдено: С(%) 64.25; H(%)
6.15, N(%) 5.88,
По способу, аналогичному примеру 1, получалось соединение примера 2.
Пример 2. (Моногидрохлорид 3-хинуклидинил
1-фенил-2- изоиндолинкарбоксилата
Исходное соединение
метил 1-фенил-2- изоиндолинкарбоксилат
Точка плавления: 164-165oC
(EtOH-Et2O)
Элементный
анализ (для C22H25N2O2
Cl•1.75H2O)
Вычислено: С(%) 63.45; H(%) 6.9; N(%) 6.73; Cl(%)
8.51;
Найдено: C(%) 63.54, H(%)
6.59; N(%) 6.76, Cl(%) 8.12.
Пример 3. К 50 мл толуольной суспензии, содержащей 720 мг этил 1-(4-пиридил)-1,2,3, 4-тетрагидро-2- изохинолинкарбоксилата и 973 мг 3-хинуклидинола, при комнатной температуре добавлялось 102 мг гидрида натрия (60%). Получающаяся смесь нагревалась с обратным холодильником в течение 5 часов и 40 минут, при этом получающийся этанол удалялся вместе с толуолом. Реакционная смесь охлаждалась до комнатной температуры с последующим добавлением 20 мл воды. Получающаяся смесь экстрагировалась хлороформом. Органический слой промывался водой и солевым раствором, сушился над безводным сульфатом натрия, а затем концентрировался при пониженном давлении. Получающийся в результате остаток очищался с помощью хроматографии на силикагельной колонке (хлороформ: метанол: 28% водный аммиак = 100: 2: 1), посредством чего получалось 827 мг 3-хинуклидинил 1- (4-пиридил)-1,2,3, 4-тетрагидро-2-изохинолин-карбоксилата в виде желтого масла. Получающееся масло растворялось в 5 мл этилацетата, и добавлялось 2 мл 4 норм хлористого водорода в этилацетатном растворе. Растворитель затем удалялся при пониженном давлении. К остатку добавлялись этанол и эфир, и полученные таким образом сырые кристаллы перекристаллизовывались из этанола и эфира, с помощью чего получалось 402 мг дигидрохлорида 3-хинуклидинил 1-(4-пиридил)-1,2,3, 4-тетрагидро-2-изохинолинкарбоксилата в виде бледно-желтых кристаллов.
Точка плавления: 167-169oC (EtOH-Et2O)
Элементный анализ (для C22
H27N3O2
Cl•2.2H2
O)
Вычислено: С(%) 55.51; H(%) 6.65; N(%) 8.83; Cl(%) 14.90.
Найдено: С(%) 55.46, H(%) 6.98, N(%) 8.64, Cl(%) 14.84.
По способу, аналогичному примеру 3, получались соединения примеров 4-6, которые будут описаны ниже.
Пример 4.
Монооксалат 3-хинуклидинил 1,2,3,
4- тетрагидро-1-(2-тиенил)
-2-изохинолинкарбоксилата
Исходное
соединение: Этил 1,2,3,4-тетрагидро-1-(2-тиенил)-2- изохинолинкарбоксилат
Элементный
анализ (для C23H26N2O6S•1.3H2O)
Вычислено: С(%) 57.32; H(%) 5.98; N(%) 5.81; S(%) 6.65.
Найдено: С(%) 57.62; H(%) 6.00; N(%) 5.84; S(%) 6.27.
Масс-анализ (m/z, FAB): 369 (М+ + 1)
Пример 5. (RS, 3'R)-3'-хинуклидинил 1,2,3,
4- тетрагидро-1-(3-тиенил)-2-изохинолинкарбоксилат
Исходные
соединения: этил 1,2,3,
4-тетрагидро-1-(3-тиенил)-2- изохинолинкарбоксилат,
(3R)-3-хинуклидинол
Свойства: Коричневое
масло
Элементный анализ (для C21H24N2O2
S•0.3H2O)
Вычислено: С(%)
67.46; H(%) 6.63; N(%) 7.49; S(%) 8.58;
Найдено: С(%) 67.35; H(%) 6.76; N(%) 7.21; S(%) 8.46.
Масс-анализ (m/z, FAB):
369 (М+ + 1)
Пример 6
3-Хинуклидинил 1-(2-фурил) -1,2,3,
4-тетрагидро-2-изохинолинкарбоксилат
Исходное соединение: этил 1-(2-фурил)-1,2,
3,
4-тетрагидро-2- изохинолинкарбоксилат
Свойства: Бледно-желтое
масло
Элементный анализ (для
C21H24N2O3•0.5H2O
Вычислено: С(%) 69.79; H(%) 6.97; N(%) 7.75;
Найдено: С(%)
70.03; H(%) 7.05; N (%) 7.44.
Масс-анализ (m/z, FAB): 353 (М+ + 1)
Пример 7. К 30 мл
пиридинового раствора, содержащего 2.09 г (1S)-1-фенил-1,2,3,
4-тетрагидроизохинолина, добавлялось 2,26 г
моногидрохлорида 3-хинуклидинилхлорформиата при комнатной температуре с последующим
перемешиванием при 80oC в течение 4 часов. Затем
добавлялось
0.12 г моногидрохлорида
3- хинуклидинилхлорформиата с последующим перемешиванием при 80oC в течение 4 часов.
Затем
добавлялось 1.01 г моногидрохлорида
3- хинуклидинилхлорформиата, и смесь
перемешивалась при 80oC в течение 25 часов. Реакционная смесь концентрировалась при пониженном давлении. К
остатку добавлялась вода, с последующей
промывкой дважды этилацетатом.
Получающийся водный слой доводился до
pH 9 с помощью насыщенного водного раствора бикарбоната натрия с последующей
экстракцией
этилацетатом. После того, как
органический слой сушился над безводным
сульфатом натрия, растворитель удалялся
при пониженном давлении, посредством чего получалось 3.02 г (1S,
3'RS)-3'-хинуклидинил
1-фенил-1,2,3,
4-тетрагидро-2-изохинолинкарбоксилата в виде желтого
масла.
Масс-анализ (m/z,
FAB): 363 (М+ + 1)
Спектр ядерно-магнитного
резонанса (ДМСО-d6, ТМС
внутренний стандарт)
δ: 1.20-2.00 (5H, м.),
2.40-2.95 (6H, м.), 3.00- 3.60 (3H, м.),
3.80-3.95 (1H, м.), 4.55-4.70 (1H, м.), 6.25 (1H, шир. с.),
7.05-7.35 (10H, м.).
Пример 8. К 120 мл толуольной суспензии, содержащей 12.0 г (1S)-этил-1-фенил-1,2,3, 4-тетрагидро-2- изохинолинкарбоксилата и 16.27 г (3R)-3-хинуклидинола, добавлялось при комнатной температуре 1,69 г гидрида натрия (60%). Получающаяся смесь нагревалась в течение 3 часов, при этом получающийся этанол удалялся вместе с толуолом. Реакционная смесь охлаждалась до комнатной температуры, и добавлялось 50 мл солевого раствора с последующей экстракцией этилацетатом. Органический слой промывался водой и затем экстрагировался 20% соляной кислотой. Получающийся водный слой доводился до pH 9-10 добавлением 1 норм. водного раствора гидроокиси натрия с последующим экстрагированием этилацетатом. Органический слой промывался солевым раствором, сушился над безводным сульфатом натрия, а затем концентрировался при пониженном давлении. Остаток растворялся в 140 мл этанола, и к получающемуся раствору добавлялось 10 мл 4 норм. хлористого водорода в этилацетатном растворе. Растворитель затем удалялся при пониженном давлении. К остатку добавлялись ацетонитрил и эфир, и получающиеся сырые или неочищенные кристаллы перекристаллизовывались из ацетонитрила и эфира, в результате чего получалось 10.1 моногидрохлорида (1S, 3'R)-3'-хинуклидинил 1-фенил-1,2,3, 4- тетрагидро-2-изохинолинкарбоксилата в виде бесцветных кристаллов.
Точка
плавления: 212-214oC
(CH3CN-Et2O)
Элементный анализ (для C23H27N2O2Cl)
Вычислено: С(%) 69.25; H(%) 6.82;
N(%) 7.02, Cl(%) 8.89,
Найдено: С(%) 69.24; H(%) 6.89; N(%)
7.03; Cl(%) 8.97.
Удельное оптическое вращение [α]
По способу, аналогичному
способу примера 8, получались соединения
следующих примеров 9-16.
Пример
9. Моногидрохлорид (1R,
3'S)-3'-хинуклидинил 1-фенил-1,2,3,
4- тетрагидро-2-изохинолинкарбоксилата
Исходные соединения: (1R)-этил 1-фенил-1,
2,3,4-тетрагидро-2-изохинолинкарбоксилат,
(3S)-3- хинуклидинол
Точка плавления: 211-212oC
(EtOH-Et2O)
Элементный анализ
(для C23H27
N2O2Cl•0.25H2O)
Вычислено:
С(%) 68,48; H(%) 6.87; N(%) 6.94; Cl(%)
8.79;
Найдено: С(%) 68.32; H(%) 6.75; N(%)
6.94; Cl(%) 8.94.
Удельное оптическое вращение [α
]
Пример 10.
Моногидрохлорид (1R, 3'R)-3-'-хинуклидинил 1-фенил-1,
2,3,
4-тетрагидро-2-изохинолинкарбоксилата
Исходные соединения:
(1R)-этил 1-фенил-1,2,3,
4-тетрагидро-2- изохинолинкарбоксилат, (3R)
-3-хинуклидинол
Точка плавления: 195-196oC
(EtOH-Et2O)
Элементный анализ (для C23
H27N2O2Cl•0.25H2O)
Вычислено: С(%) 68.48, H(%) 6.87, N(%)
6.94, Cl(%)
8.79;
Найдено: С(%) 68.73, H(%) 6.88, N(%) 6.95, Cl(%)
8.70.
Удельное оптическое вращение [α
]
Пример 11.
Моногидрохлорид (1S, 3'S)-3'-хинуклидинил
1- фенил-1,2,3,4-тетрагидро-2-изохинолинкарбоксилата
Исходные
соединения: (1S)-этил 1-фенил-1,2,3,4-тетрагидро-2- изохинолинкарбоксилат,
(3S)
-3-хинуклидинол
Точка плавления:
194-195oC (CH3CN-Et2O)
Элементный
анализ (для C23H27N2O2Cl)
Вычислено: С(%) 69.25; H(%) 6.82; N(%)
7.02; Cl(%) 8.89;
Найдено: С(%) 69.08;, H(%) 6.71; N(%) 6.99;
Cl(%)
8.91.
Удельное оптическое вращение [α]
Пример 12. Монофумарат 3-хинуклидинил 1-(4-хлорфенил)- 1,2,3,
4-тетрагидро-2-изохинолинкарбоксилата
Исходные соединения: 1-(4-хлорфенил)-1,2,3,4-тетрагидро-2-изохинолинкарбоксилат
Точка плавления: 164-166oC (EtOH-Et2O)
Элементный анализ (для C27
H29N2O6Cl•0.5H2O)
Вычислено: С(%)
62.13; H(%) 5.79; N(%) 5.37; Cl(%) 6.79;
Найдено: С(%)
62.19; H(%) 5.68; N(%) 5.23; Cl(%)
6.49.
Пример 13. (1RS, 3' R)-3'-Хинуклидинил 1-(4-фторфенил)-1,2,
3,
4-тетрагидро-2-изохинолинкарбоксилат
Исходные соединения: этил
1-(4-фторфенил)-1,2,3,
4-тетрагидро-2- изохинолинкарбоксилат, (3R)-3-хинуклидинол
Свойства: бесцветное масло
Элементный анализ (для C23H25N2O2F•
0.1H2O)
Вычислено: С(%) 72.27; H(%) 6.64; N(%) 7.33; F (%) 4.97;
Найдено:
С(%)
72.05, H(%) 6,63; N(%) 7.15; F (%) 4.99.
Масс-анализ (m/z,
FAB): 381
(М+ + 1)
Пример 14. 3-хинуклидинил 1, 2, 3,
4-тетрагидро-1- (4- толил)-2-изохинолинкарбоксилат
Исходные соединения: этил 1, 2,3, 4-тетрагидро-1- (4-толил)
-2-изохинолинкарбоксилат
Свойства: бесцветное масло
Элементный анализ (для C24H28N2O2•0.8H2O)
Вычислено:
С(%)
73.74; H(%) 7.63, N(%) 7.17;
Найдено: С(%) 73.96; H(%)
77.50; N(%) 6.95.
Масс-анализ (m/z, FAB): 377 (М+ + 1)
Пример 15. 3-Хинуклидинил
1-бензил-1, 2, 3,
4- тетрагидро-2-изохинолинкарбоксилат
Исходное
соединение: этил 1-бензил-1,2,3,4-тетрагидро-2- изохинолинкарбоксилат
Свойства: бледно-желтое масло
Элементный анализ (для
C24H28N2O2
•0.5H2O)
Вычислено: С (%) 74.78;, H (%) 7.58; N(%) 7.26;
Найдено: С (%) 74.95; H
(%) 7.83; N(%) 7.18.
Масс-анализ (m/z, FAB): 377 (M+ +
1)
Пример 16. 3 Хинуклидинил 1-циклогексил-1, 2, 3, 4-тетрагидро-2- изохинолинкарбоксилат
Исходные соединения: этил
1-циклогексил-1,2,3,4-тетрагидро-2- изохинолинкарбоксилат
Свойства: бледно-желтое аморфное вещество
Элементный анализ (для C23H32
N2O3
•0.3H2O)
Вычислено: С (%) 73.88; H
(%) 8.79; N(%) 7.49;
Найдено: С (%) 73.76; H (%) 8.75; N(%) 7.37.
Масс-анализ (m/z,
FAB): 369 (М+ +
1)
Пример 17. В 12 мл дихлорметана растворялось
1.20
г (1S, 3'R)-3'-хинуклидинил 1-фенил-1, 2, 3, 4-тетрагидро-2- изохинолинкарбоксилата, при охлаждении льдом
добавлялось 0.33 г бикарбоната
натрия и 0.79 г м-хлорнадбензойной кислоты (80%) с
последующим перемешиванием при комнатной температуре в течение одного часа. К реакционной смеси добавлялась вода,
и затем смесь экстрагировалась
дихлорметаном. Органический слой промывался водным
раствором тиосульфата натрия, а затем сушился над безводным сульфатом магния. Растворитель удалялся затем при
пониженном давлении, и остаток
очищался
с помощью хроматографии на силикагельной
колонке
(хлороформ: метанол = 20:1), посредством чего получалось 0.43 г (1'S,3R)-3-[[(1'-фенил-1',2',3',
4'- тетрагидро-2'-изохинолил)карбонил]окси]хинуклидин
1-оксида.
Свойства:
белое
аморфное вещество
Масс-анализ (m/z, FAB): 379 (М+ + 1)
Спектр
ядерно-магнитного резонанса (CDCl3, ТМС внутренний
стандарт)
δ: 1.85-2.15
(3H,
м.), 2.15-2.35 (2H, м.), 2.75-2.90 (1H, м.), 2.90-2.95 (1H, м.), 3.20- 3.50 (6H, м.),
3.70-3.80 (1H, м.), 3.85- 4.10 (1H, м.), 5.14 (1H, тир.с.), 6.14, 6.43
(1H, шир. с х 2), 7.05- 7.40 (9H,
м.).
Пример 18. К 8 мл 2-бутанонового раствора, содержащего 1.04 г (1S, 3' R)-3'-хинуклидинил 1-фенил-1, 2, 3, 4- тетрагидро-2-изохинолинкарбоксилата, добавлялось 0.18 мл метилиодида с последующим перемешиванием при 55oC в течение 40 минут. После охлаждения на воздухе выпавшие в осадок кристаллы собирались фильтрованием, а затем промывались последовательно 2- бутаноном и диэтиловым эфиром, посредством чего получалось в виде бесцветных кристаллов 0.93 г иодида (1'S, 3R)-1-метил-3-[[(1'- фенил-1', 2', 3', 4' - тетрагидро-2'-изохинолил)карбонил] окси]хинуклидиния.
Точка плавления: 202-203oC (2-бутанон)
Элементный
анализ (для C24H29N2
O2I)
Вычислено: С (%) 57.15; H (%) 5.79;
N(%) 5.55; I (%) 25.16;
Найдено: С(%) 57.17; H (%) 5.71; N(%) 5.51; I(%)
25.15.
По способу, аналогичному способу примера 8, получалось соединение следующего ниже примера 19.
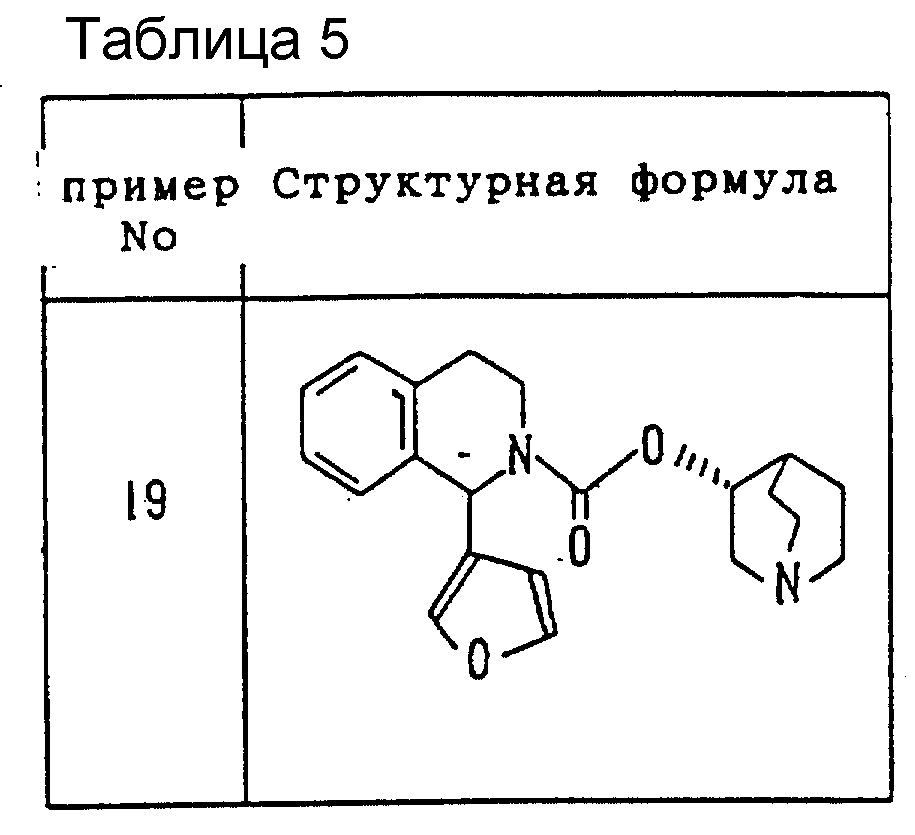
Пример 19. (1RS, 3'R)-3'-Хинуклидинил 1-(3-фурил)-1,2,3,
4-тетрагидро-2- изохинолинкарбоксилат
Исходное
соединение: этил 1-(3-фурил)-1,2,3,
4-тетрагидро- 2-изохинолинкарбоксилат
Свойства: желтое масло
Элементный анализ (для
C21H24N2O3
•
0.3H2O)
Вычислено: С (%) 70.49; H (%) 6.93; N(%) 7.83;
Найдено: С(%) 70.35; H(%) 6,83; N(%) 7.63.
Масс-анализ (m/z. El): 362 (М+)
Химические структурные формулы
соединений, полученных в примерах 1-19, показаны ниже в Таблицах 3-5.
Каждое из описанных выше соединений в примерах 3-6, 12-14, 16 и 19 может быть получено в виде оптической расщепленной формы, как показано в следующих таблицах 6-8, с использованием оптически расщепленного промежуточного продукта по способу, аналогичному способам примеров 8-11.
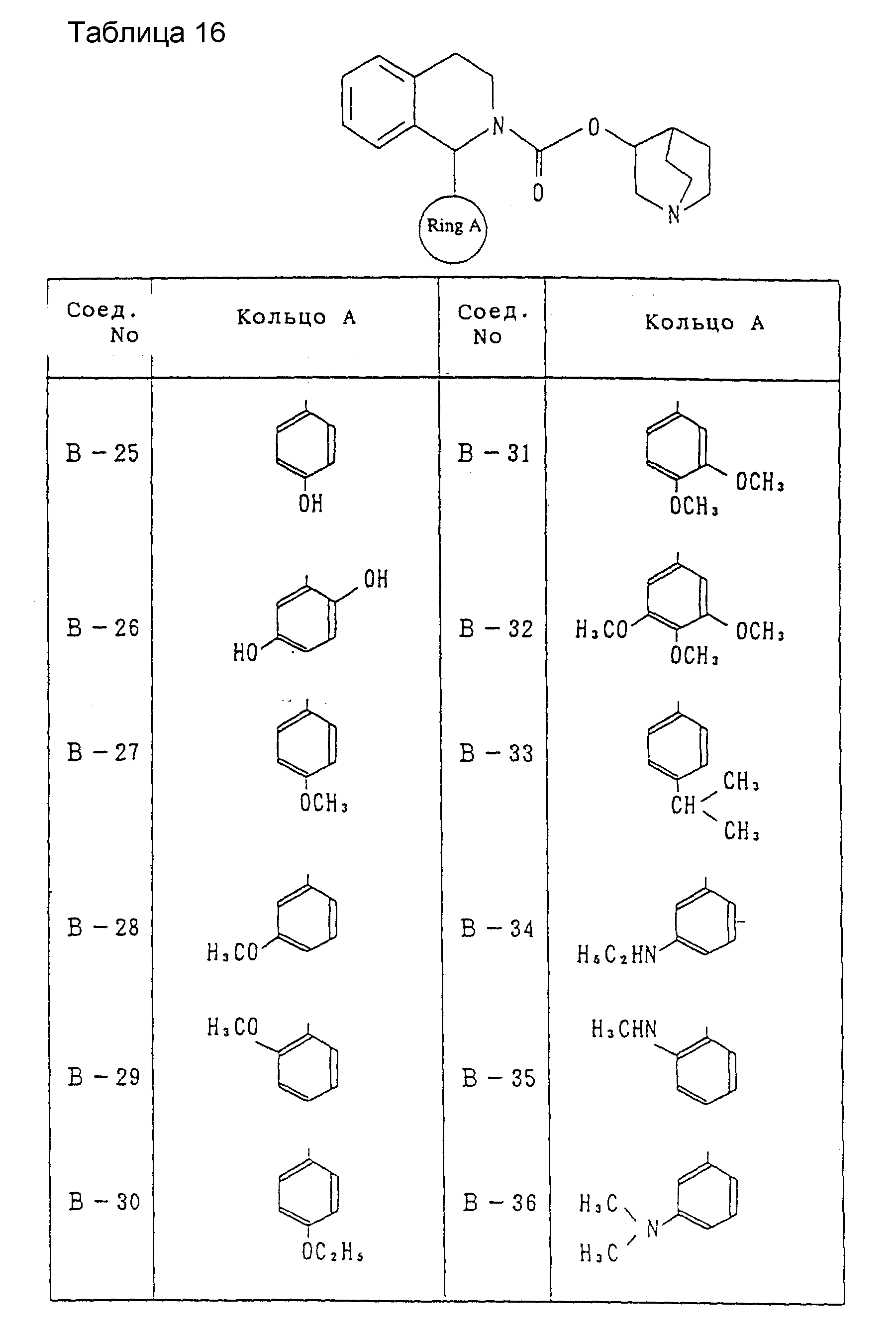
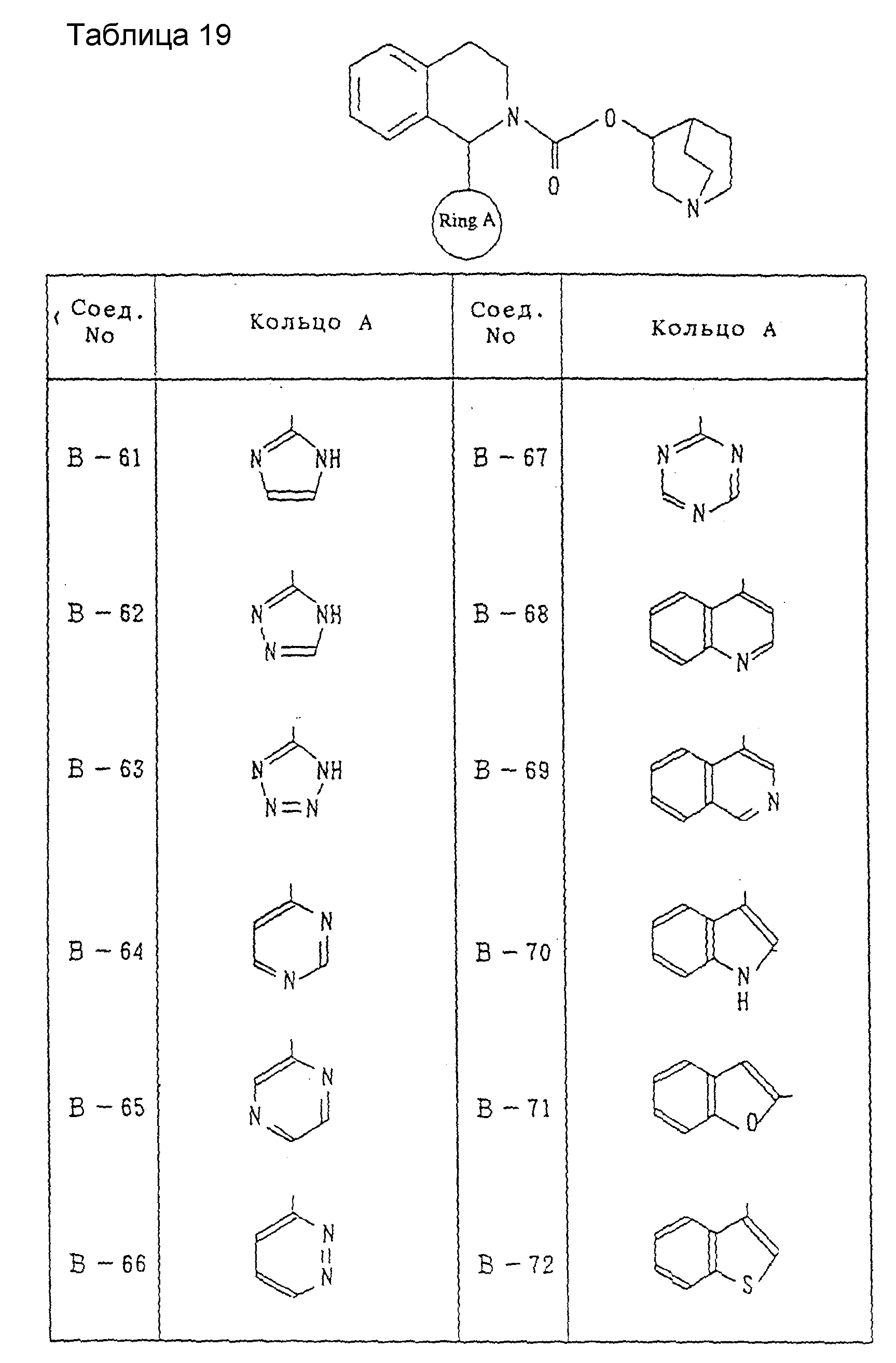
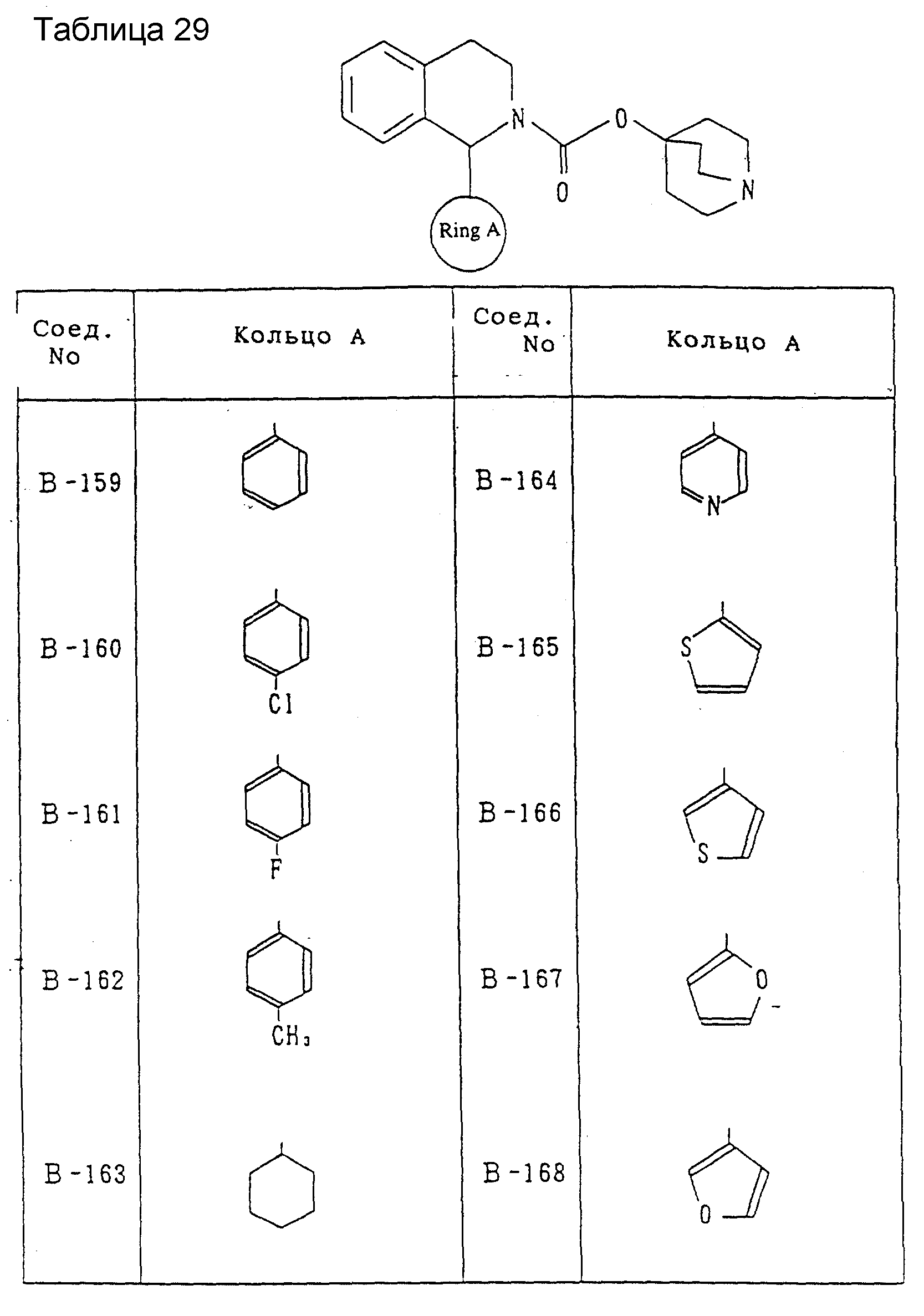
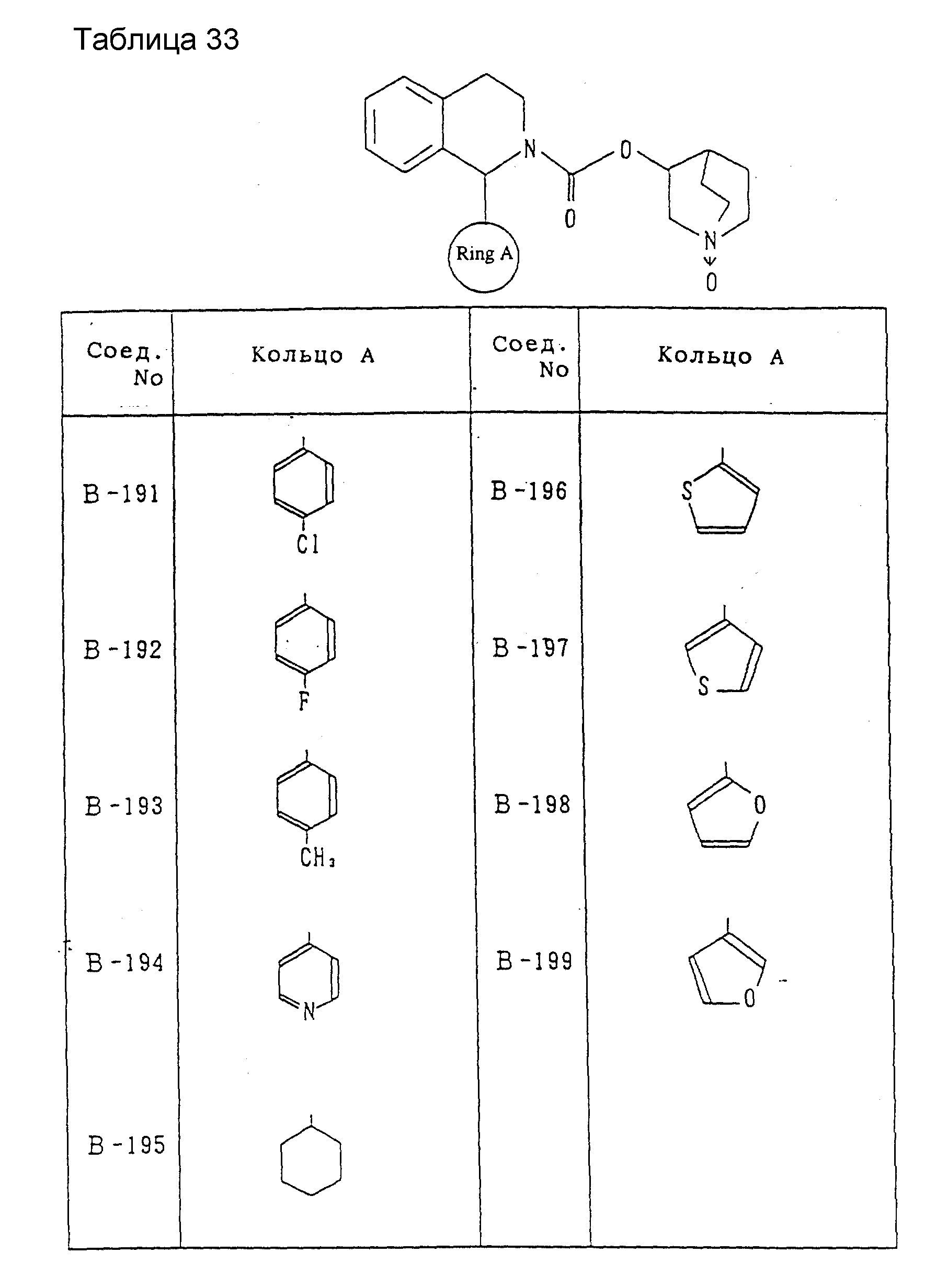
Другие соединения, охватываемые настоящим изобретением, будут показаны в таблицах 9-33. Они могут синтезироваться любым из описанных выше способов получения, способов, описанных в примерах, или способов, известных специалистам в данной области техники, и не требуют представления каких-либо экспериментов. Между прочим, эти соединения описываются в виде рацемических соединений, но включены также оптически активные вещества ввиду наличия асимметрического углерода.
Реферат
Описываются новые производные хинуклидина, представленные формулой (I), в которой кольцо А представляет фенильную группу, которая может быть необязательно замещена атомом галогена или низшей алкильной группой, циклогексильную группу, пиридильную группу, фурильную группу или тиенильную группу; Х представляет одинарную связь или метиленовую группу; l = 0 или 1; n = 1 или 2, или их соли с кислотами, или их четвертичные аммониевые соли. Описываются также фармкомпозиции на их основе. Данные соединения проявляют антогонистический эффект в отношении мускариновых M3-рецепторов и полезны в качестве профилактических или лечебных средств при урологических заболеваниях, респираторных заболеваниях или заболеваниях пищеварительной системы. 2 с. и 3 з.п. ф-лы, 33 табл.
Формула

в которой кольцо А представляет фенильную группу, которая может быть необязательно замещена атомом галогена или низшей алкильной группой, циклогексильную группу, пиридильную группу, фурильную группу или тиенильную группу;
Х представляет одинарную связь или метиленовую группу;
l = 0 или 1;
n = 1 или 2,
или их соли с кислотами, или их четвертичные аммониевые соли.
3-хинуклидинил 1-фенил-1,2,3,4-тетрагидро-2-изохинолинкарбоксилат,
3-хинуклидинил 1-(4-пиридил)-1,2,3, 4-тетрагидро-2-изохинолинкарбоксилат,
3-хинуклидинил 1,2,3, 4-тетрагидро-1-(2-тиенил)-2-изохинолинкарбоксилат,
3-хинуклидинил 1,2,3, 4-тетрагидро-1-(3-тиенил)-2-изохинолинкарбоксилат,
3-хинуклидинил (2-фурил)-1,2,3, 4-тетрагидро-2-изохинолинкарбоксилат,
3-хинуклидинил (4-хлорфенил)-1,2,3, 4-тетрагидро-2-изохинолинкарбоксилат,
3-хинуклидинил 1-(4-фторфенил)-1,2,3, 4-тетрагидро-2-изохинолинкарбоксилат,
3-хинуклидинил 1,2,3, 4-тетрагидро-1-(4-толил)-2-изохинолинкарбоксилат,
3-хинуклидинил 1-циклогексил-1,2,3, 4-тетрагидро-2-изохинолинкарбоксилат,
3-хинуклидинил 1-(3-фурил)-1,2,3, 4-тетрагидро-2-изохинолинкарбоксилат,
и их оптически активные изомеры.

в которой кольцо А представляет фенильную группу, которая может быть необязательно замещена атомом галогена или низшей алкильной группой, циклогексильную группу, пиридильную группу, фурильную группу или тиенильную группу;
Х представляет одинарную связь или метиленовую группу;
e = 0 или 1;
n = 1 или 2,
или его соль с кислотой, или его четвертичную аммониевую соль и фармацевтически приемлемый носитель.

Комментарии