6,9-бис(аминозамещенные)-бензо(g)изохинолин-5,10-дионы, способ их получения, фармацевтическая композиция на их основе и способ ингибирования опухолей у млекопитающих - RU2129546C1
Код документа: RU2129546C1
Чертежи








Описание
Изобретение относится к 6,9-бис(аминозамещенным) бензо(g)изохинолин-5, 10-дионам и, более конкретно, к тем, 6,9-заместители которых являются (аминоалкил)аминозаместителями. Было показано, что эти соединения обладают противоопухолевой активностью in vitro и in vivo.
Уже сообщалось, что некоторые 1,4-бис[(аминоалкил)-амино] антрацен-9,10-дионы обладают противоопухолевой активностью при клинических испытаниях. Из наиболее интересных можно привести аметантрон, 1,4-бис{[2-(2-оксиэтиламино)этил] амино} антрацен-9,10-дион, и митоксатрон, 5,8-диокси-1,4-бис{ [2-(2-оксиэтиламино)этил] -амино}антрацен-9,10-дион. (Zee-Cheng et al., J. Med. Chem., (1978). 21. 291-4; Cheng et al, "Progress in Medicinal Chemistry" Ellis, G. Р. and West, G.B., eds.; Elseiver; Amsterdam; 1983; pp. 20, 83 и цитированные там ссылки). Митоксатрон является онколитическим агентом широкого спектра, активность которого подобна активности антрациклинового антибиотика доксорубицина. Клинические испытания показали, что митоксантрон обладает особенно желательной активностью при лечении развивающегося рака груди, острой лейкемии и лимфомы (Legra, Drugs of Today, (1984), 20. 629). Хотя изучение на животных показало снижение кардиотоксичности по сравнению с доксорубицином, некоторая клиническая кардиотоксичность наблюдалась также и для митоксантрона, главным образом у пациентов, ранее получавших доксорубицин (R. Stuart Harris et al., Lancet, (1984), 219, и приведенные там ссылки.
Сообщалось, что аметантрон на животных оказался примерно в 10 раз менее мощным и кардиотоксичным, чем митоксантрон. Поскольку замедленная токсичность наблюдалась только для митоксантрона после введения обоих лекарств интраперитонеальным путем ненесущим крысам, не имеющим опухоли, в эффективных противоопухолевых дозах, предполагается, что наличие 5,8-диокси-замещения в митоксантроне может быть причиной отсрочки смерти (Corrbett et al, Cancer Chemother Pharmacol., 1981), 6. 161).
Кроме того, как митоксантрон, так и аметантрон обладают заметной миелодепрессивной токсичностью и оба соединения показали кросс-устойчивость к гистотипам клеток, развивающим устойчивость против доксорубицина, связанную со сверхэкспрессией гликопротеина P. Такая устойчивость, которую называют полилекарственной устойчивостью, включает ряд противоопухолевых антибиотиков, среди которых амсакрин и производные подофиллотоксина, и это является одной из главных причин терапевтических недостатков при лечении твердых опухолей указанными антибиотиками.
Следовательно, необходим поиск новых антрацендионовых противоопухолевых агентов, обладающих более высоким терапевтическим индексом, чем митоксантрон, и являющихся эффективными как для ингибирования, так и для замедления роста таких твердых опухолей, которые являются более упорными для хемотерапевтического лечения (такие как опухоли легких, груди и толстой кишки) и против гистотипов опухолей, развивающих полилекарственную устойчивость.
При поиске более безопасных, активных аналогов антрацендионов были изучены соединения, несущие гидроксильные заместители и/или (аминоалкил)аминные боковые цепи в различных положениях антрацен-9,10-дионового ядра (Cheng et al., Drugs of the Future, (1983). 8. 229), без заметного успеха.
Аза- и диаза-антрацен-9,10-дионы, такие как 6, 9-бис(этоксикарбониламино)бензо(g)хинолин-5,10-дион (1), 6,9-бис(этоксикарбониламино)бензо(g)хиназолин-5,10-дион (2), 6,9-бис(этоксикарбониламино)(g)хиназолин-5,10-дион (3), были описаны Поттом с сотрудниками (Synthesis, 1983, 31). Сообщалось, что эти соединения являются родственными противоопухолевым 1,4-бис(аминоалкил)амино)антрацен-9,10-дионам; однако не приводятся данные о противоопухолевой активности какого-либо из приведенных выше соединений. 1[(аминоалкил)амино]производные (4) 6,9-диоксибензо(g)изохинолин-5,10-диона, родственные митоксантрону, были описаны как промежуточные соединения ДНК, но они полностью лишены какой-либо "in vitro" или "in vivo" противоопухолевой активности (Croisy-Delcey et al, Eur J. Med. Chem., (1988), 23. 101-106).
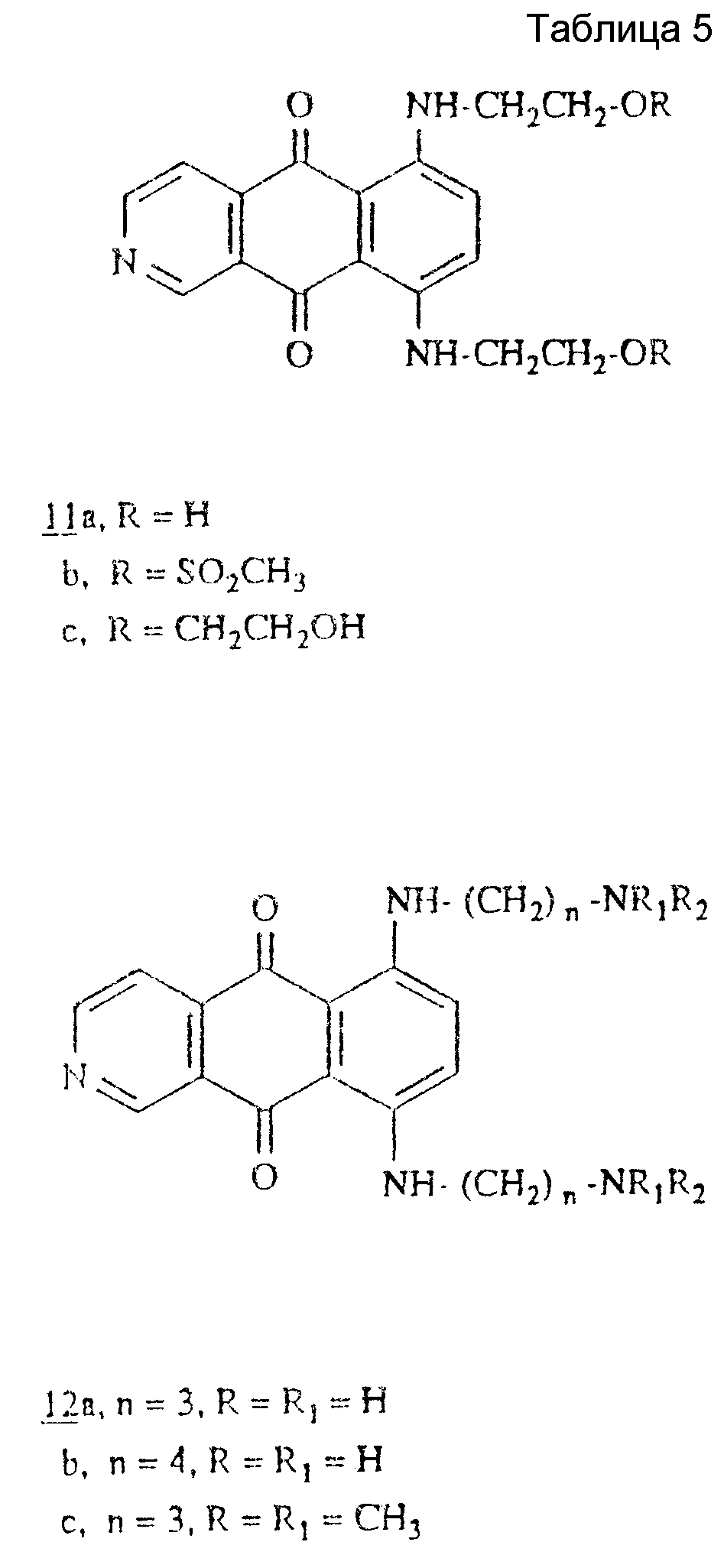
6, 9-бис[(Аминоалкил/амино] бензо(g)хинолин-5,10-дионы формулы 5a-d (смотри таблицу 1) были описаны в J. Med. Chem (1985), 28. 1124-1126, где они были упомянуты как 5, 8-бис/(аминоалкил)амино/-1-азаантрацендионы.
Как указано в таблице II, здесь далее приведены известные соединения 5, которые являются менее активными, чем соответствующие карбоциклические аналоги (6).
Действительно, как указано в таблице 11, соединения 5a и 5b являются менее цитотоксическими, чем аналоги 6a и 6b. Кроме того, соединение 5a, которые является мало цитотоксическим in vitro, не активно in vivo и оно менее активно и менее мощное, чем карбоциклический аналог 6a.
Даже хотя введение гетероатома является обычным способом медицинской химии, его эффект может быть оценен в каждом конкретном случае.
В данном случае аза-аналоги известных антрацендионов четко показали, что введение атома азота в скелет антрацендиона ухудшает противоопухолевую активность. Действительно аза-замещенные антрацендионы являются менее цитотоксическими, чем соответствующие антрацендионы и не активны "in vivo".
Следовательно, специалист в данной области не может рассматривать введение гетероатомов в скелет антрацендиона как возможный путь для получения более эффективных противоопухолевых агентов.
Хорошо известно, что скрининг для обнаружения противоопухолевого агента митоксантрона (J. Med Chem., (1978), 21. 291-294) среди ряда аналогов был проведен с использованием экспериментальной модели лейкемии мыши Р388: эта модель затем предсказала противоопухолевую активность у людей, по крайней мере, для класса противоопухолевых антибиотиков. Многие другие клинические активные противоопухолевые антибиотики являются активными на лейкемиях мыши P388 и L1210, такие как м-амсакрин и доксорубицин.
Кроме того, митоксантрон показал хорошую активность в других показателях экспериментальных опухолях, таких как карцинома легкого Льюиса у мыши и MXI карцинома молочной железы человека.
Теперь обнаружено, что соединения изобретения 6, 9-бис[(аминоалкил)амино] бензо(g)изохинолин-5,10-дионы являются активными как противоопухолевые агенты: они являются высоко эффективными против лейкемий мыши L1210 и P388 и против карциномы Льюиса легкого и MXI карциномы молочной железы человека (см. табл. II).
Краткое изложение изобретения
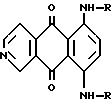
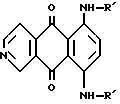
Соединения изобретения имеют формулу:

где R является C1-C10-алкилом, фенилом или C7-C10-аралкилом;
C2-C10-алкилом, имеющим один или два заместителя, выбранных в группе, состоящей из OR1 и -NR2R3;
C2-C10-алкилом, прерванным одним или двумя атомами кислорода, или одним членом, выбранным в группе, состоящей из
-NR4-, цис-CH= CH-, транс-CH= CH-, -C=C-, и необязательно замещенного одним или двумя гидроксилами (OH) или -NR2R3-группами;
R1 выбран в группе, состоящей из водорода, C1-C6-алкила, фенила, C7-C10-аралкила, -CHO, -COR5, -COOR5, -S(O2)R5, C2-C6-алкила, необязательно замещенного -NR2R3;
R2 и R3 могут быть одинаковыми или различными и выбраны в группе, состоящей из водорода, C1-C10-алкила, C7-C10-аралкила, фенила C2-C10-алкила, замещенного одним или двумя гидроксила (OH), -CHO, -COR5, -COOR5, -S/O2/R5, один из R2 или R3 является H, а другой является -C/=NH/NH2, или R2 и R3, взятые вместе с атомом азота, к которому они присоединены, образуют этилениминное кольцо или 5- или 6-тичленный ароматический или неароматический гетероцикл, который может содержать другой гетероатом, такой как сера, кислород или азот;
R4 выбран в группе, состоящей из водорода, C1-C10 -алкила, C2-C10-оксиалкила, C2-C10-алкила, замещенного -NR2R3, C7-C10-аралкила, фенила, -COR5, -COOR5 или -S/O2/R5;
R5 выбран в группе, состоящей из C1-C10-алкила, C7-C10-аралкила, α-, β- или γ-нафтила, фенила, o-, m- и n-толила;
в виде свободных оснований или их солей с фармацевтически приемлемыми кислотами.
Настоящее изобретение также относится к таутомерным формам, единичным энантиомерам и диастереоизомерам соединений формулы (I), а также к их смесям.
Настоящее изобретение также относится к нетоксичным солям соединений формулы (I) с кислотами, приемлемыми для фармацевтического и ветеринарного использования, такими как те, что получены при присоединении неорганических кислот, например, соляной, бромистоводородной, серной, фосфорной, фосфористой кислоты, и/или органических кислот, таких как уксусная пропионовая, лимонная, бензойная, молочная, малеиновая, фумаровая, винная, глютаминовая, аспаргиновая глюконовая, аскорбиновая кислоты и т.п.
Детальное описание изобретения
В соединениях (1) термин "фенил" означает фенильные кольца, которые могут быть
необязательно замещены, например (C1-C4)алкилами, CF3, атомами галоида, нитро, амино, ацетиламино, формиламино, диметиламино, окси, метокси и этоксигруппами.
Предпочтительными примерами C1-C10-алкильных групп являются метил, этил, н-пропил, втор.-пропил, н-бутил, втор-бутил, трет.бутил, н-пентил, н-гексил.
Предпочтительными примерами C7-C10-аралкилов являются бензил и 4-метоксибензил. Когда в соединениях формулы (I) R является C2-C10-алкилом, прерванным одним или двумя атомами кислорода или одним, членом в группе, состоящей из -NR4, цис-CH=CH-, транс-CH=CH-, -CH=C-, и необязательно замещенным одним или двумя гидроксилами или -NR2R3 группами по крайней мере два атома углерода предпочтительно расположены между указанными атомами кислорода и/или -NR4 и -NR2R3.
Когда в соединениях формулы (I) - NR2R3 заместитель является 5-6-членным ароматическим или неароматическим гетероциклом, который может содержать другой гетероатом, такой как сера, кислород, и азот, предпочтительными примерами указанных гетероциклов являются 1-имидазолил, 1-пирролил, 1-тетрагидропирролил, 1-пиразолил, 4-морфолинил, 1-пиперидинил, 1-пиперазинил, 1-(4-метил)пиперазинил, 1-(4-бензил)пиперазинил.
Особенно предпочтительными являются соединения формулы (I), в которой R является C2-C10-алкилом, выбранным в
группе, состоящей из:
- остатка формулы -(CH2)p-NH2, где p равно 2, 3 или 4;
- остатка формулы -(CH2)p-NR2R3, где р имеет указанные ранее значения, а R2 и R3 являются C1-C6-алкилом, или взятые вместе с атомом азота, они образуют гетероцикл, выбранный в
группе, состоящей из 1-этиленимина, 1-пирролидина, 4-морфолина, 1-пиперазина, 4-метил-1-пиперазина, 4-бензил-1-пиперазина, 1-пиперидина,
- остатка формулы -(CH2)p-NR2R3, где p имеет указанные ранее значения, и R2 является водородом и R3 является C1-C6-алкилом,
- остатка формулы

- остатка формулы -(CH2)p-NH-/CH2 /q-OH, где p и q независимо являются целым числом, выбранным в группе, состоящей из 2, 3, 4,
- остатка формулы -(CH2)p-OH, где p имеет значения, указанные выше,
- остатка формулы -(CH2p-O-(CH2)g-OH, где p и g имеются указанные ранее значения.
Конкретными примерами
предпочтительных соединений настоящего изобретения являются следующие:
6,9-бис{[(2-(амино)этил]амино}бензо(g)изохинолин-5,10-дион,
6,
9-бис{[(2-(4-морфолино)этил]амино}бензо(g)изохинолин-5,10-дион,
6,9-бис{[(2-(диметиламино)этил]амино}бензо(g)изохинолин-5,10-дион,
6,
9-бис{[(2-(диэтиламино)этил]амино}бензо(g)изохинолин-5,10-дион,
6,9-бис{ [(2-/ди(втор. -пропил)амино]этиламино}бензо(g)изохинолин-5,10-дион,
6,
9-бис{[(2-(1'-пирролидино)этил)амино}бензо(g)изохинолин-5,10-дион,
6,9-бис{[(2-(1'-азиридино)этил)амино}бензо(g)изохинолин-5,10-дион,
6,
9-бис{[(2-(метансульфонилокси)этил)амино}бензо(g)изохинолин-5,10-дион,
6,9-бис{[(4-(амино)бутил]амино}бензо(g)изохинолин-5,10-дион,
6,
9-бис{[(3-(амино)пропил]амино}бензо(g)изохинолин-5,10-дион,
6,9-бис{[(2-[(2-оксиэтил)амино]этил]амино}бензо(g)изохинолин-5,10-дион,
6,
9-бис{[(3-(диметиламино)пропил]амино}бензо(g)изохинолин-5,10-дион,
6,9-бис{[(2-окси)этил]амино}бензо(g)изохинолин-5,10-дион,
6,9-бис{[(2-(2-оксиэтокси)этил]амино}бензо(g)изохинолин-5,
10-дион,
6,9-бис{[(2-(метиламино)этил]амино}бензо(g)изохинолин-5,10-дион,
6,9-бис{[(2-(этиламино)этил]амино}бензо(g)изохинолин-5,10-дион,
6,
9-бис{[2-(н-пропиламино)этил]амино}бензо(g)изохинолин-5,10-дион,
6,9-бис{[2-(втор.-пропиламино)этил]амино}бензо(g)изохинолин-5,10-дион,
6,
9-бис{[2-(гуанидино)этил]амино}бензо(g)изохинолин-5,10-дион,
6,9-бис{[(2-амино-2,2-диметил)этил]амино}бензо(g)изохинолин-5,10-дион.
Соединения настоящего изобретения могут
быть получены при взаимодействии 6,9-дифторбензо(g)изохинолин-5,10-диона формулы (II)

с соединением формулы (III)
R' - NH2, (III)
где R' имеет те же значения, что указано в формуле (I) для R, или является группой, которая может быть превращена в R, чтобы получить соединение формулы (Ia)

а затем необязательно проводят одну или несколько следующих стадий
а) когда R' является отличным от R, предотвращают R' в R, чтобы получить соединение формулы (I),
б) когда R' является одной из групп, определенных выше для R в соединении формулы (I), и в случае, когда соединения формулы (Ia) являются такими же, как соединения формулы (I), R' может быть необязательно превращен в другую R группу, чтобы получить другое соединение формулы (I);
в) необязательно превращение в соль или сольват полученных соединений формулы (I) или разделение изомеров.
Реакцию соединения формулы (II) с соединением формулы (III) обычно проводят в присутствии стехиометрического количества или незначительного молярного избытка соединения формулы (III) в растворителе, таком как метиленхлорид, хлороформ, 1,1,1-трихлорэтан, диметоксиэтан, тетрагидрофуран, диметилсульфоксид, диметилформамид, пиридин, пиколин и их смеси, или, если это желательно, используя соединение (III) само как растворитель, необязательно в присутствии неорганического основания, такого как карбонат щелочного или щелочноземельного металла или бикарбонат, или органического основания, такого как триалкиламин, при температуре от 0oC до температуры кипения с обратным холодильником растворителя.
Предпочтительно реакцию проводят в растворителе, таком как пиридин, хлороформ или диметилсульфоксид, используя 2-10 эквивалентов соединения (III) на 1 эквивалент соединения (II) и работая при температуре от комнатной до 50oC.
Если это желательно, соединения формулы (I), в которых R
является оксиалкиламиноалкильной группой формулы
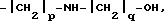
где p и q имеют указанные ранее значения,
могут быть получены при реакции соединения формулы (I), в которой R является группой формулы


где E является защищающей гидроксил группой, такой как триалкилсилан, (диалкил)арилсилан, формил, ацетил, после этой реакции необязательно может последователь удаление защищающей группы E.
Если это желательно, соединения формулы (I), в которой R является группой формулы


где R3 является водородом или C1-C6-алкилом, а p и q определены в формуле (I), чтобы получить соединение формулы (Ia), в которой R' является группой формулы

Полезные рекомендации по удалению указанных выше защищающих групп могут быть найдены у Green T.W., Wuts P.G.M., "Защищающие группы в органическом синтезе", 2-е издание. Джон Вайлей энд санс (1991).
Соединения формулы (I), у которых R является группой формулы



например, по методике, описанной в Tetra Lett (1988), 29, 3183 - 3186.
6,9-дифторбензо(g)изохинолин-5,10-дион формулы (II) может быть получен по многостадийной процедуре, включающей ацилирование по Фриделю-Крафтсу 1,4-дифторбензола ангидридом
пиридин-3,4-дикарбоновой кислоты, получая в результате соединения со структурой согласно формулам (VIIa) и (VIIb)
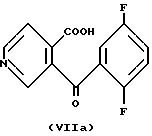

Соединения формул (VIIa) и (VIIb) затем могут быть подвергнуты реакции циклизации в 30%-й дымящейся серной кислоте (олеуме) приблизительно при 140oC, чтобы получить соединение формулы (II).
Соединения формул (III), (IV) и (V) являются известными, коммерчески доступными или же они могут быть получены по известным методикам.
Например, соединения формулы (V) могут быть получены по методикам, описанным в Synth. Comm. (1990), 20, 2559 и в J. Med. Chem., (1990), 33, 97.
Оценку биологической активности соединений настоящего изобретения осуществляли in vitro и in vivo по протоколам, разработанным в Американском Национальном Институте Рака.
Оценка in vitro цитотоксической активности соединений настоящего изобретения осуществляется при использовании клеточной линии человеческой аденокарциномы толстой кишки (Lovo), выделенной из метастазного узла, и сублинии с требуемой устойчивостью к ряду противоопухолевых агентов, среди которых доксорубицин, VP-16 и винкристин. Эта сублиния (называемая Lovo (ДХ)) показывает пониженное накопление доксорубицина и сверхэкспрессию протеина (Grandi M., Geroni C., Giuliani F.C., British, J. Cancer, (1986), 54, 515). Соединения были испытаны в МТТ-анализе (Mosman T., Быстрый колориметрический анализ клеточного роста и выживания: применение к пролиферации и анализу цитотоксичности", J. Immunol. Methods, (1983), 65, 55 - 63; Green L.M., "Быстрый колориметрический анализ выживаемости клеток, применение к количественному определению цитотоксичности и ингибирующего роста лимфокинеза", J. Immunol. Methods, (1984), 70, 257 - 268) по сравнению с митоксантроном, аметантроном и доксорубицином. Данные приведены в таблице VI.
В общем типичные соединения настоящего изобретения оказались такими же цитотоксичными, как аметантрон и митоксантрон на клеточной линии Lovo, наиболее высокую токсичность (выше, чем у митоксантрона) показало соединение 6,9-бис{ [2-(диметиламино)этил] амино} -бензо(g)изохинолин-5,10-дион (10a), описанное в примере 4 экспериментального раздела. При испытании аметатрона или митоксантрона на клеточной линии Lovo (ДХ индекс устойчивости И.У.), определенный как отношение ИК50 для устойчивой клеточной линии к ИК50 для чувствительной клеточной линии) является таким высоким, как 101,2 и 29,0 соответственно, что указывает на то, что эта сублиния обладает требуемой устойчивостью к митоксантрону и аметантрону. С другой стороны, при испытании типичных соединений настоящего изобретения на той же самой устойчивой сублинии не происходит перекрывание устойчивости с митоксантроном и аметантроном, как наблюдалось для соединений 10a, 12c, 10b, 10e и 10o, описанных в примерах 4, 22, 5, 8 и 7 экспериментального раздела соответственно. В общем эти соединения показывают на устойчивой сублинии такую же ИК50, как показал аметантрон на чувствительной Lovo клеточной линии. В частности, соединение 10a является более активным, чем митоксантрон на клеточной линии Lovo /ДХ.
Эти данные in vitro подтверждают, что типичные соединения настоящего изобретения могут быть полезными для преодоления многолекарственной устойчивости, медиированной механизмом устойчивости клетки.
Оценка in vitro цитотоксичности также осуществлялась на клетках L1210 лейкемии мыши при использовании вышеупомянутых клеток,
поддерживаемых в суспензионных культурах (среда) Маекоя, дополненная 10% лошадиной сыворотки, глютамином, пенициллином и стрептомицином), выращиваемых во влажной окружающей среде с 10% диоксида
углерода и 90% воздуха при 37oC. Соединения растворяют в диметилсульфоксиде (ДМСО) и прибавляют к суспендированным клеткам в соответствующих концентрациях. После 72 часов непрерывной
экспозиции подсчитывают концентрацию клеток, используя счетчик Коилтер и рассчитывают ингибирование роста, используя формулу:
% ингибирования роста - 1 - (количество обработанных клеток)
(количество клеток с одним ДМСО) • 100
Рассчитывают ИК50 из данных по ингибированию роста и они приведены в таблице VII по сравнению с известным соединением 5a (смотри
таблицу I для структуры 5a).
Изучение биологической активности in vivo типичных соединений настоящего изобретения проводили с использованием P388 и L1210 моделей лейкемии мыши.
Клетки P388 лейкемии мыши вводили интраперитонеально (ип) или внутривенно (ив) мышам CD2F1. Лечение начинали примерно через 24 часа после трансплантации опухоли и лекарство дозировали ип
(P388) ип/ип (или (вв)) (P388 (вв/вв) согласно предварительно установленным протоколам, обычно с 3-х дневным (P388 вв/вв) и 4-й дневным (P388 ип/ип) интервалами. Изучение проводилось в течение
60-дневного периода и регистрировали дату смерти каждого животного. Определяли % Т/С, используя среднее время выживания (СВВ) для каждой группы согласно формуле
% Т/С = ((СВВ обработанных)
/ (СВВ контроля)) • 100
Например, два типичных соединения настоящего изобретения, а именно 6,9-бис{ [2-(амино)этил] амино}бензо(g)изохинолин-5,10-дион 10i в виде дималеатной соли (10i
дималеат), описанный в примере 12, и 6,9-бис{[(2-диметиламино)этил] амино}бензо(g)изохинолин-5,10-дион, 10a, описанный в примере 4, показали более высокую активность, чем митоксантрон на модели P388
вв/вв. Соединение 10i настоящего изобретения, как в виде гидрохлорида (10i. HСl), так и в
виде дималеатной соли (10i дималеат), описанное в примере 12, также было более активно, чем митоксантрон на
модели P388 ип/ип. Кроме того, приведенные выше типичные соединения настоящего изобретения показали антилейкемическую активность в широком интервале хорошо переносимых дозировок и, в частности, они
являются активными при дозах, которые являются ниже, чем максимально переносимая доза, обеспечивая указанные для более благоприятного терапевтического индекса по сравнению с митоксантроном. Результаты
показаны в таблице VIII и таблице IX.
Противоопухолевая активность типичных соединений настоящего изобретения была также оценена на модели L1210 лейкемии мыши.
Клетки
L1210 были интраперитонеально введены мышам CDF1 и лечение начинали приблизительно через 24 часа после трансплантации опухоли. Дозировки лекарства вводили ип согласно заранее установленному протоколу,
обычно с 4-х дневным интервалом. Исследования проводили в течение 60 дней и регистрировали дату смерти каждого животного. Определяли % Т/С, используя среднее время выживания (СВВ) для каждой группы
согласно формуле
% Т/С = /(СВВ обработанных) / (СВВ контроля)/ • 100
Результаты показаны в таблицах X и XI.
Из таблицы X видно, что неожиданно более высокую противолейкемическую активность показали типичные соединения изобретения (а именно соединение 10a примера 4, соединение 10i HCl примера 12 и 6,9-бис{[2-(2-оксиэтиламино)этил] амино}бензо(g)-изохинолин-5,10-дион 10l, полученный в примере 17 (дималеатная соль) (по сравнению с известным соединением 5a).
Из таблицы XI снова четко видно благоприятное сравнение между отличной противолейкемической активностью соединения 10i HCl и митоксантрона.
Активность против твердых опухолей соединений изобретения была показана при использовании моделей карциномы Льюиса легкого на мышах и на человеческой карциноме МХ-1 молочной железы. Эти модели опухолей были заключены в группу из восьми трансплантированных опухолей, используя США-NCl в качестве группы скрининга для отбора клинически полезных противоопухолевых агентов (R.K.Y.Zee Cheng. and C.C. Cheng, "Скрининг и оценка противоопухолевых агентов", Meth. and Find. Clin. Pharmacol., (1988), 10(2), 67 - 101). В качестве примера, в таблице XII показаны данные по активности против этих двух твердых опухолей одного из типичных соединений настоящего изобретения, 6,9-бис{ [(2-амино)этил] амино} бензо(g)изохинолин-5,10-диона дималеата (10i малеат, пример 12).
Поскольку типичные соединения настоящего изобретения показали хорошие результаты на in vivo моделях P388 и L1210 лейкемии мыши, карциномы Льюиса легкого мыши и человеческой МХ-1 карциномы молочной железы, которые, как отмечалось ранее, предполагают хорошие результаты на людях, ожидается, что описанные здесь соединения будет работать против лейкемии человека и твердых опухолей.
Следовательно, соединения настоящего изобретения могут быть использованы в качестве активного ингредиента терапевтических композиций, чтобы вызвать регрессию и/или облегчение рака у млекопитающих при введении в количествах в интервале от примерно 1 мг до примерно 0,4 г на килограмм массы тела. Предпочтительный интервал доз будет от примерно 1 мг до примерно 50 мг/кг массы тела в день. Единицы дозировки могут быть применены таким образом, что от примерно 70 мг до примерно 3,5 г активного соединения для субъекта массой примерно 70 мг будут введены в течение 24-х часового периода. Дозировка может быть установлена, чтобы быть совместимой с другими режимами лечения, такими как лучевая терапия.
Фармацевтические композиции могут быть в виде таблеток, капсул, гелевых капсул, свеч, лиофилизированных порошков и растворов для внутреннего введения.
Изобретение иллюстрируется следующими неограничивающими примерами и вариациями, которые легко очевидны для специалистов в данной области. Относящиеся к делу формулы приведены в таблицах I, III, IV и V.
Пример 1.
Ангидрид пиридин-3,4-дикарбоновой кислоты (7)
Смесь 15,0 г (0,09 моля) пиридин-3,4-дикарбоновой кислоты и 30 мл уксусного ангидрида кипятят с
обратным холодильником в течение 2 часов. Отгоняют избыток уксусного ангидрида и собирают ангидрид и очищают его сублимацией (123oC при 3 мм рт. ст.), получают 7 в виде белого твердого
вещества (10,1 г, 76%), т. пл. 74 - 76oC.1H-ЯМР (CDCl3) 9,39 (с, 1H), 9,24 (д, 1H), 7,94 (д, 1H).
Пример 2.
4-(2', 5'-Дифторбензоил)никотиновая кислота (8a) и 3-(2',5'-дифторбензоил)изоникотиновая кислота (8b).
Смесь 5,0 г (0,033 моля) 7 и 17,5 г (0,131 моля) хлорида алюминия в 1,4-дифторбензоле
нагревают на масляной бане при 110oC в течение 22 часов. Отгоняют избыток 1,4-дифторбензола. Остаток охлаждают на ледяной бане и гасят 75 мл ледяной воды и 6,3 мл конц. соляной кислоты.
Отфильтровывают твердый осадок, получают 7,7 г (87%) белого порошка. Этот материал может быть перекристаллизован из ацетонитрила и воды; т. пл. 214 - 217oC;1H-ЯМР (ДМСО-d6): 9,15 (с), 8,90 (д), 7,90 (д), 7,5 (м), 7,4 (м). Анализ: вычислено для C13H7F2NO3:
C 59,32; H 2,69; N 5,32.
Найдено: C 59, 03; H 2,55; N 5,18.
Пример 3.
6,9-Дифторбензо(g)изохинолин-5,10-дион (9).
Смесь 3,0 г (0,011 моля) кетоксилот 8a и 8b в 7,5 мл дымящейся серной кислоты (30% SO3) нагревают 3 часа на масляной бане при 135 - 140oC. После охлаждения до комнатной температуры смесь выливают в 200 мл льда и нейтрализуют бикарбонатом натрия. Экстракция метиленхлоридом дает 9 в виде желтого твердого продукта (2,0 г, 72%), т.п. 199 - 200oC.
1H-ЯМР (CDCl3): 9,54 (с, 1H), 9,12 (д, 1H), 8,03 (д, 1H), 7,57 (м, 2H).
Анализ: Вычислено для C13H5F2NO2: C 63,67; H 2,04; N 5,71.
Найдено: C 63,86; H 1,66; N 5,39.
Пример 4.
6,9-Бис-{[2-(диметиламино)этил]амино}бензо(g)изохинолин-5,10-дион
Смесь 20 мг (0,08 ммоля) 6,9-дифторбензо(g)изохинолин-5,10-диона, 9, и 0,8 ммоля (0,8 мл 1 М раствора в
пиридине) N,N-диметилэтилендиамина перемешивают при комнатной температуре в течение 48 часов. Большую часть пиридина испаряют, добавляют эфир и отфильтровывают продукт 10a (24 мг, 79%) т. пл. 167
- 168oC
1H-ЯМР (CDCl3) 11,06 (шир. т., 1H), 10,97 (шир. т. 1H), 9,63 (с, 1H), 8,92 (д, 1H), 8,13 (д, 1H), 7,32 (м, 2H), 3,54 (кв, 4H), 2,7 (т, 4H), 2,38 (с,
12H); масс-спектр m/z (относительная интенсивность) 381 (2,0, M+), 5,9 (5,4), 59 (100); УФ-спектр λ макс (2-метоксиэтанол) 580 (плечо, 6200), 614 (10600), 661 (12700).
Анализ:
Вычислено для C21H27N5O2: C 66,12; H 7,13; N 18,36.
Найдено: C 66,22; H 7,10; N 18,20.
Пример 5.
6,9-бис{[2-(диэтиламино)этил]амино}бензо(g)изохинолин-5,10-дион
Раствор 684 мг (5,9 ммоля) в 2 мл пиридина прибавляют к 202 мг (0,82 ммоля) 9 в 2 мл пиридина. Пурпурную смесь
перемешивают при комнатной температуре 48 часов (ТСХ-анализ в этой точке показывает один голубой компонент: силикагель, 5% MeOH/CHCl3). Удаляют выпариванием избыток основания и пиридин в
медленном токе азота. Сырой материал затем помещают в вакуум на всю ночь. При добавлении к остатку ледяной воды отфильтровывают твердый продукт и сушат (330 мг, 84%); т. пл. 142 - 144oC.
1H-ЯМР (CDCl3) 11,10 (т, 1H), 11,00 (т, 1H), 9,60 (с, 1H), 8,92 (д, 1H), 8,10 (д, 1H), 7,25 (м, 3H), 3,50 (м, 1H), 2,82 (м, 1H), 2,35 (м, 3H), 1,10 (м, 12H).
Анализ:
Вычислено для C25H35N5O2: C 68,62; H 16,00; N 7,31.
Найдено: C 67,95; H 16,05; N 7,28
Пример 6.
6,9-Бис{ [2-(ди(втор. -пропил)амино]этил]амино}бензо(g)изохинолин-5,10-дион
Прибавляют 588 мг (4,1 ммоля) N,N-диизопропилэтилендиамина к 100 мг (0,41 ммоля) 9 в 1 мл метанола и 1 мл
воды. Смесь перемешивают при комнатной температуре 88 часов, а затем выливают в ледяную воду. Отфильтровывают голубой осадок. Твердый продукт очищают хроматографией на колонке с силикагелем.
Первоначальным элюентом был хлороформ, затем 2% и 20% метанола в хлороформе. Концентрирование последних элюентов дает 163 мг (81%) продукта 10c.
Т. пл. 134 - 136oC
1H-ЯМР (CDCl3): 10,95 - 11,20 (м, 2H), 9,63 (с, 1H), 8,92 (д, 1H), 8,13 (д, 1H), 7,33 (м, 2H), 3,45 (2к, 4H), 3,10 (к, 4H), 2,82 (т, 4H), 1,08 (д, 24H).
Анализ:
Вычислено для C29H43N5O2: C 70,55; H 8,78; N 14,19.
Найдено: C 69,23; H 8,71; N 13,43.
Пример 7.
6,9-Бис{[2-(1-пирролидино)этил]амино}бензл(g)изохинолин-5,10-дион
Раствор 690 мг (6,0 ммоля) 1-(2-аминоэтил)пирролидина в 2 мл пиридина прибавляют к 202 мг (0,82 ммоля) 9 в 2 мл
пиридина. Перемешивают смесь 49 часов при комнатной температуре. Избыток основания и пиридин удаляют, используя медленный ток азота. Остаток помещают в вакуум на всю ночь. К остатку прибавляют
холодную воду и отделяют липкий твердый продукт. Продукт экстрагируют 3 • 35 мл хлороформа, экстракты сушат над сульфатом натрия и удаляют хлороформ выпариванием на роторном испарителе,
получают 260 мг (73%) целевого продукта; ТСХ, силикагель 5% MeOH/CHCl3, одно голубое пятно; т. пл. 141 - 142oC.
1H-ЯМР (CDCl3) 11,15 (т, 1H), 11,0 (т, 1H), 9,65 (с, 1H), 8,90 (д, 1H), 8,05 (д, 1H), 7,35 (м, 2H), 3,65 (м, 4H), 2,90 (м, 4H), 2,70 (м, 4H), 1,85 (м, 8H).
Анализ:
Вычислено для C25H31
N5O2: C 69,26; H 7,21; N 16,15.
Найдено: C 69,02; H 7,25; N 16,00.
Малеатная соль. Прибавляют в атмосфере азота раствор 271 мг (2,34 ммоля) малеиновой кислоты в 5 мл этанола к суспензии 450 мг (1,04 ммоля) соединения 10d в 20 мл этанола при перемешивании. После 2 часов перемешивания медленно прибавляют 25 мл диэтилового эфира и отфильтровывают осадок, сушат его в вакууме при 40oC, получают 580 мг гигроскопичной дималеатной соли 10d; т.пл. 164 - 166oC.
Анализ:
Вычислено для C33H39N5O10 • H2O: C 57,96; H 6,04; N 10,24
Найдено: C 57,85; H 5,99; N 10,14.
Пример 8.
6,
9-Бис{[2-(4-морфолино)этил]амино}бензо(g)изохинлин-5,10-дион (10e)
Раствор 220 мг (1,7 ммоля) 4-(2-аминоэтил)морфолина в 2 мл пиридина прибавляют к 102 мг (0,42 ммоля) 9 в 1 мл пиридина.
Пурпурную смесь перемешивают 120 часов при комнатной температуре. Избыток амина и пиридин выпаривают, используя медленный ток азота, и помещают остаток на ночь в вакуум. Смесь обрабатывают хлороформом
и затем фильтруют. После удаления хлороформа остается голубой твердый продукт, который при ТСХ (силикагель, 25% MeOH/75% CHCl3) (несколько капель водного гидроксида аммония) показывает одно
голубое пятно (140 мг, 72%).
1H-ЯМР (CDCl3) 11,015 (м, 1H), 10,9 (м, 1H), 9,62 (д, 1H), 8,90 (д, 1H), 8,10 (д, 1H), 7,25 (м, 2H), 3,80 (м, 8H), 3,55 (м, 4H), 2,75 (т, 4H), 2,50 (м, 8H).
Анализ:
Вычислено для C25H31N5O4: C 64,22; H 6,68; N 11,98
Найдено: C 63,95; H 6,78, N 11,89.
Пример 9.
6,9-Бис{[2-(1'-азиридино)этил]амино}бензо(g)изохинолин-5,10-дион (10f)
Работают по методике примера 4, проводят взаимодействие соединения 9 с
N-(2-аминоэтил)азиридином и остаток, полученный после выпаривания пиридина, очищают хроматографией на колонке с силикагелем.
Собирают основную голубую полосу при элюировании 10% CH3OH в CHCl3. Кристаллизация из смеси метиленхлорида и лигроина дает темно-голубой твердый продукт, т. пл. 100 - 103oC
1H-ЯМР (CDCl3) 11,23
(шир., 1H), 11,15 (шир., 1H), 9,73 (с, 1H), 8,91 (д, 1H), 8,12 (д, 1H), 7,40 (д, 1H), 7,38 (д, 1H), 3,69 (к, 4H), 2,60 (т, 4H), 1,85 (м, 4H), 1,24 (м, 4H); масс-спектр m/z (относительная
интенсивность) 377 (100, M+), 278 (72,7), 56 (12,6).
Анализ:
Вычислено для C21H23N5O2: C 66,82, H 6,14, N 18,55.
Найдено: C 55,50, H 6,00, N 18,20.
Пример 10.
6,9-Бис{[2-(N-(трет.бутоксикарбонил)амино)этил]амино}-бензо(o) изохинолин-5,10-дион (10g)
Раствор 0,10
г (0,41 ммоля) 9 и 0,65 г (4,10 ммоля N-(т-бутилоксикарбонил)этилендиамина (Syntn. Comm. (1990), 20, 2559) в 4,0 мл пиридина перемешивают 24 часа при комнатной температуре. Добавление 20 мл воды
приводит к 10g, который отфильтровывают, промывают водой и сушат, получают 0,17 г (80%), т.пл. 213-216oC.
Кристаллизация из смеси CHCl3:CCl4 дает темно-голубой твердый продукт, т.пл. 215-216oC.
1H-ЯМР (CDCl3) 11,07 (шир., 1H), 10,96 (шир. 1H), 9,49 (с, 1H), 8,90 (д, 1H), 7,99 (д, 1H), 7,32 (с, 2H), 5,30 (шир. 2H), 3,58 (м, 4H), 3,47 (м, 4H), 1,56 (с. 18H), масс-спектр м/Z (относительная интенсивность 525 (100, M+), 339 (51,9), 57 (87,7).
Анализ:
Вычислено для
C27H35N5O6: C 61,70, H 6,73, N 13,32.
Найдено: C 61,18, H 6,29, N 12,88.
Пример 11.
6,9-Бис{ [2-(N-трет.
бутоксикарбонил-N-метиламино)этил] амино} -бензо(g)изохинолин- 5,10-дион (10h)
Прибавляют 0,29 г (1,18 ммоля) 6,9-дифторбензо(g)изохинолин-5,10-диона добавляют к раствору 0,824 г (4,73 ммоля)
N-(трет.бутоксикарбонил)-N-метилендиамина (J. Med Chem, 1990, 33. 97) в 5 мл сухого пиридина. Реакционную смесь перемешивают в атмосфере азота в течение 24 часов при комнатной температуре, а затем еще
8 часов при 50oC. Удаляют растворитель при пониженном давлении и полученный голубой осадок обрабатывают 5 мл метиленхлорида, промывают 5% раствором бикарбоната натрия (2х30 мл) и 30 мл
воды. Объединенные органические фазы сушат над сульфатом натрия и выпаривают растворитель при пониженном давлении.
Голубой остаток очищают хроматографией на колонке (силикагель 230-400 меш, 50 г элюент CH2Cl2:AcOEt:MeOH 93:5:2). получают 400 мг (61%) голубых кристаллов, т.пл. 161,5-162,5oC после перекристаллизации из CH2Cl2: гексана.
1H-ЯМР (CDCl3) 1,49 (с, 18H), 2,94 (с, 6H), 3,45-3,75 (м, 8H), 7,25-7,55 (м, 2H), 8,12 (м, 1H), 8,95 (д, 1H), 9,62 (с, 1H), 10,95 - 11,23 (м, 2H, обменивающиеся с D2O).
Пример 12.
6,9-Бис-{[2-(амино)этил]амино}бензо(g)изохинолин-5,10-дион(10i)
Из дифторида 9: В атмосфере азота прибавляют 8,
72 мл 1,2-диаминоэтана (130,5 ммоля) к раствору 4,00 г (16,3 ммоля) соединения 9 в 80 мл пиридина. Слабоэкзотермическая реакция обеспечивается умеренным охлаждением на водяной бане при 20o
C. Реакционную смесь перемешивают 34 часа при комнатной температуре, затем охлаждают до -5oC в течение 30 минут, твердый продукт отсасывают в токе азота и сушат всю ночь в вакууме при
30oC. Перекристаллизовывают 6,07 г сырого материала при растворении в 20 мл метанола при 40oC и повторном осаждении 100 мл метиленхлорида и 300 мл н-гексана, получают 5,12 г 10i
в виде голубого твердого продукта.
1H-ЯМР (CDCl3): 11,10 - 11,40 (2м, 2H), 9,53 (с, 1H), 8,93 (д, 1H), 8,13 (д, 1H), 7,35 (м, 2H), 3,55 (к, 4H), 3,10 (т, 4H) ВЭЖХ (Лихросфер 100 РП 18,5 мкм; элюент: гептасульфонат натрия 2 г/л в воде: CH3CH: диоксан 75: 20: 5, pH 3 c H3PO4:

Малеатная соль: Растворяют в атмосфере азота 3,50 г (10,8 ммолля) свободного основания 10i в смеси 170 мл этанола и 30 мл метанола при нагревании в течение 10 минут при 50oC, затем прибавляют раствор 2,87 г (24,7 ммоля) малеиновой кислоты в 30 мл этанола. После нагревания более 5 минут при 50oC смеси дают остыть до комнатной температуры и оставляют на 2 часа при 4oC. Осадок отсасывают в токе азота и сушат при 40oC в вакууме, получают 5,75 г сырого дималеата.
К суспензии 5,71 г этого сырого материала при перемешивании в 90 мл воды при 50oC прибавляют по каплям этанол до тех пор, пока все полностью не растворится (около 300 мл), затем добавляют еще 40 мл этанола и смеси дают остыть до комнатной температуры. Через 12 часов осадок отделяют отсасыванием, промывают 15 мл этанола и 10 мл диэтилового эфира, затем сушат в вакууме при 30oC в течение 5 часов, получают 4,22 г дималеатной соли 10i; т. пл. 176-178oC, сушка, он не плавится до 245oC.
Анализ:
Вычислено для C17H19N5O2•2C4H4O4•1,5H2O:
C 51,37, H 5,17, N
11,98.
Найдено: C 51,31, H 4,99, N 11,93.
1H-ЯМР (ДМСО-d6) 10,92 (шир. 1H), 10,87 (шир. 1H), 9,45 (с, 1H), 9,01 (м, 1H), 8,08 (м, 1H), 7,59 (с,
2H), 6,03 (с, 4H), 3,76 (шир, 4H), 3,08 (м, 4H),
УФ-спектр 1,528 мг в 50 мл воды, нм (E 1%): 641 (271), 597 (245), 313 (98), 273 (257), 246 (479).
Солянокислая соль:
а) Из амина 10i: Пробулькивают газообразный хлористый водород через раствор сырого амина в хлороформе до тех пор, пока раствор не будет больше голубым. Отфильтровывают твердый продукт и сушат,
получают 0,174 г (26%) темно-голубого гигроскопичного твердого продукта, т.пл. 209-212oC.
1H-ЯМР (ДМСО-d6) 10,91 (шир. 2H), 9,44 (с, 1H), 9,01 (д, 1H), 6,23 (шир. , 4H), 8,09 (д, 1H), 7,74 (с, 2H), 3,84 (м, 4H), 5,02 (м, 4H).
Анализ:
Вычислено для C17H19N5O2 • 2HCl •
4H2O: C 44,94, H 6,43, N 15,41
Найдено: C 44,52, H 5,29, N 14,53.
Свободный амин может быть регенерирован при добавлении твердого карбоната калия к ЯМР-образцу.1H-ЯМР-анализ указывает на наличие свободного амина.
б) При снятии защиты с т-БОК-аналога 10g: Пропускают газообразный хлористый водород через раствор 0,160 г (0,30 ммоля) 10g в 10 мл сухого хлороформа в течение 30 минут. Отфильтровывают темно-голубой твердый продукт и сушат, получают и сушат, получают 0,115 г (95%), т.пл. 213-215oC, структура подтверждена как солянокислой соли 10i при1H-ЯМH-анализа.
Пример 13.
6,3-Бис{[2-(ацетиламино)этил]амино}бензо(g)изохинолин-5,10-дион (10j)
Работают по
методике примера 12, используя соединение 9 и 1,2-диаминоэтан, сырую реакционную смесь наносят на колонку с силикагелем. На колонну наносят 30 мл уксусного ангидрида и ее оставляют на 15 минут.
Основную голубую фракцию 10j элюируют смесью 1:4 CH3ОH:CHCl3, ее кристаллизуют из смеси CHCl3: CH3OH, получают 0,240 г (35%) голубого твердого продукта,
т.пл. 155-156oC.
1H-ЯМР (ДМСО-d6) 11,12 (т, 1H), 11,02 (т, 1H), 9,42 (с, 1H), 8,95 (д, 1H), 8,15 (шир. , 2H), 8,03 (д, 1H), 7,62 (с, 2H), 3,57 (м, 8H), 1,83 (с, 6H); масс-спектр m/z (относительная интенсивность) 409 (2,5, M+), 337 (6,4), 86 (100).
Анализ:
Вычислено для C12H23N5
O4: C 61,60, H 5,67, N 17,10.
Найдено: C 61,37, H 5,42, N 16,89.
Пример 14.
6,9-Бис{ [2-(метиламино)этил] амино}бензо(g)изохинолин-5,
10-дион тригидрохлорид (10k)
Прибавляют 2,0 мл 6,7H этанольного HCl к раствору 440 мг (0,795 ммоля) 6,9-бис { [2-(N-трет.бутоксикарбонил-N-метиламино)-этил]амино}бензо(g) изохинолин-5,
10-диона (10h) в 40 мл CHCl3. Реакционную смесь перемешивают при комнатной температуре в атмосфере азота в течение 24 часов, затем отфильтровывают образовавшиеся темно-зеленые кристаллы,
промывают абсолютным этанолом и сушат при 40oC в вакууме, получают 945 мг (выход 94%) чистого продукта, т. пл. 188oC с разл. (Д5С оценка).
Элементный анализ:
Вычислено для C19H26Cl3N5O2 • 2H2O: C 46,51, H 6,03, N 14,14 Cl 23,60. Найдено: C 45,75, H 6,06, N 14,04, Cl 21,32. ВЭЖХ
(Лихроспер 100 ПH18, 5 мкм; элюент K2HPO4 24 мМ, н-C7H15SO3Na 2 мг/мм в H2O: CH3CH: диоксано 80:15: 5, pH 2,7 с HClO4; λ 275 нм, скорость 1 мл/мин, RT 20,11 минуты
УФ-спектр 1,07 мг в 20 мл воды: нм/El%): 641 (290, 597) 267 313 (106), 273 (278); 247 (486).
1H-ЯМР-спектр (D2O) 2,75 (с, 6H), 3,30-3,45 (м, 4H), 3,80-3,95 (м, 4H), 7,38 (с, 2H), 8,17 (д, 1H), 8,85 (д, 1H), 9,27 (с, 1H)
Пример 15.
6,
9-бис[(2-оксиэтил)амино]бензо(g)изохинолин-5,10-дион(11a)
Перемешивают 1,0 г (4,1 ммоля) дифторида 9 и 2,5 г 40,8 ммоля 2-аминоэтанола в 7 мл пиридина при комнатной температуре 18 часов.
Смесь выливают в 50 мл воды и отфильтровывают продукт 11a и сушат, получают 1,26 г (94%), т. пл. 236-239oC. При перекристаллизации из метанола получают темно-голубые иглы с т.пл.
237-239oC.
1H-ЯМР (ДМСО-d6) 1,28 (т, 1H), 11,19 (т, 1H), 9,43 (с, 1H), 8,94 (д, 1H), 8,03 (д, 1H), 7,56 (с, 2H), 5,01 (т, 2H), 3,69 (м, 4H), 3,54 (м,
4H),
Анализ:
Вычислено для C17H17N3O4: C 62,38, H 5,25, N 12,83.
Найдено: C 62,21, H 5,12, N 12,50.
Пример 16.
6,9-Бис[(2-метансульфонилоксиэтил)амино] бензо(g)изохинолин-5,10-дион(11b)
Раствор 0,30 г (0,92 ммоля) 11a в 4 мл сухого пиридина при комнатной температуре в
атмосфере азота в течение 10 минут. Прибавляют 0,24 г (2,07 ммоля) метансульфонилхлорида в смесь перемешивают 20 минут. Смесь закаливают 20 мл льда-воды и отфильтровывают твердый продукт. При
кристаллизации из смеси хлороформ-лигроин получают 0,294 г (66%) голубого продукта;
т. пл. 116-118oC.
1H-ЯМР (CDCl3) 10,98 (шир., 2H), 9,59 (с, 1H), 8,97 (д, 1H), 8,09 (д, 1H), 7,38 (д, 1H), 7,34 (д, 1Н), 4,50 (т, 4H), 3,83 (л, 4H), 3,09 (с, 6H).
Анализ:
Вычислено для C19H21N3O8S2: C 47,20, H 4,39, N 8,69.
Найдено: C 46,80, H 4,31, N 8,48.
Пример 17.
6,9-Бис{[2-[(2-октиэтил)амино]этил}бензо(g)изохинолин-5,
10-дион (10l)
а) Из мезилата (11b)
Раствор 0,40 г (0,83 ммоля) 11b и 2,21 г (16,5 ммоля) 2-(триметилсилилокси)этиламина в 6,0 мл пиридина перемешивают при комнатной температуре в
атмосфере азота в течение 48 часов. Пиридин удаляют в токе азоте и остаток обрабатывают метиленхлоридом. Этот раствор промывают насыщенным раствором бикарбоната натрия и сушат над сульфатом натрия.
При удалении растворителя остается голубое масло, которое сушат в вакууме всю ночь. Хроматография на колонке с силикагелем приводит в результате к отщеплению Si-O-связи с получением 10l. Этот продукт
элюируют смесью 1:5:5 Et3H:CH3OH: CHCl3. Концентрирование дает 10l в виде масла:
1H-ЯМР (CDCl3) 11,19 (шир, 1H), 11,06 (шир., 1H), 9,46
(с, 1H), 8,83 (д, 1H), 7,98 (д, 1H), 6,98 (с, 2H), 3,82 (м, 4H), 3,52 (м, 4H), 3,07 (м, 4H), 2,96 (м, 4H);
УФ-спектр (2-метоксиэтанол): 570 (плечо, ε = 7200), 612 ( ε = 13200),
658 ( ε = 14000).
б) Из дифторида 9
В атмосфере азота прибавляют 6,19 мл (61,2 ммоля) 2-[(2-оксиэтил)амино] этиламино к суспензии 1,00 г (4,08 ммоля) соединения 9 при
перемешивании в 30 мл пиридина при 0oC.
Через час смеси дают нагреться до комнатной температуры и оставляют при этой температуре на три часа. Реакционную смесь наносят на 100 г силикагеля в хроматографической колонке и элюируют сначала CHCl3:CH3OH 90:10, затем CHCl3:CH3OH 85:15 и, наконец, CHCl3:CH3 OH:NH4OH 85:15:1. Объединяют фракции, содержащие продукт, удаляют растворители и остаток подвергают второй очистке на хроматографической колонке с 95 г силикагеля, элюируя CHCl3 :CH3OH:NH4OH конц. от 95:5:0 до 80:20:2. Конечная очистка на 25 г основного оксида алюминия сорта I, элюируя CH2OH2: EtOH 96:4, получают 500 мг остатка, который кристаллизуют на смеси 0,5 мл этанола и 10 мл метиленхлорида, получают 142 мг 10l.
Малеатная соль: Растворяют 138 мг (0,334 ммоля) свободного амина 10l в 6 мл этанола в
атмосфере азота и прибавляют при комнатной температуре раствор 87 мг (0,75 ммоля) малеиновой кислоты в 3 мл этанола при комнатной температуре. После охлаждения в течение 3 часов при 4oC
отделяют полученные голубые кристаллы отсасыванием в токе азота, промывают 1 мл этанола и 2 мл диэтилового эфира, сушат в вакууме при 40oC, получают 160 мг дималеатной соли 10l, т.пл.
132-133oC;
1H-ЯМР (ДМСО-d6) 10,94 (шир, 1H), 10,88 (шир, 1H), 9,47 (с, 1H), 9,02 (д, 1H), 8,60 (шир, 2H), 8,09 (д, 1H), 7,63 (с, 2H), 6,01 (с, 4H), 5,32 (шир,
2H), 3,89 (м, 4H), 3,71 (м, 4H), 3,26 (м, 4H), 3,12 (м, 4H).
УФ-спектр 1,335 мг в 25 мг в 35 мл воды: нм (E1%): 641 (220), 598 (208), 312 (85), 272 (221), 246 (406).
Анализ:
Вычислено для C21H27N5O4 • 2C4H4O4 • H2O: C 52,52, H 5,57, N 10,64.
Найдено: C 52,49, H 5,56, N 10,61.
Пример 18.
6,9-Бис{ [2-/2-метоксиэтиламино)этил] амино}бензо(g)изохинолин-5,10-дион (10m)
Раствор 0,15 г (0,21
ммоля) 11b и 0,47 г (6,20 ммоля) 2-метоксиэтиламина в 2,0 мл пиридина перемешивают при комнатной температуре в атмосфере азота в течение 48 часов. Пиридин и избыток амина удаляют в вакууме. Остаток в
метиленхлориде, промывают насыщенным раствором бикарбоната натрия и сушат над сульфатом натрия. После удаления растворителя остаток очищают хроматографией на колонке с силикагелем, элюируя смесью 1:1
CH3OH:CHCl3. Кристаллизация из смеси этанола и пентанола приводит к 0,091 г (66%) 10m; т. пл. 174-175oC
1H-ЯМР-спектр (CDCl3) 11,08 (шир,
1H), 10,97 (шир, 1H), 9,56 (с, 1H), 8,90 (д, 1H), 8,05 (д, 1H), 7,31 (с, 2H), 3,62 (м, 8H), 3,43 (с, 6H), 3,08 (т, 4H), 2,94 (т, 4H), 2,66 (шир.с, 2H); масс-спектр м/Z (относительная интенсивность):
441 (100, M+), 354 (57,4), 266 (50,5).
Анализ:
Вычислено для C23H31N5O4: C 62,57, H 7,09, N 15,86.
Найдено: C 62,51, H 6,92, N 15,47.
Пример 19.
6,9-Бис{[2-(2-оксиэтокси)этил]амино}бензо(g)изохинолин-5,10-дион (11c)
Прибавляют раствор 446 мг (4,25 ммоля)
2-(2-аминоэтокси)-этанола в 1 мл пиридина к 100 мг (0,41 ммоля) 9 в 1 мл пиридина. Смесь перемешивают при комнатной температуре в течение 45 часов. Удаляют избыток амина и пиридина в медленном токе
азота, а оставшийся твердый продукт помещают на всю ночь в вакуум. К твердому продукту прибавляют холодный насыщенный раствор NaCl и продукт экстрагируют 6х25 мл хлороформа. Экстракты сушат над
сульфатом магния и концентрируют на роторном испарителе. Получают 140 мг (82%) продукта 11c, т. пл. 97-99oC.
1H-ЯСМР (CDCl3): 11,15-11,35 (2м, 2H), 9, 60 (с, 1H), 8,85 (д, 1H), 8,08 (д, 1H), 7,30 (м, 2H), 3,85 (м, 8H), 3,57-3,75 (2м, 9H), 2,75-3,25 (шир.с, 1H).
Пример 20.
6,9-Бис{[3-(амино)пропил]амино}бензо(g)
изохинолин-5,10-дион (12a)
1) Свободный амин: Раствор 870 мг (11,76 ммоля) 1,3-диаминпропана в 3 мл хлороформа прибавляют к 300 мг (1,22 моля) 9 в 6 мл хлороформа. Пурпурную смесь
перемешивают 166 часов при комнатной температуре. Смесь фильтруют и соли промывают хлороформом. Удаляют растворитель на роторном испарителе, остаток помещают в вакуум на всю ночь, получают 290 мг
(93%) 12a; ТСХ (силикагель, 25% MeOH/75% хлороформа/несколько капель водного гидроксида аммония) показывает одно голубое пятно; т. пл. 105oC (размягчается) 112-115oC
1H-ЯМР (ДМСО-d6) 11,5 (м, 1H), 11,05 (м, 1H), 9,45 (с, 1H), 8,90 (д, 1H), 8,0 (д, 1H), 7,55 (шир.с., 2H), 3,55 (шир.м., 4H), 4,65 (т, 4H), 3,75 (т, 4H), 1,75 (т, 4H).
Анализ:
Вычислено для C19H23N5O2: C 64,57, H 6,56, N 19,81.
Найдено: C 65,00, H 6,50, N 19,76.
2) Малеатная соль:
Раствор 11 мг (0,86 ммоля) малеиновой кислоты в метаноле прибавляют к 100 мг (0,28 ммоля) 12a, растворенным в 2 мл метанола и 2 мл этилацетата. Дополнительное добавление этилацетата дает голубой
осадок, который фильтруют и сушат в вакууме, получают 120 мг (79%)
1H-ЯМР (ДМСО-d6) 11,10 (т, 1H), 11,0 (т, 1H), 9,45 (с, 1H), 8,95 (д, 1H), 8,05 (д, 1H), 7,75 (шир., 4H),
7,60 (с, 2H), 6,0 (с, 4H), 3,60 (м, 4H), 2,95 (т, 4H), 1,95 (м, 4H).
Анализ
Вычислено для C23H27N5O6: C 58,84, H 5,80, N 14,
92.
Найдено: C 58,75, H 5,70, N 14,85.
Пример 21.
6,9-Бис{[4-(амино)бутил]амино}бензо(g)изохинолин-5,10-дион (12b)
1) Свободное основание:
Раствор 960 мг (10,9 ммоля) 1,4-диаминобутан в 3 мл хлороформа прибавляют к 319 мг (1,3 ммоля) 9 в 6 мл хлороформа. Перемешивают пурпурную реакционную смесь при комнатной температуре 217 часов (9
дней). Отфильтровывают выпавшие в осадок соли и концентрируют фильтрат в медленном токе азота получают 400 мг (80%) свободного амина 12b; ТСХ (силикагель, 25 MeOH/75% CHCl3 (несколько
капель водного гидроксида аммония), т.пл. 80oC (размягчается) 90-92oC.
1H-ЯМР (ДМСО-d6) 11,15 (м, 1H), 11,5 (м, 1H), 9,42 (с, 1H), 8,90 (д, 1H), 8,0 (д, 1H), 7,5 (шир. с, 2H), 3,45 (м, 4H), 2,60 (м, 4H), 1,70 (м, 4H), 1,45 (м, 4H).
Анализ:
Вычислено для C21H27N5O2: C 66,
12, H 7,13, N 18,36.
Найдено: C 64,26, H 6,95, N 17,42.
2) Малеатная соль: Раствор 116 мг (1 ммоль) малеиновой кислоты в 4 мл этилацетата прибавляют к 124 мг (0,40 ммоля) 12b в 6 мл метанола и 8 мл этилацетата. Отделяют голубое масло и смесь помещают на ночь в холодильник. Растворители удаляют декантацией, оставшийся твердый продукт тщательно промывают этилацетатом, получают голубое очень гигроскопическое твердое вещество, 125 мг (63%).
1H-ЯМР (ДМСО-d6) 11,20 (м, 1H), 11,10 (м, 1H), 9,45 (с, 1H), 8,95 (д, 1H), 8, 05 (д, 1H), 7,70 (шир. с, 4H), 6,00 (с, 4H), 3,55 (м, 4H), 2,85 (м, 4H), 1,70 (м, 8H).
Анализ:
Вычислено для C29H35N5O10: C 56,76,
H 5,75, N 11,41.
Найдено: C 53,65, H 6,10, N 10,05.
Пример 22.
6,9-Бис{[3-(диметиламино)пропил]амино}бензо(g)изохинолин-5,10-дион (12c)
Раствор 700 мг (6,9 ммоля) 3-диметиламинопропиламина в 2 мл пиридина к 100 мг (0,41 ммоля) соединения 9 в 2 мл пиридина. Смесь перемешивают при комнатной температуре 120 часов. Избыток диамина и
пиридина удаляют в медленном токе азота и остаток помещают на всю ночь в вакууме. Остаток прибавляют к холодной воде и экстрагируют 4 x 20 мл хлороформа. Экстракт сушат над сульфатом натрия и
концентрируют на роторном испарителе. Голубой твердый продукт очищают хроматографией на колонке с силикагелем. Сначала элюируют 10% метанола/90% хлороформа, затем 25% метанола/75% хлороформа. Продукт
элюируют при добавлении небольшого количества гидроксида аммония к 25% метанола/75% хлороформа. Концентрированием этих элюентов получают 92 мг/55%) целевого продукта 12c, т.пл. 107-109o
C.
1H-ЯМР (CDCl3): 11,00-11,20 (2M, 2H), 9,63 (c, 1H), 8,93 (д, 1H), 8,12 (д, 1H), 7,37 (с, 2H), 3,55 (к, 4H), 2,55 (м, 4H), 2,35 (с, 12H), 2,00 (м, 4H).
Пример 23.
6,9-бис{[2-(этиламино)этил]амино}бензо(g)изохинолин-5,10-дион (10n)
Раствор 400 мг (4,5 ммоля) N-этилэтилендиамина в 1 мл пиридина прибавляют к
соединению 9 (98 мг, 0,40 ммоля) в 1 мл пиридина. Смесь перемешивают 66 часов при комнатной температуре. Пиридин и избыток диамина удаляют в медленном токе азота, оставшийся материал оставляют в
вакууме на всю ночь. Хлороформ затем прибавляют и хлороформ дважды промывают холодной водой. Хлороформный экстракт сушат над сульфатом магния и удаляют растворитель на роторном испарителе. Полученный
голубой твердый продукт очищают хроматографией на колонке с силикагелем, используя 5% метанола/95% хлороформа в качестве начального элюента.
Элюент постепенно нагружают 5%, 10% и затем 50% метанола в хлороформе. Целевой продукт элюируют, используя 50% метанола/48% хлороформа/2% гидроксида аммония. Удаление растворителя дает 32 мг (21%) продукта 10n, т.пл. 101-102o C.
1H-ЯМР (CDCl3) 11,10 (м, 1H), 11,00 (м, 1H), 9,6 (с, 1H), 8,9 (д, 1H), 8,05 (д, 1H), 7,3 (м, 2H), 3,55 (м, 4H), 3,0 (т, 4H), 2,8 (к, 4H), 1,15 (т, 6H).
Пример 24.
6,9-бис{[2-(пропиламино)этил]амино}бензо(g)изохинолин-5,10-дион (10c)
Раствор 403 мг (4,0 ммоля) N-пропилэтилендиамина в 1 мл пиридина прибавляют к 98
мг (0,40 ммоля) соединения 9b 1 мл пиридина. Реакционную смесь перемешивают 24 часа при комнатной температуре и концентрируют в медленном токе азота. Оставшийся материал помещают на всю ночь в
вакууме. К остатку прибавляют ледяную воду и водный слой экстрагируют 5x40 мл хлороформа. Экстракты сушат над сульфатом магния и удаляют хлороформ на роторном испарителе. Голубой твердый продукт
очищают хроматографией на колонке с силикагелем. Элюируют сначала 5% метанола/95% хлороформа, постепенно увеличивая количество метанола до 10%, 20%, 30%, 40% и 50%. Целевое соединение может быть
элюировано с использованием 60% метанола/40% хлороформа, содержащего немного гидроксида аммония. Удаление элюента приводит к 50 мг (30% продукта (10o), т.пл. 105-106oC.
1H-ЯМР (CDCl3) 11,15 (м, 1H), 11,05 (м, 1H), 9,6 (с, 1H), 8,9 (д, 1H), 8,10 (д, 1H), 7,3 (м, 2H), 3,6 (м,м, 4H), 3,0 (т, 4H), 2,75 (т, 4H), 1,6 (м, 4H), H2O пик налагается). 0,95 (т, 6H).
Пример 25.
6,9-Бис-{ [2-(изопропиламино)этил] амино} бензо(g)изохинолин-5,10-дион (10p)
Раствор 450 мг (4,5 ммоля)
N-изопропилэтилидендиамина в 2 мл пиридина прибавляют к 110 мг (0,45 ммоля) соединения 9 в 1 мл пиридина. Возникает мгновенно окрашивание, подобное цвету перманганата. Смесь перемешивают 40 часов при
комнатной температуре. Пиридин и избыток диамина удаляют в медленном токе азота и помещают остаток на всю ночь в вакуум Прибавляют 20 мл хлороформа, затем ледяную воду. Поскольку появляется голубое
окрашивание водного слоя, его экстрагируют 4 x 25 мл хлороформа. Объединенные экстракты сушат над сульфатом магния и удаляют хлороформ на роторном испарителе. Полученное в результате голубое вещество
очищают хроматографией на колонке с силикагелем, используя в качестве начального элюента хлороформ, постепенно нагружая поток 2%, 5% 10%, 20% 40% и 50% метанола хлороформ. Целевой продукт элюированием
с колонки 50% метанола/49% хлороформа/ 1% гидроксида аммония. Удаление элюентов дает 56 мг /30% целевого продукта (10p); т.пл. 136-137oC.
1H-ЯМР (CDCl3 ), 11,1 (т, 1H), 11,0 (т, 1H), 9,6 (с, 1H), 8,9 (д, 1H), 8,1 (д, 1H), 7,30 (м, 2H), 3,6 (м, 4H), 3,0 (т, 4H), 2,9 (м, 2H), 1,05 (д, 6H).
Пример 26.
Биологическая
оценка in vitro : МТТ-анализ на клетках аденокарциномы Lovo толстой кишки человека
МТТ-анализ проводят согласно Mosmann T., J. Immunol. Methods, (1983), 65, 55-63 и Green L.M., J. Immunol.
Methods, (1984), 70, 257-268.
Непосредственно перед использованием соединения известные стандарты растворяют в подходящем растворителе и последовательно далее разбавляют в полноценной культуральной среде. Клетки человеческой аденокарциномы Lovo толстой кишки и сублинии, устойчивой к доксорубицину (Lovo/ДХ) (2,5 • 104 клеток/мл) помещают в пластины с 96 ячейками и предварительно инкубируют 24 часа в культуральной среде. После этого времени клетки экспонируют с лекарствами в течение 144 часов, затем прибавляют раствор тетразолил голубого тетразилий бромида (МТТ раствор) и клетки снова инкубируют в течение 4 часов. Удаляют надосадочный слой и прибавляют 150 мкл диметилсульфоксида для солюбилизации кристаллов формазана. Пластину считывают при 570 нм на регистраторе микропластин и рассчитывают ингибирующие концентрации 50% роста клеток (ИК50, мкг/мл).
Результаты приведены в таблице VI.
Пример 27.
Биологическая оценка in vitro: Лейкемия L1210 мыши
Клетки лейкемии L1210 мыши традиционным образом сохраняли в суспензионной культуре в среде МакКоя 5A, дополненной 10% лошадиной
сыворотки, глютамином, пенициллином и стрептомицином, и выращивали во влажной окружающей среде с 10% диоксида углерода и 90% воздуха при 37oC.
Для анализа токсичности in
vitro каждое соединение растворяют в диметилсульфоксиде и прибавляют 1 мл L1210 клеток/105 клеток/пробирку, чтобы получить конечную концентрацию 0,01, 0,1 и 1 мкг лекарства/мл культуры.
После 72 часов непрерывной экспозиции лекарства определяют концентрацию клеток на счетчике Каултера. Ингибирование роста рассчитывают для каждого лекарства по следующей формуле:
%
ингибирования рост = 1 - (количество обработанных клеток/количество клеток в ДМСО) • 100
Данные по ингибированию роста затем использованы для расчета величины ИК50
(расчетная концентрация лекарства, требующаяся для ингибирования роста клеток на 50% от контроля).
Результаты приведены в таблице VII.
Пример 28.
Биологические исследования in vivo: P388 лейкемия мыши (ив/вн) дни 1, 4, 7)
Клетки лейкемии P388 мыши сохраняют in vivo путем стерильных интраперитонеальных (и. п.) инъекций 106
клеток ДВА2 мышам. Для целей исследования CDFI мышам инокулировали внутривенно (вв) 106 P388 клеток и начинают обработку через 24 часа. Внутривенную дозу лекарства вводят на 1, 4 и 7 день.
Мышей наблюдают ежедневно на признаки токсичности и выживаемости. Данные о смерти регистрируют для каждого животного, которое умерло или умерщвлено в течение 60 дней исследования. Среднее время
выживания (СВВ) для каждой обработанной группы рассчитывают и определяют % Т/С, используя следующую формулу:
% Т/С = //СВВ обработанных///СВВ контроля// • 100
Результаты
противолейкемической активности 6,9-бис{[2-/диметиламино/этил] амино} бензо/g/изохинолин-5,10-диона (10a) примера 4 и 6,9-бис{ [2-(амино)этил] амино} бензо(g)изохинолин-5,10-диона (10i малеат) примера
12 по сравнению с митоксантроном приведены в таблице VIII.
Пример 29.
Биологические исследования in vivo: Лейкемия P388 мыши (ип/ип дни 1, 5, 9)
Клетки
лейкемии P388 мыши сохраняли in vivo путем стерильных интраперитонеальных (ип) инъекций 106 клеток ДВА2 мышам. Для целей исследования CDFI мышам инокулировали ип 106 P388 клеток
и начинали лечение через 24 часа. Дозы лекарства вводили ип на дни 1, 5 и 9. Мышей наблюдали ежедневно на признаки токсичности и выживания. Данные о смерти регистрировали для каждого животного,
которое умерло или было умерщвлено во время 60-тидневного исследования. Среднее время выживания (СВВ) для каждой обработанной группы рассчитывали и определяли % Т/С, используя следующую формулу:
% Т/С = ((СВВ обработанных)/(СВВ контроля)) • 100
Результаты противолейкемической активности 6,9-бис{[2-(амино)этил]амино} бензо(g)изохинолин-5,10-диона (10i) в виде
дигидрохлорида (10i HCl) и дималеата (10i малеат) (пример 12) по сравнению с митоксантроном приведены в таблице IX.
Пример 30.
Биологические исследования in vivo:
Лейкемия L1210 мыши (ип/ип, дни введения 1, 5, 9)
a) Клетки L1210 лейкемии мыши поддерживали in vivo еженедельными интраперитонеальными (ип) инъекциями 106 клеток BDFI мышей. Для
целей эксперимента мышам инокулировали ип 106 клеток L1210 и начинали лечение спустя 24 часа. Желаемые дозы лекарства вводили в дни 1, 5 и 9. Мышей наблюдали ежедневно регистрировали для
каждого животного, которое умерло или было умерщвлено. Во время 60-дневного исследования. Среднее время выживания (СВВ) для каждого экспериментальной группы было рассчитано и определен % Т/С по
следующей формуле:
% Т/С = ((СВВ обработанных)/(СВВ контроля)) • 100
Результаты приведены в таблице X.
Пример 31.
Биологические исследования
in vivo: противоопухолевая активность против карциномы Льюиса легкого мыши и карциномы МХ-1 грудной железы человека
а) Карцинома Льюиса легкого мыши
Самкам C57b1/6 мышей
трансплантировали им (внутри конечности) 105 клеток. Лечение проводили вв (внутривенно) в дни 1, 7, 15 после трансплантации опухоли (день 0). Среднюю массу опухоли (T.W.) для каждой
обрабатываемой группы рассчитывали согласно Geran R. I. et al., Cancer Chemother. Rep. (1972), 3, 51-61 и TW 1% рассчитывали 7 дней спустя после последнего введения лекарства, используя формулу:
TW 1% = 100 - (Средняя масса опухоли обработанной мыши)(средняя масса опухоли контроля) • 100
Результаты приведены в таблице XII для типичного соединения изобретения 6,
9-бис{[2-(амино)этил]амино}бензо(g)изохинолин-5,10-диона (10i) в виде дималеатной соли (10i малеат) примера 12.
б) Карцинома МХ-1 легочной железы человека
CDI ип/ип самкам
были трансплантированы подкожно фрагменты опухоли (примерно 1 мм х 1 мм х 1 мм). Лечение проводили вв сразу через неделю - три недели, когда масса опухоли достигнет в среднем 150 мг. Для всех
индивидуальных опухолей изменение массы (относительная масса опухоли) от начала лечения (V0) выражают как Vt/V0 в каждый день измерения (Vt). TW 1%
рассчитывают 7 дней спустя после последнего приема лекарства, используя формулу
TW1% = 100 - ((средняя относительная масса опухоли обработанной мыши)/(средняя относительная масса опухоли
контроля)) • 100
Результаты приведены в таблице XII для типичного соединения изобретения 6,9-бис{ [2-(амино)этил]амино}бензо(g)изохинолин-5,10-диона (10i) в виде дималеатной соли (10i
малеат) примера 12.
Реферат
Соединение формулы (I), в котором R является C1-C10-алкилом, фенилом или C7-C10-аралкилом, C2-C10-алкилом, замещенным одним или двумя заместителями, выбранными в группе, состоящей из OR1 и -NR2R3, C2-C10-алкилом, прерванным одним или двумя атомами кислорода или членом, выбранным в группе, состоящей из -NR4, цис-СН=СН-, транс-СН=СН-, -С=С-, и необязательно замещенного одним или двумя гидроксилами (ОН) или -NR2R3-группами, и в которой R1 выбран в группе, состоящей из водорода C1-C6-алкила, фенила, C7-C10-аралкила, -CHO, -COR5, -S/O2/R5 и C2-C6-алкила, необязательно замещенного -NR2R3; R2 и R3 являются одинаковыми или различными и выбраны в группе, состоящей из водорода, C1-C10-алкила, C7 -C10-аралкила, фенила, C2-C10-алкила, замещенного одним или двумя гидроксила (СH), -CHO, -COR5, -COOR5, -S/O2/R5, R2 и R3 взятые вместе с атомом азота, к которому они присоединены, образуют этилениминное кольцо или 5- или 6-членный ароматический или неароматический гетероцикл, необязательно содержащий другой гетероатом, выбранный в группе, состоящей из серы, кислорода и азота, R2 является H и R3 является -C(=NH/NH2 или R2 является -C(=NH/NH2 и R3 является Н; R4 выбран в группе, состоящей из водорода, C1-C10-алкила, C2-C10-оксиалкила, C2-C10 -алкила, замещенного -NR2R3, C7-C10-аралкила, α-, β- или γ-нафтила, фенила, о-, м- или п-толила, в виде свободного основания или его соли с фармацевтически приемлемой кислотой, обладает цитостатической и противоопухолевой активностью. Описан способ получения соединений формулы (I), а такие способ ингибирования опухолей у млекопитающих путем введения соединения формулы (I) в количестве от 1 мг до 50 мг в день на 1 кг массы тела. 4 c. и 34 з.п. ф-лы, 12 табл.

Формула
в которой R является алкилом C2-C10, замещенным одним или двумя заместителями, выбранными из группы, состоящей из OR1 и NR2R3; алкилом C2-C10, прерванным одним или двумя атомами кислорода или группой NR4 и необязательно замещенным одним или двумя гидроксильными группами или группами - NR2R3, и где R1 выбирают из группы, состоящей из водорода, алкила C1-C6;
R2 и R3, одинаковые или различные, и выбраны из группы, состоящей из водорода, алкила C1-C10 и алкила C2-C10, замещенного одной или двумя гидроксильными группами или группой -COR5, либо R2 и R3, взятые вместе с атомом азота, с которым они связаны, образуют кольцо этиленимина либо пяти- или шестичленный гетероцикл, необязательно содержащий другой гетероатом, такой, как кислород;
R4 выбирают из группы, состоящей из водорода или алкила C1-C10;
и R5 выбирают из группы, состоящей из алкила C1-C10,
в виде свободных оснований или их солей с фармацевтически приемлемыми кислотами.
6,9-бис{[2-(амино)этил]амино}бензо(g)изохинолин-5, 10-дион,
6,9-бис{[2-(4'-морфолино)этил]амино}бензо(g)изохинолин-5,10-дион,
6,9-бис{[2-(диметиламино)этил]амино}бензо(g)изохинолин-5,10-дион,
6, 9-бис{[2-(диэтиламино)этил]амино}бензо(g)изохинолин-5,10-дион,
6,9-бис{[2-(ди-втор.-пропил)этил]амино}бензо(g)изохинолин-5,10-дион,
6, 9-бис{[2-(1'-пирролидино)этил]амино}бензо(g)изохинолин-5,10-дион,
6,9-бис{[2-(1'-азиридино)этил]амино}бензо(g)изохинолин-5,10-дион,
6, 9-бис{[2-(метансульфонилокси)этил]амино}бензо(g)изохинолин-5,10-дион,
6,9-бис{[4-(амино)бутил]амино}бензо(g)изохинолин-5,10-дион,
6,9-бис{[3-(амино)пропил]амино}бензо(g)изохинолин-5, 10-дион,
6,9-бис{ [2-[(2-гидроксиэтил)амино] этил]амино}бензо(g)изохинолин-5,10-дион,
6,9-бис{[3-(диметиламино)пропил]амино}бензо(g)изохинолин-5,10-дион,
6, 9-бис{[(2-гидрокси)этил]амино}бензо(g)изохинолин-5,10-дион,
6,9-бис{[2-(2-гидроксиэтокси)этил]амино}бензо(g)изохинолин-5,10-дион,
6, 9-бис{[2-(метиламино)этил]амино}бензо(g)изохинолин-5,10-дион,
6,9-бис{[2-(этиламино)этил]амино}бензо(g)изохинолин-5,10-дион,
6,9-бис{[2-(н-пропиламино)этил]амино}бензо(g)изохинолин-5, 10-дион,
6,9-бис{[2-(втор-пропиламино)этил]амино}бензо(g)изохинолин-5,10-дион,
6,9-бис{[(2-гуанидино)этил]амино}бензо(g)изохинолин-5,10-дион,
6,9-бис{[(2-амино-2, 2-диметил)этил]амино}бензо(g)изохинолин-5,10-дион.
6,9-бис{[2-(амино)этил]амино}бензо(g)изохинолин-5,10-дион,
6,9-бис{[2-(1'-пирролидино)этил]амино}бензо(g)изохинолин-5,10-дион,
6,9-бис{[4-(амино)бутил]амино}бензо(g)изохинолин-5,10-дион,
6, 9-бис{[3-(амино)пропил]амино}бензо(g)изохинолин-5,10-дион,
6,9-бис{[2-(2-гидроксиэтил)амино]этил]амино}бензо(g)изохинолин-5,10-дион или соль любого из указанных соединений.
в которой R' является алкилом C2 - C10, замещенным одной или двумя группами OR1 или NR2R3, либо алкилом C2 - C10, прерванным одним или двумя атомами кислорода и замещенным одной или двумя гидроксильными группами или группами -NR2R3, и где R1, R2 и R3 являются атомами водорода,
подвергают взаимодействию с ангидридом C1 - C10 -алкилкарбоновой кислоты с получением соответствующего ацильного производного.
08.03.91 - по пп.2-4, 6, 9-12, 14-16, 18, 21-24, 26-28, 30, 33-36;
29.01.92 - по пп.1, 7, 8, 13, 17, 19, 20, 25, 29, 31, 32, 37, 38.

Комментарии