Производные 9-аминоакридина или их соли с органическими или неорганическими кислотами, проявляющие психотропную, антиамнестическую и липидрегулирующую активность - RU2024509C1
Код документа: RU2024509C1
Чертежи
















Описание
Изобретение относится к новым химическим соединениям, конкретно к
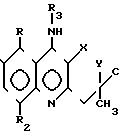
производным 9-аминоакридина общей формулы

Наиболее близким как по структуре, так и по назначению являются препараты такрин и амиридин формул


такрин амиридин
Недостатком указанных препаратов является их сравнительно высокая токсичность, побочные эффекты холинергической природы (тремор, диарея, соливация), кроме того, токсическое действие такрина на печень.
Известны производные
9-аминоакридина общей формулы

Недостатками данных соединений являются сравнительно высокая их токсичность, и как следствие этого незначительная терапевтическая широта.
Целью изобретения является поиск новых соединений в ряду 9-аминоакридина, проявляющих психотропную и антиамнестическую активность, обладающих при этом меньшей токсичностью, но большей активностью, а также проявляющих липидрегулирующую активность.
Поставленная цель достигается производными 9-аминоакридина указанной формулы, которые получают взаимодействием соответствующего замещенного нитрила антраниловой кислоты I с димедоном II, последующей циклизацией полученного гидрохлорида замещенного 2-[(5, 5-диме- тил-3-оксоциклогекс-1-енил)амино] бензо-нитрила III в замещенные 9-амино-3,3-диметил-3,4-дигидроакридин-1(2Н)-оны IV; алкилированием соединений IV алкил- или арилалкилгалогенидами в 9-алкил(арилалкил)амино-3,3-диметил-3, 4-дигидроакри- дин-1(2Н)-оны V; восстановлением соединений IV и V в 9-алкил(арилалкил)амино-3,3-диметил-1,2,3,4-тетрагидроакридин-1-оны VI; дегидратацией соединений VI в 9-алкил-(арилалкил)амино-3, 3-диметил-3,4-дигидро- акридины VII.
П р и м е р 1. 2-[(5,5-диметил-3-оксоциклогекс-1-енил)амино] бензонитрил, гидрохлорид (IIIa).
К раствору 4,72 г (0,04 моль) антранилонитрила (Ia) в 80 мл тетрагидрофурана прибавляют 6 мл концентрированной соляной кислоты, перемешивают 15 мин и прибавляют 5,6 г (0,04 моль) димедона (II). Нагревают при кипении и перемешивании в течение 12 ч, осадок отфильтровывают, промывают ацетоном, сушат. Маточный раствор упаривают до 1/3 начального объема, осадок отфильтровывают, промывают ацетоном, сушат. Осадки объединяют, получают 9,1 г (82%) IIIa, т.пл. 214-215оС (изопропанол).
П р и м е р 2. 2-[(5,5,-Диметил-3-оксоцилогекс-1-енил)амино]-3, 6-диметилбензонит- рил, гидрохлорид (IIIг).
К раствору 5,84 г (0,04 моль) 3,6-диметилантранилонитрила (IIв) в 80 мл диоксана прибавляют 6 мл концентрированной соляной кислоты, перемешивают 15 мин и прибавляют 5,6 г (0,04 моль) димедона II. Нагревают при кипении и перемешивании в течение 14 ч, осадок отфильтровывают, промывают ацетоном, сушат. Маточный раствор упаривают до 1/4 начального объема, осадок отфильтровывают, промывают ацетоном, сушат. Осадки объединяют, получают 10,5 г (87%) IIIг, т.пл. 208-209оС (изопропанол).
Аналогично получены соединения III в-ж (табл.1).
П р и м е р 3. 9-Амино-3,3-диметил-3,4-дигидроакридин-1 (2Н)-он (IVа).
К суспензии 27,7 г (0,1 моль) гидрохлорида енамина IIIа в 200 мл сухого тетрагидрофурана прибавляют 27,6 г (0,2 моль) порошка К2СО3 и 0,5 г CuCl, нагревают при кипении и перемешивании в течение 5 ч, горячий раствор отфильтровывают, осадок на фильтре промывают водой, сушат. Органический маточный раствор упаривают до 1/5 начального объема, осадок отфильтровывают, промывают водой, сушат, объединяют с первым осадком, перекрис- таллизовывают из водного этанола, получают 21,4 г (89%) IVа, т.пл.223-224оС.
П р и м е р 4. 9-Амино-3,3-диметил-3,4-дигидроакридин-1 (2Н)-он (IVa).
К суспензии 27,7 г (0, 1 моль) гидрохлорида енамина IIIа в 300 мл сухого диоксана прибавляют 27,6 г (0,2 моль) порошка К2СО3 и 0,5 г CuBr, нагревают при кипении и перемешивании в течение 5 часов, осадок отфильтровывают, промывают водой, сушат. Органический маточный раствор упаривают до 1/5 начального объема, осадок отфильтровывают, промывают водой, сушат, объединяют с первым осадком, пере- кристаллизовывают из водного этанола, получают 21,8 г (91%) IVа, т.пл. 223-224оС.
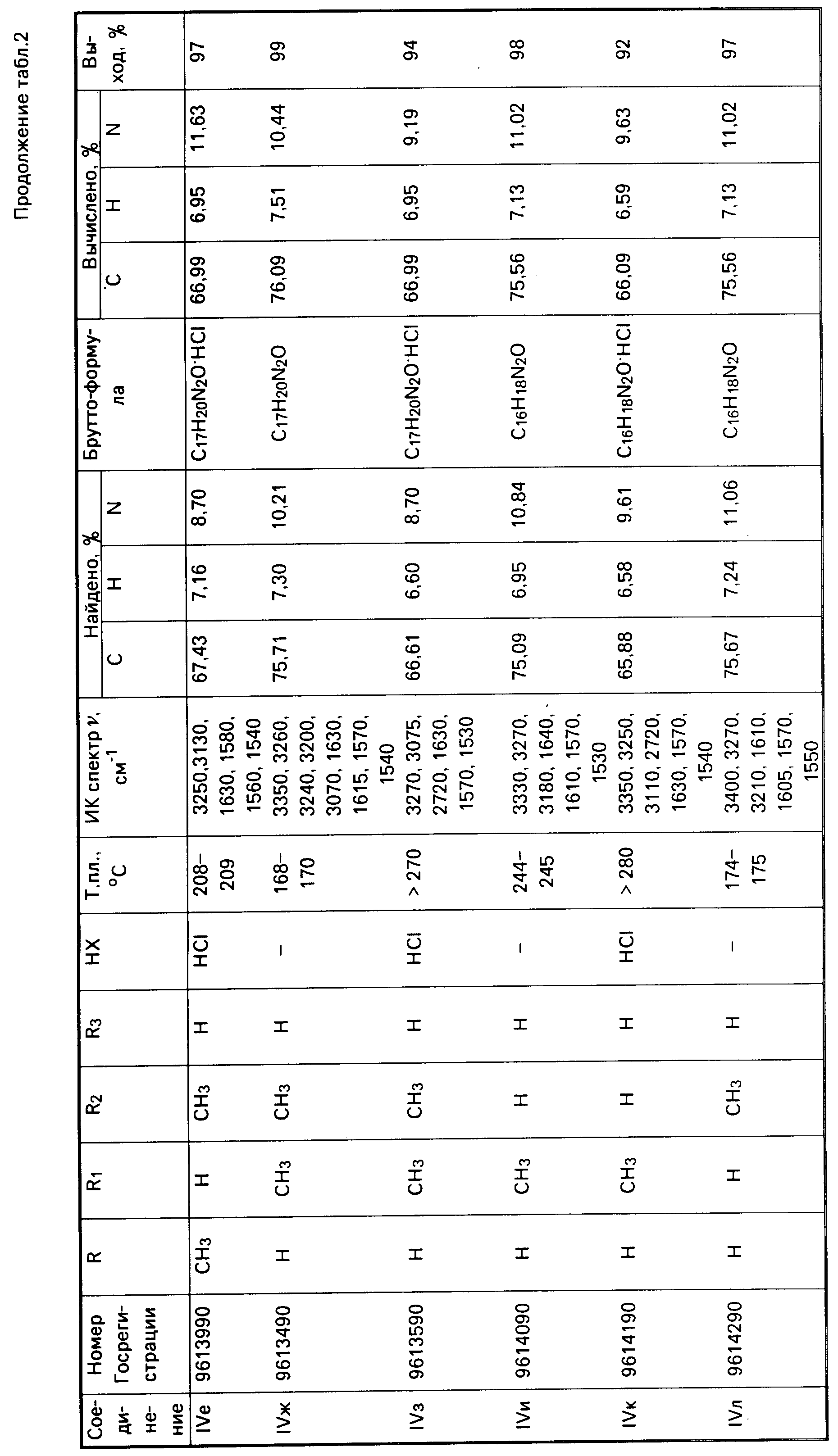
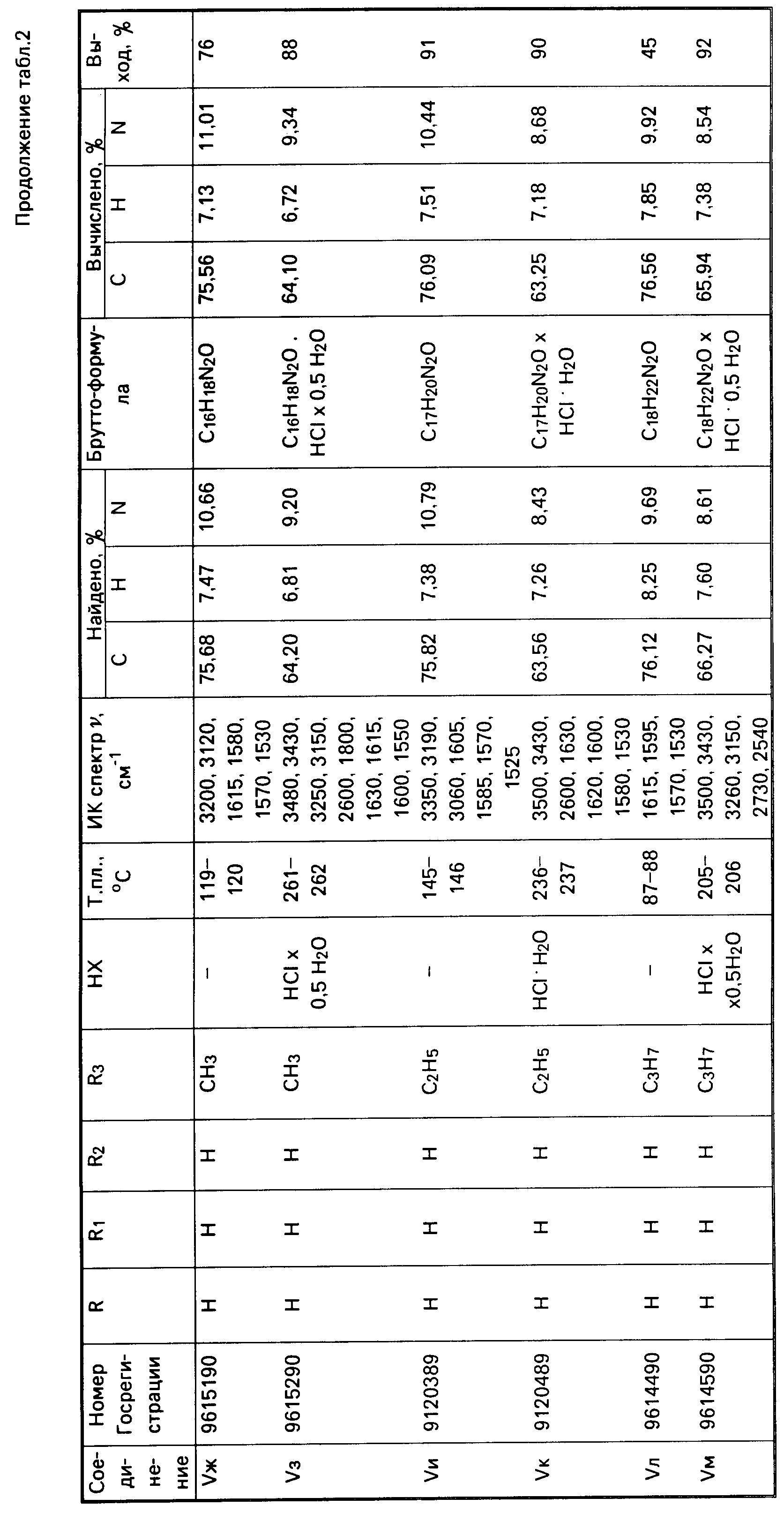
Аналогично получены соединения IV в-м (табл.2).
П р и м е р 5. 9-Бензиламино-3,3-диметил-3,4-дигидроакридин-1 (2Н)-он (Vа).
К раствору 4,8 г (0,02 моль) амина IVа в 70 мл сухого диметилсульфоксида прибавляют 2,8 г (0,05 моль) порошка КОН, перемешивают 1 ч, прибавляют 3,16 г (0,025 моль, 2,9 мл) хлористого бензила, перемешивают 6 ч, прибавляют еще 0,8-1 мл хлористого бензила и оставляют на ночь. Выливают в 350 мл воды, перемешивают 0,5 ч, оставляют на сутки, осадок отфильтровывают, промывают водой, перекристаллизовывают из водного этанола, получают 5,8 г (88% ) Vа, т.пл. 169-170оС.
Аналогично получены соединения V б-к (табл.2).
П р и м е р 6. 9-Бензиламино-3,3-диметил-3,4-дигидроакридин-1(2Н)-он (Va).
Интенсивно перемешивают смесь 2,4 г (0,01 моль) амина IVa, 1,4 г (0,011 моль, 1,27 мл) бензила хлористого, 0,5 г (C4H9)4NBr 75 мл хлористого метилена и 50 мл 50%-ного водного раствора NaOH в течение 20 ч. Выливают в 200 мл воды со льдом, органическую фазу отделяют, водную экстрагируют хлороформом (4х50 мл), упаривают, остаток перекристаллизовывают из водного этанола, получают 1,2 г (36%) Va, т.пл. 169-170оС.
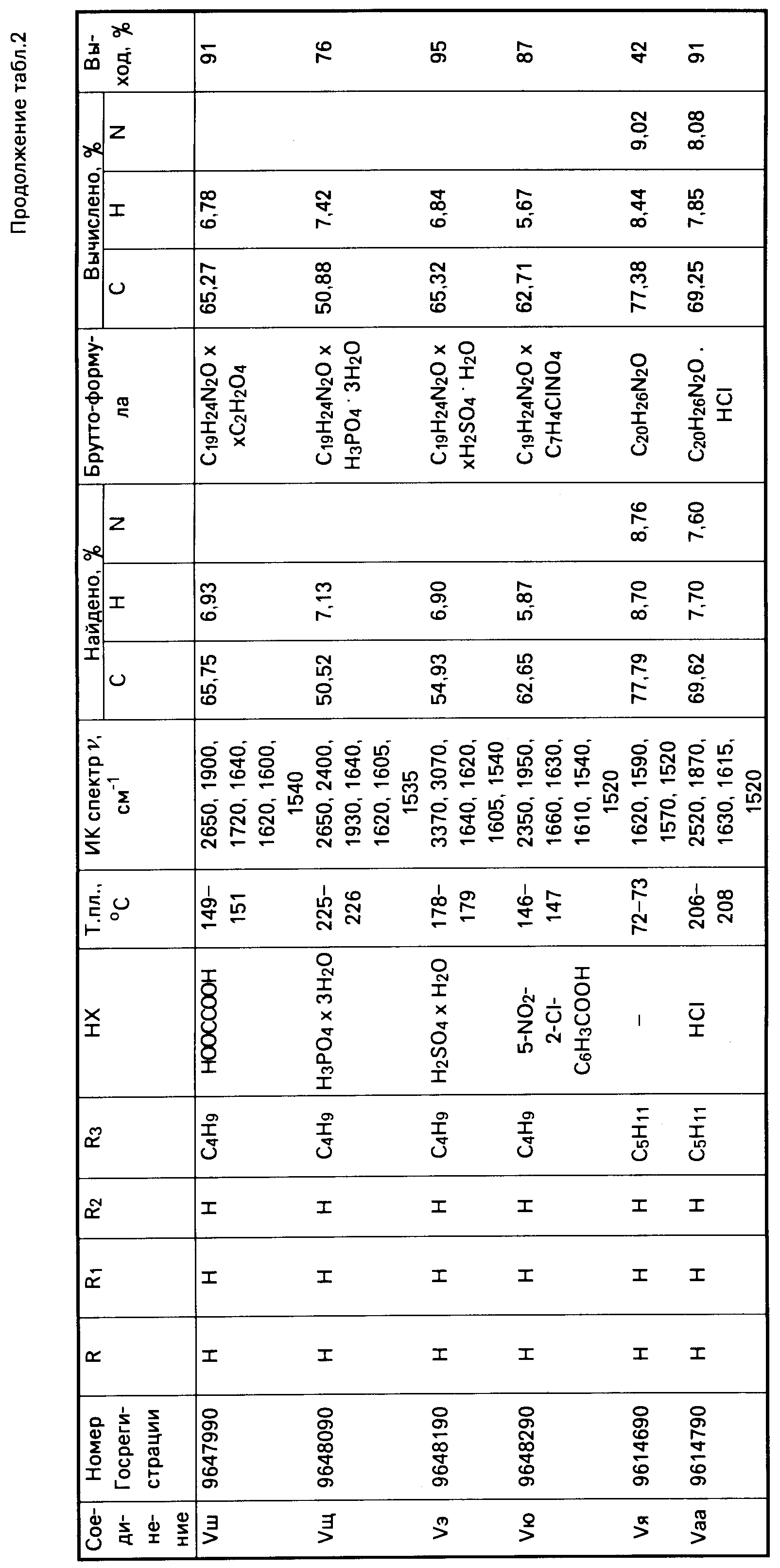
Аналогично получено соединение Vп (табл.2).
П р и м е р 7. 9-Амино-3,3-диметил-1,2,3,4-тетрагидроакридин-1-ол (VIa).
К суспензии 4,8 г (0,02 моль) IVa в 100 мл абсолютного тетрагидрофурана при 0+5о прибавляют порциями при перемешивании в токе N2 1,0 г (0,026 моль) LiAlH4. Перемешивают 5 ч при этой температуре. Разлагают последовательно 4 мл насыщенного раствора NH4Cl и 60 мл 30%-ного раствора КОН. Органическую фазу отделяют, упаривают растворитель, остаток перекристаллизовывают из водного этанола. Получают 4,2 г (87%) VIа, т.пл. 200-202оС.
Аналогично получены соединения VI б-к (табл.3).
П р и м е р 8. 9-Амино-3,3-диметил-3,4-дигидроакридин, гидрохлорид (VIIб).
Нагревают при кипении раствор 2, 42 г (0,01 моль) VIa в смеси 40 мл этанола и 5 мл концентрированной соляной кислоты в течение 1 ч. Растворитель упаривают, остаток перекристаллизовывают из этанола. Получают 2,5 г (92%) VIIб, т.пл. > 330оС.
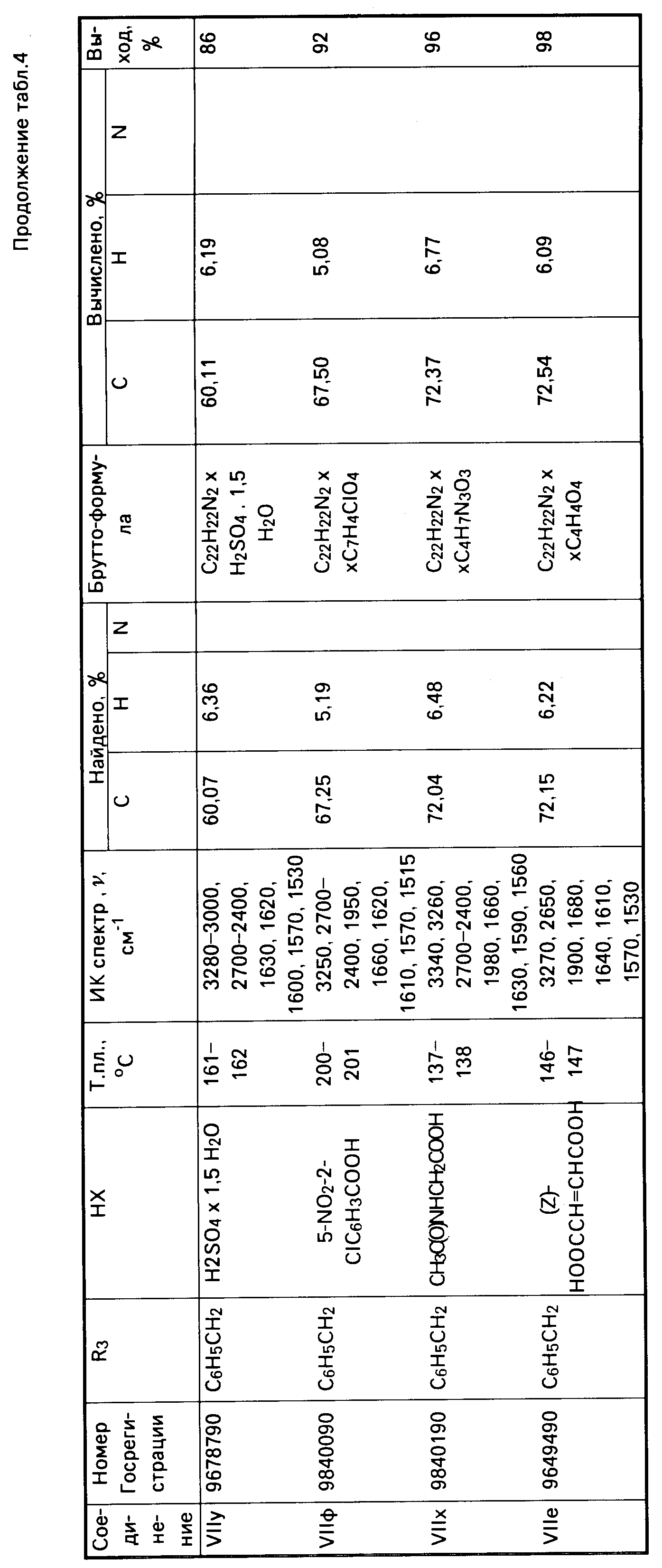
Аналогично получены соединения VII в-д (табл.4).
Изучение нейропсихотропного действия соединений IV-VII и их влияние на условно-рефлекторную деятельность проведено на нелинейных мышах-самцах весом 18-20 г и крысах весом 180-200 г. Животные содержались при температуре 21-22оС и стандартном 12-часовом режиме освещения. Доступ к корму и воде ad libitum. Изучена острая токсичность при внутрибрюшинном (в/б) введении мышам по методу Кербера. Исследовано влияние IV-VII на поведение животных, двигательную активность, на эффекты гексенала (30, 60 мг/кг), ареколина (25 мг/кг), апоморфина (2 мг/кг). Вещества вводили в/б в дозе 1/20 ЛД50. Изучено их влияние на обучение и память мышей в тесте Stepdown на модели скополаминовой амнезии. На интактных крысах влияние веществ на условно-рефлекторную деятельность изучали с помощью теста условной реакции пассивного избегания (УРПИ) в условиях, обеспечивающих в среднем 50% обучение. Соединения IV-VII вводили крысам в/б в дозе 0,1 мг/кг, эффективной в тесте УРПИ для эталон-препарата амиридина, за 20 мин. до обучения, ноотропный препарат сравнения пирацетам (250 мг/кг, в/б) - за 60 мин. Амнестический синдром моделировали 20-дневным введением скополамина крысам в дозе 1 мг/кг в/б. Для оценки антиамнестического действия препараты сравнения и соединения IV-VII вводили в течение 10 дней сразу же после окончания курса скополамина. Обучение УРПИ проводили через 24 ч после окончания курса препаратов.
Влияние веществ на сократительную активность изолированных гладкомышечных органов (подвздошная кишка морской свинки, семенные пузырьки крысы) изучено по стандартному методу Блаттнера с использованием ацетилхолина и адреналина. Влияние веществ на ацетилхолинэстеразу (АХЭ) проводили спектрометрическим методом Эллмана, используя препарат фермента из эритроцитов крови человека. Исследование действия веществ на калиевую проводимость нервного волокна перехвата Ранвье лягушки изучали методом фиксации потенциала.
Гомогенизацию ткани коры мозга крыс и выделение синаптосом проводили методом De Robertis. Влияние веществ на микровязкость мембран синаптосом изучали с помощью молекулярного зонда пирена.
В качестве препаратов сравнения, кроме упомянутых амиридина и пирацетама, использовали такрин, поскольку полученные соединения являются производными аминоакридина.
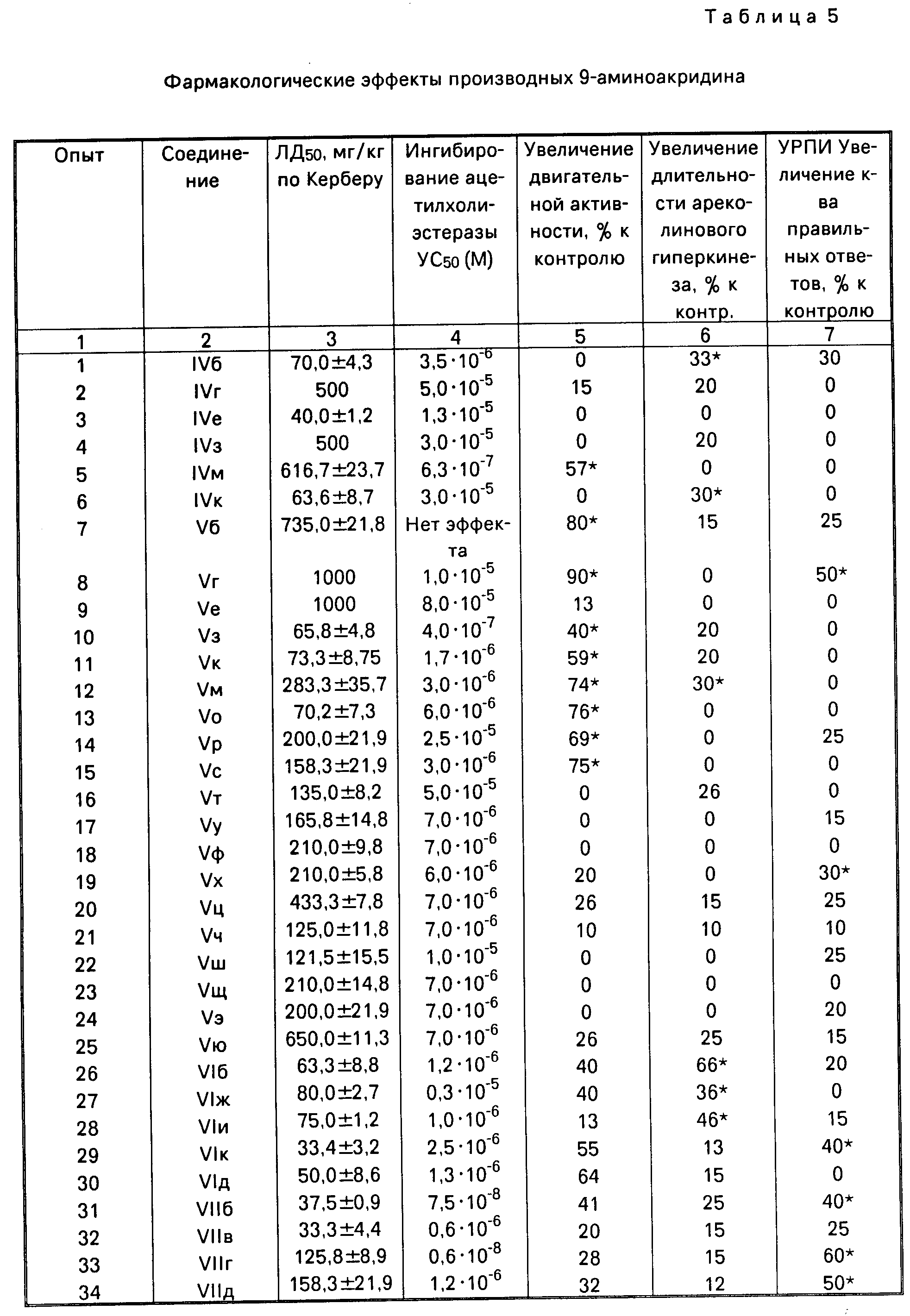
Результаты исследования фармакологической активности заявляемых соединений представлены в табл.5. Их можно отнести к классам умеренно и малотоксичных веществ, поскольку ЛД50 варьировала в пределах 40-1000 мг/кг, причем у основной группы веществ острая токсичность была более 100 мг/кг. Это выгодно отличает заявляемые соединения от препаратов сравнения такрина и амиридина, ЛД50 которых составляет 35 и 52 мг/кг соответственно, а также от прототипа. Основная группа соединений вызывала увеличение двигательной активности на 40-90%. Заявляемые соединения усиливали эффекты ареколина на 30-66% , свидетельствуя об участии холинэргических механизмов в проявлении их фармакологической активности. Вещества обладали способностью ингибировать АХЭ менее выраженно, чем препараты сравнения. Они не влияли на сократительную активность гладких мышц в отличие от амиридина. Благодаря перечисленным фактам побочные эффекты заявляемых веществ, имеющие холинэргическую природу (тремор, соливация, диарея), выражены у них слабее, чем у эталон-препаратов и наблюдались лишь к токсических дозах. Не обнаружено выраженного действия исследуемых соединений на эффекты гексенала и апоморфина.
При изучении влияния соединений IV-VII на условно-рефлекторную деятельность здоровых крыс в тесте УРПИ обнаружено, что статистически значимо улучшали число правильных ответов вещества: IVе, Vг, VIл, VIIб, VIIг, VIIд, VIIк, VIIн, VIIp, VIIc, VIIт, VIIу, Vх. Следует отметить, что соединения Vг, VIIг, VIIд обладали способностью улучшать обучение и память интактных крыс по степени выраженности, близкой к амиридину и пирацетаму (такрин был неактивен в условиях эксперимента). Однако они выгодно отличаются от амиридина по токсичности - эти соединения относятся к классу малотоксичных веществ.
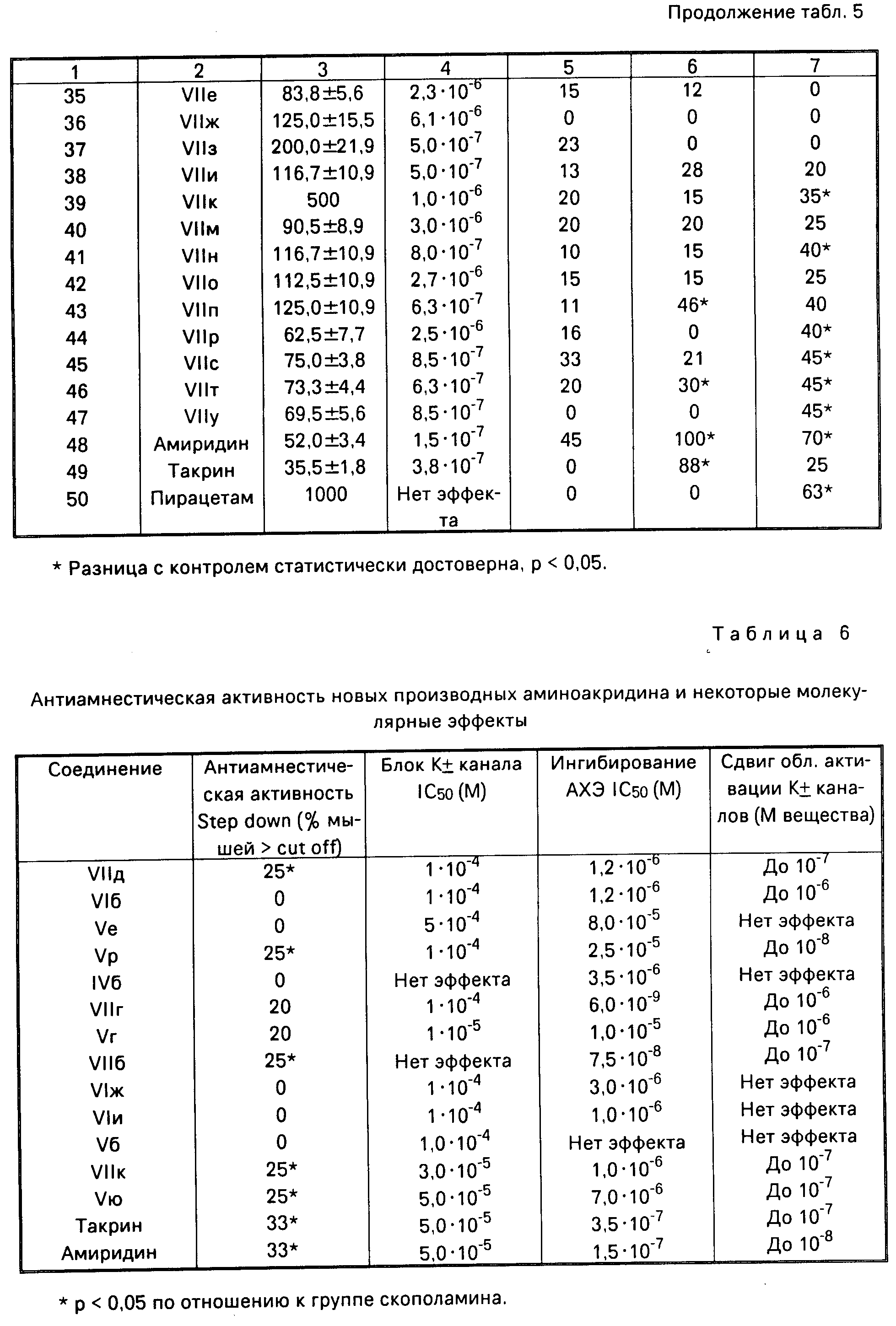
На модели патологии памяти, вызванной скополамином, в тесте Step dawn на мышах исследована антиамнестическая активность полученных соединений. Примеры представлены в табл.6. Обнаружено, что вещества VIIд, Vр, VIIб, VIIк, Vю обладают выраженной активностью, сравнимой с амиридином и такрином.
Для дальнейших исследований выбрано вещество Vр. Это соединение менее токсично, чем амиридин и такрин ЛД50 = 200+22 мг/кг). На модели амнестического синдрома, вызванного многократным введением скополамина, обнаружено, что при курсовом 10-дневном введении вещество Vр нормализовало условно-рефлекторную деятельность крыс на уровне препаратов сравнения (табл.7). При этом происходила нормализация микровязкости синаптосом коры мозга, достоверно повышенная у животных с амнезией.
В табл.8 представлены экспериментальные данные по старым (18 месячным) крысам. Обнаружено, что курсовое 20-дневное введение вещества Vр приводило к статиcтически значимому улучшению памяти животных в тесте УРПИ по сравнению с 6-месячными половозрелыми крысами. А эталон-препараты - только к восстановлению обучения и памяти до уровня 6-месячных крыс. При этом, соединение Vр по выраженности эффекта достоверно превосходило амиридин. Кроме того, под действием всех исследуемых фармакологических веществ происходила нормализация микровязкости синаптических мембран, а также содержания холестерина в синаптосомах (касается только вещества Vр и амиридина).
Липидрегулирующую активность полученных соединений производных 9-аминоакридина - оценивали in vitro на адипоцитах крысы. Адипоциты выделяли из жировой ткани придатков семенников взрослых крыс-самцов. Анализ липидного состава проводили методом тонкослойной хроматографии.
Количественный анализ фосфолипидов (ФЛ), моно- и диацилглицеридов (МДГ), триацилглицеридов (ТГ), неэтерифицированных жирных кислот (НЭЖК), свободного холестерина (СХ), метиловых эфиров жирных кислот (МеЖК) проводили методом спектрофотометрии.
Результаты исследования липидрегулирующей активности полученных соединений и пробукола - препарата, широко применяемого для лечения атеросклероза, представлены в табл.9-13.
Наиболее выраженным действием на липидный состав адипоцитов (как на абсолютные показатели, так и на соотношения отдельных фракций) обладают соединения VIIд, Vр и VIIг.
Соединение VIIд. Под влиянием данного соединения в адипоцитах происходит увеличение процентного содержания фосфолипидов с одновременным уменьшением содержания триацилглицеридов (табл.9). Несколько снижается также содержание метиловых эфиров жирных кислот. Увеличение соотношения ФЛ/ТГ (табл. 11) происходит, вероятно, не только за счет изменения процессов синтеза липидов. но и за счет выброса триацилглицеридов во внешнюю среду с одновременной задержкой фосфолипидов в клетке (табл.10,12,13). Наблюдается тенденция к увеличению относительного выброса холестерина из клетки (табл. 10,12).
Соединение Vр. По влиянию на липидный состав адипоцитов данное соединение аналогично соединению VIIд. Наблюдается накопление фосфолипидов в клетке (табл. 9,11,13), повышенный выброс триацилглицеридов во внешнюю среду (табл. 10,12) и резкое снижение содержания метиловых эфиров жирных кислот (табл.9).
Соединение VIIг. Указанное соединение обладает выраженным липолитическим действием, о чем свидетельствует повышение процентного содержания жирных кислот в клетке (табл.9) и резкое увеличение соотношения НЭЖК-ТГ в пользу жирных кислот (табл.11).
Проведенное исследование свидетельствует о том, что заявляемые соединения способны влиять на липидный состав клеток. Наиболее выраженным действием обладают соединения VIIд, Vр и VIIг. Остальные исследованные соединения также способны вызывать изменения в содержании того или иного липида. Однако сочетание свойств указанных трех соединений позволяет считать их наиболее перспективными в плане создания новых лекарственных средств для лечения заболеваний, связанных с нарушениями липидного обмена. Соединения VIIд и Vр, как обладающие способностью увеличивать соотношение ФЛ/ТГ и снижать уровень холестерина в клетке, могут быть рекомендованы для изучения в качестве потенциальных противоатеросклеротических средств и как вещества, предотвращающие жировую дистрофию органов. Соединение VIIг благодаря выраженному липолитическому эффекту, может рассматриваться как перспективное средство для лечения заболеваний, сопровождающихся ожирением. Соединения Vр и VIIг не уступают по липидрегулирующей активности одному из самых высокоэффективных в мировой практике препарату пробукол, а соединение VIIд - даже превосходит его.
Таким образом, полученные согласно изобретению производные 9-аминоакридина являются менее токсичными, чем известные лекарственные препараты (такрин, амиридин), обладающие антиамнестической активностью, действуют в сравнимых или меньших дозах, что обеспечивает данным соединениям большую широту терапевтического действия. Дополнительным ценным свойством их является то, что они проявляют липидрегулирующую активность, которая свидетельствует о перспективности данных соединений в качестве противоатеросклеротических средств и средств для лечения заболеваний, сопровождающихся нарушением липидного обмена, особенно фосфолипидов (ожирение, сахарный диабет, мембранопатии различного происхождения).
Реферат
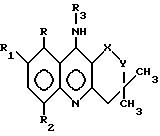
Использование: в качестве веществ, проявляющих психотропную, антиамнестическую и липидрегулирующую активность. Сущность изобретения: продукт - производные 9-аминоакридина общей формулы

Формула
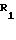

где R - H, CH3;
R1 - H, CH3, Br;
R2 - H, CH3;
R3 - H, C1 - C5-алкил, арилметил, диэтиламиноэтил;
X - C = O, CHOH, Y - CH2,
X = Y - CH = CH,
или их соли с органическими или неорганическими кислотами, проявляющие психотропную, антиамнестическую и липидрегулирующую активность.

Комментарии