Производные циклоалкано-индола и азаиндола, смесь их изомеров или отдельные изомеры и их фармацевтически приемлемые соли, производные карбоновой кислоты в качестве исходных соединений и фармацевтическая композиция, ингибирующая высвобождение ассоциирован - RU2157803C2
Код документа: RU2157803C2
Чертежи




































Описание
Изобретение относится к новым азотсодержащим гетероциклическим соединениям, обладающим ценными биологическими свойствами, в частности к производным циклоалкано-индола и -азаиндола, смеси их изомеров или отдельным изомерам и их фармацевтически приемлемым солям, производным карбоновой кислоты в качестве исходных соединений и фармацевтической композиции, ингибирующей высвобождение ассоциированных с аполипопротеином В- 100 липопротеинов.
Из заявки ЕР N 0234708 известны производные циклоалкано- индола и -азаиндола, обладающие биологической активностью, например, ингибирующей высвобождение ассоциированных с аполипопротеином В-100 липопротеинов активностью.
Задачей изобретения является расширение ассортимента производных циклоалканоиндола и -азаиндола, обладающих биологической активностью, в частности ингибирующей высвобождение ассоциированных с аполипопротеином В-100 липопротеинов активностью.
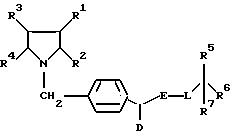
Поставленная задача решается предлагаемыми производными циклоалкано-индола и -азаиндола общей формулы (I)

в которой R1 и R2 вместе со связывающей их двойной связью означают фенильное или пиридильное кольцо или кольцо формулы
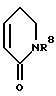
в которой
R8 означает водород или неразветвленный или разветвленный алкил с 1 - 4 атомами углерода,
R3 и R4 вместе со связывающей их двойной связью означают фенильное кольцо или четырех - до восьмичленный циклоалкеновый остаток, причем указанные для R1/R2 и R3/R4 кольца незамещены или замещены 1 - 3 одинаковыми или различными заместителями, выбранными из группы, включающей трифторметил, неразветвленную или разветвленную алкокси-группу с 1 - 6 атомами углерода, неразветвленный или разветвленный алкоксикарбонил с 1 - 6 атомами углерода в алкоксильной части, неразветвленный или разветвленный алкил с 1-6 атомами углерода, незамещенный или замещенный гидрокси-группой,
D - водород, циклоалкил с 4-12 атомами углерода, или неразветвленный или разветвленный алкил с 1-12 атомами углерода,
E - группа -CO- или - CS-,
L - атом кислорода, серы, или группа -NR9, в которой R9 означает водород или неразветвленный или разветвленный алкил с 1-6 атомами углерода, незамещенный или замещенный гидрокси-группой или фенилом,
R5- фенил, пиридил, тиенил, незамещенные или замещенные 1 - 3 одинаковыми или различными заместителями, выбранными из группы, включающей нитро-группу, карбокси-группу, галоген, неразветвленный или разветвленный алкоксикарбонил с 1-6 атомами углерода в алкоксильной части, неразветвленный или разветвленный алкил с 1-6 атомами углерода, незамещенный или замещенный гидрокси-группой, и/или группу формулы - OR10 или -NR11/R12, в которой R10 означает водород или неразветвленный или разветвленный алкил с 1-6 атомами углерода или алкенил с 2-6 атомами углерода, a R11 и R12 одинаковые или различные и означают водород, неразветвленный или разветвленный алкил с 1-6 атомами углерода или неразветвленный или разветвленный ацил с 1-8 атомами углерода, незамещенный или замещенный группой формулы -NR13/R14, в которой R13 и R14 одинаковые или различные и означают водород или неразветвленный или разветвленный ацил с 1-8 атомами углерода,
R6 - водород, карбокси-группа, неразветвленный или разветвленный алкоксикарбонил с 1-5 атомами углерода в алкоксильной части или неразветвленный или разветвленный алкил с 1-6 атомами углерода, незамещенный или замещенный гидрокси-группой или группой формулы -O-CO-R15, в которой R15 означает фенил, незамещенный или одно- до трехкратно замещенный неразветвленным или разветвленным алкилом с 1-5 атомами углерода, или неразветвленный или разветвленный алкил или алкенил 1-22 атомами углерода, незамещенный или замещенный группой формулы -OR16, в которой R16 означает водород, бензил, или неразветвленный или разветвленный ацил с 1-6 атомами углерода,
R7 - водород, или
R6 и R7 вместе означают группу формулы = О,
смесью их изомеров или их отдельными изомерами и их фармацевтически приемлемыми солями.
В качестве фармацевтически приемлемых солей можно назвать, например, соли предлагаемых соединений с минеральными кислотами, карбоновыми кислотами или сульфокислотами. Особенно предпочтительными являются, например, соли с хлористоводородной кислотой, бромистоводородной кислотой, серной кислотой, фосфорной кислотой, метансульфокислотой, этансульфокислотой, толуолсульфокислотой, бензолсульфокислотой, нафталиндисульфокислотой, уксусной кислотой, пропионовой кислотой, молочной кислотой, винной кислотой, лимонной кислотой, фумаровой кислотой, малеиновой кислотой или бензойной кислотой.
Дальнейшими фармацевтически приемлемыми солями являются соли металлов предлагаемых соединений или их аммониевые соли, содержащие свободную карбоксильную группу. Особенно предпочтительными являются, например, натриевые, калиевые, магниевые и кальциевые соли, а также аммониевые соли, производные от аммиака или органических аминов, как, например, этиламина, диэтиламина, триэтиламина, диэтаноламина, триэтаноламина, дициклогексиламина, диметиламиноэтанола, аргинина, лизина, этилендиамина или 2-фенилэтиламина.
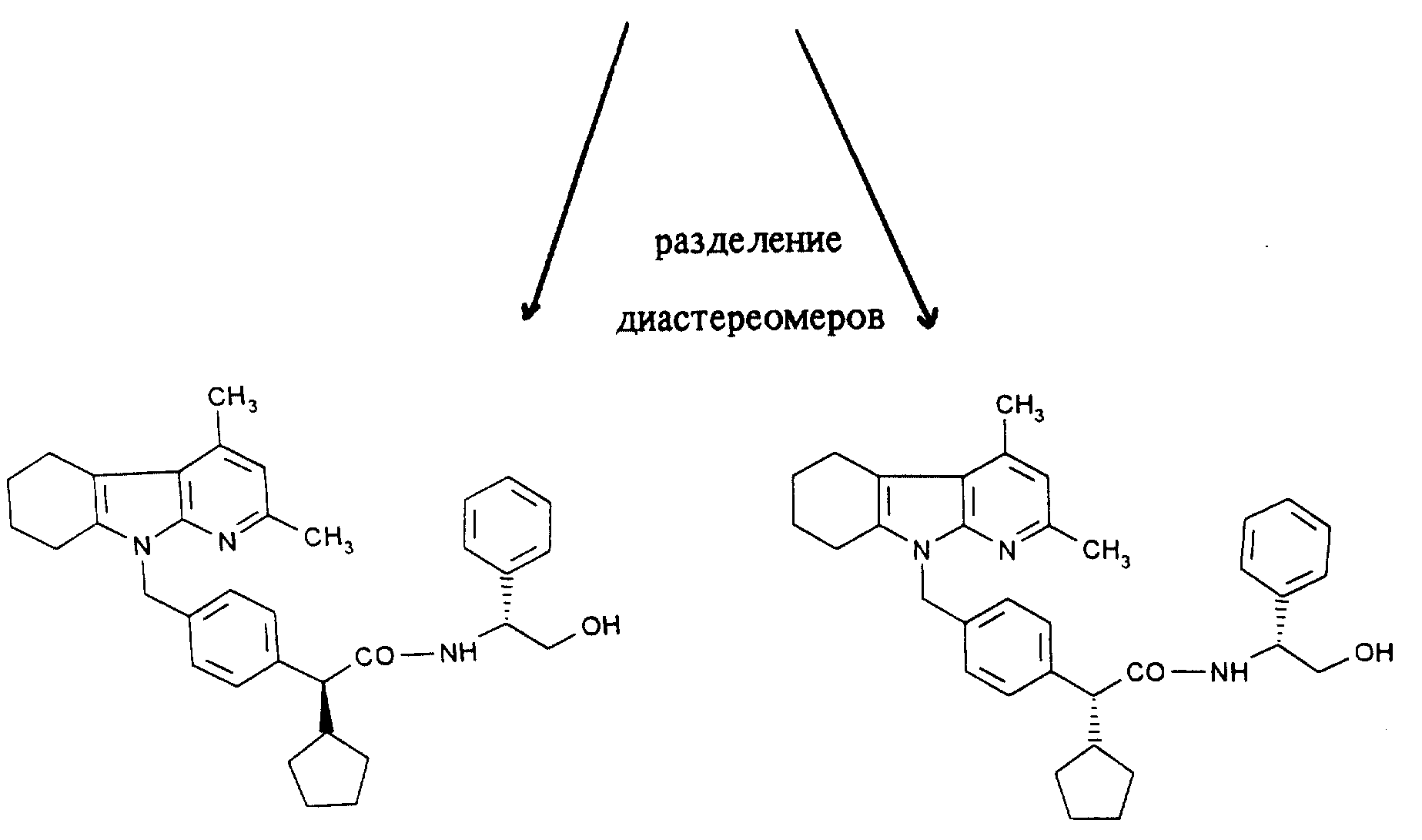
Предлагаемые соединения могут иметься в стереоизомерных формах, имеющихся или в виде изображения и зеркального изображения (энантиомеры), или не имеющихся в виде изображения и зеркального изображения (диастереомеры). Изобретение относится и к энантиомерам, и к диастереомерам, и их смесям. Смеси энантиомеров и диастереомеров можно известным методом разделять на чистые стереоизомерные компоненты.
Предпочтительными являются соединения общей формулы (I), в которой R1 и R2 вместе со связывающей их двойной
связью означают фенильное или пиридильное кольцо или кольцо формулы
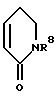
которой R8 означает водород или неразветвленный или разветвленный алкил с 1 - 3 атомами углерода,
R3 и R4 вместе со связывающей их двойной связью означают фенильное кольцо или циклопентен, циклогексен, циклогептен, циклооктен, причем указанные для R1/R2 и R3/R4 кольца незамещены или замещены 1 или 2 одинаковыми или различными заместителями, выбранными из группы, включающей трифторметил, неразветвленную или разветвленную алкокси- группу с 1-4 атомами углерода, неразветвленный или разветвленный алкоксикарбонил с 1-4 атомами углерода в алкоксильной части и неразветвленный или разветвленный алкил с 1-4 атомами углерода, незамещенный или замещенный гидрокси-группой,
D - водород, циклобутил, циклопентил, циклогексил, циклопентил, циклооктил или неразветвленный или разветвленный алкил с 1-10 атомами углерода,
E - группа -CO- или CS-,
L - атом кислорода, серы, или группа формулы -NR9, в которой R9 означает водород или неразветвленный или разветвленный алкил с 1-5 атомами углерода, незамещенный или замещенный гидрокси-группой или фенилом,
R5 - фенил, пиридил, тиенил, незамещенные или замещенные 1 или 2 одинаковыми или различными заместителями, выбранными из группы, включающей фтор, хлор, бром, неразветвленный или разветвленный алкоксикарбонил с 1-4 атомами углерода в алкоксильной части, неразветвленный или разветвленный алкил с 1- 5 атомами углерода, незамещенный или замещенный гидрокси-группой, и/или группу формулы -OR10 или -NR11R12, в которых R10 означает водород или неразветвленный или разветвленный алкил с 1-4 атомами углерода или алкенил с 2-4 атомами углерода, a R11 и R12 одинаковые или различные и означают водород, неразветвленный или разветвленный алкил с 1-5 атомами углерода или неразветвленный или разветвленный ацил с 1-6 атомами углерода, незамещенный или замещенный группой формулы -NR13R14, в которой R13 и R14 одинаковые или различные и означают водород или неразветвленный или разветвленный ацил с 1-6 атомами углерода,
R6 - водород, карбокси-группа, неразветвленный или разветвленный алкоксикарбонил с 1-4 атомами углерода в алкоксильной части или неразветвленный или разветвленный алкил с 1-5 атомами углерода, незамещенный или замещенный гидрокси-группой или группой формулы -O-CO-R15, в которой R15 означает фенил, незамещенный или одно- до трехкратно замещенный неразветвленным или разветвленным алкилом с 1-4 атомами углерода, или неразветвленный или разветвленный алкил или алкенил с 2-20 атомами углерода, незамещенный или замещенный группой формулы -OR16, в которой R16 означает водород, бензил, или неразветвленный или разветвленный ацил с 1 - 5 атомами углерода,
R7 - водород, или
R6 и R7 вместе означают группу формулы =О,
смесь их изомеров или отдельные изомеры и их фармацевтически приемлемые соли.
Особенно предпочтительными
являются соединения общей формулы (I), в которой
R1 и R2 вместе со связывающей их двойной связью означают фенильное или пиридильное кольцо или кольцо формулы

в которой R8 означает водород или метил, R3 и R4 вместе со связывающей их двойной связью означают фенильное кольцо или циклопентен, циклогексен, циклогептен, циклооктен,
причем указанные для R1/R2 и R3/R4 кольца незамещены или замещены 1 или 2 одинаковыми или различными заместителями, выбранными из группы, включающей трифторметил, неразветвленную или разветвленную алкокси-группу с 1 - 3 атомами углерода, неразветвленный или разветвленный алкоксикарбонил с 1-3 атомами углерода в алкоксильной части и неразветвленный или разветвленный алкил с 1-3 атомами углерода, незамещенный или замещенный гидрокси-группой,
D - водород, циклопентил, циклогексил, циклогептил, циклооктил или неразветвленный или разветвленный алкил с 1-6 атомами углерода,
E - группа -CO- или CS-,
L - атом кислорода, серы, или группа формулы -NR9 в которой R9 означает водород или неразветвленный или разветвленный алкил с 1 - 4 атомами углерода, незамещенный или замещенный гидрокси-группой или фенилом,
R5 - фенил, пиридил, тиенил, незамещенные или замещенные 1 или 2 одинаковыми или различными заместителями, выбранными из группы, включающей нитро-группу, карбокси-группу, фтор, хлор, бром, неразветвленный или разветвленный алкоксикарбонил с 1-3 атомами углерода в алкоксильной части, неразветвленный или разветвленный алкил с 1 - 4 атомами углерода, незамещенный или замещенный гидрокси-группой, и/или группу формулы -OR10 или -NR11R12, в которых R10 означает водород или неразветвленный или разветвленный алкил с 1-3 атомами углерода или алкенил с 2-3 атомами углерода, а R11 и R12 одинаковые или различные и означают водород, неразветвленный или разветвленный алкил с 1 - 4 атомами углерода или неразветвленный или разветвленный ацил с 1-5 атомами углерода, незамещенный или замещенный группой формулы -NR13R14, в которой R13 и R14 одинаковые или различные и означают водород или неразветвленный или разветвленный ацил с 1-6 атомами углерода,
R6 - водород, карбокси-группа, неразветвленный или разветвленный алкоксикарбонил с 1 - 3 атомами углерода в алкоксильной части или неразветвленный или разветвленный алкил с 1-4 атомами углерода, незамещенный или замещенный гидрокси-группой или группой формулы -O-CO-R15, в которой R15 означает фенил, незамещенный или одно- или трехкратно замещенный неразветвленным или разветвленным алкилом с 1-3 атомами углерода, или неразветвленный или разветвленный алкил с 1-19 атомами углерода или алкенил с 2-19 атомами углерода, незамещенный или замещенный группой формулы -OR16, в которой R16 означает водород, бензил, или неразветвленный или разветвленный ацил с 1-4 атомами углерода,
R7 - водород, или
R6 и R7 вместе означает группу формулы =O,
смесь их изомеров или отдельные изомеры и их фармацевтически приемлемые соли.
Предлагаемые соединения общей формулы (I) можно получать, например, путем перевода соединения общей
формулы (II)

в которой
R1, R2, R3, R4 и D имеют вышеуказанные значения,
в амид с использованием соединения общей формулы (III)
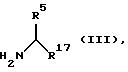
в которой R5 имеет вышеуказанные значения,
R17 имеет указанное для R6 значение, за исключением карбокси-группы,
в среде инертного растворителя и в присутствии оснований и/или вспомогательных веществ,
в случае необходимости с последующей вариацией функциональных групп путем гидролиза, этерификации или восстановления.
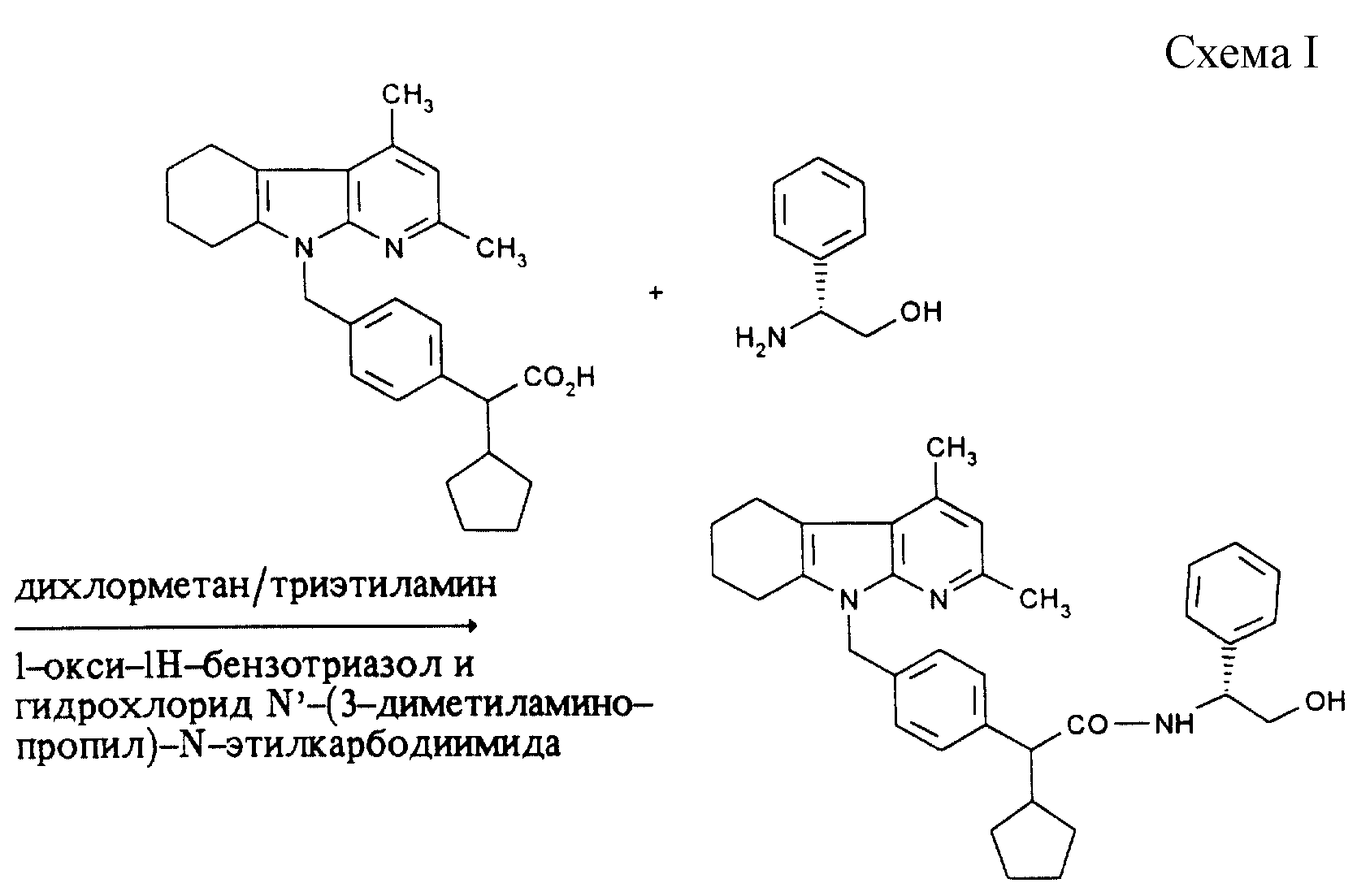
Получение предлагаемых соединений можно описать, например, с помощью следующей схемы I (см. в конце описания).
В качестве растворителя при амидировании пригодны инертные органические растворители, не изменяющиеся в условиях реакции. К ним относятся простые эфиры, как, например, простой диэтиловый эфир или тетрагидрофуран, галогенированные углеводороды, как, например, дихлорметан, трихлорметан, тетрахлорметан, 1,2-дихлор-этан, трихлорэтан, тетрахлорэтан, трихлорэтилен, углеводороды, как, например, бензол, ксилол, толуол, гексан, циклогексан, или нефтяные фракции, нитрометан, диметилформамид, ацетон, ацетонитрил и триамид гексаметилфосфорной кислоты. Кроме того, можно использовать смеси указанных растворителей. Особенно предпочтительными являются дихлорметан, тетрагидрофуран, ацетон или диметилформамид.
В качестве оснований пригодны неорганические или органические основания. Предпочтительными являются гидроокиси щелочных металлов, как, например, гидроокись натрия или калия, гидроокиси щелочноземельных металлов, как, например, гидроокись бария, карбонаты щелочных металлов как, например, карбонат натрия или калия, карбонаты щелочноземельных металлов, как, например, карбонат кальция, или алкоголяты щелочных или щелочноземельных металлов, как, например, метанолат или этанолат натрия или калия или трет.бутилат калия, органические амины (триалкиламины с 1 - 6 атомами углерода в каждой алкильной части), как, например, триэтиламин, или гетероциклы, как 1,4-диазабицикло[2.2.2]октан, 1,8-диазабицикло[5.4.0]-ундец-7-ен, пиридин, диаминопиридин, метилпиперидин или морфолин. Кроме того, в качестве оснований можно также использовать щелочные металлы, как, например, натрий, и их гидриды, как, например, гидрид натрия. Предпочтительными являются карбонаты натрия и калия и триэтиламин.
Основание используют в количестве 1 - 5 моль, предпочтительно 1 - 3 моль на моль соединения общей формулы (II).
Реакцию обычно осуществляют при температуре от 0 до 150oC, предпочтительно от +20 до +110oC, при атмосферном давлении или при повышенном или сниженном давлении, составляющем, например, 0,5 - 5 бар. Обычно работают при атмосферном давлении.
В случае необходимости амидирование можно осуществлять более интенсивным путем с использованием галоидангидридов кислот, которые можно получать из соответствующих кислот путем взаимодействия с тионилхлоридом, трихлоридом фосфора, пентахлоридом фосфора, трибромидом фосфора или оксалилхлоридом.
При необходимости вышеуказанные основания можно использовать также в качестве связывающих кислоту вспомогательных веществ при амидировании.
В качестве вспомогательных агентов пригодны также реагенты дегидратации. К ним относятся, например, карбодиимиды, как диизопропилкарбодиимид, дициклогексил-карбодиимид или гидрохлорид N-(3-димeтилaминoпpoпил)-N'-этилкapбoдиимидa, соединения карбонила, как, например, карбонилдиимидазол, 1,2-оксазолиевые соединения, как, например, 3-сульфонат 2-этил-5-фенил-1,2- оксазолия, ангидрид пропанфосфорной кислоты, изо-бутилхлороформат, гексил-фторфосфат бензотриазолил-окси-трис-(диметиламино)фосфония, амид сложного дифенилового эфира фосфоновой кислоты, хлорангидрид метансульфокислоты, в случае необходимости в присутствии основания, как, например, триэтиламина, N-этилморфолина, N-метилпиперидина или дициклогексилкарбодиимида и N- оксисукцинимида.
Связывающие кислоту агенты и агенты дегидратации обычно используют в количестве от 0,5-3 моль, предпочтительно 1 - 1,5 моль на моль соответствующей карбоновой кислоты.
Вариацию функциональных групп, например, путем гидролиза, этерификации или восстановления, а также разделение изомеров и получение солей осуществляют путем известных методов.
Карбоновые кислоты общей формулы (II)
являются новыми, так что они представляют собой дальнейший объект изобретения. Их можно получать путем взаимодействия соединения общей формулы (IV)
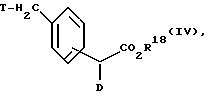
в которой D имеет вышеуказанные значения,
T - типичная отщепляемая группа, как, например, хлор, бром, йод, тозилат или мезилат, предпочтительно бром,
R18 - алкил с 1 - 4 атомами углерода, с соединением общей формулы (V)

в которой R1, R2, R3 и R4 имеют вышеуказанные значения,
в среде инертного растворителя, в случае необходимости в присутствии основания.
В качестве растворителя пригодны обычные органические растворители, не изменяющиеся в условиях реакции. Предпочтительными являются простые эфиры, как, например, простой диэтиловый эфир, диоксан, тетрагидрофуран, простой гликольдиметиловый эфир, углеводороды, как, например, бензол, ксилол, толуол, гексан, циклогексан, или нефтяные фракции, галогенированные углеводороды, как, например, дихлорметан, трихлорметан, тетрахлорметан, дихлорэтилен, трихлорэтилен или хлорбензол, сложный эфир уксусной кислоты, триэтиламин, пиридин, диметилсульфоксид, диметилформамид, триамид гексаметилфосфорной кислоты, ацетонитрил, ацетон или нитрометан. Кроме того, можно использовать смеси указанных растворителей. Особенно предпочтительными являются диметилформамид и тетрагидрофуран.
В качестве оснований пригодны неорганические или органические основания. Предпочтительными являются гидроокиси щелочных металлов, как, например, гидроокись натрия или калия, гидроокиси щелочноземельных металлов, как, например, гидроокись бария, карбонаты щелочных металлов, как, например, карбонат натрия или калия, карбонаты щелочноземельных металлов, как, например, карбонат кальция, или алкоголяты щелочных или щелочноземельных металлов, как, например, метанолат или этанолат натрия или калия или трет.бутилат калия, органические амины (триалкиламины с 1 - 6 атомами углерода в каждой алкильной части), как, например, триэтиламин, или гетероциклы, как 1,4-диазабицикло[2.2.2] октан, 1, 8- диазабицикло[5.4.0]-ундец-7-ен, пиридин, диаминопиридин, метилпиперидин или морфолин. Кроме того, в качестве оснований можно также использовать щелочные металлы, как, например, натрий, и их гидриды, как, например, гидрид натрия. Предпочтительными являются гидрид натрия, карбонат калия, триэтиламин, пиридин, трет. бутилат калия, 1,8-диазабицикло[5.4.0]ундец-7-ен и 1, 4- диазабицикло[2.2.2]октан.
Обычно основание применяют в количестве от 0,05 моль до 10 моль, предпочтительно от 1 моль до 2 моль на моль соединения общей формулы (IV).
Взаимодействие соединения общей формулы (IV) с соединением общей формулы (V) целесообразно осуществляют при температуре от -30 до +100oC, предпочтительно от -10 до +60oC, причем обычно работают при атмосферном давлении, хотя также возможно работать при повышенном или сниженном давлении, составляющем, например, 0,5 - 5 бар.
Соединения общей формулы (III) известны.
Соединения общих формул (VI) и (V) известны, или их можно получать аналогично известным методам.
Предлагаемые соединения общей формулы (I) обладают неожиданным диапазоном фармакологического действия.
Их можно использовать в качестве активных веществ в лекарствах для уменьшения изменений на стенках сосудов, а также для лечения коронарных сердечных заболеваний, недостаточности сердца, нарушений функций мозга, ишемических заболеваний головного мозга, апоплексии, нарушений местного кровообращения, нарушений микроциркуляции и тромбозов. При окклюзии сосудов решающую роль играет пролиферация гладких мышечных клеток. Предлагаемые соединения способны к торможению такой пролиферации и, таким образом, атеросклеротических процессов. Предлагаемые соединения отличаются способностью к снижению ассоциированных с аполипопротеином В-100 липопротеинов (липопротеинов очень низкой плотности и продуктов его разложения, например, липопротеина низкой плотности), аполипопротеинов В-100, триглицеридов и холестерина, то есть, они обладают ценными фармакологическими свойствами. Неожиданно действие предлагаемых соединений заключается прежде всего в снижении или полном ингибировании образования и/или высвобождения ассоциированных с аполипопротеином В-100 липопротеинов из печеночных клеток, что приводит к снижению уровня липопротеинов очень низкой плотности в плазме. Такое снижение уровня липопротеинов очень низкой плотности обязательно связано со снижением уровня аполипопротеина В-100, липопротеина низкой плотности, триглицеридов и холестерина, то есть, одновременно уменьшаются несколько из вышеприведенных факторов риска, способствующих изменениям стенок сосудов. Поэтому другим объектом изобретения является фармацевтическая композиция, ингибирующая высвобождение ассоциированных с аполипопротеином В- 100 липопротеинов, содержащая по меньшей мере один фармацевтически приемлемый носитель и по меньшей мере одно соединение вышеуказанной общей формулы (I) в виде смеси изомеров или отдельного изомера, в свободном виде или в виде фармацевтически приемлемой соли, в эффективном количестве.
Биологическое действие соединений общей формулы (I) доказывается в нижеследующих примерах.
1. Торможение высвобождения ассоциированных с аполипопротеином В-100 (АроВ-100)
липопротеинов
Опыт по торможению высвобождения ассоциированных с АроВ-100 липопротеинов из печеночных клеток осуществляли in vitro с использованием выращиваемых печеночных клеток,
предпочтительно клеток человеческой линии HepG2. Данные клетки выращивают в стандартных условиях в среде для культур эукариотных клеток, предпочтительно в среде RPMI 1640, содержащей 10% фетальной
телячей сыворотки. Клетки HepG2 синтетизуют и выделяют в надосадочную жидкость частицы ассоциированного с аполипопротеином В-100 липопротеина, имеющие в принципе похожую имеющимся в плазме частицам
липопротеида очень низкой плотности и липопротеида низкой плотности структуру. В случае человеческого липопротеина низкой плотности наличие этих частиц можно доказать с помощью иммунологического
анализа, который осуществляют с использованием антител против человеческого липопротеина низкой плотности, индуцированных в стандартных условиях в кролике. Антитела против липопротеина низкой
плотности (Kan-anti-LDL-Ak) очищали путем аффинной хроматографии на иммуносорбенте с использованием человеческого липопротеина низкой плотности. Очищенные Kan-anti- LDL-Ak адсорбируют к пластмассовой
поверхности. Целесообразно их адсорбируют к пластмассовой поверхности микротитровых пластинок, снабженных 96 углублениями, предпочтительно плиток типа MaxiSorp. Если в надосадочной жидкости клеток
Hep-G2 имеются ассоциированные с аполипопротеином В-100 частицы, то они могут связываться с Kan- anti/LDL-Ak, причем образуется иммунокомплекс, связанный с пластмассовой поверхностью. Не связанные
протеины удаляют путем промывки. Наличие связанного с
пластмассовой поверхностью иммунокомплекса доказывают с помощью моноклональных антител, индуцированных в стандартных условиях против
человеческого липопротеина низкой плотности с последующей очисткой. Данные антитела конъюгировали с ферментом перкосидаза. Последняя в присутствии перекиси водорода превращает бесцветный субстрат ТМВ
в окрашенный продукт. После подкисления реакционной смеси путем добавления серной кислоты определяют специфическое светопоглощение при 450 нм, представляющее собой меру количества ассоциированных с
аполипопротеином В-100 частиц, выделенных клетками HepG2 в надосадочную жидкость.
Неожиданно предлагаемые соединения тормозят высвобождение ассоциированных с аполипопротеином В-100 частиц. Величиной KT50 указывается концентрация соответствующего соединения, приводящая к 50%-ному снижению светопоглощения по сравнению с контролем (растворитель без активного вещества).
Соединение - KT50
примера N - [10-9 моль/л]
1 - 2,8
5 - 1,1
31 - 170
50 - 29
2. Определение
секреции липопротеинов очень низкой плотности in vivo на хомяке
Действие предлагаемых соединений на секрецию липопротеинов очень низкой плотности in vivo исследуют на хомяке. Для этого хомяки
после предварительной дачи атропина (83 мг/кг подкожно) наркотизуют путем дачи кетавета (83 мг/кг подкожно) и нембутала (50 мг/кг внутрибрюшинно). При отсутствии рефлексов у животных их открывают,
чтобы делать доступной яремную вену, в которую вводят канюлю. Затем дают 0,25 мл/кг 20%-ного раствора Triton WR-1339 в физиологическом растворе поваренной соли. Этот детергент ингибирует
липопротеинлипазу и, таким образом, приводит к повышению уровня триглицерида вследствие отсутствия катаболизма выделяемых частиц липопротеинов очень низкой плотности. Поэтому повышение уровня
триглицерида можно взять в качестве меры секреции липопротеинов очень низкой плотности. Перед дачей детергента и по истечении одного часа и двух часов после его дачи берут кровь путем пункции
ретроорбитального венозного сплетения. Кровь инкубируют в течение двух часов при комнатной температуре и при температуре 4oC в течение ночи для полного завершения свертывания. После этого
подвергают центрифугированию в течение 5 минут при 10000 g. С помощью модифицированного ферментного анализа, который можно приобретать в торговле (анализ Merckotest Trigly-ceride N 14354) определяют
концентрацию триглицерида в полученной таким образом сыворотке. Для этого к 100 мкл сыворотки в снабженных 96 углублениями плитках добавляют 100 мкл исследуемого соединения и инкубируют при комнатной
температуре в течение 10 минут. Затем в автоматическом считывающем устройстве (SLT - Spectra) определяют оптическую плотность при длине волн, составляющей 492 нм. Пробы сыворотки, содержащие
триглицерид в слишком высокой концентрации, разбавляют добавлением физиологического раствора поваренной соли. Концентрацию триглицерида в пробах определяют с помощью параллельно измеряемой стандартной
кривой. Исследуемые соединения в данном опыте дают или внутривенно непосредственно перед дачей детергента, или орально, или подкожно перед вводом анестезирующих средств.
Соединение
- ЭД50 [мг/кг]
примера N - орально
2 - 10 - 15
5 - 3 - 6
7 - 10 - 20
3. Торможение абсорбции триглицерида в кишке крыса in vivo
Соединения, подлежащие исследованию относительно их тормозящего абсорбцию триглицерида in vivo действия, дают орально мужским крысам породы Wistar весом тела 170 - 230 г. Для этого 18 часов перед
дачей соответствующего соединения животных разделяют на группы по 6 животных, и их больше не кормят, но питьевую воду предоставляют без ограничения. Животным контрольных групп дают водную трагантную
суспензию или трагантную суспензию, содержащую оливковое масло. Содержащую оливковое масло трагантную суспензию получают с использованием смесителя марки Ultra-Turrax. Подлежащие исследованию
соединения суспендируют непосредственно перед дачей в соответствующей содержащей оливковое масло трагантной суспензии, также с использованием смесителя Ultra-Turrax.
Перед дачей через желудочный зонд для определения содержания триглицерида в базальной сыворотке у каждой крысы берут кровь путем пункции ретроорбитального венозного сплетения. Затем содержащую трагант суспензию, трагантную суспензию без соединения (контроль) и соединения в суспендированном в содержащей оливковое масло трагантной суспензии виде дают животным натощак через желудочный зонд. Обычно далее берут кровь для определения повышения концентрации триглицерида в сыворотке после приема пищи час, два часа и три часа после дачи соединения через желудочный зонд.
Пробы крови подвергают центрифугированию, и после получения сыворотки концентрацию триглицеридов определяют путем фотометрии с использованием аппарата EPOS-Analyzer 5060 (фирма Eppendorf Geratebau, Netheler & Hinz GmbH/ г. Гамбург, DE). Определение триглицеридов осуществляют исключительно с применением ферментов путем стандартного ультрафиолетового анализа.
Данные по повышению триглицерида в сыворотке после приема пищи получают путем вычитания исходного количества триглицерида каждого животного от концентрации триглицерида после приема пищи (час, два часа и три часа после дачи исследуемого соединения).
Получают средние величины разностей (в ммоль/л) животных в каждой группе в каждый момент (час, два часа, три часа), и данные средние величины повышения уровня триглицерида в сыворотке (ΔTG) обработанных исследуемым соединением животных сравнивали с животными, которым дали лишь содержащую масло трагантную суспензию.
Определяют также содержание триглицерида в сыворотке животных, которым дали лишь трагант. Действие исследуемого соединения в каждый момент (по истечении часа, двух часов, трех часов) рассчитывают следующим образом, его выражают в Δ% нагруженной маслом контроли.

Действие 10 мг исследуемого соединения на кг веса тела при оральной даче на повышение триглицерида (Δ%) по истечении двух часов после нагрузки триглицеридом в сыворотке крыс, которые не ели. Повышение триглицерида в сыворотке контрольных животных, нагруженных маслом, в отношении уровня триглицерида в сыворотке контрольных животных, которым дали трагант, соответствует 100%. Каждая группа содержит 6 животных.
Повышение триглицерида в сыворотке в % по истечении 2 часов после дачи
Количество триглицерида - 100
Контроль (трагант) - 0
Исследуемое соединение в количестве 10
мг/кг веса тела, оральная дача
Пример 10 - 34
Пример 66 - 67
Пример 54 - 54
Пример 71 - 18
Пример 5 - -16
Пример 20 - 35
Для
статистической оценки используют Student's t-тест после предварительной проверки гомогенности исследуемых соединений.
Соединения, которые в один из моментов измерения снижают повышение триглицерида в сыворотке после приема пищи по меньшей мере на 30% по сравнению с контролем (p < 0,05), рассматривают как имеющие фармакологическое действие.
Новые производные циклоалкано-индола и -азаиндола общей формулы (I) можно также использовать вместе с ингибитором глюкозидазы и/или амилазы для терапии семейной гиперлипидемии, ожирения и сахарного диабета. Ингибиторы глюкозидазы и/или амилазы представляют собой, например, акарбазу, адипозин, воглибазу, миглитол, эмиглитат, фермент MDL-25637, камиглибазу (MDL-73945), тендаминстат, фермент AI-3688, трестатин, прадимилин-Q и сальбостатин.
Предпочтительной является комбинация акарбазы, миглитола, эмиглитата или воглибазы с одним из вышеприведенных соединений общей формулы (I).
Новые активные вещества можно известным образом переводить в обычные препараты, как, например, таблетки, драже, капсулы, пилюли, грануляты, аэрозоли, сиропы, эмульсии, суспензии или растворы, с использованием инертных, нетоксичных, фармацевтически приемлемых носителей или растворителей. При этом обладающее терапевтическое действие соединения имеется в концентрации примерно 0,5 -90% от веса общей смеси, то есть в количестве, обеспечивающем достижение указанных доз.
Препараты получают, например, путем добавления растворителей и/или носителей к активным веществам, в случае необходимости с использованием эмульгаторов и/или диспергаторов, причем, например, в случае использования воды в качестве разбавителя можно в случае необходимости использовать органический растворитель в качестве вспомогательного растворителя.
Препараты дают обычным методом, предпочтительно орально или парентерально, в частности чрезъязычно или внутривенно.
В случае парентеральной дачи можно использовать раствор активного вещества с применением пригодных жидких носителей.
В общем для достижения желаемого эффекта целесообразной оказалась дача активного вещества в количестве примерно 0,001 - 1 мг на кг веса тела, предпочтительно примерно 0,01 - 0,5 мг на кг веса тела, если его дают внутривенно, и в количестве примерно 0,01 -20 мг на кг веса тела, предпочтительно 0,1-10 мг на кг веса тела в случае оральной дачи.
Однако, может требоваться отклонение от указанных количеств в зависимости от веса тела или способа дачи активного вещества, от индивидуальной реакции на активное вещество, вида препарата и момента или промежутков дачи. Таким образом, в некоторых случаях может быть достаточным использовать меньше указанного минимального количества активного вещества, в то время как в других случаях необходимо будет дать больше указанного максимума. В случае дачи активного вещества в большем количестве может рекомендоваться дача нескольких отдельных доз, даваемых в течение суток.
В нижеследующих примерах для изомеров использованы следующие сокращения:
diaA = диастереомер с
более высоким значением Rf
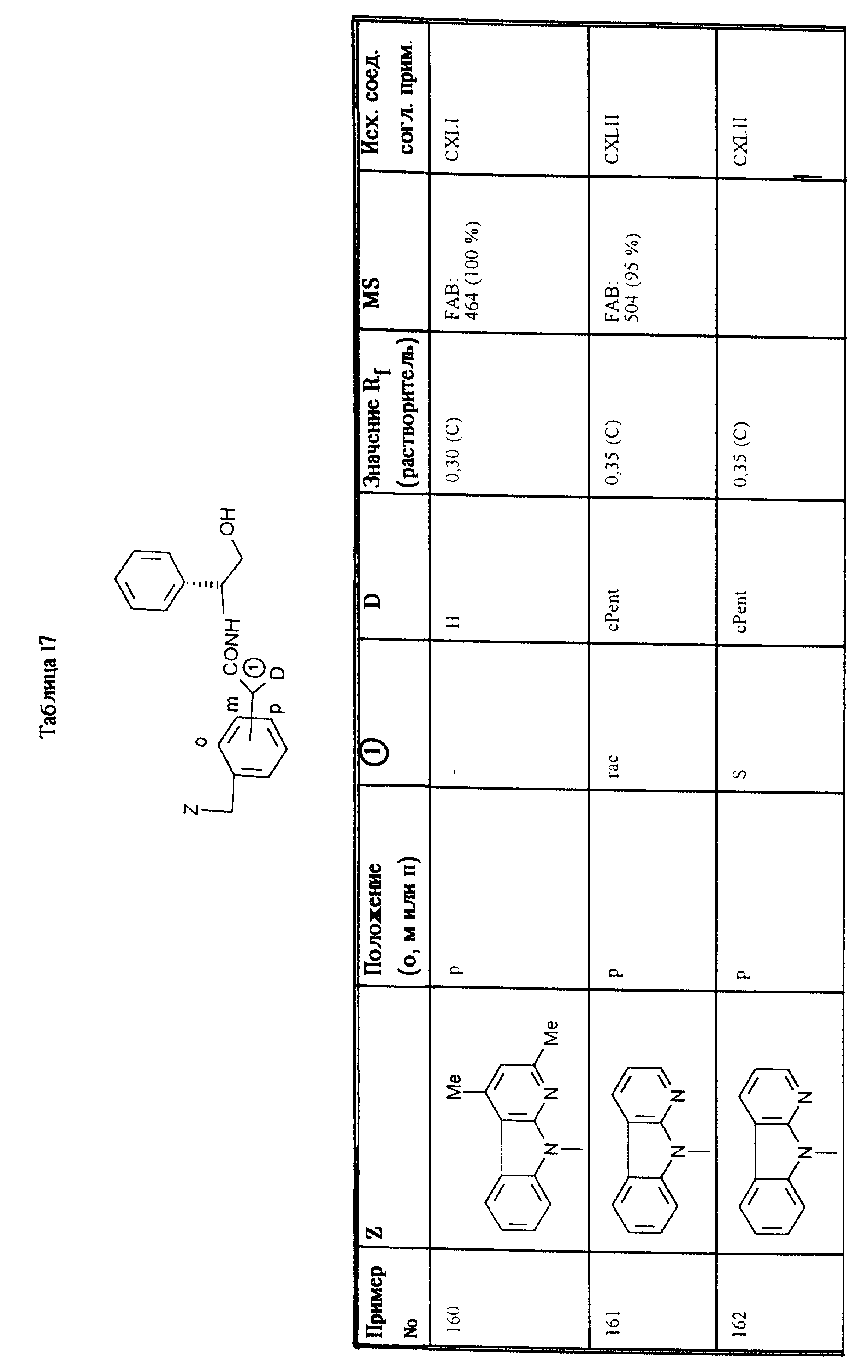
diaB = диастереомер с более низким значением Rf
ent = энантиомер
R = R-энантиомер
rac = рацемат
rac dia A
= рацемический диастереомер с более высоким значением Rf
rac dia В = рацемический диастереомер с более низким значением Rf
S = S-энантиомер
Кроме того,
использованы еще следующие сокращения:
Ac = ацетил
AcOH = уксусная кислота
iBu = изо-бутил
nBu = н-бутил
sBu = с-бутил
tBu = трет.бутил
Et = этил
cHept = циклогептил
cHex = циклогексил
Me = метил
cPent = циклопентил
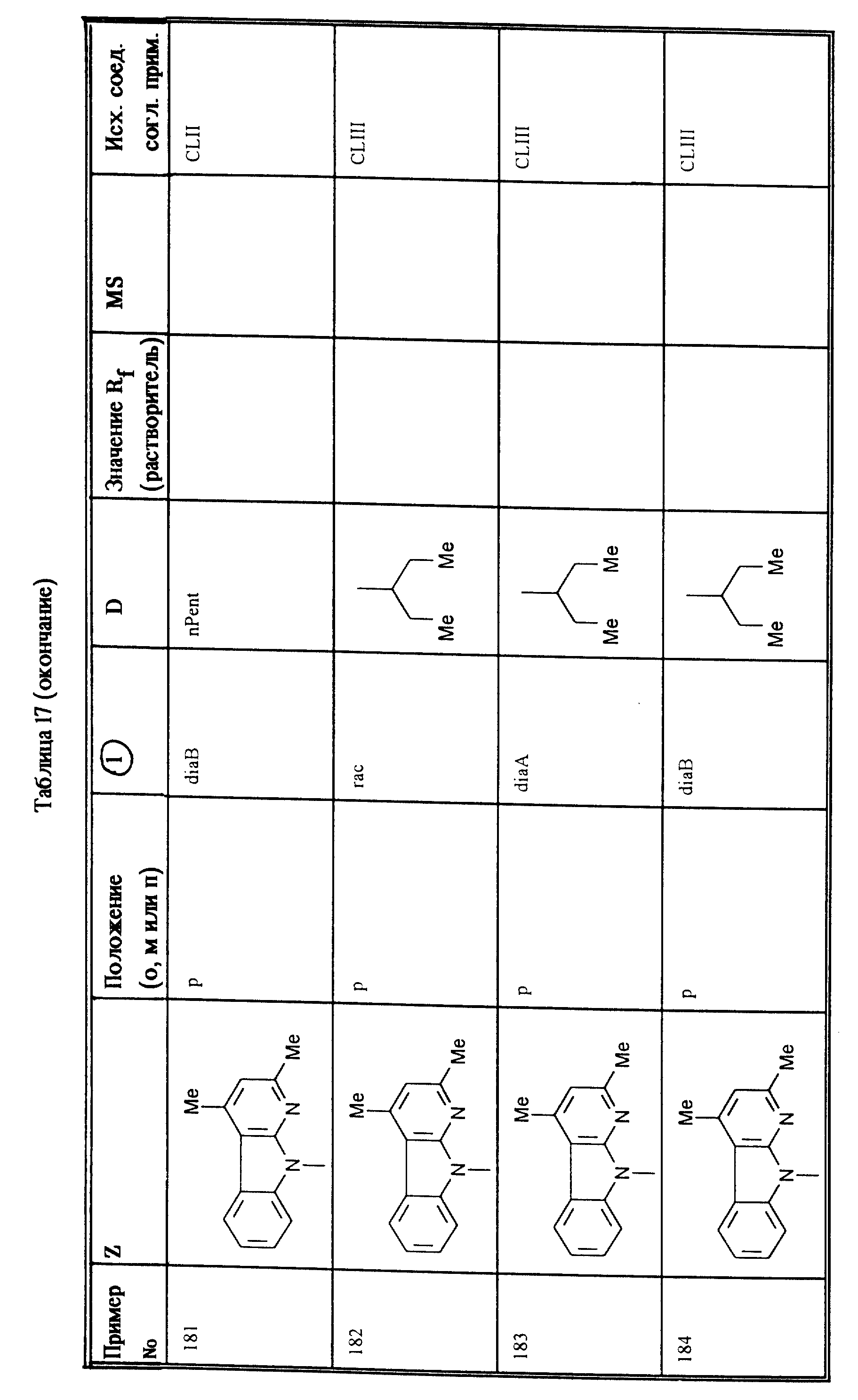
nPent = н-пентил
Ph = фенил
iPr = изопропил
TMS
= тетраметилсилан
EI = электронная ионизация
CI = ударная ионизация
MS = масс-спектр
FAB = бомбардировка быстрыми атомами
Fp = точка
плавления
В таблицах указаны следующие элюенты:
Растворитель - Обозначение
Дихлорметан и метанол 20:1 - A
Дихлорметан и метанол 50:1 - B
Дихлорметан и
этанол 20:1 - C
Дихлорметан и этанол 50:1 - D
Петролейный эфир и сложный этиловый эфир уксусной кислоты 1:1 - E
Дихлорметан, метанол и уксусная кислота 90:10:2 - F
Петролейный эфир и сложный этиловый эфир уксусной кислоты 2:1 - G
Петролейный эфир и сложный этиловый эфир уксусной кислоты 10:1 - H
Толуол - I
Толуол и сложный этиловый
эфир уксусной кислоты 1:1 - K
Петролейный эфир и сложный этиловый эфир уксусной кислоты 5:1 - L
Дихлорметан - M
Петролейный эфир и сложный этиловый эфир уксусной кислоты
20:1 - N
Дихлорметан и метанол 10:1 - O
Циклогексан и сложный этиловый эфир уксусной кислоты 1:1 - P
Толуол и сложный этиловый эфир уксусной кислоты 9:1 - Q
Толуол
и сложный этиловый эфир уксусной кислоты 8:1 - R
Петролейный эфир и сложный этиловый эфир уксусной кислоты 1:2 - S
Дихлорметан и этанол 5:1 - T
Дихлорметан и этанол 10:1
- U
Используемый для тонкослойной хроматографии элюент ВАВА получают следующим образом:
Смешивают 87,9 мл водного 0,06667-молярного раствора бифосфата калия и 12,1 мл водного 0,
06667-молярного раствора бифосфата динатрия. 60 мл полученного раствора встряхивают вместе с 200 мл н-бутилацетата, 36 мл н-бутанола и 100 мл ледяной уксусной кислоты, и водную фазу отделяют.
Органическая фаза представляет собой элюент ВАВА.
Исходные соединения
Пример I
1-аллилокси-2-хлорметил-бензол

К 11,5 г (70 ммоль) 1-аллилокси-2-оксиметил-6ензола в 110 мл дихлорметана при температуре 0oC добавляют 11,6 мл (84 ммоль) триэтиламина, после чего медленно подвергают взаимодействию с 5,4 мл (70 ммоль) хлорангидрида метансульфокислоты. По истечении 4 часов неоднократно экстрагируют водой, органическую фазу сушат над сульфатом магния и упаривают. Остаток растворителя удаляют в высоком вакууме.
Выход: 8,5 г
Значение Rf: 0,23 (из смеси дихлорметана и этанола в соотношении 20:1)
Пример II
(2-аллилокси-бензил)амин
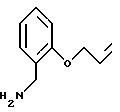
3,0 г (16,4 ммоль) полученного согласно примеру I соединения в 250 мл насыщенного метанольного раствора аммиака кипятят с обратным холодильником в течение 17 часов. Реакционную смесь упаривают в вакууме, подают в метанол и повторно упаривают; данные приемы повторяют несколько раз. Сырой продукт подают в дихлорметан и неоднократно экстрагируют водой. Водную фазу упаривают почти полностью, причем получают масло, которое кристаллизуется, когда его оставляют стоять. Выход: 0,454 г сырого продукта.
Продукт используют для дальнейшей реакции без очистки.
Значение Rf: 0,41
(элюент: ВАВА)
Пример III
6-хлор-2,4-лутидин
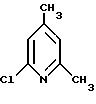
Для получения целевого соединения, известного из заявки США N 3632807, 600 r (4,91 моль) 6-амино-2,4-лутидина растворяют в 2 л метанола, и раствор при температуре примерно 0oC насыщают хлористоводородным газом. При температуре реакционной смеси ниже 10oC в течение примерно 2,5 часов каплями добавляют 1,307 л (9,82 моль) изопентилнитрита, и смесь оставляют стоять при нагревании до комнатной температуры (примерно 25oC) в течение 15 часов. Растворитель почти полностью удаляют в вакууме, добавляют 3 л дихлорметана и 1,5 л воды, и при охлаждении (< 20oC) добавлением концентрированного водного раствора аммиака доводят до значения pH, составляющего 9,5. Отделенную органическую фазу сушат над сульфатом натрия, сгущают в вакууме на ротационном испарителе и перегоняют на колонке Вигре.
Первая фракция:
Точка кипения: 47 - 49oC при 12 торр
Выход: 603 г
Вторая фракция:
Точка кипения: 82
- 85oC при 12 торр
Выход: 612 г (примерно 88% в сыром виде)
Значение Rf: 0,39 (из смеси петролейного эфира и сложного эфира уксусной кислоты в соотношении
10:1)
1H-ЯМР (CDCl3, 200 МГц, TMS): δ = 2,28 (с, 3H), 2,47 (с, 3H), 6,88 (с, 1H), 6,96 (с, 1H).
Сырой продукт, который может содержать небольшое количество 6-метокси-2,4-лутидина, без очистки используют для дальнейшей реакции.
Пример IV
6-гидразино-2,4-лутидин(4,6-диметил-2-гидразино- пиридин)
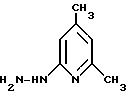
580 г (4,10 моль) полученного согласно примеру III соединения растворяют в 800 мл диэтиленгликоля, и вместе с 1050 мл гидрата гидразина размешивают при температуре ванны, составляющей примерно 140oC, в течение 48 часов. Охлажденную реакционную смесь выливают на 4,5 л простого эфира и 4,5 л воды, и органическую фазу дважды экстрагируют, каждый раз используя 2,3 л дихлорметана. Объединенные органические фазы сушат над сульфатом натрия и упаривают в вакууме. Получают 784 г сырого продукта, еще содержащего растворитель, который без очистки используют для дальнейшей реакции.
Значение Rf: примерно 0,37 (из смеси дихлорметана и метанола в соотношении 10:1)
1H-ЯМР (d6-ДМСО, 250 МГц, TMS): δ = 2,13 (с, 3H), 2,22 (с, 3H), 4,02 (с, 2H), 6,26 (с, 1H), 6,35 (с, 1H), 7,11 (с, 1H).
Пример V
2-гидразино-пиколин(2-гидразино-4-метилпиридин)
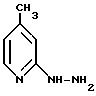
2-гидразино-4-пиколин получают из 2-хлор-4-пиколина аналогично методу согласно примеру IV.
Значение Rf: 0,06 (из смеси дихлорметана и метанола в соотношении 10:1)
Пример VI
2,4-диметил-5,6,
7,8-тетрагидро -α- карболин
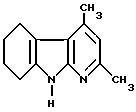
78 г (максимум 0,49 моль) сырого соединения, полученного согласно примеру IV, при комнатной температуре (примерно 25oC) подвергают взаимодействию с 59 мл (0,56 моль) циклогексанона, причем повышается температура реакционной смеси. По истечении 2 часов больше не имеется эдукта (контроль путем тонкослойной хроматографии с использованием смеси дихлорметана и метанола в соотношении 10:1). Реакционную смесь подают в 40 мл диэтиленгликоля, и реакцию осуществляют при температуре флегмы, причем путем перегонки на водоотделителе удаляют компоненты, точка кипения которых ниже точки кипения растворителя (например, реакционную воду и избыточный циклогексанон). По истечении 3 часов больше не имеется гидразона (контроль путем тонкослойной хроматографии с использованием смеси петролейного эфира и сложного эфира уксусной кислоты в соотношении 1:1). Реакционную смесь охлаждают до комнатной температуры, и при перемешивании добавляют ацетон. Образовавшийся осадок отсасывают, дополнительно промывают ацетоном и сушат в вакууме, причем получают 34,4 г продукта. Маточные растворы, почти не содержащие растворителя, повторно обрабатывают ацетоном, причем получают еще 9,3 г продукта (общий выход на трех стадиях: 43,7 г (0,22 моль, 47% теории).
Точка плавления: 248oC
Значение Rf: 0,41 (из смеси дихлорметана и метанола в соотношении 20:1)
1H-ЯМР (d6-ДМСО,
200 МГц, TMS): δ = 1,78 (м, 4H), 2,40 (с, 3H), 2,48 (с, 3H), 2,64 (м, 2H), 2,82 (м, 2H), 6,57 (с, 1H), 10,84 (с, 1H).
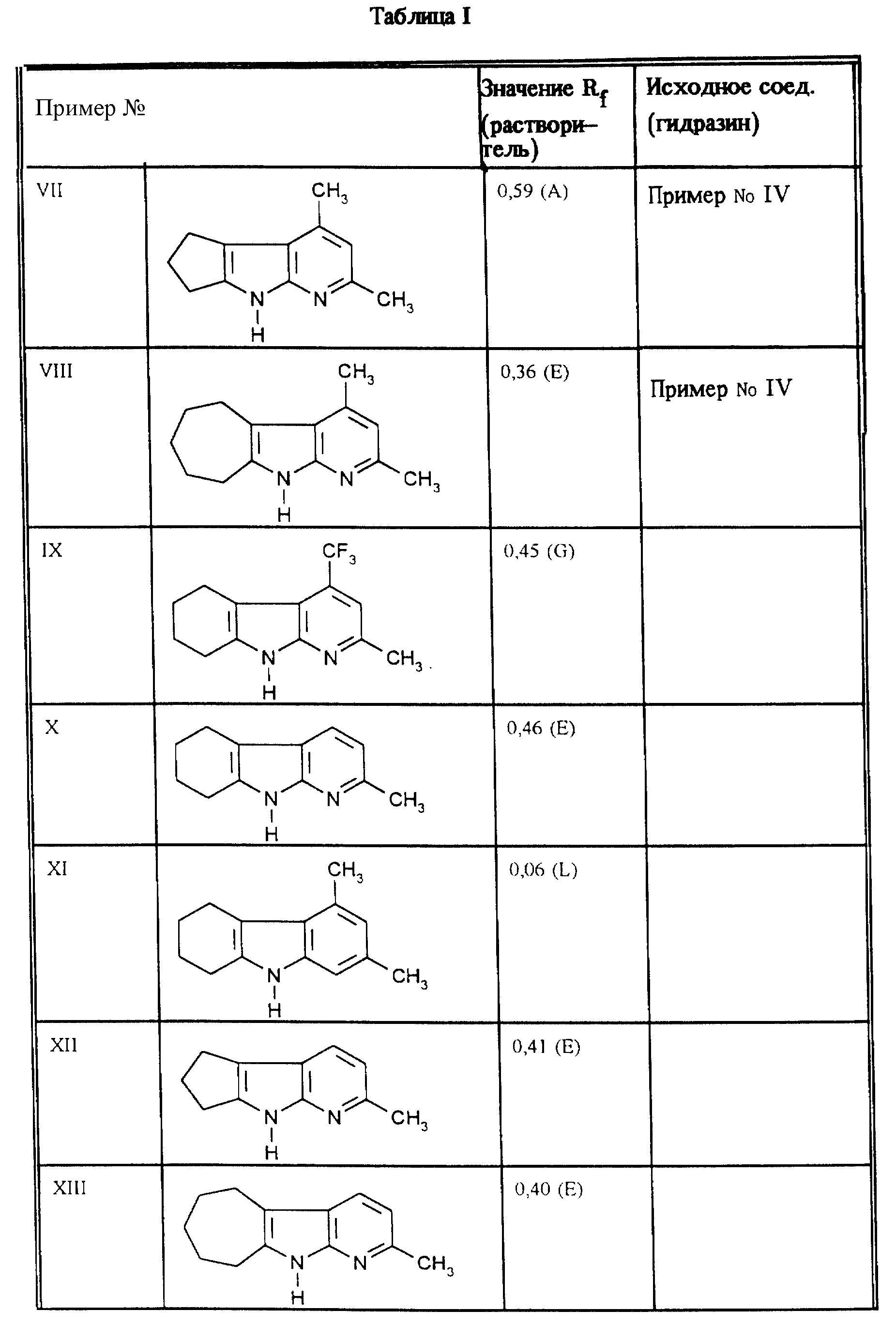
Приведенные в таблице I соединения получают путем метода, описанного в примере VI.
Пример XIX
2,4-диметил -α- карболин
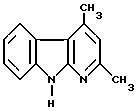
100 г (499 ммоль) полученного согласно примеру VI соединения в 700 мл диэтиленгликоля при температуре флегмы и в присутствии 52 г 5%-ного палладия на угле подвергают взаимодействию с 164 мл (1 моль) сложного диэтилового эфира фумаровой кислоты. При высокой температуре реакционной смеси путем перегонки отделяется небольшое количество этанола (в случае необходимости используют водоотделитель). По истечении примерно 8 часов больше не имеется эдукта (контроль путем тонкослойной хроматографии с использованием смеси петролейного эфира и сложного эфира уксусной кислоты в соотношении 1:1, детекция в камере с йодом). К охлажденной реакционной смеси добавляют 3 л ацетона, доводят до кипения, в горячем состоянии для осветления подают через фильтрпресс (фирма Seitz) и дополнительно промывают горячим ацетоном. При охлаждении образуется осадок, из которого в результате отсасывания, промывки холодным ацетоном и сушки в вакууме получают 58,3 г продукта. Из маточного раствора ацетон почти полностью удаляют в вакууме, причем образующийся осадок обрабатывают вышеописанным образом, причем получают еще 9,4 г продукта. Из фильтрата повторно удаляют ацетон, и после добавления н-пентана вновь получают продукт в качестве осадка (3,1 г, обработка см. выше); общий выход: 72% теории.
Точка плавления: 220 - 221oC
Значение Rа: 0,47 (из смеси петролейного
эфира и сложного эфира уксусной кислоты в соотношении 1:1)
1H-ЯМР (d6-ДМСО, 200 МГц, TMS): δ = 2,54 (с, 3H), 2,75 (с, 3H), 6,89 (с, 1H), 7,20 (м, 1H), 7,40 (м, 1H),
7,48 (дд, 1H), 8,05 (дд, 1H), 11,61 (с, 1H).
Пример XX
Сложный трет.бутиловый эфир 4-метилфенил-уксусной кислоты
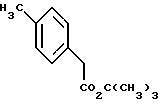
450 г (3 моль) 4-метилфенил-уксусной кислоты (фирма Aldrich), 1,13 л (12 моль) трет. бутанола и 90 г (0,74 моль) 4-(N,N-диметиламино) пиридина растворяют в 2 л дихлорметана. Добавляют 680 г (3,3 моль) дициклогексилкарбодиимида, растворенного в 400 мл дихлорметана, затем размешивают при температуре 25oC в течение 20 часов, выпавшую мочевину отсасывают, промывают с использованием 200 мл дихлорметана, и органическую фазу промывают два раза с использованием 500 мл 2 М соляной кислоты и два раза водой. После этого органическую фазу сгущают и подвергают перегонке.
Выход: 408 г (66% теории)
Точка плавления: 73 - 78oC/0,2 мм
Пример XXI
Трет.бутиловый эфир
2-циклопентил-2-(4-метилфенил)уксусной кислоты

33,5 г (0,3 моль) трет.бутилата калия при температуре 0oC подают в 100 мл безводного диметилформамида, и каплями добавляют 51,6 г (0,25 моль) соединения, полученного согласно примеру XX, в 250 мл безводного диметилформамида. Размешивают при температуре 0oC в течение 30 минут, затем при температуре 5 - 15oC каплями добавляют 32,2 мл (0,3 моль) циклопентилбромида в 150 мл безводного диметилформамида и размешивают при температуре 25oC в течение 20 часов. Сгущают, остаток распределяют между водой и простым диэтиловым эфиром, эфирную фазу сушат над сульфатом натрия и сгущают. Продукт кристаллизуется.
Выход: 67 г (97,5% теории)
Точка плавления: 51 - 53oC
Приведенные в таблице II соединения получают согласно методу аналогично примеру
XXI.
Пример XXVIII
Сложный трет.бутиловый эфир 2-(4-бромметил-фенил)-2-циклопентил- уксусной кислоты

27,4 г (0,1 моль) соединения примера XXI растворяют в 200 мл тетрахлорметана и нагревают до кипения. Добавляют 0,82 г азабисизобутиронитрила, а затем порциями добавляют 18,7 г (0,105 моль) N-бромсукцинимида, после чего нагревают с обратным холодильником в течение часа, охлаждают до температуры 0oC, и сукцинимид отделяют путем фильтрации. После сгущения фильтрата продукт выпадает. Его промывают петролейным эфиром и сушат.
Выход: 20 г (57% теории)
Точка плавления: 73 - 76oC
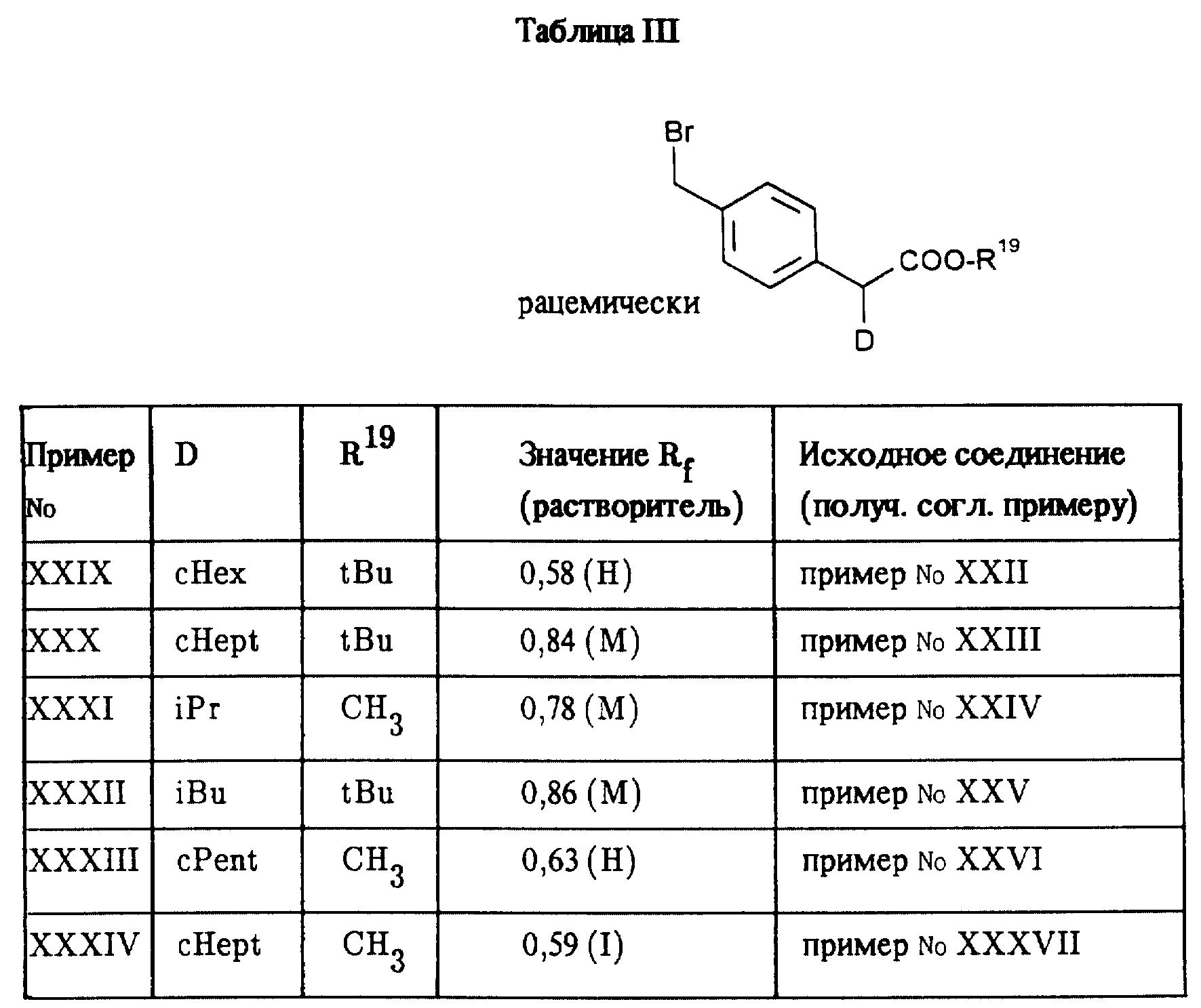
Приведенные в таблице
III соединения получают согласно методу аналогично примеру XXVIII.
Пример XXXV
Сложный трет. бутиловый эфир 2-(R, S)-2-циклопентил-2- [4-(2,3-диметил-α-карболин-9-ил)
метил] фенилуксусной кислоты
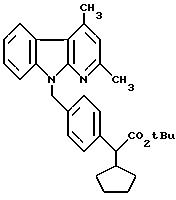
73,6 г (375 ммоль) полученного согласно примеру XIX соединения в 700 мл безводного N, N-диметилформамида подвергают взаимодействию с 42,13 г (375 ммоль) трет.бутанолата калия при температуре 25oC в течение 30 минут. Затем добавляют 161,7 г (375 ммоль) соединения, полученного согласно примеру XXVIII, в растворенном в 680 мл безводного N,N-диметилформамида виде. Взаимодействие завершено по истечении часа (контроль путем тонкослойной хроматографии с использованием смеси петролейного эфира и сложного эфира уксусной кислоты в соотношении 10:1). Для переработки добавляют 2 л буферного раствора (значение pH 4, фирма Merck) и 2 л воды, образовавшийся осадок отсасывают, промывают водой и повторно отсасывают. Немного мокрое твердое вещество последовательно размешивают с петролейным эфиром и метанолом и отсасывают. В результате сушки в вакууме над полупятиокисью фосфора получают 139,8 г (298 ммоль, 79% теории) целевого продукта.
Точка плавления: 160 - 161oC
Значение Rf: 0,39 (из смеси петролейного
эфира и сложного эфира уксусной кислоты в соотношении 10:1)
1H-ЯМР (CDCl3, 250 МГц, TMS): δ = 0,91 (м, 1H), 1,18 - 1,68 (м, 6H), 1,87 (м, 1H), 1,47 (с, 9H), 2,42
(м, 1H), 2,66 (с, 3H), 2,83 (с, 3H), 3,09 (д, 1H), 5,67 (с, 2H), 6,88 (с, 1H), 7,13 - 7,41 (м, 7H), 8,08 (д, 1H).
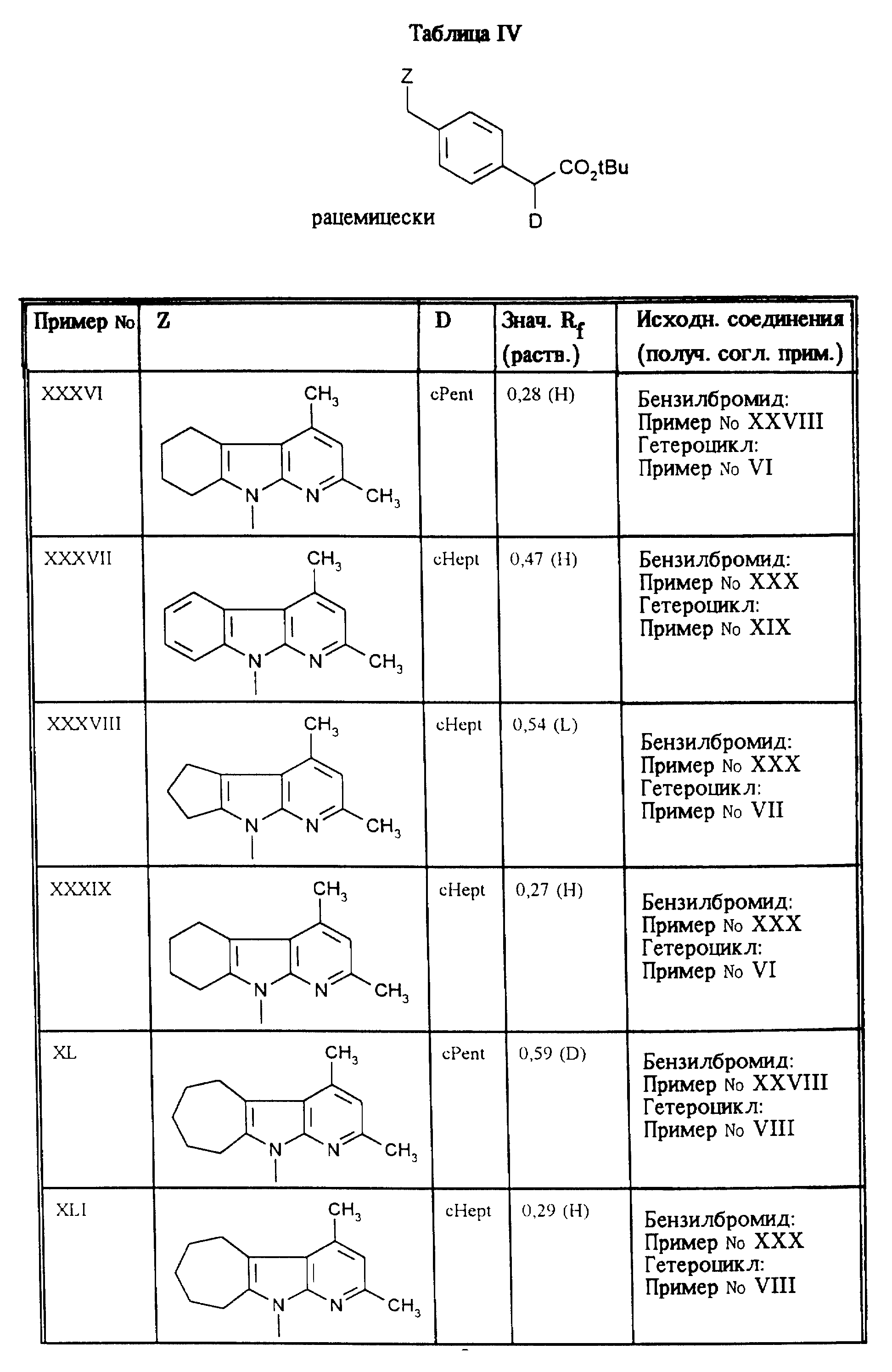
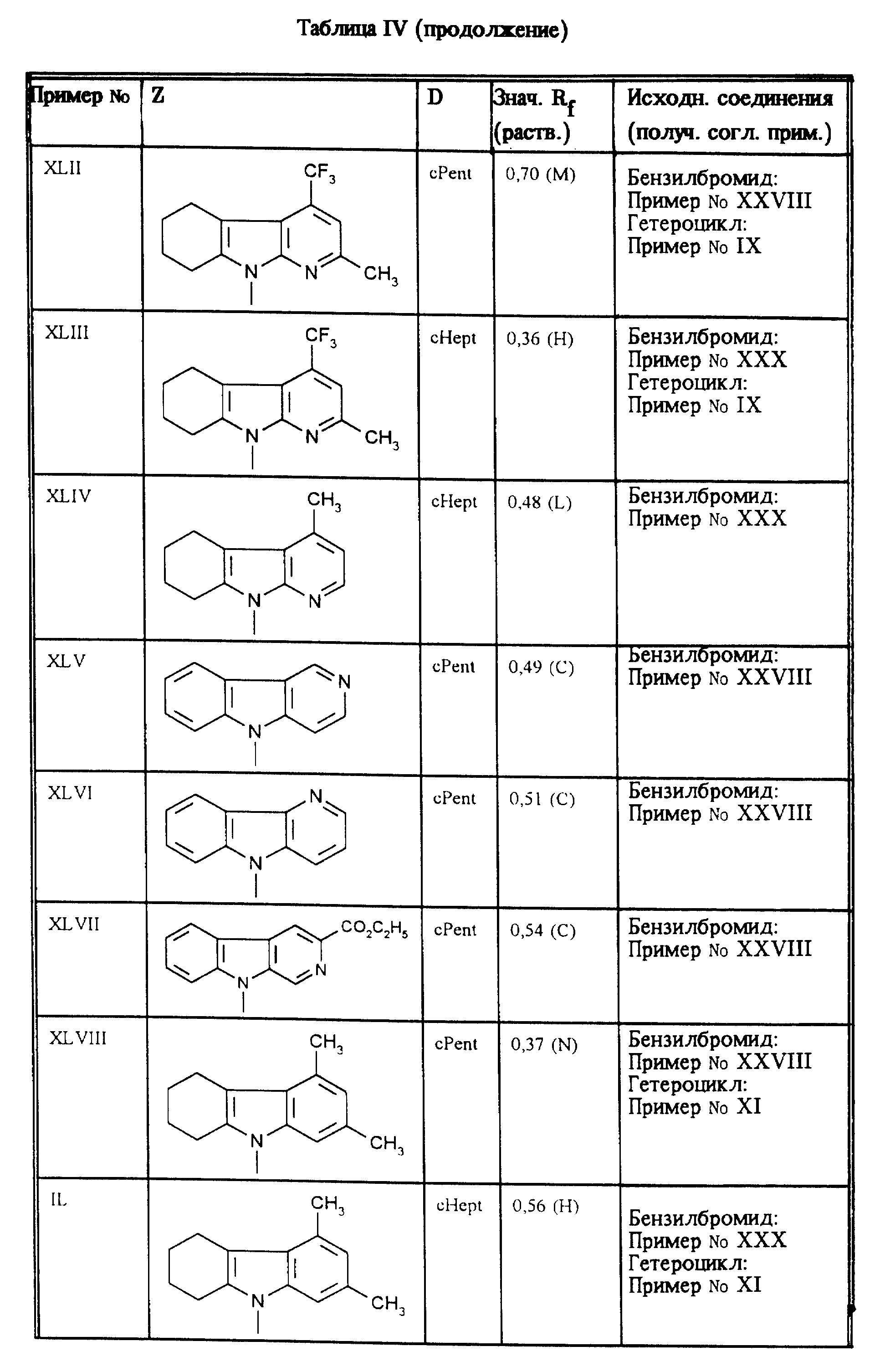
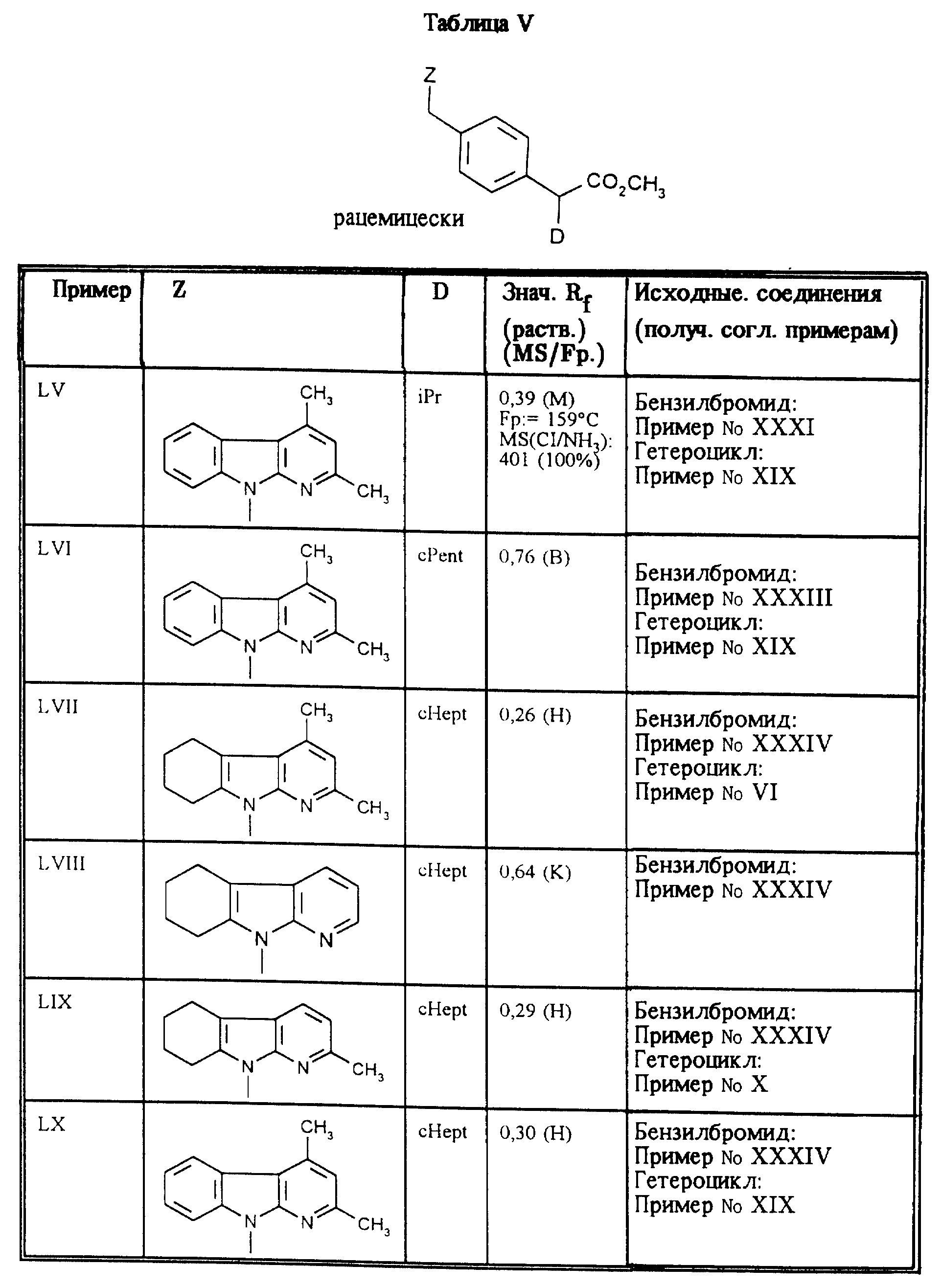
Приведенные в таблицах IV и V соединения получают по методу согласно примеру XXXV.
Пример LXI
Гидрохлорид 2-(R,S)-2-циклопентил-2-[4-(2,4-диметил -α- карболин-9-ил)- метил]-фенилуксусной кислоты

139,8 г (298 ммоль) соединения, полученного согласно примеру XXXV, растворяют в 1 л 1,4-диоксана и вместе с 240 мл концентрированной (37%-ной) соляной кислоты размешивают при температуре 70oC в течение 3 часов. По окончании взаимодействия (контроль путем тонкослойной хроматографии с использованием смеси петролейного эфира и сложного эфира уксусной кислоты в соотношении 10: 1) реакционную смесь охлаждают примерно до 15oC, после чего порциями выливают на 5 л воды. Значение pH доводят до 2,8 путем добавления 2 М водного натрового щелока, осадок отсасывают через бумажный фильтр и дополнительно промывают водой, пока значение pH промывной воды не превышает 4. Твердое вещество отсасывают, размешивают с 1 л петролейного эфира (пределы кипения 60 - 80oC), повторно отсасывают и сушат в вакууме над полупятиокисью фосфора.
Выход: 130,3 г (290 ммоль, 97% теории)
Точка плавления: 260 - 262oC
Значение Rf: 0,51 (из смеси дихлорметана и этанола в соотношении 20:1)
1H-ЯМР (d6-ДМСО, 200 МГц, TMS):
δ = 0,88 (м, 1H), 1,09 - 1,67 (м, 6H), 1,79 (м, 1H), 2,38 (м, 1H), 2,68 (с, 3H), 2,84 (с, 3H), 3,16 (д, 1H), 4,7 - 5,9 (1H), 5,80 (с, 2H), 7,12-7,26 (м, 5H), 7,32 (м, 1H), 7,49 (м, 1H), 7,59 (д,
1H), 8,17 (д, 1H).
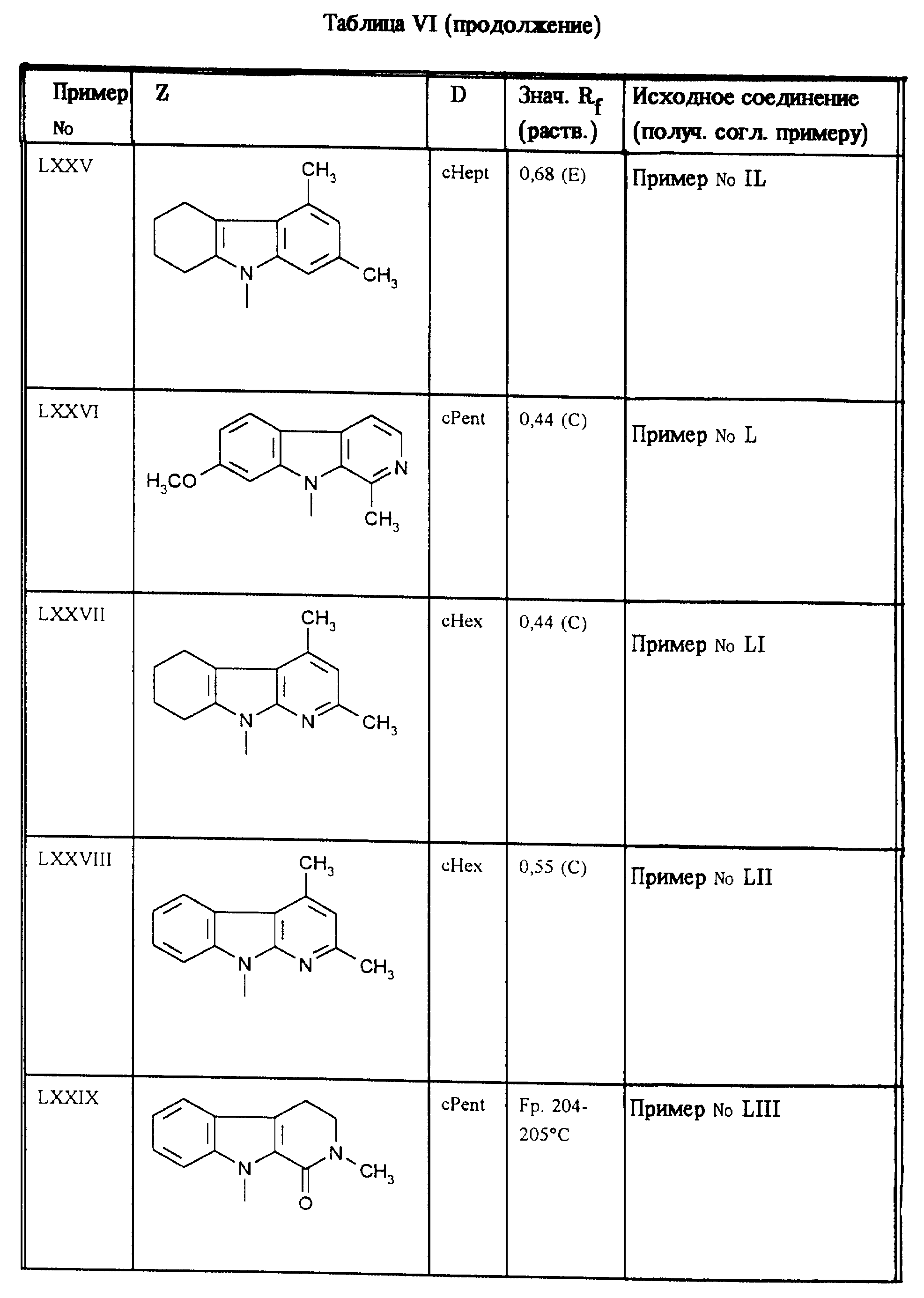
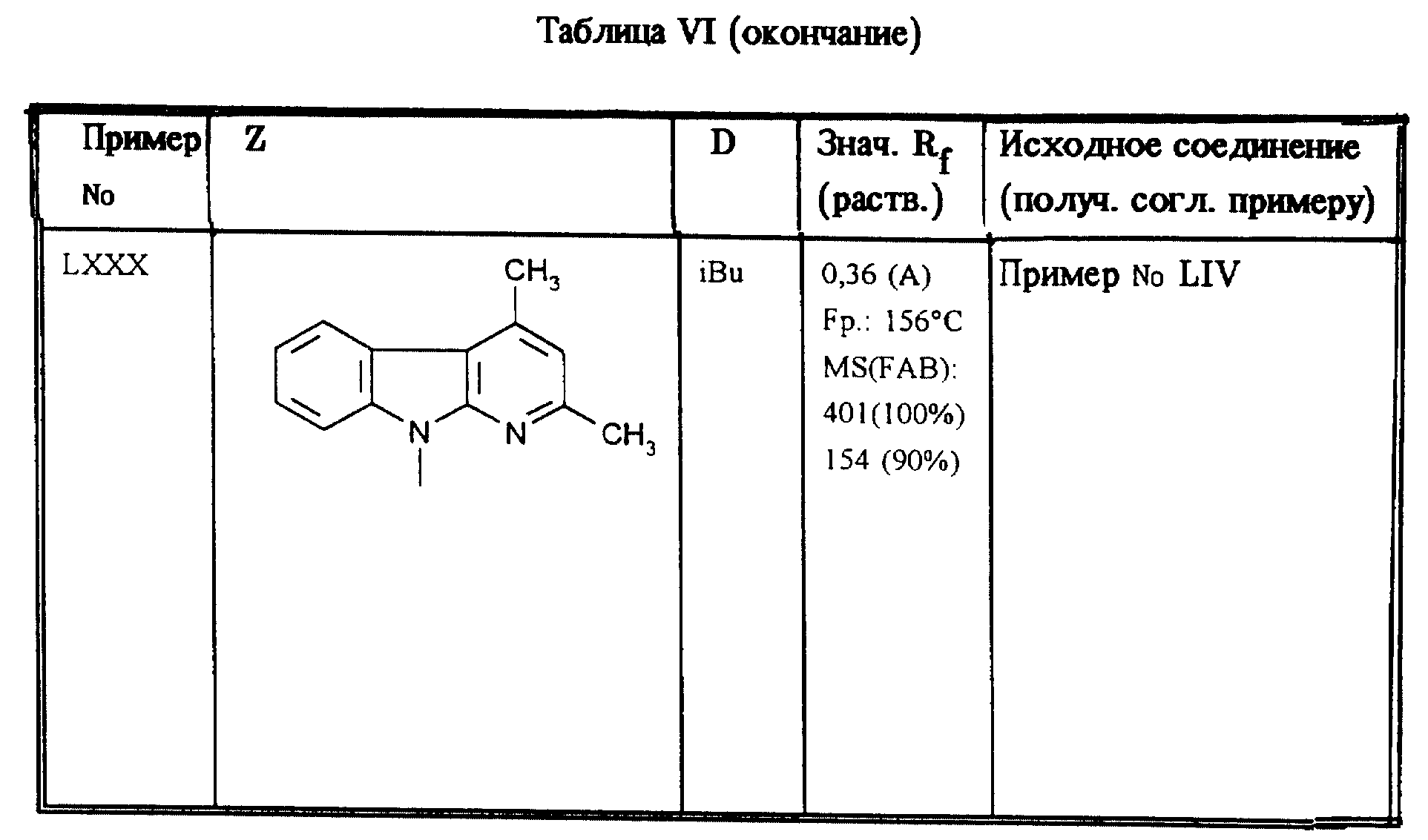
Приведенные в таблице VI соединения получают по методу согласно примеру LXI.
Пример LXXXI
2-(R,S)-2-[4-(2-мeтил-5,6,7,8-тeтpaгидpо -α
- кapбoлин-9-ил)-метил-фенил] -2-циклогептил-уксусная кислота

1,5 г (3,37 ммоль) соединения, полученного согласно примеру LIX, в течение 48 часов подвергают взаимодействию с 20 мл 1 М метанольного натрового щелока. Затем добавляют воду, и метанол упаривают. Щелочную водную фазу неоднократно экстрагируют простым эфиром, остатки органического растворителя удаляют в вакууме, и при температуре 0 - 5oC доводят до значения pH, равного примерно 2, путем добавления водной 1 М соляной кислоты. Выпавший осадок отсасывают, тщательно промывают водой и сушат в высоком вакууме над полупятиокисью фосфора.
Выход: 1,18 г Реакцию можно ускорить путем использования гидроокиси калия вместо гидроокиси натрия и добавления 1,4,7,10,13,16-гексаоксациклооктадекана.
Значение Rf: 0,39 (из смеси петролейного эфира и сложного этилового эфира уксусной
кислоты в соотношении 2:1)
Приведенные в таблице VII соединения получают по методу согласно примеру LXXXI.
Соединение согласно примеру LXXXII можно также получать по
следующему методу:
2-[4-(2,4-диметил -α- карболин-9-ил)-метил-фенил] -2-(проп-2-ил)- уксусная кислота
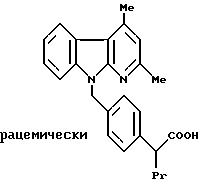
1,11 г (2,77 ммоль) соединения, полученного согласно примеру LV, в течение 18 часов кипятят с обратным холодильником вместе с 45 мл метанола и 3 мл 2 М водного натрового щелока. Так как согласно результатам тонкослойной хроматографии (смесь дихлорметана и метанола в соотношении 20:1) конверсия является неполной, добавляют 30 мл тетрагидрофурана и еще 3 мл 2 М водного натрового щелока, причем получают прозрачный раствор. Кипятят с обратным холодильником в течение 4 часов, после чего согласно тонкослойной хроматографии (см. выше) взаимодействие завершено. Реакционную смесь охлаждают, разбавляют водой и нейтрализуют добавлением 2 М водяной соляной кислоты. Осадок отсасывают, промывают водой и сушат в вакууме над полупятиокисью фосфора.
Выход: 0,597 г
Точка плавления: 225oC
Значение Rf: 0,28 (из смеси дихлорметана и метанола в соотношении 20:1)
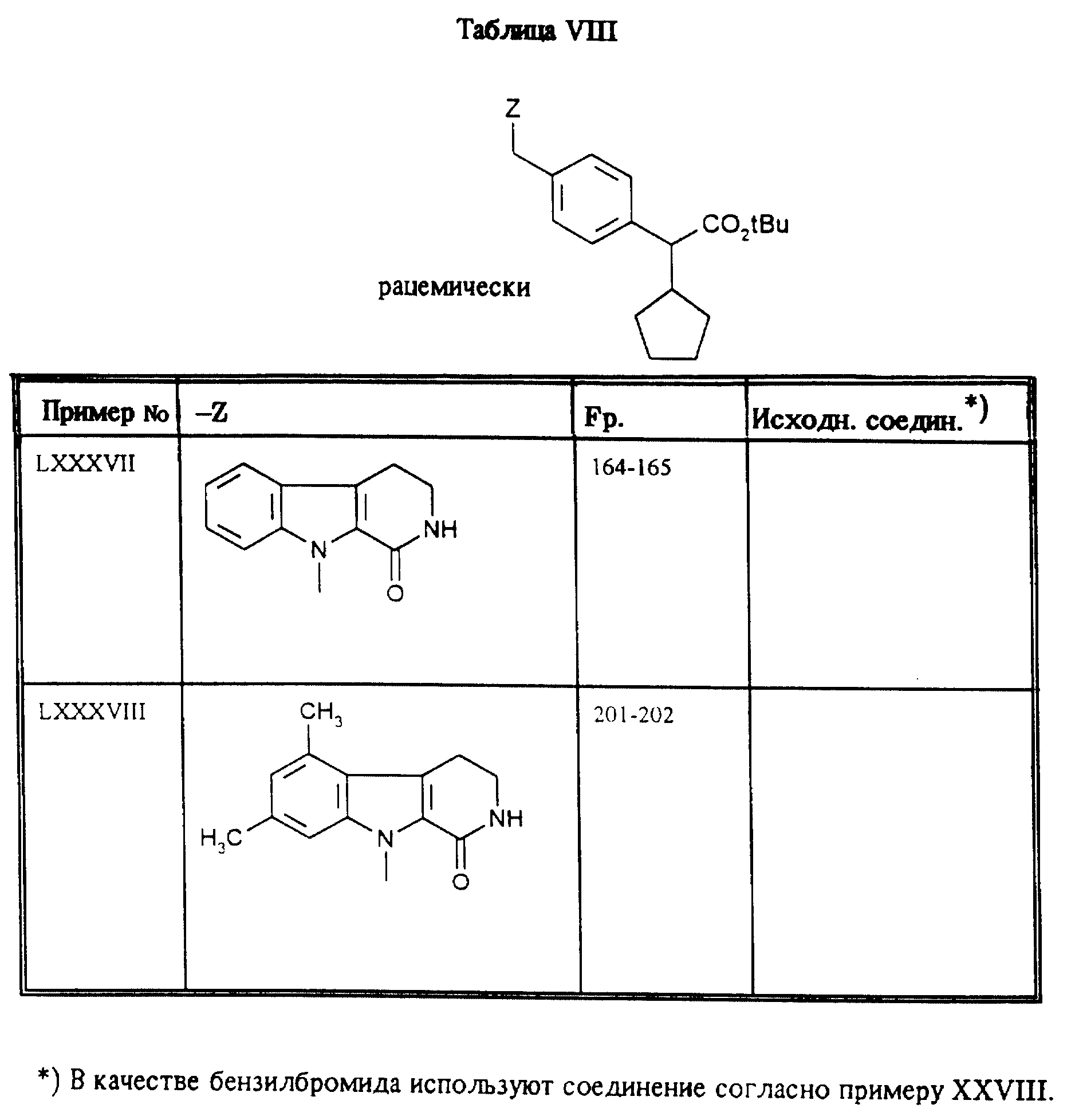
Приведенные в таблице VIII соединения
получают по методу согласно примеру XXXV.
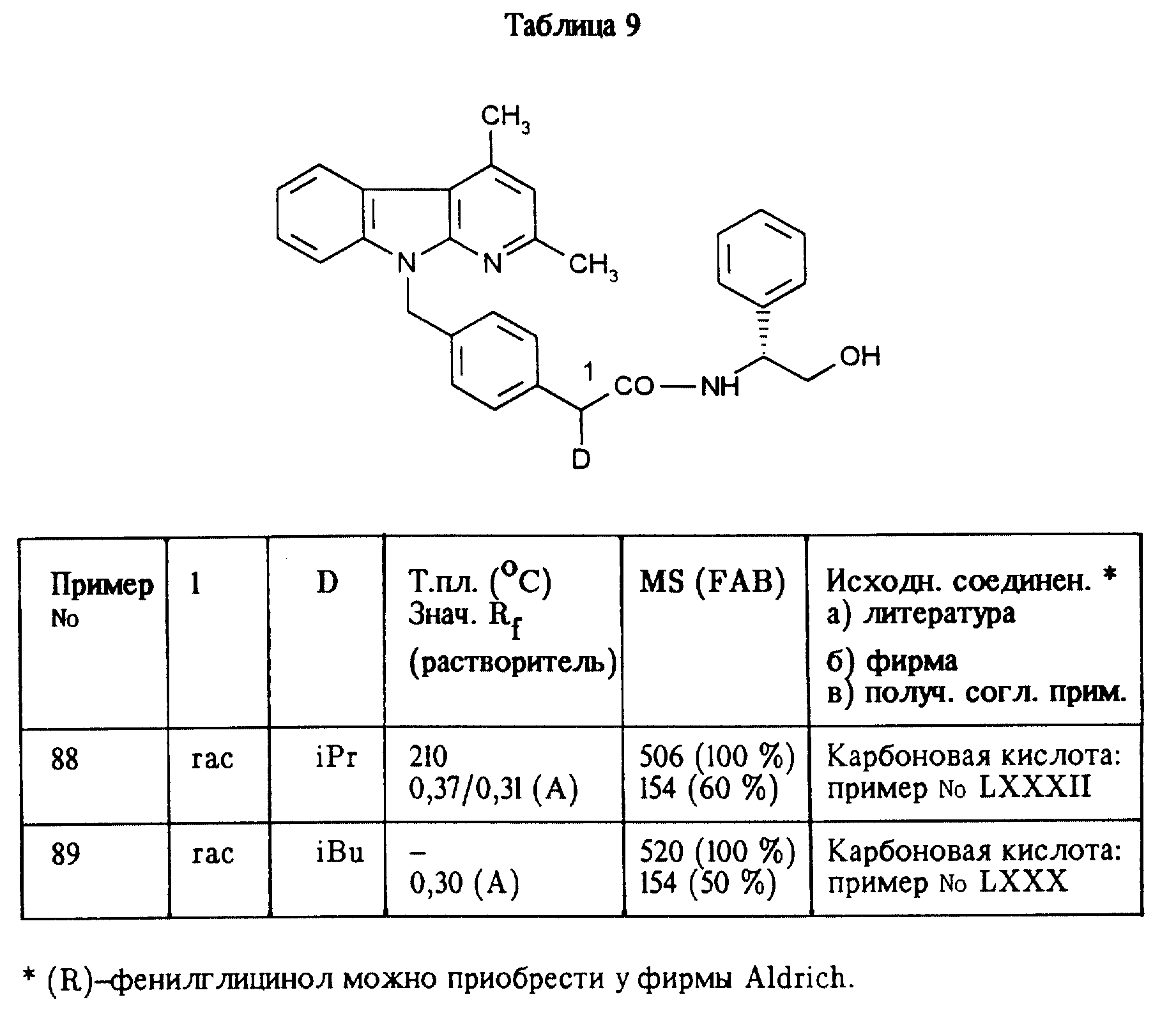
Приведенные в таблице IX соединения получают по методу согласно примеру LXI.
Пример XCI
2-гидразино-5-трифторметилпиридин

2-гидразино-5-трифторметилпиридин получают аналогично примеру IV из 2-хлор-5-трифторметилпиридина.
Значение Rf: 0,37 (ВАВА)
Пример XCII
5-оксо-5,6,7,8-тетрагидро -α- карболин
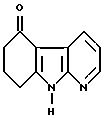
3,3 г (19,2 ммоль) 5,6,7,8-тетрагидро -α- карболина (см. S. Okuda и М. М. Robinson, J. Am. Chem. Soc. 81, стр. 740, 1959 г.) при температуре 0oC при размешивании подают в 43 мл тетрагидрофурана, и каплями добавляют раствор 15,5 г (68,2 ммоль) 2,3-дихлор-5,6-дициано-1,4-бензохинона в 277 мл тетрагидрофурана и 31 мл воды. Реакционную смесь дополнительно размешивают при температуре 0oC в течение 5 минут и при температуре 20oC в течение 2 часов, затем добавляют буфер со значением pH, равным 10 (фирма Merck), и экстрагируют простым диэтиловым эфиром. В результате упаривания органической фазы получают сырой продукт, который очищают путем хроматографии на силикагеле 60 (фирма Merck), причем в качестве элюента используют сперва смесь петролейного эфира и сложного этилового эфира уксусной кислоты в соотношении 1: 1, а затем смесь дихлорметана и метанола в соотношении 20:1. Полученные таким образом фракции размешивают с ацетоном, отсасывают, и растворитель удаляют в вакууме.
Выход: 0,92 г
Значение Rf: 0,17 (смесь
петролейного эфира и сложного этилового эфира уксусной кислоты в соотношении 1:4)
Приведенные в таблице X соединения получают по методу согласно примеру VI.
Приведенные в таблице XI соединения получают по методу согласно примеру XIX.
Приведенные в таблице XII соединения получают аналогично примеру XXXV.
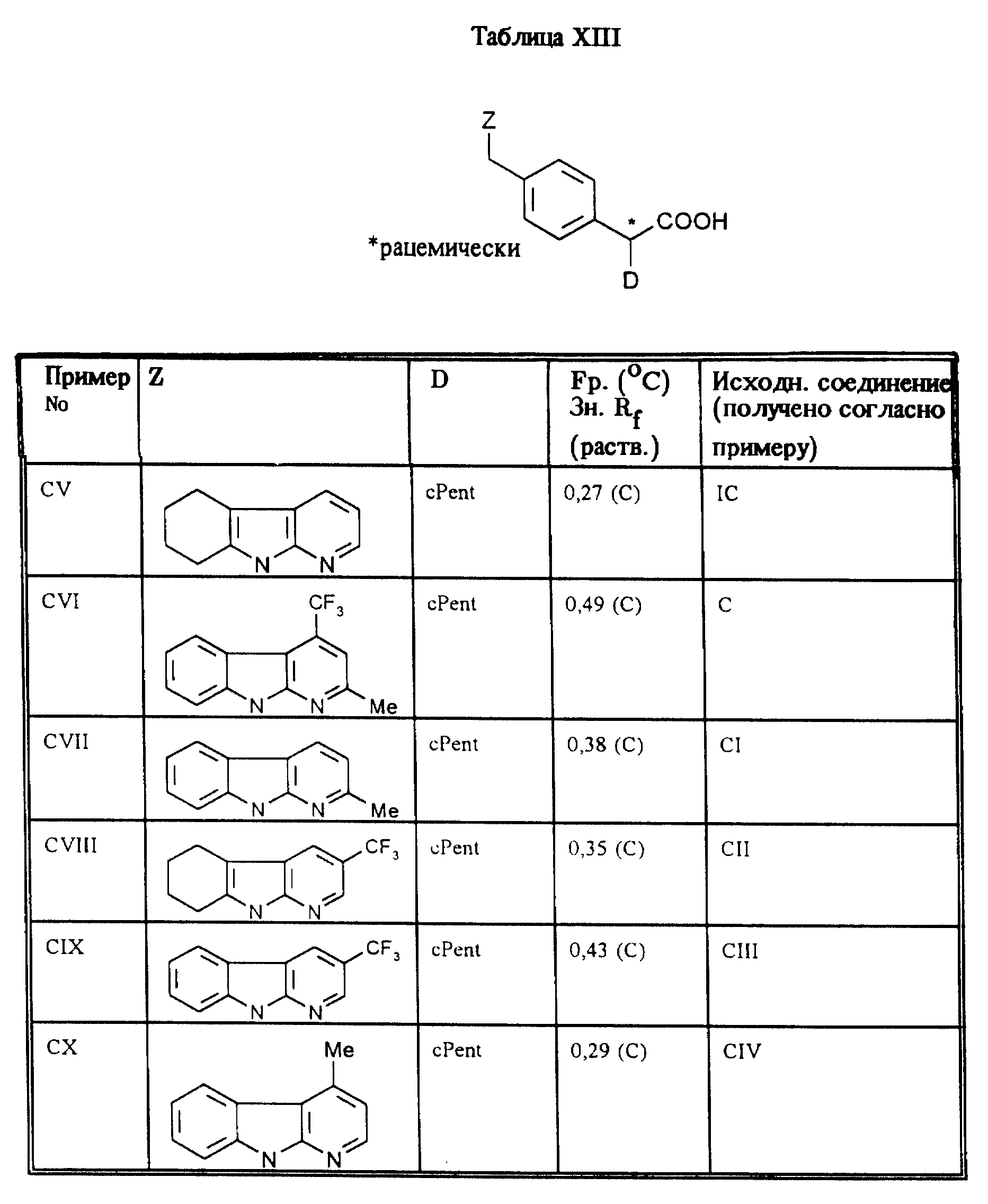
Приведенные в таблице XIII соединения получают по методу согласно примеру LXI.
Пример CXI
1-(R,S)-1-фенил-2-трифенилметилокси-этанол

13 г (94 ммоль) 1-(R, S)-1-фенил-2-окси-этанола при температуре 20oC подвергают взаимодействию с 15,6 мл (113 ммоль) триэтиламина и 23,6 г (84,6 ммоль) трифенил-метилхлорида в 200 мл диметилформамида. По истечении 20 часов выливают на буфер, имеющий значение pH 4 (фирма Merck), фазы разделяют, органическую фазу сушат над сульфатом магния и упаривают досуха. Сырой продукт очищают путем хроматографии на силикагеле 60 (фирма Merck) с использованием в качестве элюента смеси петролейного эфира и сложного этилового эфира уксусной кислоты в соотношении сперва 20:1, а затем 10:1.
Выход: 27 г.
Значение Rf: 0,36 (из смеси петролейного эфира и сложного этилового эфира уксусной кислоты в соотношении
5:1)
Пример CXII
6-хлор-5-метил-3-нитро-2-(2-оксо-циклогексил)-пиридин

20 г (95,7 ммоль) 2,6-дихлор-5-метил-3-нитро-пиридина в атмосфере аргона в качестве защитного газа при температуре 20oC в среде 200 мл диметилформамида подвергают взаимодействию с 13,3 мл (95,7 ммоль) триэтиламина и 14,5 г (95,7 ммоль) свежедистиллированного 1- пирролидино-циклопентена. По полной конверсии исходных соединений (контроль путем тонкослойной хроматографии на силикагеле с использованием в качестве элюента смеси петролейного эфира и сложного этилового эфира уксусной кислоты в соотношении 4:1) добавляют 200 мл 1 М соляной кислоты, и разбавляют добавлением примерно 600 мл воды. Выпавший осадок отсасывают, сушат в высоком вакууме над полупятиокисью фосфора и очищают путем хроматографии на силикагеле 60 (фирма Merck) с использованием в качестве элюента смеси петролейного эфира и сложного этилового эфира уксусной кислоты в соотношении 2:1.
Значение Rf: 0,69 (из смеси петролейного эфира и сложного этилового эфира уксусной кислоты
в соотношении 4:1)
Пример CXIII
2-метил-5,6,7,8-тетрагидро -δ- карболин

2,8 г (10,4 ммоль) соединения, полученного согласно примеру CXII, подвергают реакции при водородном давлении 3 бар в течение 18 часов в среде 30 мл тетрагидрофурана в присутствии 0,5 г 5%-ного палладия на угле. Затем катализатор отсасывают и неоднократно промывают метанолом и дихлорметном. Фильтрат упаривают и сушат в высоком вакууме.
Выход: 2,1 г
Значение Rf: 0,53 (из смеси дихлорметана и этанола в соотношении 5:1)
Пример CXIV
Гидрохлорид 3-метил-5,6,7,8-тетрагидро -α- карболина
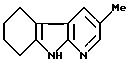
13,0 г (120,2 ммоль) 2-амино-5-метил-пиридина растворяют в 150 мл этанола, и смешивают с 60 мл 2 М соляной кислоты, упаривают досуха и сушат в высоком вакууме над гидроокисью натрия и полупятиокисью фосфора. Полученный продукт в течение 6 часов кипятят с обратным холодильником на водоотделителе в 120 мл 1,2- дихлорбензола вместе с 2, 2 г (20,1 ммоль) 2-амино-5-метил- пиридина и 11,4 г (50,0 ммоль) димерного 2-окси-циклогексанона. Затем еще раз добавляют 11,4 г (50,0 ммоль) димерного 2-окси- циклогексанона и кипятят с обратным холодильником в течение еще 3 часов. При охлаждении при температуре 20oC образуется осадок. Добавляют 150 мл ацетона, при размешивании охлаждают до температуры 0 - 5oC, осадок отсасывают и дополнительно промывают холодным простым эфиром. Полученный продукт сушат в высоком вакууме над полупятиокисью фосфора.
Выход: 18 г
Значение Rf: 0,29
(из смеси дихлорметана и этанола в соотношении 20:1)
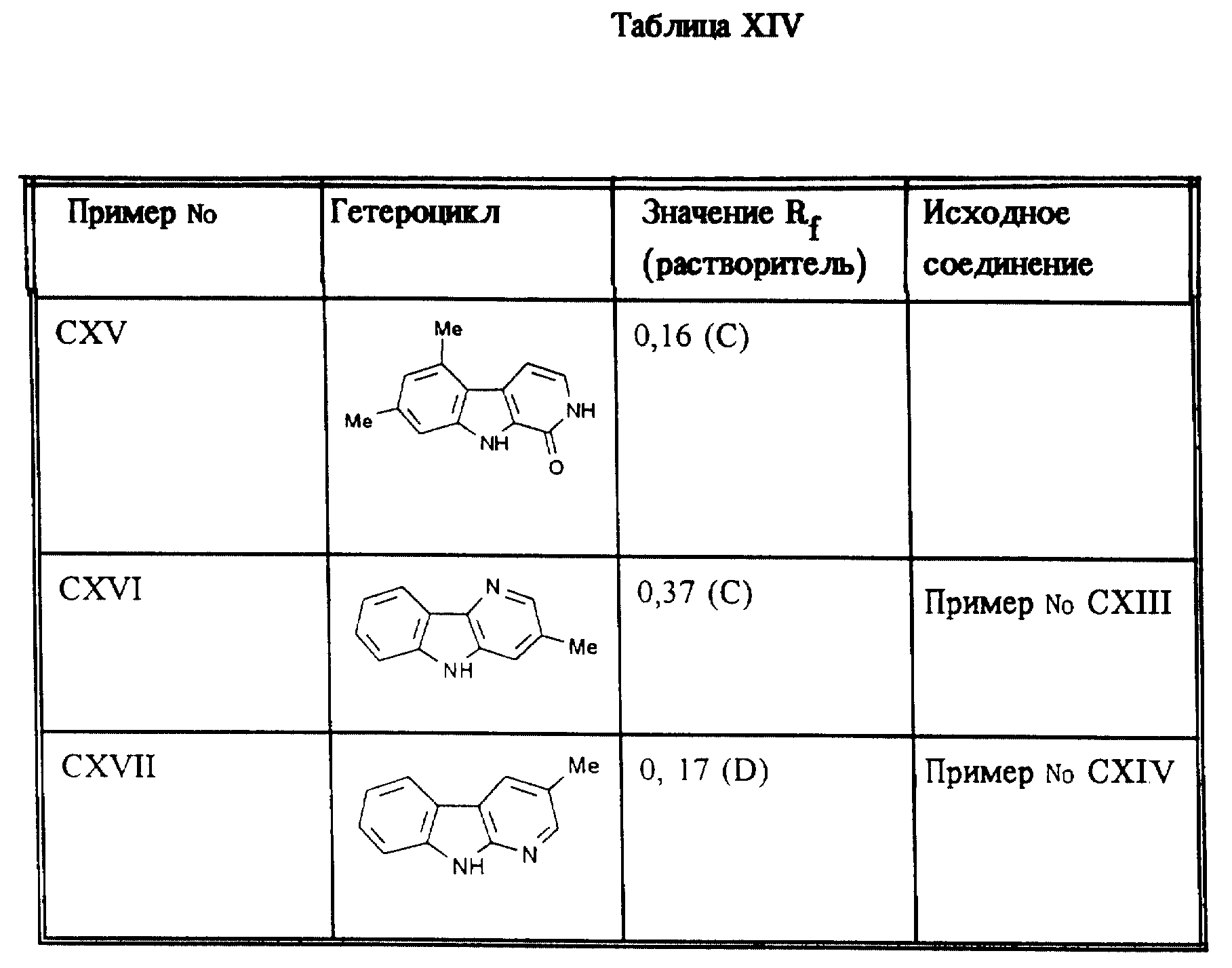
Аналогично примеру XIX получают соединения, приведенные ниже в таблице XIV.
Пример CXVIII
1-хлор-5,7-диметил
-β- карболин

10,2 г (49 ммоль) соединения, полученного согласно примеру CXV, при температуре 125oC в течение 24 часов подвергают взаимодействию с 222 мл (2,4 моль) оксихлорида фосфора и 155 мкл N,N-диметил-анилина. После охлаждения реакционную смесь выливают на 1 л ледяной воды, нейтрализуют добавлением водного раствора карбоната натрия и неоднократно экстрагируют сложным этиловым эфиром уксусной кислоты. Органическую фазу сушат над сульфатом магния, упаривают, и в высоком вакууме удаляют остатки растворителя. Сырой продукт очищают путем хроматографии на силикагеле 60 (фирма Merck) с использованием дихлорметана в качестве элюента.
Выход: 4,3
г
Значение Rf: 0,39 (из смеси дихлорметана и этанола в соотношении 20:1)
Пример CXIX
5,7-диметил-β-карболин

3,8 г (16,5 ммоль) соединения, полученного согласно примеру CXVIII, в присутствии 700 мг 10%-ного палладия на угле при температуре 20oC и при водяном давлении примерно 3 бар в течение 10 дней в среде 40 мл тетрагидрофурана подвергают взаимодействию с 1,3 г бикарбоната натрия, причем через день добавляют 300 мг 10%-ного палладия на угле и 5 мл метанола. Затем катализатор отсасывают через кизельгур, дополнительно промывают тетрагидрофураном, кипятят в среде метанола и дихлорметана и повторно отсасывают. Объединенные органические фазы упаривают, остаток размешивают с простым эфиром и отсасывают. В результате сушки в вакууме получают 3 г сырого продукта.
Значение Rf: 0,13 (из смеси
дихлорметана и этанола в соотношении 20:1)
Пример CXX
5,6-диметил-1-(пирид-2-ил)-1H-бензотриазол
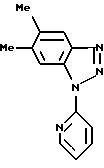
14,85 г (103 ммоль) 5,6-диметил-1H-бензтриазола растворяют в 150 мл безводного диметилсульфоксида и при температуре 20oC подвергают взаимодействию с 5 г (104 ммоль) 50 7%-ного гидрида натрия, содержащего 40% парафинового масла, до прекращения выделения водорода. Затем добавляют 10 г (103 ммоль) 2-фтор-пири- дина и кипятят с обратным холодильником в течение 18 часов. После охлаждения до температуры 20oC добавляют воду до объема примерно 1 л, образовавшийся осадок отсасывают и промывают водой. Продукт сушат в высоком вакууме над полупятиокисью фосфора и очищают путем хроматографии на силикагеле 60 (фирма Merck) с использованием в качестве элюента градиента дихлорметана до смеси дихлорметана и этанола в соотношении 100:1.
Выход: 10,6 г
Значение Rf: 0,38 (из смеси дихлорметана и этанола в соотношении 50:1)
Пример CXXI
6,7-диметил -α- карболин

8,9 г (39,7 ммоль) соединения, полученного согласно примеру CXX, в 140 г полифосфорной кислоты в атмосфере аргона медленно нагревают до температуры 165oC, причем уже перед полной конверсией исходного соединения (контроль путем тонкослойной хроматографии с использованием смеси дихлорметана и этанола в соотношении 20:1) выливают на 1,5 л воды и доводят до значения pH 6-7 путем добавления 1 М водного натрового щелока. Образовавшийся осадок отсасывают, промывают водой, повторно отсасывают, промывают петролейным эфиром и еще раз отсасывают. В результате сушки в вакууме получают 1,8 г продукта.
Значение Rf: 0,32 (из смеси дихлорметана и этанола в соотношении
20:1)
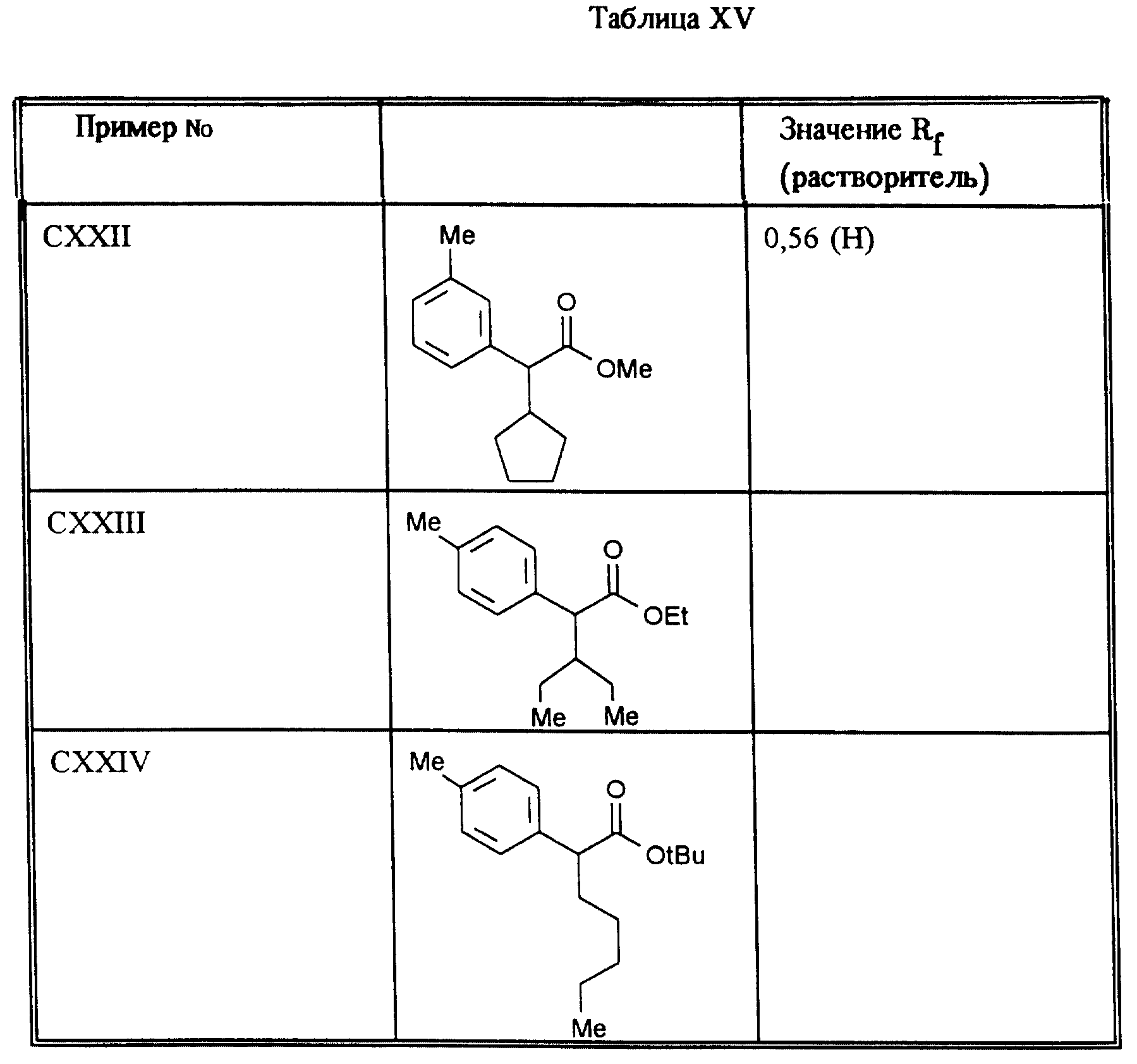
Аналогично методу примера XXI получают приведенные в таблице XV соединения.
Приведенные в таблице XVI соединения получают согласно методу по примеру XXVIII.
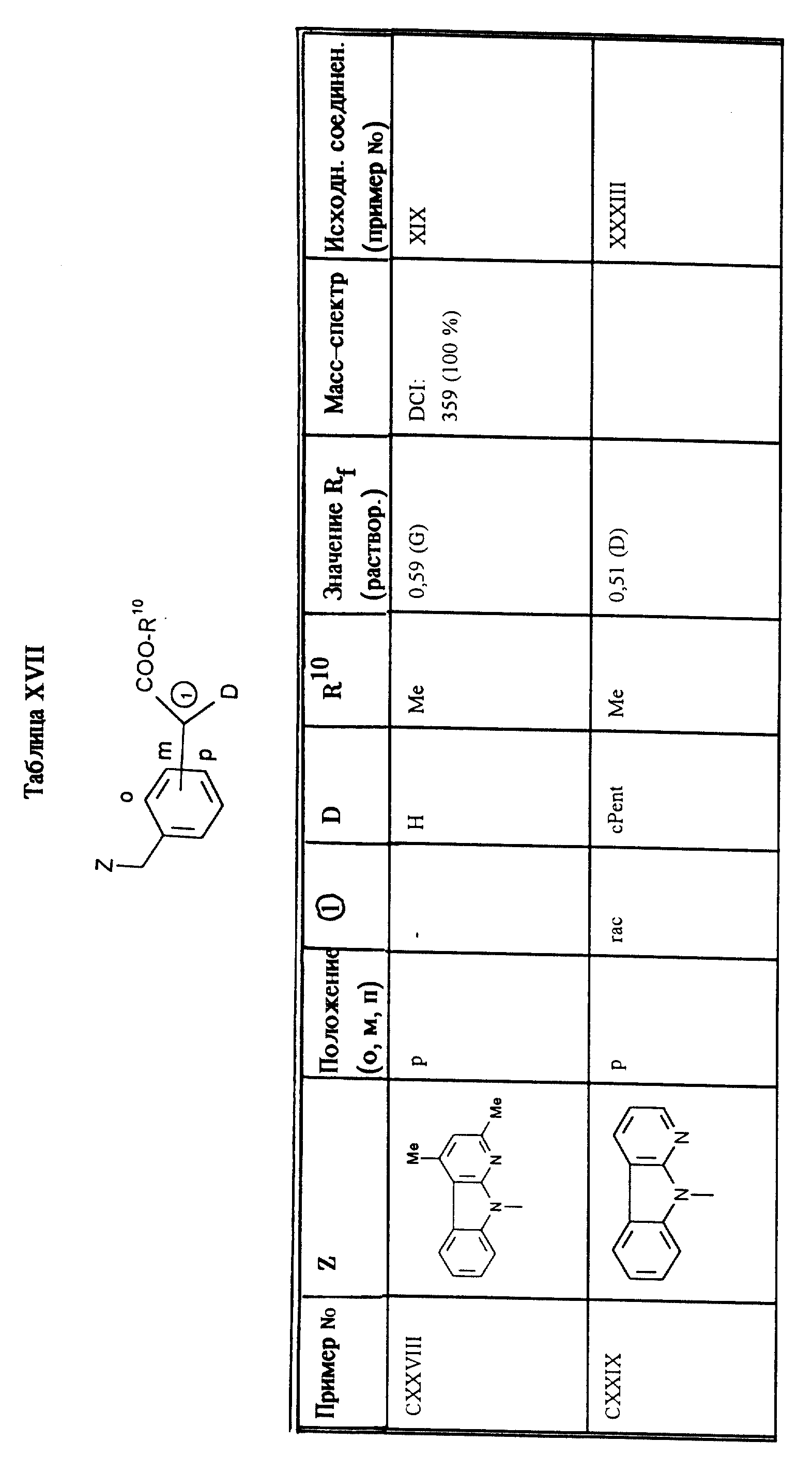
Соединения, приведенные а таблице XVII, получают аналогично примеру XXXV.
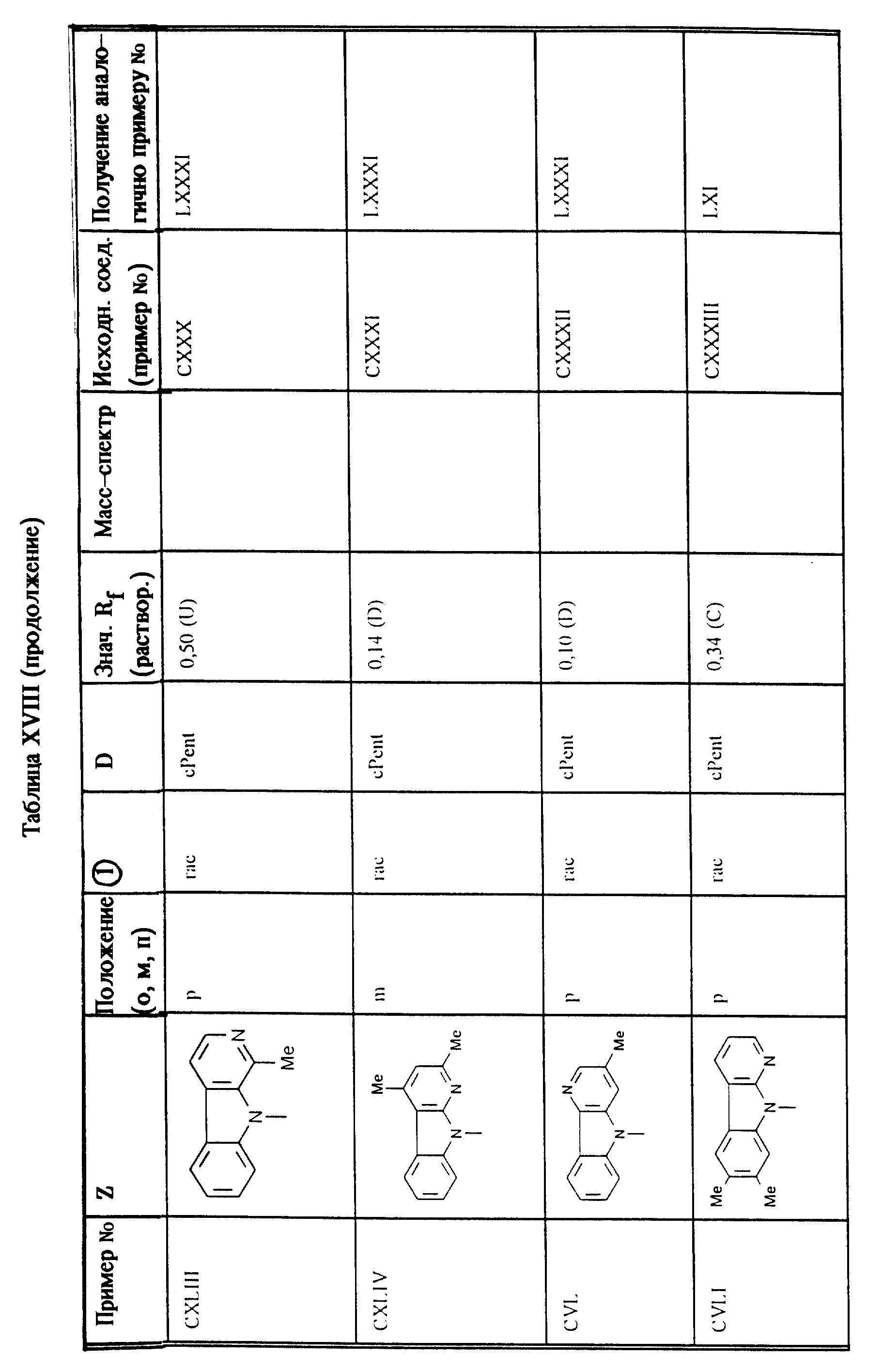
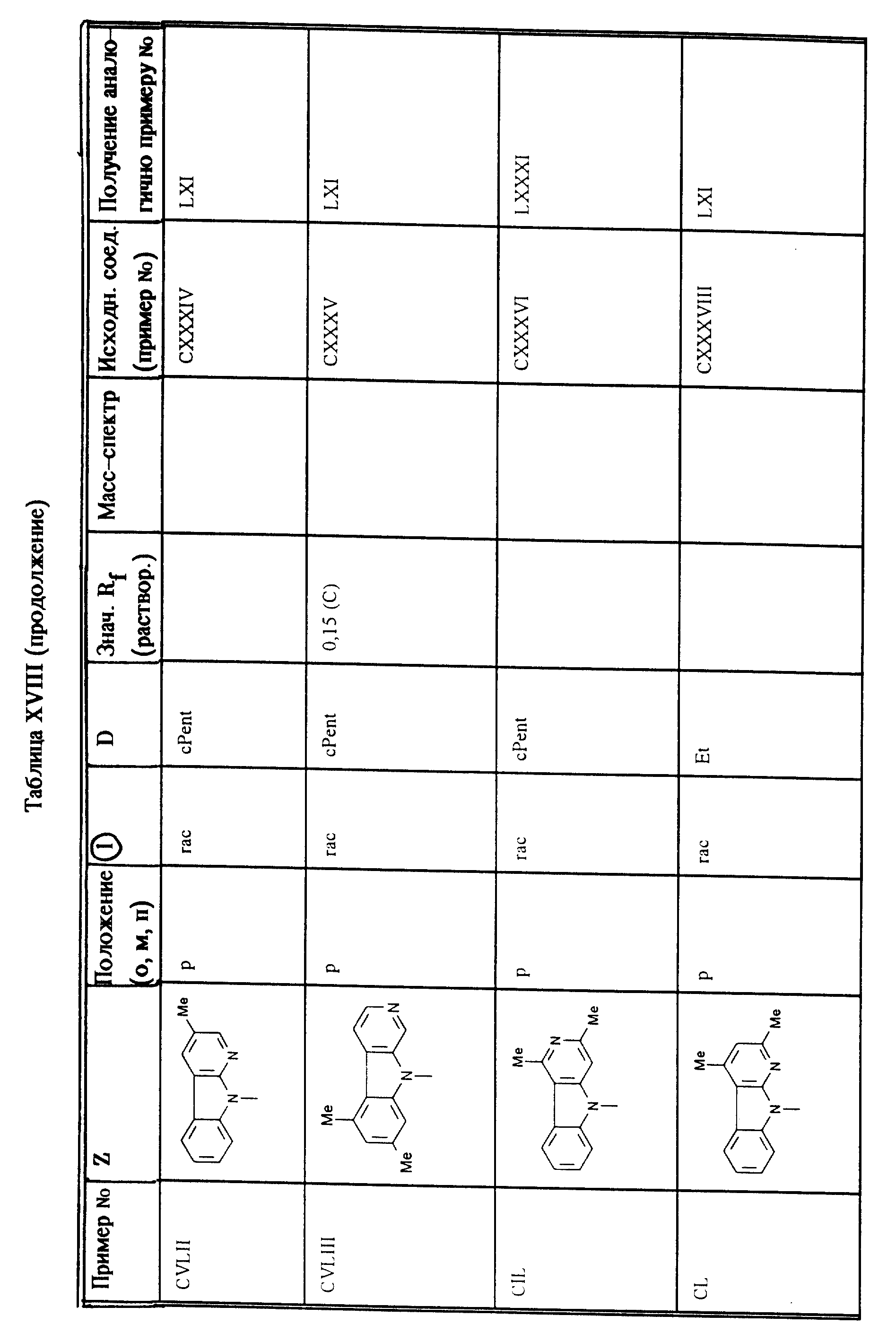
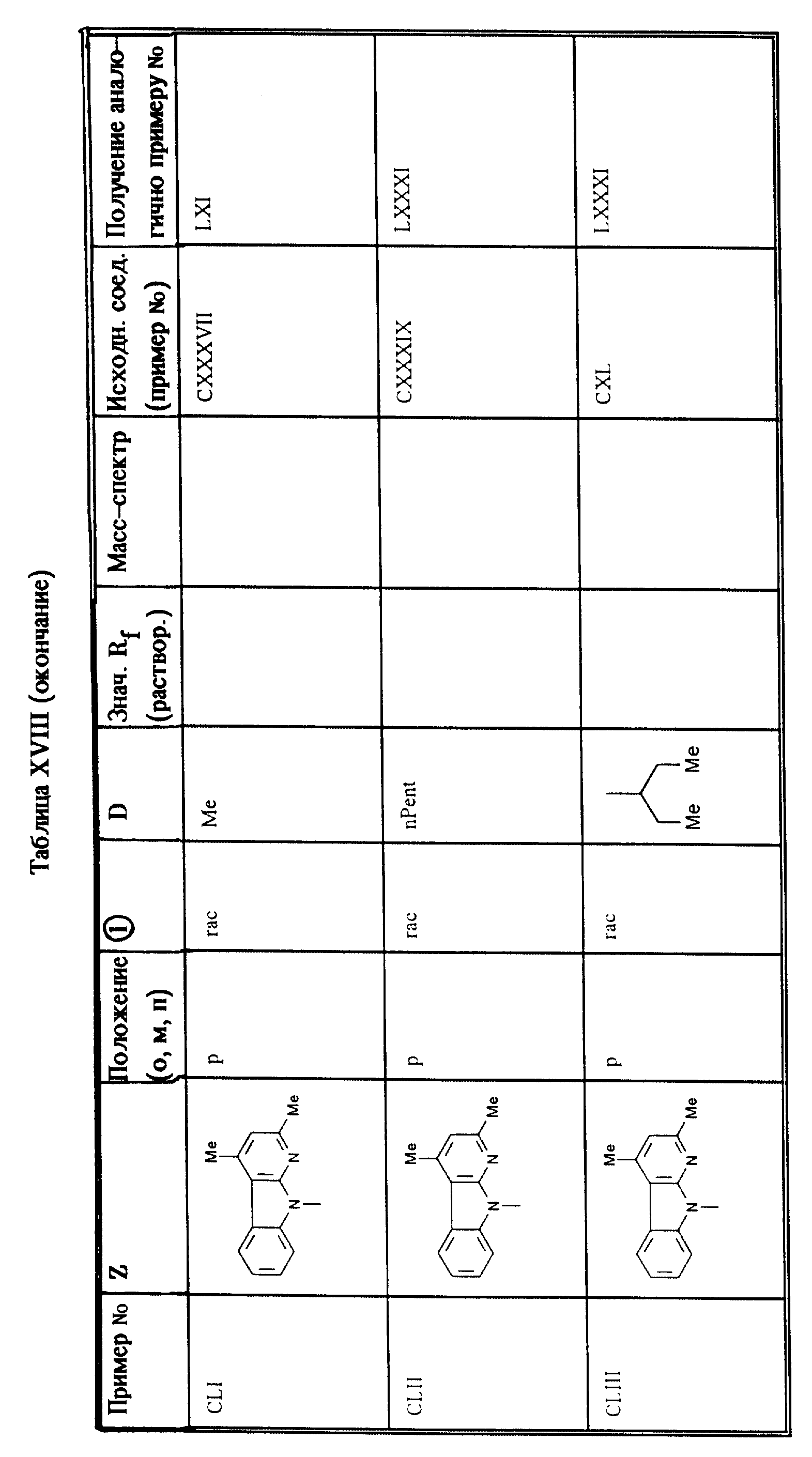
Приведенные в таблице XVIII соединения получают согласно методам, описанным в примерах LXI, LXXXI, LXXXII (второй метод) или 73.
Получение целевых соединений
Примеры 1, 2 и 3
N-[(R)-фенилглициноламид] 2-(S)- и 2-(R)- 2-[4-(2,4-диметил-5,6,7,8-тетрагидро α
- карболин-9-ил)- метил-фенил]-2-циклопентил-уксусной кислоты

3,00 г (7,2 ммоль) соединения, полученного согласно примеру LXII, и 0,99 г (7,2 ммоль) (R)-фенилглицинола (фирма Aldrich) растворяют в 70 мл дихлорметана, при температуре 0oC последовательно добавляют 1,07 г (7,9 ммоль) 1-окси-1H- бензотриазола в виде гидрата (фирма Aldrich), 1,58 г (8,3 ммоль) гидрохлорида N'-(3-диметиламинопропил)-N-этилкарбодиимида (фирма Aldrich) и 2 мл триэтиламина, и затем дополнительно размешивают при комнатной температуре в течение 20 часов. Органический раствор экстрагируют водным раствором хлорида аммония, водным раствором бикарбоната натрия и буфером со значением pH 4 (готовый буферный раствор фирмы Е. Merck, г. Darmstadt, DE), сушат над твердым безводным сульфатом натрия и упаривают.
Выход смеси диастереомеров: 3,50 г (пример 1).
Смесь
разделяют путем хроматографии на силикагеле с использованием в качестве элюента смеси дихлорметана и этанола в соотношении 50:1, причем получают:
Пример 2:
диастереомер A
[2(S)-диастереомер]: 1,23 г
Значение Rf: 0,23 (из смеси дихлорметана и этанола в соотношении 50:1)
1H-ЯМР (d-ДМСО, 250 МГц, TMS): δ = 0,87 (м, 1H), 1,19
- 1,63 (м, 6H), 1,72 (м, 1H), 2,45 (м, 1H), 2,58 (с, 3H), 2,79 (с, 3H), 3,26 (д, 1H), 3,44 - 3,53 (м, 2H), 4,21 - 4,31 (м, 2H), 5,63 (с, 2H), 6,97 - 7,11 (м, 8H), 7,20 - 7,28 (м, 3H), 7,41 (м, 1H), 7,
54 (д, 1H), 8,12 (д, 1H), 8,24 (д, 1H).
Пример 3:
диастереомер B [2(R)-диастереомер]: 1,12 г
Значение Rf: 0,16 (из смеси дихлорметана и этанола в
соотношении 50:1)
1H-ЯМР (d-ДМСО, 250 МГц, TMS): δ = 0,84 (м, 1H), 1,07 - 1,59 (м, 7H), 2,34 (м, 1H), 2,61 (c, 3H), 2,80 (c, 3H), 3,25 (д, 1H), 3,43 (м, 2H), 4,63 - 4,72 (м,
2H), 5,66 (с, 2H), 6,98 (c, 1H), 7,13 (м, 2H), 7,20 - 7,30 (м, 8H), 7,43 (м, 1H), 7,57 (д, 1H), 8,12 (д, 1H), 8,36 (д, 1H).
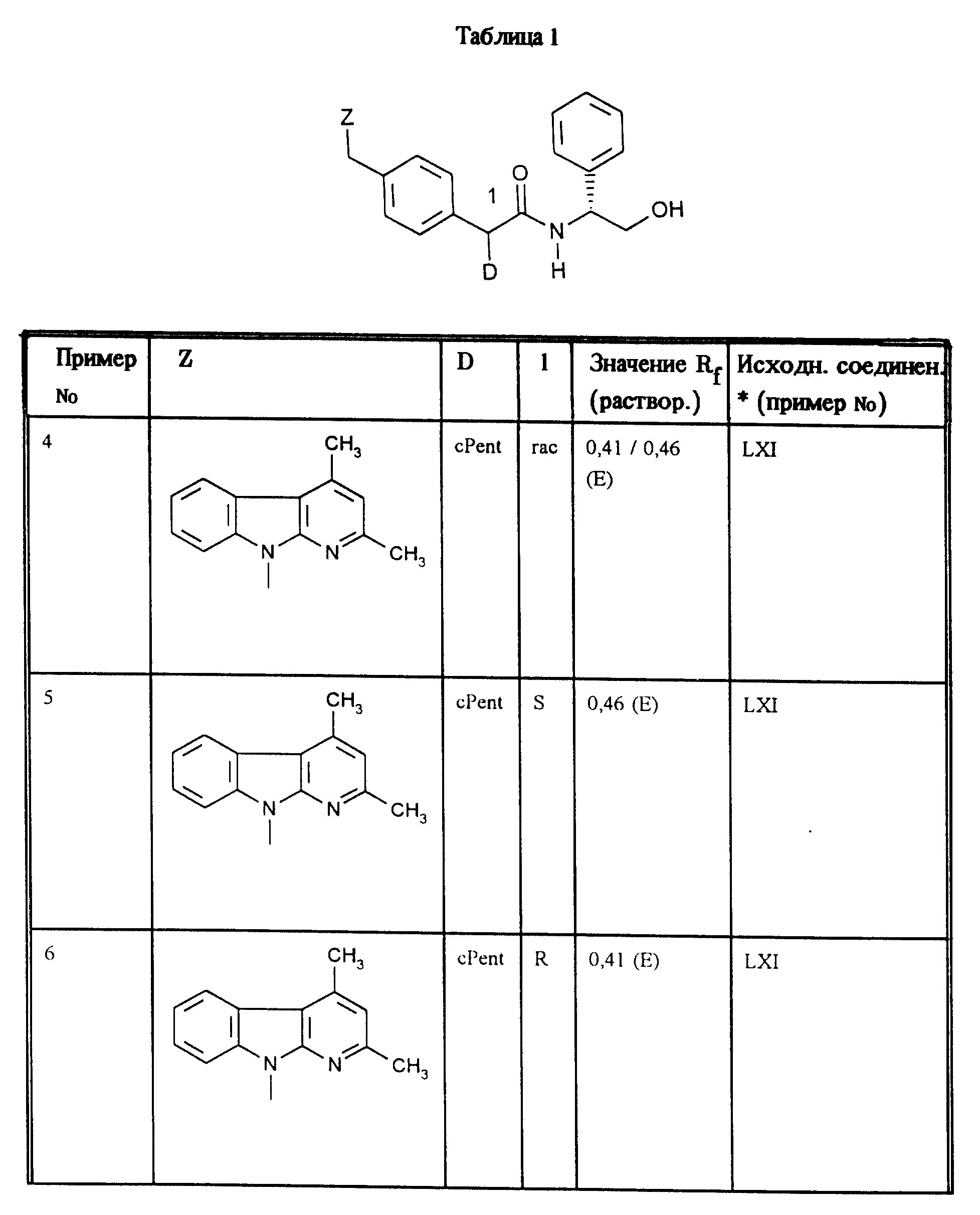
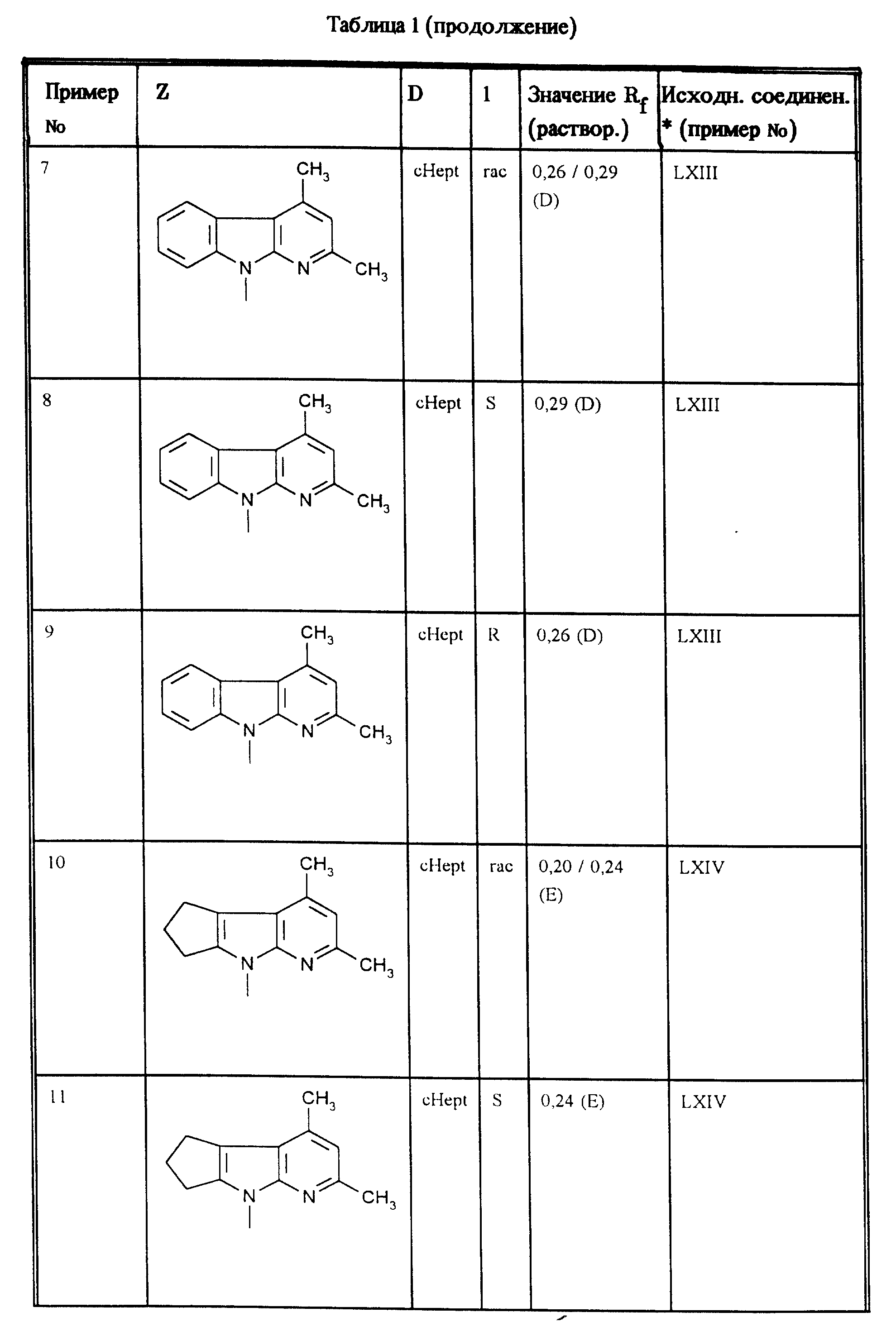
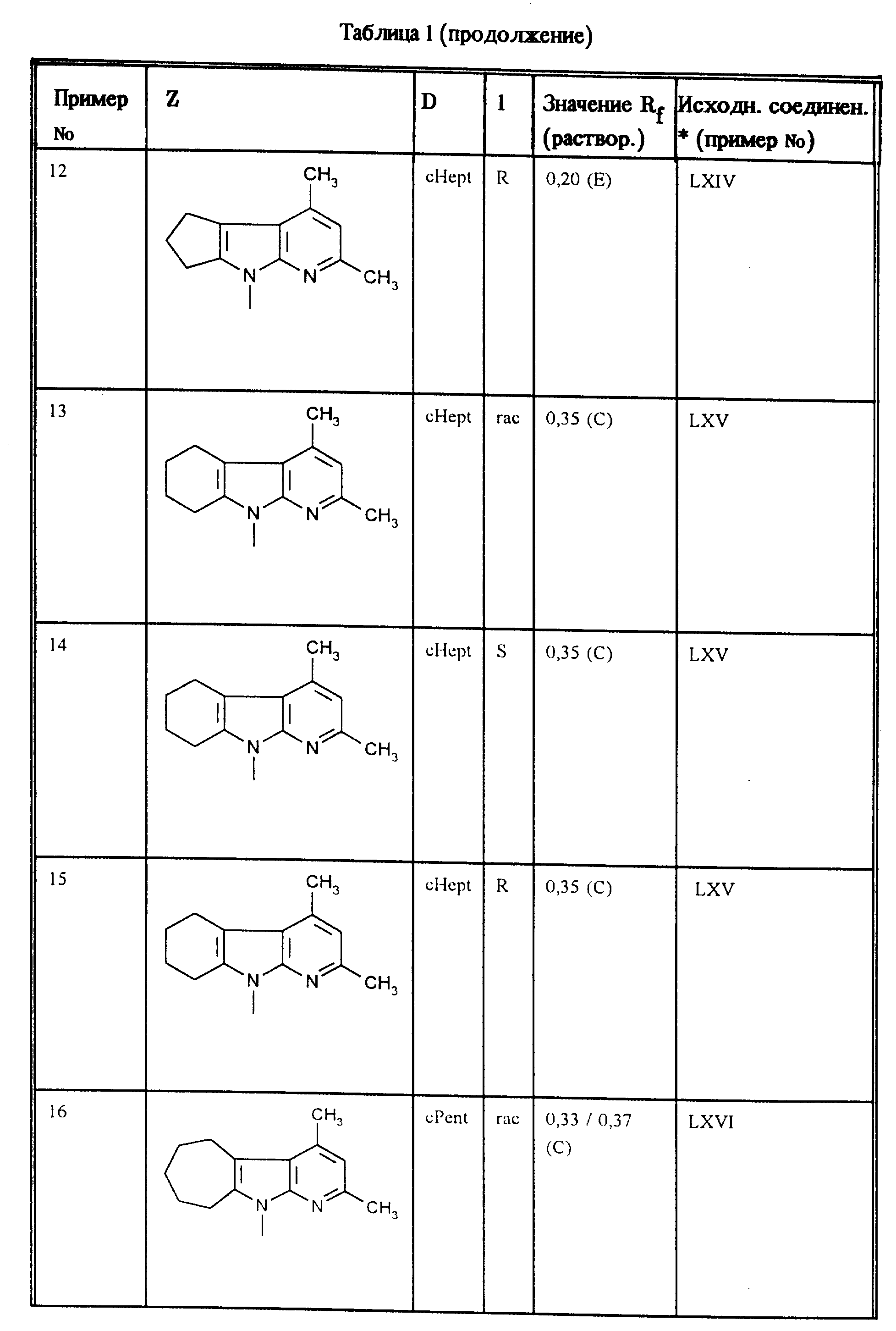
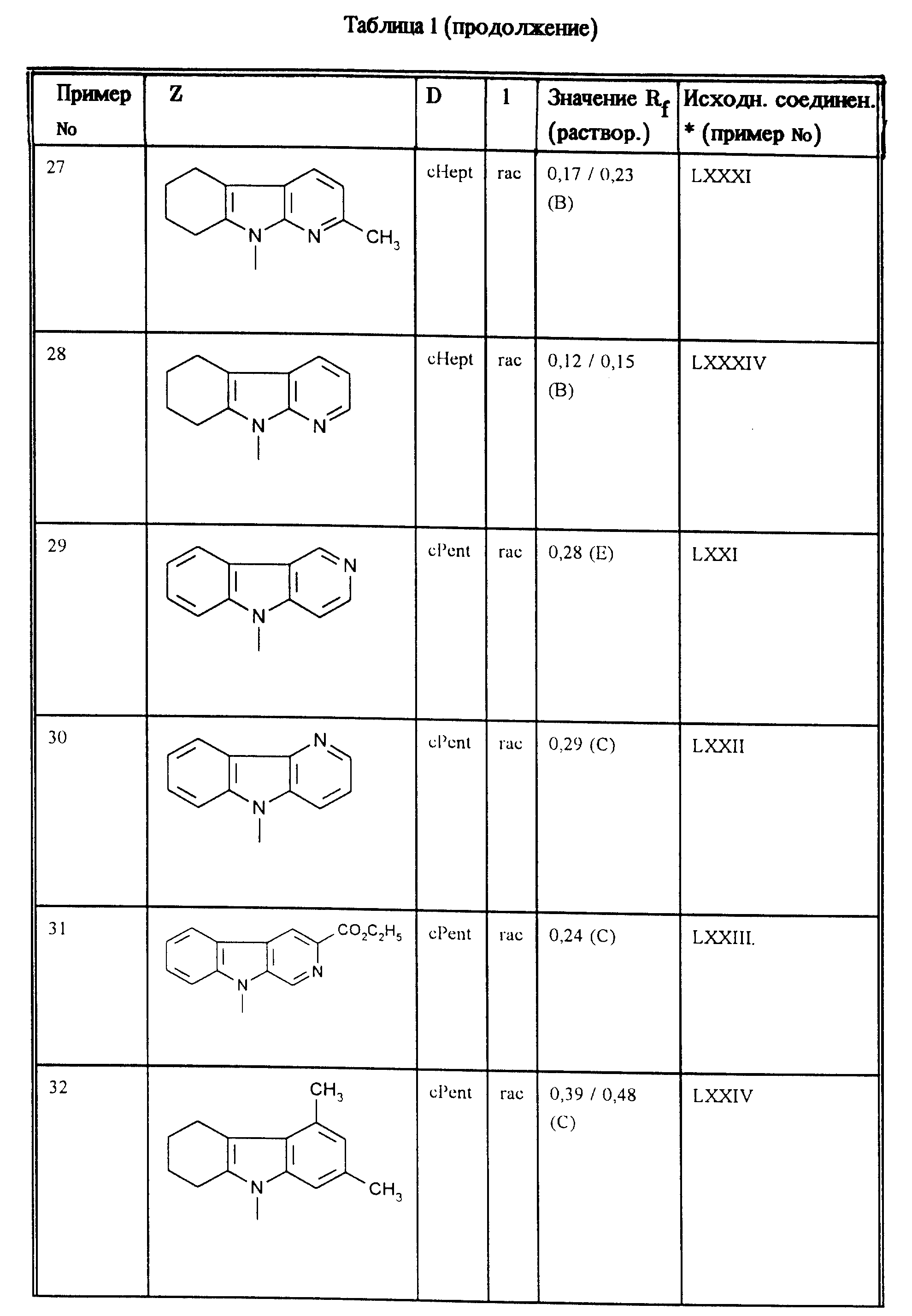
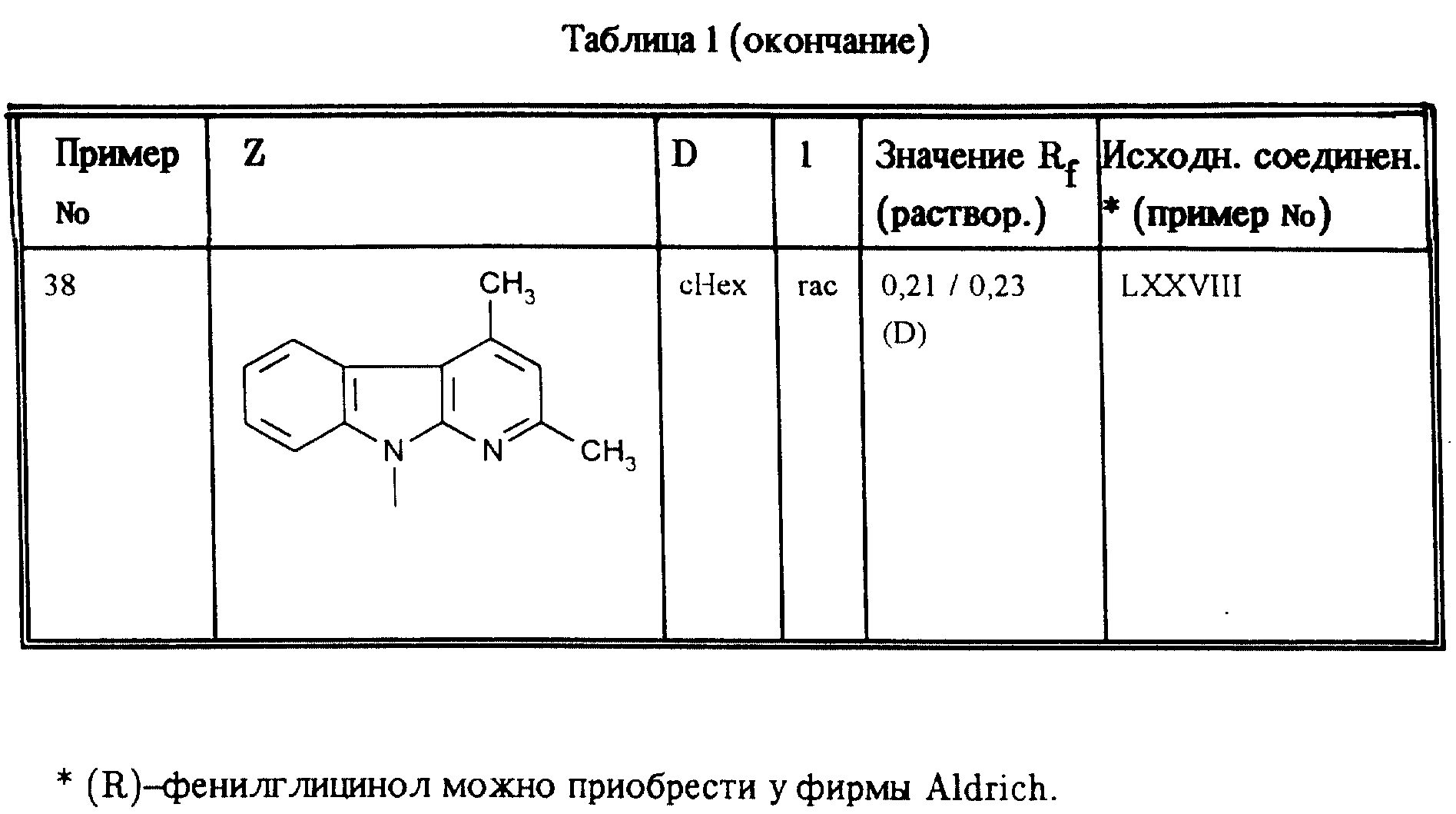
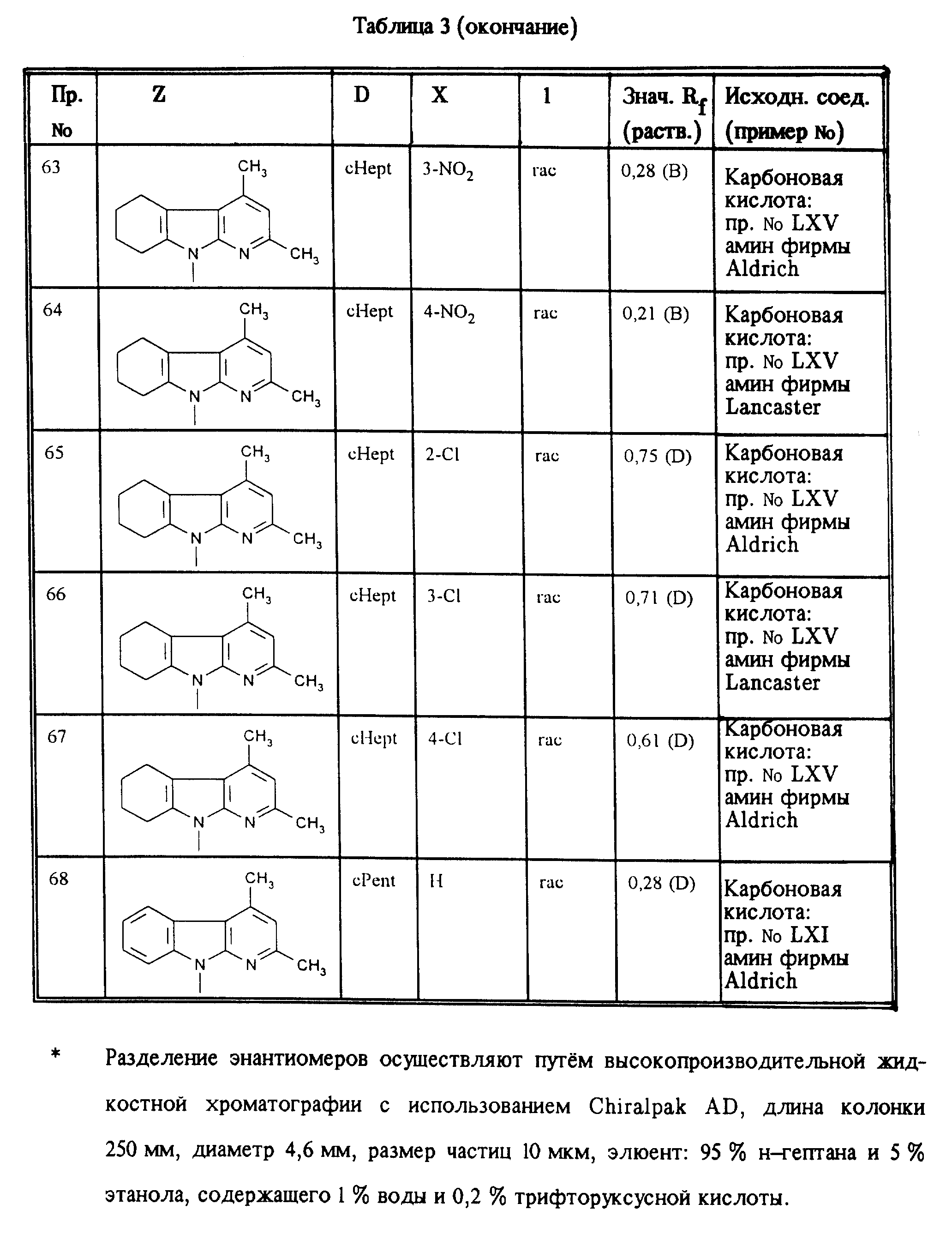
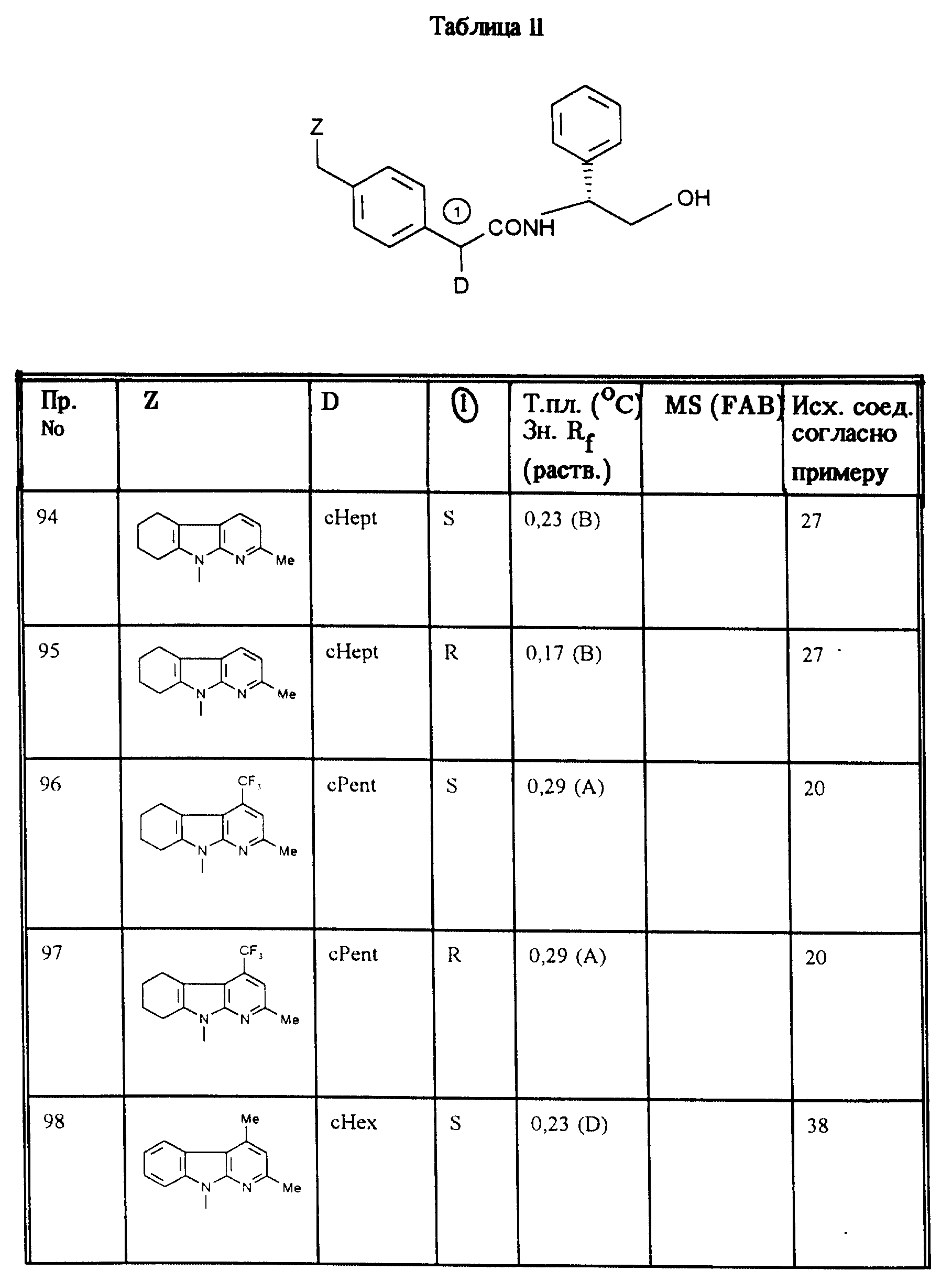
Аналогично примерам 1, 2 и 3 получают соединения, приведенные в таблицах 1, 2 и 3.
Пример 69
N-(2-оксибензил)амид 2-(R, S)-2-[4-(2,4-диметил- 5,6,7,8-тетрагидро -α- карболин-9-ил)-метил-фенил]-2-циклогептил- уксусной
кислоты

0,60 г соединения, полученного согласно примеру 58, кипятят с обратным холодильником в течение 22 часов в 3 мл метанола и 0,6 мл воды в атмосфере аргона в качестве защитного газа и в присутствии 33 мг 10 %-ного палладия на животном угле и 33 мг пара-толуолсульфокислоты в виде моногидрата. В случае неполной конверсии (контроль путем тонкослойной хроматографии с использованием смеси дихлорметана и этанола в соотношении 50:1) добавляют еще 33 г 10%-ного палладия на животном угле и 33 мг пара-толуолсульфокислоты в виде моногидрата и кипятят с обратным холодильником в течение дальнейших 24 часов. Катализатор отсасывают в горячем состоянии, промывают большим количеством горячего метанола, и фильтрат упаривают. В результате сушки в высоком вакууме над полупятиокисью фосфора получают 0,52 г продукта.
Значение Rf: 0,33 (из смеси дихлорметана
и этанола в соотношении 50:1)
Пример 70
N-(R)-фенилглициноламид 2-(R, S)-2-[4-(3-оксиметил -β- карболин-9-ил)-метил-фенил]-2-цикло-пентил-уксусной кислоты
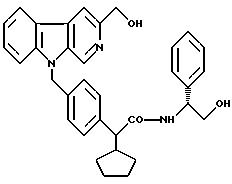
К 500 мг (0,868 ммоль) соединения, полученного согласно примеру 31, в 5 мл безводного тетрагидрофурана в атмосфере аргона при температуре 0oC каплями добавляют 1,737 мл (1,737 ммоль) 1 М раствора аланата лития в тетрагидрофуране, и дополнительно размешивают при температуре 20oC в течение 4 часов. К реакционной смеси осторожно добавляют 5 мл воды, и путем добавления 2 М водной соляной кислоты доводят до значения pH, примерно равного 2. Водную фазу неоднократно экстрагируют простым диэтиловым эфиром и дихлорметаном, сушат над сульфатом натрия и упаривают. Сырой продукт подвергают хроматографии на силикагеле 60 (фирма Merck) с использованием в качестве элюента градиента дихлорметана до смеси дихлорметана и метанола в соотношении 50:1.
Выход: 0,12 г
Значение Rf: 0,26 (из смеси дихлорметана и этанола в соотношении 20:1)
Приведенные в таблице 4 соединения получают согласно методу по примеру 70.
Пример 73
N-(4-карбоксибензил)амид 2-(R, S)-2-[4-(2,4-диметил-5,6,7,8- тетрагидро α
- карболин-9-ил)-метил-фенил]-2- циклогептил-уксусной кислоты
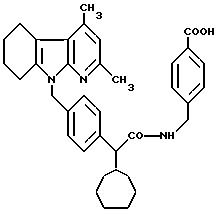
0,325 г (0,55 ммоль) соединения, полученного согласно примеру 60, при температуре 60oC в течение 18 часов подвергают взаимодействию с 0,5 мл водного 2 М натрового щелока в 3 мл метанола. Если согласно контролю путем тонкослойного анализа (с использованием растворителя F) взаимодействие не завершено, то добавляют еще 0,5 мл водного 2 М натрового щелока в 1 мл метанола и кипятят с обратным холодильником в течение 24 часов. Реакционную смесь охлаждают, путем добавления 1 М соляной кислоты доводят до значения pH, составляющего примерно 4. Осадок отсасывают, промывают водой и смесью петролейного эфира и простого диэтилового эфира в соотношении 5:1, и остатки растворителя удаляют в высоком вакууме над полупятиокисью фосфора.
Выход: 0,154 г
Значение Rf: 0,50 (из смеси
дихлорметана, метанола и уксусной кислоты в соотно шении 90:10:2)
Пример 74
N-(3-карбоксибензил)амид 2-(R, S)-2-[4-(2,4-диметил-5,6,7,8-тетрагидро- α
- карболин-9-ил)-метил-фенил]-2-циклогептил-уксусной кислоты.

Целевое соединение получают аналогично примеру 73 из соединения, полученного согласно примеру 59.
Значение Rf: 0,27 (из смеси дихлорметана и этанола в соотношении 20:1)
Соединения,
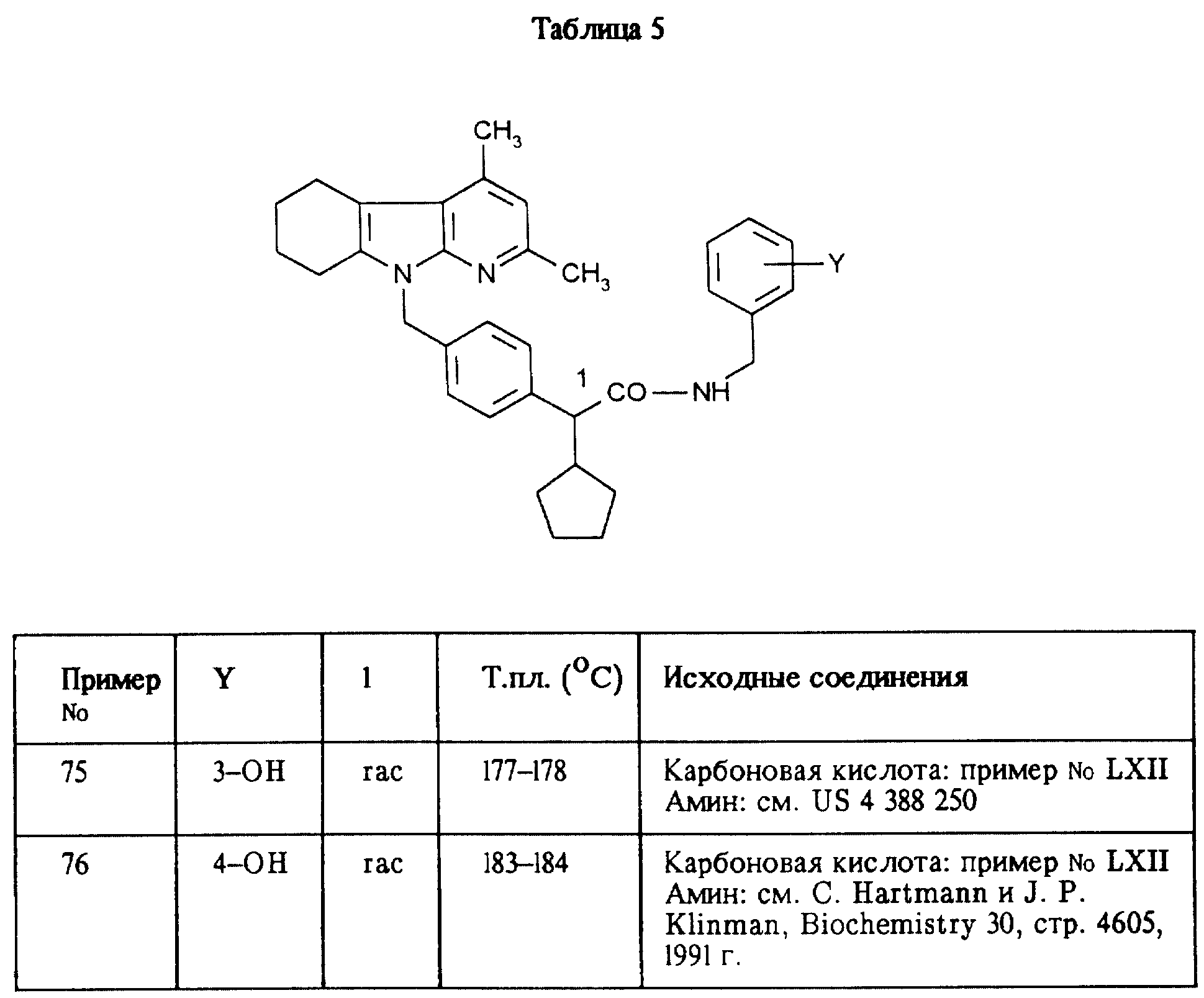
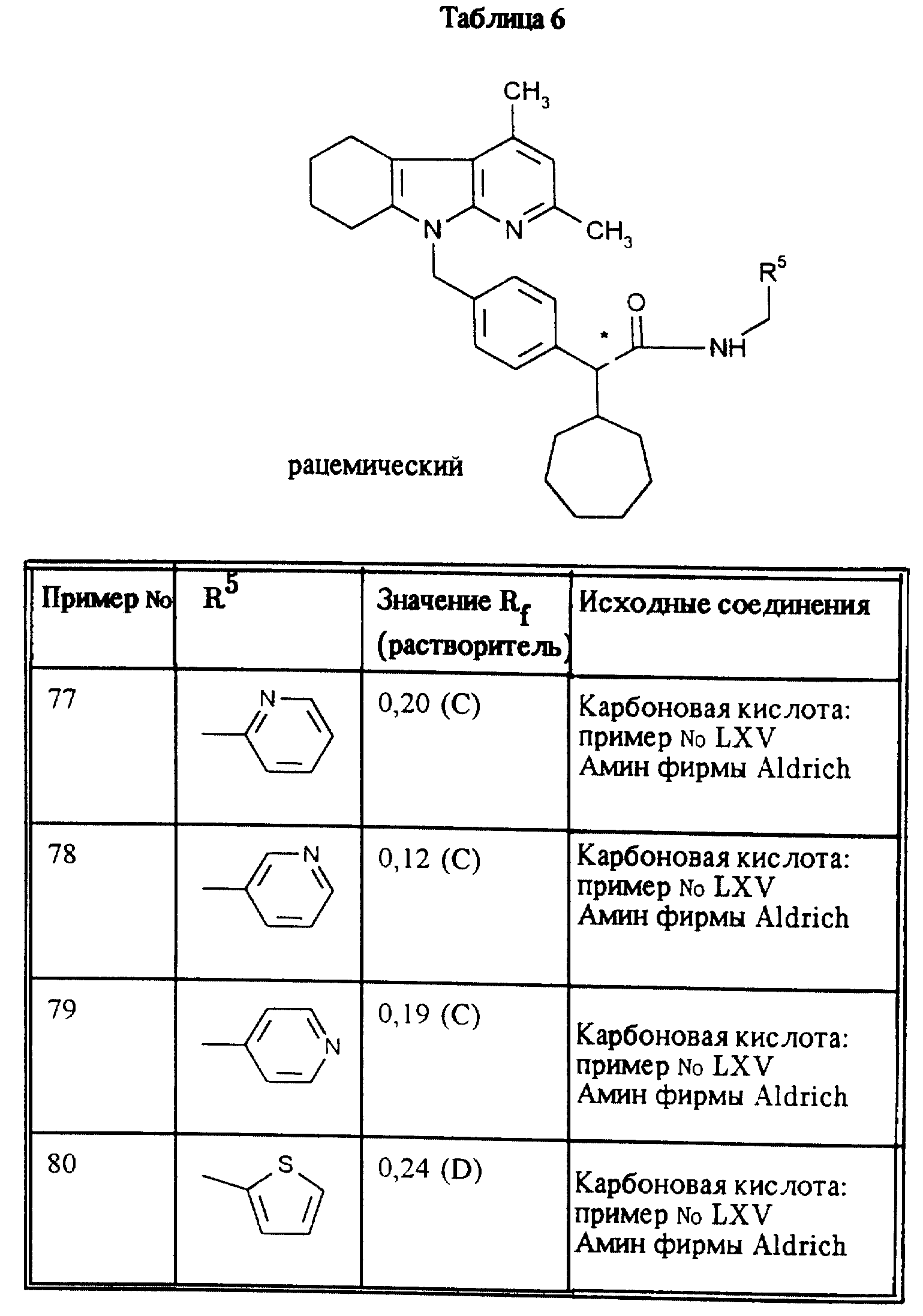
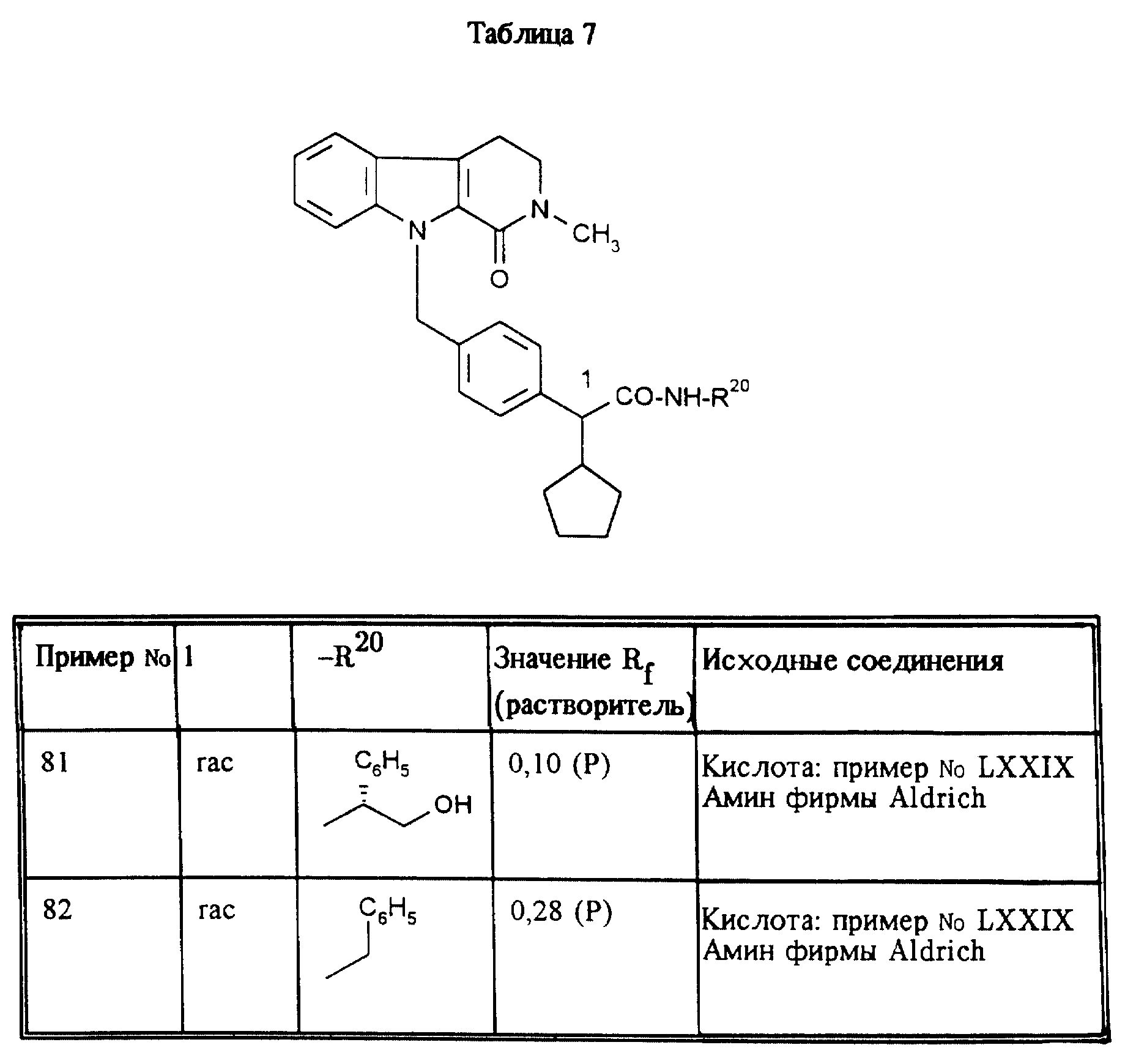
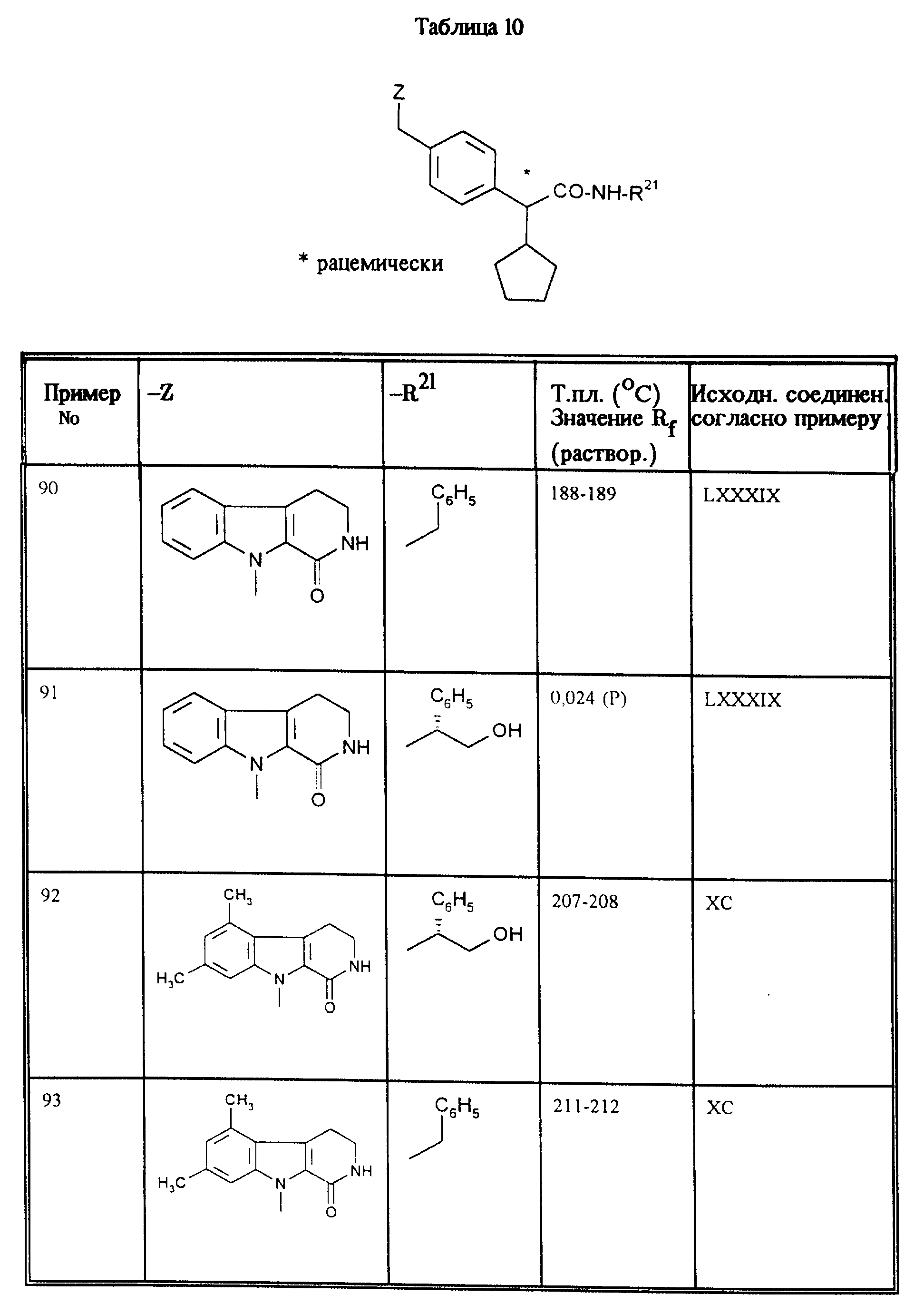
приведенные в таблицах 5, 6, 7, 8, 9 и 10, получают аналогично примеру 1.
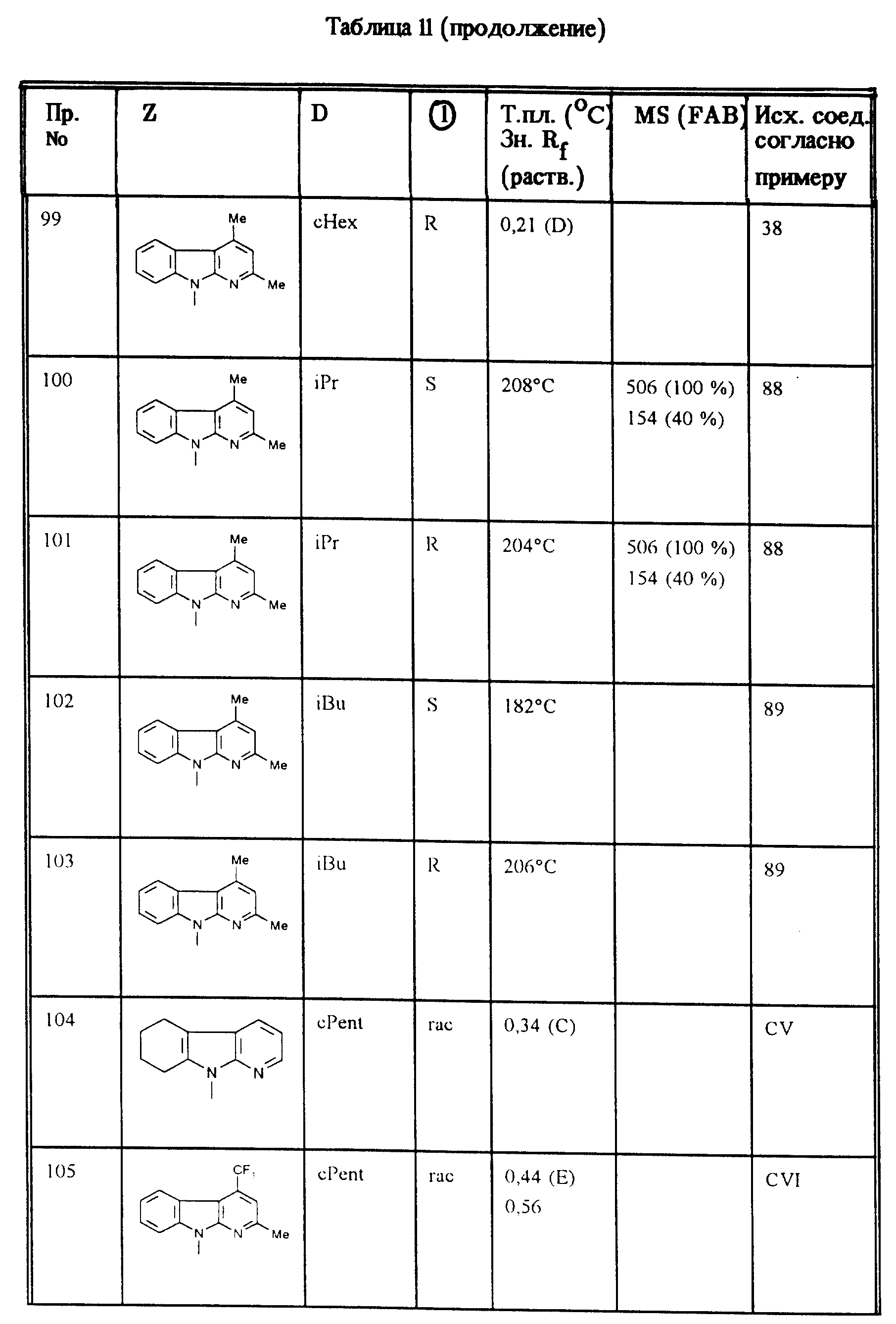
Соединения, приведенные в таблице II, получают аналогично примерам 1, 2 и 3.
Соединения, приведенные в таблице 12, получают также согласно примерам 1, 2 и 3.
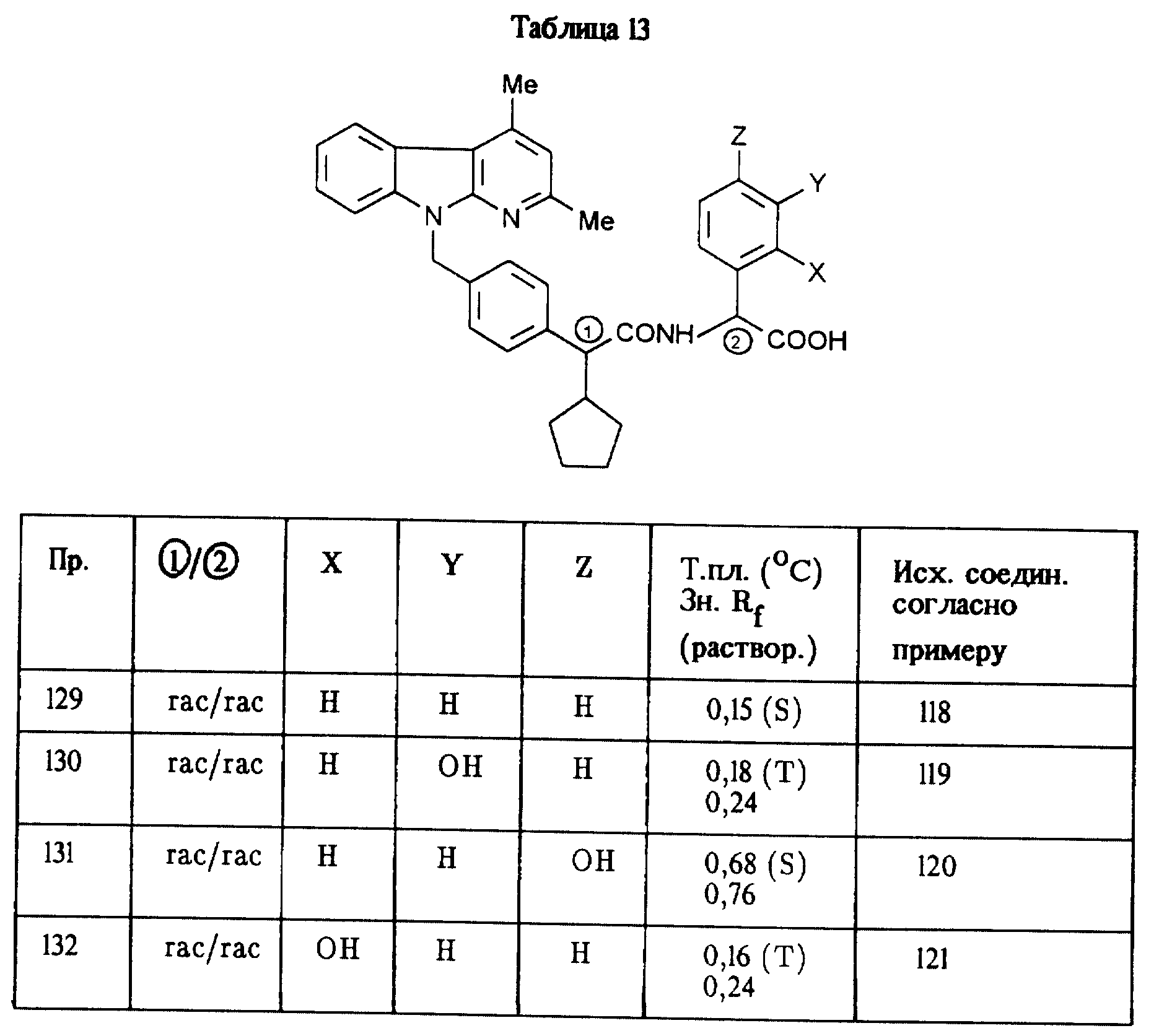
Соединения, приведенные в таблице 13, получают аналогично примеру 73.
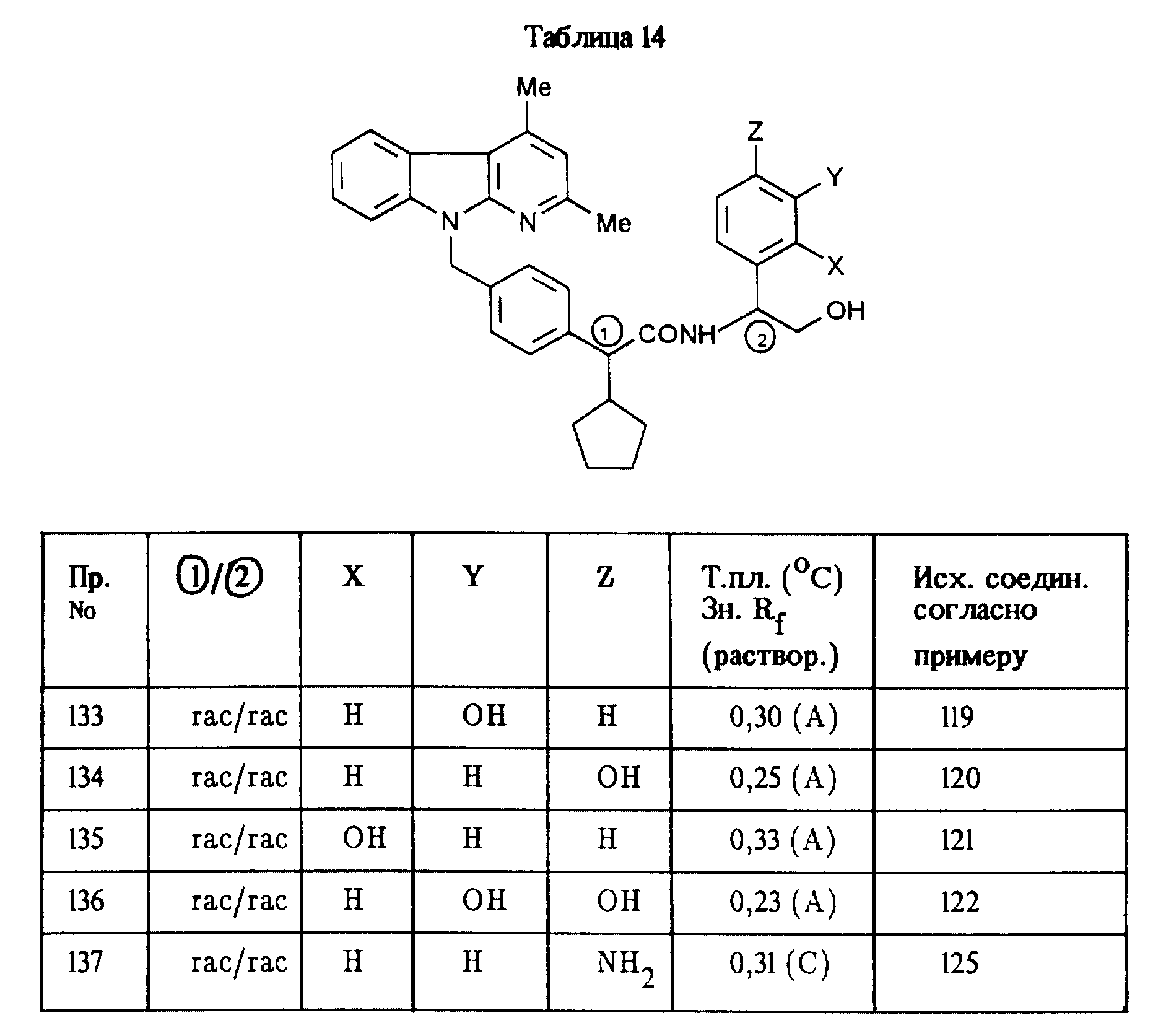
Соединения, приведенные в таблице 14, получают аналогично примеру 70.
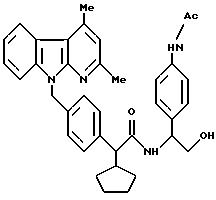
Пример 138
N-[1-(R, S)-1-(4-ацетамидо-фенил)-2-окси- этил]амид 2-(R,S)-2-[4-(2,4-диметил- α
- карболин-9-ил)-метил- фенил]-2-циклопентил-уксусной кислоты
Часть А
К 0,60 г (1,10 ммоль) соединения, полученного согласно примеру 137, в 10 мл дихлорметана добавляют 192 мкл (3,29 ммоль) триэтиламина, а затем при температуре 0oC подвергают взаимодействию с 70 мкл (0,99 ммоль) ацетилхлорида. Размешивают в течение 3 часов, причем температура реакционной смеси повышается до 20oC. Затем последовательно встряхивают с 1 М соляной кислотой, 0,1 М натровым щелоком и водой, органическую фазу сушат над сульфатом магния и упаривают.
Часть Б
Полученный таким образом сырой продукт согласно масс- спектру (FAB) двойно ацетилирован
(631,57%, М+ + H / 653,6%, M+ + Na). Поэтому его при температуре 20oC в течение часа подвергают взаимодействию в 6 мл метанола с 2 М натровым щелоком. Добавлением 1 М
соляной кислоты значение pH доводят до 2, и полученную реакционную смесь экстрагируют сложным эфиром уксусной кислоты. Органическую фазу промывают водой до нейтральности, сушат над сульфатом магния и
упаривают в вакууме. В результате сушки в высоком вакууме получают 0,28 г продукта.
Значение Rf: 0,17 (из смеси дихлорметана и этанола в соотношении 20:1)
Пример
139
N-[1-(R, S)-1-(4-ацетамидо-фенил)-2-ацетокси- этил] амид 2-(R,S)-2-[4-(2,4-диметил- α- карболин-9-ил)- метил-фенил]-2-циклопентил-уксусной кислоты

Целевое соединение получают путем взаимодействия соединения, полученного согласно примеру 137, аналогично части А примера 138 с 4 эквивалентами триэтиламина и 4 эквивалентами ацетилхлорида.
Значение Rf: 0,56 (из смеси дихлорметана и этанола в соотношении 20:1)
Соединения, приведенные в
таблице 15, получают аналогично примеру 138.
Пример 142
N-[1-(R)-1-фенил-2-ацетокси-этил] амид 2-(S)-2- [4-(2,4-диметил -α
- карболин-9-ил)-метил-фенил]-2-циклопентил- уксусной кислоты

4,5 г (8,468 ммоль) соединения, полученного согласно примеру 2, суспендируют в 300 мл дихлорметана, добавляют 2,05 мл (25,4 ммоль) пиридина и 1,82 мл (25,4 ммоль) ацетилхлорида в 30 мл дихлорметана и подвергают взаимодействию при температуре 20oC в течение 20 часов. Реакционную смесь экстрагируют буфером, имеющим значение pH 2 (фирмы Merck), и водой, сушат над сульфатом натрия и упаривают. Затем перемешивают с метанолом и сушат в высоком вакууме над полупятиокисью фосфора, в результате чего получают 3,6 г продукта.
Значение Rf: 0,62 (из смеси петролейного эфира и сложного эфира
уксусной кислоты в соотношении 1:1)
Соединения, приведенные в таблице 16, получают аналогично примеру 142.
Пример 151
N-[1-(R)-1-фенил-2-ацетокси-этил]амид
2-(S)-2- [4-(2,4-диметил -α- карболин-9-ил)-метил-фенил]-2-циклопентил- тиоуксусной кислоты

К 1,5 г (2,6 ммоль) соединения, полученного согласно примеру 142, в 50 мл диоксана добавляют 1,27 г (3,13 ммоль) 2,4-бис-(4- метоксифенил)-1,3-дитиа-2,4-дифосфетан-2,4-дисульфида, и кипятят с обратным холодильником в течение 5 часов. Реакционную смесь в вакууме упаривают досуха и очищают путем хроматографии на силикагеле марки MATREX Silica Si (фирма Amicon, Grace Company, размер частиц 20 мкм, колонка для высокопроизводительной жидкостной хроматографии) с использованием в качестве элюента смеси дихлорметана и этанола в соотношении 100:1.
Выход: 665 мг
Значение
Rf: 0,53 (из смеси петролейного эфира и сложного этилового эфира уксусной кислоты в соотношении 2:1)
MS (FAB): m/zz = 612 (4%, [M+Na]+), 590 (100%, [M+H]+,
529 (19%, М+ - AcOH).
Пример 152
N-[1-(R)-1-фенил-2-[(2-окси-ацет)-окси] - этил]амид 2-(S)-2-[4-(2,4-диметил- α
- карболин-9-ил)-метил-фенил]-2- циклопентил-уксусной кислоты
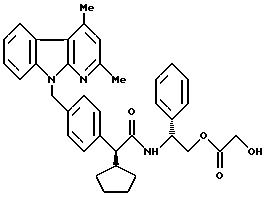
1,45 г (2,13 ммоль) соединения, полученного согласно примеру 145, в 100 мл тетрагидрофурана и в присутствии 5%-ного палладия на животном угле подвергают гидрированию при температуре 20oC и нормальном водородном давлении. По истечении 18 часов реакционную смесь отсасывают через кизельгур, неоднократно промывают метанолом и дихлорметаном, и объединенные органические растворы упаривают. Твердый остаток смешивают с пентаном, отсасывают, и остатки растворителя удаляют в высоком вакууме.
Значение Rf: 0,31 (из смеси петролейного эфира и сложного эфира уксусной кислоты в соотношении
1:1)
Пример 153
N-[1-(R)-1-фенил-2-окси-этил] -амид 2-(S)-2-[4- (2,4-диметил -α- карболин-9-ил)-метил-фенил]-2-циклопентил- тиоуксусной кислоты

Целевое соединение получают при температуре 20oC аналогично примеру 73 из соединения, полученного согласно примеру 151, в среде диметоксиэтана в качестве растворителя.
Значение Rf: 0,24 (из смеси дихлорметана и этанола в соотношении 50:1)
Пример
154
N-[1-(тиен-2-ил)-1-метоксикарбонил-метил] -амид 2-[4-(2,4-диметил -α- карболин-9-ил)-метил-фенил]-2- циклопентил-уксусной кислоты

Целевое соединение получают аналогично примерам 1, 2 и 3 из соединения, полученного согласно примеру LXII, и сложного (R, S)- (тиен-2-ил)-глицинметилового эфира.
Значение Rf: 0,67 (из смеси дихлорметана и этанола в соотношении 20:1)
Пример 155
N-[1-(тиен-2-ил)-2-окси-этил]-амид 2-[4-(2,4- диметил -α- карболин-9-ил)-метил-фенил]-2-циклопентил-уксусной кислоты

Целевое соединение получают аналогично примеру 70 из соединения, полученного согласно примеру 154.
Значение Rf: 0,21 (из смеси
дихлорметана и этанола в соотношении 50:1)
Пример 156
N-[1-(R)-1-фенил-2-(2,4,6-триметил-бензоил-окси) этил] -амид 2-(S)-2-[4-(2,4-диметил -α- карболин-9-ил)-метил- фенил]
-2-циклопентил-уксусной кислоты

Целевое соединение получают аналогично примеру 142 из соединения, полученного согласно примеру 2.
Значение Rf: 0,26 (из элюента D)
Пример 157
Сложный (R,S)-1-фенил-2-трифенилметилокси- этиловый эфир 2-(R,
S)-2-[4-(2,4-диметил -α- карболин-9-ил)- метил-фенил]-2-циклопентил-уксусной кислоты

1, 0 г (2,42 ммоль) соединения, полученного согласно примеру LXI, в 30 мл диметилформамида при температуре -30oC в течение 2 часов подвергают взаимодействию с 1 мл (7,27 ммоль) триэтиламина и 206 мкл (2,67 моль) мезилхлорида. Затем каплями добавляют раствор 1,1 г (2,9 ммоль) соединения, полученного согласно примеру CXI, и 296 мг (2,42 ммоль) диметиламинопиридина в 10 мл диметилформамида, и дополнительно размешивают в течение примерно 20 минут при медленном нагревании до 20oC. Для переработки реакционную смесь при размешивании подают в смесь простого эфира и воды, фазы разделяют, органическую фазу промывают водяным 1 М натровым щелоком и дополнительно промывают водой. Затем органическую фазу сушат над сульфатом магния и упаривают в конце в высоком вакууме.
Выход: 1,0 г
Значение Rf: 0,44 (из смеси петролейного эфира и сложного этилового эфира уксусной кислоты в соотношении 5:1)
Примеры 158 и 159
Сложный
1-(R, S)-1-фенил-2-трифенилметилокси-этиловый эфир 2-(R,S)-2-[4-(2,4-диметил -α- карболин-9-ил)-метил-фенил] -2-циклопентил-уксусной кислоты
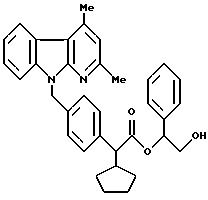
1,0 г (1,29 ммоль) соединения, полученного согласно примеру 157, размешивают в 10 мл тетрагидрофурана и 5 мл воды вместе с 5 мл трифторуксусной кислоты при температуре 20oC в течение 48 часов. Затем реакционную смесь перемешивают с 300 мл простого эфира и 200 мл водного раствора бикарбоната натрия, после прекращения выделения двуокиси углерода фазы разделяют, и органическую фазу экстрагируют буфером со значением pH 7 (фирмы Merck) и сушат над сульфатом магния. В результате упаривания растворителя получают сырой продукт, который очищают и разделяют на диастереомеры путем хроматографии на силикагеле (фирма Merck) с использованием в качестве элюента смеси петролейного эфира и сложного этилового эфира уксусной кислоты в соотношении 5:1.
рацемический диастереомер А):
Выход: 300 мг
Значение Rf: 0,54 (из смеси петролейного эфира и сложного этилового эфира уксусной
кислоты в соотношении 2:1)
рацемический диастереомер В):
Выход: 320 мг
Значение Rf: 0,42 (из смеси петролейного эфира и сложного этилового эфира уксусной кислоты
в соотношении 2:1)
Соединения, приведенные в таблице 17, получают по методу, описанному в примерах 1, 2 и 3.
Пример 185
[N-бензил-N-бензоил] -амид 2-(R, S)-2-[4-(2,
4-диметил -α- карболин-9-ил)-метил-фенил]-2-циклопентил-уксусной кислоты

2,0 г (4,8 ммоль) соединения, полученного согласно примеру LXI, в безводном диметилформамиде при температуре -30oC в течение часа подвергают взаимодействию с 0,74 мл (5,3 ммоль) триэтиламина и 0,41 мл (5,3 ммоль) мезилхлорида. Затем при температуре -30oC каплями добавляют раствор 1,07 г (5,1 ммоль) N- бензил-бензамида и 1,42 мл (10,2 ммоль) триэтиламина в 10 мл безводного диметилформамида, и при медленном нагревании до 20oC дополнительно размешивают в течение 16 часов. Реакционную смесь размешивают с простым эфиром и водой, фазы разделяют, и водную фазу дополнительно промывают после доведения до значения pH 4 соответственно 7. Объединенные органические растворы упаривают и очищают путем хроматографии на силикагеле 60 (фирма Merck) с использованием в качестве элюента сперва смеси дихлорметана и этанола в соотношении 60:1, а затем смеси петролейного эфира и сложного этилового эфира уксусной кислоты в соотношении 4:1.
Значение Rf: 0,58 (из смеси петролейного эфира и сложного этилового эфира уксусной кислоты в соотношении 2:1)
Пример 186
[N-бензоил] -амид 2-(R,S)-2-[4-(2,4-диметил -α
- карболин-9-ил)- метил-фенил]-2-циклопентил-уксусной кислоты

2,0 r (3,3 ммоль) соединения, полученного согласно примеру 185, подвергают взаимодействию в диоксане в присутствии 2 г 5%-ного палладия на животном угле при температуре 20oC и при водородном давлении примерно 1 бар. Затем отсасывают через фильтр типа Seitz, дополнительно промывают диоксаном, и фильтрат упаривают. Сырой продукт при температуре 60oC размешивают с метанолом, отсасывают при температуре 20oC, промывают холодным метанолом и сушат в вакууме над полупятиокисью фосфора.
Значение Rf: 0,49 (из смеси петролейного эфира и сложного этилового эфира
уксусной кислоты в соотношении 2:1)
Пример 187
N-[1-(R, S)-1-фенил-1-этокси-1-этоксикарбонил- метил] -амид 2-(R,S)-2-[4-(2,4-диметил -α- карболин- 9-ил)-метил-фенил]
-2-циклопентил-уксусной кислоты

Целевое соединение получают согласно примерам 1, 2 и 3 из соединения, полученного согласно примеру LXI.
Пример 188
N-[1-(R, S)-1-фенил-1-карбокси-метил]-амид 2-(R,S)-2-[4-(2,4-диметил -α
- карболин-9-ил)-метил-фенил]-2- циклопентил-уксусной кислоты

Целевое соединение получают согласно примеру 73 из соединения, полученного согласно примеру 187.
Пример 189
Сложный 1-(R,S)-2-окси-1-фенил-этиловый эфир 2-(R,S)-2-[4-(2,4-диметил- α
- карболин-9-ил)-метил-фенил]-2- циклопентил-тиоуксусной кислоты

1 г (2,42 ммоль) соединения, полученного согласно примеру LXI, в 30 мл диметилформамида при температуре -30oC в течение часа подвергают взаимодействию с 1 мл (7,27 ммоль) триэтиламина и 206 мкл (2,67 ммоль) мезилхлорида. Затем при указанной температуре каплями добавляют раствор 1-(R,S)-1-фенил-2-окси-тиоэтанола в 10 мл диметилформамида и дополнительно размешивают в течение часа. Для переработки реакционную смесь при размешивании подают в простой эфир и водный раствор бикарбоната натрия. Органическую фазу дополнительно промывают сперва буфером со значением pH 2, а затем буфером со значением pH 7, сушат над сульфатом магния и упаривают. Сырой продукт очищают путем хроматографии на силикагеле 60 (фирма Merck) с использованием в качестве элюента смеси петролейного эфира и сложного этилового эфира уксусной кислоты в соотношении 5:1.
Выход: 660 мг
Значение Rf: 0,58 (из смеси петролейного эфира и сложного этилового эфира уксусной кислоты в соотношении
2:1)
Нижеследующие примеры поясняют предлагаемую фармацевтическую композицию.
Пример 190
Таблетки состава: 20 мг соединения примера 5 в качестве активного вещества,
60 мг микрокристаллической целлюлозы (торговый продукт Авицел PH 101), 38 мг поливинилпирролидона под торговым названием Полиплаздон XL, 20 мг поливинилпирролидина с молярной массой 250, 1 мг
додецилсульфата натрия и 1 мг стеарата магния приготовляют следующим образом.
Соединение примера 5 диспергируют в жидкой среде, содержащей поливинилпирролидон с молярной массой 250 и додецилсульфат натрия. К получаемой дисперсии добавляют микрокристаллическую целлюлозу и поливнилпирролидон под названием Полиплаздон X, и получаемую смесь гранулируют в кипящем слое с последующей сушкой. Получаемые гранулы просеивают, после чего добавляют стеарат магния. Получаемую смесь перемешивают и перерабатывают в круглые таблетки весом 120 мг и диаметром 7 мм.
Пример
191
Соединение примера 5 микронизируют. Перед применением его суспендируют в воде.
Пример 192
Жидкий препарат состава: 0,1 мг/мл (жидкого препарата) соединения
примера 5 в качестве активного вещества, 10% этанола, 5% этоксилированного нонилфенола (торговый продукт Кремофор EL) и воды до 100% приготовляют следующим образом.
Активное вещество растворяют в этаноле при 60oC, добавляют этоксилированный нонилфенол и перемешивают. Затем медленно добавляют воду и охлаждают.
Реферат
Описываются новые производные циклоалкано-индола и азаиндола, смесь их изомеров или отдельные изомеры общей формулы I, их фармацевтически приемлемые соли, в которой R1 и R2 вместе со связывающей их двойной связью означают фенильное или пиридильное кольцо или кольцо формулы (А), в которой R8 - водород, C1-C4-алкил; R1, R4 вместе со связывающей их двойной связью означают фенильное кольцо или четырех- восьмичленный циклоалкеновый остаток, причем указанные для R1/R2 и R3/R4 кольца незамещены или замещены 1 - 3 одинаковыми или различными заместителями, выбранными из группы, включающей CF3, C1-C6 алкокси, C1-C6 алкоксикарбонил, C1-C6 алкил, возможно замещенный гидроксигруппой; D - водород, C4-C12 циклоалкил, C1-C12 алкил; Е - группа СО- или CS; L - О, S, - NR9; R9 - водород, C1 -C6 алкил, возможно замещенный фенилом, гидрокси; R5 - фенил, пиридил, тиенил, возможно замещенные, R6 - водород, карбоксигруппа, C1-C5 алкоксикарбонил, C1-C6алкил, возможно замещенный гидроксигруппой, -O-CO-R15, R15 - фенил, возможно замещенный, C1-C22 алкил, C2-C22алкенил; R7 - водород, R6 и R7 вместе означают группу формулы =О; описываются также промежуточные соединения, ингибирующая высвобождение ассоциированных с аполипопротеином В-100 липопротеинов фармацевтическая композиция. 3 с. и 2 з.п. ф-лы, 35 табл.
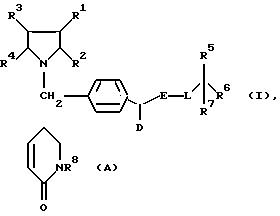
Формула
в которой R1 и R2 вместе со связывающей их двойной связью означает фенильное или пиридильное кольцо или кольцо формулы

в которой R8 - водород или неразветвленный или разветвленный алкил с 1 - 4 атомами углерода;
R3 и R4 вместе со связывающей их двойной связью означают фенильное кольцо или четырех-, восьмичленный циклоалкеновый остаток,
причем указанные для R1/R2 и R3/R4 кольца незамещены или замещены 1 - 3 одинаковыми или различными заместителями, выбранными из группы, включающей трифторметил, неразветвленную или разветвленную алкоксигруппу с 1 - 6 атомами углерода, неразветвленный или разветвленный алкоксикарбонил с 1 - 6 атомами углерода в алкоксильной части, неразветвленный или разветвленный алкил с 1 - 6 атомами углерода, незамещенный или замещенный гидроксигруппой;
D - водород, циклоалкил с 4 - 12 атомами углерода или неразветвленный или разветвленный алкил с 1 - 12 атомами углерода;
E - группа -CO- или -CS-,
L - атом кислорода, серы или группа -NR9, в которой R9 - водород или неразветвленный или разветвленный алкил с 1 - 6 атомами углерода, незамещенный или замещенный гидроксигруппой или фенилом;
R5 - фенил, пиридил, тиенил, незамещенные или замещенные 1 - 3 одинаковыми или различными заместителями, выбранными из группы, включающей нитрогруппу, карбоксигруппу, галоген, неразветвленный или разветвленный алкоксикарбонил с 1 - 6 атомами углерода в алкоксильной части, неразветвленный или разветвленный алкил с 1 - 6 атомами углерода, незамещенный или замещенный гидроксигруппой, и/или группу формулы -OR10 или -NR11R12, в которой R10 - водород или неразветвленный или разветвленный алкил с 1 - 6 атомами углерода или алкенил с 2 - 6 атомами углерода, а R11 и R12, одинаковые или различные, - водород, неразветвленный или разветвленный алкил с 1 - 6 атомами углерода или неразветвленный или разветвленный ацил с 1 - 8 атомами углерода, незамещенный или замещенный группой формулы -NR13R14, в которой R13 и R14, одинаковые или различные, - водород или неразветвленный или разветвленный ацил с 1 - 8 атомами углерода;
R6 - водород, карбоксигруппа, неразветвленный или разветвленный алкоксикарбонил с 1 - 5 атомами углерода в алкоксильной части или неразветвленный или разветвленный алкил с 1 - 6 атомами углерода, незамещенный или замещенный гидроксигруппой или группой формулы -O-CO-R15, в которой R15 - фенил, незамещенный или одно-, трехзамещенный неразветвленным или разветвленным алкилом с 1 - 5 атомами углерода, или неразветвленный или разветвленный алкил с 1 - 22 атомами углерода или алкенил с 2 - 22 атомами углерода, незамещенный или замещенный группой формулы -OR16, в которой R16 - водород, бензил или неразветвленный или разветвленный ацил с 1 - 6 атомами углерода;
R7 - водород или
R6 и R7 вместе означают группу формулы =O,
смесь их изомеров или их отдельные изомеры и их фармацевтически приемлемые соли.
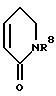
в которой R8 - водород или неразветвленный или разветвленный алкил с 1 - 3 атомами углерода;
R3 и R4 вместе со связывающей их двойной связью означают фенильное кольцо или циклопентен, циклогексен, циклогептен, циклооктен, причем указанные для R1/R2 и R3/R4 кольца незамещены или замещены 1 или 2 одинаковыми или различными заместителями, выбранными из группы, включающей трифторметил, неразветвленную или разветвленную алкоксигруппу с 1 - 4 атомами углерода, неразветвленный или разветвленный алкоксикарбонил с 1 - 4 атомами углерода в алкоксильной части и неразветвленный или разветвленный алкил с 1 - 4 атомами углерода, незамещенный или замещенный гидроксигруппой, D - водород, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил или неразветвленный или разветвленный алкил с 1 - 10 атомами углерода, E - группа -CO- или CS-, L - атом кислорода, серы или группа формулы -NR9, в которой R9 - водород или неразветвленный или разветвленный алкил с 1 - 5 атомами углерода, незамещенный или замещенный гидроксигруппой или фенилом, R5 - фенил, пиридил, тиенил, незамещенные или замещенные 1 или 2 одинаковыми или различными заместителями, выбранными из группы, включающей фтор, хлор, бром, неразветвленный или разветвленный алкоксикарбонил с 1 - 4 атомами углерода в алкоксильной части, неразветвленный или разветвленный алкил с 1 - 5 атомами углерода, незамещенный или замещенный гидроксигруппой, и/или группу формулы -OR10 или -NR11R12, в которых R10 - водород или неразветвленный или разветвленный алкил 1 - 4 атомами углерода или алкенил с 2 - 4 атомами углерода, а R11 и R12, одинаковые или различные, - водород, неразветвленный или разветвленный алкил с 1 - 5 атомами углерода или неразветвленный или разветвленный ацил с 1 - 6 атомами углерода, незамещенный или замещенный группой формулы -NR13R14, в которой R13 и R14, одинаковые или различные, - водород или неразветвленный или разветвленный ацил с 1 - 6 атомами углерода, R6 - водород, карбоксигруппа, неразветвленный или разветвленный
алкоксикарбонил с 1 - 4 атомами углерода в алкоксильной части или неразветвленный или разветвленный алкил с 1 - 5 атомами углерода, незамещенный или замещенный гидроксигруппой или группой формулы -O-CO-R15, в которой R15 - фенил, незамещенный или одно- трехзамещенный неразветвленным или разветвленным алкилом с 1 - 4 атомами углерода, или неразветвленный или разветвленный алкил с 1 - 20 атомами углерода или алкенил с 2 - 20 атомами углерода, незамещенный или замещенный группой формулы -OR16, в которой R16 - водород, бензил, или неразветвленный или разветвленный ацил с 1 - 5 атомами углерода, R7 - водород или R6 и R7 вместе означают группу формулы =O, смесь их изомеров или отдельные изомеры и их фармацевтически приемлемые соли.

в которой R8 - водород или метил,
R3 и R4 вместе со связывающей их двойной связью означают фенильное кольцо или циклопентен, циклогексен, циклогептен, циклооктен, причем указанные для R1/R2 и R3/R4 кольца незамещены или замещены 1 или 2 одинаковыми или различными заместителями, выбранными из группы, включающей трифторметил, неразветвленную или разветвленную алкоксигруппу с 1 - 3 атомами углерода, неразветвленный или разветвленный алкоксикарбонил с 1 - 3 атомами углерода в алкоксильной части и неразветвленный или разветвленный алкил с 1 - 3 атомами углерода, незамещенный или замещенный гидроксигруппой, D - водород, циклопентил, циклогексил, циклогептил, циклооктил или неразветвленный или разветвленный алкил с 1 - 6 атомами углерода, E - группа -CO- или CS-, L - атом кислорода, серы или группа формулы -NR9, в которой R9 - водород или неразветвленный или разветвленный алкил с 1 - 4 атомами углерода, незамещенный или замещенный гидроксигруппой или фенилом, R5 - фенил, пиридил, тиенил, незамещенные или замещенные 1 или 2 одинаковыми или различными заместителями, выбранными из группы, включающей нитрогруппу, карбоксигруппу, фтор, хлор, бром, неразветвленный или разветвленный алкоксикарбонил с 1 - 3 атомами углерода в алкоксильной части, неразветвленный или разветвленный алкил с 1 - 4 атомами углерода, незамещенный или замещенный гидроксигруппой, и/или группу формулы -OR10 или -NR11R12, в которых R10 - водород или неразветвленный или разветвленный алкил с 1 - 3 атомами углерода или алкенил с 2 - 3 атомами углерода, а R11 и R12, одинаковые или различные, - водород, неразветвленный или разветвленный алкил с 1 - 4 атомами углерода или неразветвленный или разветвленный ацил с 1 - 5 атомами углерода, незамещенный или замещенный
группой формулы -NR13R14, в которой R13 и R14, одинаковые или различные, - водород или неразветвленный или разветвленный ацил с 1 - 6 атомами углерода, R6 - водород, карбоксигруппа, неразветвленный или разветвленный алкоксикарбонил с 1 - 3 атомами углерода в алкоксильной части или неразветвленный или разветвленный алкил с 1 - 4 атомами углерода, незамещенный или замещенный гидроксигруппой или группой формулы -O-CO-R15, в которой R15 - фенил, незамещенный или одно- или трехкратно замещенный неразветвленным или разветвленным алкилом с 1 - 3 атомами углерода, или неразветвленный или разветвленный алкил с 1 - 19 атомами углерода или алкенил с 2 - 19 атомами углерода, незамещенный или замещенный группой формулы -OR16, в которой R16 - водород, бензил, или неразветвленный или разветвленный ацил с 1 - 4 атомами углерода, R7 - водород или R6 и R7 вместе означают группу формулы =O, смесь их изомеров или отдельные изомеры и их фармацевтически приемлемые соли.
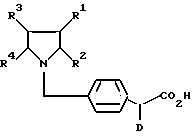
в которой R1 и R2 вместе со связывающей их двойной связью означают фенильное или пиридильное кольцо или кольцо формулы
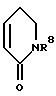
в которой R8 - водород или неразветвленный или разветвленный алкил с 1 - 4 атомами углерода,
R3 и R4 вместе со связывающей их двойной связью означают фенильное кольцо или четырех-, восьмичленный циклоалкеновый остаток, причем указанные для R1/R2 и R3/R4 кольца незамещены или замещены 1 - 3 одинаковыми или различными заместителями, выбранными из группы, включающей трифторметил, неразветвленную или разветвленную алкоксигруппу с 1 - 6 атомами углерода, неразветвленный или разветвленный алкоксикарбонил с 1 - 6 атомами углерода в алкоксильной части, неразветвленный или разветвленный алкил с 1 - 6 атомами углерода, незамещенный или замещенный гидроксигруппой, D - водород, циклоалкил с 4 - 12 атомами углерода или неразветвленный или разветвленный алкил с 1 - 12 атомами углерода, в качестве исходных соединений для получения производных циклоалканоиндола и азаиндола общей формулы (I) по пп.1 - 3.
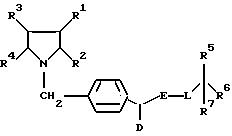
в которой R1 и R2 вместе со связывающей их двойной связью означают фенильное или пиридильное кольцо или кольцо формулы
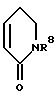
в которой R8 - водород или неразветвленный или разветвленный алкил с 1 - 4 атомами углерода,
R3 и R4 вместе со связывающей их двойной связью означают фенильное кольцо или четырех-, восьмичленный циклоалкеновый остаток, причем указанные для R1/R2 и R3/R4 кольца незамещены или замещены 1 - 3 одинаковыми или различными заместителями, выбранными из группы, включающей трифторметил, неразветвленную или разветвленную алкоксигруппу с 1 - 6 атомами углерода, неразветвленный или разветвленный алкоксикарбонил с 1 - 6 атомами углерода в алкоксильной части, неразветвленный или разветвленный алкил с 1 - 6 атомами углерода, незамещенный или замещенный гидроксигруппой, D - водород, циклоалкил с 4 - 12 атомами углерода или неразветвленный или разветвленный алкил с 1 - 12 атомами углерода, E - группа -CO- или -CS-, L - атом кислорода, серы или группа -NR9, в которой R9 - водород или неразветвленный или разветвленный алкил с 1 - 6 атомами углерода, незамещенный или замещенный гидроксигруппой или фенилом, R5 - фенил, пиридил, тиенил, незамещенные или замещенные 1 - 3 одинаковыми или различными заместителями, выбранными из группы, включающей нитрогруппу, карбоксигруппу, галоген, неразветвленный или разветвленный алкоксикарбонил с 1 - 6 атомами углерода в алкоксильной части, неразветвленный или разветвленный алкил с 1 - 6 атомами углерода, незамещенный или замещенный гидроксигруппой, и/или группу формулы -OR10 или -NR11R12, в которой R10 - водород или неразветвленный или разветвленный алкил с 1 - 6 атомами углерода или алкенил с 2 - 6 атомами углерода, а R11 и R12, одинаковые или различные, - водород, неразветвленный или разветвленный алкил с 1 - 6 атомами углерода или неразветвленный или разветвленный ацил с 1 - 8 атомами углерода, незамещенный или замещенный группой формулы -NR13R14, в которой R13 и R14, одинаковые или различные, -
водород или неразветвленный или разветвленный ацил с 1 - 8 атомами углерода, R6 - водород, карбоксигруппа, неразветвленный или разветвленный алкоксикарбонил с 1 - 5 атомами углерода в алкоксильной части или неразветвленный или разветвленный алкил с 1 - 6 атомами углерода, незамещенный или замещенный гидроксигруппой или группой формулы -O-CO-R15, в которой R15 - фенил, незамещенный или одно-, трехзамещенный неразветвленным или разветвленным алкилом с 1 - 5 атомами углерода, или неразветвленный или разветвленный алкил с 1 - 22 атомами углерода или алкенил с 2 - 22 атомами углерода, незамещенный или замещенный группой формулы -OR16, в которой R16 - водород, бензил, или неразветвленный или разветвленный ацил с 1 - 6 атомами углерода, R7 - водород или R6 и R7 вместе означают группу формулы =O, смесь их изомеров или их отдельный изомер в свободном виде или в виде фармацевтически приемлемой соли в эффективном количестве.

Комментарии