Композиции или пролекарства противомикробных и родственных противомикробным соединений, обладающие высокой проникающей способностью - RU2586287C2
Код документа: RU2586287C2
Чертежи




Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка является частичным продолжением и испрашивает приоритет на основании заявки на патент США №12/482373, поданной 10 июня 2009 года, которая включена в настоящую заявку посредством ссылки. Настоящая заявка также испрашивает приоритет согласно заявке на патент Китая №200910141944.X, поданной 10 июня 2009 года, которая включена в настоящую заявку посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[0002] Настоящее изобретение относится к области фармацевтических композиций, способных проникать через один или более биологических барьеров и к способам применения фармацевтических композиций для предотвращения, диагностирования и/или лечения у людей и животных состояний или заболеваний, поддающихся лечению с помощью противомикробных и родственных противомикробным соединений. Изобретение также относится к способам применения фармацевтических композиций для скрининга новых потенциальных лекарственных средств и к способам применения фармацевтических композиций для диагностирования состояния у биологического субъекта.
УРОВЕНЬ ТЕХНИКИ
[0003] Противомикробные средства представляют собой вещества, которые убивают или подавляют рост микроорганизмов, таких как бактерии, грибы или простейшие, а также уничтожают вирусы. Основные классы противомикробных средств включают, например, антибиотики, с помощью которых лечат связанные с бактериями состояния, противовирусные средства, с помощью которых лечат связанные с вирусами состояния, противогрибковые средства, с помощью которых лечат связанные с грибами состояния, и антипротозойные средства, с помощью которых лечат связанные с простейшими состояния.
[0004] Бета-лактамные антибиотики представляют собой класс антибиотиков, которые
содержат в своей молекулярной структуре ядро в виде четырехчленного бета-лактамного кольца. Более ста тысяч бета-лактамных антибиотиков были получены путем частичного или полного химического синтеза (L.A.Mitscher, et al., Antibiotic and Antimicrobial Drugs, in D.F.Smith, Ed., Handbook of Stereoisomers: Therapeutic Drugs, Boca Raton, FL, CRC Press, 1989; R.B.Morin and M. Gorman Eds., Chemistry and Biology of Beta-lactam Antibiotics, Volumes 1-3, New York, Academic Press, 1982; and A.L.Demain and N.A.Solomon, Eds., Antibiotics Containing the Beta-lactam Structure, Vols, 1 and 2, Handbook of experimental Pharmacology, vol.67, New York, Springer, 1983). Примеры бета-лактамных антибиотиков включают производные пенициллина, цефалоспорины, монобактамы, карбапенемы, ингибиторы бета-лактамаз, сульфонамид и хинолоны.
[0005] Наряду с широким применением противомикробных средств общей и серьезной проблемой их применения становится лекарственная устойчивость, так как патогены со временем мутируют. Следовательно, разработка новых противомикробных средств является неотложной и непростой задачей.
[0006] Многие виды противомикробных средств вводят путем внутривенной инфузии, внутримышечной инъекции, подкожным, буккальным, пероральным и ректальным путем. Пероральное введение имеет недостаток, который заключается в слабой абсорбции антибиотиков из желудочно-кишечного тракта. Внутривенный, подкожный и внутримышечный пути введения являются не только болезненными, но и требуют осуществления введения специалистами и могут приводить к другим рискам, таким как повреждение от инъекции, инфекция и другие травмы.
[0007] Одним из альтернативных способов введения лекарственного средства является местная доставка. Местная доставка лекарственного средства имеет несколько преимуществ. Указанный способ позволяет избежать инактивации лекарственного средства, обусловленной пресистемным метаболизмом в печени и желудочно-кишечном тракте. Он также обеспечивает местную доставку соответствующих концентраций лекарственного средства к намеченному месту действия без воздействия на весь организм. Фишманом (Fishman; Robert, патент США №7052715) была указана дополнительная проблема, связанная с медикаментозными средствами для перорального введения, которая заключается в том, что в кровотоке должны достигаться их значительные концентрации для эффективного лечения удаленных областей локализации боли, воспаления или инфекции. Указанные концентрации зачастую намного превышают концентрации, которые требовались бы в случае точной доставки лекарственных средств к конкретному месту локализации боли или повреждению. Для большинства противомикробных средств местное введение не может обеспечивать доставку эффективного терапевтического количества.
[0008] Следовательно, в данной области техники существует потребность в новых композициях, подходящих для действенной и эффективной доставки к месту действия состояния (например, заболевания) для предотвращения, облегчения или лечения состояний, а также минимизации нежелательных побочных эффектов.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0009] Один аспект настоящего изобретения направлен на пролекарство, обладающее высокой проникающей способностью (high penetration prodrug, HPP), или композицию, обладающую высокой проникающей способностью (high penetration composition, HPC), содержащую функциональный компонент, ковалентно связанный с транспортным компонентом через линкер. Термины «HPP» и «HPC» используются в настоящей заявке по отдельности или вместе и являются взаимозаменяемыми, если не указано иное.
[0010] Согласно конкретным вариантам реализации изобретения, функциональный компонент HPP или HPC содержит фрагмент исходного лекарственного средства, при этом требуется действенная и эффективная доставка исходного лекарственного средства биологическому субъекту и/или транспортировка исходного лекарственного средства через один или более биологических барьеров.
[0011] Согласно конкретным вариантам реализации изобретения, функциональный компонент может быть гидрофильным, липофильным или амфифильным (т.е. как гидрофильным, так и липофильным). Например, функциональный компонент может иметь липофильную природу сам по себе или может достигать липофильности путем превращения гидрофильных фрагментов функционального компонента в липофильные фрагменты. Согласно конкретным вариантам реализации изобретения, карбоксильная группа, аминогруппа, гуанидиновая группа или другая гидрофильная группа функционального компонента защищена алкильной, арильной, или гетероарилэфирной или амидной группой для придания HPP или HPC большей липофильности.
[0012] Согласно конкретным вариантам реализации изобретения, функциональный компонент HPP или HPC содержит фрагмент противомикробного или родственного противомикробному соединения. Противомикробное соединение представляет собой вещество, которое убивает или подавляет рост микроорганизмов, таких как бактерии, грибы или простейшие, а также уничтожает вирусы.
[0013] Родственное противомикробному соединение представляет собой соединение, содержащее противомикробную структуру, метаболит противомикробного соединения или агент, который может в ходе метаболизма превращаться в противомикробное средство или метаболит противомикробного средства после прохождения НРР или НРС через один или более биологических барьеров. Родственное противомикробному соединение также включает соединение, которое представляет собой аналог или миметик противомикробного средства или метаболита противомикробного средства или агент, который может в результате метаболизма превращаться в аналог или миметик противомикробного средства или метаболит противомикробного средства после прохождения НРР или НРС через один или более биологических барьеров.
[0014] Примеры противомикробных средств включают, например, антибиотики, с помощью которых лечат связанные с бактериями состояния, противовирусные средства, с помощью которых лечат связанные с вирусами состояния, противогрибковые средства, с помощью которых лечат связанные с грибами состояния и антипротозойные средства, с помощью которых лечат связанные с простейшими состояния.
[0015] Примеры антибиотиков включают, но не ограничиваются ими, бета-лактамные антибиотики, сульфонамиды и хинолоны. Примеры бета-лактамных антибиотиков включают, но не ограничиваются ими, производные пенициллина, цефалоспорины, пенемы, монобактамы, карбапенемы, ингибиторы бета-лактамаз и их комбинации. Примеры производных пенициллина включают, но не ограничиваются ими, аминопенициллины (например, амоксициллин, ампициллин и эпициллин); карбоксипенициллины (например, карбенициллин, тикарциллин и темоциллин); уреидопенициллины (например, азлоциллин, пиперациллин и мезлоциллин); мециллинам, сульбенициллин, бензатин пенициллин, пенициллин G (бензилпенициллин), пенициллин V (феноксиметилпенициллин), пенициллин О (аллилмеркаптометилпенициллин), прокаин пенициллин, оксациллин, метициллин, нафциллин, клоксациллин, диклоксациллин, флуклоксациллин, пивампициллин, гетациллин, бекампициллин, метампициллин, талампициллин, ко-амоксиклав (амоксициллин плюс клавулановая кислота) и пиперациллин. Примеры цефалоспоринов включают, но не ограничиваются ими, цефалексин, цефалотин, цефазолин, цефаклор, цефуроксим, цефамандол, цефотетан, цефокситин, цефоранид, цефтриаксон, цефотаксим, цефподоксим проксетил, цефтазидим, цефепим, цефоперазон, цефтизоксим, цефиксим и цефпиром. Примеры пенемов включают, но не ограничиваются ими, фаропенем. Примеры монобактамов включают, но не ограничиваются ими, азтреонам и тигемонам. Примеры карбапенемов включают, но не ограничиваются ими, биапенем, · дорипенем, · эртапенем, · имипенем, · меропенем · и панипенем. Примеры ингибиторов бета-лактамаз включают, но не ограничиваются ими, тазобактам (натриевую соль 4,4-диоксида [2Ы-(2альфа,3бета,5альфа)]-3-метил-7-оксо-3-(1Н-1,2,3-триазол-1-илметил)-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты), сульбактам (натриевую соль 4,4-диоксида (2S,5R)-3,3-диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты) и клавулановую кислоту ((2R,5R,Z)-3-(2-гидроксиэтилиден)-7-оксо-4-окса-1-аза-бицикпо[3.2.0]гептан-2-карбоновую кислоту). Другие примеры антибиотиков включают, но не ограничиваются ими, натриевую соль моно-(4-нитрофенил)-ового эфира [(N-бензилоксикарбониламино)метил]-фосфоновой кислоты, натриевую соль моно-(3-пиридинил)-ового эфира [(N-бензилоксикарбониламино)метил]-фосфоновой кислоты, сульфаниламид (4-аминобензолсульфонамид), сульфасалазин (6-оксо-3-(2-[4-(N-пиридин-2-илсульфамоил)фенил]гидразоно)циклогекса-1,4-диенкарбоновую кислоту), 1-циклопропил-6-фтор-4-оксо-7-пиперазин-1-ил-хинолин-3-карбоновую кислоту, налидиксовую кислоту (1-этил-7-метил-4-оксо-[1,8]нафтиридин-3-карбоновую кислоту).
[0016] Примеры сульфонамидов включают, но не ограничиваются ими, сульфаизодимидин, сульфаниламид, сульфадиазин, сульфизоксазол, сульфаметоксазол, сульфадиметоксин, сульфаметоксипиридазин, сульфацетамид, сульфадоксин, ацетазоламид, буметанид, хлорталидон, клопамид, фуросемид, гидрохлортиазид, индапамид, мефрузид, метолазон, ксипамид, дихлорфенамид, дорзоламид, ацетазоламид, этоксзоламид, сультиам, зонисамид, мафенид, целеококсиб, дарунавир, пробенецид, сульфасалазин и суматриптан.
[0017] Примеры хинолонов включают, но не ограничиваются ими, циноксацин, флумекин, налидиксовую кислоту, оксолиновую кислоту, пиромидовую кислоту, пипедимовую кислоту, розоксацин, ципрофлоксацин, эноксацин, флероксацин, ломефлоксацин, надифлоксацин, норфлоксацин, офлоксацин, пефлоксацин, руфлоксацин, балофлоксацин, гатифлоксацин, грепафлоксацин, левофлоксацин, моксифлоксацин, пазуфлоксацин, спарфлоксацин, темафлоксацин, тозуфлоксацин, клинафлоксацин, гемифлоксацин, ситафлоксацин, тровафлоксацин, прулифлоксацин, гареноксацин, эцинофлоксацин, делафлоксацин и налидиксовую кислоту.
[0018] Примеры противовирусных средств включают, но не ограничиваются ими, рифампицин, занамивир и осельтамивир.
[0019] Примеры противогрибковых средств включают, но не ограничиваются ими, полиеновые противогрибковые средства (например, натамицин, римоцидин, филипин, нистатин, амфотерицин В, кандицин), имидазольные противогрибковые средства (например, миконазол, кетоконазол, клотримазол, эконазол, бифоназол, бутоконазол, фентиконазол, изоконазол, оксиконазол, сертаконазол, сульконазол и тиоконазол), триазольные противогрибковые средства (например, флуконазол, итраконазол, изавуконазол, равуконазол, позаконазол, вориконазол и терконазол), тиазольные противогрибковые средства (например, абафунгин), аллиламины (например, тербинафин, аморолфин, нафтифин и бутенафин), эхинокандины (например, анидулафунгин, каспофунгин и микафунгин) и другие противогрибковые средства, такие как бензойная кислота, циклопирокс, толнафтат, ундециленовая кислота, флуцитозин, гризеофульвин, галопрогин.
[0020] Примеры антипротозойных средств включают, но не ограничиваются ими, элорнитин, фуразолидон, меларсопрол, метронидазол, орнидазол, паромомицин сульфат, пентамидин, пириметамин и тинидазол.
[0021] Согласно конкретным вариантам реализации изобретения, транспортный компонент НРР или НРС включает способную к протонированию группу амина, которая способна облегчать или усиливать транспортировку или прохождение НРР или НРС через один или более биологических барьеров. Согласно конкретным вариантам реализации изобретения, способная к протонированию группа амина является по существу протонированной при pH биологических барьеров, через которые НРР или НРС проникает. Согласно конкретным вариантам реализации изобретения, группа амина может быть обратимо протонирована или депротонирована.
[0022] Согласно конкретным вариантам реализации изобретения, линкер ковалентно связывает функциональный компонент с транспортным компонентом НРР и включает связь, которая способна расщепляться после прохождения НРР через один или более биологических барьеров. Способная к расщеплению связь включает, например, ковалентную связь, простую эфирную, простую тиоэфирную, амидную, сложноэфирную, сложную тиоэфирную, карбонатную, карбаматную, фосфатную или оксимную связь.
[0023] Согласно конкретным вариантам реализации изобретения, НРР или НРС противомикробного или родственного противомикробному соединения включает одну или две группы первичного, вторичного или третичного амина, которые находятся в протонированной форме при физиологическом pH. Согласно конкретным вариантам реализации изобретения, НРР или НРС включает одну группу первичного, вторичного или третичного амина, которые находятся в протонированной форме при физиологическом pH.
[0024] Согласно другому аспекту, изобретение относится к фармацевтической композиции, содержащей по меньшей мере одно НРР или НРС противомикробного или родственного противомикробному соединения и фармацевтически приемлемый носитель.
[0025] Согласно другому аспекту, изобретение относится к способу проникновения через биологический барьер с использованием НРР или НРС антибактериального или родственного противомикробному соединения.
[0026] Согласно другому аспекту, изобретение относится к способу диагностирования появления, развития или повторного возникновения состояния у биологического субъекта с использованием НРР или НРС противомикробного или родственного противомикробному соединения. Согласно конкретным вариантам реализации изобретения, НРР (или НРС) или их функциональный компонент поддается обнаружению. Согласно конкретным вариантам реализации изобретения, НРР или функциональный компонент НРР поддается обнаружению как таковой, является меченным или конъюгированным с поддающимся обнаружению маркером.
[0027] Согласно другому аспекту, изобретение относится к способу скрининга функциональных компонентов, линкеров или транспортных компонентов на предмет желаемых характеристик.
[0028] Согласно другому аспекту, изобретение относится к способу предотвращения, облегчения или лечения состояния у биологического субъекта путем введения субъекту композиции в соответствии с изобретением. Согласно конкретным вариантам реализации изобретения, способ относится к лечению состояния у субъекта, поддающегося лечению с помощью противомикробных или родственных противомикробном соединений, путем введения субъекту терапевтически эффективного количества НРР противомикробного или родственного противомикробному соединения или его фармацевтической композиции. Согласно конкретным вариантам реализации изобретения, поддающиеся лечению согласно способу состояния включают, но не ограничиваются ими, боль, повреждения и связанные с микроорганизмами состояния. Связанные с микроорганизмами состояния представляют собой состояния, которые вызваны такими микроорганизмами, как бактерии, грибы, простейшие и вирусы. Например, состояния, вызванные бактериями (связанные с бактериями состояния), состояния, вызванные простейшими (связанные с простейшими состояния), состояния, вызванные грибами (связанные с грибами состояния) и состояния, вызванные вирусами (связанные с вирусами состояния). Связанные с бактериями состояния включают, например, инфекции (например, вызванное инфекцией состояние в органе, таком как печень, легкое, желудок, мозг, почка, сердце, ухо, глаз, нос, рот, язык, толстая кишка, поджелудочная железа, желчный пузырь, двенадцатиперстная кишка, прямая кишка, желудок, ободочная и прямая кишка, кишечник, вена, дыхательная система, сосудистая система, аноректальный и анальный зуд, респираторные инфекции, инфекции верхних дыхательных путей, инфекции мочевыводящих путей, больничные инфекции, псевдомонадную инфекцию, коагулаза-положительные стафилококковые инфекции (например, кожную инфекцию, вызванное токсином заболевание, острый инфекционной эндокардит, септицемию, некротизирующую пневмонию), инфекции, связанные с имплантированными протезами, вызванные условно-патогенными микроорганизмами инфекции с септицемией и пневмонией), чуму (например, бубонную чуму и легочную чуму), сибирскую язву (например, кожную форму сибирской язвы, легочную форму сибирской язвы и желудочно-кишечную форму сибирской язвы), болезни Лайма, бруцеллез, коклюш, острый энтерит, пситтакоз, негонококковый уретрит, трахому, конъюнктивит с включениями новорожденного, венерическую лимфогранулему, псевдомембранозный колит, газовую гангрену, пищевое отравление, анаэробный целлюлит, дифтерию, диарею, менингит у детей, геморрагический колит, гемолитический уремический синдром, туляремию, пневмонию, бронхит, пептическую язву, болезнь легионеров, понтиакскую лихорадку, лептоспироз, листериоз, проказу, туберкулез, микоплазменную пневмонию, гонорею, офтальмию новорожденных, септический артрит, менингококковую инфекцию, синдром Фридериксена-Уотерхауза, пятнистую лихорадку Скалистых гор, брюшнотифозный сальмонеллез, сальмонеллез с гастроэнтеритом и энтероколитом, бактериальную дизентерию, шигеллез, цистит, менингит, септицемию, эндометрит, отит среднего уха, синусит, сифилис, некротизирующий фасциит, стрептококковый фарингит, скарлатину, ревматическую атаку, импетиго, рожу, послеродовую лихорадку и холеру. Связанные с простейшими состояния включают, например, малярию, сонную болезнь и токсоплазмоз. Связанные с грибами состояния включают, например, аспергиллез, бластомикоз, стригущий лишай, кандидоз, кокцидиоидомикоз, криптококкоз, гистоплазмоз, паракокцидиомикоз, споротрихоз и зигомикоз. Связанные с вирусами состояния включают, например, грипп, желтую лихорадку и СПИД.
[0029] Согласно конкретным вариантам реализации изобретения, фармацевтическую композицию НРР или НРС вводят биологическому субъекту различными путями, включая (но не ограничиваясь указанными) пероральный, энтеральный, буккальный, назальный, местный, ректальный, вагинальный, аэрозольный, трансмукозальный, эпидермальный, трансдермальный, дермальный, офтальмический, легочный, подкожный и/или парентеральный способ введения. Согласно конкретным предпочтительным вариантам реализации изобретения, фармацевтическую композицию НРР или НРС вводят перорально, трансдермально, местно, подкожно и/или парентерально.
[0030] В соответствии с преимуществами изобретения, не желая быть ограниченными каким-либо конкретным механизмом, терапевтически эффективное количество НРР или НРС может быть введено местно к месту локализации состояния в высокой концентрации, что приводит к снижению общей дозы по сравнению с системным введением. Преимущества изобретения также включают, например, отсутствие необходимости системного введения, снижение побочных эффектов (например, боли при инъекции, явлений со стороны желудочно-кишечного тракта/почек и других побочных эффектов) и возможные новые способы лечения благодаря высокой местной концентрации НРР, НРС или активного агента. Преимущества также включают, например, системное введение НРР или НРС биологическому субъекту с достижением более быстрой и более эффективной биодоступности, прохождение через труднопреодолимые биологические барьеры (например, гематоэнцефалический барьер и гематомолочный барьер) и новые способы лечения благодаря прохождению через биологические барьеры.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0031] Фигура 1а1: Суммарные количества гидрохлорида 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты (А), гидрохлорида 2-диметиламиноэтилового эфира аллилмеркаптометилпенициллиновой кислоты (В), гидрохлорида 2-дипропиламиноэтилового эфира 6-(2,6-диметоксибензамидо)пенициллиновой кислоты (С), гидрохлорида 4-пиперидинэтилового эфира 6-(5-метил-3-фенил-2-изоксазолин-4-карбоксамидо)пенициллиновой кислоты (D), гидрохлорида 3-пиперидинэтилового эфира 6-[3-(o-хлорфенил)-5-метил-4-изоксазолкарбоксамидо]пенициллиновой кислоты (Е), гидрохлорида 1-пиперидинэтилового эфира 6-[3-(2,6-дихлорфенил)-5-метил-4-изоксазолкарбоксамидо]пенициллиновой кислоты (F), пенициллина V (G), пенициллина О (Н), метициллина (I), оксациллина (J), клоксациллина (К) и диклоксациллина (L), проходящие через изолированную ткань кожи человека в ячейках Франца (n=5). В каждом случае наполнитель представлял собой фосфатный буфер (0,2 М), имеющий pH 7,4.
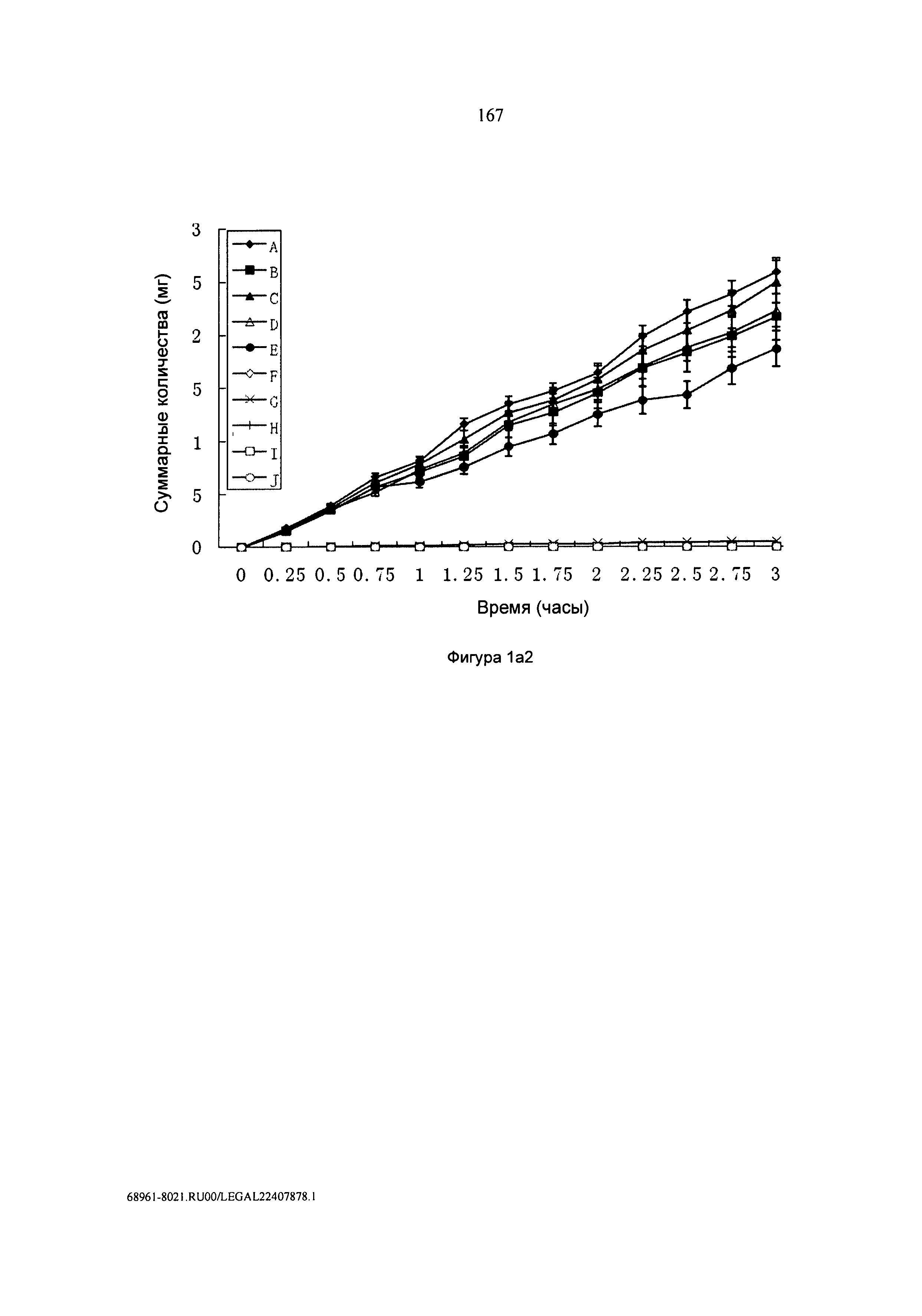
[0032] Фигура 1а2: Суммарные количества гидрохлорида этилового эфира 6-[D(-)-α-аминофенилацетамидопенициллиновой кислоты (А), гидрохлорида D-α-[(имидазолидин-2-он-1-ил)карбониламино]бензилпенициллин-2-пирролидинметилового эфира (В), гидрохлорида пирролидинэтилового эфира 6R-[2-[3-(метилсульфонил)-2-оксо-1-имидазолидинкарбоксамидо]-2-фенилацетамидо]пенициллиновой кислоты 1-(С), гидрохлорида 2-диэтиламиноэтилового эфира 6-D(-)-α-(4-этил-2,3-диоксо-1-пиперазинилкарбониламино)-α-фенилацетамидопенициллиновой кислоты (D), гидрохлорида 2-диэтиламиноэтилового эфира 7-(2-тиенилацетамидо)цефалоспорановой кислоты (Е), ампициллина (F), азлоциллина (G), мезлоциллина (Н), пиперациллина (I) и цефалотина (J), проходящих через изолированную ткань кожи человека в ячейках Франца (n=5). В каждом случае наполнитель представлял собой фосфатный буфер (0,2 М), имеющий pH 7,4
[0033] Фигура 1а3: Суммарные количества гидрохлорида 2-диэтиламиноэтилового эфира 7-[(гидроксифенилацетил)амино]-3-[[(1-метил-1Н-тетразол-5-ил)тио]метил]-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты (А), гидрохлорида 2-диэтиламиноэтилового эфира 3-[[(аминокарбонил)окси]метил]-7-[[2-фуранил(метоксиимино)ацетил]амино]-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты (В), гидрохлорида 2-диэтиламиноэтилового эфира 3-[[(аминокарбонил)окси]метил]-7-метокси-8-оксо-7-[(2-тиенилацетил)амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты (С), гидрохлорида 2-диэтиламиноэтилового эфира 7-[[[2-(ацетиламинометил)фенил]ацетил]амино]-3-[[[1-(этоксилкарбонилметил)-1Н-тетразол-5-ил]тио]метил]-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты (D), гидрохлорида 2-диэтиламиноэтилового эфира 7-[(ацетиламинофенилацетил)амино]-3-хлор-8-оксо-5-тиа-1- азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты (Е), цефамандола (F), цефуроксима (G), цефокситина (Н), цефоранида (I) и цефаклора (J), проходящих через изолированную ткань кожи человека в ячейках Франца (n=5). В каждом случае наполнитель представлял собой фосфатный буфер (0,2 М), имеющий pH 7,4.
[0034] Фигура 1а4: Суммарные количества гидрохлорида 2-диэтиламиноэтилового эфира 3-[(ацетилокси)метил]-7-[[(2-ацетиламино-4-тиазолил)(метоксиимино)ацетил]амино]-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты (А), гидрохлорида 2-диэтиламиноэтилового эфира 7-[[(2-ацетиламино-4-тиазолил)(метоксиимино)ацетил]амино]-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты (В), гидрохлорида 2-диэтиламиноэтилового эфира 7-[[[[(4-этил-2,3-диоксо-1-пиперазинил)карбонил]амино](4-ацетоксифенил)ацетил]амино]-3-[[(1-метил-1Н-тетразол-5-ил)тио]метил]-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты (С), гидрохлорида 2-диэтиламиноэтилового эфира 7-[2-(2-ацетиламино-4-тиазолил)-2-((7)-метоксиимино)ацетамидо]-3-(метоксиметил)-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты (D), гидрохлорида 2-диэтиламиноэтилового эфира 7-[2-(2-ацетиламино-4-тиазолил)-2-((Z)-этоксикарбонилметокси)имино]ацетамидо]-3-(винил)-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты (Е), цефотаксима (F), цефтизоксима (G), цефоперазона (Н), проксетила цефподоксима (I) и цефиксима (J), проходящих через изолированную ткань кожи человека в ячейках Франца (n=5). В каждом случае наполнитель представлял собой фосфатный буфер (0,2 М), имеющий pH 7,4.
[0035] Фигура 1b: Суммарные количества натриевой соли 4,4-диоксида [2S-(2альфа,3бета,5альфа)]-3-метил-7-оксо-3-(1Н-1,2,3-триазол-1-илметил)-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты (тазобактама, F), HCl соли 1-пиперидинэтилового эфира 4,4-диоксида [2S-(2альфа,3бета,5альфа)]-3-метил-7-оксо-3-(1Н-1,2,3-триазол-1-илметил)-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты (тазобактам-PEE, А), натриевой соли 4,4-диоксида (25,5Р)-3,3-диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты (сульбактам, G), HCl соли N,N-диэтиламиноэтилового эфира (25,5Р)-3,3-диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты (сульбактам-DEE, В), (2R,5R,Z)-3-(2-гидроксиэтилиден)-7-оксо-4-окса-1-аза-бицикло[3.2.0]гептан-2-карбоновой кислоты (клавулановой кислоты, Н), HCI соли 4-пиперидинэтилового эфира (2R,5R,2)-3-(2-гидроксиэтилиден)-7-оксо-4-окса-1-аза-бицикло[3.2.0]гептан-2-карбоновой кислоты (клавулановой кислоты-PEE, С), натриевой соли моно-(4-нитрофенил)-ового эфира [(N-бензилоксикарбониламино)метил]-фосфоновой кислоты (I), HCl соли (4-нитрофенил)(N,N-диэтиламинометил)-ового эфира [(N-бензилоксикарбониламино)метил]-фосфоновой кислоты (D), натриевой соли моно-(3-пиридинил)-ового эфира [(N-бензилоксикарбониламино)метил]-фосфоновой кислоты (J) и HCl соли (3-пиридинил)(1-пиперидинил)-ового эфира [(N-бензилоксикарбониламино)метил]-фосфоновой кислоты (Е), проходящих через изолированную ткань кожи человека в ячейках Франца (n=5). В каждом случае наполнитель представлял собой фосфатный буфер (0,2 М), имеющий pH 7,4.
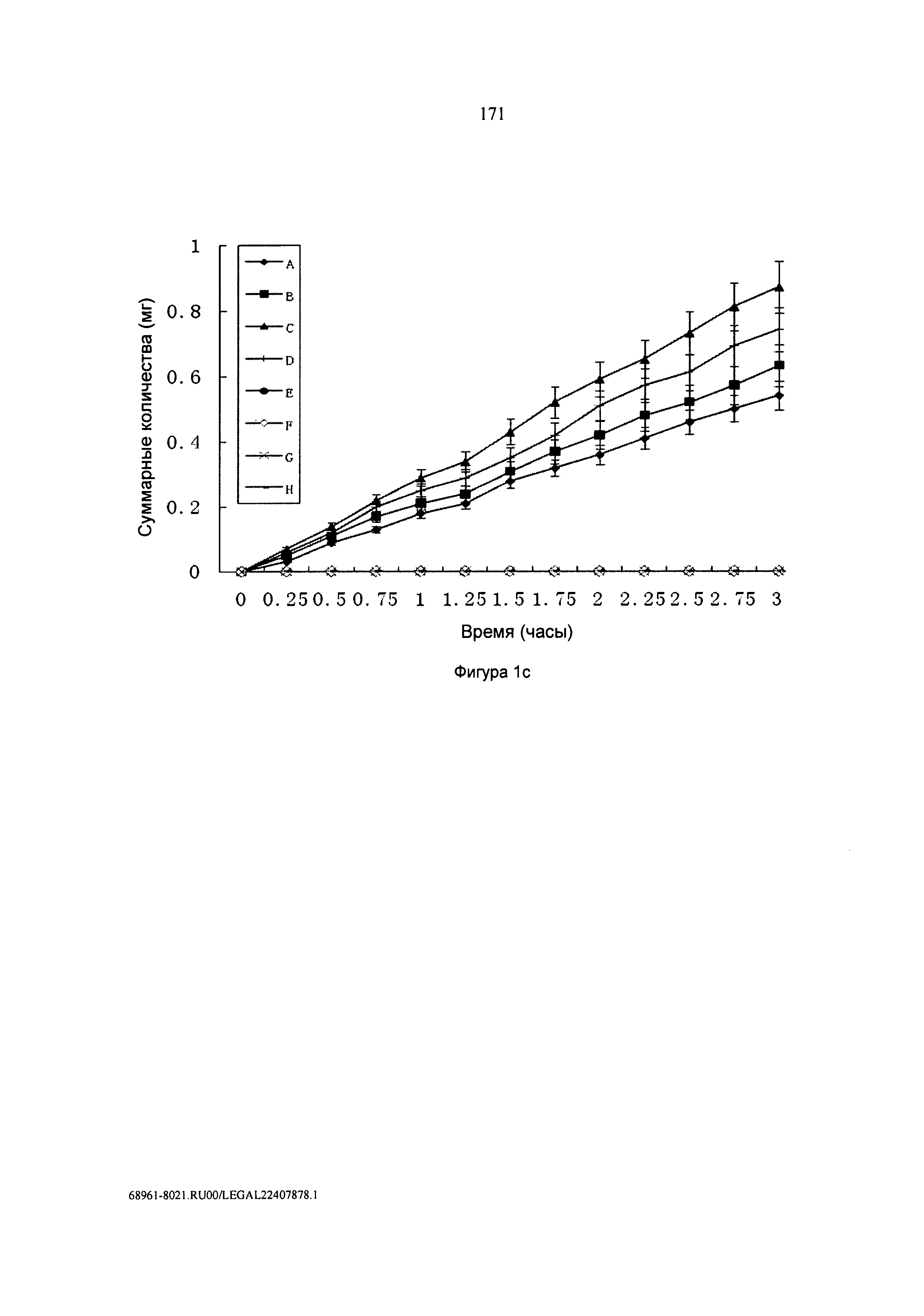
[0036] Фигура 1 с: Суммарные количества 4-аминобензолсульфонамида (сульфаниламида, Е), HCl соли 4-(4-диметиламинобутирил)амидобензолсульфонамида (DMAB-сульфаниламида, А), 6-оксо-3-(2-[4-(N-пиридин-2-илсульфамоил)фенил]гидразоно)циклогекса-1,4-диенкарбоновой кислоты, 6-оксо-3-(2-[4-(N-пиридин-2-илсульфамоил)фенил]гидразоно)циклогекса-1,4-диенкарбоновой кислоты (сульфасалазина, F), HCl соли N,N-диэтиламинопропилового эфира 6-оксо-3-(2-[4-(N-пиридин-2-илсульфамоил)фенил]гидразоно)циклогекса-1,4-диенкарбоновой кислоты (сульфасалазина-DEPE, В), 1-циклопропил-6-фтор-4-оксо-7-пиперазин-1-ил-хинолин-3-карбоновой кислоты (ципрофлоксацина, G), HCl соли бутилового эфира 1-циклопропил-6-фтор-4-оксо-7-пиперазин-1-ил-хинолин-3-карбоновой кислоты (ципрофлоксацина-BE, С), 1-этил-7-метил-4-оксо-[1,8]нафтиридин-3-карбоновой кислоты (налидиксовой кислоты, Н), HCl соли N,N-диэтиламиноэтилового эфира 1-этил-7-метил-4-оксо-[1,8]нафтиридин-3-карбоновой кислоты (налидиксовой кислоты-DEE, D), проходящих через изолированную ткань кожи человека в ячейках Франца (n=5). В каждом случае наполнитель представлял собой фосфатный буфер (0,2 М), имеющий pH 7,4.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. Структуры пролекарств. обладающих высокой проникающей способностью (НРР). или композиций, обладающих высокой проникающей способностью (НРС).
[0037] Согласно одному аспекту, изобретение относится к пролекарству, обладающему высокой проникающей способностью (НРР), или композиции, обладающей высокой проникающей способностью (НРС). Термин «пролекарство, обладающее высокой проникающей способностью», или «НРР», или «композиция, обладающая высокой проникающей способностью», или «НРС», в настоящей заявке относится к композиции, содержащей функциональный компонент, ковалентно связанный с транспортным компонентом через линкер.
[0038] Функциональный компонент НРР или НРС, который содержит фрагмент исходного лекарственного средства, имеет следующие свойства: 1) доставка исходного лекарственного средства или НРР/НРС биологическому субъекту и/или транспортировка исходного лекарственного средства через биологический барьер является/являются желаемыми, 2) НРР/НРС способна проникать или проходить через биологический барьер и 3) НРР/НРС способна расщепляться таким образом, чтобы фрагмент исходного лекарственного средства превратился в исходное лекарственное средство или метаболит исходного лекарственного средства.
[0039] Согласно конкретным вариантам реализации изобретения, функциональный компонент может быть гидрофильным, липофильным или амфифильным (гидрофильным и липофильным). Липофильный фрагмент функционального компонента может быть липофильным сам по себе или достигать липофильности путем превращения одного или более гидрофильного фрагмента функционального компонента в липофильные фрагменты. Например, липофильный фрагмент функционального компонента получают путем превращения одной или более гидрофильных групп функционального компонента в липофильные группы посредством органического синтеза. Примеры гидрофильной группы включают, но не ограничиваются ими, карбокильные, гидроксильные, тиоловые, аминные, фосфат/фосфонатные, гуанидиновые и карбонильные группы. Липофильные фрагменты, полученные посредством модификации указанных гидрофильных групп включают, но не ограничиваются ими, простые эфиры, простые тиоэфиры, сложные эфиры, сложные тиоэфиры, карбонаты, карбаматы, амиды фосфаты и оксимы. Согласно конкретным вариантам реализации изобретения, функциональный компонент липофилизируется посредством ацетилирования или ацилирования (алканоилирования). Согласно конкретным вариантам реализации изобретения, функциональный компонент липофилизируется посредством этерификации.
[0040] Согласно конкретным вариантам реализации изобретения, исходное лекарственное средство в НРР или НРС выбрано из группы, состоящей из противомикробного и родственного противомикробному соединения. Фрагмент противомикробного или родственного противомикробному соединения может быть дополнительно превращен в липофильный фрагмент, как описано выше.
[0041] Противомикробные средства представляют собой вещества, которые убивают или подавляют рост микроорганизмов, таких как бактерии, грибы, или простейшие, наряду с разрушением или подавлением роста вирусов. Основные классы противомикробных средств включают, например, антибиотики, с помощью которых лечат связанные с бактериями состояния, противовирусные средства, с помощью которых лечат связанные с вирусами состояния, противогрибковые средства, с помощью которых лечат связанные с грибами состояния и противопаразитарные средства, с помощью которых лечат связанные с паразитами состояния.
[0042] Родственное противомикробному соединение представляет собой соединение, включающее структуру противомикробного соединения, метаболит противомикробного соединения или агент, который может в результате метаболизма превращаться в противомикробное соединение или метаболит противомикробного соединения после прохождения НРР или НРС через один или более биологических барьеров. Родственное противомикробному соединение также включает соединение, которое является аналогом или миметиком противомикробного соединения или метаболита противомикробного соединения или агентом, который может в ходе метаболизма превращаться в аналог или миметик противомикробного соединения или метаболита противомикробного соединения после прохождения НРР или НРС через один или более биологических барьеров.
[0043] Примеры противомикробных соединений включают, например, антибиотики, с помощью которых лечат связанные с бактериями состояния, противовирусные средства, с помощью которых лечат связанные с вирусами состояния, противогрибковые средства, с помощью которых лечат связанные с грибами состояния, и антипротозойные средства, с помощью которых лечат связанные с простейшими состояния.
[0044] Примеры антибиотиков включают, но не ограничиваются ими, бета-лактамные антибиотики, сульфонамиды и хинолоны. Бета-лактамные антибиотики хорошо известны в данной области техники и применяются по отношению к различным состояниям. В настоящей заявке, термин «бета-лактамные антибиотики» относятся к соединению, которое включает бета-лактамное ядро.
[0045] Примеры бета-лактамных антибиотиков включают, но не ограничиваются ими, производные пенициллина, цефалоспорины, пенемы, монобактамы, карбапенемы, ингибиторы бета-лактамаз и их комбинации. Примеры производных пенициллина включают, но не ограничиваются ими, аминопенициллины (например, амоксициллин, ампициллин и эпициллин), карбоксипенициллины (например, карбенициллин, тикарциллин и темоциллин), уреидопенициллины (например, азлоциллин, пиперациллин и мезлоциллин), мециллинам, сульбенициллин, бензатин пенициллин, пенициллин G (бензилпенициллин), пенициллин V (феноксиметилпенициллин), пенициллин О (аллилмеркаптометилпенициллин), прокаин пенициллин, оксациллин, метициллин, нафциллин, клоксациллин, диклоксациллин, флуклоксациллин, пивампициллин, гетациллин, бекампициллин, метампициллин, талампициллин, ко-амоксиклав (амоксициллин плюс клавулановая кислота) и пиперациллин. Примеры цефалоспоринов включают, но не ограничиваются ими, цефалексин, цефалотин, цефазолин, цефаклор, цефуроксим, цефамандол, цефотетан, цефокситин, цефоранид, цефтриаксон, цефотаксим, цефподоксим проксетил, цефтазидим, цефепим, цефоперазон, цефтизоксим, цефиксим и цефпиром. Примеры пенемов включают, но не ограничиваются ими, фаропенем. Примеры монобактамов включают, но не ограничиваются ими, азтреонам и тигемонам. Примеры карбапенемов включают, но не ограничиваются ими, биапенем, · дорипенем, · эртапенем, · имипенем, · меропенем · и панипенем. Примеры ингибиторов бета-лактамаз включают, но не ограничиваются ими, тазобактам (натриевую соль 4,4-диоксида [2S-(2альфа,Збета,5альфа)]-3-метил-7-оксо-3-(1Н-1,2,3-триазол-1-илметил)-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты), сульбактам (натриевую соль 4,4-диоксида (25,5Р)-3,3-диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты) и клавулановую кислоту ((2R,5R,Z)-3-(2-гидроксиэтилиден)-7-оксо-4-окса-1-аза-бицикло[3.2.0]гептан-2-карбоновую кислоту). Другие примеры антибиотиков включают, но не ограничиваются ими, натриевую соль моно-(4-нитрофенил)-ового эфира [(N-бензилоксикарбониламино)метил]-фосфоновой кислоты, натриевую соль моно-(3-пиридинил)-ового эфира [(N-бензилоксикарбониламино)метил]-фосфоновой кислоты, сульфаниламид (4-аминобензолсульфонамид), сульфасалазин (6-оксо-3-(2-[4-(N-пиридин-2-илсульфамоил)фенил]гидразоно)циклогекса-1,4-диенкарбоновую кислоту), 1-циклопропил-6-фтор-4-оксо-7-пиперазин-1-ил-хинолин-3-карбоновую кислоту и налидиксовую кислоту (1-этил-7-метил-4-оксо-[1,8]нафтиридин-3-карбоновую кислоту).
[0046] Примеры сульфонамидов включают, но не ограничиваются ими, сульфаизодимидин, сульфаниламид, сульфадиазин, сульфизоксазол, сульфаметоксазол, сульфадиметоксин, сульфаметоксипиридазин, сульфацетамид, сульфадоксин, ацетазоламид, буметанид, хлорталидон, клопамид, фуросемид, гидрохлортиазид, индапамид, мефрузид, метолазон, ксипамид, дихлорфенамид, дорзоламид, ацетазоламид, этоксзоламид, сультиам, зонисамид, мафенид, целеококсиб, дарунавир, пробенецид, сульфасалазин и суматриптан.
[0047] Примеры хинолонов включают, но не ограничиваются ими, циноксацин, флумекин, налидиксовую кислоту, оксолиновую кислоту, пиромидовую кислоту, пипедимовую кислоту, розоксацин, ципрофлоксацин, эноксацин, флероксацин, ломефлоксацин, надифлоксацин, норфлоксацин, офлоксацин, пефлоксацин, руфлоксацин, балофлоксацин, гатифлоксацин, грепафлоксацин, левофлоксацин, моксифлоксацин, пазуфлоксацин, спарфлоксацин, темафлоксацин, тозуфлоксацин, клинафлоксацин, гемифлоксацин, ситафлоксацин, тровафлоксацин, прулифлоксацин, гареноксацин, эцинофлоксацин, делафлоксацин и налидиксовую кислоту.
[0048] Примеры противовирусных средств включают, но не ограничиваются ими, рифампицин, занамивир и осельтамивир.
[0049] Примеры противогрибковых средств включают, но не ограничиваются ими, полиеновые противогрибковые средства (например, натамицин, римоцидин, филипин, нистатин, амфотерицин В и кандицин), имидазольные противогрибковые средства (например, миконазол, кетоконазол, клотримазол, эконазол, бифоназол, бутоконазол, фентиконазол, изоконазол, оксиконазол, сертаконазол, сульконазол и тиоконазол), триазольные противогрибковые средства (например, флуконазол, итраконазол, изавуконазол, равуконазол, позаконазол, вориконазол и терконазол), тиазольные противогрибковые средства (например, абафунгин), аллиламины (например, тербинафин, аморолфин, нафтифин и бутенафин), эхинокандины (например, анидулафунгин, каспофунгин и микафунгин) и другие противогрибковые средства, такие как бензойная кислота, циклопирокс, толнафтат, ундециленовая кислота, флуцитозин, гризеофульвин и галопрогин.
[0050] Примеры антипротозойных средств включают, но не ограничиваются ими, элорнитин, фуразолидон, меларсопрол, метронидазол, орнидазол, сульфат паромомицина, пентамидин, пириметамин и тинидазол.
[0051] Согласно конкретным вариантам реализации изобретения, функциональный компонент НРР противомикробного или родственного противомикробному соединения включает фрагмент, имеющий структуру согласно Структуре F-1:

включая ее стереоизомеры и фармацевтически приемлемые соли.
[0052] Если иное не указано в настоящей заявке, Y выбран из группы, состоящей из Н, ОН, NHCHO, NHC(=O)R6, ОС(=O)СН3, OC(=O)R6, ОСН3, OC2H5, OR6, СН3, C2H5, R6, CH3SO3, R6SO3, NO2, CN, CF3, C2F5, C3F7, OCF3, OC2F5, OC3F7, F, Br, I, Cl и замещенного и незамещенного алкилоксила;




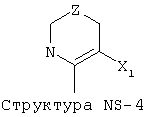
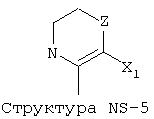
X1 выбран из группы, состоящей из Н, ОН, ОСН3, OC2H5, OR6, C(=O)NH2, CH2OC(=O)NH2, CH2OC(=O)СН3, CH2OC(=O)R6, ОС(=O)СН3, ОС(=O)R6, СН2ОСН3, СН3, C2H5, R6, Cl, F, Br, I, НС=СНСН3, НС=СН2, CH2OCH3, CH2OR6, S(CH2)n-NHR7, Структуры X1-1, Структуры X1-2, Структуры X1-3, Структуры X1-4, Структуры X1-5, Структуры X1-6, Структуры X1-7, Структуры X1-8, Структуры X1-9, Структуры X1-10, Структуры X1-11, Структуры X1-12, Структуры X1-13, Структуры X1-14, Структуры X1-15, Структуры X1-16, Структуры X1-17, Структуры X1-18, Структуры X1-19, Структуры X1-20, Структуры X1-21, Структуры X1-22, Структуры X1-23, Структуры X1-24, Структуры X1-25, Структуры X1-26, Структуры X1-27, Структуры X1-28, Структуры X1-29, Структуры X1-30, Структуры X1-31, Структуры X1-32, Структуры X1-33, Структуры X1-34, Структуры X1-35, Структуры X1-36, Структуры X1-37, Структуры X1-38, Структуры X1-39, Структуры X1-40, Структуры X1-41, Структуры X1-42, Структуры X1-43, Структуры X1-44, Структуры X1-45, Структуры X1-46, Структуры X1-47, Структуры X1-48, Структуры X1-49, Структуры X1-50, Структуры X1-51, Структуры X1-52, Структуры X1-53, Структуры X1-54, Структуры X1-55, Структуры X1-56, Структуры X1-57, Структуры X1-58, Структуры X1-59, Структуры X1-60, Структуры X1-61, Структуры X1-62, Структуры X1-63, Структуры X1-64, Структуры X1-65, Структуры X1-66, Структуры X1-67, Структуры X1-68, Структуры X1-69, Структуры X1-70, Структуры X1-71, Структуры X1-72, Структуры X1-73, Структуры X17-4, Структуры X1-75, Структуры X1-76, Структуры X1-77, Структуры X1-78, Структуры X1-79, Структуры X1-80, Структуры X1-81 и Структуры X1-82:
Структура X1-81, Структура X1-82, Rs - совместно с Y представляет собой R6OCH2C(R5)=, или сам по себе Rs - выбран из группы, состоящей из R6OOCCH(NHR7)(СН2)nC(=O)NH-, R6OOCCH(NHR7)(CH2)nSC(=O)NH-, CF3SCH2C(=O)NH-, CF3CH2C(=O)NH-, CHF2SCH2C(=O)NH-, CH2FSCH2C(=O)NH-, NH2C(=O)CHFS-CH2C(=O)NH-, R7NHCH(C(=O)OW)CH2SCH2C(=O)NH-, R7NHCH(L1-L4-L2-W)CH2SCH2C(=O)NH-, CNCH2SCH2C(=O)NH-, СН3(СН2)nC(=O)NH-, R7N=CHNR7CH2CH2S-, R7N=C(NHR7)NHC(=O)-, R7N=C(NHR7)NHC(=O)CH2, CH3C(Cl)=CHCH2SCH2C(=O)NH-, (CH3)2C(OR6)-, CNCH2C(=O)NH-, CNCH2CH2S-, R7HN=CH(NR7)CH2CH2S-, CH2=CHCH2SCH2C(=O)NH-, СН3СН(ОН)-, СН3СН(OR8)-, CH3CH(Y1)-, (СН3)2СН-, СН3СН2-, СН3(СН2)nCH=СН(СН2)mC(=O)NH-, Структуры Rs-1, Структуры Rs-2, Структуры Rs-3, Структуры Rs-4, Структуры Rs-5, Структуры Rs-6, Структуры Rs-7, Структуры Rs-8, Структуры Rs-9, Структуры Rs-10, Структуры Rs-11, Структуры Rs-12, Структуры Rs-13, Структуры Rs-14, Структуры Rs-15, Структуры Rs-16, Структуры Rs-17, Структуры Rs-18, Структуры Rs-19, Структуры Rs-20, Структуры Rs-21, Структуры Rs-22, Структуры Rs-23, Структуры Rs-24, Структуры Rs-25, Структуры Rs-26, Структуры Rs-27, Структуры Rs-28, Структуры Rs-29, Структуры Rs-30, Структуры Rs-31, Структуры Rs-32, Структуры Rs-33, Структуры Rs-34, Структуры Rs-35, Структуры Rs-36, Структуры Rs-37, Структуры Rs-38, Структуры Rs-39, Структуры Rs-40, Структуры Rs-41, Структуры Rs-42, Структуры Rs-43, Структуры Rs-44, Структуры Rs-45 и Структуры Rs-46:
W выбран из группы, состоящей из Н, замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного алкилокси, замещенного и незамещенного алкенила, замещенного и незамещенного алкинила, замещенного и незамещенного арила, замещенного и незамещенного гетероарила, способной к протонированию группы амина, фармацевтически приемлемых замещенных и незамещенных групп первичного амина, Структуры Wa, Структуры W-1, Структуры W-2, Структуры W-3, Структуры W-4, Структуры W-5, Структуры W-6, Структуры W-7, Структуры W-8, Структуры W-9, Структуры W-10, Структуры W-11, Структуры W-12, Структуры W-13, Структуры W-14, Структуры W-15, Структуры W-16, Структуры W-17 и Структуры W-18:
Z выбран из группы, состоящей из СН2, S, SO, SO2, NH, NR6, CHCH3, CHCH2CH3, CHR6, R6, -C(=O). и О;
AA представляет собой любую аминокислоту;
каждый из m и n независимо выбран из группы 0 и целого числа, например, 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20,…;
НА выбран из группы, состоящей из отсутствующей группы и фармацевтически приемлемой кислоты, например, гидрохлорида, гидробромида, гидройодида, азотной кислоты, серной кислоты, дисерной кислоты, фосфорной кислоты, фосфористой кислоты, фосфоновой кислоты, изоникотиновой кислоты, уксусной кислоты, молочной кислоты, салициловой кислоты, лимонной кислоты, винной кислоты, пантотеновой кислоты, дивинной кислоты, аскорбиновой кислоты, янтарной кислоты, малеиновой кислоты, гентизиновой кислоты, фумаровой кислоты, глюконовой кислоты, глюкуроновой кислоты, сахарной кислоты, муравьиной кислоты, бензойной кислоты, глутаминовой кислоты, метансульфоновой кислоты, этансульфоновой кислоты, бензолсульфоновой кислоты, п-толуолсульфоновой кислоты и памовой кислоты;
R выбран из группы, состоящей из отсутствующей группы, Н, СН2С(=O)OR6, замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного алкоксила, замещенного и незамещенного перфторалкила, замещенного и незамещенного алкилгалогенида, замещенного и незамещенного алкенила, замещенного и незамещенного алкинила, замещенного и незамещенного арила и замещенного и незамещенного гетероарила, где любая группа CH2 в R может быть дополнительно заменена на О, S, P, NR6 или любые другие фармацевтически приемлемые группы;
R1-R3 независимо выбраны из группы, состоящей из Н, остатков замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного алкилоксила, замещенного и незамещенного алкенила, замещенного и незамещенного алкинила, замещенного и незамещенного арила и замещенного и незамещенного гетероарила;
R5 и R35 независимо выбраны из группы, состоящей из Н, C(=O)NH2, CH2CH2OR6, CH2CH2N(СН3)2, CH2CH2N(СН2СН3)2, Cl, F, Br, I, замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного алкилоксила, замещенного и незамещенного циклоалкилоксила, замещенного и незамещенного арила, замещенного и незамещенного гетероарила, замещенного и незамещенного алкилкарбонила, замещенного и незамещенного алкиламино, -C(=0)-W, L1-L4-L2-W и W;
R6, R36 и R46 независимо выбраны из группы, состоящей из Н, F, Cl, Br, I, Na+, K+, C(=O)R5, 2-оксо-1-имидазолидинила, фенила, 5-инданила, 2,3-дигидро-1Н-инден-5-ила, 4-гидрокси-1,5-нафтиридин-3-ила, замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного алкенила, замещенного и незамещенного алкинила, замещенного и незамещенного алкилоксила, замещенного и незамещенного циклоалкилоксила, замещенного и незамещенного арила, замещенного и незамещенного гетероарила, -C(=O)-W, -L1-L4-L2-W и W;
R7 и R37 независимо выбраны из группы, состоящей из Н, F, Cl, Br, I, CH3NHC(=O)СН2СН(NHR8)С(=O), R5N=C(NHR6)NHC(=O)-, С(=O)СН3, С(=O)R6, PO(OR5)OR6, замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного алкилоксила, замещенного и незамещенного алкенила, замещенного и незамещенного алкинила, замещенного и незамещенного арила, замещенного и незамещенного гетероарила, замещенного и незамещенного алкилкарбонила, замещенного и незамещенного алкиламино, L1-L4-L2-W и C-(=O)-W;
R8 и R38 независимо выбраны из группы, состоящей из Н, F, Cl, Br, I, СН3, C2H5, CF3, CH2CH2F, CH2CH2Cl, CH2CH2Br, CH2CH2I, CH2CHF2, CH2CF2, CH2F CH2Cl, CH2Br, CH2I, CH2NR6R7, CH(NHR7)CH2C(=O)NH2, С3Н7, С4Н9, C5H11, R6, C(=O)R6,C(=0)NH2, CH2C(=O)NH2, CH2OC(=O)NH2, PO(OR5)OR6, С(CH3)2С(=O)OR6, СН(СН3)С(=O)OR6, CH2C(=O)OR6, C(=O)-W, L1-L4-L2-W, W, замещенного и незамещенного перфторалкила, замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного алкоксила, замещенного и незамещенного алкиламино, замещенного и незамещенного перфторалкила, замещенного и незамещенного алкилгалогенида и замещенного и незамещенного алкилкарбонила;
R11-R16 независимо выбраны из группы, состоящей из отсутствующей группы, Н, CH2C(=O)ORn, замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного алкоксила, замещенного и незамещенного перфторалкила, замещенного и незамещенного алкилгалогенида, замещенного и незамещенного алкенила, замещенного и незамещенного алкинила, замещенного и незамещенного арила и замещенного и незамещенного гетероарила;
Х2 выбран из группы, состоящей из отсутствующей группы, Н, С(=O), C(=S), CH2(CH2)nOR8, Cl, F, Br, I, NO2, CN, CF3, C2F5, C7R7, OCF3, OC2F5, NH2, NHR6, СН3, C2H5, R6, C(=O)NH2, CH2OC(=O)NH2, CH2C(=O)OR5, CH2(CH2)nN(СН3)2, CH2(CH2)nSO3R5, замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного перфторалкила, замещенного и незамещенного алкил, замещенного и незамещенного алкилтио, замещенного и незамещенного алкиламино и замещенного и незамещенного алкилоксила;
Х3 выбран из группы, состоящей из отсутствующей группы, Н, N3, SO3W, F, Cl, Br, ОН, ОСН3, OR6, СН3, R6, C(=O), C(=S), C(=O)OW, OW, L1-L4-L2-W и I;
X4 выбран из группы, состоящей из отсутствующей группы, N, СН и CY1;
X5 и Х35 независимо выбраны из группы, состоящей из отсутствующей группы, С(=O), C(=S), OC(=O), CH2, СН, S, О и NR5;
Y1, Y31, Y2, Y32, Y3 и Y4 независимо выбраны из группы, состоящей из Н, ОН, OW, OC(=O)W, L1-L4-L2-W, ОС(=O)СН3, CH3, C2H5, С3Н7, С4Н9, R6, SO3R6, CH2OR6, CH2OC(=O)R6, CH2C(=O)OR8, ОСН3, ОС2Н5, OR6, CH3SO2, R6SO2, CH3SO3, R6SO3, NO2, CN, CF3, OCF3, CH2(CH2)nNR5R6, CH2(CH2)nOR6, CH(C(=O)NH2)NHR6, CH2C(=O)NH2, F, Br, I, Cl, CH=CHC(=O)NHCH2C(=O)OW, CH=CHC(=O)NHCH2L1-L4-L2-W, NR8C(=O)R5, SO2NR5R8, C(=O)R8, SRs, замещенного и незамещенного перфторалкила, замещенного и незамещенного алкоксила, замещенного и незамещенного алкилтио, замещенного и незамещенного алкиламино, замещенного и незамещенного перфторалкила, замещенного и незамещенного алкилгалогенида и замещенного и незамещенного алкилкарбонила;
L1 выбран из группы, состоящей из отсутствующей группы, О, S, -O-L3-, -S-L3-, -N(L3)-, -N(L3)-CH2-O, -N(L3)-CH2-N(L5)-, -O-CH2-O-, -O-СН(L3)-O и -S-СН(L3)-O-;
1-2 выбран из группы, состоящей из отсутствующей группы, О, S, -O-L3-, -S-L3-, -N(L3)-, -N(L3)-CH2-O, -N(L3)-CH2-N(L5)-, -O-CH2-O-, -O-СН(L3)-O, -S-СН(L3)-O-, -O-L3-, -N-L3-, -S-L3-, -N(L3)-L5- и L3;
L4 выбран из группы, состоящей из С=O, C=S,



каждый из L1, L2 и L4, L3 и L5 независимо выбраны из группы, состоящей из отсутствующей группы, Н, CH2C(=O)OL6, замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного арила, замещенного и незамещенного гетероарила, замещенного и незамещенного алкоксила, замещенного и незамещенного алкилтио, замещенного и незамещенного алкиламино, замещенного и незамещенного перфторалкила и замещенного и незамещенного алкилгалогенида, где любой атом углерода или атом водорода может быть дополнительно независимо заменен на О, S, P, NL3 или любые другие фармацевтически приемлемые группы;
L6 независимо выбран из группы, состоящей из Н, ОН, Cl, F, Br, I, замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила и замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного арила, замещенного и незамещенного гетероарила, замещенного и незамещенного алкоксила, замещенного и незамещенного алкилтио, замещенного и незамещенного алкиламино, замещенного и незамещенного перфторалкила и замещенного и незамещенного алкилгалогенида, где любой атом углерода или атом водорода может быть дополнительно независимо заменен на О, S, N, Р(O)OL6, СН=СН, С=С, CHL6, CL6L7, арил, гетероарил или циклические группы;
1-7 независимо выбран из группы, состоящей из Н, ОН, Cl, F, Br, I, замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила и замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного арила, замещенного и незамещенного гетероарила, замещенного и незамещенного алкоксила, замещенного и незамещенного алкилтио, замещенного и незамещенного алкиламино, замещенного и незамещенного перфторалкила и замещенного и незамещенного алкилгалогенида, где любой атом углерода или атом водорода может быть дополнительно независимо заменен на О, S, N, Р(O)OL6, СН=СН, С≡С, CHL6, CL6L7, арил, гетероарил или циклические группы; и
любые CH2 группы могут быть заменены на О, S, или NH.
[0053] Согласно конкретным вариантам реализации изобретения, функциональный компонент НРР или НРС противомикробного или родственного противомикробному соединения включает фрагмент, имеющий структуру, выбранную из группы, состоящей из Структуры FP-1, Структуры FP-2, Структуры FP-3, Структуры FP-4, Структуры FP-5, Структуры FP-6, Структуры FP-7, Структуры FP-8, Структуры FP-9, Структуры FP-10, Структуры FP-11, Структуры FP-12, Структуры FP-13, Структуры FP-14, Структуры FP-15, Структуры FP-16, Структуры FP-17, Структуры FP-18, Структуры FP-19, Структуры FP-20, Структуры FP-21, Структуры FP-22, Структуры FP-23, Структуры FP-24, Структуры FP-25, Структуры FP-26, Структуры FP-27, Структуры FP-28, Структуры FP-29, Структуры FP-30, Структуры FP-31, Структуры FP-32, Структуры FP-33, Структуры FP-34, Структуры FP-35, Структуры FP-36, Структуры FP-37, Структуры FP-38, Структуры FP-39, Структуры FP-40, Структуры FP-41, Структуры FP-42, Структуры FP-43, Структуры FP-44, Структуры FP-45, Структуры FP-46, Структуры FP-47, Структуры FP-48, Структуры FP-49, Структуры FP-50, Структуры FP-51, Структуры FP-52, Структуры FP-53, Структуры FP-54, Структуры FP-55, Структуры FP-56, Структуры FP-57, Структуры FP-58, Структуры FP-59, Структуры FP-60, Структуры FP-61, Структуры FP-62, Структуры FP-63, Структуры FP-64, Структуры FP-65, Структуры FP-66, Структуры FP-67, Структуры FP-68, Структуры FP-69, Структуры FP-70, Структуры FP-71, Структуры FP-72, Структуры FP-73, Структуры FP-74, Структуры FP-75, Структуры FP-76, Структуры FP-77, Структуры FP-78, Структуры FP-79, Структуры FP-80, Структуры FP-81, Структуры FP-82, Структуры FP-83, Структуры FP-84, Структуры FP-85, Структуры FP-86, Структуры FI-1, Структуры FI-2, Структуры FI-3, Структуры FI-4, Структуры FI-5, Структуры FI-6, Структуры FI-7, Структуры FI-8, Структуры FI-9, Структуры FI-10, Структуры FI-11, Структуры FI-12, Структуры FI-13, Структуры FI-14, Структуры FI-15, Структуры FI-16, Структуры FI-17, Структуры FI-18, Структуры FI-19, Структуры FI-20, Структуры FI-21, Структуры FI-22, Структуры FI-23, Структуры FI-24, Структуры FI-25, Структуры FI-26, Структуры FI-27, Структуры FI-28, Структуры FI-29, Структуры FI-30, Структуры FI-31, Структуры FI-32, Структуры FI-33, Структуры FS-1, Структуры FS-2, Структуры FS-3, Структуры FS-4, Структуры FS-5, Структуры FS-6, Структуры FS-7, Структуры FS-8, Структуры FS-9, Структуры FS-10, Структуры FS-11, Структуры FS-12, Структуры FS-13, Структуры FS-14, Структуры FS-15, Структуры FS-16, Структуры FS-17, Структуры FS-18, Структуры FS-19, Структуры FS-20, Структуры FT-1, Структуры FT-2, Структуры FT-3, Структуры FT-4, Структуры FT-5, Структуры FT-6, Структуры FT-7, Структуры FT-8, Структуры FT-9, Структуры FT-10, Структуры FT-11, Структуры FT-12, Структуры FT-13, Структуры FT-14, Структуры FT-15 и Структуры FT-16:
включая стереоизомеры и их фармацевтически приемлемые соли, где:
n, R5, R7, X5, X35, Y1, Y2, Y31, Y32, Y3 и Y4 такие, как определено выше;
L31 определен так же, как L1 выше, L32 определены так же как L2 выше, L34 определены так же как 1-4 выше, согласно конкретным вариантам реализации изобретения, -L1-L4-L32- и -L31-L34-L32- независимо выбраны из группы, состоящей из -O-, -Х-, -O-Х-, -N-X-, -S-X-, -X5-, -O-X5-, -n-X5-, -S-X5-, -О-X7-, -O-С(=O)-, -NH-С(=O)-, -С(=O)-, -С(=O)-O-, -C(=O)-N- и С(=O)-Х-;
X выбран из группы, состоящей из отсутствующей группы, С(=O), ОС(=O), CH2, СН, S, NH, NR6 и О;
X6, X36 и X46 независимо выбраны из группы, состоящей из отсутствующей группы, С(=O), C(=S), OC(=0), CH2, СН, S, О и NR5; и
Х7 выбран из группы, состоящей из отсутствующей группы, С(=O), C(=S), OC(=O), CH2, СН, S, О и NR5.
[0054] Согласно конкретным вариантам реализации изобретения, функциональный компонент НРР противомикробного и родственного противомикробному соединения включает фрагмент, имеющий структуру согласно Структуре F-1, Структуре FP-1, Структуре FP-2, Структуре FP-3, Структуре FP-4, Структуре FP-5, Структуре FP-6, Структуре FP-7, Структуре FP-8, Структуре FP-9, Структуре FP-10, Структуре FP-11, Структуре FP-12, Структуре FP-13, Структуре FP-14, Структуре FP-15, Структуре FP-16, Структуре FP-17, Структуре FP-18, Структуре FP-19, Структуре FP-20, Структуре FP-21, Структуре FP-22, Структуре FP-23, Структуре FP-24, Структуре FP-25, Структуре FP-26, Структуре FP-27, Структуре FP-28, Структуре FP-29, Структуре FP-30, Структуре FP-31, Структуре FP-32, Структуре FP-33, Структуре FP-34, Структуре FP-35, Структуре FP-36, Структуре FP-37, Структуре FP-38, Структуре FP-39, Структуре FP-40, Структуре FP-41, Структуре FP-42, Структуре FP-43, Структуре FP-44, Структуре FP-45, Структуре FP-46, Структуре FP-47, Структуре FP-48, Структуре FP-49, Структуре FP-50, Структуре FP-51, Структуре FP-52, Структуре FP-53, Структуре FP-54, Структуре FP-55, Структуре FP-56, Структуре FP-57, Структуре FP-58, Структуре FP-59, Структуре FP-60, Структуре FP-61, Структуре FP-62, Структуре FP-63, Структуре FP-64, Структуре FP-65, Структуре FP-66, Структуре FP-67, Структуре FP-68, Структуре FP-69, Структуре FP-70, Структуре FP-71, Структуре FP-72, Структуре FP-73, Структуре FP-74, Структуре FP-75, Структуре FP-76, Структуре FP-77, Структуре FP-78, Структуре FP-79, Структуре FP-80, Структуре FP-81, Структуре FP-82, Структуре FP-83, Структуре FP-84, Структуре FP-85, Структуре FP-86, Структуре FI-1, Структуре FI-2, Структуре FI-3, Структуре FI-4, Структуре FI-5, Структуре FI-6, Структуре FI-7, Структуре FI-8, Структуре FI-9, Структуре FI-10, Структуре FI-11, Структуре FI-12, Структуре FI-13, Структуре FI-14, Структуре FI-15, Структуре FI-16, Структуре FI-17, Структуре FI-18, Структуре FI-19, Структуре FI-20, Структуре FI-21, Структуре FI-22, Структуре FI-23, Структуре FI-24, Структуре FI-25, Структуре FI-26, Структуре FI-27, Структуре FI-28, Структуре FI-29, Структуре FI-30, Структуре FI-31, Структуре FI-32, Структуре FI-33, Структуре FS-1, Структуре FS-2, Структуре FS-3, Структуре FS-4, Структуре FS-5, Структуре FS-6, Структуре FS-7, Структуре FS-8, Структуре FS-9, Структуре FS-10, Структуре FS-11, Структуре FS-12, Структуре FS-13, Структуре FS-14, Структуре FS-15, Структуре FS-16, Структуре FS-17, Структуре FS-18, Структуре FS-19, Структуре FS-20, Структуре FT-1, Структуре FT-2, Структуре FT-3, Структуре FT-4, Структуре FT-5, Структуре FT-6, Структуре FT-7, Структуре FT-8, Структуре FT-9, Структуре FT-10, Структуре FT-11, Структуре FT-12, Структуре FT-13, Структуре FT-14, Структуре FT-15 и Структуре FT-16, как определено выше, включая стереоизомеры и их фармацевтически приемлемые соли, где:
m=0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20,…;
n=0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20,…;
R1 выбран из группы, состоящей из Н, C1-C20алкил,C1-C20алкилоксила, C1-C20алкенила, C1-C20алкинила, арила и гетероарила;
R2 выбран из группы, состоящей из Н, остатков C1-C20алкила, C1-C20алкилокси, C1-C20алкенила, C1-C20алкинила, арила и гетероарила;
R3 выбран из группы, состоящей из Н, остатков C1-C20алкила, C1-C20алкилокси, С1-C20алкенила, C1-C20алкинила, арила и гетероарила;
r5 и R35 независимо выбраны из группы, состоящей из Н, -C(=O)NH2, CH2CH2OR6, CH2CH2N(CH3)2, CH2CH2N(CH2CH3)2, CH2CH2OR6, Cl, F, Br, I, C1-C20алкила, C1-C20циклоалкила, C1-C20алкилоксила, C1-C20циклоалкилоксила, C1-C20алкенила, C1-C20циклоалкенила, C1-C20циклоалкинила, C1-C20алкинила, арила, гетероарила, C(=O)-W и W;
R6, R36 и R46 независимо выбраны из группы, состоящей из Н, F, Cl, Br, I, Na+, K+, C(=O)R5, 2-оксо-1-имидазолидинила, фенила, 5-инданила, 2,3-дигидро-1Н-инден-5-ила, 4-гидрокси-1,5-нафтиридин-3-ила, C1-C12алкила, C1-C12циклоалкила, C1-C12алкилоксила, C1-C12циклоалкилоксила, C1-C12алкенила, C1-C12циклоалкенила, C1-C12циклоалкинила, C1-C12алкинила, арила, гетероарила, C(=O)-W и W;
R7 и R37 независимо выбраны из группы, состоящей из Н, F, Cl, Br, I, CH3NHC(=O)СН2СН(NHR8)С(=O), R5N=C(NHR6)NHC(=O)-, С(=O)СН3, C(=O)R6, PO(OR5)OR6, C1-C20алкила, C1-C20алкилоксила, C1-C20алкенила, C1-C20алкинила, арила, гетероарила, C(=O)-W и W;
R8 и R38 независимо выбраны из группы, состоящей из Н, F, Cl, Br, I, СН3, C2H5, CF3, CH2CH2F, CH2CH2Cl, CH2CH2Br, CH2CH2I, CH2CHF2, CH2CF3, CH2F, CH2Cl, CH2Br, CH2I, CH2NR6R7, CH(NHR7)CH2C(=O)NH2, С3Н7, С4Н9, C5H11, R6, C(=O)R6, C(=O)NH2, CH2C(=O)NH2, CH2OC(=O)NH2, PO(OR5)OR6, С(CH3)2С(=O)OR6, СН(CH3)С(=O)OR6, CH2C(=O)OR6, C(=O)-W;
X2 выбран из группы, состоящей из отсутствующей группы, Н, CH2(CH2)nOR8, Cl, F, Br, I, NO2, CN, CF3, C2F5, C3F7, OCF3, OC2F5, NH2, NHR6, СН3, С2Н5, R6, C(=O)NH2, CH2OC(=O)NH2, CH2C(=O)OR5, CH2(CH2)nN(CH3)2, СН2(СН2)nSO3R5, C1-8алкила, C1-8алкилтио, С1-8алкиламино и C1-8алкилоксила;
Х3 выбран из группы, состоящей из отсутствующей группы, Н, N3, SO3W, F, Cl, Br, ОН, ОСН3, OR6, СН3, R6, C(=O)OW, OW и I;
Х4 выбран из группы, состоящей из отсутствующей группы, N, СН и CY1;
X5 и Х35 независимо выбраны из группы, состоящей из отсутствующей группы, С(=O), C(=S), OC(=O), CH2, СН, S, О и NR5;
каждый из Y1, Y31, Y2, Y32, Y3 и Y4 независимо выбран из группы, состоящей из Н, ОН, OW, OC(=O)W, ОС(=O)СН3, СН3, С2Н5, С3Н7, С4Н9, SO3R6, CH2OR6, CH2OC(=O)R6, CH2C(=O)OR8, ОСН3, OC2H5, CH3SO2, R6SO2, R6SO3OR6, CH3SO3, R6SO3, NO2, CN, CF3, OCF3, CH=CHC(=O)NHCH2C(=O)OW, CH2(CH2)nNR5R6, СН22(СН2)nOR6, CH(C(=O)NH2)NHR6, CH2C(=O)NH2. F, Br, I и Cl;
Z, AA, HA, R, Rs, Y, R11-R16, X, L1, L2, L4, L31, L32, L34 и W определены так же как, выше; и
любые группы CH2 могут быть заменены на О, S, NRe или любые другие фармацевтически приемлемые группы.
[0055] В настоящей заявке, термин «фармацевтически приемлемая соль» означает такие соли соединений согласно изобретению, которые являются безопасными для применения у субъекта. Фармацевтически приемлемые соли включают соли кислотных и основных групп, присутствующих в соединениях согласно изобретению. Фармацевтически приемлемые соли присоединения кислоты включают, но не ограничиваются ими, гидрохлорид, гидробромид, гидройодид, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, изоникотинат, ацетат, лактат, салицилат, цитрат, тартрат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкаронат, сахарат, формат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат (т.е., 1,11-метилен-бис-(2-гидрокси-3-нафтоат)). Конкретные соединения согласно изобретению могут образовывать фармацевтически приемлемые соли с различными аминокислотами. Подходящие соли оснований включают, но не ограничиваются ими, соли алюминия, кальция, лития, магния, калия, натрия, цинка и диэтаноламина. Обзор фармацевтически приемлемых солей см. в BERGE ЕТ AL, 66 J. PHARM. SCI.1-19 (1977), включенном в настоящую заявку посредством ссылки.
[0056] В настоящей заявке, если иное не указано, термин «алкил» означает разветвленную или неразветвленную, насыщенную или ненасыщенную, одновалентную или поливалентную углеводородную группу, включая насыщенные алкильные группы, алкенильные группы и алкинильные группы. Примеры алкила включают, но не ограничиваются ими, метил, этил, пропил, изопропил, бутил, изобутил, m-бутил, пентил, гексил, гептил, октил, нонил, децил, ундецил, додецил, этенил, прпенил, бутенил, изобутенил, пентенил, гексенил, гептенил, октенил, ноненил, доценил, ундеценил, додеценил, этинил, пропинил, бутинил, изобутинил, пентинил, гексинил, гептинил, октинил, нонинил, децинил, ундецинил, додецинил, метилен, этилен, пропилен, изопропилен, бутилен, изобутилен, m-бутилен, пентилен, гексилен, гептилен, октилен, нонилен, децилен, ундецилен и додецилен. Согласно конкретным вариантам реализации изобретения, углеводородная группа содержит от 1 до 30 атомов углерода. Согласно конкретным вариантам реализации изобретения, углеводородная группа содержит от 1 до 20 атомов углерода. Согласно конкретным вариантам реализации изобретения, углеводородная группа содержит от 1 до 12 атомов углерода.
[0057] В настоящей заявке, если иное не указано, термин «циклоалкил» означает алкил, который содержит по меньшей мере одно кольцо и не содержит ароматических колец. Примеры циклоалкила включают, но не ограничиваются ими, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклононил, циклодецил, циклоундецил и циклододецил. Согласно конкретным вариантам реализации изобретения, углеводородная цепь содержит от 1 до 30 атомов углерода. Согласно конкретным вариантам реализации изобретения, углеводородная группа содержит от 1 до 20 атомов углерода. Согласно конкретным вариантам реализации изобретения, углеводородная группа содержит от 1 до 12 атомов углерода.
[0058] В настоящей заявке, если иное не указано, термин «гетероциклоалкил» означает циклоалкил, где по меньшей мере один атом в кольце представляет собой не атом углерода. Примеры атома, представляющего собой не атом углерода, в кольце включают, но не ограничиваются ими, S, О и N.
[0059] В настоящей заявке, если иное не указано, термин «алкоксил» означает алкил, циклоалкил или гетероциклоалкил, который содержит один или более атомов кислорода. Примеры алкоксила включают, но не ограничиваются ими, -СН2-ОН, -ОСН3, -O-Re, -Re-OH, -Re1-O-Re2-, где Re, Re1 и Re2 могут являться одинаковыми или различаться и представлять собой алкил, циклоалкил или гетероциклоалкил.
[0060] В настоящей заявке, если иное не указано, термин «алкилгалогенид» означает алкил, циклоалкил или гетероциклоалкил, который содержит один или более атомов галоген, где атомы галогена могут являться одинаковыми или различаться. Термин «галоген» означает фтор, хлор, бром или йод. Примеры алкилгалогенида включают, но не ограничиваются ими, -Re-F, -Re-Cl, -Re-Br, -Re-l, -Re(F)-, -Re(Cl)-, -R2(Br)- и -Re(l)-, где Re представляет собой алкил, циклоалкил или гетероциклоалкил.
[0061] В настоящей заявке, если иное не указано, термин «алкилтио» означает алкил, циклоалкил или гетероциклоалкил, который содержит один или более атомов серы. Примеры алкилтио включают, но не ограничиваются ими, -CH2-SH, -SCH3, -S-Re, -Re-SH, -Re1-S-Re2-, где Re, Re1 и Re2 являются одинаковыми или различаются и представляют собой алкил, циклоалкил или гетероциклоалкил.
[0062] В настоящей заявке, если иное не указано, термин «алкиламино» означает алкил, циклоалкил или гетероциклоалкил, который содержит один или более атомов азота. Примеры алкиламино включают, но не ограничиваются ими, -CH2-NH, -NCH3, -N(Re1)-Re2, -N-Re, -Re-NH2, -Re1-N-Re2 И -Re-N(Re1)-Re2, где Re, Re1 и Re2 являются одинаковыми или различаются и представляют собой алкил, циклоалкил или гетероциклоалкил.
[0063] В настоящей заявке, если иное не указано, термин «алкилкарбонил» означает алкил, циклоалкил или гетероциклоалкил, который содержит одну или более карбонильных групп.Примеры алкилкарбонильной группы включают, но не ограничиваются ими, альдегидную группу (-Re-C(O)-H), кетоновую группу (-Re-C(O)-Re1), группу карбоновой кислоты (Re-C(=0)OH), группу сложного эфира (-Re-C(=O)O-Re1), карбоксамид, (-Re-C(=O)O-N(Re1)Re2), группу энона (-Re-C(O)-C(Re1)=C(Re2)Re3), группу ацилгалогенида (-Re-С(О)-Xh) и группу ангидрида кислоты (-Re-C(O)-O-C(O)-Re1), где Re, Re1, Re2 и Re3 являются одинаковыми или различаются и представляют собой алкил, циклоалкил или гетероциклоалкил; и Xh представляет собой галоген.
[0064] В настоящей заявке, если иное не указано, термин «перфторалкил» означает алкил, циклоалкил или гетероциклоалкил, который содержит одну или более групп фтора, включая, но не ограничиваясь указанными, перфторметил, перфторэтил, перфторпропил.
[0065] В настоящей заявке, если иное не указано, термин «арил» означает химическую структуру, включающую одно или более ароматических колец. Согласно конкретным вариантам реализации изобретения, все атомы кольца представляют собой атомы углерода. Согласно конкретным вариантам реализации изобретения, один или более атомов кольца представляют собой не атомы углерода, например, атомы кислорода, азота или серы («гетероарил»). Примеры арила включают, но не ограничиваются ими, фенил, бензил, нафталенил, антраценил, пиридил, хиноил, изохиноил, пиразинил, хиноксалинил, акридинил, пиримидинил, хиназолинил, пиридазинил, циннолинил, имидазолил, бензимидазолил, пуринил, индолил, фуранил, бензофуранил, изобензофуранил, пирролил, индолил, изоиндолил, тиофенил, бензотиофенил, пиразолил, индазолил, оксазолил, бензоксазолил, изоксазолил, бензизоксазолил, тиаксолил, гуанидино и бензотиазолил.
[0066] Согласно конкретным вариантам реализации изобретения, транспортный компонент НРР включает способную к протонированию группу амина, которая может способствовать транспортировке или прохождению НРР через один или более биологических барьеров (например, в > от примерно 20 раз, > от примерно 50 раз, > от примерно 100 раз, > от примерно 300 раз, > от примерно 500 раз, > от примерно 1000 раз более быстрому, чем исходного лекарственного средства). Согласно конкретным вариантам реализации изобретения, способная к протонированию группа амина является по существу протонированной при физиологическом pH. Согласно конкретным вариантам реализации изобретения, группа амина может быть обратимо протонирована. Согласно конкретным вариантам реализации изобретения, транспортный компонент может быть отщеплен или не отщеплен от функционального компонента после проникновения НРР через один или более биологических барьеров. Согласно конкретным вариантам реализации изобретения, функциональный компонент может также содержать один или более транспортных компонентов, в частности, в случае противомикробных и родственных противомикробным соединений, имеющих по меньшей мере свободную аминогруппу.
[0067] Согласно конкретным вариантам реализации изобретения, способная к протонированию группа амина выбрана из группы, включающей фармацевтически приемлемые замещенные и незамещенные группы первичного амина, фармацевтически приемлемые замещенные и незамещенные группы вторичного амина и фармацевтически приемлемые замещенные и незамещенные группы третичного амина.
[0068] Согласно конкретным вариантам реализации изобретения, способная к протонированию группа амина выбрана из группы, состоящей из фармацевтически приемлемых замещенных и незамещенных групп первичного амина, Структуры W-1, Структуры W-2, Структуры W-3, Структуры W-4, Структуры W-5, Структуры W-6, Структуры W-7, Структуры W-8, Структуры W-9, Структуры W-10, Структуры W-11, Структуры W-12, Структуры W-13, Структуры W-14, Структуры W-15, Структуры W-16, Структуры W-17 и Структуры W-18, как определено выше, включая стереоизомеры и их фармацевтически приемлемые соли.
[0069] Согласно конкретным вариантам реализации изобретения, линкер, ковалентно связывающий функциональный компонент и транспортный компонент НРР, включает связь, которая способна расщепляться после проникновения НРР через один или более биологических барьеров (ББ). Способная к расщеплению связь включает, например, ковалентную связь, простую эфирную, простую тиоэфирную, амидную, сложноэфирную, сложную тиоэфирную, карбонатную, карбаматную, фосфатную или оксимную связь.
[0070] Согласно конкретным вариантам реализации изобретения, НРР противомикробных и родственных противомикробным соединений имеет следующую Структуру L-1:

включая стереоизомеры и их фармацевтически приемлемые соли, где:
F представляет собой функциональный компонент НРР противомикробного или родственного противомикробному соединения. Примеры F включают Структуру F-1, Структуру FP-1, Структуру FP-2, Структуру FP-3, Структуру FP-4, Структуру FP-5, Структуру FP-6, Структуру FP-7, Структуру FP-8, Структуру FP-9, Структуру FP-10, Структуру FP-11, Структуру FP-12, Структуру FP-13, Структуру FP-14, Структуру FP-15, Структуру FP-16, Структуру FP-17, Структуру FP-18, Структуру FP-19, Структуру FP-20, Структуру FP-21, Структуру FP-22, Структуру FP-23, Структуру FP-24, Структуру FP-25, Структуру FP-26, Структуру FP-27, Структуру FP-28, Структуру FP-29, Структуру FP-30, Структуру FP-31, Структуру FP-32, Структуру FP-33, Структуру FP-34, Структуру FP-35, Структуру FP-36, Структуру FP-37, Структуру FP-38, Структуру FP-39, Структуру FP-40, Структуру FP-41, Структуру FP-42, Структуру FP-43, Структуру FP-44, Структуру FP-45, Структуру FP-46, Структуру FP-47, Структуру FP-48, Структуру FP-49, Структуру FP-50, Структуру FP-51, Структуру FP-52, Структуру FP-53, Структуру FP-54, Структуру FP-55, Структуру FP-56, Структуру FP-57, Структуру FP-58, Структуру FP-59, Структуру FP-60, Структуру FP-61, Структуру FP-62, Структуру FP-63, Структуру FP-64, Структуру FP-65, Структуру FP-66, Структуру FP-67, Структуру FP-68, Структуру FP-69, Структуру FP-70, Структуру FP-71, Структуру FP-72, Структуру FP-73, Структуру FP-74, Структуру FP-75, Структуру FP-76, Структуру FP-77, Структуру FP-78, Структуру FP-79, Структуру FP-80, Структуру FP-81, Структуру FP-82, Структуру FP-83, Структуру FP-84, Структуру FP-85, Структуру FP-86, Структуру FI-1, Структуру FI-2, Структуру FI-3, Структуру FI-4, Структуру FI-5, Структуру FI-6, Структуру FI-7, Структуру FI-8, Структуру FI-9, Структуру FI-10, Структуру FI-11, Структуру FI-12, Структуру FI-13, Структуру FI-14, Структуру FI-15, Структуру FI-16, Структуру FI-17, Структуру FI-18, Структуру FI-19, Структуру FI-20, Структуру FI-21, Структуру FI-22, Структуру FI-23, Структуру FI-24, Структуру FI-25, Структуру FI-26, Структуру FI-27, Структуру FI-28, Структуру FI-29, Структуру FI-30, Структуру FI-31, Структуру FI-32, Структуру FI-33, Структуру FS-1, Структуру FS-2, Структуру FS-3, Структуру FS-4, Структуру FS-5, Структуру FS-6, Структуру FS-7, Структуру FS-8, Структуру FS-9, Структуру FS-10, Структуру FS-11, Структуру FS-12, Структуру FS-13, Структуру FS-14, Структуру FS-15, Структуру FS-16, Структуру FS-17, Структуру FS-18, Структуру FS-19, Структуру FS-20, Структуру FT-1, Структуру FT-2, Структуру FT-3, Структуру FT-4, Структуру FT-5, Структуру FT-6, Структуру FT-7, Структуру FT-8, Структуру FT-9, Структуру FT-10, Структуру FT-11, Структуру FT-12, Структуру FT-13, Структуру FT-14, Структуру FT-15 и Структуру FT-16, как определено выше;
Т представляет собой транспортный компонент НРР противомикробного или родственного противомикробному соединения. Например, Т выбран из группы, состоящей из способной к протонированию группы амина, фармацевтически приемлемых замещенных и незамещенных групп первичного амина, фармацевтически приемлемых замещенных и незамещенных групп вторичного амина и фармацевтически приемлемых замещенных и незамещенных групп третичного амина, Структуры W-1, Структуры W-2, Структуры W-3, Структуры W-4, Структуры W-5, Структуры W-6, Структуры W-7, Структуры W-8, Структуры W-9, Структуры W-10, Структуры W-11, Структуры W-12, Структуры W-13, Структуры W-14, Структуры W-15, Структуры W-16, Структуры W-17 и Структуры W-18, как определено выше; и
L1, L31, L2, L32, L4 и L34 такие, как определено выше, согласно конкретным вариантам реализации изобретения, -L1-L4-L2- и L31-L34L-32- независимо выбраны из группы, состоящей из -O-, -Х-, -O-Х-, -N-X-, -S-X-, -Х5-, -O-Х5-, -N-X5-, -S-X5-, -O-X7-, -O-C(=O)-, -NH-С(=O)-, -С(=O)-, -С(=O)-O-, -С(=O)-N- и С(=O)-Х- где X, X5 и Х7 такие, как определено выше.
[0071] Согласно конкретным вариантам реализации изобретения, НРР или НРС противомикробного или родственного противомикробному соединения включает структуру, выбранную из группы, состоящей из Структуры Р-1, Структуры Р-2, Структуры Р-3, Структуры Р-4, Структуры Р-5, Структуры Р-6, Структуры Р-7, Структуры Р-8, Структуры Р-9, Структуры Р-10, Структуры Р-11, Структуры Р-12, Структуры Р-13, Структуры Р-14, Структуры Р-15, Структуры Р-16, Структуры Р-17, Структуры Р-18, Структуры Р-19, Структуры Р-20, Структуры Р-21, Структуры Р-22, Структуры Р-23, Структуры Р-24, Структуры Р-25, Структуры Р-26, Структуры Р-27, Структуры Р-28, Структуры Р-29, Структуры Р-30, Структуры Р-31, Структуры Р-32, Структуры Р-33, Структуры Р-34, Структуры Р-35, Структуры Р-36, Структуры Р-37, Структуры Р-38, Структуры Р-39, Структуры Р-40, Структуры Р-41, Структуры Р-42, Структуры Р-43, Структуры Р-44, Структуры Р-45, Структуры Р-46, Структуры Р-47, Структуры Р-48, Структуры Р-49, Структуры Р-50, Структуры Р-51, Структуры Р-52, Структуры Р-53, Структуры Р-54, Структуры Р-55, Структуры Р-56, Структуры Р-57, Структуры Р-58, Структуры Р-59, Структуры Р-60, Структуры Р-61, Структуры Р-62, Структуры Р-63, Структуры Р-64, Структуры Р-65, Структуры Р-66, Структуры Р-67, Структуры Р-68, Структуры Р-69, Структуры Р-70, Структуры Р-71, Структуры Р-72, Структуры Р-73, Структуры Р-74, Структуры Р-75, Структуры Р-76, Структуры Р-77, Структуры Р-78, Структуры Р-79, Структуры Р-80, Структуры Р-81, Структуры Р-82, Структуры Р-83, Структуры Р-84, Структуры Р-85, Структуры Р-86, Структуры I-1, Структуры I-2, Структуры I-3, Структуры I-4, Структуры I-5, Структуры I-6, Структуры I-7, Структуры I-8, Структуры I-9, Структуры I-10, Структуры I-11, Структуры I-12, Структуры I-13, Структуры I-14, Структуры I-15, Структуры I-16, Структуры I-17, Структуры I-18, Структуры I-19, Структуры I-20, Структуры I-21, Структуры I-22, Структуры I-23, Структуры I-24, Структуры I-25, Структуры I-26, Структуры I-27, Структуры I-28, Структуры I-29, Структуры I-30, Структуры 1-31, Структуры 1-32, Структуры I-33, Структуры S-1, Структуры S-2, Структуры S-3, Структуры S-4, Структуры S-5, Структуры S-6, Структуры S-7, Структуры S-8, Структуры S-9, Структуры S-10, Структуры S-11, Структуры S-12, Структуры S-13, Структуры S-14, Структуры S-15, Структуры S-16, Структуры S-17, Структуры S-18, Структуры S-19, Структуры S-20, Структуры Т-1, Структуры Т-2, Структуры Т-3, Структуры Т-4, Структуры Т-5, Структуры Т-6, Структуры Т-7, Структуры Т-8, Структуры Т-9, Структуры Т-10, Структуры Т-11, Структуры Т-12, Структуры Т-13, Структуры Т-14, Структуры Т-15 и Структуры Т-16:
включая стереоизомеры и их фармацевтически приемлемые соли, где: m, n, R1, R2, R5, R35, R6, R36, R46, R7, R8, R38, T, W, X, X2, X4, X5, X35, X6, X36, X46, X7, Y1, Y2, Y31, Y32, Y3, Y4, Z, АА, НА, R, Rs и R11-R16 такие, как определено выше.
II. Фармацевтические композиции, содержащие НРР
[0072] Согласно другому аспекту, изобретение относится к фармацевтической композиции, содержащей по меньшей мере одно пролекарство НРР противомикробного или родственного противомикробному соединения и фармацевтически приемлемый носитель.
[0073] Термин «фармацевтически приемлемый носитель» в настоящей заявке означает фармацевтически приемлемый материал, композицию или наполнитель, такой как жидкий или твердый наполнитель, разбавитель, вспомогательное вещество, растворитель или инкапсулирующий материал, вовлеченный в перенос или транспортировку НРР от одной области локализации, жидкости тела, ткани, органа (внутреннего или наружного), или части тела, к другой области локализации, жидкости тела, ткани, органу или части тела.
[0074] Каждый носитель является «фармацевтически приемлемым» с точки зрения его совместимости с другими ингредиентами, например, НРР, лекарственной формой, и подходит для использования в контакте с тканью или органом биологической системы, не проявляет избыточной токсичности, не вызывает раздражения, аллергической реакции, иммуногенности или других проблем или осложнений в соответствии с благоприятным соотношением польза/риск.
[0075] Некоторые примеры материалов, которые могут использоваться в качестве фармацевтически приемлемых носителей, включают: (1) сахара, такие как лактоза, глюкоза и сахароза; (2) крахмалы, такие как кукурузный крахмал и картофельный крахмал; (3) целлюлозу и ее производные, такие как карбоксиметилцеллюлоза натрия, этилцеллюлоза и ацетат целлюлозы; (4) порошкообразный трагант; (5) солод; (6) желатин; (7) тальк; (8) вспомогательные вещества, такие как масло какао и воска для суппозиториев; (9) масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль;
(11) полиолы, такие как глицерин, сорбитол, маннит и полиэтиленгликоль; (12) сложные эфиры, такие как этилолеат и этиллаурат; (13) агар; (14) буферные агенты, такие как гидроксид магния и гидроксид алюминия; (15) альгиновую кислоту; (16) апирогенную воду;
(17) изотонические солевые растворы; (18) раствор Рингера; (19) спирты, такие как этиловый спирт и пропановый спирт; (20) фосфатные буферные растворы и (21) другие нетоксичные совместимые вещества, используемые в области приготовления лекарственных форм, такие как ацетон.
[0076] Фармацевтические композиции могут содержать фармацевтически приемлемые вспомогательные вещества, необходимые для приближения к физиологическим условиям, такие как регуляторы pH и буферные агенты, регуляторы токсичности и т.д., например, ацетат натрия, хлорид натрия, хлорид калия, хлорид кальция, лактат натрия лактат и т.д.
[0077] Согласно одному варианту реализации изобретения, фармацевтически приемлемый носитель представляет собой водный носитель, например, забуференный раствор и т.д. Согласно конкретным вариантам реализации изобретения, фармацевтически приемлемый носитель представляет собой полярный растворитель, например, ацетон и спирт.
[0078] Концентрация НРР в указанных лекарственных формах может сильно различаться и выбирается главным образом в зависимости от жидкого объема, вязкости, массы тела и т.д. в соответствии с конкретным выбранным способом введения и требований биологической системы. Например, концентрация может составлять от 0,0001% до 100%, от 0,001% до 50%, от 0,01% до 30%, от 0,1% до 20%, от 1% до 10% по массе.
[0079] Композиции согласно изобретению можно вводить для профилактического, терапевтического и/или гигиенического применения. Указанное введение может представлять собой местное, мукозальное, например, пероральное, назальное, вагинальное, ректальное, парентеральное, трансдермальное, подкожное, внутримышечное, внутривенное, ингаляционное, офтальмическое введение и другие подходящие способы введения. Фармацевтические композиции можно вводить в различных единичных дозированных лекарственных формах в зависимости от способа введения. Например, единичные лекарственные формы, подходящие для перорального введения, включают порошки, таблетки, пилюли, капсулы и пастилки, и формы для трандермального введения включают раствор, суспензию и гель.
[0080] Таким образом, типичная доза фармацевтической композиции для трансдермального, перорального и внутривенного введения составляет от примерно 10-10 г до примерно 100 г, от примерно 10-10 г до примерно 10-3 г, от примерно 10-9 г до примерно 10-6 г, от примерно 10-6 г до примерно 100 г, от примерно 0,001 г до примерно 100 г, от примерно 0,01 г до примерно 10 г, или от примерно 0,1 г до примерно 1 г на субъекта в день. Можно использовать дозы от примерно 0,01 мг до примерно 100 г на субъекта в день.
Существующие способы получения композиций для парентерального введения известны или очевидны специалистам в данной области техники и описаны более подробно в таких публикациях, как Remington: The Science и Practice of Pharmacy 21st ed., Mack Publishing Company, Easton, Pa. (2005).
III. Применения НРР
i) Способы прохождения через биологический барьер
[0081] Согласно другому аспекту, изобретение относится к способу применения композиции согласно изобретению для проникновения через один или более биологических барьеров у биологического субъекта. Способ включает этап введения биологическому субъекту НРР противомикробного или родственного противомикробному соединения или его фармацевтической композиции. Согласно конкретным вариантам реализации изобретения, скорость проникновения НРР через один или более биологических барьеров превышает в более чем от примерно 20 раз или больше, 50 раз или больше, > от примерно 100 раз или больше, > от примерно 200 раз или больше, > от примерно 300 раз или больше, > от примерно 500 раз или больше, > от примерно 1000 раз или больше, скорость проникновения исходного лекарственного средства.
[0082] Термин «биологический барьер» в настоящей заявке относится к биологическому слою, который разделяет окружение на разные пространственные области или части, при этом указанное разделение способно модулировать (например, сокращать, ограничивать, облегчать или не оказывать влияния) прохождение, проникновение или транспорт субстанции или вещества из одной части/области в другую. Различные пространственные области или части в настоящей заявке могут иметь одинаковое или разное химическое или биологическое окружение (окружения). Биологический слой в настоящей заявке включает (но не ограничивается указанными) биологическую мембрану, слой клеток, биологическую структуру, внутреннюю поверхность субъектов, организмов, органов или полостей тела, наружную поверхность субъектов, организмов, органов или полостей тела или их любую комбинацию или множество.
[0083] Примеры биологических мембран включают липидные двухслойные структуры, мембраны эукариотических клеток, мембраны прокариотических клеток и внутриклеточные мембраны (например, ядерную мембрану или мембрану органелл, такую как мембрана или оболочка аппарата Гольджи, шероховатого и гладкого эндоплазматического ретикулума (ЭПР), рибосом, вакуолей, везикул, липосом, митохондрий, лизосом, ядра, хлоропластов, пластид, пероксисом или микротелец).
[0084] Липидный бислой в настоящей заявке представляет собой двойной слой молекул класса липидов, включая (но не ограничиваясь указанными) фосфолипиды и холестерол. Согласно конкретному варианту реализации изобретения, липиды бислоя представляют собой амфифильные молекулы, состоящие из полярных группы «головы» и неполярных жирных кислот «хвоста». Бислой состоит из двух слоев липидов, расположенных таким образом, что их углеводородные хвосты обращены друг к другу с образованием масляного ядра и удерживаются вместе благодаря гидрофобным эффектам, тогда как их заряженные головы обращены к водным растворам с каждой из сторон мембраны. Согласно другому конкретному варианту реализации изобретения, липидный бислой может содержать одну или более встроенных молекул белка и/или сахара.
[0085] Примеры слоя клеток включают выстилку эукариотических клеток (например, эпителий, собственную пластинку слизистой оболочки и гладкомышечную или мышечную слизистую оболочку (в желудочно-кишечном тракте)), выстилку прокариотических клеток (например, поверхностный слой или S-слой, который относится к двумерной структуре мономолекулярного слоя, состоящего из идентичных белков или гликопротеинов, в частности, S-слой относится к части клеточной оболочки, обычно наблюдаемой у бактерий и архей), биопленку (структурированную совокупность микроорганизмов, инкапсулированных в самостоятельно наработанную полимерную матрицу и прикрепленную к живой или инертной поверхности) и слой растительных клеток (например, эпидермис). Клетки могут являться нормальными клетками или патологическими клетками (например, больными клетками, раковыми клетками).
[0086] Примеры биологических структур включают структуры, изолированные посредством плотного или окклюзионного соединения, обеспечивающего барьер для прохода токсинов, бактерий и вирусов, например, гематомолочный барьер и гематоэнцефалический барьер (ГЭБ). В частности, ГЭБ состоит из непроницаемого эндотелия, который обеспечивает как биофизический барьер, образованный плотными соединениями, соединяющими соседние эндотелиальные клетки, так и транспортный барьер, состоящий из эффлюксных переносчиков. Биологическая структура может также включать смесь клеток, белков и Сахаров (например, кровяные сгустки).
[0087] Примеры внутренней поверхности субъектов, организмов, органов или полостей тела включают слизистую оболочку щек, слизистую оболочку пищевода, слизистую оболочку желудка, слизистую оболочку кишечника, слизистую оболочку органов обоняния, слизистую оболочку ротовой полости, слизистую оболочку бронхов, слизистую оболочку матки и эндометрий (слизистую оболочку матки, внутренний слой стенки пыльцевого зерна или слой внутренней стенки споры) или их комбинацию или множество.
[0088] Примеры наружных поверхностей субъектов, организмов, органов или полостей тела включают капилляры (например, капилляры сердечной ткани), слизистые оболочки, которые представляют собой продолжение кожи (такие как, например, слизистые оболочки носа, губ, ушей, половых органов и ануса), наружную поверхность органа (например, печени, легкого, желудка, мозга, почки, сердца, уха, глаза, носа, рта, языка, толстой кишки, поджелудочной железы, желчного пузыря, двенадцатиперстной кишки, прямой кишки, желудка, ободочной и прямой кишки, кишечника, вены, органов дыхательной системы, сосудистой системы, аноректальной и анальной области), кожу, кутикулу (например, омертвевшие слои клеток эпидермиса или кератиноцитов или поверхностный слой перекрывающихся клеток, покрывающих волосяной стержень животных, многослойные структуры снаружи от эпидермиса многих беспозвоночных, кутикулу растений или полимеры кутин и/или кутан), внешний слой стенки пыльцевого зерна или слой внешней стенки споры и их комбинацию или множество.
[0089] Кроме того, биологический барьер также включает углеводный слой, белковый слой или любые другие биологические слои или их комбинацию или множество. Например, кожа представляет собой биологический барьер, который состоит из множества биологических слоев. Кожа включает слой эпидермиса (наружная поверхность), слой дермы и подкожный слой. Слой эпидермиса содержит несколько слоев, включая слой базальных клеток, слой шиповатых клеток, слой гранулярных клеток и роговой слой. Клетки эпидермиса называются кератиноцитами. Роговой слой («stratum corneum») представляет собой верхний слой эпидермиса, в котором клетки плоские и чешуевидные («чешуйчатые») по форме. Указанные клетки содержат большое количество кератина и расположены в виде перекрывающихся слоев, придающих поверхности кожи прочность и жиро- и водонепроницаемость.
ii) Способы диагностирования состояния в биологической системе
[0090] Согласно другому аспекту, изобретение относится к способу применения композиции согласно изобретению для диагностирования состояния в биологической системе. Способ включает следующие этапы:
1) введение биологическому субъекту композиции, содержащей НРР противомикробного или родственного противомикробному соединения;
2) выявление наличия, локализации или количества НРР, функционального компонента НРР или его метаболита у биологического субъекта; и
3) определение состояния в биологической системе.
[0091] Согласно конкретным вариантам реализации изобретения, НРР (или агент, отщепляемый от НРР) агрегирует в месте действия, где возникает состояние. Согласно конкретным вариантам реализации изобретения, также выявляют наличие, локализацию или количество функционального компонента НРР. Согласно конкретным вариантам реализации изобретения, также определяют появление, развитие, прогрессирование или повторное появление связанного состояния (например, инфекции).
[0092] Согласно конкретным вариантам реализации изобретения, НРР является меченным или конъюгированным с поддающимся выявлению агентом. Альтернативно, НРР получают с включением радиоизотопов для выявления. Существуют многочисленные поддающиеся выявлению агенты, которые в целом могут быть сгруппированы в следующие категории:
(a) Радиоизотопы, такие как35S,14С,13С,15N,125I,3H и131I. Диагностический агент может быть меченным радиоизотопом согласно методикам, известным в данной области техники, и радиоактивность можно измерить с помощью метода сцинтилляционного счета; кроме того, диагностический агент может иметь спиновую метку для электронного парамагнитного резонанса для мечения атома углерода и азота.
(b) Флуоресцентные агенты, такие как BODIPY, аналоги BODIPY, хелаты редкоземельных элементов (хелаты европия), флуоресцеин и его производные, FITC, 5,6-карбоксифлуоресцеин, родамин и его производные, дансил, лиссамин, фикоэритрин, зеленый флуоресцентный белок, желтый флуоресцентный белок, красный флуоресцентный белок и техасский красный. Количественную оценку флуоресценции можно проводить с помощью флуорометра.
(c) различные агенты, представляющие собой ферменты для субстратов, такие как люциферазы (например, люцифераза светлячка и люцифераза бактерий), люциферин, 2,3-дигидрофталазиндионы, малатдегидрогеназа, уреаза, пероксидазы, такие как пероксидаза хрена (HRPO), щелочная фосфатаза, р-галактозидаза, глюкоамилаза, лизозим, оксидазы сахаридов (например, оксидаза глюкозы, оксидаза галактозы и глюкоза-6-фосфатдегидрогеназа), гетероциклические оксидазы (такие как уриказа и оксидаза ксантина), лактопероксидаза, микропероксидаза и т.д. Примеры комбинаций фермент-субстрат включают, например: (i) пероксидазу хрена (HRPO) с гидрогенпероксидазой в качестве субстрата, где гидрогенпероксидаза окисляет предшественник красителя (например, ортофенилендиамин (OPD) или 3,3',5,5'-тетраметилбензидингидрохлорид (ТМВ)); (ii) щелочную фосфатазу (АР) с пара-нитрофенилфосфатом в качестве хромогенного субстрата и (iii) β-D-галактозидазу (P-D-Gal) с хромогенным субстратом (например, п-нитрофенил-β-D-галактозидазой) или флуорогенным субстратом 4-метилумбеллиферил-β-D-галактозидазой.
[0093] Согласно конкретным вариантам реализации изобретения, поддающийся выявлению агент необязательно является конъюгированным с диагностическим агентом, но способен выявлять наличие диагностического агента, и диагностический агент может быть выявлен.
[0094] Согласно конкретным вариантам реализации изобретения, НРР согласно изобретению может быть обеспечена в виде набора, т.е. упакованной комбинации реагентов в заранее заданных количествах с инструкциями для осуществления диагностического анализа. Если НРР является меченным ферментом, набор включает субстраты и кофакторы, необходимые ферменту (например, предшественник субстрата, который обеспечивает поддающийся выявлению хромофор или флуорофор). Кроме того, могут быть включены другие добавки, такие как стабилизаторы, буферы (например, блокирующий буфер или лизирующий буфер) и т.д. Относительное количество различных реагентов может сильно различаться с обеспечением концентрации реагентов в растворе, по существу оптимизирующей чувствительность анализа. В частности, реагенты могут быть предложены в виде сухих порошков, обычно лиофилизированных, включая вспомогательные вещества, которые при растворении обеспечивают раствор реагентов, имеющий подходящую концентрацию.
iii) Способы скрининга вещества на предмет желаемых характеристик
[0095] Согласно другому аспекту, изобретение относится к способу скрининга НРР на предмет желаемых характеристик.
[0096] Согласно конкретным вариантам реализации изобретения, способ включает: ковалентное связывание тестируемого функционального компонента с транспортным компонентом через линкер с образованием тестируемой композиции (или ковалентное связывание функционального компонента с тестируемым транспортным компонентом через линкер или ковалентное связывание функционального компонента с транспортным компонентом через тестируемый линкер)
2) введение тестируемой композиции в биологическую систему; и
3) выявление наличия у тестируемой композиции желаемой природы или характеристики.
[0097] Согласно одному варианту реализации, желаемые характеристики могут включать, например, 1) способность тестируемого функционального компонента образовывать композицию, обладающую высокой проникающей способностью, или превращаться обратно в исходное лекарственное средство, 2) способность и/или скорость проникновения тестируемой композиции, 3) действенность и/или эффективность тестируемой композиции, 4) транспортную способность тестируемого транспортного компонента и 5) способность тестируемого линкера расщепляться.
iv) Способы лечения состояния у биологического субъекта
[0098] Согласно другому аспекту, изобретение относится к способу применения композиции согласно изобретению для лечения состояния в биологической системе. Способ включает введение фармацевтической композиции в биологическую систему.
[0099] Термин «проведение лечения» в настоящей заявке означает излечивание, облегчение, подавление или предотвращение. Термин «лечить» в настоящей заявке означает излечить, облегчить, подавить или предотвратить. Термин «лечение» в настоящей заявке означает излечение, облегчение, подавление или предотвращение.
[00100] Термин «биологическая система», «биологический субъект» или «субъект» в настоящей заявке означает орган, группу органов, которые работают совместно для выполнения конкретной функции, организм или группу организмов. Термин «организм» в настоящей заявке означает скопление молекул, которое функционирует как более-менее стабильное целое и имеет свойства жизни, такое как животное, растение, гриб или микроорганизм.
[00101] Термин «животное» в настоящей заявке означает эукариотический организм, характеризующийся произвольным движением. Примеры животных включают, но не ограничиваются ими, позвоночных (например, человека, млекопитающих, птиц, рептилий, амфибий, рыб, мешкожаберных и ланцетников), оболочников (например, сальп, аппендикулярий, сорберацей и асцидий), членистоногих (например, насекомых, многоножек, малакапод, паукообразных, морских пауков, меростоматов, ракообразных и аннелид), Gehyrea (Anarthropoda) и гельминтов (например, коловраток).
[00102] Термин «растение» в настоящей заявке означает организмы, принадлежащие царству Plantae. Примеры растений включают, но не ограничиваются ими, семенные растения, мхи, папоротники и родственные папоротникам растения. Примеры семенных растений включают, но не ограничиваются ими, цикадные, гинкговые, хвойные, гнетофиты, покрытосемянные. Примеры мхов включают, но не ограничиваются ими, печеночные, антоцетовые и листостебельные мхи. Примеры папоротников включают, но не ограничиваются ими, ужовниковые (например, гадючий язык, лунную траву и гроздевик), мараттиевые и лептоспорангиаты. Примеры родственных папоротникам растений включают, но не ограничиваются ими, плауновидные (например, Clubmoss, Spikemoss и Quillwort), псилотовые (например, Lycopodiophyta и Whisk fern) и хвощевые (например, конский хвост).
[00103] Термин «гриб» в настоящей заявке означает эукариотический организм, который является представителем царства Fungi. Примеры грибов включают, но не ограничиваются ими, хитридиевые грибы, бластокладиомицетов, неокаллимастигомицетов, зигомицетов, гломеромицетов, аскомицетов и базидиомицетов.
[00104] Термин «микроорганизм» при использовании в настоящей заявке означает организм, который является микроскопическим (например, с микрометровым линейным размером). Примеры микроорганизмов включают, но не ограничиваются ими, бактерии, грибы, архей, протистов и микроскопические растения (например, зеленые водоросли) и микроскопических животных (например, планктон, планарий и амебу).
[00105] Некоторые примеры состояний, которые можно лечить согласно способу, включают состояния, которые можно лечить с помощью исходного лекарственного средства из НРР.
v). Способы применения НРР противомикробных и родственных противомикробным соединений и их фармацевтических композиций в лечении
[00106] Согласно другому аспекту, изобретение относится к способу применения НРР противомикробных или родственных противомикробным соединений или их фармацевтических композиций в лечении состояния в биологической системе или у субъекта путем введения НРР противомикробного или родственного противомикробному соединения или его фармацевтической композиции в биологическую систему или субъекту.
[00107] Противомикробные и родственные противомикробным соединения могут быть применены для регуляции широкого спектра биологических процессов в биологической системе. Состояния, которые связаны с такими биологическими процессами, являются поддающимися лечению с помощью соответствующих противомикробных или родственных противомикробным соединений и, следовательно, поддающимися лечению с помощью НРР/НРС противомикробных или родственных противомикробным соединений и их фармацевтической композиции.
[00108] Указанные состояния включают, но не ограничиваются ими, боль, повреждения и связанные с микроорганизмами состояния. Связанные с микроорганизмами состояния представляют собой состояния, которые вызваны микроорганизмами, такими как бактерии, грибы, простейшие и вирусы. Например, состояния, вызванные бактериями (связанные с бактериями состояния), состояния, вызванные простейшими (связанные с простейшими состояния), состояния, вызванные грибами (связанные с грибами состояния) и состояния, вызванные вирусом (связанные с вирусами состояния).
[00109] Связанные с бактериями состояния включают, например, инфекции (например, вызванное инфекцией состояние органа, такого как печень, легкое, желудок, мозг, почка, сердце, ухо, глаз, нос, рот, язык, толстая кишка, поджелудочная железа, желчный пузырь, двенадцатиперстная кишка, прямая кишка, желудок, ободочная и прямая кишка, кишечник, вена, дыхательная система, сосудистая система, аноректальный и анальный зуд, респираторные инфекции, инфекции верхних дыхательных путей, инфекции мочевыводящих путей, больничные инфекции, псевдомонадную инфекцию, коагулаза-положительные стафилококковые инфекции (например, кожную инфекцию, вызванное токсином заболевание, острый инфекционной эндокардит, септицемию, некротизирующую пневмонию), инфекции, связанные с имплантированными протезами, вызванные условно-патогенными микроорганизмами инфекции с септицемией и пневмонией), чуму (например, бубонную чума и легочную чума), сибирскую язву (например, кожную форму сибирской язвы, легочную форму сибирской язвы и желудочно-кишечную форму сибирской язвы), болезнь Лайма, бруцеллез, коклюш, острый энтерит, инфекцию дыхательных путей, пситтакоз, негонококковый уретрит, трахому, конъюнктивит с включениями новорожденного, венерическую лимфогранулему, псевдомембранозный колит, газовую гангрену, пищевое отравление, анаэробный целлюлит, дифтерию, диарею, менингит у детей, геморрагический колит, гемолитический уремический синдром, туляремию, пневмонию, бронхит, пептическую язву, болезнь легионеров, понтиакскую лихорадку, лептоспироз, листериоз, проказу, туберкулез, микоплазменную пневмонию, гонорею, офтальмию новорожденных, септический артрит, менингококковую инфекцию, синдром Фридериксена-Уотерхауза, пятнистую лихорадку Скалистых гор, брюшнотифозный сальмонеллез, сальмонеллез с гастроэнтеритом и энтероколитом, бактериальную дизентерию/шигеллез, цистит, менингит и септицемию, эндометрит, отит среднего уха, синусит, сифилис, некротизирующий фасциит, стрептококковый фарингит, скарлатину, ревматическую атаку, импетиго, рожу, послеродовую лихорадку и холеру.
[00110] Связанные с простевшими состояния включают, например, малярию, сонную болезнь и токсоплазмоз.
[00111] Связанные с грибами состояния включают, например, аспергиллез, бластомикоз, стригущий лишай, кандидоз, кокцидиоидомикоз, криптококкоз, гистоплазмоз, паракокцидиомикоз, споротрихоз и зигомикоз.
[00112] Связанные с вирусами состояния включают, например, грипп, желтую лихорадку и СПИД.
[00113] Согласно конкретным вариантам реализации изобретения, способ лечения состояния, поддающегося облегчению или лечению с помощью противомикробных или родственных противомикробным соединений, у субъекта, включает введение указанному субъекту терапевтически эффективного количества НРР противомикробного или родственного противомикробному соединения или его фармацевтической композиции.
[00114] НРР или его фармацевтическая композиция может вводиться в биологическую систему в соответствии с любым способом введения, известным в данной области техники, включая, но не ограничиваясь указанными, пероральное, энтеральное, буккальное, назальное, местное, ректальное, вагинальное, аэрозольное, трансмукозальное, эпидермальное, трансдермальное, дермальное, офтальмическое, легочное, подкожное и/или парентеральное введение. Фармацевтические композиции можно вводить в различных единичных лекарственных формах в зависимости от способа введения;
[00115] Парентеральное введение относится к способу введения, который, как правило, представляет собой инъекцию, которая включает (но не ограничивается указанными) внутривенную, внутримышечную, внутриартериальую, интратекальную, внутрикапсулярную, внутриглазничную, внутрисердечную, внутрикожную, внутрибрюшинную, транстрахеальную, подкожную, субкутикулярную, внутрисуставную, подкапсулярную, субарахноидальную, интраспинальную и/или интрастернальную (внутригрудинную) инъекцию и/или инфузию.
[00116] НРР или его фармацевтическая композиция может вводиться субъекту в форме лекарственной формы или состава, подходящего для каждого способа введения. Лекарственные формы, применимые в способах согласно изобретению, включают одно или более НРР, один или более их фармацевтически приемлемых носителей и возможно другие терапевтические ингредиенты. Лекарственные формы могут для удобства быть представлены в виде единичной лекарственной формы и могут быть приготовлены согласно любым способам, хорошо известным в области фармации. Количество активного ингредиента, которое может комбинироваться с материалом носителя для получения единичной формы дозирования, будет меняться в зависимости от субъекта, подверженного лечению, и конкретного способа введения. Количество НРР, которое может комбинироваться с материалом носителя для получения фармацевтически эффективной дозы, в целом будет представлять собой такое количество НРР, которое обеспечивает терапевтический эффект. В целом, из возможных ста процентов указное количество будет варьировать от примерно 1 процента до примерно девяноста девяти процентов НРР, предпочтительно от примерно 1 процента до примерно 20 процента.
[00117] Способы получения указанных лекарственных форм или композиций включают этап объединения НРР с одним или более фармацевтически приемлемыми носителями и, возможно, одним или более дополнительными ингредиентами. В целом, лекарственные формы готовят путем равномерного и непосредственного объединения НРР с жидкими носителями или мелкоизмельченными твердыми носителями, или и теми, и другими, и затем при необходимости путем формования продукта.
[00118] Лекарственные формы, подходящие для перорального введения могут быть получены в форме капсул, кахетов, пилюлей, таблеток, таблеток для рассасывания (с использованием ароматизированных основ, обычно сахарозы и камеди или траганта), порошков, гранул или в виде раствора или суспензии в водной или неводной жидкости или в виде жидкой эмульсии типа масло-в-воде или вода-в-масле или в виде эликсира или сиропа или в виде пастилок (с использованием инертной основы, такой как желатин и глицерин или сахароза и камедь) и/или в виде растворов для полоскания рта и т.д., при этом каждая из перечисленных форм содержит предопределенное количество НРР в качестве активного ингредиента. Соединение можно также вводить в виде болюса, электуария или пасты.
[00119] В твердых формах дозирования для перорального введения (например, капсулах, таблетках, пилюлях, драже, порошках, гранулах и т.д.) НРР смешивают с одним или более фармацевтически приемлемыми носителями, такими как цитрат натрия или фосфат дикальция и/или любой из следующих: (1) наполнители или добавки, такие как крахмал, лактоза, сахароза, глюкоза, маннит и/или кремниевая кислота; (2) связующие вещества, такие как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и/или камедь; (3) увлажняющие агенты, такие как глицерол; (4) дезинтегрирующие агенты, такие как агар-агар, карбонат кальция, картофельный или маниоковый крахмал, альгиновая кислота, конкретные силикаты и карбонат натрия, (5) замедляющие растворение агенты, такие как парафин, (6) усилители абсорбции, такие как соединения четвертичного аммония; (7) смачивающие агенты, такие как, например, ацетиловый спирт и моностеарат глицерола; (8) абсорбенты, такие как каолин и бетонитовая глина; (9) скользящие вещества, такие как тальк, стеарат кальция, стеарат магния, твердые поиэтиленгликоли, лаурилсульфат натрия и их смеси; и (10) красители. В случае капсулы, таблетки и пилюли фармацевтические композиции могут также включать буферные агенты. Твердые композиции подобного типа могут также использоваться в качестве наполнителей мягких и твердых желатиновых капсул с использованием таких вспомогательных веществ, как лактоза или молочные сахара, также как высокомолекулярные полиэтиленгликоли и т.д.
[00120] Таблетка может быть получена путем прессования или формования, возможно совместно с одним или более дополнительными ингредиентами. Прессованные таблетки могут быть получены с использованием связующих агентов (например, желатина или гидроксипропилметилцеллюлозы), вещества, обеспечивающего скольжение, инертного разбавителя, консерванта, дезинтегрирующего вещества (например, крахмала гликолята натрия или сшитой карбоксиметилцеллюлозы натрия), поверхностно-активного или диспергирующего агента. Формованные таблетки могут быть получены путем формования смеси порошкообразных противомикробных средств или пептидомиметиков, увлажненных инертным жидким разбавителем, в подходящем приборе. Таблетки и другие твердые дозированные формы, такие как драже, капсулы, пилюли и гранулы, необязательно могут иметь насечку или быть приготовлены с покрытиями или оболочками, такими как энтеросолюбильные покрытия и другие покрытия, хорошо известные в области приготовления фармацевтических лекарственных форм. Они могут быть также приготовлены таким образом, чтобы обеспечивать замедленное или контролируемое высвобождение НРР в области его применения, например, с использованием гидроксипропилметилцеллюлозы в различных пропорциях для обеспечения желаемого профиля высвобождения, других полимерных матриц, липосом и/или микросфер. Указанные формы можно стерилизовать путем, например, фильтрования через удерживающий бактерии фильтр или путем включения стерилизующих агентов в виде стерильной твердой композиции, которая может растворяться в стерильной воде или некоторой другой стерильной среде для инъекций непосредственно перед применением. Указанные композиции также могут необязательно содержать успокаивающие агенты и могут представлять собой такую композицию, которая высвобождает НРР только, или предпочтительно, в конкретных участках желудочно-кишечного тракта, возможно, с замедленным высвобождением. Примеры включенных композиций, которые можно применять, включают полимерные вещества и воски. НРР может также находиться в микроинкапсулированной форме, если это применимо, с одним или более выше описанных вспомогательных веществ.
[00121] Жидкие дозированные формы для перорального введения включают фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к НРР жидкие дозированные формы могут содержать инертные разбавители, обычно используемые в данной области техники, такие как, например, вода или другие растворители, солюбилизирующие агенты и эмульгирующие агенты, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, масла (в частности, хлопковое, арахисовое, кукурузное, масло зародышей пшеницы, оливковое, касторовое и кунжутное масло), глицерол, тетрагидрофуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот сорбитана и их смеси. Кроме инертных разбавителей композиции для перорального введения могут также включать вспомогательные вещества, такие как смачивающие агенты, эмульгирующие агенты и суспендирующие агенты, подсластители, ароматизаторы, красители, отдушки и консерванты.
[00122] Суспензии помимо НРР могут содержать суспендирующие агенты, такие как, например, этоксилированные изостеариловые спирты, полиоксиэтиленсорбитол и сложные эфиры сорбитана, микрокристаллическую целлюлозу, метагидроксид алюминия, бентонит, агар-агар и трагант и их смеси.
[00123] Лекарственные формы для ректального или вагинального введения могут быт представлены в виде суппозиториев, которые могут быть получены путем смешения одного или более НРР с одним или более подходящими не вызывающими раздражение вспомогательными веществами или носителями, включая, например, масло какао, полиэтиленгликоль, воск для суппозиториев или салицилат, и которые являются твердым при комнатной температуре, но жидким при температуре тела и, следовательно, тают в полости прямой кишки или вагинальной полости и высвобождают активный агент. Лекарственные формы, подходящие для вагинального введения также включают лекарственные формы в виде пессария, тампона, крема, геля, пасты или спрея, содержащие указанные носители, которые являются подходящими, как известно в данной области техники.
[00124] Лекарственные формы для местного или трансдермального или эпидермального или дермального введения композиции НРР включают порошки, спреи, мази, пасты, крема, лосьоны, гели, растворы, пластыри и ингаляторы. Активный компонент может смешиваться в стерильных условиях с фармацевтически приемлемым носителем и с любыми консервантами, буферами или пропеллентами, которые могут быт необходимы. Мази, пасты, крема и гели могут содержать, в дополнение к композиции НРР вспомогательные вещества, такие как животные и растительные жиры, масла, воска, парафины, крахмал, трагант, производные целлюлозы, полиэтиленгликоли, силиконы, бетониты, кремниевую кислоту, тальк и оксид цинка или их смеси. Порошки и спреи могут содержать в дополнение к композиции НРР вспомогательные вещества, такие как лактоза, тальк, кремниевая кислота, гидроксид алюминия, силикаты кальция и полиамидный порошок или смеси указанных веществ. Спреи, кроме того, могут содержать обычные пропелленты, такие как хлорфторуглеводород и летучие незамещенные углеводороды, такие как бутан и пропан. Лучшие лекарственные формы для местного или трандермального введения представляют собой раствор чистой воды, водный раствор, водный раствор этанола и водный раствор изопропанола.
[00125] НРР или их фармацевтические композиции могут альтернативно вводиться в виде аэрозолей. Указанное введение может осуществляться путем приготовления водных аэрозолей, липосомных составов или твердых частиц, содержащих НРР. Может использоваться неводная суспензия (например, фторуглеродный пропеллент). Также могут использоваться ультразвуковые небулайзеры Водные аэрозоли получают путем приготовления водного раствора или суспензии агента вместе со стандартными фармацевтически приемлемыми носителями и стабилизаторами. Носители и стабилизаторы различаются в зависимости от требований для конкретного соединения, но, как правило, включают неионные поверхностно-активное вещества (твины, плюроники или полиэтиленгликоль), нетоксичные белки, такие как сывороточный альбумин, сложные эфиры сорбитана, олеиновую кислоту, лецитин, аминокислоты, такие как глицин, буферы, соли, сахара или сахарные спирты. Аэрозоли в целом готовят из изотонических растворов.
[00126] Трансдермальные пластыри могут также использоваться для доставки композиции НРР к области-мишени. Указанные лекарственные формы могут быть получены путем растворения или диспергирования агента в подходящей среде. Усилители абсорбции могут также использоваться для увеличения тока пептидомиметика через кожу. Скорость указанного тока может контролироваться либо путем обеспечения контролирующей скорость мембраны или диспергирования пептидомиметика в полимерной матрице или геле.
[00127] Офтальмические лекарственные формы, глазные мази, порошки, растворы и т.д. также рассматриваются в пределах объема настоящего изобретения.
[00128] Лекарственные формы, подходящие для парентерального введения, включают НРР в комбинации с одним или более фармацевтически приемлемыми стерильными водными или неводными растворами, дисперсиями, суспензиями или эмульсиями или стерильными порошками, которые могут быть восстановлены с получением стерильных растворов или дисперсий для инъекций непосредственного перед использованием и которые могут содержать антиоксиданты, буферы, бактериостатики, растворы, придающие лекарственной форме изотоническое свойства, соответствующие свойствам крови предполагаемого реципиента, или суспендирующие агенты или загустители.
[00129] Примеры подходящих водных и неводных носителей, которые можно использовать в лекарственных формах, подходящих для парентерального введения, включают воду, этанол, полиолы (такие как, например, глицерол, пропиленгликоль, полиэтиленгликоль и т.д.) и их приемлемые смеси, растительные масла, такие как оливковое масло, и органические сложные эфиры, подходящие для инъекций, такие как этилолеат. Приемлемая текучесть может поддерживаться, например, путем использования материалов покрытия, таких как лецитин, путем поддержания необходимого размера частиц (в случае дисперсий) и путем использования поверхностно-активных веществ.
[00130] Лекарственные формы, подходящие для парентерального введения, могут также содержать вспомогательные вещества, такие как консерванты, увлажняющие агенты, эмульгирующие агенты и диспергирующие агенты. Предотвращение действия микроорганизмов может быть обеспечено путем включения различных антибактериальных и противрогрибковых агентов, например, парабена, хлорбутанола, фенолсорбиновой кислоты и т.д. Также при желании можно включать в композиции изотонические агенты, такие как сахара, хлорид натрия и т.д. Кроме того, пролонгированная абсорбция фармацевтических форм для инъекций может осуществляться путем включения агентов, которые задерживают абсорбцию, таких как моностеарат алюминия и желатин.
[00131] Формы инъецируемых депо получают путем формирования микроинкапсулированных матриц, содержащих НРР, или биодеградируемых полимеров, таких как полилактид-полигликолид. В зависимости от отношения НРР к полимеру и природы конкретного используемого полимера скорость высвобождения лекарственного средства может контролироваться. Примеры других бдиодеградируемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Лекарственные формы инъецируемых депо также готовят путем включения НРР в липосомы или микроэмульсии, которые совместимы с тканями тела.
[00132] Согласно конкретным вариантам реализации изобретения, НРР противомикробного или родственного противомикробному соединения или его фармацевтическая композиция доставляется к месту локализации заболевания или опухоли в терапевтически эффективной дозе. Как известно в области фармакологии, точное количество фармацевтически эффективной дозы НРР, которая обеспечит наиболее эффективные результаты с точки зрения лечебного эффекта у конкретного пациента, будет зависеть, например, от активности, конкретной природы, фармакокинетики и биодоступности конкретного НРР, физиологического состояния субъекта (включая расу, возраст, пол, вес, режим питания, тип и стадию заболевания, общее физическое состояние, восприимчивость к конкретной дозе и типу лекарственного средства), природы фармацевтически приемлемого носителя в лекарственной форме, применяемого способа и частоты введения и чувствительности или восприимчивости заболевания, вызванного интересующими патогенными микробными организмами, среди прочих. Однако вышеприведенные рекомендации могут использоваться в качестве основы для точного регулирования схемы лечения, например, определения оптимальной дозы для введения, требующего проведения не более чем рутинных экспериментов, состоящих из наблюдения за субъектом и регулировки дозы. Remington: The Science и Practice of Pharmacy (Gennaro ed. 20.sup.th edition, Williams & Wilkins PA, USA) (2000).
IV. ПРЕИМУЩЕСТВА
[00133] Противомикробные соединения (например, антибиотики) и родственные противомикробным соединения часто являются гидрофильными и с трудом проникают через мембранный барьер кожи. Когда Противомикробные или родственные противомикробным соединения принимаются пероральным путем, они могут инактивироваться при первом прохождении метаболизма. В случае инъекции, введение противомикробных и родственных противомикробным соединений является болезненным и может требовать частых и дорогостоящих посещений клиники.
[00134] Согласно конкретным вариантам реализации изобретения, поскольку НРР или НРС согласно изобретению способны пересекать один или более биологических барьеров, НРР или НРС можно вводить местно (например, локально или трансдермально) с достижением места локализации состояния без необходимости их системного введения (например, перорального или парентерального введения). Местное введение и проникновение НРР или НРС позволяет НРР или НРС достигать той же локальной концентрации агента или лекарственного средства при введении намного меньшего количества или дозы НРР или НРС по сравнению с системным введением исходного агента или лекарственного средства; альтернативно, большей локальной концентрации, которая не достижима при системном введении, или достижима при введении значительно больших доз агента при системном введении. Высокая локальная концентрация НРР/НРС или его исходного агента в случае расщепления обеспечивает более эффективное или намного более быстрое лечение состояния по сравнению с системным введением исходного агента, а также новое лечение состояния, которое ранее могло быть невозможным или не наблюдалось. Локальное введение НРР или НРС может позволить снизить потенциальный вред страдание от системного введения у биологического субъекта, например, нежелательных явлений, связанных с системным воздействием агента, явлений со стороны желудочно-кишечного тракта/почек. Кроме того, локальное введение может позволить НРР или НРС проходить через множество биологических барьеров и достигать системного действия через, например, системное кровообращение, и, таким образом, избегать необходимости системного введения (например, инъекции) и боли, связанной с парентеральной инъекцией.
[00135] Согласно конкретным вариантам реализации изобретения, НРР/НРС или фармацевтические композиции согласно изобретению могут вводиться системно (например, перорально или парентерально). НРР/НРС или активный агент (например, лекарственное средство или метаболит) НРР/НРС может входить в системный кровоток с более высокой скоростью, чем исходный агент, и быстрее достигать места локализации состояния. Кроме того, НРР/НРС могут пересекать биологический барьер (например, гематоэнцефалический барьер и гематомолочный барьер), через который не проникают исходные агенты при их отдельном введении, и, таким образом, предлагают новые способы лечения состояния, которое ранее было невозможным или не наблюдалось.
[00136] Например, НРР/НРС противомикробных или родственных противомикробным соединений согласно изобретению демонстрировали высокую скорость проникновения через биологический барьер (например, в > от примерно 10 раз, > от примерно 50 раз, > от примерно 100 раз, > от примерно 200 раз, > от примерно 300 раз, > от примерно 1000 раз больше скорости противомикробных или родственных противомикробным соединений, введенных по отдельности). Не наблюдали или наблюдали слабо выраженные нежелательные явления у субъектов, которые принимали противомикробные НРР/НРС, тогда как у субъектов, которые принимали исходные противомикробные средства в таких же дозах, наблюдали побочные эффекты (такие как тошнота).
[00137] Наряду с широким применением противомикробных средств, общей и серьезной проблемой стала лекарственная устойчивость, так как патогены со временем мутировали. НРР/НРС или фармацевтические композиции согласно изобретению могут проникать через один или более биологических барьеров, таких как биопленка, клеточная стенка бактерий, грибов и других микроорганизмов с намного большими скоростями и могут преодолевать лекарственную устойчивость.
V. ПРИМЕРЫ
[00138] Следующие примеры предложены для лучшей иллюстрации заявленного изобретения и никоим образом не ограничивают объем изобретения. Все конкретные композиции, материалы и способы, описанные ниже, полностью или частично, находятся в пределах объема изобретения. Указанные конкретные композиции, материалы и способы не ограничивают изобретение и приведены только для иллюстрации конкретных вариантов реализации изобретения в пределах объема изобретения. Специалист в данной области техники может получить эквивалентные композиции, материалы и способы, не прибегая к изобретательству, в пределах объема изобретения. Необходимо понимать, что возможны различные варианты способов, описанных в настоящей заявке, в пределах изобретения. Согласно изобретению, предполагается, что такие варианты включены в объем изобретения.
Пример 1. Получение НРР из исходного лекарственного средства.
[00139] Согласно конкретным вариантам реализации изобретения, исходное соединение, имеющее следующую Структуру F-C:

превращают в НРР, имеющее Структуру L-1:

Структура L-1 включая стереоизомеры и их фармацевтически приемлемые соли, где:
F, L1, L2 и L4 такие, как определено выше;
Т представляет собой транспортный компонент НРР противомикробного или родственного противомикробному соединения. Например, Т выбран из группы, состоящей из W и R6, как определено выше.
[00140] Согласно конкретным вариантам реализации изобретения, НРР, имеющее Структуру L-1, готовят в соответствии с органическим синтезом путем реакции исходных соединений или производных исходных соединений, имеющих Структуру D (например, галогенангидридов, смешанных ангидридов исходных соединений и т.д.):

Структура D с соединением Структуры Е (Схема 1):

где We выбран из группы, состоящей из ОН, галогена, алкоксикарбонила и замещенного арилоксикарбонилокси; и
F, L1, L2, L4 и Т такие, как определено выше.
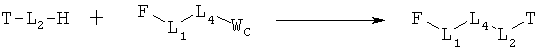
Схема 1. Получение НРР из исходного соединения (I).
[00141] Согласно конкретным вариантам реализации изобретения, НРР, имеющее Структуру L-1, готовят в соответствии со Схемой 1, как описано выше, где 1-4 представляет собой C=O.
[00142] Согласно конкретным вариантам реализации изобретения, исходное соединение, имеющее следующую Структуру F:

подвергают реакции с соединением, имеющим следующую Структуру G:

с получением НРР Структуры L:

включая ее стереоизомеры и фармацевтически приемлемые соли, где:
F, L1, L2 и L4 такие, как определено выше;
Т представляет собой транспортный компонент НРР противомикробного или родственного противомикробному соединения. Например, Т выбран из группы, состоящей из W и R6, как определено выше; и
М выбран из группы, состоящей из Na, K или другого металла. WN выбран из группы, состоящей из ОН, галогена, алкоксикарбонила и замещенного арилоксикарбонилокси. (Схема 2)

Схема 2. Получение НРР из исходного соединения (II).
[00143] Согласно конкретным вариантам реализации изобретения, НРР, имеющее Структуру L-1, готовили путем органического синтеза, при этом для нежелательных реакционных сайтов, таких как -С(=O)ОН, -NH2, -ОН или -SH, вводили защитные группы до связывания транспортного компонента с функциональным компонентом в соответствии с одним из путей синтеза, как описано выше. Согласно конкретным вариантам реализации изобретения, полученное НРР, имеющее защитные группы, может быть дополнительно частично или полностью депротектировано для получения частично защищенного НРР или незащищенного НРР, соответственно.
Получение гидрохлорида 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты
[00144] 39 г пенициллина V калия растворяли в 100 мл ацетонитрила. 39 г 2-бром-N,N-диэтилэтиламина. HBr в этилацетате добавляли в реакционную смесь. Смесь перемешивали в течение 16 ч при комнатной температуре (КГ). 39 г (0,15 моль) 2-бром-N,N-диэтилэтиламина. HBr и 30 г бикарбоната натрия добавляли в реакционную смесь. Смесь перемешивали в течение дополнительных 12 ч при KT. Твердое вещество удаляли посредством фильтрования. 3,5 г HCl в 50 мл эфира добавляли в реакционную смесь при перемешивании. Твердый продукт собирали посредством фильтрования. После высушивания получали 38 г желаемого гигроскопического продукта (78,2%). Элементарный анализ: C22H32ClN3O5S; MW: 486,0. Рассчитано, % С: 54,37; Н: 6,64; N: 8,65; Cl: 7,29; О: 16,46; S: 6,60; Обнаружено, % С: 54,32; Н: 6,68; N: 8,61; Cl: 7,32; О: 16,51; S: 6,56.
Получение гидрохлорида 2-диэтиламиноэтилового эфира 6-(2,6-диметоксибензамидо)пенициллиновой кислоты
[00145] 38 г 6-(2,6-диметоксибензамидо)пенициллиновой кислоты растворяли в 300 мл хлорформа. 20,6 г N,N'-дициклогексилкарбодиимида добавляли в реакционную смесь. 11,7 г N,N-диметиламиноэтанола и 2 г 4-диметиламинопиридина добавляли в реакционную смесь. Смесь перемешивали в течение 10 часов при KT. Твердое вещество удаляли посредством фильтрования. Раствор хлорформа промывали с помощью 5% NaHCO3 (2×100 мл) и воды (3×100 мл). Органический раствор сушили над безводным сульфатом натрия. Сульфат натрия удаляли посредством фильтрования. 3,5 г HCl в 50 мл эфира добавляли в реакционную смесь при перемешивании. Твердый продукт собирали посредством фильтрования. После высушивания получали 40 г желаемого гигроскопического продукта (77,5%). Элементарный анализ: C23H34ClN3O6S; MW: 516,05. Рассчитано, % С: 53,53; Н: 6,64; N: 8,14; Cl: 6,87; О: 18,60; S: 6,21; Обнаружено, % С: 53,49; Н: 6,68; N: 8,11; Cl: 6,90; О: 18,64; S: 6,18.
Получение гидрохлорида 2-диэтиламинопропилового эфира ацетамидофенилацетамидопенициллиновой кислоты
[00146] 43 г натриевой соли ацетамидофенилацетамидопенициллиновой кислоты растворяли в 100 мл ацетонитрила. 40 г 2-бром-N,N-диэтилпропиламина.НВг в этилацетате добавляли в реакционную смесь. Смесь перемешивали в течение 16 ч при КГ. 40 г 2-бром-N,N-диэтилпропиламина. HBr и 30 г бикарбоната натрия добавляли в реакционную смесь. Смесь перемешивали в течение дополнительных 12 ч при KT. Твердое вещество удаляли посредством фильтрования. 3,5 г HCl в 50 мл эфира добавляли в реакционную смесь при перемешивании. Твердый продукт собирали посредством фильтрования. После высушивания получали 35 г желаемого гигроскопического продукта. Элементарный анализ: C26H33ClN4O5S; MW: 541,11. Рассчитано, % С: 55,49; Н: 6,89; N: 10,35; Cl: 6,55; О: 14,78; S: 5,92; Обнаружено, % С: 55,44; Н: 6,92; N: 10,32; Cl: 6,58; О: 14,82; S: 5,92.
Получение гидрохлорида 4-пиперидинэтилового эфира 6-(5-метил-3-фенил-2-изоксазолин-4-карбоксамидо)пенициллиновой кислоты
[00147] 50 г натриевой соли 6-(5-метил-3-фенил-2-изоксазолин-4-карбоксамидо)пенициллиновой кислоты растворяли в 100 мл ацетонитрила. 38 г 4-пиперидинэтилбромида. HBr в этилацетате добавляли в реакционную смесь. Смесь перемешивали в течение 16 ч при КГ. 38 г 4-пиперидинэтилбромида. HBr и 30 г бикарбоната натрия добавляли в реакционную смесь. Смесь перемешивали в течение дополнительных 12 ч при KT. Твердое вещество удаляли посредством фильтрования. 3,5 г HCl в 50 мл эфира добавляли в реакционную смесь при перемешивании. Твердый продукт собирали посредством фильтрования. После высушивания получали 30 г желаемого гигроскопического продукта. Элементарный анализ: C26H33ClN4O5S; MW: 549,08. Рассчитано, % С: 56,88; Н: 6,06; N: 10,20; Cl: 6,46; О: 14,57; S: 5,83; Обнаружено, % С: 56,85; Н: 6,08; N: 10,19; Cl: 6,47; О: 14,59; S: 5,82.
Получение гидрохлорида 2-диэтиламиноэтилового эфира 3-[[(аминокарбонил)окси]метил]-7-метокси-8-оксо-7-[(2-тиенилацетил)амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты
[00148] 41 г натриевой соли 3-[[(аминокарбонил)окси]метил]-7-метокси-8-оксо-7-[(2-тиенилацетил)амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты растворяли в 100 мл ацетонитрила. 35 г 2-бром-N,N-диэтилэтиламина. HBr в этилацетате добавляли в реакционную смесь. Смесь перемешивали в течение 16 ч при КГ. 30 г 2-Бром-N,N-диэтилэтиламина. HBr и 30 г бикарбоната натрия добавляли в реакционную смесь. Смесь перемешивали в течение дополнительных 12 ч при KT. Твердое вещество удаляли посредством фильтрования. 3,5 г HCl в 50 мл эфира добавляли в реакционную смесь при перемешивании. Твердый продукт собирали посредством фильтрования. После высушивания получали 30 г желаемого гигроскопического продукта. Элементарный анализ: C22H31ClN4O7S2; MW: 563,08. Рассчитано, % С: 46,93; Н: 5,55; N: 9,95; Cl: 6,30; О: 19,89; S: 11,39; Обнаружено, % С: 46,91; Н: 5,57; N: 9,93; Cl: 6,32; О: 19,91; S: 11,36.
[00149] Другие НРР противомикробного или родственного противомикробному соединения можно синтезировать с помощью подобных способов.
Пример 2. НРР противомикробных и родственных противомикробным соединений имеют большие скорости проникновения через кожу человека in vitro по сравнению с их исходными лекарственными средствами.
[00150] Скорости проникновения НРР и их исходных лекарственных средств через кожу человека измеряли in vitro с помощью модифицированных ячеек Франца. Ячейка Франца имела две камеры, верхнюю камеру для образцов и нижнюю приемную камеру. Ткань кожи человека (360-400 мкм толщиной), которая разделяла верхнюю и приемную камеры, выделяли из передней и задней области бедра.
[00151] Тестируемое соединение (2 мл, 10% в 0,2 М фосфатном буфере, pH 7,4) добавляли в камеру для образцов ячейки Франца. Приемная камера содержала 10 мл 0,2 М фосфатного буфера, который перемешивали при 600 об/мин. Количество тестируемого соединения, проникающего через кожу, определяли с помощью метода высокоэффективной жидкостной хроматографии (ВЭЖХ). Результаты показаны на Фигурах 1а1, 1а2, 1а3, 1а4, 1b и 1с. Наблюдаемые значения тока тестируемых соединений, рассчитанные на основе наклона кривых на Фигурах 1а1, 1а2, 1а3 и 1а4, суммированы в Таблице 1а. Наблюдаемые значения тока тестируемых соединений, рассчитанные на основе наклона кривых на Фигурах 1b и 1с, обобщены в Таблицах 1b и 1с соответственно.
[00152] Так как самое низкое поддающееся выявлению наблюдаемое значение скорости тока согласно указанному способу составляло 1 мкг/см2/ч, исходные лекарственные средства, которые имели наблюдаемое значение скорости тока, равное или меньшее 1 мкг/см2/ч, рассматривались как не поддающиеся выявлению в анализе проникновения через ткань кожи. Для исходных соединений (например, пенициллина V, пенициллина О), которые имели наблюдаемые значения скорости тока < 1 мкг/см2/ч, НРР имели поддающиеся выявлению наблюдаемые значения скорости тока. Для исходных соединений, которые имели наблюдаемые значения скорости тока > 1 мкг/см2/ч, НРР имели большие поддающиеся выявлению наблюдаемые значения скорости тока. Следовательно, НРР противомикробных или родственных противомикробным соединений показали большую скорость проникновения (в 340-600 раз большую) через ткань кожи по сравнению с их исходными соединениями.
Пример 3. Скорость проникновения НРР через кожу и/или гематоэнцефалический барьер in vivo
[00153] Исследовали скорости проникновения in vivo НРР бета-лактамных антибиотиков через кожу и гематоэнцефалический барьер у интактных бесшерстных мышей. Смесь для нанесения, состоящую из 20% раствора гидрохлорида 2-диэтиламиноэтилового эфира 6-(2,6-диметоксибензамидо)пенициллиновой кислоты, гидрохлорида 2-диэтиламиноэтилового эфира 6-(5-метил-3-фенил-2-изоксазолин-4-карбоксамидо)пенициллиновой кислоты, гидрохлорида 2-диэтиламиноэтилового эфира 6-[3-(о-хлорфенил)-5-метил-4-изоксазолкарбоксамидо]пенициллиновой кислоты, метициллина, оксациллина и клоксациллина в 1 мл изопропанола, наносили на 10 см2 спины бесшерстных мышей, соответственно. Через 2 часа мышей умерщвляли. 5 мл метанола добавляли к 1 г гомогенизированной крови, печени, почки, мышцы или мозга. Образцы центрифугировали в течение 5 мин и анализировали с помощью ВЭЖХ (Таблица 2). Не было обнаружено лекарственных средств у мышей, получавших лечение только исходным лекарственным средством (метициллином, оксациллином и клоксациллином). Результаты показали, что указанные пролекарства имели высокую скорость проникновения через гематоэнцефалический барьер, тогда как соответствующие исходные лекарственные средства были не способны проникать через кожу.
[00154] Отбирали 90 лактирующих молочных коров. 500 мг гидрохлорида 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты (пенициллина V-DEE), гидрохлорида 2-диэтиламиноэтилового эфира 6-(2,6-диметоксибензамидо)пенициллиновой кислоты (метициллина-DEE) или гидрохлорида 2-диэтиламиноэтилового эфира 7-[[(2-ацетиламино-4-тиазолил)(метоксиимино)ацетил]амино]-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты (цефтизоксима-DEE) в 10 мл фосфатного буфера (0,2 М), имеющего pH 7,4, распыляли на кожу вымя два раза в день. Через 1 час после местного применения отбирали и анализировали образцы молока (Таблица 3). Определяли количество исходных лекарственных средств. Результаты показали, что указанные пролекарства имели очень высокую скорость проникновения через гематомолочный барьер. Высокие скорости проникновения через гематомолочный или гематоэнцефалический барьер делают их очень ценными средствами для лечения инфекций мозга, молочной железы, предстательной железы и других инфекций.
Пример 4. НРР противомикробных или родственных противомикробным соединений проникают через клеточную стенку бактерий быстрее, чем их исходные лекарственные средства.
[00155] 0,5 ммоль тестируемого соединения гидрохлорида 1-пиперидинэтилового эфира (6-феноксиацетацетамидопенициллановой кислоты (пенициллин V-PEE), пенициллина V, гидрохлорида 2-пирролидинметилового эфира 6-(2,6-диметоксибензамидо)пенициллиновой кислоты (метициллина-PME), метициллина, гидрохлорида 2-диэтиламиноэтилового эфира 7-[[(2-ацетиламино-4-тиазолил)(метоксиимино)ацетил]амино]-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты (цефтизоксима-DEE) или цефтизоксима) добавляли в 100 мл суспензии Е.Coli и перемешивали в течение 3 минут. Смесь центрифугировали при 3000 об/мин. Супернатант удаляли и осадок промывали три раза с помощью фосфатного буфера, имеющего pH 7,4. Ацетонитрил (100 мл) добавляли в осадок и смесь нагревали до 60°C в течение 2 минут. Раствор ацетонитрила собирали и выпаривали до высыхания. Количество тестируемого соединения определяли с помощью ВЭЖХ. Результаты показаны в Таблице 4.
Пример 5. Превращение НРР в их исходные лекарственные средства.
[00156] НРР противомикробных или родственных противомикробным соединений быстро превращались в исходные противомикробные или родственные противомикробным соединения с высоким выходом в плазме крови человека.
[00157] НРР противомикробного или родственного противомикробному соединения (10 мг) растворяли в 0,1 мл 0,2М фосфатного буфера с pH 7,4. 1 мл плазмы крови человека, предварительно нагретой до 37°C, добавляли в смесь. Смесь держали на водяной бане при 37°C и через каждые 2 мин отбирали по 0,2 мл образцов и добавляли к 0,4 мл метанола для осаждения белков плазмы. Образцы центрифугировали в течение 5 мин и анализировали с помощью ВЭЖХ. Результаты показали, что большинство НРР противомикробных или родственных противомикробным соединений превращалось в исходные противомикробные или родственные противомикробным соединения (Таблица 5).
Пример 6. Минимальная ингибирующая концентрация (М1С) НРР противомикробных или родственных противомикробным соединений
[00158] Минимальную ингибирующую концентрацию (MIC) противомикробных средств и их пролекарств оценивали в соответствии с источником Jennifer M. Andrews, Journal of Antimicrobial Chemotherapy 48, suppl. S1, 5-16 (2001). Результаты (Таблицы 6а-6 с) показали, что НРР противомикробных средств были способны преодолевать (3-лактамную устойчивость у устойчивых к метициллину Staphylococcus aureus (MRSA) в соответствии с минимальными ингибирующими концентрациями (MIC).
Пример 7. Противогрибковая активность НРР противомикробных или родственных противомикробным соединений
[00159] Противогрибковую активность гидрохлорида 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты (пенициллина V-DEE), гидрохлорида 2-диэтиламиноэтилового эфира 6-(2,6-диметоксибензамидо)пенициллиновой кислоты (метициллина-DEE) и гидрохлорида 2-диэтиламиноэтилового эфира 7-[[(2-ацетиламино-4-тиазолил)(метоксиимино)ацетил]амино]-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты (цефтизоксима-DEE) оценивали в соответствии с источником Roether W. et al., Mykosen 27 (1), 14-28 (1984). Результаты представлены в Таблице 7, ниже.
Пример 8. Лечение клинического мастита с помощью НРР бета-лактамных антибиотиков или родственных им соединений.
[00160] Отбирали 90 лактирующих молочных коров. Бактериологическую эффективность считали достигнутой, если образцы, полученные из поврежденного участка на 17 и 22 день, были свободными от видов бактерий, выделенных из образца, полученного до проведения лечения. Клиническую эффективность определяли как исчезновение клинических признаков заболевания, которые наблюдались на 1 день до проведения лечения, другими словами, по возращению к нормальному приему пищи, ректальной температуре <39,0°C, общего состояния, отсутствия эдемы вымени, нормального вида и нормального выхода молока.
[00161] 500 мг гидрохлорида 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты (пенициллина V-DEE), гидрохлорида 2-диэтиламиноэтилового эфира 6-(2,6-диметоксибензамидо)пенициллиновой кислоты (метициллина-DEE) или гидрохлорида 2-диэтиламиноэтилового эфира 7-[[(2-ацетиламино-4-тиазолил)(метоксиимино)ацетил]амино]-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты (цефтизоксима-DEE) в 10 мл фосфатного буфера (0,2 М) с pH 7,4 распыляли на кожу вымя два раза в день. Результаты показаны в Таблицах 8а и 8b. Пролекарства демонстрировали очень высокую клиническую эффективность и бактериологическую эффективность.
Пример 9. Аттивность пролекарств противомикробных лекарственных средств в отношении М. tuberculosis.
[00162] Шестинедельных самок мышей (мыши BALB/c) инфицировали 2,21±0,15×103 КОЕ М. tuberculosis H37Rv воздушно-капельным путем. Через 20 дней, когда среднее КОЕ в легких составляло 8,23±0,27×107 КОЕ, начинали лечение. Группа А представляла собой не подверженную лечению группу (n=20), группа В представляла собой лечебную группу, получающую изониазид/моксифоксацин/пиразинамид (0,18/0,22/1,2 ммоль/кг, пероральное введение) в течение 45 дней, группа С представляла собой лечебную группу, получающую изониазид/моксифоксацин/пиразинамид (0,18/0,22/1,2 ммоль/кг, пероральное введение) в течение 90 дней, группа D представляла собой лечебную группу, получающую N,N-метил-фенилаланил)изониазид (про-изониазид, полученный из N-метилфенилаланина и изониазида, трансдермальное введение)/ бутиловый эфир 1-циклопропил-7-[(1S,6S)-2,8-диазабицикло[4.3.0]нон-8-ил]-6-фтор-8-метокси-4-оксо-хинолин-3-карбоновой кислоты (про-моксифоксацин)/ N,N-диэтиламиноэтиловый эфир пиразиноевой кислоты (про-пиразиноевая кислота, 0,18/0,22/1,2 ммоль/кг, трансдермальное введение) в течение 45 дней, группа Е представляла собой лечебную группу, получающую про-изониазид/про-моксифоксацин/про-пиразиноевую кислоту (0,18/0,22/1,2 ммоль/кг, трансдермальное введение) в течение 90 дней, группа F представляла собой лечебную группу, получающую про-изониазид/про-моксифоксацин/про-пиразиноевую кислоту (0,06/0,07/0,4 ммоль/кг, трансдермальное введение) в течение 45 дней, и группа G представляла собой лечебную группу, получающую про-изониазид/про-моксифоксацин/про-пиразиноевую кислоту (0,06/0,07/0,4 ммоль/кг, трансдермальное введение) в течение 90 дней. После окончания лечения мышей поддерживали в отсутствии лечения в течение дополнительных 90 дней и затем умерщвляли для определения процента мышей, от которых получали отрицательные на патоген культуры легкого, указывающие на излечение. Результаты показали, что пролекарства являются более эффективными по сравнению с их исходными лекарственными средствами и могут применяться трансдермально (Таблицы 9а и 9b).
Пример 10. Лечение туберкулеза у взрослых (сниженная доза для детей).
[00163] 40 мг N-(N-метил-фенилаланил)изониазида (про-изониазида)/50 мг бутилового эфира 1-циклопропил-7-[(18,68)-2,8-диазабицикло[4.3.0]нон-8-ил]-6-фтор-8-метокси-4-оксохинолин-3-карбоновой кислоты (про-моксифоксацина)/40 мг N,N-диэтиламиноэтилового эфира пиразиноевой кислоты (про-пиразиноивой кислоты) в 3 мл воды наносили на кожу грудной клетки или любые другие области кожи тела пациента (в области инфецированных органов) каждое утро и вечер (два раза в день) в течение 90 дней или до момента выздоровления.
Пример 11. Лечение проказы или болезни Гансена (HD) у взрослых (сниженная доза для детей).
[00164] 30 мг 4-диметиламинобутириламидофенил-4'-аминофенилсульфона (про-дапсона)/50 мг бутилового эфира 1-циклопропил-7-[(13,63)-2,8-диазабицикло[4.3.0]нон-8-ил]-6-фтор-8-метокси-4-оксо-хинолин-3-карбоновой кислоты (про-моксифоксацина)/15 мг 2(4-диметиламинобутирилтиобензимидазола в 3 мл воды наносили на кожу в области инфицированных органов тела пациента каждое утро и вечер (два раза в день) в течение 6 месяцев или до момента выздоровления.
Пример 12. Лечение ушной инфекции.
[00165] 20 мг гидрохлорида 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты в 1 мл воды наносили на кожу в области инфицированных ушей пациента каждое утро и вечер (два раза в день) в течение двух недель или до момента выздоровления.
Пример 13. Лечение инфекций нижних дыхательных путей у взрослых (сниженная доза для детей).
[00166] 80 мг гидрохлорида 2-пирролидинметилового эфира 0-а-[(имидазолидин-2-он-1-ил)карбониламино]бензилпенициллина в 3 мл воды наносили на кожу в области шеи и/или грудной клетки пациента каждое утро и вечер (два раза в день) в течение двух недель или до момента выздоровления.
Пример 14. Лечение инфекции верхних дыхательных путей у взрослых (сниженная доза для детей).
[00167] 80 мг гидрохлорида 2-диэтиламиноэтилового эфира 6-D(-)-α-(4-этил-2,3-диоксо-1-пиперазинилкарбониламино)-α-фенилацетамидопенициллиновой кислоты в 2 мл воды наносили на кожу в области шеи пациента каждое утро и вечер (два раза в день) в течение двух недель или до выздоровления.
Пример 15. Лечение инфекций верхних дыхательных путей у взрослых (сниженная доза для детей).
[00168] 30 мг гидрохлорида 2-диэтиламиноэтилового эфира 3-[[(аминокарбонил)окси]метил]-7-метокси-8-оксо-7-[(2-тиенилацетил)амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты в 2 мл воды распыляли в рот или нос пациента каждое утро и вечер (два раза в день) в течение двух недель или до момента выздоровления
Пример 16. Лечение менингита у взрослых (сниженная доза для детей).
[00169] 80 мг гидрохлорида 2-диэтиламиноэтилового эфира 6-D(-)-α-(4-этил-2,3-диоксо-1-пиперазинилкарбониламино)-α-фенилацетамидопенициллиновой кислоты в 3 мл воды наносили на кожу в области шеи и головы пациента каждое утро и вечер (два раза в день) в течение двух недель или до момента выздоровления.
Пример 17. Лечение диарейных расстройств (сниженная доза для детей).
[00170] 80 мг гидрохлорида 2-диэтиламиноэтилового эфира 7-(2-тиенилацетамидо)цефалоспорановой кислота в 3 мл воды наносили на кожу в области пупка пациента каждое утро и вечер (два раза в день) в течение двух недель или до момента выздоровления.
Пример 18. Лечение инфекции молочной железы.
[00171] 50 мг гидрохлорида 2-диэтиламиноэтилового эфира 7-[(гидроксифенилацетил)амино]-3-[[(1-метил-1Н-тетразол-5-ил)тио]метил]-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты в 2 мл воды наносили на кожу в область молочной железы пациента каждое утро и вечер (два раза в день) в течение двух недель или до момента выздоровления.
Пример 19. Лечение инфекций половой системы мужчин и женщин (сниженная доза для детей).
[00172] 80 мг гидрохлорида 2-диэтиламиноэтилового эфира 3-[[(аминокарбонил)окси]метил]-7-[[2-фуранил(метоксиимино)ацетил]амино]-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты в 3 мл воды наносили на кожу наносили в лобковой области пациента каждое утро и вечер (два раза в день) в течение двух недель или до момента выздоровления.
Реферат
Группа изобретений относится к химико-фармацевтической промышленности и представляет собой соединение с высокой проникающей способностью, представляющее собой HCl соль 1-пиперидинэтилового эфира 4,4-диоксида [2S-(2альфа,3бета,5альфа)]-3-метил-7-оксо-3-(1Н-1,2,3-триазол-1-илметил)-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты (тазобактам-РЕЕ), HCl соль N,N-диэтиламиноэтилового эфира 4,4-диоксида (2S,5R)-3,3-диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты (сульбактам-DEE), HCl соль 4-пиперидинэтилового эфира (2R,5R,Z)-3-(2-гидроксиэтилиден)-7-оксо-4-окса-1-аза-бицикло[3.2.0]гептан-2-карбоновой кислоты (клавулановая кислота-РЕЕ), HCl соль (4-нитрофенил)(N,N-диэтиламинометил)-ового эфира [(N-бензилоксикарбониламино)метил]-фосфоновой кислоты, HCl соль (3-пиридинил)(1-пиперидинэтил)-ового эфира [(N-бензилоксикарбониламино)метил]-фосфоновой кислоты, HCl соль 4-(4-диметиламинобутирил)амидобензолсульфонамида (DMAB-сульфаниламид), HCl соль N,N-диэтиламинопропилового эфира 6-оксо-3-(2-[4-(N-пиридин-2-илсульфамоил)фенил]гидразоно)циклогекса-1,4-диенкарбоновой кислоты (сульфасалазин-DEPE), HCl соль бутилового эфира 1-циклопропил-6-фтор-4-оксо-7-пиперазин-1-ил-хинолин-3-карбоновой кислоты (ципрофлоксацин-ВЕ), HCl соль N,N-диэтиламиноэтилового эфира 1-этил-7-метил-4-оксо-[1,8]нафтиридин-3-карбоновой кислоты (налидиксовая кислота-DEE), а также фармацевтическую композицию, содержащую эффективное количество такого соединения и фармацевтически приемлемый носитель. 2 н. и 2 з.п. ф-лы, 19 пр., 9 табл., 6 ил.




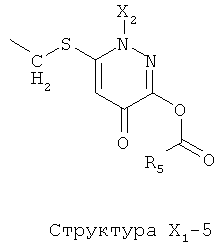
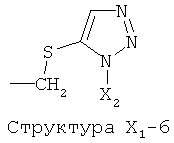


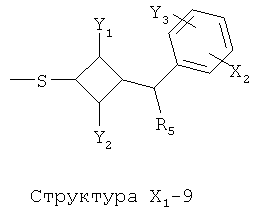
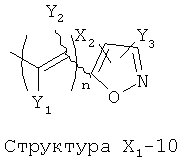






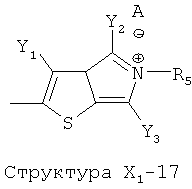







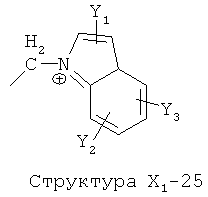











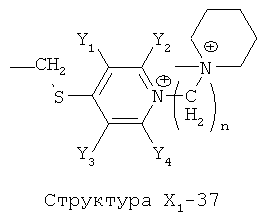













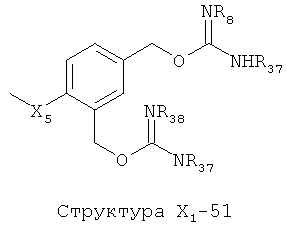
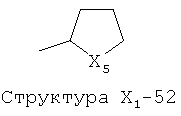





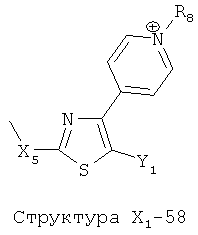
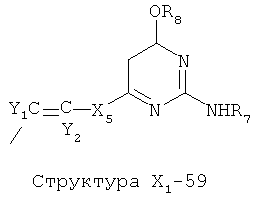
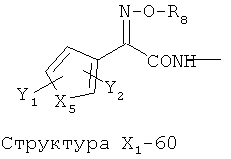


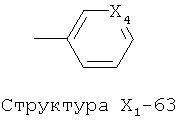



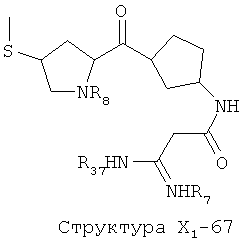
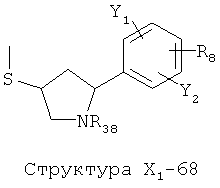
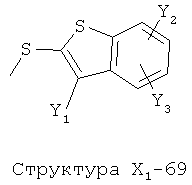



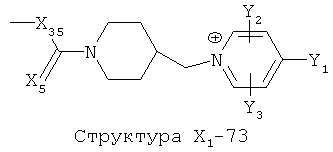


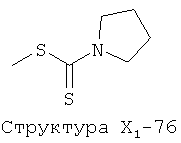










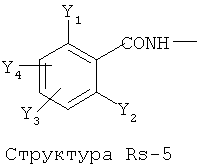


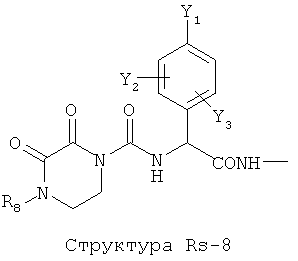









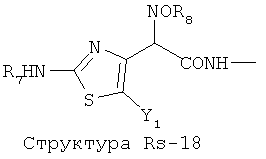

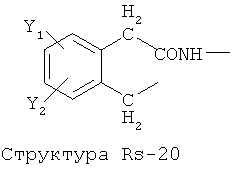


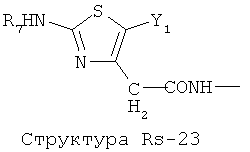

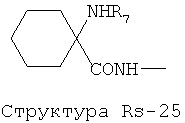


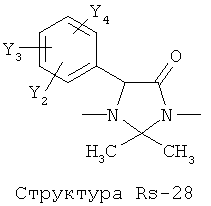


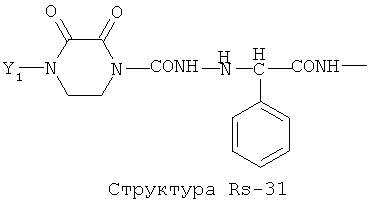



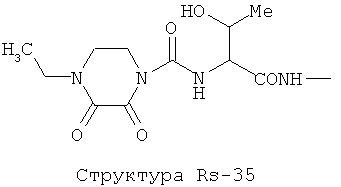






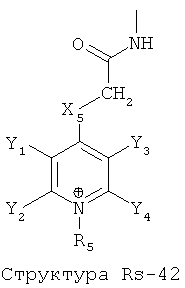












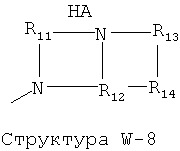

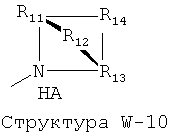


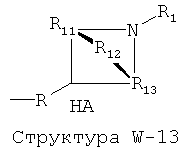




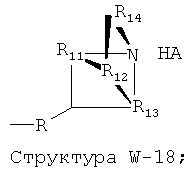
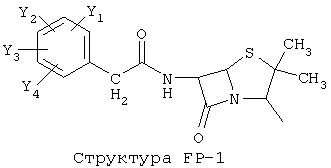
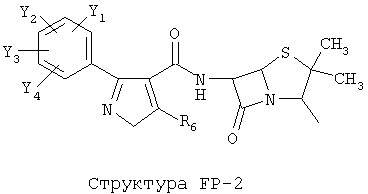







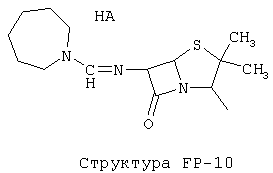




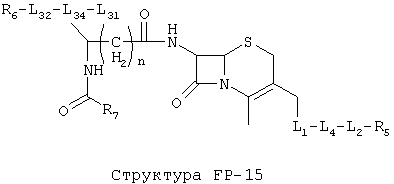



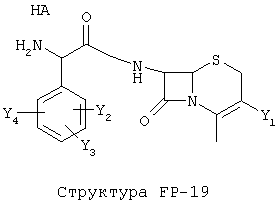

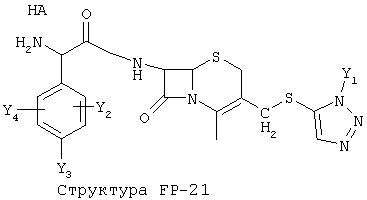





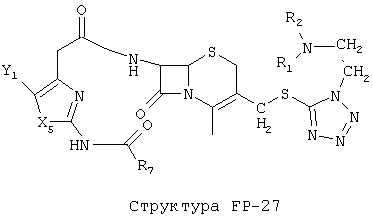

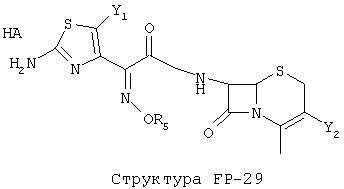





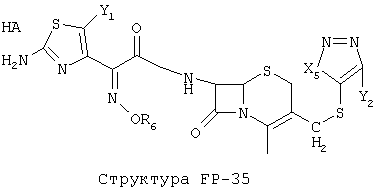
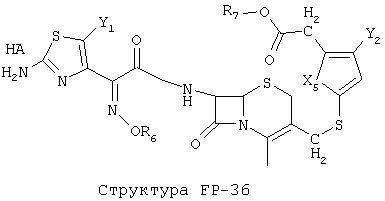



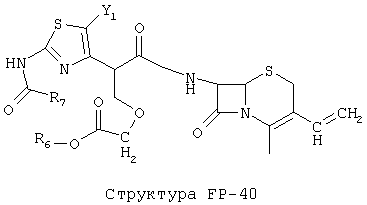



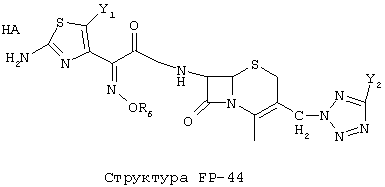
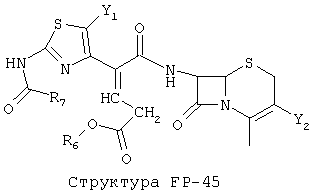


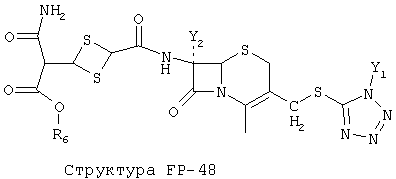




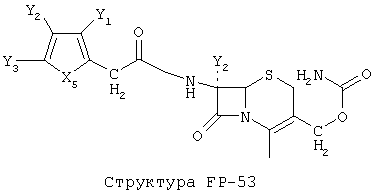



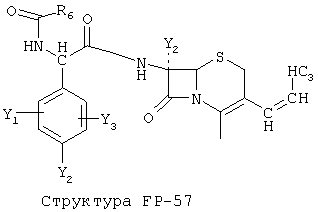






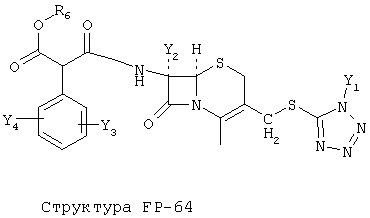
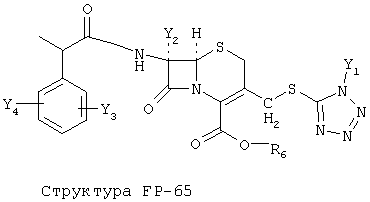





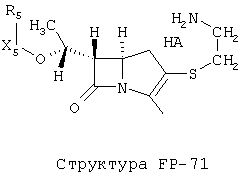
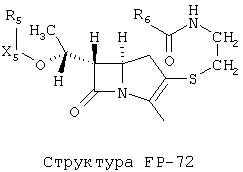


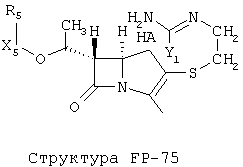



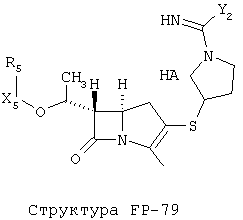




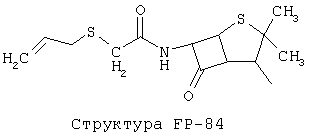

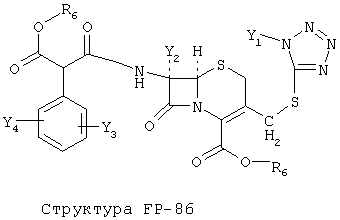
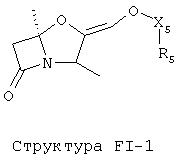

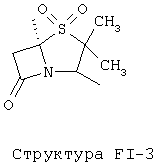
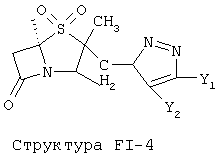




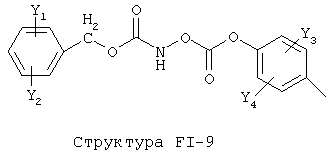

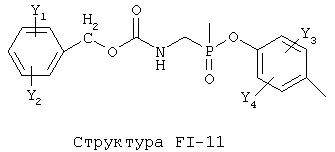



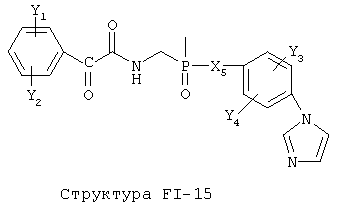
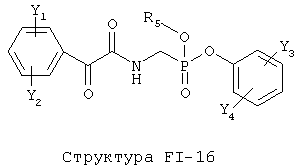




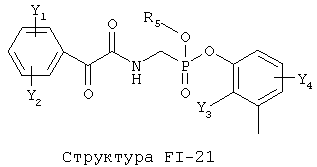



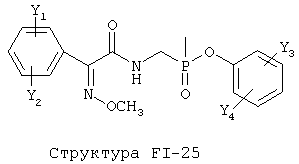





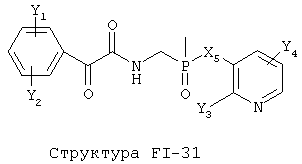
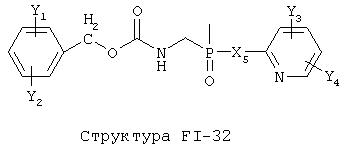
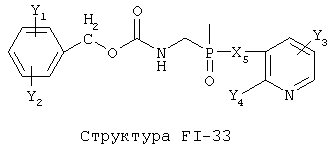
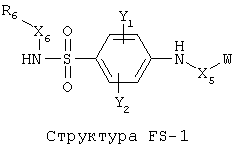




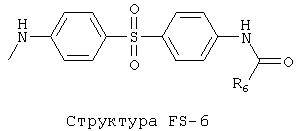







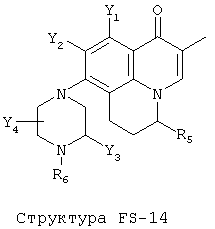


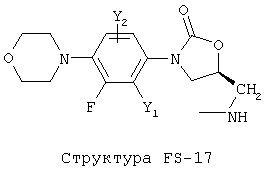






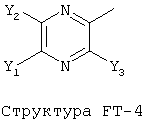

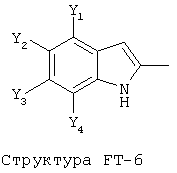

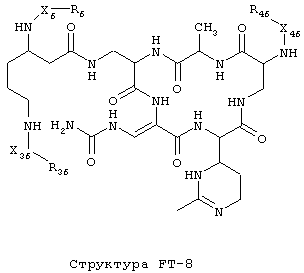











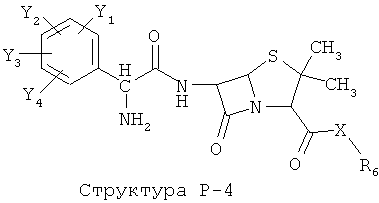




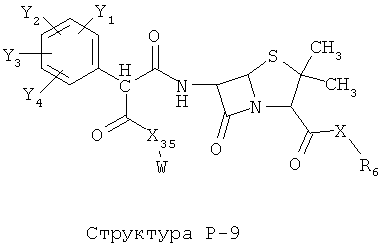
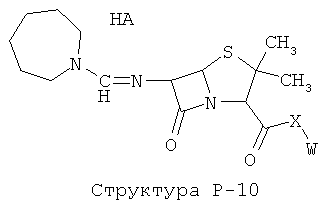
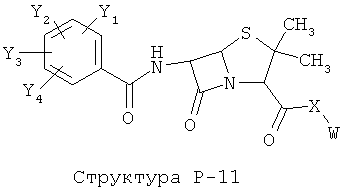









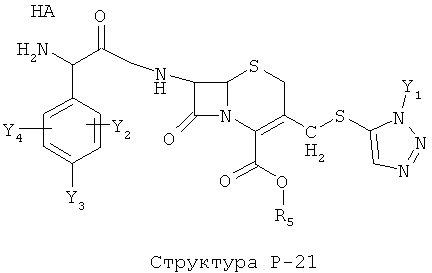








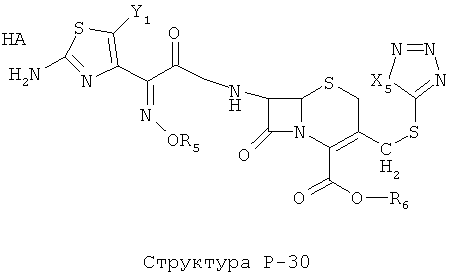
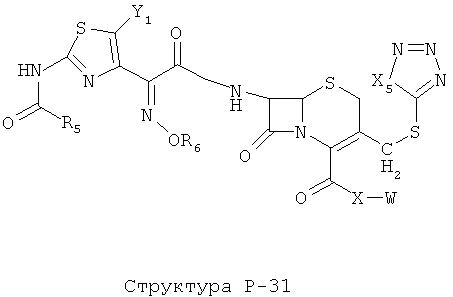
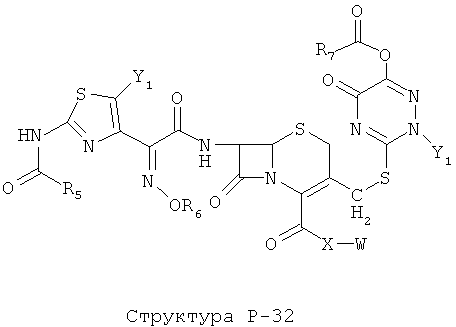
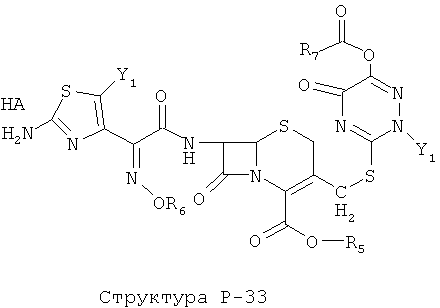


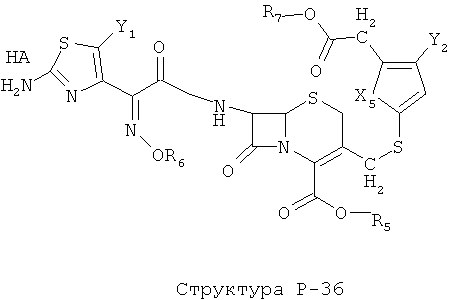
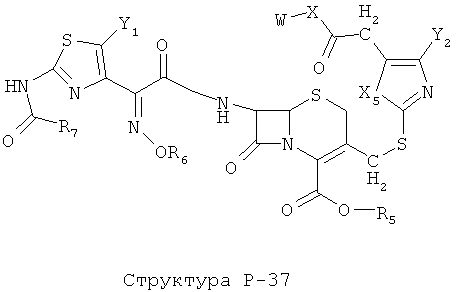
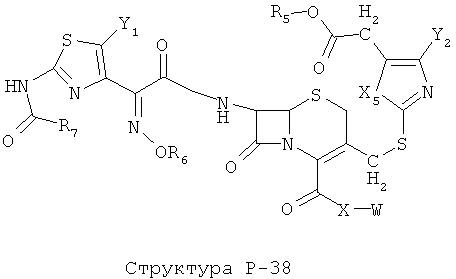




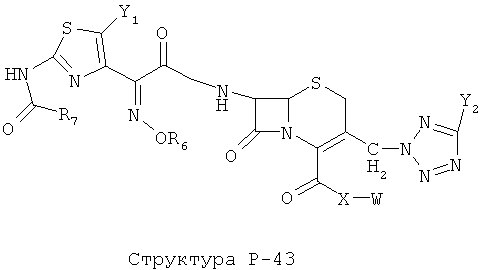
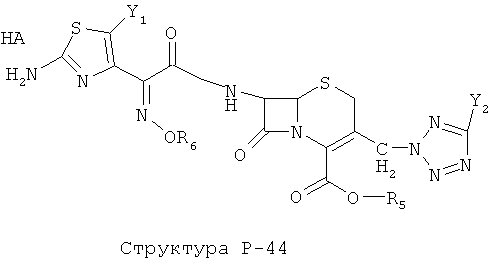
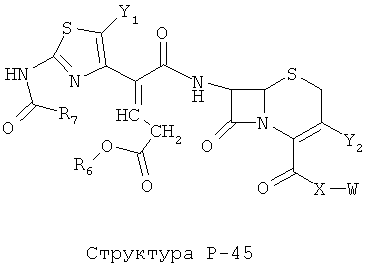


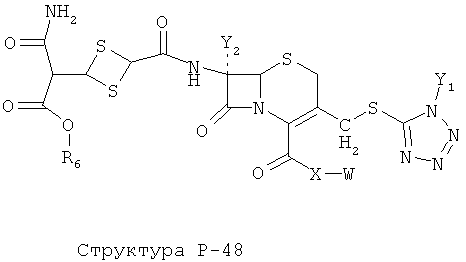



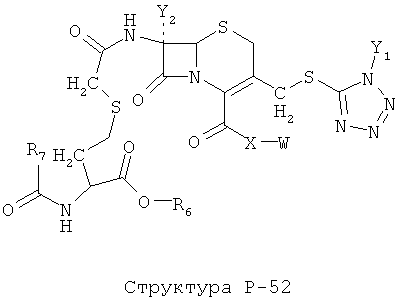
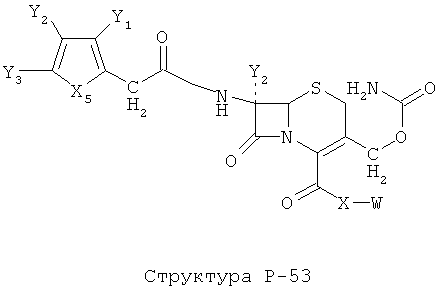



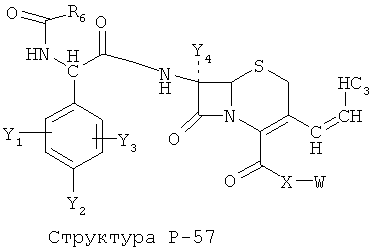







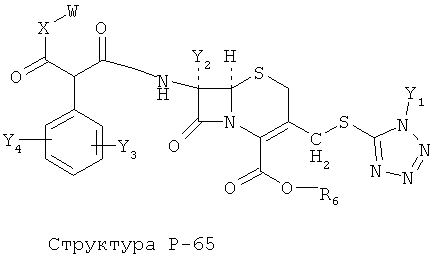

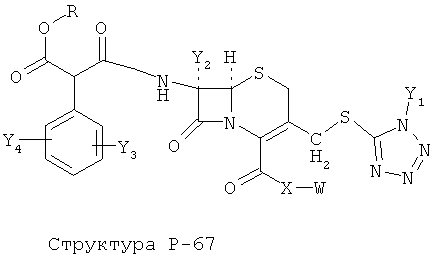




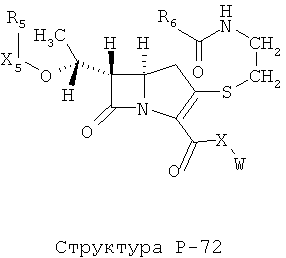

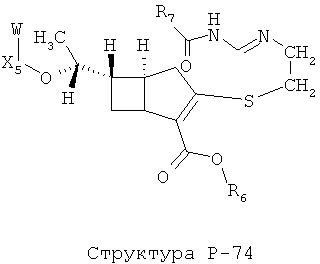
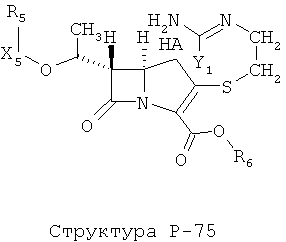
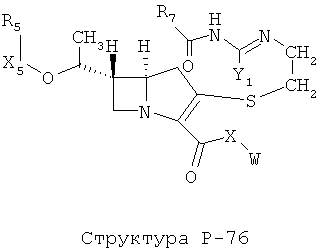
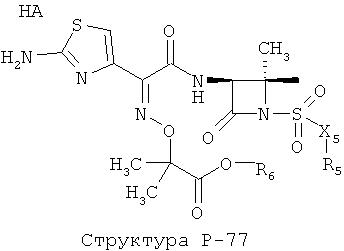






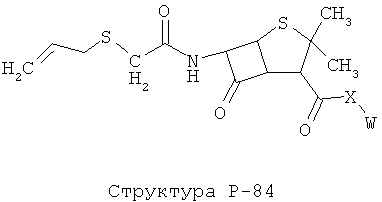
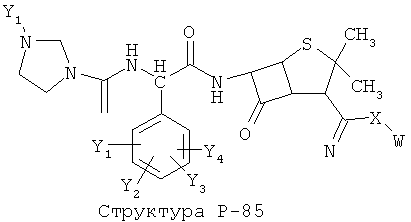




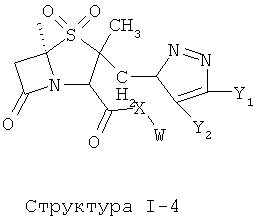

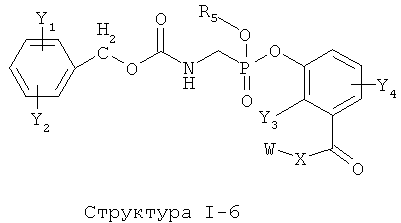
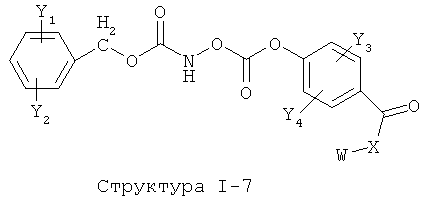



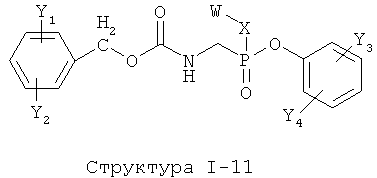









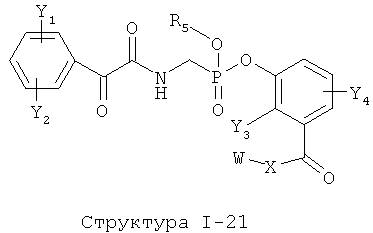


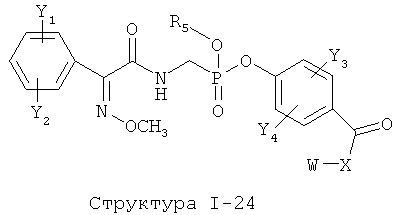
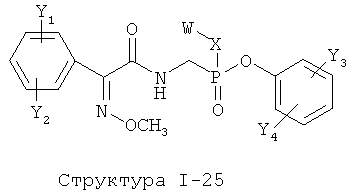
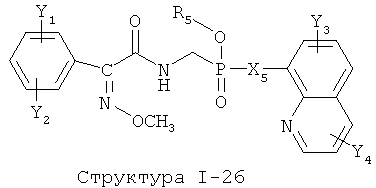








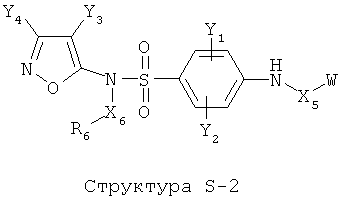





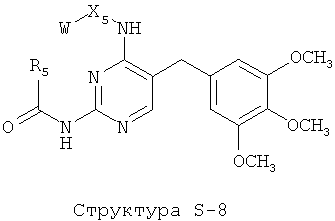






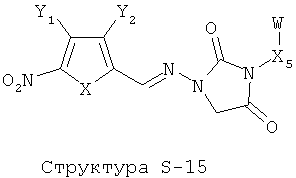
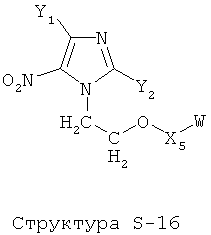





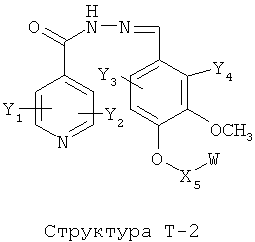















Комментарии