Функциональный пищевой продукт, содержащий очищенный экстракт (atc2), выделенный из pseudolysimachion rotundum var subintegrum, с высоким содержанием активного ингредиента, для предотвращения или лечения воспаления, аллергии и астмы - RU2682653C1
Код документа: RU2682653C1
Чертежи







Описание
Область техники
[1] Настоящее изобретение относится к функциональному пищевому продукту на основе очищенного экстракта, выделенного из Pseudolysimachion rotundum var subintegrum, содержащего большое количество активного ингредиента, для предотвращения или лечения воспаления, аллергии и астмы.
Уровень техники
[2] В целом, воспалительная реакция является нормальной реакцией человеческого организма, вызванной отеком, болью и т. д., в том случае, если произошло какое-либо проникновение в ткань или клетку, которое вызывало некоторые органические изменения в данной ткани или клетке. Недавно было установлено, что в патогенез воспалительного заболевания вовлечены различные виды цитокинов.
[3] Аллергические реакции могут быть разделены на четыре категории, а именно на реакции I, II, III и IV типа в соответствии с разновидностями ответов, или на две категории, а именно на аллергическую реакцию немедленного типа, такого как тип I, II или III, и аллергическую реакцию замедленного типа, такого как тип IV, в соответствии с продолжительностью периода времени, прошедшего с момента повторной сенсибилизации, вызванной аллергеном, до времени начала реакции.
[4] Из всех перечисленных аллергических реакций аллергия I типа, которая протекает с участием антител IgE и называется аллергией анафилактического типа, вызывает бронхиальную астму, атопические заболевания, такие как дерматит или гастроэнтерит и т. д., аллергический ринит, такой как сенная лихорадка, аллергический конъюнктивит, пищевую аллергию и тому подобное.
[5] Астма считается сложным синдромом, поражающим дыхательные пути, который характеризуется различными клиническими симптомами, например, кашлем, одышкой, вызванной обструкцией дыхательных путей, острым или хроническим воспалением дыхательных путей, гиперчувствительностью дыхательных путей (AHR) и их структурной перестройкой, и может поддаваться обратимому или необратимому излечению. В большинстве случаев астма представляет собой аллергическое заболевание и характеризуется хроническим воспалением дыхательных путей и гиперчувствительностью бронхов (Minoguchi K and Adachi M., Pathophysiology of asthma. In: Cherniack NS, Altose MD, Homma I. editors. Rehabilitation of the patient with respiratory disease. New York: McGraw-Hill, 1999, pp97-104).
[6] Астма может быть разделена на два типа, а именно на приобретенную бронхиальную астму и эндогенную бронхиальную астму. Приобретенная астма вызывается воздействием антигена и имеет положительную реакцию при аллергической кожной пробе или бронхопровокационном аллерготесте на антиген. В целом, снижается возраст, при котором начинает развиваться это заболевание. Такой тип астмы в основном вызывается клещами домашней пыли из рода Dermatophagoides, пыльцой, эпителием животных, грибками и т. п. Эндогенная астма вызывается инфекциями верхних дыхательных путей, физическим упражнением, эмоциональной неустойчивостью, изменением климата и влажности и наиболее распространена у взрослых пациентов. Помимо этого при приобретенной астме комплекс IgE-антиген можно обнаружить с помощью аллергической кожной пробы вследствие увеличения уровня IgE в сыворотке крови.
[7] С точки зрения патофизиологии астма рассматривается как хроническое воспаление, обусловленное Т-хелперами 2 типа (Th2), и различные медиаторы воспаления, такие как цитокины, хемокины, сигнальные молекулы, молекулы адгезии и факторы роста, иммунные клетки и структурные клетки в дыхательных путях, участвуют в различных стадиях патогенеза астмы (Elias JA et al., J Clin Invest., 111, pp 291-7, 2003). Активированные воспалительные клетки, такие как эозинофилы, тучные клетки, альвеолярные макрофаги и т.д., в бронхах пациентов, страдающих астмой, высвобождают различные медиаторы воспаления, такие как содержащие цистеин лейкотриены, простагландины и т.д., и принимают участие в мощном сужении бронхов (Maggi E., Immunotechnology 3, pp233-244, 1998; Pawankar R. Curr. Opin. Allergy Clin. Immunol., 1, pp3-6, 2001; Barnes PJ et al., Phamacol. Rev. 50, pp515-596, 1998).
[8] Соответственно, ввиду того, что выработка различных цитокинов, участвующих в активации воспалительных клеток, таких как ИЛ-4, ИЛ-5, ИЛ-13 и т.д., и IgE, и выработка цистеинсодержащих лейкотриенов, которые высвобождаются из воспалительных клеток, являются основными причинами воспаления, аллергической реакции и астмы, вплоть до настоящего времени проводились активные исследования этих соединений, направленные на разработку агентов, ингибирующих их выработку.
[9] Авторы настоящего изобретения сосредоточили свои усилия на разработке сильного терапевтического агента, полученного безопасно и эффективно из природных ресурсов, таких как растения, животные и т. д., где указанный терапевтический агент обладает сильной ингибиторной активностью в отношении выработки воспалительных клеток, и, наконец, обнаружили, что экстракт Pseudolysimachion longifolium продемонстрировал сильную противовоспалительную, противоаллергическую и противоастматическую активность (патент Кореи №10-860080), и различные соединения, выделенные из указанного экстракта, такие как верпрозид (6-О-3,4-дигидроксибензоилкаталпол), пикрозид II (6-О-4-гидрокси-3-метоксибензоилкаталпол), верминозид (6-О-3,4-дигидроксициннамоилкаталпол), 6-О-вератроилкаталпол (6-О-3,4-диметоксибензоилкаталпол), минекозид (6-О-3-гидрокси-4-метоксициннамоилкаталпол), каталпол и т. п., также продемонстрировали сильную противовоспалительную, противоаллергическую и противоастматическую активность (публикация заявки на патент Кореи №10-2006-125499).
[10] Тем не менее, при массовом производстве и промышленном применении экстракта Pseudolysimachion longifolium возникает ряд трудностей, поскольку растительный экстракт содержит очень небольшое количество активных ингредиентов, таких как производные каталпола.
[11] Pseudolysimachion rotundum var subintegrum представляет собой многолетнее травянистое растение, распространенное в Корее, Китае, Японии, на острове Сахалин и в России.
[12] Основываясь на результатах предыдущих исследований, направленных на изучение противовоспалительной, противоаллергической и противоастматической активности экстракта Pseudolysimachion longifolium, раскрытого в патенте Кореи №10-860080, авторы настоящего изобретения предприняли попытку разработать более эффективный способ получения более сильных и более концентрированных ингредиентов, демонстрирующих противовоспалительную, противоаллергическую и противоастматическую активность, выделенных из экстракта Pseudolysimachion rotundum var subintegrum.
[13] Однако сообщения или описания эффективного способа получения более сильных и более концентрированных ингредиентов, демонстрирующих противовоспалительную, противоаллергическую и противоастматическую активность, выделенных из экстракта Pseudolysimachion rotundum var subintegrum, в сравнении со способами, раскрытыми в приведенных выше литературных источниках, принципы изобретения которых включены в настоящую заявку посредством ссылки, отсутствовали.
[14] В связи с этим авторы настоящего изобретения обнаружили новый пригодный к применению в промышленности способ получения очищенного экстракта, содержащего большее количество активных ингредиентов, таких как производные каталпола, из экстракта Pseudolysimachion rotundum var subintegrum, при этом указанный очищенный экстракт продемонстрировал более сильную противовоспалительную, противоаллергическую и противоастматическую активность, чем экстракт, полученный с помощью стандартного способа получения, раскрытого в уровне техники, согласно результатам различных исследований в условиях in vivo, таких как исследование ингибирования выработки эозинофилов, высвобождения иммуноглобулина и воспалительных хемокинов в плазму крови и бронхоальвеолярную жидкость, а также исследование подавления гиперчувствительности дыхательных путей и гиперплазии бокаловидных клеток в ОВА-сенсибилизированной/иммунизированной модели на мышах.
Сущность изобретения
Техническая задача
[15] В настоящем изобретении предложен диетический пищевой продукт, содержащий в качестве активного ингредиента очищенный экстракт согласно изобретению, содержащий большое количество активных ингредиентов, таких как производные каталпола из Pseudolysimachion rotundum var subintegrum в качестве активного ингредиента, в количестве, эффективном для лечения и профилактики воспалительных, аллергических или астматических заболеваний.
Решение задачи
[16] Соответственно, задача настоящего изобретения заключается в том, чтобы обеспечить новый функциональный пищевой продукт, содержащий очищенный экстракт, содержащий большое количество производных каталпола, выделенный из экстракта Pseudolysimachion rotundum var subintegrum.
[17] В настоящем документе термин «производные каталпола» включает верпрозид, каталпозид, пикрозид II, изованиллоилкаталпол, 6-O-вератроилкаталпол и т. д.
[18] В настоящем документе термин «Pseudolysimachion rotundum var subintegrum» включает культивированное или выращенное в природных условиях растение и коммерчески доступное растение, но не ограничивается такими растениями, описанными в настоящем документе.
[19] В настоящем документе термин «новый очищенный экстракт» включает: (a) очищенный экстракт, фракционированный с использованием бутанола (в дальнейшем обозначенный как «ATC1»), и (b) очищенный экстракт после вторичного фракционирования (в дальнейшем обозначенный как «ATC2»).
[20] В частности, термин «очищенный экстракт, фракционированный с использованием бутанола (ATC1)», характеризуется содержанием 15-50% (масс./масс.) верпрозида, 0,3-10% (масс./масс.) вератровой кислоты, 0,5-10% (масс./масс.) каталпозида, 0,3-10% (масс./масс.) пикрозида II, 0,3-10% (масс./масс.) изованиллоилкаталпола и 0,3-10% (масс./масс.) 6-О-вератроилкаталпола в расчете на общую массу экстракта (100%) Pseudolysimachion rotundum var subintegrum; предпочтительно 20-25% (масс./масс.) верпрозида, 0,5-5% (масс./масс.) вератровой кислоты, 1-5% (масс./масс.) каталпозида, 0,5-5% (масс./масс.) пикрозида II, 0,5-5% (масс./масс.) изованиллоилкаталпола и 1-5% (масс./масс.) 6-О-вератроилкаталпола в расчете на общую массу экстракта (100%) Pseudolysimachion rotundum var subintegrum;
[21] или характеризуется содержанием производных каталпозида 12,3-47% (масс./масс.) в общем экстракте (100%) из Pseudolysimachion rotundum var subintegrum и относительным смешанным отношением (масс./масс.) каждого из производных каталпозида, составляющим 15,0-18,0 (масс./масс.) верпрозида, 2,10-2,60 (масс./масс.) каталпозида, 1 (масс./масс.) пикрозида II, 1,00-1,30 (масс./масс.) изованиллоилкаталпола и 2,00-2,30 (масс./масс.) 6-О-вератроилкаталпола; предпочтительно 16,0-17,0 (масс./масс.) верпрозида, 2,20-2,50 (масс./масс.) каталпозида, 1 (масс./масс.) пикрозида II, 1,10-1,20 (масс./масс.) изованиллоилкаталпола и 2,10-2,20 (масс./масс.) 6-О-вератроилкаталпола; более предпочтительно 16,20-16,99 (масс./масс.) верпрозида, 2,40-2,45 (масс./масс.) каталпозида, 1 (масс./масс.) пикрозида II, 1,10-1,19 (масс./масс.) изованиллоилкаталпола и 2,10-2,19 (масс./масс.) 6-О-вератроилкаталпола.
[22] Более конкретно термин «очищенный экстракт, фракционированный с использованием бутанола (ATC1)» характеризуется тем, что указанный экстракт получают способом, согласно которому: добавляют по меньшей мере один экстрагирующий растворитель, выбранный из воды, C1-C4-низшего спирта, такого как метанол, этанол, бутанол и т.д. или их смеси, предпочтительно смесь воды и этанола, более предпочтительно 30-80 (масс./масс.) этанола в воде, к высушенному Pseudolysimachion rotundum var subintegrum на 1-м этапе; экстрагируют по меньшей мере одним способом экстракции, выбранным из экстракции горячей водой с обратным холодильником, экстракции холодной водой, экстракции ультразвуком или обычной экстракции, предпочтительно экстрагируют холодной водой с последующей экстракцией с обратным холодильником при температуре в диапазоне от 10 до 100 °C, предпочтительно от 20 до 90 °C, в течение периода от 30 минут до 72 часов, предпочтительно от 6 часов до 48 часов, более предпочтительно экстрагируют холодной водой при температуре в диапазоне от 10 до 60 °C, предпочтительно от 20 до 50 °C, в течение периода от 30 минут до 72 часов, предпочтительно от 6 часов до 48 часов, с последующей экстракцией с обратным холодильником при температуре от 40 до 120 °C, предпочтительно от 60 до 90 °C, в течение периода от 30 минут до 72 часов, предпочтительно от 6 часов до 48 часов, повторяют указанные этапы, чтобы получить указанный 1-й экстракт на 2-м этапе; суспендируют указанный 1-й экстракт в приблизительно 0,5-10-кратном объеме (об./об.), предпочтительно в приблизительно 1-5-кратном объеме (об./об.) воды с получением суспендированного экстракта на 3-м этапе; и добавляют приблизительно 0,5-20-кратный объем (об./об.), предпочтительно приблизительно 1-10-кратный объем (об./об.) бутанола, фракционируют в водном слое и бутанольном слое, и собирают бутанольный слой с получением указанного очищенного экстракта, фракционированного с использованием бутанола (ATC1), содержащего 15-50% (масс./масс.) верпрозида, 0,3-10% (масс./масс.) вератровой кислоты, 0,5-10% (масс./масс.) каталпозида, 0,3-10% (масс./масс.) пикрозида II, 0,3-10% (масс./масс.) изованиллоилкаталпола и 0,3-10% (масс./масс.) 6-О-вератроилкаталпола в расчете на общую массу экстракта (100%) Pseudolysimachion rotundum var subintegrum, для лечения и предотвращения воспалительного, аллергического или астматического заболевания.
[23] Соответственно, в другом варианте реализации, настоящее изобретение также относится к способу получения указанного очищенного экстракта, фракционированного с использованием бутанола (ATC1), выделенного из Pseudolysimachion rotundum var subintegrum, согласно которому: добавляют по меньшей мере один экстрагирующий растворитель, выбранный из воды, C1-C4-низшего спирта, такого как метанол, этанол, бутанол и т.д. или их смеси, предпочтительно смесь воды и этанола, более предпочтительно 30-80 (масс./масс.) этанола в воде, к высушенному Pseudolysimachion rotundum var subintegrum на 1-м этапе; экстрагируют по меньшей мере одним способом экстракции, выбранным из экстракции горячей водой с обратным холодильником, экстракции холодной водой, экстракции ультразвуком или обычной экстракции, предпочтительно экстрагируют холодной водой с последующей экстракцией с обратным холодильником при температуре в диапазоне от 10 до 100 °C, предпочтительно от 20 до 90 °C, в течение периода от 30 минут до 72 часов, предпочтительно от 6 часов до 48 часов, более предпочтительно экстрагируют холодной водой при температуре в диапазоне от 10 до 60 °C, предпочтительно от 20 до 50 °C, в течение периода от 30 минут до 72 часов, предпочтительно от 6 часов до 48 часов, с последующей экстракцией с обратным холодильником при температуре от 40 до 120 °C, предпочтительно от 60 до 90 °C, в течение периода от 30 минут до 72 часов, предпочтительно от 6 часов до 48 часов, повторяют указанные этапы, чтобы получить указанный 1-й экстракт на 2-м этапе; суспендируют указанный 1-й экстракт в приблизительно 0,5-10-кратном объеме (об./об.), предпочтительно в приблизительно 1-5-кратном объеме (об./об.) воды с получением суспендированного экстракта на 3-м этапе; и добавляют приблизительно 0,5-20-кратный объем (об./об.), предпочтительно приблизительно 1-10-кратный объем (об./об.) бутанола, фракционируют в водном слое и бутанольном слое, и собирают бутанольный слой с получением указанного очищенного экстракта, фракционированного с использованием бутанола (ATC1), содержащего 15-50% (масс./масс.) верпрозида, 0,3-10% (масс./масс.) вератровой кислоты, 0,5-10% (масс./масс.) каталпозида, 0,3-10% (масс./масс.) пикрозида II, 0,3-10% (масс./масс.) изованиллоилкаталпола и 0,3-10% (масс./масс.) 6-О-вератроилкаталпола в расчете на общую массу экстракта (100%) Pseudolysimachion rotundum var subintegrum, для лечения и предотвращения воспалительного, аллергического или астматического заболевания.
[24] В частности, термин «очищенный экстракт после вторичного фракционирования (ATC2)» характеризуется содержанием 30-60% (масс./масс.) верпрозида, 0,5-10% (масс./масс.) вератровой кислоты, 2-20% (масс./масс.) каталпозида, 1-10% (масс./масс.) пикрозида II, 1-10% (масс./масс.) изованиллоилкаталпола и 2-20% (масс./масс.) 6-О-вератроилкаталпола в расчете на общую массу экстракта (100%) Pseudolysimachion rotundum var subintegrum; предпочтительно 40-50% (масс./масс.) верпрозида, 1-5% (масс./масс.) вератровой кислоты, 3-10% (масс./масс.) каталпозида, 2-5% (масс./масс.) пикрозида II, 2-8% (масс./масс.) изованиллоилкаталпола и 3-8% (масс./масс.) 6-О-вератроилкаталпола в расчете на общую массу экстракта (100%) Pseudolysimachion rotundum var subintegrum;
[25] или характеризуется содержанием 36,5-91% (масс./масс.) производных каталпозида в общем экстракте (100%) Pseudolysimachion rotundum var subintegrum и относительным смешанным отношением (масс./масс.) каждого из производных каталпозида равным 13,0-16,0 (масс./масс.) верпрозида, 2,20-2,50 (масс./масс.) каталпозида, 1 (масс./масс.) пикрозида II, 1,10-1,40 (масс./масс.) изованиллоилкаталпола и 2,00-2,20 (масс./масс.) 6-О-вератроилкаталпола; предпочтительно 14,0-15,0 (масс./масс.) верпрозида, 2,30-2,45 (масс./масс.) каталпозида, 1 (масс./масс.) пикрозида II, 1,20-1,35 (масс./масс.) изованиллоилкаталпола и 2,00-2,10 (масс./масс.) 6-О-вератроилкаталпола; более предпочтительно 14,50-14,99 (масс./масс.) верпрозида, 2,35-2,43 (масс./масс.) каталпозида, 1 (масс./масс.) пикрозида II, 1,25-1,34 (масс./масс.) изованиллоилкаталпола и 2,01-2,09 (масс./масс.) 6-О-вератроилкаталпола.
[26] Более конкретно, термин «очищенный экстракт после вторичного фракционирования (ATC2)» характеризуется тем, что в соответствии со способом его получения: добавляют по меньшей мере один экстрагирующий растворитель, выбранный из воды, C1-C4-низшего спирта, такого как метанол, этанол, бутанол и т.д. или их смеси, предпочтительно смесь воды и этанола, более предпочтительно 30-80% (масс./масс.) этанола в воде, к высушенному Pseudolysimachion rotundum var subintegrum на 1-м этапе; экстрагируют по меньшей мере одним способом экстракции, выбранным из экстракции горячей водой с обратным холодильником, экстракции холодной водой, экстракции ультразвуком или обычной экстракции, предпочтительно экстрагируют холодной водой с последующей экстракцией с обратным холодильником при температуре в диапазоне от 10 до 100 °C, предпочтительно от 20 до 90 °C, в течение периода от 30 минут до 72 часов, предпочтительно от 6 часов до 48 часов, более предпочтительно экстрагируют холодной водой при температуре в диапазоне от 10 до 60 °C, предпочтительно от 20 до 50 °C, в течение периода от 30 минут до 72 часов, предпочтительно от 6 часов до 48 часов, с последующей экстракцией с обратным холодильником при температуре от 40 до 120 °C, предпочтительно от 60 до 90 °C, в течение периода от 30 минут до 72 часов, предпочтительно от 6 часов до 48 часов, повторяют указанные этапы, чтобы получить указанный 1-й экстракт на 2-м этапе; суспендируют указанный 1-й экстракт в приблизительно 0,5-10-кратном объеме (об./об.), предпочтительно в приблизительно 1-5-кратном объеме (об./об.) воды с получением суспендированного экстракта на 3-м этапе; добавляют приблизительно 0,5-20-кратный объем (об./об.), предпочтительно приблизительно 1-10-кратный объем (об./об.) бутанола, фракционируют в водном слое и бутанольном слое, и собирают бутанольный слой с получением указанного очищенного экстракта, фракционированного с использованием бутанола (ATC1), на 3-м этапе; и очищают указанный очищенный экстракт, фракционированный с использованием бутанола (ATC1), по меньшей мере одним способом очистки, выбранным из группы, состоящей из распределительной хроматографии с обращенной фазой, распределительной хроматографии с нормальной фазой, ионообменной хроматографии и гель-проникающей хроматографии, чтобы получить указанный очищенный экстракт после вторичного фракционирования (ATC2), содержащий 30-60% (масс./масс.) верпрозида, 0,5-10% (масс./масс.) вератровой кислоты, 2-20% (масс./масс.) каталпозида, 1-10% (масс./масс.) пикрозида II, 1-10% (масс./масс.) изованиллоилкаталпола и 2-20% (масс./масс.) 6-О-вератроилкаталпола в расчете на общую массу экстракта (100%) Pseudolysimachion rotundum var subintegrum, для лечения и предотвращения воспалительного, аллергического или астматического заболевания.
[27] Соответственно, в другом варианте реализации, настоящее изобретение также относится к способу получения указанного очищенного экстракта после вторичного фракционирования (ATC2), выделенного из Pseudolysimachion rotundum var subintegrum, в соответствии с которым: добавляют по меньшей мере один экстрагирующий растворитель, выбранный из воды, C1-C4-низшего спирта, такого как метанол, этанол, бутанол и т.д. или их смеси, предпочтительно смесь воды и этанола, более предпочтительно 30-80% (масс./масс.) этанола в воде, к высушенному Pseudolysimachion rotundum var subintegrum на 1-м этапе; экстрагируют по меньшей мере одним способом экстракции, выбранным из экстракции горячей водой с обратным холодильником, экстракции холодной водой, экстракции ультразвуком или обычной экстракции, предпочтительно экстрагируют холодной водой с последующей экстракцией с обратным холодильником при температуре в диапазоне от 10 до 100 °C, предпочтительно от 20 до 90 °C, в течение периода от 30 минут до 72 часов, предпочтительно от 6 часов до 48 часов, более предпочтительно экстрагируют холодной водой при температуре в диапазоне от 10 до 60 °C, предпочтительно от 20 до 50 °C, в течение периода от 30 минут до 72 часов, предпочтительно от 6 часов до 48 часов, с последующей экстракцией с обратным холодильником при температуре от 40 до 120 °C, предпочтительно от 60 до 90 °C, в течение периода от 30 минут до 72 часов, предпочтительно от 6 часов до 48 часов, повторяют указанные этапы, чтобы получить указанный 1-й экстракт на 2-м этапе; суспендируют указанный 1-й экстракт в приблизительно 0,5-10-кратном объеме (об./об.), предпочтительно в приблизительно 1-5-кратном объеме (об./об.) воды с получением суспендированного экстракта на 3-м этапе; добавляют приблизительно 0,5-20-кратный объем (об./об.), предпочтительно приблизительно 1-10-кратный объем (об./об.) бутанола, фракционируют в водном слое и бутанольном слое, и собирают бутанольный слой с получением указанного очищенного экстракта, фракционированного с использованием бутанола (ATC1), на 3-м этапе; и очищают указанный очищенный экстракт, фракционированный с использованием бутанола (ATC1), по меньшей мере одним способом очистки, выбранным из группы, состоящей из распределительной хроматографии с обращенной фазой, распределительной хроматографии с нормальной фазой, ионообменной хроматографии и гель-проникающей хроматографии, с получением указанного очищенного экстракта после вторичного фракционирования (ATC2), содержащего 30-60% (масс./масс.) верпрозида, 0,5-10% (масс./масс.) вератровой кислоты, 2-20% (масс./масс.) каталпозида, 1-10% (масс./масс.) пикрозида II, 1-10% (масс./масс.) изованиллоилкаталпола и 2-20% (масс./масс.) 6-О-вератроилкаталпола в расчете на общую массу экстракта (100%) Pseudolysimachion rotundum var subintegrum, для лечения и предотвращения воспалительного, аллергического или астматического заболевания.
[28] В частности, термин «дополнительный способ очистки» выбран из (i) распределительной хроматографии с обращенной фазой, (ii) распределительной хроматографии с нормальной фазой, (iii) ионообменной хроматографии или (iv) гель-проникающей хроматографии, предпочтительно распределительной хроматографии с обращенной фазой или любого хроматографического метода, в котором в качестве неподвижной фазы используется любая смола, которая может удерживать неполярное вещество во время элюирования полярного вещества, например, смола сефадекс, такая как сефадекс, сефадекс LH20, сефадекс G-25, сефадекс G-10, сефароза, супердекс, метилакрилатная смола, карбоксиметилцеллюлоза, сульфопропилцеллюлоза, карбоксиметилсефадекс, сульфопропилсефадекс, карбоксиметилсефароза, сульфопропилсефароза и т. п.; смола на основе обратного полимера, в которой используется сополимер стирена-дивинилбензола, такой как полимер X, HP20, полимер PRP-h1 и т. п., или смола-носитель на основе метакрилата и т.д.; стандартный силикагель, такой как продукт BPC (хроматография на неподвижной фазе), продукт диоксида кремния, закупленный у YMC Co. Ltd, продукт диоксида кремния, закупленный у DAISO Co. Ltd, продукт диоксида кремния, закупленный у ASAHI Co. Ltd, продукт диоксида кремния, закупленный у COSMOSYL Co. Ltd и т. п.; продукт октадецилсиликагеля, использованный в качестве наполнителя для ВЭЖХ, такой как продукт октадецилсиликагеля, закупленный у YMC Co. Ltd, продукт октадецилсиликагеля, закупленный у DAISO Co. Ltd, продукт октадецилсиликагеля, закупленный у ASAHI Co. Ltd, продукт октадецилсиликагеля, закупленный у CHEMCO Co. Ltd, продукт октадецилсиликагеля, закупленный у Merck Co. Ltd, продукт октадецилсиликагеля, закупленный у COSMOSYL Co. Ltd, продукт октадецилсиликагеля, закупленный у FUJI Co. Ltd и т. п.
[29] В предпочтительном варианте реализации, в соответствии с которым в качестве дополнительного процесса очистки согласно настоящему изобретению используется (i) распределительная хроматография с обращенной фазой, «неподвижная фаза вышеописанной распределительной хроматографии с обращенной фазой» может представлять собой любые неподвижные фазы, например, неподвижной фазой может быть вещество, используемое в качестве обращенной фазы, которое может удерживать неполярное вещество во время элюирования полярного вещества, предпочтительно неподвижная фаза на основе силикагеля, неподвижная фаза на основе полимера, такого как полистирол и т.д., и т. п., более предпочтительно неподвижная фаза на основе производных силикагеля, таких как С2, С4, С6, С8, С10, С12, C14, С16, С18 и т. п.; или неподвижная фаза на основе полимера, такого как PS-2, Oasis HLB и т. п., более предпочтительно в качестве обращенной фазы используют силикагель (C18(IV)-D), продукт ODS-A/ODS-AQ от YMC Co. Ltd., продукт SP-C-ODS от CHEMCO Co. Ltd., продукт SP-ODS-RPS от DAISO Co. Ltd., продукт 5C18 от COSMOSYL Co. Ltd., продукт Chromatorex от FUJI Co. Ltd., и т.д.
[30] В предпочтительном варианте реализации, в соответствии с которым в качестве дополнительного способа очистки согласно настоящему изобретению используется (i) распределительная хроматография с обращенной фазой, «подвижная фаза в вышеописанной (i) распределительной хроматографии с обращенной фазой» может представлять собой по меньшей мере один растворитель, выбранный из воды, ацетонитрила, низшего спирта, такого как метанол, этанол, бутанол и т.д., тетрагидрофурана (ТГФ) или его смеси, предпочтительно представляет собой воду, низший спирт, такой как метанол, этанол, бутанол и т.д., или их смесь, более предпочтительно смесь из растворителей воды и метанола, более предпочтительно смесь из растворителей воды и метанола в соотношении от 90:10 (об./об.) до 60:40 (об./об.), для элюирования полярного вещества.
[31] В предпочтительном варианте реализации, в соответствии с которым в качестве дополнительного способа очистки согласно настоящему изобретению используется (ii) распределительная хроматография с нормальной фазой, «неподвижная фаза в вышеописанной распределительной хроматографии с нормальной фазой» может представлять собой любые неподвижные фазы, например, в качестве неподвижной фазы можно использовать вещество с нормальной фазой, которое может задерживать полярное вещество во время элюирования неполярного вещества, предпочтительно может быть использована неподвижная фаза на основе силикагеля, Fluorosyl® или глинозема, или неподвижная фаза на основе полимера, содержащего фрагменты -CN, диол, -NH2, и т. п., более предпочтительно неподвижная фаза на основе силикагеля, Fluorosyl® или глинозема и т.д.
[32] В предпочтительном варианте реализации, в соответствии с которым в качестве дополнительного способа очистки согласно настоящему изобретению используется распределительная хроматография с нормальной фазой (ii), «подвижная фаза в вышеописанной (ii) распределительной хроматографии с нормально фазой» может представлять собой по меньшей мере один растворитель, выбранный из гексана, гептана, этилацетата, этанола, диэтилового эфира, 2-пропанола или их смеси, предпочтительно гексан, гептан, этилацетат или их смесь, для элюирования неполярного вещества.
[33] В предпочтительном варианте реализации, в соответствии с которым в качестве дополнительного способа очистки согласно настоящему изобретению используется (iii) ионообменная хроматография, «неподвижная фаза в вышеописанной (iii) ионообменной хроматографии» может представлять собой любые высокомолекулярные неподвижные фазы, которые содержат заряженный сшивающий фрагмент, предпочтительно катионообменную смолу, анионообменную смолу или синтетический адсорбент и т. п., более предпочтительно сильно кислую катионообменную смолу, такую как Amberlite IR-120, Dowex 60W-x8, SKIB и т.д.; слабокислую катионообменную смолу, такую как Amberlite IRA-67, Dowex 3-x4A и т.д.; сильно основную катионообменную смолу, такую как DIAION SKIB, DIAION PK216, DIAION CR20, DIAION UBK555 (Mitsubishi Chemical Co.), TRILITE SPC 160H, TRILITE SPC 180H, TRILITE SPC 400JH (Samyang Co. Ltd.), AMBERLITE 200C Na, AMBERLITE CG50, AMBERLITE CR1310 Na, AMBERJET 200H, AMBERLYST 131 WET, ALBERLYST 232 WET (ROHM и HAAS Co. Ltd.), Lewatit VP OC 1800, Lewatit VP OC 1812, Lewatit MDS1368 Na, Lewaitit K1221 (Bayer Co. Ltd.), PUROLITE PCR833CA, PUROLITE C145 (Purolite Co. Ltd.), MFG210, MFG 250 (Finex Co. Ltd.) и т.д.; сильно основную анионообменную смолу, такую как SA11A, SA20A, SA21A и т.д.; или CaptoQ (GE Healthcare Co. Ltd.), или смолу, обладающую аналогичными свойствами, такую как Toyopearl QEA (Tosoh Co. Ltd.), Q Sepharose FF (GE Healthcare Co. Ltd.), Fractogel EMD, Fractogel TMAE, Fractogel HICAP (Merck KGaA Co. Ltd или Darmstadt Co. Ltd.); более предпочтительно SA21A; адсорбент, такой как SP207, HP20SS, HP20 и т.д., более предпочтительно HP20.
[34] В предпочтительном варианте реализации, в соответствии с которым в качестве дополнительного способа очистки согласно настоящему изобретению используется (iv) гель-проникающая хроматография, «неподвижная фаза в вышеописанной (iv) гель-проникающей хроматографии» может представлять собой неподвижные фазы на основе любого типа геля, который может осуществлять разделение в зависимости от размера образца, предпочтительно гель на основе декстрана, такой как сефадекс (например, сефадекс G-25), гель на основе полиакриламида, такой как сефакрил (например, сефакрил-S400), гель на основе агарозы, такой как супероза или сефароза (например, сефароза CL-4B) или их комбинации, такие как супердекс 200, комбинированный декстран (например, Sephadex™) или сшитый агарозный гель (Superose™) и т. п., однако подходящие гели не ограничиваются теми, которые перечислены в настоящем документе. «Подвижная фаза в вышеописанной (iv) гель-проникающей хроматографии» может представлять собой буферный раствор, выбранный из группы, состоящей из натрий-ацетатного буфера, натрий-фосфатного буфера, аммоний-ацетатного буфера, MES (2-(N-морфолино)этансульфоновой кислоты), Бис-Трис[2-бис(2-гидроксиэтил)амино-2-(гидроксиметил)-1,3-пропандиола], ADA (N-(2-ацетамидо)иминодиацетата), PIPES [пипераксин-N,N'-бис(2-этансульфоновой кислоты)], BES (N,N'-бис(2-гидроксиэтил)-2-аминоэтансульфоновой кислоты), MOPS [3-(N-морфолино)пропансульфоновой кислоты)], TES (N-трис(гидроксиметил)метил-2-аминоэтансульфоновой кислоты), HEPES (N-2-гидроксиэтилпиперазин-N'-2-этансульфоновой кислоты) и т. п.; предпочтительно натрий-ацетатный буфер, натрий-фосфатный буфер или аммоний-ацетатный буфер.
[35] В предпочтительном варианте реализации настоящего изобретения, в дополнение к (i) распределительной хроматографии с обращенной фазой, (ii) распределительной хроматографии с нормальной фазой, (iii) ионообменной хроматографии, (iv) гель-проникающей хроматографии или их комбинации, может быть проведена (v) гель-проникающая хроматография или гель-фильтрационная хроматография, в качестве еще одного способа очистки, раскрытого в настоящем документе.
[36] В настоящем изобретении также предложен новый очищенный экстракт, такой как (a) очищенный экстракт, фракционированный с использованием бутанола (в дальнейшем обозначенный как «ATC1»), или (b) очищенный экстракт после вторичного фракционирования (в дальнейшем обозначенный как «ATC2»), полученный в соответствии со способами получения, описанными выше.
[37] В настоящем изобретении также предложен новый очищенный экстракт, фракционированный с использованием бутанола (ATC1) из экстракта Pseudolysimachion rotundum var subintegrum, полученный в соответствии со способами получения, описанными выше, который содержит 12,3-47% (масс./масс.) производных каталпозида в общем экстракте (100 %) из Pseudolysimachion rotundum var subintegrum, при этом указанные производные каталпозида состоят из 15-50% (масс./масс.) верпрозида, 0,3-10% (масс./масс.) вератровой кислоты, 0,5-10% (масс./масс.) каталпозида, 0,3-10% (масс./масс.) пикрозида II, 0,3-10% (масс./масс.) изованиллоилкаталпола и 0,3-10% (масс./масс.) 6-О-вератроилкаталпола, предпочтительно 20-25% (масс./масс.) верпрозида, 0,5-5% (масс./масс.) вератровой кислоты, 1-5% (масс./масс.) каталпозида, 0,5-5% (масс./масс.) пикрозида II, 0,5-5% (масс./масс.) изованиллоилкаталпола и 1-5 % (масс./масс.) 6-О-вератроилкаталпола в расчете на общую массу экстракта (100%) Pseudolysimachion rotundum var subintegrum.
[38] В настоящем изобретении также предложен новый очищенный экстракт, фракционированный с использованием бутанола (ATC1) из экстракта Pseudolysimachion rotundum var subintegrum, полученный в соответствии со способами получения, описанными выше, который характеризуется относительным смешанным отношением (масс./масс.) каждого из производных каталпозида, составляющим 15,0-18,0 (масс./масс.) верпрозида, 2,10-2,60 (масс./масс.) каталпозида, 1 (масс./масс.) пикрозида II, 1,00-1,30 (масс./масс.) изованиллоилкаталпола и 2,00-2,30 (масс./масс.) 6-О-вератроилкаталпола; предпочтительно 16,0-17,0 (масс./масс.) верпрозида, 2,20-2,50 (масс./масс.) каталпозида, 1 (масс./масс.) пикрозида II, 1,10-1,20 (масс./масс.) изованиллоилкаталпола и 2,10-2,20 (масс./масс.) 6-О-вератроилкаталпола; более предпочтительно 16,20-16,99 (масс./масс.) верпрозида, 2,40-2,45 (масс./масс.) каталпозида, 1 (масс./масс.) пикрозида II, 1,10-1,19 (масс./масс.) изованиллоилкаталпола и 2,10-2,19 (масс./масс.) 6-О-вератроилкаталпола.
[39] В настоящем изобретении также предложен новый очищенный экстракт после вторичного фракционирования (ATC2) из экстракта Pseudolysimachion rotundum var subintegrum, полученный в соответствии со способами получения, описанными выше, который содержит 36,5-91% (масс./масс.) производных каталпозида в общем экстракте (100%) Pseudolysimachion rotundum var subintegrum, при этом указанные производные каталпозида состоят из 30-60% (масс./масс.) верпрозида, 0,5-10% (масс./масс.) вератровой кислоты, 2-20% (масс./масс.) каталпозида, 1-10% (масс./масс.) пикрозида II, 1-10% (масс./масс.) изованиллоилкаталпола и 2-20% (масс./масс.) 6-О-вератроилкаталпола в расчете на общую массу экстракта (100%) Pseudolysimachion rotundum var subintegrum; предпочтительно 40-50% (масс./масс.) верпрозида, 1-5% (масс./масс.) вератровой кислоты, 3-10% (масс./масс.) каталпозида, 2-5% (масс./масс.) пикрозида II, 2-8% (масс./масс.) изованиллоилкаталпола и 3-8% (масс./масс.) 6-О-вератроилкаталпола в расчете на общую массу экстракта (100%) Pseudolysimachion rotundum var subintegrum.
[40] В настоящем изобретении также предложен новый очищенный экстракт после вторичного фракционирования (ATC2) из экстракта Pseudolysimachion rotundum var subintegrum, полученный в соответствии со способами получения, описанными выше, который характеризуется относительным смешанным отношением (масс./масс.) каждого из производных каталпозида, составляющим 13,0-16,0 (масс./масс.) верпрозида, 2,20-2,50 (масс./масс.) каталпозида, 1 (масс./масс.) пикрозида II, 1,10-1,40 (масс./масс.) изованиллоилкаталпола и 2,00-2,20 (масс./масс.) 6-О-вератроилкаталпола; предпочтительно 14,0-15,0 (масс./масс.) верпрозида, 2,30-2,45 (масс./масс.) каталпозида, 1 (масс./масс.) пикрозида II, 1,20-1,35 (масс./масс.) изованиллоилкаталпола и 2,00-2,10 (масс./масс.) 6-О-вератроилкаталпола; более предпочтительно 14,50-14,99 (масс./масс.) верпрозида, 2,35-2,43 (масс./масс.) каталпозида, 1 (масс./масс.) пикрозида II, 1,15-1,24 (масс./масс.) изованиллоилкаталпола и 2,01-2,09 (масс./масс.) 6-О-вератроилкаталпола.
[41] «Очищенный экстракт», раскрытый в настоящем документе, можно использовать в сухой форме, полученной методом вакуумного испарения, методом сублимационной сушки или методом высушивания горячим воздухом и т. д.
[42] В настоящем документе термин «воспалительное заболевание» включает экзему, атопический дерматит, конъюнктивит, пародонтоз, ринит, отит среднего уха, ларингофарингит, тонзиллит, пневмонию, язву желудка, гастрит, болезнь Крона, колит, геморрой, подагру, анкилозирующий спондилоартрит, ревматическую лихорадку, системную красную волчанку, фибромиалгию, псориатический артрит, остеоартрит, ревматоидный артрит, периартрит плеча, тендинит, тендосиновит, тендовагинит, миозит, гепатит, цистит, нефрит, синдром Шегрена, рассеянный склероз, хроническое воспалительное заболевание, острое воспалительное заболевание и т.д., но не ограничивается заболеваниями, перечисленными в настоящем документе, предпочтительно включает экзему, атопический дерматит, ревматоидный артрит, хроническое воспалительное заболевание, острое воспалительное заболевание и т. д.
[43] В настоящем документе термин «аллергическое заболевание» включает аллергический ринит, аллергический дерматит, контактный дерматит, крапивницу, аллергию на укусы насекомых, пищевую аллергию, лекарственную аллергию, аллергический конъюнктивит, гиперчувствительность и т.д., но не ограничиваются заболеваниями, перечисленными в настоящем документе, предпочтительно включает аллергический ринит, аллергический дерматит, контактный дерматит, крапивницу, аллергию на укусы насекомых, пищевую аллергию, лекарственную аллергию, более предпочтительно аллергический дерматит, контактный дерматит.
[44] В настоящем документе термин «астматическое заболевание» включает астму любого типа, вызванную различными внешними факторами, но не ограничивается теми, которые перечислены в настоящем документе, например, пылевыми клещами, шерстью или перхотью животных, тараканами, пищевым продуктом, лекарственным препаратом, кашлем, сигаретным дымом, загрязнением воздуха, пищевой добавкой, физической активностью, такой как упражнение и т. д., изменением погоды, желтым песком, стрессом и т. д.
[45] В настоящем документе термин «предотвращать» включает любое действие, направленное на ингибирование или задержку возникновения определенного заболевания или расстройства, раскрытого в настоящем документе, путем введения композиции согласно настоящему изобретению; в настоящем документе термин «лечить» включает любое действие, направленное на облегчение или благоприятное изменение симптомов, связанных с определенным заболеванием или расстройством, раскрытым в настоящем документе, путем введения композиции согласно настоящему изобретению.
[46] Авторы настоящего изобретения установили, что новый промышленный способ получения очищенного экстракта может обеспечить большее количество активных ингредиентов, т.е. от 36,5% до 91,0% (масс./масс.), таких как производные каталпола, из экстракта Pseudolysimachion rotundum var subintegrum, по сравнению с неочищенным экстрактом, который получен стандартным способом, описанным в предшествующем уровне техники, в котором содержание производных каталпола составляет всего 8,49% (масс./масс.), согласно результатам различных исследований методом ВЭЖХ, например, очищенный экстракт согласно настоящему изобретению (ATC1) содержит 17,60% (масс./масс.) верпрозида, 0,72% (масс./масс.) вератровой кислоты, 2,62% (масс./масс.) каталпозида, 1,08% (масс./масс.) пикрозида II, 1,26% (масс./масс.) изованиллоилкаталпола и 2,36% (масс./масс.) 6-O-вератроилкаталпола (см. пример 2), и очищенный экстракт согласно настоящему изобретению (ATC2) содержит 43,83% (масс./масс.) верпрозида, 1,80% (масс./масс.) вератровой кислоты, 7,07% (масс./масс.) каталпозида, 2,93% (масс./масс.) пикрозида II, 3,85% (масс./масс.) изованиллоилкаталпола и 6,15% (масс./масс.) 6-О-вератроилкаталпола, тогда как неочищенный экстракт (НЭ), полученный стандартным способом, раскрытым в предшествующем уровне техники, содержит только 5,9% (масс./масс.) верпрозида, 0,21% (масс./масс.) вератровой кислоты, 0,82% (масс./масс.) каталпозида, 0,40% (масс./масс.) пикрозида II, 0,42% (масс./масс.) изованиллоилкаталпола и 0,74% (масс./масс.) 6-О-вератроилкаталпола в расчете на общую массу экстракта (100%) Pseudolysimachion rotundum var subintegrum; неочищенный экстракт; а также очищенный экстракт согласно настоящему изобретению проявил более сильную противовоспалительную, противоаллергическую и противоастматическую активность, по сравнению с экстрактом, полученным с помощью стандартного способа получения, согласно результатам различных исследований в условиях in vivo, таких как исследование ингибирования выработки эозинофилов, высвобождения иммуноглобулина и воспалительных хемокинов в плазму крови и бронхоальвеолярную жидкость, а также исследование подавления гиперчувствительности дыхательных путей и гиперплазии бокаловидных клеток в ОВА-сенсибилизированной/иммунизированной мышиной модели.
[47] Таким образом, в соответствии с другим аспектом настоящего изобретения, в настоящем изобретении предложена фармацевтическая композиция, содержащая в качестве активного ингредиента указанный очищенный экстракт, содержащий большое количество активных ингредиентов, полученный в соответствии с вышеописанными способами из Pseudolysimachion rotundum var subintegrum, для лечения и предотвращения воспалительного, аллергического или астматического заболевания.
[48] В настоящем изобретении предложена фармацевтическая композиция, содержащая в качестве активного ингредиента указанный очищенный экстракт, содержащий большое количество активных ингредиентов, полученный в соответствии с вышеописанными способами из Pseudolysimachion rotundum var subintegrum, и фармацевтически приемлемые носители или вспомогательные вещества, для лечения и предотвращения воспалительного, аллергического или астматического заболевания.
[49] В соответствии с другим аспектом настоящего изобретения, в настоящем изобретении также предложено применение указанного очищенного экстракта, содержащего большое количество активных ингредиентов, полученного в соответствии с вышеописанными способами из Pseudolysimachion rotundum var subintegrum, для изготовления лекарственных средств, используемых для лечения или предотвращения воспалительного, аллергического или астматического заболевания.
[50] В настоящем документе термин «фармацевтически приемлемые носители или вспомогательные вещества» включает фармацевтические добавки, неактивные ингредиенты, используемые для изготовления лекарственного средства. Такие добавки включают красители, ароматизаторы, связующие вещества, смягчающие вещества, наполнители, смазывающие вещества, консерванты и многие другие классы. Обычные вспомогательные вещества включают кукурузный крахмал, лактозу, тальк, стеарат магния, сахарозу, желатин, стеарат кальция, диоксид кремния, шеллак и глазурь, которая хорошо известна в данной области техники (см. главную страницу веб-сайта Управления по контролю качества пищевых продуктов и лекарственных средств США: www.fda.gov или веб-сайт, содержащий информацию о лекарственных препаратах: www.drugs.com) или из более ранних литературных источников (например, Rowe, Raymond C et al., Handbook of Pharmaceutical Excipients, Pharmaceutical Press, 7th Edition, 2012).
[51] В соответствии с другим аспектом настоящего изобретения, в настоящем изобретении также предложен способ лечения или предотвращения воспалительного, аллергического или астматического заболевания у млекопитающих, включающий введение терапевтически эффективного количества указанного очищенного экстракта, содержащего большое количество активных ингредиентов, полученного в соответствии с вышеописанными способами из Pseudolysimachion rotundum var subintegrum, указанному млекопитающему, страдающему от воспалительных, аллергических или астматических заболеваний.
[52] Композиция согласно настоящему изобретению для лечения и предотвращения воспалительного, аллергического или астматического заболевания может содержать вышеуказанные экстракты в количестве 0,1 ~ 99%, предпочтительно 0,1 ~ 50% по массе в расчете на общую массу композиции.
[53] Композиция в соответствии с настоящим изобретением может быть обеспечена в форме фармацевтической композиции, содержащей фармацевтически приемлемые носители, адъюванты или разбавители, например, лактозу, декстрозу, сахарозу, сорбит, маннит, ксилит, эритрит, мальтит, крахмалы, гуммиарабик, альгинат, желатин, фосфат кальция, силикат кальция, целлюлозу, метилцеллюлозу, поливинилпирролидон, воду, метилгидроксибензоат, пропилгидроксибензоат, тальк, стеарат магния и минеральное масло. Составы могут дополнительно содержать наполнители, предотвращающие агглютинацию агенты, смазывающие агенты, смачивающие агенты, ароматизаторы, эмульгаторы, консерванты и т. п. Композиции согласно настоящему изобретению могут быть приготовлены так, чтобы обеспечить быстрое, устойчивое или замедленное высвобождение активного ингредиента после их введения пациенту с использованием любого из способов, хорошо известных в данной области техники.
[54] Например, композиции согласно настоящему изобретению могут быть растворены в маслах, пропиленгликоле или других растворителях, которые обычно используются для проведения инъекции. Подходящие примеры носителей включают физиологический раствор, полиэтиленгликоль, этанол, растительные масла, изопропилмиристат и т. п., но не ограничиваются ими. Экстракт согласно настоящему изобретению, пригодный для местного введения, может быть приготовлен в виде мазей и кремов.
[55] Фармацевтические композиции, содержащие композицию согласно настоящему изобретению, могут быть получены в любой форме, такой как лекарственная форма для приема внутрь (порошок, таблетка, капсула, мягкая капсула, лекарственное средство на водной основе, сироп, эликсиры, пилюля, порошок, саше, гранулы) или для местного применения (крем, мазь, лосьон, гель, бальзам, пластырь, паста, спрей, аэрозоль и т. п.), или препарат для инъекций (раствор, суспензия, эмульсия).
[56] Композиция согласно настоящему изобретению, предложенная в виде фармацевтических лекарственных форм, может быть использована в виде ее фармацевтически приемлемых солей, и может быть использована по отдельности или в соответствующей комбинации, а также в комбинации с другими фармацевтически активными соединениями.
[57] Желательная доза экстракта согласно настоящему изобретению изменяется в зависимости от заболевания и массы субъекта, степени тяжести заболевания, лекарственной формы, способа и периода введения, и может быть выбрана специалистом в данной области техники. Однако для получения желаемых результатов, как правило, рекомендуют вводить экстракт согласно настоящему изобретению в количестве от 0,0001 до 1000 мг/кг, предпочтительно от 0,001 до 100 мг/кг массы тела/сутки. Доза может быть введена в виде однократной дозы или разделена на несколько введений в сутки.
[58] Фармацевтическую композицию согласно настоящему изобретению можно вводить субъекту-животному, такому как млекопитающие (крыса, мышь, домашние животные или человек) с помощью различных путей введения. Все способы введения включены в область настоящего изобретения, например, введение можно осуществлять перорально, ректально или с помощью внутривенной, внутримышечной, подкожной, внутрикожной, интратекальной, эпидуральной или интрацеребровентрикулярной инъекции.
[59] Оригинальный экстракт согласно настоящему изобретению можно применять в качестве основного компонента или добавки и вспомогательного агента при получении различных функциональных диетических пищевых продуктов и пищевых продуктов для медицинского ухода.
[60] Соответственно, другой целью настоящего изобретения является обеспечение функционального диетического пищевого продукта, содержащего указанный очищенный экстракт, содержащий большое количество активных ингредиентов, полученный в соответствии с вышеописанными способами из Pseudolysimachion rotundum var subintegrum, для предотвращения или облегчения воспалительного, аллергического или астматического заболевания.
[61] В настоящем документе термин «функциональный диетический пищевой продукт» представляет собой функциональный пищевой продукт с улучшенной функциональностью, такой как физическая функциональность или физиологическая функциональность, за счет добавления экстракта согласно настоящему изобретению в обычные пищевые продукты, чтобы предотвратить или улучшить течение заболевания человека или млекопитающего, которое описано в настоящем документе.
[62] Другая цель настоящего изобретения заключается в обеспечении пищевого продукта для медицинского ухода, содержащего указанный очищенный экстракт, содержащий большое количество активных ингредиентов, полученный в соответствии с вышеописанными способами из Pseudolysimachion rotundum var subintegrum, совместно с ситологически приемлемой добавкой, для предотвращения или облегчения воспалительного, аллергического или астматического заболевания.
[63] В настоящем документе термин «пищевой продукт для медицинского ухода» обозначает пищевой продукт, содержащий экстракт согласно настоящему изобретению, который не имеет какого-либо конкретного желаемого действия, но при этом имеет общее желаемое действие, составляя небольшую долю от общего количества продукта в форме добавки либо составляя полную долю от всего количества продукта в форме порошка, гранулы, капсулы, пилюли, таблетки и т. д.
[64] В настоящем документе термин «ситологически приемлемая добавка» включает «любое вещество, предполагаемое использование которого приводит или, как обоснованно ожидается, приведет – прямо или косвенно – к его включению в качестве компонента в пищевой продукт или влиянию иным способом на характеристики любого пищевого продукта», и указанная добавка может быть отнесена к одной из трех групп в зависимости от ее происхождения, т.е., (1), химическая синтетическая добавка, такая как кетоны, глицин, цитрат калия, никотиновая кислота и др; (2) природная добавка, такая как краситель из хурмы, экстракт солодки, кристаллическая целлюлоза, гуаровая камедь и т.д.; (3) смешанная добавка, такая как натриевая соль L-глутамата, консерванты, анилиновый краситель и т.д. или различные категории в соответствии с ее функцией в пищевом продукте, например, загуститель, ускоряющий созревание агент, отбеливающий агент, усиливающее экскрецию вещество, увлажнитель, предотвращающий слипание агент, осветлители, отвердитель, эмульгатор, стабилизатор, загуститель, основания и кислоты, вспенивающие агенты, питательные вещества, красящее вещество, ароматизатор, подсластитель, консервант, антиоксидант и т.д., которые хорошо известны в данной области техники или из ранее опубликованных литературных источников (см. «Codex General Standard for Food Additives» (GSFA, Codex STAN 192-1995) на главной странице веб-сайта GSFA: www.codexalimentarius.net/gsfaonline/index.html).
[65] Если вещество добавлено в пищевой продукт для выполнения конкретной задачи в данном продукте, то такое вещество называется прямой добавкой, тогда как косвенные пищевые добавки представляют собой добавки, становятся частью пищевого продукта в следовых количествах вследствие его упаковки, хранения или другой обработки.
[66] В настоящем документе «продукты для медицинского ухода или функциональные диетические пищевые продукты» могут содержаться в пищевых продуктах, диетических напитках, диетических пищевых добавках и т.д., и могут быть приготовлены в виде стандартной лекарственной формы, такой как порошок, гранула, таблетка, суспензия, эмульсия, сироп, жевательная таблетка, капсула, напиток и т.д.; или в форме пищевого продукта, например, хлеб, рисовые хлебцы, сухие фрукты, конфеты, шоколад, жевательная резинка, мороженое, молоко, например, молоко с низким содержанием жира, молоко с гидролизованной лактозой, козье молоко, обработанное молоко, молочный продукт, такой как кисломолочный продукт, сливочное масло, концентрированное молоко, сливки, топленое масло, природный сыр, плавленый сыр, сухое молоко, молочная сыворотка и т.д., обработанный мясной продукт, такой как котлета, ветчина, колбаса, бекон и т.д., обработанный яичный продукт, продукт из мяса рыб, такой как рыбный пирог и т.д., лентовидные макаронные изделия, такие как лапша быстрого приготовления, сухая лапша, влажная лапша, жареная лапша, нежареная лапша, желатинизированная сухая лапша, приготовленная лапша, замороженная лапша, макаронные изделия и т.д., чай, такой как чай в пакетиках, экстракт чая и т.д., диетические напитки, такие как фруктовые напитки, овощные напитки, газированные безалкогольные напитки, соевое молоко, молочные напитки, смешанные напитки, и т.д., приправы, такие как соевый соус, паста из соевых бобов, паста из красного перца, паста из черных бобов «Chunjang» (разновидность продукта из ферментированных соевых бобов, окрашенных карамелью), соевые бобы «Cheonggukjang» (соевые бобы, ферментированные под действием B. subtillis в природных условиях), смешанная паста, уксус, соус, кетчуп, карри, заправка и т.д., маргарин, жир-разрыхлитель, пицца и т.д., но не ограничивающиеся продуктами, перечисленными в настоящем документе, для предотвращения или улучшения течения заболевания, описанного в настоящем документе.
[67] Указанный экстракт, описанный выше, также может быть добавлен к пищевому продукту или напитку для предотвращения и улучшения течения заболевания, описанного в настоящем документе. Количество экстракта, описанного выше, в пищевом продукте или напитке, используемом в качестве функционального диетического пищевого продукта или пищевого продукта для медицинского ухода, обычно может варьироваться от приблизительно 0,01 до 100% (масс./масс.) от общей массы пищевого продукта в отношении композиции функционального диетического продукта. В частности, несмотря на то, что предпочтительное количество экстракта согласно настоящему изобретению в функциональном диетическом пищевом продукте, пищевом продукте для медицинского ухода или специальном питательном продукте может варьироваться в соответствии с предполагаемым назначением каждого пищевого продукта, экстракт согласно настоящему изобретению предпочтительно используют главным образом в качестве добавки, при этом количество экстракта согласно настоящему изобретению в пищевом продукте находится в диапазоне от приблизительно 0,01 до 5%, например, в лапше и т. п., от 40 до 100% в пищевых продуктах для медицинского ухода в расчете на 100% композиции пищевого продукта.
[68] При условии, что композиция диетического напитка согласно настоящему изобретению содержит вышеописанный экстракт или его соединение в качестве основного компонента в указанном соотношении, отсутствуют какие-либо конкретные ограничения в отношении другого жидкого компонента, при этом другой компонент может представлять собой различные отдушки или природные углеводы и т.д., например, обычный напиток. Примеры вышеупомянутого природного углевода включают моносахарид, такой как глюкоза, фруктоза и т.д.; дисахарид, такой как мальтоза, сахароза и т.д.; обычный сахар, такой как декстрин, циклодекстрин; и сахарный спирт, такой как ксилит, эритрит и т.д. Помимо отдушек, упомянутых выше, предпочтительными являются природные отдушки, такие как тауматин, экстракт стевии, такой как леводиозид А, глицирризин и др., а также синтетические отдушки, такие как сахарин, аспартам и др. Количество природного углевода, описанного выше, обычно находится в диапазоне от приблизительно 1 до 20 г, предпочтительно от 5 до 12 г в расчете на 100% композиции указанного напитка.
[69] Другие компоненты, помимо указанной композиции, представляют собой различные питательные вещества, витамин, минерал или электролит, синтетический ароматизатор, краситель и улучшающий свойства агент, в случае сыра, шоколада и др., пектиновую кислоту и ее соль, альгиновую кислоту и ее соль, органическую кислоту, защитный коллоидный клей, регулирующий рН агент, стабилизатор, консервант, глицерин, спирт, способствующий карбонизации агент, используемый в газированном напитке, и др. Другой компонент, помимо тех, которые описаны выше, может представлять собой фруктовый сок для приготовления натурального фруктового сока, напиток с фруктовым соком и овощной напиток, в котором компонент может быть использован самостоятельно или в комбинации. Соотношение компонентов не имеет большого значения, но, как правило, находится в диапазоне от приблизительно 0 до 20% (масс./масс.) в расчете на 100% (масс./масс.) композиции согласно настоящему изобретению. Примеры пищевых продуктов, содержащих вышеописанный экстракт или соединение, входящее в указанный экстракт, которые можно добавлять к другим продуктам, включают различные пищевые продукты, напитки, жевательную резинку, витаминный комплекс, оздоровительный пищевой продукт и т. п.
[70] Оригинальный экстракт согласно настоящему изобретению не имеет токсического действия и, следовательно, не вызывает нежелательных явлений; использование данного экстракта является безопасным.
[71] Специалисты в данной области техники поймут, что различные модификации и варианты могут быть осуществлены в композициях, способах применения и препаратах согласно настоящему изобретению, не отступая от сущности или объема настоящего изобретения.
[72] Настоящее изобретение более конкретно описано в примерах ниже. Тем не менее, следует понимать, что настоящее изобретение никоим образом не ограничивается указанными примерами.
Преимущества настоящего изобретения
[73] В соответствии с описанием настоящего изобретения, в настоящем документе предложен новый промышленный способ получения очищенного экстракта, содержащего большее количество активных ингредиентов, таких как производные каталпола, из экстракта Pseudolysimachion rotundum var subintegrum, при этом очищенный экстракт имел более сильную противовоспалительную, противоаллергическую и противоастматическую активность, по сравнению с экстрактом, полученным с помощью стандартного способа получения, раскрытого в данной области техники, согласно результатам различных исследований в условиях in vivo, таких как исследование ингибирования выработки эозинофилов, высвобождения иммуноглобулина и воспалительных хемокинов в плазму крови и бронхоальвеолярную жидкость, а также исследование подавления гиперчувствительности дыхательных путей и гиперплазии бокаловидных клеток в ОВА-сенсибилизированной/иммунизированной мышиной модели. Следовательно, указанный экстракт может быть использован в качестве терапевтического лекарственного средства или функционального диетического пищевого продукта для лечения и предотвращения воспалительного, аллергического или астматического заболевания.
Краткое описание чертежей
[74] Описанные выше и дополнительные цели, признаки и другие преимущества настоящего изобретения будут более понятны из следующего ниже подробного описания в совокупности с прилагаемыми чертежами, где:
[75] на фиг. 1 показаны результаты исследования методом ВЭЖХ неочищенного экстракта из Pseudolysimachion rotundum var subintegrum, полученного в сравнительном примере 1;
[76] на фиг. 2 показаны результаты исследования методом ВЭЖХ очищенного экстракта согласно настоящему изобретению (ATC1) из Pseudolysimachion rotundum var subintegrum, полученного в примере 1;
[77] на фиг. 3 показаны результаты исследования методом ВЭЖХ очищенного экстракта согласно настоящему изобретению (ATC2) из Pseudolysimachion rotundum var subintegrum, полученного в примере 2;
[78] на фиг. 4 показано подавляющее действие очищенного экстракта согласно настоящему изобретению на гиперчувствительность дыхательных путей в ОВА-сенсибилизированной/иммунизированной мышиной модели;
[79] на фиг. 5 показано ингибиторное действие очищенного экстракта согласно настоящему изобретению на привлечение воспалительных клеток в жидкость бронхоальвеолярного лаважа (БАЛ);
[80] на фиг. 6 показано ингибиторное действие очищенного экстракта согласно настоящему изобретению на высвобождение иммуноглобулина (общий IgE) в сыворотку крови;
[81] на фиг. 7 показано ингибиторное действие очищенного экстракта согласно настоящему изобретению на высвобождение ОВА-специфичного IgE в сыворотку крови;
[82] на фиг. 8 показано ингибиторное действие очищенного экстракта согласно настоящему изобретению на высвобождении ИЛ-1бета;
[83] на фиг. 9 показано ингибиторное действие очищенного экстракта согласно настоящему изобретению на высвобождение воспалительных хемокинов;
[84] на фиг. 10 показано ингибиторное действие очищенного экстракта согласно настоящему изобретению на привлечение воспалительных клеток в альвеолы легочной ткани согласно результатам гистологического исследования жидкости бронхоальвеолярного лаважа;
[85] на фиг. 11 показано ингибиторное действие очищенного экстракта согласно настоящему изобретению на секрецию слизи в легочной ткани согласно результатам гистологического исследования жидкости бронхоальвеолярного лаважа.
Лучший вариант реализации настоящего изобретения
[86] Специалисты в данной области техники поймут, что различные модификации и варианты могут быть осуществлены в композициях, способах применения и препаратах согласно настоящему изобретению, не отступая от сущности или объема настоящего изобретения.
[87] Настоящее изобретение более конкретно описано в примерах ниже. Тем не менее, следует понимать, что настоящее изобретение никоим образом не ограничивается указанными примерами.
[88] ПРИМЕРЫ
[89] Представленные далее справочный пример, примеры и экспериментальные примеры предназначены для дополнительной иллюстрации настоящего изобретения без ограничения его объема.
[90] Сравнительный пример 1. Получение неочищенного экстракта из Pseudolysimachion rotundum var subintegrum
[91] 1-1. Получение неочищенного экстракта (ATE)
1 кг[92] высушенного Pseudolysimachion rotundum var subintegrum (выращенного в 244, Soi-myeon Eumseong-gun Chungcheongbuk-do в Корее в соответствии с требованиями Надлежащей сельскохозяйственной практики (НСХП)) нарезали на небольшие куски и смешивали с 10 л 40% этанола. Смесь перемешивали при комнатной температуре в течение 24 часов и экстрагировали с помощью метода экстракции с обратным холодильником при 78 °C в течение 12 часов, чтобы собрать фильтрат три раза. Экстракт фильтровали через фильтровальную бумагу, чтобы удалить твердые частицы. Собранный фильтрат концентрировали с помощью роторного испарителя (EYELA, N-2100, Япония) при 55~65 °C при пониженном давлении и сушили с использованием устройства для сублимационной сушки, чтобы получить 202 г сухого неочищенного экстракта (в дальнейшем обозначенного «ACE») для использования в качестве сравнительного примера.
[93] 1-2. Получение неочищенного экстракта (АТМ)
1,1 кг[94] высушенного Pseudolysimachion rotundum var subintegrum (выращенного по адресу 244, Soi-myeon Eumseong-gun Chungcheongbuk-do в Корее в соответствии с требованиями Надлежащей сельскохозяйственной практики (НСХП)) нарезали на небольшие куски и смешивали с 5 л метанола. Смесь перемешивали при комнатной температуре в течение 24 часов и экстрагировали с помощью метода экстракции с обратным холодильником при 78 °C в течение 12 часов, чтобы собрать фильтрат три раза. Экстракт фильтровали через фильтровальную бумагу, чтобы удалить твердые частицы. Собранный фильтрат концентрировали с помощью роторного испарителя (EYELA, N-2100, Япония) при 55~65 °C при пониженном давлении и сушили с использованием устройства для сублимационной сушки, чтобы получить 100,5 г сухого неочищенного экстракта (в дальнейшем обозначенного «ACM») для использования в качестве сравнительного примера.
[95] 1-3. Исследование компонентного состава
[96] Исследование компонентного состава проводили с использованием ВЭЖХ (модель Agilent 1260, США) в соответствии с условием, указанным в таблице 1, и результаты приведены на Фиг.1.
[97] Как следует из Фиг.1, было подтверждено, что каждый ингредиент детектировали на 9,548 мин (верпрозид), 10,817 мин (вератровая кислота), 16,728 мин (каталпозид), 20,346 мин (пикрозид II), 21,853 мин (изованиллоилкаталпол) и 30,462 мин (6-О-вератроилкаталпол), соответственно.
[98] Содержание каждого ингредиента (%) в образце рассчитывали на основании хроматограммы ВЭЖХ (время удерживания) в соответствии с математической формулой 1.
[99] [Математическая формула 1]
[100] Содержание каждого ингредиента = концентрация стандарта (мг/мл)/концентрация исследуемого образца (мг/мл)×At/As×чистота стандарта (%),
[101] где «At» обозначает площадь пика для ингредиента в исследуемом образце и «As» обозначает площадь пика для стандарта, при условии, что отобранный объем исследуемого образца был идентичен объему стандарта.
[102] Таблица 1
[Таблица 1] Условия проведения ВЭЖХ
[103] В результате, было подтверждено, что неочищенный экстракт из Pseudolysimachion rotundum var subintegrum содержит всего 8,49% (масс./масс.) производных каталпозида, т.е., 5,9% (масс./масс.) верпрозида, 0,21% (масс./масс.) вератровой кислоты, 0,82% (масс./масс.) каталпозида, 0,40% (масс./масс.) пикрозида II, 0,42% (масс./масс.) изованиллилкаталпола и 0,74% (масс./масс.) 6-О-вератроилкаталпола, соответственно, как следует из таблицы 2.
[104] Таблица 2
Результаты исследования методом ВЭЖХ (неочищенный экстракт: ACE)
[105] Пример 1. Получение очищенного экстракта (ATC1) из Pseudolysimachion rotundum var subintegrum
[106] Неочищенный экстракт (ACE) из Pseudolysimachion rotundum var subintegrum, полученный стандартным способом в соответствии со сравнительным примером 1, суспендировали в 2 л дистиллированной воды, и в суспензию добавляли 2 л бутанола для фракционирования в бутанолрастворимой фракции и водорастворимой фракции. Бутанолрастворимую фракцию собирали, концентрировали при пониженном давлении и сушили с получением 82 г очищенного экстракта согласно настоящему изобретению, фракционированного с использованием бутанола (ATC1), который использовали в качестве исследуемого примера.
[107] Исследование компонентного состава проводили с использованием ВЭЖХ (модель Agilent 1260, США) в соответствии с условием, указанным в таблице 1, и результаты показаны на Фиг. 2.
[108] Как следует из фиг. 2, было подтверждено, что каждый ингредиент детектировали на 9,545 мин (верпрозид), 10,821 мин (вератровая кислота), 16,727 мин (каталпозид), 20,345 мин (пикрозид II), 21,853 мин (изованиллоилкаталпол) и 30,462 мин (6-O-вератроилкаталпол), соответственно.
[109] Содержание каждого ингредиента (%) в образце рассчитывали на основании хроматограммы ВЭЖХ (время удерживания) в соответствии с математической формулой 1.
[110] В результате, было подтверждено, что очищенный экстракт согласно настоящему изобретению, фракционированный с использованием бутанола (ATC1) из Pseudolysimachion rotundum var subintegrum, содержит 25,64% (масс./масс.) производных каталпозида, т.е. 17,60% (масс./масс.) верпрозида, 0,72% (мас/масс.) вератровой кислоты, 2,62% (масс./масс.) каталпозида, 1,08% (масс./масс.) пикрозида II, 1,26% (масс./масс.) изованиллилкаталпола и 2,36% (масс./масс.) 6-О-вератроилкаталпола, соответственно, как следует из таблицы 3.
Таблица 3
Результаты исследования методом ВЭЖХ (очищенный экстракт: ATC1)
[111] Пример 2. Получение очищенного экстракта (ATC2) из Pseudolysimachion rotundum var subintegrum
[112] Очищенный экстракт согласно настоящему изобретению, фракционированный с использованием бутанола (ATC1) из Pseudolysimachion rotundum var subintegrum в соответствии с примером 1, растворяли в 75 мл смешанного растворителя (дистиллированная вода:метанол = 1:0,003), и 75 г раствора наносили на колонку с обращенной фазой (С18 (IV) D 75-120 нм, AGC Si-Tech Co. Ltd., Япония, 450), элюировали суспензию с помощью растворителя для элюирования (дистиллированная вода:метанол = 90:10 → 60:40). Элюированный раствор объемом 8,4 л, подвижный в начальной системе элюирующего растворителя (дистиллированная вода: метанол = 90:10), собирали и концентрировали при пониженном давлении. Элюированный раствор объемом 5,6 л, подвижный в последней системе элюирующего растворителя (дистиллированная вода:метанол = 60:40), собирали, концентрировали при пониженном давлении и сушили с получением 33 г очищенного экстракта согласно настоящему изобретению после вторичного фракционирования (ATC2), и использовали в качестве исследуемого примера.
[113] Исследование компонентного состава проводили с использованием ВЭЖХ (модель Agilent 1260, США) в соответствии с условием, указанным в таблице 1, и результаты показаны на Фиг. 3.
[114] Как следует из Фиг. 3, было подтверждено, что каждый ингредиент детектировали на 9,525 мин (верпрозид), 10,818 мин (вератровая кислота), 16,721 мин (каталпозид), 20,346 мин (пикрозид II), 21,857 мин (изованиллоилкаталпол) и 30,462 мин (6-O-вератроилкаталпол), соответственно.
[115] Содержание каждого ингредиента (%) в образце рассчитывали на основании хроматограммы ВЭЖХ (время удерживания) в соответствии с математической формулой 1.
[116] В результате, было подтверждено, что очищенный экстракт согласно настоящему изобретению после вторичного фракционирования (ATC2) из Pseudolysimachion rotundum var subintegrum содержит 65,63% (масс./масс.) производных каталпозида, т.е. 43,83% (масс./масс.) верпрозида, 1,80% (масс./масс.) вератровой кислоты, 7,07% (масс./масс.) каталпозида, 2,93% (масс./масс.) пикрозида II, 3,85% (масс./масс.) изованиллилкаталпола и 6,15% (масс./масс.) 6-О-вератроилкаталпола, соответственно, как следует из таблицы 4.
[117] Таблица 4
Результаты исследования методом ВЭЖХ (очищенный экстракт: ATC2)
[118] Экспериментальный пример 1. Предварительное определение общего уровня IgE в сыворотке крови в ОВА-сенсибилизированной/иммунизированной мышиной модели
[119] Чтобы установить, имеет ли очищенный экстракт более высокую фармакологическую активность по сравнению с неочищенным экстрактом, полученным в сравнительном примере, описанное далее предварительное исследование проводили в соответствии со способом, раскрытым в литературе (Elias, J. A. et al., J. Clin. Invest., 111, pp297-297, 2003).
[120] 1-1. Сенсибилизация животных и иммунизация дыхательных путей
[121] Самки мышей линии BALB/C (массой приблизительно 20 г), свободные от патогенной флоры, в возрасте 6 недель, которых рутинно подвергали серологическому скринингу для выявления соответствующих респираторных инфекций, были приобретены у ORIENT Co. (Сеул, Корея) и акклиматизированы к экспериментальному окружению в течение 1 недели.
[122] В общих чертах, мышей сенсибилизировали путем внутрибрюшинной инъекции 20 мкг ОВА (овальбумин; A5503, Sigma, Сент-Луис, Массачусетс, США), который был эмульгирован в 2 мг гидроксида алюминия в 200 мкл фосфатно-солевого буфера (ФСБ) (рН 7,4), один раз в две недели. Мышей иммунизировали ОВА через дыхательные пути (1% ОВА в ФСБ) в течение 30 мин с помощью ультразвукового ингалятора (NE-U12; Omron Corp., Токио, Япония) с 28-го по 34-й день после начальной сенсибилизации. Через 24 часа после обработки антигеном определяли гиперчувствительность дыхательных путей, и мышей умерщвляли через 48 часов после последней иммунизации. Мышей умерщвляли с помощью передозировки пентобарбитала (Энтобал(Entobal)®, Hanrim Pharm. Co. Ltd.) через 24 часа после последней иммунизации, затем проводили трахеотомию. После закапывания в легкие 1,2 мл физиологического раствора (ФСБ), жидкость бронхоальвеолярного лаважа (БАЛ) получали три раза путем аспирации (общий объем 1,5 мл) с помощью катетеризации трахеи.
[123] Группы разделяли на несколько подгрупп, т.е., (a) нормальная контрольная группа (НК): группы, получавшие или не получавшие ОВА; (b) группа с индуцированной астмой (ОВА): группы, получавшие ОВА для индукции астмы; и (c) сравнительная группа: группы, получавшие положительный контроль (M30, монтелукаст, 30 мг/кг внутрь, Sigma-Aldrich Co. Ltd., SML-0101) за 1 час до ингаляции ОВА.
[124] Исследуемая группа состоит из 6 мышей в каждой группе, и за 1 час до ингаляции ОВА мышам перорально вводили различные концентрации исследуемого образца, ATC1 (30 мг/кг и 100 мг/кг) и ATM (30 и 100 мг/кг).
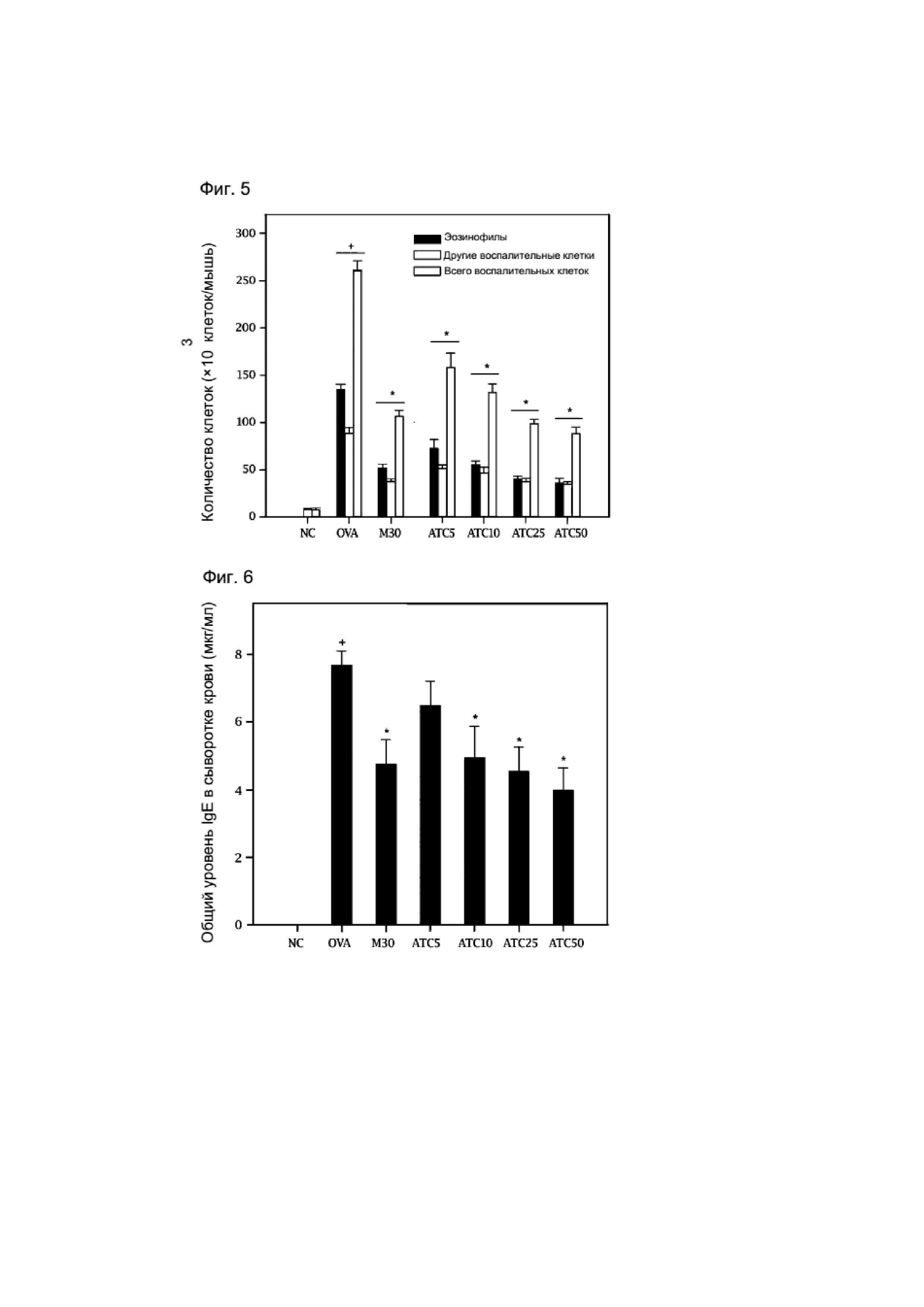
[125] Как показано в таблице 5, общий уровень IgE в сыворотке крови в группе с индуцированной астмой (ОВА) был значительно увеличен, тогда как в группе, получавшей исследуемый образец, в которой различные концентрации исследуемых образцов (ATC1, 30 мг/кг и 100 мг/кг) вводили перорально, уровень IgE был снижен, по сравнению с группой, получавшей неочищенный экстракт из Pseudolysimachion rotundum var subintegrum (ATM, 30 и 100 мг/кг). (см. таблицу 5).
[126] Таблица 5
[Таблица 5]
Общий уровень IgE в сыворотке крови
[127] Экспериментальный пример 2. Противоастматическое действие согласно результатам исследования гиперчувствительности дыхательных путей в ОВА-сенсибилизированной/иммунизированной мышиной модели
[128] Чтобы подтвердить противоастматическое действие исследуемых образцов, полученных в примерах с помощью исследования гиперчувствительности дыхательных путей в ОВА-сенсибилизированной/иммунизированной мышиной модели, описанное далее исследование было проведено в соответствии со способом, раскрытым в литературе (Elias, J. A. et al., J. Clin. Invest., 111, pp297-297, 2003).
[129] 1-1. Сенсибилизация животных и иммунизация дыхательных путей
[130] Самки мышей линии BALB/C (приблизительно 20 г), свободные от патогенной флоры, в возрасте 6 недель, которых рутинно подвергали серологическому скринингу для выявления соответствующих респираторных инфекций, были приобретены у ORIENT Co. (Сеул, Корея) и акклиматизированы к экспериментальному окружению в течение 1 недели.
[131] В общих чертах, мышей сенсибилизировали путем внутрибрюшинной инъекции 20 мкг ОВА (овальбумин; A5503, Sigma, Сент-Луис, Массачусетс, США), который был эмульгирован в 2 мг гидроксида алюминия в 200 мкл фосфатно-солевого буфера (ФСБ) (рН 7,4), один раз в две недели. Мышей иммунизировали ОВА через дыхательные пути (1% ОВА в ФСБ) в течение 30 мин с помощью ультразвукового ингалятора (NE-U12; Omron Corp., Токио, Япония) с 28-го по 34-й день после начальной сенсибилизации. Через 24 часа после введения антигена определяли гиперчувствительность дыхательных путей, и мышей умерщвляли через 48 часов после последней иммунизации. Мышей умерщвляли с помощью передозировки пентобарбитала (Энтобал(Entobal)®, Hanrim Pharm. Co. Ltd.) через 24 часа после последней иммунизации, затем проводили трахеотомию. После закапывания в легкие 1,2 мл физиологического раствора (ФСБ), жидкость бронхоальвеолярного лаважа (БАЛ) получали три раза путем аспирации (общий объем 1,5 мл) с помощью катетеризации трахеи.
[132] Была исследована группа мышей (n = 6); мыши получили следующее лечение: (1) группа, не получавшая ОВА, использованная в качестве нормальной контрольной группы (НК); (2) контрольная группа, получавшая ОВА путем инъекции и ингаляции, использованная в качестве группы с индуцированной астмой (ОВА); (3) группа положительного контроля, получавшая известный препарат для лечения астмы (монтелукаст; 30 мг/кг, внутрь, Sigma-Aldrich Корея, SML-0101, M30) за 1 час до ингаляции ОВА; (4) группа, получавшая исследуемый образец, в которой различные концентрации исследуемых образцов, т.е. 5 мг/кг, 10 мг/кг, 25 мг/кг и 50 мг/кг очищенного экстракта (ATC2), вводили перорально за 1 час до ингаляции ОВА.
[133] 1-2. Оценка гиперчувствительности дыхательных путей
[134] Для того чтобы оценить гиперчувствительность дыхательных путей мышей, резистентность дыхательных путей определяли с использованием аппарата (однокамерная плетизмография всего тела, OCP3000, All Medicus, Сеул, Корея), и определенное значение статистически рассчитывали с помощью индекса Penh («повышенная пауза»), который отражает степень обструкции дыхательных путей. Индекс Penh определяли в течение 3 минут путем оценки начального значения в фазе нормального дыхания, после чего определяли значение индекса Penh после вдыхания ФСБ, используя ультразвуковой ингалятор (NE-U12, Imron Corp., Токио, Япония) в течение 3 минут.
[135] После этого, чтобы определить индекс Penh, ингаляционным путем вводили различные увеличивающиеся концентрации метахолина (A2251, Sigma, Сент-Луис, Массачусетс, США), 12, 25 и 50 мг/мл. Увеличение индекса Penh после ингаляции метахолина выражали в процентах (%), при этом значение индекса Penh в начальных условиях принимали за 100%. Индекс Penh рассчитывали в соответствии с математической формулой 2, результат показан на Фиг. 4.
[Математическая формула 2]
Penh= (Te/RT-1)×PEF/PIF:
Te: время выдоха (период от ингаляции до следующей ингаляции);
RT: время релаксации (период, в течение которого выдыхаемый объем достигает 30% вдыхаемого объема во время вдоха)
PEF: пиковая скорость форсированного выдоха
PIF: пиковая скорость форсированного вдоха
[136] В результате, было подтверждено, что индекс Penh в контрольной группе, получавшей ОВА путем инъекции и ингаляции, которую использовали в качестве группы с индуцированной астмой (ОВА), резко увеличивался, в то время как в группе, не получавшей ОВА, использованной в качестве нормальной контрольной группы (НК), данный индекс постепенно увеличивался с увеличением концентрации метахолина.
[137] Изредка индекс Penh в группе положительного контроля, получавшей монтелукаст (МО), а также в группе, получавшей исследуемый образец, в которой различные концентрации исследуемых образцов вводили перорально (ATC-10, ATC-25, и ATC-50), был значительно снижен, независимо от концентрации метахолина. (см. таблицу 6).
[138] Таблица 6
[Таблица 6]
Индекс Penh
[139] Было подтверждено, что изменения индекса Penh были выраженными в группе, получавшей высокие дозы метахолина, но не в группе, получавшей более низкие дозы метахолина, и индекс Penh в группе, получавшей исследуемый образец, при аналогичной концентрации метахолина, был существенно снижен в зависимости от дозы.
[140] Соответственно, было подтверждено, что очищенный экстракт согласно настоящему изобретению эффективно подавляет гиперчувствительность дыхательных путей и, следовательно, является полезным в лечении или предотвращении астматического заболевания и аллергического заболевания дыхательных путей.
[141] Экспериментальный пример 3. Влияние на уровень эозинофилов и воспалительных клеток в БАЛ
[142] Для того чтобы подтвердить ингибиторное действие исследуемых образцов, полученных в примерах, на уровень эозинофилов и воспалительных клеток в жидкости бронхоальвеолярного лаважа (БАЛ), описанное далее исследование выполняли в соответствии со способом, раскрытым в литературе (Chen M. et al., Immunolgy, pp376-384, 2011).
[143] Жидкость бронхоальвеолярного лаважа (БАЛ), полученную в экспериментальном примере 1, выделяли для определения уровня воспалительных клеток.
[144] Общее количество воспалительный клеток оценивали путем подсчета клеток по меньшей мере в пяти квадратах гемоцитометра после исключения мертвых клеток с помощью окрашивания трипановым синим (Daigle I. et al., Swiss Med Wkly, 131, pp 231–7, 2001). По 100 мкл БАЛ наносили на стекло и центрифугировали (200g, 4°C, 10 мин), используя аппарат CellSpin (Cyto12.5+clip5, Hanil Science Industrial, Корея), чтобы зафиксировать клетки на стекле. Клетки окрашивали реагентом Diff-Quick® Stain (Sysmex, каталожный номер 38721, Швейцария) в соответствии с инструкциями изготовителя. Статистическую значимость определяли с помощью двухстороннего t-теста Стьюдента для независимых средних, и критический уровень достоверности устанавливали при p<0,05.
[145] Как показано на Фиг. 5, общее количество эозинофилов и воспалительных клеток в контрольной группе, получавшей ОВА путем инъекции и ингаляции, значительно увеличивалось, по сравнению с количеством в группе, не получавшей ОВА, использованной в качестве нормальной контрольной группы (НК).
[146] Общее количество эозинофилов и воспалительных клеток в группе положительного контроля, получавшей монтелукаст (МО), а также в группе, получавшей исследуемый образец, в которой различные концентрации исследуемых образцов вводили перорально (ATC-5, ATC-10, ATC-25 и ATC-50), было значительно снижено. (См. таблицу 7)
[147] Таблица 7
Общее количество эозинофилов и воспалительных клеток в БАЛ
[148] Экспериментальный пример 4. Влияние на уровень IgE и ОВА-специфичного IgE в сыворотке крови
[149] Для того чтобы подтвердить ингибиторное действие исследуемых образцов, полученных в примерах, на уровень IgE и ОВА-специфичного IgE в сыворотке крови, описанное далее исследование проводили в соответствии со способом, раскрытым в литературе (Kay, A.B., The New England Journal of Medicine, 344, pp30-37, 2001).
[150] Выделяли сыворотку крови и жидкость бронхоальвеолярного лаважа (БАЛ), полученную в экспериментальном примере 1, чтобы определить уровень IgE и ОВА-специфичного IgE в сыворотке крови.
[151] Сыворотку крови и жидкость бронхоальвеолярного лаважа (БАЛ) вносили в 96-луночные планшеты (планшеты для ИФА) и покрывали 0,1 М NaHCO3 буферным раствором (рН 8,3), содержащим 20 мкг/мл ОВА (Sigma, Миссури, США) в течение ночи при 4 °С. После ингибирования неспецифичной реакции с использованием ФСБ, содержащего 1% бычьего сывороточного альбумина, сыворотку для исследования разбавляли в соотношении 1:400 и приводили в контакт для взаимодействия в течение 2 часов при комнатной температуре. После промывки сыворотку приводили в контакт с разбавленным (×300) моноклональным антителом к IgE мыши (MCA419, Serotec, Оксфорд, Великобритания) в течение 2 часов и разбавленным (×4000) конъюгированным с пероксидазой хрена поликлональным антителом козы к IgG крысы (STAR110P, Serotec, Великобритания) в течение 1 ч при комнатной температуре. После промывки раствор окрашивали с использованием субстрата пероксидазы хрена 3,3',5,5'-тетраметилбензидина (52-00-02, KPL), и реакцию останавливали добавлением 2 н. H2SO4, чтобы определить оптическую плотность при 450 нм с помощью спектроскопии (VersaMax, Molecular Devices, США).
[152] Как показано на Фиг. 6 и Фиг. 7, уровень IgE и ОВА-специфичного IgE в сыворотке крови в контрольной группе, получавшей ОВА путем инъекции и ингаляции, использованной в качестве группы с индуцированной астмой (ОВА), был значительно увеличен, тогда как в группе положительного контроля, получавшей монтелукаст (МО), а также в группе, получавшей исследуемый образец, в которой различные концентрации исследуемых образцов вводили перорально (ATC-5, ATC-10, ATC-25 и ATC-50), уровень был значительно снижен. См. таблицу 8.
[153] Таблица 8
Уровень IgE и ОВА-специфичного IgE в сыворотке крови
[154] Соответственно, было подтверждено, что очищенный экстракт согласно настоящему изобретению эффективно ингибировал уровень IgE и ОВА-специфичного IgE в сыворотке крови, и, следовательно, указанный экстракт является полезным для лечения или предотвращения аллергического заболевания или астматического заболевания.
[155] Экспериментальный пример 5. Влияние на уровень воспалительных цитокинов в БАЛ
[156] Для того чтобы подтвердить ингибиторное действие исследуемых образцов, полученных в примерах, на уровень цитокинов Th2 (ИЛ-4, ИЛ-5 и ИЛ-13) и ИЛ-1β в жидкости бронхоальвеолярного лаважа (БАЛ), описанное далее исследование выполняли с помощью твердофазного иммуноферментного анализа в формате «сэндвич», раскрытого в литературе (Renz H. et al., J. Exp. Med., 1777, pp1175-1180, 1993).
[157] Сыворотку крови и жидкость бронхоальвеолярного лаважа (БАЛ) вносили в 96-луночные планшеты (планшеты для ИФА), покрытые антителом к цитокину, чтобы индуцировать реакцию антиген-антитело в течение 2 часов при комнатной температуре. Уровень цитокинов Th2 (ИЛ-4, ИЛ-5 и ИЛ-13) и ИЛ-1β в жидкости бронхоальвеолярного лаважа (БАЛ) определяли с помощью набора для ИФА (Biosource Int., Калифорния, США), специфично взаимодействующего с каждым цитокином, в соответствии с инструкцией производителя.
[158] Как показано на Фиг. 8 и Фиг. 9, через 48 часов после обработки ОВА уровень цитокинов Th2 (ИЛ-4, ИЛ-5 и ИЛ-13) и ИЛ-1β в контрольной группе, получавшей ОВА путем инъекции и ингаляции, использованной в качестве группы с индуцированной астмой (ОВА), был значительно увеличен, по сравнению с группой, не получавшей ОВА, использованной в качестве нормальной контрольной группы (НК).
[159] Увеличенный уровень цитокинов Th2 (ИЛ-4, ИЛ-5 и ИЛ-13) и ИЛ-1β в группе положительного контроля, получавшей монтелукаст (МО, 30 мг/кг), а также в группе, получавшей исследуемый образец, в которой различные концентрации исследуемых образцов вводили перорально (ATC-10, ATC-25 и ATC-50), был значительно снижен. (см. таблицу 9)
[160] Таблица 9
Уровень цитокинов Th2 (ИЛ-4, ИЛ-5 и ИЛ-13) и ИЛ-1β
[161] Соответственно, было подтверждено, что очищенный экстракт согласно настоящему изобретению эффективно ингибирует уровень цитокинов Th2 (ИЛ-4, ИЛ-5 и ИЛ-13) и ИЛ-1β в БАЛ, и, следовательно, указанный экстракт является полезным для лечения или предотвращения аллергического заболевания и астматического заболевания.
[162] Экспериментальный пример 6. Гистологическое исследование ткани легких
[163] Для того чтобы подтвердить противоастматическое действие исследуемых образцов, полученных в примерах, описанное далее гистопатологическое исследование бронхоальвеолярной ткани проводили способом, раскрытым в литературе (Kwak YG. et al., J. Clin. Invest., 111, pp1083-1092, 2003).
[164] Полученные ткани легких мышей Balb/C, которым не проводили бронхоальвеолярный лаваж, фиксировали в течение 24 часов в 10% нейтральном забуференном растворе формалина. После заливки парафином образцы нарезали на срезы толщиной 4 мкм, ткани окрашивали раствором гематоксилина/эозина (гематоксилин; Sigma MHS-16, и эозин, Sigma HT110-I-32), и оценивали степень воспаления в пяти областях каждого среза, выбранных случайным образом. (Оценка степени воспаления 0: воспалительные клетки не обнаруживаются в окружающих бронхи тканях, оценка степени воспаления 1: воспалительные клетки спорадически обнаруживаются в окружающих бронхи тканях; оценка степени воспаления 2: тонкий слой воспалительных клеток обнаруживается в большей части окружающих бронхи тканей; оценка степени воспаления 3: толстый слой воспалительных клеток обнаруживается в большей части окружающих бронхи тканей).
[165] Как показано на Фиг. 10, в контрольной группе, получавшей ОВА путем инъекции и ингаляции, которую использовали в качестве группы с индуцированной астмой (ОВА), в тканях, окружающих бронхиолы, были обнаружены многие типы воспалительных клеток, включая эозинофилы, а также гиперплазия эпителиальных клеток и гипертрофия мышц трахеи, тогда как в группе положительного контроля, получавшей монтелукаст (МО, 30 мг/кг), а также в группе, получавшей исследуемый образец, в которой различные концентрации исследуемых образцов вводили перорально (ATC-10, ATC-25 и ATC-50), инвазия воспаленных клеток была значительно снижена. (См. таблицу 10)
[166] Таблица 10
Оценка степени воспаления и соотношение числа бокаловидных клеток и эпителиальных клеток в бронхиолах
[167] Экспериментальный пример 7. Оценка гиперплазии бокаловидных клеток
[168] Для того чтобы подтвердить противоастматическое действие исследуемых образцов, полученных в примерах, описанное далее исследование гиперплазии бокаловидных клеток в бронхоальвеолярной ткани проводили способом, раскрытым в литературе (Lee KS. et al., FASEB J., 20, pp455-465, 2006).
[169] Полученные ткани легких мышей Balb/C, которым не проводили бронхоальвеолярный лаваж, фиксировали в течение 24 часов в 10% нейтральном забуференном растворе формалина. После заливки парафином образцы нарезали на срезы толщиной 4 мкм, ткань окрашивали реактивом Шиффа (PAS stain kit, T-K7308, IMEB, Калифорния, США), чтобы определить соотношение бокаловидных клеток и эпителиальных клеток бронхиол.
[170] Как показано на Фиг. 11, соотношение бокаловидных клеток и эпителиальных клеток бронхиол было значительно увеличено в контрольной группе, получавшей ОВА путем инъекции и ингаляции, которую использовали в качестве группы с индуцированной астмой (ОВА), по сравнению с нормальной контрольной группой (НК), тогда как в группе положительного контроля, получавшей монтелукаст (Mo, 30 мг/кг), а также группе, получавшей исследуемый образец, в которой различные концентрации исследуемых образцов вводили перорально (ATC-10, ATC-25 и ATC-50), соотношение бокаловидных клеток и эпителиальных клеток бронхиол было значительно снижено. См. таблицу 9.
[171] Экспериментальный пример 8. Исследование острой токсичности экстракта при пероральном введении у крыс
[172] Исследование острой токсичности проводили путем введения экстракта согласно настоящему изобретению 6-недельным крысам линии SPF Sprague-Dawley.
[173] Экстракт согласно настоящему изобретению в дозах 250 мг/кг, 500 мг/кг, 1000 мг/кг, 5000 мг/кг вводили перорально каждой группе, состоящей из 2 крыс, и наблюдали симптомы у крыс в течение 14 дней. После введения экстракта или его соединений наблюдали все клинические изменения, т.е., смертность, клинические признаки, изменения массы тела, также был проведен анализ крови, такой как общий анализ крови и биохимический анализ крови. После вскрытия наблюдали патологические изменения органов брюшной полости и органов грудной клетки.
[174] Отсутствовали какие-либо отклонения смертности, клинических признаков, изменений массы тела и результатов макроскопических исследований в любой группе или любой половой группе. Отсутствовали какие-либо признаки токсичности в исследуемой группе, получавшей 5000 мг/кг экстракта или соединений согласно настоящему изобретению.
[175] Соответственно, было подтверждено, что оригинальный экстракт, полученный в настоящем изобретении, представлял собой действенное и безопасное вещество с ЛД50 более 5000 мг/кг при введении внутрь.
Способ реализации изобретения
[176] Далее будут описаны способы приготовления и виды вспомогательных веществ, которые не ограничиваются перечисленными в настоящем документе. Типичные примеры препаратов были описаны следующим образом.
[177] Приготовление инъекционной формы
[178] Препарат для инъекций получали путем растворения активного компонента, доведения значения рН до приблизительно 7,5, с последующим заполнением 2 мл ампулы всеми компонентами и стерилизацией препарата для инъекций стандартным способом.
[179] Приготовление порошка
Препарат в форме порошка получали путем смешения вышеуказанных компонентов и заполнения запечатанной упаковки.
[180] Приготовление таблетки
[181] Препарат в форме таблетки получали путем смешивания вышеупомянутых компонентов и таблетирования.
[182] Приготовление капсулы
[183] Препарат в форме капсулы получали путем смешивания вышеупомянутых компонентов и заполнения желатиновой капсулы с помощью стандартного способа получения лекарственных форм на основе желатина.
[184] Приготовление жидкой формы
Препарат в жидкой форме получали путем растворения активного компонента, с последующим заполнением 1000 мл ампулы всеми компонентами и стерилизацией с помощью стандартного способа для приготовления жидкой лекарственной формы.
[185] Приготовление диетического пищевого продукта
Количество витаминов и смеси минералов, указанных выше, может варьироваться различными способами. Такие варианты не следует рассматривать как отступающие от сущности и объема настоящего изобретения.
[186] Приготовление диетического напитка
Диетический напиток получали путем растворения активного компонента, смешивания, перемешивания при 85 °С в течение 1 часа, фильтрования с последующим заполнением 1000 мл ампулы всеми компонентами и стерилизацией стандартным способом для приготовления диетического напитка.
[187] Настоящее изобретение было подробно описано выше, и будет очевидно, что настоящее изобретение может быть изменено многими способами. Такие варианты не следует рассматривать как отступающие от сущности и объема настоящего изобретения, и все подобные модификации, как будет понятно специалистам в данной области техники, должны быть включены в объем следующей формулы изобретения.
Промышленная применимость
[188] Как описано в настоящем изобретении, в настоящем изобретении предложен новый оригинальный промышленно применимый способ получения очищенного экстракта, содержащего большее количество активных ингредиентов, таких как производные каталпола, из экстракта Pseudolysimachion rotundum var subintegrum, при этом указанный очищенный экстракт имел более сильную противовоспалительную, противоаллергическую и противоастматическую активность, по сравнению с экстрактом, полученным с помощью стандартного способа получения, раскрытого в данной области техники, согласно результатам различных исследований в условиях in vivo, таких как исследование ингибирования выработки эозинофилов, высвобождения иммуноглобулина и воспалительных хемокинов в плазму крови и бронхоальвеолярную жидкость, а также исследование подавления гиперчувствительности дыхательных путей и гиперплазии бокаловидных клеток в ОВА-сенсибилизированной/иммунизированной мышиной модели. Следовательно, указанный экстракт может быть использован в качестве терапевтического лекарственного средства или функционального диетического пищевого продукта для лечения и предотвращения воспалительного, аллергического или астматического заболевания.
Реферат
Изобретение относится к фармацевтической промышленности, а именно к продукту для предотвращения или облегчения воспалительного заболевания. Функциональный пищевой продукт, содержащий очищенный экстракт после вторичного фракционирования (АТС2), полученный из экстракта Pseudolysimachion rotundum var subintegrum фракционированием бутанолом, очисткой и последующим фракционированием с помощью хроматографии, для предотвращения или облегчения воспалительного заболевания, содержащий 30-60% масс./масс. вепрозида, 0,5-10% масс./масс. вератровой кислоты, 2-20% масс./масс. каталпозида, 1-10% масс./масс. пикрозида II, 1-10% масс./масс. изованиллоилкаталпола и 2-20% масс./масс. 6-О-вератроилкаталпола в расчете на общую массу экстракта (100%) Pseudolysimachion rotundum var subintegrum. Функциональный пищевой продукт, содержащий очищенный экстракт после вторичного фракционирования (АТС2), полученный из экстракта Pseudolysimachion rotundum var subintegrum фракционированием бутанолом, очисткой и последующим фракционированием с помощью хроматографии, для предотвращения или облегчения воспалительного заболевания, который содержит 36,5-91% масс./масс. производных каталпозида в общем экстракте (100%) Pseudolysimachion rotundum var subintegrum и который имеет следующее относительное содержание масс./масс. каждого из производных каталпозида: 13,0-16,0 масс./масс. вепрозида, 2,20-2,50 масс./масс. каталпозида, 1 масс./масс. пикрозида II, 1,10-1,40 масс./масс. изованиллоилкаталпола и 2,00-2,20 масс./масс. 6-О-вератроилкаталпола. Вышеописанные продукты эффективны для предотвращения или облегчения воспалительного заболевания. 2 н. и 1 з.п. ф-лы, 15 ил., 10 табл., 7 пр.

Комментарии