1
Изобретение относится к способу
Получения новых производных арилокси пропаноламинов, обладающих ценными
фармакологическими свойствами и которые могут найти применение в медицине .
Цель изобретения - способ получения новых производных арилоксипропа-
ноламицов, обладающих более выраженными кардиотоническими и f -блокирующими свойствами.
Пример 1. Оксалат 1-фенокси- 3- 2-(1,2,4-триметил-5-пиразолон-3-
-ил-амино)этиламино пропан-2-ола.
3,8 г фенилглицидилового эфира,
8,8 г 3-(2-аминоэтиламино)-1,2,4-три- метил1-5-пиразолона перемешивают в
течение 22 ч при . Растворяют реакционную смесь в метиленхлориде и
очищают с помощью хроматографирова- ния на колонке с силикагелем и элю-
ентом метиленхлорид - метанол (9:1)
и метиленхлорид - триэтиламин-мета- нол (20:2: 1).
Выход 5,2 г (61%), масло.
Из этилацетата при добавлении эквивалентного количества щавелевой
кислоты выпадает оксалат, его пере- кристаллизовывают из этанола при добавлении
активированного угля и получают бесцветные кристаллы, т.пл. 141-142 С (разл.).
Применяемый в качестве исходного соединения 3-(2-аминоэтиламино)-,2,
4-триметил-5-пиразолон может быть получен следующим образом.
Диэтиловый эфир метилмалоновой кислоты и N,N -диметилгидраЗИН кипятят в присутствии метилата натрия в
метаноле в течение 170 ч в атмосфере |азота с обратным холодильником. Получают
3-окси-1,2,4-триметил-5-пира- золон в виде бесцветных кристаллов , Т.пл. 87-89°С (из этилацетата).
Из названного соединения в ре
3,0 г фенилглицидиловог о эфира и
7,2 г 4-(2-аминоэтиламино)-2,5,6-три- 20 метштиримидина перемешивают в 5 мл
изо1Тропанола в течение 20 ч при 60-70 0, после чего смесь разделяют
на колонке с силикагелем элюирующей смесью метиленхлорид - метанол - тризультате взаимодействия с хлорокисью
фосфора (3,5 ч кипячения) получаютэтиламин (30:2:1). В результате песоль
3,5-дихлор-1,2,4-триметилпиразо-рекристаллизации из этилацетата с исла , обработка которого водным раст-пользованием отбеливающей глины и аквором
едкого натра и экстракция ме-тивированного угля получают 2,9 г
тиленхлоридом дает З-хлор-1,2,4-три-(44%) бесцветных кристаллов, т.пл.
метил-5-пиразолон, т.пл. 37-8°С. ЗО119-12ГС.
Применяемый в качестве исходного
Его подвергают взаимодействию ссоединения 4-(2-аминоэтиламино)-2,5,
избыточным количеством этилендиамина6-триметилпиримидин, бесцветные крис (22 ч при температуре кипения), за-таллы, т.пл. 109-111 С (из зтилацетем
упаривают, остаток для удаления 35тата), можно получить в результате
взаимодействия 4-хлор-2,5,6-триметил40
солей из метанольного раствора пропускают
через ионообменник 1 Р А-400 (ОН-форма) и очищают на сили- кагеле смесью метиленхлорид - метанол
8:2. Получают 3-(2-аминоэтил- амино)-1,2,4-триметил-5-пиразолон в виде желтоватого масла (выход 81%)
Пример 2. 1-Фенокси-ЗтС2-(1, 3,5-триметилпиразол-4-иламино)этил-
амино пропан-2-ол фумарат.
Смесь 3,8 г фенилглицидилового
эфира и 8,4 г 4-(2-амино-этш1амино)- -1,3., 5-триметилпиразола выдерживают
при комнатной температуре в течение 48 ч. Растворяют в метиленхлориде,
встряхивают с водой,, сушат и чистят на силикагеле, используя в качестве
элюента смесь метиленхлорида - аммиака - метанола 92:8. Получают 4,7 г (59%) масла. Его растворяют в 55
этилацетате, добавляют 1,7 г фумаро- вой кислоты, вьшавший осадок растирают
с изопропанолом и перекристал- лизовывают из этанола. Получают цепиримидина с избыточным количеством этилендиамина при комнатной температуре (48 ч) .
Пример 4. 1-(4-Бензилокси- фенокси)(2,6-диметилфенилами- но)этиламино пропан-2-ол.
5,12 г 4-бензилоксифенилглицидило- 45 вого эфира и 6,56 г Н-(2,6-диметилфе-
.нил)этилендиамина нагревают при 70°С при перемешивании в течение 20 ч.
Очистку осуществляют с помощью ионообменной хроматографии (амберлит
50 CG-5011 практ.(Серва). Выход 6,8 г (81%), вязкое светлое масло).
П р и м е р 4. 1-(4-Пропоксифзнок- си)3- 2-(2,6-диметилфениламино)этил- амино пропан-2-ол.
4,15 г 4-пропоксифенилглицидило- вого эфира и 6,6 г (2,6-диметилфе-
нил)этилендиамина оставляют стоять в течение трех дней при комнатной
температуре и разделяют смесь при по
5
левой продукт в виде бесцветных кристаллов с т.пл. (разл.).
Исходный 4-(2-аминоэтиламино)-1, 3,5-триметилпиразол получают взаймо-
действием 4-амино-1,3,5-триметилпи- разола с N-2-бромметилфталимидом в
присутствии карбоната калия в ацето- нитриле 16 ч при температуре кипения и получают 4-(2-фталимидоэтил-
амино)-1,3,5-пиразол, желтоватые кристаллы, т.пл. 122-123 С (из этанола ), гидразинолиз дает 4-(2-ами-
ноэтиламино)-1,3,5-триметилпиразол в виде масла.
П р и м е р 3. 1-Фенокси-З- 2-(2, 4,5-триметш1пиримидин-6-иламино)этил- амино пропан 2-ол.
3,0 г фенилглицидиловог о эфира и 7,2 г 4-(2-аминоэтиламино)-2,5,6-три-
0 метштиримидина перемешивают в 5 мл изо1Тропанола в течение 20 ч при
60-70 0, после чего смесь разделяют на колонке с силикагелем элюирующей
смесью метиленхлорид - метанол - три40
пиримидина с избыточным количеством
этилендиамина при комнатной температуре (48 ч) .
5
Пример 4. 1-(4-Бензилокси- фенокси)(2,6-диметилфенилами- но)этиламино пропан-2-ол.
5,12 г 4-бензилоксифенилглицидило- 5 вого эфира и 6,56 г Н-(2,6-диметилфе-
.нил)этилендиамина нагревают при 70°С при перемешивании в течение 20 ч.
Очистку осуществляют с помощью ионообменной хроматографии (амберлит
0 CG-5011 практ.(Серва). Выход 6,8 г (81%), вязкое светлое масло).
П р и м е р 4. 1-(4-Пропоксифзнок- си)3- 2-(2,6-диметилфениламино)этил- амино пропан-2-ол.
4,15 г 4-пропоксифенилглицидило- вого эфира и 6,6 г (2,6-диметилфе-
нил)этилендиамина оставляют стоять в течение трех дней при комнатной
температуре и разделяют смесь при помощи ионообменной хроматографии. Выход
4,3 г (58%), бесцветные кристаллы , т.пл. 51-54 С, нейтральный фума- рат, т.пл. 168-169°С (этанол).
Примерз. 1-(3,4-Диметокси- фенокси)(1,3,5-триметилпирими-
дин-2,А-дион-6-иламино)этш1амино1 пр пан-2-ол,
4,2 г 3,4-диметоксифенилглициди-
лового эфира и 8,5 г 4-(2-аминоэтил- амино)-1,3,5-триметилпиримидин-2,б (1Н,ЗН)-диона в 5 МП диметилформа-
мида перемешивают в течение 48 ч при комнатной температуре. Затем , растворяют в метиленхлориде, трижды
встряхивают с водой, экстрагируют органическую фазу 1 н. раствором уксусной
кислоты, водную фазу добавлением разбавленного раствора едкого натра подщелачивают и экстрагируют
раствор метиленхлоридом. После высушивания метиленхлоридный экстракт
хроматографируют на силикагеле элюи- рующей смесью метиленхлорид - метанол
- аммиачный метанол (насыщенньш) 20:1: 1.
Полученный после упаривания чистой
фракции остаток перекристаллизо- вывают из этилацетата. Выход 2,0 г (24%), бесцветные кристаллы, т.пл.
103-104°С.
Прим ер 6. Нейтральный фума-
рат 1-фенокси-3- З-(1,3,3-триметилпи римидин-2,4-дион-6-Ш1амино)пропиламино пропан-2-ола.
3,8 г фенилглицидилового эфира оставляют стоять с 10 г 4-(3-амино-
пропиламино)-1,3,5-триметилпирими- дин-2,6 (1Н,ЗН)-диода при комнатной температуре в течение 20 ч, после
чего хроматографируют на силикагеле элюирующей смесью метиленхлорид -
аммиачный метанол 9:1. Масло (5,5 г полученное из чистых фракций после
упаривания, в этилацетате смешивают с 1,7 г фумаровой кислоты и полученную соль перекристаллизовывают
из этанола.
Выход 2,5 г (23%), бесцветные кристаллы, т.пл. 132-133°С.
Применяемый в качестве исходного продукта 4-(3-амино-пропиламино)-1,
3,5-триметилпиримидин-2,6-(1Н,ЗН), бесцветное масло, может быть получен в результате взаимодействи я 4-
4-хлор 1,3,5-триметилпиримидин-2,6 (1Н,ЗН)-диона с избыточным количест
вом 1,3-диаминопропана при 10-15°С.
о-
Ш
287748 6
Пример 7. Бензоат 1-фенокси-3- 2-(4-индазолиламино)этилами- но пропан-2-ола.
3,0 г фенилглицидилового эфира и 7,0 г 4-(2-аминоэтиламино)индазо-
ла .растворяют в 7 мл диметилформами- да при нагревании, после чего оставляют
в течение 20 ч при комнатной температуре. Растворяют в метилен- хлориде, дважды встряхивают с водой,
высушивают сульфатом натрия, обрабатывают раствор отбеливающей глиной , упаривают, растворяют в этил- ,
ацетате и добавляют 3,0 г бензойной кислоты. Полученную соль перекрис-
та ллизовывают из изопропанола при добавлении отбеливающей глины и активированного угля.
Выход 3,9 г (43%), бесцветные кристаллы, т.пл. .155-156°С.
Применяемый в качестве исходного соединения 4-(2-аминоэтиламино)инда-
зол можно получить из 4-оксииндазола и избыточного количества (10х) суль-
фата этилёндиамина с выходом 43% (в водном растворе при кипячении в течение
часа): светло-бежевые кристалJ5
20
30
лы, т.пл, 138-140°С (из метиленхлори- да) .
0
П р и м е р 8. 1-(4-Фторфенок- си)(2,6-диметилфениламино)- этиламино пропан-2-ол.
3,36 г 4-фторфенилглицидилового
5 эфира оставляют стоять с 6,6 г N-(2,
6-диметилфенил)этилёндиамина в течение двух дней при комнатной температуре
. Смесь разделяют хроматографи- рованием на силикагеле элюирующей смесью этилацетат - метанол - три-
этиламин 100:10:1, и после испарения чистых фракций получают 5,0 г целевого
соединения в виде вязкого масла. После растворения в эфире при до5
бавлении 2,5 г бензойной кислоты выпадает бензоат, который перекристаллизовывают
из изопропанола. Выход 5,2 г (57%), бесцветные кристаллы, т.пл. /05-106°С.
0 Пример9. Оксалат 1-фенокси- (2-метил-4-оксиметил-тиофен-3-
-иламино)этиламино пропан-2-ола.
0,27.г фенилглицидилового эфира,
0,5 г 3-(2-аминоэтиламино)-2-метил-45 -оксиметилтиофена и 2. мл ацетонитри-
ла перемешивают в течение 24 ч при 40°С. Реакционный раствор упаривают,
остаток растворяют в этаноле и смешивают с этанольным раствором щавелевой кислоты. После осаждения кристаллов их дважды перекристаллизовы- вают из этанола.
Выход 0,23 г (30%), бесцветные кристаллы, т.пл. 117-120°С.
Применяе мое в качестве исходного соединения производное тиофена можно
получить в результате следующих стадий .
1..3-Амино-2-метил-4-оксиметилти-
офен, т.пл. 70-71°С, в результате восстановления метилового зфира 2-ме-
тил-З-аминотиофен-4-карбоновой кислоты литийалюминийгидридом в эфире,
2.3-(2-Фталимидоэтиламино)-2-ме- тил-4-оксиметилтиофен, желтоватые кристаллы, т.пл. 96-97 С (эфир), в
результате взаимодействия названного соединения с Н-(2-бромметил)фтали-
мидом в присутствии карбоната калия (7ч, 100°С, расплав).
3.3-(2-Аминоэтиламино)-2-метил- -4-оксиметилтиофен, бесцветное масло
, в результате гидразинолиза производного 3-(2-фталимидоэтиламино)тио- фена.
Пример 10. 1-Фенокси-3- 2- -(2-аминохиназолин-4-иламино)этил- амино проп ан-2-ол.
3,32 г фенилглицидилового эфира и 9,0 г 2-амино-4-(2-аминоэтиламино)
хиназолина в 100 мл изопропанола перемешивают 24 ч при 50°С. Реакционную
смесь упаривают и очищают хрома- тографированием, получают 2,0 г (26%)
бесцветного масла. Растворяют его в смеси этилйцетата и этанола (3:1),
добавляют фумаровую кислоту, кристаллизуется фумарат, бесцветные кристаллы , т.пл. 204-206°С.
Применяемое в качестве исходного соединения производное хиназолина моно
получить в результате следующих взаимодействий:
2-Хлор -4-(2-аминоэтиламино)хина- золйнполучают при взаимодействии , 2,4-дихлорхиназолина и избыточного
количества этилендиамина при 8-10°С. Из него путем взаимодействия с уксусным
ангидридом в метаноле получаю 2-хлор-4-(ацетамидоэтш1амино)хиназо- лин, бесцветные кристаллы, т.пл.
202-204°С. Из этого соединения получают при взаимодействии с жидким аммиаком
в этаноле (1:2) в автоклаве (48 ч, 110°С) и удалении солей с ионообменной смолой (ОН-форма)-2-
2-aминo-4-(2-aцeтaмидoэтилaминo)xи- нaзoлин, из которого гидролизом в
O
5 0
0 5
0
5 0
5
2 и. НС1 в течение 4 ч при температуре
кипения, удалением солей с ионообменной смолой (ОН-форма) и хрома-
тографированием на силикагеле получают 2-амино-4-(2-аминоэтиламино)хи-
назолин, бесцветные кристаллы, т.пл. 152-156 С.
Пример 11. 1-Фенокси-3- 2-
-(З-метилхиноксалин-2-иламино)этил- амино пропан-2-ол.
5,6 г фенилглицидилового эфира и 15 г 2-(2-аминоэтиламино)-3-метил- хиноксалина растворяют в небольшом
количестве диметилформамида и нагревают 32 ч при . Затем реакционный
раствор выливают в воду, экстрагируют метиленхлоридом, высушивают
и очищают хроматографированием на силикагеле .
Выход 4,2 г (33%), вязкое масло.
Из этилацетата при добавлении
фумаровой кислоты выпадает.соль, которую перекристаллизовывают из этанола
, получают бесцветные кристаллы, т.пл. 152-153 С (нейтральный гидрат фумарата).
Применяемый в качестве исходного соединения 2-(2-аминоэтиламино)-3-
-метилхиноксалин получают в результате взаимодействия 2-хлор-З-метил-
хиноксалина с избыточным количеством этилендиамина и удаления солей с помощью
ионообменной смолы (ОН-форма), бесцветные кристаллы, т.пл. 60-61 С (из ксилола).
Пример 12. 1-Фенокси-З- 2-( 1, 2,3,4-тетрагидроакридин-9-иламино) этиламино пропан-2-ол.
1,5 г фенилглицидилового эфира и 5,0 г 9-(2-аминоэтиламино)-1,2,3,4-
-тетрагидроакридина растворяют в метаноле и кипятят .в течение 1 ч. Смесь
упаривают и остаток очищают хроматографированием , как указано в примере 9.
Выход 1,0 г (26%), бесцветные кристаллы, т.пл. 99-100°С (из изопропанола ) .
Применяемое исходное соединение 9-(2-аминоэтиламино)-1,2,3,4-тетра-
гидроакридин, бесцветное масло, получают в результате взаимодействия
9-хлор-1,2,3,4-тетрагидроакридина с избыточным количеством этилендиамина , кипятят в течение 12 ч.
Аналогичным образом получают: Кислый фумарат 1-фенокси-3- 2-(1,
3-диметил-5-п-бутилпиримидин-2,4-дион-6-иламино;этиламиноЗ пропан-2-ола
т.пл. 78-8а°С (разл.);
Кислый фумарат 1-фенокси-З- 2-(1,
3-диметил-5-фенилпириьтидин-2,4-днон- -6-иламино)этиламино пропан-2-ола, т.пл. 181-183 С;
Гидрохлорид 1-фенокси-З- 2-(1,3- -диметил-5-цианпиримидин-2,4-дион-6-
-иламино)этиламино пропан-2-ола, т.пл. 202-204°С;
1-Фенокси-3- 3-(1,3,5-триметилпи- римидин-2,4-дион-6-иламино)-2,2-ди- метилпропиламино пропан-2-ол, т.пл.
111-112 0;
Кислый фумарат 1-фенокси-З- 2-(1, 3,5-триметилпиримидин-2-он-4-дион-6-
-иламино)этиламино пропан-2-ола, т.пл. 151-153°С (разл;).
Пример 13. Кислый фумарат 1-фенокси-3- 2-(1,3-диметил-5-п-бу тилпиримидин-2,4-дион-6-иламино)этиламино
пропан-2-ола.
5,5 г 4-ХЛОР-1,3-димeтил-5-п-бy-
тилпиpимидин-2,6-( 1Н,ЗН)-диона и 5,0 г 1-фенокси-3-(2-аминоэтилами-
но)пропан-2-ола перемешивают в 20 мл диметилформамида четыре дня при
Раствор упаривают, остаток растворяют в метиленхлориде, встряхивают с
водой, высушивают и очищают хроматографией на колонке с силикагелем с
использованием элюета метиленхлорид метанол (9:1). В результате упаривания чистых фракций получают 4,4 г
желтоватого масла. Его растворяют в этилацетате и смешивают с раствором
1,3 г фумаровой кислоты в этилацетате .. После кристаллизации осадок отфильтровывают
и промывают этилацета- том. Выход 2,4 г (17%), бесцветные кристаллы, т.пл. 78-80°С (разл.).
Пример 14. Кислый фумарат 1-фенокси-З- 2-(1,3-диметил-5-фенил- пиримидин-2,4-дион-6-иламино)этиламино
пропан-2-ола.
5,0 г 4-хлор-1,3-димeтил-5-фeнил-
пиpимидин-2 ,6( 1Н, ЗН)-диона, 4,2 г 1-фенокси-3-(2-аминоэтиламино)про-
пан-2-ола и 3,5 мл N-этилдиизопропил амина кипятят в 20 мл ацетонитрила
в течение 48 ч с обратным холодильником . Смесь упаривают в вакууме, переносят остаток в метиленхлорид,
встряхивают раствор с 2 н. раствором едкого натра, высушивают и разделяют
хроматографически на колонке с сили- кагелей элюирующей смесью метиленхлорид
- метанол - насыщенный аммиаком метанол 40:1:1.
Полученное в результате упаривания чистых фракций масло (5,3 г) растворяют в 10 мл этилацетата, после
чего смешивают с раствором 2 г фумаровой кислоты в 20 мл этанола, После
кристаллизации осадок отсасывают и промывают этилацетатом.
Выход 6,7 (62%), бесцветные кристаллы , т.пл. 181-183 С.
Пример15. Гидрохлорид 1-фенокси-З- 2-(1,З-диметил-5-цианпири- мидин-2,4-дион-6-иламино)этиламино
пропан-2 ола.
При охлаждении 5 г 4-хлор-5-циан 1
,3-диметилпиримидин-2,6(1Н,ЗН)- -диона маленькими порциями вносят в раствор 5,26 г 1-фенокси-3-(2-амино-
этиламино)пропан-2 ола в 20 мл диметилформамида . Реакционную смесь
перемешивают 2 ч при комнатной температуре , смешивают с 60 мл изопро-
панола, отсасывают и промывают изо- пропанолом.
Выход 8,7 г (85%), бесцветные
кристаллы, т.пл. 202-204 С.
Пример 16. 1-фенокси-З- З- -(1,3,5-триметилпиримидин-2,4-дион- -6-иламино)-2,2-диметилпропилами-
но пропан-2-ол.
4,5 г 4-хлор-1,3,5-триметилпири-
мидин-2,6-(1Н, ЗН)-диона и 6,1 г 1-фенокси-З-(З-амино-2,2-диметилпро-
пиламино)пропан-2-ола (т.кип. 159- (0,01 мм рт.ст.) из фенилглицидилового эфира и 2,2 диметил-1,3-
-диаминопропана в 8 мл пиридина перемешивают 50 ч при . Затем вносят в метиленхлорид, встряхивают
с водой, высушивают, упаривают и
хроматографируют на силикагеле.
Выход 2,3 г (24% от теории), бесцветные кристаллы, т.пл. 111-112°С (из этилацетата).
Пример17. Кислый фумарат 1-фенокси-3- 2-(1,3,5-триметилпири-
мидин-2-он-4-тион-6-иламино)этилами- ноЗ пропан-2-ола.
5,0 г 1-фенокси-3-(2-аминоэтиламино )пропан-2-ола и 5,2 г 4-метил- меркапто-1,3,5-триметш1пиримидин-
-2(ЗН)-он-6(1Н)-тиона кипятят в 150 мл изопропанола в течение 22 ч
с обратным холодильником. Реакционную смесь хроматографируют. Полученное
желтоватое масло (7,5 г) растворяют в этилацетате. Добавляют раствор 2j3 г фумаровой кислоты в
смеси этилацетата и этанола, отсасывают выпавшие кристаллы и перекрис-
таллизовывают из этанола.
Выход 5,8 г (49%), желтые кристаллы
, т.пл. 151-153°С (разл.).
Применяемый в качестве исходно- 5
го соединения 4-метилмеркапто-1,3,5- -триметилпиримидин-2(ЗН)-он-6(1 Б)-ти-
он, желтые кристаллы, т.пл. 93-94 0 .(из этилацетата) получают метилиро-
ванием 4-меркапто-1,3,5-триметилпи- 0 римидин-2(ЗН)-он-6(Н)-тиона.
Аналогичным образом получают:
Оксалат 1-фенокси-З- 2-(1,2,4-три-
метил-5-пиразолон-3-иламино)этилами- но пролан-2-ола, т.пл. 141-124 С 5 (разл.); -
1-Фенокси-3- 2-(2,4,5-триметилпи- римидин-6-иламино)этиламино пропан-
-2-ол, т.пл. 119-121°С;
1-(4-Бензилоксифенокси)(2, 20
6-диметилфениламино)этиламино про- пан-2-ол, вязкое светлое масло;
1-(4-Пропоксифенокси)(2,6- -диметилфениламино)этиламино про- пан-2-ол, т.пл. 51-54°С;
1-(3,4-Диметоксифенокси)( 1 , 3,5-триметилпиримидин-2,4-дион-6-ил-
амино)этиламино пропан-2-ол, т.пл. 103-104°С;
Нейтральный фумарат 1-фенокси-З- (1,3,5-триметилпиримидин-2,4-ди- он-6-иламино)пропиламино пропан-2-
-ола, т.пл. 132-133°С;
Бензоат-1-фенокси-3- 2-(4-индазо-
лиламино)этиламино пропан-2-ола, 35 т.пл. 155-156°С;
Нейтральный фумарат 1-(4-оксифе- нокси)-3-Г2-(2,6-диметилфениламино ) гфопан-2-ола, т.пл. 193-1959С;
1-(4-Фторфенокси)-3- 2-(2,6-ди- 40 метилфениламино)этиламино пропан-
-2-ол, т.пл. 105-106°С;
25
30
45
Оксалат 1-фенокси-3- 2-(2-метил- -4-оксиметилтиофен-3-иламино)этил -
амино пропан-2-ола, т.пл. 117-120 С;
1-Фенекси-З- 2-(6-хлорпиридазин-З-
-иламино)этиламино пропан-2-ол, т.пл. 147-149°С;
1-Фенокси-3- 2-(2-аминохиназо- 50 лин-4-иламино)этиламино пропан-2-ол, т.пл. фумарата 204-206°С;
1-Фенокси-3- 2-(3-метилхинокса- лин-2-иламино)этиламино пропан-2-ол,
т.пл. 152-153°С (нейтральный гидрат фумарата);.
1-Фенокси-3-С2-(1,2,3,4-тетрагид- роакриднн-9-иламино)этиламино} про- пан-2-ол, т.пл. 99-100°С.
55
Испытание кардиотокической актив-
шости.
Для определения кардиотонической активности соединений, получаемых по
предлагаемому способу, брались беспородные собаки обоих полов, которым
предварительно были имплантированы катетеры в артерию и вену бедра и
через миокард в левый желудочек. Животные бьши пригодны, лишь в клинически
здоровом состоянии, т.е. не ранее чем через 10 дней после имплантации.
Во время опыта, в котором животные были в состоянии бодрствования,
непрерывно регистрировалось артериальное кровяное давление через кате-
|Тер и электромеханический преобразователь давления. Кроме того, при помощи
импульсного манометра, которьй вводился в- катетер желудочка и выдвигался
до сердца, непрерывно измерялось давление в левом желудочке и отсюда определялась дифференциация
5
0
5
0
по времени dp/dt (fror)
MCLKt
Частота сердца (.t(-cr вычислялась подсчетом сердечной
деятельности при быстром движении ленты в определенных точках измерения.
Вещества вводились в дозе 0,25 мг/мг . мин через 60 мин после
чего следовало 30-минутное дополнительное наблюдение. Для некоторых веществ дозы повышались в 10 раз
или дозы увеличивали замедленно в логарифмической дозировке, чтобы
можно было охватывать по возможности большой интервал доз.
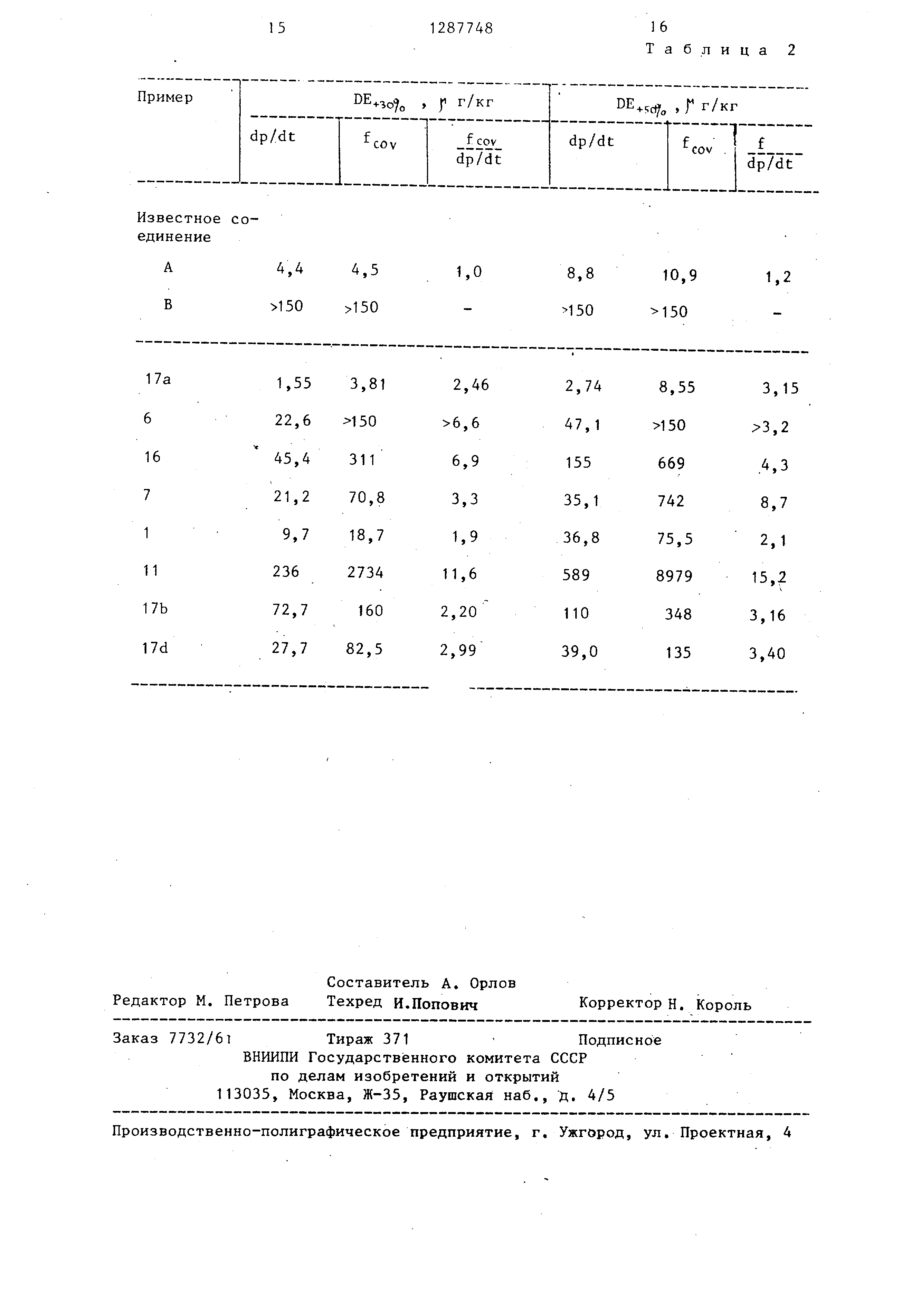
Из логарифма, применяемой дозы и времени измерения dp/dt глакс , или
частоту (fj-or ) вычислялась линейная регрессия. Отсюда могли калькулироваться
дозы и DE.5oY, (f г/кг), которые вызывали повьшение исходных
5
0
dp/dt
макс 1
ИЛИ f
cor
на 30
величин
или 50%. В табл. 1 приведены испытания
кардиотонического действия соединений , получаемых по предлагаемому способу.
Результаты сравнительных испытаний известных соединений и веществ,
полученных по предлагаемому способу, приведены в табл. 2.
Известное соединение А - (1-фенок- 5 си-3-С2-(2,6-диметилфениламино)этил-
амино пропан-2-ол), хотя и имеет хорошее кардиотоническое действие (повьшение dp/dt), но в этой же
дозе повышает также частоту, что,не131287748I-i
желательно, так как ведет к перегруз-нее, чем повышение частоты. Следоваке сердца.тельно, чем выше частное, тем лучше
Для оценки кардиотонического дай-вещество. Напротив, низкие дозы не
ствия веществ прежде всего искалимогут считаться критерием особенно
дозы, которые повьплают на 30 или 50% 5благоприятного действия, оно опредесердечную деятельность (dp/dt) иляется отношением действия на сердечсердечную
частоту (ftor ) деятельность и сердечную частоту.
Далее вычисляли частное от деления
на . Особен- Другое сравнительное вещество В но ценны вещества, которые имеют вы- (1-фенокси-З- 2-(1,3-диметилпиримисокую
величину частного, так как этидин-2,4-дион-6-иламино)этиламино провещества в пересчете на дозу дают по-пан-2-ол) - не имеет кардиотоническовышение
сердечной деятельности силь-го действия.
96 92
98 105 105
97 99 98
93 115 108 123 141 140
dp/dt,
мм рт,ст./с
2,15 2,05 2,48 2,60 2,90 3,68 3,18 4,4
98
97 106 100 105 106 102
Фумарат 1-) Рд, мм рт.ст.
-дксифенокси)-
-3-f2-(1,3,5-I
-трвметилпкри- f , удары/мин 55 57 77 63 65 85 108 3,81 8,55 у 57 1о
кидин-2,4-дион-6-иламино )этилaMHHoJ пропан-2-олаdp/dt ,
.ст./с 2,80 3,20 3,30 3,40 3,80 4,
X + 96,9
мм рт.
40 4,80 1,55 2,74 у 81 1о
Примечание .
f - сердечная частота, удары/мин.
dp/dt - скорость повышения давления в левом желудочке, мм рт.ст./с. Sijy доза, которая вызьгаает повышение нсходньос величин на 30 и 50%, ,
98 105 105
4,5 10,9 у 53 1о
X + 95,5
8,8 у 67 1о X + 86,5
X + 96,9
40 4,80 1,55 2,74 у 81 1о
X + 114,4
Известное соединение
Редактор М. Петрова
Составитель А. Орлов Техред И.Попович
Заказ 7732/6t Тираж 371 Подписное ВНИИПИ Государственного комитета СССР
по делам изобретений и открытий 113035, Москва, Ж-35, Раушская наб., д. 4/5
Производственно-полиграфическое предприятие, г, Ужгород, ул. Проектная, 4












Комментарии