Полициклические соединения, их производные, фармацевтические препараты как усилители и метод лечения нарушения мыслительной деятельности - RU2152944C1
Код документа: RU2152944C1
Чертежи















Описание
Изобретение относится к дизамещенным полициклическим соединениям, их производным, фармацевтическим препаратам и методам использования при лечении у млекопитающих нарушения мыслительной деятельности и/или неврологических дисфункций и/или депрессий таких как болезни, связанные с дегенерацией нервной системы, и не только их. Кроме того, эти соединения могут быть использованы в качестве реагентов при изучении биохимических механизмов, вызванных нейротрансмиттерами болезней.
Необходимость в эффективном лечении расстройств нервной системы и неврологической недостаточности растет. Многие из этих расстройств связаны со старением ввиду дегенеративных изменений нервной системы. Хотя на ранних стадиях ряда заболеваний некоторые системы поражаются скорее специфически (например, холинэргические системы при болезни Альцгеймера и Myasthenia Gravis, допаминэргическая система при паркинсонизме и так далее), многочисленные дефициты в нейротрансмиттерной системе (ацетилхолин, допамин, норэпинефрин, серотонин) обычно обнаруживаются на более поздних стадиях при таких заболеваниях, как старческое слабоумие, слабоумие при обширном инфаркте, болезни Хантингтона, умственной отсталости и так далее. Это объясняет наблюдаемую обычно множественную симптоматологию, которая включает мыслительные, неврологические и эффективные/психотические компоненты (см. Geof fries, Psychopharmacol, (1985), 86:245). Принято считать, что недостаточность синтеза и выделения ацетилхолина в мозгу связана с ухудшением мыслительной деятельности (см. Francis, et al., N.Engl.J.Med., (1985) 7:313), тогда как неврологические расстройства (например, симптомы паркинсонизма), депрессия и умственные изменения могут быть вызваны повреждением допаминэргической и серотонэргической систем соответственно. Другие неврологические нарушения (например, Myasthenia Gravis) связаны с холинэргической недостаточностью в периферической нервной системе. Применяемая до сих пор стратегия лечения включает такие вазоактивные средства, как винкамин и пентоксифиллин; ускорители обмена веществ, такие как эрголоид мезилаты; пирацетам, и нафтидрофурил; предшественники нейротрансмиттеров, такие как 1-ДОФА, холин и 5-гидрокситриптамин; трансмиттер, метаболизирующий ингибиторы энзима, такие как физостигмин; и нейропептиды такие, как адренокортикотропный гормон и родственные вазопрессину пептиды. За исключением L-ДОФА для лечения паркинсонизма и ингибитора холинэстеразы для лечения Myasthenia Gravis этими методами лечения обычно не удается усилить остаточную функцию пораженной системы усилением вызванной раздражителем секреции нейротрансмиттеров. Теоретически такое усиление должно было бы улучшить отношение сигнал/шум во время химической передачи информации, таким образом уменьшая недостаточность в процессах, связанных с мыслительной деятельностью, неврологической функцией и регулированием настроения.
DeNoble, et al., Pharmacol. Biochem. Behavior, (1990) 36:957; Cook, et al., Pharmacol. Biochem. Behavior, (1990) 19:301; Nickolson, et al., Pharmacol. Biochem. Behavior, (1990) 19:285; и патент US 4760083 (1988) показали на опытах in vitro, что соединение 3, 3-бис-(4-пиридинилметил)-1-фенилиндолин-2-он пригодно при лечении дисфункции мыслительной деятельности.
Патент US 5173489, выданный 22 декабря 1992 г, описывает α,α′
- дизамещенные ароматические или гетероароматические соединения формулы

или их соли;
где X и Y соединены между собой, образуя насыщенное кольцо или ненасыщенный первый карбо- или гетероцикл, а указанный углеродный атом в этом кольце соединен по меньшей мере с одним ароматическим или гетероароматическим кольцом, конденсированным с первым кольцом; один из Het1 или Het2 представляет собой 2-, 3-, или 4-пиридинил или 2-, 4-, 5- пиримидинил, а другой выбирается из ряда
(a) 2-, 3- или 4-пиридинил
(b) 2-, 4- или 5-пиримидинил
(c) 2-пиразинил
(d) 3- или 4-пиридазинил
(e) 3- или 4-пиразолил
(f) 2- или 3-тетрагидрофуранил и
(g) 3-тиенил,
которые применимы в качестве усилителей мыслительной деятельности. Все вышеприведенные источники говорят о необходимости двух дополнительных гетероарильных групп для активности.
European Patent application, WO 93/14085, опубликованный 22 июля 1993 г, описывает соединения формулы

где Q

которые пригодны как усилители секреции нейротрансмиттеров.
European Patent application, WO 93/14092, опубликованный 22 июля 1993 года, описывает соединения формулы

где Q

которые применимы в качестве усилителей секреции нейротрансмиттеров.
Ни в одном из вышеперечисленных источников не указаны и не предлагаются соединения, являющиеся предметом данного изобретения - конденсированные полициклические системы типа 6-5-5, где A - шестичленная ароматическая система; B - пятичленная гетероциклическая система и C - пятичленное кольцо между циклами A и B. Далее, показано, что некоторые соединения, являющиеся предметом данного изобретения, особенно те из них, которые имеют в качестве заместителя в полициклической системе 2-фторпиридинилметильную группу, способны вызывать заметное увеличение уровня ацетилхолина в мозгу. Продемонстрированная способность увеличивать уровень ацетилхолина, измеряемый непосредственно в мозгу, представляет четкое и неожиданное преимущество над соединениями, описанными в литературе.
Сущность изобретения
Было обнаружено, что некоторые полициклические соединения увеличивают вызванную
раздражителем секрецию нейротрансмиттеров, особенно ацетилхолина, в нервных тканях; таким образом, улучшая процессы, входящие в обучение и запоминание задачи активного избегания. Дальнейшее
доказательство этого эффекта характеризуется измеряемыми увеличениями уровня нейротрансмиттера ацетилхолина в мозгу.
Соответственно, данное изобретение относится к новым полициклическим
соединениям, представленным формулой (I)

или их фармацевтически пригодным солям,
где A - ароматическое или гетероароматическое кольцо, выбранное из группы, включающей

B - ароматическое или гетероароматическое кольцо, выбранное из группы, включающей

Z означает связь, -C(=O), -O-, -S(=O)- или -SO2-;
P означает фенил;
R2 означает -H, -I, -R4, -OR4, -OH, -COOR4, -(CH2)nC≡CR5, -(CH2)nNR6COR4 или -NR6R6a;
R3 означает -H или -OR4;
R2a означает H, C1-C4 алкил или фенил;
R4 - C1-C4 алкил;
R5, R6 и R6a каждый, независимо, означает H или C1-C6 алкил;
n равно 0 или 1;
R выбран из группы, включающей
-H,-(CH2)n,-(Het-2) или -(CH2)n, -Y;
Het-1 и Het-2, каждый, независимо, означают гетероцикл, выбранный из

где X означает H, Cl, F, Br или OR4;
n' равно 1, 2 или 4;
Y означает -OR6, -CO2R6, -CN или -CONHR6;
при условии, что когда A означает шестичленное ароматическое или гетероароматическое кольцо,
Het-1 и Het-2 оба не являются

где X означает H.
Предпочтительными являются соединения, где В означает ароматическое или гетероароматическое кольцо, выбранное из группы, включающей

Далее предпочтительными являются соединения, где R выбран из группы, включающей -H, -CH2 -(Het-2), -CH2CO2Et, -(CH2)4OCOCH3, - (CH2)4CONH2, -(CH2)4OH и -(CH2)4-CN.
Еще предпочтительными являются соединения, где
R2 означает -H, -I, -R4, -C≡CH, -OR4, -NR6R6a,
- COOR4 или -(CH2)nNR6COR6;
R3 означает водород;
R выбран из группы, включающей:
-H, -CH2
-(Het-2), -CH2CO2Et, -(CH2)4OCOCH3, - (CH2)4CONH2, -(CH2)4OH и -(CH2)4-CN.
Наиболее предпочтительными являются соединения, где A означает шестичленное ароматическое или гетероароматическое кольцо, выбранное из
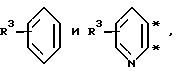
R2 означает -H, -I, -R4, -C≡CH, -OR4, -NR6R6a, -COOR4 или -(CH2)nNR6COR4;
R3 означает H;
X означает H, F, Cl, Br или OR4;
R выбран из группы, включающей -H, -CH2-(Het-2), -CH2CO2Et, -(CH2)4OCOCH3, -(CH2)4CONH2, -(CH2)4OH и -(CH2)4-CN.
Особенно предпочтительны соединения по настоящему изобретению, выбранные из группы, включающей:
4-(4-пиридинилметил)-4H-индено[1,2-b]тиофен;
4-(4-пиридинилметил)-4H-индено[1,2-b]тиофен-4-пентан-нитрил, гидробромид гидрат;
этиловый эфир 4-(4-пиридинилметил)-4H-индено[1,2-b] тиофен-4- уксусной кислоты, гидрохлорид;
4-(4-пиридинилметил)-4H-индено[1,2-b] тиофен-4-пентанамида гидрат гидрохлорида;
2-фтор-4-[4-(4-пиридинилметил)-4H-индено[1,2-b] тиофен-4-илметил] пиридин;
4-[4-(фенил)-4H-индено[1,
2-b]тиофен-4-илметил]пиридин;
4-(4-пиридинилметил)-4H-индено[1,2-b]тиофен-4-бутанол;
4-(4-пиридинилметил)-4H-тиено[2'3':3,4]циклопента[1,2-b]пиридин;
4-[(2-фтор-4-пиридинил)метил] -4-(4-пиридинилметил)-4H-тиено [3',2':4,5] циклопента[1,2-b]пиридин;
2,4-дигидро-2-фенил-4,4-бис (4-пиридинилметил)пиразоло-[4,3-b] пирролизин;
9,
9-бис[(2-фтор-4-пиридинил)метил]-2-гидрокси-9H-флуорен;
5-[(2-фтор-4-пиридинил)метил]-5-(4-пиридинилметил)-5H-индено [1,2-b]пиридин;
5- [(2-фтор-4-пиридинил)метил]
-5-(4-пиридинилметил)-5H-индено [2,1-b] пиридин;
10,10-бис [(2-фтор-4-пиридинил)метил]-9(10H)-антраценон;
9-[(2-фтор-4-пиридинил)метил]-9-(4-пиридинилметил)-9H-ксантен;
10-[(2-фтор-4-пиридинил)метил]-10-(4-пиридинилметил)-9(10)- антраценон;
9,9-бис[(2-фтор-4-пиридинил)метил]-4-азаксантен;
5,5-бис[(2-фтор-4-пиридинил)метил]-5H-индено[1,2-b]пиридин;
4,4-бис[(2-фтор-4-пиридинил)метил]-4H-тиено[3',2':4,5] циклопента[1,2-b] пиридин;
9-[(2-фтор-4-пиридинил)метил]-9-(4-пиридинилметил)-4-азаксантен;
9,
9-бис[(2-фтор-4-пиридинил)метил]-2-метоксифлуорен;
9,9-бис[(2-фтор-4-пиридинил)метил]-7-метокси-4-азаксантен;
10,10-бис[(2-фтор-4-пиридинил)метил]-3-гидрокси-9(10)антраценон;
10,10-бис[(2-фтор-4-пиридинил)метил]-2,6-диметокси-9(10H) -антраценон;
9,9-бис[(2-фтор-4-пиридинил)метил]-циклопента[1,2-b:3,4-b] дипиридин;
5,
5-бис[(2-фтор-4-пиридинил)метил]-2-фенил-5H-индено-[1,2-d] пиримидин,
10,10-бис[(2-фтор-4-пиридинил)метил]-3-метокси-9(10H)-антраценон;
9,9-бис[(2-фтор-4-пиридинил)метил]-9H-индено[2,
1-b]пиридин;
5,5-бис[(2-фтор-4-пиридинил)метил]-7-этинил-5H-индено[2,1-b] пиридин;
9,9-бис[(2-фтор-4-пиридинил)метил]-9H-индено[1,2-b]пиразин;
5,
5-бис[(2-фтор-4-пиридинил)метил]-5H-индено[1,2-d]пиримидин;
5,5-бис[(2-бром-4-пиридинил)метил]-5H-индено[1,2-b]пиридин;
9,9-бис[(2-фтор-4-пиридинил)метил]-2-[(N-метил-N-ацетиламино)
метил]флуорен;
10,10-бис[(2-бром-4-пиридинил)метил]-9(10H)-антраценон;
5,5-бис[(2-хлор-4-пиридинил)метил]-5H-индено[1,2-b]пиридин;
5,
5-бис[(2-фтор-4-пиридинил)метил]-2-метил-5H-индено[1,2-d] пиримидин;
5,5-бис[(2-метокси-4-пиридинил)метил]-5H-индено[1, 2-b]пиридин;
5,
5-бис[(2-фтор-4-пиридинил)метил]-7-(этил)-5H-индено-[1,2-b] пиридин;
5,5-бис[(2-хлор-6-метил-4-пиридинил)метил]-5H-индено[1,2-b] пиридин;
5,
5-бис[(2-метил-4-пиридинил)метил]-5H-индено[1,2-b]пиридин;
5,5-бис[(2-фтор-4-пиридинил)метил]-7-иод-5H-индено[1,2-b] пиридин;
метиловый эфир 9,
9-бис[(2-фтор-4-пиридинил)метил]-9H-флуорен-1- карбоновой кислоты;
метиловый эфир 9-[(2-фтор-4-пиридинил)метил]-9-(4-пиридинилметил)- 9H-флуорен-1-карбоновой кислоты, рацемат;
5,
5-бис[(2-фтор-4-пиридинил)метил] -5H-циклопента[2,1-b: 3,4-b'] дипиридин,
метиловый эфир 5-[(2-фтор-4-пиридинил)метил]-5-(4-пиридинилметил)- 5H-циклопента[2,1-b: 3,4-b']
дипиридин-4-карбоновой кислоты, дигидрохлорид (рацемат);
метиловый эфир 5-[(2-фтор-4-пиридинил)метил]-5-(4-пиридинилметил)- 5H-циклопента[2,1-b:3,4-b] дипиридин-4-карбоновой кислоты,
гидрохлорид, (-)-изомер;
метиловый эфир 5-[(2-фтор-4-пиридинил)метил]-5-(4-пиридинилметил)- 5H-циклопента[2,1-b: 3,4-b'] дипиридин-4-карбоновой кислоты, гидрохлорид, (+)-изомер;
5,
5-бис-[(6-фтор-3-пиридинил)метил] -5H-циклопента[2,1-b:3,4-b'] дипиридин;
5-[(6-фтор-2-пиридинил)метил]-5-(4-пиридинилметил)-5H-циклопента [2,1-b: 3,4-b'] дипиридин;
5,
5-бис-[(6-фтор-2-пиридинил)метил] -5H-циклопента[2,1-b:3,4-b'] дипиридин;
5,5-бис-[(3-метил-4-пиридинил)метил] -5H-циклопента[2,1-b: 3,4-b'] дипиридин, тригидрохлорид;
2-фтор-4-[(9-(4-пиридинилметил)-9H-флуорен-9-ил)метил] пиридин, гидрохлорид;
5-[(2-фтор-4-пиридинил)метил]-5-(4-пиридинилметил)-5H-циклопента [2,1-b: 3,4-b'] дипиридин;
5,
5-бис-[(2-фтор-4-пиридинил)метил]тиоксантен-10,10-диоксид;
5,5-бис-[(2-фтор-4-пиридинил)метил]тиоксантен-10-оксид.
Кроме того, предложен метод лечения нарушения мыслительной деятельности и/или недостаточности неврологической функции и/или депрессии и умственных расстройств у пациентов, страдающих расстройствами нервной системы, такими как болезни Альцгеймера, Паркинсона, старческое слабоумие, слабоумие при обширном инфаркте, болезнь Хантингтона, умственная неполноценность, Myasthenia gravis и так далее введением реципиентам, страдающим от этих заболеваний, терапевтически эффективных количеств соединения формулы (I). Описанные здесь соединения могут иметь асимметрические центры. Все хиральные, диастереомерные и рацемические формы также входят в настоящее изобретение. Многие геометрические изомеры олефинов, C=N двойных связей и им подобные могут также присутствовать среди описанных здесь соединений, и все устойчивые изомеры рассматриваются в настоящем изобретении.
Когда любое определение (например, от R1 к R6, m, n, P, W, Y, A, B и так далее) встречается более, чем один раз в любой группе или в формуле (I), его значение в каждом случае не зависит от его значения в любом другом случае. Кроме того, сочетание заместителей и/или определений допустимы только в сочетаниях, дающих устойчивые соединения.
Здесь и в формуле изобретения "*" означают место присоединения колец A и B, чтобы более ясно показать возможные пространственные изомеры.
Здесь и в формуле изобретения "алкил" включает как разветвленные, так и неразветвленные насыщенные алифатические углеводородные группы, имеющие указанное количество атомов углерода; "алкокси" представляет алкильную группу с указанным количеством углеродных атомов, соединенную через кислородный мостик.
Термин "замещенный" употребляется здесь и в формуле изобретения для обозначения того, что один или более атомов водорода у подходящего атома заменен на указанную группу, при условии, что нормальная валентность у подходящего атома не превышена и что в результате образуется устойчивое соединение.
Под "устойчивым соединением" или "устойчивой структурой" подразумевается здесь соединение, которое может быть выделено из реакционной смеси пригодной степени чистоты и превращено в эффективный терапевтический агент.
Как здесь, так и в формуле изобретения "фармацевтически пригодные соли" относятся к производным описанных соединений, которые модифицированы превращением в кислые или основные соли. Примеры включают, но не ограничиваются только ими, минеральные или органические кислые соли или основные группы, такие как амины; щелочные или органические соли кислых радикалов, таких как карбоновые кислоты; ацетильные, формильные и бензоильные производные спиртов и аминов и так далее.
Фармацевтически пригодные соли соединений, являющихся предметом изобретения, могут быть получены взаимодействием свободных кислых или основных форм этих соединений со стехиометрическим количеством соответствующего основания или кислоты в воде или органическом растворителе или их смеси; обычно предпочитают неводные среды, такие как эфир, этилацетат, этанол, изопропанол или ацетонитрил. Список пригодных солей находится в Remington's Pharmaceutical Sciences, 17 th ed. Mack Publishing Company, Easton, PA, (1985), p. 1418, здесь мы приводим ссылки.
Термин "терапевтически эффективный" как здесь, так и в формуле изобретения обозначает такое количество соединения формулы (I), которое способно усилить остаточную функцию пораженной системы усилением вызванной раздражителем секреции нейротрансмиттера, тем самым уменьшая недостаточность процессов, относящихся к мыслительной деятельности, неврологической функции и регулированию настроения.
"Терапевтически эффективное количество" здесь и в формуле изобретения обозначает количество, пригодное для лечения нарушения мыслительной деятельности и/или недостаточности неврологической функции и/или депрессии и умственных расстройств у пациентов, страдающих такими нарушениями нервной системы, как болезнь Альцгеймера, болезнь Паркинсона, старческое слабоумие, слабоумие при обширном инфаркте, болезнь Хантингтона, умственная отсталость, Myasthenia gravis и так далее. Кроме того, эти соединения могут быть использованы как реагенты в изучении биохимического механизма заболеваний, вызванных нейротрансмиттером.
Подробное
описание изобретения
Соединения этого изобретения могут быть описаны, как состоящие из двух частей: "ядро", представляющее трициклическую систему, образованную A и B и центральным пяти- или
шестичленным кольцом (C); и "боковые группы", которые состоят из 'CH2-Het-1' и 'R'.
Ядра (основа) могут быть синтезированы методами, описанными ниже и приведенными ссылками, которые здесь приводятся: Zaschtuvka, E, and Huisgen, R, Chem.Ber., (1960) 93:81; Mazzola, V.J., et al., J. Org.Chem., (1967) 32: 486; Rault, S. et al., Heterocycles, (1983) 20: 477; Laduree, D.and Robba, M. , Heterocycles, (1984) 22: 303; Massa, S. et al., J. Heterocyclic Chem., (1990) 27:1805; and Shen J-K, and Katayama, H.; Chem Lett., (1992) 451.
Дополнительные группы "ядра", пригодные для синтеза соединений настоящего изобретения, могут быть получены в соответствии с методами, описанными в литературных ссылках ниже или аналогично описанным методам.




< 1> Chem. Ber 1971, 104, 2975-83;
<2> J.Med. Chem 1978, 21, 623-8;
<3> Получено по аналогии с <2> с использованием азаинданона вместо инданона. Изомеры с другим положением азота также приемлемы.
<4> Farmaco, Ed.Sci 1985, 40, 979-86;
<5> Farmaco, Ed. Sci 1979, 34, 72-80;
<6> Получен по аналогии с <5> с использованием азаинданона вместо инданона. Другие азотные изомеры положения также приемлемы.
<7> Rend Accad
Sci Fis Mat, Naples 1983, 50, 353-6;
<8> Tetrahedron 1991, 47, 6851-6886
<9> Получен по аналогии с вышеприведенным с использованием азаинданона вместо
инданона. Другие изомеры положения атома азота также приемлемы; см. Heterocycles 1991, 32, 41-72.
<10> J Med Chem 1975, 18, 1-8 и Yakugaku Zasshi 1976, 96, 99-109;
<11> Получено по аналогии с <10>;
<12> J Org Chem 1986, 51, 2011-21;
<13> Heterocycles 1988, 27, 2643-50.
Восстановление антрахинонов в антроны можно проводить с применением тиосульфата натрия как описано в J. Chem Soc 1954, 274-8; J. Org. Chem 1979, 44, 632-3; или с помощью алюмогидрида лития, как
описано в J.Org.Chem 1981, 46, 1552-7:
Синтез
Соединения формулы I, где R - -CH2-(Het-2), и Het-1=Het-2, могут быть получены из соответствующего "ядра", как показано на
схеме I.

Основания, применимые для образования аниона, включают (но не ограничиваются только ими) гидроокись натрия или калия, амид натрия, диизопропиламид лития (LDA), гидрид натрия, трет-бутилат калия, алкоголят натрия, алкоголят калия, гидрид калия, 2,2,6,6- тетраметилпиперидид лития, бутиллитий, втор-бутиллитий, трет- бутиллитий, гексаметилдисилазид лития, натрия или калия. Реакцию можно проводить в апротонном растворителе, обычно в эфире, таком как (но не только) тетрагидрофуран (THF), диоксан, глим, диглим или диэтиловый эфир (Et2O); или бензин или толуол.
Кроме того, реакцию можно проводить в диметилформамиде (DMF) или диметилацетамиде (DMAC). Однако, если реагенты растворимы в неполярном растворителе, реакцию можно проводить в углеводородном растворителе, таком как гексаны, гептан, циклогексан, метилциклогексан, бензол или толуол.
Если реагенты совместимы с водой, реакцию можно проводить в системе растворителей, содержащих воду и любой из вышеупомянутых органических растворителей.
В зависимости от силы основания реакции могут проводиться при температурах от -78oC до температур кипения растворителей. Обычно соединение, такое как (II) бис-алкилируется, давая (Ia) реакцией (II) в условиях межфазного катализа (МФК). Суспензию метиленактивного соединения (II) в смеси 50% натриевой щелочи и толуола, содержащую каталитические количества катализатора МФК, такого как тетрабутиламмонийиодид или бромид обрабатывают, прибавляя по каплям, например, 4-пиколилхлорида гидрохлорид (2,2 эквивалента), получая при этом Ia.
Соединения формулы I, где R не является -CH2-(Het-2) или Het-1 = Het-2, могут быть синтезированы по уравнению, показанному на схеме II.
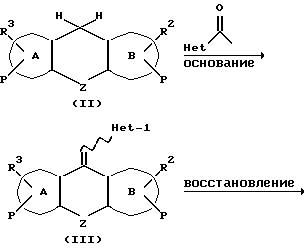

Метиловое соединение II в результате альдольной конденсации с соответствующим замещенным альдегидом пиридинового или пиримидинового ряда дает (III), который может быть восстановлен натрийборгидридом, Pd/c и муравьиной кислотой, и водородом в присутствии растворенного металла, например цинка в уксусной кислоте, давая при этом (IV). Промежуточное соединение (IV) растворяется в сухом THF, охлаждается до 0oC, обрабатывается 1,1 эквивалента гексаметилдисилазида натрия или калия и краун-эфира, перемешивается 10-60 мин в атмосфере инертного газа, к нему по каплям прибавляется раствор алкилирующего агента R-X в сухом THF, где X-уходящая группа, такая как галоген, OSO2Me или тозил. Реакционная смесь перемешивается на холоду один час, а затем при комнатной температуре до тех пор, пока не исчезнет исходное соединение (хроматография). Реакционная смесь упаривается в вакууме, а остаток экстрагируется из воды хлористым метиленом. Органический слой промывается водой и рассолом, сушится безводным сульфатом магния, фильтруется и упаривается в вакууме. В зависимости от чистоты соединения настоящего изобретения могут быть в виде масла, смолы и аморфного осадка; или перекристаллизовываются из соответствующей системы растворителей; или далее очищаются хроматографией, возгонкой или перегонкой. Соединения могут также существовать в виде "свободных оснований или в виде солей кислот, образующихся при добавлении фармацевтически пригодных кислот. Кроме того, соединения формулы (I) могут быть в виде рацематов, смеси диастереомеров или оптически активных изомеров.
Далее, соединения этого изобретения, где X не равен H, могут быть синтезированы и включены в состав соединений настоящего изобретения с использованием промежуточных соединений, представленных ниже. Эти соединения, будучи обработаны методами, описанными ранее, либо другими методами, используемыми в органическом синтезе, превращаются в соединения формулы (I).
Исходные замещенные пиридины, перечень которых представлен в табл. IA, описаны в литературе или получаются в промышленности.
Получение замещенных метилпиридинов представлено на схеме III.

Реагенты:
a) NaNO2, HX, CuX2, b) H2, Pd/c или SnCl2; c) H2O2; H2SO4; d) HNO3, H2SO4; e) CF3I, Cu, HMPT; f) 1) MCPBA, 2) KCN.
Кроме того, если получение замещенных и незамещенных галометиленпиридинов настоящего изобретения не описано в литературе, они синтезировались из исходных или промежуточных соединений по схеме IV.

Реагенты:
a) CBr4, PPh3, b) NCS или NBS; c) NaBH4; MeOH; d) 1) SOCl2, 2) MeOH; e) PCC, f) NaBH4, g) I2/DMSO; h) DIBAL-H.
Соединения формулы I, где Het-1 или Het-2 - замещенные пиримидины, получаются из замещенных пиримидинов, получаемых промышленно или описанных в литературе, таких как те, что представлены в табл. IБ.
Другие соединения формулы I могут быть получены путем превращений функциональных групп соединений, представленных в данном изобретении, с использованием стандартных методов органического синтеза. Некоторые примеры таких превращений показаны на схеме V.

Ряд других соединений настоящего изобретения может быть синтезирован аналогичным путем с использованием обычных методов органического синтеза, например, превращением R2, R3 или Y в другую функциональную группу.
Например, сложный эфир (CO2 R5) был превращен в соответствующую кислоту (CO2H); или спирт (OH) может быть далее превращен в простой эфир (OR5) или в "обратный сложный эфир" (O-COR5). В этом случае сложный эфир омылением превращается в кислоту (CO2H), которую можно восстановить до спирта. Или сложный эфир может быть непосредственно восстановлен до спирта. Другой путь превращения в "обратные сложные эфиры" (-OC(=O)R5) может быть осуществлен исходя из сложного эфира, который восстанавливается до спирта, далее ацилируется галоидангидридом или ангидридом или же спирт конденсируется с кислотой в присутствии N,N-дициклогексилкарбодиимида, диимидазолилкетона или любого другого дегидратирующего агента, известного в препаративной органической химии. Hитрил превращается в соответствующий амид методом, предложенным Hоллером, Org, Syn, Coll. Vol. 11: p 586. Тот же амид может быть получен из соответствующего сложного эфира гидролизом, активацией карбоксила и реакцией с аммиаком. Заменой аммиака на первичные и вторичные амины можно получить другие амиды данного изобретения. Восстановлением амидов получаются соответствующие амины.
Соединения данного изобретения и их синтезы далее иллюстрируются следующими примерами. Все температуры даны в градусах Цельсия.
Методика 1.

В трехгорлую круглодонную колбу на 500 мл помещают ZnCl2 (75 мл; 1,0 M в Et2O) и охлаждают до 0oC. Из капельной воронки в течение 30 мин прибавляют раствор 2-тиениллития (75 мл; 1.0 M в THF). Двухфазную систему перемешивают еще один час, затем через трубку приливают к раствору метил 2-иодобензоата (13,1 r, 0.05 мол) и тетракис(трифенилфосфин)-палладия (2,9 г, 0,0025 мол) в THF (120 мл). Реакцию оставляют перемешиваться при комнатной температуре в течение ночи. Добавляют 500 мл воды и образовавшуюся эмульсию фильтруют через целит. Органический слой отделяют, а водный - экстрагируют EtOAc (1х500 мл, 2х250 мл). Объединенные EtOAc вытяжки промывают рассолом, сушат Na2 SO4, фильтруют, снова сушат MgSO4. Полученный в результате последующего фильтрования и упаривания сырой эфир сразу омыляют KOH (5.61 г, 5.10 мол), водой (16.5 мл) и EtOH (65 мл) при кипении в течение часа. Реакционную смесь упаривают при 30oC, разбавляют водой (200 мл), промывают EtOAc(3x50 мл), Et2O и фильтруют через целит. Водный раствор подкисляют конц. HCl и экстрагируют EtOAc (3х100 мл). Органический слой промывают рассолом, сушат MgSO4, фильтруют, упаривают и перегоняют азеотропной перегонкой с бензолом. Образовавшееся коричневое масло охлаждают в течение ночи и получают кислоту (10 г) с количественным выходом. Неочищенную кислоту растворяют в бензоле (113 мл) и обрабатывают при комнатной температуре оксалилхлоридом (4,7 мл, 0, 053 мол) (катализатор DMF). После перемешивания в течение 1 часа реакционную смесь упаривают в вакууме. Остаток растворяют в бензоле (113 мл) при 4oC и добавляют 5,7 мл (0.053 мол) четыреххлористого олова. Перемешивают 15 мин (или до завершения реакции, о чем судят по ТСХ), разбавляют водой и 1N HCl до однородности и экстрагируют Et2O. Эфирные вытяжки обрабатывают обычным способом, и сырой продукт очищают на силикагеле (элюент гексан/эфир = 5: 1), давая изображенный продукт (5.8 г) с выходом 58%; температура плавления 99-100oC. Вариации этого метода включают использование 2-тиофен-триметилолова вместо 2-тиениллития и тионилхлорида вместо оксалилхлорида для образования хлорангидрида кислоты.
Методика 2

Раствор исходного кетона в методике 1 (1.28 г) греют при 160oC в диэтиленгликоле, добавляют гидразин (13,9 мл) и поднимают температуру до 200oC в течение 40 мин. После охлаждения и разбавления водой и последующей экстракции эфиром с количественным выходом было выделено коричневое твердое вещество; температура плавления 62-64oC.
Получение 2-фтор-4-хлорметилпиридина
В одногорлую круглодонную колбу на 1000 мл, снабженную магнитной мешалкой,
обратным холодильником и нагревателем, помещают 2-фтор- 4-пиколин (13.33 г, 120 мл) и CCl4 (~250 мл), N-хлорсукцинимид (23,98 г, 180 ммол, 1,5 экв) и перекись бензоила (1.5 г). Реакционную
смесь кипятят 6 ч, добавляют еще 1.5 г перекиси бензоила и греют до утра. Контроль по ТСХ (1:1 толуол/хлористый метилен). (При больших концентрациях образуется больше дихлорпродукта). Реакционная
смесь охлаждается до или ниже комнатной температуры, фильтруется через целит и осадок промывается еще CCl4. Органический раствор промывают насыщенным раствором тиосульфата натрия (Na2S2O3), насыщенным раствором NaHCO3, водой и рассолом. Сушат сульфатом магния, фильтрат упаривают, получая масло; определяют соотношение продуктов методом ЯМР.
Эта сырая смесь продуктов может быть использована для следующей стадии без дальнейшей очистки (Из двух порций было получено 32,94 г смеси продуктов, содержащей 60% желаемого продукта, 16%
дихлорзамещенного и 24% исходного соединения).
Пример 1.

4-(4-Пиридинилметил)-4H-индено[1,2-В]тиофен
Раствор метиленового соединения (методика 2) (1,87 г, 0,011 мол) приводит во взаимодействие с 4-пиридинкарбоксальдегидом (1.05 мл, 0.011 мол), KOtBu-трет (1.35 г. 0,012 мол) в THF (40 мл) 5 минут. Реакционную смесь разбавляют насыщенным раствором NH4Cl (100 мл) и экстрагируют CH2Cl2 (3х50 мл). Объединенные CH2C2 вытяжки промывают дополнительным количеством NH4Cl, сушат MgSO4. После концентрирования в вакууме сырое красное масло реагирует с цинком (11.0 г) в ACOH (50 мл) при кипении. Обычной нейтрализацией и экстракцией получают названное соединение в виде твердого вещества с 75%-ным выходом; температура плавления 91-93oC (гексан/этилацетат).
Методика 3
Общий метод алкилирования

К раствору примера 1 (1 эквив.) и 18-краун-6 (0,1 эквив.) в THF (50 мл на 2 ммол) при 0oC добавляют гексаметилдисилазид калия (1 эквив.) и перемешивают 45 мин. Добавляют электрофил (R-Br) [всегда бромид] (1 эквив.) в THF (10 мл) и оставляют на ночь при комнатной температуре. Реакционную смесь разбавляют CHCl3/NH4Clнасыщ. (50 мл каждого). Экстрагируют CHCl3, объединенные CHCl3 вытяжки промывают рассолом, сушат MgSO4, фильтруют и упаривают. Сырой остаток очищают жидкостной хроматографией на колонке с силикагелем (элюент MeOH/CHCl3), получая свободное основание. Характеристики обычно приводятся для гидрохлоридов или гидробромидов; однако, в некоторых случаях свободное основание предпочтительнее.
Пример 2

3-[4-(4-Пиридинилметил)-4H-индено[1,2-В] тиофен-4- илметил-бенонитрил гидробромид гидрат
Исходя из 3-цианобензилбромида (методика 3) данное соединение (C25H18N2S HBr H2O) получают с выходом 92%; температура плавления 246-251o (разл.)
Пример 3

4-(4-Пиридинилметил)-4H-индено[1,2-В] тиофен-4-валеронитрил гидробромид гидрат
Вышеназванное соединение получают из 5-бромвалеронитрила по методике 3 с выходом 33%; температура плавления 136oC (разл). (C22 H20N2S HBr H2O).
Пример 4

Этиловый эфир 4-(4-пиридинилметил)-4H-индено[1,2-Вb] тиофен-4-уксусной кислоты гидрохлорид
Вышеназванное соединение (C21H19N2OS HCl) получают из этилового эфира 2-бромацетоуксусной кислоты по методике 3 с выходом 75%; температура плавления 183-187oC.
Пример 5

4-(4-Пиридинилметил)-4H-индено[1,2-В]тиофен-4-бутанолацетат гидрохлорид
Вышеуказанное соединение (C23H23N2S HCl) получают из 4-бромбутилацетата по методике 3 с выходом 69%; температура плавления 186-190oC.
Пример 6.

4-(4-Пиридинилметил)-4H-индено[1,2-В] тиофен-4-пентанамид гидрохлорид гидрат
Используя метод, описанный Noller, Org. Syn, Coll, Vol. 11, p. 586, нитрил из примера 3 превращают в соответствующий амид (C22H22N2OS HCl H2O) с выходом 65%; температура плавления 187-190oC.
Пример 7

2-Фтор-4-[4-(4-пиридинилметил)-4H-индено[1,2-В]тиофенилметил]-пиридин
Вышеназванное соединение получают из 2-фтор-4-пиколилхлорида по методике 3. Выход C23H17FN2S 57%; температура плавления 117-119oC.
Пример 8

4 [4-(фенил)-4H-индено[1,2-В]тиофен-4-илметил]-пиридин
Путем использования бензилбромида по методике 3 получают вышеназванное соединение (C24H19NS) с выходом 20%; температура плавления 88-92oC.
Пример 9
4-(4-Пиридинилметил)-4H-индено[1,2-В]тиофен-4-бутанол
Вышеуказанное соединение получают щелочным гидролизом продукта из примера 5 в виде масла с количественным выходом; C21H21NOS, М.в. 335,45 масс-спектр 336 (М+1).
Методика 4
Для получения данного соединения была применена методика, аналогичная методике 1, но вместо метил-2-иодбензоата взят метил- 2-бромникотинат.
Пример 10
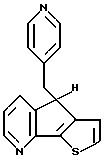
4-(4-Пиридинилметил)-4H-тиено[2',3':3,4] циклопента[1,2-В] пиридин
Введением продукта из методики 4 в методики 2 и 3 получают вышеназванное соединение (C16H12N2S) с выходом 45%; температура плавления 178-181oC.
Пример 11

4-[(2-Фтор-4-пиридинил)метил] -4-(4-пиридинилметил)-4H-тиено [3',2':4,5] циклопента[1,2-b]пиридин
Взяв за исходное продукт из примера 10 и используя 2-фтор-4-пиколилхлорид по методике 3 получают вышеназванное соединение (C22H16FN3S) с выходом 92%; температура плавления 192-193oC.
Пример 12

Данное монопиколильное производное может быть получено способом, описанным для примера 1, исходя из 9H-пирроло[1,2a] индола, который синтезирован по методу, предложенному Mazzola, V.J.,et al.; J.Org.Chem, (1967) 32: 486.
Пример 13

9-(4-Пиридинилметил)9-((2-фтор-4-пиридинилметил)-9H- пирроло[1,2-A]индол
Вышеназванное соединение получено по методике, примененной для примера 11, из примера 12, взятого в качестве исходного.
Пример 14

1,4-Дигидро-1-(фенилметил)-4,4-бис(4-пиридинилметил) индено[1,2-C] пиразол
К смеси KOBu-трет. (1,44 г, 12,8 ммол) в 20 мл DMSO/Et2O (1:1) при перемешивании в атмосфере сухого азота и 10oC прибавляют по каплям раствор N-бензилпиразоиндена (6,1 ммол) в 10 мл DMSO. Затем к смеси прибавляют по каплям в течение 30 мин раствор 4-пиколилхлорида (свободное основание) (14,6 ммол) в 30 мл Et2O. Смесь перемешивают при комнатной температуре 16 ч и выливают в 100 мл воды. Экстрагируют 100 мл Et2O. Экстракт промывают водой и рассолом, сушат MgSO4, фильтруют и упаривают в вакууме, получают 1,8 г продукта в виде пены. Пену хроматографируют на силикагеле (CH2Cl2 - элюент). Соответствующие фракции объединяют и упаривают в вакууме. Остаток перекристаллизовывают из смеси EtOAc/гексан. Получают вышеуказанное соединение с выходом 74%; температура плавления 154-155oC; Вычислено для C29H24N4 в %: C 81.28; H 5.65; N 13.08. Найдено в %: C 80.73: H 5.77: N 12.82. Масс-спектр m/e 429(М+1).
Пример 15

2, 4-Дигидро-2-фенил-4,4-бис(4-пиридинилметил)-пиразоло[4,3-В] пирролизин
К раствору 2,4-дигидро-2-фенилпиразоло[4,3-b] пирролизина (6.1 ммол) и 18-краун-6 (6.1 ммол) в тетрагидрофурана при 0o добавляют гексаметилдисилазид калия, затем 4-пиколилхлорид (14.6 ммол, свободное основание в толуоле) и реакцию оставляют на ночь при комнатной температуре. Обычной экстракцией и очисткой получают вышеуказанное соединение в виде твердого вещества с выходом 4%; температура плавления 169-170oC; Анализ: вычислено для C26H21N5 в %; C 77.40; H 5.25; N 17.36. Найдено в %: C 77.01; H 5.12; N 17,18. Масс-спектр m/e 404 (М+1).
В табл. 1 приведены вещества, полученные методами, проиллюстрированными вышеприведенными примерами.
Используя методы, проиллюстрированные вышеприведенными примерами, получают следующие соединения.
Пример 61

9,9-Бис((2-фтор-4-пиридинил)метил)-2-гидрокси-9H-флуорен
Температура плавления 200-201oC. Масс-спектр (NH3/Cl) m/e 401(М+H);
Анализ: Вычислено для C25H18F2N2O•0.25H2O, в %: C 74.15; H 4.61; N 6,92; F 9.38. Найдено в %: C 73.91; H 5.10; N 6, 39; F 8.94.
Выход 49%.
Пример 62

5-(2-фтор-4-пиридинил)метил)-5-(4-пиридинилметил)-5H-индено [1.2-b] пиридин
Температура плавления 164-5oC. Масс-спектр (NH3/Cl) m/e 368(М+H);
Анализ: Вычислено для C24H18FN•0.25H2O в %: C 77.50; H 5.01; N 11,30. Найдено в %: C 77.63; H 4.85; N 11,20.
Выход 22%.
Пример 63.

5-(2-Фтор-4-пиридинил)метил)-5-(4-пиридинилметил)-5H- индено[2.1-b] пиридин
Температура плавления 163-4oC. Масс-спектр (NH3/Cl) m/e 368(М+H);
Анализ: Вычислено для C24H18FN3 в %: C 78.44; H 4.94; N 11,11
Найдено в %: C 78.10; H 4.78; N 11,36.
Выход 22%.
Пример 64

10, 10-Бис((2-фтор-4-пиридинил)метил)-9(10H)-антраценон
Температура плавления 156-157oC. Масс-спектр (NH3/Cl) m/e 413 (М+H);
Анализ: Вычислено для C26 H18F2N2O •0.25H2O в %: C 75.72; H 4.40; N 6,70; F 9.21. Найдено в %: C 75.54; H 4.38; N 6,76; F 9.27%.
Выход 44%.
Пример 65

9-((2-Фтор-4-пиридинил)метил)-9-(4-пиридинилметил)-9H-ксантен
Температура плавления 180-1oC. Масс-спектр (NH3-Cl) m/e 383(М+H);
Анализ: Вычислено для C25H19FN2O •0.25H2O в %: C 77.60; H 5.08; N 7,24. Найдено в %: C 77.94; H 4.97; N 7,25.
Выход 3%.
Пример 66

9-((2-Фтор-4-пиридинил)метил-9-(4-пиридинилметил)-9H-ксантен
Температура плавления 199-201oC. Масс-спектр (NH3-Cl) m/e 395(М+H);
Анализ: Вычислено для C26H19FN2O в %: C 79.17; H 4.86; N 7,10. Найдено в %: c 78.84; H 4.80; N 7,13.
Выход 12%.
Пример 67

9,9-Бис((2-фтор-4-пиридинилметил)-4-азаксантен
Температура плавления 185-189oC. Масс-спектр (NH3 -Cl) m/e 402(М+H);
Анализ: Вычислено для C24H17N3F2O в %: C 71.81; H 4.27; N 10,47. Найдено в %: C 71.50; H 4.25; N 10,28.
Выход 10%.
Пример 68
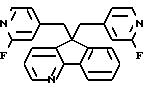
5, 5-Бис((2-фтор-4-пиридинил)метил)-5H-индено[1,2-b]пиридин
Температура плавления 137-140oC. Масс-спектр (Cl/NH3) m/e 386(М+H);
Анализ: Вычислено для C24H17N3F2 в %: C 74.79; H 4.45; N 10,90; F 9.86. Найдено в %: C 74.39; H 4.51; N 10,91; F 9.91.
Выход 46%.
Пример 69

4,4-Бис((2-фтор-4-пиридинил)метил)-4H-тиено[3',2':4,5]циклопента [1,2-b] пиридин.
Температура плавления 157-9oC. Масс-спектр
(Cl/NH3) m/e 392(М+H);
Анализ: Вычислено для C22H15F2N3S в %: C 67.50; H 10.73; S 8,19. Найдено в %: C 67.11; H 3.88; N 10,69; S
8.34.
Выход 55%.
Пример 70.

9-((2-Фтор-4-пиридинил)метил)-9-(4-пиридинилметил)-4-азаксантен
Температура плавления 206-208oC. Масс-спектр (NH3-Cl) m/e 384(М+H);
Анализ: Вычислено для C24H18FN3O•0,25H2O в %: C 74.31; H 4.81; N 10,83. Найдено в %: C 74.17; H 4.69; N 10,67%.
Выход 12%.
Пример 71

9,9-Бис((2-фтор-4-пиридинил)метил)-2-метаксифлуорен
Температура плавления 143-146oC. Масс-спектр (NH3-Cl) m/e 415(М+H);
Анализ: Вычислено для C26H20F2N2O в %: C 75.35; H 4.86; N 6,76. Найдено в %: C 75.33; H 4.78; N 6, 67.
Выход 54%.
Пример 72

9, 9-Бис((2-фтор-4-пиридинил)метил-7-метокси-4-азаксантен
Температура плавления 196-197oC. Масс-спектр (NH3-Cl) m/e 432(М+H);
Анализ: Вычислено для C25 H19F2N3O2 в %: C 69.60; H 4.44; N 9,74. Найдено: C 69.55; H 4.37; N 9,74.
Выход 8%.
Пример 73

10,10-Бис((2-фтор-4-пиридинил)метил)-3-окси-9(10H)-антраценон
Температура плавления 219-221oC. Масс-спектр (NH3-Cl) m/e 429(М+H);
Анализ: Вычислено для C26H18F2N2O2 в %: C 72.89; H 4.23; N 6,54. Найдено в %: C 72.97; H 4.19; N 6,48.
Выход 26%.
Пример 74

10, 10-Бис((2-фтор-4-пиридинил)метил)-2,6-диметокси-9(10H)-антраценон
Температура плавления 151-2oC. Масс-спектр (Cl/NH3) m/e 473(М+H);
Анализ: Вычислено для C28H22F2N2O2 в %: C 71.17; H 4.69; N 5,93; F 8.04. Найдено в %: C 70.76; H 4.86; N 5,90; F 7.91.
Выход 12%.
Пример
75

9,9-Бис((2-фтор-4-пиридинил)метил)-циклопента[1.2-b:3,4-b']дипиридин
Температура плавления 134-5oC. Масс-спектр (Cl/NH3) m/e 387(М+H);
Анализ: Вычислено для C23H16F2N4 в %: C 71.49; H 4.17; N 14,50; F 9.83. Найдено в %: C 71.08; H 4.00; N 14,29; F 9.96.
Выход 27%.
Пример 76

5,5-Бис((2-фтор-4-пиридинил)метил)-2-фенил-5H-индено[1,2-d]пиримидин
Температура плавления 213-5oC. Масс-спектр (Cl/NH3) m/e 463(М+H);
Анализ: Вычислено для C29H20F2N4 в %: C 75.31; H 4.36; N 12,11; F 8.22. Найдено в %: C 74.98; H 4.31; N 12,01; F 8.36.
Выход 30%.
Пример 77

10,10-Бис((2-фтор-4-пиридинил)метил)-3-метокси-9-(10H)-антраценон
Температура плавления 155-7oC. Масс-спектр (Cl/NH3) m/e 443(М+H);
Анализ: Вычислено для C27H20F2N2O2 в %: C 73.29; H 4.56; N 6,33; F 8.59%. Найдено в %: C 72.90; H 4.54; N 6,24; F 8.55%.
Выход 27%.
Пример 78

9,9-Бис((2-фтор-4-пиридинил)метил)-9H-индено-[2,1-b]пиридин
Температура плавления 128-130oC. Масс-спектр (Cl/NH3) m/e 386(М+H);
Анализ: Вычислено для C24H17F2N3 в %: C 74.79; H 4.45; N 10,90; F 9.86. Найдено в %: C 74.50; H 4.24; N 10,75; F 9.87.
Выход 35%.
Пример 79

5,5-Бис((2-фтор-4-пиридинил)метил)-7-(этинил)-5H-индено- [2, 2-b]пиридин
Температура плавления 139-40oC. Масс-спектр (Cl/NH3) m/e 410(М+H);
Анализ: Вычислено для C26H17F2N3 в %: C 76.27; H 4.19; N 10,26; F 9.28. Найдено в %: C 75.95; H 4.14; N 10,09; F 9.18.
Выход 43%.
Пример 80
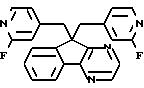
9,9-Бис((2-Фтор-4-пиридинил)метил)-9H-индено-[1,2-b]пиразин
Температура плавления 119-20oC. Масс-спектр (Cl/NH3 ) m/e 387(М+H);
Анализ: Вычислено для C23H16F2N2 в %: C 71.49; H 4.17; N 14,50; F 9.83. Найдено в %: C 71.28; H 4.12; N 14,47; F 9.73.
Выход 68%.
Пример 81

5, 5-Бис((2-фтор-4-пиридинил)метил)-5H-индено-[1,2-d]пиримидин
Температура плавления 171-4oC. Масс-спектр (Cl/NH3) m/e 387(М+H);
Анализ: Вычислено для C23H16F2N4 в %: C 71.49; H 4.17; N 14,50; F 9.83. Найдено в %: C 71.30; H 4.09; N 14,40; F 9.96.
Выход 64%.
Пример 82

5,5-Бис((2-бром-4-пиридинил)метил)-5H-индено-[1,2-b]пиридин
Температура плавления 190oC. Масс-спектр (Cl/NH3) m/e 508(М+H);
Анализ: Вычислено для C24H17Br2N3 в %: C 56.83; H 3.38; N 8,28; Br 31.51. Найдено в %: C 57.20; H 3.43; N 8,20; Br 31.12%.
Выход 63%.
Пример 83

9, 9-Бис((2-фтор-4-пиридинил)метил-2-((N-метиламино)метил)флуорен
Температура плавления 130-4oC. Масс-спектр (Cl/NH3) m/e 428(М+H);
Выход 92%.
Пример 84

9, 9-Бис((2-фтор-4-пиридинил)метил)-2-((N-метил-N- метоксикарбониламино)метил)флуорен
Масло. Масс-спектр (Cl/NH3) m/e 486 (М+H);
Анализ: Вычислено для C29H25F2N3O2 •0.5H2O в %: C 70.43; H 5.30; N 8,50. Найдено в %: C 70.65; H 5.08; N 8,53.
Выход 85%.
Пример 85

9,9-Бис((2-фтор-4-пиридинил)метил)-2-((N-метил-N-ацетиламино) метил)флуорен
Температура плавления 136-7oC. Масс-спектр (Cl/NH3) m/e 470(М+H);
Анализ: Вычислено для C29H25F2N3O •0,25H2O в %: C 73.48; H 5.42; N 8,86. Найдено в %: C 73.30; H 5.34; N 8,67.
Выход 79%.
Пример 86

10.10-Бис(2-бром-4-пиридинил)метил)-9(10H)-антраценон
Температура плавления 182-3oC. Масс-спектр (Cl/NH3) m/e 535(М+H);
Анализ: Вычислено для C26H18Br2N2O в %: C 58.45; H 3.40; N 5,24; Br 29.91. Найдено: C 58.69; H 3.26; N 5,22; Br 29.68.
Выход 54%.
Пример 87

5,5-Бис((2-хлор-4-пиридинил)метил)-5H-индено-[1,2-b]пиридин
Температура плавления 188-90oC. Масс-спектр (Cl/NH3) m/e 418(М+H);
Анализ: Вычислено для C24H17Cl2N3 в %: C 68.91; H 4.10; N 10,04; Cl 16.95. Найдено в %: C 68.70; H 3.99; N 9,95; Cl 16.76.
Выход 48%.
Пример 88

5,5-Бис((2-фтор-4-пиридинил)метил)-2-метил-5H-индено-[1, 2- d] пиримидин
Температура плавления 114-5oC. Масс-спектр (Cl/NH3) m/e 401(М+H);
Анализ: Вычислено для C24H18F2N4 в %: C 71.99; H 4.53; N 13,99; F 9.49. Найдено в %: C 71.88; H 4.52; N 13; F 9.87.
Выход 31%.
Пример 89

5,5-Бис((2-метокси-4-пиридинил)метил)-5H-индено-[1, 2-b]пиридин
Температура плавления 138-40oC. Масс-спектр (Cl/NH3) m/e 410(М+H);
Анализ: Вычислено для C26H23N3O2 в %: C 76.26; H 5.66; N 10,26. Найдено в %: C 75.84; H 5.54; N 10,14.
Выход 50%.
Пример 90

5,5-Бис((2-фтор-4-пиридинил)метил)-7-(этил)-5H-индено [1,2-b]пиридин
Масло. Масс-спектр (Cl/NH3) m/e 414(М+H);
Анализ: Вычислено для C26H21F2N3 в %: C 75.53; H 5.12; N 10,16. Найдено в %: C 75; H 5.36; N 9,95%.
Выход 90%.
Пример 91.

5,5-Бис((2-хлор-6-метил-4-пиридинил)метил)-5H-индено[1,2-b]пиридин
Температура плавления 159-60oC. Масс-спектр (Cl/NH3) m/e 446(М+H);
Анализ: Вычислено для C26H21Cl2N3 в %: C 69.96; H 4.68; N 9,41, Cl 15.88. Найдено в %: C 70,00; H 4.74; N 9,31, Cl 15.82.
Выход 14%.
Пример 92

5,5-Бис((2-метил-4-пиридинил)метил)-5H-индено[1,2-b]пиридин
Температура плавления 177-9oC. Масс-спектр (Cl/NH3) m/e 378(М+H);
Анализ: Вычислено для C26H23N3 в %: C 82.73; H 6,14; N 11,13 Найдено в %: C 82,54; H 6.12; N 11,10.
Выход 90%.
Пример 93

5,5-Бис((2-фтор-4-пиридинил)метил)-7-(иод)-5H-индено[1,2-b]пиридин
Температура плавления 158-61oC. Масс-спектр (Cl/NH3) m/e 512(М+H);
Анализ: Вычислено для C24H16F2IN3 в %: C 56.38; H 3.15; F 7.43; N 8,22. Найдено в %: C 56,83; H 3.17; F 7.58; N 8,1%
Выход 25%.
Пример 94

9, 9-Бис((2-фтор-4-пиридинил)метил)-9H-флуорен-1-карбоновой кислоты метиловый эфир.
Температура плавления 126-127oC. Масс-спектр (NH3/Cl) m/e 443(М+H);
Анализ: Вычислено для C27H20F2N2O2 в %: C 73.29; H 4.56; N 6,33; F 8,59. Найдено в %: C 72.99; H 4.56; N 6,24; F 8,59.
Выход 49%.
Пример 95

9-((2-Фтор-4-пиридинил)метил)-9-(4-пиридинилметил)-9H-флуорен- 1-карбоновой кислоты метиловый эфир, рацемат
Температура плавления 144-6oC. Масс-спектр (NH3/Cl) m/e 425(М+H);
Анализ: Вычислено для C27H21FN2O2 •0,25H2O в %: C 75.60; H 5.05; N 6,53; F 4.43. Найдено в %: C 75,69; H 4.85; N 6,42; F 4.26.
Выход 55%.
Пример 96

9, 9-Бис((2-фтор-4-пиридинил)метил)-9H-флуорен-1-амин
Температура плавления 182-4oC. Масс-спектр (NH3/Cl) m/e 400(М+H);
Анализ: Вычислено для C25H19F2N3 •0.25H2O в %: C 74.34; H 4.87; N 10,40; F 9,41. Найдено в %: C 74,43; H 4.68; N 10,39; F 9.39.
Выход 25%.
Пример
97

5,5-Бис((2-фтор-4-пиридинил)метил)-5H-циклопента[1,2-b:3.4-b'] дипиридин
Температура плавления 239-241oC. Масс-спектр (NH3/Cl) m/e 387(М+H);
Анализ: Вычислено для C23H16F2N4• 0,25H2 O в %: C 70.67; H 4.25; N 14,33; F 9.72. Найдено в %: C 70,95; H 4.05; N 14,24; F 9.37.
Выход 44%.
Пример 98

5-((2-Фтор-4-пиридинил)метил)-5-(4-пиридинилметил)-5H-циклопента [2,1-b: 3.4-b']дипиридин-4-карбоновой кислоты метиловый эфир дигидрохлорид (рацемат)
Температура плавления 181-9oC. Масс-спектр (NH3-Cl) m/e 427(М+H);
Анализ: Вычислено для C25H19FN4O2 •2HCl•H2O в %: C 58.04; H 4.48; N 10,83; Cl 13.70. Найдено в %: C 58,45; H 4.30; N 10,76; Cl 13,73.
Выход 79%.
Пример 99

5-((2-Фтор-4-пиридинил)метил)-5-(4-пиридинилметил)-5H- циклопента[2,1-b: 3.4-b'] дипиридин-4-карбоновой кислоты метиловый эфир гидрохлорид, (-)-изомер
Температура плавления - гигроскопичное. [α] = -14.95o (C=0.6, CHCl3). Масс-спектр (NH3-Cl) m/e 427(М+H);
Анализ: Вычислено для C25H19FN4O2 • HCl•0,5H2O в %: C 63.43; H 4.49; N 11,87; Cl 7,51. Найдено в %: C 63,47; H 4.06; N 11,73; Cl 7,26.
Выход 73%.
Пример 100

5-((2-Фтор-4-пиридинил)метил)-5-(4-пиридинилметил)-5H-циклопента [2,1-b: 3.4-b'] дипиридин-4-карбоновой кислоты метиловый эфир, гидрохлорид. (+)-изомер
Температура плавления - гигроскопическое. [α]
Анализ: Вычислено для C25H19FN4O2 •HCl•0,5H2O в %: C 63.63; H 4.49; N 11,87; Cl 7.51. Найдено в %: C 63.60; H 4.03; N 11,80; Cl 7.01.
Выход 90%.
Пример 101

5-((2-Фтор-4-пиридинил)метил)-5-(4-пиридинилметил)-5H-циклопента [2.1-b: 3.4-b'] дипиридин-4-карбоновой кислоты метиловый эфир, гидрохлорид. (+)-изомер
Температура плавления 237-238oC. Масс-спектр (NH3-Cl) m/e 387(М+H);
Анализ: Вычислено для C23H16N4F2 •0,25H2O в %: C 70.67; H 4.25; N 14,33; F 9.72. Найдено в %: C 70,81; H 4.08; N 14,26; F 9.70.
Выход 88%.
Пример
102

5-((6-Фтор-2-пиридинил)метил)-5-(4-пиридинилметил)-5H- циклопента[2,1-b: 3.4-b']дипиридин
Температура плавления 180-182oC. Масс-спектр (NH3-Cl] m/e 369(М+H);
Анализ: Вычислено для C23H17N3F• 0, 25H2O в %: C 74.08; H 4.73; N 15,02; F 5.09. Найдено в %: C 73,94; H 4.53; N 14,93; F 4.84.
Выход 81%.
Пример 103

5,5-Бис((6-фтор-2-пиридинил)метил)-5H-циклопента[2,1-b:3.4-b] дипиридин
Температура плавления 221-225oC. Масс-спектр (NH3-Cl) m/e 387(М+H);
Анализ: Вычислено для C23H16N4F2 •0,33H2O в %: C 70.40; H 4.28; N 14,28; F 9.68. Найдено в %: C 70,71; H 4.04; N 14,30; F 9.53.
Выход 81%.
Пример 104

5,5-Бис((3-метил-4-пиридинил)метил)-5H-циклопента[2,1-b: 3.4-b'] дипиридин, тригидрохлорид
Температура плавления 301oC(разл.). Масс-спектр (NH3-Cl) m/e 379(М+H);
Анализ: Вычислено для C25H22N4•3HCl •2H2O в %: C 57.32; H 5.58; N 10,69; Cl 20.30. Найдено в %: C 57,68; H 5.41; N 9,96; Cl 20.76.
Выход 71%.
Пример 105
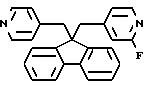
2-Фтор-4-((9-пиридинилметил)-9H-флуорен-9-ил)метил)пиридин, гидрохлорид
Температура плавления > 220oC. Масс-спектр (Cl/NH3) m/e 386(М+H);
Анализ: Вычислено для C25H21N2F•1,2HCl •0,5H2O в %: C 71.63; H 5.10; N 6,68; F 4.53; Cl 10.15. Найдено в %: C 71,40; H 4.86; N 6,54; F 4.14; Cl 10.55.
Выход 13%.
Пример 106

5-((2-Фтор-4-пиридинил)метил)-5-(4-пиридинилметил)-5H-циклопента [2,1-b: 3.4-b']дипиридин
Температура плавления 228-230oC. Масс-спектр (Cl/NH3) m/e 369(М+H);
Анализ: Вычислено для C23H17FN4• 0,25H2O в %: C 74.08; H 4.73; N 15,02. Найдено в %: C 74,25; H 4.53; N 15,11%.
Выход 69%.
Пример 107

5,5-Бис(2-фторпиридин-4-илметил)тиоксантен-10,10-диоксид
Смесь тиоксантен-10,10-диоксида (1,00 г, 4.3 ммол), 4- хлорметил-2-фторпиридина (1.45 г, 9.6 ммол), бензолтриэтиламмонийхлорида (90 мг, 0.4 ммол) и 50%-ного раствора NaOH (2.5 мл) в толуоле (60 мл) перемешивают при 50-60oC (температура в реакционной колбе) 18 ч. После охлаждения до комнатной температуры реакционную смесь выливают в воду (100 мл) и трижды экстрагируют этилацетатом. Объединенные органические вытяжки сушат над MgSO4, фильтруют и упаривают в вакууме. Хроматографией на колонке (эфир:гексан=1:1) получают вышеназванный продукт (0.68 г, Rf 0.2): температура плавления > 200oC.
1H ЯМР (300 МГц, CDCl3): 8,3 (d, 2H, J=7), 7.9 (d, 2H, J=7), 7.6 (t, 2H, J= 7), 7.45 (t, 2H, J=7), 6.45-6.35 (m,
2H), 6.2 (s,2H), 3.8 (s,4H); Cl - масс-спектр высокого разрешения: Вычислено для C25H18F2N2O2S: 449,1135 (М+H): Найдено: 449.1150
Пример
108

5,5-Бис- (2-фторпиридин-4-илметил) тиоксантен-10-оксид
Смесь тиоксантен-10-оксида (1.00 г, 4.7 ммол), 4-хлорметил-2-фторпиридина (1.73 г, 10.3 ммол),
бензилтриэтиламмонийхлорида (90 мг, 0.4 ммол) и 50%-ного раствора NaOH (2.5 мол) в 60 мл толуола перемешивают при 50-60oC (температура внутри колбы) 18 ч. По охлаждении до комнатной температуры реакционную смесь выливают в воду (100 мл) и экстрагируют этилацетатом. Объединенные органические вытяжки сушат над MgSO4, фильтруют и упаривают в вакууме. Хроматографией на колонке (эфир: гексан III) с последующей препаративной ТСХ получают вышеназванный продукт (с примесью 5,5-бис-(2-фторпиридин-4-илметил)-тиоксантен-10,10-диоксида).
(0.12 г, Rf 0.1): температура плавления > 200oC.1H ЯМР (300 МГц, CDCl3): 8,3 (d, 1H, J=7), 8.2 (d, 2H, J=7), 7.9 (d, 1H, J=7), 7.85 (d, 2H, J=7), 7.6 (t, 2H, J=7), 7.5 (t, 1H, J=7), 7.45 (t, 1H, J=7), 7.35 (t, 2H, J= 7), 7.25 (d, 1H, J=7), 7.15 (d, 2H, J=7), 6.45-6.35 (m, 2H), 6.2 (s,2H), 3.9 (s,2H); 3.8 (s, 2H), 3,15 (s, 2H), Cl - мacc-спектрометрия: 433(M+H).
Пример 109
2,6-Диметил-4-((9-(4-пиридинилметил)-9H-флуорен-9-ил)метил) пиридин, дигидрохлорид
Температура плавления 180oC. Масс-спектр (Cl/NH3) m/e 372(М+H для свободного основания);
1H ЯМР (300 МГц, CDCl3): 8,05 (d, 2H), 7.45 (d, 2H), 7.38 (d, 2H), 7.30 (т, 4H), 6.45 (d, 2H), 6,20 (s,2H), 3.40 (s,2H); 3.25 (s, 2H), 2.20 (s, 6H).
Выход 91% (для свободного основания).
Пример 110

5-((2,6-Диметил-4-пиридинил)метил)-5-(4-пиридинилметил) -5H-циклопента[2,1-b:3.4-b']дипиридин
Температура плавления >240oC. Масс-спектр (Cl/NH3) m/e 378(М+H);
Анализ: Вычислено для C25H22N4• 0,25H2O в %: C 78.40; H 5.92; N 14,63. Найдено в %: C 78,05; H 5.58; N 14,32.
Выход 73%.
Пример 111

5,5-Бис((2, 6-диметил-4-пиридинил)метил)-5H-циклопента[2,1-b: 3.4-b'] дипиридин, E-2-фумарат
Температура плавления 98-101oC(разл). Масс-спектр (NH3-Cl) m/e 407(М+H);
Анализ: Вычислено для C27H26N4C4 H4O4•1,2H2O в %: C 67.74; H 6.05; N 10,19. Найдено в %: C 67,64; H 6.48; N 8,71.
Выход 50%.
Пример 112

5, 5-Бис((2-фтор-4-пиридинил)метил)-5H-индено[1,2-с]пиридазин
Температура плавления 219-20oC(разл). Масс-спектр (Cl/NH3) m/e 387(М+H), 278 (M+H-C6H4 NF); 169 (M+H)-2(C6H4NF);
Анализ: Вычислено для C23H16F2N4 в %: C 71.49; H 4.17; N 14,50; F 9.83. Найдено в %: C 71,21; H 4.13; N 14,45; F 9.80.
Выход 22%.
Хотя в данном изобретении описаны весьма специфические соединения, это не означает, что части, элементы этих соединений должны быть неизменными. Различные эквиваленты, изменения, модификации могут быть сделаны специалистом в этой области без нарушения существа этого изобретения, и понятно, что такие равноценные соединения также являются частью этого изобретения.
Соединения формулы (I) активизируют секрецию нейротрансмиттеров и эффективны в случаях нарушения памяти. Именно поэтому соединения этого изобретения находят применение при лечении нарушения мыслительной деятельности и/или недостаточности неврологической функции и/или при депрессии и умственных отклонениях у пациентов, страдающих нервными расстройствами, такими как болезнь Альцгеймера, болезнь Паркинсона, старческое слабоумие, слабоумие при обширном инфаркте, болезни Хантингтона, умственной отсталости, Myasthenia Gravis и так далее.
Активность соединений этого изобретения в отношении секреции нейротрансмиттеров определяли, используя стандартные методики биохимического анализа, например, анализ нейротрансмиттерной секреции, как описано ниже. Способность соединений настоящего изобретения эффективно уменьшать нарушения памяти продемонстрировано стандартными поведенческими тестами, например моделью пассивной профилактики (PA), вызванной гипоксией амнезии у крыс, как описано ниже.
Анализ нейротрансмиттерной секреции
Эффективность соединений этого изобретения по отношению к секции
нейротрансмиттера (ACh) определяли методом, описанным Nickolson, et al. Drug Development Research, (1990)19; 285-300, являющимся модификацией метода, описанного Mulder, et al. Brain Res., (1974)
70:372.
Использовались мужские особи крыс Wistar (Charies River) весом 175-200 г. Крысы обезглавливаются и мозг вскрывается немедленно. Готовятся срезы (0,3 мм толщиной) теменной доли коры головного мозга (сырой вес примерно 100 мг) и помещаются в 10 мл питательной среды Krebs Ringer (KR), содержащей NaCl (116 мМ), KCl (3 мМ), CaCl2 (1-3 мМ), MgCl2 (1.2 мМ), KH2PO4 (1-2 мМ), Na2SO4 (1-2 мМ), NaHCO3 (25.0 мМ) и глюкозу (11.0 мМ), к которой добавляют 10 uCi 3H-холина (специфическая активность примерно 35 Ci/мМ; NEN), 10 мл немеченого холина, так что конечная концентрация составляет 1 микромоль. Препараты головного мозга термостатируют 30 мин при 37o при постоянном токе 95% O2 /5%CO2. В этих условиях часть радиоактивного холина, поглощенная препаратом, превращается в радиоактивный ацетилхолин (ACh) холинэргическими нервными окончаниями, содержащимися в синаптических пузырьках, и выделяется при деполяризации под действием питательной среды, содержащей высокую концентрацию иона калия (K+).
После того, как ACh помечен, образцы промывают трижды нерадиоактивной средой KR и переносят в аппарат для непрерывного промывания для измерения влияния лекарства на ACh секрецию. Аппарат для непрерывного промывания состоит из 10 термостатированных стеклянных колонок диаметром 5 мм, снабженных gF/F фильтрами из стеклянного волокна для удерживания образца (примерно 10 мг ткани на колонку).
Промывание проводят в KR-среде (0.3 мл/мин), содержащей 10 мМ гемихолина-3 (HC-3). HC-3 предотвращает повторное поглощение холина, образующегося во время промывания из фосфолипидов и выделяющегося ACh, который превращается в немеченый. ACh и выделяется преимущественно по сравнению с ранее образовавшимся меченым ACh. Питательная среда подается с помощью 25-канального пульсационного насоса (Бринкмана фирмы Исматек) и нагревается до 37oC в термостатированном змеевике из нержавеющей стали перед подачей в промывную колонку. Каждая колонка снабжена 4-х ходовым клапаном (приборы Бекманна), который позволяет быстро менять от низкой до высокой K+/KR-среду, и двумя 10-канальными 3-х ходовыми клапанами для изменения от не содержащей до содержащей лекарства низкой и высокой K+/KR-среды. После 15-минутного промывания не специфически связанной радиоактивности, начинают собирать 4 мин фракции. После трех 4-минутных фракций первоначальная питательная среда меняется на kR- среду, в которой концентрация KCl увеличена до 25 мМ (высокая K+среда) (S1I). Вызванная деполяризацией стимуляция выделения с помощью высокой K+/KR-среды длится 4 мин. Свободные от лекарств низко- и высококонцентрированные K+/KR-среды заменяются содержащими лекарства и наполнители низко- и высококонцентрированными K+/KR-средами, и промывание продолжается тремя 4-х минутными порциями низкоконцентрированной K+/KR-среды, одной 4-х минутной порцией высококонцентрированной K+/KR-среды (S2), и двумя 4-х минутными порциями низкоконцентрированной K+/KR-среды.
Лекарства вводятся в среду после 100-кратного разбавления применяемых концентраций лекарства (в 0,9% физиологическом растворе) низко- или высококонцентрированными K+/KR-средами. Для равнения пропускается также линопирдин.
Все промывные фракции собираются в пузырьках со счетчиками сцинтилляций. После промывания срезы удаляются из промывных колонок и экстрагируются 1.0 мл 0.1 N HCl. К промывным фракциям и экстрактам добавляют 12 мл жидкого счетчика сцинтилляций (NEN), и образцы считаются на жидкостном сцинтилляционном счетчике Packard Tricarb. На разбавление поправка не делается.
Отношение S2/S1 (сравнение с контрольными образцами, где нет лекарств во время S2) является мерой способности лекарства увеличивать или уменьшать вызванную раздражителем секрецию ацетилхолина.
Для отдельных соединений этого изобретения был проведен анализ нейротрансмиттерной секреции и выявлена их эффективность при вызываемой лекарствами секреции нейротрансмиттеров. Результаты, выраженные в %, вызванной лекарствами ACh-секреции, показаны на табл. II.
Пассивная профилактика (ПП) амнезии у крыс, вызванной гипоксией.
Неголодные мужские особи СД крыс весом 165-210 г тренируют на ПП аппарате следующим образом: крыс помещают на светлой стороне камеры, состоящей из двух отсеков, и дают 90 с, чтобы войти в темный отсек. Через 10 с после того, как крыса входит в темную половину, в течение 3 с подается импульс (1.0 мА) на решетку пола, затем через 10 с - еще один 3-х секундный импульс. Ретенция проверяется через 4 ч. Крысам дают 300 с на то, чтобы они вошли в темный отсек; время замечается. Нарушение памяти вызывается смесью кислорода (6,5%) и азота, действию которой подвергают крыс в течение 30 мин прежде, чем проводить ПП испытания. Дозы испытываемого соединения назначаются (0.1 мл/100 г; SC) в соответствии со временем ПП испытания.
Отдельные соединения этого изобретения были испытаны на модели пассивного привыкания (ПП) крыс при амнезии, вызванной гипоксией, и оказались эффективными для снижения нарушения памяти, вызванного гипоксией (в отличие от наполнителя, при Манн-Уитни и тесте). Результаты, среднее время сохранения скрытого состояния показаны на табл. II и III.
Методика
микродиализа
Мужские особи крыс Wistar усыпляют, и направляющие канюли стереотаксически имплантируют в мозг на уровне дорсального гиппокампа. После минимального восстановительного периода 72
ч, зонды для диализа (0,5 мм диаметр, 4.0 мм длина, из BAS) вводятся в гиппокамп через направляющие канюли. Зонды промываются со скоростью 2 мкл/мин искусственной спинномозговой жидкостью, содержащей
100 мкм физостигминсульфата (ингибитор холинэстеразы). Крысам дают привыкнуть 2 ч прежде, чем начинают собирать образцы. Образцы диализата собирают каждые 20 мин (40 мкл) и немедленно вводят в
высокопроизводительный жидкостной хроматограф, приспособленный для электрохимического обнаружения (HPLC-EC) ацетилхолина (ACh). После сбора 3 порций исходной жидкости вводятся лекарства или
наполнители из расчета 0.01 мл/г веса тела, и образцы диализата собираются еще 3 ч. Высота пиков ACh из 3-х образцов до введения лекарств усредняется для определения начального уровня ACh. Высоту
ACh- пиков после введения лекарств измеряют и определяют (в процентах) изменение уровня ACh по сравнению с начальным, в конце эксперимента место введения зонда проверяют гистологически.
HPLC-EC анализ ацетилхолина
ACh выделяется хроматографией на обратной фазе (Hamilton PRP-1 колонка 150х4.5 мм) и превращается в ацетат, бетаин и перекись водорода в колонке с
неподвижным энзимом в качестве реактора (BAS). Перекись водорода затем определяется электрохимически. Подвижная фаза для хроматографии состоит из 0.2 М Na2HPO4, 0.1 мМ EDTA, 0.5
мМ SOS, 0.9 мМ TMA•Cl, pH доводится до 8.0 фосфорной кислотой и 50 мл Kathon CG (ESA), добавляемых в 1 литр подвижной фазы для замедления развития бактерий.
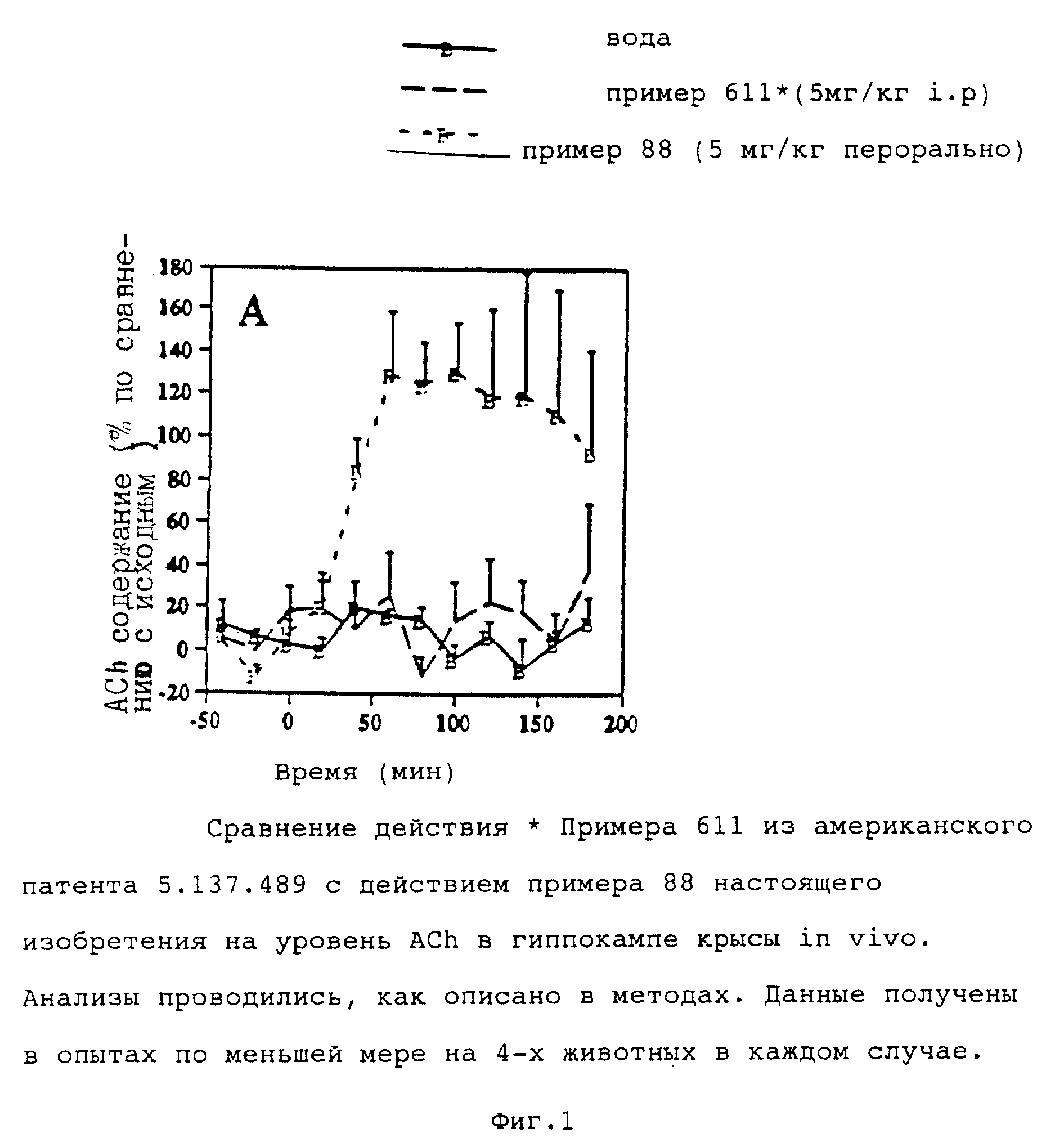
Результаты.
Фиг. 1, 2 (A и B) показывают влияние наличия фтора в парных заместителях в ряду антрона и азафлуорена на способность соединения повышать уровень ACh в гиппокампе крыс in vivo. Испытуемые соединения вводились в количестве 5 мг/кг, за исключением примера N 64, который вводился в количестве 1 мг/кг. Соединения вводились перорально, за исключением примера N 611 в US патенте 5137489, который вводился i.p.
Пример N 611 в американском патенте 5137489 не влияет на уровень ACh по сравнению с наполнителем (A). Это наблюдалось даже в том случае, когда соединение вводилось таким путем (i.p.), который обеспечивает большую биодоступность, чем оральный путь. Пример 68 настоящего изобретения, дифторированный аналог примера 611 из американского патента 5137489, с другой стороны, ведет к двукратному увеличению ACh-уровня, который сохраняется более 1 ч (A). Производное антрона пример N 440 из американского патента 5137489 при дозе 5 мг/кг приводит к максимальному содержанию ACh, превышающему исходный на 72% (B). Пример N 64 настоящего изобретения дифторный аналог примера N 440 в американском патенте 5137489, при дозе 1 мг/кг, приводит к замедленному увеличению уровня ACh, причем максимальный уровень более чем на 100% превышает начальный (B).
По контрасту с наблюдаемым эффектом от примера 400 (американский патент 5137489) увеличение уровня ACh после введения по примеру 64 настоящего изобретения сохранялось в течение всего времени испытания (3 ч). Все данные микродиализа показаны на табл. IV.
Площадь % под кривой (из графической фиг. 7) максимум - максимальный % усиления-секреции ACh по сравнению с исходным @ минут после введения.
Длительность минуты секреции выше.
Нет определенных точек.
Соединения этого изобретения могут также быть использованы как реагенты или стандарты при биохимическом исследовании неврологической функции, дисфункции и заболевания.
Дозировка и способ применения
Соединения этого изобретения могут применяться для лечения нарушения мыслительной деятельности и/или недостаточности
неврологической функции и/или депрессий и умственных расстройств любым способом, при котором возникает контакт активного агента с подвергающейся его действию частью тела млекопитающего или пациента.
Соединения могут быть введены любым удобным способом, пригодным для применения в сочетании с фармацевтическим или индивидуальным терапевтическим средством или с сочетанием терапевтических средств. Они
могут вводиться одни, но обычно назначаются в виде фармацевтической композиции, состоящей из соединения и фармацевтического носителя, выбираемого в зависимости от способа введения и на основании
обычной фармацевтической практики.
Дозировка меняется в зависимости от применения и известных факторов, таких как фармакодинамический характер отдельных агентов и их способ и путь введения; возраст реципиента, вес и здоровье; природа и сила симптомов; вид сопутствующего лечения; частота лечения; желаемый эффект. Для применения при лечении вышеназванных заболеваний или состояний соединения этого изобретения могут назначаться перорально ежедневно в количестве активного ингредиента 0.001-100 мг/кг веса тела. Обычно доза 0.01-10 мг/кг/день, поделенная на 1-4 приема в день, или в виде форм пролонгированного действия является эффективной для достижения желаемого фармакологического действия. Формы выпуска (фармацевтические композиции), удобные для введения, содержат ~1-100 мг активного ингредиента на единицу. В этих фармацевтических композициях активный ингредиент обычно составляет по весу от 0,5 до 95% от веса композиции.
Активный ингредиент может назначаться перорально в виде твердых форм, таких как капсулы, таблетки и порошки; или в виде жидких форм, таких как эликсиры, сиропы и/или суспензии. Соединения этого изобретения могут также вводиться парентерально в стерильных жидких формах.
Для хранения активного ингредиента могут использоваться желатиновые капсулы, а в качестве носителей могут быть использованы лактоза, крахмал, стеарат магния, стеариновая кислота или производные целлюлозы и так далее. Подобные разбавители могут быть использованы для таблетирования. Как таблетки, так и капсулы могут производится в виде форм пролонгированного действия, что обеспечивает продолжительное медикаментозное лечение. Таблетки могут быть покрыты сахаром или пленкой, чтобы замаскировать неприятный вкус или защитить активные ингредиенты от атмосферного воздействия или обеспечить селективное расщепление таблетки в желудочно-кишечном тракте.
Жидкие формы для орального введения могут содержать красители и корригенты для лучшего восприятия пациентом.
В целом вода, фрмацевтически пригодные масла, физиологический раствор, водный раствор декстрозы (глюкозы) и аналогичных cахаров, гликоли, такие как пропиленгликоль или полиэтиленгликоль, удобны в качестве носителей в парентеральных растворах. Растворы для парентерального введения преимущественно содержат водный раствор соли активного ингредиента, подходящие стабилизирующие агенты и, если необходимо, масла. Антиокислители, такие как бисульфит натрия, сульфит натрия или аскорбиновая кислота отдельно или в комбинациях являются хорошими стабилизирующими агентами. Также применяется лимонная кислота и ее соли и EDTA. Кроме того, парентеральные растворы могут содержать консерванты, такие как бензалконийхлорид, метил- или пропилпарабен или хлорбутанол.
Применяемые фармацевтические носители описаны в "Remington's Pharmaceutical Sciences"., A.Osol.(и ссылки в ней).
Удобные фармацевтические формы выпуска соединений этого изобретения могут быть проиллюстрированы следующими примерами.
Капсулы
Большое количество единичных капсул готовится
наполнением стандартных состоящих из двух частей желатиновых капсул, каждой - по 100 мг порошкообразного активного ингредиента, 150 мг галактозы, 50 мг целлюлозы и 6 мг стеарата магния.
Мягкие желатиновые капсулы.
Готовят смесь активных ингредиентов в усвояемом масле, таком как соевое, хлопковое или оливковое, и методом точного замещения под давлением впрыскивают в желатин, получая мягкие желатиновые капсулы, содержащие 100 мг активного ингредиента. Капсулы моют и сушат.
Таблетки
Большое количество таблеток готовят удобным
методом, так что единичная доза составляет 100 мг активного ингредиента, 0,2 мг коллоидной двуокиси кремния, 5 мг стеарата магния, 275 мг микрокристаллической целлюлозы, 11 мг крахмала и 98.8 мг
лактозы. Можно покрыть таблетку соответствующей оболочкой для улучшения вкуса или уменьшения абсорбции.
Инъекции
Парентеральные композиции, удобные для инъекций, готовятся
растворением 1.5% по весу активного ингредиента в растворе, содержащем 10% по объему пропиленгликоля в воде. Раствор стерилизуется обычно принятым способом.
Суспензии
Водные
суспензии готовятся для орального введения, так что 5 мл содержат 25 мг мелкораздробленного активного ингредиента, 200 мг натрийкарбоксиметилцеллюлозы, 5 мг бензоата натрия, 1.0 граствора сорбита,
U.S.P, и 0,025 мл ванилина.
Капли в нос
Водный раствор готовится так, что в 1 мл содержится 10 мг активного ингредиента, 1.8 мг метилпарабена, 0.2 мг пропилпарабена и 10 мг
метилцеллюлозы. Раствор разливают в миллилитровые флаконы.
Ингалятор
Гомогенная смесь активного ингредиента в полисорбате 80 готовится так, что конечная концентрация
активного ингредиента составляет 10 мг на емкость и конечная концентрация полисорбата 80 в емкости составляет 1% по весу. Смесь разливается по контейнерам, на контейнерах укрепляются клапаны и под
давлением добавляется дихлортетрафторэтан.
Предшествующая информация является необходимой, для того чтобы применять на практике заявляемые соединения. Поскольку цитируемые заявки могут содержать дополнительную полезную информацию, эти цитируемые материалы представлены в ссылках.
Реферат
Описываются новые полициклические соединения формулы I или их фармацевтически пригодные соли, где А - ароматическое или гетероароматическое кольцо, выбранное из группы, включающей а, b, с, В - ароматическое или гетероароматическое кольцо, выбранное из группы, включающей группу d, Z означает связь, -С(=O), -О-, -S(=O) - или -SO2, Р означает фенил, R2 означает - Н , -l, -R4, -OR4, - ОН, - COOR4- -(СН2),-(CH2)nC≡CR5, - (CH2)nNR6COR4 или -NR6R6a, R3 означает - Н или - OR4, R2a означает Н, C1-С4-алкил или фенил, R4 - C1-С4-алкил, R5, R6 и R6a каждый независимо означает Н или C1-С4-алкил, n = 0 или 1, R выбран из группы, включающей - Н, -(СH2)n -(Het-2) или (СН2)n - Y, Het -1 и Het-2 каждый независимо означают гетероцикл, выбранный из е, где Х означает Н, Cl, F, Вr или OR4, n равно 1, 2 или 4, Y означает -OR6 -CO2R6, -CN или CONHR6, при условии, что когда А означает шестичленное ароматическое или гетероароматическое кольцо, Het-1 и Het-2 оба не являются f, где Х означает Н. Соединения формулы I усиливают секрецию нейротрансмиттера ацетилхолина и поэтому могут быть пригодны при лечении болезней человека, при которых наблюдается пониженное его содержание, таких как болезнь Альцгеймера и других состояний, включающих обучение и мыслительную деятельность. Описывается также их производные, фармацевтические препараты на основе соединений (I) и метод лечения нарушения мыслительной деятельности. 8 с. и 5 з.п. ф-лы, 2 ил., 4 табл.



Формула

или их фармацевтически пригодные соли,
где A - ароматическое или гетероароматическое кольцо, выбранное из группы, включающей



B - ароматическое или гетероароматическое кольцо, выбранное из группы, включающей




Z - означает связь, -C(=O), -O-, -S(=O)- или -SO2;
P означает фенил;
R2 означает -H, -I, -R4, -OR4, -OH, -COOR4, -(CH2)nC≡CR5, -(CH2)nNR6COR4 или -NR6R6a;
R3 означает -H или -OR4;
R2a означает H, C1-C4-алкил или фенил;
R4-C1-C4 -алкил;
R5, R6 и R6a каждый независимо означают H или C1-C6-алкил;
n равно 0 или 1;
R выбран из группы, включающей -H, -(CH2)n′-(Het-2) или -(CH2)n′-Y
Het-1 и Het-2 каждый независимо, означают гетероцикл, выбранный из

или

где X означает H, Cl, F, Br или OR4;
n' равно 1,2 или 4;
Y означает -OR6, -CO2R6, -CN или -CONHR6;
при условии, что когда A означает шестичленное ароматическое или гетероароматическое кольцо, Het-1 и Het-2 оба не являются

где X означает H.



3. Соединение по п.2, отличающееся тем, что R выбран из группы, включающей -H, -CH2-(Het-2), -CH2CO2Et, -(CH2)4OCOCH3, -(CH2)4CONH2, -(CH2)4OH и -(CH2)4 -CN.

R2 означает -H, -I, -R4, -C≡CH,, -OR4, -NR6R6a, -COOR4 или -(CH2)n NR6COR4; R3 означает H; X означает H, F, Cl, Br или OR4; R выбран из группы, включающей -H, -CH2-(Het-2), -CH2CO2Et, -(CH2)4OCOCH3, -(CH2)4CONH2,
-(CH2)4OH и -(CH2)4-CN.
4-(4-пиридинилметил)-4H-индено[1,2-b]тиофен;
4-(4-пиридинилметил)-4H-индено[1,2-b] тиофен-4-пентаннитрил, гидробромид гидрат;
этиловый эфир 4-(4-пиридинилметил)-4H-индено[1,2-b] тиофен-4-уксусной кислоты, гидрохлорид;
4-(4-пиридинилметил)-4H-индено[1,2-b] тиофен-4-пентанамида гидрат гидрохлорида;
2-фтор-4-[4-(4-пиридинилметил)-4H-индено[1,2-b]тиофен-4-илметил]пиридин;
4-[4-фенил)-4H-индено[1,2-b]тиофен-4-илметил]придин;
4-(4-пиридинилметил)-4H-индено[1,2-b]тиофен-4-бутанол;
4-(4-пиридинилметил)-4H-[2'3':3,4]циклопента[1,2-b]пиридин;
4-[(2-фтор-4-пиридинил)метил] -4-(4-пиридинилметил)-4H-тиено[3', 2':4,5] циклопента[1,2-b]пиридин;
2, 4-дигидро-2-фенил-4,4-бис(4-пиридинилметил)пиразоло-[4,3-b]пирролизин;
9,9-бис-[(2-фтор-4-пиридинил)метил]-2-гидрокси-9H-флуорен;
5-[(2-фтор-4-пиридинил)метил]-5-(4-пиридинилметил)-5H-индено[1,2-b]пиридин;
5-[(2-фтор-4-пиридинил)метил]-5-(4-пиридинилметил)-5H-индено[1,2-b]пиридин;
10, 10-бис-[(2-фтор-4-пиридинил)метил]-9(10H)-антраценон;
9-[(2-фтор-4-пиридинил)метил]-9-(4-пиридинилметил)-9H-ксантен;
10-[(2-фтор-4-пиридинил)метил]-10-(4-пиридинилметил)-9(10)-антраценон;
9,9-бис[(2-фтор-4-пиридинил)метил]-4-азаксантен;
5,5-бис[(2-фтор-4-пиридинил)метил]-5H-индено[1,2-b]пиридин;
4,4-бис[(2-фтор-4-пиридинил)метил] -4H-тиено[3',2':4,5]циклопента[1,2-b] пиридин;
9-[(2-фтор-4-пиридинил)метил]-9-(4-пиридинилметил)-4-азаксантен;
9, 9-бис[(2-фтор-4-пиридинил)метил]-2-метоксифлуорен;
9,9-бис[(2-фтор-4-пиридинил)метил]-7-метокси-4-азаксантен;
10,10-бис[(2-фтор-4-пиридинил)метил]-3-гидрокси-9(10)антраценон;
10,10-бис[(2-фтор-4-пиридинил)метил]-2,6-диметокси-9(10H)-антраценон;
9,9-бис[(2-фтор-4-пиридинил)метил]циклопента [1,2-b : 3,4-b']дипиридин;
5, 5-бис[(2-фтор-4-пиридинил)метил]-2-фенил-5H-индено[1,2-d]пиримидин,
10,10-бис[(2-фтор-4-пиридинил)метил]-3-метокси-9(10H)-антраценон;
9,9-бис[(2-фтор-4-пиридинил)метил]-9H-индено[2, 1-b]пиридин;
5,5-бис[(2-фтор-4-пиридинил)метил]-7-этинил-5H-индено[2,1-b]пиридин;
9,9-бис[(2-фтор-4-пиридинил)метил]-9H-индено[1,2-b]пиразин;
5, 5-бис[(2-фтор-4-пиридинил)метил]-5H-индено[1,2-d]пиримидин,
5,5-бис[(2-бром-4-пиридинил)метил]-5H-индено[1,2-b]пиридин;
9,9-бис[(2-фтор-4-пиридинил)метил] -2-[(N-метил-N-ацетиламино) метил] флуорен;
10,10-бис[(2-бром-4-пиридинил)метил]-9-(10H)-антраценон;
5,5-бис[(2-хлор-4-пиридинил)метил]-5H-индено[1,2-b]пиридин;
5, 5-бис[(2-фтор-4-пиридинил)метил]-2-метил-5H-индено[1,2-d]пиримидин,
5,5-бис[(2-метокси-4-пиридинил)метил]-5H-индено[1,2-b]пиридин;
5, 5-бис[(2-фтор-4-пиридинил)метил]-7-(этил)-5H-индено[1,2-b]пиридин;
5,5-бис[(2-хлор-6-метил-4-пиридинил)метил]-5H-индено[1,2-b]пиридин;
5,5-бис[(2-метил-4-пиридинил)метил]-5H-индено[1, 2-b]пиридин;
5,5-бис[(2-фтор-4-пиридинил)метил]-7-иод-5H-индено[1,2-b]пиридин;
метиловый эфир 9,9-бис[(2-фтор-4-пиридинил)метил] -9H-флуорен-1-карбоновой кислоты;
метиловый эфир 9-[(2-фтор-4-пиридинил)метил] -9-(4-пиридинилметил)9H-флуорен-1-карбоновой кислоты, рацемат;
5,5-бис[(2-фтор-4-пиридинил)метил] -5H-циклопента[1,2-b : 3,4-b']дипиридин,
метиловый эфир 5-[(2-фтор-4-пиридинил)метил]-5-(4-пиридинилметил)-5H-циклопента[2,1-b : 3,4-b'] дипиридин-4-карбоновой кислоты, дигидрохлорид (рацемат),
метиловый эфир 5-[(2-фтор-4-пиридинил)метил]-5-(4-пиридинилметил)-5H-циклопента[2,1-b : 3,4-b]дипиридин-4-карбоновой кислоты, гидрохлорид, (-)-изомер;
метиловый эфир 5-[(2-фтор-4-пиридинил)метил]-5-(4-пиридинилметил)-5H-циклопента[2,1-b : 3,4-b'] дипиридин-4-карбоновой кислоты, гидрохлорид, (+)-изомер;
5,5-бис[(6-фтор-3-пиридинил)метил] -5H-циклопента[2, 1-b : 3,4-b']дипиридин;
5-[(6-фтор-2-пиридинил)метил]-5-(4-пиридинилметил)-5H-циклопента[2,1-b : 3,4-b']дипиридин,
5,5-бис[(6-фтор-2-пиридинил)метил] -5H-циклопента[2,1-b : 3, 4-b']дипиридин;
5,5-бис[(3-метил-4-пиридинил)метил]-5H-циклопента[2,1-b : 3,4-b']дипиридин, тригидрохлорид;
2-фтор-4-[(9-(4-пиридинилметил)-9H-флуорен-9-ил)метил] -пиридин, гидрохлорид;
5-[(2-фтор-4-пиридинил)метил]-5-(4-пиридинилметил)-5H-циклопента[2,1-b : 3,4-b']дипиридин;
5,5-бис[(2-фтор-4-пиридинил)метил]тиоксантен-10,10-диоксид;
5, 5-бис[(2-фтор-4-пиридинил)метил]тиоксантен-10-оксид.
08.04.1993: A - ароматическое или гетероароматическое кольцо, выбранное из группы, включающей:


Z означает связь, Het-1 означает 4-пиридинилметил, P означает фенил, R2 означает -H, -R4, -OR4, -OH или -COOR4, R3 означает -H или -OR4, R4 означает -C1-C4-алкил, R выбран из группы, включающей -H, -(CH2)n′-Y, 2-фтор-4-пиридинилметил или 2-, 3- или 4-пиридинилметил, Y означает -OR6, -COOR6, -CN или -CONHR6, n' равно 1,2 или 4;
28.03.1994 B - ароматическое кольцо формулы

Z - означает -C = O; R2 означает -I или -C≡CH; R обозначает -(CH2 )-(Het-2), Het-1 и Het-2 независимо выбраны из 2-, 3- или 4-пиридинилметила, замещенные X, где X означает Cl, F или Br, за исключением 2-фтор-4-пиридинилметила; остальные признаки имеют приоритет по дате подачи данной заявки 04.04.1994.

Комментарии