(S)-α-фенил-2-пиридинэтанамин и его соль с неорганическими кислотами, способ их получения, лекарственный препарат на их основе и способ лечения судорог - RU2128650C1
Код документа: RU2128650C1
Описание
Настоящее изобретение описывает энантиомер известного соединения и его использование в качестве лекарственного средства, в частности, для лечения нейродегенеративных расстройств, а также способ его получения и лекарственные составы, его содержащие.
В настоящее время для лечения нейродегенеративных расстройств применяются лекарства, не обладающие линейными фармакокинетическими свойствами: при введении пациенту определенной дозы лекарства трудно предсказать соответствующую дозе концентрацию лекарства в его крови. Высказывалось мнение, что идеальным лекарством в этой области будет средство, для которого будет соблюдаться линейное соотношение дозы и концентрации в плазме крови пациента, т. е. изменение дозы будет приводить к предсказуемому изменению концентрации лекарства в крови пациента ("Pharmacokinetics of old, new and yet-to-be discovered antiepileptic drugs", R.H. Levy and B.M. Kerr, Epilepsia, vol. 30, Supp 1, S35-S41, 1989).
В европейской патентной заявке 356035
описано значительное количество веществ, применимых для лечения нейродегенеративных расстройств, в том числе и α фенил-2 пиридинэтанамин (в настоящем документе мы будем называть его
1-фенил-2-(2-пиридинил) этиламин), соответствующий формуле

Это вещество не обладает линейной фармакокинетикой, а его (S)-энантиомер, как ни странно, проявляет линейные фармакокинетические свойства
Итак, предметом настоящего изобретения является (S) -α- фенил-2-пиридинэтанамин, соответствующий формуле
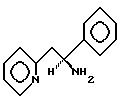
практически без примеси (R)-энантиомера, и его производные, приемлемые к фармацевтическому применению (далее мы будем называть их "соединения/вещества, предложенные настоящим изобретением").
Выражение "практически без примеси (R)-энантиомера" означает, что в порции (S)-энантиомера содержится не более 10% по весу (R)-энантиомера, т.е. чистота (S)-энантиомера превышает 90%; в предпочтительном случае в смеси содержится не более 1% по весу (R)-энантиомера, а в наиболее предпочтительном случае (S)-энантиомер является чистым.
К производным, приемлемым для фармацевтического применения, относятся соединения - биологические предшественники (пролекарства) (S) -α- фенил-2-пиридинэтанамина, а также - они представляют особый интерес - соли от соединения с кислотами.
К приемлемым биологическим предшественникам (+) -α- фенил-2-пиридинэтанамина относятся амидные производные аминогруппы от связи с аминокислотами, в частности, α -аминокислотами, например глицином. Их можно получать стандартными способами, например, амидные производные аминокислот можно готовить способами, описанными в "Advanced Organic Chemistry" by J.March, 2 издание, опубликованное McGraw-Hill p 1171 (Органическая химия для специалистов". Дж. Марч).
Соли от соединения (S) -α- фенил-2-пиридинэтанамина с кислотами включают соли неорганических кислот (например, дигидрохлорид и дигидробромид) и соли, образованные с органическими кислотами: формат, ацетат, малат, бензоат и фумарат.
α- Фенил-2-пиридинэтанамин может быть получен одним из стандартных способов (например, путем добавления аниона 2-пиколина к N-триметилсилил-бензальдимину). В этом случае (S) -α- фенил-2-пиридинэтанамин можно получить в результате одной или нескольких реакций α- фенил-2-пиридинэтанамина с хиральной кислотой, при которой выпадает в осадок диастереомерная соль, и одной или нескольких рекристаллизаций.
Таким образом, настоящее изобретение предлагает также способ получения соединения, предложенного настоящим изобретением, который предусматривает селективную преципитацию диастереомерной соли, образованной в результате реакции между α- фенил-2-пиридинэтанамином и хиральной кислотой. В связи с этим стоит упомянуть хиральные кислоты: D-или L-винную, и особенно S(+) и R(-) миндальную. Преципитацию можно провести в органическом растворителе, который серьезно не повлияет на ход реакции (например, в этилацетате), при температуре, близкой к комнатной.
Соединения, предложенные настоящим изобретением, имеют лекарственное назначение, в частности, пригодны для использования в качестве антиконвульсантов и нейропротектантов при лечении нейродегенеративных расстройств. В числе этих расстройств инсульт, церебральная ишемия, церебральный паралич, последствия гипогликемии, эпилепсия, вызванное СПИДом слабоумие, болезнь Альцгеймера, хорея Хантингтона, оливопонтоцеребеллярная атрофия, перинатальная асфиксия, болезнь Паркинсона, гипоксия, повреждения нейронов, связанные со злоупотреблением различными веществами (например, наркотиками или кокаином), ретинопатия, шизофрения, ишемические состояния после остановки сердца или хирургических операций, интоксикации, повреждения спинного мозга, боковой амиотрофический склероз.
Одно из предположений о природе нейродегенеративных расстройств гласит, что дегенерацию нервной ткани вызывает или ускоряет деятельность аминокислот возбуждения, присутствующих обычно в центральной нервной системе (ЦНС). Медиатором быстрого возбуждения в мозгу млекопитающих считается глутамат - эндогенная аминокислота. Глутамат известен также как сильный нейротоксин, способный уничтожать нейроны ЦНС при условиях, связанных с инсультом и остановкой сердца. Выяснилось, что чувствительность центральных нейронов к гипоксии и ишемии можно снизить при помощи антагонистического действия по отношению к постсинаптическим глутаматным рецепторам. Глутамат является агонистом широкого спектра и действует на четыре нейронных рецептора возбуждения. Эти рецепторы названы по аналогии с аминокислотами, возбуждающими их: каинатные (KA), N-метил-D-аспарагинатные (NMDA), кискалатные (QUIS) и 2-амин-4-фосфонобутиратные (APB). Глутамат считается смешанным агонистом, способным связываться с рецепторами всех четырех типов и возбуждать их. Таким образом, средства, блокирующие действие глутамата на эти рецепторы или проявляющие антагонизм по отношению к нему, способны предотвратить токсическое поражение нервной системы, связанное с гипоксией или ишемией. В частности, средства, связывающиеся с площадками рецепторов NMDA и блокирующие действие глутамата на эти рецепторы, полезны для лечения и предупреждения нейродегенеративных заболеваний.
Фармакологическую активность соединений, предложенных настоящим изобретением, можно оценить по результатам опытов, описанных ниже.
a) Блокирующее действие по отношению к NMDA оценивается по способности снимать у мышей судороги, вызванные внутривенным введением 150 мг/кг NMDA в соответствии с процедурой Czuczwar'a et al. (Neurotransmitters, Seizures and Epilesy III, edited by G. Nistico et al. Raven Press, New York, 1986, pages 235-246 - "Нейромедиаторы, судороги и эпилепсия"). Мышам интраперитонеально вводят испытываемое вещество, а через 30 минут дают NMDA. Действие NMDA проявляется в утрате животными рефлекса направления тонических/клонических судорогах. За проявлением этих признаков наблюдают в течение 60 минут после введения NMDA, затем подсчитывают смертность.
b) Антагонистическое действие по отношению к NMDA-рецепторам можно оценивать in vitro путем измерения активности испытываемого вещества при ингибировании связывания антагониста рецепторов, 10, 11-дигирдо-5-метил-5H-дибензо[a, b] -циклогептен-5,10-имина (МК801), с рецепторами. Постановка опыта описана у Foster and Wong, Br.J.Pharmacol 91, 403-409 (1987).
c) Аффинность с NMDA-и глициновыми рецепторами можно оценить в опытах по связыванию [3H]L-глутамата и [3H]-глицина, поставленных по способу Monaghan and Cotman, PNAS, 83, 7532 (1986) и Watson et al., Neurosci. Res. Comm, 2, 169, (1988).
d) Антигипоксическое действие удобно проверять на мышах. Группы мышей исследуют через различные промежутки времени после интраперитонеального введения возрастающих доз испытываемого вещества. Записывают время жизни животных в гипоксической среде (96% азота и 4% кислорода) с регулируемой температурой. Проводят статическое сравнение между экспериментальной и контрольной (вводят только носитель) группами. Записывают реакцию на дозу и минимальную эффективную дозу испытываемого вещества (A. A.Artu and J.D. Michenfelder, Anaesthesia and Analgesia, 1981, 60, 867). Можно вводить испытываемые вещества и другими способами.
e) Антиэпилептическое действие оценивается по способности испытываемого вещества предупреждать тоническое разгибание задних конечностей, вызванное у мышей и крыс максимальным электрошоком, при пероральном, интраперитонеальном, внутривенном или подкожном введении. Процедура разработана отделением эпилепсии NINCDS (R.J.Porter et al. Cleve. Clin. Quarterly 1984, 51, 293). Проводят сравнение с действием известных препаратов дилантина и фенобарбитала.
f) Инсульт с закупоркой четырех сосудов вызывает у крыс глобальную ишемию и представляет собой основной способ оценки эффективности испытываемых соединений по предупреждению поражения уязвимых участков мозга, обычно пирамидальных CA1-нейронов или гипокампа. Эти участки отвечают за кратковременную память, как у лабораторных животных, так и у человека. В первый день крысам прижигают под анастезией вертебральные артерии, а каротиды изолируют. На второй день каротиды зажимают на различные промежутки времени. Для уничтожения нейронов CA1 достаточно 10 минут. Зажимы снимают, кровоток восстанавливается, и испытываемое вещество вводят через различные промежутки времени после восстановления кровотока. В период ишемии и выздоровления температуры тела поддерживают на уровне 37oC. Нейроны CA1 обычно погибают в течение 48-72 часов, поэтому крысы получают лечение на протяжении хотя бы трех дней (интраперитонеально, внутривенно или перорально), а на 7-й день у них извлекают мозг для гистологического анализа. Определение состояния нейронов CA1 производится двумя способами: считают жизнеспособные нейроны и определяют степень тяжести патологии (W.A. Pulsinelli and A.Buchan, "The NMDA receptor/ion channel: lts importance to in vivo ischemia injury to selectively vulnerable neurons", Pharmacology of Cerebral lschemia, edited by J. Krieglstein and H. Oberpichler, published by Wissenschaftliche Verlagsgesellschaft, Stuttgart, 1990, p. 169).
g) Фокальный инсульт. При этом используются крысы со спонтанной гипертензией, так как у них слабое коллатеральное мозговое кровообращение. У них вызывают 2- часовую фокальную ишемию мозга путем пережимания средней мозговой артерии и каротиды, расположенной на той же стороне (под анестезией). Лекарство вводят (обычно интраперитонеально) до или через различные промежутки времени после пережимания артерий, либо после восстановления кровотока в течение 2 часов. Через 24 часа после опыта мозг удаляют, замораживают и разрезают на части. Эффективность лекарства по сокращению объема инфаркта коры головного мозга подсчитывают при помощи специально оборудованного компьютера (A.M.Buchan, D.Xue and A.Slivka, Stroke, 1992, 23, 273.).
Токсичность веществ, предложенных настоящим изобретением, определяется следующими способами:
a) Опыты по
дозировке на основе описанных у N.W.Spurling and P.F.Carey, "A protocol for dose selection in repeat dose toxicity studies", poster presentation 974 at the Society of Toxicology annual meeting,
Seattle, USA, 23 - 27 February 1992 (стенд 974 на ежегодном заседании Общества токсикологов с Сиэтле, США, 23-27, февраля 1992). Крысам вводят ежедневно внутривенно возрастающие дозы испытываемых
веществ, пока не находят максимальную повторяемую дозу, при превышении которой конвульсии и другие отклонения от нормы неприемлемы.
b) Опыты с поворотной площадкой (L.L.Cougenour, J.R.McLean, and R.B. Parker, Pharmacol Biochem Behav, 1977, 6, 351). Мышам вводят испытываемое вещество и через 30 минут сажают их на небольшую сетчатую платформу, которую поворачивают на угол 180o. Мышам, которые за 30 секунд не выберутся, засчитывают поражение. При достаточном числе доз и животных EД50 (доза, дающая 50% поражений) определяется легко.
c) Тест на 28 поведенческих признаков по S.Iwin [Psychopharmacology 1968, 13, 222]. Мышам (по 3 в группе) вводят возрастающие от группы к группе дозы испытываемого вещества в пределах 25-400 мг/кг и наблюдают 28 симптомов сразу же, через 30 минут, через 3 и 24 часа после введения.
d) Тест на фенциклидиновое поведение. "Фенциклидиновое" поведение - это побочные эффекты действия конкурентных и неконкурентных антагонистов NMDA-рецепторов. Чтобы выяснить, оказывает ли испытываемое вещество такое побочное действие, крысам вводят его перорально (в дозах кратных ED50 (50% антиэпилептического действия) из опыта с электрошоком). Затем животных помещают в индивидуальные камеры из прозрачного пластика и наблюдают за их поведением в течение 4 часов в ожидании проявления одного из 5 характерных признаков: повышенной активности, атаксии, кружения, качания головой и ретропульсии. В экспериментальную группу взяли 5 крыс, поведение которых сравнивали с поведением контрольных животных, получавших фенциклидин. Общий счет встречаемости составил 25, т.е. 5 крыс по 5 признаков. Фенциклидин дает такой счет при дозе, в 10 раз большей ED50 (W. Koek, J.H.Woods. P.Ornstein, 1987, Phychopharmacology, 91, 279).
e) Опыт с узкой доской для измерения степени повреждения нервной системы у крыс [G.E.Garske et al., Epilepsy Research, 1991, 9, 161]. Крыс сажают на узкую доску (1,25 см шириной, на высоте 40 см над столом), которая начинается в хорошо освещенной входной камере, проходит через постепенно темнеющий коридор и кончается в темной выходной камере. Длина доски составляет 63 см. Крыса считается ненормальной, если не может пройти по доске. Здесь учитываются две характерные особенности поведения крыс: они боятся высоты и любят темноту.
Линейную фармакокинетику можно обнаружить у крыс путем оценки площади под кривыми зависимости концентрации лекарства в плазме крови от времени, полученными при однократном введении испытываемого вещества внутривенно возрастающими дозами (Smith et al., Xenobiotica, 20, 1187 - 1199, 1990). Кровь берут катетером из яремной вены в разное время в течение 24 часов. Плазму отделяют центрифугированием и определяют концентрацию испытываемого вещества при помощи жидкостной хроматографии высокого давления с ультрафиолетовым облучением. Строят график по значениям концентрации во времени для каждой дозы и вычисляют площадь под графиком. Если средство обладает линейной фармакокинетикой, площадь под графиком будет прямого пропорциональна дозе. Если линейная фармакокинетика проявляется у крыс, значит, она будет проявляться у человека (Leander et al., Epilepsia, 33, 696-704, 1992, at p 703).
Помимо этого, настоящим изобретением предложен способ лечения нейродегенеративного расстройства, предусматривающий введение пациенту терапевтически эффективного количества соединения, предложенного настоящим изобретением. Особый интерес представляет способ, при котором введенная доза прямо пропорциональна концентрации лекарственного вещества в плазме крови.
В упомянутых выше случаях дозы будут меняться в зависимости от состава соединения, способа введения и схемы лечения. Однако, как правило, результат оказывается удовлетворительным, если вводить соединения, предложенные настоящим изобретением, животным в дневной дозировке от 0,1 мг до 20 мг на килограмм животного веса, предпочтительно, дробными дозами от 1 до 4 раз в день или в виде препаратов длительного действия. Людям следует вводит от 5 до 1400 мг в день, предпочтительно, от 10 до 100 мг, в формах и дозировках, пригодных для перорального введения и содержащих от 2 мг до 1400 мг активного соединения в смеси с жидким или твердым фармацевтическим носителем или разбавителем.
Соединения, предложенные настоящим изобретением, можно использовать в чистом виде и в виде соответствующих лекарственных форм, пригодных для энтерального и парентерального применения. В соответствии с настоящим изобретением, следует применять лекарственный состав, содержащий предпочтительно не более 80% по весу, а более предпочтительно - не более 50% по весу, соединения, предложенного настоящим изобретением, в смеси с приемлемыми к фармацевтическому применению добавкой, разбавителем или носителем.
Примерами разбавителей и носителей
могут служить
для таблеток и драже: лактоза, крахмал, тальк, стеариновая кислота;
для капсул: винная кислота ли лактоза;
в растворах для инъекций: вода, спирты, глицерин,
растительные масла;
для суппозиториев: натуральные или сгущенные масла и воски.
При лечении болезни Паркинсоса предпочтительно в качестве добавки к веществам, предложенным настоящим изобретением, использовать L-бора.
Кроме того, настоящим изобретением предусмотрено использование вещества, предложенного настоящим изобретением, в качестве активного начала при изготовлении медикамента для лечения нейродегенеративного расстройства.
Достоинства веществ, предложенных настоящим изобретением, заключаются в том, что они менее токсичны, более эффективны, дольше действуют, имеют более широкий спектр действия, являются более сильными, дают меньше побочных эффектов, легче усваиваются и имеют другие фармакологические свойства, выгодно отличающие их от уже известных и используемых в соответствующей области веществ.
Изобретение иллюстрируется следующими примерами
Пример 1. Приготовление (S) -α
- фенил-2-пиридинэтанамина дигидрохлорида:
a) α- фенил-2-пиридинэтанамин дигидрохлорид.
К охлажденному (0oC) раствору бензальдегида (34, 24 г, 0,323 моль) в 600 мл тетрагидрофурана добавили лития бис(триметилсилил)-амид (323 мл 1,0 M раствора в тетрагидрофуране, 0,323 моль) по каплям, в течение 30 минут. Смесь перемешивали при 0oC в течение трех часов.
В отдельную колбу с круглым дном, содержащую охлажденный (минут 78oC) раствор 2-пиколина (30,0 г; 0,323 моль) в тетрагидрофуране (600 мл), добавили n-бутиллития (129,2 мл 2,5 M раствора в гексане) понемногу в течение двадцати минут.
Первой смеси позволили нагреться до 0oC и оставили так еще на 40 минут. Вторую смесь (содержащую
соединившийся с литием анион 2-пиколина) каплями добавляли в первую в течение 20 минут. Затем, еще через 30 минут, ледяную баню убрали и смеси позволили нагреться до температуры окружающей среды. Еще
через час смесь вылили в разделительную воронку со льдом (1л) и 12 NHCl (200 мл). Водный слой промыли 3х200 мл диэтилового эфира (Et2O) и подщелочили 25% NaOH в воде. Водный слой
экстрагировали 2х200 мл хлороформа, экстракт высушили над MgSO4, профильтровали и сконцентрировали в вакууме. Остаток растворили в этилацетате (EtOAc) и подкислили насыщенным раствором
HCl/EtOAc. Раствор разбавили Et2O, а полученное белое твердое вещество отфильтровали и высушили в вакууме. Получили соединение, названное в подзаголовке (43%, 37,08 г), температура
плавления 206 - 208oC
b) -α- фенил-2-пиридинэтанамина дигидрохлорид.
К раствору рацемической смеси α-фенил-2-пиридинэтанамина (свободное основание продукта этапа (а), получение путем нейтрализации водного раствора продукта этапа(а) 25%-ным раствором NaOH в воде и экстрагирования хлороформом) (10,96 г; 0,0553 моль) в этилацетате (400 мл) добавили раствор S(+)-миндальной кислоты (8,41 г; 0,0553 моль) в этилацетате (300 мл). Полученный преципитат рекристаллизовали из горячего этилацетата (500 мл) еще три раза. Соль подщелочили 25% раствором NaOH в воде, экстрагировали хлороформом 3х100 мл, высушили над MgSO4, профильтровали и сконцентрировали в вакууме. Остаток растворили в этилацетате (300 мл) и подкислили насыщенным раствором HCl/EtOAc. Полученное белое твердое вещество отфильтровали и высушили в вакууме. Получили (-)-α-фенил-2-пиридинэтанамина дигидрохлорид (5,5 г), температура плавления 220 - 222oC, [α]D =-87,3o (c = 1,0 CH3OH).
Фильтрат от первоначальной преципитации нейтрализовали 25% раствором NaOH в воде, экстрагировали в 2х250 мл
CHCl3, высушили над MgSO4, профильтровали и сконцентрировали в вакууме. Остаток растворили в этилацетате (500 мл) и добавили к этому раствору раствор R(-)-миндальной кислоты (6,5
г, 0,043 моль) в этилацетате (500 мл). Преципитат отфильтровали и рекристаллизовали еще три раза. Соль подщелочили 25% раствором NaOH в воде, экстрагировали хлороформом 3х100 мл, высушили над MgSO4, профильтровали и сконцентрировали в вакууме. Остаток растворили в этилацетате (300 мл) и подкислили насыщенным раствором HCl/EtOAc. полученное белое твердое вещество отфильтровали и высушили
в вакууме. Получили соединение, указанное в заголовке (3,84 г), температура плавления 220 - 222oC, [α]D =+87,1o (c = 1,1 CH3OH)
Чистоту
энантиомера можно определить путем воздействия на миндальную кислоту или дигидрохлорид энантиочистым (более 99,5%) метилбензил изоцианатом с последующей жидкостной хроматографией высокого давления с
нормальной последовательностью фаз и этанолом/гексаном [6:94] в качестве растворителя. Чистота энантиомеров, полученных так, как описано выше, составила более 99,5%
Рентгеновская
кристаллография показала, что (+)-энантиомер имеет абсолютную-(S) стереохимию.
Пример 2. Соединение из примера 1 обнаруживало активность (ED50) в дозе 3,7 мг/кг при предупреждении тонического разгибания задних конечностей у крыс, вызванного максимальным электрошоком (см. выше), при пероральном введении. Для энантиомера доза RD50 составляла 20,2 мг/кг.
Методы проведения экспериментов
Фармакокинетика α- фенил-2-пиридинэтанамина (соединения, упоминаемого в EP-A-0356035 под названием
1-фенил-2-(2-пиридинил)этиламин), (S) -α- фенил-2-пиридинэтанамина (соединения по настоящему изобретению и его энантиомера (R) -α- фенил-2-пиридинэтанамин) были изучены (в виде
дигидрохлоридов) с помощью способов, описанных на стр. 6 строка 30 по стр. 7 строка 8 настоящей заявки
Результаты
Соотношение между концентрацией в плазме и временем выражены в виде
кривых по каждой дозе, и площади участков под каждой кривой вычислены. На чертеже приведена диаграмма площади под кривой "концентрация в плазме/время" против дозы каждого тестированного соединения.
Структурные формулы соединений приведены ниже

α - Фенил-2-пиридинэтанамин.

(S) α- Фенил-2-пиридинэтанамин.

(R) α Фенил-2-пиридинэтанамин
Выводы
(S) -α- Фенил-2-пиридинэтанамин проявляет линейную фармакокинетику поскольку, как показано на чертнеже, площадь под кривой "концентрация в плазме/время" для данных доз указанного соединения прямо пропорциональна назначаемой дозе.
α- Фенил-2-пиридинэтанамин и (R) -α- фенил-2-пиридинэтанамин не дают линейной фармакокинетики, поскольку площадь под кривой "концентрация в плазме/время" для данных доз указанных соединений не является прямо пропорциональной назначаемой дозе.
Поэтому предполагается, что (S) -α- фенил-2-пиридинэтанамин будет проявлять линейную фармакокинетику при использовании для лечения человека, в то время как α- фенил-2-пиридинэтанамин и (R) -α- фенил-2-пиридинэтанами не будут проявлять линейную фармамокинетику при лечении человека.
Линейная фармакокинетика (S) -α- фенил-2-пиридинэтанамина является неожиданным и весьма благоприятным свойством соединения, поскольку позволяет прогнозировать концентрацию соединения в головном мозге человека на основе концентраций в плазме, что облегчает дозировку, и поэтому данное соединение более привлекательно в качестве лекарственного препарата, чем α - фенил-2-пиридинэтанамин или (R) -α- фенил-2-пиридинэтанамин.
Реферат
Изобретение относится к (S)-α-фенил-2-пиридинэтанамину и его солям с неорганическими кислотами (I), которые обладают противосудорожной активностью (ЕД50 в дозе 3,7 мг/кг). Изобретение относится к лекарственному препарату, обладающему противосудорожным действием, который содержит вещество (I) в эффективном количестве и фармацевтически приемлемые добавки. Изобретение относится к способу лечения судорог путем введения терапевтически эффективной дозы соединения (I). Изобретение относится также к способу получения (I), который заключается в обработке рацемического α-фенил-2-пиридинэтанамина хиральной кислотой с последующим селективным осаждением диастереомерной соли. 4 с. и 4 з.п.ф-лы, 1 ил.


Комментарии