Производные пиридина, фармацевтическая композиция, обладающая антагонистическим действием на mglu r5 человека - RU2203889C2
Код документа: RU2203889C2
Чертежи














Описание
Изобретение относится к применению 2-арилалкенил-, 2-гетероарилалкенил-, 2-арилалкинил-, 2-гетероарилалкинил-, 2-арилазо- и 2-гетероарилазопиридинов для модулирования активности метаботропных рецепторов глутамата (mGluR) и к лечению опосредованных mGluR5 заболеваний, к фармацевтическим композициям, предназначенным для использования в такой терапии, а также к новым 2-арилалкенил-, 2-гетероарилалкенил-, 2-арилалкинил-, 2-гетероарилалкинил-, 2-арилазо- и 2-гетероарилазопиридинам.
Было установлено, что 2-арилалкенил-, 2-гетероарилалкенил-, 2-арилалкинил-, 2-гетероарилалкинил-, 2-арилазо- и 2-гетероарилазопиридины, включая фармацевтически приемлемые соли (в дальнейшем средства по изобретению) могут быть использованы в качестве модуляторов mGluR. Модуляцию mGluR можно продемонстрировать различными путями, включая, в частности, испытания с их связыванием и функциональные испытания, такие как испытания со вторичным переносом или определение изменений концентрации внутриклеточного кальция. Так, например, для некоторых средств по изобретению при исследовании обмена инозитолфосфата в линиях рекомбинантных клеток, экспрессирующих mGluR5a человека (hmGluR5a), полученное значение ИК50 составляло от примерно 1 нМ до примерно 50 мкМ.
Средства по изобретению обладают, в частности, ценными фармакологическими свойствами. Так, например, они проявляют заметное и селективное модулирующее, прежде всего антагонистическое, действие на hmGluR. Это может быть установлено in vitro, например на рекомбинантных hmGluR5, в особенности на выделяемых с помощью препаративной тонкослойной хроматографии (ПТХ) подтипах этих рецепторов, таких как mGluR5, с использованием различных методик, в частности таких, как определение ингибирования роста концентрации внутриклеточного Са+2, индуцированного агонистом, в соответствии с L.P. Daggett и др., Neuropharm. том 34, с. 871-886 (1995), P.J. Flor и др., J. Neurochem. том 67, с. 58-63 (1996), или определением того, в какой мере ингибируется индуцированный агонистом рост обмена инозитолфосфата, как это описано у Т. Knoepfel и др., J. Pharmacol. том 288, с. 389-392 (1994), у L.P. Daggett и др., Neuropharm. том 67, с. 50-63 (1996), а также в цитируемых в этих работах ссылках. Выделение и экспрессия подтипов hmGluR описаны в патенте US 5521297. Для некоторых средств по изобретению установленные значения ИК50 составляли от примерно 1 нМ до примерно 50 мкМ, которые определяли по ингибированию индуцированного квискалатом обмена инозитолфосфата, установленного в рекомбинантных клетках, экспрессирующих hmGluR5a.
Таким образом, изобретение относится к средствам по изобретению, предназначенным для лечения заболеваний, связанных с нарушением передачи глютаматэргического сигнала и расстройством нервной системы, частично или полностью опосредуемым hmGluR5.
Примерами расстройств, связанных с нарушением передачи глютаматэргического сигнала, являются эпилепсия, церебральная ишемия, прежде всего острая ишемия, ишемическая болезнь глаз, спазм мышц, как, например, частичная или общая мышечная спастичность, прежде всего судороги или боль.
Примерами расстройств нервной системы, частично или полностью опосредедуемых hmGluR5, являются острые, травматические или хронические дегенеративные процессы нервной системы, такие как болезнь Паркинсона, старческое слабоумие, болезнь Альцгеймера, хорея Гентингтона, боковой амиотрофический склероз, рассеянный склероз, психические болезни, такие как шизофрения, тревожное состояние, депрессия и болевые ощущения.
Изобретение относится также к применению средств по изобретению при лечении заболеваний, связанных с нарушением передачи глютаматэргического сигнала и расстройством нервной системы, частично или полностью опосредуемым mGluR группы I.
Далее, изобретение относится также к применению средств по изобретению для приготовления фармацевтической композиции, предназначенной для лечения заболеваний, связанных с нарушением передачи глютаматэргического сигнала и расстройством нервной системы, частично или полностью опосредуемым mGluR группы I.
Изобретение относится также к способу лечения заболеваний, полностью или частично опосредуемых mGluR группы I (предпочтительно mGluR5), который включает введение в организм человека или теплокровного животного, нуждающегося в таком лечении, терапевтически эффективного количества средства по изобретению.
Еще одним объектом изобретения являются новые 2-арилалкенил-, 2-гетероарилалкенил-, 2-арилалкинил-, 2-гетероарилалкинил-, 2-арилазо- и 2-гетероарилазопиридины и их соли и способ их получения.
Изобретение относится далее к фармацевтической композиции, которая совместно с обычными фармацевтическими наполнителями в качестве фармацевтически действующего компонента включает новый 2-арилалкенил-, 2-гетероарилалкенил-, 2-арилалкинил-, 2-гетероарилалкинил-, 2-арилазо- или 2-гетероарилазопиридин или его фармацевтически приемлемую соль.
Средства по
изобретению представляют собой,
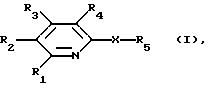
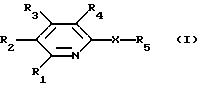
например, соединения формулы I
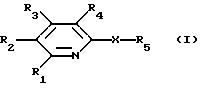
в которой R1 обозначает водород, низший алкил, соответственно (низш. )алкил, гидрокси(низш.)алкил, (низш.)алкиламиногруппу, пиперидино, карбокси, этерифицированную карбокси, амидированную карбокси, незамещенный или (низш.) алкил-, (низш. )алкокси, галоид- и/или трифторметилзамещенный N-(низш. )алкил-N-фенилкарбамоил, (низш.)алкокси, галоид(низш.)алкил или галоид(низш. )алкокси,
R2 обозначает водород, (низш.) алкил, карбокси, этерифицированную карбокси, амидированную карбокси, гидрокси (низш.) алкил, гидроксил, (низш. )алкокси или (низш.)алканоилокси, 4-(4-фторбензоил)пиперидин-1-илкарбокси, 4-трет-бутилоксикарбонилпиперазин-1-илкарбокси, 4-(4-азидо-2-гидроксибензоил)пиперазин-1-илкарбокси или 4-(4-азидо-2-гидрокси-3-иодбензоил) пиперазин-1 - илкарбокси,
R3 обозначает водород, (низш.)алкил, карбокси, (низш.)алкоксикарбонил, (низш.)алкилкарбамоил, гидрокси(низш.)алкил, ди(низш.)алкиламинометил, морфолинокарбонил или 4-(4-фторбензоил)пиперидин-1-илкарбокси,
R4 обозначает водород, (низш.)алкил, гидроксил, гидрокси(низш.)алкил, амино (низш.) алкил, (низш.)алкиламино (низш.)алкил, ди(низш. )алкиламино(низш. )алкил, незамещенную или гидроксизамещенную (низш. )алкиленамино (низш. ) алкил, (низш. )алкокси, (низш.)алканоилокси, амино (низш. ) алкокси-, (низш. )алкиламино(низш. )алкокси, ди(низш.)алкиламино (низш.) алкокси, фталимидо(низш.)алкокси, незамещенную или гидрокси или 2-оксоимидазолидин-1-илзамещенную (низш.)алкиленамино(низш.) алкокси, карбокси, этерифицированную или амидированную карбокси, карбокси(низш.)алкокси или этерифицированную карбокси (низш.)алкокси,
X обозначает необязательно галоидзамещенную низшую алкениленовую или алкиниленовую группу, присоединенную посредством соседних ненасыщенных углеродных атомов или азо(-N=N-)группы, и
R5 обозначает ароматическую или гетероароматическую группу, которая является незамещенной или замещена одним или несколькими заместителями, выбранными из (низш. )алкила, галогенов, галоид (низш.)алкила, галоид (низш. )алкокси, (низш.)алкенила, (низш.)алкинила, незамещенного или (низш.)алкил-, (низш.)алкокси-, галоид- и/или трифторметилзамещенного фенила, незамещенного или (низш. )алкил-, (низш.)алкокси-, галоид- и/или трифторметилзамещенного фенил(низш.)алкинила, гидроксила, гидрокси(низш.)алкила, (низш. )алканоилокси(низш. )алкила, (низш. )алкокси, (низш. )алкенилокси, (низш. )алкилендиокси, (низш. )алканоилокси, амино-, (низш.)алкиламино-, (низш. )алканоиламиногруппы и N-(низш.)алкил-N-(низш.)алканоиламино (низш.)алкокси, незамещенной или (низш. )алкил-, (низш.)алкокси-, галоид- и/или трифторметилзамещенной фенокси, незамещенной или (низш.)алкил-, (низш.)алкокси-, галоид- и/или трифторметилзамещенной фенил(низш.)алкокси, ацила, карбокси, этерифицированной карбокси, амидированной карбокси, циано-, карбокси (низш. )алкиламино-, этерифицированной карбокси (низш.)алкиламино-, амидированной карбокси (низш. )алкиламино-, фосфоно(низш.)алкиламино-, этерифицированной фосфоно(низш. )алкиламино-, нитро-, амино-, (низш.)-алкиламино-, ди(низш. )алкиламино-, ациламино-, N-ацил-N-(низш. )алкиламино-, фениламино, фенил (низш. )алкиламино-, циклоалкил(низш. )алкиламино- и гетероарил(низш. )алкиламиногрупп, каждая из которых может быть незамещенной или (низш. )алкил-, (низш.)алкокси-, галоид- и/или трифторметилзамещенной,
обычные фотоафинные лиганды и обычные радиоактивные маркеры, включая их N-оксиды и их фармацевтически приемлемые соли.
Соединения формулы I, содержащие основные группы, способны образовывать кислотно-аддитивные соли, а соединения формулы I, содержащие кислотные группы, могут образовывать соли с основаниями. Соединения формулы I, содержащие основные группы и, кроме того, содержащие по меньшей мере по одной кислотной группе, способны также образовывать внутренние соли.
К ним также относятся как полные, так и неполные соли, т.е., другими словами, соли с 1, 2 или 3 экв., предпочтительно с 2 экв., основания на моль кислоты формулы I или соли с 1, 2 или 3 экв., предпочтительно с 1 экв., кислоты на моль основания формулы I.
Для выделения и очистки можно также использовать фармацевтически неприемлемые соли. Для терапевтических целей применяют только фармацевтически приемлемые нетоксичные соли, и поэтому они предпочтительны.
В настоящем описании термин "галоид" использован для обозначения атома фтора, хлора, брома или иода.
Когда Х обозначает алкениленовую группу, предпочтительна транс-конфигурация.
Предпочтительными соединениями формулы I являются те,
в которых
Х обозначает необязательно
галоидзамещенную (С2-С4) алкениленовую или алкиниленовую группу, присоединенную посредством соседних ненасыщенных углеродных атомов,
R1 обозначает водород,
(С1-С4)алкил, (С1-С4)алкокси, гидрокси(С1-С4)алкил, цианогруппу, этинил, карбокси, (С1-С4)алкоксикарбонил,
ди(С1С4)алкиламиногруппу, (С1-С6)алкиламинокарбонил, трифторметилфениламинокарбонил,
R2
обозначает водород, гидроксил, (С1
-С4)алкил, гидрокси(С1-С4)алкил, (С1-С4)алкокси, карбокси, (С2-С5
)алканоилокси, (С1-С4)
алкоксикарбонил, ди(С1-С4)алкиламино(С1-С4)алканоил, ди(С1-С4)алкиламинометил,
4-(4-фторбензоил)пиперидин-1-илкарбокси,
4-трет-бутилоксикарбонилпиперазин-1 - илкарбокси, 4-(4-азидо-2-гидроксибензоил) пиперазин-1 илкарбокси или 4-(4-азидо-2-гидрокси-3-иодбензоил)
пиперазин-1-ил-карбокси,
R3
обозначает водород, (С1-С4)алкил, карбокси, (С1-С4)алкоксикарбонил, (С1-С4
)алкилкарбамоил, гидрокси(С1-С4)алкил,
ди(С1-С4) алкиламинометил,
морфолинокарбонил или 4-(4-фторбензоил)пиперидин-1-илкарбокси,
R4 обозначает водород, гидроксил, (С1-C4) алкокси, карбокси, (С2-С5)алканоилокси, (С1-С4)алкоксикарбонил, амино(С1
-C4) алкокси, ди(С1-С4
)алкиламино(С1-С4)алкокси, ди(С1-С4)алкиламино(С1-С4)алкил, карбокси (С1-С4) алкилкарбонил, (С1-С4) алкоксикарбонил (С1-С4) алкокси, гидрокси(С1-С4)алкил или
м-гидрокси-п-азидофенилкарбониламино(С1-C4) алкокси и
R5 обозначает группу формулы
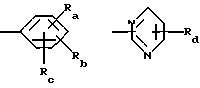
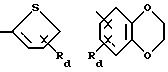
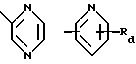
в которой Ra и Rb каждый независимо друг от друга обозначает водород, гидроксил, галоген, нитро-, цианогруппу, карбокси, (С1 -С4)алкил, (С1-C4)алкокси, гидрокси(С1 -С4)алкил, (С1-С4)алкоксикарбонил, (С2-С7)алканоил, (С2-С5)алканоилокси, (С2-С5)алканоилокси(С1-С4)алкил, трифторметил, трифторметокси, триметилсилилэтинил, (С2-С5 )алкинил, амино-, азидо-, амино(С1С4)алкокси, (С2-С5)алканоиламино(С1-С4)алкокси, (С1-С4)алкиламино(С1-С4)алкокси, ди (С1-С4) алкиламино(С1-С4) алкокси, (С1-С4)алкиламино-, ди(С1-С4)алкиламино-, моногалоидбензиламино-, тиенилметиламино-, тиенилкарбониламиногруппу, трифторметилфениламинокарбонил, тетразолил, (С2-С5)алканоиламино-, бензилкарбониламино-, (С1 -С4)алкиламинокарбониламино-, (С1-С4 )алкоксикарбониламинокарбониламиногруппу или (С1-С4)алкилсульфонил, Rc обозначает водород, фтор, хлор, бром, гидроксил, (С1-С4)алкил, (С2С5)алканоилокси, (С1-С4)алкокси- или цианогруппу и
Rd обозначает водород, галоген или (С1-С4)алкил.
Более предпочтительными соединениями формулы I являются те, в которых
Х имеет значения, указанные выше, а
R1 обозначает водород, (С1-С4)алкил, (С1-С4)алкокси, цианогруппу, этинил или ди(С1-С4)алкиламиногруппу,
R2
обозначает водород, гидроксил, карбокси, (С1-С4
)алкоксикарбонил, ди(С1-С4)алкиламинометил, 4-(4-фторбензоил) пиперидин-1-илкарбокси,
4-трет-бутилоксикарбонилпиперазин-1-илкарбокси,
4-(4-азидо-2-гидроксибензоил)пиперазин-1-илкарбокси или 4- (4-азидо-2-гидрокси-3-иодбензоил)пиперазин-1-илкарбокси,
R3 имеет
значение, указанное выше,
R4
обозначает водород, гидроксил, карбокси, (С2-С5)алканоилокси, (С1-С4)алкоксикарбонил, амино(С1
-С4)алкокси, ди (С1-С4) алкиламино(С1-С4)алкокси, ди(С1-С4)алкиламино(С1-С4)алкил или гидрокси(С1-С4)алкил и
R5 обозначает группу формулы
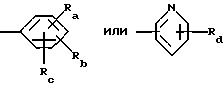
в которой Ra и Rb каждый независимо друг от друга обозначает водород, галоген, нитро-, цианогруппу, (С1-С4)алкил, (С1-С4)алкокси, трифторметил, трифторметокси или (С2-С5 )алкинил и
Rc и Rd имеют значения, указанные выше.
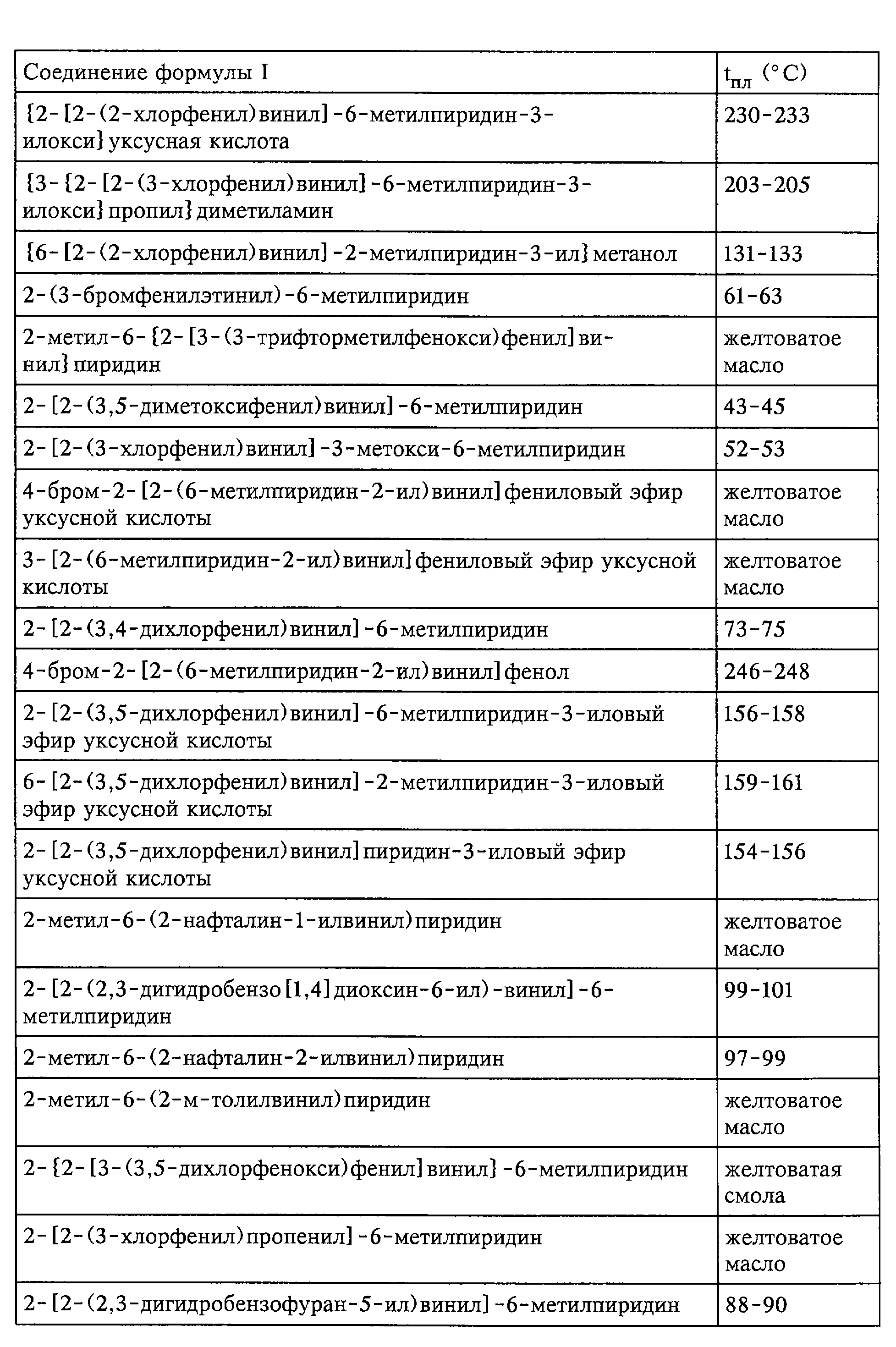
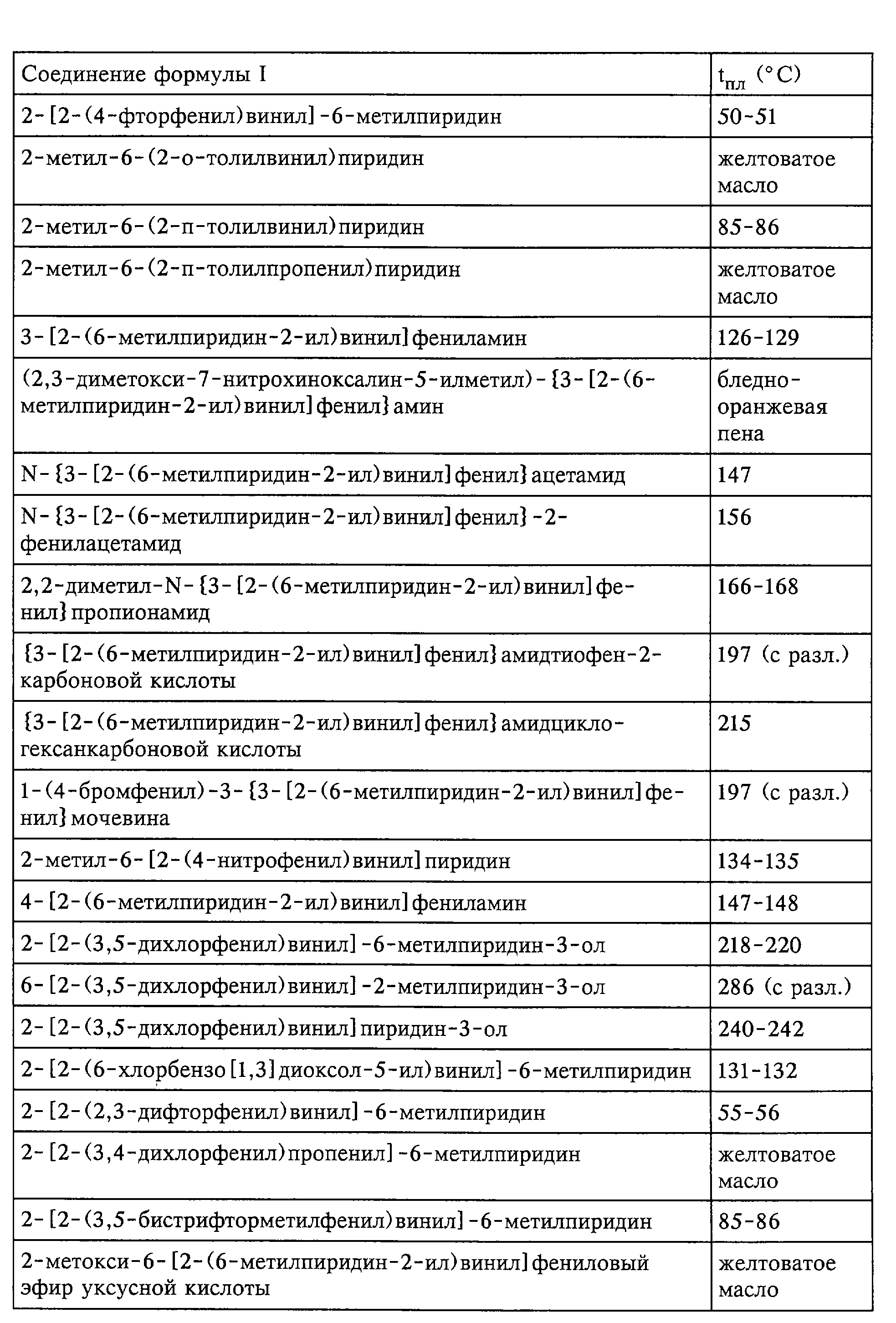
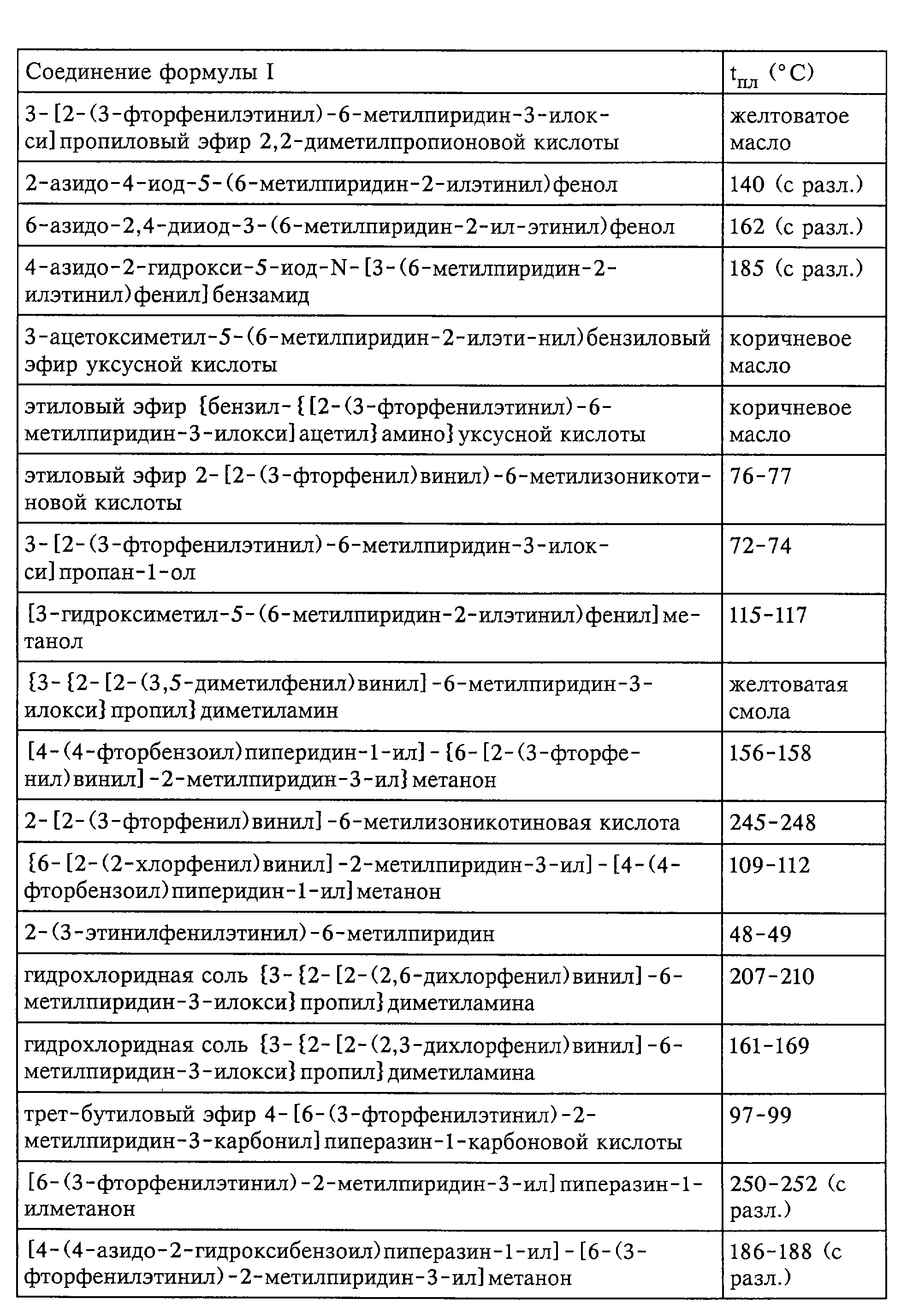
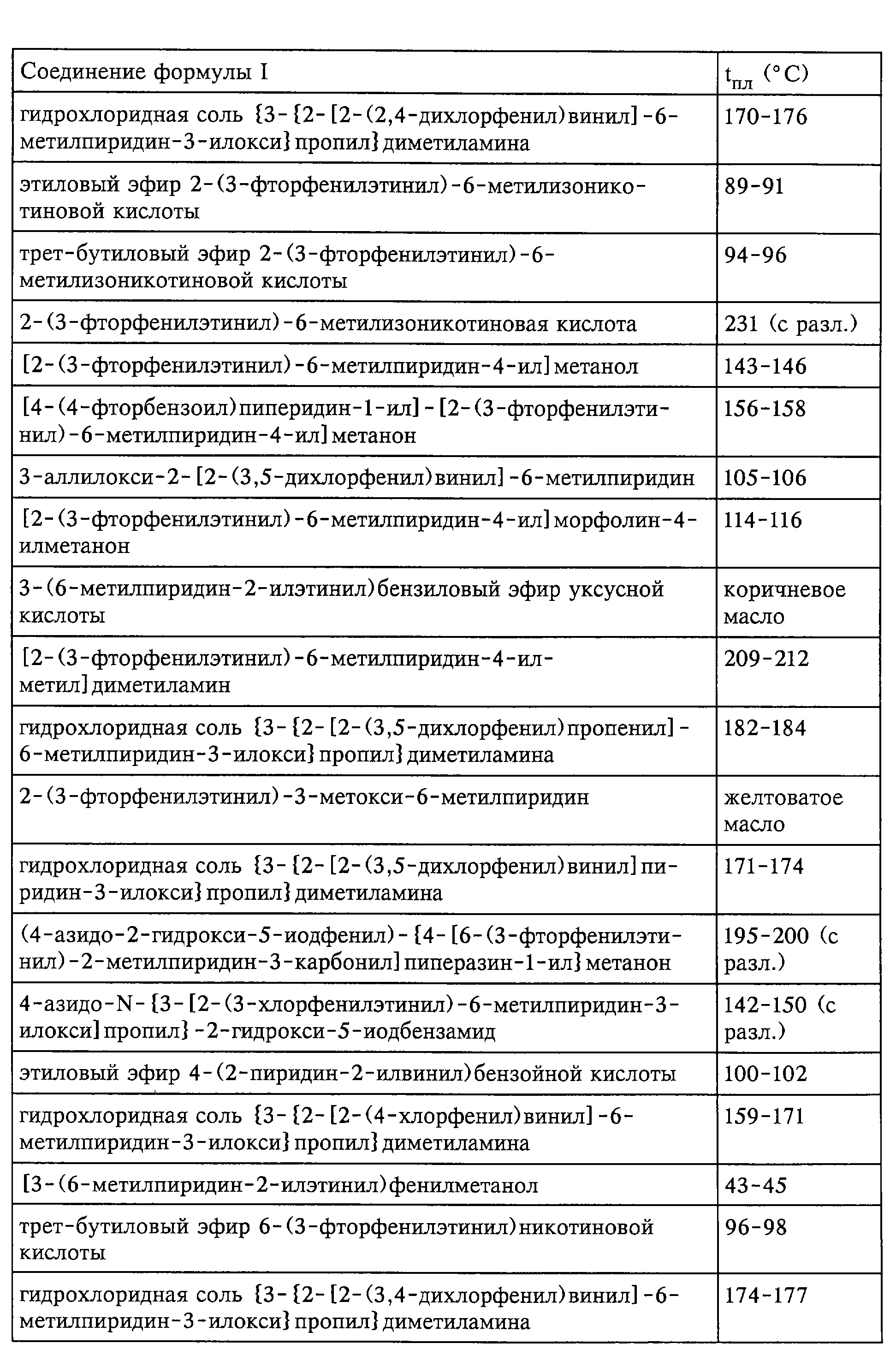
Средства по изобретению включают, например, соединения, описанные в нижеследующих примерах.
Полезность средств по изобретению при лечении вышеупомянутых заболеваний можно было бы подтвердить в ходе проведения ряда стандартных тестов, включая описанные ниже.
Средства по изобретению проявляют противосудорожное действие на модели судорог, вызванных электрошоком, в дозах от примерно 10 до 100 мг/кг при интраперитонеальном или пероральном введении за 0,25-8 ч до начала исследования [см. Е.А. Swinyard, J. Pharm. Assoc. Scient. Ed.38, 201 (1949), и J. Pharmacol. Exptl. Therap. 106. 319 (1952)].
В дозах от примерно 4 до 40 мг/кг при пероральном введении средства по изобретению проявляют способность реверсировать гипералгезию, вызванную полным адъювантом Фрейнда (ПАФ) [см. J. Donnerer и др., Neuroscience 49. 693-698 (1992), и C.J. Woolf, Neuroscience 62, 327-331 (1994)].
Очевидно, что при всех вышеупомянутых показаниях соответствующую дозу варьируют в зависимости, например, от конкретно используемого соединения, субъекта, пути введения, а также природы и серьезности болезненного состояния, при котором проводят лечение. Однако обычно удовлетворительные результаты у животных достигаются при ежедневной дозе от примерно 0,5 до примерно 100 мг/кг живого веса животного. В случае более крупных млекопитающих, например людей, рекомендуемая ежедневная доза составляет от примерно 5 до 1500 мг, предпочтительно от примерно 10 до примерно 1000 мг соединения, которое целесообразно вводить в организм в виде дробных доз до 4 раз в день или в форме лекарственного препарата с непрерывным высвобождением.
Предпочтительные соединения при вышеупомянутых показаниях включают {3-{ 2-[2-транс-(3,5-дихлорфенил)винил] - 6-метилпиридин-3-илокси} пропил} диметиламин (А), 2-метил-6-стирилпиридин (Б), 2-(3-фторфенилэтинил)-6-метилпиридин (В) и 2-(4-этокси-3-трифторметилфенилэтинил)-6-метилпиридин (Г). Было установлено, например, что в вышеупомянутой модели судорог, вызванных электрошоком, соединения А и Б проявляют противосудорожное действие в случае предварительного интраперитонеального введения при значениях ЭД50 соответственно 30 и 35 мг/кг (время предварительной обработки соответственно 4 ч и 15 мин) и что в моделе гипералгезии, вызванной вышеупомянутым ПАФ, соединения В и Г способны к реверсии гипералгезии при значениях ЭД50 соответственно 4,2 и 19 мг/кг в случае перорального введения (время постобработки 3 ч).
Как указано выше, средства по изобретению включают 2-арилалкенил-, 2-гетероарилалкенил-, 2-арилалкинил-, 2-гетероарилалкинил-, 2-арилазо- и 2-гетероарилазопиридины и их соли, которые в дальнейшем называются "соединениями по изобретению".
К соединениям по изобретению относятся те
соединения приведенной выше формулы I и их соли, у которых Х и R1-R5 имеют значения, указанные выше, при условии, что
когда R3 обозначает водород,
а) в
соединениях формулы I, в которой каждый из R1, R2 и R4 обозначает водород, значения R5 отличны от
фенила, моногалоидфенила, 2,4- и 3,4-дихлорфенила, 3-и
4-трифторметилфенила, метилфенила, 3,4- и 2,5-диметилфенила, 4-изопропилфенила, 3,5-ди-трет-бутилфенила, метоксифенила, 3,4-диметоксифенила, 2,4,
5- и 3,4,5-триметоксифенила, гидроксифенила, 3,
5-дигидроксифенила, 4-гидрокси-3,5-диметилфенила, 3-гидрокси-4-метокси- и 4-гидрокси-3-метоксифенила, 4-гидрокси(3-метил-5-трет-бутил-, 2- и
4-ацетиламинофенила, 3,5-диизопропил- и 3,
5-ди-трет-бутил)фенила, 4-карбокси и 4-этоксикарбонилфенила, 4-цианофенила, 3-метоксикарбонилфенила, 3-карбокси-5-метоксифенила, 2-пиридинила,
5-хлор-2-пиридинила и 6-метил-2-пиридинила, когда Х
обозначает этенилен, или значения R5 отличны от фенила, 4-метилфенила, 4-метоксифенила, 4-бромфенила и 2- и 4-хлорфенила, когда Х
обозначает 1,2-пропилен, присоединенный к R5 во
2-м положении, или значения R5 отличны от фенила, 2-и 4-хлорфенила и 3-метоксифенила, когда Х обозначает 1,2-пропилен,
присоединенный к R5 в 1-м положении, или же значения R5 отличны от 4-метоксифенила, когда Х обозначает 2,3-бут-2-енилен или 1,2-бут-1-енилен, присоединенный к R5 во
2-м положении, или значения R5 отличны от 4-метоксифенила и
4-изопропилфенила, когда Х обозначает 2,3-пент-2-енилен, присоединенный к R5 в 3-м положении, или значения R5 отличны от фенила, 4-метилфенила, метоксифенила и 4-гидроксифенила,
когда Х обозначает 3,4-гекс-3-енилен;
б) в соединениях формулы I, в которой R1 обозначает метил, а
каждый из R2 и R4 обозначает водород, значения R5
отличны от фенила, 3-метилфенила, 2-метоксифенила, 2-хлорфенила, 4-цианофенила, 2-пиридинила и 6-метил-2-пиридинила,
когда Х обозначает этенилен;
в) в соединениях формулы I, в которой каждый
из R1 и R2 обозначает водород, а R4 обозначает карбокси, значения R5
отличны от фенила, 3-метилфенила, 4-метоксифенила и 4-бромфенила, когда Х обозначает
этенилен;
г) в соединениях формулы I, в которой каждый из R1 и R2 обозначает
водород, а R4 обозначает метил, значения R5 отличны от фенила,
3-метокси, 4-метокси и 3,4-диметоксифенила, 2-хлор- и 2,4-дихлорфенила и 6-метилпирид-2-ила, когда Х обозначает
этенилен, или значения R5 отличны от фенила, когда Х обозначает 1,
2-проп-1-енилен, присоединенный к R5 во 2-м положении;
д) в соединениях формулы I, в которой каждый из
R1 и R2 обозначает водород, а R4 обозначает
2-диметиламиноэтоксикарбонил или 3-диметиламинопропилоксикарбонил, значения R5 отличны от 4-метоксифенила,
когда Х обозначает этенилен;
е) в соединениях формулы I, в которой каждый
из R1 и R2 обозначает водород, а R4 обозначает 2-диметоксиэтокси, значения R5 отличны от фенила, 4-метилфенила и 4-метоксикарбонилфенила, когда Х обозначает
этенилен;
ж) значения R5 отличны от фенила, когда каждый из R1 и R2
обозначает водород, а R4 обозначает гидроксил или этоксикарбонил, или, когда
каждый из R1 и R2 обозначает водород, а R4 обозначает гидроксил, или когда
R1 обозначает метил, R2 обозначает водород, а R4 обозначает
метокси, или R1 обозначает бут-1-енил, R2 обозначает водород и R4
обозначает водород, или R1 обозначает водород, а R4 обозначает
2-диметоксиэтокси, а Х в каждом случае обозначает этенилен, и при условии, что когда R3 обозначает
водород, Х обозначает этенилен,
а') значения R5 отличны от фенила,
2- и 4-нитрофенила, 4-аминофенила, 4-хлорфенила, 4-метилфенила, 4-метоксифенила, 4-этоксикарбонилфенила,
5-формил-2-метоксифенила, 5-карбокси-2-метилфенила и пиридила, когда каждый из R1,
R2 и R4 обозначает водород;
б') в соединениях формулы I, в которой каждый
из R2 и R4 обозначает водород, значения R5 отличны от фенила,
3-метилфенила, 6-метилпиридин-2-ила и 2-метоксифенила, когда R1 обозначает метил, значения
R5 отличны от 6-бромпиридин-2-ила, когда R1 обозначает бром, и значения
R5 отличны от 6-гексилоксипиридин-2-ила, когда R1 обозначает гексилокси;
в') в соединениях формулы I, в которой каждый из R1 и R4 обозначает
водород, значения R5 отличны от фенила, 4-аминофенила и 4-пропилфенила, когда R2
обозначает метил, значения R5 отличны от фенила, 4-цианофенила и 4-пентилфенила, когда
R2 обозначает этил, значения R5 отличны от 3-циано-4-этоксифенила и
3-бром-4-метоксифенила, когда R2 обозначает бутил, значения R5 отличны от
4-метоксифенила и 4-бутоксифенила, когда R2 обозначает пентил, значения R5
отличны от 4-трет-бутилфенила, 3-трет-бутил-4-гидроксифенила, 4-трет-бутил-3-гидроксифенила и
4-гексилоксифенила, когда R2 обозначает карбокси, значения R5 отличны от фенила,
когда R2 обозначает метоксикарбонил или метоксикарбамоил, значения R4
отличны от 3-трет-бутилфенила, 3-трет-бутил-4-гидроксифенила и 4-(4-метилпентил)фенила, когда R2
обозначает этоксикарбонил, и значения R5 отличны от 4-пентилоксифенила, когда
R2 обозначает 2-метилбутилоксикарбонил;
г') в соединениях формулы I, в которой каждый из
R1 и R2 обозначает водород, значения R5 отличны от фенила,
когда R4 обозначает гидроксил, метил, этил, карбокси, метоксикарбонил или карбамоил.
Предпочтительные соединения по изобретению представляют собой, как указано выше, средства по изобретению.
Соединения по изобретению могут быть получены аналогично методам синтеза известных соединений формулы I.
Таким образом, соединения по
изобретению, которые отвечают формуле I, могут быть получены, например, по способу, который включает
а)
реакцию соединения формулы II
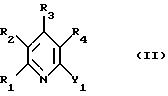
с соединением формулы Y2-R5 (III), в которой либо один из Y1 и Y2 обозначает низший алканоил, а другой обозначает низший алкил или триарилфосфоранилиденметил, либо один из Y1 и Y2 обозначает реакционноспособную этерифицированную гидроксильную группу, а другой обозначает группу Y3-X-, в которой Y3 обозначает водород или металлсодержащую группу, R1, R2, R3, R4 и R5 имеют значения, указанные выше, и функциональные группы R1, R2, R3 и R4, равно как и функциональные заместители у R5, могут быть временно защищены, или
б) удаление H-Y4 из соединения формулы IV
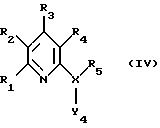
в которой Y4 обозначает группу, которая является донором электронов, R1, R2, R3, R4, X и R5 имеют значения, указанные выше, и функциональные группы R1, R2, R3 и R4, равно как и функциональные заместители у R5, могут быть временно защищены, с удалением всех временно защищающих групп и при необходимости превращение соединения формулы I, которое может быть получено по вышеописанным вариантам, в другое соединение формулы I, разделение смеси изомеров, которые могут быть получены, на индивидуальные изомеры и/или превращение соединения формулы I, содержащего по меньшей мере одну солеобразующую группу, которое может быть получено по вышеописаным способам, в соль или превращение соли, которая может быть получена по вышеописанным вариантам, в соответствующее свободное соединение или в другую соль.
Низший алканоил Y2 или, что более предпочтительно, группа Y1 представляет собой, например, С1-С3 алканоильную группу, такую как формил, ацетил или пропионил, в особенности формил. Низшая алкильная группа Y1 или, что более предпочтительно, Y2 представляет собой, например, С1-С3 алкильную группу, такую как метил, этил или пропил, прежде всего метил. Триарилфосфоранилиденметил Y2 или, что более предпочтительно, Y1 представляет собой, например, трифенилфосфоранилиденметил.
Когда один из Y1 и Y2 обозначает реакционноспособную этерифицированную гидроксильную группу, а другой обозначает группу формулы Y3-X-, в которой Y3 обозначает водород, в предпочтительном варианте реакцию конденсации проводят в соответствии с методом сочетания Хека, например в присутствии меди, медного катализатора или каталитической системы благородный металл/фосфин, такой как палладий или соль палладия (II), в присутствии триарилфосфина, например ацетата палладия и трифенилфосфина, или в присутствии системы бистрифенилфосфин/палладийдихлорид, предпочтительно в присутствии три(низш. )алкиламина, например триметиламина, целесообразно в присутствии Сu1-I, в полярном органическом растворителе, таком как амид N,N-ди(низш. )алкилалифатической кислоты, в частности в диметилформамиде, ди(низш. )алкилсульфоксиде, например в диметилсульфоксиде, или диоксане, при температуре от соответственно 15 до соответственно 120oС, предпочтительно при кипении.
Когда один из Y1 и Y2 обозначает реакционноспособную этерифицированную гидроксильную группу, а другой обозначает группу формулы Y3-X-, в которой Y3 обозначает металлсодержащий радикал, такой как галоидмагниевый радикал, в предпочтительном варианте реакцию конденсации проводят в соответствии с методом Гриньяра, согласно которому в предпочтительном варианте металлсодержащее промежуточное соединение получают in situ.
Когда один из Y1 и Y2 обозначает (низш.)алканоил, а другой обозначает (низш. )алкил, в предпочтительном варианте реакцию межмолекулярной конденсации соединений формул II и III проводят в соответствии с методом Шо и Уагстаффа или одной из многих его модификаций.
Когда один из y1 и Y2 обозначает (низш.)алканоил, а другой обозначает Триарилфосфоранилиденметил, в предпочтительном варианте реакцию конденсации проводят в соответствии с хорошо известным методом синтеза олефинов Виттига, предпочтительнее путем получения in situ фосфоранилидено-вого компонента из соответствующего триарилфосфонийгалогенида, например реакцией этого последнего с металлсодержащим основанием, таким как гидрид щелочного металла, в частности гидрид натрия, или металлорганическим основанием, таким как соединение (низш. )алкила и металла, в частности бутиллитий, или алкоголятом щелочного металла, например трет-бутоксидом калия, предпочтительно в инертном органическом растворителе, таком как ароматический или арилалифатический углеводород, например бензол или толуол, при температуре от соответственно -10 до соответственно 39oС, предпочтительно вначале при 0-10oС, а затем при комнатной температуре.
Группами Y4, которые служат донарами электронов, являются, например, этерифицированные гидроксильные группы, такие как гидроксильные группы, этерифицированные органической кислотой, например (низш.)алканоилокси- или гидроксильные группы, этерифицированные неорганической кислотой, в частности галоидные группы, или третичные аминовые группы, такие как три(низш. )алкиламиногруппы, например триметиламиновая, или (низш.)алкиленаминовые, (низш.)азаалкиленаминовые, (низш.)оксиалкиленаминовые или (низш. )тиаалкиленаминовые группы, такие как пирролидиновая, пиперидиновая, морфолиновая и тиоморфолиновая, или соответствующие четвертичные аммониевые группы.
Защита функциональных групп упомянутыми защитными группами, сами защитные группы и реакции их удаления описаны, например, в общеизвестных литературных источниках.
Процесс удаления H-Y4 из соединений формулы IV можно проводить обычным путем. Так, например, воду или низшие алифатические кислоты можно удалять путем азеотропной перегонки, в частности в толуоле, целесообразно в мягких кислых условиях. Галогениды водорода можно удалять в основных условиях, в частности реакцией с алкоголятом щелочного металла, предпочтительно в соответствующем низшем спирте в качестве растворителя или сорастворителя, или выдержкой при повышенной температуре в присутствии третичного амина, такого, как три(низш.)алкиламин.
Исходные материалы для проведения вышеописанных реакций общеизвестны. Новые исходные материалы могут быть получены аналогично методам получения известных исходных материалов.
Соединения формулы I, которые могут быть получены в соответствии с предлагаемым способом, можно превращать в другие соединения формулы I обычным путем. Так, например, свободную карбоксильную группу можно этерифицировать или амидировать и этерифицированную или амидированную карбоксильную группу можно превращать в свободную карбоксильную группу, а этерифицированную карбоксильную группу можно превращать в незамещенную или замещенную карбамоильную группу, свободную аминогруппу можно ацилировать или алкилировать, а свободный гидроксил можно ацилировать.
Соединения формулы I можно окислять по обычным методам, таким как реакция с органической надкислотой, в результате чего образуются соответствующие пиридин-N-оксидные производные.
Соли соединений формулы I можно превращать в свободные соединения по известным методам, например обработкой основанием или кислотой.
По известным же методам образующиеся соли можно превращать в другие соли.
Соединения формулы I, включая их соли, могут также быть получены в форме гидратов или могут содержать растворитель, используемый для кристаллизации.
Вследствие тесной связи между новыми соединениями в свободной форме и в форме их солей в вышеприведенной и следующей частях настоящего описания любую ссылку на свободные соединения и их соли следует рассматривать как относящуюся и к свободным соединениям, и к соответствующим солям.
В соединении формулы I конфигурацию индивидуальных хиральных центров можно селективно реверсировать. Так, например, конфигурацию асимметричных углеродных атомов, которые несут нуклеофильные заместители, такие как амино- и гидроксильные группы, можно реверсировать реакцией нуклеофильного замещения второго порядка, необязательно после перевода присоединенного нуклеофильного заместителя в приемлемую уходящую группу, которая является донором протонов, и реакции с реагентом, вводящим новый заместитель, или конфигурацию углеродных атомов, при которых имеются гидроксильные группы, можно реверсировать окислением и восстановлением аналогично описанию к ЕР-А 0236734.
Изобретение относится также к фармацевтическим композициям, включающим соединения формулы I.
Фармацевтически приемлемые соединения по настоящему изобретению могут быть использованы, например, при приготовлении фармацевтических композиций, которые включают эффективное количество действующего компонента совместно или в смеси со значительным количеством неорганических или органических твердых или жидких фармацевтически приемлемых носителей.
Фармацевтические композиции по изобретению представляют собой композиции для энтерального, такого как интраназальный, ректальный или пероральный, а также для парентерального, такого как внутримышечный или внутривенный, пути введения в организм человека и теплокровных животных, которые содержат эффективную дозу фармакологически действующего компонента индивидуально или совместно со значительным количеством фармацевтически приемлемых носителей. Доза этого действующего компонента зависит от вида теплокровного животного, массы тела, возраста и индивидуального состояния, индивидуальных фармакокинетических данных, заболевания, при котором необходимо лечение, и пути введения в организм.
Фармацевтические композиции включают от приблизительно 1 до приблизительно 95%, предпочтительно от приблизительно 20 до приблизительно 90% действующего компонента. На основе фармацевтических композиций по изобретению можно готовить, например, препараты в дозах на один прием, например, такие как в форме ампул, пузырьков, суппозиториев, драже, таблеток и капсул.
Фармацевтические композиции по настоящему изобретению готовят по методам, которые известны, например путем проведения соответствующего процесса растворения, лиофилизации, смешения, гранулирования или приготовления лекарств на меде или сиропе.
Дозы, предназначенные для введения теплокровным животным или, например, человеку, в частности субъекту с массой тела приблизительно 70 кг, прежде всего дозы, эффективные при расстройствах, вызванных или связанных с нарушением передачи глютаматэргического сигнала, составляют от приблизительно 3 мг до приблизительно 3 г, предпочтительно от приблизительно 10 мг до приблизительно 1 г, например приблизительно по 20-500 мг каждому субъекту в день, в предпочтительном варианте разделенные на равные 1-4 одинарные дозы в препаративной форме одинакового объема. Дети обычно получают около половины дозы взрослого субъекта. Дозу, необходимую для каждого индивидуума, можно проконтролировать, например, определением концентрации в сыворотке действующего компонента и регулированием оптимального уровня.
Ниже изобретение проиллюстрировано на примерах, не ограничивающих его объем. Температура указана в градусах Цельсия, а давление - в миллибарах (мбар).
ПРИМЕР
1
3-[2-(6-метилпиридин-2-ил)винил]бензонитрил
Раствор 4,2 мл (36,28 ммоль) 2,6-диметилпиридина и 4,95 г (37,74 ммоль) 3-цианобензальдегида в 6,85 мл
уксусного ангидрида кипятят с
обратным холодильником в течение 16 ч. Далее под вакуумом выпаривают уксусный ангидрид и остаток очищают хроматографией в колонке (400 г силикагеля). Элюирование в
колонке осуществляют вначале 400 мл
толуола, а затем смесью толуол/этилацетат в соотношении 95:5. Фракции, содержащие целевое соединение, объединяют и упаривают под вакуумом. Твердый остаток
перекристаллизовывают из
метиленхлорида/гексана и выделяют 3,18 г белых кристаллов (температура плавления: 91-92oС).
ПРИМЕР 2
2-[2-(6-метилпиридин-2-ил)винил]бензонитрил
Раствор 5,
8 мл (50 ммоль) 2,6-диметилпиридина и 6,81 г (52 ммоль) 2-цианобензальдегида в 9,5 мл уксусного ангидрида кипятят с обратным
холодильником в течение 16 ч. Далее под вакуумом выпаривают уксусный
ангидрид и остаток очищают хроматографией в колонке (400 г силикагеля). Элюирование в колонке осуществляют вначале 400 мл толуола,
а затем смесью толуол/этилацетат в соотношении 95:5. Фракции,
содержащие целевое соединение, объединяют и упаривают под вакуумом. Твердый остаток перекристаллизовывают из
метиленхлорида/диизопропилового эфира и выделяют белые кристаллы (температура плавления:
113-114oС).
ПРИМЕР 3
2-метил-6-[2-(пиридин-4-ил)винил]пиридин
Раствор 5,8 мл (50 ммоль) 2,6-диметилпиридина и 4,9 мл (52 ммоль) пиридин-4-карбальдегида в
9,5 мл уксусного ангидрида кипятят с обратным холодильником в течение 16 ч. Далее под вакуумом выпаривают
уксусный ангидрид и остаток очищают хроматографией в колонке (900 г силикагеля). Элюирование
в колонке осуществляют вначале 5 л толуола/ацетона в соотношении 4:1, затем 5 л толуола/ацетона в
соотношении 3:1 и в завершение 15 л толуола/ацетона в соотношении 2:1. Фракции, содержащие целевое
соединение, объединяют и упаривают под вакуумом. Твердый остаток перекристаллизовывают из
метиленхлорида/диизопропилового эфира и выделяют 0,956 г белых кристаллов (температура плавления: 72-73oС).
ПРИМЕР 4
2-метил-6-[2-(пиридин-3-ил) винил]пиридина
Раствор 5,8 мл (50 ммоль) 2,6-диметилпиридина и 4,9 мл (52 ммоль) пиридин-3-карбальдегида в 9,5 мл
уксусного ангидрида кипятят с обратным холодильником в течение 10 ч. Далее под вакуумом
выпаривают уксусный ангидрид и остаток очищают хроматографией в колонке (900 г силикагеля). Элюирование в
колонке осуществляют вначале 7 л толуола/ацетона в соотношении 9:1, затем 5 л толуола/ацетона
в соотношении 4:1 и в завершение 5 л толуола/ацетона в соотношении 2: 1. Фракции, содержащие целевое
соединение, объединяют и упаривают под вакуумом. Твердый остаток перекристаллизовывают из
метиленхлорида/диизопропилового эфира и выделяют 4,28 г продукта в виде бесцветного масла, которое
затвердевает при стоянии при 6-8oС.
ПРИМЕР 5
2-[2-(3-бромфенил)этинил]-6-метилпиридин
1,2 г (2,8 ммоль) 2-[1,2-дибром-2-(3-бромфенил)этил]
-6-метилпиридина растворяют в 10 мл этанола. Добавляют 0,9 г (16,1 ммоль) гидроксида калия
(порошкообразного) и образовавшуюся суспензию кипятят с обратным холодильником в течение 4 ч. Далее
суспензию охлаждают до комнатной температуры, выливают в 100 мл рассола и трижды экстрагируют с
использованием каждый раз по 30 мл трет-бутилметилового эфира. Объединенные органические фазы промывают
30 мл рассола, сушат над cульфатом натрия, фильтруют и упаривают под вакуумом. 0,720 г
Указанного в заголовке соединения получают в виде бесцветного масла, которое затвердевает при стоянии
(температура плавления 60-61oС).
Исходный материал может быть получен следующим образом.
а) 2-[2-(3-бромфенил)винил]-6-метилпиридин
Раствор 24 мл
(200 ммоль) 2,6-диметилпиридина и 25,6 мл (207 ммоль) 3-бромбензальдегида в 38 мл уксусного
ангидрида кипятят с обратным холодильником в течение 7,5 ч. Далее под вакуумом выпаривают уксусный ангидрид
и остаток растворяют в 500 мл 4н. соляной кислоты и дважды экстрагируют с использованием
каждый раз по 200 мл гексана. Затем водную фазу четыре раза экстрагируют с использованием каждый раз по 300 мл
трет-бутилметилового эфира. Объединенные органические фазы дважды промывают с
использованием каждый раз по 300 мл насыщенного раствора NаНСО3 в воде, после чего один раз 300 мл рассола,
сушат над сульфатом натрия, фильтруют и упаривают под вакуумом, получая в виде
бесцветных кристаллов 4,2 г указанного в заголовке соединения с температурой плавления 58-59oС.
б) 2-[1,2-дибром-2-(3-бромфенил)этил] -6-метилпиридин
1 г (3,6
ммоль) 2-(3-бромфенилэтинил)-6-метилпиридина растворяют в 5 мл тетрахлорида углерода и раствор нагревают до 55-60oС. По каплям добавляют раствор 0,23 мл (4,4 ммоль) брома (Вr2) в
1 мл тетрахлорида углерода. Реакционную смесь выдерживают при 55-60oС в течение 30 мин, а затем охлаждают
до комнатной температуры. Образовавшийся осадок собирают фильтрованием и сушат под
вакуумом. Таким путем в виде желтых кристаллов выделяют 1,3 г указанного в заголовке соединения с температурой
плавления 164-166oС.
ПРИМЕР 6
3-[2-(6-метилпиридин-2-ил)этинил1 бензонитрил
Смесь 1 г (8,54 ммоль) 2-этинил-6-метилпиридина (полученного аналогично методу,
описанному у D.E. Ames и др., Synthesis, 1981, с. 364-365), 2,3 г
(12,8 ммоль) 3-бромбензонитрила, 0,47 г (0,7 ммоль) бис (трифенилфосфин) палладий (II) хлорида, 80 мг (0,41 ммоль) иодида
одновалентной меди и 1,53 мл (15 ммоль) триэтиламина в 10 мл диметилформамида
в течение 3 ч перемешивают при 90oС. Реакционную смесь охлаждают до комнатной температуры, выливают в воду и
экстрагируют дихлорметаном. Органический слой сушат над сульфатом натрия,
фильтруют, упаривают досуха и остаток очищают хроматографией на силикагеле, используя смесь гексан/этилацетат в соотношении
4:1 в качестве элюента. В результате кристаллизации полученного продукта из
гексана в виде коричневых кристаллов выделяют 0,53 г (выход: 28,4%) указанного в заголовке соединения с температурой
плавления 120-123oС.
ПРИМЕР 7
По методу,
аналогичному описанному в примере 1 (когда Х обозначает алкенилен) или в примере 5 (когда Х обозначает алкинилен), могут
быть получены соединения формулы I; представленные в табл.1.
Типовой пример на фармацевтическую композицию.
В качестве примера фармацевтической композиции представлен
следующий состав таблетки, мг:
Соединение формулы I
- 2-[2-(пиридин-3-ил)этинил]-6-метилпиридин (в форме основания) - 20
Кукурузный крахмал - 125
Лактоза - 25
Гидроксипропилцеллюлоза - 25
Стеарат магния - 5
Общее (на табл.) - 200
20 г соединения формулы I в виде свободного основания добавляют к смеси 125 г кукурузного крахмала,
25 г лактозы и 25 г гидроксипропилцеллюлозы.
Полученную смесь смешивают с 5 г стеарата магния и прессуют в таблетки.
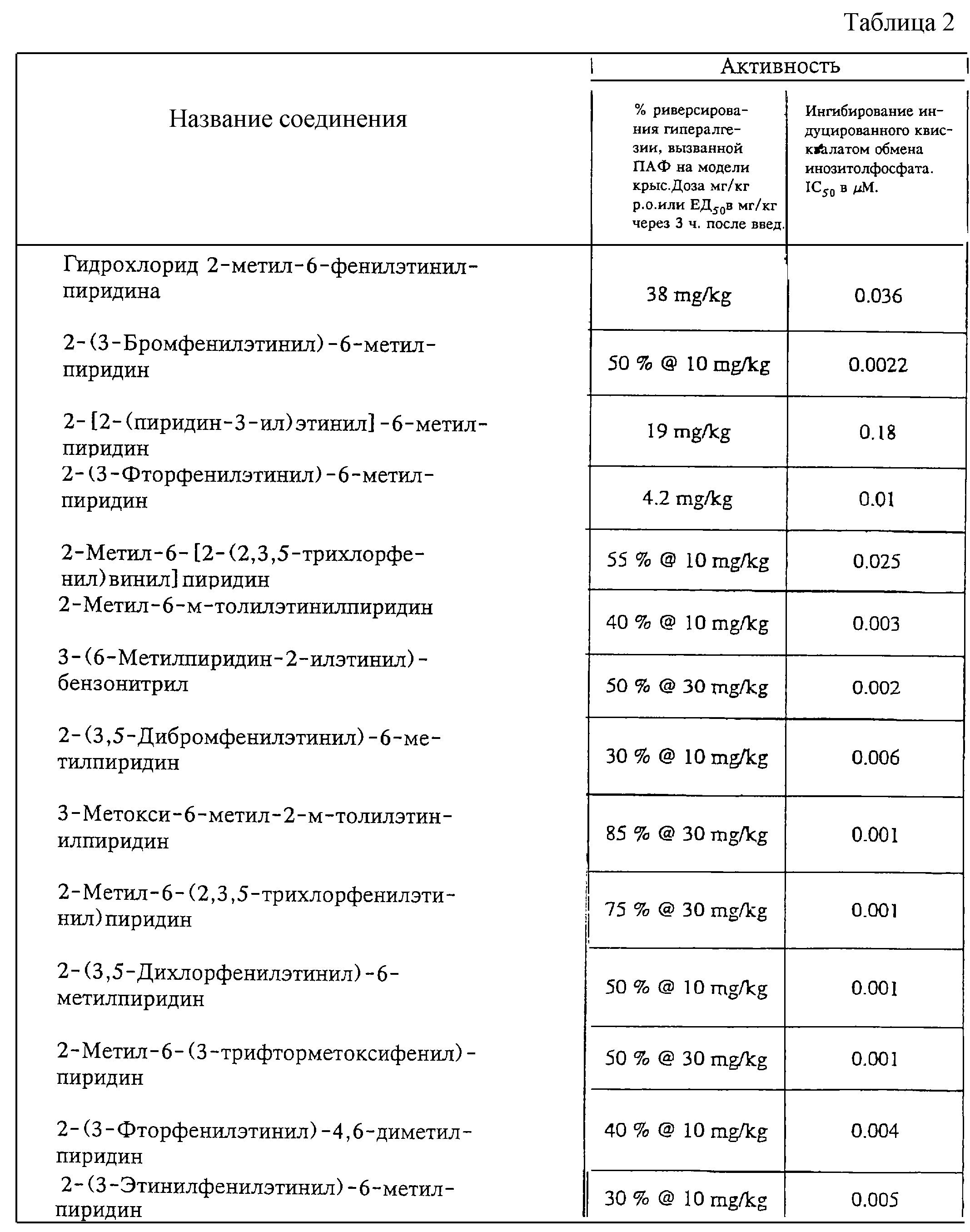
Данные фармакологических исследований в опытах in vivo представлены в табл. 2.
Реферат
Описываются производные пиридина формулы (I), в которой Х - (С2-С4)-алкиниленовая группа, присоединенная посредством соседних ненасыщенных углеродных атомов, R1 - (С1-С4)алкил, (С1-С4) алкокси этинил, (С1-С4) алкоксикарбонил, ди(С1-С4)алкиламиногруппа, R2 - водород, (С1-С4)алкил, гидрокси-(С1-С4)алкил, ди(С1-С4)алкиламинометил, 4-(4-фторбензоил)пиперидин-1-илкарбонил, 1-трет.бутилоксикарбонилпиперазин-1-илкарбонил, 4-(4-азидо-2-гидроксибензоил)-пиперазин-1-илкарбонил, R3 - водород, (С1-С4 )алкил, карбокси, (С1-С4 ) алкоксикарбонил, гидрокси (С1-С4) алкил, ди(С1-С4) алкиламинометил, морфолинокарбонил, 4-(4-фторбензоил)пиперидин-1-илкарбонил, R4 -водород, (С1-С4)алкокси, карбокси, (С2-С5)алканоилокси, (С1-С4) алкоксикарбонил, амино (С1-С4)алкокси, ди(С1 -С4)алкиламино (С1-С4)алкокси, ди(С1-С4)алкиламино (С1 -С4)алкил, (С1-С4)алкоксикарбонил (С1 -С4)алкокси, ди(С1-С4)алкиламино (С1-С4)алкокси, м-гидрокси-n-азидофенил - карбониламино (С1-С4)алкокси, R5 - замещенные фенил или пиридил, в свободной форме или в форме фармацевтически приемлемой соли. Описывается также фармацевтическая композиция на основе указанных соединений. Технический результат - соединения пригодны для применения при лечении расстройств, полностью или частично опосредуемых mGluR5. 3 с. и 3 з.п.ф-лы, 2 табл.
Формула
в которой Х обозначает (С2-С4)алкиниленовую группу, присоединенную посредством соседних ненасыщенных углеродных атомов;
R1 обозначает (С1-С4)алкил, (С1-С4)алкокси, этинил, (С1-С4)алкоксикарбонил, ди(С1-С4 )алкиламиногруппу;
R2 обозначает водород, (С1 -С4)алкил, гидрокси(С1-С4)алкил, ди(С1-С4)алкиламинометил, 4-(4-фторбензоил)пиперидин-1-илкарбонил, 4-трет-бутилоксикарбонилпиперазин-1-илкарбонил, 4-(4-азидо2-гидроксибензоил)пиперазин-1-илкарбонил;
R3 обозначает водород, (С1 -С4)алкил, карбокси, (С1-С4)алкоксикарбонил, гидрокси(С1-С4)алкил, ди(С1-С4)алкиламинометил, морфолинокарбонил или 4-(4-фторбензоил)пиперидин-1-илкарбонил;
R4 обозначает водород, (С1-С4)алкокси, карбокси, (С2-С5)алканоилокси, (С1-С4)алкоксикарбонил, амино(С1 -С4)алкокси, ди(С1-С4)алкиламино(С1-С4)алкокси, ди(С1-С4)алкиламино(С1-С4)алкил,
(С1-С4)алкоксикарбонил(С1-С4)алкокси, ди(С1-С4)алкиламино(С1-С4)алкокси или м-гидрокси-п-азидофенилкарбониламино(С1-С4)алкокси и
R5 обозначает группы формулы
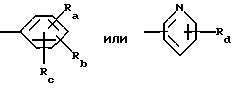
где Ra и Rb каждый независимо друг от друга обозначает водород, гидроксил, галоген, нитро-, цианогруппу, (С1-С4 )алкил, (С1-С4)алкокси, гидрокси(С1-С4)алкил, (С1-С4)алкоксикарбонил, (С2-С7)алканоил, (С2-С5)алканоилокси, (С2-С5 )алканоилокси(С1-С4)алкил, трифторметил, трифторметокси, (С2-С5)алкинил, амино-, азидо-, амино(С1-С4)алкокси, тиенилкарбониламиногруппу, бензилкарбониламиногруппу или(С1-С4)алкилсульфонил;
Rc обозначает водород, фтор, бром, хлор, гидроксил, (С1-С4 )алкил;
Rd обозначает водород, галоген или (С1-С4)алкил,
при условии, что у соединений, у которых R2, R3 и R4 обозначают водородные атомы, когда R1 обозначает метил, значения R5 отличны от фенила, 3-метилфенила, 6-метилпиридин-2-ила и 3-метоксифенила, в свободной форме или в форме фармацевтически приемлемой соли.

Комментарии