Наночастица (варианты), ее содержащая композиция, включающий названную композицию продукт питания и способ получения наночастиц (варианты) - RU2552957C2
Код документа: RU2552957C2
Чертежи
















Описание
Область техники, к которой относится изобретение
Настоящее изобретение используют в пищевой, фармацевтической и косметической отраслях и в области нанотехнологии, и оно состоит из инкапсуляции биологически активных соединений с использованием казеина в качестве покрывающего вещества.
Уровень техники
Пищевая промышленность нуждается в технологическом развитии, чтобы соответствовать новым запросам потребителей. Нанотехнология представляет большие возможности для коренной перестройки пищевой промышленности, поскольку посредством данной технологии возможно инкапсулировать биологические активные соединения (БАС), например, вкусовые добавки, витамины, минералы, эфирные масла, антиоксиданты, пребиотики и т.п., с целью получения многочисленных преимуществ, например, с целью увеличения периода хранения продукта, уменьшения количества используемых БАС, контроля из высвобождения, повышения их биодоступности, маскировки нежелательных вкусов и т.п.
При разработке носителя, подходящего для инкапсуляции БАС, очень важно правильно выбрать материал, используемый в качестве покрывающего вещества или матрицы, в этом плане должны быть приняты во внимание лекарственная форма, ее токсичность, продукт (продукт питания, косметический, фармацевтический продукт и т.п.), в который будет введен препарат, и т.п. в числе других факторов. В области нанотехнологии пищевых продуктов не рекомендуется использовать синтетические полимеры, поскольку они могут нести проблемы токсичности. Природные полимеры не имеют данных недостатков, однако их использование предполагает разработку более сложных способов получения частиц, более того, в большинстве случаев размер полученных частиц (превышающий 100 мкм в большинстве случаев) сложно контролировать, вследствие этого данные наночастицы могут быть замечены потребителем и изменить органолептические свойства целевого пищевого продукта.
Белки входят в материалы, традиционно используемые в качестве веществ для покрытия БАС. Описано использование казеина как носителя для инкапсуляции гидрофобных БАС, предназначенных для использования в пищевых продуктах (см. СА 2649788 и ЕР 2011472).
Фолиевая кислота (птероилмоноглутаминовая кислота или витамин В9), водорастворимый витамин группы В, входящий в группу фолатов, является основным в важных биохимических процессах, таких как синтез ДНК. Ее недостаток ассоциирован с наличием мегалобластной анемии, болезни Альцгеймера, синдрома Дауна, гуморальных нарушений, некоторых типов рака (раком толстой кишки, раком шейки матки, лейкозом, раком поджелудочной железы), дефектов нервных трубок, появляющихся в процессе развития плода, осложнений во время беременности и мужского бесплодия. Однако она не может быть синтезирована организмом, поэтому должна вводиться с помощью различных добавок или диеты.
Хотя фолаты по природе присутствуют в продуктах питания (например, фруктах и овощах), в основном в форме полиглутаматов, их биодоступность, как правило, 50% или меньше, является неполной. Вследствие этого употребление продуктов питания, обогащенных фолиевой кислотой, может создавать дополнительную возможность повышения потребления указанного витамина в тех случаях, когда потребление фолатов ниже, чем рекомендуется. Тем не менее, биодоступность фолиевой кислоты, добавляемой в продукты питания, является неполной вследствие (в числе других причин) эффекта матрицы (фолиевая кислота может быть связана с компонентом продукта питания, что, таким образом, препятствует ее всасыванию) или присутствия какого-либо компонента в продукте питания, который снижает ее биодоступность. Кроме того, фолиевая кислота не очень хорошо всасывается, если она не солюбилизирована, в кишке. Недостатком добавок или витаминизированных препаратов с фолиевой кислотой, которые вводят с помощью капсул, таблеток и т.п., является то, что они распадаются в желудке под действием желудочных кислот, фолиевая кислота осаждается, превращаясь в свою менее растворимую форму, при этом только часть введенной фолиевой кислоты достигает кишки.
Кроме того, витаминизация продуктов питания фолатами или фолиевой кислотой представляет собой сложный процесс, поскольку как фолаты, так и их производные, а также фолиевая кислота чувствительны в числе прочих факторов к изменениям температуры, освещения или рН, вследствие этого существует риск нарушения их стабильности в условиях обработки продукта питания, и биоактивное количество витамина, необходимое потребителю, может значительно уменьшиться. Таким образом при витаминизации продуктов питания данным витамином необходимо принимать во внимание указанные аспекты, поскольку самые большие потери могут происходить во время хранения и приготовления продуктов питания.
Описано обогащение продуктов питания фолиевой кислотой, в основном молочных и зерновых продуктов. Описаны также пищевые добавки (ЕР 2002839) или продукты питания, обогащенные фолиевой кислотой или фолатами, такие как колбасный фарш (ES 2302571), молочные продукты (ЕР 1941804), детское питание (US 4753926) или даже консервы на основе куриного мяса, свинины или говядины (RU 2223672 и RU 2213493). Однако в описанных случаях не рассматривают ни возможные взаимодействия витамина с матрицей пищевого продукта, ни его биодоступность.
Описан также способ получения альгинатных или пектиновых микрокапсул, содержащих фолиевую кислоту, для ее защиты от факторов окружающей среды, которые приводят к ее разложению, таких как условия в желудке, с достижением ее высвобождения в кишке. Однако полученные микрокапсулы слишком большие, что влияет на органолептические свойства целевого продукта питания. Кроме того, разработан способ инкапсуляции фолиевой кислоты в наносферах из поли(молочной-согликолевой кислоты) (PLGA) и достижения ее замедленного высвобождения, хотя результаты положительны, их введение в продукты питания опасно вследствие использования данного полимера, поэтому оно ограничено областями медицины и фармации.
Вследствие этого существует необходимость создания систем инкапсуляции БАС, предпочтительно водорастворимых, более предпочтительно кислых водорастворимых БАС, например, фолиевой кислоты, которые полностью или частично преодолевают вышеупомянутые недостатки.
Раскрытие изобретения
В настоящее время неожиданно обнаружено, что наночастицы, сформированные из казеина, кроме того, содержащие основную аминокислоту (например, аргинин или лизин) и металл, подходящий для продуктов питания (например, кальций), образуют новую инкапсулирующую и стабилизирующую систему для биологически активных соединений (БАС), которые являются как водо-, так и жирорастворимыми, предпочтительно водорастворимыми, более предпочтительно кислыми водорастворимыми БАС, предназначенную для их использования в продуктах питания, косметических и фармацевтических продуктах.
Вследствие этого в одном аспекте изобретение относится к наночастицам, содержащим казеиновую матрицу, основную аминокислоту и металл, пригодный для использования в продуктах питания, выбранный из двухвалентного металла, трехвалентного металла и их комбинаций. Указанные наночастицы можно использовать в качестве технологических добавок, кроме того, они обладают способностью к инкапсуляции БАС, предпочтительно водорастворимого БАС, более предпочтительно кислого водорастворимого БАС, такого как, например, витамин группы В или С, такой как фолиевая кислота, пантотеновая кислота и аскорбиновая кислота или другие гидрофильные соединения, хотя они могут также включать жирорастворимое БАС.
Указанные наночастицы стабильны и способны защищать БАС от разложения внешними факторами, например, светом, изменениями рН, окислением и т.п., как во время обработки продукта (например, продукта питания, фармацевтического или косметического продукта), так и во время хранения, и, кроме того, когда их используют в продуктах питания, они защищают БАС от кислых условий желудка, препятствуя его высвобождению в желудочном тракте, позволяя, таким образом, избежать его осаждения и, вследствие этого, избежать пониженной биодоступности. Более того, обнаружено, что указанные наночастицы способны растворяться в (искусственной) кишечной среде, способствуя полному высвобождению БАС в кишке для соответствующего всасывания и, кроме того, позволяя избежать проблем токсичности любого типа. Указанные наночастицы преимущественно инертны в продукте питания, в который они введены, позволяя, таким образом, БАС избежать реакции с различными компонентами матрицы и снижения его биодоступности.
Кроме того, одно из важных свойств наночастиц, предусматриваемых данным изобретением, заключается в использовании казеина в качестве природного носителя для защиты БАС как от условий окружающей среды, так и условий в желудке, способствуя его высвобождению в кишке и повышая, таким образом, биодоступность, поскольку казеин сам по себе демонстрирует питательные свойства, так что он дополняет положительные эффекты самого БАС.
В другом аспекте изобретение относится к способу получения указанных наночастиц. Данный способ прост и применим в промышленном масштабе. В основном данный способ не предусматривает синтетические или реакционные полимеры, которые не одобрены в качестве пищевых добавок, минимизируя включение поверхностно-активных веществ или эмульгаторов, и он дает возможность получения наночастиц в нанометрическом масштабе с контролируемым размером частиц.
В конкретном варианте осуществления указанный способ, кроме того, предусматривает сушку суспензии, содержащей указанные наночастицы, с целью получения препарата в форме порошка, сохраняющего БАС стабильным в течение времени, данный тип порошкового препарата особенно подходит для его использования в твердых продуктах питания. В основном указанную высушивающую обработку проводят в присутствии вещества, защищающего наночастицы. Наночастицы, содержащие БАС, полученные таким образом, легко можно суспендировать в водной среде, защищая БАС от разложения в растворе. Полученный конечный продукт стабилен и защищает БАС в течение длительных периодов хранения и, кроме того, подходит для различных типов продуктов питания, как жидкостей (например, напитков и т.п.), так и твердых продуктов.
В другом аспекте изобретение относится к композициям, содержащим указанные наночастицы, предназначенным для их применения в пищевой, фармацевтической или косметической отраслях. В действительности указанные наночастицы можно ввести в кремы, гели и гидрогели с целью получения стабильных косметических препаратов, подходящих для применения в данной области. Указанные наночастицы можно также получить с наполнителями, подходящими для применения указанных наночастиц местно.
В другом аспекте изобретение относится к продукту питания, содержащему указанную композицию на основе казеиновых наночастиц, предусматриваемых данным изобретением. В конкретном варианте осуществления указанный продукт питания находится в жидкой, полутвердой или твердой форме.
Краткое описание чертежей
На Фигуре 1 представляют схематическое изображение конкретного варианта осуществления способа, соответствующего изобретению, используемого для получения казеиновых наночастиц, содержащих фолиевую кислоту.
На Фигурах 2 и 3 представляют изображения ненагруженных казеиновых наночастиц, полученные с помощью трансмиссионной электронной микроскопии (ТЕМ). Черная полоса, расположенная на нижней левой границе изображений, соответствует эталону 100 нм.
На Фигурах 4 и 5 представляют изображения казеиновых наночастиц, содержащих фолиевую кислоту, полученные с помощью трансмиссионной электронной микроскопии (ТЕМ). Черная полоса, расположенная на нижней левой границе изображений, соответствует эталону 100 нм.
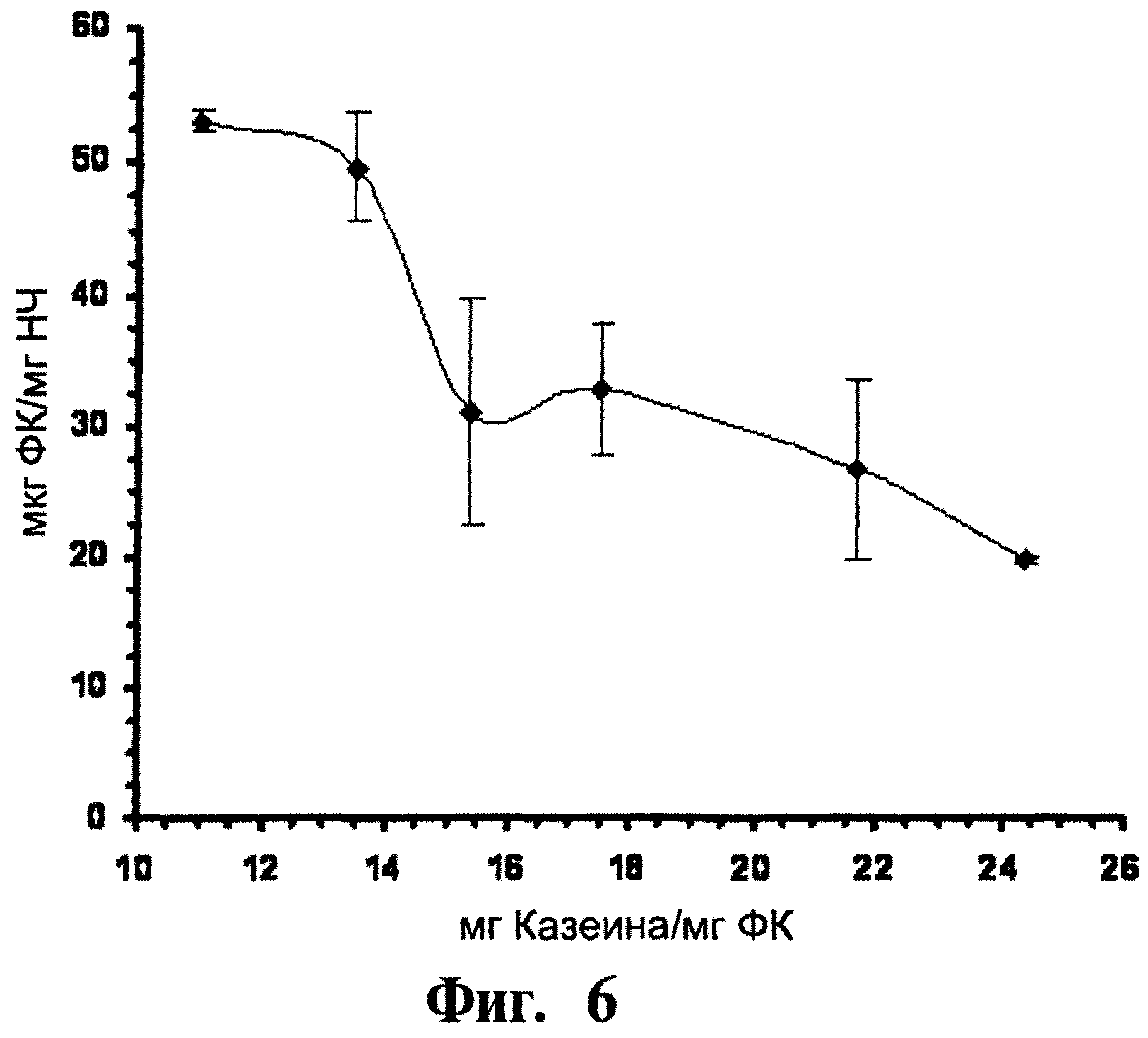
На Фигуре 6 представляют соотношение количества инкапсулированной фолиевой кислоты и количества казеина на каждый мг фолиевой кислоты, добавленной в препарат. Во всех препаратах соотношение масс лизина и белка перед добавлением раствора фолиевой кислоты составляет 1:12.
На Фигурах 7-11 представляют полученные с помощью сканирующей электронной микроскопии (SEM) микрофотографии казеиновых наночастиц, содержащих фолиевую кислоту и имеющих в своем составе лизин, без обработки высоким давлением (Фиг.7 и 8), с обработкой при 100 МПа, 5 минут (Фиг.9), с обработкой при 400 мПа, 5 минут (Фиг.10) и с обработкой при 800 МПа, 5 минут (Фиг.11).
На Фигуре 12 представляют полученные с помощью сканирующей электронной микроскопии (SEM) микрофотографии казеиновых наночастиц, содержащих фолиевую кислоту и имеющих в своем составе аргинин с обработкой при 400 МПа, 5 минут.
На Фигуре 13 представляют высвобождение фолиевой кислоты из казеиновых наночастиц без обработки высоким давлением после их инкубирования в искусственной желудочной жидкости (SGF) (в течение первых 2 часов: 0-2 час) и искусственной кишечной жидкости (SIF) (2 - 24 час) при 37±1°С. Данные означают среднее - стандартное отклонение (n=6).
На Фигурах 14 и 15 представляют высвобождение фолиевой кислоты из казеиновых наночастиц с обработкой высоким давлением (Фиг.14) 150 МПа, 5 минут и (Фиг.15) 400 МПа, 5 минут) после их инкубирования в искусственной желудочной жидкости (SGF) (в течение первых 2 часов: 0-2 час) и искусственной кишечной жидкости (SIF) (2-8 час) при 37±1°С. Данные означают среднее - стандартное отклонение (n=4).
На Фигурах 16 и 17 представляют сывороточную концентрацию фолиевой кислоты (нг/мл) как функцию времени после введения различных препаратов витаминов лабораторным животным. Результаты показывают как среднее - стандартное отклонение (n=5).
Внутривенный путь, доза 1 мг/кг (Фиг.16).
Пероральный путь, доза 1 мг/кг (Фиг.17): неинкапсулированная фолиевая кислота, растворенная в воде (•); фолиевая кислота, инкапсулированная в казеиновых наночастицах, диспергированных в воде (■); фолиевая кислота инкапсулированная в казеиновых наночастицах, обработанных высоким давлением, диспергированных в воде (▲). Осуществление изобретения
Настоящее изобретение предусматривает казеиновые наночастицы и способы инкапсуляции биологически активных соединений (БАС) с целью предохранения их от разложения под действием внешних факторов, таких как свет, изменение рН, окисление и т.п.
Определения
С целью облегчения понимания настоящего изобретения значение некоторых терминов и выражений, как используют в контексте изобретения, приведено ниже.
Как описано в данном контексте, термин "основная аминокислота" включает лизин, аргинин и гистидин.
Как описано в данном контексте, термин "казеин" относится к конъюгированному белку, составляющему приблизительно 80% всех белков молока. Он представляет собой белок фосфопротеинового типа, который входит в определение глобулинов, он растворим, имеет высокую способность влагоудержания и осаждается приблизительно при рН 4,6 при 20°С. Он сформирован четырьмя основными фракциями (αs1-казеин, (αs2-казеин, β-казеин и κ-казеин), отличающимися друг от друга композициями аминокислот, распределением заряда и тенденцией к образованию агрегатов в присутствии кальция. В молоке казеины формируют большие коллоидные частицы диаметром от 50 до 600 нм (в среднем приблизительно 150 нм), называемые "казеиновыми мицеллами". Данные частицы формируют посредством гидрофобных взаимодействий и комплексированием фосфата кальция с фосфосериновыми радикалами, присутствующими в структуре казеина. Данные мицеллы образуют очень стабильную коллоидную систему в молоке, являясь одной из основных причин его цвета, термостабильности и коагуляции реннином.
Как описано в данном контексте, термин "биологически активное соединение" или "БАС" относится к любому жиро- и водорастворимому соединению, обладающему питательной, лечебной и/или косметической активностью. Неограничивающие иллюстративные примеры БАС, соответствующие настоящему изобретению, включают аминокислоты, антимикробные препараты, ароматизаторы, консерванты, подсластители, стероиды, лекарственные препараты, гормоны, липиды, пептиды, полинуклеотиды, полисахариды, белки, протеогликаны, вкусовые добавки, витамины и т.п.
Как описано в данном контексте, термин "водорастворимое биологически активное соединение" или "водорастворимое БАС" относится к соединению, обладающему питательной, лечебной и/или косметической активностью, которое растворимо (хорошорастворимо, легкорастворимо, растворимо, труднорастворимо или малорастворимо) в водном растворе согласно критериям, определенным в Королевской Испанской фармакопее:
Неограничивающие иллюстративные примеры водорастворимых БАС включают витамины, например, витамины из групп В или С и их производные, соли или сложные эфиры, гиалуроновую кислоту, хондроитинсульфат, тиоктовую (липоевую) кислоту, их соли или сложные эфиры и т.п. В конкретном варианте осуществления указанное водорастворимое БАС выбрано из группы, состоящей из фолиевой кислоты, 4-аминобензойной кислоты, ниацина, пантотеновой кислоты, тиаминмонофосфата, тиаминпирофосфата, тиаминтрифосфата, аскорбиновой кислоты, птероилполиглутаминовых кислот (производных фолиевой кислоты: фолатполиглутаматов, полиглутаматфолатов), фолиновой кислоты, никотиновой кислоты, гиалуроновой кислоты, тиоктовой кислоты (альфа-липоевой кислоты), п-кумаровой кислоты, кофеиновой кислоты, их фармацевтически или косметически приемлемых или пищевого качества производных, сложных эфиров или солей или их смесей.
Как описано в данном контексте, термин "жирорастворимое биологически активное соединение" или "жирорастворимое БАС" относится к соединению, обладающему питательной, лечебной и/или косметической активностью и которое растворимо (хорошорастворимо, легкорастворимо, растворимо, труднорастворимо или малорастворимо) в жирах и маслах согласно критериям, определенным в Королевской Испанской фармакопее. Неограничивающие иллюстративные примеры жирорастворимых БАС включают витамины, например, витамины из групп A, D, Е, K и их производные, фосфолипиды, каротиноиды (каротины, ликопен, лютеин, капсантин, зеаксантин и т.п.), омега-3 жирные кислоты (докозагексаеновую кислоту (ДГК), эйкозапентаеновую кислоту (ЭПК), и т.п.), фитостанолы и фитостеролы (ситостерол, кампестерол, стигмастерол и т.п.), полифенолы (кверцетин, рутин, ресвератрол, кемпферол, мирицетин, изорамнетин и т.п.) и их производные.
Говорят, что продукт имеет "пищевое качество", когда его использование в пище человека или животного безопасно в соответствии с продовольственным стандартом страны или организации, например, дочерней Организации по вопросам продовольствия и сельского хозяйства (ПСК) Организации Объединенных Наций (ООН) или Всемирной Организации здравоохранения (ВОЗ); следовательно, продукт "пищевого качества" представляет собой нетоксичный продукт "пригодный для использования в продуктах питания", и поэтому оба выражения являются синонимами и их взаимозаменяемо используют в данном описании.
Как описано в данном контексте, термин "двухвалентный металл" включает любой элемент металл, валентность которого 2, например, щелочноземельный металл, например, кальций, магний, цинк и т.п., или, если он имеет несколько валентностей, одна из них 2, например, железо, и т.п., при условии, что он фармацевтически или косметически приемлем или пригоден для использования в продуктах питания.
Как описано в данном контексте, "трехвалентный металл" включает любой элемент металл, валентность которого 3, или, если он имеет несколько валентностей, одна из них 3, например, железо, и т.п., при условии, что он фармацевтически или косметически приемлем или пригоден для использования в продуктах питания.
Как описано в данном контексте, термин "наночастица" относится к коллоидным системам сферического типа или аналогичной формы с размером меньше чем 1 микрометр (мкм), предпочтительно порядка величины 10-900 нанометров (нм).
Как описано в данном контексте, термин "средний размер" относится к среднему диаметру популяции наночастиц, которые совместно передвигаются в водной среде. Средний размер данных систем можно измерить стандартными способами, известными компетентному специалисту в области техники и описанными, например, в экспериментальной части (см. ниже). Наночастицы, соответствующие изобретению, характеризуются тем, что имеют средний размер частиц меньше чем 1 мкм, как правило, находящийся в интервале от 1 до 999 нм, предпочтительно от 10 до 900 нм, более предпочтительно от 50 до 500 нм, еще более предпочтительно от 100 до 200 нм. В конкретном варианте осуществления наночастицы, соответствующие изобретению, имеют средний размер частиц, находящийся в интервале от 50 до 200 нм, предпочтительно приблизительно 140 нм.
Наночастицы
В одном аспекте изобретение относится к наночастице, далее называемой наночастица, соответствующая изобретению, содержащей казеиновую матрицу, основную аминокислоту и металл, выбранный из двухвалентного металла, трехвалентного металла и их комбинаций.
В конкретном варианте осуществления указанная основная аминокислота выбрана из группы, состоящей из аргинина, лизина, гистидина и их смесей.
В другом конкретном варианте осуществления предпочтительно, когда указанный металл представляет собой двухвалентный металл пищевого качества, выбранный из группы, состоящей из кальция, магния, цинка, железа (в двухвалентной форме) и их комбинаций.
В другом конкретном варианте осуществления указанный металл представляет собой трехвалентный металл пищевого качества, такой как, например, железо в трехвалентной форме.
Наночастицы, соответствующие изобретению, можно использовать в качестве технологических добавок, например, в качестве заменителей жиров, и т.п. Наночастицы, соответствующие изобретению, кроме того, обладают способностью к инкапсуляции биологически активного соединения (БАС).
Так, в другом конкретном варианте осуществления, наночастица, соответствующая изобретению, кроме того, содержит биологически активное соединение (БАС). Указанное БАС может представлять собой водорастворимое БАС или жирорастворимое БАС; в данном случае наночастицу, соответствующую изобретению, иногда определяют в данном описании как "нагруженную наночастицу, соответствующую изобретению".
В конкретном варианте осуществления указанное БАС представляет собой водорастворимое БАС, предпочтительно кислое водорастворимое БАС. В более конкретном варианте осуществления указанное водорастворимое БАС выбрано из группы, состоящей из:
a) витамина из группы В или С;
b) производного витамина, соответствующего а);
c) соединения, выбранного из гиалуроновой кислоты, хондроитинсульфата и тиоктовой кислоты;
а) соли или сложного эфира любого из вышеупомянутых соединений а)-с) и
е) их комбинаций.
В специальном варианте осуществления указанное водорастворимое БАС выбрано из группы, состоящей из фолиевой кислоты, 4-аминобензойной кислоты, ниацина или витамина ВЗ, пантотеновой кислоты или витамина В5, тиаминмонофосфата, тиаминпирофосфата, тиаминтрифосфата, аскорбиновой кислоты, птероилполиглутаминовых кислот (производных фолиевой кислоты:
фолатполиглутаматов, полиглутаматфолатов), фолиновой кислоты, никотиновой кислоты, гиалуроновой кислоты, тиоктовой кислоты или альфа-липоевой кислоты, п-кумаровой кислоты, кофеиновой кислоты, их фармацевтически или косметически приемлемых или пищевого качества производных, сложных эфиров или солей или их смесей.
В специальном варианте осуществления указанное БАС представляет собой кислое водорастворимое БАС, такое как фолиевая кислота, пантотеновая кислота, аскорбиновая кислота и т.п.
Не желая быть связанными какой-либо теорией, считают, что в присутствии металла, такого как двухвалентный металл (например, кальций), α- и β-казеины агрегируются вследствие своей гидрофильности, и происходит потеря поверхностного заряда, когда радикалы фосфосерина, находящиеся на их поверхности, связываются с катионной частью. Водорастворимое БАС, предпочтительно кислое (например, фолиевая кислота), также электростатически взаимодействует с указанным металлом, поэтому оно будет захватываться гидрофобной матрицей, генерируемой данными типами казеина. κ-Казеин, в свою очередь, не реагирует с металлом (например, кальцием), поэтому он связан своей гидрофобной частью с частицей, причем его водорастворимая фракция контактирует с внешней водной средой. Указанная водорастворимая фракция имеет в дополнение к высокой доле карбонильных групп (кислотные группы аминокислот, таких как глутаминовая или аспарагиновая кислота), полярные группы, соответствующие серильным и треонильным остаткам, связанным с три- и тетрасахаридами. Таким образом, считают, что после формирования наночастиц основная аминокислота (например, лизин), находящаяся в растворе, будет связана с поверхностью данных наночастиц вследствие электростатического взаимодействия [например, это могут быть ковалентные связи после обработки нагреванием во время их прохождения через распылительную сушку (когда требуется)] с карбоксильными группами указанной фракции. На Фигуре 1 представляют схематическое изображение нагруженных наночастиц, соответствующих настоящему изобретению, содержащих казеиновую матрицу, лизин (основная аминокислота) и кальций (двухвалентный металл).
В другом специальном варианте осуществления указанное БАС представляет собой жирорастворимое БАС, хотя в данном случае будет необходимым сформировать предпочтительно однородную суспензию БАС в водной среде или, более предпочтительно, растворить БАС в органическом растворителе, медленно добавляя указанную водную суспензию или указанный органический раствор в раствор, содержащий источник казеина (например, казеинат), и инкубировать смесь.
Механизм захвата будет отличаться от того, что описан для водорастворимого БАС, поскольку жирорастворимое БАС будет захватываться во внутренней гидрофобной части наночастиц вследствие аффинности между обоими фракциями независимо от того, обладают ли они или не обладают способностью взаимодействовать с (двухвалентным или трехвалентным) металлом.
В конкретном варианте осуществления указанное БАС представляет собой жирорастворимое БАС, выбранное из витаминов, например, витаминов из групп A, D, Е, K и их производных, фосфолипидов, каротиноидов (каротинов, ликопена, лютеина, капсантина, зеаксантина и т.п.), омега-3 жирных кислот (например, DHA, EPA и т.п.), аминокислот (например, изолейцина, лейцина, метионина, фенилаланина, триптофана и валина), фитостанолов и фитостеринов (например, ситостерина, кампестерина, стигмастерина и т.п.), полифенолов (например, кверцетина, рутина, ресвератрола, кампферола, мирицетина, изорамнетина и т.п.) и их производных.
Массовое соотношение БАС:казеин в нагруженной наночастице, соответствующей изобретению, может варьировать в широком интервале, в неограничивающем иллюстративном примере массовое соотношение БАС: казеин в нагруженной наночастице, соответствующей изобретению, может составлять от 1:1 до 1:200, предпочтительно от 1:10 до 1:80, более предпочтительно от приблизительно 1:15 до 1:35. В конкретном варианте осуществления БАС представляет собой водорастворимое БАС и массовое соотношение (водорастворимого) БАС:казеин в нагруженной наночастице, соответствующей изобретению, составляет от 1:1 до 1:50, предпочтительно от 1:10 до 1:30, более предпочтительно от приблизительно 1:15 до 1:20. В другом конкретном варианте осуществления БАС представляет собой жирорастворимое БАС, и массовое соотношение (жирорастворимый) БАС:казеин в нагруженной наночастице, соответствующей изобретению, составляет от 1:1 до 1:200, предпочтительно от 1:10 до 1:80, более предпочтительно от приблизительно 1:20 до 1:35.
Кроме того, если необходимо, в состав наночастиц, соответствующих изобретению, как тех, которые нагружены БАС, так и тех, которые не нагружены, может быть включен антиоксидант, например, аскорбиновая кислота (витамин С), и т.п., с целью повышения их стабильности в плане температуры и окисления. В конкретном варианте осуществления БАС представляет собой фолиевую кислоту и антиоксидант представляет собой аскорбиновую кислоту, действие которой, по-видимому, заключается в защите фолиевой кислоты от разложения при воздействии ультрафиолетового облучения, изменения рН, нагревания, кислорода и т.п., и, кроме того, обеспечивает питательную поддержку аскорбиновой кислоты. Данный антиоксидант может быть соинкапсулирован с БАС или введен в покрытие наночастиц, соответствующих изобретению.
Способ получения наночастиц
В другом аспекте изобретение относится к способу получения наночастиц, содержащих казеиновую матрицу, основную аминокислоту и металл, выбранный из двухвалентного металла, трехвалентного металла и их комбинаций (наночастицы, соответствующие изобретению), далее "способ [1], соответствующий изобретению", который предусматривает:
a) получение водного раствора, содержащего источник казеина и основную аминокислоту, и
b) добавление водного раствора металла, выбранного из двухвалентного металла, трехвалентного металла и их комбинаций, к раствору, полученному на стадии а).
В другом аспекте изобретение также относится к способу получения наночастицы, содержащей казеиновую матрицу, основную аминокислоту, металл, выбранный из двухвалентного металла, трехвалентного металла и их комбинаций, и биологически активное соединение (нагруженные наночастицы, соответствующие изобретению), далее "способ [2], соответствующий изобретению", который предусматривает:
a) смешивание (i) водного раствора, содержащего источник казеина и первую основную аминокислоту, с (ii) раствором, содержащим биологически активное соединение, и
b) добавление водного раствора металла, выбранного из двухвалентного металла, трехвалентного металла и их комбинаций, к смеси, полученной на стадии а).
На стадии а) способа [1], соответствующего изобретению, водный раствор, содержащий источник казеина и основную аминокислоту, получают принятыми способами, известными компетентным специалистам в области техники, например, путем добавления указанного источника казеина и основной аминокислоты к водной среде.
На стадии а) способа [2], соответствующего изобретению, водный раствор (i), содержащий источник казеина и основную аминокислоту, смешивают с раствором (ii), содержащим БАС. Природа и композиция указанного раствора (ii), содержащего БАС, может варьировать в зависимости от типа и природы БАС. Так, в конкретном варианте осуществления, когда БАС представляет собой водорастворимое БАС, указанный раствор (ii), содержащий БАС, представляет собой водный раствор; в другом конкретном варианте осуществления, когда БАС представляет собой кислое водорастворимое БАС, указанный раствор (ii), содержащий БАС, представляет собой водный раствор, содержащий, кроме того, вторую основную аминокислоту, и в другом конкретном варианте осуществления, когда БАС представляет собой жирорастворимое БАС, указанный раствор (ii), содержащий БАС, представляет собой его суспензию в водной среде или, предпочтительно, органический раствор, более предпочтительно
органический раствор смешивающегося с водой растворителя, такого как, например, этанол.
Казеин, который можно использовать для практической реализации обоих способов [способов [1] и [2], соответствующих изобретению], может происходить из практически любого источника казеина, например, молока, бобов и т.п. Казеин можно обнаружить в указанном растворе в форме кислого казеина или казеината. В конкретном варианте осуществления указанный источник казеина содержит казеин в форме казеината, предпочтительно казеината натрия. Хотя можно также использовать казеинат кальция и фосфокальция, они меньше подходят на практике, поскольку кальций используют для формирования наночастиц после смешивания казеината с активным ингредиентом, вследствие этого, если раствор казеината уже содержит кальций в среде, практическая реализация способа может быть сильно нарушена.
Количество казеина, которое может содержаться в водном растворе, образованном на стадии а) способа [1], соответствующего изобретению, а также в водном растворе (i) [содержащем источник казеина и первую основную аминокислоту], используемом на стадии а) способа [2], соответствующего изобретению, может варьировать в широких пределах;
однако в конкретном варианте осуществления количество казеина, содержащегося в указанном водном растворе, составляет от 0,1% до 10% (масс./об.), предпочтительно от 0,5% до 5%, более предпочтительно от 1% до 3%.
Основная аминокислота вносит вклад в растворение казеина и, при необходимости, БАС, особенно кислых водорастворимых БАС, поэтому она играет очень важную роль в получении БАС, которые нагружены наночастицами, соответствующими изобретению, и БАС, которые не нагружены. В действительности, по-видимому, при повышении рН раствора основная аминокислота дает возможность растворяться казеинату без необходимости использовать неорганические соли, и, кроме того, она действует как основа для сохранения гидрофильных концов каппа (κ)-фракций казеина в анионной форме, так что частицы с отрицательным поверхностным зарядом поддерживаются в суспензии и не агрегируются вследствие электростатического отталкивания.
Основная аминокислота, которую можно использовать для практической реализации обоих способов [способы [1] и [2], соответствующие изобретению], выбрана из группы, состоящей из аргинина, лизина, гистидина и их смесей, предпочтительно из аргинина, лизина и их смесей. Основная аминокислота, которая может быть внутри или снаружи наночастиц, соответствующих изобретению, играет существенную технологическую роль, поскольку она способствует растворению компонентов перед формированием наночастиц, и она поддерживает подходящий рН после их получения на обеих сторонах наночастиц (внутри и снаружи). В качестве иллюстрации, фолиевая кислота малорастворима в воде, но легкорастворима в слабощелочном водном растворе, поэтому присутствие основной аминокислоты способствует растворению фолиевой кислоты.
В конкретном варианте осуществления способа [2], соответствующего изобретению, когда БАС представляет собой кислое водорастворимое БАС, указанный раствор (ii), содержащий БАС, представляет собой водный раствор, содержащий, кроме того, вторую основную аминокислоту (для предупреждения осаждения БАС). Хотя в данном случае предусматривают возможность использования двух различных основных аминокислот, в конкретном варианте осуществления основная аминокислота, используемая для получения водного раствора, содержащего источник казеина (первая основная аминокислота), и используемая для получения водного раствора, содержащего БАС (вторая основная аминокислота), одинаковы и выбраны из группы, состоящей из аргинина, лизина, гистидина и их смесей, предпочтительно из аргинина, лизина и их смесей.
Количество основной аминокислоты, которое может содержаться в растворе, образованном на стадии а) способа [1], соответствующего изобретению, и в растворе (i), соответствующей стадии а) способа [2], соответствующего изобретению, может варьировать в широких пределах и в основном зависит от используемой основной аминокислоты. Вследствие этого, хотя массовое соотношение основная аминокислота:казеин может сильно варьировать, в конкретном варианте осуществления массовое соотношение основная аминокислота:казеин в растворе, образованном на стадии а) способа [1], соответствующего изобретению, или в растворе (i) способа [2], соответствующего изобретению, составляет от 1:1 до 1:50, предпочтительно от 1:10 до 1:40, более предпочтительно приблизительно 1:12, когда используемая основная аминокислота представляет собой лизин, или приблизительно 1:25, когда используемая основная аминокислота представляет собой аргинин.
Когда БАС представляет собой кислое водорастворимое БАС, раствор (ii), соответствующий стадии а) способа [2], соответствующего изобретению, содержащий указанное БАС, содержит, кроме того, вторую основную аминокислоту, которая, как упомянуто выше, может быть такой же или отличаться от указанной первой основной аминокислоты, в данном случае соотношение основная аминокислота:казеин в способе [2], соответствующем изобретению, т.е. после смешивания растворов (i) и (ii), соответствующих стадии а) указанного способа, составляет от 1:1 до 1:50, предпочтительно от 1:5 до 1:20, более предпочтительно приблизительно 1:6, когда используемая основная аминокислота представляет собой лизин, или приблизительно 1:9, когда используемая основная аминокислота представляет собой аргинин.
Как способ [1], соответствующий изобретению, так и способ [2], соответствующий изобретению, включают стадию добавления а) водного раствора металла, выбранного из двухвалентного металла, трехвалентного металла и их комбинаций [стадия b)] к раствору, соответствующему стадии. Не желая быть связанными какой-либо теорией, считают, что указанный металл, такой как двухвалентный металл (например, кальций), дает возможность создания мостика внутри нагруженной наночастицы, соответствующей изобретению, которая способствует стабилизации БАС, в частности, когда БАС представляет собой водорастворимое БАС, предпочтительно кислое водорастворимое БАС, или водорастворимое БАС, способное взаимодействовать с указанным металлом (например, кальцием), например, фолиевая кислота, пантотеновая кислота или витамин группы В или С либо его производные, в данном случае, считают, что указанный металл, например, указанный двухвалентный металл (например, кальций), действует как мостик между казеином (в форме казеината) и БАС, предпочтительно водорастворимого БАС, более предпочтительно кислого водорастворимого БАС, или водорастворимого БАС, способного взаимодействовать с указанным металлом, оставляя указанное БАС связанным с гидрофобной фракцией нагруженных наночастиц, соответствующих изобретению.
В конкретном варианте осуществления указанный металл представляет собой двухвалентный металл, выбранный из кальция, магния, цинка, железа в двухвалентной форме и их комбинаций, предпочтительно кальций. В другом конкретном варианте осуществления указанный металл представляет собой трехвалентный металл, такой как железо в трехвалентной форме.
Хотя в действительности для практической реализации указанных способов [1] и [2], соответствующих изобретению, можно использовать любой водный раствор кальция, преимущественно раствор пищевого качества, [см. "Codex General Standard for Food Additives" (Свод основных стандартов по пищевым добавкам) GSFA в режиме онлайн для соотношения солей кальция, используемых в микроинкапсуляции пищевых продуктов] в конкретном варианте осуществления указанный раствор соли кальция выбран из группы, состоящей из хлорида кальция, ацетата кальция, глюконата кальция, лактата кальция, сорбата кальция, аскорбата кальция, цитрата кальция, пропионата кальция, сульфата кальция и их смесей, предпочтительно хлорида кальция. На практике карбонат кальция или альгинат кальция не рекомендуются, поскольку они являются солями, которые нерастворимы или очень малорастворимы в воде. Аналогично любой водный раствор магния, цинка или железа в двухвалентной или трехвалентной форме можно использовать для практической реализации указанных способов [1] и [2], соответствующих изобретению.
Массовое соотношение металл:казеин, где "металл" относится к указанному металлу, выбранному из двухвалентного металла, трехвалентного металла и их комбинаций, может варьировать в широких пределах, однако в конкретном варианте осуществления массовое соотношение металл:казеин составляет от 1:5 до 1:15, предпочтительно от 1:7 до 1:10, более предпочтительно приблизительно 1:8,5. В конкретном варианте осуществления указанный металл представляет собой двухвалентный металл.
Способ [2], соответствующий изобретению, приводит к получению нагруженных наночастиц, соответствующих изобретению, и в данном случае стадия а) предусматривает смешивание (i) водного раствора, содержащего источник казеина и первую основную аминокислоту, с (ii) раствором, содержащим БАС. Свойства указанного БАС упомянуты выше. В конкретном варианте осуществления указанное БАС представляет собой водорастворимое БАС, предпочтительно кислое водорастворимое БАС, например, фолиевую кислоту, 4-аминобензойную кислоту, ниацин или витамин В3, пантотеновую кислоту или витамин В5, тиаминмонофосфат, тиаминпирофосфат, тиаминтрифосфат, аскорбиновую кислоту, птероилполиглутаминовые кислоты (производные фолиевой кислоты: фолатполиглутамины, полиглутаматфолаты), фолиновую кислоту, никотиновую кислоту, гиалуроновую кислоту, тиоктовую кислоту, п-кумаровую кислоту, кофеиновую кислоту, их фармацевтически или косметически приемлемые либо пищевого качества производные, сложные эфиры или соли и их смеси. В другом конкретном варианте осуществления указанное БАС представляет собой жирорастворимое БАС, например, витамин группы A, D, Е, K и их производные, фосфолипид, каротиноид (например, каротины, ликопен, лютеин, капсантин, зеаксантин и т.п.), омега-3 жирную кислоту (например, ДГК, ЭПК и т.п.), аминокислоту (например, изолейцин, лейцин, метионин, фенилаланин, триптофан и валин), фитостанол или фитостерин (например, ситостерин, кампестерин, стигмастерин и т.п.), полифенол (например, кверцетин, рутин, ресвератрол, кампферол, мирицетин, изорамнетин и т.п.) или их производные.
Массовое соотношение БАС:казеин в нагруженной наночастице, соответствующей изобретению, может варьировать в широких пределах, в неограничивающем иллюстративном случае массовое соотношение БАС:казеин в нагруженной наночастице, соответствующей изобретению, может составлять от 1:1 до 1:200, предпочтительно от 1:10 до 1:80, более предпочтительно от приблизительно 1:15 до 1:35. В конкретном варианте осуществления БАС представляет собой водорастворимое БАС, и массовое соотношение (водорастворимое) БАС:казеин в нагруженной наночастице, соответствующей изобретению, составляет от 1:1 до 1:50, предпочтительно от 1:10 до 1:30, более предпочтительно от приблизительно 1:15 до 1:20. В другом конкретном варианте осуществления БАС представляет собой жирорастворимое БАС, и массовое соотношение (жирорастворимое) БАС:казеин в нагруженной наночастице, соответствующей изобретению, составляет от 1:1 до 1:200, предпочтительно от 1:10 до 1:80, более предпочтительно от приблизительно 1:20 до 1:35.
Аналогичным образом, массовое соотношение основная аминокислота:БАС (соответствующее водному раствору (ii), содержащему кислое водорастворимое БАС и вторую основную аминокислоту, используемую на стадии а) способа [2], соответствующего изобретению), может варьировать в широких пределах, однако, в конкретном варианте осуществления массовое соотношение основная аминокислота:(кислое водорастворимое) БАС в данном растворе (ii) составляет от 1:0,1 до 1:3, предпочтительно от 1:0,5 до 1:1, более предпочтительно приблизительно 1:0,75.
Как упомянуто выше, в состав наночастиц, соответствующих изобретению, как тех, которые нагружены БАС, так и тех, которые не нагружены, можно ввести антиоксидант, например, аскорбиновую кислоту (витамин С), и т.п., с целью повышения их стабильности в отношении температуры и окисления. В данном случае указанный антиоксидант может быть соинкапсулирован с БАС (при необходимости) или находиться в покрытии наночастиц, соответствующих изобретению, в данном случае указанные способы [1] и [2], соответствующие изобретению, будут соответствующим образом адаптированы для введения антиоксиданта в состав наночастиц, например, путем добавления антиоксиданта к водному раствору, содержащему указанное БАС и основную аминокислоту.
В конкретном варианте осуществления БАС представляет собой фолиевую кислоту и антиоксидант представляет собой аскорбиновую кислоту, действие которой, по-видимому, заключается в защите фолиевой кислоты от разложения под воздействием ультрафиолетового излучения, изменения рН, нагревания, кислорода и т.п., и, кроме того, обеспечивает питательную поддержку аскорбиновой кислоты. Указанный антиоксидант может быть соинкапсулирован с БАС или введен в покрытие наночастиц, соответствующих изобретению.
Кроме того, при необходимости как способ [1], соответствующий изобретению, так и способ [2], соответствующий изобретению, могут включать одну или более дополнительных стадий, направленных на стабилизацию полученных наночастиц при использовании разных обработок.
В конкретном варианте осуществления указанная стабилизирующая обработка предусматривает воздействие на суспензию, содержащую сформированные наночастицы, соответствующие изобретению, как те, которые нагружены БАС, так и те, которые не нагружены, высоким давлением, например, давлением, лежащим в интервале от 100 до 800 МПа, как правило, от 350 до 600 МПа. В конкретном варианте осуществления указанная обработка предусматривает воздействие на суспензию наночастиц циклами от 3 до 5 минут давления от 100 МПа до 800 МПа, как правило, от 350 до 600 МПа; в действительности давление 400 МПа обеспечивает положительные результаты.
В другом конкретном варианте осуществления указанная стабилизирующая обработка предусматривает воздействие на суспензию, содержащую сформированные наночастицы, соответствующие изобретению, как те, которые нагружены БАС, так и те, которые не нагружены, УВТ (ультравысокой температуры), например, температуры от 130°С до 140°С в течение 2-5 секунд с последующим быстрым охлаждением.
Аналогичным образом, при необходимости как способ [1], соответствующий изобретению, так и способ [2], соответствующий изобретению, могут включать стадию сушки суспензии, содержащей сформированные наночастицы, с целью получения наночастиц, соответствующих изобретению, как тех, которые нагружены БАС, так и тех, которые не нагружены, в форме порошка. Данная форма представления указанных наночастиц вносит вклад в их стабильность и, кроме того, особенно полезна для их возможного использования в твердых продуктах питания, таких как мука, хлеб, выпечка, зерновых продуктах, сухом молоке и т.п., а также в косметических и/или фармацевтических продуктах.
В действительности любую принятую технологию или способ, подходящие для сушки суспензий, содержащих наночастицы, можно использовать для осуществления данной стадии сушки, однако в конкретном варианте осуществления высушивание суспензии, содержащей наночастицы, проводят с помощью распылительной сушки или посредством лиофилизации. Данную обработку, как правило, проводят посредством добавления подходящего защитного компонента для указанных наночастиц, такого как сахарид, например, лактоза, трегалоза, маннит, сахароза, мальтодекстрин, глюкоза, сорбит, мальтоза и т.п., и их смесей к суспензии наночастиц. Указанный защитный компонент защищает наночастицы, соответствующие изобретению, от разложения под действием нагревания, а также окисления в процессе сушки.
Массовое соотношение казеин:сахарид может варьировать в широких пределах, однако в конкретном варианте осуществления массовое соотношение казеин:сахарид составляет от 1:1 до 1:4, предпочтительно приблизительно 1:2.
Аналогичным образом в конкретном варианте осуществления раствор, содержащий сахарид, может, кроме того, содержать антиоксидант, такой как аскорбиновая кислота (витамин С), и т.п., в данном случае, массовое соотношение казеин:сахарид:антиоксидант, например, витамин С, может составлять 1:0,75-2,5:0,01-1,5, предпочтительно 1:2,0:0,10.
Наночастицы, соответствующие изобретению, полученные согласно способу [1], соответствующему изобретению, т.е. наночастицы, содержащие казеиновую матрицу, основную аминокислоту и металл, выбранный из двухвалентного металла, трехвалентного металла и их комбинаций, образуют посредством способа, который предусматривает: а) получение водного раствора, содержащего источник казеина и основную аминокислоту, и b) добавление водного раствора металла, выбранного из двухвалентного металла, трехвалентного металла и их комбинаций, к раствору, соответствующему стадии а), образуют дополнительный аспект настоящего изобретения.
Аналогичным образом нагруженные наночастицы, соответствующие изобретению, полученные согласно способу [2], соответствующему изобретению, т.е. наночастицы, содержащие казеиновую матрицу, основную аминокислоту, металл, выбранный из двухвалентного металла, трехвалентного металла и их комбинаций, и БАС, полученные с помощью способа, который предусматривает а) смешивание (i) водного раствора, содержащего источник казеина и первую основную аминокислоту с (ii) раствором, содержащим БАС, и b) добавление водного раствора металла, выбранного из двухвалентного металла, трехвалентного металла и их комбинаций, к смеси, полученной в результате на стадии а), образуют дополнительный аспект настоящего изобретения.
Варианты применения
Наночастицы, соответствующие изобретению, можно использовать в качестве технологических добавок, например, заместителей жира, и т.п. Они также обладают способностью инкапсуляции БАС, например, водорастворимого БАС или жирорастворимого БАС.
В конкретном варианте осуществления наночастицы, соответствующие изобретению, дают возможность инкапсуляции БАС, предпочтительно водорастворимого БАС, более предпочтительно кислого водорастворимого БАС, и его включения в фармацевтические, косметические композиции и композиции продуктов питания, поскольку другие ингредиенты, которые не являются природными полимерами (для предупреждения токсичности, связанной с синтетическими полимерами) и не имеют пищевого качества, не используют при их получении и в конечном продукте (наночастицах). Указанные наночастицы защищают БАС от разложения внешними факторами (светом, изменениями рН, окислением и т.п.).
Преимущественно наночастицы, соответствующие изобретению, имеют средний размер меньше чем 1 мкм, предпочтительно составляющий от 50 до 200 нм, более предпочтительно приблизительно 140 нм, для предупреждения изменения органолептических свойств (структуры, ощущаемой небом).
Аналогичным образом наночастицы, соответствующие изобретению, повышают биодоступность БАС в кишечнике, защищая указанное БАС от пептических кислотных условий желудка и способствуя их растворению и высвобождению в кишечнике.
Наночастицы, соответствующие изобретению, могут быть ресуспендированы в водной среде при защите БАС от разложения при растворении. Они, кроме того, могут быть представлены в форме сухого порошка, сохраняющей БАС в стабильном состоянии и дающей возможность его хранения в течение длительного времени (особенно для их включения в твердые пищевые продукты).
Кроме того, наночастицы, соответствующие изобретению, подходят также для получения косметических и фармацевтических композиций, предназначенных для местного применения.
Вследствие этого в другом аспекте изобретение относится к композиции, далее "композиция, соответствующая изобретению", содержащей по меньшей мере одну наночастицу, соответствующую изобретению, в конкретном варианте осуществления наночастица, соответствующая изобретению, представляет собой наночастицу, содержащую казеиновую матрицу, основную аминокислоту и металл, выбранный из двухвалентного металла, трехвалентного металла и их комбинаций, в другом конкретном варианте осуществления наночастица, соответствующая изобретению, представляет собой нагруженную наночастицу, соответствующую изобретению, т.е. наночастицу, содержащую казеиновую матрицу, основную аминокислоту, металл, выбранный из двухвалентного металла, трехвалентного металла и их комбинаций, и БАС с питательной, лечебной и/или косметической активностью, а также фармацевтически или косметически приемлемый носитель или носитель, подходящий для продукта питания.
В конкретном варианте осуществления указанное БАС выбрано из группы, состоящей из аминокислот, антимикробных препаратов, ароматизаторов, консервантов, подсластителей, стероидов, лекарственных препаратов, гормонов, липидов, пептидов, полинуклеотидов, полисахаридов, белков, протеогликанов, вкусовых добавок, витаминов и их смесей.
В конкретном варианте осуществления указанное БАС представляет собой водорастворимое БАС, предпочтительно кислое водорастворимое БАС. Неограничивающие иллюстративные примеры водорастворимых БАС включают витамины, например, витамины группы В или С и их производные, соли или сложные эфиры, гиалуроновую кислоту, хондроитинсульфат, тиоктовую кислоту, их соли или сложные эфиры и т.п. В конкретном варианте осуществления указанное водорастворимое БАС выбрано из группы, состоящей из фолиевой кислоты, 4-аминобензойной кислоты, ниацина, пантотеновой кислоты, тиаминмонофосфата, тиаминпирофосфата, тиаминтрифосфата, аскорбиновой кислоты, птероилполиглутаминовых кислот (производных фолиевой кислоты: фолатполиглутаматов, полиглутаматфолатов), фолиновой кислоты, никотиновой кислоты, гиалуроновой кислоты, тиоктовой кислоты, п-кумаровой кислоты, кофеиновой кислоты, их фармацевтически или косметически приемлемых или пищевого качества производных, сложных эфиров или солей или их смесей.
В другом конкретном варианте осуществления указанное БАС представляет собой жирорастворимое БАС. Неограничивающие иллюстративные примеры жирорастворимых БАС включают витамины, например, группы A, D, Е, K и их производные, фосфолипиды, каротиноиды (каротины, ликопен, лютеин, капсантин, зеаксантин и т.п.), омега-3 жирные кислоты (например, ДГК, ЭПК и т.п.), аминокислоты (например, изолейцин, лейцин, метионин, фенилаланин, триптофан и валин), фитостанолы и фитостерины (например, ситостерин, кампестерин, стигмастерин и т.п.), полифенолы (например, кверцетин, рутин, ресвератрол, кампферол, мирицетин, изорамнетин и т.п.) или их производные.
В конкретном варианте осуществления композиция, соответствующая изобретению, представляет собой фармацевтическую композицию, подходящую для ее введения местным путем, в данном случае указанная композиция содержит фармацевтически приемлемый носитель, который содержит один или более наполнителей, подходящих для местного введения, например, в форме геля, мази, крема и т.п. Информацию о наполнителях, подходящих для получения фармацевтических композиций, предназначенных для местного введения, а также о получении указанных фармацевтических композиций можно найти в монографии С.Fauli i Trillo "Tratado de Farmacia Galenica" (Справочник по галеновым препаратам), 10 изд., 1993, Luzán 5, S.A. de Ediciones. Доза наночастиц, соответствующих изобретению, предназначенная для введения, может варьировать в широких пределах, например, от приблизительно 0,5 (г/см2 площади, подвергаемой лечению) до приблизительно 2 (г/см2 площади, подвергаемой лечению) композиции, соответствующей изобретению, содержащей от 0,1% до 30% наночастиц, соответствующих изобретению, предпочтительно от 0,5% до 5%.
В другом конкретном варианте осуществления композиция, соответствующая изобретению, представляет собой косметическую композицию, подходящую для местного введения, в данном случае указанная композиция содержит коcметически приемлемый носитель, содержащий один или более наполнителей, подходящих для местного введения, например, в форме геля, крема, шампуня, лосьона и т.п. Информацию о наполнителях, подходящих для получения косметических композиций, предназначенных для местного введения, а также о получении указанных фармацевтических композиций можно найти в монографии Octavio Diez Sales "Manual de Cosmetologia" (Справочник по косметологи и), 1 изд., 1998, Editorial Videocinco, S.A.
В другом конкретном варианте осуществления композиция, соответствующая изобретению, представляет собой композицию продукта питания, такого как твердый, жидкий или полутвердый продукт питания.
В конкретном варианте осуществления композиция, соответствующая изобретению, содержит:
казеин, от 10% до 50% в пересчете на массу;
фолиевую кислоту, от 0,9% до 2,5% в пересчете на массу;
кальций, от 1% до 6% в пересчете на массу; и
основную аминокислоту, от 1% до 7% в пересчете на массу; и
сахарид, от 30% до 80% в пересчете на массу,
причем все соотношения приводят в пересчете на массу относительно общей массы композиции.
В другом конкретном варианте осуществления композиция, соответствующая изобретению, содержит:
казеин, от 10% до 50% в пересчете на массу;
фолиевую кислоту, от 0,9% до 2,5% в пересчете на массу;
кальций, от 1% до 6% в пересчете на массу; и
основную аминокислоту, от 20% до 55% в пересчете на массу; и
сахарид, от 20% до 55% в пересчете на массу; и
аскорбиновую кислоту, от 1% до 25%,
причем все соотношения приводят в пересчете на массу относительно общей массы композиции.
Альтернативно, композицию, соответствующую изобретению, можно ввести в продукт питания, вследствие этого в другом аспекте изобретение относится к продукту питания, содержащему композицию, соответствующую изобретению. Указанный продукт питания можно обнаружить в жидкой, полутвердой или твердой форме. Преимущественно для предупреждения или минимизации полного или частичного растворения наночастиц, соответствующих изобретению, и, таким образом, внесения вклада в их стабильность, указанный продукт питания имеет кислый рН, т.е. меньше 7, предпочтительно меньше или равный 6, более предпочтительно меньше или равный 5. Иллюстративные примеры продуктов питания, которые можно обогатить или витаминизировать композицией, соответствующей изобретению, включают молоко и его производные (йогурты, сыры, творожные продукты и т.п.), соки, джемы, хлебобулочные продукты, ферментированное мясо, соусы и т.п. Аналогично композицию, соответствующую изобретению, можно ввести в продукты питания для животных, например, в корма.
Примеры
В следующих примерах описывают получение казеиновых частиц, которые могут заключать в себе биологически активное соединение, в частности, фолиевую кислоту. Они способны защищать соединение от разрушения, которому оно может подвергнуться в продукте питания вследствие ранее упомянутого множества факторов. Данные примеры демонстрируют также способность указанных наночастиц защищать фолиевую кислоту от условий, имеющихся в желудке, после их приема и высвобождать ее в среде кишечника.
Общий способ получения ненагруженных казеиновых наночастиц
Способ получения казеиновых наночастиц предусматривает растворение казеината натрия (ANVISA, Madrid, Spain) в водной среде вместе с определенным количеством основной аминокислоты с последующим добавлением при перемешивании с помощью магнитной мешалки и при постоянном потоке определенного объема раствора кальция, что приводит к началу образования наночастиц с внешним видом молочной суспензии.
Физико-химическая характеризация наночастиц
Различные исследования, необходимые для получения полной физико-химической характеризации наночастиц, описаны ниже.
Размер и поверхностный заряд наночастиц определяют на основании физико-химических тестов, последний устанавливают посредством измерения дзета-потенциала. Первый из параметров получают путем фотонно-корреляционной спектроскопии при использовании Zetasizer nano Z-S (Malvern Instruments/Optilas, Spain), тогда как дзета-потенциал измеряют с помощью анализатора дзета-потенциала (Zeta Potential Analyzer) (Brookhaven Instruments Corporation, New York, USA).
Выход, получаемый при использовании способа формирования наночастиц, рассчитывают путем количественного определения остающегося свободного казеина после получения наночастиц, собранного в супернатантах, полученных при центрифугировании препарата (17000×g, 20 минут). Таким образом, количество казеина, который формирует частицы в препарате, оценивают как разницу между исходным добавляемым количеством и количеством, определяемым в супернатантнах, собранным на стадии очистки. Данную количественную оценку проводят с помощью ультрафиолетовой (УФ) спектрометрии при длине волны 282 нм (Agilent 8453, система спектроскопии в УФ-видимой области). Выход оценивают как:
Для осуществления различных вычислений используют калибровочную кривую от 150 до 1500 мкг/мл (R2=0,9992; и LD=36 мкг/мл; LQ=119 мкг/мл).
Кроме того, проводят исследование, направленное на количественную оценку осадков, полученных после центрифугирования, с целью подтверждения результатов, полученных на основании разницы между общим казеинатом и казеинатом, содержащимся в супернатанте. В данном случае для разрушения частиц используют 0,05 М NaOH, который является той же самой средой, что используют для получения калибровочной кривой. Вследствие этого в данном случае выход оценивают как:
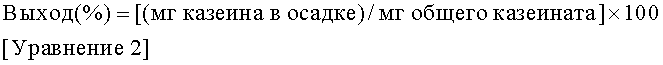
Максимальное поглощение, показанное для казеината, полученного в данной среде, составляет 300 нм. Концентрации, используемые для построения калибровочной кривой, также лежат в интервале от 150 до 1500 мкг/мл (R2=0,9996; LD=26 мкг/мл; LQ=85 мкг/мл).
Морфологию наночастиц наблюдают с помощью сканирующей электронной микроскопии (Zeiss, DSM 940A, Germany). В данном случае лиофилизированные наночастицы покрывают слоем молекулярного золота 9 нм (Emitech K550 Team, Sputter-Coater, United Kingdom) и фотографии делают с помощью микроскопа Zeiss DMS 940 A (United States).
Общий способ получения казеиновых наночастиц, содержащих фолиевую кислоту
Способ получения казеиновых наночастиц, содержащих фолиевую кислоту, предусматривает растворение казеината натрия в водной среде вместе с определенным количеством основной аминокислоты с последующим добавлением при перемешивании магнитной мешалкой определенного объема раствора фолиевой кислоты, предварительно приготовленного в водной среде с определенным количеством основной аминокислоты. После инкубирования смеси в течение нескольких минут последняя стадия состоит из добавления соли кальция, приводящей к формированию наночастиц, имеющих внешний вид молочно-желтоватой суспензии.
Сформированные наночастицы необязательно могут быть подвергнуты гидростатической обработке высоким давлением (Stansted Fluid Power, ISOLAB модель FPG11500B110; серия No.: 7844) циклами от 1 до 5 минут при 100-800 МПа с целью их стабилизации.
Затем и через 3 минуты гомогенизации посредством перемешивания добавляют определенный объем раствора сахарида (лактозы, трегалозы, маннита, глюкозы, сорбита, мальтодекстрина или мальтозы), не прекращая перемешивание. Наконец, суспензию лиофилизируют или распыляют в распылительной сушке (минираспылительная сушка Buchi B-191, Buchi Labortechnik AG, Switzerland) в следующих условиях:
- Температура поступающего воздуха: 60-100°С
- Температура выходящего воздуха: 30-90°С
- Давление воздуха: 2-10 бар [2-10×105 Па]
- Скорость прокачивания образца: 2-9 мл/мин
- Аспирация: 30-100%
- Поток воздуха: 200-900 л/час.
Необязательно препараты можно высушить после добавления сахарида посредством лиофилизации вместо распылительной сушки.
Определение количества фолиевой кислоты, связанной с казеиновыми частицами
Количество фолиевой кислоты, связанной с наночастицами, определяют с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) согласно способу, описанному Faye [см. раздел Faye Russell, L, Quantitative Determination of Water-Soluble Vitamins (Количественное определение водорастворимых витаминов) в монографии Food Analysis by HPLC (Анализ продуктов питания с помощью ВЭЖХ), под ред. Nollet, L.M.L, Marcel Dekker, Inc., New York, 2 изд., глава 10 (2000) стр.444-445]. Анализ проводят на хроматографе модели 1100 серии LC (Agilent, Waldbornn, Germany), связанном с системой УФ-детекции с диодной матрицей. Данные анализируют с помощью компьютера Hewlett-Packard с программным обеспечением Chem-Station G2171. Для выделения фолиевой кислоты используют нагретую до 40°С колонку Alltech С 18 Alltima™ (5 мкм, 150 мм × 2,1 мм) с совместимой колонкой Gemini®C18AJO-7596. Подвижную фазу готовят из смеси Н3PO4 (33 мМ, рН 2,3)/ацетонитрил в градиенте (см. Таблицу 1) и прокачивают со скоростью потока 0,25 мл/мин. Детекцию осуществляют при длине волны 290 нм. Объем инжекции образца составляет 10 мкл. Время удержания фолиевой кислоты составляет 22,6±0,5 минут.
Перед количественным определением образца строят различные калибровочные кривые концентраций от 2 до 400 мкг/мл, получая определенные и точные результаты с подтверждением больше чем на 95% того, что присутствие казеина и/или аминокислот в растворе не будет нарушать корректное количественное определение фолиевой кислоты.
Для анализа свежеполученного образца (перед его сушкой), супернатанты, полученные после фильтрации определенного объема препарата, количественно определяют с использованием трубок для диализа Vivaspin® 300,000 MWCO (VIVASPIN 2, Sartorius stedim Biotech, Germany). Осадок, в свою очередь, растворяют в 0,05 М NaOH, чтобы разрушить частицы и сохранить казеин и фолиевую кислоту, и аминокислоту в растворе и, таким образом, осуществить их количественное определение. Сумма содержания фолиевой кислоты, обнаруженной в обеих фракциях (супернатант и осадок), совпадает во всех случаях с общим исходно добавленным количеством. Более того, возможно также определить общее количество фолиевой кислоты путем растворения 1 мл препарата в 1 мл 0,05 М NaOH. Данное исследование позволяет подтвердить, что разница между количеством добавленной фолиевой кислоты и фолиевой кислоты, полученной при количественном определении с помощью описанного хроматографического способа, превышает 10% во всех случаях.
Кроме того, 10 мг наночастиц берут для количественного определения порошковых образцов, их ресуспендируют в 2 мл воды и центрифугируют, затем обрабатывают таким же образом, как свежеполученные образцы.
Исследование кинетики высвобождения для высвобождения фолиевой кислоты из наночастиц в искусственной желудочно-кишечной среде
Кинетику высвобождения для высвобождения фолиевой кислоты из наночастиц определяют, диспергируя приблизительно 10 мг данного соединения в 2 мл искусственной желудочной среды (0-2 час) (USP (Фармакопея США) XXIII) при 37±1°С. В заданное время суспензии наночастиц центрифугируют (17000×g, 20 минут) и количество фолиевой кислоты в супернатантах количественно определяют вышеупомянутым способом ВЭЖХ. После удаления супернатантов из желудочной среды добавляют искусственную кишечную среду (2-24 час) (USP XXIII) при 37±1°С, затем обрабатывают таким же образом, как в вышеописанном случае.
Долю фолиевой кислоты, высвобождающейся во всех случаях, рассчитывают, принимая во внимание общее содержание витамина, присутствующего в препарате, взятом для каждого исследования.
Фармакокинетические исследования. Биодоступность фолиевой кислоты, инкапсулированной в казеиновых наночастицах
Фармакокинетические исследования проводят согласно правилам Комитета по этике института (Institution Ethics Committee), а также Европейского законодательства по экспериментальным животным (European legislation on experimental animals) (86/609/EU). В данном случае 25 самцов крыс Wistar со средней массой 200 г помещают в нормальные условия чередования света и темноты (12 часов - 12 часов), и в течение недели перед исследованием их кормят без ограничений кормом с дефицитом фолиевой кислоты (диета с дефицитом фолиевой кислоты. TD. 95247. Harlan, USA) и водой. За двенадцать часов до введения препаратов крыс изолируют в клетки для изучения метаболизма без избытка корма, но при свободном доступе к питьевой воде.
Животных делят на 5 групп лечения (5 крыс/группу). Первой группе перорально вводят только 1 мл PBS (фосфатного буфера рН 7,4). Следующие три группы лечат пероральными дозами только 1 мг/кг (200 мкг/крысу) фолиевой кислоты, включенной в любой из следующих препаратов: (i) свободная фолиевая кислота (неинкапсулированная) (Aditio, Panreac Quimica, Barcelona, Spain); (ii) казеиновые наночастицы с инкапсулированной фолиевой кислотой; (iii) казеиновые наночастицы, обработанные высоким давлением, с инкапсулированной фолиевой кислотой. 1 мл каждого из различных препаратов, диспергированных в воде, вводят через гастроэзофагеальные канюли (катетер). Наконец, такую же дозу свободной фолиевой кислоты (1 мг/кг), растворенной в солевой сыворотке (0,5 мл), внутривенно вводят пятой группе в подкожную вену бедра.
Перед введением препаратов забирают кровь из хвостовой подкожной вены с целью проверки исходного уровня витамина у каждой крысы. После введения забирают кровь в объеме приблизительно 500 мкл в различные периоды времени при использовании пробирок для сывороточного сепаратора (Микропробирка SARSTEDT 1,1 мл Z-Gel). Во всех случаях забор крови проводят после погружения животного в сон при использовании ингаляционной анестезии (изофлуран:кислород) для предупреждения боли у крыс, проверяя их константы во всех точках времени.
Затем объем крови восполняют внутрибрюшинным введением 500 мкл сыворотки на основе физиологического раствора, предварительно нагретой до температуры тела животного. При исследовании в данный период состояния животных (подвижность, агрессивность, аллергические реакции и температура) не обнаруживают никаких существенных изменений.
Предварительная обработка и количественное определение фолиевой кислоты в образцах сыворотки
Количественное определение фолиевой кислоты в образцах сыворотки, полученных после центрифугирования пробирок с кровью (6000 об/мин, 20 мин, 20°С), проводят способом ферментного иммуноанализа. В данном случае используют набор Elisa Kit (Diagnostic automation, INC. Calabasas, California USA), одобренный FDA (Управлением по контролю за продуктами и лекарствами США) для количественного определения фолиевой кислоты в продуктах питания. Проводят количественное определение образцов сыворотки без предварительной обработки и следуя инструкциям изготовителя.
Поскольку набор разработан для применения в продуктах питания, проводят серию предварительных исследований для подтверждения его способности к количественному определению витамина в образцах сыворотки. Данные исследования состоят из проведения исчерпывающего сравнения результатов, полученных с помощью набора, и результатов, полученных способом высокоэффективной жидкостной хроматографии, описанным в предшествующих разделах, со следующим способом предварительной подготовки: различные количества (0-300 мкл) фолиевой кислоты, растворенной в 50 мМ растворе тетрабората натрия, полученном в 1% (масс./об.) аскорбате натрия, добавляют к 50 мкл сыворотки. Полученный в результате раствор доводят до конечного объема 350 мкл (разведение сыворотки 1:7) 50 мМ раствором тетрабората натрия. Каждую смесь кипятят в течение 30 минут и затем охлаждают до 2°С и выдерживают в течение ночи при указанной температуре.
После центрифугирования полученных в результате образцов при 20000 об/мин в течение 20 минут и фильтрования их через фильтр 20 мкм количественно определяют содержание в них фолиевой кислоты с использованием ранее описанного способа высокоэффективной жидкостной хроматографии. В данном случае и вследствие низкой концентрации витамина в сыворотке используют стандартный способ добавления для минимизации ошибок в количественном определении и для исключения какого-либо влияния матрицы.
Во всех исследованных случаях разницы в концентрациях фолиевой кислоты в сыворотке в обоих способах составляли меньше чем 10%. Вследствие этого выбирают способ ферментного иммуноанализа для количественной оценки совокупности образцов, поскольку для него требуется меньшее количество сыворотки для анализа и это более простой и ускоренный способ, предел определения (2 нг/мл) которого значительно меньше, чем у хроматографического способа.
Общий способ получения казеиновых наночастиц, содержащих жирорастворимую активную субстанцию кверцетин
Способ получения казеиновых наночастиц, содержащих кверцетин, предусматривает растворение казеината натрия в водной среде вместе с определенным количеством основной аминокислоты с последующим добавлением при перемешивании с помощью магнитной мешалки определенного объема раствора аскорбиновой кислоты и затем кверцетина, предварительно растворенного в этаноле. После инкубирования смеси в течение нескольких минут последняя стадия состоит из добавления соли кальция, вызывающей формирование наночастиц с внешним видом молочно-желтоватой суспензии.
Сформированные наночастицы необязательно могут быть подвегнуты гидростатической обработке высоким давлением (Stansted Fluid Power, ISOLAB модель FPG11500B110; серия No.: 7844) циклами от 1 до 5 минут при 100-800 МПа с целью их стабилизации.
Затем и через 3 минуты гомогенизации посредством перемешивания добавляют определенный объем раствора сахарида (лактозы, трегалозы, маннита, глюкозы, сорбита, мальтодекстрина или мальтозы), не прекращая перемешивание. Наконец, суспензию лиофилизируют или распыляют в распылительной сушке (минираспылительная сушка Buchi B-191, Buchi Labortechnik AG, Switzerland) в следующих условиях:
- Температура поступающего воздуха: 60-100°С
- Температура выходящего воздуха: 30-90°С
- Давление воздуха: 2-10 бар [2-10×105 Па]
- Скорость прокачивания образца: 2-9 мл/мин
- Аспирация: 30-100%
- Поток воздуха: 200-900 л/час.
Необязательно препараты можно высушить после добавления сахарида посредством лиофилизации вместо распылительной сушки.
Определение количества кверцетина, связанного с казеиновыми частицами
Количество кверцетина, связанного с наночастицами, определяют с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) согласно способу, описанному Lacopini (Lacopini et al., J Food Comp Anal 2008;21:589-598), хотя с некоторыми изменениями. Анализ проводят на хроматографе модели 1100 серии LC (Agilent, Waldbornn, Germany), связанном с системой УФ-детекции с диодной матрицей. Данные анализируют с помощью компьютера Hewlett-Packard с программным обеспечением Chem-Station G2171. Для выделения фолиевой кислоты используют нагретую до 40°С колонку Alltech C18Alltima™ (5 мкм, 150 мм × 2,1 мм) с совместимой колонкой Gemini® C18 AJO-7596 и смесь вода/метанол/ледяная уксусная кислота в градиенте (см. Таблицу 2) в качестве подвижной фазы, прокачиваемой при скорости потока 0,25 мл/мин. Детекцию осуществляют при длине волны 260 нм, объем инжекции образца составляет 10 мкл и время удержания кверцетина составляет 24,2±0,2 минуты.
Перед количественным определением образцов строят различные калибровочные кривые концентраций от 1 до 100 мкг/мл в водно-спиртовой среде (75% этанол), получая определенные и точные результаты выше чем 95%.
Для анализа свежеприготовленных образцов (перед их сушкой) супернатанты, полученные после процесса очистки наночастиц фильтрацией (17000 об/мин, 20 мин), разводят до получения водно-спиртового раствора с содержанием этанола 50% (масс./об.).
Наконец, количество кверцетина, связанного с наночастицами [эффективность инкапсуляции (Е.Е.)], рассчитывают как разницу между исходном добавленным количеством кверцетина (Q) и его количеством, определенным в супернатантах, согласно следующему уравнению:
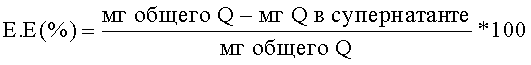
Пример 1. Получение и характеризация ненагруженных казеиновых наночастиц. Выход способа их получения. Влияние типа используемой аминокислоты на стабильность и физико-химические свойства наночастиц
1 г казеината натрия растворяют вместе с 90 мг лизина в 75 мл воды. Затем к данному раствору добавляют 40 мл 0,8% CaCl2 при перемешивании с помощью магнитной мешалки и постоянном потоке. Данный процесс осуществляют в трех повторностях.
На Фигурах 2 и 3 показывают полученные с помощью электронной трансмиссионной микроскопии изображения казеиновых частиц, приготовленных данным способом.
Кроме того, такое же исследование проводят в отсутствие аминокислоты или при использовании 50 мг аргинина вместо лизина, чтобы понять влияние типа аминокислоты на физико-химические свойства частиц.
В Таблице 3 суммируют основные физико-химические параметры полученных в результате наночастиц.
Проведенные статистические исследования (непараметрический тест независимых выборок Крускала-Уаллиса) показывают, что отсутствует статистически достоверное доказательство, подтверждающее, что имеется разница между физико-химическими параметрами препаратов. Вследствие этого можно заключить, что тип аминокислоты не нарушает свойств ненагруженных наночастиц.
Такое же исследование проводят с варьированием соотношения аминокислот, добавленных в препарат, приходя к аналогичным заключениям, т.е. соотношение и тип аминокислоты не нарушает конечных свойств ненагруженных частиц.
Для понимания стабильности препаратов измеряют физико-химические параметры трех типов наночастиц в течение времени. Полученные результаты включают в Таблицу 4.
Во время их получения три типа наночастиц имеют размеры одного порядка величины и относительно низкие полидисперсии (считая, что для значений PDI, меньшей чем 0,3, распределение частиц по размеру однородно). Данные значения размеров и дисперсии не показывают значительных изменений на протяжении всего исследования в случае наночастиц, полученных с аминокислотой. Однако через два часа после их получения наночастицы, которые получают без аминокислоты, имеют значительное увеличение как среднего размера, так и полидисперсии (для значения полидисперсии больше чем 0,3 величина размера частиц не репрезентативна, она является только ориентировочной, поскольку существует большая неоднородность диаметров), достигая очень высоких значений полидисперсии после окончания исследования. Данные увеличения указывают на существование феномена агрегации частиц. Данный феномен даже подтверждают на микроскопическом уровне, поскольку, когда три препарата наблюдают в течение времени, подтверждают, что наночастицы без аминокислоты осаждаются, приводя к формированию молочного слоя, тогда как наночастицы, полученные с аминокислотой, формируют однородную суспензию. В свете данных результатов считают, что присутствие аминокислоты важно для получения частиц, которые стабильны в течение времени.
Кроме того, все три типа препаратов снова получают и изучают их физико-химические свойства после того, как их сушат способом распылительной сушки. Условия процесса следующие:
- Температура поступающего воздуха: 90°С
- Температура выходящего воздуха: 49°С
- Давление воздуха: 6 бар [6×105 Па]
- Скорость прокачивания образца: 4,5 мл/мин
-Аспирация: 100%
- Поток воздуха: 600 л/час.
Данное исследование проводят с целью понимания влияния аминокислоты, когда наночастицы сушат во время их получения, хотя в данном случае ни один из препаратов не демонстрирует феномен агрегации. Полученные результаты включают в Таблицу 5.
При ресуспендировании наночастиц с аминокислотой, высушенных в порошок, в водной среде отмечают, что распределение по размеру продолжает оставаться монодисперсным и их размеры немного превышают размеры их гомологов перед тем, как их высушивают распылительной сушкой. Однако у наночастиц, полученных без аминокислоты, размер и значения полидисперсии больше, указывая на то, что они могут подвергаться феномену агрегации при сушке. Таким образом, присутствие аминокислоты также необходимо, когда частицы высушивают посредством распылительной сушки.
В свете указанного заключают, что физико-химические свойства наночастиц с аминокислотой отличаются от свойств не содержащих ее частиц, они имеют более низкую тенденцию к агрегации и, вследствие этого, представляют собой препараты, выбранные для инкапсуляции биологически активных соединений.
Пример 2. Получение и характеризация казеиновых наночастиц, содержащих фолиевую кислоту. Влияние содержания лизина и Фолиевой кислоты на эффективность инкапсуляции
Различные растворы, все из которых содержат 100 мг казеината натрия и различные количества лизина (0-8,5 мг), получают в конечном объеме 7,5 мл воды.
Кроме того, 300 мг фолиевой кислоты растворяют вместе с 400 мг лизина в 50 мл воды.
Затем 1 мл раствора фолиевой кислоты добавляют к раствору казеината. Через 5 минут инкубирования к смеси добавляют 4 мл 0,8% CaCl2 при перемешивании с помощью магнитной мешалки и постоянном потоке. Данный процесс осуществляют в трех повторностях для каждого типа препарата.
На Фигурах 4 и 5 показывают изображения, полученные с помощью электронной трансмиссионной микроскопии казеиновых частиц с инкапсулированной фолиевой кислотой, полученных данным способом.
Физико-химические свойства, полученные в каждом случае, включены в Таблицу 6:
Проведенные статистические исследования (непараметрический тест независимых выборок Крускала-Уаллиса) показывают, что отсутствует статистически достоверное доказательство, подтверждающее, что имеется разница в физико-химических свойствах последних трех препаратов, включенных в таблицу (с содержанием лизина 3,9, 4,5 и 8,5 мг). В первом случае это подтверждает тот факт, что, хотя раствор фолиевой кислоты содержит лизин, отсутствие аминокислоты в исходном растворе казеината способствует частичному осаждению фолиевой кислоты кальцием, что вызывает ошибки в количественном определении витамина, поскольку не вся фолиевая кислота в осадке инкапсулирована после центрифугирования.
Дополнительные исследования позволяют подтвердить, что, когда раствор витамина содержит аминокислоту, но раствор казеината не содержит, максимальное количество фолиевой кислоты, которое можно ввести в препарат без ее осаждения, составляет 4 мг, причем затем получают результаты, аналогичные приведенным в Таблице 6 (25,5±1 мкг ФК/мг НЧ и эффективность инкапсуляции: 68,7±0,5). Таким образом подтверждают, что присутствие аминокислоты не влияет на количество инкапсулированного витамина. Однако, поскольку наночастицы, полученные без аминокислоты, менее стабильны и имеют более высокую тенденцию к агрегации (см. Пример 1), препараты получают в присутствии данной аминокислоты.
Для того, чтобы понять влияние количества фолиевой кислоты, добавленной в препарат, на физико-химические свойства частиц, проводят такое же исследование при варьировании только количества добавляемого раствора фолиевой кислоты, причем количество аминокислоты в исходном растворе казеина остается постоянным, составляя 8,5 мг.
На Фигуре 6 показывают соотношение количества инкапсулированной фолиевой кислоты как функцию количества витамина, добавленного в препарат.
Размеры, обнаруженные с исследованных препаратах, лежат в интервале от 132 до 140 нм при полидисперсии меньше чем 0,2 во всех случаях. В данном примере значения эффективности инкапсуляции несравнимы, поскольку количество добавленной фолиевой кислоты различно. Максимальное значение составляет 73,1±7,5 для массового соотношение казеин:фолиевая кислота 13,5:1.
В результате данного исследования можно заключить, что, поскольку соотношение мг казеина/мг ФК в препарате уменьшено (т.е. поскольку исходное количество фолиевой кислоты, добавленной в препарат, возрастает), получают повышенное количество фолиевой кислоты, инкапсулированной внутри наночастиц. Однако, когда количество казеина, находящееся в препарате (в мг), на каждый мг фолиевой кислоты меньше, чем опытные величины, наблюдают образование осадков и нестабильных препаратов, таких как имеют место в отсутствие лизина.
Пример 3. Получение и характеризация казеиновых наночастиц, содержащих фолиевую кислоту, высушенных распылительной сушкой. Влияние способа сушки на конечный препарат
Два раствора, оба содержащие 1000 мг казеината натрия и 90 мг лизина, готовят в конечном объеме 75 мл воды.
Кроме того, 600 мг фолиевой кислоты растворяют вместе с 800 мг лизина в 100 мл воды.
Затем к каждому раствору казеината добавляют 7,5 мл раствора фолиевой кислоты. Через 5 минут инкубирования 40 мл 0,8% CaCl2 добавляют к смеси при перемешивании с помощью магнитной мешалки и постоянном потоке.
Наконец, один из препаратов центрифугируют для количественной оценки фолиевой кислоты в супернатанте и осадке, тогда как в другой добавляют 1900 мг лактозы перед тем, как высушить с помощью распылительной сушки. Условия процесса следующие:
- Температура поступающего воздуха: 90°С
- Температура выходящего воздуха: 45°С
- Давление воздуха: 6 бар [6×105 Па]
- Скорость прокачивания образца: 4,5 мл/мин
- Аспирация: 95%
- Поток воздуха: 600 л/час.
Физико-химические свойства, наблюдаемые с обоих случаях, включены в Таблицу 7.
Проведенные статистические исследования (непараметрический тест независимых выборок Крускала-Уаллиса) показывают, что имеется статистически достоверная разница (р<0,05) между эффективностями инкапсуляции, полученными для обоих препаратов. Данная разница может быть обусловлена способом высушивания препарата распылительной сушкой при указанных температурах, вызывающих частичное разложение казеиновых наночастиц, приводящее к высвобождению части ранее инкапсулированной фолиевой кислоты.
Данные результаты демонстрируют необходимость применения способа поперечного сшивания частиц, который находится в процессе разработки, чтобы можно было повысить их стабильность и предупредить вышеуказанное снижение эффективности инкапсуляции в способе центрифугирования или сушки препарата.
Пример 4. Получение и характеризация казеиновых наночастиц с лизином, содержащих фолиевую кислоту, стабилизированных высоким давлением и высушенных способом распылительной сушки. Влияние обработки на физико-химические свойства наночастиц
Различные растворы, все из которых содержат 1000 мг казеината натрия и 90 мг лизина, получают в конечном объеме 75 мл воды.
Кроме того, растворяют 600 мг фолиевой кислоты вместе с 800 мг лизина в 100 мл воды.
Затем 7,5 мл раствора фолиевой кислоты добавляют к раствору казеината. Через 5 минут инкубирования 40 мл 0,8% СаСl2 добавляют к смеси при перемешивании с помощью магнитной мешалки и постоянном потоке.
После формирования частиц препараты переносят в запечатанные пластиковые емкости и подвергают гидростатической обработке высоким давлением (0 МПа; 100 МПа, 5 минут; 200 МПа, 5 минут; 400 МПа, 5 минут; 600 МПа, 5 минут или 800 МПа, 5 минут).
После окончания процесса 1900 мг лактозы, растворенной в воде, добавляют к каждому препарату и высушивают его с использованием распылительной сушки в следующих условиях:
- Температура поступающего воздуха: 85°С
- Температура выходящего воздуха: 45°С
- Давление воздуха: 6 бар [6×105 Па]
- Скорость прокачивания образца: 4,5 мл/мин
- Аспирация: 95%
- Поток воздуха: 600 л/час.
В Таблице 8 суммируют основные физико-химические свойства полученных в результате наночастиц.
Как можно видеть из Таблицы 8, независимо от типа используемой обработки препаратов, наночастицы имеют близкие поверхностные заряды. Однако результаты дают возможность определить, что по мере повышения давления, используемого для обработки, уменьшается размер полученных частиц, достигая максимального уменьшения 7%. Однако количество инкапсулированного витамина (и вследствие этого эффективность инкапсуляции) достигает более высоких значений по мере повышения используемого давления, причем получают рост 65% относительно препаратов, не подвергшихся обработке (в случае образцов, обработанных 800 МПа).
Кроме того, на Фигурах 7-11 показывают микрофотографии препаратов, не подвергшихся обработке высоким давлением, и тех, которые обработаны 100, 400 и 800 МПа, полученные с помощью сканирующей электронной микроскопии. Они дают подтверждение того, как наночастицы, полученные без гидростатической обработки высоким давлением, частично изменяются под воздействием различных способов, которыми на них воздействуют после получения (высушивание распылительной сушкой, центрифугирование, получение микрофотографий способом, при котором достигают высоких температур), причем частицы, подвергшиеся обработке высоким давлением, более стабильны.
Данные результаты показывают, что используемые гидростатические обработки высоким давлением поперечно сшивают наночастицы, делая их более стабильными и, вследствие этого, предупреждая их разложение после центрифугирования, сушки и фотографирования. Все эти факты объясняют повышенную эффективность инкапсуляции, полученную в обработанных образцах, поскольку частичное разложение наночастиц в некоторых из данных способов сушки или центрифугирования будет приводить к высвобождению фолиевой кислоты и, вследствие этого, к получению пониженной эффективности инкапсуляции.
Пример 5. Получение и характеризация казеиновых наночастиц с аргинином, содержащих фолиевую кислоту, при использовании высоких давлений, высушенных распылительной сушкой.
Влияние используемой аминокислоты на конечный результат
Раствор 3,065 мг казеината натрия с 123 мг аргинина получают в конечном объеме 210 мл воды.
Кроме того, 605 мг фолиевой кислоты растворяют вместе с 800 мг аргинина в 100 мл воды.
Затем к раствору казеината добавляют 27 мл раствора фолиевой кислоты. Через 5 минут инкубирования к смеси добавляют 120 мл 0,8% CaCl2 при перемешивании с помощью магнитной мешалки и постоянном потоке.
После формирования частиц препарат переносят в запечатанную пластиковую емкость и подвергают гидростатической обработке высоким давлением, состоящей из 5 минутного цикла при 400 МПа.
После окончания процесса добавляют 5,880 мг маннита, растворенного в воде, к 300 мл препарата, обработанного высоким давлением, и высушивают его при использовании способа распылительной сушки в следующих условиях:
- Температура поступающего воздуха: 85°С
- Температура выходящего воздуха: 45°С
- Давление воздуха: 6 бар [6×105 Па]
- Скорость прокачивания образца: 4,5 мл/мин
- Аспирация: 95%
- Поток воздуха: 600 л/час.
В Таблице 9 суммируют основные физико-химические свойства полученного в результате препарата.
На Фигуре 12 показывают микрофотографии, полученные сканирующей электронной микроскопией (SEM) казеиновых наночастиц, содержащих фолиевую кислоту, и с включением в препарат аргинина при обработке 400 МПа, 5 минут.
Как можно видеть, полученный в результате препарат имеет свойства, аналогичные свойствам наночастиц, полученных при использовании лизина вместо аргинина.
Пример 6. Исследование кинетики высвобождения для высвобождения фолиевой кислоты из наночастиц в искусственной желудочно-кишечной среде. Влияние обработки высоким давлением на кинетику высвобождения
Для проведения исследований высвобождения берут порошковые препараты, описанные в Примере 4 (без обработки высоким давлением, обработанные 100 МПа и 400 МПа).
На Фигуре 13 показывают кинетику высвобождения, полученную в случае образцов, прошедших обработку высоким давлением. На ней видно, что после двух часов инкубирования в желудочной среде достигают максимальных значений высвобождения фолиевой кислоты 4%. Однако в условиях кишечника частицы казеина растворяются, высвобождая более высокий процент витамина (достигающий 90% через 24 часа исследования). Более того, в данной среде образцы, центрифугированные после их инкубирования, фактически не имеют осадка казеина, который свидетельствует об их растворении и, вследствие этого, высвобождении витамина. Таким образом, видно, что разработанный препарат сохраняет фолиевую кислоту инкапсулированной в желудочном тракте, препятствуя снижению его биодоступности в условиях желудка. Кроме того, наночастицы растворяются в кишке, способствуя высвобождению витамина и устраняя проблему какой-либо токсичности, которая может возникать вследствие присутствия наночастиц.
В случае образцов, обработанных высокими давлениями, на Фигурах 14 и 15 показывают кинетику их высвобождения. На них можно видеть, что профиль очень близок к обнаруженному для образцов, полученных без обработки высоким давлением, причем максимальный процент высвобождения через 6 часов в искусственной кишечной среде немного ниже (70%), чем обнаруженный для образцов, не прошедших обработку, на данный момент (80%).
Таким образом, использование высокого гидростатического давления для казеиновых наночастиц с целью поперечного сшивания не модифицирует существенным образом профиль высвобождения ингредиента из образца, хотя общее количество витамина, высвобождающегося через 6 часов, снижается на 10%.
Пример 7. Фармакокинетическое исследование фолиевой кислоты, инкапсулированной в казеиновых наночастицах
В Таблице 10 суммируют основные физико-химические свойства наночастиц, тестированных в фармакокинетическом исследовании. Оба типа наночастиц (с обработкой и без обработки высоким давлением) получают согласно способу, описанному в Примере 5.
Фармакокинетическое исследование делят на три фазы. Первая фаза состоит из внутривенного введения 1 мг/кг фолиевой кислоты, растворенной в фосфатном буфере; вторая фаза состоит из перорального введения 1 мл фосфатного буфера крысам из группы 5 самцов крыс Wistar (исходные уровни витамина в течение времени исследуют в данной группе крыс). Наконец, третья фаза состоит из перорального введения 1 мг/кг (i) фолиевой кислоты, растворенной в воде, (ii) фолиевой кислоты, инкапсулированной в казеиновые наночастицы, и (iii) фолиевой кислоты, инкапсулированной в казеиновые наночастицы, обработанные высокими давлениями, группам крыс, составленных из 5 животных.
После введения в различные периоды времени (0, 1, 2, 3, 8 и 24 часа) забирают кровь в объеме приблизительно 500 мкл и собирают в пробирки для сепаратора сыворотки с последующим восстановлением объема крови животного внутрибрюшинным введением равного объема солевой сыворотки. Фармакокинетический анализ данных, полученных после введения фолиевой кислоты, проводят с использованием способа некомпартментной настройки программы фармакокинетической настройки WiNNonlin 1.5 (Pharsight Corporation, Mountain View, United States).
Полученные результаты (после вычитания исходных уровней) совместно представляют на Фигурах 16 и 17. Как можно видеть, внутривенное введение фолиевой кислоты (см. Фиг.16) демонстрирует пик сывороточной концентрации лекарственного препарата при всасывании первого образца с последующим резким снижением сывороточных уровней лекарственного препарата. Профили, полученные при пероральном введении витамина (см. Фиг.17), различны, поскольку максимумы концентрации существенно ниже;
они появляются в течение более длительного времени и снижаются более плавным образом. Однако, при сравнении уровней витамина, показанных после перорального введения фолиевой кислоты в свободной форме (без инкапсуляции) или инкапсулированной в казеиновых наночастицах (с обработкой или без обработки высоким давлением), обнаруживают профили концентрации в аналогичные периоды времени, но максимальные значения выше при введении инкапсулированного витамина.
Значения фармакокинетических параметров, полученных после проведения некомпартментного анализа экспериментальных данных настоящего исследования, включены в Таблицу 11.
Как можно видеть, значения AUC подвергаются существенным изменениям в зависимости от типа используемого препарата. Когда витамин инкапсулирован в казеиновых наночастицах, значения AUC существенно выше, чем значения, полученные после введения свободной фолиевой кислоты, и, кроме того, они сохраняются в период до 24 часов после введения. Наблюдают, что среднее время пребывания (МВТ) фолиевой кислоты в плазме близко у двух препаратов наночастиц и больше сравнительно со свободной формой (пероральный и внутривенный препараты).
Согласно данным результатам рассчитано, что пероральная биодоступность казеиновых наночастиц с инкапсулированной фолиевой кислотой, которая составляет 52% в обоих препаратах, на 45% выше, чем данные значения, полученные после перорального введения свободной фолиевой кислоты.
Пример 8. Косметический препарат ГЦ с казеиновыми наночастицами с инкапсулированной фолиевой кислотой
Раствор, содержащий 200 мг казеината натрия и 18 мг лизина, получают в конечном объеме 15 мл воды.
Кроме того, 600 мг фолиевой кислоты растворяют вместе с 800 мг лизина в 100 мл воды.
Затем к раствору казеината добавляют 1,5 мл раствора фолиевой кислоты. Через 5 минут инкубирования к смеси добавляют 8 мл 0,8% CaCl2 при перемешивании смеси с помощью магнитной мешалки и постоянном потоке.
Наконец, препарат центрифугируют при 17000×g, 20 минут. Супернатант отбрасывают и осадок ресуспендируют в 25 мл воды.
Дополнительно получают раствор, содержащий 7 г глицерина и 0,2 г нипагина натрия в 42 мл воды. Раствор нагревают на водяной бане до 50°С и затем добавляют водный раствор казеиновых наночастиц, содержащий фолиевую кислоту, получая конечный водный раствор, с которым готовят косметический препарат.
Кроме того, также нагревают 25 г Neo PCL O/W при 70°С до его полного расплавления. После того, как данная жировая фаза расплавится, добавляют вышеописанный водный раствор при постоянном перемешивании до получения O/W (типа масло в воде) эмульсии, которая является истинной и стабильной в течение времени. Органолептическая оценка полученного в результате крема положительна, он имеет однородный внешний вид и не содержит комочки.
Такое же исследование проводят, кроме того, с использованием препарата наночастиц, обработанных высоким давлением (400 МПа, 5 минут) и высушенных с помощью распылительной сушки, описанной в Примере 4. Берут 600 мг препарата и ресуспендируют в 25 мл воды, обрабатывая затем таким же образом, как описано выше. Полученный в результате крем имеет однородный внешний вид и не содержит комочки.
Пример 9. Косметический препарат [2] с казеиновыми наночастицами с инкапсулированной фолиевой кислотой
Раствор, содержащий 200 мг казеината натрия и 18 мг лизина, получают в конечном объеме 15 мл воды.
Кроме того, 600 мг фолиевой кислоты растворяют вместе с 800 мг лизина в 100 мл воды.
Затем к раствору казеината добавляют 1,5 мл раствора фолиевой кислоты. Через 5 минут инкубирования к смеси добавляют 8 мл 0,8% CaCl2 при перемешивании смеси с помощью магнитной мешалки и постоянном потоке.
Наконец, препарат центрифугируют при 17000×g, 20 минут. Супернатант отбрасывают и осадок ресуспендируют в 25 мл воды.
Дополнительно 0,5 г Carbopol Ultrez 10 растворяют в 75 мл воды. Суспензию наночастиц добавляют в раствор. После гомогенизации смеси добавляют достаточное количество триметиламина до получения рН 10. Смесь гомогенизируют до получения однородного и стабильного слегка желтоватого геля Carbopol.
Такое же тест проводят, кроме того, с использованием препарата наночастиц, обработанных высоким давлением (400 МПа, 5 минут) и высушенных с помощью распылительной сушки, описанных в Примере 4. Берут 600 мг препарата и ресуспендируют в 25 мл воды, обрабатывая затем таким же образом, как описано выше. Полученный в результате гель имеет слегка желтоватый цвет и однородный и стабильный внешний вид.
Пример 10. Косметический препарат [3] с казеиновыми наночастицами с инкапсулированной фолиевой кислотой
3 г глицерилмоностеарата смешивают с 5 г изопропилмиристата и 2 г цетилового спирта. Смесь нагревают на водяной бане при 70°С.
Кроме того, 87 г геля Carbopol, содержащего казеиновые наночастицы с фолиевой кислотой, описанные в Примере 8, нагревают до 50°С в воде вместе с 3 г раствора сорбита. Данный раствор добавляют к первому, осторожно перемешивая до получения однородной эмульсии.
Пример 11. Получение и характеризация казеиновых наночастиц. содержащих кверцетин
Раствор, содержащий 100 мг казеината натрия и 8,5 мг лизина (или 5,5 мг аргинина), получают в 7,5 мл воды.
Кроме того, получают раствор аскорбата натрия в воде с концентрацией 12 мг/мл, 0,5 мл которого добавляют к смеси казеината и лизина. Причина использования аскорбата натрия состоит в том, чтобы предупредить окисление кверцетина в процессе получения наночастиц.
Кроме того, 50 мг кверцетина растворяют в 5 мл этанола.
Затем 0,15 мл раствора кверцетина добавляют к раствору казеината. Через 5 минут инкубирования 4 мл 0,8% СаСl2 добавляют к смеси при перемешивании с помощью магнитной мешалки при постоянном потоке. Данный процесс проводят в трех повторностях для каждого типа препарата.
Физико-химические свойства, полученные в каждом случае, включены в Таблицу 12.
Полученные результаты показывают, что наночастицы, соответствующие изобретению, подходят также для инкапсуляции биологически активных соединений с жирорастворимыми свойствами и дают возможность получения высоких процентов эффективности инкапсуляции.
Кроме того, результаты позволяют подтвердить то, что присутствие одной или другой аминокислоты не влияют на физико-химические свойства полученных в результате наночастиц.
С целью повышения количества инкапсулированного кверцетина повторяют исследование с использованием лизина в качестве аминокислоты и различных количеств кверцетина (от 0,05 до 0,50 мл раствора кверцетина в этаноле). Полученные результаты включены в Таблицу 13.
Полученные результаты показывают, что по мере повышения количества кверцетина в препарате, количество инкапсулированного кверцетина повышается в том же соотношении, тогда как эффективность инкапсуляции остается постоянной.
Кроме того, проводят тесты в соответствии с ранее описанным способом, но с диспергированием кверцетина в воде (вместо его растворения в этаноле) перед его добавлением к раствору казеината. Полученные результаты показывают, что часть кверцетина инкапсулирована в казеиновых наночастицах, хотя эффективность инкапсуляции меньше, чем в предшествующем случае, где кверцетин растворяют в этаноле перед его добавлением к раствору казеината.
Реферат
Группа изобретений относится к наночастицам для инкапсуляции биологически активных соединений. Наночастица содержит казеиновую матрицу, основную аминокислоту и металл, выбранный из группы, включающей двухвалентный металл, трехвалентный металл и их комбинации. Предложен способ получения наночастиц, включающий приготовление водного раствора источника казеина и основной аминокислоты и добавление к приготовленному раствору водного раствора металла, выбранного из группы, включающей двухвалентный металл, трехвалентный металл и их комбинации, с получением суспензии, содержащей сформированные наночастицы. Как вариант, способ получения наночастиц включает смешение водного раствора источника казеина и основной аминокислоты с раствором биологически активного соединения и добавление к полученной смеси водного раствора металла, выбранного из группы, с получением суспензии, содержащей сформированные наночастицы. Наночастицы, полученные вышеуказанными способами, используют в сочетании с носителем для приготовления продуктов питания, в также в фармацевтической и косметической отраслях. Изобретение позволяет получить наночастицы с повышенной стабильностью и низким значением полидисперсности. 7 н. и 33 з.п. ф-лы, 17 ил., 13 табл., 11 пр.

Комментарии