Этиленово-ненасыщенные полимеризующиеся мономеры на основе производного пиперидина - RU2086540C1
Код документа: RU2086540C1
Чертежи



Описание
Изобретение относится к этиленовоненасыщенным композициям, содержащим 1-гидрокарбил-окси-2,2,6,6-тетраметилпиперидиновые функциональные группы, и к полимерам и сополимерам, произведенным из них.
Мономерные сополимеризующиеся стабилизаторы света, которые содержат пространственно затрудненную аминную функцию, известны из уровня техники, как свидетельствует следующий список типичных патентов и публикаций: патенты США 4 294 949, 4 210 612, 4 743 657; и Ф.Каррер, Makiomol chem. 1980, V 181, 595; K. W. Lee J. Polym. science. Poly chem. bd 1972, v. 10 3295; T. Kutosaki, J. Polym. science, Poly. Chem. bd, 1974, v. 12, 1407.
Ни в одной из приведенных выше ссылок не раскрыты или не предложены настоящие соединения, замещенные при атоме 1-N гидрокарбилокси-группой.
Не способные к полимеризации затрудненные амины, замещенные при атоме 1-N гидрокарбилокси-группой, описаны в Европейском патенте ЕП-А-309 402. Однако описанные в нем соединения не могут быть гомополимеризованы или сополимеризованы; таким образом, теряется ключевой элемент гибкости, присущий предлагаемым здесь этиленовоненасыщенным материалам.
Согласно настоящему изобретению используют этиленовоненасыщенный, полимеризующийся мономер, содержащий функциональную группу затрудненного амина, в которой 1-N атом замещен гидрокарилокси-группой.
Согласно настоящему изобретению также используют гомополимеры указанного мономера, которые обладают повышенной стойкостью к миграции и к потерям, обусловленным испарением в условиях конечного использования.
Еще одним объектом настоящего изобретения является использование сополимеров этих мономеров с большим разнообразием других этиленовоненасыщенных мономеров, не имеющих функциональной группы затрудненного амина.
Согласно настоящему изобретению используют этиленовоненасыщенные, полимеризующиеся мономеры, содержащие функциональную группу
затрудненного амина, в которой 1-N
атом замещен гидрокарбилокси-группой, причем указанная функциональная группа имеет формулу E

где L1 и L2 являются метилом и R1 является алкилом с 1-18 атомами углерода или циклогексилом, причем этот мономер выбирают из группы, состоящей из формул I-VI

Когда X является -O- или -NH-,
n равно 1 или 2,
m является целым числом в интервале от 10 до 100,
R2 является водородом или метилом,
R3 и R4 являются водородом.
Предпочтительно m является целым числом в интервале от 10 до 30.
Предпочтительно R2, R3 и R4 каждый является атомами водорода или R3 и R4 являются атомами водорода и R2 - метил.
Когда R1 алкил, то он является, например, метилом, этилом, бутилом, амилом, октилом, нонилом, додецилом, тетрадецилом, октадецилом, эйкозилом, трикозилом или триконтилом.
Каждый из мономеров формулы I-VI содержит этиленовоненасыщенную группу, которая допускает полимеризацию мономера с использованием свободнорадикального инициирования, фотоинициирования, полимеризацию с переносом группы, привитую полимеризацию или катионную или анионную полимеризацию, чтобы получить либо гомополимер, либо сополимер, когда сополимеризуются вместе более, чем один мономер формулы I-VI.
Кроме того, каждый из мономеров формул I-VI может сополимеризоваться с отдельным виниловым мономером, не имеющим в наличии группы формулы E, чтобы получить сополимер, имеющий в качестве объединенной части основной цепи полимера стабилизирующие звенья, которые имеют присоединенные к ним боковые группы формулы E.
Указанный полимер или сополимер включает продукт полимеризации: а) от 1 до 100 мас. в расчете на сумму полимера или сополимера, по меньшей мере одного этиленовоненасыщенного, полимеризующегося мономера, содержащего функциональную группу затрудненного амина, в которой 1-N атом замещен гидрокарбил-окси-группой, причем эта функция имеет формулу Е.

где L1 и L2 являются метилом и R1 является алкилом с 1-18 атомами углерода или циклогексилом, причем этот мономер выбирают из группы, состоящей из формулы I-VI

Когда X является -0- или -NH-,
n равно 1 или 2,
m является целым числом от 10 до 100,
R2 является водородом или метилом,
R3 и R4 являются водородом.
Предпочтительно m является целым числом от 10 до 30.
б) от 99 до 0 мас. в расчете на сумму полимера или сополимера, по меньшей мере одного этиленовоненасыщенного, полимеризующегося мономера, не содержащего группу формулы E, и выбранного из группы, состоящей из сложных эфиров и амидов акриловой и метакриловой кислот, итаконатов, цитраконатов, стирола, винилпиридинов, дивинилбензолов, акрилонитрила, метакрилонитрила, N-винил-2-пирролидона, N-винилкарбазола, малеимидов, винилсульфоната, альфа-олефинов, изопрена, бутадиена, виниловых сложных эфиров, простых виниловых эфиров и галоидированных олефинов.
Такие сополимеры, содержащие даже небольшое количество компонента а), могут создать звенья с высокой степенью светостабилизации, которые не могут мигрировать, потеряться за счет улетучивания или иначе покинуть критический центр защиты сополимера от повреждающего воздействия химически активных лучей.
Этиленовоненасыщенные сополимеры также могут содержать функцию, поглощающую УФ-лучи, такую как гидроксифенилзамещенный бензотриазол или сим-триазин, гидроксизамещенный бензофенон, оксанилид или альфа-цианоциннамат. Примеры таких этиленово ненасыщенных УФ-поглотителей описаны в ряде патентов США, которые указаны в этом патенте в качестве известного уровня техники.
Акриловые бензотриазолы описаны в патентах США N 4 413 095, 4 716 234, 4 785 063 и 4 803 254. Акрилоксиалкил-бензотриазолы описаны в патенте США N 4 260 768. Винилзамещенные бензотриазолы описаны в патенте США N 4 508 882. Этиленовоненасыщенные бензотриазолы описаны в патенте США N 3 493 539. Акриловые бензофеноны описаны в патенте США N 4 310 650.
Имеется несколько методик синтеза, которые могут быть
использованы для приготовления настоящих мономеров. Они включают:
а) переэтерификацию с использованием 4-гидрокси-2,2,6,
6-тетраметилпиперидина и сложного эфира низшего алкила ненасыщенной
кислоты, такой как акриловая, фумаровая, муконовая или т.п.
б) этерфикацию с использованием 4-гидрокси-2,2,6,
6-тетраметилпиперидина и хлорангидрида кислоты, такого как акрилоил-или
метакрилоил-хлорид;
в) амидированные с использованием 4-амино-2,2,6,6-тетраметилпиперидина и хлорангидрида кислоты,
такого как акрилоил- или метакрилоил-хлорид;
г) имидирование с
использованием 4-амино-2,2,6,6-тетраметилпиперидина и циклического ангидрида, такого как малеиновый ангидрид, с последующей
циклизацией промежуточной малеаминовой кислоты;
д) замещение
галоида с использованием ненасыщенного бензил- или аллил-галогенида и алкоголята металла 4-гидрокси-2,2,6,6-тетраметилпиперидина,
и
е) каталитическое окисление предварительно полученного
4-ацилоилокси-2,2,6,6-тетраметилпиперидина трет-бутилгидроперекисью или перекисью водорода в присутствии катализатора триокисда
молибдена и углеводородного растворителя.
Промежуточные вещества, которые необходимы для приготовления соединений по изобретению, являются в основном имеющимися в продаже реагентами или могут быть получены известными из уровня техники, традиционными способами.
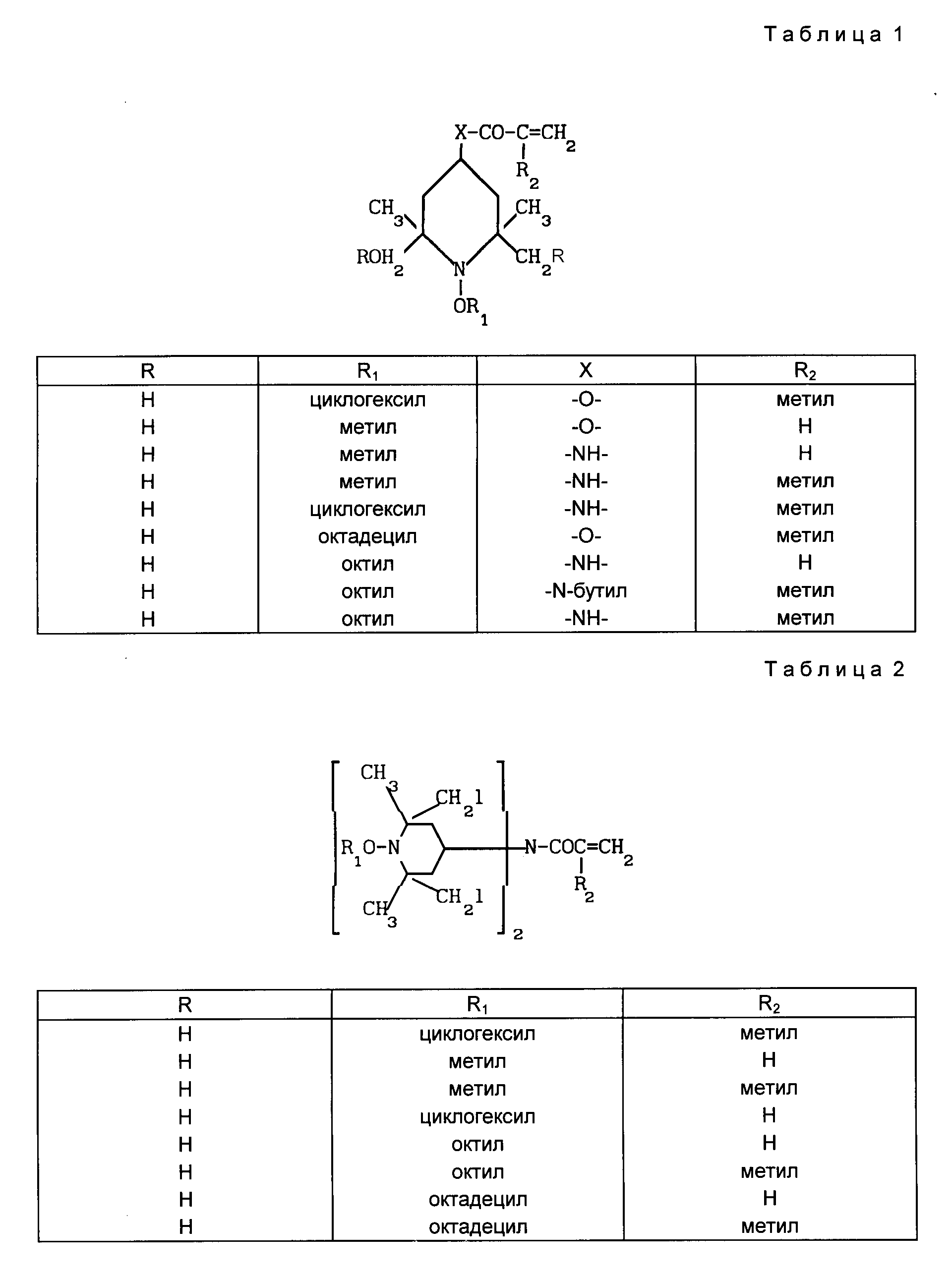
В табл. 1-4 приведены типичные мономерные соединения настоящего изобретения:


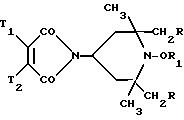

Полимеры и сополимеры настоящего изобретения могут быть получены из упомянутых выше мономеров с помощью обычных методов полимеризации, которые в общем описаны Губен-Вейлем в кн. "Методы органической химии", 1962, том 14/1, с. 1010-73 и раскрыты для ненасыщенных производных пиперидина в патенте США N 4 210 612.
Субстраты, в которых особенно эффективны вещества по изобретению, представляют собой полиолефины, такие как полиэтилен и полипропилен; полистирол, особенно включая ударопрочный полистирол; акрилонитрил-бутадиен-стироловая (АБС) смола; эластомеры, такие как например бутадиеновый каучук, сополимер этилена с пропиленом, сополимер этилена, пропилена и диена, бутадиен-стирольный и нитрильный каучуки.
В общем, соединения изобретения применяют в
количестве примерно от 0,01 до 5 мас. от веса стабилизированной композиции, хотя это количество
может изменяться для конкретного субстрата и применения. Выгодным интервалом является от 0,5 до 2 и
особенно от 0,1 до 1
Стабилизаторы настоящего изобретения могут быть легко введены в
органические полимеры по традиционным методикам, на любой удобной стадии до производства из них
формованных изделий. Например, стабилизатор может быть смешан с полимером в виде сухого порошка, или в
суспензии, или эмульсии полимера. Получающиеся стабилизированные полимерные композиции также
могут необязательно содержать различные традиционные добавки.
Особый интерес представляет использование настоящих производных во множестве покрывающих систем, включая системы, отверждаемые на воздухе и отверждаемые кислотным катализатором. В частности, физическая целостность поддерживается на высоком уровне, со значительным снижением потерь блеска и пожелтения. Ключевые улучшения включают существенное отсутствие торможения отверждения, обусловленное свето-стабилизаторами-N-алкил затрудненными аминами; существенное отсутствие флоккуляции и дестабилизации дисперсии, наблюдаемых при использовании N-алкил затрудненных аминов в некоторых пигментированных покрывающих системах, и отсутствие потерь адгезии между покрытиями и поликарбонатным субстратом. Соответственно настоящее изобретение также относится к использованию настоящих соединений, необязательно вместе с дополнительными стабилизаторами, для стабилизации покрытий, отверждаемых на воздухе, на основе алкидных смол; термопластичных акриловых смол, акриловых алкидов, акриловых алкидных или полиэфирных смол, необязательно модифицированных кремнием, изоцианатами, изоциануратами, кетиминами или оксазолидинами; и эпоксидными смолами, сшитыми карбоновыми кислотами, ангидридами, полиаминами или меркаптанами; и акриловых и полиэфирных смолистых систем, модифицированных реакционноспособными группами в основной цепи и сшитых эпоксидами; против разлагающего действия света, влаги и кислорода.
Кроме того, при промышленном применении эмали с высоким содержанием твердых веществ на основе способных к сшиванию акриловых, полиэфирных, уретановых или алкидных смол отверждаются при добавлении кислотного катализатора. Свето-стабилизаторы, содержащие группу основного азота, обычно неудовлетворительны в этой области применения. Образование соли между кислотным катализатором и свето-стабилизатором приведет к несовместимости или нерастворимости и осаждению соли и к понижению степени отверждения, и к понижению светозащитному действию, и к плохой влагостойкости.
Эти катализируемые кислотой, высушиваемые в печи лаки базируются на термически сшиваемых акриловых, полиэфирных, полиуретановых, полиамидных или алкидных смолах. Лаки акриловых смол, которые могут быть стабилизированы против действия света, влаги и кислорода в соответствии с этим изобретением, представляют собой традиционные акриловые лаки, высушиваемые в печи, или термореактивные смолы, включая акрилово-меламинные системы, которые описаны, например, в учебнике Х.Киттеля "Лаки и нанесение покрытий", том 1, ч.2, на стр. 735 и 742 (Берлин, 1972), в книге Х.Вагнера и Х.Ф.Саркса "Искусственные смолы для лаков" (1977), стр. 229-238 и в книге С.Паулса "Поверхностные покрытия: наука и технология", (1985).
Полиэфирные лаки, которые могут быть стабилизированы против действия света и влаги, представляют собой традиционные лаки, высушиваемые в печи, которые описаны, например, на стр. 86-99 в цитированной книге Х.Вагнера и Х. Ф.Саркса.
Лаки алкидных смол, которые могут быть стабилизированы от воздействия света и влаги в соответствии с изобретением, являются традиционными, высушиваемыми в печи лаками, которые используются, в частности, для покрытия автомобилей (автомобильные отделочные лаки), например, лаки на основе алкид/меламиновых смол и алкид/акриловых/меламиновых смол (см. Х.Вагнер и Х.Ф. Саркс, стр. 99-123). Прочие сшивающие агенты включают гликолауриловые смолы, блокированные изоцианаты или эпоксидные смолы.
Кислотно катализируемые, высушиваемые в печи лаки, стабилизированные в соответствии с изобретением, пригодны как для отделочных покрытий металла, так и для оттеночной отделки твердых тел, особенно в случае отделки ретушированием, а также для применения в покрытии различных монет. Лаки, стабилизированные в соответствии с этим изобретением, предпочтительно наносятся традиционным образом, двумя способами: либо методом однократного покрытия, либо методом двукратного покрытия. В последнем случае сначала наносится базовое покрытие, содержащее пигмент, и затем поверх него наносится покровное покрытие прозрачного лака.
Следует также отметить, что настоящие замещенные пространственно затрудненные амины применимы для использования в термореактивных смолах с некислотно катализируемым отверждением, таких как эпоксидные, эпокси-полиэфирные, виниловые, алкидные, акриловые и полиэфирные смолы, необязательно модифицированные кремнием, изоцианатами или изоциануратами. Эти эпоксидные и эпокси-полиэфирные смолы сшиваются традиционными сшивателями, такими как кислоты, ангидриды кислоты, амины и т.п.
Соответственно эпоксид может применяться в качестве сшивающего агента для различных акриловых или полиэфирных смолистых систем, которые модифицируются из-за наличия реакционно-способных групп в структуре основной цепи.
Для того чтобы достигнуть максимума светостабильности в таких покрытиях, может быть выгодным конкурентное использование других традиционных светостабилизаторов. Примерами являются упомянутые выше поглотители УФ-облучения бензофенонового, бензотриазолового, производственных акриловой кислоты или оксанилидного типа, или арил-симм-триазиновые, или металлсодержащие светостабилизаторы, например, никельорганические соединения. В дважды покрытых системах эти дополнительные светостабилизаторы могут быть добавлены к прозрачному покрытию и/или к пигментированному основному покрытию.
Если используются такие сочетания, то сумма всех светостабилизаторов составляет от 0,2 до 20 мас. предпочтительно от 0,5 до 5 мас. в расчете на пленкообразующую смолу.
Примеры различных классов поглотителей УФ-облучения, которые могут быть использованы в настоящих сочетаниях вместе с упомянутыми выше пиперидиновыми соединениями, обсуждены в статье Х.Дж. Хеллера в European Polymer Journal Supplement, 1969, стр. 105-132. Эти классы включают фенилсалицилаты, орто-гидроксибензофеноны, гидроксиксантоны, бензоксанзолы, бензомидазолы, оксадиазолы, триазолы, пиримидины, хиназолины, симм-триазины, гидроксифенил-бензотрианзолы, альфа-цианоакрилаты и бензоаты.
Типичными поглотителями УФ-излучения, имеющими особое значение, являются:
а) 2-(2-Гидроксифенил)-бензотриазолы, например 5,'-метил-3',
5'-ди-трет-бутил-, 5'-трет-бутил, 5'-(1,1,3,3-тетраметилбутил)-, 5-хлор-3', 5'-ди-трет-бутил-, 5-хлор-3'-трет-бутил-5'-метил-,
3'-втор-бутил-5'-трет-бутил-, 4'-октокси- и 3', 5'-ди-трет-амиловые
производные.
б) 2-Гидроксибензофеноны, например 4-гидрокси-, 4-метокси-4-октокси-, 4-децилокси-, 4-додецилокси, 4-бензилокси-, 4,2',4-тригидрокси- и 2'-гидрокси-4, 4'-диметокси-производные.
в) Акрилаты, например, альфа-циано-бета, бета-дифенилакриловой кислоты этиловый или изооктиловый эфир, метиловый эфир альфа-карбомето-коричной кислоты, метиловый или бутиловый эфир альфа-циано-бета-метил-п-метоксикоричной кислоты, альфа-карбометокси-п-метоксикоричной кислоты метиловый эфир, N-(бета-карбометокси-бета-циановинил)-2-метилиндолин.
г) Соединения никеля, например, никелевые комплексы 2,2-тио-бис-/4-(1,1,3,3-тетраметилбутил)-фенола/, такие как комплексы 1:1 или 1:2, необязательно с дополнительными лигандами, такими как н-бутиламин, триэтаноламин или N-циклогексил-диэтаноламин, дибутилдитиокарбамат никеля, никелевые соли 4-гидрокси-3, 5-ди-трет-бутилбензилфосфониевой кислоты, моноалкиловых эфиров, таких как метиловых, этиловых, или бутиловых, никелевых комплексов кетоксимов, таких как 2-гидрокси-4-фенилундецилкетоксим, никелевые комплексы 1-фенил-4-лауроил-5-гидроксипиразола, необязательно с дополнительными лигандами.
д) Диамиды щавелевой кислоты, например 4,4'-ди-актилоксиоксанилид, 2,2'-ди-октилокси-5, 5'-ди-третбутилоксанилид, 2,2'-ди-додециокси-5,5'-ди-трет-бутилоксанилид, 2-этокси-2'-этил-оксанилид, N,N'-бис-(3-диметиламино-пропил)оксаламид, 2-этокси-5-трет-бутил-2'-этилоксанилид, и его смеси с 2-этокси-2'-этил-5,4'-ди-трет-бутилоксанилидом и смеси с орто- и пара-метокси-, а также орто- и пара-этоксидизамещенными оксанилидами.
е) Гидроксифенил-симм-триазины, такие как 2, 6-бис-(2, 4-диметилфенил)-4-(2-гидрокси-4-октилоксифенил)-симм- -триазин, или соответствующая 4-(2,4-дигидрокси-фенильная)-производная.
Особенно ценными в качестве состабилизаторов в композициях, содержащих настоящие соединения, являются бензотриазолы с высоким молекулярным весом и низкой летучестью, такие как 2-[2-гидрокси-3,5-ди(альфа-диметилбензил)фенил] -2H-бензотриазол, 2-[2-гидрокси-3,5-ди-трет-октилфенил] -2H-бензотриазол, 2-[2-гидрокси-3-альфа, альфа-диметилбензил-5-третоктилфенил]-2H-бензотриазол, 2-[2-гидрокси-3-трет-октил-5-альфа, альфа-диметалбензилфенил]-2H-бензотриазол, 2-[2-гидрокси-3,5-ди-трет-амилфенил]-2H-бензотриазол, 2-[2-гидрокси-3-трет-бутил-5-(2-омега-гидроксиокта-(этиленокси)карбонил)-этилфенил] -2H-бензотриазол, додецилированный 2-[2-гидрокси-5-метилфенил]-2H-бензотриазол, 2-[2-гидрокси-3-трет-бутил-5-(2-октилоксикарбонил)-этилфенил] -2H-безо-триазол, и 5-хлорсоединения, соответствующие каждому из вышеназванных бензотриазолов.
Наиболее предпочтительными бензотриазолами, пригодными в качестве состабилизаторов, являются 2-[2-гидрокси-3,5-ди(альфа, альфа-диметилбензил)фенил] -2H-бензотриазол, додецилированный 2-[2-гидрокси-5-метилфенил]-2H-бензотриазол, 2-[2-гидрокси-3-трет-бутил-5-(2-омега-гидроксиокта-(этиленокси)карбонил)-этилфенил] -2H-бензотриазол, 2-[2-гидрокси-3-трет-бутил-5-(2-октилоксикарбонил)-этилфенил] -2H-бензотриазол и 5-хлор-2-[2-гидрокси-3-трет-бутил-5-(2-окстилоксикарбонил)-этилфенил]-2H-бензотриазол.
Кроме того, предполагается, что настоящие соединения могут быть особенно эффективными в качестве стабилизаторов для полиолефиновых волокон, особенно для полипропиленовых волокон при использовании в сочетании с другими стабилизаторами, выбранными из группы, состоящей из фенольных антиокислителей, пространственно затрудненных светостабилизаторов, органических фосфорных соединений, поглотителей УФ-излучения и их смесей.
Кроме того, предпочтительным вариантом использования настоящих соединений является использование стабилизированных композиций, содержащих дополнительно фосфит или фосфонит. Количество фосфита или фосфонита, которое используется в композициях, составляет от 0,05 до 2 мас. предпочтительно от 0,1 до 1,0 мас. в расчете на пленкообразующую смолу.
Типичные фосфит и фосфониты включают трифенилфосфит, дифенилалкилфосфиты, фенилдиалкилфосфиты, три-(нонилфенил)фосфит, трилаурилфосфит, триоктадецилфосфит, ди-стеарилпентаэритрит дифосфит, трис-(2, 4-ди-трет-бутилфенил)фосфит, ди-изодецилпентаэритрит- дифосфит, ди-(2,4-ди-трет-бутилфенил)пантаэритритдифосфит, тристеарилсорбит- трифосфит, тетракис-(2,4-ди-трет-бутилфенил)-4, 4-дифенилендифосфонит.
Катализируемые кислотой термореактивные эмали должны стабилизироваться, для того чтобы иметь соответствующие функции в областях конечного применения. Использованными стабилизаторами являются стерически затрудненные амины, предпочтительно те, которые замещены при атоме азота инертной блокирующей группой, для того чтобы предотвратить осаждение основного амина, стабилизированного кислотным катализатором, с сопутствующим торможением отверждения, необязательно в сочетании с поглотителями УФ-излучения, такими как бензотриазолы, бензофенолы, замещенные симм-триазины, фенилбензоаты или оксанилиды.
Для придания повышенной долговечности отвержденным эмалям (измеряется по блеску при 20oС, различению образа, растрескиванию или помутнению) эти стабилизаторы не должны тормозить отверждение (нормальное прогревание автомобильных покрытий при 82oC, измеряется по твердости, адгезии, стойкости к растворителю и стойкости к влажности), эмаль не должна желтеть при отверждении и, кроме того, изменение цвета при воздействии света должно быть минимальным; стабилизаторы должны быть растворимыми в органических растворителях, которые обычно применяются в покрытиях, таких как метиламилкетон, ксилол, н-гексилацетат, спирт и т.д.
Настоящие свето-стабилизаторы затрудненные амины, замещенные при атоме азота кислородзамещенной функцией, удовлетворяют каждому из этих требований и обеспечивают сами по себе или в сочетании с поглотителем УФ-лучей эффективную защиту свето-стабилизации отвержденным, кислотно катализируемым термореактивным эмалям.
Предпочтительный вариант воплощения настоящего требования относится к стабилизированным композициям,
включающим кислотно катализируемое термореактивное покрытие или эмаль на основе
а) термически сшиваемых акриловых, полиэфирных или алкидных смол, содержащих
б) NO-R1
-замещенное 2,2,6,6-тетраалкилпиперидиновое соединение и
в) УФ-поглотитель, выбранный из группы, состоящей из бензофенонов, бензоприазолов, производных акриловой кислоты, никельорганических
соединений, арил-симм-триазинов и оксанилидов.
Дополнительными ингредиентами, которые могут содержаться в эмалях и покрытиях, являются антиоксиданты, например стерически затрудненные фенольные производные, соединения фосфора, такие как фосфиты, фосфины или фосфониты, пластификаторы, разравнивающие агенты, катализаторы отверждения, загустители, промоторы адгезии или диспергаторы.
Еще одной предпочтительной комбинацией стабилизаторов является сочетание их с гидроксиламином, чтобы защитить полипропиленовые волокна от газового выцветания.
Пример 1. Бис-(1-циклогексилокси-2,2,6,6-тетраметилпиперидин-4-ил)транс-, транс-муконат. Раствор 1,70 г диметилового эфира транс, транс-муконовой кислоты, 5,62 г 1-циклогексилокси-2,2,6, 6-тетраметилпиперидин-4-ола и 0,025 г амида лития в 100 мл толуола нагревают с обратным холодильником и ловушкой Дина и Старка в течение 8 ч. Затем реакционную смесь разбавляют этилацетатом и промывают водой, рассолом и сушат над безводным сульфатом магния. При концентрировании при пониженном давлении с последующим хроматографическим разделением получают указанное в заголовке вещество в виде белого твердого вещества, точка плавления 181-184oC.
Пример 2. 1-Циклогексилокси-2,2,6,6-тетраметилпиперидин-4-иловый эфир карбокси-терминированного полибутадиена (HYCAR 2000•162). Хлористый оксалил (2,10 мл) добавляют к раствору HYCAR 2000•162 (25,0 г) в 75 мл толуола. После перемешивания при комнатной температуре в течение ночи реакционную смесь концентрируют при пониженном давлении, чтобы удалить избыток хлористого оксалила. Остаток растворяют в 50 мл сухого толуола и затем обрабатывают 3,06 г 1-циклогексилокси-2,2,6, 6-тетраметилпиперидин-4-ола и 1,8 мл триэтиламина в 50 мл толуола. После перемешивания в течение ночи реакционную смесь фильтруют и концентрируют при пониженном давлении, чтобы получить указанное в заголовке соединение в виде легкого масла n 1,5138. Анализы ИК- и ЯМР-спектроскопии свидетельствуют о завершении реакции и введении в полимер функциональной группы затрудненного амина.
Пример 3. 1-Циклогексилокси-2,2,6,6-тетраметил-4-акрилоил-оксипиперидин. Раствор 1, 6 мл хлористого акрилоила в 20 мл хлористого метилена добавляют к перемешиваемому раствору 5,11 г 1-циклогексилокси-2,2,6,6-тетраметилпиперидин-4-ола и 3,10 мл триэтиламина в 20 мл хлористого метилена при 0oC. После перемешивания при комнатной температуре в течение 2 ч растворитель удаляют при пониженном давлении. Затем остаток очищают методом жидкостной хроматографии, чтобы получить указанное в заголовке соединение в виде белого твердого вещества с температурой плавления 49-52oC.
Анализ. Вычислено для C18H31NO3 : C 69,9 H 10,1 N 4,5.
Найдено C 60,0 H 10,5 N 4,5.
Пример 4. 1-Циклогексил-2,2,6,6-тетраметил-4-метакрилоилоксипиперидин. Методику примера 3 повторяют, используя 5,11
г
1-циклогексилокси-2,2,6,6-тетраметилпиперидин-4-ола, 2,0 мл хлористого метакилоила и 3,10 мл триэтиламина в хлористом метилене. Упомянутый выше продукт выделяют в виде бесцветного масла n
Анализ. Вычислено для C19H33NO3: C 70,6 H 10,3 N 4,3.
Найдено: C 70,0 H 10,6 N 4,3.
Пример 5. 1-Метокси-2,2,6,6-тетраметил-4-акрилоилоксипиперидин. Методику примера 3 повторяют, используя 3,51 г 1-метокси-2,2,6,
6-тетраметилпиперидин-4-ола, 1,6 мл хлористого акрилоила и 3,10 мл триэтиламина в хлористом метилене. Упомянутый выше продукт выделяют в виде бесцветной жидкости n
Анализ. Вычислено для C13H23NO3: C 64,7 H 9,6 N 5,8.
Найдено: C 64,0 H 9,8 N 5,6.
1-Метокси-4-метакрилоилокси-2,2,6,6-тетраметилпиперидин получают посредством замещения эквивалентным количеством метакрилоилхлорида вместо акрилоилхлорида.
Пример 6. 1-Циклогексил-2,2,6,6-тетраметил-4-акриламидопиперидин. Методику примера 3 повторяют, используя 3,0 г 4-амино-1-циклогексилокси-2,2,6,6-тетраметилпиперидина, 0,92 мл акрилоилхлорида и 1,8 триэтиламина в хлористом метилене. Указанное в заголовке вещество выделяют в виде белого твердого соединения, точка плавления 154-161oC.
Анализ. Вычислено для C18H32N2O2: C 70,1 H 10,5 N 9,1.
Найдено: C 70,5 H 10,8 N 9,0.
Пример 7. N, N-Бис-(1-циклогексилокси-2, 2,6,6-тетраметилпиперидин-4-ил)акриламид. Указанное в заголовке соединение получают, когда в методике примера 6 эквивалентное количество 4-амино-1-циклогексилокси-2,2,6, 6-тетраметилпиперидина замещают на N,N-бис-(1-циклогексилокси-2,2,6,6-тетраметилпиперидин-4-ил)амин.
Пример 8. 1-Октилокси-2,2,6.6-тетраметил-4-акрилоилоксипиперидин. Методику примера
3 повторяют, используя
эквивалентное количество 1-октилокси-2,2,6,6-тетраметилпиперидин-4-ола вместо 1-циклогексил-2,2,6,6-тетраметилпиперидин-4-ола, чтобы получить указанное в заголовке соединение в
виде бесцветной
жидкости. n
Анализ. Вычислено для C20H37NO3: C 70,8 H 11,0 N 4,1.
Найдено: C 71,0 H 10,8 N 4,6.
Пример 9. 4-Малеимидо-1-циклогексилокси-2,2,6,6-тетраметилпиперидин. К раствору 5,29 г 4-амино-циклогексилокси-2,2,6,6-тетраметилпиперидина в 50 мл ацетона по каплям добавляют в течение 10 мин раствор малеинового ангидрида (1,96 г) в ацетоне. После нагревания с обратным холодильником в течение 30 мин получают промежуточную малеаминовую кислоту. Раствор малеаминовой кислоты, ацетат натрия (0,3 г) и 6,4 мл уксусного ангидрида нагревают при 80oC в течение 2 ч. Затем раствор концентрируют при пониженном давлении и остаток очищают методом жидкостной хроматографии, чтобы получить указанное в заголовке соединение в виде белого твердого вещества с температурой плавления 135-139oC.
Анализ. Вычислено для C19H30N2O6 C 68,2 H 9,0 N 8,4.
Найдено: C 68,6 H 9,3 N 8,4.
Пример 10. 1-Циклогексилокси-2,2,6,6-тетраметил-4-винилбензилоксипиперидин. Раствор 1-циклогексилокси-2,2,6,6-тетраметилпиперидин-4-ола (5,11 г в N,N-диметилформамиде) добавляют по каплям к
перемешиваемой суспензии гидрида натрия (0,88 г 60-ной дисперсии). После перемешивания реакционной смеси при комнатной температуре в течение 1 ч и при 60oC в течение 30 мин добавляют
раствор хлористого винилбензила (3,05 г) в 5 мл N,N-диметилформамида. Реакционную смесь нагревают при 75oC в течение 7 ч. Затем реакционную смесь концентрируют при пониженном давлении и
остаток распределяют
между этилацетатом и водой. Органический слой промывают водой, сушат над безводным сульфатом магния и затем выпаривают, чтобы получить желтое масло. Методом препаративной
жидкости хроматографии получают указанное в заголовке соединение в виде светложелтого масла. n
Анализ. Вычислено для C24H37NO2: C 77,6 H 10,0 N 3,8.
Найдено: C 77,4 H 10,2 N 3,7.
Пример 11. 1-Октилокси-2,2,6, 6-тетраметил-4-акрилоилоксипиперидин. К раствору 4-акрилоилокси-2,2,6,6-тетраметилпиперидин-1-оксила (10,0 г) в 150 мл н-октана добавляют 0,6 г триоксида молибдена. Образовавшуюся суспензию нагревают с обратным холодильником и вставленной ловушкой Дина и Старка. По каплям добавляют 70-ный водный раствор трет-бутилгидроперекиси (17,0 г) в течение 30 мин с удалением азеотропа. После кипячения в течение 8 ч бесцветную реакционную смесь охлаждают до комнатной температуры и суспендированный катализатор удаляют посредством фильтрации. Фильтрат перемешивают с водным раствором бисульфита натрия в течение 1 ч. Органический слой промывают рассолом, сушат над безводным сульфатом магния и затем выпаривают. Методом жидкостной хроматографии остатка получают указанное в заголовке соединение в виде бесцветной жидкости.
Анализ. Вычислено для C20H37NO3: C 70,8 H 11,0 N 4,1.
Найдено: C 70,6 H 11,1 N 4,1.
Пример 12. 4-Аллилокси-1-октилокси-2,2,6,6 тетраметилпиперидин. К раствору 4-гидрокси-1-октилокси-2,2,6,6-тетраметилпиперидина (30,0 г, 105 ммоль) в 150 мл тетрагидрофурана добавляют гидрид натрия (2,65 г, 110 ммоль) в атмосфере азота. Реакционную смесь нагревают с обратным холодильником в течение 3 ч, охлаждают до 35oC и обрабатывают 12,7 г (110 ммоль) бромистого аллила. Реакционную смесь нагревают с обратным холодильником в течение 1 ч, затем распределяют между этилацетатом (150 мл) и водой (50 мл). Органический слой промывают насыщенным раствором хлористого натрия (100 мл), сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток растворяют в 50 мл гептана и пропускают через набивку с силикагелем (алюент смесь 5:1 гептан + этилацетат). Сырой продукт очищают методом флэш-хроматографии (силикагель; 9:1 гептан этилацетат), чтобы получить 23,9 г (выход 70) указанного в заголовке соединения в виде бесцветного масла.
Анализ. Вычислено для C20H39NO2: C 73,8 H 12,1 N 4,3.
Найдено: C 74,0 H 12,7 N 4,7.
Пример 13. 1-Октилокси-4-метакрилоилокси-2,2,6,
6-тетраметилпиперидин.
Повторяют методику примера 3, используя 1-октилокси-4-гидрокси-2,2,6,6-тетраметилпиперидин, хлористый метакрилоил и триэтиламин в хлористом метилене, чтобы получить указанное в
заголовке соединение в
виде бесцветного масла n
Анализ. Вычислено для C21H39NO3: C 71,3 H 11,1 N 4,0.
Найдено: C 71,3 H 11,2 N 4,2.
Пример 14. Светостабилизация полипропилена. Этот пример иллюстрирует эффективность стабилизаторов изобретения как светостабилизаторов. Порошок полипропилена (Хаймонт Профакт 6501), стабилизированный 0,2 мас. н-октадецилового эфира 3,5-ди-трет-бутил-4-гидроксикоричной кислоты тщательно смешивают с указанным количеством добавки. Затем смешанные материалы размалывают на двухшариковой мельнице при 182oC в течение 5 мин, после чего стабилизированный полипропилен прокатывается из мельницы в листы и охлаждается. Размолотый полипропилен затем нарезается на куски и формируется под давлением на гидравлическом прессе при 250oC и 175 фунт/кв.дюйм (1,2 МПа) в пленку толщиной 5 мил (0,127 мм). Этот образец подвергают воздействию флуоресцентного солнечного света/черного света (ФС/4с) в камере до разрушения. Разрушение оценивается в ч, необходимых для достижения 50 карбонильного поглощения в ИК-спектре экспонированных пленок (см. табл. 5).
Пример 15. Мономерную композицию, включающую 23,5 бутилакрилата, 27 бутилметакрилата, 30 2-гидроксиэтилакрилата, 15 стирола, 3 акриловой кислоты и 1,5 акрилатного мономера, приготовленного в примере 11 (все процентные значения являются весовыми) и 0,4 трет-амилперокси-0-(20 этилгексил) монопероксикарбонатного инициатора, полимеризуют в кипящем ксилоле, чтобы образовался стабилизированный акриловый полиоловый полимер, имеющий молекулярный вес 1300 (среднечисловой) и 6000 (средневесовой).
Пример 16. Стабилизированный акриловый полиол, приготовленный в примере 15, смешивают с достаточным количеством нестабилизированного акрилового полиола, полученного по той же самой методике примера 15, но 1,5 мас. акрилатного мономера примера 11 заменяют бутилакрилатом, так что в описанной далее конечной акрилово-меламиновой рецептуре присутствует 1 пространственно затрудненного аминного акрилата в расчете на сумму твердых смол. Акрилово-меламинная рецептура включает (все величины даны в весовых частях): 70 частей описанной выше акриловой полиоловой смеси, 18 частей меламинной смоля (Цимел 303, фирма Америкэн Цианамид), 0,51 части сернокислотного катализатора (D D BSA Цикат, 70 600, фирма Америкэн Цианамид), 0,6 частей промотора текучести (FC 431, 30 твердых фтороуглеводородов, ЗМ) и 8,8 частей метиламилкетона. Термореактивные акриловые эмали готовят, используя цитированные выше рецептуры. Куски стального листового материала 9,16•30,48 см, покрытые полиэфирной /эпоксидной грунтовкой, затем покрывают серебряным металлическим основным покрытием и окончательно отделочной эмалью. Основное покрытие разбрызгивается на лист с покрытием до толщины около 0,023 мм и сушится на воздухе в течение 3 мин. Затем на лист распыляется прозрачная отделочная эмаль до толщины примерно 0,05 мм. После высушивания на воздухе в течение 10 мин покрытые листы прогреваются в течение 30 мин при 121oC. Затем определяются значения Кнооповской твердости прогретых покрытий.
Твердость по Кноопу кислотно отвержденных покрытий с высоким содержанием твердого вещества (присутствующий
светостабилизатор, мас.):
Контроль 9,3
1 сополимера примера 15 9,
4
+ 3 сополимера примера 15 + 3 поглотителя УФ-излучения* 9,1
1 сополимера
затрудненного амина, не имеющего группу H-OR1** 1,0
*2-(2-гидрокси-3,5-ди-трет-амилфенил)-2H-бензотриазол
** акриловый полиол,
произведенный из 1,2,2,6,6-пентаметил-4-акрилоилоксипиперидина.
Эффективность отверждения оценивалась по значениям твердости по Коопу. Более высокие величины соответствуют повышенной твердости и улучшенному отверждению. Соединения изобретения, имеющие N-гидрокарбилокси-группу, не вызывают торможения отверждения, что характерно для таких соединений, которые имеют N-алкилзамещение.
После хранения в течение 1 недели в помещении с кондиционированным воздухом эти покрытые панели выветривали в установке для QUV экспозиции в соответствии со стандартом ASTM G-53/77 с использованием пузырьков FS-40 (см. табл. 6).
Пример 17. Составляется двухкомпонентное акрилово-уретановое отделочное покрытие на основе полиола, состоящего из мономеров, таких как 2-гидроксиэтилакрилат, бутилакрилат, бутилметакрилат, стирол и ариловая кислота, и алифатической изоцианатной сшивающей смолы (марка Десмодур ЭН-3390 от фирмы Моубэй Корп. ) в соотношении 1,05/1,00, с тем чтобы оно включало 1 мас. светостабилизатора пространственно затрудненного амина. Промышленно доступные стальные панели 10,16•30,48 см (фирма Адванст Коутингз Текнолоджи) сначала грунтуют имеющейся в продаже эпоксидной грунтовкой и затем покрывают распылением термопластичного серебряного металлического основного покрытия до толщины примерно 0,023 мм и сушат на воздухе в течение 5 мин. Затем распыляют стабилизированное акриловоуретановое прозрачное покрытие на основное покрытие до толщины около 0,049 мм. После хранения в течение 1 месяца в помещении с кондиционированным воздухом покрытие панели проветривают в Везерометре с ксеноновым излучением. Блеск и различение образа (РО) измеряли с интервалом в 300 ч (см. табл. 7).
Пример 18. Серебряную металлическую акрилово-алкидную эмаль стабилизируют указанным количеством поглотителя УФ-излучения и производной пространственно затрудненного амина (на вес суммы твердого вещества смолы) и затем распыляют до толщины 0,07 мм на панелях, загрунтованных эпоксидно-аминной грунтовкой. После старения покрытых панелей при комнатной температуре в течение 1 мес их экспонировали в Везерометре с ксеноновым излучением, причем блеск при 60o измеряли с интервалом в 100 ч (см. табл. 8).
Реферат
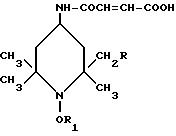
Использование: в качестве мономерных сополимеризующихся стабилизаторов света. Сущность изобретения: продукт - этиленовоненасыщенный полимеризующийся мономер на основе производного пиперидина ф-лы I, где R1-C1-C18-алкил или циклогексил, E - радикал ф-лы -X-CO-(CH=CH)2-COX-R3, X-CO-CR2=CH2, -X-CH2-C6H4-CH= CH2, -X-CH2-CH=CH2 или -O-CO-(C4H6)m-CO-O-R3, где X обозначает -O- или -NH-, R2 - водород или метил, m - целое число от 1 до 30. Реагент 1: пиперидинол ф-лы II. Реагент 2: производное ненасыщенной карбоновой кислоты. Условия реакции: в среде инертного органического растворителя в присутствии амина.
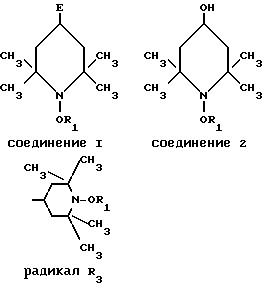
2 з.п. ф-лы, 8 табл.
Формула

где R1 С1 С18-алкил или циклогексил;
Е радикал формулы

Х-СО-CR2=СН2,


-X-CH2-CH‗CH2
или
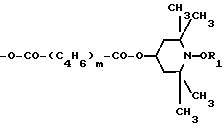
где Х -О или -NH-;
R2 водород или метил;
m 10 30 целое число.

Комментарии