N-замещенные производные пиперидина в качестве агентов серотонинового рецептора - RU2320646C2
Код документа: RU2320646C2
Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к азациклическим соединениям с фармакокинетическими свойствами для лечения симптомов, заболеваний и расстройств, связанных с моноаминовыми рецепторами, включая серотониновые рецепторы.
Уровень техники
Серотонин или 5-гидрокситриптамин (5-HT) играет существенную роль в функционировании организма млекопитающего. В центральной нервной системе 5-HT является важным нейротрансмиттером и нейромодулятором, который вовлечен в такие разнообразные формы поведения и реакции, как сон, питание, локомоция, восприятие боли, познавательная способность и память, сексуальное поведение, контроль температуры тела и кровяного давления. В спинном мозге серотонин играет важную роль в контролирующих системах афферентных периферических ноцицепторов (Moulignier, Rev. Neurol., 150:3-15 (1994)). 5-HT также были приписаны периферические функции в сердечно-сосудистой, гематологической и желудочно-кишечной системах. Было обнаружено, что 5-HT медиирует разнообразные сократительные, секреторные и электрофизиологические эффекты, включая сокращение сосудистых и несосудистых гладких мышц и агрегацию тромбоцитов (Fuller, Biology of Serotonergic Transmission, 1982; Boullin, Serotonin in Mental Abnormalities 1:316 (1978); Barchas et al., Serotonin and Behavior (1973)). 5-HT2A подтип рецептора (также называемый подклассом) широко и, помимо этого, дискретно экспрессируется в головном мозге человека, включая многие корковые, лимбические области и область переднего мозга, которые, как предполагают, включены в модуляцию высших познавательных и аффективных функций. Данный подтип рецептора также экспрессируется на зрелых тромбоцитах, где он опосредует, в свою очередь, агрегацию тромбоцитов, одну из начальных стадий процесса тромбоза сосудов.
При условии широкого распределения серотонина в организме, понятно, что существует огромная заинтересованность в лекарствах, которые воздействуют на серотонинергические системы (Gershon et al., The Peripheral Actions of 5-Hydroxytryptamine, 246 (1989); Saxena et al., J. Cardiovascular Pharmacol. 15: Supp. 7 (1990)). Серотониновые рецепторы являются членами огромного генного семейства мембранно-связанных белков человека, которые функционируют как трансдукторы межклеточной коммуникации. Они существуют на поверхности различных типов клеток, включая нейроны и тромбоциты, где при их активации эндогенным лигандом серотонина, либо экзогенно вводимыми лекарствами, они изменяют свою конформационную структуру и затем взаимодействуют с последующими медиаторами клеточной передачи сигнала. Многие из данных рецепторов, включая подкласс 5-HT2A, являются связанными с G-белком рецепторами (GPCR), которые передают сигнал, активируя белки, связывающие гуаниновые нуклеотиды (G-белки), приводя к генерированию или ингибированию молекул вторичных мессенджеров, таких как циклическая АМФ, инозитолфосфаты и диацилглицерин. Данные вторичные мессенджеры затем модулируют функцию разнообразных внутриклеточных ферментов, включая киназы и ионные каналы, которые, в конечном счете, воздействуют на возбудимость и функцию клетки.
По меньшей мере, 15 генетически различных подтипов 5-HT рецепторов были идентифицированы и приписаны к одному из семи семейств (5-HT1-7). Каждый подтип показывает уникальное распределение, предпочтение к различным лигандам и функциональную корреляцию.
Серотонин может являться важным компонентом в различных типах болезненных состояний, таких как определенные психиатрические расстройства (депрессия, агрессивность, приступы паники, обсессивно-компульсивные расстройства, психоз, шизофрения, суицидная тенденция), определенные нейродегенеративные расстройства (деменция альцгеймеровского типа, паркинсонизм, хорея Гентингтона), анорексия, булимия, расстройства, связанные с алкоголизмом, инсульт и мигрень (Meltzer, Neuropsychopharmacology, 21:106S-115S (1999); Barnes & Sharp, Neuropharmacology, 38:1083-1152 (1999); Glennon, Neurosci. Biobehavioral Rev., 14:35 (1990)). Недавно доказано сильное вовлечение 5-HT2 подтипа рецептора в этиологию таких медицинских состояний, как гипертензия, тромбоз, мигрень, спазм сосудов, ишемия, депрессия, тревога, психоз, шизофрения, расстройства сна и расстройства аппетита.
Шизофрения представляет собой особенно разрушительное нейропсихиатрическое расстройство, которым страдает примерно 1% человеческой популяции. Было оценено, что общая финансовая стоимость диагностики, лечения и потери социальной продуктивности индивидуумов, страдающих данным заболеванием, превышает 2% валового национального продукта (ВНП) Соединенных Штатов. Современная терапия, прежде всего, включает фармакотерапию с использованием класса лекарств, известных как антипсихотические препараты. Антипсихотические препараты являются эффективными для улучшения позитивных симптомов (например, галлюцинаций и бреда), но они часто не улучшают негативные симптомы (например, социальную и эмоциональную абстиненцию, апатию и невыраженность речи).
В настоящее время прописывается девять основных классов антипсихотических препаратов для лечения психотических симптомов. Однако использование данных соединений ограничивается профилем их побочных эффектов. Почти все ″типичные″ соединения или соединения старого поколения обладают существенным неблагоприятным воздействием на моторную функцию человека. Данные ″экстрапирамидальные″ побочные эффекты, названные так из-за своего воздействия на модулирующие моторные системы человека, могут быть как острыми (например, дистонические реакции, потенциально угрожающий жизни, но редкий нейролептический злокачественный синдром), так и хроническими (например, акатизия, тремор и поздняя дискенизия). Поэтому разработка лекарств фокусируется на новых ″атипичных″ веществах, не имеющих данные неблагоприятные побочные эффекты.
Антипсихотические лекарства, как было показано, взаимодействуют с огромным числом центральных моноаминергических нейротрансмиттерных рецепторов, включая допаминергические, серотонинергические, адренергические, мускариновые и гистаминергические рецепторы. Возможно, что терапевтическое и неблагоприятное воздействие данных лекарств опосредуется различными подтипами рецепторов. Высокая степень генетической и фармакологической гомологии данных подтипов рецепторов затрудняет разработку селективных к подтипам соединений, а также определение нормальной физиологической или патофизиологической роли любого конкретного подтипа рецептора. Таким образом, существует необходимость в разработке лекарств, которые являются селективными по отношению к индивидуальным классам и подклассам рецепторов среди моноаминергических нейротрансмиттерных рецепторов.
Наиболее распространенная теория, описывающая механизм действия антипсихотических лекарств, включает антагонизм допаминовых D2 рецепторов. К сожалению, существует вероятность того, что антагонизм допаминовых D2 рецепторов также опосредует экстрапирамидальные побочные эффекты. Антагонизм 5-HT2A является альтернативным молекулярным механизмом для лекарств с антипсихотической эффективностью, возможно посредством антагонизма повышенной или усиленной сигнальной трансдукции через серотонинергические системы. Поэтому антагонисты 5-HT2A являются хорошими кандидатами для лечения психоза без экстрапирамидальных побочных эффектов.
Обычно данные рецепторы, как было предположено, находятся в состоянии покоя, если они не активированы связыванием агониста (лекарство, которое активирует рецептор). К настоящему моменту времени понято, что существенная часть, если не большая, GPCR моноаминовых рецепторов, включая серотониновые рецепторы, может существовать в частично активированном состоянии в отсутствие своих эндогенных агонистов. Данную повышенную базальную активность (конститутивную активность) можно ингибировать соединениями, называемыми обратными агонистами. Как агонисты, так и обратные агонисты обладают собственной активностью по отношению к рецептору, заключающейся в том, что они одни могут, соответственно, активировать или дезактивировать данные молекулы. Противоположным образом классические или нейтральные антагонисты конкурируют с агонистами и обратными агонистами за доступ к рецептору, но не обладают присущей им способностью ингибировать повышенные базальные или конститутивные реакции рецептора.
Заявители недавно выяснили важный аспект функции 5HT2A рецептора, используя Технологию выбора и амплификации рецептора (R-SAT) (патент США 5707798, 1998; Chem. Abstr. 128:111548 (1998) и содержащиеся там ссылки) для изучения 5-HT2 подкласса серотониновых рецепторов. R-SAT представляет собой фенотипический анализ функции рецептора, который включает гетерологическую экспрессию рецепторов в фибропластах млекопитающих. Используя данную методику, у заявителей была возможность продемонстрировать, что природные 5-HT2A рецепторы обладают значительной конститутивной, или не зависящей от агониста, рецепторной активностью (патент США 6358698; Weiner et al. J. Pharmacol. Exp. Ther. 2001, 299 (1), 268-276, которые включены в настоящее описание посредством ссылки во всей своей полноте, включая рисунки). Более того, прямым тестированием огромного числа центрально действующих лекарственных соединений с известной клинической активностью при нейропсихиатрических заболеваниях заявители определили, что все соединения с антипсихотической эффективностью обладают общим молекулярным свойством. Почти каждое из данных соединений, используемых психиатрами для лечения психоза, как было обнаружено, является мощным обратным агонистом 5-HT2A. Данная уникальная клинико-фармакологическая корреляция для одного подтипа рецептора является убедительным доказательством того, что обратный агонизм 5-HT2A рецептора является молекулярным механизмом антипсихотической эффективности в организме человека.
Детальная фармакологическая характеризация большого числа антипсихотических соединений показала, что они обладают широкой активностью по отношению ко многим родственным подтипам рецепторов. Большинство данных соединений показывает агонистическую, конкурентную антагонистическую или обратную агонистическую активность по отношению ко многим подтипам моноаминергических рецепторов, включая серотонинергические, допаминергические, адренергические, мускариновые и гистаминергические рецепторы. Данная широкая активность, вероятно, отвечает за седативные, гипотензивные и моторные побочные эффекты данных соединений. Поэтому было бы огромным достижением разработать соединения, которые являются селективными обратными агонистами 5-HT2A рецептора, которые обладают незначительной или вообще не обладают активностью к другим подтипам моноаминовых рецепторов, особенно к допаминовым D2 рецепторам. Такие соединения могут быть применимы при лечении заболевания человека (например, в качестве антипсихотических препаратов) и могут избежать неблагоприятных побочных эффектов, ассоциированных с неселективными взаимодействиями с рецепторами.
US 4853394 описывает сложные эфиры и амиды N-(гидроксиэтилпиперид-4-ила), которые усиливают двигательную функцию желудка, обладают антирвотной активностью и 5-HT антагонистической активностью.
EP 0260070 описывает 4-(4-(4-хлорфенил)-4-гидрокси-1-пиперидинил)-1-(4-фторфенил)-1-бутаноновый эфир уксусной кислоты для купирования, облегчения, предупреждения или ингибирования проявления психических отклонений.
Сущность изобретения
Описываются соединения формулы I
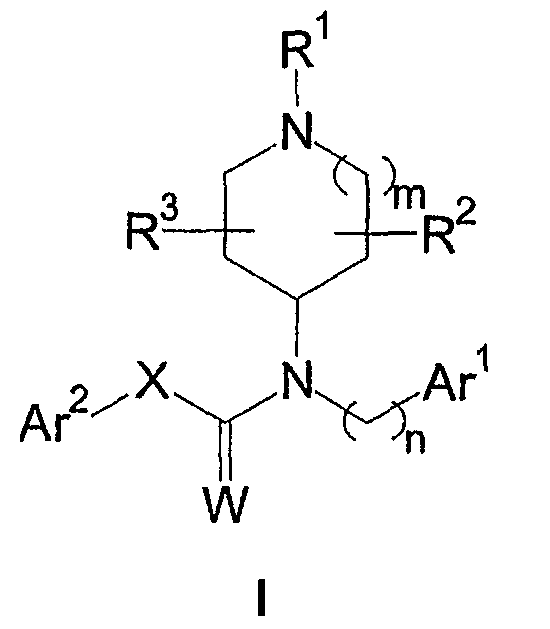
или их фармацевтически приемлемые соли, амиды, сложные эфиры или пролекарства,
где R1 выбран из группы, состоящей из необязательно замещенного гетероциклила и необязательно замещенного (гетероциклил)C1-6-алкила;
R2 и R3 независимо выбраны из группы, состоящей из водорода, C1-6-алкила и галогена, или R2 вместе с R3 образует кольцо;
m выбран из группы, состоящей из 0, 1 и 2;
n выбран из группы, состоящей из 1, 2 и 3;
Ar1 представляет собой необязательно замещенный арил или гетероарил;
W выбран из группы, состоящей из O и S;
X выбран из группы, состоящей из необязательно замещенного метилена, необязательно замещенного этилена, необязательно замещенного пропилена, необязательно замещенного винилена и CH2N(RN), где RN выбран из водорода и C1-6 -алкила, и
Ar2 представляет собой необязательно замещенный арил или гетероарил.
Также описаны способы ингибирования активности моноаминового рецептора, включающие контактирование моноаминового рецептора или системы, содержащей моноаминовый рецептор, с эффективным количеством одного или нескольких соединений формулы I. Также описаны способы ингибирования активации моноаминового рецептора, включающие контактирование моноаминового рецептора или системы, содержащей моноаминовый рецептор, с эффективным количеством одного или нескольких соединений формулы I. Кроме того, описаны способы лечения психотического заболевания с использованием соединения формулы I.
Подробное описание изобретения
В данном описании следующие ниже определения будут использоваться во всей их полноте для определения технических терминов, а также будут использоваться во всей их полноте для определения объема притязаний группы изобретений, для которой испрашивается защита в формуле изобретения. Термин ″конститутивная активность″ определяется как базальная активность рецептора, которая не зависит от присутствия агониста. Конститутивную активность рецептора можно измерить с использованием ряда различных способов, включая клеточные (например, мембранные) препараты (см., например, Barr & Manning, J. Biol. Chem. 272:32979-87 (1997)), очищенные восстановленные рецепторы, содержащие или не содержащие связанный G-белок в фосфолипидных везикулах (Cerione et al., Biochemistry 23:4519-25 (1984)), и функциональные клеточные анализы (патент США 6358698).
Термин ″агонист″ означает соединение, которое увеличивает активность рецептора при его контактировании с рецептором.
Термин ″антагонист″ означает соединение, которое конкурирует с агонистом или обратным агонистом за связывание с рецептором, посредством этого блокируя действие агониста или обратного агониста на рецептор. Однако антагонист (также известный как ″нейтральный″ антагонист) не действует на конститутивную рецепторную активность.
Термин ″обратный агонист″ означает соединение, которое снижает базальную активность рецептора (т.е. опосредованную рецептором передачу сигналов). Такие соединения также известны как отрицательные антагонисты. Обратный агонист является лигандом для рецептора, приводя к тому, что рецептор принимает неактивное состояние относительно базального состояния, имеющего место в отсутствие любого лиганда. Таким образом, в то время как антагонист может ингибировать активность агониста, обратный агонист представляет собой лиганд, который может изменить конформацию рецептора в отсутствие агониста. Понятие обратного агониста было введено Bond et al. в Nature 374:272 (1995). Более конкретно, Bond et al. предположили, что не связанный с лигандом β2-адреноцептор существует в равновесии между неактивной конформацией и спонтанно-активной конформацией. Предполагается, что агонисты стабилизируют рецептор в активной конформации. Наоборот, обратные агонисты, как полагают, стабилизируют неактивную конформацию рецептора. Таким образом, в то время как антагонист проявляет свою активность посредством ингибирования агониста, обратный агонист может дополнительно проявлять свою активность в отсутствие агониста, ингибируя самопроизвольную конверсию не связанного с лигандом рецептора в активную конформацию.
Термин ″5-HT2A рецептор″ означает рецептор, обладающий активностью, соответствующей активности подтипа серотонинового рецептора человека, который характеризуется молекулярным клонированием и фармакологией, как детально описано Saltzman et al. в Biochem. Biophys. Res. Comm. 181:1469-78 и Julius et al. в Proc. Natl. Acad. Sci. USA 87:928-932.
Термин ″субъект″ относится к животному, предпочтительно к млекопитающему, наиболее предпочтительно к человеку, который является объектом лечения, обследования или эксперимента.
Термин ″селективный″ определяется как свойство соединения, в соответствии с которым количество соединения, достаточное для осуществления желаемого ответа конкретного типа, подтипа, класса или подкласса рецептора, вызывает значительно меньшее действие или не оказывает воздействия на активность других типов рецептора.
Термины ″селективность″ или ″селективный″, в отношении обратного агониста, понимают как свойство соединения по изобретению, в соответствии с которым количество соединения, оказывающее эффективное воздействие обратного агониста на 5-HT2A рецептор и, таким образом, снижающее его активность, вызывает незначительную или вообще не вызывает обратноагонистическую или антагонистическую активность на другие, родственные или неродственные рецепторы. В частности, определенные соединения по изобретению, как было обнаружено, по существу не взаимодействуют с другими серотониновыми рецепторами (5-HT 1A, 1B, 1D, 1E, 1F, 2B, 2C, 4A, 6 и 7) при концентрациях, при которых передача сигнала 5-HT2A рецептором сильно или полностью подавлена. Предпочтительно соединения по изобретению также являются селективными по отношению к другим моноаминсвязывающим рецепторам, таким как допаминергические, гистаминергические, адренергические и мускариновые рецепторы. Соединения, которые являются высокоселективными по отношению к 5-HT2A рецепторам, могут обладать целебным действием при лечении психоза, шизофрении или аналогичных психоневрологических расстройств, в то же время избегая неблагоприятных эффектов, вызванных лекарствами, предлагаемыми для этой цели до настоящего времени.
EC50 для агониста означает концентрацию соединения, необходимую для достижения 50% от максимального ответа, видимого в R-SAT. Для обратных агонистов EC50 означает концентрацию соединения, необходимую для достижения 50% ингибирования R-SAT ответа от базальных уровней в отсутствие соединения.
Используемый в данном описании термин ″ совместное введение″ фармакологически активных соединений относится к доставке двух или более различных химических веществ in vitro или in vivo. Совместное введение относится к одновременной доставке различных веществ, к одновременной доставке смеси веществ, а также к доставке одного вещества, после чего следует доставка второго вещества или дополнительных веществ. Во всех случаях вещества, которые вводятся совместно, предназначены для работы в сочетании друг с другом.
В настоящем контексте термин ″арил″ означает карбоциклическое ароматическое кольцо или циклическую систему. Кроме того, термин ″арил″ включает конденсированные циклические системы, в которых, по меньшей мере, два арильных кольца или, по меньшей мере, один арил и, по меньшей мере, один C3-8-циклоалкил имеют, по меньшей мере, одну общую химическую связь. Некоторые примеры ″арильных″ колец включают необязательно замещенный фенил, нафталинил, фенантренил, антраценил, тетралинил, флуоренил, инденил и инданил. Термин ″арил″ относится к ароматическим, предпочтительно бензольным группам, присоединенным через один из атомов углерода, образующего кольцо, и необязательно несущим один или несколько заместителей, выбранных из гетероциклила, гетероарила, галогена, гидрокси, амино, циано, нитро, алкиламидо, ацила, C1-6-алкокси, C1-6-алкила, C1-6-гидроксиалкила, C1-6-аминоалкила, C1-6-алкиламино, алкилсульфенила, алкилсульфинила, алкилсульфонила, сульфамоила или трифторметила. Арильная группа может быть замещена в пара- и/или мета-положении. Типичные примеры арильных групп включают, но не ограничиваются ими, фенил, 3-галогенфенил, 4-галогенфенил, 3-гидроксифенил, 4-гидроксифенил, 3-аминофенил, 4-аминофенил, 3-метилфенил, 4-метилфенил, 3-метоксифенил, 4-метоксифенил, 4-трифторметоксифенил, 3-цианофенил, 4-цианофенил, диметилфенил, нафтил, гидроксинафтил, гидроксиметилфенил, трифторметилфенил, алкоксифенил, 4-морфолин-4-илфенил, 4-пирролидин-1-илфенил, 4-пиразолилфенил, 4-триазолилфенил и 4-(2-оксопирролидин-1-ил)фенил.
В настоящем контексте термин ″гетероарил″ означает гетероциклическую ароматическую группу, в которой один или несколько атомов углерода в ароматическом кольце заменены одним или несколькими гетероатомами, выбранными из группы, включающей азот, серу, фосфор и кислород.
Кроме того, в настоящем контексте термин ″гетероарил″ включает конденсированные циклические системы, в которых, по меньшей мере, одно арильное кольцо и, по меньшей мере, одно гетероарильное кольцо, по меньшей мере, два гетероарильных кольца, по меньшей мере, одно гетероарильное кольцо и, по меньшей мере, одно гетероциклическое кольцо или, по меньшей мере, одно гетероарильное кольцо и, по меньшей мере, одно C3-8-циклоалкильное кольцо имеют, по меньшей мере, одну общую химическую связь.
Имеется в виду, что термин ″гетероарил″ относится к ароматическим, C3-8-циклическим группам, дополнительно содержащим один атом кислорода или серы или вплоть до четырех атомов азота, или комбинацию одного атома кислорода или серы с одним или двумя атомами азота, и их замещенным соединениям, а также к бензо- и пиридо-конденсированным производным, предпочтительно присоединенным через один из образующих кольцо атомов углерода. Гетероарильные группы могут содержать один или несколько заместителей, выбранных из галогена, гидрокси, амино, циано, нитро, алкиламидо, ацила, C1-6-алкокси, C1-6-алкила, C1-6-гидроксиалкила, C1-6-аминоалкила, C1-6-алкиламино, алкилсульфенила, алкилсульфинила, алкилсульфонила, сульфамоила или трифторметила. В некоторых вариантах осуществления гетероарильные группы могут представлять собой пяти- или шестичленные ароматические гетероциклические системы, содержащие 0, 1 или 2 заместителя, которые могут быть одинаковыми или отличными друг от друга, выбранными из указанного выше списка. Типичные примеры гетероарильных групп включают, но не ограничиваются ими, незамещенные, моно- или дизамещенные производные фурана, бензофурана, тиофена, бензотиофена, пиррола, пиридина, индола, оксазола, бензоксазола, изоксазола, бензизоксазола, тиазола, бензотиазола, изотиазола, имидазола, бензимидазола, пиразола, индазола, тетразола, хинолина, изохинолина, пиридазина, пиримидина, пурина и пиразина, каждое из которых является предпочтительным, а также фуразана, 1,2,3-оксадиазола, 1,2,3-тиадиазола, 1,2,4-тиадиазола, триазола, бензотриазола, птеридина, феноксазола, оксадиазола, бензопиразола, хинолизина, циннолина, фталазина, хиназолина и хиноксалина. В некоторых вариантах осуществления заместители представляют собой галоген, гидрокси, циано, O-C1-6-алкил, C1-6-алкил, гидрокси-C1-6-алкил, амино-C1-6-алкил.
Имеется в виду, что в настоящем контексте термин ″алкил″ и ″C1-6-алкил″ означает прямую или разветвленную насыщенную углеводородную цепь, в которой наиболее длинная цепь имеет от одного до шести атомов углерода, например метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил и гексил. Алкильная цепь необязательно может быть замещенной.
Имеется в виду, что термин ″гетероциклил″ означает трех-, четырех-, пяти-, шести-, семи- и восьмичленные кольца, в которых атомы углерода вместе с 1-3 гетероатомами составляют указанное кольцо. Гетероциклил необязательно может содержать одну или несколько ненасыщенных связей, расположенных, однако, таким образом, что ароматическая π-электронная система не возникает. Гетероатомы независимо выбраны из кислорода, серы и азота.
Гетероциклил может дополнительно содержать одну или несколько карбонильных или тиокарбонильных функциональных групп с тем, чтобы данное определение включало оксо-системы и тио-системы, такие как лактамы, лактоны, циклические имиды, циклические тиоимиды, циклические карбаматы и т.п.
Гетероциклильные кольца необязательно могут быть конденсированы с арильными кольцами так, что данное определение включает бициклические структуры. Предпочтительными являются такие конденсированные гетероциклильные группы, которые имеют одну общую связь с необязательно замещенным бензольным кольцом. Примеры гетероциклильных групп, конденсированных с бензольным кольцом, включают, но не ограничиваются ими, бензимидазолидинон, тетрагидрохинолин и метилендиоксибензольные кольцевые структуры.
Некоторые примеры ″гетероциклилов″ включают, но не ограничиваются ими, тетрагидротиопиран, 4H-пиран, тетрагидропиран, пиперидин, 1,3-диоксин, 1,3-диоксан, 1, 4-диоксин, 1,4-диоксан, пиперазин, 1,3-оксатиан, 1,4-оксатиин, 1,4-оксатиан, тетрагидро-1,4-тиазин, 2H-1,2-оксазин, малеимид, сукцинимид, барбитуровую кислоту, тиобарбитуровую кислоту, диоксопиперазин, гидантоин, дигидроурацил, морфолин, триоксан, гексагидро-1,3,5-триазин, тетрагидротиофен, тетрагидрофуран, пирролин, пирролидин, пирролидон, пирролидинон, пиразолин, пиразолидин, имидазолин, имидазолидин, 1,3-диоксол, 1,3-диоксолан, 1,3-дитиол, 1,3-дитиолан, изоксазолин, изоксазолидин, оксазолин, оксазолидин, оксазолидинон, тиазолин, тиазолидин и 1,3-оксатиолан. Связь с гетероциклом может быть в положении гетероатома или посредством атома углерода гетероцикла, или, для производных, конденсированных с бензольным кольцом, посредством атома углерода бензольного кольца.
Термин ″(гетероциклил)C1-6-алкил″ означает гетероциклильные группы, соединенные как заместители через алкильные группы, каждая из которых является такой, как определено в настоящем описании. Гетероциклильные группы (гетероциклил)C1-6-алкильных групп могут быть замещенными или незамещенными. Имеется в виду, что термин ″(гетероциклил)C1-6 -алкил″ означает алкильную цепь, замещенную, по меньшей мере, один раз гетероциклильной группой, обычно в положении конца алкильной цепи.
В настоящем контексте термин ″ C2-8-алкенил″ означает углеводородную группу с прямой или разветвленной цепью, имеющую от двух до восьми атомов углерода и содержащую одну или несколько двойных связей. Некоторые примеры C2-8-алкенильных групп включают аллил, гомоаллил, винил, кротил, бутенил, пентенил, гексенил, гептенил и октенил. Некоторые примеры C2-8-алкенильных групп, содержащих более одной двойной связи, включают бутадиенильную, пентадиенильную, гексадиенильную, гептадиенильную, гептатриенильную и октатриенильную группы, а также их разветвленные формы. Положение ненасыщенности (двойной связи) может находиться в любом положении углеродной цепи.
В настоящем контексте термин ″C2-8-алкинил″ означает углеводородную группу с прямой или разветвленной цепью, имеющую от двух до восьми атомов углерода и содержащую одну или несколько тройных связей. Некоторые примеры C2-8-алкинильных групп включают этинил, пропинил, бутинил, пентинил, гексинил, гептинил и октинил, а также их разветвленные формы. Положение ненасыщенности (тройной связи) может находиться в любом положении цепи. Ненасыщенной может быть больше чем одна связь, так что ″C2-8-алкинил″ представляет собой диин или ендиин, как известно специалисту в данной области.
В настоящем контексте термин ″C3-8-циклоалкил″ означает трех- четырех-, пяти-, шести-, семи- и восьмичленные кольца, включающие только атомы углерода. C3-8-циклоалкил необязательно может содержать одну или несколько ненасыщенных связей, расположенных, однако, таким образом, что ароматическая π-электронная система не возникает.
Некоторыми примерами предпочтительного ″C3-8-циклоалкила″ являются циклопропановый, циклобутановый, циклопентановый, циклопентеновый, циклопентадиеновый, циклогексановый, циклогексеновый, 1,3-циклогексадиеновый, 1, 4-циклогексадиеновый, циклогептановый, циклогептеновый карбоциклы.
Термины ″(арил)C1-6-алкил″ означают арильную группу, соединенную как заместитель через C1-6-алкильную группу, каждая из которых является такой, как определено в настоящем описании. Арильные группы (арил)C1-6-алкила могут быть замещенными или незамещенными. Примеры включают бензил, замещенный бензил, 2-фенилэтил, 3-фенилпропил и нафтилалкил.
Термины ″(циклоалкил)C1-6-алкил″ означают циклоалкильные группы, соединенные как заместители через алкильную группу, каждая из которых является такой, как определено в настоящем описании.
При использовании в настоящем описании термин ″O-C1-6 -алкил″ означает C1-6-алкилокси или алкокси, такие как метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, трет-бутокси, пентилокси, изопентилокси, неопентилокси и гексилокси.
Термин ″галоген″ включает фтор, хлор, бром и иод.
В настоящем контексте, т.е. в связи с терминами ″C1-6 -алкил″, ″арил″, ″гетероарил″, ″гетероциклил″, ″C3-8-циклоалкил″, ″гетероциклил(C1-6-алкил)″, ″ (циклоалкил)алкил″, ″O-C1-6-алкил″, ″C2-8-алкенил″ и ″C2-8-алкинил″, термин ″необязательно замещенный″ означает то, что рассматриваемая группа может быть замещенной один или несколько раз, например 1-5 раз или 1-3 раза или 1-2 раза, одной или несколькими группами, выбранными из C1-6-алкила, C1-6-алкокси, оксогруппы (которая может быть представлена в таутомерной енольной форме), карбоксила, амино, гидрокси (которая, когда присутствует в енольной системе, может быть представлена в таутомерной кетоформе), нитро, алкилсульфонила, алкилсульфенила, алкилсульфинила, C1-6-алкоксикарбонила, C1-6-алкилкарбонила, формила, амино, моно- и ди(C1-6 -алкил)амино, карбамоила, моно- и ди(C1-6-алкил)аминокарбонила, амино-C1-6-алкиламинокарбонила, моно- и ди(C1-6-алкил)амино-C1-6-алкиламинокарбонила, C1-6-алкилкарбониламино, C1-6-алкилгидроксиимино, циано, гуанидино, карбамидо, C1-6-алканоилокси, C1-6-алкилсульфонилокси, дигалоген-C1-6-алкила, тригалоген-C1-6-алкила, гетероциклила, гетероарила и галогена. В общем, вышеуказанные заместители могут быть восприимчивыми к дополнительному необязательному замещению.
Термин ″соли″ означает фармацевтически приемлемые кислотно-аддитивные соли, получаемые обработкой основной формы функциональной группы, такой как амин, соответствующими кислотами, такими как неорганические кислоты, например, галогеноводородными кислотами, обычно хлористоводородной, бромистоводородной, фтористоводородной или иодистоводородной кислотой, серной кислотой, азотной кислотой, фосфорной кислотой и т.п., или органическими кислотами, например уксусной, пропионовой, гидроксиуксусной, 2-гидроксипропионовой, 2-оксопропионовой, этандиовой, пропандиовой, бутандиовой, (Z)-2-бутендиовой, (Е)-бутендиовой, 2-гидроксибутандиовой, 2,3-дигидроксибутандиовой, 2-гидрокси-1,2,3-пропантрикарбоновой, метансульфоновой, этансульфоновой, бензолсульфоновой, 4-метилбензолсульфоновой кислотой, циклогексансульфаминовой, 2-гидроксибензойной, 4-амино-2-гидроксибензойной и другими кислотами, известными специалисту в данной области.
Настоящее изобретение включает в объем своих притязаний пролекарства соединений по данному изобретению. В общем, такие пролекарства являются неактивными производными соединений по данному изобретению, которые легко превращаются in vivo в желаемое соединение. Традиционные методики выбора и получения подходящих пролекарственных производных описаны, например, в Design of Prodrugs (ed. H. Bundgaard, Elsevier, 1985). Метаболиты данных соединений включают активные частицы, которые получаются при введении соединений по данному изобретению в биологическую среду.
Когда соединения по изобретению имеют, по меньшей мере, один хиральный центр, они могут существовать в виде рацемата или энантиомеров. Необходимо отметить, что все такие изомеры и их смеси включены в объем настоящего изобретения. Более того, некоторые кристаллические формы соединений по настоящему изобретению могут существовать в виде полиморфов, и подразумевается, что они как таковые включены в настоящее изобретение. Кроме того, некоторые из соединений по настоящему изобретению могут образовывать сольваты с водой (т.е. гидраты) или обычными органическими растворителями. Такие сольваты также включены в объем притязаний настоящего изобретения.
Когда способы получения соединений по данному изобретению приводят к смеси стереоизомеров, такие изомеры можно разделить обычными методами, такими как препаративная хиральная хроматография. Соединения можно получить в рацемической форме или индивидуальные энантиомеры можно получить стереоселективным синтезом или разделением. Соединения можно разделить на энантиомеры стандартными методами, такими как образование диастереоизомерных пар путем образования соли с оптически активной кислотой, такой как (-)-ди-п-толуоил-d-виннная кислота и/или (+)-ди-п-толуоил-l-виннная кислота, после чего следует фракционированная кристаллизация и регенерация свободного основания. Соединения можно также разделить, используя хиральные вспомогательные соединения, путем образования диастереомерных производных, таких как сложные эфиры, амиды или кетали, после чего следует хроматографическое разделение и удаление хиральных вспомогательных соединений.
Соединения по настоящему изобретению являются эффективными при оральном введении. Эксперименты in vivo, проведенные на грызунах, показали, что более низкая доза соединений по настоящему изобретению приводит к равной или к улучшенной поведенческой реакции на животных моделях психоза. Данные результаты свидетельствуют о более высокой биодоступности соединений по настоящему изобретению по сравнению с соединениями, описанными в предшествующем уровне техники. Улучшенная биодоступность подтверждается наблюдением, что новые соединения, представленные в настоящем описании, не являются значительно более эффективными при анализе их действия на серотониновые рецепторы in vitro и, помимо этого, представляют значительное улучшение при оральном введении. Весьма улучшенная эффективность, наблюдаемая после оральной дозы, вероятно, является результатом увеличенной метаболической стабильности, улучшенных физико-химических свойств, таких как растворимость или химическая стойкость, или различных фармакокинетических характеристик, таких как распределение, проницаемость или т.п. Не связывая себя с конкретной теорией, разумно приписать такие различия присутствию гетероциклического заместителя на атоме азота пиперидинового кольца данных соединений. Присутствие такого гетероциклического заместителя может повлиять на поведение данных производных с точки зрения растворимости и/или метаболической лабильности. Присутствие гетероатомов в заместителях, близких к атому азота, как предполагается, также влияет на основность атома азота, которая, в свою очередь, может воздействовать на такие свойства, как распределение (LogD) или метаболизм.
Обычно высокая степень биодоступности любого фармацевтического препарата считается весьма полезной. Это относится, прежде всего, к способности вводить эффективную и еще и безопасную дозу лекарства всем субъектам независимо от их потенциальной предрасположенности к зависящему от полиморфизма метаболизму лекарства. Примеры таких многочисленных полиморфизмов хорошо известны в данной области. Таким образом, лекарство, которое подвергается значительному метаболизму в течение своего первого прохождения через печень, либо в желудочно-кишечном тракте, будет показывать относительно низкую и иногда зависящую от дозы биодоступность, измеряемую в виде концентрации в плазме, достигаемой после перорального распределения. Различия между индивидуумами в воздействии лекарства, как правило, являются более сильными, когда лекарство трудно метаболизируется и, как следствие, показывает низкую оральную биодоступность. Субъекты с полиморфизмом, приводящим к изменениям в активности метаболизирующих лекарство ферментов, вероятно, станут подвергаться действию существенно различающихся (обычно более высоких) уровней в плазме, по сравнению с субъектами, показывающими обычную метаболическую активность. Поэтому аспекты настоящего изобретения относятся к новым соединениям, которые показывают характеристики, наводящие на мысль о превосходных свойствах лекарства по сравнению с препаратами, известными из предшествующего уровня техники.
В общем, соединения формулы I являются активными по отношению к моноаминовым рецепторам, особенно к серотониновым рецепторам. Некоторые соединения по изобретению обладают общим свойством, действуя в качестве обратных агонистов 5-HT2A рецепторов. Таким образом, эксперименты, проведенные на клетках, скоротечно экспрессирующих человеческий фенотип указанного рецептора, показали, что соединения общей формулы I ослабляют передачу сигналов такими рецепторами в отсутствие дополнительных лигандов, действующих на рецептор. Таким образом, обнаружено, что данные соединения обладают присущей активностью по отношению к данному рецептору и способны ослаблять базальные, не стимулируемые агонистом, конститутивные сигнальные реакции, которые показывает 5-HT2A рецептор. Наблюдение, что соединения общей формулы I являются обратными агонистами, также показывает, что данные соединения обладают способностью антагонизировать активацию 5-HT2A рецепторов, которая обусловливается эндогенными агонистами или лигандами, представляющими собой экзогенные синтетические агонисты.
В определенных вариантах осуществления настоящее изобретение предлагает соединения, которые показывают относительно высокую степень селективности по отношению к 5-HT2A подтипу серотониновых рецепторов относительно других подтипов серотонинового (5-HT) семейства рецепторов, а также других рецепторов, наиболее конкретно моноаминергических связанных с G-белком рецепторов, таких как допаминовые рецепторы. В других вариантах осуществления соединения по настоящему изобретению действуют в качестве обратных агонистов 5-HT2A подтипа серотониновых рецепторов.
Поэтому соединения общей формулы I могут быть полезны для лечения или облегчения симптомов болезненных состояний, связанных с нарушенной функцией, в частности с повышенными уровнями активности, особенно 5-HT2A рецепторов, вне зависимости от того, связано ли данное нарушение функции с неподходящими уровнями стимуляции рецептора или фенотипическими аберрациями.
Другие исследователи ранее высказали предположение, что определенные нейропсихологические заболевания могут быть вызваны изменением уровней конститутивной активности моноаминовых рецепторов. Такую конститутивную активность можно было бы видоизменить посредством контакта соответствующего рецептора с синтетическим обратным агонистом. Непосредственным тестированием огромного количества центрально действующих лекарственных соединений с известной клинической активностью при нейропсихиатрическом заболевании заявители определили, что все соединения с антипсихотической эффективностью обладают общим молекулярным свойством. Было обнаружено, что практически все данные соединения, которые используются психиатрами для лечения психозов, являются сильными обратными агонистами 5HT2A. Данная корреляция является убедительным доказательством того, что обратный агонизм 5HT2A рецептора представляет собой молекулярный механизм антипсихотической эффективности у человека.
Детальная фармакологическая характеризация огромного числа антипсихотических соединений в лаборатории заявителей показала, что они обладают широкой активностью по отношению к множеству родственных подтипов рецепторов. Большинство данных соединений показывает агонистическую, конкурентную антагонистическую или обратную агонистическую активность по отношению к множеству подтипов моноаминергических рецепторов, включая серотонинергические, допаминергические, адренергические, мускариновые и гистаминергические рецепторы. Данный широкий спектр активности, вероятно, отвечает за седативные, гипотензивные и моторные побочные эффекты данных соединений. Отсюда следует, что описанные в данном описании соединения будут обладать эффективностью в качестве, например, новых антипсихотических средств, но будут иметь меньшие или менее тяжелые побочные эффекты по сравнению с существующими соединениями.
Таким образом, в первом аспекте настоящее изобретение относится к соединению формулы I
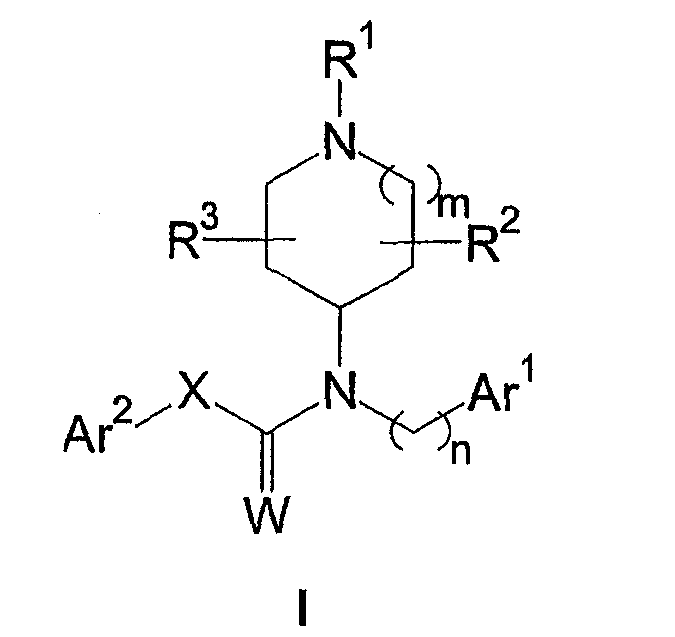
или его фармацевтически приемлемой соли, амиду, сложному эфиру или пролекарству,
где R1 выбран из группы, состоящей из необязательно замещенного гетероциклила и необязательно замещенного (гетероциклил)C1-6-алкила;
R2 и R3 независимо выбраны из группы, состоящей из водорода, C1-6-алкила и галогена, или R2 вместе с R3 образует цикл;
m выбран из группы, состоящей из 0, 1 и 2;
n выбран из группы, состоящей из 1, 2 и 3;
Ar1 представляет собой необязательно замещенный арил или гетероарил;
W выбран из группы, состоящей из O и S;
X выбран из группы, состоящей из необязательно замещенного метилена, необязательно замещенного этилена, необязательно замещенного пропилена, необязательно замещенного винилена и CH2N(RN), где RN выбран из водорода и C1-6 -алкила, и
Ar2 представляет собой необязательно замещенный арил или гетероарил.
Как обсуждалось выше, считается, что присутствие гетероциклического заместителя на атоме азота пиперидинового кольца данных соединений улучшает биодоступность соединений по сравнению с родственными соединениями, известными специалисту в данной области.
В некоторых вариантах осуществления гетероциклил или (гетероциклил)C1-6-алкил группы R1 может быть необязательно замещен. Заместитель может быть выбран из галогена, гидрокси, алкила, алкокси и амино. В некоторых вариантах осуществления заместитель может находиться на алкильной цепи или на циклической системе. В дальнейших вариантах осуществления заместитель находится на циклической системе.
В определенных вариантах осуществления кольцо гетероциклила в R1 можно выбрать из группы, состоящей из тетрагидротиопирана, 4H-пирана, тетрагидропирана, пиперидина, 1,3-диоксина, 1,3-диоксана, 1,4-диоксина, 1,4-диоксана, пиперазина, 1,3-оксатиана, 1,4-оксатиина, 1,4-оксатиана, тетрагидро-1,4-тиазина, 2H-1,2-оксазина, малеимида, сукцинимида, барбитуровой кислоты, тиобарбитуровой кислоты, диоксопиперазина, гидантоина, дигидроурацила, морфолина, триоксана, гексагидро-1,3,5-триазина, тетрагидротиофена, тетрагидрофурана, пирролина, пирролидина, пирролидона, пирролидинона, пиразолина, пиразолидина, имидазолина, имидазолидина, 1,3-диоксола, 1,3-диоксолана, 1,3-дитиола, 1,3-дитиолана, изоксазолина, изоксазолидина, оксазолина, оксазолидина, оксазолидинона, тиазолина, тиазолидина и 1,3-оксатиолана. В некоторых вариантах осуществления гетероциклическое кольцо выбрано из 1,3-диоксана, 1,3-диоксолана и тетрагидропирана.
Азациклическое кольцо может представлять собой 5-, 6- или 7-членное кольцо, когда m выбрано из 0, 1 и 2. Однако в определенных вариантах осуществления азациклическое кольцо представляет собой 6-членное кольцо, в котором m равно 1.
Кроме замещения на атоме азота, азациклическое кольцо может быть замещено R2 и R3. R2 и R3 можно независимо выбрать из группы, состоящей из водорода, C1-6-алкила и галогена, или так, чтобы R2 вместе с R3 образовывали кольцо. То есть R2 и R3 могут представлять собой бирадикалы, которые объединены с образованием 3-, 4-, 5-, 6- или 7-членной циклической системы с атомами азациклического кольца.
В некоторых вариантах осуществления азациклическая кольцевая система выбрана из
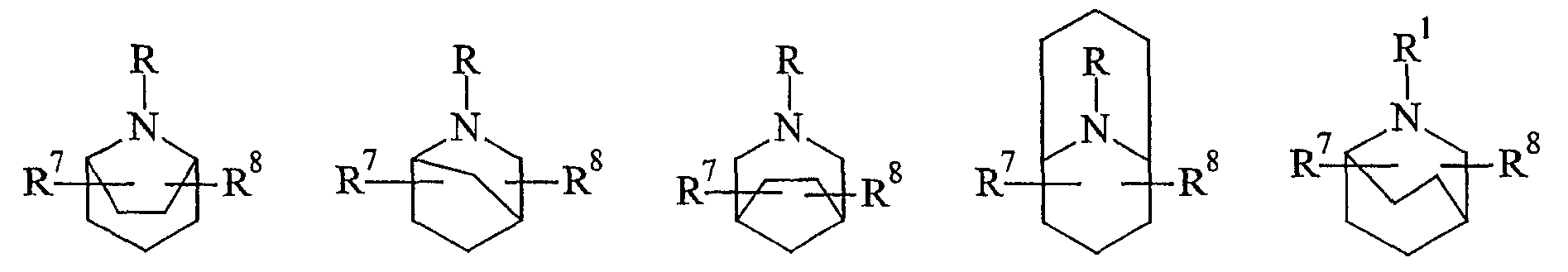
в которых R7 и R8 независимо выбраны из группы, состоящей из водорода, галогена, гидроксила и C1-6-алкила. В определенных вариантах осуществления R7 и R8 представляют собой водород.
В других вариантах осуществления R2 и R3 представляют собой водород.
В некоторых вариантах осуществления R1 представляет собой необязательно замещенный (гетероциклил)C1-6-алкил. В конкретных случаях данных вариантов осуществления R1 представляет собой необязательно замещенный (гетероциклил)метил, необязательно замещенный (гетероциклил)этил или необязательно замещенный (гетероциклил)пропил. В других вариантах осуществления R1 представляет собой необязательно замещенный (гетероциклил)этил.
Ar1 связан с центральным атомом азота посредством короткой алифатической цепи, содержащей 1, 2 или 3 атома углерода. В определенных вариантах осуществления n равно 1, приводя к метиленовому мостику между центральным атомом азота и Ar1. Ar1 может представлять собой необязательно замещенный арил или гетероарил. В некоторых вариантах осуществления Ar1 представляет собой необязательно замещенный арил. В некоторых вариантах осуществления центральный атом азота связан с необязательно замещенной бензильной группой.
В определенных вариантах осуществления Ar1 представляет собой необязательно замещенный арил, который может являться 4-замещенным арилом. 4-Заместитель 4-замещенного арила может представлять собой любой заместитель, известный специалисту в данной области, например C1-6-алкил, C1-6-алкокси, карбоксил, амино, гидрокси, тиол, нитро, циано, гуанидино, карбамидо и галоген. В некоторых вариантах осуществления галоген представляет собой фтор, в то время как в других вариантах осуществления галоген представляет собой хлор.
В других вариантах осуществления Ar1 выбран из группы, состоящей из алкилзамещенного фенила, алкоксизамещеного фенила, галогензамещенного фенила, гидроксизамещенного фенила и аминозамещенного фенила. В некоторых вариантах осуществления заместитель может присутствовать 0-5 раз или 0-4 раза или 0-3 раза, например 0, 1, 2 или 3 раза. В определенных вариантах осуществления заместитель присутствует 1-2 раза. В некоторых вариантах осуществления Ar1 представляет собой 4-замещенный арил, выбранный из группы, состоящей из 4-галогенфенила и 4-алкилфенила. В некоторых вариантах осуществления фенильная группа представляет собой 4-фторфенил.
В других вариантах осуществления Ar1 представляет собой необязательно замещенный гетероарил. Гетероарил может содержать заместители, известные специалисту в данной области, такие как C1-6-алкил, C1-6-алкокси, карбоксил, амино, гидрокси, тиол, нитро, циано, гуанидино, карбамидо и галоген.
Кроме связи с азациклическим кольцом и Ar1 посредством короткой алифатической цепи, центральный атом азота связан с Ar2 посредством мостика, содержащего 2-4 атома углерода. Данный мостик включает карбонильную или тиокарбонильную функциональную группу, где W выбран из группы, состоящей из кислорода и серы. В некоторых вариантах осуществления W представляет собой кислород.
В определенных вариантах осуществления X может быть выбран из группы, состоящей из необязательно замещенного метилена, необязательно замещенного этилена, необязательно замещенного пропилена, необязательно замещенного винилена и CH2N(RN). Таким образом, X может удлинять мостиковую группу на 1-3 атома между центральным атомом азота и Ar2 и воспроизводить центральную азотную часть амида или карбамида. В некоторых вариантах осуществления X выбран из группы, состоящей из необязательно замещенного метилена, необязательно замещенного этилена и CH2N(RN). В некоторых вариантах осуществления X представляет собой необязательно замещенный метилен или CH2N(RN), где RN может являться водородом.
В определенных вариантах осуществления Ar2 может представлять собой необязательно замещенный арил или гетероарил. В определенных вариантах осуществления Ar2 представляет собой необязательно замещенный арил. В некоторых вариантах осуществления Ar2 представляет собой 4-замещенный арил.
В дальнейшем варианте осуществления Ar2 может быть выбран из группы, состоящей из алкоксизамещенного фенила, галогензамещенного фенила, гидроксизамещенного фенила, аминозамещенного фенила и гетероциклилзамещенного фенила.
В определенных вариантах осуществления Ar2 представляет собой 4-замещенный арил, в котором заместитель выбран из группы, состоящей из алкила, алкокси, галогена, гидрокси, амино, алкиламино, гетероциклила и гетероарила. В некоторых вариантах осуществления заместитель на Ar2 выбран из хлора, фтора, гидрокси, метокси, этокси, пропокси, изопропокси, н-бутокси, втор-бутокси, трет-бутокси, трифторметокси, N-морфолинила, N-пирролидинила, N-пиразолила, N-триазолила и 2-оксопирролидинила.
В другом аспекте настоящее изобретение относится к соединению, выбранному из группы, включающей
гидрохлорид N-{1-[2-(1,3-диоксолан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-N'-(4-изобутоксибензил)карбамида;
тартрат N-{1-[2-(1, 3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-[4-(2-гидрокси-2-метилпропокси)фенил]ацетамида;
N-(4-фторбензил)-N-(пиперидин-4-ил)-2-(4-изобутоксифенил)ацетамид;
дигидрохлорид N-{1-[3-(3,5-диметилпиперидин-1-ил)пропил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида;
дигидрохлорид метилового эфира 1-[3-(4-{(4-фторбензил)-[2-(4-изобутоксифенил)ацетил]амино}пиперидин-1-ил)пропил]пиперидин-4-карбоновой кислоты;
диоксалат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[2-(1-метилпирролидин-2-ил)этил]пиперидин-4-ил}ацетамида;
диоксалат N-{1-[3-(2, 6-диметилморфолин-4-ил)пропил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида;
диоксалат N-(4-фторбензил)-N-{1-[3-(3-гидроксипиперидин-1-ил)пропил]пиперидин-4-ил}-2-(4-изобутоксифенил)ацетамида;
диоксалат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[3-(2-метилпиперидин-1-ил)пропил]пиперидин-4-ил}ацетамида;
диоксалат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-[1-(3-пирролидин-1-илпропил)пиперидин-4-ил]ацетамида;
диоксалат N-{1-[3-(2, 5-диметилпирролидин-1-ил)пропил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида;
диоксалат N-(4-фторбензил)-N-{1-[3-(3-гидроксиметилпиперидин-1-ил)пропил]пиперидин-4-ил}-2-(4-изобутоксифенил)ацетамида;
оксалат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[3-(4-(S)-изопропил-2-оксооксазолидин-3-ил)пропил]пиперидин-4-ил}ацетамида;
оксалат N-[2-(4-фторфенил)этил]-2-(4-изобутоксифенил)-N-{1-[3-(4-(S)-изопропил-2-оксооксазолидин-3-ил)пропил]пиперидин-4-ил}ацетамида;
оксалат N-[2-(4-фторфенил)этил]-N-{1-[3-(4-(S)-изопропил-2-оксооксазолидин-3-ил)пропил]пиперидин-4-ил}-2-(4-пропоксифенил)ацетамида;
оксалат N-(4-фторбензил)-N-{1-[3-(4-(S)-изопропил-2-оксооксазолидин-3-ил)пропил]пиперидин-4-ил}-2-(4-пропоксифенил)ацетамида;
оксалат N-{1-[2-(1, 3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида;
оксалат N-{1-[2-(1, 3-диоксан-2-ил)этил]пиперидин-4-ил}-N-[2-(4-фторфенил)этил]-2-(4-изобутоксифенил)ацетамида;
оксалат N-{1-[2-(1, 3-диоксан-2-ил)этил]пиперидин-4-ил}-N-[2-(4-фторфенил)этил]-2-(4-пропоксифенил)ацетамида;
тартрат N-{1-[2-(1, 3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-пропоксифенил)ацетамида;
тартрат N-{1-[2-(1, 3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-N'-(4-изобутоксибензил)карбамида;
тартрат N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-фторфенил)ацетамида;
тартрат N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-п-толилацетамида;
тартрат 2-бензофуран-5-ил-N-{1-[2-(1, 3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)ацетамида;
тартрат 2-(2,3-дигидробензофуран-5-ил)-N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)ацетамида;
тартрат N-{1-[2-(2,2-диметил-1,3-диоксолан-4-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида;
N-{1-[2-(1, 3-диоксан-4-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)амин;
тартрат N-{1-[2-(1,3-диоксан-4-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида;
тартрат N-{1-[2-(1,3-диоксан-4-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-трифторметилфенил)ацетамида;
тартрат 2-(4-цианофенил)-N-{1-[2-(1, 3-диоксан-4-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)ацетамида;
гидрохлорид N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[2-(2-оксоимидазолидин-1-ил)этил]пиперидин-4-ил}ацетамида;
гидрохлорид 2-(4-метоксифенил)-N-(4-метилбензил)-N-{1-[2-(2-оксоимидазолидин-1-ил)этил]пиперидин-4-ил}ацетамида;
гидрохлорид N-(4-фторбензил)-2-(4-изопропоксифенил)-N-{1-[2-(2-оксоимидазолидин-1-ил)этил]пиперидин-4-ил}ацетамида;
гидрохлорид N-(4-фторбензил)-2-(4-изопропоксифенил)-N-{1-[3-(3-метил-2-оксо-2, 3-дигидробензоимидазол-1-ил)пропил]пиперидин-4-ил}ацетамида;
гидрохлорид N-{1-[2-(2,4-диоксо-1, 4-дигидро-2H-хиназолин-3-ил)этил]пиперидин-4-ил}-2-(4-метоксифенил)-N-(4-метилбензил)ацетамида;
гидрохлорид 2-(4-метоксифенил)-N-(4-метилбензил)-N-{1-[3-(2-оксо-2, 3-дигидробензоимидазол-1-ил)пропил]пиперидин-4-ил}ацетамида;
гидрохлорид N-(4-фторбензил)-2-(4-изопропоксифенил)-N-{1-[4-(2-оксо-2, 3-дигидробензоимидазол-1-ил)бутил]пиперидин-4-ил}ацетамида;
гидрохлорид N-{1-[2-(2,4-диоксо-1, 4-дигидро-2H-хиназолин-3-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изопропоксифенил)ацетамида;
бензиловый эфир 4-(4-фторбензиламино)пиперидин-1-карбоновой кислоты;
N-(1-бензилоксикарбонилпиперидин-4-ил)-N-(4-фторбензил)-N'-(4-изопропоксибензил)карбамид;
оксалат N-(4-фторбензил)-N'-(4-изопропоксибензил)-N-пиперидин-4-илкарбамида;
оксалат N-{1-[2-(1,3-диоксолан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-N'-(4-изопропоксибензил)карбамида;
гидрохлорид N-{1-[2-(1, 3-диоксолан-2-ил)этил]пиперидин-4-ил]-2-(4-метоксифенил)-N-(4-метилбензил)ацетамида;
гидрохлорид N-{1-[2-(1, 3-диоксолан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида;
гидрохлорид N-{1-[2-(1, 3-диоксолан-2-ил)этил]пиперидин-4-ил}-2-(4-изопропоксифенил)-N-(4-метилбензил)ацетамида;
тартрат N-{1-[2-(1, 3-диоксолан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-пропоксифенил)ацетамида;
оксалат N-(4-фторбензил)-N'-(4-изопропоксибензил)-N-{1-[2-((S)-4-метил-1, 3-диоксолан-2-ил)этил]пиперидин-4-ил}карбамида;
оксалат N-(4-фторбензил)-N'-(4-изопропоксибензил)-N-[1-(3-морфолин-4-илпропил)пиперидин-4-ил]карбамида;
дигидрохлорид 2-(4-метоксифенил)-N-(4-метилбензил)-N-[1-(2-морфолин-4-илэтил)пиперидин-4-ил]ацетамида;
дигидрохлорид 2-(4-метоксифенил)-N-(4-метилбензил)-N-[1-(3-морфолин-4-илпропил)пиперидин-4-ил]ацетамида;
дигидрохлорид N-(4-фторбензил)-2-(4-изобутоксифенил)-N-[1-(3-морфолин-4-илпропил)пиперидин-4-ил]ацетамида;
дигидрохлорид N-(4-фторбензил)-2-(4-изопропоксифенил)-N-[1-(3-морфолин-4-илпропил)пиперидин-4-ил]ацетамида;
оксалат N-(4-фторбензил)-N'-(4-изопропоксибензил)-N-[1-(3-пиперидин-1-илпропил)пиперидин-4-ил]карбамида;
тартрат N-(4-фторбензил)-N'-(4-изопропоксибензил)-N-[1-(3-((S)-4-изопропил-2-оксазолидинон-1-илпропил)пиперидин-4-ил]карбамида;
оксалат N-(4-фторбензил)-N'-(4-изопропоксибензил)-N-{1-[2-(2,5, 5-триметил-1,3-диоксан-2-ил)этил]}пиперидин-4-ил]карбамида;
оксалат N-{1-[3-(1,3-диоксолан-2-ил)пропил]пиперидин-4-ил}-N-(4-фторбензил)-N'-(4-изопропоксибензил)карбамида;
оксалат N-[1-(2,2-диметил-1,3-диоксан-5-ил)пиперидин-4-ил]-N-(4-фторбензил)-N'-(4-изопропоксибензил)карбамида;
оксалат N-(4-фторбензил)-N'-(4-изопропоксибензил)-N-{[2-(1-метилпирролидин-2-ил)этил]пиперидин-4-ил}карбамида;
оксалат N-[1-(2,2-диметил-1, 3-диоксан-5-ил)пиперидин-4-ил]-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида оксалат;
тартрат N-[1-(1,3-диоксан-5-ил)пиперидин-4-ил)-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида;
тартрат N-[1-(2,2-диметил-1,3-диоксан-5-ил)пиперидин-4-ил]-N-(4-фторбензил)-2-(4-фторфенил)ацетамида;
тартрат N-{1-[2-(1, 3-диоксан-4-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-фторфенил)ацетамида;
тартрат N-{1-[2-(1, 3-диоксан-4-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-трифторметоксифенил)ацетамида;
тартрат N-{1-[2-(1, 3-диоксан-4-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-пропоксифенил)ацетамида;
тартрат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-[1-(тетрагидропиран-4-ил)пиперидин-4-ил]ацетамида;
тартрат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-[1-(тетрагидропиран-4-илметил)пиперидин-4-ил]ацетамида;
тартрат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[2-(тетрагидропиран-4-ил)этил]пиперидин-4-ил]ацетамида;
тартрат N-(4-фторбензил)-2-(4-фторфенил)-N-[1-(тетрагидропиран-4-ил)пиперидин-4-ил]ацетамида;
тартрат N-[1-((S)-3, 5-дигидроксипентил)пиперидин-4-ил]-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида;
тартрат N-{1-[2-((4S)-1, 3-диоксан-4-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида;
N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)амин;
тартрат 2-(4-бензилоксифенил)-N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)ацетамида;
тартрат N-{1-[2-(1, 3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-гидроксифенил)ацетамида;
тартрат N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-метоксифенил)ацетамида;
тартрат N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изопропилфенил)ацетамида;
тартрат N-{1-[2-(1, 3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-трифторметоксифенил)ацетамида;
оксалат N-{1-[2-(1, 3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-этоксифенил)ацетамида;
оксалат N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изопропоксифенил)ацетамида;
оксалат N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-фенилацетамида;
оксалат N-{1-[2-(1, 3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-[4-(2-фторэтокси)фенил]ацетамида;
оксалат N-{1-[2-(5,5-диметил-1, 3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида;
оксалат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[2-((R)-4-метил-1, 3-диоксан-2-ил)этил]пиперидин-4-ил}ацетамида;
оксалат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[2-((S)-4-метил-1,3-диоксолан-2-ил)этил]пиперидин-4-ил}ацетамида;
оксалат N-{1-[2-(4,6-диметил-1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида;
оксалат N-(4-фторбензил)-N-{1-[2-((S)-4-метил-1, 3-диоксолан-2-ил)этил]пиперидин-4-ил}-2-(4-трифторметоксифенил)ацетамида;
оксалат N-(4-фторбензил)-2-(4-изопропилфенил)-N-{1-[2-((S)-4-метил-1, 3-диоксолан-2-ил)этил]пиперидин-4-ил}ацетамида;
оксалат N-(4-фторбензил)-N-{1-[2-((R)-4-метил-1,3-диоксан-2-ил)этил]пиперидин-4-ил}-2-(4-трифторметоксифенил)ацетамида;
оксалат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[2-(2,5,5-триметил-1,3-диоксан-2-ил)этил]пиперидин-4-ил}ацетамида;
оксалат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[2-(2-метил-1, 3-диоксолан-2-ил)этил]пиперидин-4-ил}ацетамида;
тартрат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[3-(1,3-диоксолан-2-ил)пропил]пиперидин-4-ил}ацетамида;
дигидрохлорид N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-(3-пиперидин-1-илпропил)пиперидин-4-ил}ацетамида;
оксалат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[2-(тетрагидропиран-2-илокси)этил]пиперидин-4-ил}ацетамида;
N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[3-(2-оксопиперидин-1-ил)пропил]пиперидин-4-ил}ацетамид;
гидрохлорид N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[3-(2-оксопирролидин-1-ил)пропил]пиперидин-4-ил}ацетамида;
оксалат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[3-((R)-4-изопропил-2-оксооксазолидин-3-ил)пропил]пиперидин-4-ил}ацетамида;
оксалат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[3-(2-оксооксазолидин-3-ил)пропил]пиперидин-4-ил}ацетамида;
тартрат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[3-((S)-4-метил-2-оксооксазолидин-3-ил)пропил]пиперидин-4-ил}ацетамида;
оксалат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[3-((S)-4-этил-2-оксооксазолидин-3-ил)пропил]пиперидин-4-ил}ацетамида;
L-тартрат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[2-(1, 3-оксотиолан-2-ил)этил]пиперидин-4-ил}ацетамида;
L-тартрат 2-(4-бромфенил)-N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)ацетамида;
L-тартрат N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изобутиламинофенил)ацетамида;
L-тартрат N-{1-[2-(1, 3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-пропиламинофенил)ацетамида;
L-тартрат N-{1-[2-(1, 3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-(1-нитропропил)фенил)ацетамида;
L-тартрат N-{1-[2-(1, 3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-[4-(2-оксопирролидин-1-ил)фенил]ацетамида;
L-тартрат N-{1-[2-(1, 3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изобутилсульфанилфенил)ацетамида;
L-тартрат N-{1-[2-(1, 3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-иодфенил)ацетамида;
L-тартрат 2-(4-ацетофенил)-N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)ацетамида;
L-тартрат 2-[4-(1-гидроксииминоэтил)фенил]-N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)ацетамида;
L-тартрат N-{1-[2-(1, 3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-морфолин-4-илфенил)ацетамида;
L-тартрат N-{1-[2-(1, 3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-пиразол-1-илфенил)ацетамида;
L-тартрат N-{1-[2-(1, 3-диоксан-2-ил)-1-метилэтил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида;
L-тартрат N-{1-[2-(1, 3-диоксан-4-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-пиразол-1-илфенил)ацетамида;
тартрат N-[1-((R)-3, 5-дигидроксипентил)пиперидин-4-ил]-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида;
тартрат N-{1-[2-((4R)-1, 3-диоксан-4-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида и
L-тартрат N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-[4-(1,2, 4-триазол-4-ил)фенил]ацетамида.
Как указано, заявители обнаружили, что соединения формулы I являются эффективными модуляторами 5-HT2A подтипа серотониновых рецепторов человека. Таким образом, далее изобретение относится к способу ингибирования активности моноаминового рецептора, включающему контактирование моноаминового рецептора или системы, содержащей моноаминовый рецептор, с эффективным количеством одного или нескольких соединений, которые охарактеризованы в настоящем описании. Моноаминовый рецептор может представлять собой серотониновый рецептор, обычно 5-HT2A подкласса.
Серотониновый рецептор может альтернативно находиться в центральной нервной системе или в периферической нервной системе. Обычно серотониновый рецептор может находиться в клетках крови или тромбоцитах. В определенных вариантах осуществления серотониновый рецептор может быть мутированным или модифицированным.
Активность моноаминового рецептора, которая модулируется, обычно может представлять собой сигнальную активность. Кроме того, активность обычно может являться конститутивной. Активность, связанная с серотониновым рецептором, обычно может представлять собой активацию.
В другом аспекте настоящее изобретение относится к способу ингибирования активации моноаминового рецептора, включающему контактирование моноаминового рецептора или системы, содержащей моноаминовый рецептор, с эффективным количеством одного или нескольких соединений, которые охарактеризованы в настоящем описании. Активация, которую можно ингибировать способом по настоящему изобретению, обычно может представлять собой активацию, происходящую в результате воздействия агониста. Вещество-агонист может быть экзогенным или эндогенным. Кроме того, активация может быть конститутивной.
Другой аспект настоящего изобретения относится к лечению болезненных состояний, связанных с дисфункцией моноаминового рецептора, и к применению соединения формулы I для получения лекарственного средства для лечения болезненного состояния, связанного с моноаминовым рецептором. Болезненное состояние может быть связано с активацией моноаминового рецептора, например с повышенной активностью моноаминового рецептора.
В еще одном аспекте настоящее изобретение относится к способу лечения шизофрении, включающему введение субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы I, которое охарактеризовано в настоящем описании. Альтернативно изобретение относится, в частности, к применению соединения формулы I для получения лекарственного средства для лечения шизофрении. Дальнейший аспект относится к способу лечения мигрени, включающему введение субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы I. Альтернативно изобретение относится, в частности, к применению соединения формулы I для получения лекарственного средства для лечения мигрени. Дальнейший аспект изобретения относится к способу лечения психоза, включающему введение субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы I. Альтернативно изобретение относится, в частности, к применению соединения формулы I для получения лекарственного средства для лечения психоза. Еще один дополнительный аспект изобретения относится к способу лечения психотических симптомов, таких как галлюцинации, являющихся результатом введения допаминовых агонистов, таких как L-dopa, индивидуумам, нуждающимся в лечении, например людям, страдающим болезнью Паркинсона, включающему введение соединения формулы I. Альтернативно изобретение относится, по меньшей мере, отчасти, к применению соединения формулы I для получения лекарственного средства для лечения психотических симптомов, таких как галлюцинации, являющихся результатом введения допаминовых агонистов, таких как L-dopa, индивидуумам, нуждающимся в лечении, например людям, страдающим болезнью Паркинсона.
Другой аспект настоящего изобретения относится к способу лечения болезненного состояния, связанного с моноаминовым рецептором, включающему введение субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества одного или нескольких соединений формулы I, которые охарактеризованы в настоящем описании. Болезненное состояние может быть выбрано из группы, состоящей из шизофрении, шизоаффективного нарушения; психоза и родственных поведенческих анормальностей, наблюдаемых при нейродегенеративных расстройствах, включающих болезнь Паркинсона, болезнь Альцгеймера, деменцию с тельцами Леви, лобно-височную деменцию, болезнь Гентингтона и спиноцеребеллярную атрофию; вызванного лекарствами психоза, включая побочные эффекты, наблюдаемые при терапии хронических нейродегенеративных заболеваний, таких как болезни Альцгеймера, Паркинсона и Гентингтона, использующей селективный ингибитор обратного захвата серотонина (СИОЗС); синдрома Рейно; мигрени; гипертензии; тромбоза; спазма сосудов; ишемии; депрессии; тревоги; моторного тика; синдрома Туретта; дискинезии; двигательных флуктуаций; тремора; ригидности; брадикинезии; психомоторного замедления; привыкания, включая хронический алкоголизм, опийную наркоманию и привыкание к никотину; нарушений сна; нарушений аппетита; снижения либидо и проблем с эякуляцией. Таким образом, изобретение относится к применению соединения формулы I, которое охарактеризовано в настоящем описании, для получения лекарственного средства для лечения заболеваний и состояний, выбранных из группы, состоящей из шизофрении, шизоаффективного нарушения; психоза и родственных поведенческих анормальностей, наблюдаемых при нейродегенеративных расстройствах, включающих болезнь Паркинсона, болезнь Альцгеймера, деменцию с тельцами Леви, лобно-височную деменцию, болезнь Гентингтона и спиноцеребеллярную атрофию; вызванного лекарствами психоза, включая побочные эффекты, наблюдаемые при СИОЗС терапии хронических нейродегенеративных заболеваний, таких как болезни Альцгеймера, Паркинсона и Гентингтона; синдрома Рейно; мигрени; гипертензии; тромбоза; спазма сосудов; ишемии; депрессии; тревоги; моторного тика; синдрома Туретта; дискинезии; двигательных флуктуаций; тремора; ригидности; брадикинезии; психомоторного замедления; привыкания, включая хронический алкоголизм, опийную наркоманию и привыкание к никотину; нарушений сна; нарушений аппетита; снижения либидо и проблем с эякуляцией.
Другой аспект настоящего изобретения относится к лечению вызванного лекарствами психоза и лечению побочных эффектов, наблюдаемых при СИОЗС терапии поведенческих аспектов хронических нейродегенеративных заболеваний, обычно для лечения психотических симптомов, таких как галлюцинации, после введения допаминовых агонистов, таких как L-dopa, пациентам, нуждающимся в таком лечении, например, людям, страдающим болезнью Паркинсона.
Аналогично аспекты настоящего изобретения относятся к способу лечения заболеваний и состояний, как описано в данном описании, включающему введение дополнительного или терапевтического количества одного или нескольких соединений формулы I. Таким образом, изобретение относится к применению соединения формулы I для получения лекарственного средства для лечения заболеваний и состояний, как описано в данном описании, где соединение формулы I является единственным активным агентом в лекарственном средстве или является дополнительным, где лекарственное средство дополнительно включает агент, известный специалисту в данной области для лечения указанных заболеваний и состояний.
Другие аспекты изобретения относятся к фармацевтическим композициям, содержащим эффективное количество соединения общей формулы I. Соединения по настоящему изобретению можно вводить в виде любой из вышеуказанных композиций и в соответствии с режимами дозировок, принятыми в данной области, всякий раз, когда требуется конкретное фармакологическое модифицирование активности моноаминового рецептора.
Аспекты настоящего изобретения также предлагают фармацевтические композиции, содержащие одно или несколько соединений по изобретению вместе с фармацевтически приемлемым разбавителем или эксципиентом. Предпочтительно такие композиции находятся в виде единичной дозированной формы, такой как таблетки, пилюли, капсулы (включая композиции длительного высвобождения или отсроченного высвобождения), порошки, гранулы, эликсиры, настои, сиропы и эмульсии, стерильные парентеральные растворы или суспензии, аэрозоли или жидкие распыляемые растворы, капли, ампулы, автоматические устройства для инъекций или суппозитории, для орального, парентерального (например, внутривенного, внутримышечного или подкожного), интраназального, подъязычного или ректального введения или для введения ингаляцией или инсуффляцией, и могут быть составлены соответствующим образом и в соответствии с принятой практикой, например, как описано в Remington's Pharmaceutical Sciences, (Gennaro, ed., Mack Publishing Co., Easton PA, 1990, включенного в данное описание посредством ссылки). Альтернативно композиции могут представлять собой формы длительного высвобождения, подходящие для введения один раз в неделю или один раз в месяц; например, нерастворимая соль активного соединения, такая как соль капроновой кислоты, может быть адаптирована для предоставления депо-препарата для внутримышечной инъекции. Целью настоящего изобретения также является предложить подходящие локальные композиции для введения, например, в глаза или кожу или слизистую оболочку.
Дальнейший аспект изобретения относится к способу установления генетического полиморфизма, предрасполагающего субъекта быть чувствительным к одному или нескольким соединениям формулы I, которые охарактеризованы в настоящем описании, включающему:
введение субъекту терапевтически эффективного количества соединения;
определение реакции указанного субъекта на указанное соединение, таким образом, устанавливая чувствительного субъекта, имеющего улучшенное болезненное состояние, связанное с моноаминовым рецептором, и установление генетического полиморфизма у субъекта, обладающего чувствительностью, где генетический полиморфизм предрасполагает субъекта быть чувствительным к соединению. Улучшенное болезненное состояние обычно связано с 5-HT классом или 5-HT2A подклассом моноаминергических рецепторов.
Дальнейший аспект изобретения относится к способу установления субъекта, подходящего для лечения одним или несколькими соединениями формулы I, включающему определение присутствия полиморфизма у субъекта, где полиморфизм предрасполагает субъекта быть чувствительным к соединению и где присутствие полиморфизма показывает, что субъект подходит для лечения одним или несколькими соединениями формулы I.
Способы получения
Соединения по настоящему изобретению можно синтезировать описанными ниже способами или модифицированием данных способов. Пути модифицирования данной методологии включают, среди прочего, температуру, растворитель, реагенты и т.д. и являются очевидными для специалиста в данной области.
Например, соединения формулы C могут быть синтезированы из соответствующего кетона A восстановительным аминированием с использованием любого первичного амина. Реакцию легко осуществляют, перемешивая реагенты в инертном растворителе, таком как метанол или этанол, содержащем уксусную кислоту. В качестве восстановителя можно использовать NaBH4, NaCNBH3, BH3·пиридин или любой родственный реагент, включая нанесенные на твердый носитель реагенты. Реакцию обычно осуществляют при комнатной температуре. Кетон A, примером которого является пиперидон, можно выбрать из списка соединений, соответствующих Z-группе, указанной для соединения формулы (I). Кетоны могут быть коммерчески доступны или их можно синтезировать способом, описанным Lowe et al. в J. Med. Chem. 37: 2831-40 (1994); Carroll et al. в J. Med. Chem. 35: 2184-91 (1992) или Rubiralta et al. в Piperidine - Structure, Preparation, Reactivity and Synthetic Applications of Piperidine and its Derivatives. (Studies in Organic Chemistry 43, Elsevier, Amsterdam, 1991). Защитная группа P включает такие группы, как описано в T.W. Greene, P.G.M. Wuts, Protective Groups in Organic Chemistry, 3 Ed. John Wiley & Sons, 1999, и их необходимо выбирать таким образом, чтобы они были устойчивы в используемых реакционных условиях и легко удалялись на удобной стадии с использованием известной в данной области методики. Типичными защитными группами являются N-Boc, N-Cbz, N-Bn.
Альтернативно, амин C можно синтезировать из первичного амина B восстановительным аминированием с альдегидом. Реакцию легко осуществляют, перемешивая реагенты в инертном растворителе, таком как метанол или этанол, содержащем уксусную кислоту. В качестве восстановителя можно использовать NaBH4, NaCNBH3, BH3·пиридин или любой родственный реагент, включая нанесенные на твердый носитель реагенты. Реакцию обычно осуществляют при комнатной температуре. Первичный амин B, примером которого является 4-аминопиперидин, можно выбрать из списка соединений, соответствующих Z-группе, указанной для соединения формулы I. Амины могут быть коммерчески доступны или их можно синтезировать из соответствующих кетонов. Защитную группу P можно выбрать, как указано выше.
Альтернативно, амин C можно синтезировать из первичного амина B алкилированием алкилирующим агентом (R-L1). Уходящая группа L1 представляет собой, соответственно, атом галогена, например брома или иода, или сульфонат, например толуолсульфонат или метансульфонат, или другую уходящую группу, благоприятствующую протеканию реакции. Реакцию легко осуществляют, перемешивая реагенты в основных условиях в инертном растворителе, например, диизопропилэтиламин в ацетонитриле или K2CO3 в N,N-диметилформамиде. Реакцию обычно осуществляют при температурах от комнатной температуры до 80°С. Первичный амин B, примером которого является 4-аминопиперидин, можно выбрать из списка соединений, соответствующих Z-группе, указанной для соединения формулы I. Амины могут быть коммерчески доступны или их можно синтезировать из соответствующих кетонов. Защитную группу P можно выбрать, как указано выше.
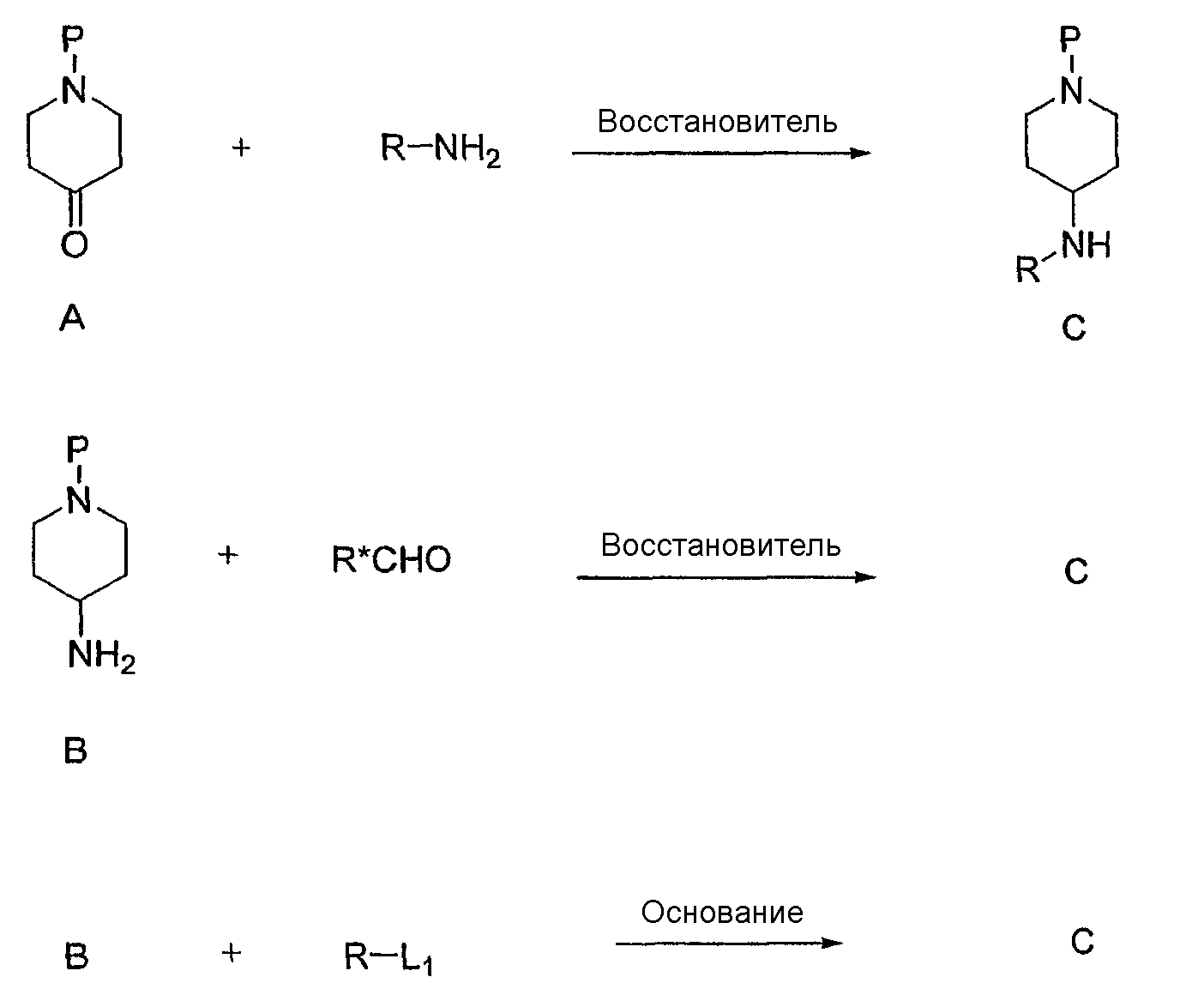
На данной схеме R и R* определены в соответствии с формулой I, P представляет подходящую защитную группу и L1 представляет подходящую уходящую группу.
Вторичный амин C можно ацилировать с использованием любого изоцианата или изотиоцианата (Q1-N=C=W), получая соответствующую мочевину или тиомочевину D. Реакцию обычно осуществляют, перемешивая реагенты с использованием избытка изоцианата или изотиоцианата в инертном растворителе, например дихлорметане, при температуре между 0°С и комнатной температурой и в безводных условиях. Амин C также можно ацилировать, используя галогенангидрид карбоновой кислоты (Q2COX), например хлорангидрид или ангидрид карбоновой кислоты (Q2C=O)2O), получая амид общей структуры E. Реакцию обычно проводят, используя избыток ацилирующего агента и соответствующее основание, например триэтиламин или диизопропилэтиламин, в инертном растворителе, например дихлорметане, при температуре от 0°С до комнатной температуры и в безводных условиях. В качестве альтернативы галогенангидридам карбоновой кислоты или ангидридам карбоновой кислоты амин C можно ацилировать, используя карбоновую кислоту (Q2COOH) и подходящее связующее вещество, например PyBroP, DCC или EDCI. Реакцию обычно проводят, используя избыток ацилирующего агента и связующего вещества в инертном растворителе, например дихлорметане, при температуре от 0°С до комнатной температуры и в безводных условиях. Соединения общей формулы (E) можно превратить в соответствующие тиоамиды, используя методику, описанную Varma et al. в Org. Lett. 1: 697-700 (1999), Cherkasov et al. в Tetrahedron 41:2567 (1985) или Scheibye et al. в Bull. Soc. Chim. Belg. 87:229 (1978).
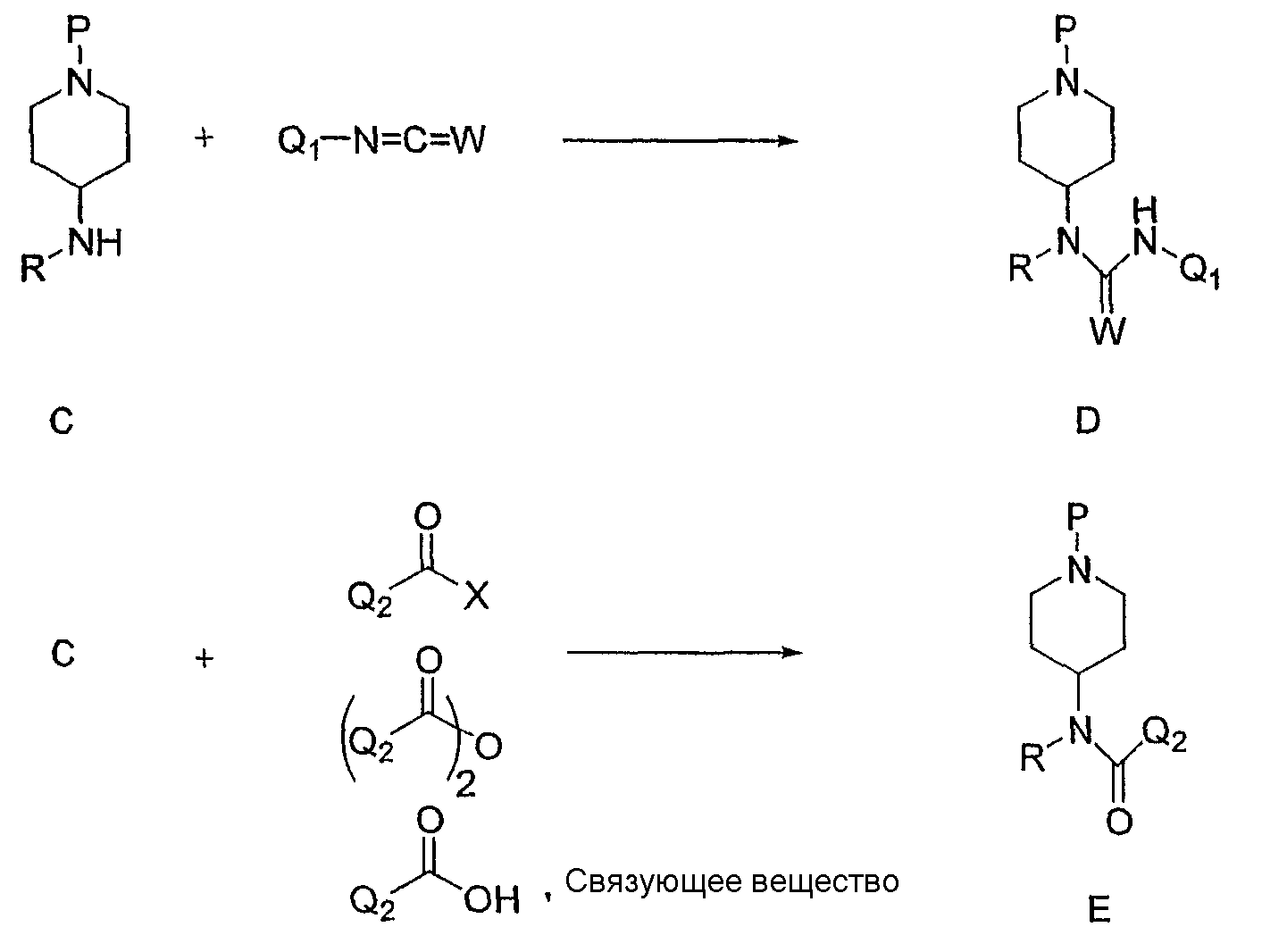
На данной схеме R, Q1, Q2 и W определены в соответствии с формулой (I), P представляет подходящую защитную группу и X представляет галоген.
Заместитель T на циклическом атоме азота в соединениях F или G можно ввести двустадийным способом. Сначала защитную группу на мочевине D или амиде E удаляют, используя хорошо известные способы. Например, N-Boc-группу удаляют обработкой защищенного соединения 4М HCl в диоксане или трифторуксусной кислотой в дихлорметане. Затем вторичные амины, полученные из D и E, можно алкилировать восстановительным аминированием с использованием альдегида (T*-CHO) или кетона (T=O). Реакцию легко осуществляют, перемешивая реагенты в инертном растворителе, таком как метанол или этанол. В качестве восстановителя можно использовать борогидрид, нанесенный на твердый носитель, NaBH4, NaCNBH3, BH3·пиридин, H2/Pd-C или любой родственный реагент, включая нанесенные на твердый носитель реагенты. Реакцию обычно проводят при комнатной температуре.
Альтернативно, соединения F и G можно синтезировать из вторичного амина, полученного из D или E, как описано выше, алкилированием алкилирующим агентом (T-L1). Уходящая группа L1, соответственно, представляет собой атом галогена, например брома или иода, или сульфонат, например толуолсульфонат или метансульфонат, или другую уходящую группу, благоприятствующую протеканию реакции. Реакцию легко осуществляют, перемешивая реагенты в основных условиях в инертном растворителе, например диизопропилэтиламине в ацетонитриле или K2CO3 в N,N-диметилформамиде. Реакцию обычно осуществляют при температурах от комнатной температуры до 80°С.
Альтернативно, T-группу можно ввести на первой стадии синтетической последовательности, приводя к соединениям по настоящему изобретению N-алкилированием соединения H любым алкилирующим агентом (T-L1). Уходящая группа L1, соответственно, представляет собой атом галогена, например брома или иода, или сульфонат, например толуолсульфонат или метансульфонат, или другую уходящую группу, благоприятствующую протеканию реакции. Реакцию легко осуществляют, перемешивая реагенты в основных условиях в инертном растворителе, например диизопропилэтиламине в ацетонитриле или K2CO3 в N, N-диметилформамиде. Реакцию обычно осуществляют при температурах от комнатной температуры до 80°С. Альтернативно, T-группу можно ввести на первой стадии восстановительным аминированием с использованием альдегида (T*-CHO) или кетона (T=O) и подходящим образом защищенного соединения H', примером которого является 4-пиперидонэтиленкеталь. Реакцию легко осуществляют, перемешивая реагенты в инертном растворителе, таком как метанол или этанол. В качестве восстановителя можно использовать борогидрид, нанесенный на твердый носитель, NaBH4, NaCNBH3, BH3 ·пиридин, H2/Pd-C или любой родственный реагент, включая нанесенные на твердый носитель реагенты. Реакцию обычно проводят при комнатной температуре, но менее реакционноспособные карбонильные соединения могут требовать более высокие температуры и/или предварительное образование соответствующего имина при удалении воды перед добавлением восстановителя. Удаление защитной группы дает желаемое соединение J. Вторичный амин H и H', примером которого является 4-пиперидон и его защищенное производное, можно выбрать из списка соединений, соответствующих Z-группам, перечисленным для соединения формулы (I). Амины могут быть коммерчески доступны или их можно синтезировать способом, описанным Lowe et al. в J. Med. Chem. 37: 2831-40 (1994) и Carroll et al. в J. Med. Chem. 35: 2184-91 (1992).
Альтернативно, соединения общей формулы J можно синтезировать, используя в качестве исходного соединения K, с использованием способа, описанного Kuehne et al. в J. Org. Chem. 56:2701 (1991) и Kuehne et al. в J. Org. Chem. (1991) 56:513.
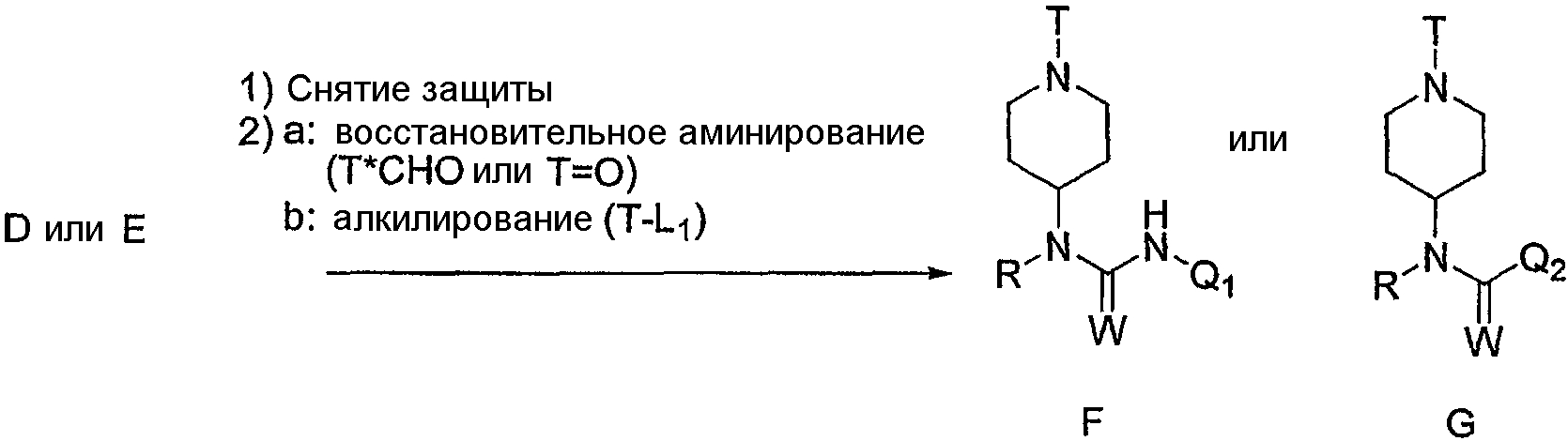

На данной схеме R, Q1, Q2, W и T определены в соответствии с формулой (I), и L1 представляет собой подходящую защитную группу.
Гетероциклилалкильные алкилирующие агенты, такие как T-L1, могут быть коммерчески доступны или обычно их можно получить алкилированием гетероцикла бифункциональным алкильным линкером, как показано ниже. Уходящие группы L1 и L2, соответственно, представляют собой атом галогена, например хлор, бром или иод, или сульфонат, например толуолсульфонат или метансульфонат, или другую уходящую группу, благоприятствующую протеканию реакции. Реакцию легко осуществляют, перемешивая реагенты в основных условиях в инертном растворителе, например диизопропилэтиламине в ацетонитриле, или K2CO3 в N,N-диметилформамиде. Реакцию обычно осуществляют при температурах от комнатной температуры до 80°С. Полученный на данной стадии алкилирующий агент может взаимодействовать in situ на следующей стадии с вторичным амином (т.е. D/E со снятой защитой или H) или его можно выделить из реакционной смеси перед дальнейшим использованием. Гетероциклилалкильные спирты, такие как T*-CH2OH или T-OH, также могут быть превращены в соответствующие алкилирующие агенты T-L1, превращением гидроксила в уходящую группу, например, толуолсульфонированием, метансульфонированием или галогенированием. Альтернативно, T*-CH2OH или T-OH можно окислить до соответствующих альдегидов или кетонов T*-CHO или T=O, например, хлорхроматом пиридиния, CrO3-H2SO4 или методами Сверна или Десс-Мартина, для использования на стадии восстановительного аминирования с вторичными аминами, как описано выше.
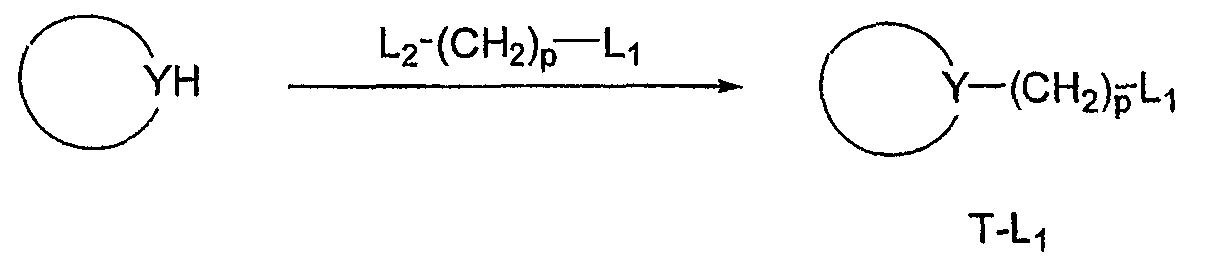
На данной схеме Y, p и T определены в соответствии с формулой (I), и L1 и L2 представляют собой подходящие защитные группы.
Функциональные блоки, включающие ароматические группы Ar1 и Ar2, могут быть коммерчески доступны или их можно синтезировать способами, описанными в литературе. Введение заместителей на Ar1 и Ar2 можно осуществить из подходящего предшественника на любой соответствующей стадии получения данных соединений.
Например, соединения, содержащие алкоксизаместители, обычно можно получить синтезом простых эфиров по Вилльямсону из соответствующих гидроксиарильных производных.
Структуры, содержащие аминный заместитель на Ar1 или Ar2, можно получить из подходящих галогеновых и псевдогалогеновых предшественников (например, Br-, I-, Cl-, трифлат-, нонафлат-, тозилатзамещенных арильных производных) аминированием, катализируемым металлами, такими как Pd или Ni (Hartwig, Angew. Chem. Int. Ed., 1998, 37, 2046-2067; Yang & Buchwald, J. Organometallic Chem., 1999, 576, 125-146; Hartwig в Modern Amination Methods; Ricci Ed.; Wiley-VCH: Weinheim, Germany, 2000) или аминированием, катализируемым Cu (Buchwald et al. Org. Lett., 2002, 4, 581-584; Kwong & Buchwald, Org. Lett., 2003, 5, 793-796). Альтернативно, данные соединения можно получить алкилированием предшественников на основе анилина (Hickinbottom, J. Chem. Soc. 1930, 992) или восстановительным аминированием (Emerson & Walters, J. Amer. Chem. Soc., 1938, 60, 2023; Milovic et al. Synthesis, 1991, 11, 1043-1045), или дегидратирующим алкилированием (Rice & Kohn, J. Amer. Chem. Soc., 1955, 77, 4052; Brown & Reid, J. Amer. Chem. Soc., 1924, 46, 1838). Кроме того, соединения данного типа также можно синтезировать из соответствующих бороновых кислот катализируемым Cu сочетанием (Antilla & Buchwald, Org. Lett., 2001, 3, 2077-2079).
Структуры, содержащие амидный заместитель на Ar1 или Ar2, можно получить из подходящих галогеновых и псевдогалогеновых предшественников катализируемым амидированием с использованием Pd (Yin & Buchwald, J. Amer. Chem. Soc., 2002, 124, 6043-6048) или Cu (Buchwald et al. J. Amer. Chem. Soc., 2002, 124, 7421-7428). Альтернативно, данные соединения также можно получить из соответствующих анилиновых предшественников ацилированием (Wolf, Liebigs Ann. Chem., 1952, 576, 35; Yasukara et al. J. Chem. Soc. Perkin Trans. 1, 2000, 17, 2901-2902; Nigam & Weedon, J. Chem. Soc., 1957, 2000) либо формилированием (Hirst & Cohen, J. Chem. Soc., 1895, 67, 830; Olah & Kuhn, Chem. Ber. 1956, 89, 2211; Guthrie et al. Can. J. Chem., 1993, 71, 2109-2122).
Соединения, содержащие алкилсульфанильный заместитель на Ar1 или Ar2, можно получить из подходящих галогеновых или псевдогалогеновых предшественников катализируемой тиоэтерификацией с использованием в качестве катализатора Pd (Li, J. Org. Chem., 2002, 67, 3643-3650) или Cu (Kwong & Buchwald, Org. Lett., 2002, 4, 3517-3520). Альтернативно, данные соединения можно получить алкилированием соответствующих бензолтиольных предшественников (Vogel, J. Chem. Soc., 1948, 1809; Landini & Rocca, Synthesis, 1974, 565-566; Bun-Hoi et al. J. Org. Chem., 1951, 16, 988). Альтернативно, алкиларилсульфанилы можно получить облучением бензолтиолов и алкенов (Screttas & Micha-Screttas, J. Org. Chem., 1978, 43, 1064-1071).
Соединения по изобретению, содержащие ацильную группу на Ar1 или Ar2, можно получить из соответствующих арилиодидов катализируемым ацилированием с использованием Pd в качестве катализатора (Cacchi et al. Org. Lett., 2003, 5, 289-293). Альтернативно, данные соединения можно получить из соответствующих бензолов реакцией Фриделя-Крафтса (Read, J. Amer. Chem. Soc., 1922, 44, 1746-1755) или присоединением арильного реактива Гриньяра к нитрилам (Whitmore et al. J. Amer. Chem. Soc., 1947, 69, 235-237) или к ацилхлоридам (Whitmore & Lester, J. Amer. Chem. Soc., 1942, 64, 1247), либо катализируемым ацилированием арилбороновых кислот с использованием в качестве катализатора Pd (Gooβen & Ghosh, Angew. Chem. Int. Ed. Engl., 2001, 40, 3458-3460) или Rh.
Соединения по изобретению, которые несут N-содержащий ароматический гетероцикл на Ar1 или Ar2, можно получить катализируемым металлом кросс-сочетанием (Buchwald et al. Org. Lett., 2002, 2, 1403-1406; Buchwald et al. J. Amer. Chem. Soc., 2001, 123, 7727-7729; Buchwald et al. J. Amer. Chem. Soc., 2002, 124, 11684-11688). Альтернативно, данные соединения можно получить из подходящих предшественников, таких как арилгидразины, ариламины или арилнитрилы, известными из литературы способами (например, Alvisi, Gazz. Chem. Ital., 1892, 22, 159; Finar, Godfrey, J. Chem. Soc., 1954, 2293; Muri et al. Synth. Commun., 1998, 28, 1299-1321; Artico et al. Europ. J. Med. Chem. Chim. Ther., 1992, 27, 219-228; Biagi et al. Farmaco Ed. Sci. 1988, 43, 597-612; Stefancich et al. Farmaco Ed. Sci. 1984, 39, 752-764).
Как правило, в ходе любого способа получения соединений по настоящему изобретению может быть необходимо и/или желательно защитить чувствительные или реакционноспособные группы любой из рассматриваемых молекул. Этого можно достичь с помощью традиционных защитных групп, таких, как описано в Protective Groups in Organic Chemistry (ed. J.F.W. McOmie, Plenum Press, 1973) и Green & Wuts, Protective Groups in Organic Synthesis, John Wiley & Sons, 1991. Защитные группы можно удалить на подходящей последующей стадии с использованием способов, известных в данной области.
ПРИМЕРЫ
Приведенные ниже примеры являются не ограничивающими и представляют собой только иллюстрацию некоторых вариантов осуществления настоящего изобретения.
Химический синтез
Общие методики
Спектры ЯМР1Н записаны на спектрометре Varian Mercury-VX400MHz при 400 МГц и химические сдвиги даны в величинах δ [м.д.] относительно остаточного пика хлороформа (CDCl3) в 7,26 м.д. и метанола (CD3OD) в 3,31 м.д. в качестве растворителя. Константы взаимодействия, J, даны в герцах. Если не указано иное, ЯМР-спектры соединений приведены для их свободной аминной формы. Из-за присутствия ротамеров, как правило, наблюдается две группы сигналов и дается соотношения ротамеров. В случае, когда можно безошибочно идентифицировать соответствующие сигналы для каждого из двух ротамеров, они даются совместно [например, 4,66-4,58 и 3,76-3,68 (2м, 1H)]. Картриджи кислотной ионообменной твердофазной экстракции (SPE) представляют собой MEGA BE-SCX компании Varian.
Вещества и растворители имели наивысшую степень чистоты, доступную из коммерческих источников, и использовались без дополнительной очистки.
Метод ВЭЖХ/ЖХМС
Анализ осуществляют на комбинированной препаративной/аналитической системе Waters/Micromass, состоящей из ZMD одиночного квадрупольного масс-спектрометра, оборудованного интерфейсом с электрораспылительной ионизацией. Система ВЭЖХ состоит из градиентного насоса Waters 600 с дегазацией в режиме он-лайн, системой управления образцом 2700 и детектором 996 PDA. Разделение проводят на колонке X-Terra MS C18, 5 мкм 4,6×50 мм. Буфер A: 10 мМ ацетат аммония в воде, буфер B: 10 мМ ацетат аммония в смеси ацетонитрил/вода 95/5. Градиент составляет от 30% B до 100% B в течение 7 мин, выдерживают при 100% B в течение 1 мин и повторно уравновешивают в течение 5,5 мин. Система работает при 1 мл/мин.
Получение гидрохлоридных солей
Обычно третичные амины растворяют в дихлорметане, обрабатывают избытком 1М HCl в диэтиловом эфире и осаждают из н-гептана. Растворители удаляют в вакууме и после сушки гидрохлоридные соли получают в виде бесцветных твердых веществ.
Получение оксалатных или тартратных солей
Обычно третичные амины растворяют в метаноле, обрабатывают 1 экв. соответствующей кислоты, удаляют растворитель, соль вновь растворяют в дихлорметане и осаждают из н-гептана. Растворители удаляют в вакууме, получая соли в виде бесцветных твердых веществ.
Получение производных фенилацетилхлорида
Производное фенилуксусной кислоты (15 ммоль) растворяют в дихлорметане (100 мл) и медленно добавляют оксалилхлорид (45 ммоль). Реакционную смесь перемешивают в течение 4 часов и затем выпаривают досуха. Продукт получают в виде бесцветного масла и используют непосредственно после получения на стадии ацилирования.
4-Изобутоксифенилуксусная кислота (128NLS28)
Метил(4-гидроксифенил)ацетат (14,6 г, 0,0885 моль) растворяют в ДМФА (200 мл), добавляют карбонат калия (31,0 г, 0,224 ммоль) и смесь перемешивают в течение 1 ч при комнатной температуре (кт). Добавляют 1-бром-2-метилпропан (19,2 мл, 0,177 моль) и смесь нагревают при 80°С в течение 3 дней при энергичном перемешивании. Смесь охлаждают до кт, фильтруют, удаляют растворитель и остаток распределяют между 1,5М NaOH и этилацетатом. Органический слой выпаривают, остаток растворяют в смеси метанола (100 мл) и воды (100 мл), добавляют KOH (10 г, 0,178 моль) и смесь перемешивают в течение ночи при кт. Метанол удаляют выпариванием и смесь экстрагируют дихлорметаном. Органический слой сливают, водный слой подкисляют 4М HCl до рН 2-3 и дважды экстрагируют дихлорметаном. Объединенные органические слои сушат над Na2SO4, фильтруют и выпаривают, получая указанное в заголовке соединение (16,9 г, 92%) в виде бесцветного твердого вещества.
4-Пропоксифенилуксусная кислота (98AF77-66)
Получают, как описано для 128NLS28, используя пропилбромид в качестве алкилирующего агента.
4-Изопропоксифенилуксусная кислота (130AF24-163)
Получают, как описано для 128NLS28, используя изопропилбромид в качестве алкилирующего агента.
Гидрохлорид N-{1-[2-(1,3-диоксолан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-N'-(4-изобутоксибензил)карбамида (80MBT86-2C)
Моногидрат гидрохлорида 4-пиперидона (4,0 г, 26,0 ммоль) растворяют в дихлорметане (130 мл). После добавления триэтиламина (8,66 г, 85,8 ммоль) смесь перемешивают в течение 10 мин и затем охлаждают до 0°С. По каплям при перемешивании добавляют ангидрид трифторуксусной кислоты (12,0 г, 57,2 ммоль). Спустя 2 ч при комнатной температуре реакцию останавливают добавлением воды (100 мл) и водную фазу экстрагируют дихлорметаном (2× 100 мл). Объединенные органические фазы сушат над Na2SO4, фильтруют и концентрируют, получая 1-(трифторацетил)-4-пиперидон (5,07 г, 100%).
4-Фторбензиламин (3,14 г, 25,9 ммоль) растворяют в метаноле (150 мл). Добавляют 1-(трифторацетил)-4-пиперидон (5,07 г, 25,9 ммоль) и pH доводят примерно до 5 уксусной кислотой. Реакционную смесь перемешивают в течение 5 мин и медленно при перемешивании добавляют NaBH3CN (2,46 г, 38,9 ммоль). Спустя 20 ч, при комнатной температуре реакционную смесь концентрируют. Добавляют 2М NaOH (100 мл) и водную фазу экстрагируют дихлорметаном (2×100 мл). Объединенные органические фазы сушат над Na2SO4, фильтруют и концентрируют, получая N-(4-фторбензил)-1-(трифторацетил)пиперидин-4-амин (50ELH85, 2,91 г, 37%).
4-Изобутоксифенилуксусную кислоту (7,6 г, 36,5 ммоль) растворяют в ТГФ (50 мл). Добавляют Proton SpongeTM (8,2 г, 38 ммоль) и смесь перемешивают в течение 15 мин. По каплям добавляют дифенилфосфорилазид (10,6 г, 38 ммоль) и смесь кипятят с обратным холодильником в течение 4 ч. Смесь охлаждают до комнатной температуры и помещают в морозильную камеру при -18°С на 20 ч. Образовавшийся в результате белый осадок энергично перемешивают с диэтиловым эфиром (250 мл) в течение 15 мин и фильтруют. Фильтрат выпаривают, получая неочищенный 4-изобутоксибензилизоцианат (1,97 г, 9,6 ммоль), который растворяют в дихлорметане (50 мл) и добавляют к раствору 50ELH85 (2,91 г, 9,6 ммоль) в дихлорметане (50 мл). Реакционную смесь перемешивают в течение 20 ч и концентрируют. Неочищенный продукт очищают флэш-хроматографией (0-5% метанола в дихлорметане), получая N-(4-фторбензил)-N-[1-(трифторацетил)пиперидин-4-ил]-N'-(4-изобутоксибензил)карбамид (76ELH17, 3,90 г, 91%).
Соединение 76ELH17 (3,90 г, 8,7 ммоль) растворяют в метаноле (12 мл) и добавляют к 2М раствору карбоната калия в метаноле (100 мл) при перемешивании. Через 4 ч метанол выпаривают и водную фазу экстрагируют дихлорметаном (2×100 мл). Объединенные органические фазы сушат над Na2SO4, фильтруют и концентрируют, получая получистое твердое вещество (2,95 г), которое очищают флэш-хроматографией (10% метанола в дихлорметане с 1% триэтиламина), получая N-(4-фторбензил)-N-(пиперидин-4-ил)-N'-(4-изобутилоксибензил)карбамид (76ELH18, 1,40 г, 39%) в виде бесцветного твердого вещества.
ЖХМС m/z 414 [M+H]+.1 H-ЯМР (CDCl3): δ 7,21-6,75 (м, 8H), 4,47-4,42 (м, 1Н), 4,39 (т, J=5 Гц, 1H), 4,35 (с, 2H), 4,27 (д, J=5 Гц, 2H), 3,68 (д, J=6 Гц, 2H), 3,13-3,06 (м, 2H), 2,74-2,66 (м, 2H), 2,11-1,99 (м, 1Н), 1,78-1,71 (м, 3H), 1,58-1,46 (м, 2H), 1,00 (д, J=6 Гц, 6H).
Соединение 76ELH18 (200 мг, 0,484 ммоль) растворяют в ацетонитриле (20 мл). Добавляют карбонат калия (74 мг, 0,553 ммоль) и иодид натрия (80 мг, 0,553 ммоль), после чего добавляют 2-(2-бромэтил)-1,3-диоксолан (100 мг, 0,553 ммоль). Реакционную смесь кипятят с обратным холодильником в течение 20 ч. Смесь концентрируют, добавляют воду (50 мл) и водную фазу экстрагируют дихлорметаном (2×50 мл). Объединенные органические фазы сушат над Na2SO4, фильтруют и выпаривают. Образовавшееся масло дважды очищают флэш-хроматографией (5% метанола в дихлорметане), получая бесцветное масло (50 мг, 20%).
Rf=0,70 (MeOH/CH2Cl2, 1:9). ЖХМС m/z 514 [M+H]+.1H-ЯМР (CDCl3): δ 7,21-6,75 (м, 8H), 4,94 (т, J=4,5 Гц, 1H), 4,73-4,62 (м, 1H), 4,58 (т, J=5,5 Гц, 1H), 4,41 (с, 2H), 4,26 (д, J=5,5 Гц, 2H), 4,00-3,80 (м, 4H), 3,68 (д, J=6,0 Гц, 2H), 3,43-3,35 (м, 2H), 2,94-2,87 (м, 2H), 2,68-2,57 (м, 2H), 2,45-2,32 (м, 2H), 2,20-2,13 (м, 2H), 2,10-2,00 (м, 1H), 1,88-1,81 (м, 2H), 1,00 (д, J=6,0 Гц, 6H). ВЭЖХ tR=8,1 мин.
Полученное соединение превращают в его гидрохлоридную соль, которую получают в виде бесцветного твердого вещества (80MBT86-2C).
Тартрат N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-[4-(2-гидрокси-2-метилпропокси)фенил]ацетамида (106MBT54-D)
Метил(4-гидроксифенил)ацетат (500 мг, 3,0 ммоль) растворяют в ДМФА (3 мл). Добавляют K2CO3 (829 мг, 6,0 ммоль), после чего добавляют изобутиленоксид (800 мкл, 9,0 ммоль). Смесь нагревают до 150°С микроволновым излучением в течение 30 мин и концентрируют. Остаток растворяют в смеси метанола и воды, 1:1 (20 мл). Добавляют NaOH (1 г) и смесь перемешивают в течение 30 мин. Метанол удаляют на роторном испарителе. Водную фазу подкисляют 4М HCl и экстрагируют дихлорметаном (2×50 мл). Объединенные органические фазы экстрагируют 2М NaOH (2×50 мл). Затем объединенные водные фазы подкисляют 4М HCl и экстрагируют дихлорметаном (2×50 мл). Объединенные органические фазы сушат над Na2SO4, фильтруют и выпаривают, получая [4-(2-гидрокси-2-метилпропокси)фенил]уксусную кислоту (106MBT52-D, 470 мг, 70%) в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3): δ 7,19 (м, 2H), 6,88 (м, 2H), 3,78 (с, 2H), 3,57 (с, 2H), 1,34 (с, 6H).
Кислоту 106MBT52-D (150 мг, 0,67 ммоль) растворяют в дихлорметане (10 мл). Добавляют N-{1-[2-(1, 3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)амин (118AF52-95, 180 мг, 0,56 ммоль), после чего добавляют триэтиламин (235 мкл, 0,84 ммоль). Добавляют гексафторфосфат бром-трис-пирролидинофосфония (PyBroP, 392 мг, 0,84 ммоль) и смесь перемешивают при комнатной температуре в течение 2 ч. Смесь концентрируют и пропускают через предварительно промытую (метанолом) ионообменную колонку (0,88 ммоль/г, 1 г). Колонку промывают метанолом (8×4 мл), оставшийся продукт элюируют из колонки 10% NH4OH в метаноле (2×4 мл) и выпаривают. Полученное в результате масло растворяют в дихлорметане (20 мл) и промывают насыщенным водным NaHCO3 (5×20 мл). Органическую фазу сушат над Na2SO4, фильтруют и выпаривают. Полученное в результате масло очищают флэш-хроматографией (0-5% метанола в дихлорметане), получая бесцветное масло (110 мг, 31%).
Rf=0,64 (MeOH/CH2Cl2, 1:9). ЖХМС m/z 529 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,4:0,6): δ 7,25-6,82 (м, 8H), 4,64-4,48 (м, 2,4H), 4,44 (с, 1,2H), 4,10-4,03 (м, 2H), 3,79-3,67 (м, 5,2H), 3, 50 (с, 1,2H), 2,90-2,81 (м, 2H), 2,42-3,95 (м, 2H), 2,12-1,98 (м, 2,2H), 1,87-1,79 (м, 0,8H), 1,76-1,48 (м, 5,2H), 1,36-1,27 (м, 7,8H). ВЭЖХ tR=6,1 мин.
Собранное соединение превращают в его тартратную соль, которую получают в виде бесцветного твердого вещества (106MBT54-D).
N-(4-Фторбензил)-N-(пиперидин-4-ил)-2-(4-изобутоксифенил)ацетамид (103NLS56)
К раствору амина 118AF93-51 (10,37 г, 30,3 ммоль) и триэтиламина (9,36 мл, 60,6 ммоль) в дихлорметане (200 мл) по каплям при 0°С добавляют раствор 4-изобутоксифенилацетилхлорида 128NLS28 (8,93 г, 39,4 ммоль) в дихлорметане (100 мл). Раствор перемешивают при кт в течение 3 ч, затем добавляют воду и смесь промывают насыщенным водным NaHCO3. Органический слой промывают 5% HCl, водой и насыщенным раствором соли, сушат над сульфатом натрия, фильтруют и выпаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле, элюируя ступенчатым градиентом смеси 0-50% этилацетата в н-гептане, получая N-(4-фторбензил)-N-[1-(бензилоксикарбонил)пиперидин-4-ил]-2-(4-изобутоксифенил)ацетамид в виде бесцветного масла.
Данное соединение растворяют в абсолютном этаноле (200 мл) и гидрируют в течение ночи при кт с использованием Pd/C (10%, 1 г) в качестве катализатора. Смесь фильтруют через Целит, растворитель удаляют и остаток сушат в вакууме, получая бесцветное масло (7,02 г, 58% за обе стадии). Данное соединение используют без дальнейшей очистки.
ЖХМС m/z 399 [M+H]+. ВЭЖХ tR=8,8 мин.
Дигидрохлорид N-{1-[3-(3, 5-диметилпиперидин-1-ил)пропил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида (103NLS45-B)
К 3,5-диметилпиперидину (43 мкл, 0,33 ммоль) в ДМФА (1 мл) добавляют карбонат калия (132 мг, 1,0 ммоль), после чего добавляют 1-хлор-3-иодопропан (32 мкмоль, 0,30 ммоль) и смесь перемешивают при 50°С в течение 2 ч. После охлаждения до кт добавляют раствор 103NLS56 (100 мг, 0,25 ммоль) в ДМФА (0,5 мл), после чего добавляют иодид натрия (45 мг, 0,30 ммоль). Смесь встряхивают в течение 20 ч при 60°С, фильтруют, выпаривают досуха и очищают колоночной хроматографией на силикагеле, элюируя ступенчатым градиентом смеси 0-10% метанола в дихлорметане. Далее остаток очищают, пропуская через картридж SPE с обращенной фазой С18, получая желаемое соединение (35 мг, 25%), которое превращают в его дигидрохлоридную соль.
Rf=0,61 (MeOH/CH2Cl2, 1:9). ЖХМС m/z 552 [M+H]+. ВЭЖХ tR=8,7 мин.
Дигидрохлорид метилового эфира 1-[3-(4-{(4-фторбензил)-[2-(4-изобутоксифенил)ацетил]амино}пиперидин-1-ил)пропил]пиперидин-4-карбоновой кислоты (103NLS45-E)
Получают способом, который описан для 103NLS45-В, используя метиловый эфир пиперидин-4-карбоновой кислоты (44 мкл, 0,33 ммоль). Выход 7 мг, 5%.
ЖХМС m/z 582 [M+H]+. ВЭЖХ tR=7,8 мин.
Диоксалат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[2-(1-метилпирролидин-2-ил)этил]пиперидин-4-ил}ацетамида (103NLS63-G)
К раствору амина 103NLS56 (15 мг, 0,038 ммоль) в ДМФА (0,3 мл) добавляют раствор гидрохлорида 2-(2-хлорэтил)-1-метилпирролидина (8,4 мг, 0,045 ммоль) в ДМФА (0,1 мл), после чего добавляют карбонат цезия (50 мг, 0,15 ммоль) и иодид натрия (6,8 мг, 0,045 ммоль). Смесь перемешивают в течение ночи при 60°С, распределяют между дихлорметаном и насыщенным водным раствором NaHCO3. Органический слой сушат над сульфатом натрия, фильтруют и выпаривают. Остаток очищают препаративной ВЭЖХ с обращенной фазой (С18) и полученное соединение (10,5 мг, 54%) превращают в его диоксалатную соль.
ЖХМС m/z 510 [M+H]+. ВЭЖХ tR=8,1 мин.
Диоксалат N-{1-[3-(2,6-диметилморфолин-4-ил)пропил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида диоксалат (103NLS69-A)
К раствору 2,6-диметилморфолина (6,1 мкл, 49 мкмоль) в ДМФА (0,3 мл) добавляют 1-хлор-3-иодопропан (4,9 мкл, 45 мкмоль) в ДМФА (0,05 мл), после чего добавляют карбонат цезия (50 мг, 0,15 ммоль). Смесь встряхивают при 50°С в течение 3 ч. После охлаждения до кт добавляют производное пиперидина 103NLS56 (15 мг, 38 мкмоль) в ДМФА (0,1 мл) и иодид натрия (6,8 мг, 45 мкмоль) и перемешивают в течение ночи при 60°С. Смесь распределяют между дихлорметаном и насыщенным водным раствором NaHCO3. Органический слой сушат над сульфатом натрия, фильтруют и выпаривают. Остаток очищают препаративной ВЭЖХ с обращенной фазой (С18) и полученное соединение (6,3 мг, 30%) превращают в его диоксалатную соль.
ЖХМС m/z 554 [M+H]+. ВЭЖХ tR=8,7 мин.
Диоксалат N-(4-фторбензил)-N-{1-[3-(3-гидроксипиперидин-1-ил)пропил]пиперидин-4-ил}-2-(4-изобутоксифенил)ацетамида (103NLS69-B)
Получают способом, который описан для 103NLS69-A, используя гидрохлорид 3-гидроксипиперидина (6,8 мг, 49 мкмоль). Выход 7,9 мг, 30%.
ЖХМС m/z 540 [M+H]+. ВЭЖХ tR=8,1 мин.
Диоксалат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[3-(2-метилпиперидин-1-ил)пропил]пиперидин-4-ил}ацетамида (103NLS69-С)
Получают способом, который описан для 103NLS69-A, используя 2-метилпиперидин (5,8 мкл, 49 мкмоль). Выход 5,2 мг, 26%.
ЖХМС m/z 538 [M+H]+. ВЭЖХ tR=8,7 мин.
Диоксалат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-[1-(3-пирролидин-1-илпропил)пиперидин-4-ил]ацетамида (103NLS69-D)
Получают способом, который описан для 103NLS69-A, используя пирролидин (5,0 мкл, 49 мкмоль). Выход 4,6 мг, 24%.
ЖХМС m/z 510 [M+H]+. ВЭЖХ tR=8,4 мин.
Диоксалат N-{1-[3-(2,5-диметилпирролидин-1-ил)пропил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида (103NLS69-Е)
Получают способом, который описан для 103NLS69-A, используя 2,5-диметилпирролидин (6,0 мкл, 49 мкмоль). Выход 3,4 мг, 17%.
ЖХМС m/z 538 [M+H]+. ВЭЖХ tR=8,7 мин.
Диоксалат N-(4-фторбензил)-N-{1-[3-(3-гидроксиметилпиперидин-1-ил)пропил]пиперидин-4-ил}-2-(4-изобутоксифенил)ацетамида (103NLS69-F)
Получают способом, который описан для 103NLS69-A, используя 3-гидроксиметилпиперидин (5,5 мкл, 49 мкмоль). Выход 5,5 мг, 26%.
ЖХМС m/z 554 [M+H]+. ВЭЖХ tR=8,0 мин.
(4S)-3-(3-Хлорпропил)-4-изопропилоксазолидинон-2-он (103NLS94)
Гидрид натрия (60% суспензия в масле, 288 мг, 7,2 ммоль) добавляют к раствору (S)-4-изопропил-2-оксазолидинона (775 мг, 6,0 ммоль) в сухом тетрагидрофуране (50 мл) в атмосфере аргона. Суспензию перемешивают в течение 15 мин при кт, затем по каплям в течение 30 мин добавляют 1-бром-3-хлорпропан (1,18 мл, 12,0 ммоль). Смесь кипятят с обратным холодильником в течение ночи, фильтруют и фильтрат выпаривают в вакууме. Осадок очищают колоночной хроматографией на силикагеле, элюируя ступенчатым градиентом смеси 0-4% метанола в дихлорметане, получая (4S)-3-(3-хлорпропил)-4-изопропилоксазолидинон-2-он (824 мг, 67%) в виде бесцветного масла.
Оксалат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[3-(4-(S)-изопропил-2-оксооксазолидин-3-ил)пропил]пиперидин-4-ил}ацетамида (117NLS01)
К раствору 103NLS56 (207 мг, 0,52 ммоль) добавляют карбонат калия (215 мг, 1,56 ммоль) с последующим добавлением алкилирующего агента 103NLS94 (127 мг, 0,62 ммоль) и иодида натрия (93 мг, 0,62 ммоль). Смесь перемешивают при 65°С в течение ночи, растворитель удаляют и остаток распределяют между этилацетатом и водой. Органический слой сушат над Na2SO4, фильтруют и выпаривают. Остаток очищают колоночной хроматографией на силикагеле, элюируя ступенчатым градиентом смеси 0-4% метанола в дихлорметане. Дальнейшую очистку вещества выполняют пропусканием через кислотный ионообменный SPE картридж, получая желаемое соединение (209 мг, 71%) в виде бесцветного масла, которое превращают в его оксалатную соль.
Rf=0,35 (MeOH/CH2Cl2, 5:95). ЖХМС m/z 568 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,6:0,4) δ 7,21-6,80 (м, 8H, Ar-H), 4,60-4,53 (м, 0,6H, пип-Н), 4,49 и 4,43 (2с, 2H, бензил-Н), 4,19-4,14 (м, 1H, окса-CH2), 4,06-4,01 (м, 1H, окса-CH2), 3,77-3,67 (м, 4,2H, пип-Н, окса-NCH, CH2OiBu, бензил-Н), 3,53-3,46 (м, 2,2H, бензил-Н, OCONCH2), 2,98-2,85 (м, 3H, пип-Н, OCONCH2), 2,39-2,25 (м, 2H, NCH2), 2,10-2,00 (м, 3,2H, CH(CH3)2, пип-Н, CHOiBu), 1,85-1,50 (м, 6H, пип-Н, NCH2CH2), 1-29 (м, 0,8H, пип-Н), 1,01-0,99 (м, 6H, CH3OiBu), 0,89-0,83 (м, 6H, CH(CH3)2). ВЭЖХ tR=8,9 мин.
Оксалат N-[2-(4-форфенил)этил]-2-(4-изобутоксифенил)-N-{1-[3-(4-(S)-изопропил-2-оксооксазолидин-3-ил)пропил]пиперидин-4-ил}ацетамида (117NLS03-А)
Получают способом, который описан для 117NLS01, используя N-[2-(4-фторфенил)этил]-2-(4-изобутоксифенил)-N-(пиперидин-4-ил)ацетамид (111 мг, 0,27 ммоль, полученный по методике, описанной для 103NLS56). Выход 90 мг, 57%.
Rf=0,30 (MeOH/CH2Cl2, 5:95). ЖХМС m/z 582 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,6:0,4) δ 7,18-6,80 (м, 8H, Ar-H), 4,40-4,35 (м, 0, 4H, пип-Н), 4,20-4,15 (м, 1H, окса-CH2), 4,05-4,01 (м, 1H, окса-CH2), 3,75-3,46 (м, 6,6H, пип-Н, окса-NCH, CH2OiBu, бензил-Н, OCONCH2), 3,36 (м, 2H, ArCH2CH2N), 3,02-2,84 (м, 3H, пип-Н, OCONCH2), 2,81-2,75 (м, 2H, ArCH2), 2,37-2,25 (м, 2H, NCH2), 2,09-1,98 (м, 2,8H, CH(CH3)2, пип-Н, CHOiBu), 1,85-1,62 (м, 6H, пип-Н, NCH2CH2), 1,31 (м, 1,2H, пип-Н), 1,00-0,97 (м, 6H, CH3OiBu), 0,89-0,84 (м, 6H, CH(CH3)2). ВЭЖХ tR=9,1 мин.
Оксалат N-[2-(4-фторфенил)этил]-N-{1-[3-(4-(S)-изопропил-2-оксооксазолидин-3-ил)пропил]пиперидин-4-ил}-2-(4-пропоксифенил)ацетамида (117NLS03-В)
Получают способом, который описан для 117NLS01, используя N-[2-(4-фторфенил)этил]-N-(пиперидин-4-ил)-2-(4-пропоксифенил)ацетамид (108 мг, 0,27 ммоль, полученный по методике, описанной для 103NLS56). Выход 76 мг, 50%.
Rf=0,33 (MeOH/CH2Cl2,5:95). ЖХМС m/z 568 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,6:0,4) δ 7,17-6,81 (м, 8H, Ar-H), 4,40-4,35 (м, 0,4H, пип-Н), 4,20-4,15 (м, 1H, окса-CH2), 4,05-4,01 (м, 1H, окса-CH2), 3,90-3,85 (м, 2H, OCH2OPr), 3,72-3,48 (м, 4,6H, пип-Н, окса-NCH, бензил-Н, OCONCH2), 3,36-3,30 (м, 2H, ArCH2CH2N), 2,99-2,86 (м, 3H, пип-Н, OCONCH2), 2,80-2,74 (м, 2H, Ai-CH2), 2,38-2,26 (м, 2H, NCH2), 2,11-2,03 (м, 1,8H, CH(CH3)2, пип-Н), 1,87-1,64 (м, 8H, пип-Н, CH2OPr, NCH2CH2), 1,31 (м, 1,2H, пип-Н), 1,03-0,98 (м, 3H, CH3OPr), 0,88-0,83 (м, 6H, CH(CH3)2). ВЭЖХ tR=8,5 мин.
Оксалат N-(4-фторбензил)-N-{1-[3-(4-(S)-изопропил-2-оксооксазолидин-3-ил)пропил]пиперидин-4-ил}-2-(4-пропоксифенил)ацетамида (117NLS03-С)
Получают способом, который описан для 117NLS01, используя N-(4-фторбензил)-N-(пиперидин-4-ил)-2-(4-пропоксифенил)ацетамид (104 мг, 0,27 ммоль, полученный по методике, описанной для 103NLS56). Выход 120 мг, 80%.
Rf=0,36 (MeOH/CH2Cl25:95). ЖХМС m/z 554 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,6:0,4) δ 7,19-6,78 (м, 8H, Ar-H), 4,57-4,48 (м, 0,6H, пип-Н), 4,48 и 4, 42 (2c, 2H, бензил-Н), 4,18-4,12 (м, 1H, окса-CH2), 4,04-4,00 (м, 1H, окса-CH2), 3,91-3,85 (м, 2H, OCH20Pr), 3,75-3,66 (м, 2,2H, пип-Н, окса-NCH, бензил-Н), 3,49-3,43 (м, 2,2H, бензил-Н, OCONCH2), 2,98-2,80 (м, 3H, пип-Н, OCONCH2), 2,33-2,25 (м, 2H, NCH2), 2,05-1,50 (м, 10,2H, CH(CH3)2, NCH2CH2, пип-Н, CH20Pr), 1,27 (м, 0,8H, пип-Н), 1,18-0,98 (м, 3H, CH3ОPr), 0,87-0,81 (м, 6H, CH(CH3)2). ВЭЖХ tR=8,3 мин.
Оксалат N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида (103NLS63-F)
Получают способом, который описан для 117NLS01, используя 103NLS56 (262 мг, 0,657 ммоль) и 2-(2-бромэтил)-1,3-диоксан в качестве алкилирующего агента. Иодид натрия не требуется. Выход 152 мг, 45%.
Rf=0,35 (MeOH/CH2Cl2 1:9). ЖХМС m/z 513 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,6:0,4) δ 7,26-6,80 (м, 8H, Ar-H), 4,63-4,39 (м, 3,6H, пип-Н, диоксан-Н, бензил-Н), 4, 09-4,01 (м, 2H, диоксан-Н), 3,78-3,64 (м, 5,2H, пип-Н, диоксан-Н, CH2OiBu, бензил-Н), 3,50 (с, 1,2H, бензил-Н), 2,92-2,79 (м, 2H, пип-Н), 2,43-2,34 (м, 2H, NCH2), 2,10-1,96 (м, 3, 2H, диоксан-Н, пип-Н, CHOiBu), 1,88-1,48 (м, 6H, пип-Н, NCH2CH2), 1,35-1,24 (м, 1,8H, диоксан-Н, пип-Н), 1,01 (м, 6H, CH3OiBu). ВЭЖХ tR=8,8 мин.
Оксалат N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-[2-(4-фторфенил)этил]-2-(4-изобутоксифенил)ацетамида (117NLS03-D)
Получают способом, который описан для 117NLS03-А, используя 2-(2-бромэтил)-1,3-диоксан в качестве алкилирующего агента. Иодид натрия не требуется. Выход 99 мг, 70%.
Rf=0,35 (MeOH/CH2 Cl2 5:95). ЖХМС m/z 527 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,7:0,3) δ 7,18-6,80 (м, 8H, Ar-H), 4,58-4,54 (м, 1H, диоксан-Н), 4,48-4,41 (м, 0,3H, пип-Н), 4,10-4,06 (м, 2H, диоксан-Н), 3,77-3,66 (м, 5,4H, диоксан-Н, бензил-Н, CH2OiBu), 3,64-3,52 (м, 1,3H, бензил-Н, пип-Н), 3,37-3,32 (м, 2H, CH2NCO), 2,99 и 2,89 (2м, 2H, пип-Н), 2, 82-2,76 (м, 2H, ArCH2), 2,49-2,39 (м, 2H, NCH2), 2,12-2,00 (м, 2,6H, диоксан-Н, пип-Н, CHOiBu), 1,88-1,67 (м, 6H, пип-Н, CH2OiBu, NCH2CH2), 1,35-1,31 (м, 2,4H, диоксан-Н, пип-Н), 1,00 (т, 6H, J=6,6, CH3OiBu). ВЭЖХ tR=8,8 мин.
Оксалат N-{1-[2-(1, 3-диоксан-2-ил)этил]пиперидин-4-ил}-N-[2-(4-фторфенил)этил]-2-(4-пропоксифенил)ацетамида (117NLS03-Е)
Получают способом, который описан для 117NLS03-В, используя 2-(2-бромэтил)-1, 3-диоксан в качестве алкилирующего агента. Иодид натрия не требуется. Выход 90 мг, 65%.
Rf=0,23 (MeOH/CH2Cl25:95). ЖХМС m/z 513 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,7:0,3) δ 7,21-6,81 (м, 8H, Ar-H), 4,58-4,54 (м, 1H, диоксан-Н), 4,48-4,42 (м, 0,3H, пип-Н), 4,10-4,06 (м, 2H, диоксан-Н), 3,91-3,86 (м, 2H, CH2ОPr), 3,77-3,69 (м, 3,4H, диоксан-Н, бензил-Н), 3,63-3,56 (м, 1,3H, бензил-Н, пип-Н), 3,38-3,31 (м, 2H, CH2NCO), 2,99 и 2,89 (2м, 2H, пип-Н), 2,82-2,76 (м, 2H, ArCH2 ), 2,49-2,39 (м, 2H, NCH2), 2,12-2,00 (м, 1,6H, диоксан-Н, пип-Н), 1,87-1,65 (м, 8H, пип-Н, CH2OPr, NCH2CH2), 1,35-1,31 (м, 2,4H, диоксан-Н, пип-Н), 1,05-1, 00 (м, 3H, CH3ОРr). ВЭЖХ tR=8,0 мин.
Тартрат N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-пропоксифенил)ацетамида (117NLS03-F)
Получают способом, который описан для 117NLS03-С, используя 2-(2-бромэтил)-1,3-диоксан в качестве алкилирующего агента. Иодид натрия не требуется. Выход 107 мг, 79%.
Rf=0,41 (MeOH/CH2Cl25:95). ЖХМС m/z 499 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,6:0,4) δ 7,20-6,80 (м, 8H, Ar-H), 4,62-4, 56 (м, 0,6H, пип-Н), 4,54-4,51 (м, 1H, диоксан-Н), 4,49 и 4,43 (2с, 2H, бензил-Н), 4,08-4,04 (м, 2H, диоксан-Н), 3,92-3,87 (м, 2H, OCH2OPr), 3,76-3,68 (м, 3,2H, пип-Н, диоксан-Н, бензил-Н), 3,50 (с, 1,2H, бензил-Н), 2,90-2,83 (м, 2H, пип-Н), 2,43-2,36 (м, 2H, NCH2), 2,10-1,98 (м, 2,2H, диоксан-Н, пип-Н,), 1,86-1,51 (м, 8H, пип-Н, CH2OРr, NCH2CH2 ), 1,32-1,27 (м, 1,8H, диоксан-Н, пип-Н), 1,05-0,99 (м, 3H, CH3). ВЭЖХ tR=7,6 мин.
Тартрат N-{1-[2-(1, 3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-N'-(4-изобутоксибензил)карбамида (117NLS25)
Получают способом, который описан для 117NLS01, используя 2-(2-бромэтил)-1, 3-диоксан (24 мкл, 0,18 ммоль) в качестве алкилирующего агента и N-(4-фторбензил)-N'-(4-изобутоксибензил)-N-(пиперидин-4-ил)карбамид (76ELH18, 50 мг, 0,12 ммоль). Иодид натрия не требуется. Выход 38 мг, 60%.
Rf=0,32 (MeOH/CH2Cl21:9). ЖХМС m/z 528 [M+H]+.1H-ЯМР (CDCl3) δ 7,18-6,74 (м, 8H, Ar-H), 4,53 (т, 1H, J= 5,1, диоксан-Н), 4,46 (т, 1H, J=5,3, NH), 4,33-4,25 (м, 5H, пип-Н, бензил-Н), 4,08-4,04 (м, 2H, диоксан-Н), 3,75-3,68 (м, 2H, диоксан-Н), 3,66 (д, 2H, J=6,6, CH2OiBu), 2,93-2,88 (м, 2H, пип-Н), 2,43-2,39 (м, 2H, NCH2), 2,09-1,98 (м, 4H, CHOiBu диоксан-Н, пип-Н), 1,77-1,56 (м, 6H, пип-Н, NCH2CH2), 1,32-1,28 (м, 1H, диоксан-Н), 0,99 (д, 6H, J= 6,6, CH3OiBu). ВЭЖХ tR=8,7 мин.
Тартрат N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-фторфенил)ацетамида (117NLS87-А)
К раствору 118AF52-95 (300 мг, 0,93 ммоль) и триэтиламина (0,52 мл, 3,72 ммоль) в сухом ТГФ (10 мл) при 0°С по каплям добавляют раствор 4-фторфенилацетилхлорида (0,19 мл, 1,39 ммоль) в ТГФ (5 мл) и перемешивают при кт в течение 3 ч. Реакционную смесь фильтруют и фильтрат выпаривают досуха. Остаток распределяют между этилацетатом и 1М NaOH, органический слой промывают насыщенным раствором соли, сушат над Na2SO4, фильтруют и выпаривают. Очистка колоночной хроматографией на силикагеле с элюированием ступенчатым градиентом смеси 0-8% метанола в дихлорметане с последующей очисткой соединения пропусканием через кислотный ионообменный SPE картридж, дает желаемое соединение (131 мг, 31%), которое превращают в его тартратную соль, как описано выше.
Rf=0,39 (MeOH/CH2Cl21:9). ЖХМС m/z 459 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,6:0,4) δ 7,25-6,88 (м, 8H, Ar-H), 4,58-4,52 (м, 0,6H, пип-Н), 4,50 (т, 1H, J=5,1, диоксан-Н), 4,48 и 4,44 (2с, 2H, бензил-Н), 4,06-4,02 (м, 2H, диоксан-Н), 3,78 и 3,50 (2с, 2H, бензил-Н), 3,72-3,64 (м, 2,4H, пип-Н, диоксан-Н), 2,84 (м, 2H, пип-Н), 2,40-2,35 (м, 2H, NCH2), 2,07-1,99 (м, 2,2H, диоксан-Н, пип-Н), 1,85-1,50 (м, 6H, пип-Н, NCH2CH2), 1,30-1,25 (м, 1,8H, диоксан-Н, пип-Н). ВЭЖХ tR=6,9 мин.
Тартрат N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-п-толилацетамида (117NLS87-В)
Получают способом, который описан для 117NLS87-А, используя 4-метилфенилацетилхлорид и 118AF52-95 (300 мг, 0,93 ммоль). Выход 119 мг, 28%.
Rf=0,43 (MeOH/CH2Cl21:9). ЖХМС m/z 455 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,5:0,5) δ 7,17-6,87 (м, 8H, Ar-H), 4,60-4,53 (м, 0,5H, пип-Н), 4,50 (т, 1H, J=5,1, диоксан-Н), 4,48 и 4,41 (2с, 2H, бензил-Н), 4,05-4,01 (м, 2H, диоксан-Н), 3,77-3,66 (м, 3,5H, пип-Н, бензил-Н, диоксан-Н), 3,50 (с, 1H, бензил-Н), 2,87-2,80 (м, 2H, пир-Н), 2,40-2,34 (м, 2Н, NCH2), 2,30 и 2, 28 (2с, 3Н, СН3), 2,07-1,95 (м, 2H, диоксан-Н, пип-Н), 1,83-1,50 (м, 6H, пип-Н, NCH2СН2), 1,29-1,25 (м, 2H, диоксан-Н, пип-Н). ВЭЖХ tR=7,7 мин.
Тартрат 2-бензофуран-5-ил-N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)ацетамида (128NLS22-А)
Бензофуран-5-илуксусную кислоту получают, адаптируя методику, описанную Dunn et al. (J. Med. Chem., 1986, 29, 2326), и ее превращают в соответствующий ацетилхлорид обработкой оксалилхлоридом. Указанное в заголовке соединение получают из 118AF52-95 (58 мг, 0,18 ммоль) способом, который описан для 117NLS87-А. Выход 27 мг, 43%.
Rf=0,52 (MeOH/CH2Cl21:9). ЖХМС m/z 481 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,6:0,4) δ 7,64-6,68 (м, 9H, Ar-H), 4,62-4,54 (м, 0,6H, пип-Н) 4,53-4,44 (м, 3H, диоксан-Н, бензил-Н), 4,07-4,03 (м, 2H, диоксан-Н), 3,82-3,61 (м, 3,2H, пип-Н, бензил-Н, диоксан-Н), 3,45 (с, 1,2H, бензил-Н), 2,91-2,80 (м, 2H, пип-Н), 2,44-2,35 (м, 2H, NCH2), 2,08-1,98 (м, 2,2H, диоксан-Н, пип-Н), 1,85-1,56 (м, 6H, пип-Н, NCH2CH2), 1,32-1,27 (м, 1,8H, диоксан-Н, пип-Н). ВЭЖХ tR=6,6 мин.
Тартрат 2-(2,3-дигидробензофуран-5-ил)-N-{1-[2-(1, 3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)ацетамида (128NLS22-В)
Соединение (2,3-дигидробензофуран-5-ил)уксусную кислоту получают, адаптируя методику, описанную Dunn et al. (J. Med. Chem., 1986, 29, 2326), и превращают в соответствующий ацетилхлорид обработкой оксалилхлоридом. Указанное в заголовке соединение получают из 118AF52-95 (58 мг, 0,18 ммоль) способом, который описан для 117NLS87-А. Выход 27 мг, 31%.
Rf=0,50 (MeOH/CH2Cl21:9). ЖХМС m/z 483 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,6:0,4) δ 7,10-6,60 (м, 7H, Ar-H), 4,55-4,40 (м, 5,6H, пип-Н, диоксан-Н, бензил-Н', ArOCH2), 4,01-3,97 (м, 2H, диоксан-Н), 3,72-3,62 (м, 3,2H, пип-Н, бензил-Н, диоксан-Н), 3,41 (с, 1,2H, бензил-Н), 3,14-3,06 (м, 2H, OCH2CH2), 2,80 (м, 2H, пип-Н), 2,35-2,30 (м, 2H, NCH2), 1,99-1,93 (м, 2,2H, диоксан-Н, пип-Н), 1,80-1,44 (м, 6H, пип-Н, NCH2CH2), 1,27-1,22 (м, 1,8H, диоксан-Н, пип-Н). ВЭЖХ tR=6,9 мин.
Тартрат N-{1-[2-(2,2-диметил-1, 3-диоксолан-4-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида (117NLS37)
1-(2',2'-Диметил-1',3'-диоксалан-4'-ил)этанол получают согласно методикам, описанным в литературе (Carman R.M. et al. Aust. J. Chem., 1998, 51, 955), и окисляют в альдегид обработкой хлорхроматом пиридиния. Неочищенный альдегид (80 мг, 0,55 ммоль) добавляют к раствору 103NLS56 (184 мг, 0,46 ммоль) в метаноле (5 мл). Добавляют уксусную кислоту (0,05 мл), после чего добавляют цианборогидрид натрия (58 мг, 0,92 ммоль) и смесь перемешивают в течение ночи при кт. Растворитель удаляют и остаток распределяют между дихлорметаном и 1М NaOH. Органический слой промывают насыщенным NH4Cl, сушат над Na2SO4, фильтруют и выпаривают. Очистка колоночной хроматографией на силикагеле с элюированием смесью 0-5% метанола в дихлорметане дает желаемое соединение (50 мг, 21%), которое превращают в его тартратную соль.
Rf=0,39 (MeOH/CH2Cl2 1:9). ЖХМС m/z 527 [M+H]+.1H-ЯМР (CDCl3,ротамеры 0,6:0,4) δ 7,22-6,79 (м, 8H, Ar-H), 4,62-4,54 (м, 0,6H, пип-Н), 4,49 и 4,42 (2с, 2H, бензил-Н), 4,06-3,98 (м, 1H, диоксалан-Н), 3,75-3,66 (м, 4,4H, пип-Н, CH2OiBu, бензил-Н), 3,48 (м, 2H, диоксалан-Н), 2,89-2,83 (м, 2H, пип-Н), 2,45-2,25 (м, 2H, NCH2), 2,07-1,99 (м, 2,2H, пип-Н, CHOiBu), 1,85-1,51 (м, 6H, пип-Н, NCH2CH2), 1,36-1,28 (м, 6,8H, C(CH3)2, пип-Н), 1,02-0,99 (м, 6H, CH3OiBu). ВЭЖХ tR=9,3 мин.
4-[2-(Толуолсульфонилокси)этил]-1,3-диоксан (128NLS46-B)
Суспензию 1,3,5-пентантриола (1,01 г, 8, 33 ммоль), параформальдегида (0,46 г) и метансульфокислоты (0,33 мл) в ДМФА (3 мл) нагревают в течение 10 мин при 130°С микроволновым излучением. Смесь распределяют между этилацетатом и водой, органический слой сушат над Na2SO4, фильтруют и выпаривают. Остаток растворяют в метаноле (3 мл), добавляют концентрированную HCl (0,09 мл) и смесь нагревают при 80°С в течение 10 мин микроволновым излучением. Добавляют этилацетат и 2М NaOH, водный слой дважды экстрагируют этилацетатом и объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4, фильтруют и выпаривают. Неочищенный продукт обрабатывают п-толуолсульфонилхлоридом и DMAP, следуя методикам, описанным в литературе (Moune et al. J. Org. Chem., 1997, 62, 3332). Указанное в заголовке соединение (1,18 г, 49% полный выход неочищенного вещества) получают в виде желтоватого масла, которое используют без очистки.
N-{1-[2-(1, 3-Диоксан-4-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)амин (128NLS52)
К суспензии моногидрата гидрохлорида 4-пиперидона (1,26 г, 8,23 ммоль) в ацетонитриле (100 мл) добавляют карбонат калия (3,4 г, 24,6 ммоль), после чего добавляют толуолсульфонат 128NLS46-В (3,54 г, 12,36 ммоль) и иодид натрия (1,85 г, 12,35 ммоль) и перемешивают в течение ночи при 60°С. Смесь фильтруют, фильтрат выпаривают в вакууме и остаток распределяют между 1М NaOH и этилацетатом. Органический слой отделяют, водный слой дважды экстрагируют этилацетатом и объединенные органические слои сушат над сульфатом натрия, фильтруют и выпаривают досуха. Очистка остатка колоночной хроматографией на силикагеле с элюированием ступенчатым градиентом смеси 0-4% метанола в дихлорметане дает 1-[2-(1, 3-диоксан-4-ил)этил]пиперидин-4-он (128NLS50, 1,73 г, 98%).
К раствору 128NLS50 (1,73 г, 8,13 ммоль) в метаноле (100 мл) по каплям добавляют 4-фторбензиламин (0,93 мл, 8,13 ммоль) и уксусную кислоту. К смеси при 0°С медленно добавляют цианборогидрид натрия (2,15 г, 40 ммоль) и перемешивают при кт в течение ночи. Реакционную смесь концентрируют в вакууме и остаток распределяют между дихлорметаном и 1М NaOH, водный слой дважды экстрагируют дихлорметаном и объединенные органические слои сушат над Na2SO4, фильтруют и выпаривают досуха. Очистка остатка колоночной хроматографией на силикагеле с элюированием смесью 0-30% метанола в дихлорметане дает указанное в заголовке соединение (1,51 г, 58%) в виде бесцветного твердого вещества.
Тартрат N-{1-[2-(1,3-диоксан-4-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида (128NLS62)
Получают способом, который описан для 117NLS87-А, используя 4-изобутоксифенилацетилхлорид и 128NLS52 (480 мг, 1,49 ммоль). Выход 458 мг, 60%.
Rf=0,36 (MeOH/CH2Cl2 1:9). ЖХМС m/z 513 [M+H]+.1H-ЯМР (CDCl3,ротамеры 0,6:0,4) δ 7,21-6,80 (м, 8H, Ar-H), 5,01 (д, 1H, J=6,1, диоксан-Н), 4,66-4,56 (м, 1,6H, пип-Н, диоксан-Н) 4,51 и 4,44 (2c, 2H, бензил-Н), 4,09-4,05 (м, 1H, диоксан-Н), 3,77 и 3,51 (2c, 2H, бензил-Н), 3,70-3,57 (м, 4,4H, пип-Н, диоксан-Н, CH2OiBu), 2,91-2,83 (м, 2H, пип-Н), 2,45-2,34 (м, 2H, NCH2), 2,10-2, 00 (м, 2,2H, пип-Н, CHOiBu), 1,85-1,26 (м, 8,8H, пип-Н, диоксан-Н, NCH2CH2), 1,03-1,00 (м, 6H, CH3OiBu). ВЭЖХ tR=8,8 мин.
Тартрат N-{1-[2-(1,3-диоксан-4-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-трифторметилфенил)ацетамида (128NLS54-А)
Получают способом, который описан для 117NLS87-А, используя 4-трифторфенилацетилхлорид и 128NLS52 (116 мг, 0,32 ммоль). Выход 52 мг, 32%.
Rf=0,42 (MeOH/CH2Cl21:9). ЖХМС m/z 509 [M+H]+.1H-ЯМР (CDCl3,ротамеры 0,6:0,4) δ 7,60-6,90 (м, 8H, Ar-H), 4,99 (д, 1H, J=6,1, диоксан-Н), 4,65-4,54 (м, 1,6H, пип-Н, диоксан-Н), 4,52 и 4,47 (2с, 2H, бензил-Н), 4,07-4,04 (м, 1H, диоксан-Н), 3,88 (с, 0,8H, бензил-Н), 3,69-3,56 (м, 3,6H, бензил-Н, пип-Н, диоксан-Н), 2,89 (м, 2H, пип-Н), 2,49-2,31 (м, 2H, NCH2), 2,07-1,99 (м, 1,2H, пип-Н), 1,89-1,36 (м, 8,8H, пип-Н, диоксан-Н, NCH2CH2). ВЭЖХ tR=7,3 мин.
Тартрат 2-(4-цианофенил)-N-{1-[2-(1, 3-диоксан-4-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)ацетамида (128NLS54-С)
4-Цианофенилуксусную кислоту синтезируют согласно способу, описанному Jaeger et al. (J. Chem. Soc., 1941, 744-747), и превращают в соответствующий ацетилхлорид обработкой оксалилхлоридом. Указанное в заголовке соединение получают способом, который описан для 117NLS87-А, используя 4-цианофенилацетилхлорид и 128NLS52 (116 мг, 0,32 ммоль). Выход 60 мг, 40%.
Rf=0,40 (MeOH/CH2Cl21:9). ЖХМС m/z 466 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,7:0,3) δ 7,62-6,89 (м, 8H, Ar-H), 4,97 (д, 1H, J=6,1, диоксан-Н), 4,63 (м, 1H, диоксан-Н), 4,59-4,47 (м, 2,7H, пип-Н, бензил-Н), 4,06-4,02 (м, 1H, диоксан-Н), 3,86 (с, 0,6H, бензил-Н), 3,69-3,55 (м, 3,7H, бензил-Н, пип-Н, диоксан-Н), 2,91-2,86 (м, 2H, пип-Н), 2,47-2,30 (м, 2H, NCH2), 2,05-1,39 (м, 10H, пип-Н, диоксан-Н, NCH2CH2). ВЭЖХ tR=4,3 мин.
Гидрохлорид N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[2-(2-оксоимидазолидин-1-ил)этил]пиперидин-4-ил}ацетамида (69NLS97)
Получают способом, который описан для 117NLS01, используя 103NLS56 (240 мг, 0,60 ммоль) и 1-(2-толуолсульфонилоксиэтил)-2-имидазолидинон в качестве алкилирующего агента. Выход 95 мг, 31%.
ЖХМС m/z 511 [M+H]+.1H-ЯМР (CD3OD, ротамеры 0,6:0,4) δ 7,24-6,81 (м, 8H, Ar-H), 4,56 и 4,52 (2с, 2H, бензил-Н), 4,41-4,37 и 3,93-3,88 (м, 1H, пип-Н), 3,84 и 3,56 (2с, 2H, бензил-Н), 3,73-3,69 (м, 2H, CH2OiBu), 3,46-3,20 (м, 6H, имид-CH2, NCH2CH2), 2,99-2,85 (м, 2H, пип-Н), 2,44 (м, 2H, NCH2), 2, 10-1,96 (м, 3,2H, пип-Н, CHOiBu), 1,67-1,62 (м, 3H, пип-Н), 1,30 (м, 0,8H, пип-Н), 1,03-0,99 (м, 6H, J=6,6, CH3OiBu). ВЭЖХ tR =9,5 мин.
Выбирая подходящие вторичные амины (полученные по аналогии со способом, описанным для 103NLS56), следующие ниже соединения получают с использованием аналогичной методики.
Гидрохлорид 2-(4-метоксифенил)-N-(4-метилбензил)-N-{1-[2-(2-оксоимидазолидин-1-ил)этил]пиперидин-4-ил}ацетамида (63ELH39-B)
ЖХМС m/z 465 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,6:0,4) δ 7,30-6,80 (м, 8H), 4,60-4,53 (м, 0,6H), 4,50 и 4,43 (2с, 2H), 3,78 (м, 4,2H), 3,51 (с, 1,2H), 3,46-3,24 (м, 6H), 2,92-2,79 (м, 2H), 2,46-2,40 (м, 2H), 2, 35 и 2,29 (2с, 3H), 2,11-2,05 (м, 1,2H), 1,92-1,86 (м, 0,8H), 1,65-1,50 (м, 3,2H, частично накрыт сигналом HDO), 1,31 (м, 0,8H).
Гидрохлорид N-(4-фторбензил)-2-(4-изопропоксифенил)-N-{1-[2-(2-оксоимидазолидин-1-ил)этил]пиперидин-4-ил}ацетамида (63ELH87)
Гидрохлорид N-(4-фторбензил)-2-(4-изопропоксифенил)-N-{1-[3-(3-метил-2-оксо-2,3-дигидробензоимидазол-1-ил)пропил]пиперидин-4-ил}ацетамида (103NLS39)
Получают способом, который описан для 117NLS01, используя N-(4-фторбензил)-N-(пиперидин-4-ил)-2-(4-изопроксифенил)ацетамид (229 мг, 0,59 ммоль) и 1-(3-хлорпропил)-3-метил-1,3-дигидробензимидазол-2-он в качестве алкилирующего агента. Выход 205 мг, 61%.
Rf=0,29 (MeOH/CH2Cl25:95). ЖХМС m/z 573 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,5:0,5) δ 7,18-6,78 (м, 12H, Ar-H), 4,59-4,43 (м, 3,5H, пип-Н, OCH, бензил-Н), 3,88 (т, 2H, J=6,8, NCONCH2), 3,74 (м, 1,5H, пип-Н, бензил-Н), 3,49 (с, 1H, бензил-Н), 3,38 и 3,37 (2с, 3H, NCH3), 2,93-2, 79 (м, 2H, пип-Н), 2,36-2,29 (м, 2H, NCH2), 2,02-1,95 (м, 1H, пип-Н), 1,90-1,46 (м, 6H, пип-Н, NCH2CH2), 1,31-1,25 (м, 7H, пип-Н, CH(CH3)2). ВЭЖХ tR=8,0 мин.
Выбирая подходящие вторичные амины (полученные по аналогии со способом, описанным для 103NLS56) и алкилирующие агенты, следующие ниже соединения получают, используя аналогичную методику:
гидрохлорид N-{1-[2-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)этил]пиперидин-4-ил}-2-(4-метоксифенил)-N-(4-метилбензил)ацетамида (63ELH29A),
гидрохлорид 2-(4-метоксифенил)-N-(4-метилбензил)-N-{1-[3-(2-оксо-2,3-дигидробензоимидазол-1-ил)пропил]пиперидин-4-ил}ацетамида (50ELH89),
гидрохлорид
N-(4-фторбензил)-2-(4-изопропоксифенил)-N-{1-[4-(2-оксо-2,3-дигидробензоимидазол-1-ил)бутил]пиперидин-4-ил}ацетамида (63ELH91),
гидрохлорид N-{1-[2-(2,4-диоксо-1, 4-дигидро-2Н-хиназолин-3-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изопропоксифенил)ацетамида (63ELH89).
Бензиловый эфир 4-(4-фторбензиламино)пиперидин-1-карбоновой кислоты (118AF93-51)
К раствору бензил 4-оксо-1-пиперидинкарбоксилата (10,2 г, 43,8 ммоль) в метаноле (150 мл) при комнатной температуре по каплям добавляют раствор 4-фторбензиламина (5,48 г, 43,8 ммоль) в смеси метанола и уксусной кислоты (5:1, 60 мл). К данной смеси медленно добавляют цианборогидрид натрия (5,5 г, 87,5 ммоль). После 20 часов перемешивания при кт реакционную смесь нейтрализуют и растворитель удаляют выпариванием при пониженном давлении. Остаток распределяют между дихлорметаном и водой. Органический слой сушат над сульфатом натрия, фильтруют и выпаривают досуха. Очистка остатка колоночной хроматографией на силикагеле с элюированием смесью 7% метанола в дихлорметане дает желаемое соединение (9,0 г, 60%).
Rf=0,56 (MeOH/CH2Cl25:95). ЖХМС m/z 343 [M+H]+. ВЭЖХ tR=6,2 мин.
N-(1-Бензилоксикарбонилпиперидин-4-ил)-N-(4-фторбензил)-N'-(4-изопропоксибензил)карбамид (118AF97-120)
К раствору 4-(изопропокси)фенилуксусной кислоты (2,89 г, 14,9 ммоль) в сухом тетрагидрофуране (18 мл) при кт в атмосфере аргона добавляют 1,8-бис(диметиламино)нафталин (3,19 г, 14,9 ммоль). После 25 минут перемешивания при кт по каплям добавляют дифенилфосфорилазид (4,10 г, 14, 9 ммоль) и смесь кипятят с обратным холодильником в течение 6 часов. Смесь охлаждают до кт и затем выдерживают при -20°С в течение ночи, осаждая соль фосфата аммония. К холодной реакционной смеси добавляют смесь диэтилового эфира и этилацетата (1:1 об./об., 25 мл). Осадок отфильтровывают от реакционной смеси и промывают смесью диэтиловый эфир : этилацетат (1:1 об./об., 20 мл). Фильтрат выпаривают досуха, получая 1-изоцианатметил-4-изопропоксибензол в виде масла (3,2 г), которое используют на следующей стадии без дальнейшей очистки.
К раствору бензилового эфира 4-(4-фторбензиламино)пиперидин-1-карбоновой кислоты 118AF93-51 (5,7 г, 16,7 ммоль) в сухом тетрагидрофуране (20 мл) добавляют карбонат натрия (3,5 г, 25,3 ммоль). К данной суспензии добавляют раствор 1-изоцианатметил-4-изопропоксибензола (3,2 г, 16,7 ммоль) в сухом тетрагидрофуране (10 мл) в атмосфере аргона. Реакционную смесь перемешивают в течение ночи при кт. Затем данную смесь распределяют между дихлорметаном и водой. Органический слой сушат над сульфатом натрия, фильтруют и выпаривают досуха. Очистка остатка колоночной хроматографией на силикагеле с элюированием смесью 8% метанола в дихлорметане дает желаемое соединение (2,0 г, 22%).
Rf=0,36 (MeOH/CH2Cl2,5:95). ЖХМС m/z 534 [M+H]+. ВЭЖХ tR=10,2 мин.
Оксалат N-(4-фторбензил)-N'-(4-изопропоксибензил)-N-пиперидин-4-илкарбамида (118AF99-121)
Желаемое соединение получают гидрированием 118AF97-120 (2,0 г, 3,75 ммоль) в абсолютном этаноле (100 мл), используя палладий на угле в качестве катализатора. Продукт очищают колоночной хроматографией на силикагеле, элюируя ступенчатым градиентом смеси 5-10% метанола в дихлорметане. Выход 1,16 г, 77%.
Rf=0,10 (MeOH/CH2Cl2, 10:90). ЖХМС m/z 400 [M+H]+.1H-ЯМР (CDCl3) δ 7,19 (м, 2H, Ar-H), 7,01-6,69 (м, 4H, Ar-H), 6,76 (м, 2H, Ar-H), 4,51-4,40 (м, 3H, пип-Н, OCH(CH3), NH), 4,35 (с, 2H, бензил-Н), 4,28 (с, 1H, бензил-Н), 4,27 (с, 1H, бензил-Н), 3,14-3,07 (м, 2H, пип-Н), 2,74-2,68 (м, 2H, пип-Н), 2,10 (уширенный с, 1H, NH), 1,78-1,70 (м, 2H, пип-Н), 1,58-1,48 (м, 2H, пип-Н), 1,31 (д, 6H, J=6,0, OCH(CH3)). ВЭЖХ tR=5,9 мин.
Оксалат N-{1-[2-(1,3-диоксолан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-N'-(4-изопропоксибензил)карбамида (130AF10-147)
К раствору 118AF99-121 (0,3 г, 0,75 ммоль) в сухом N,N-диметилформамиде (2 мл) добавляют карбонат калия (0,21 г, 1,50 ммоль). Суспензию встряхивают в течение 30 минут при 58°С. К теплой суспензии по каплям добавляют раствор 2-(2-бромэтил)-1,3-диоксолана (0,163 г, 0,90 ммоль) в сухом N,N-диметилформамиде (0,4 мл) и нагревание продолжают в течение ночи. Смесь охлаждают до кт, затем фильтруют и распределяют между водой и дихлорметаном. Органический слой промывают водным раствором 4% сульфата магния и выпаривают досуха. Очистка остатка колоночной хроматографией на силикагеле с элюированием смесью 4% метанола в дихлорметане дает желаемое соединение (197 мг, 53%). Продукт превращают в его оксалатную форму, как описано выше.
Rf=0,39 (MeOH/CH2Cl2, 4:94). ЖХМС m/z 500 [M+H]+.1H-ЯМР (CDCl3) δ 7,17 (м, 2H, Ar-H), 7,00-6,95 (м, 4H, Ar-H), 6,76 (м, 2H, Ar-H), 4,88 (т, 1H, J=4,8, диоксалан-Н), 4,51-4,44 (м, 2H, NH, CH(CH3)2), 4,36-4,26 (м, 5H, бензил-Н, пип-Н), 3,95-3,80 (м, 4H, диоксалан-Н), 2,98-2,91 (м, 2H, пип-Н), 2,48-2,43 (м, 2H, NCH2), 2,10-2,01 (м, 2H, пип-Н), 1,85-1,79 (м, 2H, NCH2CH2), 1,76-1,58 (м, 4H, пип-Н), 1,30 (д, 6H, J=6,0, CH(CH3)2). ВЭЖХ tR=6,9 мин.
Выбирая подходящие вторичные амины (полученные по аналогии со способом, описанным для 103NLS56), следующие ниже соединения получают с использованием аналогичной методики:
гидрохлорид N-{1-[2-(1, 3-диоксолан-2-ил)этил]пиперидин-4-ил}-2-(4-метоксифенил)-N-(4-метилбензил)ацетамида (63ELH29В),
гидрохлорид N-{1-[2-(1, 3-диоксолан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида (74AKU06-2),
гидрохлорид N-{1-[2-(1, 3-диоксолан-2-ил)этил]пиперидин-4-ил}-2-(4-изопропоксифенил)-N-(4-метилбензил)ацетамида (76ELH07),
тартрат N-{1-[2-(1, 3-диоксолан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-пропоксифенил)ацетамида (38PH50).
Оксалат N-(4-фторбензил)-N'-(4-изопропоксибензил)-N-{1-[2-((S)-4-метил-1, 3-диоксолан-2-ил)этил]пиперидин-4-ил}карбамида (130AF12-148)
К раствору 130AF10-147 (50 мг, 0,10 ммоль) в 1,4-диоксане (1 мл) добавляют 4М HCl (0,5 мл) и воду (0,5 мл). Смесь перемешивают в герметичной колбе в течение 10 минут под микроволновым излучением при 120°С. Затем смесь распределяют между дихлорметаном и водой. Органический слой сушат над сульфатом натрия, фильтруют и выпаривают досуха. Остаток растворяют в 1,4-диоксане (1 мл) и добавляют раствор (S)-(+)-пропиленгликоля (39 мг, 0,51 ммоль) в 1,4-диоксане (0,5 мл). После добавления HCl (4М в диоксане, 0, 5 мл) смесь перемешивают в герметичной колбе в течение 20 минут под микроволновым излучением при 120°С. Смесь распределяют между насыщенным раствором бикарбоната натрия и дихлорметаном. Органический слой выпаривают досуха. Очистка остатка колоночной хроматографией на силикагеле с элюированием ступенчатым градиентом смеси 4-8% метанола в дихлорметане дает желаемое соединение (2,1 мг, 4%). Продукт превращают в его оксалатную форму, как описано выше.
Rf=0,36 (MeOH/CH2Cl2, 4:94). ЖХМС m/z 514 [M+H]+. ВЭЖХ tR=7,2 мин.
Оксалат N-(4-фторбензил)-N'-(4-изопропоксибензил)-N-[1-(3-морфолин-4-илпропил)пиперидин-4-ил]карбамида (130AF09-145)
К холодной суспензии морфолина (200 мг, 2,29 ммоль) и карбоната натрия (0,63 г, 4,56 ммоль) в сухом тетрагидрофуране (8 мл) при 0°С добавляют раствор 1-хлор-3-бромпропана в сухом тетрагидрофуране (2 мл). Смесь перемешивают при 45°С в течение ночи. Смесь охлаждают до кт, фильтруют и выпаривают досуха. Очистка остатка колоночной хроматографией на силикагеле с элюированием смесью этилацетата и н-гептана (70:30) дает 3-хлор-1-морфолин-4-илпропан (156 мг, 42%).
Раствор 3-хлор-1-морфолин-4-илпропана (7,6 мг, 0,046 ммоль) в сухом N,N-диметилформамиде (0,10 мл) добавляют к раствору 118AF99-121 (15 мг, 0,037 ммоль) и карбоната цезия (40 мг, 0,123 ммоль) в смеси сухого N,N-диметилформамида и ацетонитрила (1:2, 0,30 мл). После добавления иодида натрия (7,0 мг, 0,047 ммоль) смесь встряхивают в течение ночи при 60°С. Смесь охлаждают до кт. Ацетонитрил удаляют выпариванием при пониженном давлении и остаток распределяют между дихлорметаном (2 мл) и водой (1 мл). Органический слой выпаривают досуха. Очистка остатка препаративной ВЭЖХ с обращенной фазой (С18) дает желаемое соединение (6,1 мг, 32%).
ЖХМС m/z 527 [M+H]+. ВЭЖХ tR=6,2 мин.
Выбирая подходящие вторичные амины (полученные по аналогии со способом, описанным для 103NLS56), следующие ниже соединения получают с использованием аналогичной методики:
дигидрохлорид 2-(4-метоксифенил)-N-(4-метилбензил)-N-[1-(2-морфолин-4-илэтил)пиперидин-4-ил]ацетамида (63ELH40-2),
дигидрохлорид 2-(4-метоксифенил)-N-(4-метилбензил)-N-[1-(3-морфолин-4-илпропил)пиперидин-4-ил]ацетамида (63ELH41-2),
дигидрохлорид N-(4-фторбензил)-2-(4-изобутоксифенил)-N-[1-(3-морфолин-4-илпропил)пиперидин-4-ил]ацетамида (74AKU07-2),
дигидрохлорид N-(4-фторбензил)-2-(4-изопропоксифенил)-N-[1-(3-морфолин-4-илпропил)пиперидин-4-ил]ацетамида (76ELH14-A).
Оксалат N-(4-фторбензил)-N'-(4-изопропоксибензил)-N-[1-(3-пиперидин-1-илпропил)пиперидин-4-ил]карбамида (130AF09-146)
Желаемое соединение синтезируют из пиперидина, 1-хлор-3-бромпропана и 118AF99-121 (15 мг, 0,037 ммоль), используя такой же способ, как для получения 130AF09-145. Выход 5,8 мг, 30%.
ЖХМС m/z 525 [M+H]+. ВЭЖХ tR=6,8 мин.
Тартрат N-(4-фторбензил)-N'-(4-изопропоксибензил)-N-[1-(3-((S)-4-изопропил-2-оксазолидинон-1илпропил)пиперидин-4-ил]карбамида (130AF14-152)
Желаемое соединение синтезируют из (4S)-3-(3-хлорпропил)-4-изопропилоксазолидинон-2-она 103NLS94 (7,4 мг, 0,045 ммоль) и 118AF99-121 (15 мг, 0,037 ммоль), используя такой же способ, как для получения 130AF09-145. Выход 3,3 мг, 16%.
ЖХМС m/z 569 [M+H]+. ВЭЖХ tR=8,2 мин.
Оксалат N-(4-фторбензил)-N'-(4-изопропоксибензил)-N-{1-[2-(2,5,5-триметил-1,3-диоксан-2-ил)этил]пиперидин-4-ил}карбамида (130AF07-143)
Желаемое соединение синтезируют из 2-бром-1-(2,5, 5-триметил-1,3-диоксан-2-ил)этана (10,7 мг, 0,045 ммоль) и 118AF99-121 (15 мг, 0,037 ммоль), используя такой же способ, как для получения 130AF09-145. Выход 8,3 мг, 15%.
ЖХМС m/z 556 [M+H]+. ВЭЖХ tR=9,6 мин.
Оксалат N-{1-[3-(1,3-диоксолан-2-ил)пропил]пиперидин-4-ил}-N-(4-фторбензил)-N'-(4-изопропоксибензил)карбамида (130AF07-131)
Желаемое соединение синтезируют из 3-хлор-1-(1,3-диоксолан-2-ил)пропана (6,79 мг, 0,045 ммоль) и 118AF99-121 (15 мг, 0,037 ммоль), используя такой же способ, как для получения 130AF09-145. Выход 5,6 мг, 11%.
ЖХМС m/z 514 [M+H]+. ВЭЖХ tR=8,3 мин.
Оксалат N-[1-(2,2-диметил-1, 3-диоксан-5-ил)пиперидин-4-ил]-N-(4-фторбензил)-N'-(4-изопропоксибензил)карбамида (130AF05-129)
Раствор 2,2-диметил-1,3-диоксан-5-она (9,75 мг, 0,075 ммоль) в метаноле (0,10 мл) добавляют к раствору 118AF99-121 (15 мг, 0,037 ммоль) в метаноле (0,10 мл). Реакционную смесь перемешивают при кт после добавления уксусной кислоты (60 мкл 1М раствора в метаноле). После 2 ч перемешивания добавляют раствор цианборогидрида натрия (5 мг, 0,079 ммоль) в метаноле (0,10 мл) и перемешивание продолжают в течение ночи при кт. Растворитель удаляют выпариванием при пониженном давлении и остаток распределяют между 2М водным гидроксидом натрия и дихлорметаном. Слои разделяют фильтрованием через PTFE фильтр. Органический слой выпаривают досуха. Очистка остатка препаративной ВЭЖХ с обращенной фазой (С18) дает желаемое соединение (2,3 мг, 12%).
ЖХМС m/z 514 [M+H]+. ВЭЖХ tR=9,0 мин.
Оксалат N-(4-фторбензил)-N'-(4-изопропоксибензил)-N-{[2-(1-метилпирролидин-2-ил)этил]пиперидин-4-ил}карбамида (130AF07-135)
Желаемое соединение синтезируют из 2-(2-хлорэтил)-1-метилпирролидина гидрохлорида (7,7 мг, 0,041 ммоль) и 118AF99-121 (15 мг, 0,037 ммоль), используя такой же способ, как для получения 130AF09-145. Выход 4,4 мг, 23%.
ЖХМС m/z 511 [M+H]+. ВЭЖХ tR=7,0 мин.
Оксалат N-[1-(2,2-диметил-1,3-диоксан-5-ил)пиперидин-4-ил]-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида (130AF22-105)
К раствору 103NLS56 (179 мг, 0,45 ммоль) в метаноле (10 мл) по каплям добавляют раствор 2,2-диметил-1,3-диоксан-5-она (81 мг, 0,62 ммоль) в метаноле (10 мл). Реакционную смесь перемешивают при кт после добавления уксусной кислоты (200 мкл). Через 2 часа медленно добавляют цианборогидрид натрия (56 мг, 0,90 ммоль) и перемешивание продолжают в течение ночи при кт. Смесь нейтрализуют несколькими каплями 2М водного гидроксида натрия. Растворитель удаляют выпариванием при пониженном давлении и остаток распределяют между водой и дихлорметаном. Органический слой сушат над сульфатом натрия, фильтруют и выпаривают досуха. Очистка остатка колоночной хроматографией на силикагеле с элюированием смесью 6% метанола в дихлорметане дает желаемое соединение (98 мг, 43%).
Rf=0,32 (MeOH/CH2Cl2 6:94). ЖХМС m/z 513 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,4:0,6) δ 7,26-6,79 (м, 8H, Ar-H), 4,63-4,54 (м, 0,6H, пип-Н), 4,50 и 4,43 (2с, 2H, бензил-Н), 3,91 и 3,88 (2д, 1H, J=5,6, диоксан-Н), 3,79-3,67 (м, 6,2Н, диоксан-H, бензил-Н, пип-Н, CH2OiBu), 3,51 (с, 1,2H, бензил-Н), 2,98-2,88 (м, 2H, пип-Н), 2,64-2,52 (м, 1H, диоксан-Н), 2,38-2,28 (м, 1,2H, пип-Н), 2,17-2,00 (м, 1,8H, CH(CH3)2, пип-Н), 1,72-1,47 (м, 3,2H, пип-Н), 1,43 (м, 0,8H, пип-Н), 1, 38-1,22 (м, 6H, диоксан-CH3), 1,01 (м, 6H, CH(CH3)2). ВЭЖХ tR=10,0 мин.
Тартрат N-[1-(1, 3-диоксан-5-ил)пиперидин-4-ил]-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида (130AF26-164)
К раствору 130AF22-105 (98,2 мг, 0,19 ммоль) в 1,4-диоксане (2 мл) добавляют 3М водной HCl (1 мл) и воду (1 мл) и смесь перемешивают в герметичной колбе под микроволновым излучением в течение 10 минут при 120°С. Смесь распределяют между водой и дихлорметаном и органический слой сушат над сульфатом натрия, фильтруют и выпаривают досуха. Остаток растворяют в 1,4-диоксане (2 мл). К данному раствору добавляют раствор формальдегида (37% водный раствор, 101 мг, 1,16 ммоль) в 1, 4-диоксане (0,5 мл). Реакционную смесь перемешивают в герметичной колбе в течение 30 минут под микроволновым излучением при 120°С. К реакционной смеси при комнатной температуре добавляют молекулярные сита (4Å) и удаляют через 24 часа. Смесь нагревают в течение дополнительных 20 минут при 120°С под микроволновым излучением и распределяют между дихлорметаном и бикарбонатом натрия. Органический слой сушат над сульфатом натрия, фильтруют и выпаривают досуха. Очистка остатка колоночной хроматографией на силикагеле с элюированием смесью 6% метанола в дихлорметане дает желаемое соединение (17 мг, 18%). Продукт превращают в его тартратную форму, как описано выше.
Rf=0,30 (MeOH/CH2Cl26:94). ЖХМС m/z 485 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,4:0,6) δ 7,21-6,80 (м, 8H, Ar-H), 4,88 (м, 1H, диоксан-Н), 4,61-4,56 (м, 1,6H, диоксан-Н, пип-Н), 4,50 и 4,43 (2с, 2H, бензил-Н), 4,12-4, 06 (м, 2H, диоксан-Н) 3,85-3,60 (м, 5,2H, диоксан-Н, бензил-Н, пип-Н, CH2OiBu), 3,51 (с, 1,2H, бензил-Н), 2,94-2,86 (м, 2H, пип-Н), 2,59-2,48 (м, 1H, диоксан-Н), 2,37-2,28 (м, 1,2H, пип-Н), 2,17-2,01 (м, 1,8H, CH(CH3)2, пип-Н), 1,68-1,46 (м, 3,2H, пип-Н), 1,46-1,30 (м, 0,8H, пип-Н), 1,02 (м, 6H, CH(CH3)2). ВЭЖХ tR=9,5 мин.
Тартрат N-[1-(2,2-диметил-1,3-диоксан-5-ил)пиперидин-4-ил]-N-(4-фторбензил)-2-(4-фторфенил)ацетамида (130AF35-168)
Желаемое соединение синтезируют из 2, 2-диметил-1,3-диоксан-5-она (59 мг, 0,45 ммоль) и N-(4-фторбензил)-2-(4-фторфенил)-N-пиперидин-4-илацетамида (83 мг, 0,24 ммоль), используя такой же способ, как для получения 130AF22-105. Исходное вещество N-(4-фторбензил)-2-(4-фторфенил)-N-пиперидин-4-илацетамид получают так же, как 103NLS56.
Rf=0,26 (MeOH/CH2Cl25:95). ЖХМС m/z 459 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,4:0,6) δ 7,28-6,91 (м, 8H, Ar-H), 4,63-4,52 (м, 0,6H, пип-Н), 4,51 и 4,46 (2с, 2H, бензил-Н), 3,92-3,88 (м, 2H, диоксан-Н), 3,82-3,69 (м, 3,2Н, диоксан-Н, бензил-Н, пип-Н), 3,54 (с, 1,2H, бензил-Н), 2,99-2,90 (м, 2H, пип-Н), 2,62-2,51 (м, 1H, диоксан-Н), 2,39-2,28 (м, 1,2H, пип-Н), 2,18-2,10 (м, 0,8H, пип-Н), 1,72-1,50 (м, 3,2H, пип-Н), 1,42-1,31 (м, 6,8H, пип-Н, диоксан-CH3). ВЭЖХ tR=7,9 мин.
Тартрат N-{1-[2-(1, 3-диоксан-4-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-фторфенил)ацетамида (130AF41-171)
Исходное вещество N-(4-фторбензил)-2-(4-фторфенил)-N-пиперидин-4-илацетамид получают тем же способом, как 103NLS56.
К раствору N-(4-фторбензил)-2-(4-фторфенил)-N-пиперидин-4-илацетамида (79,4 мг, 0,23 ммоль) в сухом N,N-диметилформамиде (3 мл) добавляют карбонат калия (64 мг, 0,46 ммоль). К данной суспензии по каплям при комнатной температуре добавляют раствор 4-[2-(тозилокси)этил]-1,3-диоксана 128NLS46В (99 мг, 0,35 ммоль) в сухом N,N-диметилформамиде (1 мл). Реакционную смесь перемешивают в течение ночи при 60°С и распределяют между дихлорметаном и водой. Органический слой сушат над сульфатом натрия, фильтруют и выпаривают досуха. Очистка остатка колоночной хроматографией на силикагеле с элюированием ступенчатым градиентом смеси 2-5% метанола в дихлорметане дает желаемый продукт (71 мг, 67%). Продукт превращают в его тартратную форму, как описано выше.
Rf=0,41 (MeOH/CH2Cl26:96). ЖХМС m/z 459 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,4:0,6) δ 7,28-6,90 (м, 8H, Ar-H), 4,99 (м, 1H, диоксан-Н), 4,77-4,64 (м, 1,6H, пип-Н, диоксан-Н), 4,52 (с, 2H, бензил-Н), 3,80-3,56 (м, 4,4H, диоксан-H, бензил-Н, пип-Н), 3,21-3,08 (м, 1,2H, пип-Н), 2,96-2,88 (м, 0,8H, пип-Н), 2,75-2,56 (м, 1,2H, NCH2), 2,52-2,24 (м, 2H, пип-Н, NCH2), 2,04-1,30 (м, 9,8H, пип-Н, NCH2CH2, диоксан-Н). ВЭЖХ tR=6,4 мин.
Тартрат N-{1-[2-(1,3-диоксан-4-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-трифторметоксифенил)ацетамида (130AF80-186)
К раствору N-{1-[2-(1, 3-диоксан-4-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)амина 128NLS52 (96 мг, 0,30 ммоль) в сухом дихлорметане (5 мл) при кт добавляют триэтиламин (125 мкл, 0,89 ммоль). Раствор охлаждают до -10°С и по каплям добавляют раствор (4-трифторметоксифенил)ацетилхлорида (71 мг, 0,30 ммоль) в сухом дихлорметане (1 мл). Реакционную смесь перемешивают в течение ночи при кт. Растворитель удаляют выпариванием при пониженном давлении. Остаток суспендируют в тетрагидрофуране и фильтруют. Фильтрат выпаривают досуха и остаток очищают колоночной хроматографией на силикагеле, элюируя смесью 4% метанола в дихлорметане, получая желаемое соединение (46 мг, 30%). Соединение превращают в его тартратную форму, как описано выше.
Rf=0,33 (MeOH/CH2Cl2 6:94). ЖХМС m/z 459 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,4:0,6) δ 7,34-6,91 (м, 8H, Ar-H), 5,01 (д, 1H, J=6,0, диоксан-Н), 4,66-4,54 (м, 1,6H, пип-Н, диоксан-Н), 4, 52 и 4,49 (2с, 2H, бензил-Н), 4,09-4,05 (м, 1H, диоксан-Н), 3,83 (с, 0,8H, бензил-Н), 3,72-3,56 (м, 3,6Н, диоксан-Н, бензил-Н, пип-Н), 2,94-2,86 (м, 2H, пип-Н), 2,50-2,32 (м, 2H, NCH2), 2, 11-2,00 (м, 1,2H, пип-Н), 1,90-1,52 (м, 8,8H, пип-Н, NCH2CH2, диоксан-Н). ВЭЖХ tR=7,6 мин.
Тартрат N-{1-[2-(1, 3-диоксан-4-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-пропоксифенил)ацетамида (130AF71-184)
К раствору N-{1-[2-(1,3-диоксан-4-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)амина 128NLS52 (126 мг, 0,39 ммоль) в сухом дихлорметане (5 мл) при кт добавляют триэтиламин (163 мкл, 1,17 ммоль). Раствор охлаждают до -15°С и по каплям добавляют раствор (4-пропоксифенил)ацетилхлорида (92 мг, 0,43 ммоль) в сухом дихлорметане (2 мл). Реакционную смесь перемешивают в течение 2 часов при кт. Растворитель удаляют выпариванием при пониженном давлении. Остаток суспендируют в тетрагидрофуране и фильтруют. Фильтрат выпаривают досуха и остаток очищают колоночной хроматографией на силикагеле, элюируя ступенчатым градиентом смеси 0-4% метанола в дихлорметане, получая желаемое соединение (66 мг, 34%). Продукт превращают в его тартратную форму, как описано выше.
Rf=0,16 (MeOH/CH2Cl24:96). ЖХМС m/z 499 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,4:0,6) δ 7,21-6,78 (м, 8H, Ar-H), 5,00 (м, 1H, диоксан-Н), 4,66-4,54 (м, 1,6H, пип-Н, диоксан-Н), 4,50 и 4,44 (2с, 2H, бензил-Н), 4,10-4,03 (м, 1H, диоксан-Н), 3,92-3,87 (м, 2H, OCH2OРr), 3,78-3,50 (м, 4,4H, диоксан-Н, бензил-Н, пип-Н), 2,92-2,82 (м, 2H, пип-Н), 2,50-2,29 (м, 2H, NCH2), 2,09-1,98 (м, 1,2H, пип-Н), 1,88-1,27 (м, 10,8H, пип-Н, NCH2СН2, диоксан-Н, CH2ОPr), 1,05-099 (м, 3H, CH3OРr). ВЭЖХ tR=7,6 мин.
Тартрат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-[1-(тетрагидропиран-4-ил)пиперидин-4-ил]ацетамида (130AF33-166)
К раствору 103NLS56 (57 мг, 0,14 ммоль) в метаноле (2 мл) добавляют раствор тетрагидро-4Н-пиран-4-она (43 мг, 0,42 ммоль) в метаноле (1 мл). После добавления уксусной кислоты (100 мкл) реакционную смесь перемешивают в течение 15 минут в герметичной колбе под микроволновым излучением при 100°С. Затем к смеси добавляют цианборогидрид натрия (26 мг, 0,42 ммоль) и перемешивание продолжают в течение дополнительных 60 мин под микроволновым излучением при 80°С. Смесь пропускают через кислотный ионообменный SPE картридж. Дальнейшая очистка продукта колоночной хроматографией на силикагеле с элюированием ступенчатым градиентом смеси 2-5% метанола в дихлорметане дает желаемое соединение (19,2 мг, 28%). Соединение превращают в его тартратную форму, как описано выше.
Rf=0,18 (MeOH/CH2Cl25:95). ЖХМС m/z 483 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,4:0,6) δ 7,21-6,80 (м, 8H, Ar-H), 4,64-4,56 (м, 0,6H, пип-Н), 4,51 и 4,45 (2с, 2H, бензил-Н), 4,02-3, 96 (м, 2H, ТГП-Н), 3,77-3,68 (м, 3,2H, бензил-Н, CH2OiBu, пип-Н), 3,51 (с, 1,2H, бензил-Н), 3,30 (т, 2H, J=12,0, ТГП-Н), 2,98-2,88 (м, 2H, пип-Н), 2,46-2,34 (м, 1H, ТГП-Н), 2,28-2,19 (м, 1, 2H, пип-Н), 2,10-1,99 (м, 1,8H, CHOiBu, пип-Н), 1,73-1,47 (м, 7,2H, пип-Н, ТГП-Н), 1,39-1,33 (м, 0,8H, пип-Н), 1,01 (м, 6H, CH3OiBu). ВЭЖХ tR=8,0 мин.
Тартрат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-[1-(тетрагидропиран-4-илметил)пиперидин-4-ил]ацетамида (130AF82-187)
Указанное в заголовке соединение синтезируют из N-(4-фторбензил)-2-(4-изобутоксифенил)-N-пиперидин-4-илацетамида 103NLS56 (110 мг, 0,27 ммоль) и тетрагидро-2H-пиран-4-илкарбальдегида (63 мг, 0,55 ммоль), используя такой же способ, как для получения 130AF33-166. Выход 18 мг, 13%.
Rf=0,30 (MeOH/CH2Cl2, 5:95). ЖХМС m/z 497 [M+H]+. ВЭЖХ tR=8,4 мин.
Тартрат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[2-(тетрагидропиран-4-ил)этил]пиперидин-4-ил}ацетамида (130AF83-188)
Указанное в заголовке соединение синтезируют из N-(4-фторбензил)-2-(4-изобутоксифенил)-N-пиперидин-4-илацетамида 103NLS56 (110 мг, 0,27 ммоль) и тетрагидро-2H-пиран-4-илацетальальдегида (70,5 мг, 0,55 ммоль), используя такой же способ, как для получения 130AF33-166. Выход 40 мг, 29%.
Rf=0,30 (MeOH/CH2Cl2, 5:95). ЖХМС m/z 511 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0, 4:0,6) δ 7,21-6,80 (м, 8H, Ar-H), 4,65-4,55 (м, 0,6H, пип-Н), 4,51 и 4,44 (2с, 2H, бензил-Н), 3,95-3,89 (м, 2H, ТГП-Н), 3,78-3,66 (м, 3,2H, бензил-Н, CH2OiBu, пип-Н), 3,51 (с, 1,2H, бензил-Н), 3,34 (т, 2H, J=12,0, ТГП-Н), 2,92-2,82 (м, 2H, пип-Н), 2,34-2,26 (м, 2H, NCH2CH2), 2,11-1,96 (м, 2,2H, пип-Н, CHOiBu), 1,84-1,20 (м, 11,8H, пип-Н, ТГП-Н, СН2CH2N), 1,02 (м, 6H, CH3OiBu). ВЭЖХ tR=8,2 мин.
Тартрат N-(4-фторбензил)-2-(4-фторфенил)-N-[1-(тетрагидропиран-4-ил)пиперидин-4-ил]ацетамида (130AF37-169)
Желаемое соединение синтезируют из тетрагидро-4H-пиран-4-она и N-(4-фторбензил)-2-(4-фторфенил)-N-пиперидин-4-илацетамида, используя такой же способ, как для получения 130AF33-166. Исходное вещество N-(4-фторбензил)-2-(4-фторфенил)-N-пиперидин-4-илацетамид получают так же, как 103NLS56.
Rf=0,29 (MeOH/CH2Cl2, 5:95). ЖХМС m/z 429 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,4:0,6) δ 7,29-6,91 (м, 8H, Ar-H), 4,64-4,55 (м, 0,6H, пип-Н), 4,52 и 4,48 (2с, 2H, бензил-Н), 4,02-3,95 (м, 2H, ТГП-Н), 3,80 (с, 0,8H, бензил-Н), 3,75-3,64 (м, 0,4H, пип-Н), 3,54 (с, 1,2H, бензил-Н), 3,34 (т, 2H, J=12,0, ТГП-Н), 2,99-2,90 (м, 2H, пип-Н), 2,48-2,36 (м, 1H, ТГП-Н), 2,26-2,20 (м, 1,2H, пип-Н), 2,08-2,00 (м, 0,8H, пип-Н), 1,76-1,47 (м, 7,2H, пип-Н, ТГП-Н), 1,41-1,34 (м, 0,8H, пип-Н). ВЭЖХ tR=5,6 мин.
Тартрат N-[1-((S)-3,5-дигидроксипентил)пиперидин-4-ил]-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида (130AF65-182)
Соединение (R)-5-[(4-метилбензолсульфонил)окси]пентан-1,3-диол синтезируют в соответствии с методикой Moune et al. (J. Org. Chem., 1997, 62, 3332-3339). К раствору 103NLS56 (94 мг, 0,24 ммоль) в сухом N,N-диметилформамиде (3 мл) добавляют карбонат калия (83 мг, 0,60 ммоль). К данной суспензии добавляют раствор (R)-5-[(4-метилбензолсульфонил)окси]пентан-1,3-диола (82 мг, 0,28 ммоль) в сухом N, N-диметилформамиде (1 мл), после чего добавляют иодид натрия (43 мг, 0,29 ммоль). Реакционную смесь перемешивают в течение ночи при 60°С. Затем ей дают охладиться до кт, фильтруют и выпаривают досуха. Остаток распределяют между дихлорметаном и 2М водным гидроксидом натрия. Органический слой сушат над сульфатом натрия, фильтруют и выпаривают досуха. Очистка остатка колоночной хроматографией на силикагеле с элюированием ступенчатым градиентом смеси 6-10% метанола в дихлорметане дает желаемое соединение (35 мг, 29%), которое превращают в его тартратную форму, как описано выше.
Rf=0,48 (MeOH/CH2Cl2, 10:90). ЖХМС m/z 501 [M+H]+. ВЭЖХ tR=7,4 мин.
Тартрат N-{1-[2-((4S)-1, 3-диоксан-4-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида (130AF67-183)
К раствору виннокислой соли 130AF65-182 (37 мг, 0,056 ммоль) в 1,4-диоксане добавляют параформальдегид (9 мг, 0,28 ммоль) и хлористоводородную кислоту (4М в 1,4-диоксане, 0,5 мл). Реакционную смесь перемешивают в течение 2 часов в герметичной колбе под микроволновым облучением при 120°С и распределяют между дихлорметаном и бикарбонатом натрия. Органический слой промывают насыщенным раствором соли, сушат над сульфатом натрия, фильтруют и выпаривают досуха. Очистка остатка кислотным ионообменным SPE картриджем дает желаемое соединение (9,0 мг, 31%), которое превращают в его тартратную форму, как описано выше. Определяют, что энантиомерный избыток (ee) составляет 94%, используя анализ хиральной ВЭЖХ (колонка Chiralpak AD, 4,6×250 мм; гептан/изопропанол, 50:50, 0,3% DEA; 0,5 мл/мин; tR 20,5 мин).
Rf=0,41 (MeOH/CH2Cl2, 8:92). ЖХМС m/z 513 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,4:0,6) δ 7,21-6,80 (м, 8H, Ar-H), 5,00 (м, 1H, диоксан-Н), 4,68-4,54 (м, 1,6H, пип-Н, диоксан-Н), 4,51 и 4,45 (2с, 2H, бензил-Н), 4,06 (м, 1H, диоксан-Н), 3,77-3,48 (м, 6,4H, диоксан-Н, бензил-Н, CH20iBu, пип-Н), 2,98-2,79 (м, 2H, пип-Н), 2,50-2,58 (м, 2H,NCH2), 2,14-1,99 (м, 2,2H, CHOiBu, пип-Н), 1,90-1,25 (м, 8,8H, пип-Н, NCH2CH2, диоксан-Н), 1,02 (м, 6H, CH3OiBu). ВЭЖХ tR=8, 7 мин.
N-{1-[2-(1,3-Диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)амин (118AF52-95).
К раствору гидрохлорида моногидрата 4-пиперидона (6,45 г, 42,0 ммоль) в ацетонитриле (200 мл) добавляют карбонат натрия (17,4 г, 125,9 ммоль). После 30 минут перемешивания при кт к реакционной смеси по каплям добавляют раствор 2-(2-бромэтил)-1,3-диоксана (8, 45 г, 43,3 ммоль) в ацетонитриле (50 мл), перемешивание продолжают в течение ночи при кт и кипятят с обратным холодильником в течение дополнительных 2 часов. Растворитель удаляют выпариванием при пониженном давлении и остаток распределяют между водой и дихлорметаном. Органический слой сушат над сульфатом натрия, фильтруют и выпаривают досуха. Очистка остатка колоночной хроматографией на силикагеле с элюированием смесью 7% метанола в дихлорметане дает 1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-он (6,19 г, 69%).
К раствору 4-фторбензиламина (3,9 мл, 34 ммоль) в метаноле (100 мл) в атмосфере аргона при кт добавляют раствор 1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-она (6,19 г, 29 ммоль) в метаноле (80 мл). После 30 минут перемешивания при кт реакционную смесь подкисляют (рН=5) уксусной кислотой и охлаждают до 0°С. К холодной смеси медленно добавляют цианборогидрид натрия (2,15 г, 40 ммоль) и перемешивание продолжают при кт в течение ночи. Реакционную смесь подщелачивают 2М NaOH и концентрируют в вакууме. Остаток распределяют между этилацетатом и водой. Органический слой сушат над сульфатом натрия, фильтруют и выпаривают досуха. Остаток растворяют в абсолютном этаноле (57 мл). К данному раствору добавляют раствор малеиновой кислоты (3,31 г, 28,5 ммоль) в абсолютном этаноле (60 мл), приводя к образованию осадка. Осадок собирают фильтрованием и превращают в свободное основание основной экстракцией. Выход 8,5 г, 91%.
Rf=0,29 (MeOH/CH2Cl2, 7:93). ЖХМС m/z 323 [M+H]+.1H-ЯМР (CDCl3) δ 7,25 (м, 2H, Ar-H), 6,95 (м, 2H, Ar-H), 4,54 (т, 1H, J=5,6, диоксан-Н), 4,07-4,02 (м, 2H, диоксан-Н), 3,73-3,67 (м, 4H, диоксан-Н, бензил-Н), 2,85-2,79 (м, 2H, пип-Н), 2, 49-2,37 (м, 3H, NCH2, пип-Н), 2,05-1,72 (м, 7H, пип-Н, NCH2CH2, диоксан-Н), 1,44-1,25 (м, 4H, диоксан-Н, пип-Н, NH). ВЭЖХ tR=1,4 мин.
Тартрат 2-(4-бензилоксифенил)-N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)ацетамида (118AF66-102)
Раствор триэтиламина (0,89 мл, 6,38 ммоль) и 118AF52-95 (0,80 г, 2,48 ммоль) в сухом ТГФ (10 мл) охлаждают до 0°С. К холодной реакционной смеси по каплям добавляют раствор 4-бензилоксифенилацетилхлорида (0,72 г, 2,76 ммоль) и перемешивание продолжают при кт в течение 2 час. Реакционную смесь фильтруют и фильтрат выпаривают досуха. Очистка остатка колоночной хроматографией на силикагеле с элюированием ступенчатым градиентом 0-6% метанола в дихлорметане дает желаемое соединение (0,53 г, 39%), которое превращают в его тартратную форму, как описано выше.
Rf=0,27 (MeOH/CH2Cl2, 7:93). ЖХМС m/z 547 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,4:0,6) δ 7,46-6,86 (м, 13H, Ar-H), 5,08-5,02 (м, 2H, PhCH2O), 4,64-4,42 (м, 3,6H, пип-Н, бензил-Н, диоксан-Н), 4,11-4,02 (м, 2H, диоксан-Н), 3,79-3,67 (м, 3,2H, диоксан-Н, бензил-Н, пип-Н), 3,50 (с, 1,2H, бензил-Н), 2,94-2,80 (м, 2H, пип-Н), 2,46-2,34 (м, 2H, NCH2), 2,12-1,98 (м, 2,2H, диоксан-Н, пип-Н), 1,87-1,50 (м, 6H, пип-Н, NCH2CH2), 1,36-1,24 (м, 1,8H, пип-Н, диоксан-Н). ВЭЖХ tR=8,9 мин.
Тартрат N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-гидроксифенил)ацетамида (118AF67-103)
Желаемое соединение получают гидрированием 118AF66-102 (0,50 г, 0,92 ммоль) в абсолютном этаноле (200 мл), используя палладий на угле в качестве катализатора. Продукт очищают колоночной хроматографией на силикагеле, элюируя ступенчатым градиентом 3-6% метанола в дихлорметане. Желаемое соединение (0,22 г, 53%) превращают в его тартратную форму, как описано выше.
Rf=0,30 (MeOH/CH2Cl2, 6:94). ЖХМС m/z 457 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,4:0,6) δ 7,13-6,86 (м, 6H, Ar-H), 6,72-6,64 (м, 2H, Ar-H), 4,66-4,57 (м, 0,6H, пип-Н), 4,54 (м, 1H, диоксан-Н), 4,48 и 4,37 (2с, 2H, бензил-Н), 4,08-4,01 (м, 2H, диоксан-Н), 3,80-3,66 (м, 3,2H, диоксан-Н, бензил-Н, пип-Н), 3,47 (м, 1,2H, бензил-Н), 2,94-2,82 (м, 2H, пип-Н), 2,47-2,39 (м, 2H, NCH2), 2,10-1,97 (м, 2,2H, диоксан-Н, пип-Н), 1,88-1,53 (м, 6H, пип-Н, NCH2CH2), 1,34-1,25 (м, 1,8H, пип-Н, диоксан-Н). ВЭЖХ tR=3,0 мин.
Тартрат N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-метоксифенил)ацетамида (118AF60-96)
Раствор триэтиламина (0,57 мл, 4,09 ммоль) и 118AF52-95 (328 мг, 1,02 ммоль) в сухом ТГФ (5 мл) охлаждают до 0°С. К холодной реакционной смеси по каплям добавляют раствор 4-метоксифенилацетилхлорида (376 мг, 2,04 ммоль) и перемешивание продолжают при кт в течение 20 час. Реакционную смесь распределяют между 2М NaOH и водой. Органический слой сушат над сульфатом натрия, фильтруют и выпаривают досуха. Остаток очищают колоночной хроматографией на силикагеле, элюируя ступенчатым градиентом смеси 0-6% метанола в дихлорметане. Окончательная очистка продукта кислотным ионообменным SPE картриджем дает желаемое соединение (153 мг, 33%), которое превращают в его тартратную форму, как описано выше.
Rf=0,40 (MeOH/CH2Cl2, 4:96). ЖХМС m/z 471 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,4:0,6) δ 7,24-6,79 (м, 8H, Ar-H), 4,63-4,54 (м, 0,6H, пип-Н), 4,52 (т, 1H, J=5,2, диоксан-Н), 4,49 и 4,44 (2с, 2H, бензил-Н), 4,09-4,01 (м, 2H, диоксан-Н), 3,79-3,68 (м, 6,2H, диоксан-Н, бензил-Н, пип-Н, OCH3), 3,50 (м, 1,2H, бензил-Н), 2,91-2,80 (м, 2H, пип-Н), 2,43-2,36 (м, 2H, NCH2), 2,10-1,98 (м, 2,2H, диоксан-Н, пип-Н), 1,86-1,51 (м, 6H, пип-Н, HCH2CH2), 1,34-1,26 (м, 1,8H, пип-Н, диоксан-Н). ВЭЖХ tR=7,0 мин.
Тартрат N-{1-[2-(1, 3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изопропилфенил)ацетамида (118AF63-100)
Желаемое соединение синтезируют из 118AF52-95 (400 мг, 1,24 ммоль) и 4-изопропилфенилацетилхлорида (340 мг, 1,73 ммоль), используя такой же способ, как для получения 118AF66-102. Дальнейшую очистку проводят кислотным ионообменным SPE картриджем. Выход 273 мг, 46%.
Rf=0,34 (MeOH/CH2Cl2, 7:93). ЖХМС m/z 483 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,4:0,6) δ 7,22-6,89 (м, 8H, Ar-H), 4, 64-4,43 (м, 3,6H, пип-Н, диоксан-Н, бензил-Н), 4,09-4,02 (м, 2H, диоксан-Н), 3,79 (с, 0,8H, бензил-Н), 3,76-3,66 (м, 2,4H, диоксан-Н, пип-Н), 3,54 (м, 1,2H, бензил-Н), 2,92-2,79 (м, 3H, пип-Н, CH(CH3)2), 2,41-2,35 (м, 2H, NCH2), 2,12-1,98 (м, 2,2H, диоксан-Н, пип-Н), 1,85-1,49 (м, 6H, пип-Н, NCH2СН2), 1,34-1,19 (м, 7,8H, пип-Н, диоксан-Н, CH(CH3)2). ВЭЖХ tR=8,6 мин.
Тартрат N-{1-[2-(1, 3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-трифторметоксифенил)ацетамида (118AF58-98)
Желаемое соединение синтезируют из 118AF52-95 (328 мг, 1,02 ммоль) и 4-трифторметоксифенилацетилхлорида (345 мг, 1,44 ммоль), используя такой же способ, как для получения 118AF66-102. Выход 267 мг, 49%.
Rf=0,31 (MeOH/CH2Cl2, 4:96). ЖХМС m/z 525 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,4:0,6) δ 7,30-6,90 (м, 8H, Ar-H), 4,63-4,48 (м, 3,6H, пип-Н, диоксан-Н, бензил-Н), 4,05 (м, 2H, диоксан-Н), 3,82 (с, 0,8H, бензил-Н), 3,76-3,62 (м, 2,4H, диоксан-Н, пип-Н), 3,55 (м, 1,2H, бензил-Н), 2,92-2,84 (м, 2H, пип-Н), 2,43-2,36 (м, 2H, NCH2), 2,10-1,96 (м, 2,2H, диоксан-Н, пип-Н), 1,88-1,79 (м, 0,8H, пип-Н), 1,76-1,52 (м, 5,2H, пип-Н, NCH2CH2), 1,38-1,26 (м, 1,8H, пип-Н, диоксан-Н). ВЭЖХ tR=8,4 мин.
Оксалат N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-этоксифенил)ацетамида (118AF68-104)
Желаемое соединение синтезируют из 118AF52-95 (400 мг, 1,24 ммоль) и 4-этоксифенилацетилхлорида (300 мг, 1,51 ммоль), используя такой же способ, как для получения 118AF66-102. Дальнейшую очистку проводят кислотным ионообменным SPE картриджем. Выход 0,15 г, 25%.
Rf=0,26 (MeOH/CH2Cl2, 6:94). ЖХМС m/z 485 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,4:0,6) δ 7,20-6,79 (м, 8H, Ar-H), 4,64-4, 54 (м, 0,6H, пип-Н), 4,52 (т, 1H, J=5,2, диоксан-Н), 4,49 и 4,43 (2с, 2H, бензил-Н), 4,07-3,97 (м, 4H, диоксан-Н, OCH2), 3,76-3,66 (м, 3,2H, диоксан-Н, пип-Н, бензил-Н), 3,49 (с, 1,2H, бензил-Н), 2,91-2,80 (м, 2H, пип-Н), 2,42-2,32 (м, 2H, NCH2), 2,10-1,97 (м, 2,2H, диоксан-Н, пип-Н), 1,86-1,48 (м, 6H, пип-Н, NCH2СН2), 1,42-1,36 (м, 3H, CH3 ), 1,34-1,24 (м, 1,8H, пип-Н, диоксан-Н). ВЭЖХ tR=7,6 мин.
Оксалат N-{1-[2-(1, 3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изопропоксифенил)ацетамида (118AF73-107)
Желаемое соединение синтезируют из 118AF52-95 (400 мг, 1,24 ммоль) и 4-изопропоксифенилацетилхлорида (340 мг, 1,60 ммоль), используя такой же способ, как для получения 118AF66-102. Дальнейшую очистку проводят кислотным ионообменным SPE картриджем. Выход 91 мг, 15%.
Rf=0,58 (MeOH/CH2Cl2, 8:92). ЖХМС m/z 499 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,4:0,6) δ 7,19-6,78 (м, 8H, Ar-H), 4, 64-4,42 (м, 4,6H, пип-Н, диоксан-Н, бензил-Н, CHOiPr), 4,07 (м, 2H, диоксан-Н), 3,76-3,68 (м, 3,2H, диоксан-Н, пип-Н, бензил-Н), 3,49 (с, 1,2H, бензил-Н), 2,91-2,80 (м, 2H, пип-Н), 2,42-2, 35 (м, 2H, NCH2), 2,10-1,99 (м, 2,2H, диоксан-Н, пип-Н), 1,85-1,51 (м, 6H, пип-Н, NCH2C2), 1,31 (м, 7,8H, OCH(CH3)2, пип-Н, диоксан-Н). ВЭЖХ tR=8,1 мин.
Оксалат N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-фенилацетамида (118AF77-109)
Желаемое соединение синтезируют из 118AF52-95 (300 мг, 0,93 ммоль) и фенилацетилхлорида (197 мг, 1,27 ммоль), используя такой же способ, как для получения 118AF66-102. Дальнейшую очистку проводят кислотным ионообменным SPE картриджем. Выход 68 мг, 17%.
Rf=0,28 (MeOH/CH2Cl2, 5:95). ЖХМС m/z 441 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,4:0,6) δ 7,33-6,89 (м, 9H, Ar-H), 4,65-4,44 (м, 3,6H, пип-Н, диоксан-Н, бензил-Н), 4,09-4,03 (м, 2H, диоксан-Н), 3,84 (с, 0,8H, бензил-Н), 3,76-3,67 (м, 2,4H, диоксан-Н, пип-Н), 3,57 (с, 1,2H, бензил-Н), 2,92-2,79 (м, 2H, пип-Н), 2,44-2,34 (м, 2H, NCH2), 2,10-1,98 (м, 2,2H, диоксан-Н, пип-Н), 1,86-1,51 (м, 6H, пип-Н, NCH2CH2), 1,34-1,23 (м, 1,8H, пип-Н, диоксан-Н). ВЭЖХ tR=6,1 мин.
Оксалат N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-[4-(2-фторэтокси)фенил]ацетамида (118AF85-113)
Желаемое соединение синтезируют из 118AF52-95 (360 мг, 1,11 ммоль) и 4-(2-фторэтокси)фенилацетилхлорида (282 мг, 1,30 ммоль), используя такой же способ, как для получения 118AF66-102. Дальнейшую очистку проводят кислотным ионообменным SPE картриджем. Выход 84 мг, 15%.
Rf=0,36 (MeOH/CH2Cl2, 5:95). ЖХМС m/z 503 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,4:0,6) δ 7,27-6,84 (м, 8H, Ar-H), 4,80 (м, 1H, OCH2CH2F), 4,68 (м, 1H, OCH2CH2F), 4,65-4,45 (м, 3,6H, пип-Н, диоксан-Н, бензил-Н), 4,22 (м, 1H, OCH2CH2F), 4,16 (м, 1H, OCH2CH2F), 4,10-4,03 (м, 2H, диоксан-Н), 3,79-3,68 (м, 3,2H, диоксан-Н, пип-Н, бензил-Н), 3,51 (с, 1,2H, бензил-Н), 2,92-2,82 (м, 2H, пип-Н), 2,44-2,36 (м, 2H, NCH2), 2,12-1,99 (м, 2,2H, диоксан-Н, пип-Н), 1,88-1,51 (м, 6H, пип-Н, NCH2CH2), 1,35-1,26 (м, 1, 8H, пип-Н, диоксан-Н). ВЭЖХ tR=7,0 мин.
Оксалат N-{1-[2-(5,5-диметил-1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида (118AF27-83)
Желаемое соединение синтезируют из N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида 103NLS63F (22 мг, 0,042 ммоль) и 2, 2-диметил-1,3-пропандиола (33 мг, 0,38 ммоль), используя такой же способ, как для получения 130AF12-148. Очистка продукта ВЭЖХ с обращенной фазой (С18) дает указанное в заголовке соединение (2,8 мг, 12%). ЖХМС m/z 541 [M+H]+. ВЭЖХ tR=9,9 мин.
Оксалат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[2-((R)-4-метил-1, 3-диоксан-2-ил)этил]пиперидин-4-ил}ацетамида (118AF29-84)
Желаемое соединение синтезируют из N-{1-[2-(1, 3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида 103NLS63F (38 мг, 0,074 ммоль) и (R)-(-)-1,3-бутандиола (33 мг, 0,38 ммоль), используя такой же способ, как для получения 130AF12-148. Очистка продукта ВЭЖХ с обращенной фазой (С18) дает указанное в заголовке соединение (11,6 мг, 28%). ЖХМС m/z 527 [M+H]+. ВЭЖХ tR=8,7 мин.
Оксалат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[2-((S)-4-метил-1,3-диоксолан-2-ил)этил]пиперидин-4-ил}ацетамида (118AF31-85)
Желаемое соединение синтезируют из N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида 103NLS63F (40 мг, 0,078 ммоль) и (S)-(+)-пропиленгликоля (30 мг, 0,39 ммоль), используя такой же способ, как для получения 130AF12-148. Очистка продукта ВЭЖХ с обращенной фазой (С18) дает указанное в заголовке соединение (21 мг, 53%). ЖХМС m/z 513 [M+H]+. ВЭЖХ tR=9,9 мин.
Оксалат N-{1-[2-(4,6-диметил-1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида (118AF37-88)
Желаемое соединение синтезируют из N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида 103NLS63F (40 мг, 0,078 ммоль) и 2,4-пентандиола (41 мг, 0,39 ммоль), используя такой же способ, как для получения 130AF12-148. Очистка продукта ВЭЖХ с обращенной фазой (С18) дает указанное в заголовке соединение (9 мг, 21%). ЖХМС m/z 541 [M+H]+. ВЭЖХ tR=10,5 мин.
Оксалат N-(4-фторбензил)-N-{1-[2-((S)-4-метил-1,3-диоксолан-2-ил)этил]пиперидин-4-ил}-2-(4-трифторметоксифенил)ацетамида (118AF87-114)
Желаемое соединение синтезируют из N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-трифторметоксифенил)ацетамида 118AF58-98 (70 мг, 0,13 ммоль) и (S)-(+)-пропиленгликоля (53 мг, 0,69 ммоль), используя такой же способ, как для получения 130AF12-148. Очистка продукта колоночной хроматографией на силикагеле с элюированием ступенчатым градиентом смеси 0-4% метанола в дихлорметане дает указанное в заголовке соединение (31 мг, 46%). Rf=0,17 (MeOH/CH2Cl2, 4:96). ЖХМС m/z 525 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,4:0,6) δ 7,34-6,91 (м, 8H, Ar-H), 5,03 и 4,92 (2т, 1H, J=4,8, диоксалан-Н), 4,66-4,56 (м, 0,6H, пип-Н), 4,52 и 4,49 (2с, 2H, бензил-Н), 4,22-4,07 (м, 1,4H, диоксалан-Н), 3,95-3,89 (м, 0,6H, диоксалан-Н), 3,84 (с, 0,8H, бензил-Н), 3,74-3,64 (м, 0,4H, пип-Н), 3,57 (с, 1,2H, бензил-Н), 3,40-3,33 (м, 1H, диоксалан-Н), 2,78-2,86 (м, 2H, пип-Н), 2,49-2,38 (м, 2H, NCH2), 2,10-2,01 (м, 1,2H, пип-Н), 1,70-1,53 (м, 6H, пип-Н, NCH2CH2), 1,40-1,22 (м, 3,8H, пип-Н, CH3). ВЭЖХ tR=8,7 мин.
Оксалат N-(4-фторбензил)-2-(4-изопропилфенил)-N-{1-[2-((S)-4-метил-1,3-диоксолан-2-ил)этил]пиперидин-4-ил}ацетамида (118AF91-117)
Желаемое соединение синтезируют из N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изопропилфенил)ацетамида 118AF63-100 (150 мг, 0,31 ммоль) и (S)-(+)-пропиленгликоля (95 мг, 1,24 ммоль), используя такой же способ, как для получения 130AF12-148. Очистка продукта колоночной хроматографией на силикагеле с элюированием ступенчатым градиентом смеси 0-4% метанола в дихлорметане дает указанное в заголовке соединение (51,2 мг, 34%).
Rf=0,19 (MeOH/CH2Cl2, 4:96). ЖХМС m/z 483 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,4:0,6) δ 7,24-6,90 (м, 8H, Ar-H), 5,03 и 4,92 (2т, 1H, J=4,8, диоксалан-Н), 4,67-4,55 (м, 0,6H, пип-Н), 4,51 и 4,47 (2с, 2H, бензил-Н), 4,21-4,07 (м, 1,4H, диоксалан-Н), 3,94-3,89 (м, 0,6H, диоксалан-Н), 4,81-3,50 (м, 1, 2H, бензил-Н, пип-Н), 3,55 (с, 1,2H, бензил-Н), 3,40-3,33 (м, 1H, диоксалан-Н), 2,94-2,83 (м, 3H, пип-Н, CH(CH3)2), 2,47-2,38 (м, 2H, NCH2), 2,09-2,01 (м, 1,2, пип-Н), 1,86-1,52 (м, 6H, пип-Н, NCH2CH2), 1,31-1,19 (м, 9,8H, пип-Н, CH3, CH(CH3)2). ВЭЖХ tR=8,6 мин.
Оксалат N-(4-фторбензил)-N-{1-[2-((R)-4-метил-1,3-диоксан-2-ил)этил]пиперидин-4-ил}-2-(4-трифторметоксифенил)ацетамида (118AF75-108)
Желаемое соединение синтезируют из N-{1-[2-(1, 3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-трифторметоксифенил)ацетамида 118AF58-98 (70 мг, 0,13 ммоль) и (R)-(-)-1,3-бутандиола (60 мг, 0,66 ммоль), используя такой же способ, как для получения 130AF12-148. Очистка продукта колоночной хроматографией на силикагеле с элюированием ступенчатым градиентом смеси 0-4% метанола в дихлорметане дает указанное в заголовке соединение (28 мг, 40%).
Rf=0,24 (MeOH/CH2Cl2, 5:95). ЖХМС m/z 539 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,4:0,6) δ 7,33-6,91 (м, 8H, Ar-H), 4,64-4,48 (м, 3,6H, бензил-Н, диоксан-Н, пип-Н), 4,04 (м, 1H, диоксан-Н), 3,83 (с, 0,8H, бензил-Н), 3,75-3,63 (м, 2,4H, диоксан-Н, пип-Н), 3,56 (с, 1,2H, бензил-Н), 2,92-2,83 (м, 2H, пип-Н), 2, 44-2,38 (м, 2H, NCH2), 2,09-2,01 (м, 1,2 пип-Н), 1,89-1,53 (м, 7H, диоксан-Н, пип-Н, NCH2CH2), 1,44-1,31 (м, 1,8H, диоксан-Н, пип-Н), 1,19 (м, 3H, CH3). ВЭЖХ tR=9,0 мин.
Оксалат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[2-(2,5,5-триметил-1,3-диоксан-2-ил)этил]пиперидин-4-ил}ацетамида (118AF33-86)
Желаемое соединение синтезируют из N-(4-фторбензил)-2-(4-изобутоксифенил)-N-пиперидин-4-илацетамида 103NLS56 (145 мг, 0,36 ммоль) и 2-(2-бромэтил)-2,5,5-триметил-1,3-диоксана (104,5 мг, 0,44 ммоль), используя такой же способ, как для синтеза 130AF65-182. Очистка продукта колоночной хроматографией на силикагеле с элюированием смесью 5% метанола в дихлорметане дает указанное в заголовке соединение (119 мг, 58%).
Rf=0,15 (MeOH/CH2Cl2, 5:95). ЖХМС m/z 555 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,4:0,6) δ 7,20-6,79 (м, 8H, Ar-H), 4,66-4,56 (м, 0,6H, пип-Н), 4,49 и 4,43 (2с, 2H, бензил-Н), 3,76-3,68 (м, 3,2H, пип-Н, бензил-Н, CH2OiBu), 3,52-3,47 (м, 4H, диоксан-Н), 3,41 (м, 1,2H, бензил-Н), 2,93-2,84 (м, 2H, пип-Н), 2,48-2,40 (м, 2H, NCH2), 2,11-2,00 (м, 2,2H, CHOiBu, пип-Н), 1,87-1,80 (м, 2,8H, пип-Н, NCH2CH2), 1,72-1,50 (м, 3,2H, пип-Н), 1,33 (с, 3,8H, CH3, пип-Н), 1,02-0,87 (м, 12H, CH3). ВЭЖХ tR=9,8 мин.
Оксалат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[2-(2-метил-1,3-диоксолан-2-ил)этил]пиперидин-4-ил}ацетамида (118AF35-87)
Желаемое соединение синтезируют из N-(4-фторбензил)-2-(4-изобутоксифенил)-N-пиперидин-4-илацетамида 103NLS56 (311 мг, 0,78 ммоль) и 2-(2-бромэтил)-2-метил-1,3-диоксолана (188 мг, 0,96 ммоль), используя такой же способ, как для синтеза 130AF65-182. Очистка колоночной хроматографией на силикагеле с элюированием смесью 5% метанола в дихлорметане дает указанное в заголовке соединение (61 мг, 15%).
Rf=0,20 (MeOH/CH2Cl2, 5:95). ЖХМС m/z 513 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,4:0,6) δ 7,17-6,76 (м, 8H, Ar-H), 4,64-4,52 (м, 0,6H, пип-Н), 4,47 и 4, 41 (2с, 2H, бензил-Н), 3,93-3,82 (м, 4H, диоксалан-Н), 3,76-3,63 (м, 3,2H, бензил-Н, CH2OiBu, пип-Н), 3,47 (с, 1,2H, бензил-Н), 2,94-4,83 (м, 2H, пип-Н), 2,43-2,32 (м, 2H, NCH2), 2,12-1,97 (м, 2,2H, CHOiBu, пип-Н), 1,84-1,72 (м, 2,8H, пип-Н, NCH2CH2), 1,70-1,50 (м, 3,2H, пип-Н), 1,27 (с, 3,8H, CH3, пип-Н), 0,98 (м, 6H, CH3OiBu). ВЭЖХ tR=8,8 мин.
Тартрат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[3-(1,3-диоксолан-2-ил)пропил]пиперидин-4-ил}ацетамида (118AF79-39)
Желаемое соединение синтезируют из N-(4-фторбензил)-2-(4-изобутоксифенил)-N-пиперидин-4-илацетамида 103NLS56 (156 мг, 0,39 ммоль) и 2-(3-хлорпропил)-1,3-диоксолана (62 мкл, 0,47 ммоль), используя такой же способ, как для синтеза 130AF65-182. Очистка колоночной хроматографией на силикагеле с элюированием ступенчатым градиентом смеси 0-4% метанола в дихлорметане дает указанное в заголовке соединение (49 мг, 25%).
Rf=0,45 (MeOH/CH2Cl2, 7:93). ЖХМС m/z 513 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,4:0, 6) δ 7,21-6,79 (м, 8H, Ar-H), 4,84 (т, 1H, J=4,4, диоксалан-Н), 4,66-4,56 (м, 0,6H, пип-Н), 4,50 и 4,44 (2с, 2H, бензил-Н), 3,95-3,90 (м, 2H, диоксалан-Н), 3,84-3,67 (м, 5,2H, бензил-Н, CH2OiBu, пип-Н, диоксалан-Н), 3,50 (с, 1,2H, бензил-Н), 2,94-2,84 (м, 2H, пип-Н), 2,34-2,27 (м, 2H, NCH2), 2,10-1,98 (м, 2,2H, CHOiBu, пип-Н), 1,84-1,78 (м, 0,8H, пип-Н), 1, 71-1,50 (м, 7,2H, пип-Н, NCH2CH2), 1,34-1,25 (м, 0,8H, пип-Н), 1,01 (м, 6H, CH3OiBu). ВЭЖХ tR=8,0 мин.
Дигидрохлорид N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-(3-пиперидин-1-илпропил)пиперидин-4-ил}ацетамида (98AF36-43)
Желаемое соединение синтезируют из N-(4-фторбензил)-2-(4-изобутоксифенил)-N-пиперидин-4-илацетамида 103NLS56 (189 мг, 0,47 ммоль), 1-пиперидина (61 мкл, 0,61 ммоль) и 1-хлор-3-иодпропана (61 мкл, 0,57 ммоль), используя такой же способ, как для синтеза 130AF09-145. Очистка продукта колоночной хроматографией на силикагеле с элюированием смесью 10% метанола в дихлорметане дает указанное в заголовке соединение (75,6 мг, 31%).
Rf=0,13 (MeOH/CH2Cl2, 1:4). ЖХМС m/z 524 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,4:0,6) δ 7,21-6,81 (м, 8H, Ar-H), 4,66-4, 54 (м, 0,6H, пип-Н), 4,51 и 4,45 (2с 2H, бензил-Н), 3,78-3,68 (м, 3,2H, бензил-Н, CH2OiBu, пип-Н), 3,52 (с, 1,2H, бензил-Н), 2,93-2,83 (м, 2H, пип-Н), 2,40-2,23 (м, 8H, NCH2), 2, 15-1,26 (м, 15H, пип-Н, CH(CH3)2, CH2), 1,02 (м, 6H, CH(CH3)2). ВЭЖХ tR=8,0 мин.
Оксалат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[2-(тетрагидропиран-2-илокси)этил]пиперидин-4-ил}ацетамида (98AF41-44)
Желаемое соединение синтезируют из N-(4-фторбензил)-2-(4-изобутоксифенил)-N-пиперидин-4-илацетамида 103NLS56 (185 мг, 0,46 ммоль) и 2-(2-хлорэтокси)тетрагидро-2H-пирана (75 мкл, 0,51 ммоль), используя такой же способ, как для синтеза 130AF09-145. Очистка продукта колоночной хроматографией на силикагеле с элюированием смесью 4,5% метанола в дихлорметане дает указанное в заголовке соединение (96 мг, 40%).
Rf=0,18 (MeOH/CH2Cl2, 4:96). ЖХМС m/z 527 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,4:0,6) δ 7,21-6,78 (м, 8H, Ar-H), 4,67-4,56 (м, 0,6H, пип-Н), 4,54 (м, 1H, THP), 4,49 и 4,44 (2с, 2H, бензил-Н), 3,86-3,66 (м, 5,2H, бензил-Н, CH2OiBu, пип-Н, CHO), 3,58-3,43 (м, 3,2H, бензил-Н, CHO), 3,01-2,89 (м, 2H, пип-Н), 2,62 и 2,55 (2т, 2H, J=6,0, NCH2CH2O), 2,26-2,17 (м, 1,2H, пип-Н), 2,12-1,96 (м, 1,8H, CHOiBu, пип-Н), 1,82-1,44 (м, 9,2H, пип-Н, THP), 1,33-1,26 (м, 0,8H, пип-Н), 1,01 (м, 6H, CH(CH3)2). ВЭЖХ tR=7,2 мин.
N-(4-Фторбензил)-2-(4-изобутоксифенил)-N-{1-[3-(2-оксопиперидин-1-ил)пропил]пиперидин-4-ил}ацетамид (98AF73-64)
К раствору 2-пиперидона (54 мг, 0,54 ммоль) в сухом ТГФ (2 мл) в атмосфере аргона добавляют гидрид натрия (60% суспензия в масле, 26 мг, 0,65 ммоль). После 15 минут перемешивания при кт реакционную смесь охлаждают до 0°С в течение 15 минут. К холодной смеси по каплям добавляют 1-бром-3-хлорпропан (160 мкл, 1,62 ммоль) и перемешивание продолжают в течение ночи при кт. Смесь распределяют между водой и этилацетатом, органический слой сушат над сульфатом натрия, фильтруют и выпаривают досуха. Очистка остатка колоночной хроматографией на силикагеле с элюированием ступенчатым градиентом смеси 60-80% этилацетата в н-гептане дает 1-(3-хлорпропил)пиперидин-2-он (33 мг, 35%).
Rf=0,22 (этилацетат/н-гептан, 8:2). ЖХМС m/z 176 [M+H]+. ВЭЖХ tR=1,8 мин.
Раствор 1-(3-хлорпропил)пиперидин-2-она (32 мг, 0,18 ммоль) в сухом ДМФА (2 мл) добавляют к суспензии карбоната калия (52 мг, 0,38 ммоль) и N-(4-фторбензил)-2-(4-изобутоксифенил)-N-пиперидин-4-илацетамида 103NLS56 (62 мг, 0,15 ммоль) в сухом ДМФА (2 мл). После добавления иодида натрия (25 мг, 0,17 ммоль) смесь перемешивают в течение ночи при 48°С. Затем ее распределяют между водой и дихлорметаном. Органический слой сушат над сульфатом натрия, фильтруют и выпаривают досуха. Очистка остатка ВЭЖХ с обращенной фазой (C18) дает желаемое соединение (2,6 мг, 3%).
Rf=0,11 (MeOH/CH2Cl2, 5:95). ЖХМС m/z 538 [M+H]+. ВЭЖХ tR=8,2 мин.
Гидрохлорид N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[3-(2-оксопирролидин-1-ил)пропил]пиперидин-4-ил}ацетамида (98AF76-65)
Желаемое соединение синтезируют из N-(4-фторбензил)-2-(4-изобутоксифенил)-N-пиперидин-4-илацетамида 103NLS56 (107 мг, 0,27 ммоль), 2-пирролидона и 1-бром-3-хлорпропана, используя такой же способ, как для синтеза 98AF73-64. Очистка продукта колоночной хроматографией на силикагеле с элюированием ступенчатым градиентом смеси 4-8% метанола в дихлорметане дает указанное в заголовке соединение (15 мг, 11%).
Rf=0,39 (MeOH/CH2Cl2, 1:9). ЖХМС m/z 524 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,4:0,6) δ 7,20-6,80 (м, 8H), 4,65-4,53 (м, 0,6H), 4,50 и 4,44 (2с, 2H), 3,76-3,67 (м, 3,2H), 3,51 (м, 1,2H), 3,34 (т, 2H, J=7,2), 3,26 (т, 2H, J=7,2), 2,95-2,82 (м, 2H), 2,38-2,25 (м, 4H), 2,12-1,96 (м, 4,2H), 1,86-1,56 (м, 6H), 1,29 (м, 0,8H), 1,01 (м, 6H). ВЭЖХ tR=7,6 мин.
Оксалат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[3-((R)-4-изопропил-2-оксооксазолидин-3-ил)пропил]пиперидин-4-ил}ацетамида (98AF100-73)
К раствору (R)-4-изопропил-2-оксазолидинона (356 мг, 2,75 ммоль) в сухом тетрагидрофуране (17 мл) в атмосфере аргона добавляют гидрид натрия (55% суспензия в масле, 144 мг, 3,31 ммоль). Суспензию перемешивают в течение 1 часа при кт, затем охлаждают до 0°С и по каплям добавляют раствор 1-бром-3-хлорпропана в сухом тетрагидрофуране (3 мл). После 48 часов перемешивания при 58°С смесь гасят водой. Растворитель удаляют выпариванием при пониженном давлении и остаток распределяют между водой и дихлорметаном. Органический слой выпаривают досуха. Очистка остатка колоночной хроматографией на силикагеле с элюированием смесью этилацетата и н-гептана (70:30) дает (4R)-3-(3-хлорпропил)-4-изопропилоксазолидинон-2-он (401 мг, 71%).
К суспензии карбоната калия (217 мг, 1,57 ммоль) и N-(4-фторбензил)-2-(4-изобутоксифенил)-N-пиперидин-4-илацетамида 103NLS56 (250 мг, 0,63 ммоль) в сухом ДМФА (6 мл) добавляют раствор (4R)-3-(3-хлорпропил)-4-изопропилоксазолидинон-2-она (160 мг, 0,78 ммоль) в сухом ДМФА (2 мл). После добавления иодида натрия (113 мг, 0,75 ммоль) смесь перемешивают в течение ночи при 62°С и распределяют между водой и дихлорметаном. Органический слой сушат над сульфатом натрия, фильтруют и выпаривают досуха. Очистка остатка колоночной хроматографией на силикагеле с элюированием смесью 5% метанола в дихлорметане дает желаемое соединение (143 мг, 40%).
Rf=0,28 (MeOH/CH2Cl2, 6:96). ЖХМС m/z 568 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,4:0,6) δ 7,20-6,78 (м, 8H, Ar-H), 4, 61-4,51 (м, 0,6H, пип-Н), 4,48 и 4,42 (2с, 2H, бензил-Н), 4,15 (т, 1H, J=8,8, окса-Н), 4,01 (м, 1H, окса-Н), 3,78-3,64 (м, 4,2H, пип-Н, бензил-Н, окса-Н, CH2OiBu), 3,48 (м, 2,2H, бензил-Н, CONCHCH2), 2,92-2,79 (м, 3H, пип-Н, CONCHCH2), 2,34-2,22 (м, 2H, NCH2CH2CH2), 2,10-1,96 (м, 3,2H, пип-Н, CHiPr, CHOiBu), 1, 76-1,50 (м, 6H, пип-Н, NCH2CH2), 1,32-1,26 (м, 0,8H, пип-Н), 0,99 (м, 6H, CH3OiBu), 0,81-0,87 (м, 6H, CH3iPr). ВЭЖХ tR=9,1 мин.
Оксалат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[3-(2-оксооксазолидин-3-ил)пропил]пиперидин-4-ил}ацетамида (98AF94-71)
Желаемое соединение синтезируют из N-(4-фторбензил)-2-(4-изобутоксифенил)-N-пиперидин-4-илацетамида 103NLS56 (298 мг, 0,75 ммоль), 2-оксазолидона и 1-бром-3-хлорпропана, используя такой же способ, как для синтеза 98AF100-73. Очистка продукта колоночной хроматографией на силикагеле с элюированием смесью 5% метанола в дихлорметане дает указанное в заголовке соединение (157 мг, 40%).
Rf=0,23 (MeOH/CH2Cl2, 5:95). ЖХМС m/z 526 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,4:0,6) δ 7,20-6,78 (м, 8H, Ar-H), 4,61-4,50 (м, 0,6H, пип-Н), 4,48 и 4,42 (2с, 2H, бензил-H), 4,29-4-24 (м, 2H, окса-OCH2), 3,78-3,65 (м, 3,2H, пип-Н, бензил-Н, CH2OiBu), 3,52-3,48 (м, 3,2H, бензил-Н, окса-NCH2), 3,25 (т, 2H, J=7,2, CONCH2 CH2CH2N), 2,89-2,80 (м, 2H, пип-Н), 2,33-2,26 (м, 2H, NCH2CH2CH2NCO), 2,09-1,76 (м, 3H, пип-Н, CHOiBu), 1,71-1,49 (м, 5,2H, пип-Н, NCH2CH2CH2), 1,33-1,27 (м, 0,8H, пип-Н), 1,00 (м, 6H, CH3OiBu). ВЭЖХ tR=7,8 мин.
(S)-4-Метилоксазолидин-2-он (118AF10-77)
К раствору L-аланинола (500 мг, 6,65 ммоль) и 1,1-карбонилдиимидазола (1,29 г, 7,98 ммоль) в сухом ТГФ (10 мл) при кт в атмосфере аргона по каплям добавляют триэтиламин (0,94 мл, 6,65 ммоль). Реакционную смесь перемешивают в течение ночи при 60°С. Растворитель удаляют выпариванием при пониженном давлении. Очистка остатка колоночной хроматографией на силикагеле с элюированием смесью 6% метанола в дихлорметане дает желаемое соединение (450 мг, 67%).
Rf=0,39 (MeOH/CH2Cl2, 6:94).1H-ЯМР (CDCl3) δ 6,74 (м, 1H), 4,45-4,34 (м, 1H), 4,98-4,77 (м, 2H), 1,17 (м, 3H).
Тартрат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[3-((S)-4-метил-2-оксооксазолидин-3-ил)пропил]пиперидин-4-ил}ацетамида (118AF18-81)
Желаемое соединение синтезируют из N-(4-фторбензил)-2-(4-изобутоксифенил)-N-пиперидин-4-илацетамида 103NLS56 (205 мг, 0,52 ммоль), (S)-4-метилоксазолидин-2-она (118AF10-77) и 1-бром-3-хлорпропана, используя такой же способ, как для синтеза 98AF100-73. Далее осуществляют очистку кислотным ионообменным SPE картриджем. Выход 106 мг, 38%.
Rf=0,22 (MeOH/CH2Cl2, 6:94). ЖХМС m/z 540 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,4:0,6) δ 7,20-6,78 (м, 8H, Ar-H), 4,61-4,50 (м, 0,6H, пип-Н), 4,48 и 4,42 (2с, 2H, бензил-Н), 4,34 (м, 1H, окса-Н), 3,84-3,66 (м, 5,2H, пип-Н, бензил-Н, окса-Н, CH2OiBu), 3,49 (с, 1,2H, бензил-Н), 3,42-3,34 (м, 1H, CONCH2), 3,09-3,00 (м, 1H, CONCH2), 2,92-2,79 (м, 2H, пип-Н), 2,33-2,26 (м, 2H, NCH2), 2,10-1,98 (м, 2,2H, пип-Н, CHOiBu,), 1,86-1,76 (м, 0,8H, пип-Н), 1,72-1,48 (м, 5,2H, пип-Н, NCH2CH2), 1,29 (м, 0,8H, пип-Н), 1,22 (м, 3H, окса-CH3), 0,99 (м, 6H, CH3OiBu). ВЭЖХ tR=8,4 мин.
(S)-4-Этилоксазолидин-2-он (118AF08-76)
К раствору (S)-(+)-2-амино-1-бутанола (515 мг, 5,77 ммоль) и 1,1-карбонилдиимидазола (1,10 г, 6,78 ммоль) в сухом ТГФ (10 мл) при кт в атмосфере аргона по каплям добавляют триэтиламин (0,80 мл, 5,74 ммоль). Реакционную смесь перемешивают в течение ночи при кт. Растворитель удаляют выпариванием при пониженном давлении. Очистка остатка колоночной хроматографией на силикагеле с элюированием смесью 6% метанола в дихлорметане дает желаемое соединение (485 мг, 73%).
Rf=0,42 (MeOH/CH2Cl2, 6:94).
Оксалат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[3-((S)-4-этил-2-оксооксазолидин-3-ил)пропил]пиперидин-4-ил}ацетамида (118AF16-80)
Желаемое соединение синтезируют из N-(4-фторбензил)-2-(4-изобутоксифенил)-N-пиперидин-4-илацетамида 103NLS56 (202 мг, 0,51 ммоль), (S)-4-этилоксазолидин-2-она (118AF08-76) и 1-бром-3-хлорпропана, используя такой же способ, как для синтеза 98AF100-73. Очистка продукта кислотным ионообменным SPE картриджем дает указанное в заголовке соединение (126 мг, 44%).
Rf=0,28 (MeOH/CH2Cl2, 6:94). ЖХМС m/z 554 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,4:0,6) δ 7,20-6,78 (м, 8H, Ar-H), 4,61-4,52 (м, 0,6H, пип-Н), 4,48 и 4,42 (2с, 2H, бензил-Н), 4,32-4,26 (м, 1H, окса-Н), 3,94-3,88 (м, 1H, окса-Н), 3,76-3,66 (м, 4,2H, пип-Н, бензил-Н, окса-Н, CH2OiBu), 3,49 (с, 1,2H, бензил-Н), 3,46-3,37 (м, 1H, CONCH2), 3,04-2,96 (м, 1H, CONCH2), 2,90-2,78 (м, 2H, пип-Н), 2,33-2,24 (м, 2H, NCH2), 2,11-1,96 (м, 2,2H, пип-Н, CHOiBu), 1,82-1,75 (м, 0,8H, пип-Н), 1,74-1,42 (м, 7,2H, пип-Н, NCH2CH2, CH2CH3), 1,29 (м, 0,8H, пип-Н), 1,00 (м, 6H, CH3OiBu), 0,85 (м, 3H, CH2CH3). ВЭЖХ tR=8,7 мин.
2-(2-Бромэтил)-1,3-оксотиолан (121JP11)
Адаптируя методику Yamada et al. (Tetrahedron Lett., 1998, 39, 7709-7712), к смеси 2-(2-бромэтил)-1,3-диоксолана (1,45 г, 8,0 ммоль) и 2-меркаптоэтанола (2,81 мл, 40 ммоль) в дихлорметане (15 мл) при кт в атмосфере Ar по каплям добавляют эфирный комплекс трифторида бора (5 мл, 40 ммоль) и перемешивают при кт в течение ночи. К неочищенной смеси добавляют насыщенный водный NaHCO3 (100 мл), после чего экстрагируют, используя Et2O (3×100 мл), сушат (Na2SO4) и выпаривают в вакууме. Очистка вакуумной перегонкой (90°С, 1 мм рт. ст.) дает 1,08 г указанного в заголовке соединения в виде желтого масла. Чистота данного вещества после перегонки составляет 71% (по данным анализа ГХ) и его используют на стадии алкилирования (121JP12) без дополнительной очистки.
L-Тартрат N-(4-фторбензил)-2-(4-изобутоксифенил)-N-{1-[2-(1, 3-оксотиолан-2-ил)этил]пиперидин-4-ил}ацетамида (121JP12)
Указанное в заголовке соединение получают по общей методике, описанной выше для 103NLS63-F с использованием 103NLS56 (130 мг, 0,33 ммоль) и 121JP11 (85 мг, 0,43 ммоль) в качестве алкилирующего агента. Обработка, как для 121JP11, последующая вакуумная фильтрационная хроматография на силикагеле (ВФХ, этилацетат/н-гептан 0:1→этилацетат/н-гептан 1:0→этилацетат/MeOH 4:1) дает 85 мг (51%) 121JP12 в виде бесцветного густого масла. L-Тартратную соль получают, как описано выше.
Rf=0, 57 (MeOH/CH2Cl2, 1:10). ЖХМС m/z 515 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,5:0,5) δ 7,20-6,76 (м, 8H), 5,10-5,00 (м, 1H, оксотиолан-Н), 4,66-4, 54 (м, 0,5H, пип-Н), 4,48 и 4,42 (2с, 2H, бензил-Н), 4,30-4,22 (м, 1H, оксотиолан-Н), 3,78-3,64 (м, 4,5H, пип-Н, бензил-Н, оксотиолан-Н, OCH2OiBu), 3,48 (с, 1H, бензил-Н), 3,01-2,82 (м, 4H, пип-Н, оксотиолан-Н), 2,60-2,34 (м, 2H, NCH2), 2,21-1,56 (м, 8H, пип-Н, NCH2CH2, CHOiBu), 1,32-1,22 (м, 1H, пип-Н), 1,04-0,96 (м, 6H, CH3OiBu). ВЭЖХ tR=10,1 мин.
L-Тартрат 2-(4-бромфенил)-N-{1-[2-(1,3-диоксан-2-ил)этил)пиперидин-4-ил}-N-(4-фторбензил)ацетамида (121JP13)
Указанное в заголовке соединение получают по методике, описанной выше для 117NLS87-A с использованием 118AF52-95 (200 мг, 0,62 ммоль) и 4-бромфенилуксусной кислоты (500 мг, 2,32 ммоль). К неочищенной смеси добавляют насыщенный водный NaHCO3 (100 мл), после чего экстрагируют CH2Cl2 (3×100 мл), сушат (Na2SO4) и выпаривают в вакууме. ВФХ на силикагеле (этилацетат/н-гептан 1:1→этилацетат/н-гептан 1:0→этилацетат/MeOH 2:1) дает 250 мг (78%) 121JP13 в виде густого масла. L-Тартратную соль получают, как описано выше.
Rf=0,49 (MeOH/CH2Cl2, 1:10). ЖХМС m/z 521 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,6:0,4) δ 7,50-6,88 (м, 8H), 4,62-4,57 (м, 0,4H, пип-Н), 4,50 (т, 1H, J=4,9, диоксан-Н) 4,48 и 4,42 (2с, 2H, бензил-Н), 4,06-4,00 (м, 2H, диоксан-Н), 3,76 и 3,50 (2с, 2H, бензил-Н), 3,75-3,60 (м, 2,6H, пип-Н, диоксан-Н), 3,01 и 2,90 (2д, 2H, J=10,5, пип-Н), 2,52 и 2,41 (2т, 2H, J=8,0, NCH2), 2,10-1,98 (м, 2,2Н, диоксан-Н, пип-H), 1,97-1,58 (м, 6H, пип-Н, NCH2CH2), 1,38-1,20 (м, 1,8H, диоксан-Н, пип-Н). ВЭЖХ tR=8,3 мин.
L-Тартрат N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изобутиламинофенил)ацетамида (121JP27)
Адаптируя методику Buchwald et al. (J. Amer. Chem. Soc., 1996, 118, 7215-7216), 121JP13 (100 мг, 192 мкмоль), изобутиламин (17 мг, 230 мкмоль), Pd2dba3 (11,6 мг, 19,2 мкмоль), BINAP (12,0 мг, 38,4 мкмоль) и NaOtBu (25,8 мг, 269 мкмоль) помещают в колбу, добавляют толуол (2 мл) и полученную в результате смесь перемешивают при 80°С в течение 18 час. Обработка, как для 121JP13, последующая препаративная ВЭЖХ с обращенной фазой (С18) дают 25,7 мг (27,0%) 121JP27 в виде густого бесцветного масла. L-Тартратную соль получают, как описано выше.
Rf=0,30 (MeOH/CH2Cl2, 1:10). ЖХМС m/z 512 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,5:0,5) δ 7,10-6,81 (м, 6H), 6,59-6,49 (м, 2H), 4, 65-4,55 (м, 0,5H, пип-Н), 4,55-4,50 (м, 1H, диоксан-Н), 4,50 и 4,43 (2с, 2H, бензил-Н), 4,10-4,02 (м, 2H, диоксан-Н), 3,80-3,67 (м, 3,5H, пип-Н, бензил-Н, диоксан-Н) 3,45 (с, 1H, бензил-Н), 2,95-2,85 (м, 4H, пип-Н, NHCH2CH(CH3)2)), 2,45-2,35 (м, 2H, NCH2), 2,09-1,99 (м, 2H, диоксан-Н, пип-Н), 1,91-1,50 (м, 7H, NCH2CH2, пип-Н, NHCH2CH(CH3)2), 1,38-1,25 (м, 2H, диоксан-Н, пип-Н), 0,98 (м, 6H, NHCH2CH(CH3)2). ВЭЖХ tR=8,2 мин.
L-Тартрат N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-пропиламинофенил)ацетамида (121JP28)
Получают так же, как описано в методике синтеза 121JP27, с использованием пропиламина (16 мг, 230 мкмоль) вместо изобутиламина, получая 24 мг (25%) 121JP28 в виде густого масла. L-Тартратную соль получают, как описано выше.
Rf=0,33 (MeOH/CH2Cl2, 1:10). ЖХМС m/z 498 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,5:0,5) δ 7,11-6,82 (м, 6H), 6,53-6,43 (м, 2H), 4,58-4,49 (м, 0,5H, пип-Н), 4,48-4,45 (м, 1H, диоксан-Н), 4,42 и 4,35 (2с, 2H, бензил-Н), 4,05-3,95 (м, 2H, диоксан-Н), 3,70-3,60 (м, 3,5H, пип-Н, бензил-Н, диоксан-Н), 3,40 (с, 1H, бензил-Н), 3,05-2,95 (м, 2H, пип-Н), 2,85-2,70 (м, 2H, NHCH2CH2CH3), 2,48-2,38 (м, 2H, NCH2), 2,05-1,90 (м, 2H, диоксан-Н, пип-Н), 1,92-1,40 (м, 8H, NCH2CH2, пип-Н, NHCH2CH2CH3), 1,40-1,28 (м, 2H, диоксан-Н, пип-Н), 0,98 (м, 3H, NHCH2CH2CH3). ВЭЖХ tR=7,3 мин.
L-Тартрат N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-(1-нитропропил)фенил)ацетамида (121JP34)
Адаптируя методику Vogl & Buchwald (J. Org. Chem., 2002, 67, 106-111), 121JP13 (135 мг, 0,26 ммоль), 1-нитропропан (47 мг, 0,52 ммоль), Cs2CO3 (95 мг, 0,29 ммоль), 2-ди-трет-бутилфосфинодифенил (15,5 мг, 52 мкмоль) и Pd2dba3 (11,9 мг, 13 мкмоль) помещают в колбу, добавляют ДМЭ (2 мл) и реакционную смесь перемешивают при 60°С в течение 20 час. Обработка как для 121JP13, последующая препаративная ТСХ (CH2Cl2/MeOH, 15:1, 10× элюирование) дают 22 мг (16%) 121JP34 в виде густого бесцветного масла. L-Тартратную соль указанного в заголовке соединения получают, как описано выше.
Rf=0,58 (MeOH/CH2Cl2, 1:10). ЖХМС m/z 528 [M+H]+. ВЭЖХ tR=8,1 мин.
L-Тартрат N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-[4-(2-оксопирролидин-1-ил)фенил]ацетамида (121JP31)
Адаптируя методику Yin & Buchwald (J. Amer. Chem. Soc., 2002, 124, 6043-6048), 121JP13 (124 мг, 0,24 ммоль), пирролидона (24,7 мг, 0,29 ммоль), Cs2CO3 (111 мг, 0,34 ммоль), Xantphos (20,8 мг, 0,036 ммоль) и Pd2 dba3 (11,0 мг, 0,012 ммоль) помещают в колбу, добавляют диоксан (2 мл) и реакционную смесь перемешивают при 90°С в течение 70 час. Обработка, как для 121JP13, последующая очистка, как для 121JP27, дают 8 мг (7%) 121JP31 в виде густого бесцветного масла. L-Тартратную соль получают, как описано выше.
Rf=0,31 (MeOH/CH2Cl2, 1:10). ЖХМС m/z 524 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,6:0,4) δ 7,60-6,80 (м, 8H), 4,60-4,50 (м, 0,4H, пип-Н), 4,47 (т, 1H, J=5,1, диоксан-Н) 4,42 и 4,38 (2с, 2H, бензил-Н), 4,04-3,97 (м, 2H, диоксан-Н), 3,82-3,60 (м, 5,4H, пип-Н, диоксан-Н, бензил-Н, пиррол-Н), 3,25 (с, 1,2H, бензил-Н), 2,90-2,72 (м, 2H, пип-Н), 2,60-2,50 (м, 2H, пиррол-Н), 2,39-2,32 (м, 2H, NCH2) 2,18-1,90 (м, 4,2Н, диоксан-Н, пип-Н, пиррол-Н), 1,81-1,40 (м, 6H, пип-Н, NCH2CH2), 1,32-1,18 (м, 1,8H, диоксан-Н, пип-Н). ВЭЖХ tR=4,9 мин.
L-Тартрат N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изобутилсульфанилфенил)ацетамида (121JP33)
Адаптируя методику Li (J. Org. Chem., 2002, 67, 3643-3650), 121JP13 (120 мг, 0,231 ммоль), 2-метил-1-пропантиол (25 мг, 0,28 ммоль), [(tBu)2P(OH)]2PdCl2 (11,6 мг, 0,0231 ммоль) и NaOtBu (44 мг, 0,46 ммоль) помещают в колбу, добавляют толуол (2 мл) и реакционную смесь перемешивают при 110°С в течение 16 час. Обработка, как для 121JP13, и очистка, как для 121JP27, дают 1,7 мг (1,4%) 121JP33 в виде густого бесцветного масла. L-Тартратную соль указанного в заголовке соединения получают, как описано выше.
Rf=0,46 (MeOH/CH2Cl2, 1:10). ЖХМС m/z 529 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,6:0,4) δ 7,24-6,82 (м, 8H), 4,57-4,48 (м, 0,4H, пип-Н), 4,47 (т, 1H, J=5,1, диоксан-Н), 4,45 и 4,38 (2с, 2H, бензил-Н), 4, 05-3,95 (м, 2H, диоксан-Н), 3,72 (с, 0,8H, бензил-Н), 3,70-3,60 (м, 2,6H, пип-Н, диоксан-Н) 3,44 (с, 1,2H, бензил-Н), 2,87-2,75 (м, 2H, пип-Н), 2,72 (т, 2H, J=6,5, SCH2CH(CH3 )2)), 2,38-2,28 (м, 2H, NCH2), 2,05-1,88 (м, 2,2H, диоксан-Н, пип-Н), 1,81-1,48 (м, 7H, NCH2СН2, пип-Н, SCH2CH(CH3)2), 1, 30-1,20 (м, 1,8H, диоксан-Н, пип-Н), 0,98 (т, 6H,J=6,7, SCH2CH(CH3)2). ВЭЖХ tR=8,8 мин.
L-Тартрат N-{1-[2-(1, 3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-иодфенил)ацетамида (121JP40)
Указанное в заголовке соединение получают по методике, описанной выше для 117NLS87-A, используя 118AF52-95 (400 мг, 1,24 ммоль) и 4-иодфенилуксусную кислоту (1,22 г, 4,64 ммоль). Обработка, как для 121JP13, и очистка, как для 121JP34, дают 320 мг (46%) 121JP40 в виде густого бесцветного масла. L-Тартратную соль получают, как описано выше.
Rf=0,52 (MeOH/CH2Cl2, 1:10). ЖХМС m/z 567 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,6:0,4) δ 7,65-7,55 (м, 2H), 7,16-6,85 (м, 6H), 4,59-4,50 (м, 0,6H, пип-Н), 4,51 (т, 1H, J=5,0, диоксан-Н), 4,50 и 4,42 (2с, 2H, бензил-Н), 4,09-4,00 (м, 2H, диоксан-Н), 3,75 и 3,49 (2с, 2H, бензил-Н), 3,74-3,54 (м, 2,4H, пип-Н, диоксан-Н), 2,85 (д, 2H, J=10,6, пип-Н), 2,41-2,35 (м, 2H, NCH2), 2,08-1,95 (м, 2,2H, диоксан-Н, пип-Н), 1,88-1,50 (м, 6H, пип-Н, NCH2СН2), 1,39-1,27 (м, 1,8H, диоксан-Н, пип-Н). ВЭЖХ tR=8,6 мин.
L-Тартрат 2-(4-ацетофенил)-N-{1-[2-(1, 3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)ацетамида (121JP44)
Адаптируя методику Cacchi et al. (Org. Lett., 2003, 5, 289-293), 121JP40 (68 мг, 0,12 ммоль), уксусный ангидрид (61 мг, 0,6 ммоль), Pd2dba3 (1,4 мг, 1,5 мкмоль), литийхлорид (26 мг, 0,6 ммоль) и EtNiPr2 (31 мг, 0,24 ммоль) помещают в колбу, добавляют ДМФА (0,9 мл) и полученную в результате смесь перемешивают при 100°С в течение 18 час. Обработка, как для 121JP13, и очистка, как для 121JP34, дают 19 мг (33%) 121JP44 в виде густого бесцветного масла. L-Тартратную соль получают, как описано выше.
Rf=0,50 (MeOH/CH2Cl2, 1:10). ЖХМС m/z 483 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,6:0,4) δ 7,88-7,78 (м, 2H), 7,36-6,84 (м, 6H), 4,58-4,49 (м, 0,4H, пип-Н), 4,48-4,46 (м, 1H, диоксан-Н), 4,45 и 4,38 (2с, 2H, бензил-Н), 4,05-3,95 (м, 2H, диоксан-Н), 3,81 и 3,55 (2с, 2H, бензил-Н), 3,70-3,60 (м, 2,6H, пип-Н, диоксан-Н), 2,85-2,75 (м, 2H, пип-Н), 2,54 и 2,52 (2с, 3H, CH3), 2,38-2,27 (м, 2H, NCH2), 2,05-1,92 (м, 2,2H, диоксан-Н, пип-Н), 1,81-1, 45 (м, 6H, NCH2CH2, пип-Н), 1,32-1,22 (м, 1,8H, диоксан-Н, пип-Н). ВЭЖХ tR=5,5 мин.
L-Тартрат 2-[4-(1-гидроксииминоэтил)фенил]-N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)ацетамида (121JP48)
121JP44 (14 мг, 29 мкмоль), пиридин (4,6 мг, 58 мкмоль) и этанол (5 мл) помещают в колбу, в которую добавляют гидроксид гидроксиламина (4,1 мг, 58 мкмоль), и полученную в результате смесь перемешивают при кт в течение 5 час. Обработка, как для 121JP13, и очистка, как для 121JP34, дают 7 мг (49%) 121JP48 в виде густого бесцветного масла. L-Тартратную соль получают, как описано выше.
Rf=0,40 (MeOH/CH2Cl2, 1:10). ЖХМС m/z 498 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,6:0,4) δ 7,63-7,51 (м, 2H), 7,33-6,88 (м, 6H), 4,66-4,58 (м, 0,4H, пип-Н), 4,56-4,53 (м, 1H, диоксан-Н), 4,51 и 4, 40 (2с, 2H, бензил-Н), 4,10-4,04 (м, 2H, диоксан-Н), 3,85 и 3,58 (2с, 2H, бензил-Н), 3,78-3,67 (м, 2,6H, пип-Н, диоксан-Н) 2,97-2,83 (м, 2H, пип-Н), 2,47-2,37 (м, 2H, NCH2), 2,26 и 2,24 (2с, 3H, CH3), 2,12-1,98 (м, 2,2H, диоксан-Н, пип-Н), 1,88-1,58 (м, 6H, NCH2CH2, пип-Н), 1,37-1,29 (м, 1,8H, диоксан-Н, пип-Н). ВЭЖХ tR=4,0 мин.
L-Тартрат N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-морфолин-4-илфенил)ацетамида (121JP49)
Адаптируя методику Buchwald et al. (Org. Lett., 2002, 4, 581-584), 121JP40 (50 мг, 88 мкмоль), морфолин (9,2 мг, 106 мкмоль), CuI (1,7 мг, 8,8 мкмоль) и K3PO4 (37,6 мг, 177 мкмоль) помещают в колбу в атмосфере воздуха, добавляют этиленгликоль (2 мл) и полученную в результате смесь перемешивают при 80°С в течение 16 ч в атмосфере воздуха. Обработка, как для 121JP13, и очистка, как для 121JP34, дают 4,7 мг (10%) 121JP49 в виде густого бесцветного масла. L-Тартратную соль получают, как описано выше.
Rf=0,33 (MeOH/CH2Cl2, 1:10). ЖХМС m/z 526 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,6:0,4) δ 7,18-6,72 (м, 8H), 4,62 и 4,37 (2с, 2H, бензил-Н), 4,57-4,50 (м, 0,4H, пип-Н), 4,50-4,42 (м, 1H, диоксан-Н), 4,05-3,95 (м, 2H, диоксан-Н), 3,82-3,75 (м, 4H, морф-Н), 3,69 и 3,43 (2с, 2H, бензил-Н), 3,68-3,61 (м, 2,6H, пип-Н, диоксан-Н), 3,12-3,03 (м, 4H, морф-Н), 2,85-2,75 (м, 2H, пип-Н), 2,38-2,27 (м, 2H, NCH2), 2, 07-1,90 (м, 2,2H, диоксан-Н, пип-Н), 1,82-1,45 (м, 6H, NCH2CH2, пип-Н), 1,30-1,22 (м, 1,8H, диоксан-Н, пип-Н). ВЭЖХ tR=6,2 мин.
L-Тартрат N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-пиразол-1-илфенил)ацетамида (121JP56)
Адаптируя методику Buchwald et al. (J. Amer. Chem. Soc., 2001, 123, 7727-7729), 121JP40 (48 мг, 85 мкмоль), пиразол (7 мг, 102 мкмоль), CuI (0,4 мг, 1,7 мкмоль), рацемический транс-1,2-циклогександиамин (1,0 мг, 8,5 мкмоль) и K2CO3 (25 мг, 181 мкмоль) помещают в колбу, добавляют диоксан (1,5 мл) и полученную в результате смесь перемешивают при 110°С в течение 60 ч. Обработка, как для 121JP13, и очистка, как для 121JP34, дают 3,9 мг (9%) 121JP56 в виде густого бесцветного масла. L-Тартратную соль получают, как описано выше.
Rf=0,27 (MeOH/CH2Cl2, 1:10). ЖХМС m/z 507 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,6:0,4) δ 7,86 и 7,82 (2д, 1H, J=2,2, пираз-Н), 7,64 (д, 1H, J=4,4, пираз-Н), 7,62-6,83 (м, 8H), 6,42-6,36 (м, 1H, пираз-Н), 4,60-4,49 (м, 0,6H, пип-Н), 4,48 (т, 1H, J=5,1, диоксан-Н), 4,45 и 4,38 (2с, 2H, бензил-Н), 4,05-3,95 (м, 2H, диоксан-Н), 3,80 и 3,54 (2с, 2H, бензил-Н), 3,70-3,61 (м, 2,4H, пип-Н, диоксан-Н), 2,85-2,75 (м, 2H, пип-Н), 2,38-2,28 (м, 2H, NCH2), 2,07-1,90 (м, 2,2H, диоксан-Н, пип-Н), 1,82-1,45 (м, 6H, NCH2CH2, пип-Н), 1,35-1,22 (м, 1,8H, диоксан-Н, пип-Н). ВЭЖХ tR=6, 4 мин.
2-(2-Бромпропил)-1,3-диоксан (121JP80)
Адаптируя методику Büchi и Wüest (J. Org. Chem., 1969, 34, 1122-1123), к концентрированному водному HBr (5,2 г, 64 ммоль) по каплям в течение 5 мин при 5°С в атмосфере воздуха добавляют кротоновый альдегид (3 г, 43 ммоль). После 15 мин перемешивания при 5°С, в результате чего бесцветная смесь становится коричневатой, добавляют 1,3-пропандиол (8,1 г, 107 ммоль) и реакционную смесь перемешивают при 5°С в течение дополнительного 0,5 ч, затем ей дают нагреться до кт и, наконец, перемешивают при кт в течение 2 ч. Затем неочищенную реакционную смесь экстрагируют н-гептаном (2×200 мл), объединенные экстракты н-гептана сушат над Na2 SO4, выпаривают в вакууме и 121JP80 выделяют вакуумной перегонкой (75°С, 0,18 мм рт.ст.), получая 124 мг (1,4%) указанного в заголовке соединения в виде бесцветной жидкости.
Данные исследования:1H-ЯМР (CDCl3) δ 4,73 (дд, 1H, J=7,2, 3,4), 4,26-4,18 (м, 1H), 4,15-4,06 (м, 2H), 3,83-3,75 (м, 2H), 2,15-1,97 (м, 3H), 1,71 (д, 3H, J=6,6), 1,38-1,32 (м, 1H).
L-Тартрат N-{1-[2-(1,3-диоксан-2-ил)-1-метилэтил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида (121JP84)
Указанное в заголовке соединение получают по методике, описанной выше для 103NLS63-F, используя 103NLS56 (202 мг, 0,51 ммоль) и 121JP80 (124 мг, 0,59 ммоль) в качестве алкилирующего агента. Обработка, как для 121JP13, и очистка, как для 121JP34, дают 1,9 мг (0,7%) 121JP84 в виде густого масла. L-Тартратную соль получают, как описано выше.
Rf=0,43 (MeOH/CH2 Cl2, 1:10). ЖХМС m/z 527 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,5:0,5) δ 7,19-6,80 (м, 8H), 4,50-4,33 (м, 3,5H, диоксан-Н, бензил-Н, пип-Н), 4,04-3,93 (м, 2H, диоксан-Н), 3,72-3,55 (м, 5,5H, диоксан-Н, бензил-Н, пип-Н, OCH2OiBu), 3,42 (с, 1H, бензил-Н), 2,78-2,59 (м, 2H, пип-Н), 2,34-2,16 (м, 1H, NCH), 2,08-1,89 (м, 2H, пип-Н, CHOiBu), 1,79-0,77 (м, 17H, CH3OiBu, NCHCH3, NCHCH2, пип-Н, диоксан-Н). ВЭЖХ tR=8,5 мин.
Этиловый эфир 4-иодфенилуксусной кислоты (121JP58)
4-Иодфенилуксусную кислоту (3 г), этанол (20 мл) и концентрированную H2SO4 (5 мл) кипятят с обратным холодильником в течение ночи. Затем выпаривают примерно 15 мл этанола, остаток экстрагируют дихлорметаном (3×100 мл), объединенные органические экстракты промывают насыщенным водным NaHCO3, сушат над Na2SO4 и выпаривают в вакууме, получая 2,97 г (90%) 121JP58 в виде желтого масла.
Данные исследования:1H-ЯМР (CDCl3) δ 7,62 (д, 2H, J=8,4), 7,02 (д, 2H, J=8,4), 4,07 (кв, 2Н, J=7,0), 3,59 (с, 2H), 1,12 (т, 3H, J=7,0).
Этиловый эфир 4-пиразол-1-илфенилуксусной кислоты (121JP64)
121JP58 (290 мг, 1,0 ммоль) обрабатывают таким же образом, как 121JP40 для синтеза 121JP56. После нагревания реакционной смеси при 110°С в течение 72 ч и обработки как 121JP13 неочищенную смесь очищают ВФХ (CH2Cl2/MeOH 1:0→20:1), получая 180 мг (78%) 121JP64 в виде желтого масла.
Данные исследования:1H-ЯМР (CDCl3) δ 7,92 (дд, 1H, J=2,3, 1,0), 7,72 (д, 1H, J=1,3), 7,62 (д, 2H, J=8,7), 7,39 (д, 2H, J=8,7), 6,42 (дд, 1H, J=2,5, 1,9), 4,18 (кв, 2Н, J=7,0), 3,61 (с, 2H), 1,22 (т, 3H, J=7,1).
4-Пиразол-1-илфенилуксусная кислота (121JP68, 87)
121JP64 (180 мг, 0,78 ммоль), моногидрат гидроксида лития (164 мг, 3,9 ммоль), H2O (10 мл) и ТГФ (10 мл) перемешивают в течение ночи при кт. Затем неочищенное вещество экстрагируют дихлорметаном (3×150 мл), рН водной фазы доводят примерно до 3, используя 4М HCl, и экстрагируют дихлорметаном (3×150 мл). Объединенные органические слои сушат над Na2SO4, фильтруют и выпаривают в вакууме, получая 128 мг (81%) 121JP68 в виде твердого желтого вещества.
Данные исследования:1H-ЯМР (CDCl3) δ 7,90 (м, 1H), 7,75 (м, 1H), 7,63 (д, 2H, J=8,6), 7,38 (д, 2H, J=8,6), 6,45 (м, 1H), 3,68 (с, 2H).
L-Тартрат N-{1-[2-(1,3-диоксан-4-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-пиразол-1-илфенил)ацетамида (121JP91)
Указанное в заголовке соединение получают по общей методике, описанной выше для 117NLS87-A, используя 128NLS52 (87 мг, 0,27 ммоль) и 121JP87 (60 мг, 0,27 ммоль). Обработка, как для 121JP13, и очистка, как для 121JP34, дает 25 мг (18%) 121JP91 в виде бесцветного масла. L-Тартратную соль получают, как описано выше.
Rf=0,34 (MeOH/CH2Cl2, 1:10). ЖХМС m/z 507 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,5:0,5) δ 7,92 и 7,88 (2д, 1H, J=2,2, пираз-Н), 7,71 (д, 1H, J=4,7, пираз-Н), 7,69-6,90 (м, 8H), 6,48-6,42 (м, 1H, пираз-Н), 5,00 (д, 1H, J=6,3, диоксан-Н), 4,65 (д, 1H, J=6,4, диоксан-Н), 4,63-4,55 (м, 0,5H, пип-Н), 4,52 и 4,46 (2с, 2H, бензил-Н), 4,10-4,02 (м, 1H, диоксан-Н), 3,86 и 3,57 (2с, 2H, бензил-Н), 3,78-3,55 (м, 2,5H, пип-Н, диоксан-Н) 2,93-2,82 (м, 2H, пип-Н), 2,49-2,30 (м, 2H, NCH2), 2,10-1,98 (м, 1H, пип-Н), 1,90-1,33 (м, 9H, NCH2CH2, пип-Н, диоксан-Н). ВЭЖХ tR=5,2 мин.
Тартрат N-[1-((R)-3,5-дигидроксипентил)пиперидин-4-ил]-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида (130AF93-189)
Желаемое соединение синтезируют из (S)-5-[(4-метилбензолсульфонил)окси]пентан-1,3-диола (Moune et al. J. Org. Chem., 1997, 62, 3332-3339) и 103NLS56, используя такой же способ, как описано для получения 130AF65-182.
Rf=0,48 (MeOH/CH2Cl2, 10:90). ЖХМС m/z 501 [M+H]+. ВЭЖХ tR=7,4 мин.
Тартрат N-{1-[2-((4R)-1, 3-диоксан-4-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-(4-изобутоксифенил)ацетамида (130AF95-190)
Желаемое соединение (7,9 мг, 55%) синтезируют из 130AF93-189 (18,6 мг, 0,028 ммоль), используя такой же способ, как описано для получения 130AF67-183. С использованием анализа хиральной ВЭЖХ (колонка Chiralpak AD, 4,6×250 мм; гептан/i-PrOH 50:50, 0,3% DEA; 0,5 мл/мин; tR=22,7 мин) определяют, что энантиомерный избыток составляет 99%. Данные1H-ЯМР и ЖХМС идентичны 130AF67-183.
4-(1,2, 4-Триазол-4-ил)фенилуксусная кислота (141JP01)
Адаптируя методику Catarzi et al. (J. Med. Chem., 2001, 44, 3157-3165), к суспензии 4-аминофенилуксусной кислоты (201 мг, 1,33 ммоль) в безводном пиридине добавляют диформилгидразин (352 мг, 4,0 ммоль) и затем по каплям триметилсилилхлорид (2,53 мл, 20 ммоль) и Et3N (1,30 мл, 9,3 ммоль). Смесь нагревают при 100°С в течение ночи, летучие компоненты удаляют при пониженном давлении и полученное в результате твердое вещество обрабатывают водой (6 мл), собирают, промывают H2O и сушат в вакууме, получая 251 мг (93%) 141JP01 в виде твердого светло-коричневого вещества. ЖХМС m/z 204 [M+H]+.1H-ЯМР (ДМСО-d6) δ 9,05 (с, 2H), 7,62 (д, 1H, J=8,6), 7,40 (д, 1H, J=8,2), 3, 61 (с, 2H).
L-Тартрат N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)-2-[4-(1,2,4-триазол-4-ил)фенил]ацетамида (141JP13)
Кислоту 141JP01 (35 мг, 0,17 ммоль), N-{1-[2-(1,3-диоксан-2-ил)этил]пиперидин-4-ил}-N-(4-фторбензил)амин (118AF52-95, 55 мг, 0,17 ммоль) и диизопропилэтиламин (52 мг, 0,51 ммоль) растворяют в ДМФА (5 мл). Добавляют гексафторфосфат бром-трис-пирролидинофосфония (PyBroP, 119 мг, 0,25 ммоль) и смесь перемешивают при кт в течение 2 ч. Смесь концентрируют и пропускают через кислотный ионообменный SPE картридж. Картридж промывают метанолом (8×4 мл) и остающийся продукт элюируют из колонки 10% NH4OH в метаноле (2×4 мл) и выпаривают. Полученное в результате масло очищают как 121JP34, получая 47 мг (54%) 141JP13 в виде бесцветного масла. L-Тартратную соль получают, как описано выше.
Rf=0,26 (MeOH/CH2Cl2, 1:10). ЖХМС m/z 508 [M+H]+.1H-ЯМР (CDCl3, ротамеры 0,5:0,5) δ 8,47 и 8,41 (2с, 1H, -H), 7,48-6,89 (м, 8H, Ar-H), 4,62-4,56 (м, 0,6H, пип-Н), 4,56-4,49 (м, 3H, диоксан-Н, бензил-Н), 4,10-4,01 (м, 2H, диоксан-H), 3,79 и 3,61 (2с, 2H, бензил-Н), 3,77-3,67 (м, 2,4H, пип-Н, диоксан-Н), 2,94-2,84 (м, 2H, пип-Н), 2,45-2,35 (м, 2H, NCH2), 2,10-1,43 (м, 9H, диоксан-Н, NCH2CH2, пип-Н), 1,37-1,27 (м, 1H, диоксан-Н).
Определение рецепторной активности in vitro
Анализ выбора и амплификации рецептора (R-SAT)
Функциональный рецепторный анализ, Технология выбора и амплификации рецептора (R-SAT™), используют (с незначительными модификациями относительно методики, описанной ранее (Brann, M.R., патент США 5707798, 1998; Chem. Abstr. 1998, 128, 111548), для отбора соединений на эффективность по отношению к 5-HT2A рецептору. Короче говоря, NIH3T3 клетки выращивают в 96-луночных планшетах для выращивания культур тканей до 70-80% слияния. Клетки трансфицируют в течение 12-16 часов плазмидной ДНК, используя SuperFect (Qiagen Inc.) согласно протоколам изготовителя. Обычно R-SAT выполняют при 50 нг/лунка рецептора и 20 нг/лунка плазмидной ДНК β-галактозидазы. Все используемые рецепторы и G-белки находятся в pSI векторе экспрессии для клеток млекопитающего (Promega Inc.), как описано ранее. Ген 5-HT2A рецептора подвергают дополнительной амплификации внутренними праймерами из кДНК головного мозга, используя олигодезоксинуклеиды, исходя из опубликованной последовательности (Saltzman et al. Biochim. Biophys Res. Comm. 1991, 181, 1469). Для крупномасштабных трансфекций клетки трансфицируют в течение 12-16 часов, затем трипсинизируют и замораживают в ДМСО. Затем замороженные клетки размораживают, высевают 10000-40000 клеток на лунку в 96-луночный планшет, который содержит лекарство. Затем в том и другом способе клетки выращивают в увлажненной атмосфере, содержащей 5% CO2, в течение пяти дней. Затем среду удаляют из планшетов и активность маркерного гена измеряют, добавляя субстрат β-галактозидазы о-нитрофенил-β-D-галактопиранозид на (ONPG, в PBS c 5% NP-40). Полученную в результате колориметрическую реакцию измеряют на спектрофотометрическом планшет-ридере (Titertek Inc.) при 420 нМ. Все данные анализируют с использованием компьютерной программы XLFit (IDBSm). Эффективность представляет собой процент максимальной репрессии по сравнению с репрессией контрольным соединением (ритансерин в случае 5-HT2A). pIC50 представляет собой отрицательный log(IC50), где IC50 является рассчитанной молярной концентрацией, которая продуцирует 50% от максимальной репрессии.
Определение поведенческих эффектов in vivo
Животные и аппаратура
В качестве субъектов используют самцов мыши NSA (Harlan; San Diego, Ca). Масса мышей составляет 20-30 г. Животных помещают 8/на клетку в систему One Cage (One Cage; Lab Products, Inc., Seaford, DE) c подстилкой (1/8 дюймовая Bed ″O″ Cob; Harlan Teklad, Madison, WI) в комнате с контролируемой температурой 22±3°С и 12-часовым циклом свет : темнота (освещают с 6 часов до полудня). Вода и стандартный корм для грызунов (Harlan Teklad) в домашней клетке постоянно имелись в распоряжении. Для тестирования пластмассовые клетки для определения двигательной активности (20×20×30 см; AccuScan Instruments, Columbus, OH) оборудуют фотоэлементом для измерения горизонтальной активности. Данные собирают, используя компьютерную программу Versamax (AccuScan Instruments).
Методика
Для определения спонтанной активности тестируемые соединения вводят по отдельности (подкожно за 10 мин или перорально за 30 мин до сессии). Для экспериментов по гиперактивности мышам вводят инъекцией 0,3 мг/кг MK-801 в.б. за 15 мин до сессии (пиковая доза для получения гиперактивности на обращенной U-образной кривой доза-эффект, как определено в пилотных экспериментах) в комбинации с растворителем или тестируемым соединением. Данные по двигательной активности собирают в течение 15 мин сессии в освещенной комнате. Мышей до этого не подвергают тестированию в клетках для исследования двигательной активности. Каждую дозу или комбинацию доз тестируют для отдельной группы мышей (n=8).
Анализ данных
Рассчитывают пройденное расстояние (см) и усредняют по животным в группе. Дисперсионный анализ (ANOVA) и последующий t-тест Даннета по сравнению с контролем, представляющим собой растворитель, проводят для каждой функции доза-ответ. Наиболее низкую дозу, которая, как обнаруживают, значительно отличается от контроля, представляющего собой растворитель, определяют как минимальную эффективную дозу (МЭД).
Активность соединения
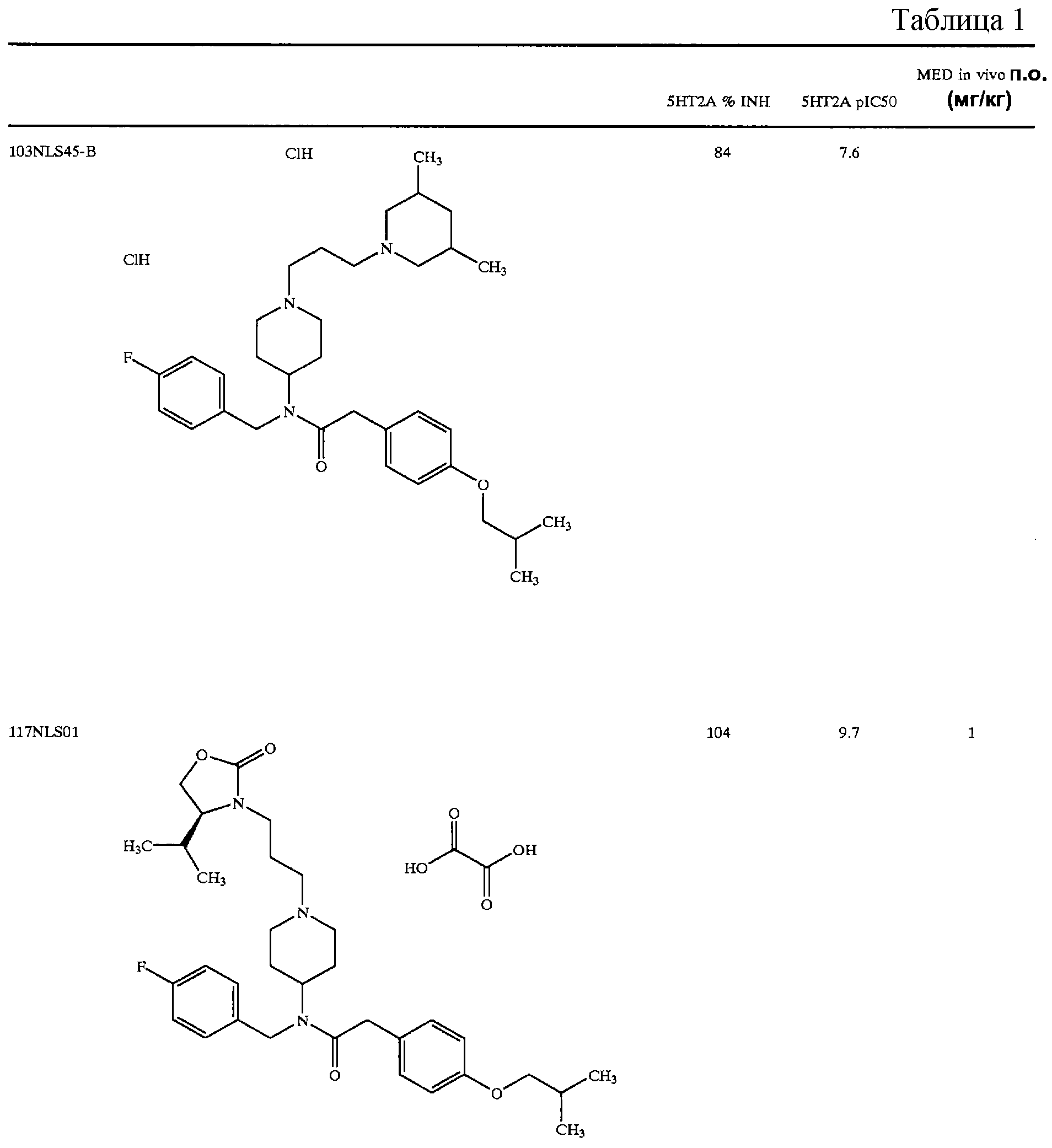
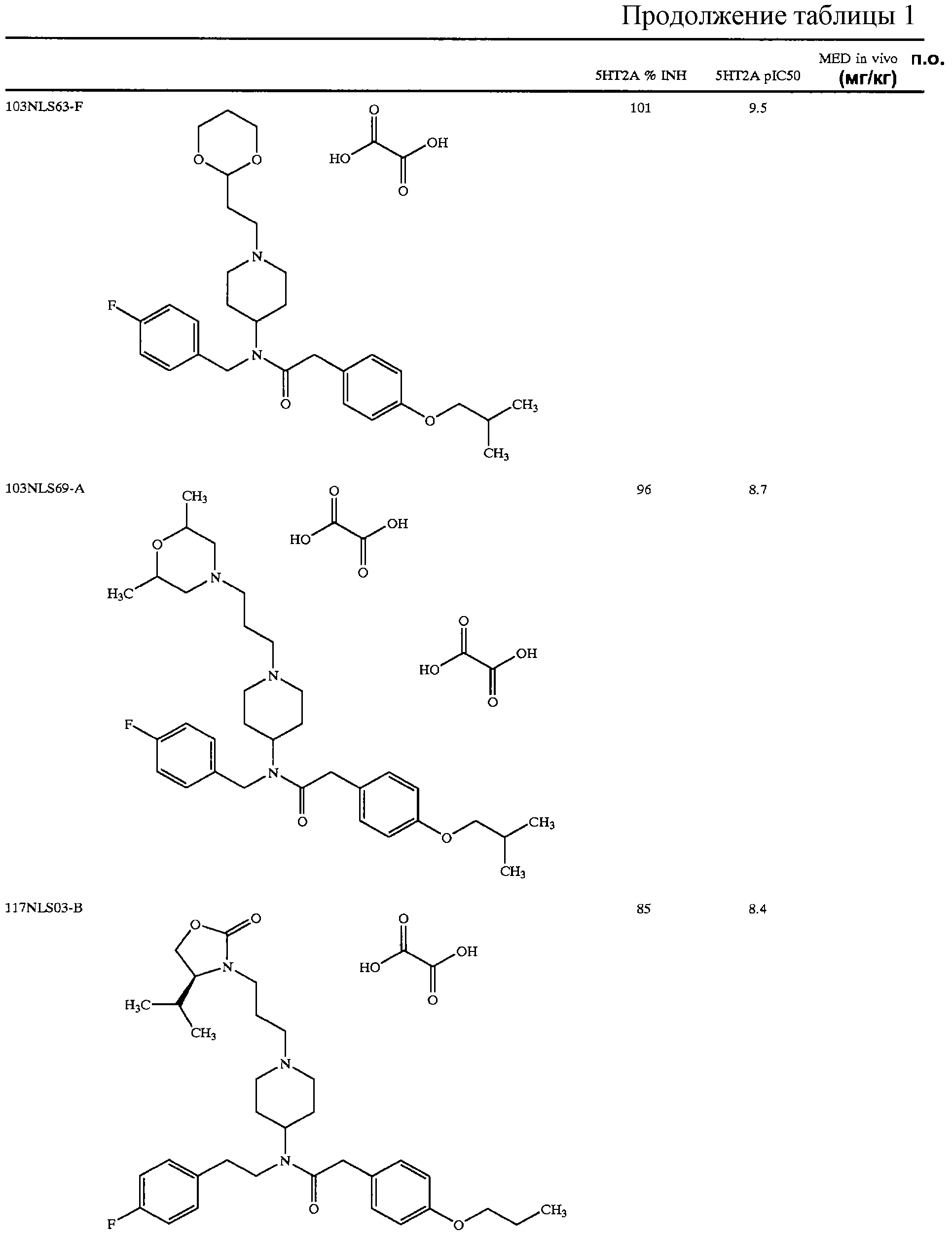
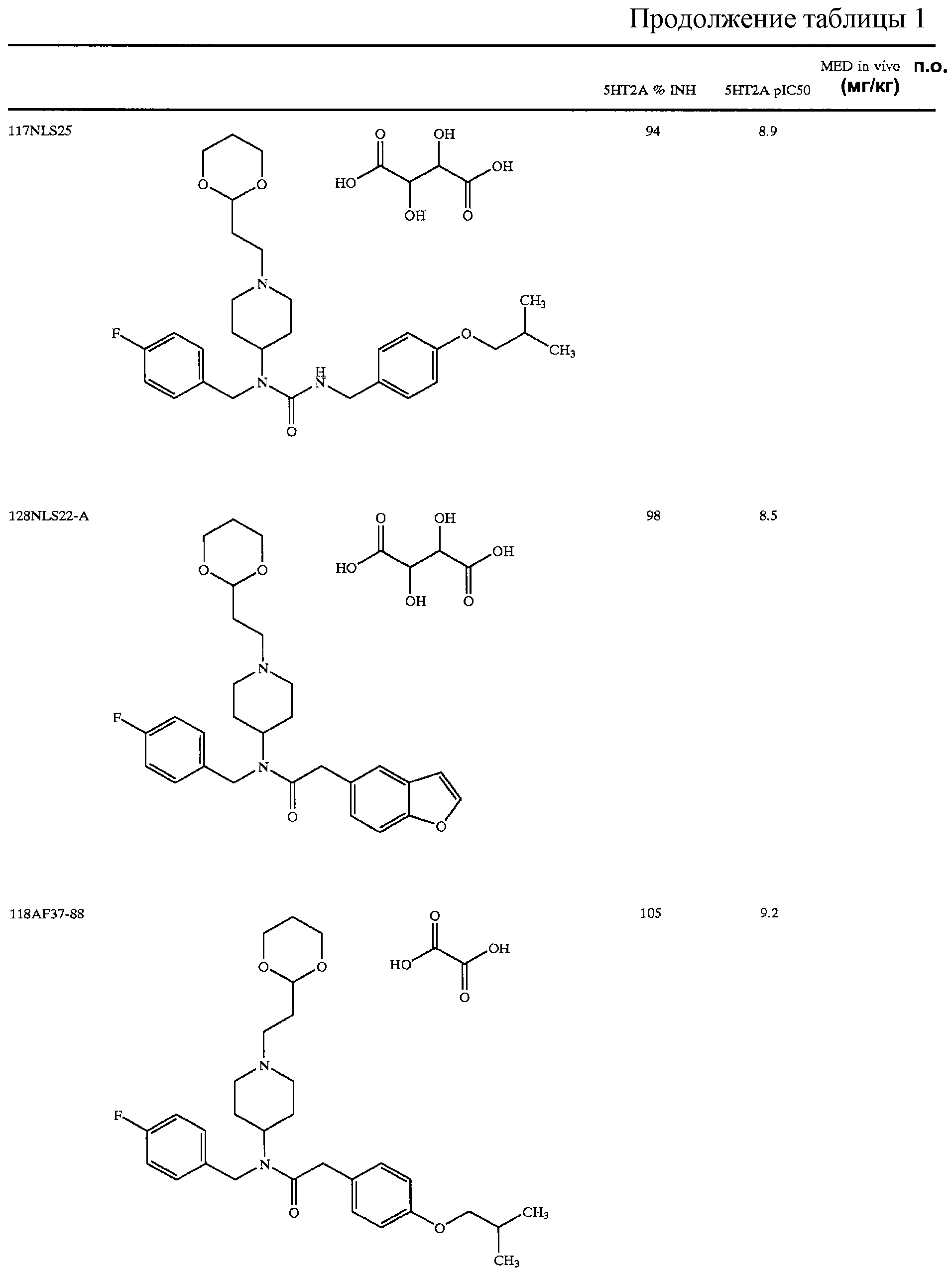
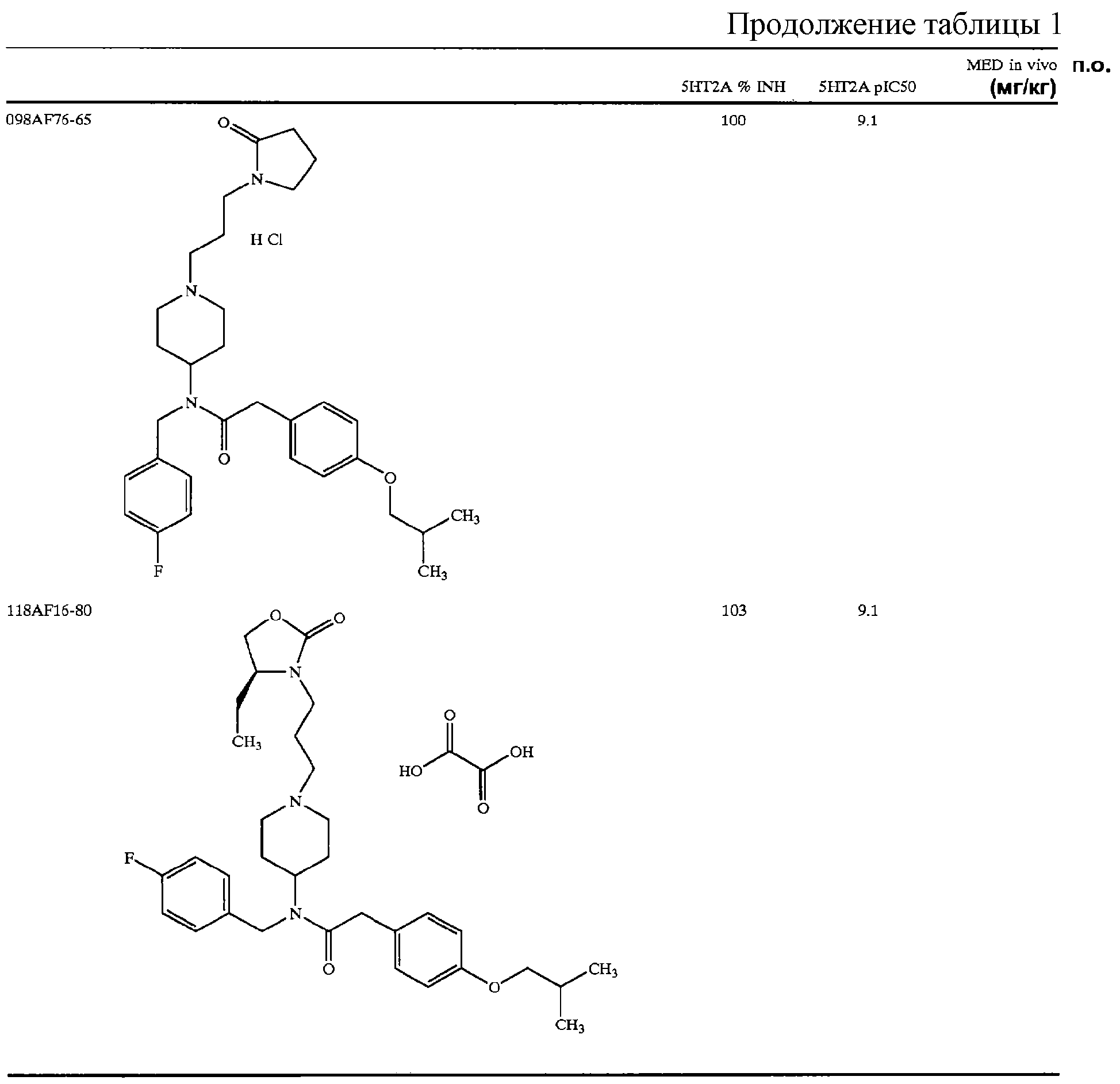
Реферат
Изобретение относится к новым соединениям - N-замещенным производным пиперидина формулы I или к их фармацевтически приемлемым солям, амидам, сложным эфирам
где значения для R1, R2, R3, m, X, n, W, Ar1, Ar2 раскрыты в формуле изобретения. Изобретение также относится к способам ингибирования активности и способам ингибирования активации моноаминового рецептора, включающим контактирование моноаминового рецептора или системы, содержащей моноаминовый рецептор, с эффективным количеством одного или нескольких соединений формулы I. Кроме того, изобретение относится к применению соединений формулы I для лечения психотических заболеваний. 5 н. и 30 з.п. ф-лы, 1 табл.
Формула

Комментарии