Композиция, обладающая противовоспалительными свойствами, штамм lactobacillus plantarum - продуцент танназы (варианты) и его применения - RU2356942C2
Код документа: RU2356942C2
Чертежи
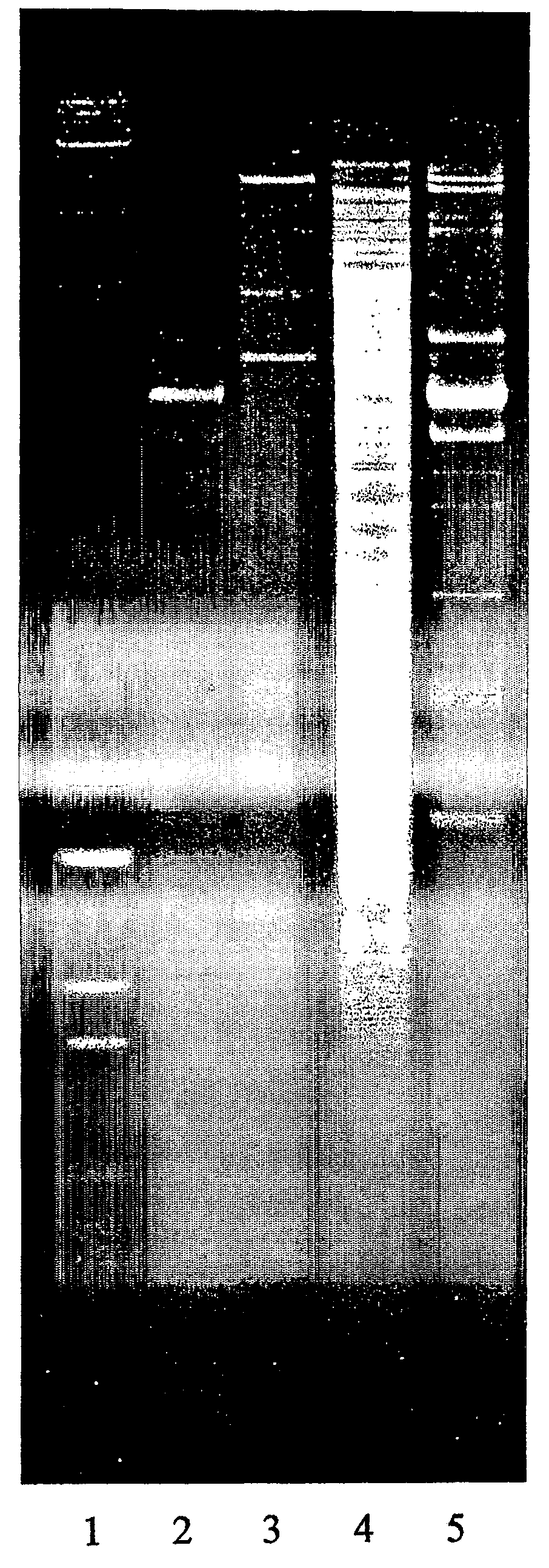
Описание
Настоящее изобретение относится к композиции с противовоспалительными свойствами и контролирующим воздействием на кишечную микрофлору in vivo и консервирующими свойствами in vitro, содержащий необязательно новый, продуцирующий танназу штамм Lactobacillus plantarum с выраженной способностью к адгезии к слизистой оболочке кишечника человека.
Предпосылки
Танины, определяемые как водорастворимые фенольные продукты, способные к преципитации белков из водного раствора, представляют собой встречающиеся в природе соединения. Существуют два класса танинов, гидролизуемые танины, производные галлиевой кислоты и эллаговой кислоты, и конденсированные танины, т.е. проантоцианидины, являющиеся олигомерами и полимерами флаванолов. Танины подавляют рост ряда микроорганизмов и устойчивы к микробным атакам (Chung, K.T., et al. (1998), Tannins and human health: A review. Critical Reviews in Food Science and Nutrition 38: 421-464). Плесень и дрожжи и некоторые аэробные бактерии обычно лучше подходят для деградирования танинов, но анаэробное деградирование также происходит, например, в желудочно-кишечном тракте (Bhat, T.K., et al. (1998), Microbial degradation of tannins - A current perspective. Biodegradation 9: 343-357).
Танины известны как антинутриенты, т.е. они снижают эффективность преобразования организмом усвоенных питательных веществ в новые вещества в организме. Однако также сообщали о благоприятных для здоровья эффектах танинов, т.е. противоонкогенные эффекты, способность понижать кровяное давление и модулировать разные виды иммунного ответа. Вероятно, эти эффекты связаны с антиоксидантными свойствами танинов (Chung et al. 1998). Сообщали, эллаговая кислота представляет собой эффективный антиоксидантный танин с противоонкогенными свойствами. Проантоцианидины представляют собой еще один тип танина с необычайно высокими антиоксидантными свойствами, присутствующие, например, в винограде и оливках. Таким образом, танины, присутствующие в растительной пище в различных концентрациях, сильно влияют на здоровье человека. Принимать большие количества танинов нежелательно, так как они могут вовлекаться в формирование злокачественной опухоли и препятствуют пищеварению, но прием небольшого количества танина правильного типа может являться полезным для здоровья человека, посредством воздействия на метаболические ферменты, иммунномодулирование или другие функции (Chung et al. 1998).
Однако продукты анаэробного разложения многих танинов, вырабатываемые в кишечном тракте, также могут образовывать соединения с полезными эффектами для здоровья (Bhat et al. 1998). Такие продукты разложения представляют собой, например, производные фенилпропионовой и фенилуксусной кислот (Bhat et al. 1998). Эти соединения оказывают противовоспалительное действие при всасывании в ЖКТ. Эти соединения вместе с другими продуктами разложения танинов также обладают широким диапазоном противомикробного действия в ЖКТ, подавляя нежелательные бактерии.
Предшествующий уровень
Большинство видов Lactobacillus не способны разлагать танины, но штаммы близкородственных видов L. plantarum, L. pentosus и L.paraplantarum могут обладать танназной активностью, Osawa, R., et al. (2000), Isolation of tannin-degrading lactobacilli from humans and fermented foods, Applied and Environmental Microbiology 66: 3093-3097.
Некоторые штаммы Lactobacillus plantarum обладают специфической способностью к адгезии к эпителиальным клеткам человека, блокированной в присутствии маннозы, Adlerberth, I., etal., (1996), A mannose-specific adherence mechanism in Lactobacillus plantarum conferring binding to the human colonic cell line HT-29. Applied and Environmental Microbiology 62: 2244-2251.
Сущность изобретения
Обнаружили, что штаммы Lactobacillus plantarum со способностью к адгезии к слизистой оболочке кишечника человека и способные продуцировать танназу при разложении танинов, образуют соединения, противодействующие вредным бактериям в желудочно-кишечном тракте (ЖКТ) и обладают противовоспалительным действием при всасывании в ЖКТ.
На чертеже изображены отдельные фрагменты ДНК, полученные посредством расщепления хромосомной ДНК штаммов Lactobacillus plantarum HEAL 9 (2 трек), HEAL 19 (3 трек), 299v (4 трек) и HEAL 99 (5 трек) при помощи фермента рестрикции EcoRI. В качестве стандарта использовали маркер высокомолекулярной ДНК (BRL) и маркер молекулярной массы ДНК VI (Roche)(1 трек).
Описание изобретения
Настоящее изобретение относится к композиции, содержащей один или несколько штаммов Lactobacillus plantarum или близкородственных видов Lactobacillus, продуцирующих танназу, обладающих способностью к адгезии к слизистой оболочке кишечника человека в сочетании с танином. Указанная композиция in vivo продуцирует соединения, обладающие антимикробным и противовоспалительным действием и in vitro продуцирует соединения с предохраняющим действием.
Также изобретение относится к композиции, содержащей один или несколько продуцирующих танназу штаммов Lactobacillus в сочетании с танином и носителем.
Примеры носителей представляют собой овсяную кашу, ферментированные кисломолочные пищевые продукты, устойчивый крахмал. Для улучшения размножения бактерий и увеличения продукции противовоспалительных или предохраняющих производных, к композиции можно добавлять пищевую клетчатку. Также в качестве носителя можно применять такую пищевую клетчатку как фруктоолигосахариды, галактоолигосахариды, лактулозу, мальтодекстрины, β-глюканы и гуаровую смолу.
Особенно изобретение относится к пищевой композиции, содержащей штамм Lactobacillus, продуцирующий танназу вместе с более или менее чистыми фракциями танина, например, эллаговой кислотой, флавоноидами такими как проантоцианидины и антоцианидины, или лигнаны, или с пищевыми компонентами с богатым содержанием танинов, как, например, овсяные хлопья, ячмень, красный сорго, тонкоизмельченный внутренний корковый слой сосны и сок или вытяжка из винограда, цитрусовых, брусники, черники, черной смородины, клюквы, земляники, малины и плодов шиповника.
Также изобретение относится к фармацевтической композиции, содержащей продуцирующий танназу штамм Lactobacillus, вместе с более или менее чистыми фракциями танина, например, эллаговой кислотой, флавоноидами, такими как проантоцианидины и антоцианидины, или лигнаны, или с каким-либо другим фармацевтически приемлемым источником танина.
Для достижения профилактического или терапевтического эффекта композиции по изобретению содержание танинов предпочтительно должно составлять приблизительно 500-1000 мг в сутки. В случае измельченных плодов шиповника в виде порошка это приблизительно соответствует 100 г, или 4 литра в форме отвара из плодов шиповника.
Танины представляют собой водорастворимые фенольные продукты с различной молекулярной массой, способные осаждать белки из водного раствора. Существуют два класса танинов: гидролизуемые танины, полученные из галлиевой кислоты и эллаговой кислоты, и конденсированные танины, т.е. проантоцианидины, являющиеся олигомерами и полимерами флавонолов.
Таким образом, называемые конденсированными или негидролизуемые танины, являются более устойчивыми к расщеплению микроорганизмами, чем гидролизуемые танины. Как правило, танины содержатся в семенах фруктов, таких как виноград, яблоки, бананы, черная смородина, клюква, малина, земляника, оливки, фасоль, семена сорго, очищенное и пальчатое просо, кока, чай и кофе.
Композиция по изобретению может представлять собой пищевую композицию, где носитель представляет собой пищевой продукт. В фармацевтической композиции носитель должен представлять собой терапевтически приемлемый носитель. Композицию можно назначать среднему потребителю для улучшения показателей здоровья для предотвращения возможного развития заболеваний, таких как инфекций ЖКТ, диабета, воспалительных заболеваний кишечника (IBD), синдрома раздраженной кишки (IBS), злокачественной опухоли или сердечно-сосудистых заболеваний, или облегчение указанных заболеваний.
Фармацевтическую композицию по изобретению можно составлять, в виде например, суспензий, таблеток, капсул и порошков, которые можно вводить перорально. Указанные препараты также можно вводить в виде клизмы.
Настоящее изобретение особенно относится к продуцирующему танназу штамму Lactobacillus plantarum или близкородственным видам Lactobacillus, способным к адгезии к слизистой оболочке кишечника человека, характеризующихся наличием танназной активности, определяемой способом, описанным Osawa и Walsh, в Applied and Environmental Microbiology, Vol. 59, No. 4, April 1993, p. 1251-1252, не претендуя на права на штаммы Lactobacillus plantarum 299, DSM 6595 и Lactobacillus plantarum 299v, DSM 9843.
Предпочтительные штаммы, продуцирующие танназу, принадлежат к штаммам Lactobacillus plantarum и способны выживать в желудочно-кишечном тракте (ЖКТ). Выживание в этом контексте означает, что штаммы способны к метаболизму и размножению (жизни) в ЖКТ в течение определенного времени.
Согласно предпочтительному аспекту изобретение относится к следующим новым штаммам, которые хранили в Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH с 28 ноября 2002 и которым присвоены следующие инвентарные номера: Lactobacillus plantarum HEAL 9, DSM 15312, Lactobacillus plantarum HEAL 19, DSM 15313, и Lactobacillus plantarum HEAL 99, DSM 15316, а также их варианты, имеющие тот же профиль REA.
Новые штаммы выделяли из слизистой оболочки толстой кишки здоровых взрослых людей при помощи селективного культивирования в агаре Рогозы. После этого штаммы характеризовали по REA.
Согласно другому аспекту изобретение относится к применению продуцирующего танназу штамма Lactobacillus plantarum в сочетании с танином для получения лекарственного средства для профилактического или терапевтического лечения сердечно-сосудистых заболеваний, воспалительных заболеваний кишечника (IBD), синдрома раздраженной кишки (IBS), желудочно-кишечных инфекций, диабета, злокачественной опухоли, болезни Альцгеймера или заболеваний аутоиммунного происхождения. Примеры продуцирующих танназу штаммов представляют собой новые штаммы HEAL 9, HEAL 19 и HEAL 99, а также известные ранее штаммы Lactobacillus plantarum 299, DSM 6595 и Lactobacillusplantarum 299v, DSM 9843.
Желательно, чтобы количество продуцирующих танназу бактерий, применяемое в композиции изобретения, составляло не менее чем 109 КОЕ/дозу в сутки.
Согласно другому аспекту изобретение относится к применению продуцирующего танназу штамма Lactobacillus в сочетании с танинами для консервации пищи. Примеры продуцирующих танназу штаммов представляют собой новые штаммы HEAL 9, HEAL 19 и HEAL 99, а также известные ранее штаммы Lactobacillus plantarum 299, DSM 6595 и Lactobacillus plantarum 299v, DSM 9843. Затем указанные штаммы будут продуцировать консерванты прямо в пищевые продукты вследствие деградации танинов. Обеспечение танинами можно осуществлять или посредством добавления в продукт чистыми фракциями танинов или посредством добавления в продукт естественными, менее определенными добавками с высоким содержанием танинов, как, например, плоды шиповника, красный сорго или тонкоизмельченный внутренний корковый слой сосны.
Смеси штаммов утилизирующих танин Lactobacillus и танины можно вводить в терапевтических целях или в качестве поддерживающего воздействия для снижения факторов риска сердечно-сосудистых заболеваний, метаболического синдрома, диабета, воспалительных заболеваний кишечника (IBD), синдрома раздраженной кишки (IBS), желудочно-кишечных инфекций или заболеваний аутоиммунного происхождения.
Штаммы L. plantarum HEAL 9, HEAL 19 и HEAL 99 обладают более высокой способностью к адгезии к клеткам слизистой оболочки толстой кишки по сравнению со штаммом Lactobacillus plantarum 299v, DSM 9843.
Экспериментальная часть
Выделение штаммов
42 различных, только что выделенных штамма Lactobacillus тестировали и сравнивали с хорошо известным исходным штаммом-пробиотиком Lactobacillus plantarum 299v, DSM 9843 по их способности продуцировать танназу, т.е. разрушать танины. Штаммы перечислены в таблице 1 ниже.
Способ отбора
Применяемый способ определения танназной активности описали ранее Osawa и Walsh (1993). Принцип детекции представляет собой то, что продукт разложения танина - метилгаллат - измеряют посредством указанных ниже процедур:
Тестируемые бактерии культивировали в анаэробных условиях на агаре MRS (Merck, Darmstadt, Germany) в течение 2 суток при 37°С, после чего клетки собирали и суспендировали в 5 мл 0,9 мас.%/об. NaCl. Суспензию клеток центрифугировали, ресуспендировали клетки в 10 мл 0,9% NaCl и измеряли поглощение при 620 нм (в качестве стандарта применяли раствор 0,9% NaCl). Суспензию клеток растворяли до того, чтобы поглощение находилось в интервале от 0,1 до 0,6 (спектрофотометр Pharmacia LKB, Novaspec II). После центрифугирования клетки ресуспендировали в 1 мл метилгаллатного буфера (3,7 г/л метилгаллата [Aldrich Chemical Company, Inc., Milwaukee, WI, USA], 4,5 г/л NaH2PO4, pH 5,0 [фильтрованный стерильный]), пробирку инкубировали при 37°C в течение 24 часов. Добавляли один мл буфера NaHCO3 (42 г NaHCO3 на литр, pH 8,6), раствор инкубировали в течение 1 часа при комнатной температуре, после чего измеряли поглощение при 440 нм (буфер NaHCO3 применяли в качестве стандарта). Цвет суспензии определяли визуально.
Чтобы считать танназную активность положительной цвет должен являться коричневым или зеленым. Количественное значение танназной активности получали как отношение между поглощением клеточной суспензии (A620; количество клеток) в начале инкубации с метилгаллатом к поглощению после 24-часовой инкубации с метилгаллатом (A440; окраска свободных галлиевых кислот после воздействия кислорода в щелочных условиях).
Результаты
Результаты определения штаммов Lactobacillus с танназной активностью показаны в таблице 1. Большинство протестированных штаммов не обладали какой-либо танназной активностью. Однако 11 штаммов оказались положительными и представлены в таблице 1.
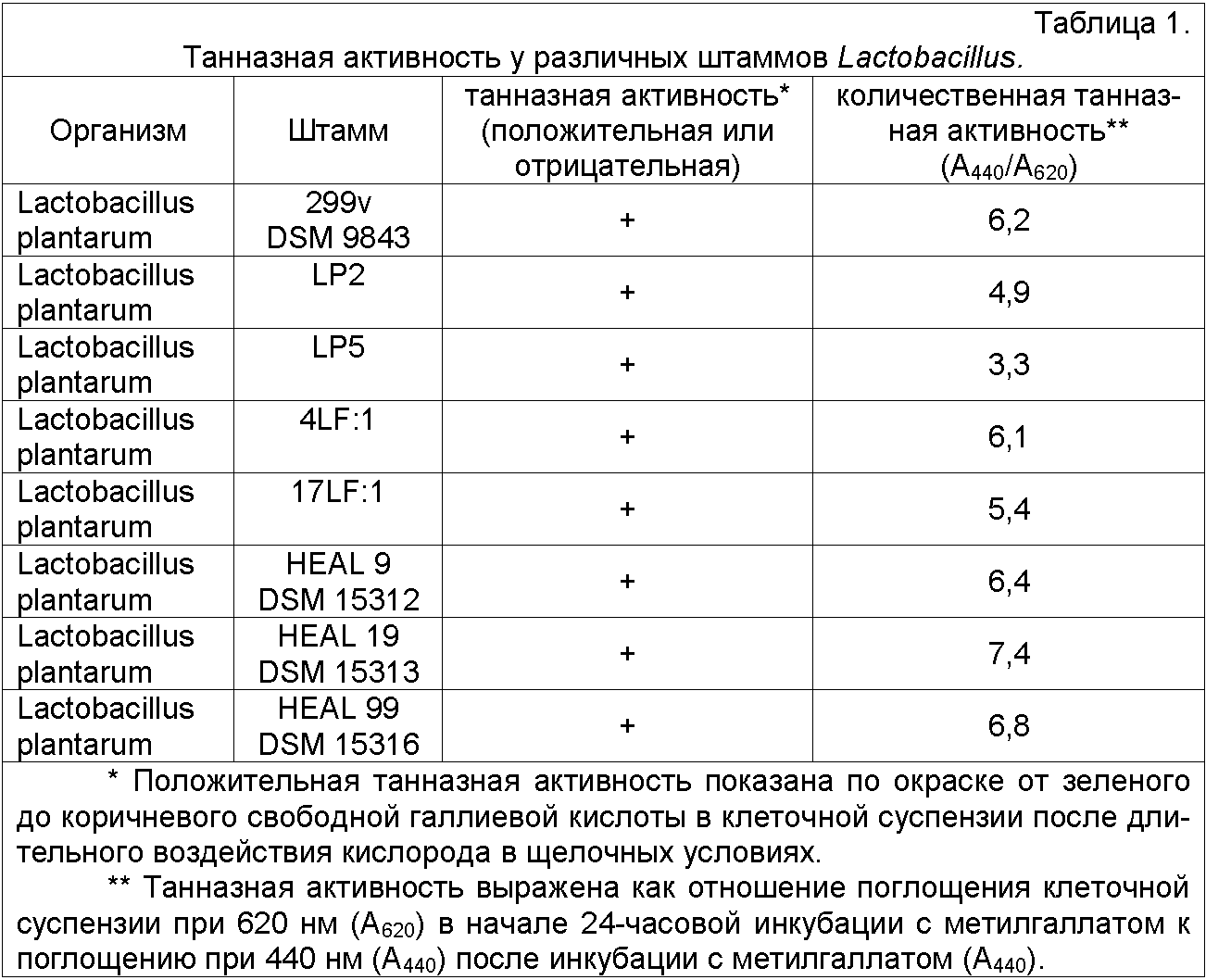
Три из положительных на танназу штаммов L. plantarum обладали повышенной танназной активностью по сравнению с хорошо известным штаммом-пробиотиком Lactobacillus plantarum 299v, DSM 9843, т.е. L. plantarum HEAL 9, L. plantarum HEAL 19 и L. plantarum HEAL 99. Их выделили из слизистой оболочки кишечника здоровых людей.
Генотипическое идентифицирование посредством REA
Штаммы проверяли по профилю расщепления хромосомной ДНК посредством рестрикционно-эндонуклеазного анализа - REA - способ по Stahl M, Molin G, Persson A, Ahrne S & Stahl S, International Journal of Systematic Bacteriology, 40:189-193, 1990, и дополнительно разработанный Johansson, M-L, et al., International Journal of Systematic Bacteriology 45:670-675, 1995. Схематически REA можно описать следующим образом: выделяли хромосомную ДНК исследуемых штаммов и расщепляли рестрикционными эндонуклеазами. 0,75 мкг каждой ДНК отдельно расщепляли при 37°C в течение 4 ч 10 единицами EcoRI и HindIII; каждую эндонуклеазу применяли отдельно. Фрагменты расщепленной ДНК разделяли по размерам посредством электрофореза, применяя покрытые буфером горизонтальные блочные гели. Гели состояли из 150 мл 0,9% агарозы (ультрачистая степень для ДНК; низкой электроэндоосмотичности; BioRad Laboratories, Richmond, USA), были залиты как блочные гели (150 на 235 мм). В качестве стандартов одновременно применяли 0,2 мкг маркера высокомолекулярной ДНК (Bethesda Research Laboratories, MD, USA) и 0,5 мкг маркера молекулярной массы ДНК VI (Roche, Germany). Минимальное искривление полос и максимальную четкость границ достигали за счет внесения образца ДНК в содержащем фиколл буфере для внесения (2 г фиколла, 8 мл воды, 0,25% бромфенола).
Электорофорез проводили при постоянном напряжении 40В в течение 18 часов при температуре 6-8°C. Во время запуска буфер (89 мМ Tris, 23 мМ H3PO4, 2 мМ EDTA натрия, pH 8,3) перемешивали. После этого гели окрашивали в течение 20 минут бромистым этидием (2 мкг/мл), краситель отмывали в дистиллированной воде, визуализировали при 302 нм в УФ-трансиллюминаторе (UVP Inc., San Gabriel, USA) и фотографировали. Данный способ проведения электрофореза дает хорошо распределенные и сравнительно хорошо-разделенные полосы вплоть до молекулярной массы 1,2 × 106.
Результаты анализа представлены на чертеже.
Адгезия к клеткам HT-29
Все 32 штамма L. plantarum, выделенные из слизистой оболочки человека, тестировали по адгезии к клеткам линии HT-29, представляющим эпителиальные клетки карциномы толстой кишки человека при манноза-специфическом связывании (способ, описанный Wold, A, et al, Infection and Immunity, Oct. 1988, p. 2531-2537). Клетки аденокарциномы человека линии HT-29 культивировали в среде Игла с добавлением 10% эмбриональной телячьей сыворотки, 2 мМ L-глутамина, 50 мкг/мл гентамицина (Sigma Chemical Co., Saint Louis, Mo, USA). Через несколько суток после достижения клетками конфлуентности их открепляли при помощи содержащего EDTA буфера (0,54 мМ), отмывали и суспендировали в сбалансированном солевом растворе Хэнкса (HBSS) в концентрации 5 x 106/мл. Бактерии собирали, отмывали и суспендировали в HBSS в концентрации 5 × 109/мл (2 × оптической плотности 1,5 при 597 нм). Клетки, бактерии и HBSS смешивали в соотношении 1:1:3 и инкубировали с переворачиванием в течение 30 минут 4°С. Клетки однократно отмывали ледяным раствором PBS и фиксировали нейтральным забуференным формалином (Histofix, Histolab, Gцtebrog, Sweden). Количество бактерий, прикрепленных к каждой, по крайней мере, из 40 клеток определяли, применяя интерференция-контрастную микроскопию (500 x увеличение, Nicon Optophot, с интерференция-контрастным оборудованием, Bergström Instruments, Göteborg, Sweden), считали среднее количество бактерий на клетку.
Все штаммы, за исключением трех HEAL-штаммов, имели величины в интервале 0,3-14 (адгезия в солевом растворе; соответствующие величины в присутствии метилманнозида составляли 0,5-2,4, соответственно). Большинство штаммов имели величины меньше 10. Результаты приведены ниже в таблице 2.

Тест на экспериментальной модели на мышах
Метод
Пятнадцать мышей Balb/C делили на пять групп (3 мышы на группу) и кормили различными сочетаниями из нормальной пищи измельченных в порошок плодов шиповника (высокое содержание танинов) и танназа-положительного штамма Lactobacillus plantarum 299v. Составляющие смешивали с небольшим количеством воды, чтобы придать кашицеобразную консистенцию. Группы 1 и 2 получали нормальную мышиную пищу, Группа 3 получала нормальную пищу с добавлением измельченных в порошок плодов шиповника (1,6 г в сутки), Группа 4 получала нормальную пищу с добавлением L. plantarum 299v (1010 бактерия на прием) и Группа 5 получала нормальную пищу с добавлением измельченных в порошок плодов шиповника и L. plantarum 299v. Мышей до индукции повреждения ишемия/реперфузия кормили один раз в сутки в течение 6-8 суток. Повреждение производили по следующему протоколу для вскрытия: мышам в качестве подкожной анестезии вводили 0,15 мл раствора Кетамин/Ксилазин (7,85 мг/мл и 2,57 мг/мл, соответственно). Производили срединный разрез брюшной стенки и пережимали верхнюю брыжеечную артерию, применяя атравматичную сосудистую петлю и кровоостанавливающий зажим. Вводили 1,0 мл PBS в брюшную полость для восстановления жидкости. Перед удалением сосудистой петли и кровоостанавливающего зажима и наблюдением за немедленной реперфузией артерия оставалась окклюдированной в течение 30 минут. Брюшную полость закрывали, используя последовательный викриловый шов 3-0. Животному позволяли пробудиться от анестезии, убирали с подогреваемого столика и помещали обратно в клетку. Через 4 часа и 15 минут животному снова вводили анестезию, образцы тканей и кала получали в следующем порядке и помещали в предварительно взвешенные пробирки: ткань печени, ткань брыжейки подвздошной кишки, стул слепой кишки для получения бактериологических образцов и ткань слепой и подвздошной кишки для колориметрического анализа перекисного окисления липидов, и ткань слепой и подвздошной кишки на гистологическое исследование. Образцы для бактериологического определения взвешивали и помещали в среду для заморозки и немедленно замораживали при -70°C. Образцы для колориметрического анализа (LP0586) промывали в PBS, взвешивали, гомогенизировали, делили, после чего немедленно замораживали при -70°C.
Методы анализа
Бактериологическое определение выполняли, определяя количество жизнеспособных микроорганизмов при инкубации в анаэробных условиях (BBL Gas Pak Plus, Becton Dickinson and Company, Sparks, MD, USA) на агаре Рогозы (Merck, Darmstadt, Germany) при 37°C в течение 3 суток, VRBD-агаре (Merck, Darmstadt, Germany) при 37°C в течение 24 часов и агаре Brain heart infusion (BHI; Oxoid, Basingstoke, Hampshire, England) при 37°C в течение 3 суток. Определение количества жизнеспособных микроорганизмов на BHI также проводили в анаэробных условиях.
Колориметрический анализ перекисного окисления липидов проводили при помощи спектрофотометра и набора для анализа Bioxytech® LPO-586TM (OxisResearchTM, Oxis Health Products, Inc., Portland). Анализ проводили в соответствии с описанием производителя.
Перекисное окисление липидов представляет собой хорошо доказанный механизм клеточного повреждения и используется как индикатор окислительного стресса в клетках и тканях. Пероксиды липидов нестабильны и распадаются с формированием сложных рядов соединений, включающих реакционно-способные карбонильные соединения. При распаде пероксиды полиненасыщенных жирных кислот образуют малоновый диальдегид (MDA) и 4-гидроксиалкенали (HAE). Измерение MDA может быть использовано как индикатор перекисного окисления липидов. LPO-586TM представляет собой колориметрический анализ, предназначенный для количественного определения MDA и основанный на реакции хромогенного реагента N-метил-2-фенилиндола с MDA при 45°C. Одна молекула MDA взаимодействует с двумя молекулами N-метил-2-фенилиндола, образуя стабильный хромофор с максимальным поглощением при 586 нм.
Результаты
Перекисное окисление липидов, измеряемое в виде малонового диальдегида (MDA) на грамм ткани толстой кишки, измеряли у обрабатываемых разными способами мышей, а результаты представлены в таблице 3. Ишемия/реперфузия повышала MDA. Предварительное добавление мышам в пищу измельченных в порошок плодов шиповника (группа 3) или L. plantarum 299v (группа 4) снижало MDA по сравнению с положительным контролем (группа 2). Однако воздействие совместной предварительной обработки измельченными в порошок плодами шиповника и L. plantarum 299v снижало MDA намного более выражено (группа 5).

Результаты определения количества жизнеспособных микроорганизмов представлены в таблице 4. Повреждение ишемия/реперфузия повышало количество жизнеспособных микроорганизмов на агаре Рогозы и BHI в 10 раз (сравнение группы 1 и группы 2). Только измельченные в порошок плоды шиповника (группа 3) приводили к более низкому количеству живых микроорганизмов по сравнению с другими пищевыми альтернативами. Группа, получавшая L. plantarum 299v и измельченные в порошок плоды шиповника (группа 5), показала такое же количество живых микроорганизмов как группы с повреждением ишемия/реперфузия без измельченных в порошок плодов шиповника (группы 2 и 4), за исключением Enterobacteriacea, которых было меньше. Однако количество живых микроорганизмов на субстрате, позволяющее расти лактобактериям (в группе 5), превалировало у L. plantarum 299v.

Заключение
Танины плодов шиповника снижали общее количество бактерий в кишечнике мышей с повреждением, но когда мышам вводили L. plantarum 299v одновременно с плодами шиповника, снижение ослаблялось, а индуцированное таннином снижение дополнялось L. plantarum 299v. Таким образом, танины поддерживали баланс кишечной флоры в пользу штамма-пробиотика. Введение порошка плодов шиповника снижало перекисное окисление липидов, но этот эффект усиливался в присутствии L. plantarum 299v одновременно с порошком плодов шиповника.
Штаммы L. plantarum HEAL 9, HEAL 19 и HEAL 99 обладают более высокой танназной активностью, чем L. plantarum 299v, и в дополнение более высокой способностью к адгезии к клеткам слизистой оболочки толстой кишки человека, чем L. plantarum 299v.
Реферат
Пищевая или фармацевтическая композиция, обладающая противовоспалительными свойствами, содержит один или несколько штаммов Lactobacillus plantarum, выбранных из группы, состоящей из штамма Lactobacillus plantarum DSM 15312 - продуцента танназы, штамма Lactobacillus plantarum DSM 15313 - продуцента танназы, штамма Lactobacillus plantarum DSM 15316 - продуцента танназы, и танин. Применяют вышеуказанные штаммы Lactobacillus plantarum в сочетании с танином для получения лекарственного средства для профилактического или терапевтического лечения сердечно-сосудистых заболеваний, диабета, воспалительных заболеваний кишечника, синдрома раздраженной кишки, желудочно-кишечных инфекций, злокачественной опухоли, болезни Альцгеймера или заболеваний аутоиммунного происхождения, а также для консервирования пищевых продуктов и для получения пищевого продукта. Это обеспечивает более высокую танназную активность и более высокую способность к адгезии к клеткам слизистой оболочки толстой кишки при употреблении композиции. 7 н. и 2 з.п. ф-лы, 1 ил., 4 табл.

Комментарии