Способ получения производных фенилпиперидина или их солей - SU452095A3
Код документа: SU452095A3
Описание
(54) СПСЮОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ИХ СОЛЕЙ ФЕНИЛПИПЕРИДИНА Ш111
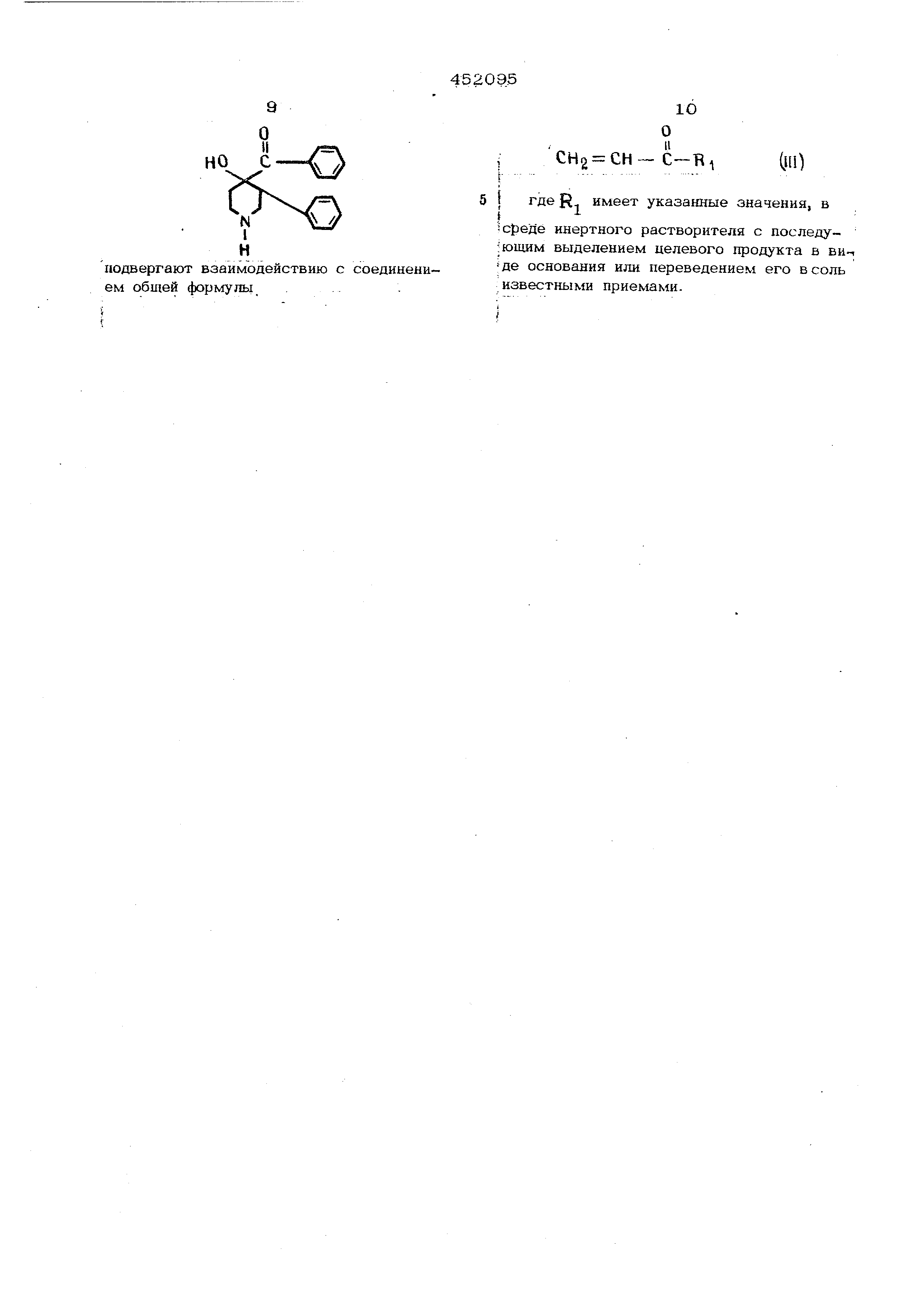
нение формулы (Ш) и подвергают смесь реакции обмена продолжительное время, например 2-10 час, при повышенной температуре , предпочтительно от до температуры кипения реакщ1онной смеси; при необходимости процесс проводят в присутствии сильноосновного конденсирующего средства, например гидроокиси бензилтриметиламмония .
Полученные соединения могут быть переведены в соль известными приемами.
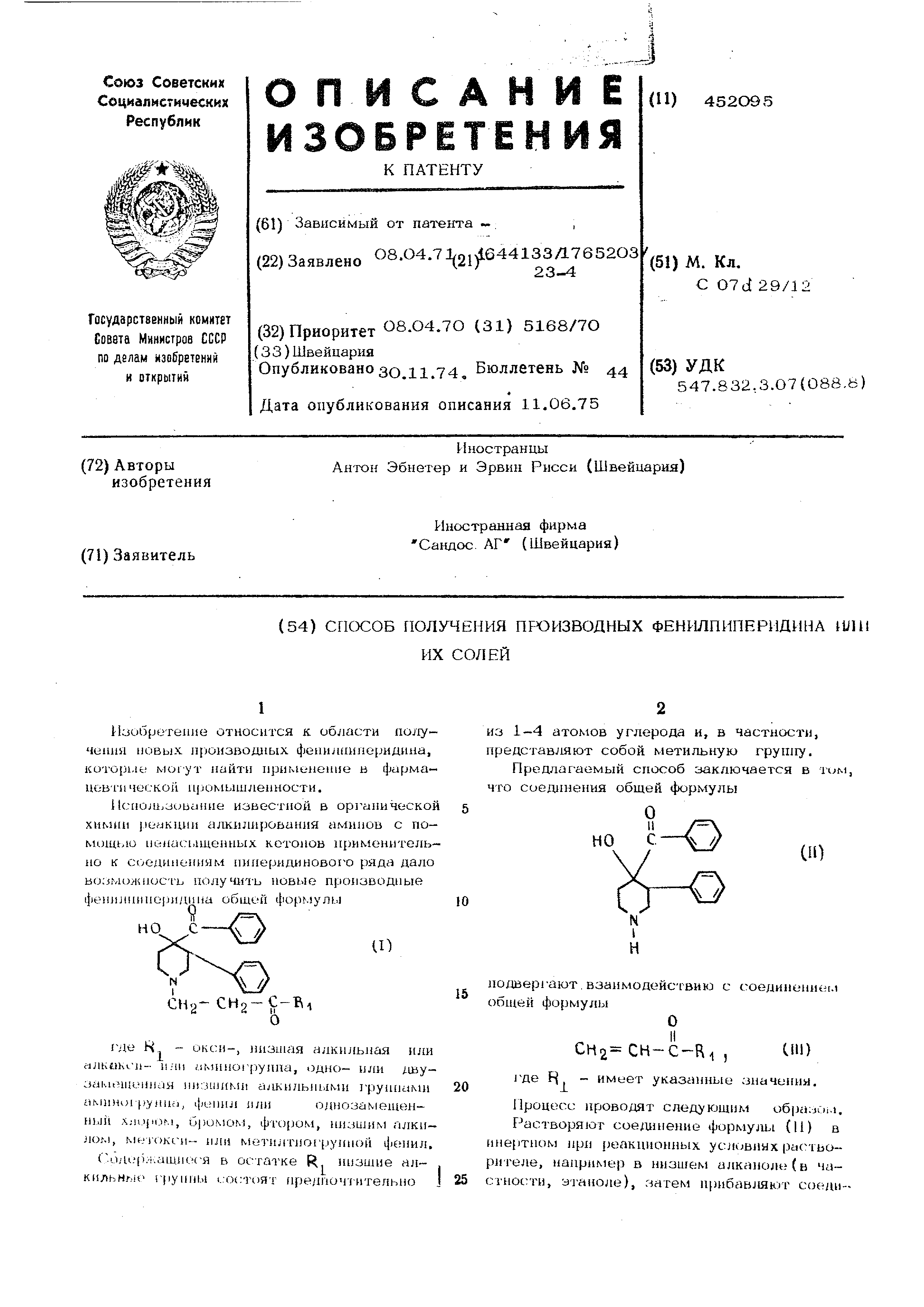
Пример. 4-(-4-Бензоил-4-гидрокси-3-фенилпиперидино )-2-бутанон (1У).
Раствор 20,0 г 4-бензоил-4-гидрокси- -3-фенилпепиридина и 5,0 г метилвинилкетона в 20О мл этанола разогревают 3 час до кипения, а затем выпаривают досуха. Хромато1 рафируют остаток на силикагеле, причем элюирую - реакционный продукт смесью хлороформа и метанола 99:1.Д;ш превращения основания в гидробромид рас-рворяют остаток элюирования в этаноле, прибавляют вычисленное количество смеси бромистого водорода и ледяной уксусной кислоты и дают смеси кристаллизоваться. После перекристалл11зации из этанола получают чистый г ид|эобромид соединения формулы С1У) с т. пл. 167-169°С.
А, Исходный 4-бензоил-1-метил-3-фе- ннлппперидин получают следующим образом.
10,1 г ма1ния наслаивают с 20 мл аб- силютио1Чз тстрагидрофурапа и травят не- ск1 шжими кристаллами йода и 0,5 мл этил (лб|.юмида. Затем прибавдшют раствор (35,0 г бромбенэола в 8О мл абсолютного тет(агидрос{)урана по каплям так, чтобы реакция не прекращалась. Затем кипятят реакционную смесь еще 2 час с обратным холодильником , охлаждают ее до S-C и в течение 15-20 мин добавдшют при этой тем- нературе раствор ЗО,О г этилового эфира 1,2,3 ,в-тетра1-11Дро-1-мет1ии13оникотиповой кислоты в 5О мл абсолютно1Х) тетра1Ч1дрофу| а11а . Н течение 30 мин нагревают смесь до кпионкя, охлаждают до и при инIeijCHBHOM не))емешивании выливают ее в раствор во г хлорида аммония в 4О мл ле- дяпой вод.1. Несколько раз экстра1 ируют полученную водную суспензию метиленхло- |)11дом, и при взбалтывании извлекают экстракч с помощью 2 н. раствора солянойкисЛПТ1Д . Прибавлением концентрированного наrpoBoio щелока доводят кислые растворы при охлаждении до щелочной реакц и1, экст- 1агирую их метиленхлоридом, сушатэкст|iiiKii .i над карбонатом калия и выпаривают их при пониженном давлении. ПерегО1ШЮТ
остаток в высоком вакууме, причем сперва отделяется этиловый эфир 1-метил-З-фенилизоникотиновой кислоты с т. кип. 1ОО110 С (0,О5 мм рт. ст.) как головной погон, потом 4-бензоил-1-метил-3-фениллиперкрмн прн leS-lSO-C (0,05 мм рт. ст.). Прибавлением бромводорода к cвoбo ь ному основанию получают гидробромид 4-бензоил-1-метил-3-фенилпиперидина с т. пл. 243-244°С (разложение).
Б. 4-Б ензоилг4-бром-1 -метил-3-фени лпиперидин .
К раствору 165,7 г гидробромида 4-бензоил-1-метил-3-фени/шиперидипа в 1700 мл ледяной уксусной кислоты прибавляют в течение 5 час 147 г брома при температуре 10О С, после это1х перемещивают исходную смесь еще 1 час при той же iсамой температуре. Выдерживают реакционную смесь одну ночь при комнатной температуре , выпаривают ее под пониженным давлением при температуре и прибавляют ацетон к остатку. После выкристалли зовывания в холодильнике получают чистый гидробромид 4-бензоил-4-бром-1-метил-3-фенилпиперидина с т. пл. 163-164°С (легкое разложение).
В. 4-Бензоил-4-гидрокси-1 -метил-3-фенилпипери ди п..
К раствору 23,3 г натрия в 700млме танола прибавляют 148,4 г гидробромида 4-бензоил-4-б ром-1-мети л-3-фенилпиперидина по порциям при охлаждении льдом. Пе- ремещивают 22 час при комнатной темп ратуре и, прибавляя концентрированную соляную кислоту но каплям, доводят реакционную смесь до кислой по конгореакпии, Перемещивают еще 15 мин и затем вышривают метанол при попижепном давлении и 60 С. К остатку добавляют 2O%-ныйpacJ вор карбопата ка;шя и после STOIXJ экст1загируют несколько раз хлоро(}юрмом. Сущат соединенные экстракты хлорсх})орма над сульфатом магния, фиш труют и сгущают их под пониженным давлением до появления признаков кристаллизсщии. Выдерживают концентрат одну ночь в холодильнике и получают чистый 4-бепзоил-4-гидрокси-1-метил-3-фенилпиперидип с т. пл. 1 67169 0 .
Г. 4-Апетокс и-4-бензои л-1-мети л-3-фени jni ипериди н.
197,4 г 4-бензоил-4-гидрокси-1.-метил-З-феинлпиперидина растворяют в 2 ООО мл ангидрида уксусной кислоты при 9ОЧ:: и медленно разогревают pacTBOjj до16(3С. Охлаждают реакционную смесь примерно до lOO С и перегонкой гфи разрежении водоструйным насосом удаляют избыточный ан- гидрид уксусной кислоты. Растворяют вязкий остаток в хлороформу и извлекают его, путем взбалтывания с 1омрщью холодного, разбавленного раствор гидроокиси натрия. Сушат оргшшческий слой над сульфатом магния, выпаривают растворитель под пониженным давлением и перекристаллизовывают остаток один раз из, приблизительно, 2000 мл этанола. Получают чистый 4-аце- токси-4-бензоил-1 метил-3-фенилпиперидин с т. пл. 158-159°С. Д. Этиловый эфир 4-ацетокси 4-бензоил-3-фенилпиперидинкарбоновой кислоты. К раствору 206,7 г 4-ацетокси-4-б ьзоил-1-метил-3-4 )еши1г(иперидина в 2000м абсолютного бензола добавляют 392 мл этилового эфира хлормуравьиной кислоты и нри перемешивании разогревают реакционную смесь 16 час до кипения. Три раза экстрагируют, сушат органическую фазу над сульфатом магния и выпаривают досуха После кристал/шзации остатка из бензола получают чистый этиловый эфир 4-ацетокси 4-бензоил-3-фенилпиперидинкарбоновой кислоты с т. пл. 125-126 С, Е. 4-Бензо1Ш-4-гидрокси-3-фенилпиперидин . 216,1 г ЭТИЛОВ01Х) эфира 4-ацетокси4-беизоил-3-феш1лпилерядннкарбоновой кислоты суспендируют в смеси из 15ОО мл концентрированной соляной кислоты ибООм воды и при перемешивании разогревают суспензию 72 час до кипения. Отфильтровывают выделяющийся после охлаждения реакционной смеси продукт, перекристаллизовывают его еще раз из этанола и получают чистый гидрохлорид 4-бензоил-4-гидрокси- -З-фешишипериднна с т. пл. 236-237 С. Пример 2. Амид 3-(4-бензоил-4-гидрокси-3-феш1Л1П (перидино)-пропионовой кислоты (У). Смесь из 2 О,О г 4-бензоил-4-гидрокси-3-фенилпиперидина и 5,1 г амида акриловой кислоты в 2ОО мл этанола нагревают 6,5 час при перемешивании до кипения. Выпаривают реакционную при пониженном давлении досуха и выкристаллизовывают остаток из смеси этанола и петролейногчэ aijjnpa. После повторной перекристаллизации из этанола получаюг шстое соед11ненпе с т. ил. 151-151,5°С. Пример 3. 5-(4-Бензо1Ш-4 ГидрОг кс11-3-)е11Илп(1яеридино)-2,2-диметил-3- -пентанон (У 1 ), Рартвор 14,1 г 4 бензоил-4-гидрокси- З-фенилгшперидиыа и 6,3 г треа -бути ши- нилкетона в 2ОО мл этанола разогревают 2 час с обратным холодильником до кипения и затем выпаривают его досуха. Раст- : воряют остаток в простом эфире, прибавдшют вычисленное количество бромисто1хз водорода в ледяной уксусной кислоте и опять вьшаривают растворители. Два раза перекристаллизовывают полученный сырой гидробромид из этанола и получают чистый гидробромид соединения (У1) с т.пл. 187il88 ,5°C. Пример 4. 5-(4-Бензоил-4-гидрокси-3-фенилпиперидино )-3-пентанон ( У11). 4-Бензоил-4-гидрокси-3-фепилпиперид11И подвергают реакции обмена с этилви)илке- , тоном по примеру 3. Т. пл. гидрохлорида соединения (УП) 185-187°С (разложение, из этанола. П р и м е р 5. 6-(4-Бензо1Ш-4-гидрокси-3-фенилпиперидино ) -2-.метил-4-гекса- нон (УШ). 4-Бепзрил-4-гидрокси-З-фенилпинеридин подвергают реакции обмена с 2-метилпропи;тинилкетоном по 1фимеру 3. Т. пл, гид- рохлорида соединения (yilJ) 162-164°С (легкое разложение, из этанола). П р и м е р 6. Этиловый эфир 3-С4-бензоил-4-гидрокси-3-4 )е1шл-Ш1перядиио) -пропионовой кислоты (IX). 4-Бензоил-4-гидрокси-3-фени;типериди11 подвергают р акщ1и обмена с этиловым })iiром акриловой кислоты по примеру З.ЧЧил. гидрохлорида соединения (IX) 205-20G°( (из эа анола). П р и м е р 7. 3-(4-Бензоил 4-гидрокси-3-фенилпи11ерндино )-пропииао1зая кис-лота (X). .4-Бензош -4-гчщрокси-3-фенилпи11е})идни подвергают реакции обмена с акриловой кислотой по примеру 3. Продолжи голыюсп. реакции 15 час нри температуре кипения. Г. пл. гидрохлорида соединения (X) 178179 ,5 С (из воды). При м е р 8. 3-(4-Бепзо1ш-4-1-нд|1окси-3- (|)еншп1иперидина)-1Ч-метил11ро11иона-МИД (XI). 4-Бензоил-4-гидрокси-3-t ieHnjuuiiie)iiдин подьергают реакции обмела с -мечи--. ламидом акриловой кислоты но iiinir. ,Ч. Продолжитешэность реакции 15 час при температуре ки11е ия. Т. iu. соедилекии (XI) 193-19б : (из мегаиола). П р и м е р 9. 3-(4-В ;нзонл-4--г11Л|)С.| кcи-3-{}JeниJП llпepидииo)- N -диэчилирошШ намид (ХП). 4-Бензоил-4-гидрокси-3-фенилпиперидин подвергают реакции обмена с N -диэтиламидом акриловой кислоты по примеру 3Продолжительностьреакции 15 час при температуре кипения. Т. пл. гидрохлоридмоногидрата соединения (ХП) 110-115°С (из воды). Пример 10. 5-(4-Бензоил-4-гидрокси-3-фенилпиперидино )-2-метил-3-пен- танон (XIU). 4-Беизоил-4-гидрокси-3-фени/типериди подвергают реакции обмена с изопропилвинилкетоном но примеру 3. Т. пл. гид- рохлорида соединения () 193-195 С (из.эгаиола). Пример 11. 3-(4-Бензоил-4-гидрок (:и-3-фенилпиперидино)-пропиофенон (Х1У). 4 Бензоил-4-гидрокси-3-фенилпипериди подвергают реакции обмена с фени;шини; кетоном по примеру 3. Т. пл. гидрохло- риди соединения 182-184 С (из этанола) П р и м е р 12. 3-(4-Бeнзoил-4-гидpoкcи-3-фе11илпиперидино )-II. -метоксипро- ; пиофенон (ХУ). j 4-Бопзоил-4-гидрокси-З-фенилпипери:дин подвергают реакции обмена с п-метокcифeниJгвilнилкeтoпoм по примеру 3. Т.пл. 1-идробромида соединения (ХУ) 17О-172 С (и.ч 3r;niOJUi). I II р и м е р 13. 3-(4-0епзоил-4-гидрокси-3-1 ))ени;ти11еридино)-п-ф1Орпропиофенон (ХУ 1). 4-Бепзоил- -1Ч1дрокси-3-4)ени1пп1пери- Д41Н подво.)гают реакции обмена с n-cjjropijjeniijiBHHiuiKercJHo .M по примеру 3. Т. ал. Гилроброкпща соединения (ХУ1) 11бд: 1 (из этанола). 11 р и м е {J 14. 3-(4-Бепзоил-4-1-идрок1;и-3-фепилпи11ерпди1ю )-п..хлорпро1П1рфе- ион (ХУ11). -1-Бен:1оил 4-гидрокси-3-|}|енилпи перидин подьи л-ак)г реакции обмена с п-х:лор фупилвинилкегоном по примеру 3. Г. ил. гидроб ю.мида соединения (ХУИ) 119 .121 С (из этанола). 11 р и м е р 15. 3-(4-Веп:.юил-4 идрок (-и-.3-фепил1П1Иеридино)-п-брог,П1})опио4|енон (ХУ111). .10ил..-4-1идрокс-и.--3-фенилпиперидин iO)itit-(j -;iioi- реакции обмена с п.-.5р()мфенилliiuiiiJiKeioHOM но примеру 3. Г. пл, гидре)tipoMUiii 1:.)1,ЛИнеН11и (ХУ1И) 177 С. (из эга П р и м е р 16. 3-(4-Бензоил-4-гид-. рокси-3-фенилпиперидино)-м-меток сипропиоф/ено .н (XIX). 4-БензЬйл-4-гидрокси 3-фени:П1ицерилин подвергают реакции обмена с м-метоксифе- ни;юинилкетоном по примеру 3. Т. пл. гидробромида соединения (XIX) 165-166,5 С из этанола). Пример 17. 3-(4-Бeнзuил 4-rид- poкcи-3-фенилпиперидино)-.м-метилпронио- фенон (XX). 4-Бензоил-4-гидрокси-3-фeниJпiипepидин подвергают реакции обмена с м-толи;шинилкетоном по примеру 3. Т.пл. j nnpo- бромида соединения (XX) 163-164 С (из смеси этанола и простого эфира). Пример 18. 3-(4-Бензаил-4-окси-3-4 )енилпиперидино)-п-метилтпопропиофенон (XXI). 4-Бе1 зоил-4-окси-3-фенилпиперидин подвер ают взаимодействию с п-метилтио.-. фени;шинилкегоном по 1фимеру 3. Г. нл. гидрохлорида соединения (XX Л j 17 9-1 80 (; (разложение из этанола). Предмет и з о б р е i- е н и я Способ получения производных 1.(л;нилпиперидина общей CH -CH2--C R, где H, . - ок(.;и-,пи;илая aJlкиJП.ИilЯ, алкок - си.- или aMHHorfjynuti, одно- или двузамещенная низпшми алк1 Л1Л1Ь ми гру1П1ами аминогруппа , фени.(1 или одпо.замешенный ипо- ром, бромом, фгором, НИ31ПИМ аЛКИЛОМ, метокси- или меги;п-иогруп 1ой фенил, или их солей, о т п и ч а ю и1 и и с я тем, что соединение общей



Реферат

Формула


Комментарии