Использование микробных сообществ для лечения человека и животных - RU2758387C2
Код документа: RU2758387C2
Чертежи


Описание
Область, к которой относится изобретение
Настоящее изобретение относится к смеси бактерий, принадлежащих по меньшей мере к 6 или 7 различным и специфическим видам бактерий, предпочтительно, для применения в целях профилактики или лечения желудочно-кишечных расстройств. Более предпочтительно, указанную смесь бактерий культивируют в ферментере перед введением указанной смеси индивидууму для профилактики или лечения указанного расстройства.
Предшествующий уровень техники
Экосистема кишечника человека и животного состоит из множества различных сред обитания и метаболических ниш, которые колонизуются так называемыми микробиотами, содержащими более чем 1011микроорганизмов на грамм сырой массы содержимого, преимущественно анаэробов (Macfarlane & Macfarlane, 1997). В настоящее время хорошо известно, что микробиом кишечника человека или животного играет важную роль в сохранении здоровья и самочувствия человека благодаря выделению энергии, модуляции иммунной системы и вырабатыванию резистентности к колонизации условно-патогенных микроорганизмов (Fuller & Gibson, 1997; Cummings & Macfarlane, 1997). Существуют доказательства того, что взаимодействие бактерий и их метаболитов со слоем слизистой и/или со стенкой кишечника является важным фактором (Barnett et al., 2012). Несмотря на то, микробиом кишечника, как правило, остается стабильным в течение длительного периода времени, однако, его состав меняется в зависимости от внешних условий, таких как изменение режима питания, прием антибиотиков, ужесточение санитарных мер и стресс. Это приводит к несбалансированным состояниям желудочно-кишечного тракта, называемым дисбактериозом (Clemente et al., 2012). Дисбактериоз характеризуются умеренными или тяжелыми нарушениями состава нормального микробиома кишечника, что приводит к исчезновению ключевых видов микроорганизмов, к утрате специфических микробных функций и, как следствие, к нарушению модуляции активности стенки кишечника. Это может приводить к колонизации патогенных микроорганизмов и вызывать диарею или некрозирующий энтерит (Sekirov et al., 2008). Одной из тяжелых форм такого патогенеза является CDAD (диарея, ассоциированная с Clostridium difficile), лечение которой методами классической терапии антибиотиками все чаще и чаще не дает нужного результата. Другими последствиями микробного дисбактериоза может быть нарушение иммунного ответа, приводящее к хроническому воспалению (Willing et al., 2009) или к пищевым аллергиям, или увеличение проницаемости кишечника, питательная мальабсорбция или даже бактериемия. Побочные эффекты дисбактериоза в отношении микробной функциональности и физиологии стенки кишечника могут, таким образом, подорвать здоровье человека. На самом деле, запор, СРК, ВЗК, резервуарный илеит, метаболический синдром, ожирение, диабет, сердечно-сосудистые заболевания, психические состояния, нарушение когнитивной функции, нейродегенеративные заболевания, различные виды рака (например, рак толстой кишки), воспаление женских половых органов, CDAD, ревматизм или ревматоидный артрит ассоциируются с изменениями активности/состава микробиоты кишечника. Поэтому совершенно очевидно, что дисбактериоз необходимо предупреждать или устранять при его появлении.
Если дисбактериоз связан с присутствием патогенов, то очевидной стратегией, используемой для удаления опасных для здоровья микроорганизмов, является применение антибиотиков. Однако, в последние десятилетие широко распространенное и неправильное использование антибиотиков широкого спектра привело к резкому повышению резистентности к антибиотикам (Brandl et al., 2008). Кроме того, антибиотики также уничтожают природные кишечные микроорганизмы, многие из которых выполняют важные функции и приносят пользу для здоровья, то есть, препятствуют развитию дисбактериоза. В результате, за последние 2 десятилетия было проведено огромное количество исследований по поису полезных пищевых продуктов, а в частности, по разработке пребиотиков и пробиотиков. Хотя концепция получения пребиотиков является привлекательной, поскольку она относится к пищевой модуляции природных кишечных микроорганизмов, которые уже адаптировались к хозяину (Van Loo et al., 1999), однако, такая концепция используется, главным образом, в профилактических целях. Для терапевтического применения, в случае существенного нарушения кишечного микробиома было бы больше пользы от внедрения ключевых видов микробов, а не от получения субстратов, которые оказывают благоприятное воздействие на полезные для здоровья виды, но которые реже встречаются или даже отсутствуют у больного человека. Возможным решением этой проблемы является введение жизнеспособных, содействующих укреплению здоровья микроорганизмов, называемых пробиотиками (Lannitti & Palmieri, 2010). Пробиотические продукты, в основном, состоят из 1 или двух не связанных между собой штаммов микроорганизмов (в основном бактерий, продуцирующих молочную кислоту) со специфической функциональностью. Однако, выживание пробиотических штаммов в жестких условиях верхнего отдела пищеварительного тракта является проблематичным, и конкуренция с огромным природным микробиомом почти отсутствует. Тем не менее, концепция введения новых видов микроорганизмов в кишечник с ослабленной экосистемой набирает обороты в последние годы за счет применения фекальных микробных трансплантатов (FMT) (Khoruts et al., 2010). Это способствует передаче фекальной микробной суспензии от здорового донора к больному реципиенту. Эта форма бактериотерапии применяется, главным образом, для лечения резистентных к антибиотикам инфекций и дает положительный эффект в 90% и более случаях. FMT в настоящее время применяется для лечения многих других патологий, которые вызываются желудочно-кишечным дисбактериозом (болезнь Крона, ожирение, синдром раздраженного кишечника). Считается, что FMT может эффективно работать в том случае, когда наблюдается серьезный недостаток одиночных пробиотических штаммов. Тем не менее, недостаточно охарактеризованная природа фекальных трансплантатов ассоциируется с риском передачи инфекционных заболеваний, и в настоящее время возникают вопросы по поводу их широкого применения при менее острых и опасных для жизни патологий (De Vrieze 2013).
В начале 2013, альтернатива использованию трансплантатов фекальных микроорганизмов появилась в публикации научной статьи (Petrof et al., 2013) и в патентной заявке WO2013037068: «Method for treatment of disorders of the gastrointestinal system» - («Метод лечения расстройств желудочно-кишечного тракта»), где описано использование синтетической смеси микробов, которые были выделены у человека, исходя из их культуральных свойств и использованы в качестве терапевтического средства для лечения CDAD. Такой продукт также состоит из известной серии микроорганизмов, которые позволили бы решить проблемы, связанные с передачей заболеваний от фекальных трансплантатов, при соблюдении критериев QPS. Однако, смешивание микроорганизмов друг с другом не гарантирует их взаимодействие между собой и заполнение ими функциональных ниш, которым требуются микробные сети. Следовательно, стабильность продукта, стандартизация и выполнение важных функций не могут быть гарантированы.
В патентной заявке WO2014145958A2 (Network-based microbial compositions and methods) (Микробные композиции и методы на основе микробных сетей) предлагается введение млекопитающему, нуждающемуся в эффективном количестве терапевтической бактериальной композиции, множества выделенных бактерий или очищенного бактериального препарата. Множество выделенных бактерий или очищенный бактериальный препарат способны образовывать так называемую экологическую сеть. Для этого препарата, бактерии выбирают на основе геномной информации и вводят млекопитающему в виде набора штаммов, принадлежащих к отдельным сообществам.
В публикации Becker et al. (2011) описано сообщество, состоящее из 8 различных штаммов: Anaerostipes caccae, Bacteroides thetaiotaomicron, Bifidobacterium longum, Blautia producta, Clostridium butyricum, Clostridium ramosum, Escherichia coli, Lactobacillus plantarum. Это сообщество обозначается SIHUMIx (Упрощенная расширенная человеческая микробиота). Это искусственное сообщество микроорганизмов было протестировано в исследованиях на крысах путем сравнения микроорганизмов у крыс, инокулированных SIHUMIx, с микроорганизми, присутствующими у обычного человека и у неинфицированных крыс. Авторы утверждают, что такое сообщество является репрезентативным для микробиоты, присутствующей в толстой кишке человека, с точки зрения состава и функциональности. Эти сообщества микроорганизмов развивались в зависимости от возраста крыс, но с течением времени, их состав становился стабильным.
Van den Abbeele et al. (2013) предположили возможность создания сообществ, разлагающих гликаны, с использованием обычных ферментеров in vitro, которые могут быть инокулированы соответствующими ключевыми видами и смесью микроорганизмов, обнаруживающих симбиотический рост на минимальной среде. После инокуляции и стабилизации может быть достигнуто такое отдельное сообщество микробных сетей, несущих конкретные функции и продуцируемых в больших масштабах.
И наконец, Newton et al. (1998) использовали анаэробные хемостаты для создания воспроизводимых определенных бактериальных сообществ, включающих 14 различных сахаролитических видов и видов, сбраживающих аминокислоты (то есть, Bifidobacterium longum, Bif. adolescentis, Bif. pseudolongum, Bif. infantis, Bacteroides thetaiotaomicron, Bact. vulgatus, Lactobacillus acidophilus, Enterococcus faecalis, Ent. faecium, Escherichia coli, Clostridium perfringens, Cl. butyricum, Cl. innocuum, Cl. Bifermentans) для исследования влияния сульфат-восстанавливающей бактерии (SRB) Desulfovibrio desulfuricans на другие кишечные микроорганизмы.
Однако, все еще существует необходимость в разработке альтернативных и специфических смесей бактериальных видов, которые могут быть эффективно использованы для профилактики или лечения желудочно-кишечных расстройств. Более того, абсолютно неизвестно, будут ли предварительно адаптированные смеси при их введении обладать такими же терапевтическими свойствами, как и отдельные сообщества и предварительно неадаптированные смеси одних и тех же видов бактерий, или они будут обладать худшими или лучшими свойствами.
Краткое описание чертежей
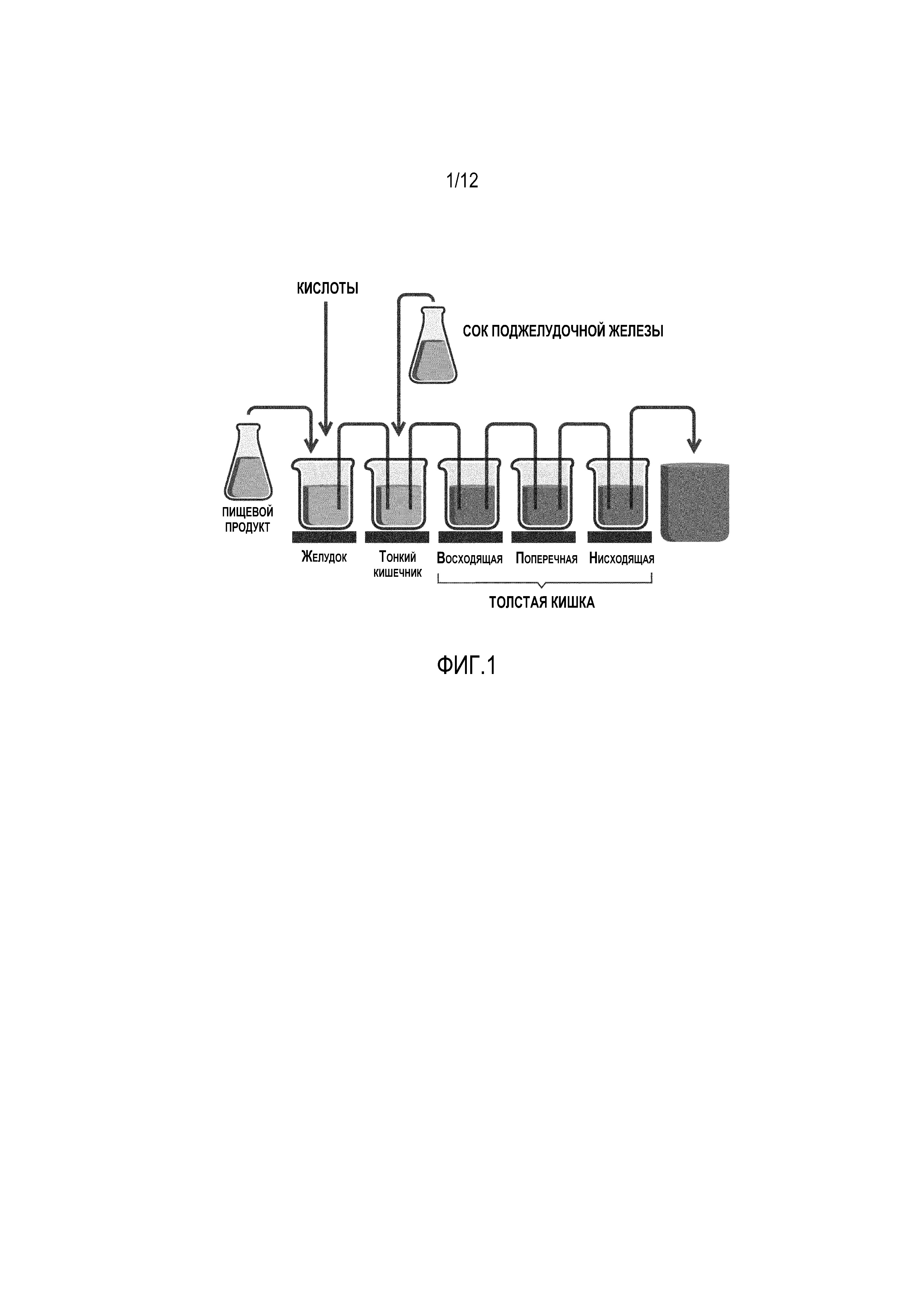
Фигура 1: Схематическое изображение системы SHIME®, которая состоит из желудка, тонкого кишечника и трех различных областей толстой кишки. Жидкая питательная среда SHIME® и соматические клетки поджелудочной железы входят в сосуды, которые имитируют желудок и тонкую кишку, соответственно. После определенного времени пребывания в этих стерильных сосудах, суспензия занимает три последовательно расположенных отсека толстой кишки, то есть, отсеков восходящей, поперечной и нисходящей толстой кишки, каждый из которых характеризуется различными рН и временем пребывания. Эти сосуды засевают фекальной микробиотой человека. Все сосуды хранятся в анаэробных условиях, создаваемых путем продувки зоны «хэдспейса» N2, с непрерывным перемешиванием и выдерживанием при 37°C.
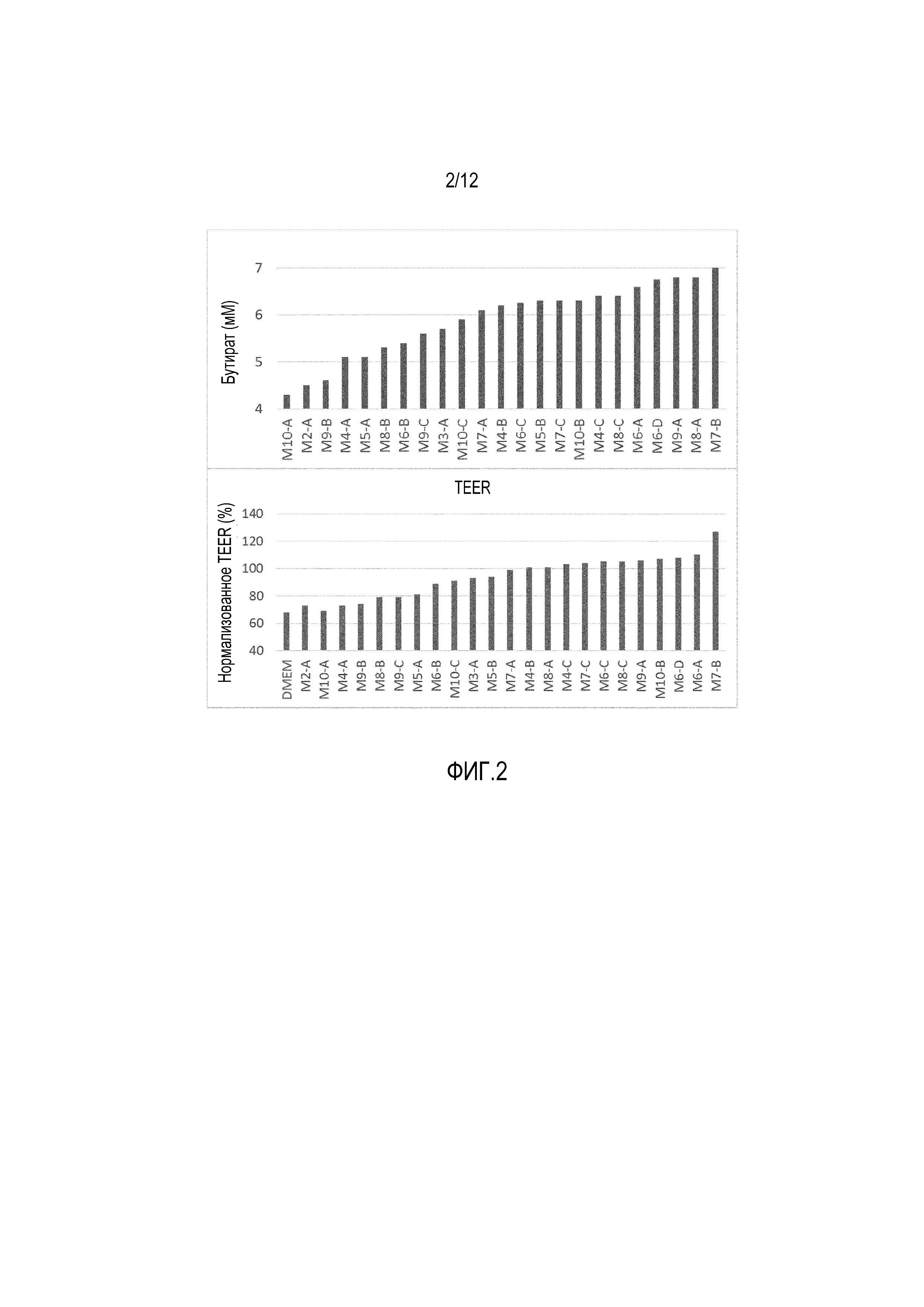
Фигура 2: Продуцирование бутирата 23 различными композициями после 24-часового инкубирования (верхняя панель) и его влияние на трансэпителиальное электрическое сопротивление (TEER) клеток Сасо-2, культивируемых в присутствии клеток THP1 (нижняя панель). В последнем случае, образцы, собранные после 24-часового инкубирования 23 композиций, были стерильно отфильтрованы и добавлены (1:5 об/об) в течение 24 часов в апикальный компартмент клеток Сасо-2, культивированных в течение 14 дней на полупроницаемых вставках и размещенных на верхней части РМА-стимулированных макрофагов, происходящих от THP1 (совместные культуры). В качестве контроля использовали только одну культуральную среду (DMEM). Клетки THP1, культивируемые в присутствии РМА в течение 48 часов, вызывают повреждение клеток Сасо-2, как было определено по уменьшению TEER в DMEM-контроле. Величины TEER были нормализованы по величинам, измеренным до совместного культивирования (0 ч.) и выражены в процентах от исходной величины. Различным композициям были присвоены следующие коды: MX-Y, где X=число изолятов, присутствующих в композиции, а Y=уникальная композиция A, B, C и т.п. с изолятами X.
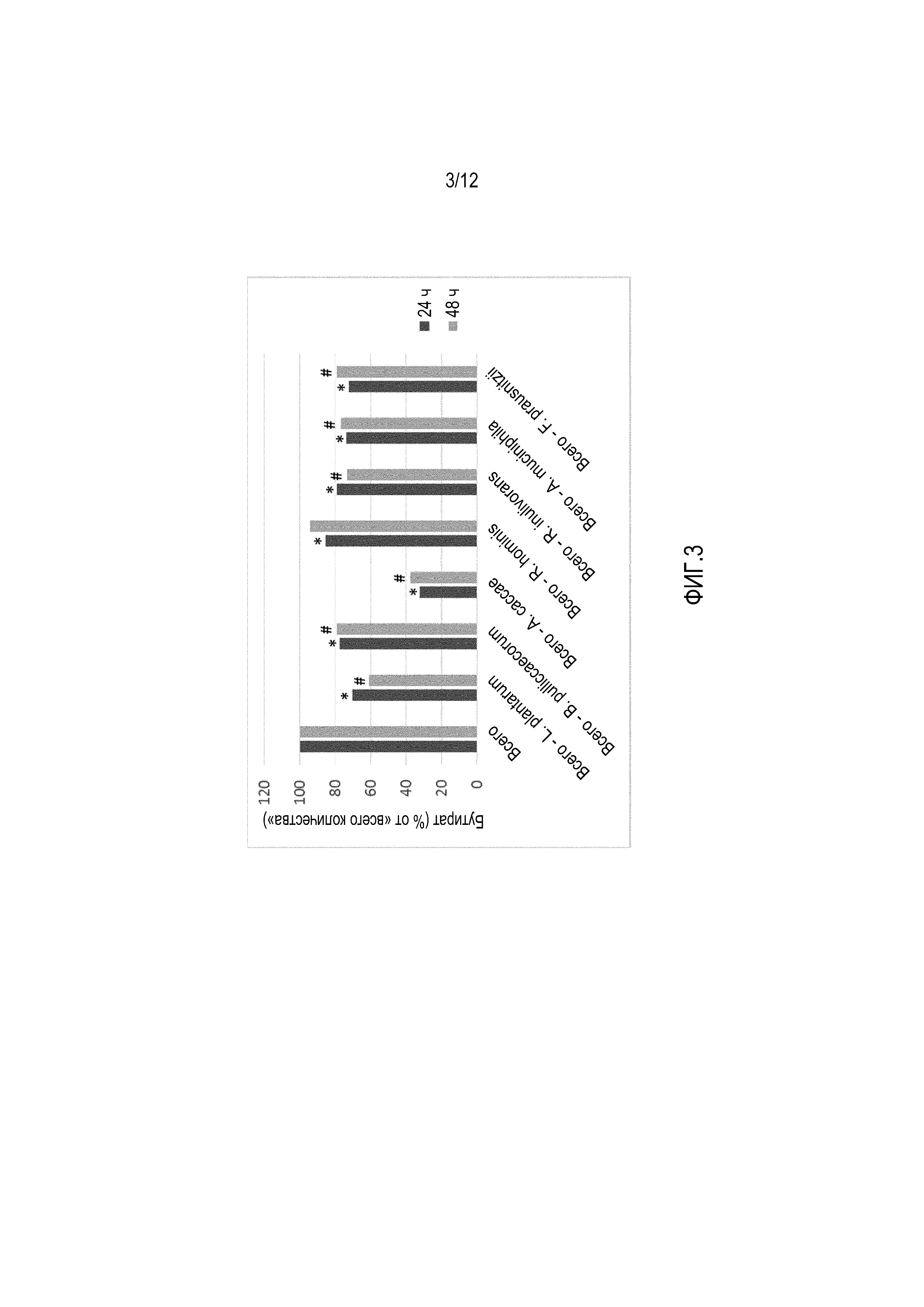
Фигура 3: Продуцирование бутирата после 24-часового и 48-часового инкубирования в кондиционированной питательной среде SHIME® полной композицией из 7 видов или композициями из 6 видов, из которых каждый раз исключался один из 7 исходных видов. Результаты представлены как процент продуцирования бутирата, детектируемого при каждом инкубировании с композицией из 6 видов, в отличие от композиции, состоящей из всех 7 видов. Эти композиции были обозначены как «Полная» (из всех 7 видов) или «полная - X», где Х являются видом, исключенным из полной композиции.* р <0,05 по сравнению с «Полной композицией» через 24 ч.; # р <0,05 по сравнению с «Полной композицией» через 48 ч.
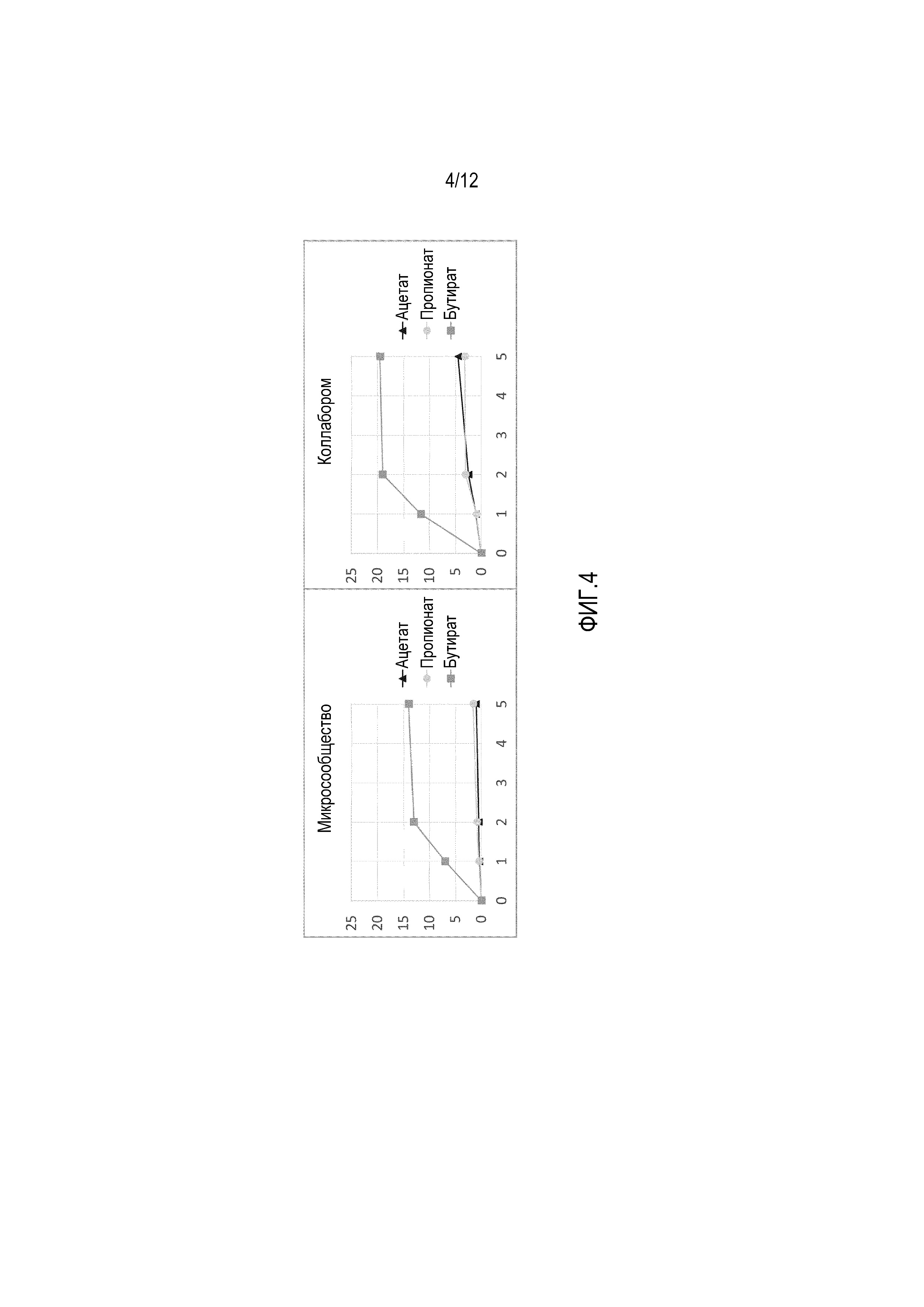
Фигура 4: Уровни (мМ) бутирата, пропионата и ацетата, продуцированных композицией в течение 5-дневного анаэробного инкубирования в кондиционированной питательной среде SHIME®. Композицию получали либо с использованием стратегии «микросообществ» (левая панель), либо с использованием стратегии «коллаборомов» (правая панель).
Фигура 5: Изменение уровней (мМ) пропионата (левая панель) и бутирата (правая панель) в течение 14 дней в 3 независимых циклах продуцирования композиции с использованием стратегии «коллаборомов». После предварительного культивирования в соответствующей культуральной среде, штаммы композиции смешивали, высевали и культивировали в течение 14 дней в трех экземплярах в системе SHIME®, состоящей из одной области толстой кишки при рН 6,15-6,4.
Фигура 6: Изменение уровней SCFA, выраженное как моль % ацетата, пропионата и бутирата в течение определенного времени после продуцирования композиции с использованием альтернативной стратегии «коллаборомов». После предварительного культивирования в соответствующей культуральной среде, штаммы композиции смешивали, высевали и культивировали в течение 8 дней в трех экземплярах в отдельных ферментерах, работающих в режиме культивирования периодической культуры с подпиткой. Через определенные интервалы времени в течение 16 часов, 40% (по объему) культуральной среды заменяли кондиционированной питательной средой SHIME®.
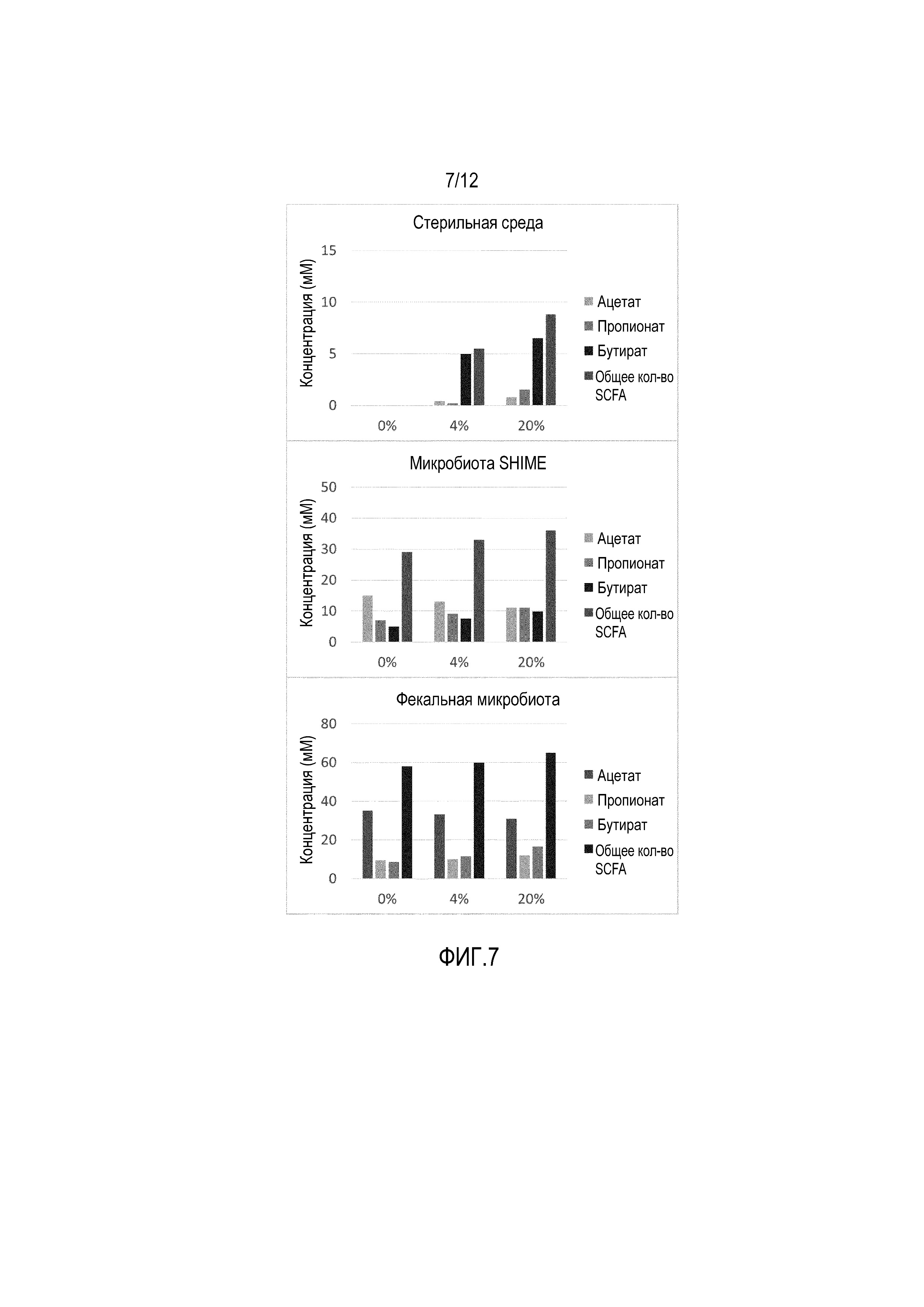
Фигура 7: Продуцирование (мМ) ацетата, пропионата, бутирата и общих жирных кислот с короткой цепью (SCFA) после 24-часового инкубирования (i) cо стерильной базальной средой (верхняя панель) или со стерильной средой, подаваемой (ii) с микробиотами, полученными из области толстой кишки SHIME (средняя панель), или (iii) с фекальной микробиотой (нижняя панель). Различные обработки композицией, продуцируемой с использованием стратегии «коллаборомов», были проведены в пределах от 0% до 4% и 20% от общего объема инкубирования.
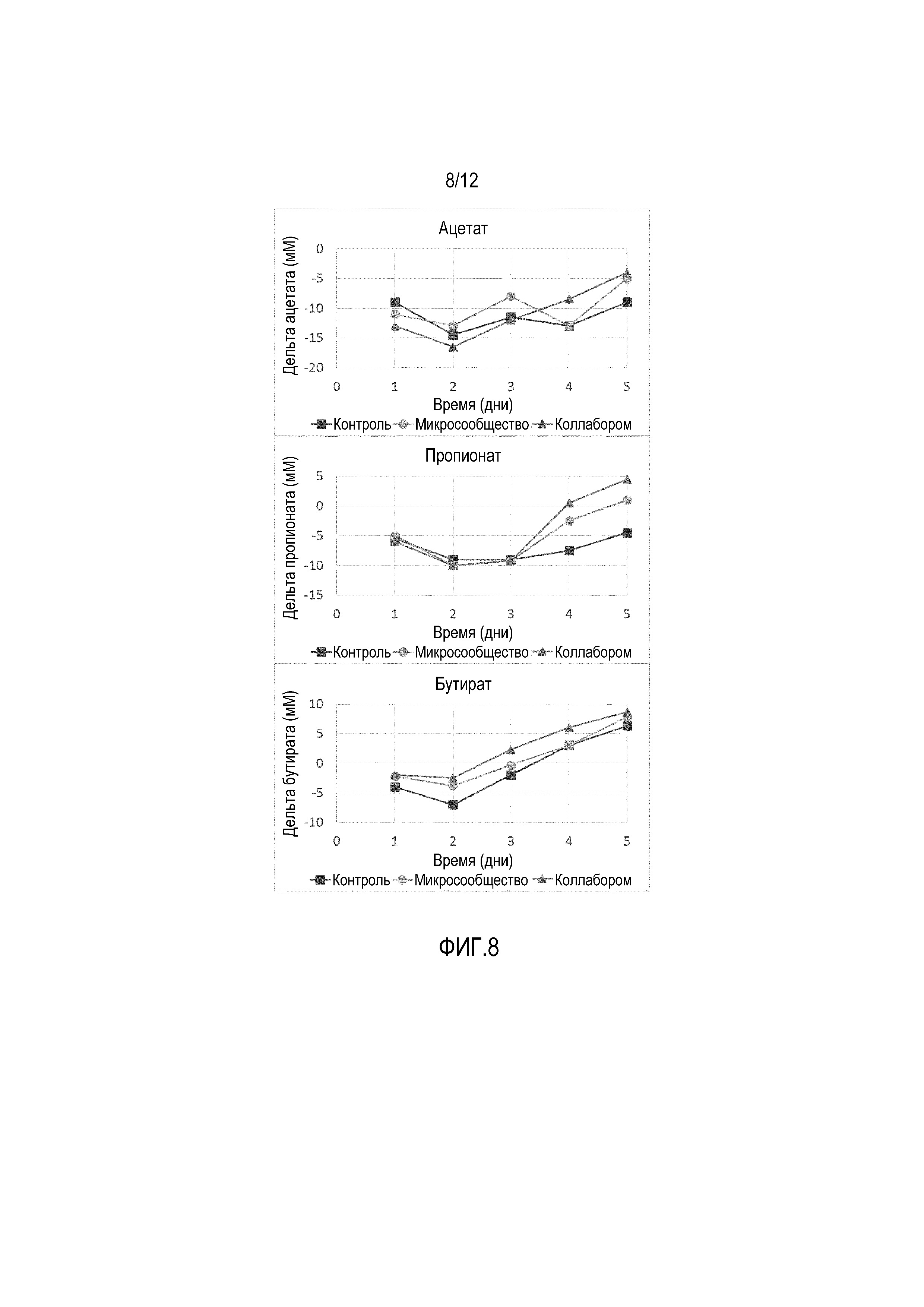
Фигура 8: Изменение уровней (мМ) ацетата (верхняя панель), пропионата (средняя панель) и бутирата (нижняя панель) в эксперименте по введению антибиотиков в M-SHIME®. После индуцирования дисбактериоза микробиоты толстой кишки в системе SHIME® путем введения коктейля из антибиотиков (40/40/10 мг/л амоксициллина/ципрофлоксацина/тетрациклина, соответственно), микробиоту, подвергнутую дисбактериозу, обрабатывали в течение 5 дней композицией, полученной либо с использованием стратегии «микросообществ», либо с использованием стратегии «коллаборомов» (день 1=начало введения композиции). Результаты выражены в виде дельты уровней SCFA в SHIME в каждый период времени по сравнению с величинами до введения антибиотиков.
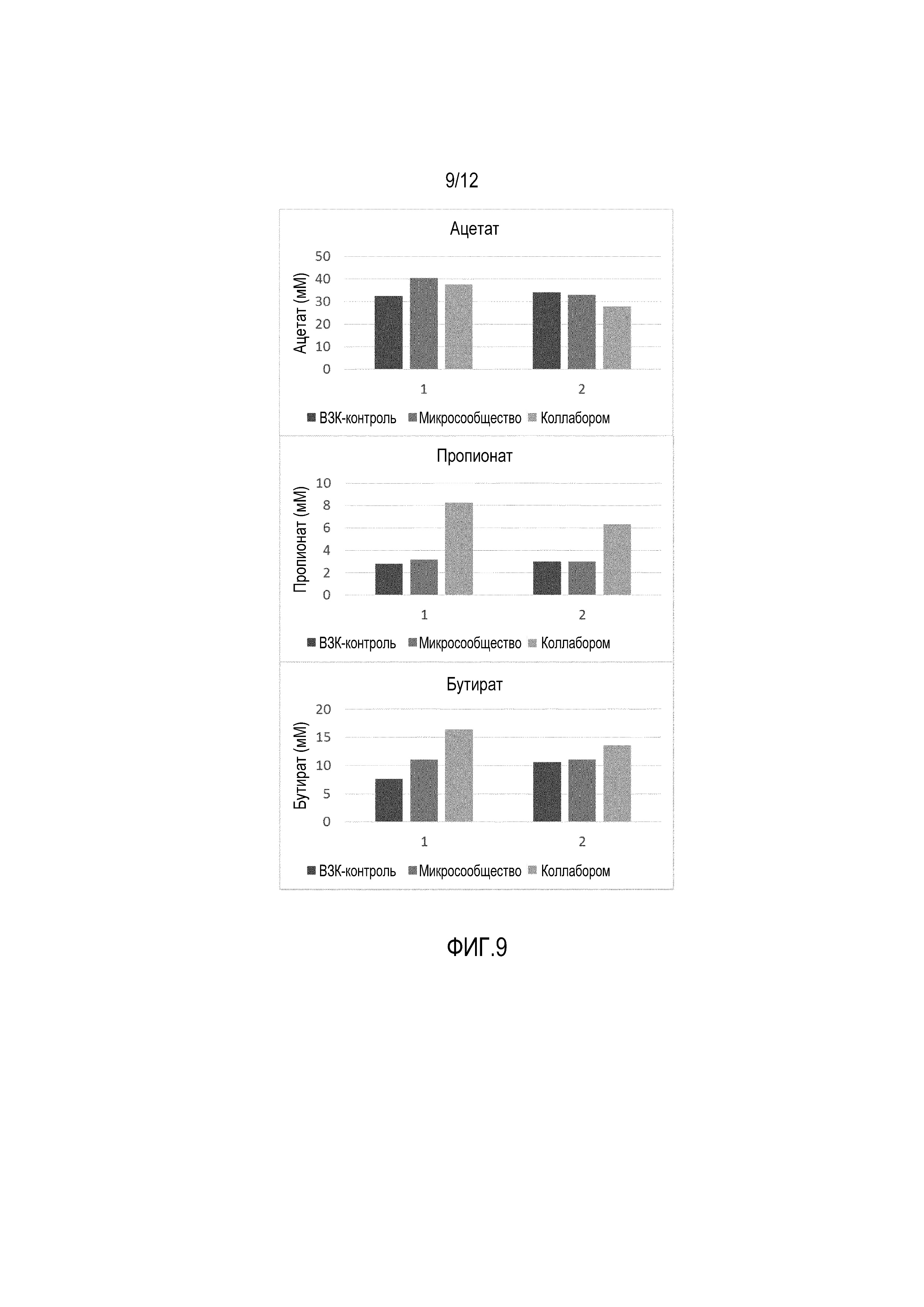
Фигура 9: Уровни (мМ) ацетата (верхняя панель), пропионата (средняя панель) и бутирата (нижняя панель) в эксперименте по устранению ВЗК-ассоциированного дисбактериоза в М-SHIME®. Три независимых сосуда SHIME® с толстой кишкой инокулировали фекальным материалом, взятым у пациента с язвенным колитом. Одновременно, в соответствующий сосуд SHIME с толстой кишкой вводили одну дозу композиции, полученной либо с использованием стратегии «микросообществ», либо с использованием стратегии «коллаборомов». Третий эксперимент проводили параллельно в качестве контроля без введения композиции. Продуцирование ацетата, пропионата и бутирата наблюдалось через 1 и 2 дня после введения композиции.
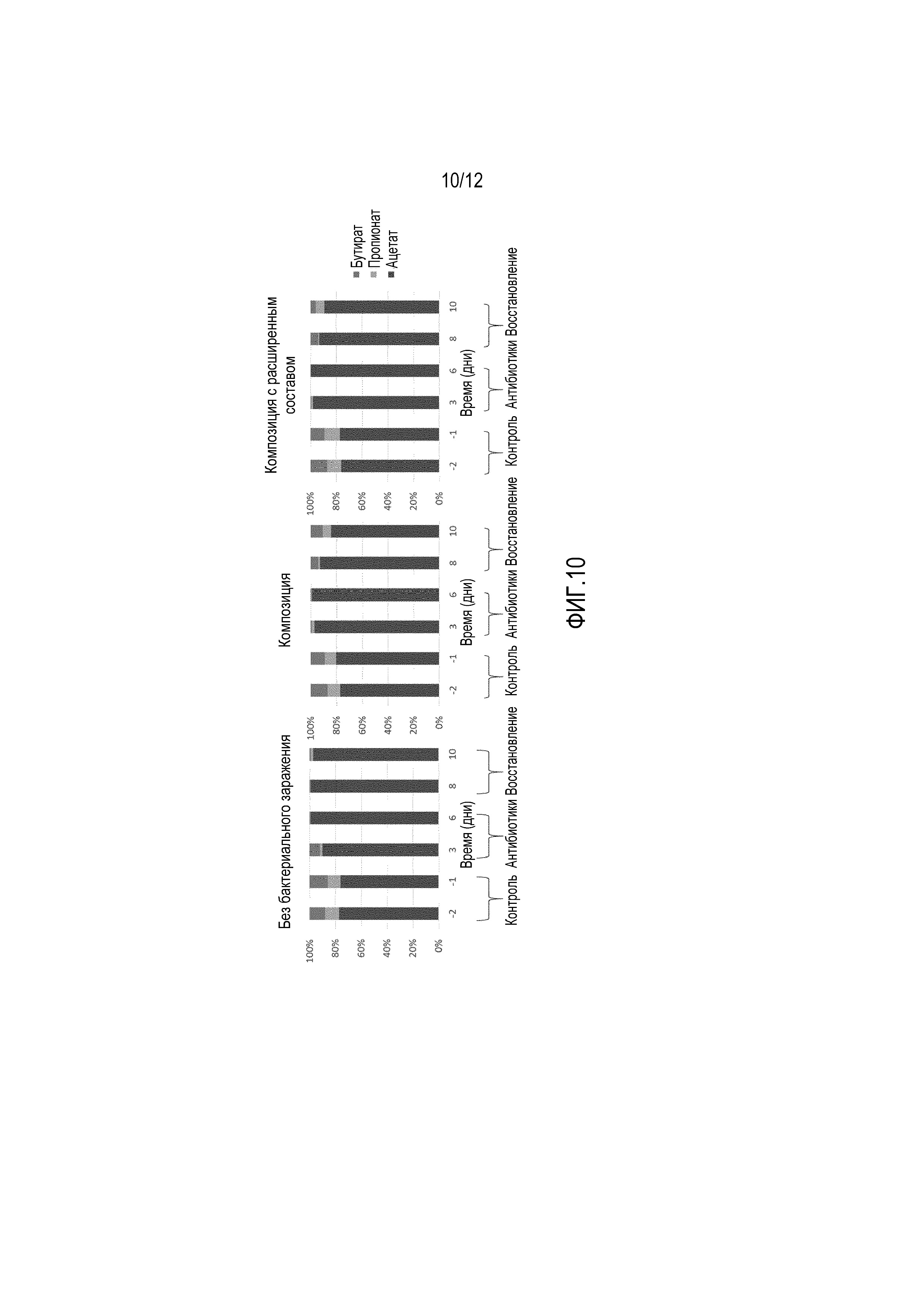
Фигура 10: Изменение уровней (мол. %) ацетата, пропионата и бутирата в эксперименте по введению антибиотиков мышам С57/BL6. После контрольного периода, в течение которого мышам давали стандартный корм, дисбактериоз микробиоты кишечника индуцировали добавлением клиндамицина (250 мг/л) в питьевую воду в течение 5 дней. После этого, мышам (n=10/группу) в течение 5 дней вводили перорально через желудочный зонд либо физиологический раствор (в качестве контроля - без бактерий; левая панель), либо композицию, полученную с использованием стратегии «коллаборомов» (средняя панель), либо композицию с расширенным составом, полученную с использованием стратегии «коллаборомов» (правая панель). Образцы фекалий мышей, взятые у одной и той же экспериментальной группы, объединяли и количественно оценивали уровни ацетата, пропионата и бутирата.
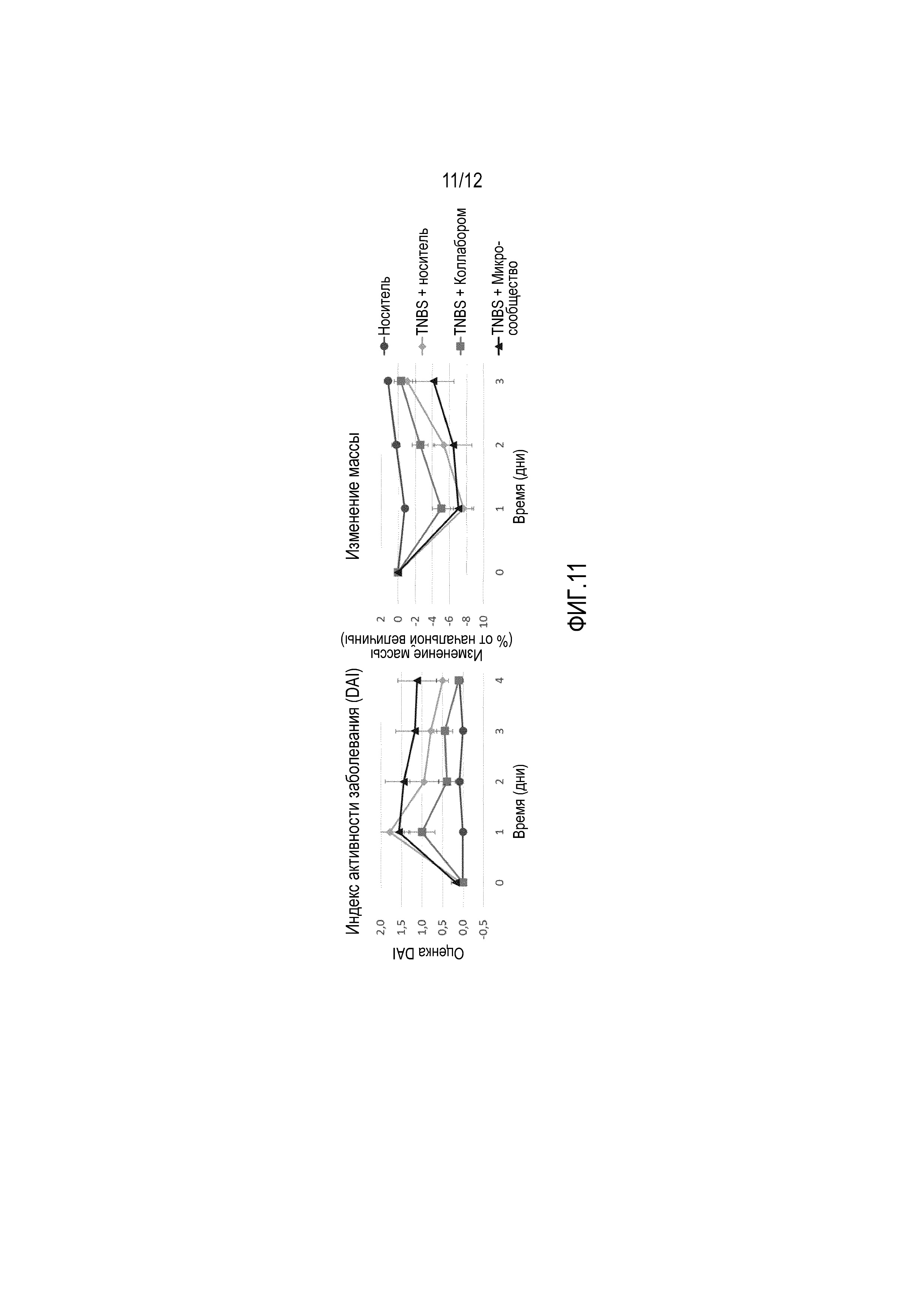
Фигура 11: Изменение индекса тяжести заболевания (DAI) и изменение массы в эксперименте с TNBS-индуцированным колитом у мышей С57/BL6. После 1-недельного периода акклиматизации, в котором мышам давали стандартный корм, начинали эксперимент. Животных каждой группы (n=9/группу) обрабатывали в течение 5 дней подряд с помощью перорального зонда. При всех обработках, профилактическую дозу вводили за 1 день до ректального введения 2 мг TNBS/50% EtOH, и эксперимент завершали через 4 дня после введения TNBS, а затем мышей умерщвляли. При этом были проведены следующие обработки: TNBS+физиологический раствор (контрольный TNBS в качестве носителя); TNBS+композиция, полученная с использованием стратегии «микросообществ», и TNBS+композиция, полученная с использованием стратегии «коллаборомов». В качестве контроля-носителя была включена обычная группа (без TNBS-обработки, но с обработкой физиологическим раствором).
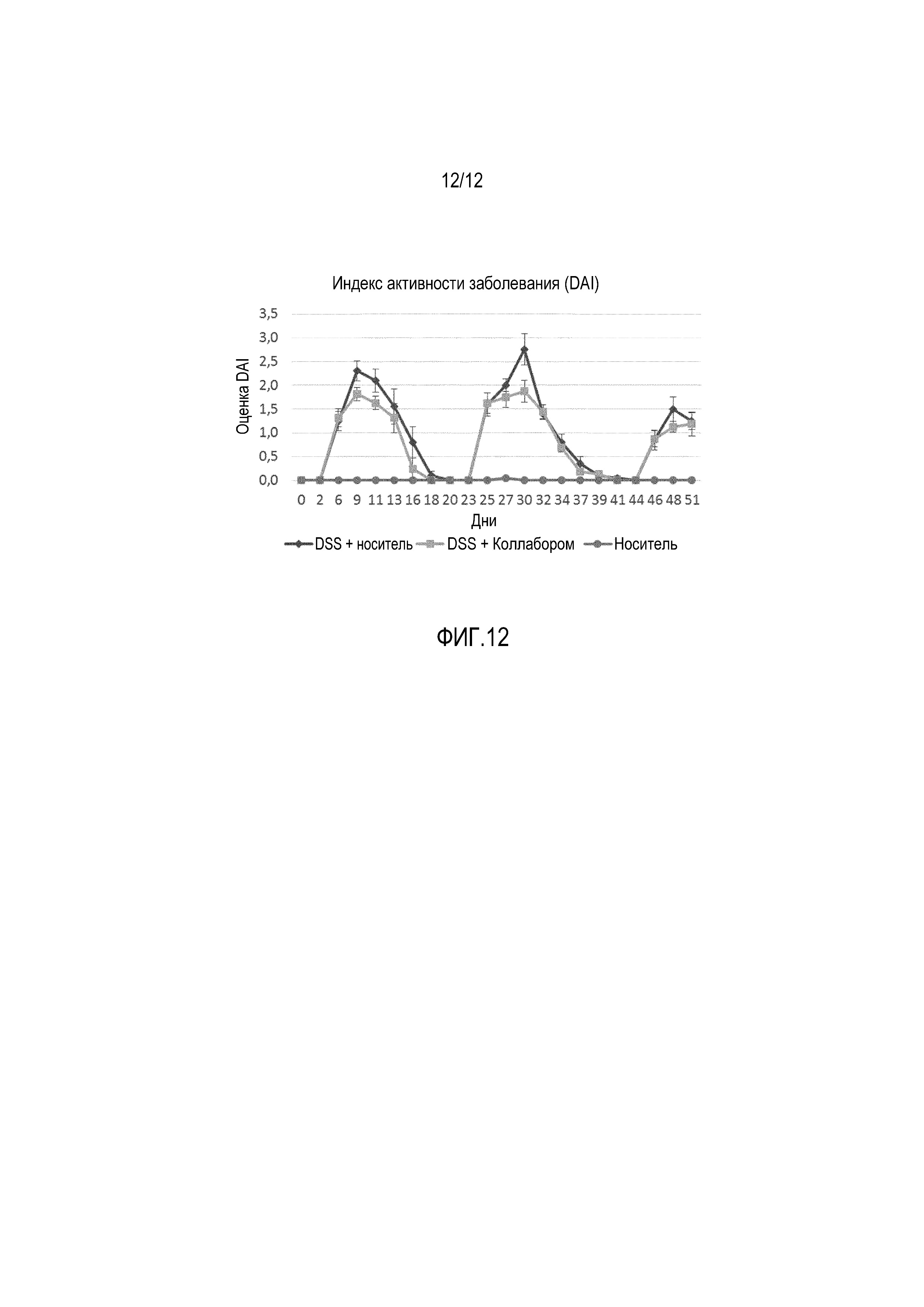
Фигура 12: Изменение индекса тяжести заболевания (DAI) наблюдали в эксперименте с DSS-индуцированным колитом у мышей С57/BL6. После 1-недельного периода акклиматизации, в котором мышам давали стандартный корм, начинали эксперимент. Животных каждой группы (n=10/группу) обрабатывали 3 раза в неделю в течение 8 дней подряд с помощью перорального зонда. При всех обработках, профилактическую дозу вводили за 1 неделю до проведения первого DSS-цикла. Первый DSS-цикл начинали со 2-й недели, и этот цикл включал введение DSS один раз в неделю (0,25% в питьевой воде) с последующим перерывом в две недели. После первого цикла проводили идентичный второй DSS-цикл. Третий DSS-цикл состоял из введения DSS один раз в неделю с последующим перерывом на одну неделю, после чего животных умерщвляли. При этом были проведены следующие обработки: DSS+физиологический раствор (контрольный DSS в качестве носителя); DSS+композиция, полученная с использованием стратегии «микросообществ». В качестве контроля-носителя была включена обычная группа (без DSS-обработки, но с обработкой физиологическим раствором).
Сущность изобретения
Настоящее изобретение относится, в первую очередь, к композиции, состоящей, по существу, из бактерий, принадлежащих к виду Faecalibacterium prausnitzii, Butyricicoccus pullicaecorum, Roseburia inulinivorans, Roseburia hominis, Akkermansia muciniphila, Lactobacillus plantarum и Anaerostipes caccae, предпочтительно используемых для профилактики или лечения симптомов, ассоциированных с желудочно-кишечным расстройством.
Другими словами, настоящее изобретение относится к способу профилактики или лечения симптомов, ассоциированных с желудочно-кишечным расстройством у индивидуума, нуждающегося в этом, где указанный способ включает введение терапевтически эффективного количества композиции, по существу, состоящей из бактерий, принадлежащих к виду Faecalibacterium prausnitzii,Butyricicoccus pullicaecorum, Roseburia inulinivorans, Roseburia hominis, Akkermansia muciniphila, Lactobacillus plantarum и Anaerostipes caccae.
Настоящее изобретение также относится к описанной выше композиции, где указанным желудочно-кишечным расстройством является нарушение барьерной функции кишечника, диарея, запор, синдром раздраженного кишечника, воспалительное заболевание кишечника, болезнь Крона, язвенный колит, глютеновая болезнь, резервуарный илеит, воспаление слизистой оболочки, инфекция кишечника, дисбактериоз микробиоты кишечника или любая их комбинация.
Настоящее изобретение также относится к описанной выше композиции, где указанное желудочно-кишечное расстройство подвергают профилактике или лечению посредством: а) стимуляции роста и/или активности одной или ограниченного числа полезных бактерий в кишечном тракте, b) ингибирования роста и/или активности одной или ограниченного числа патогенных бактерий в кишечном тракте, c) относительного увеличения уровня связывания непатогенных бактерий со слизистой оболочкой желудочно-кишечной поверхности, d) снижения неконтролируемого поглощения антигенов, провоспалительных агентов, бактерий или бактериальных продуктов кишечником, e) обеспечения противовоспалительной активности на поверхности кишечника, f) улучшения функционирования кишечного барьера, g) получения бактериальных метаболитов или h) любой комбинации а)-g).
Настоящее изобретение также относится к описанной выше композиции, где бактерия, принадлежащая к виду Roseburia hominis, была удалена из указанной композиции.
Настоящее изобретение также относится к описанной выше композиции, где бактерия, принадлежащая к виду Escherichia coli, Enterococcus faecium, Lactobacillus mucosae, Bifidobacterium adolescentis, Bifidobacterium longum, Bacteroides thetaiotaomicron и Bacteroides vulgatus, была дополнительно добавлена к указанной композиции.
Настоящее изобретение также относится к описанной выше композиции, которая также содержит один или более пребиотиков.
В своем предпочтительном варианте, настоящее изобретение относится к описанной выше композиции, где указанные бактерии предварительно адаптируют путем их совместного культивирования в ферментере перед введением указанной композиции для профилактики или лечения указанных желудочно-кишечных расстройств.
В соответствии с этим, настоящее изобретение также относится к описанной выше композиции, где указанный ферментер представляет собой динамический имитатор желудочно-кишечного тракта.
Более конкретно, настоящее изобретение относится к описанной выше композиции, где указанные бактерии выбраны из списка следующих штаммов: Faecalibacterium prausnitzii LMG P-29362, Faecalibacterium prausnitzii DSMZ 17677, Butyricicoccus pullicaecorum LMG P-29360, Butyricicoccus pullicaecorum LMG24109, Roseburia inulinivorans LMG P-29365, Roseburia inulinivorans DSMZ 16841, Roseburia hominis LMG P-29364, Roseburia hominis DSMZ 16839, Akkermansia muciniphila LMG P-29361, Akkermansia muciniphila DSMZ 22959, Lactobacillus plantarum LMG P-29366, Lactobacillus plantarum ZJ31 6, Anaerostipes caccae LMG P-29359, Anaerostipes caccae DSMZ 14662 и/или штаммов, последовательности которых по меньшей мере на 97% идентичны последовательностям рРНК 16S по меньшей мере одного из указанных штаммов.
Настоящее изобретение также относится к описанной выше композиции, где указанной композицией является фармацевтическая композиция, приготовленная в виде лекарственной формы для ректального введения или в виде лекарственной формы для перорального введения.
В соответствии с этим, настоящее изобретение также относится к описанной выше композиции, где указанной пероральной лекарственной формой является капсула, микрокапсула, таблетка, гранула, порошок, пастилка, пилюля, суспензия или сироп.
Настоящее изобретение также относится к описанной выше композиции, которая включена в продукты питания, напитки, пищевые добавки или натуральные препараты.
Более конкретно, настоящее изобретение относится к описанной выше композиции, где указанная композиция содержит от 105 до 1011 колониеобразующих единиц бактерий.
Описание изобретения
Кишечный микробиом содержит сотни видов микроорганизмов, которые сосуществуют у различных индивидуумов, и которые взаимодействуют друг с другом и с хозяином. В настоящее время, обычно считается, что кишечная микробиота играет ключевую роль в сохранении здоровья человека и профилактике заболеваний, благодаря регуляции метаболических функции и иммунного гомеостаза (Cenit et al., 2014). Было проведено несколько исследований по изучению комплексных микробных сообществ кишечника в попытке определить «базовый микробиом», подразумевая при этом, что каждый человек имеет общее ключевое число основных видов или штаммов, которые определяют функциональные возможности микробиома здорового кишечника (Kinross et al., 2011). На основе этой концепции (то есть, что все люди заселяются базовым микробиомом) существует обширная литература, в которой описаны композиции и функции микробиоты кишечника (например, ключевые виды бактерий, микробиота слизистой и просветов, бактерии проксимального и дистального отдела толстой кмшки и т.п.) и функциональный анализ генома, и в которой можно найти целый список микробов-кандидатов, охватывающий основные функциональные свойства комплексного микробиома человеческого кишечника.
Настоящее изобретение относится, в первую очередь, к конкретному выбору подгруппы видов бактерий микробиома человеческого кишечника, который дает особый и неожиданный эффект. Более конкретно, настоящее изобретение относится к композиции, состоящей, по существу, из бактерий, принадлежащих к виду Faecalibacterium prausnitzii, Butyricicoccus pullicaecorum, Roseburia inulinivorans, Roseburia hominis, Akkermansia muciniphila, Lactobacillus plantarum и Anaerostipes caccae, которые предпочтительно использовать для профилактики или лечения симптомов, ассоциированных с желудочно-кишечным расстройством. Термин «состоящий по существу из» указывает на то, что данная композиция может включать другие виды бактерий и/или другие компоненты при условии, что они не будут оказывать негативного влияния на эффект (то есть, на профилактику или лечение симптомов, ассоциированных с желудочно-кишечным расстройством) указанной композиции. В одном из вариантов осуществления изобретения, композиция согласно изобретению включает бактерии, принадлежащие к виду Faecalibacterium prausnitzii, Butyricicoccus pullicaecorum, Roseburia inulinivorans, Roseburia hominis, Akkermansia muciniphila, Lactobacillus plantarum и Anaerostipes caccae.
В другом варианте осуществления изобретения, композиция согласно изобретению состоит из бактерий, принадлежащих к виду Faecalibacterium prausnitzii, Butyricicoccus pullicaecorum, Roseburia inulinivorans, Roseburia hominis, Akkermansia muciniphila, Lactobacillus plantarum и Anaerostipes caccae.
Бактерии вида Faecalibacterium prausnitzii (Duncan et al., 2002), Butyricicoccus pullicaecorum (Eeckhaut et al., 2008), Roseburia inulinivorans (Duncan et al., 2006), Roseburia hominis (Duncan et al., 2006), Akkermansia muciniphila (Derrien et al., 2004), Lactobacillus plantarum (Walter, 2008) и Anaerostipes caccae (Schwiertz et al., 2002) представляют собой бактерии, хорошо известные специалистам. Термин «симптомы, ассоциированные с желудочно-кишечным расстройством» означает проблемы со здоровьем у людей и животных. Применение композиции согласно изобретению позволяет, в частности, осуществлять профилактику/лечение дисбактериоза, и тем самым способствует позитивной модуляции взаимодействий между бактериями и поверхностью кишечника. В результате наблюдается улучшенное функционирование поверхности кишечника, например, улучшение барьерной, гормональной и иммунной функций. Воздействие на поверхность кишечника происходит быстрее в том случае, когда вводят дозу «предварительно адаптированной композиции» по сравнению с дозой серии одних и тех штаммов по отдельности (см. далее). Используемый здесь термин «модуляция или улучшение барьерной, гормональной и иммунной функций поверхности кишечника» означает модификацию любого параметра, который влияет на нормальный гомеостаз поверхности кишечника, а в частности, на его роль в защите первой линии от инвазии патогенов, антигенов или других вредных веществ, и на его роль в продуцировании веществ (например, иммунных молекул, гормонов), которые оказывают системное влияние на хозяина. Указанные параметры включают, но не ограничиваются ими:
- стимуляцию роста и/или активности одной или ограниченного числа полезных бактерий в желудочно-кишечном тракте (например, лактобактерий, бифидобактерий, бутират- или пропионат-продуцирующих бактерий и т.п.);
- ингибирование роста и/или активности одной или ряда патогенных бактерий в кишечном тракте;
- относительное увеличение прикрепления непатогенных бактерий к слизистой оболочке поверхности кишечника;
- уменьшение неконтролируемого поглощения антигенов, провоспалительных молекул, бактерий или бактериальных продуктов кишечником;
- модуляцию лимфоидной ткани кишечника (GALT) и иммунной системы хозяина;
- продуцирование специфических бактериальных метаболитов (например, пропионата, бутирата); и модуляцию продуцирования некоторых кишечных сигнальных молекул, которые прямо или опосредованно модулируют метаболический гомеостаз (например, проглюкагона, GLP-1, GLP-2, FIAF).
Таким образом, настоящее изобретение относится к композиции, описанной выше, где указанное желудочно-кишечное расстройство подвергают профилактике или лечению посредством: а) стимуляции роста и/или активности одной или ограниченного числа полезных бактерий в кишечном тракте, b) ингибирования роста и/или активности одной или ограниченного числа патогенных бактерий в кишечном тракте, c) относительного увеличения уровня связывания непатогенных бактерий со слизистой оболочкой желудочно-кишечной поверхности, d) снижения неконтролируемого поглощения антигенов, провоспалительных агентов, бактерий или бактериальных продуктов кишечником, e) обеспечения противовоспалительной активности на поверхности кишечника, f) улучшения функционирования кишечного барьера, g) получения бактериальных метаболитов или h) любой комбинации а)-g).
Патологическими состояниями, которые могут быть ассоциированы с общими желудочно-кишечными расстройствами, являются, но не ограничиваются ими, запор, синдром раздраженного кишечника (СРК), воспалительные заболевания кишечника (ВЗК), дисбактериоз микробиоты кишечника, воспаление слизистой оболочки, метаболический синдром, ожирение, диабет, сердечно-сосудистое заболевание, синдром хронической усталости, психическое заболевание, нарушение когнитивной функции, нейродегенеративное заболевание, рак в любой форме, аутоиммунное заболевание, нарушение функционирования иммунной системы, ревматизм, ревматоидный артрит, воспаление женских репродуктивных органов, инфицирование патогенами (бактериями, вирусами и грибами). Примерами нейродегенеративных заболеваний являются, но не ограничиваются ими, АБС, деменция, болезнь Альцгеймера, болезнь Паркинсона и болезнь Гентингтона. Примерами рака различных типов являются, но не ограничиваются ими, рак легких, рак молочной железы, рак предстательной железы, рак поджелудочной железы, а в частности, рак прямой и ободочной кишки. Примерами аутоиммунных заболеваний являются, но не ограничиваются ими, рассеянный склероз, атопический дерматит, глютеновая болезнь, псориаз и волчанка.
Исходя из наблюдений того, что композиции согласно изобретению усиливают взаимодействие и/или активность непатогенных бактерий на слизистой оболочке желудочно-кишечного эпителия, предполагается, что указанные препараты являются особенно подходящими для улучшения барьерной функции поверхности кишечника, такой как, например, предупреждение или уменьшение неконтролируемого поглощения антигенов, провоспалительных молекул, патогенных бактерий или бактериальных продуктов кишечником. Одним из таких признаков нарушения барьерной функции слизистой является воспалительное заболевание кишечника. Поскольку обычно считается, что при воспалительных заболеваниях кишечника, повреждение слизистой оболочки с нарушением восстановления после такого повреждения является одним из ключевых факторов, вызывающих такие хронические заболевания, то композиции согласно изобретению должны оказывать благоприятное воздействие при таком состоянии. В соответствии с этим, целью настоящего изобретения является применение композиций согласно изобретению для профилактики и лечения состояний, ассоциированных с нарушением барьерной функции и характеризующихся неконтролируемым поглощением антигенов, провоспалительных молекул, патогенных бактерий или бактериальных продуктов кишечником.
Используемый здесь термин «воспалительные заболевания кишечника» также упоминаются как «хронические кишечные заболевания», и этот термин включает любое состояние, характеризующееся стойким воспалением слизистой оболочки на различных уровнях желудочно-кишечного тракта, такое как, например, синдром воспаленного кишечника, воспаление слизистой оболочки, язва желудка, болезнь Крона, язвенный колит, рак прямой и ободочной кишки и резервуарный илеит.
Поскольку хорошо известно, что воспаление слизистой оболочки, в основном, характеризуется воспалением выстилки поверхности слизистой оболочки ротовой полости и желудочно-кишечного тракта, которое обычно является побочным эффектом при химиотерапии и лучевой терапии или трансплантации стволовых клеток, то также следует отметить, что применение композиций согласно изобретению будет оказывать благоприятное воздействие при таких состояниях. В соответствии с этим, целью настоящего изобретения является применение композиций согласно изобретению для профилактики и лечения состояний, ассоциированных с воспалением слизистой оболочки. Воспаление слизистой оболочки может возникать в любом участке по всему желудочно-кишечному тракту. В случае ротовой полости, он обычно называется воспалением слизистой оболочки полости рта.
Следует также отметить, что применение композиций согласно изобретению обеспечивает защиту от инвазии антигенов, которые вызывают аллергические реакции, поскольку такие аллергены могут содержаться в определенных пищевых продуктах, химических веществах и других молекулах. Таким образом, в другом своем варианте, настоящее изобретение относится к применению композиций для профилактики и лечения состояний, ассоциированных с инвазией антигенов, которые вызывают аллергические реакции (например, пищевые аллергии, астму, экзему).
Кроме того, следует отметить, что применение этих композиций влияет на лимфоидную ткань кишечника (GALT), а также на иммунную систему. Помимо других эффектов, это может приводить к снижению уровня экспрессии провоспалительных цитокинов и увеличению продуцирования иммунорегуляторных факторов, а также к повышению активности лимфоцитов. Следовательно, предполагается, что указанные композиции являются особенно подходящими для улучшения развития и функционирования иммунной системы хозяина.
В другом аспекте изобретения, исходя из наблюдения того, что композиции согласно изобретению модулируют эпителиальный барьер, и следовательно уменьшают хроническое воспаление, предполагаются, что указанные композиции являются особенно подходящими для регуляции и улучшения метаболического гомеостаза. Неограничивающими эффектами влияния указанных препаратов на метаболический гомеостаз являются регуляция усвояемости пищи и метаболизма жира и глюкозы, повышение секреции инсулина и чувствительности к инсулину и регуляция синтеза холестерина и метаболизма. В соответствии с этим, целью настоящего изобретения является применение композиций согласно изобретению для регуляции усвояемости пищи, стимуляции ощущения сытости, регуляции массы тела, профилактики и лечения состояний, ассоциированных с нарушением метаболического гомеостаза, таких как ожирение и диабет типа 2.
Основываясь на наблюдении того, что композиция согласно изобретению снижает некоторые установленные причинные факторы риска развития сердечно-сосудистых заболеваний (ССЗ), предполагается, что в другом аспекте изобретения, указанные композиции особенно подходящими для профилактики ССЗ. Фактически, ССЗ относится к любому заболеванию, которое влияет на сердечно-сосудистую систему, но, обычно, этот термин относится к заболеванию, ассоциированному с атеросклерозом. Атеросклероз представляет собой синдром поражения артериальных кровеносных сосудов и хронические воспалительные реакции в стенках артерий, что в значительной степени обусловлено накоплением макрофагов, лейкоцитов и липопротеинов низкой плотности. Развитие ССЗ зависит от множества механизмов, и при этом был также идентифицирован ряд явных причинных факторов риска. Эти факторы включают, но не ограничиваются ими, повышенной уровень холестерина ЛНП, повышенный уровень триглицеридов в плазме, метаболические заболевания (ожирение, сахарный диабет и т.п.), хроническое воспаление и окислительный стресс. Особенно важное значение имеют два последних фактора. Атеросклероз развивается в результате окисления ЛНП (LDL-ox) свободными радикалами, а в частности, свободными радикалами кислорода в случае окислительного стресса. Избыточная реакция иммунной системы, в случае хронического воспаления, приводит к повреждению, вызываемому окислением ЛНП, которое также способствует повышению тяжести заболевания. Поэтому, целью настоящего изобретения является применение композиций согласно изобретению для профилактики или лечения ССЗ.
В другом аспекте изобретения, учитывая благоприятное влияние композиций согласно изобретению в отношении адгезии нормальной микробиоты на слой слизистой оболочки, было высказано предположение, что применение композиций будет обеспечивать защиту от адгезии на слизистой оболочке и инвазии патогенов. Примерами патогенов являются, но не ограничиваются ими, Bacillus anthracis; Bacillus cereus; Bordetella pertussis; Borrelia burgdorferi; Brucella abortus; Brucella canis; Brucella melitensis; Brucella suis; Campylobacter jejuni; Chlamydia pneumonia; Chlamydia trachomatis; Chlamydophila psittaci; Clostridium botulinum; Clostridium difficile; Clostridium perfringens; Clostridium tetani; Corynebacterium diphtheria; энтеротоксигенная Escherichia coli (ETEC); энтеропатогенная E. coli; E. coli 0157.Ή7; Francisella tularensis; Haemophilus influenza; Helicobacter pylori; Legionella pneumophila; Leptospira interrogans; Listeria monocytogenes; Mycobacterium leprae; Mycobacterium tuberculosis; Mycoplasma pneumonia; Neisseria gonorrhoeae; Neisseria meningitides; Pseudomonas aeruginosa; Rickettsia rickettsia; Salmonella typhi; Salmonella typhimurium; Shigella sonnei; Staphylococcus aureus; Staphylococcus epidermidis; Staphylococcus saprophyticus; Streptococcus agalactiae; Streptococcus pneumonia; Streptococcus pyogenes; Treponema pallidum; Vibrio cholera; Yersinia pestis; Candida spp.; норовирус (вирус Норуолк); вирус гепатита A; вирусы, вызывающие оспу, грипп, паротит, корь, куриную оспу; вирус Эбола и вирус коревой краснухи. Таким образом, в другом своем варианте, настоящее изобретение относится к применению композиций согласно изобретению для профилактики и лечения состояний, ассоциированных с адгезией на слизистой оболочке и инвазией патогенов, а в частности, для лечения и профилактики приобретенной диареи и диареи путешественников.
Настоящее изобретение также относится к способу профилактики или лечения симптомов, ассоциированных с желудочно-кишечным расстройством у индивидуума, нуждающегося в этом, где указанный способ включает введение терапевтически эффективного количества композиции, состоящей, в основном, из бактерий, принадлежащих к виду Faecalibacterium prausnitzii, Butyricicoccus pullicaecorum, Roseburia inulinivorans, Roseburia hominis, Akkermansia muciniphila, Lactobacillus plantarum и Anaerostipes caccae.
Термин «индивидуум, нуждающийся в лечении» относится к человеку или животному, не являющемуся человеком, имеющим желудочно-кишечное расстройство, описанное выше.
Термин «терапевтически эффективное количество» означает минимальное объединенное общее количество бактерий 7 видов, которые способны оказывать профилактическое или терапевтическое действие. Эти 7 видов бактерий перечислены ниже: Faecalibacterium prausnitzii, Butyricicoccus pullicaecorum, Roseburia inulinivorans, Roseburia hominis, Akkermansia muciniphila, Lactobacillus plantarum и Anaerostipes caccae.
Однако, термин «терапевтически эффективное количество» может также означать минимальное объединенное общее количество бактерий 6 видов, перечисленных ниже: Faecalibacterium prausnitzii, Butyricicoccus pullicaecorum, Roseburia inulinivorans, Akkermansia muciniphila, Lactobacillus plantarum и Anaerostipes caccae.
В зависимости от цели применения, указанное комбинированное общее количество может быть суммой равных количеств каждой из 7 видов бактерий или неравных количеств каждой из 7 видов бактерий, где каждый один вид из 7 видов бактерий имеет минимальный избыток в 0,0001% от совокупного общего количества, более предпочтительно, минимальный избыток в 0,001% от совокупного общего количества, а наиболее предпочтительно, минимальный избыток в 0,01% от совокупного общего количества. Таким образом, если, например, 6 видов бактерий имеют избыток 10,00% от совокупного общего количества, то 7-й вид имеет избыток 40,00% от совокупного общего количества. В зависимости от цели применения, указанное совокупное общее количество составляет в пределах суточной дозы от 102 до 1014бактериальных клеток, предпочтительно в пределах суточной дозы от 103 до 1013 бактериальных клеток, более предпочтительно в пределах суточной дозы от 104 до 1012 бактериальных клеток, а наиболее предпочтительно, в пределах суточной дозы от 105 до 1011 бактериальных клеток.
Настоящее изобретение также относится к описанной выше композиции, из которой исключены бактерии, принадлежащие к виду Roseburia hominis. Термин «исключенный» относится, в частности, к получению композиции из 6 видов бактерий, как указано ниже в разделе «Примеры», без добавления или удаления бактерий вида Roseburia hominis как бактерии 7-го вида.
Настоящее изобретение также относится к описанной выше композиции, в которую были добавлены бактерии, принадлежащие к видам Escherichia coli, Enterococcus faecium, Lactobacillus mucosae, Bifidobacterium adolescentis, Bifidobacterium longum, Bacteroides thetaiotaomicron и Bacteroides vulgatus.
Бактерии видов Escherichia coli (Rath et al. 1999), Enterococcus faecium (Schleifer et al. 1984), Lactobacillus mucosae (Roos et al. 2000), Bifidobacterium adolescentis (Scharek et al. 2000), Bifidobacterium longum (Bahaka et al. 1993), Bacteroides thetaiotaomicron (Scharek et al. 2000) и Bacteroides vulgatus (Rath et al. 1999) хорошо известны специалистам в данной области. Настоящее изобретение также относится к описанной выше композиции, которая также содержит один или более пребиотиков.
Термин «пребиотик» означает любое химическое вещество, которое индуцирует рост или активность микроорганизмов (например, бактерий), оказывающих благоприятный эффект на хозяина. Следовательно, пребиотики могут влиять или изменять состав микроорганизмов в микробиоме кишечника. Однако, в принципе, этот термин имеет более общее значение, который может также относиться и к другим участкам тела. Типичными, но не ограничивающими пребиотиками являются не разлагающие волокна соединения, которые по меньшей мере частично проходят через верхнюю часть желудочно-кишечного тракта в негидролизованном виде и стимулируют рост или активность полезных бактерий, которые колонизируют толстую кишку благодаря их действию в качестве субстрата.
В своем предпочтительном варианте, настоящее изобретение относится к описанной выше композиции, где указанные бактерии культивируют вместе в ферментере, а затем указанную композицию вводят для профилактики или лечения указанных желудочно-кишечных расстройств. Эти композиции также называются (см. далее) как композиции «стратегии коллаборомов» или «альтернативной стратегии коллаборомов». В противоположность этому, композиция, где указанные бактерии не культивируют вместе в ферментере до их введения, называется композицией (см. далее), полученной с использованием «стратегии микросообществ».
В соответствии с этим, настоящее изобретение также относится к описанной выше композиции, где указанный ферментер представляет собой динамический имитатор желудочно-кишечного тракта. В данном конкретном случае, последние композиции также называются (см. далее) как «стратегия коллаборомов».
SHIME® (Имитатор микробной экосистемы человека) представляет собой динамическую in vitro модель человеческого желудочно-кишечного тракта, которая состоит из пяти сосудов с двойной рубашкой, имитирущих желудок, тонкую кишку, а также три области толстой кишки (восходящеую, поперечную и нисходящую толстую кишку), с общим временем удерживания 72 часа (рис. 1). В сосуды-имитаторы желудка и тонкого кишечника, три раза в день добавляли 140 мл питательной среды SHIME® и 60 мл сока поджелудочной железы, соответственно (Van den Abbeele et al., 2010). После первоначального 2-недельного периода стабилизации, который позволяет микробиоте адаптироваться к созданным условиям in vitro, была начата процедура выделения. Таким образом, отобранные микробные штаммы согласно изобретению могут быть инокулированы в одностадийные реакторы (альтернативная стратегия коллаборомов) или в многостадийные реакторы или в динамические имитаторы желудочно-кишечного тракта (например, SHIME® или M-SHIME®, стратегия коллаборомов) в стандартных условиях, которые являются репрезентативными для ЖКТ. В соответствии с этим, настоящее изобретение относится к реактору, содержащему композицию, включающую, состоящую из, или, в основном, состоящую из них, бактерии, принадлежащие к 6 или 7-14 видам, определенным в настоящей заявке и перечисленным ниже, где указанный реактор:
- включает композицию, содержащую, состоящую из них или, по существу, состоящую из них, бактерии, принадлежащие к виду Faecalibacterium prausnitzii, Butyricicoccus pullicaecorum, Roseburia inulinivorans, Roseburia hominis, Akkermansia muciniphila, Lactobacillus plantarum и Anaerostipes caccae, или
- включает композицию, содержащую, состоящую из них или, по существу, состоящую из них, бактерии, принадлежащие к виду Faecalibacterium prausnitzii, Butyricicoccus pullicaecorum, Roseburia inulinivorans, Akkermansia muciniphila, Lactobacillus plantarum и Anaerostipes caccae или
- включает композицию, содержащую, состоящую из них или, по существу, состоящую из них, бактерии, принадлежащие к виду Faecalibacterium prausnitzii, Butyricicoccus pullicaecorum, Roseburia inulinivorans, Roseburia hominis, Akkermansia muciniphila, Lactobacillus plantarum, Anaerostipes caccae, Escherichia coli, Enterococcus faecium, Lactobacillus mucosae, Bifidobacterium adolescentis, Bifidobacterium longum, Bacteroides thetaiotaomicron и Bacteroides vulgatus.
В предпочтительном варианте осуществления изобретения, этот реактор, содержащий указанную композицию, работает в стандартизированных условиях, репрезентативных для желудочно-кишечного тракта, как определено ниже.
Параметрами, характеризующими стандартизированные условия, являются, но не ограничиваются ими: рН (в пределах от 1,5 до 8); наличие источников углерода (углеводов или белков или их комбинаций); время удерживания в конкретном реакторе (в пределах от 10 минут до 200 часов); доступность кислорода (в пределах от 0 до 8 г/л); наличие микроэлементов; присутствие/отсутствие антибиотиков; концентрация солей желчных кислот (в пределах от 0 до 20 мМ); наличие тяжелых металлов; наличие факторов, таких как молекулы иммунной системы хозяина. В предпочтительном варианте осуществления изобретения, параметры, характеризующие стандартизированные условия, включают рН, время удерживания в конкретном реакторе и концентрацию солей желчных кислот, которые определены выше. В зависимости от сложности коллаборомов, для получения функционально стабильного коллаборомов требуется период времени от 1 до 15 дней. В среднем, для создания коллаборомов, состоящего из 7-14 членов, время, достаточное для получения функционально стабильного коллаборомов, составляет от 3 до 10 дней (в зависимости от условий окружающей среды). Следовательно, определенную здесь композицию можно получить после «формирования» или культивирования бактерий в течение периода времени от 3 до 10 дней в условиях, где рН, время удерживания в конкретном реакторе и концентрация солей желчных кислот были определены в настоящей заявке. Такой способ позволяет получать композицию или коллабором, которые являются функционально стабильными.
В контексте настоящего изобретения, термин «функционально стабильный коллабором» означает определенную здесь композицию, содержащую разное начальное количество видов бактерий после культивирования по меньшей мере в течение 3 или 5 или 10 дней.
В другом своем аспекте, настоящее изобретение относится к реактору, работающему в стандартизированных условиях, репрезентативных для желудочно-кишечного тракта, где указанный реактор имеет следующие параметры: рН в пределах от 1,5 до 8; наличие источников углерода; время удерживания от 10 минут до 200 часов; доступность кислорода в пределах от 0 до 8 г/л; наличие микроэлементов; присутствие/отсутствие антибиотиков; концентрация солей желчных кислот в пределах от 0 до 20 мМ; наличие тяжелых металлов; наличие факторов, таких как молекулы иммунной системы хозяина. В одном из вариантов осуществления изобретения, указанный реактор имеет параметры, характеризующие стандартизированные условия, включая рН, время удерживания в конкретном реакторе и концентрацию солей желчных кислот, которые определены в предыдущем параграфе. В одном из вариантов осуществления изобретения, указанный реактор содержит композицию из 5-20 бактерий различных видов или 6-14 бактерий различных видов или 5-15 бактерий различных видов. В предпочтительном варианте осуществления изобретения, время удерживания такой композиции в реакторе составляет от 3 до 14 дней или от 3 до 10 дней, что позволяет получить функционально стабильный коллабором.
Более конкретно, настоящее изобретение относится к композиции и к применению набора микробных штаммов, имеющих специфические функциональные свойства и предварительно адаптированных для их совместного функционирования, в целях профилактики или лечения заболеваний человека и животных и достижения более быстрого биотерапевтического действия и более высокой эффективности по сравнению с теми же самыми штаммами в минимальных сообществах («стратегия микросообществ»). Такой набор микроорганизмов, предварительно адаптированных для их совместного функционирования, называется «стратегией коллаборомов» или «альтернативной стратегией коллаборомов».
Другими словами, настоящее изобретение относится к предварительно адаптированным композициям, состоящим из серий микробных штаммов, предпочтительно используемых в целях значительного сокращения времени до начала биотерапевтического эффекта и/или значительного повышения эффективности лечения дисбактериоза по сравнению с теми же самыми микробными штаммами в минимальных сообществах.
Термин «значительное сокращение времени до начала биотерапевтического эффекта» означает, что серия микроорганизмов, после их предварительной адаптации, может функционировать по меньшей мере на 5% быстрее (по временной шкале), предпочтительно, по меньшей мере на 10% быстрее, более предпочтительно по меньшей на 20% быстрее, а наиболее предпочтительно, по меньшей мере на 30% быстрее по сравнению с набором тех же самых штаммов в минимальных сообществах. Любое значение ниже 5% считается физиологически незначимым.
Термины «значительное повышение эффективности лечения» означает, что серия микроорганизмов после их предварительной адаптации, может функционировать по меньшей мере на 5% более эффективно, предпочтительно, по меньшей мере на 10% более эффективно, более предпочтительно по меньшей на 20% более эффективно, а наиболее предпочтительно, по меньшей мере на 30% более эффективно. Эффективность зависит от конечной цели применения серии микроорганизмов. Возможными функциональными параметрами являются, но не ограничиваются ими, продуцирование короткоцепочечных жирных кислот (SCFA); улучшение барьерной проницаемости кишечника; уменьшение/увеличение уровня провоспалительных цитокинов; увеличение уровня противовоспалительных цитокинов; снижение концентрации патогенов (по меньшей мере на 0,5 log); снижение выделения газа; стимуляция специфических рецепторов стенки кишечника; и т.п. Любое значение ниже 5% считается физиологически незначимым.
Следовательно, более конкретно, настоящее изобретение относится к способу профилактики или лечения дисбактериоза у человека и животных, нуждающихся в этом, где указанный способ включает введение терапевтического количества предварительно адаптированной композиции из серии микробных штаммов указанному человеку или животному, где указанное лечение позволяет значительно сократить время до начала биотерапевтического эффекта и/или значительно повысить эффективность лечения по сравнению с введением серии тех же самых микробных штаммов в минимальных сообществах.
Более конкретно, настоящее изобретение относится к описанной выше композиции, в которой указанные бактерии выбраны из списка следующих штаммов: Faecalibacterium prausnitzii LMG P-29362, Faecalibacterium prausnitzii DSMZ 17677, Butyricicoccus pullicaecorum LMG P-29360, Butyricicoccus pullicaecorum LMG24109, Roseburia inulinivorans LMG P-29365, Roseburia inulinivorans DSMZ 16841, Roseburia hominis LMG P-29364, Roseburia hominis DSMZ 16839, Akkermansia muciniphila LMG P-29361, Akkermansia muciniphila DSMZ 22959, Lactobacillus plantarum LMG P-29366, Lactobacillus plantarum ZJ31 6, Anaerostipes caccae LMG P-29359, Anaerostipes caccae DSMZ 14662 и/или штаммов, последовательности которых по меньшей мере на 97% идентичны последовательностям рРНК 16S по меньшей мере одного из указанных штаммов.
Указанные выше штаммы, имеющие регистрационные номера LMG Р-29362, LMG Р-29360, LMG Р-29365, LMG Р-29364, LMG Р-29361, LMG Р-29366 и LMG Р-29359, были депонированы в лаборатории BCCM/LMG Laboratorium voor Microbiologie, Universiteit Gent (UGent), K. L. Ledeganckstraat 35, B-9000 Гент, Бельгия.
Указанные выше штаммы, имеющие регистрационные номера DSMZ 17677, LMG24109, DSMZ 1 6841, DSMZ 16839, DSMZ 22959, ZJ316 и DSMZ 14662, были подробно описаны и депонированы в общедоступных коллекциях и являются доступными для квалифицированных специалистов всего мира.
Также совершенно очевидно, что варианты каждого из указанных штаммов, которые имеют последовательность, по меньшей мере на 97% (то есть, на 97, 98, 99%) гомологичную последовательности рРНК 16S каждого из указанных соответствующих штаммов, также являются частью настоящего изобретения. Так, например, определение «гомологии» такой последовательности приводится, например, Eeckhaut et al. (2008). Используемый здесь термин «рРНК 16S» относится к последовательности нуклеиновой кислоты приблизительно из 1542 нуклеотидов, которая является компонентом небольшой прокариотической рибосомной субъединицы (30S). Известно, что рРНК 16S действует как каркас, определяющий положения рибосомных белков. Последовательность рРНК 16S обычно используется для филогенетических исследований, поскольку известно, что она является в высокой степени консервативной. Сравнительный анализ последовательностей рРНК 16S тысяч микроорганизмов указывал на присутствие сигнатурных олигонуклеотидных последовательностей. Используемый здесь термин «гомология» означает сходство последовательностей нуклеиновых кислот. Так, например, в общем случае, если две нуклеиновые кислоты имеют идентичные последовательности, то это означает, что они имеют 100% гомологию. Изменение нуклеотидной последовательности одной из нуклеиновых кислот приводит к снижению процента гомологии. Вообще говоря, процент гомологии количественно определяет степень идентичности между двумя последовательностями нуклеиновых кислот.
Идентичность последовательностей или гомология последовательностей определяется здесь как отношение между двумя или более аминокислотными (полипептидными или белковыми) последовательностями или двумя или более последовательностями нуклеиновой кислоты (полинуклеотидными последовательностями), как было определено путем сравнения последовательностей. Обычно, идентичность или сходство последовательностей определяют по всей длине сравниваемых последовательностей. В литературе, термин «идентичность» также определяется как степень родства аминокислотных последовательностей или последовательностей нуклеиновых кислот, и в зависимости от ситуации, она может быть определена по сходству фрагментов таких последовательностей. «Сходство» между двумя аминокислотными последовательностями определяют путем сравнения аминокислотной последовательности и ее консервативных аминокислотных замен в одном полипептиде с последовательностью второго полипептида. «Идентичность» и «сходство» можно легко вычислить различными способами, известными специалистам в данной области. В предпочтительном варианте осуществления изобретения, идентичность последовательностей определяют путем сравнения последовательностей по всей их длине, как это определено в настоящей заявке.
Для определения наибольшего соответствия между тестируемыми последовательностями были разработаны предпочтительные методы определения идентичности. Методы определения идентичности и сходства были представлены кодами в общедоступных компьютерных программах. Предпочтительными компьютерными программами для определения идентичности и сходства двух последовательностей являются, например, BestFit, BLASTP, BLASTN, и FASTA (Altschul, S. F. et al., J. Mol. Biol. 215:403-410 (1990), и эти программы имеются в общедоступной базе данных NCBI и в других источниках (BLAST Manual, Altschul, S., et al., NCBI NLM NIH Bethesda, MD 20894). Наиболее предпочтительным используемым алгоритмом является EMBOSS (httpi//www.ebi.ac.uk/emboss/aliqn). Предпочтительными параметрами для сравнения аминокислотных последовательностей с использованием EMBOSS являются пробел на пропуск 10,0, пробел на удлинение 0,5, матрица Blosum 62. Предпочтительными параметрами для сравнения последовательностей нуклеиновых кислот с использованием EMBOSS являются пробел на пропуск 10,0, пробел на удлинение 0,5, матрица полноразмерной ДНК (матрица для определения идентичности ДНК).
При определении степени подобия аминокислотных последовательностей, специалист в данной области может также учитывать, но необязательно, так называемые «консервативные» замены аминокислот, которые будут очевидны специалистам. Консервативные аминокислотные замены означают взаимозаменяемые остатки, имеющие сходные боковые цепи. Так, например, в группу аминокислот с алифатическими боковыми цепями входят глицин, аланин, валин, лейцин и изолейцин; в группу аминокислот, имеющих алифатические гидроксильные боковые цепи, входят серин и треонин; в группу аминокислот, имеющих амид-содержащие боковые цепи, входят аспарагин и глутамин; в группу аминокислот, имеющих ароматические боковые цепи, входят фенилаланин, тирозин и триптофан; в группу аминокислот, имеющих основные боковые цепи, входят лизин, аргинин и гистидин; а в группу аминокислот, имеющих серусодержащие боковые цепи, входят цистеин и метионин. Предпочтительными консервативными группами аминокислотных замен являются: валин-лейцин-изолейцин, фенилаланин-тирозин, лизин-аргинин, аланин-валин и аспарагин-глутамин. Вариантами описанных здесь аминокислотных последовательностей с заменами являются последовательности, в которых по меньшей мере один остаток в описанных последовательностях был удален, а на его место был введен другой остаток. Предпочтительно, чтобы аминокислотная замена была консервативной. Предпочтительными консервативными заменами для каждой из встречающихся в природе аминокислот являются замены: Ala на Ser; Arg на Lys; Asn на Gln или His; Asp на Glu; Cys на Ser или Ala; Gln на Asn; Glu на Asp; Gly на Pro; His на Asn или Gln; Ile на Leu или Val; Leu на Ile или Val; Lys на Arg, Gln или Glu; Met на Leu или Ile; Phe на Met, Leu или Tyr; Ser на Thr; Thr на Ser; Trp на Tyr; Tyr на Trp или Phe; и Val на Ile или Leu.
Cпециалистам в данной области хорошо известно, что последовательности рРНК 16s могут быть депонированы онлайн, например, в GenBank (http://www.ncbi.nlm.nih.gov/genbank/), и что они могут быть получены по их уникальному регистрационному номеру для использования в качестве эталонной последовательности рРНК 16s при оценке гомологии последовательностей, как описано, например, Eeckhaut et al. (2008). Регистрационные номера GenBank для последовательностей рРНК 16s композиции из 7 видов бактерий перечислены ниже. Для получения соответствующих последовательностей рРНК 16s, эти регистрационные номера могут быть взяты из сайта http//www.ncbi.nlm.nih.gov/qenbank/ для оценки гомологии последовательностей.
Настоящее изобретение также относится к описанной выше композиции, где указанная композиция представляет собой фармацевтическую композицию, приготовленную либо в виде лекарственной формы для ректального введения, либо для перорального введения.
В соответствии с этим, настоящее изобретение также относится к описанной выше композиции, где указанная пероральная лекарственная форма представляет собой капсулу, микрокапсулу, таблетку, гранулу, порошок, пастилку, пилюлю, суспензию или сироп.
Настоящее изобретение также относится к описанной выше композиции, которая включена в продукты питания, напитки, пищевые добавки или натуральные препараты.
Таким образом, настоящее изобретение также относится к описанной выше композиции, которая используется в качестве пищевого продукта, пищевой добавки или лекарственного препарата для лечения человека, домашних животных, животных, выращиваемых на фермах или водных животных. Таким образом, композиция может быть введена в пищевой продукт, функциональные пищевые продукты, пищевые добавки, косметические средства, натуральные препараты, в пробиотическую композицию или фармацевтический препарат. Пищевой продукт обычно представляет собой съедобный продукт, состоящий, главным образом, из одного или более белков, углеводов и жиров, содержащих макроэлементы. Пищевой продукт может также содержать один или более микроэлементов, таких как витамины или минералы.
Используемый здесь термин «пищевой продукт» также охватывает напитки. Примерами пищевых продуктов, в которые может быть включена такая композиция, являются пирожки-снэки, крупы, булочки, сдобы, печенье, пирожные, кондитерские изделия, обработанные овощи, сладости, пробиотические препараты, в том числе йогурты, напитки, жидкости на основе растительных масел, жидкости на основе животного жира, замороженные кондитерские изделия и сыры. Предпочтительными пищевыми продуктами являются йогурты, сыры и другие молочные продукты. Примерами напитков являются безалкогольные напитки, сиропы, сквош (сок с мякотью), сухие смеси для напитков и питательные напитки. Натуральным препаратом являются пищевой ингредиент, пищевая добавка или пищевой продукт, которые, как считается, являются полезными для здоровья, в том числе для профилактики и лечения заболевания. Функциональный пищевой продукт представляет собой пищевой продукт, который обычно продается как полезный беспримесный пищевой продукт для употребления после приема пищи.
Настоящее изобретение также относится к пробиотику, содержащему обсуждаемую здесь композицию. Пробиотик обычно представляет собой «живую» добавку, которая может улучшать микробиоту кишечника. Такие пробиотики могут быть, в частности, приготовлены для человека, а также для сельскохозяйственных и домашних животных и для водных животных. Пробиотик может дополнительно содержать один или более приемлемых наполнителей или отдушек, подходящих для приема вовнутрь человеком или животным.
Композиция согласно изобретению может быть использована для получения фармацевтических композиций. Таким образом, настоящее изобретение также относится к фармацевтической композиции, содержащей композицию согласно изобретению и фармацевтически приемлемый наполнитель или носитель.
Композиции, содержащие соединения согласно изобретению, могут быть приготовлены в различных формах, например, в форме таблетки, капсулы или порошка. Примерами наполнителей, которые могут присутствовать в таких композициях, являются разбавители (например, крахмал, производные целлюлозы или производные сахара), стабилизатор (например, гигроскопичные наполнители, такие как диоксид кремния или мальтодекстрин), лубрикант (например, стеарат магния), буфер (например, фосфатный буфер), связующее вещество, материал для покрытия, консервант или суспендирующий агент. Подходящие наполнители хорошо известны специалистам в данной области.
Более конкретно, настоящее изобретение относится к описанной выше композиции, где указанная композиция содержит всего 105-1011 колониеобразующих единиц бактерий согласно изобретению.
В этом документе и в формуле изобретения, глагол «включать» и его грамматические формы используется в своем неограничивающем смысле, и означает, что включены элементы, следующие после этого глагола, но, при этом не исключены элементы, не указанные конкретно. Кроме того, глагол «состоять» может быть заменен на «состоять, по существу из», и это означает, что определенная здесь композиция, помимо конкретно указанных компонентов, может содержать дополнительный(е) компонент(ы), который(е) не изменяет(ют) уникальные свойства изобретения. Кроме того, если приводится ссылка на элемент, перед которым стоит неопределенный артикль «а» или «аn», то это не исключает возможности того, что присутствует более чем один элемент, если в контексте описания точно не указано, что должен присутствовать один и только один элемент. Таким образом, неопределенный артикль «а» или «аn» обычно означает «по меньшей мере один».
Все патенты и ввылки на литературу, цитируемые в настоящем описании, во всей своей полноте вводятся в настоящее описание посредством ссылки. Нижеследующие примеры представлены лишь в иллюстративных целях и никоим образом не должны рассматриваться как ограничение объема настоящего изобретения.
Примеры
Пример 1. Получение композиции согласно изобретению
1.1. Выделение бактерий для композиции
Для инокуляции модели SHIME® был выбран молодой, здоровый донор, который ранее не проходил терапию антибиотиками. Путем регуляции нескольких рабочих параметров модели SHIME® (фиг. 1, Van den Abbeele et al., 2010) можно обогатить и отобрать сети микробиоты кишечника, которые оказывают благоприятное воздействие на здоровье человека, такие как микробиоты, участвующие в ферментации пищевых волокон, в метаболизме желчных кислот, в расщеплении лактозы и т.п. Система SHIME® была использована для выделения бактериальных штаммов с различными функциональными свойствами, таких как штаммы, разлагающие волокна (например, Bifidobacteria, Bacteroides), ферментирующие штаммы (например, Escherichia coli) или продуценты лактата (например, Lactobacilli, Pediococci и Enterococci), продуценты бутирата (например, Anaerostipes caccae, Butyricicoccus pullicaecorum, Faecalibacteruim prausnitzii, Roseburia hominis, Roseburia inulinivorans, Clostridium butyricum) и продуценты пропионата (например, Bacteroides thetaiotaomicron, Bacteroides vulgatus, Roseburia inulinivorans, Akkermansia muciniphila). Для этих целей могут быть отобраны селективные среды, такие как LAMVAB (Lactobacilli; Hartemink et al., 1997), RB (Bifidobacteria; Hartemink et al. 1996), среда с энтерококками (Enterococci; Possemiers et al., 2004), TBX {Escherichia coli; Le Bon et al., 2010), BBE (группа Bacteroides fragilis; Livingston et al., 1978), среда с минимальным содержанием муцина (Akkermansia; Derrien et al., 2004), M2GSC (продуценты бутирата; Barcenilla et al. 2000) или лактат-содержащая минимальная среда SHIME (продуценты бутирата), минимальная среда SHIME, содержащая сукцинат и фукозу (продуценты пропионата), обогащенная сульфатом минимальная среда (восстановители сульфата), минимальная среда SHIME, содержащая арабиноксилан и планшеты с кровяным агаром (Prevotella). Помимо SHIME, бактерии также выделяли непосредственно из свежего образца фекалий здорового донора с использованием той же самой стратегии.
На практике были получены 10-кратные разведения образцов, собранных из компартментов толстой кишки SHIME, или гомогенизированные образцы фекалий, и эти образцы были распределены по агаровым планшетам, содержащим среду конкретного состава, описанную выше. Планшеты инкубировали при 37°C в соответствующих условиях культивирования бактерий различных групп. После инкубирования было собрано приблизительно 30 колоний на бактериальную группу, и эти колонии инкубировали в соответствующей жидкой культуральной среде в соответствующих условиях. Концентрации короткоцепочечных жирных кислот в ночных культурах были проанализированы с помощью газовой хроматографии, как описано Possemiers et al. (2004). Кроме того, образец жидких культур использовали для филогенетического анализа. ДНК экстрагировали, как описано Possemiers et al., 2004, и почти все последовательности рРНК 16S амплифицировали для каждого изолята с использованием универсальных праймеров эубактерий fD1 и rD1 (Weisburg et al., 1991). После очистки, образцы ДНК отдавали для секвенирования. Полученные последовательности выравнивали с имеющимися последовательностями для идентификации каждого изолята с помощью пакета программ BLAST (http://blast.ncbi.nlm.nih.gov/Blast.cqi).
1.2. Получение композиции согласно изобретению
Для объединения различных бактериальных штаммов в фактически реальные функциональные микробные сети были использованы чистые культуры, выделенные из реактора SHIME® и фекалий (как описано в Примере 1.1). Кроме того, чистые культуры были получены из коллекций культур, таких как BCCM/LMG (http://bccm.belspo.be) и DSMZ (www.dsmz.de).
Жирные кислоты с короткой цепью (SCFA) являются конечными продуктами ферментации пищевых волокон в кишечных микробиотах и, как известно, оказывают некоторое благоприятное воздействие на здоровье хозяина. Основными продуцируемыми SCFA являются ацетат, бутират и пропионат в приблизительном молярном соотношении 60:20:20. Ацетат может всасываться кишечником и используется хозяином в качестве энергетического субстрата, а бутират является основным источником энергии для кишечного эпителия, и было доказано, что он обладает протективным действием против воспаления и рака толстой кишки. Пропионат имеет такую же локальную активность в кишечнике, как и бутират, но, при этом он также транспортируется в печень, где, как было показано, он обладает положительным холестерин-снижающим эффектом и регулирует уровень глюкозы в крови.
Учитывая важные и разнообразные физиологические роли SCFA, можно сказать, что нарушение этой кишечной микробной функции (например, при желудочно-кишечных расстройствах) может оказывать существенное влияние на здоровье хозяина. Следовательно, в этом примере проводили скрининг для получения композиции, которая может индуцировать самый высокий уровень продуцирования общих SCFA и в наиболее предпочтительных соотношениях. В последнем случае, бутират рассматривается как самый интересный из всех различных продуцируемых SCFA. Кроме того, влияние различных композиций на целостность кишечного барьера оценивали путем совместного культивирования эпителиальных и иммунных клеток.
На практике, из глицериновых маточных растворов было получено всего 20 изолятов (именуемых «изолятами-X») с наиболее интересными профилями ферментации, после проведения раунда выделения и отбора, как описано в 1.1, или они были заказаны из коллекций культур, после чего эти изоляты культивировали в соответствующих оптимальных условиях культивирования для получения гомогенных суспензий бактериальных штаммов.
Изоляты были объединены в количествах от 2 до 10 в серии 98 отдельных первоначальных экспериментов скрининга. Для каждого эксперимента, ферментацию начинали в стерильных бутылях для инкубирования, содержащих стерилизованную питательную среду SHIME®, доведенную до рН 6,8 с помощью КН2PO4/K2HPO4, и продували азотом. Затем стерилизованную среду инокулировали 10% (об/об) смешанным инокулятом, состоящим из равных объемов выбранных видов. Бутыли для инкубирования продували азотом для гарантии создания анаэробных условий и инкубировали при 37°C (90 оборотов в минуту). Образцы анализировали через 24 часа на продуцирование SCFA. Затем отбирали композиции с самым высоким уровнем продуцирования бутирата, после чего их использовали в конечном эксперименте с 23 различными сериями бактерий (именуемыми MX-Y, где Х=число изолятов, присутствующих в композиции, а Y=уникальная композиция А, В, C и т.п. с изолятами Х).
Эти 23 комбинации снова инкубировали, как описано выше. Через 24 часа брали образцы для анализа на SCFA и на комбинацию с моделью совместной культуры клеток Сасо-2 и THP1, как описано Possemiers et al. (2013). Конечной точкой последнего эксперимента является измерение транс-эпителиального электрического сопротивления (TEER) в качестве меры для оценки защитных эффектов в отношении функции кишечного барьера.
На фиг. 2 представлены уровни бутирата, полученные после 24-часового инкубирования 23 различных композиций, а также их влияние на величины TEER. Сильное изменение наблюдалось в отношении уровней бутирата и влияния на функционирование кишечного барьера, причем, комбинации с самыми высокими уровнями бутирата необязательно индуцировали самое высокое протективное действие в отношении уровней TEER, как показали различные оценочные рейтинги. Удивительно то, что одна композиция из 7 различных изолятов (называемая M7-B на фиг. 2) заняла первое место по уровням бутирата через 24 часа, а особенно, по протективному действию в отношении функции кишечного барьера. Эта композиция содержала 6 изолятов SHIME и одну культуру, полученную из образца человеческих фекалий. Секвенирование гена рРНК 16S и сравнение его последовательности с последовательностью базы данных NCBI BLAST показали, что М7-B состоит из новых изолятов SHIME Lactobacillus plantarum, Faecalibacterium prausnitzii, Roseburia inulinivorans, Roseburia hominis, Akkermansia muciniphila и Anaerostipes caccae и нового фекального изолята Butyricicoccus pullicaecorum. Интересно отметить, что все новые изоляты присутствовали по меньшей мере в одной из других композиций, показанных на фиг. 2, но ни одна из других композиций не обнаруживала такой же эффективности в отношении продуцирования бутирата и протективного эффекта в отношении величин TEER. Это указывает на то, что наблюдаемый эффект не связан ни с одним из конкретных видов, присутствующих в композиции, и только конкретная комбинация из этих 7 бактерий неожиданно давала положительные результаты.
7 новых изолятов были депонированы в коллекции бактерий BCCM/LMG (Гент, Бельгия) с регистрационными номерами: Faecalibacterium prausnitzii LMG P-29362, Butyricicoccus pullicaecorum LMG P-29360, Roseburia inulinivorans LMG P-29365, Roseburia hominis LMG P-29364, Akkermansia muciniphila LMG P-29361, Lactobacillus plantarum LMG P-29366 и Anaerostipes caccae LMG P-29359.
Поскольку дополнительный эксперимент выявил неожиданное синергическое действие между 7 изолятами и потребность в присутствии каждого из видов, то был проведен эксперимент, в котором каждый раз из исходной композиции, состоящей из 7 изолятов, был удален один из этих изолятов (то есть, он был элиминирован). На практике, ферментацию снова начинали в стерильных бутылях для инкубирования, содержащих стерилизованную питательную среду SHIME®, доведенную до рН 6,8 с помощью КН2PO4/K2HPO4, и продували азотом. Затем стерилизованную среду инокулировали 10% (об/об) смешанным инокулятом, состоящим из равных объемов 6 из 7 изолятов. В качестве контроля использовали полную композицию из 7 изолятов и проводили всего 8 параллельных инкубирований. Бутыли для инкубирования продували азотом для гарантии создания анаэробных условий и инкубировали при 37°C (90 оборотов в минуту). Образцы анализировали через 24 часа и 48 часов на продуцирование бутирата. Как показано на фиг. 3, удаление только одного вида из первоначального состава композиции приводило к значительному снижению уровней продуцирования бутирата через 24 часа для всех композиций из 6 видов до 80% от уровня продуцирования бутирата в исходной композиции. Кроме того, после инкубирования в течение 48 часов, уровни бутирата были значительно ниже для всех композиций из 6 видов, за исключением композиции, не содержащей Roseburia hominis. Это подтверждает, что все изоляты композиции имеют важное значение для достижения полного потенциала композиции. Поскольку только одна композиция, не содержащая Roseburia hominis, имела функциональные свойства, аналогичные функциональным свойствам полной композиции после 48-часового инкубирования, то можно также предсказать, что второй по эффективности является композиция из 6 видов, состоящая, в основном, из Faecalibacterium prausnitzii, Butyricicoccus pullicaecorum, Roseburia inulinivorans, Akkermansia muciniphila, Lactobacillus plantarum и Anaerostipes caccae.
1.3. Получение композиции согласно изобретению
Композицию, состоящую из видов Lactobacillus Plantarum, Faecalibacterium prausnitzii, Butyricicoccus pullicaecorum, Roseburia inulinivorans, Roseburia hominis, Akkermansia muciniphila и Anaerostipes caccae, получали с использованием 3 различных стратегий. Эти стратегии включают: 1) культивирование отдельных видов композиции с последующим их смешиванием, 2) совместное культивирование видов композиций в многостадийном ферментере (то есть, модель SHIME® in vitro, как описано выше), и 3) совместное культивирование видов композиций в одностадийном ферментере.
В первой стратегии (стратегии «микросообществ»), выбранные виды выделяли из глицериновых маточных растворов и культивировали в соответствующих оптимальных условиях культивирования для получения гомогенных суспензий бактериальных штаммов. Для оценки их функциональной активности получали смешанный инокулят, состоящий из равных объемов выбранных видов. Этот инокулят в количестве 10% (об/об) добавляли в стерильные бутыли для инкубирования, содержащие стерилизованную питательную среду SHIME®, доведенную до рН 6,8 с помощью КН2PO4/K2HPO4. Бутыли для инкубирования продували азотом для гарантии создания анаэробных условий и инкубировали при 37°C (90 оборотов в минуту). Через определенные 16-часовые интервалы времени, 40% (об:об) культуральной среды заменяли кондиционированной питательной средой SHIME®. Кондиционированную питательную среду SHIME® получали путем инкубирования 700 мл нормального корма SHIME® (pH 2) в течение 1 часа при 37°C, после чего добавляли 300 мл сока поджелудочной железы (рН 6,8), в который было добавлено 25 г/л NaHCО3, 23,6 г/л КН2PO4 и 4,7 г/л K2HPO4. Образцы анализировали в течение 5 дней на продуцирование SCFA (фиг. 4). Уровни бутирата достиглали 7 мМ после 24-часового инкубирования микросообществ, и максимум 14 мМ через 5 дней.
Во второй стратегии (т.е. стратегии «коллаборомов» или стратегии, «где указанные бактерии культивировали вместе в динамическом имитаторе желудочно-кишечного тракта до введения»), выбранные виды выделяли из глицериновых маточных растворов и культивировали в соответствующих оптимальных условиях культивирования для получения гомогенных суспензий бактериальных штаммов. Затем штаммы смешивали и высевали с тремя повторностями в системе SHIME® (Van den Abbeele et al., 2010), состоящей из одной области толстой кишки при рН 6,15-6,4. Для получения функциональной коллаборомной композиции, период адаптации составлял две недели. Необходимость и актуальность такого периода адаптации была четко продемонстрирована по изменению профилей SCFA во время культивирования композиции выбранных видов (фиг. 5). Первоначально, этой композиции требуется определенное время адаптации, чтобы приспособиться друг к другу и стать активными в превращении подаваемых субстратов в SCFA. Однако, через 4-6 дней после инокуляции, продуцирование SCFA этой композицией начинало стабилизироваться, в результате чего были детектированы высокие уровни бутирата. В последний день инкубирования (день 14), после каждого из трех инкубирований получали в высокой степени сходные стабильные и очень активные функциональные композиции с уровнями бутирата, составляющими 19 мМ.
После замораживания стабилизированного коллаборомов при -80°С в виде глицеринового маточного раствора с последующим оттаиванием для его использования в качестве инокулята таким же способом, как и для стратегии микросообществ, было неожиданно обнаружено, что уровни бутирата увеличивались быстрее и достигали 25% при тех же самых условиях инкубирования, как и в случае использования стратегии микросообществ отдельных видов (фиг. 4). Уровни бутирата достигали 12 мМ уже после 24-часового инкубирования микросообществ и составляли максимум 19 мМ уже через 2 дня.
В третьей стратегии, продуцирование указанной композиции осуществляли с использованием оптимизированного одностадийного ферментера, работающего в режиме периодической культуры с подпиткой (то есть, альтернативная стратегия «коллаборомов» или стратегия, «где указанные бактерии культивировали вместе в ферментере до введения»). Выбранные виды выделяли из глицериновых маточных растворов и культивировали в соответствующих оптимальных условиях культивирования для получения гомогенных суспензий бактериальных штаммов. Ферментацию начинали в стерильных бутылях для инкубирования, содержащих стерилизованную питательную среду SHIME®, доведенную до рН 6,8 с помощью КН2PO4/K2HPO4, и продували азотом. Затем стерилизованную среду инокулировали 10% (об/об) смешанным инокулятом, состоящим из равных объемов выбранных видов. Бутыли для инкубирования продували азотом для гарантии создания анаэробных условий и инкубировали при 37°C (90 оборотов в минуту). Через определенные 16-часовые интервалы времени, 40% (об:об) культуральной среды заменяли кондиционированной питательной средой SHIME®. Кондиционированную питательную среду SHIME® получали путем инкубирования 700 мл нормального корма SHIME® (pH 2) в течение 1 часа при 37°C, после чего добавляли 300 мл сока поджелудочной железы (рН 6,8), в который было добавлено 25 г/л NaHCО3, 23,6 г/л КН2PO4 и 4,7 г/л K2HPO4.
Как показано на фиг. 6, продуцирование общих SCFA, и соотношения SCFA, продуцируемых этой композицией, стабилизировались после проведения 6 циклов замены. При повторной инокуляции с использованием той же стратегии, описанной выше, стабилизированный коллабором давал максимальное продуцирование SCFA (отношение ацетата/пропионата/бутирата составляло приблизительно 14/12/74) на 2 дня раньше по сравнению с той же самой серией видов в стратегии микросообществ, а продуцирование бутирата было на 25% выше.
Пример 2: Эксперименты in vitro
2.1 Эффект добавления функциональной композиции к комплексным сообществам микробов кишечника
Этот эксперимент показал, что функциональная композиция является активной при инокуляции в смешанное микробное сообщество кишечника, где существует сильная конкуренция за связывание субстратов толстой кишки с членами этого комплексного кишечного сообщества, которое, по оценкам, состоит из 500-1000 видов микроорганизмов. Для решения этой проблемы был проведен эксперимент в небольших бутылях для инкубирования с использованием композиции, содержащей Lactobacillus Plantarum, Faecalibacterium prausnitzii, Butyricicoccus pullicaecorum, Roseburia inulinivorans, Roseburia hominis, Akkermansia muciniphila и Anaerostipes caccae, где указанная композиция была получена с использованием стратегии коллаборомов, как описано в Примере 1.3. Предварительно адаптированную композицию в возрастающей концентрации (0, 4 и 20%) промывали в PBS и добавляли к трем различным средам, таким как:
1) Стерильная базальная среда [2 г/л пептона, 2 г/л дрожжевого экстракта, 2 мл/л твина 80, 10 мкл/л витамина К1, 500 мг/л L-цистеина•HCl, 100 мг/л NaCl, 40 мг/л К2HPО4, 40 мг/л КН2РО4, 10 мг/л MgSО4•7H2О, 6,7 мг/л CACl2•2H2О, 1,5 мг/л резазурина, 50 мг/л гемина (50 мг/л) - рН 5,5]+6 г/л крахмала;
2) Базальная среда+20% фекальной суспензии (полученной, как описано De Boever et al., 2000).
3) Базальная среда+20% суспензия толстой кишки SHIME®, содержащая полную микробиоту.
Увеличение концентрации предварительно адаптированного бутират-продуцирующего сообщества от 0% до 4% и 20% приводило к пропорциональному увеличению абсолютных уровней бутирата (фиг. 7). Это наблюдалось не только в стерильной среде, но также и в среде с добавлением смешанной микробиоты, полученной из образца фекалий или области толстой кишки SHIME®. Таким образом, этот эксперимент показал, что такая композиция является активной не только когда она присутствует в неконкурентной окружающей среде толстой кишки, но она также дает более высокие уровни бутирата при ее введении в смешанную микробиоту, где множество кишечных микробов конкурируют за связывание с одними и теми же питательные веществами. Кроме того, увеличивался не только уровень бутирата, но также сильно возрастал уровень продуцирования пропионата. Такое совокупное увеличение указанных уровней и снижение уровня ацетата при инкубировании наводит на мысль, что эта композиция может модулировать общие профили ферментации микробов, в результате чего могут достигаться более полезные для здоровья профили.
2.2. Эффективность функциональной композиции в восстановлении метаболических функций микробного сообщества кишечника, подвергнутого дисбактериозу, индуцированному антибиотиками
Предполагается, что применение антибиотиков вызывает серьезные нарушения кишечного микробного сообщества. Было показано, что микробная композиция, подвергнутая дисбактериозу, является более восприимчивой к инфицированию патогенами. Кроме того, ряд желудочно-кишечных заболеваний, таких как воспалительные заболевания кишечника, коррелирует с микробной композиции, подвергнутой дисбактериозу, что подчеркивает важность микробиома кишечника для здоровья человека. Восстановление таксономического состава, а особенно функциональности, после длительного приема антибиотика, обычно занимает три месяца, и достигает состояния, наблюдаемого до лечения, а именно, микробного сообщества кишечника здорового индивидуума (Panda et al., 2014). Уменьшение времени восстановления после воздействия антибиотиков, может, таким образом, снизить риск развития серьезных инфекций и улучшить здоровье хозяина в целом. В соответствии с этим, наблюдаемая функциональная активность выбранной композиции может рассматриваться как перспективная стратегия повышения уровня восстановления микробных сообществ после индуцированного антибиотиками дисбактериоза и снижения риска инфицирования.
В этом примере, дисбактериоз, индуцированный антибиотиками, был смоделирован в системе SHIME® in vitro путем введения дозы соответствующих антибиотиков. Цель этого эксперимента заключалась в оценке восстановления типичных «здоровых» профилей метаболитов в моделируемой среде толстого кишечника после введения функциональной композиции. Кроме того, целью этого эксперимента является дифференциация эффективности композиции, полученной с использованием либо стратегии «микросообществ», либо стратегии «коллаборомов» (см. Пример 1.3). Этот эксперимент повторяли с использованием композиции, содержащей Lactobacillus Plantarum, Faecalibacterium prausnitzii, Butyricicoccus pullicaecorum, Roseburia inulinivorans, Roseburia hominis, Akkermansia muciniphila и Anaerostipes caccae. Для более точной имитации полного функционального профиля микробиома кишечника, в композицию, используемую в этом конкретном эксперименте, дополнительно вводили Escherichia coli, Enterococcus faecium, Lactobacillus mucosae, Bifidobacterium adolescentis, Bifidobacterium longum, Bacteroides thetaiotaomicron и Bacteroides vulgatus.
На практике, сосуды SHIME® (рН 6,15-6,40) инокулировали фекальным материалом и оставляли для стабилизации на 14 дней (в системе М-SHIME® - Van den Abbeele et al., 2012). После 2-недельного контрольного периода, микробиоту толстой кишки SHIME® обрабатывали коктейлем из антибиотиков (40/40/10 мг/л амоксициллина/ципрофлоксацин/тетрациклина, соответственно) для индуцирования дисбактериоза. На следующий день, микробиоту, подвергнутую дисбактериозу, обрабатывали в течение 5 дней функциональной композицией, полученной с использованием либо стратегии «микросообществ», либо стратегии «коллаборомов». Конечной точкой исследования является оценка восстановления типичных «здоровых» профилей метаболитов SCFA в моделируемой среде толстой кишки. Контрольный сосуд SHIME® был использован для имитации спонтанного восстановления метаболической активности микробного сообщества кишечника после воздействия антибиотиков без введения композиции. Результаты выражены в виде дельты уровней SCFA в SHIME в каждый момент времени по сравнению с результатми, полученными до введения антибиотиков (фиг. 8).
После обработки сосудов SHIME® антибиотиками наблюдалось значительное снижение уровня продуцирования ацетата, пропионата и бутирата. Это наблюдение подтверждает нарушение микробного сообщества кишечника. Восстановление профиля метаболита (в условиях продуцирования SCFA) до состояния, набюдаемого перед обработкой, проиллюстрировно на фиг. 8 как изменение уровня ацетата, пропионата и бутирата в течение 5 дней. Это указывает на то, что восстановление функциональности было медленным в случае контроля (без введения композиции), и при этом, полного восстановления уровня ацетата и пропионата в течение 5 дней не наблюдалось. Интересно отметить, что лечение композицией приводило к более быстрому восстановлению по сравнению с контролем для всех 3 SCFA. Кроме того, композиция, полученная с использованием стратегии «микросообществ», индуцировала полное восстановление уровней пропионата и бутирата через 5 дней и 3 дня, соответственно, а композиция, полученная с использованием стратегии «коллаборомов», индуцировала более быстрое восстановление по сравнению с восстановлением при применении стратегии «микросообществ», и в этом случае, полное восстановление уровней пропионата и бутирата достигалось через 4 дня и 2,5 дня, соответственно. И наконец, стратегия «коллаборомов» также приводила к повышению конечной активности с повышенным уровнем пропионата и бутирата, в отличие от стратегии «микросообществ». Эти результаты подтверждают возможность применения этой композиции для восстановления микробного дисбактериоза, опосредуемого антибиотиками. Кроме того, эти результаты ясно показали, что предварительная адаптация с использованием стратегии «коллаборомов» позволяет достичь более эффективного восстановления продуцирования микробных SCFA после воздействия антибиотиков по сравнению со стратегией «микросообществ».
2.3: Эффективность функциональной композиции в восстановлении метаболических функций микробного сообщества кишечника, подвергнутого дисбактериозу, при воспалительных заболеваниях кишечника
Воспалительные заболевания кишечника (ВЗК) ассоциируются с нарушением микробных взаимодействий у хозяина, что, в свою очередь, по меньшей мере частично, ассоциируется с дисбактериозом микробиоты кишечника. В последнем случае, например, наблюдается снижение количества бутирил-СоА: ацетат-СоА-трансферазы и пропионат-киназы (Vermeiren et al., FEMS 2011), что, в свою очередь негативно влияет на способность к сбалансированному продуцированию SCFA. Учитывая важное влияние SCFA на нормальное развитие и сохранение кишечной микробиоты, можно сделать вывод, что восстановление состава и функциональности микробиоты, а именно, продуцирования SCFA может положительно влиять на симптомы, ассоциированные с ВЗК. В соответствии с этим, наблюдаемая функциональная активность выбранной композиции может оказаться перспективной стратегией ускорения восстановления микробных сообществ при дисбактериозе в случае ВЗК, применяемой в качестве основной стратегии для восстановления и сохранения барьера здорового кишечника.
В этом примере, ВЗК-ассоциированный дисбактериоз был смоделирован с помощью in vitro-модели М-SHIME®, как было описано ранее (Vigsnaes et al. 2013). Цель этого эксперимента заключается в оценке восстановления микробиоты, а именно, профилей SCFA в моделируемой среде толстой кишки после введения функциональной композиции. Кроме того, целью этого эксперимента является дифференциация эффективности композиции, полученной с использованием либо стратегии «микросообществ», либо стратегии «коллаборомов» (см. Пример 1.3). Этот эксперимент повторяли с использованием композиции, содержащей Lactobacillus Plantarum, Faecalibacterium prausnitzii, Butyricicoccus pullicaecorum, Roseburia inulinivorans, Roseburia hominis, Akkermansia muciniphila и Anaerostipes caccae.
На практике, сосуды SHIME® (рН 6,15-6,40) инокулировали фекальным материалом, взятым у пациента с язвенным колитом (система М-SHIME® - Van den Abbeele et al., 2012). Одновременно, для имитации введения, в область толстой кишки добавляли одну дозу функциональной композиции, полученной с использованием либо стратегии «микросообществ», либо стратегии «коллаборомов». Третий эксперимент проводили параллельно в качестве контрольного эксперимента без введения композиции. Продуцирование ацетата, пропионата и бутирата наблюдалось через 1 и 2 дня после введения композиции.
Полученные результаты представлены на фиг. 9: введение композиции, полученной с использованием стратегии «микросообществ», приводило к повышению уровня продуцирования SCFA (в основном, ацетата и бутирата) на день 1, но этот эффект уже не наблюдался на день 2. Это указывает на то, что такая композиция является функционально активной в среде микробиома при ВЗК. Интересно отметить, что влияние на продуцирование пропионата и бутирата было гораздо более выраженным после введения композиции, полученной с использованием стратегии «коллаборомов», то есть, в данном случае наблюдалось 4-кратное и 3-кратное повышение уровня пропионата и бутирата, соответственно, по сравнению с ВЗК-контролем. В отличии от композиции, полученной с использованием стратегии «микросообществ», этот эффект был еще достаточно выраженным на день 2 и соответствовал более низкому продуцированию ацетата (на что указывало повышение уровня перекрестной питающей культуры и, тем самым, увеличение сети микроорганизмов). Эти результаты подтверждают возможность применения этой композиции для устранения ВЗК-ассоциированного микробного дисбактериоза. Кроме того, эти данные ясно указывают на то, что предварительная адаптация с использованием стратегии «коллаборомов» приводила к более эффективному восстановлению продуцирования микробных SCFA при ВЗК по сравнению со стратегией «микросообществ».
2.4. Эффективность функциональной композиции в ингибировании роста вегетативных Clostridium difficile в анализе на моделирование in vitro
В данном примере был проведен тест на провокационное заражение Clostridium difficile для того, чтобы определить является ли функциональная композиция не только функционально активной в кишечных условиях, но может ли она также защитить окружающую среду кишечника от инфекций. В таком тесте на провокационное заражение, композицию инфицировали вегетативными клетками Clostridium difficile (Cdif) для оценки их способности ингибировать рост Cdif в смоделированных желудочно-кишечных условиях. Кроме того, был проведен эксперимент по дифференцированию эффективности композиции, полученной либо с использованием стратегии «микросообществ», либо с использованием стратегии «коллаборомов» (см. пример 1.3). Этот эксперимент повторяли с использованием композиции, содержащей Lactobacillus Plantarum, Faecalibacterium prausnitzii, Butyricicoccus pullicaecorum, Roseburia inulinivorans, Roseburia hominis, Akkermansia muciniphila и Anaerostipes caccae.
На практике, глицериновый маточный раствор Clostridium difficile (LMG 21717Т) оттаивали и высевали в бутыль, содержащую бульон, обогащенный средой клостридий (RCM), который затем продували азотом для создания анаэробных условий. Бутыль инкубировали в шейкерном инкубаторе (90 оборотов в минуту) в течение 24 часов, и 10% выращенной культуры снова инокулировали в бульон RCM. Через 24 часа после культивирования, гомогенизированную культуру C. difficile разделяли на аликвоты (с тремя повторностями) в бутылях (10% об/об), содержащих:
1) базальную среду (контроль);
2) базальную среду, содержащую композицию, полученную с использованием стратегии «микросообществ»;
3) базальную среду, содержащую композицию, полученную с использованием стратегии «коллаборомов»;
4) базальную среду, содержащую суспензию толстой кишки SHIME®.
Бутыли инкубировали при 37°C в шейкерном инкубаторе (90 оборотов в минуту). Через регулярные промежутки времени, образец собирали и сразу замораживали при -80°С до количественной оценки C. difficile с помощью кол.ПЦР-анализа на основе детектирования и количественной оценки гена триозо-фосфат-изомеразы. Для этой цели, геномную ДНК экстрагировали как описано Boon et al. (2003). Реакцию амплификации проводили с использованием прямого и обратного олигонуклеотида: 5'-TATGGACTATGTTGTAATAGGAC-3' (прямого) и 5'-CATAATATTGGGTCTATTCCTAC-3' (обратного). Абсолютное количество ПЦР-продукта вычисляли путем построения стандартной кривой.
В этом регулируемом анализе на моделирование in vitro, рост C. difficile наблюдался в базальной среде после 48-часового инкубирования, что подтверждало присутствие контроля в анализе на моделирование in vitro. Суспензия толстой кишки SHIME® (как модель реального фекального трансплантата) обнаруживала наибольшее ингибирование роста C. difficile после 48-часового инкубирования (то есть, 58%). Интересно отметить, что аналогичный результат был получен для композиции, полученной с использованием стратегии «коллаборомов», на что указывало приблизительно 53% ингибирование роста C. difficile. Самый низкий эффект наблюдался при добавлении композиции, полученной с использованием стратегии «микросообществ» (то есть, 23% ингибирование роста). Этот эксперимент наглядно продемонстрировал, что рост C. difficile в значительной степени ингибируется под действием композиции, и что такое ингибирование является наиболее ярко выраженным в случае предварительной адаптации композиции, полученной с использованием стратегии «коллаборомов».
2.5. Влияние функциональной композиции на биомаркер функционирования кишечного барьера и на кишечный иммунитет у хозяина
В Примерах 2.1-2.3 показано, что композиция является функционально активной в комплексных кишечных условиях и может восстанавливать профили кишечных метаболитов, причем, самая высокая активность наблюдалась при продуцировании с использованием стратегии «коллаборомов». Это может, в свою очередь, благоприятно влиять на кишечный эпителий и, тем самым, на функционирование кишечного барьера и местный иммунитет.
В этом примере, для оценки такой возможности была использована комбинация образцов, взятых из предыдущих экспериментов по установленной модели совместного культивирования энтероцитов (клеток Сасо-2) и макрофагов (THP1) (Possemiers et al. 2013). В этой модели, стимуляция клеток THP1 липополисахаридами приводит к повышению уровня продуцирования провоспалительных цитокинов, что, в свою очередь, будет разрушать слой энтероцитов, создавая так называемое состояние «негерметичного» кишечника. Влияние на «негерметичный» кишечник измеряют путем оценки эффекта трансэпителиального электрического сопротивления (TEER) [измерения эффективности кишечного барьера] и уровня продуцирования воспалительных цитокинов по сравнению с контролем.
На практике, образцы, собранные на 1 день после проведения эксперимента М-SHIME, как описано в примере 2.3, объединяли с моделью совместной культуры «негерметичного» кишечника.
2.6. Влияние вариаций идентичности штамма на функциональную активность композиции
Для того, чтобы определить, является ли неожиданный синергический эффект 7 изолятов в композиции штамм-специфическим, или он может быть также достигнут с использованием других штаммов того же вида, был проведен дополнительный эксперимент. В этом примере, две различных композиции получали с использованием стратегии «коллаборомов» (см. пример 1.3). Композиция 1 содержит специфические изоляты, описанные в примере 1.2, а композиция 2 состоит из штаммов тех же самых видов, полученных из коллекции культур:
- Композиция 1: Faecalibacterium prausnitzii LMG P-29362, Butyricicoccus pullicaecorum LMG P-29360, Roseburia inulinivorans LMG P-29365, Roseburia hominis LMG P-29364, Akkermansia muciniphila LMG P-29361, Lactobacillus plantarum LMG P-29366 и Anaerostipes caccae LMG P-29359;
- Композиция 2: Lactobacillus plantarum ZJ316, Faecalibacterium prausnitzii (DSMZ 17677), Butyricicoccus pullicaecorum (LMG 24109), Roseburia inulinivorans (DSMZ 16841), Roseburia hominis (DSMZ 16839), Akkermansia muciniphila (DSMZ 22959) и Anaerostipes caccae (DSMZ 14662).
На практике, выбранные виды выделяли из глицериновых маточных растворов и культивировали в соответствующих оптимальных условиях роста для получения гомогенных суспензий бактериальных штаммов. Затем штаммы смешивали с получением Композиции 1 и Композиции 2, соответственно, и каждую из них засевали с тремя повторностями в систему SHIME® (Van den Abbeele et al., 2010), состоящую из одной области толстой кишки при рН 6,15-6,4. Профили продуцирования бутирата наблюдали в течение 14 дней.
Интересно отметить, что динамика продуцирования бутирата была очень похожа для обеих композиций, то есть, сначала наблюдались сильные колебания, а затем, приблизительно через 6 дней, уровни бутирата стабилизировались. По окончании эксперимента (день 14), уровни бутирата для композиции 1 составляли 19,3 мМ, а уровни для композиции 2 составляли 18,8 мМ. Это указывает на то, что синергический эффект, наблюдаемый в композиции Примера 1.2, может быть воспроизведен с использованием различных штаммов, полученных из одних и тех же видов.
Пример 3. Эксперименты in vivo
3.1. Мышиная модель разрушения микробиоты желудочно-кишечного тракта, индуцируемого антибиотиками
В этом примере был проведен эксперимент для того, чтобы определить, может ли функциональная композиция восстанавливать метаболическую способность микробиома кишечника после индуцированного антибиотиками дисбактериоза также в условиях in vivo.
В этом примере использовали композицию, содержащую Lactobacillus plantarum, Faecalibacterium prausnitzii, Butyricicoccus pullicaecorum, Roseburia inulinivorans, Roseburia hominis, Akkermansia muciniphila и Anaerostipes caccae и полученную с использованием стратегии «коллаборомов» Примера 1.3. Кроме того, для того, чтобы определить, необходима ли более точная имитация полного профиля функциональности кишечного микробиома, проводили дополнительный эксперимент, в котором использовали композицию с добавлением Escherichia coli, Enterococcus faecium, Lactobacillus mucosae, Bifidobacterium adolescentis, Bifidobacterium longum, Bacteroides thetaiotaomicron и Bacteroides vulgatus (эта композиция называеся композицией с «расширенным составом»).
На практике, «композицию» и «композицию с расширенным составом» приготавливали в свежем виде с использованием стратегии «коллаборомов», два раза промывали в PBS (в анаэробной камере для обеспечения анаэробных условий), концентрировали в 100 мкл и вводили мышам через желудочный зонд, как только это было возможно. Были закуплены мыши (C57/НД6) в возрасте по меньшей мере 5 недель, и этих мышей содержали в условиях с отсутствием патогенов и давали стандартный корм. Эксперименты на мышах проводили в соответствии с протоколами, утвержденными Комитетом по этике проведения испытаний на животных Гентского Университета в Бельгии. Для индуцирования дисбактериоза, вызываемого антибиотиками, в питьевую воду вводили дозу антибиотика клиндамицина в концентрации 250 мг/л. Через 5 дней после введения антибиотика, содержимое желудка мышей нейтрализовали NaHCO3, после чего мышам (10 мышей на группу) перорально через желудочный зонд в течение 5 дней подряд вводили:
1) композицию в физиологическом растворе;
2) композицию с «расширенным составом» в физиологическом растворе и
3) физиологический раствор (контроль).
Обычную группу (которой не вводили антибиотики, но которую обрабатывали физиологическим раствором) включали в качестве контроля для исключения вариабельности, возникающей после введения зонда. Во время эксперимента брали образцы фекалий (приблизительно 100 мг/мышь) и хранили при -80°С для последующих анализов.
Профили SCFA, полученные из образцов фекалий, взятых у мышей одних и тех же групп, показали, что 5-дневная обработка антибиотиками приводила к значительному снижению уровня продуцирования бутирата и пропионата до такой степени, что продуцировался только ацетат (фиг. 10). Как показано на фиг. 10, спонтанное восстановление метаболических функций происходило медленно и начиналось только приблизительно через 5 дней (D10) после последней обработки антибиотиками, хотя молярные соотношения трех основных SCFA (ацетата, пропионата и бутирата) не достигали состояния, наблюдаемого до введения антибиотиков. Однако, после обработки мышей «композицией» или «композицией с расширенным составом», полученной с использованием стратегии «коллаборомов», восстановление метаболизма бутирата началось уже приблизительно через 3 дня (d8) после обработки антибиотиками. Более того, метаболическая активность у мышей, обработанных обеими композициями, почти полностью восстановливалась через 5 дней после введения последней дозы антибиотиков (d10) с хорошим продуцированием как пропионата, так и бутирата. Композиция с расширенным составом содержала более высокое разнообразие продуцентов ацетата и пропионата по сравнению с обычной композицией, о чем также свидетельствовал несколько иной профиль ферментации на 10-й день эксперимента. В заключение следует отметить, что этот пример дает подтверждение in vivo, что функциональная композиция является эффективной для достижения более быстрого и более активного восстановления профилей кишечных метаболитов после дисбактериоза, индуцированного антибиотиками. Кроме того, изменение точных комбинаций видов в композиции позволяет скорректировать конечный результат в отношении специфических профилей метаболитов.
3.2. Мышиная TNBS-модель воспаления
Модель с использованием TNBS (2,4,6-тринитробензолсульфоновой кислоты) представляет собой широко используемую модель колита, которая имитирует некоторые признаки болезни Крона (Scheiffele et al., 2001), включая потерю массы, кровянистую диарею и утолщение стенки кишечника. Гистопатологический анализ на TNBS выявил очаги трансмурального воспаления кишечника с образованием глубоких язв, классические признаки которых наблюдаются у пациентов с БК. Это делает TNBS-модель хорошим кандидатом для in vivo оценки способности функциональной композиции предотвращать и/или устранять повреждения слизистой оболочки кишечника при ВЗК и стимулировать сохранение/развитие барьера здорового кишечника.
В этом примере была использована композиция, содержащая Lactobacillus plantarum, Faecalibacterium prausnitzii, Butyricicoccus pullicaecorum, Roseburia inulinivorans, Roseburia hominis, Akkermansia muciniphila и Anaerostipes caccae, для оценки благоприятных эффектов после применения TNBS-модели. Кроме того был проведен эксперимент по дифференцированию эффективности композиции, полученной либо с использованием стратегии «микросообществ», либо с использованием стратегии «коллаборомов» (см. пример 1.3). Колит у животных был вызван ректальной инстилляцией TNBS, то есть, агентов, сенсибилизирующих слизистую оболочку и разведенных в этаноле. Введение этанола является необходимым условием разрушения барьера слизистой оболочки толстой кишки для обеспечения проникновения TNBS в собственную пластинку слизистой. TNBS гаптенизирует локализованные микробные белки толстой кишки и кишечника, в результате чего, они становятся иммуногенными и запускают природные и адаптивные иммунные ответы у хозяина.
На практике, самцы 8-10-недельных мышей C57BL6/J были помещены в камеру с регулируемой температурой при 20°С с 12-часовым циклом день-ночь. Животные имели свободный доступ к воде и к коммерчески доступному корму. Мыши были произвольно распределены по клеткам во избежание эффектов «изолятора». Эксперимент начинали после акклиматизации в течение 1 недели. Каждую группу (n=9/группу) обрабатывали 5 дней подряд с помощью перорального зонда. Профилактическую дозу при всех обработках начинали за 1 день до ректального введения 2 мг TNBS/50%EtOH и продолжали в течение 4 дней после введения TNBS, а затем мышей умерщвляли. Была проведена следующая обработка:
1) TNBS+композиция, полученная с использованием стратегии «микросообществ» в физиологическом растворе;
2) TNBS+композиция, полученная с использованием стратегии «коллаборомов» в физиологическом растворе; и
3) TNBS+физиологический раствор (контроль).
Обычную группу (которую не подвергали TNBS-обработке, но обрабатывали физиологическим раствором) включали в качестве контроля для исключения вариабельности, возникающей после введения зонда. Конечной точкой исследования был ежедневный мониторинг активности заболевания (перед ежедневной обработкой) путем измерения массы тела, наличия крови в фекалиях (ColoScreen) и оценки общего внешнего вида.
Результаты этого примера представлены на фиг. 11. У контрольной группы, обработанной носителем (физиологическим раствором) без TNBS не наблюдалось ни потери массы, ни активности заболевания, а у контрольной группы, которой вводили TNBS, сразу наблюдалась 8% потеря массы на день 1 и сильное повышение активности заболевания. И потеря масса и активность заболевания были частично восстановлены в конце исследования. Интересно отметить, что композиции давала сильный протективный эффект, предотвращающий потерю массы и активность заболевания, и все же степень этого протективного эффекта зависела от стратегии получения композиции. Начальный слабый протективный эффект наблюдался на день 1 в случае стратегии «микросообществ», на что указывало снижение потери массы и активности заболевания, но этот протективный эффект больше не наблюдался в последующие дни исследования. В противоположность этому, введение композиции, полученной с использованием стратегии «коллаборомов», давал сильный профилактический эффект, предотвращающий потерю массы и активность заболевания на день 1, по сравнению с TNBS-контролем, а более быстрое и полное восстановление наблюдалось к конце исследования, на что указывало возвращение активности заболевания на уровень, наблюдаемый в случае использования контроля-носителя. В заключение следует отметить, что этот пример дает подтверждение in vivo, что функциональная композиция является эффективной для достижения более быстрого предотвращения и более быстрого и эффективного устранения кишечного воспаления и активности заболевания при TNBS-индуцированном колите. Кроме того, эти результаты ясно продемонстрировали, что предварительная адаптация с использованием стратегии «коллаборомов» является более эффективной, чем адаптация в случае использования стратегии «микросообществ».
3.3. Мышиная DSS-модель воспаления
DSS-модель хронического колита представляет собой широко используемую модель колита, которая имитирует некоторые признаки болезни Крона, включая потерю массы и кровянистую диарею. В соответствии с гистопатологическим анализом, длительное введение DSS вызывало воспаление кишечника с типичными структурными изменениями, такими как искривление крипт, инфильтрация воспалительных клеток (суб)слизистой оболочки и фиброз, то есть, признаки, наблюдаемые у пациентов с БК. Это делает DSS-модель хорошим кандидатом для in vivo оценки способности функциональной композиции предотвращать и/или устранять повреждения слизистой оболочки кишечника при ВЗК и стимулировать сохранение/развитие барьера здорового кишечника.
В этом примере была использована композиция, содержащая Lactobacillus plantarum, Faecalibacterium prausnitzii, Butyricicoccus pullicaecorum, Roseburia inulinivorans, Roseburia hominis, Akkermansia muciniphila и Anaerostipes caccae, и полученная с использованием стратегии «коллаборомов» (см. пример 1.3) для оценки благоприятных эффектов после применения DSS-модели хронического колита. Колит был вызван у животных путем повторного введения DSS в питьевую воду (0,25% контрольное заражение). Этот эксперимент проводили всего 8 дней с 3 циклами введения DSS и восстановления.
На практике, самцы 6-недельных мышей C57BL6/J были помещены в камеру с регулируемой температурой при 20°С с 12-часовым циклом день-ночь. Животные имели свободный доступ к воде и к коммерчески доступному корму. Мыши были произвольно распределены по клеткам во избежание эффектов «изолятора». Эксперимент начинали после акклиматизации в течение 1 недели. Каждую группу (n=10/группу) обрабатывали 3 раза в неделю 8 дней подряд с помощью перорального зонда. Профилактическую дозу при всех обработках начинали за 1 неделю до первого DSS-цикла. Первый DSS-цикл начинали на неделю 2, и этот цикл включал введение DSS в течение 1 недели (0,25% в питьевой воде) с последующим 2-недельным восстановлением. После первого цикла проводили идентичный второй DSS-цикл. Третий DSS-цикл состоял из введения DSS в течение одной недели с последующим восстановлением в течение одной недели, после чего животных умерщвляли. Была проведена следующая обработка:
1) Контроль без DSS
2) DSS+композиция, полученная с использованием стратегии «коллаборомов» в физиологическом растворе (3 раза в неделю); и
3) DSS+физиологический раствор (DSS-контроль).
Конечной точкой исследования был ежедневный мониторинг индекса активности заболевания (DAI) во время каждого DSS-цикла три раза в неделю (перед ежедневной обработкой) путем измерения массы тела, наличия крови в фекалиях (ColoScreen) и оценки общего внешнего вида. Как показано на фиг. 12, в случае контрольной группы, обработанной носителем (физиологическим раствором) без DSS, какого-либо влияния на DAI не наблюдалось, а у контрольной группы, которой вводили DSS, наблюдалось значительное увеличение DAI в каждом цикле введения. Интересно отметить, что указанная композиция давала сильный протективный эффект (приблизительно 25% снижение DAI в каждом цикле) от активности заболевания. Это также указывает на то, что функциональная композиция является эффективной для достижения сильного протективного эффекта, защищающего от кишечного воспаления и активности заболевания при DSS-индуцированном колите.
Пример 3.5. Модель воспаления слизистой оболочки
Воспаление слизистой оболочки является клиническим термином, используемым для описания повреждений слизистых оболочек после противораковой терапии. Воспаление слизистой оболочки происходит во всем желудочно-кишечном тракте (ЖКТ) (в том числе во рту), в мочеполовых путях и в меньшей степени на других поверхностях слизистых оболочек. Его тяжесть и продолжительность варьируется в зависимости от дозы и типа используемого лекарственного средства.
Важной особенностью воспаления слизистой оболочки является то, что оно ограничивает дозу химиотерапии. Эпителий крипты ЖКТ является особенно восприимчивым к химиотерапевтической токсичности, и его симптомами являются тошнота и рвота, боли в животе, вздутие и понос из-за прямого воздействия цитотоксических веществ на слизистую оболочку. Крысиная модель воспаления слизистой оболочки кишечника, индуцированного 5-фторурацилом (5-FU), была разработана Keefe и др. для оценки влияния химиотерапии на ЖКТ, и в настоящее время эта модель является одной из наиболее широко используемых моделей для исследования воспаления слизистой оболочки у крыс, индуцированного химиотерапией (Keefe 2004).
В этом примере, в качестве основы для эксперимента была использована композиция, содержащая Lactobacillus plantarum, Faecalibacterium prausnitzii, Butyricicoccus pullicaecorum, Roseburia inulinivorans, Roseburia hominis, Akkermansia muciniphila и Anaerostipes caccae и полученная с использованием стратегии «коллаборомов» Примера 1.3. Воспаление слизистой оболочки индуцировали путем введения одной внутрибрюшинной дозы 5-FU.
На практике, всего 30 крыс были произвольно распределены по контрольным и экспериментальным группам в соответствии с определенной временной точкой. Все крысы в экспериментальных группах получали одну внутрибрюшинную дозу 5-FU (150 мг 5-FU/кг массы тела). Крыс в контрольных группах обрабатывали растворителем, используемым в качестве носителя (диметилсульфоксидом). После введения химиотерапевтических препаратов, конечные точки исследования, такие как смертность, диарея и общее клиническое состояние, оценивали четыре раза в течение 24 часов. Крыс, входящих в подгруппы, умерщвляли путем обескровливания и смешения шейных позвонков через 24, 48 и 72 часа после введения препарата. Первичными представляющими интерес конечными точками являются изменение массы, диарея и общее клиническое состояние (оценка слабости). Вторичными конечными точками являются данные гистологического анализа образцов кишечника и данные анализа микробиоты стула и слизистой оболочки кишечника.
Для того, чтобы оценить влияние композиции с точки зрения профилактики или ослабления оцениваемых симптомов, некоторым крысам 8 дней подряд вводили композицию с помощью перорального зонда. Профилактическую дозу вводили за 5 дней до начала введения 5-FU и продолжали вводить в течение 3-х дней после введения 5-FU или до умерщвления крыс. Контрольным животным композицию не вводили.
Библиография
- Bahaka et al. 1993 - Phenotypic and genomic analyses of human strains belonging or related to Bifidobacterium longum, Bifidobacterium infantis and Bifidobacterium breve. - Int J Syst Evol Microbiol. 43: 565-573
- Barcenilla et al. 2000 - Phylogenetic relationships of butyrate-producing bacteria from the human gut - Appl Environ Microbiol 66, 1 654-1 661
- Barnett et al. 2012 - The interactions between endogenous bacteria, dietary components and the mucus layer of the large bowel. - Food Funct. 3: 690-9
- Becker et al. 201 1 - Human intestinal microbiota: characterization of a simplified and stable gnotobiotic rat model - Gut Microbes, 2: 25-33
- Boon et al. 2003 - Bioaugmentation as a tool to protect the structure and function of an activated-sludge microbial community against a 3-chloroaniline shock load - Appl Environ Microbiol, 69: 151 1-1520
- Brandl et al. 2008 - Vancomycin-resistant enterococci exploit antibiotic-induced innate immune deficits - Nature. 455: 804-7
- Cenit et al. 2014 - Rapidly expanding knowledge on the role of the gut microbiome in health and disease - Biochim Biophys Acta. 1842: 1984-1992
- Clemente et al. 2012 - The impact of the gut microbiota on human health: an integrative view - Cell. 148: 1258-70
- Cummings & Macfarlane, 1997 - Role of intestinal bacteria in nutrient metabolism - J Parenter Enteral Nutr. 21: 357-65
- Derrien et al. 2004 - Akkermansia muciniphila gen. nov., sp. nov., a human intestinal mucin-degrading bacterium - Int J Syst Evol Microbiol. 54: 1469- 1476
- De Vrieze 2013 - Medical research. The promise of poop - Science. 341: 954- 7
- Duncan et al. (2002) - Growth requirements and fermentation products of Fusobacterium prausnitzii, and a proposal to reclassify it as Faecalibacterium prausnitzii gen. nov., comb. nov. - Int J Syst Evol Microbiol. 52: 2141 -2146
- Duncan et al. (2006) - Proposal of Roseburia faecis sp. nov., Roseburia hominis sp. nov. and Roseburia inulinivorans sp. nov., based on isolates from human faeces - Int J Syst Evol Microbiol. 56: 2437-2441
- Eeckhaut et al. (2008) - Butyricicoccus pullicaecorum gen. nov., sp. nov., an anaerobic, butyrate-producing bacterium isolated from the caecal content of a broiler chicken - Int J Syst Evol Microbiol, 58: 2799-2802
- Fuller & Gibson, 1997 - Modification of the intestinal microflora using probiotics and prebiotics - Scand J Gastroenterol Suppl. 222: 28-31
- Hartemink et al. 1996 - Raffinose-Bifidobacterium (RB) agar, a new selective medium for bifidobacteria - J Microbiol Methods, 27: 33-43
- Hartemink et al. 1997 - LAMVAB- A new selective medium for the isolation of lactobacilli from faeces - J Microbiol Methods, 29: 77-84
- Lannitti and Palmieri, 2010 - Therapeutical use of probiotic formulations in clinical practice - Clin Nutr. 29: 701 -25
- Le Bon et al. 2010 - Influence of probiotics on gut health in the weaned pig -Livestock Sci, 133: 179-181
- Livingston et al. 1798 - New medium for selection and presumptive identification of the Bacteroides fragilis group. J Clin Microbiol 7: 448-453 Keefe 2004 - Gastrointestinal mucositis: a new biological model - Supp Care Cane, 12: 6-9
- Khoruts et al, 2010 - Changes in the composition of the human fecal microbiome after bacteriotherapy for recurrent Clostridium difficile-associated diarrhea - J Clin Gastroenterol. 44: 354-60
- Kinross et al. 201 1 - Gut microbiome-host interactions in health and disease -Genome Med. 3: 14
- Macfarlane & Macfarlane, 1997 - Human colonic microbiota: ecology, physiology and metabolic potential of intestinal bacteria - Scand J Gastroenterol, 32: 3-9
- Newton et al 1998 - Growth of a human intestinal Desulfovibrio desulfuricans in continuous cultures containing defined populations of saccharolytic and amino acid fermenting bacteria - J Appl Microbiol 85: 372-380
- Panda et al. 2014 - Short-Term Effect of Antibiotics on Human Gut Microbiota - PloS One, 9: e95476
- Petrof et al, 2013 - Stool substitute transplant therapy for the eradication of Clostridium difficile infection: 'RePOOPulating' the gut - Microbiome 1: 3-10 Possemiers et al. 2004 - PCR-DGGE-based quantification of stability of the microbial community in a simulator of the human intestinal microbial ecosystem - FEMS Microbiol Ecol, 49: 495-507
- Possemiers et al. 2013 - A dried yeast fermentate selectively modulates both the luminal and mucosal gut microbiota, enhances butyrate production and protects against inflammation, as studied in an integrated in vitro approach - J Agric Food Chem, 61: 9380-9392
- Rath et al. 1999 - Differential induction of colitis and gastritis in HLA-B27 transgenic rats selectively colonized with Bacteroides vulgatus or Escherichia coli. - Infect Immun, 67: 2969-2974
- Roos et al. 2000 - Lactobacillus mucosae sp. nov., a new species with in vitro mucus-binding activity isolated from pig intestine. Int J Syst Evol Microbiol, 50 251 -258
- Scharek et al. 2000 - Bifidobacterium adolescentis Modulates the Specific Immune Response to Another Human Gut Bacterium, Bacteroides thetaiotaomicron, in Gnotobiotic Rats - Immunobiology, 5: 429-441
- Scheiffele and Fuss 2002 - Induction of TNBS colitis in mice. Curr Protocols Immunol, doi: 10.1002/0471 142735. im1519s49
- Schleifer et al. 1984 - Transfer of Streptococcus faecalis and Streptococcus faecium to the Genus Enterococcus nom. rev. as Enterococcus faecalis comb nov. and Enterococcus faecium comb. nov. - Int J Syst Evol Microbiol 34: 31 -34
- Schwiertz et al. 2002 - Anaerostipes caccae gen. nov., sp. nov., a new saccharolytic, acetate-utilising, butyrate-producing bacterium from human faeces - Syst AppI Microbiol 25, 46-51
- Sekirov et al, 2008 - Antibiotic-induced perturbations of the intestinal microbiota alter host susceptibility to enteric infection - Infect Immun. 76: 4726-36
- Van den Abbeele et al. 2010 - Microbial community development in a dynamic gut model is reproducible, colon region specific, and selective for Bacteroidetes and Clostridium cluster IX - AppI Environ Microbiol 76: 5237-5246
- Van den Abbeele et al. 2013 - Prebiotics, faecal transplants and microbial network units to stimulate biodiversity of the human gut microbiome - Microb Biotechnol. 6: 335-40
- Van Loo et al, 1999 - Functional food properties of non-digestible oligosaccharides: a consensus report from the ENDO project (DGXII AIRII-CT94-1095) - Br J Nutr. 81: 121 -32
- Vermeiren et al. 2011 - Decreased colonization of fecal Clostridium coccoides/Eubacterium rectale species from ulcerative colitis patients in an in vitro dynamic gut model with mucin environment - FEMS Microbiol Ecol, 79: 685-696
- Vigsnaes et al. 2013 - Microbiotas from UC patients display altered metabolism and reduced ability of LAB to colonize mucus - Sci Rep. 3:1110 Walter 2008 - Ecological Role of Lactobacilli in the Gastrointestinal Tract: Implications for Fundamental and Biomedical Research - AppI Environ Microbiol, 74: 4985-4996
- Weisburg et al. 1991-16S ribosomal DNA amplification for phylogenetic study - J. Bacteriol, 173: 697-703
- Willing et al, 2009 - Twin studies reveal specific imbalances in the mucosa-associated microbiota of patients with ileal Crohn's disease - Inflamm Bowel Dis. 15: 653-60
- WO2013037068 - Method for treatment of disorders of the gastrointestinal system (Allen-Vercoe and Petrof, 2013)
- WO2014145958A2 - Network-based microbial compositions and methods (Henn et al 2014).
Реферат
Группа изобретений относится к области фармацевтики, а именно к композиции для профилактики или лечения симптомов, ассоциированных с желудочно-кишечным расстройством, и к реактору для получения функционально стабильного коллаборома, содержащему эту композицию. Композиция состоит из эффективного количества бактерий, принадлежащих к видуFaecalibacterium prausnitzii, Butyricicoccus pullicaecorum, Roseburia inulinivorans, Roseburia hominis, Akkermansia muciniphila, Lactobacillus plantarumиAnaerostipes caccae,или из эффективного количества бактерий, принадлежащих к видуFaecalibacterium prausnitzii, Butyricicoccus pullicaecorum, Roseburia inulinivorans, Akkermansia muciniphila, Lactobacillus plantarumиAnaerostipes caccae, и, в случае необходимости, фармацевтически приемлемого эксципиента или эксципиентов. Реактор представляет собой динамическуюin vitroмодель человеческого желудочно-кишечного тракта, которая состоит из пяти сосудов с двойной рубашкой, имитирующих желудок, тонкую кишку и три области толстой кишки: восходящую, поперечную и нисходящую толстую кишку, с общим временем удерживания 72 ч. Группа изобретений обеспечивает получение синергической композиции, состоящей из определенных видов бактерий, обеспечивающей высокую эффективность для профилактики или лечения симптомов, ассоциированных с желудочно-кишечным расстройством. 2 н. и 8 з.п. ф-лы, 12 ил., 3 табл., 3 пр.

Комментарии