Производные фталазина и терапевтические средства для эректильной дисфункции - RU2229476C2
Код документа: RU2229476C2
Описание
Техническая область изобретения
Данное изобретение относится к производным фталазина. Более точно, оно относится к профилактическим и терапевтическим средствам для мужской эректильной дисфункции, а также к профилактическим и терапевтическим средствам для женской половой дисфункции или дисменоррагии.
Предшествующий уровень
Полагают, что в Японии количество латентных пациентов с эректильной дисфункцией насчитывает приблизительно 3000000 человек. Сообщается, что в США число пациентов с эректильной дисфункцией достигает 20000000, и 15% мужчин в возрасте от пятидесяти до шестидесяти лет и приблизительно 1/3 мужчин в возрасте от шестидесяти до семидесяти лет страдает от этого заболевания. В этой возрастной группе половой акт расценивается как приятное и эмоциональное поведение. При обязательном улучшении качества жизни ожидается, что в будущем эректильная дисфункция будет возведена в степень не только медицинской, но и социальной проблемы. Это заболевание подразделяется на органическую импотенцию, вызываемую расстройствами нервов, кровеносных сосудов или мышц в половом члене, и функциональную (психическую) импотенцию, вызываемую умственными или психологическими проблемами. Для эрекции необходимы три фактора, а именно: повышение артериального кровотока в пенисе, регуляция оттока крови из вен полового члена и релаксация (расслабление) кавернозной ткани. Когда, по меньшей мере, одно из этих состояний ингибировано, возникает эректильная дисфункция.
Урологические методы лечения эректильной дисфункции, осуществляемые в настоящее время, включают лекарственную терапию и оперативное протезирование пениса с использованием протезов пениса (penile prosthetic appliances).
В качестве лекарственной терапии в кавернозную ткань пениса можно вводить папаверин гидрохлорид или простагландин Еl. Однако это лечение в настоящее время трудно выполнимо, поскольку в Японии не допускается, чтобы пациент сам вводил себе инъекцию, а обращаться к врачу при каждом половом акте на практике невозможно. Кроме того, инъекция папаверина гидрохлорида вызывала бы, хотя и в исключительных случаях, болезненный симптом, называемый приапизмом. Таким образом, лечение с помощью существующих лекарств практически невозможно. Следовательно, разработка лекарственной терапии, клинически эффективной на практике, является крайне необходимой.
В 1984 году Bowman and Drummond сообщили, что селективный ингибитор циклической GMP фосфодиэстеразы М&В22948 (zaprinast) повышал содержание циклической GMP в ткани и релаксировал ретракторную мышцу пениса быка (Cyclic GMP mediates neurogenic relaxation in bovine retractor penic muscle, Br. J.Phamacol., 81, 665-674, 1984). После этого другие авторы один за другим описали релаксацию пещеристого тела пениса посредством повышения содержания циклической GMP в ткани (Int. J.Impotence Res., 4, 85-93, 1992; J.Urol., 147, 1659-1655, 1992; N.Engl. J.Med., 326, 90-94, 1992). Однако ни одно из соединений, применяемых в этих исследованиях, не могло удовлетворительно применяться клинически вследствие низкой эффективности и т.д.
Ингибитор фосфодиэстеразы типа V также эффективен в отношении нарушения женской половой функции.
Производные фталазина, обладающие ингибиторным действием на фосфодиэстеразу V типа, описаны в WO 9605176 (JP-A 8-225541), но не были описаны ни спиросоединения, содержащие атомы азота, ни их бициклические и 6-членные гетероциклические производные, ни профилактическое и терапевтическое применение таких соединений для эректильной дисфункции.
Описание изобретения
Заявителями данного изобретения были проведены разносторонние исследования, в результате чего установлено, что фталазиновые соединения, представленные формулой (I), проявляют высокую селективность в отношении фосфодиэстеразы V типа, которая представляет собой фермент, расщепляющий циклическую GMP, оказывают мощное ингибиторное действие на нее, а также проявляют сильное расслабляющее (релаксирующее) действие на пещеристое тело пениса с повышением биологической способности и обладают высокой безопасностью, и таким образом, было сформулировано данное изобретение.
Данное изобретение относится к фталазиновым соединениям, конкретно не описанным в публикации JP-A-225541, к фталазиновым соединениям, не предположенным в этой публикации, а также к способу получения некоторых из этих соединений.
Изобретение относится к фталазиновому соединению, представленному формулой (I), его фармакологически приемлемой соли или гидрату:

где R1 и R2 являются одинаковыми или отличаются друг от друга и представляют атом галогена, C1-C4алкильную группу, которая может быть замещена атомом галогена, гидроксильную группу, C1-C4алкоксигруппу, которая может быть замещена атомом галогена, или цианогруппу;
Х представляет цианогруппу, нитрогруппу, атом галогена, тиокарбамоильную группу, гидроксииминогруппу, которая может быть замещена C1-C4алкильной группой, арил-С1-С4алкильную группу, карбокси C1-С4алкильную группу или гетероарильную группу, которая может быть замещена 1 - 3 заместителями, выбранными из представленной далее группы заместителей А;
Y представляет:
i) группу, представленную формулой (II):
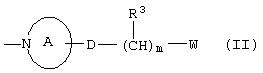
где кольцо А представляет 4-8-членное аминное кольцо, которое может быть замещено метильной группой и может содержать двойную связь; D представляет одинарную связь или атом кислорода; R3 представляет атом водорода, C1-C4 алкильную группу или атом галогена; m представляет целое число от 0 до 3; W представляет аминогруппу, гидроксильную группу, цианогруппу, карбоксильную группу, которая может быть защищена, или C1-C4 алкоксигруппу;
ii) группу, представленную формулой (III):
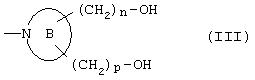
где кольцо В представляет 4-8-членное аминное кольцо, которое может содержать двойную связь, и n и р являются одинаковыми или отличаются друг от друга и равны 0 или представляют целое число от 1 до 3;
iii) группу, представленную формулой (IV):

где кольцо G представляет 4-8-членное аминное кольцо, которое может содержать двойную связь, Е представляет гидроксильную группу, атом галогена, C1-C4алкильную группу или C1-C4алкоксигруппу, J представляет формулу -(CHR4 )q-Q (где R4 представляет атом водорода или C1-C4алкильную группу, Q представляет гидроксильную группу, атом галогена, карбоксильную группу, которая может содержать защитную группу, карбамоильную группу или азолильную группу не содержащую гетероатома, отличного от атома азота, q представляет 0 или целое число от 1 до 4), или Е и J могут образовывать 3-6-членное кольцо вместе с атомом углерода, к которому они присоединены, и кольцо, необязательно содержащее гетероатом и необязательно содержащее заместитель;
iv) группу, представленную формулой (V):

где М представляет одинарную связь или C1-C4 алкиленовую группу, которая может быть замещена гидроксильной группой, карбоксильную группу, C1-C4алкильную группу или C1-C4 алкоксигруппу, кольцо К представляет 5-8-членное аминное кольцо, образованное вместе с кольцом М, и кольцо L представляет 5-8-членное алкильное кольцо, которое может содержать заместитель и может содержать атом кислорода;
v) группу, представленную формулой (VI):

где кольцо Р представляет 5-7-членное аминное кольцо и R5представляет атом водорода или C1-C4алкильную группу, которая может быть замещена атомом галогена, гидроксильную группу или карбоксильную группу;
vi) алкинильную группу, алкенильную группу или алкильную группу, которые могут содержать заместитель;
vii) фенильную группу, которая может быть замещена 1-3 заместителями, выбранными из приведенной далее группы заместителей А, или
viii) пиридильную группу, пиримидильную группу, тиенильную группу, тиазолильную группу или фурильную группу, которые могут быть замещены 1-3 заместителями, выбранными из приведенной далее группы заместителей А;
группа заместителей A: C1 -C4алькильная группа, которая может быть замещена атомом галогена, цианогруппой, нитрогруппой или гидроксильной группой; C1-C4алкоксигруппа, которая может быть замещена атомом галогена, цианогруппой, нитрогруппой или гидроксильной группой; цианогруппа; нитрогруппа; карбоксильная группа, которая может иметь защитную группу; гидроксильная группа, которая может иметь защитную группу; карбамоильная группа, которая может быть замещена группой низшего алкила; атом галогена; аминогруппа, которая может быть замещена C1-C4ацильной группой, C1-C4 алкилсульфонильной группой или арилсульфонильной группой, которая может содержать заместитель;
l представляет целое число от 1 до 3;
при условии, что исключены следующие случаи:
случай, когда l равно 1 или 2, Х представляет цианогруппу, нитрогруппу или атом хлора, R1 представляет атом хлора, R2 представляет метоксигруппу, кольцо А представляет 5- или 6-членное аминное кольцо, D представляет одинарную связь, m равно 0 и W представляет карбоксильную группу, которая может содержать защитную группу или C1-C4алкоксильную группу; случай, где l равно 1, R1 представляет атом хлора, R2представляет метоксигруппу, кольцо А представляет насыщенное 5- или 6-членное аминное кольцо, D представляет одинарную связь, и W представляет гидроксильную группу; случай, где l равно 1, кольцо В представляет 5- или 6-членное аминное кольцо, n и р равны 0; случай, где l равно 1, Е и Q представляют гидроксильные группы и q равно 0, и случай, где l равно 1, Х представляет атом хлора и Y представляет фенильную группу, замещенную метоксигруппой.
Кроме того, заявителями данного изобретения было установлено, что соединения представленной далее формулы (VII) также проявляют сильное релаксирующее действие на пещеристое тело пениса с повышением биоспособности и обладают высокой безопасностью. Таким образом, соединения (VII) также входят в объем данного изобретения.
Терапевтическое средство для эректильной дисфункции, которое включает фталазиновое соединение, представленное формулой (VII), его фармакологически приемлемую соль или гидрат в качестве активного ингредиента:
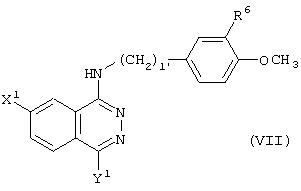
где l’ представляет целое число от 1 до 3; R6 представляет атом галогена, C1 -C4алкильную группу, которая может быть замещена атомом галогена, или цианогруппу;
Х1 представляет цианогруппу, нитрогруппу или атом галогена;
Y1 представляет:
i) группу, представленную формулой (VIII):

где кольцо А1 представляет 5- или 6-членное аминное кольцо;
m1 равно 0 или представляет целое число от 1 до 3; Z представляет аминогруппу, гидроксильную группу, которая может иметь защитную группу, карбоксильную группу, которая может иметь защитную группу, C1-C4 алкоксигруппу или цианогруппу;
ii) группу, представленную формулой (IX):

где кольцо В1 представляет 5- или 6-членное аминное кольцо, n1 и р1 равны 0 или представляют целые числа от 1 до 3;
iii) тиоморфолиногруппу, в которой морфолиногруппа или ее атом серы могут быть окислены;
iv) фенильную группу, которая может быть замещена 1-3 заместителями, выбранными из представленной далее группы заместителей А1;
v) гетероарильную группу, которая представляет собой пиридильную группу, пиримидильную группу, тиенильную группу или фурильную группу, которые могут быть замещены 1-3 заместителями, выбранными из представленной далее группы заместителей А1, или
vi) группу формулы -N(R7)-(CH2)s-Het, где R7 представляет группу низшего алкила, Het представляет пиридильную группу или пиримидильную группу, которые могут быть замещены 1-3 заместителями, выбранными из представленной ниже группы заместителей А1, и s равно 0 или представляет целое число от 1 до 3;
группа заместителей А1: группа низшего алкила, замещенная атомом галогена, цианогруппой, нитрогруппой или гидроксильной группой, низшая алкоксигруппа, которая может быть замещена атомом галогена, цианогруппой, нитрогруппой или гидроксильной группой; цианогруппа; нитрогруппа; карбоксильная группа, которая может иметь защитную группу; гидроксильная группа, которая может иметь защитную группу; карбамоильная группа, которая может быть замещена низшей алкильной группой; атом галогена; фенильная группа, которая может быть замещена алкильной группой, алкоксигруппой, атомом галогена или аминогруппой.
Данное изобретение представляет способ получения соединения, представленного формулой (XI):

(где X, R1, R2 и l принимают значения, определенные выше, Y3 представляет фенильную группу, пиридильную группу, пиримидильную группу, тиенильную группу или фурильную группу, которые могут иметь заместитель, выбранный из представленной выше группы заместителей А1), который включает стадию взаимодействия соединения, представленного формулой (X)

(где Hal представляет атом галогена и R1, R2, l и Х принимают значения, определенные выше) с соединением формулы Y3-B(OH)2.
Данное изобретение, где Y3 имеет значения, указанные выше, предоставляет профилактическое и терапевтическое средство при эректильной дисфункции, которое включает фталазиновое соединение, представленное приведенной выше формулой (I), его фармакологически приемлемую соль или его гидрат в качестве активного ингредиента. Кроме того, оно представляет профилактическое или терапевтическое средство при женской половой дисфункции или дисменоррагии, которое включает фталазиновое соединение, представленное приведенной выше формулой (I) или (VII), его фармакологически приемлемую соль или гидрат в качестве активного ингредиента.
Данное изобретение представляет фармацевтическую композицию, включающую фармакологически или клинически эффективное количество фталазинового соединения, представленного приведенной выше формулой (I) или (XI), его фармакологически приемлемой соли или гидрата, и фармакологически приемлемые носители.
Данное изобретение представляет способ или применение для профилактики или лечения эректильной дисфункции, женской половой дисфункции или дисменоррагии, который включает стадию введения фармакологически или клинически эффективного количества фталазинового соединения, представленного приведенной выше формулой (I) или (VII), его фармакологически приемлемой соли или гидрата пациенту, страдающему эректильной дисфункцией, женской половой дисфункцией или дисменоррагией.
В определениях, сформулированных в данном изобретении, атомы галогена, определенные в X, R1, R2, R3, R4, R5, Е, Q, в группах заместителей А и А1, означают атом фтора, атом хлора, атом брома и атом йода.
С1-С4алкильные группы, определенные в R1, R2, R3, R4, R5, R6, R7, в группах заместителей А и А1, означают линейные или разветвленные алкильные группы, содержащие 1-4 атома углерода, такие как метил, этил, н-пропил, изопропил, н-бутил, изобутил, 1-метилпропил и трет-бутил. С1-С4алкоксигруппы, определенные в R1, R2 и группах заместителей А и А1, означают группы, полученные из указанных выше С1-С4алкильных групп, и такие группы включают, например, метоксигруппу, этоксигруппу, пропоксигруппу и т.п.
Защитные группы в карбоксильной группе, которая может иметь защитную группу, определенные в Q, W, в группах заместителей А и А1, означают, например, низшие алкильные группы, такие как метильная группа, этильная группа и трет-бутильная группа; низшие алкильные группы, замещенные фенильной группой, которая может содержать заместитель, такие как п-метоксибензил, п-нитробензил, 3,4-диметоксибензил, дифенилметил, тритил и фенетил; галогенированные низшие алкильные группы, такие как 2,2,2-трихлорэтил и 2-йодэтил; низший алканоилокси-низшие алкильные группы, такие как пивалоилоксиметил, ацетоксиметил, пропионилоксиметил, бутилилоксиметил, валелилоксиметил, 1-ацетоксиэтил, 2-ацетоксиэтил, 1-пивалоилоксиэтил и 2-пивалоилоксиэтил; высший алкалоилокси-низшие алкильные группы, такие как пальмитоилоксиэтил, гептадеканоилоксиметил и 1-пальмитоилоксиэтил; низшие алкоксикарбонилокси-низшие алкильные группы, такие как метокси-карбонилоксиметил, 1-бутоксикарбонилоксиэтил и 1-(изопропок-сикарбонилокси)этил; карбокси-низшие алкильные группы, такие как карбоксиметил и 2-карбоксиэтил; гетероарильные группы, такие как 3-фталидил; бензоилокси-низшие алкильные группы, необязательно содержащие заместитель, такие как 4-глицилоксибензоилоксиметил; (замещенный диоксолен)-низшие алкильные группы, такие как (5-метил-2-оксо-1,3-диоксолен-4-ил)метил; циклоалкилзамещенный низший алканоилокси-низшие алкильные группы, такие как 1-циклогексилацетилоксиэтил, и циклоалкилоксикарбонилокси-низшие алкильные группы, такие как 1-циклогексилоксикарбонилоксиэтил. Другими словами, любая группа, которая может быть разложена любыми средствами in vivo для образования карбоновой кислоты, может служить защитной группой для карбоксильной группы.
Защитные группы в гидроксильной группе, которая может иметь защитную группу, определенные в группах заместителей А и А1, означают, например, ацильные группы, такие как формильная группа, ацетильная группа и бензоильная группа; низшие алкоксиметильные группы, такие как 2-метоксиэтоксиметильная группа. Другими словами, любая группа, которая может быть разложена любыми средствами in vivo для образования гидроксильной группы, может служить защитной группой для гидроксильной группы.
Азолильная группа, не содержащая гетероатома, отличного от атома азота, и определенная в Q, означает группы, полученные из пиррола, пиразола, имидазола, триазола, тетразола, индазола, бензимидазола и бензотриазола.
В формуле (IV) соединение, полученное из кольца, образованного с помощью Е и J с атомом углерода, к которому они присоединены, и кольца G, представляет собой спиросоединение. Кольцо, образованное с помощью Е и J вместе с атомом углерода, к которому они присоединены, включает циклобутан, циклопентан, циклогексан, оксиран, тетрагидрофуран, тетрагидропиран, бутиролактон и бутилолактам. Кроме того, заместитель на этих кольцах включает гидроксильную группу, карбоксильную группу, которая может иметь указанную выше защитную группу, C1-C4алкильную группу, которая может быть замещена гидроксильной группой, такую как гидроксиметильная группа и гидроксиэтильная группа, карбонильную группу и атом галогена, такой как атом фтора или хлора.
В формуле (V) бициклическое кольцо, которое, когда М представляет C1-C4алкиленовую группу, образовано из колец К и L, как подразумевается, является сшитым кольцом. Заместитель на кольце L включает гидроксильную группу, карбоксильную группу, которая может иметь указанную выше защитную группу, C1-C4алкильную группу, которая может быть замещена гидроксильной группой, такую как гидроксиметильная группа и гидроксиэтильная группа, C1-C4 алкилкарбонильную группу, которая может быть замещена карбоксильной группой, такую как карбоксиметильная группа и карбоксиэтильная группа, атом галогена, такой как атом фтора и атом хлора, винильную группу и т.д.
Заместители в алкинильной группе, алкенильной группе или алкильной группе, когда Y может иметь заместитель, включают C1-C4алкильные группы, такие как метильная группа, этильная группа, пропильная группа, изопропильная группа, бутильная группа, изобутильная группа, втор-бутильная группа и трет-бутильная группа; группы, полученные из циклоалканов, такие как ципропропан, циклобутан, циклопентан и циклогексан; C1-C4алкоксигруппы, полученные из указанных выше C1-C4алкильных групп, такие как метоксигруппа, этоксигруппа и пропоксигруппа и т.д.; гидроксильную группу; аминогруппу, которая может быть замещена C1-C4алкильной группой; циклические амины, которые могут быть замещены гидроксильной группой, например азиридин, азетидин, пирролидин и пиперидин; гидрокси-С1-С4алкильные группы; гидрокси-С1-С4алкоксигруппы; карбоксиалкоксигруппы; атомы галогена, такие как атом фтора и атом хлора.
В Х гетероарильная группа включает группы, полученные из пиррола, пиразола, имидазола, триазола, тетразола, индазола, бензимидазола, бензотриазола, тиазола, изотиазола, тиадиазола, бензотиадиазола, пиридина, пиримидина, триазина, хинолина, изохинолина, нафтилидина, фталазина и т.д.
В данном изобретении фармакологически приемлемая соль включает, например, соли неорганических кислот, такие как гидрохлорид, сульфат, гидробромат и фосфат, и соли органических кислот, такие как формиат, ацетат, малеат, фумарат, тартрат, метансульфонат, бензолсульфонат и толуолсульфонат.
Само собой разумеется, что в данном изобретении в случае соединений, имеющих асимметричный атом, их оптически активные соединения включены в область данного изобретения.
Кроме того, соединения, которые метаболизируют in vivo с образованием соединений данного изобретения, и соединения, образованные через метаболизм из соединений данного изобретения, также включены в область данного изобретения.
Благодаря прекрасной способности абсорбироваться при пероральном введении и длительности действия (ling-lasting action) эти фталазиновые соединения, их фармакологически приемлемые соли или гидраты могут вводиться подкожно, внутривенно или перорально для лечения, вместо инъекции непосредственно в пещеристое тело пениса или в наружные половые органы, что делает их предпочтительными в качестве профилактических и терапевтических средств при эректильной дисфункции и в качестве профилактических и терапевтических средств при женской половой дисфункции или дисменоррагии.
Хотя вводимая доза соединений данного изобретения конкретно не ограничена, обычно они вводятся взрослым в дозе от 5 до 100 мг, предпочтительно от 10 до 1000 мкг при внутривенном введении или в дозе от 1 до 1000 мг, предпочтительно от 5 до 100 мг при пероральном введении.
Способ получения 1
Способы получения соединений, аналогичных соединениям данного изобретения или их фармакологически приемлемых солей, описаны в публикации WO 965176 (JP-A-225541), и фталазиновые соединения данного изобретения получают таким же способом, как показано ниже:

где Y2 представляет:
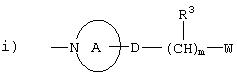
где кольцо A, D, R3, m и W принимают значения, определенные выше;

где кольцо В, n и р принимают значения, определенные выше;

где кольцо G, Е и J принимают значения, определенные выше;
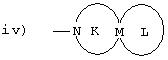
где кольцо К, кольцо L и М принимают значения, определенные выше, и
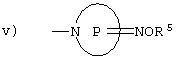
где кольцо Р и R5 принимают значения, определенные выше.
Hal представляет атом галогена, и R1, R2, l и Х принимают значения, определенные выше.
Это реакция, в которой соединение, представленное формулой (X), подвергается взаимодействию с HY2 в растворителе, давая соединение, представленное формулой (XII). В качестве реакционного растворителя предпочтителен N-метил-2-пирролидин, но может использоваться любой растворитель, инертный для данной реакции. Предпочтительные результаты могут быть получены при использовании HY2 в избыточном количестве относительно соединения (X) или при использовании органического основания, такого как диизопропилэтиламин, или соли, такой как карбонат калия, карбонат натрия или гидрокарбонат натрия. Температура реакции находится в интервале от комнатной до точки кипения растворителя, предпочтительно 100°С или более.
Синтез HY2, необходимого для получения соединения, в котором W представляет цианогруппу, не описан в WO 9605176 (JP-А 8-225541), и его осуществляют следующим образом:

А в случае, когда W, определенная выше, представляет аминогруппу, которая конкретно не определена в указанной выше публикации, синтезируют HY2, в котором аминогруппа является защищенной, и затем удаляют защитную группу следующим образом:

В формуле (I) НY2, где Y представлен формулами (IV) и (V), может быть получен с использованием соединения, описанного в публикации WO 9806720, или с использованием способа, описанного в этой публикации. 1) Например, некоторые из соединений, представленных формулой (IV), получены с помощью представленного далее процесса.
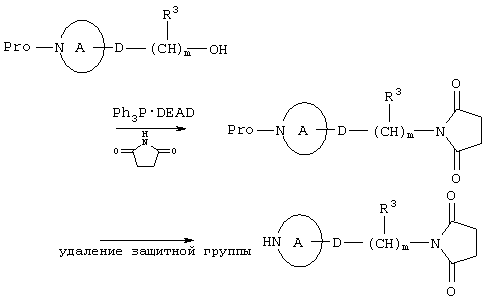
где G1 представляет 4-8-членное кольцо; Q1 представляет пирролил, пиразолил, имидазолил, триазолил, тетразолил, индазолил, бензимидазолил, бензотриазолил или атом фтора и Pro представляет защитную группу для атома азота.
В растворителе, таком как толуол, ксилол или тетрагидрофуран, метилтрифенилсульфонийбромид подвергается обработке основанием, таким как трет-бутоксид калия или бутиллитий, и подвергается взаимодействию с кетоновым соединением, представленным формулой (а), в результате чего может быть получено соединение, представленное формулой (b). Температура реакции составляет предпочтительно от -78°С до комнатной температуры.
Соединение (b) подвергается взаимодействию с трихлорацетилхлоридом в растворителе, таком как диэтиловый эфир, диметоксиэтан или тетрагидрофуран, с получением дихлорциклобутанонового соединения (f). (Альтернативно, когда оно взаимодействует с диацетилхлоридом, получают монохлорпроизводное. Монохлорпроизводное также может быть получено взаимодействием с трихлорацетилхлоридом с последующей обработкой уксусной кислотой). И затем продукт подвергается обработке восстановителем, таким как порошкообразный цинк, в результате может быть получено циклобутаноновое соединение, представленное формулой (g). Температура реакции предпочтительно составляет от 10 до 50°С. Когда соединение (g) подвергается обработке пероксидом, таким как 3-хлорпербензойная кислота, в присутствии гидрокарбоната натрия в растворителе, таком как дихлорметан, может быть получено лактоновое соединение, представленное формулой (h). Температура реакции предпочтительно находится в интервале от комнатной температуры до 40°С. Когда соединение (b) подвергается обработке дихлоркетеном и диазометаном, получают циклопентаноновое соединение формулы (f), а когда соединение (g) подвергается обработке диазометаном, получают циклопентаноновое соединение формулы (g). Когда циклопентаноновое соединение дополнительно обрабатывается диазометаном, получают циклогексаноновое соединение.
Когда соединение (b) подвергается обработке перкислотой, такой как магнийфталатмоноперкислота, получают эпоксидное соединение, представленное формулой (с). Когда эпоксидное соединение (с) подвергается взаимодействию с натриевой солью азола, содержащего в качестве гетероатомов только атомы азота, в растворителе, таком как диметилформамид, получают соответствующее соединение, представленное формулой (d) (Q1 представляет 1-имидазолильную группу, 1-триазолильную группу и т.д.). Обработкой гидрофторидом калия при температуре 100-150° С в присутствии Bu4N+H2 F3 в качестве соединения формулы (d) получают фторметильное соединение, где Q1 представляет атом фтора.
С другой стороны, фторсодержащее соединение, представленное формулой (е), получают обработкой соединения (с) гидрофторидом пиридина в растворителе, таком как метиленхлорид при температуре от -10 до 10° С.
2) Среди соединений, представленных формулой (V), соединения, в которых М представляет метилен, замещенный гидроксильной группой, получают, например, способом, представленным ниже.

Соединения, в которых L содержит атом кислорода, также могут быть получены этим способом.
Способ получения 2
Соединения формулы (I), где Y представляет алкинильную группу, алкенильную группу или алкильную группу, которые могут содержать заместитель, могут быть получены следующим способом.

где Hal представляет атом галогена; R8 представляет необязательно замещенную C1-C4 алкильную группу или необязательно замещенную циклоалкильную или циклоалкилалкильную группу и R1, R2, l и Х принимают значения, определенные выше.
Реакцию соединения формулы (X) с алкиновым (ацетиленовым) соединением проводят в присутствии каталитического количества дихлорбистрифенилфосфинпалладия(II), йодида меди и третичного амина при комнатной температуре или при нагревании. Используемый растворитель включает диметилформамид или 1-метилпирролидинон. Используемый третичный амин включает триэтиламин, диизопропилэтиламин, DBU и диметиланилин.
Температура реакции предпочтительно 0-150°С.
Превращение алкинового соединения, представленного формулой (XIII), в алкеновое соединение, представленное формулой (XIV), или в алкановое соединение, представленное формулой (XV), проводят посредством каталитического восстановления, например, в присутствии катализатора Линдлара или Pd-C катализатора.
Способ получения 3
Кроме того, фталазиновые соединения, где Y представляет Y3, который представляет собой необязательно замещенный арил или гетероарильную группу, получают следующим образом:

Y3 представляет фенильную группу, пиридильную группу, пиримидильную группу, тиенильную группу или фурильную группу, которые могут содержать от 1 до 3 заместителей, выбранных из указанной выше группы заместителей A; Hal представляет атом галогена и R1, R2, l и Х принимают значения, определенные выше.
Реакцию проводят взаимодействием 1-галогенхиназолинового соединения, представленного формулой (X), с комплексом палладия с валентностью 0 или 2 и борной кислотой, диалкоксибораном или триалкилоловом, содержащими соответствующую арильную группу или гетероарильную группу. Борную кислоту, диалкоксиборан или триалкилолово, содержащие арильную группу или гетероарильную группу, и палладиевый комплекс растворяют или суспендируют в 2-фазном растворителе, состоящем из органического растворителя и водного раствора карбоната натрия. Смесь подвергается взаимодействию при температуре в интервале от комнатной температуры до температуры кипения растворителя в течение от приблизительно 1 до 24 часов в потоке газообразного азота. В качестве палладиевого комплекса может использоваться любой палладиевый комплекс, который позволяет проводить реакцию, и предпочтительны тетракис(трифенилфосфин)палладий и т.д. В качестве органического растворителя может использоваться любой растворитель, который инертен по отношению к реакции, и предпочтительными являются ксилол, толуол, тетрагидрофуран или смесь этих растворителей.
Способ получения 4
В формуле (I) соединения, показанные в следующей далее схеме реакций, могут быть получены сочетанием известных реакций с использованием соединения (XVII), где Х представляет цианогруппу.

где R9 представляет атом водорода, C1 -C4алкильную группу, которая может быть замещена атомом галогена, арил-С1-С4-алкильную группу или карбокси-С1-С4-алкильную группу; R10 представляет C1 -C4алкильную группу и R1, R2, l и Y принимают значения, определенные выше.
Способ получения 5
Некоторые из соединений формулы (I), в которых Х представляет гетероарильную группу, могут быть получены способом, описанным в Способе получения 3.

где Hal представляет атом галогена; Het1 представляет гетероарильную группу и R1, R2, l и Y имеют значения, определенные выше.
Атом галогена предпочтительно представляет атом брома или атом йода.
Кроме того, соединения формулы (I) с азолильной группой, не содержащей гетероатома, отличного от атома азота, получают согласно описанному выше Способу получения 1 после предварительного получения соответствующего соединения, представленного формулой (X). Соответствующее соединение формулы (X) получают, например, согласно способу, описанному в публикации WO 9605176, после обработки диметил-4-фторфталата азолом, не содержащем гетероатома, отличного от атома азота, с получением диметил-4-азолилфталата, который затем подвергается обработке гидразином, давая 6-азолил-2,3-дигидро-1,4-фталазиндион.
Способ получения 6
Соединение формулы (I), в котором Y представлен формулой (VI), может быть получено превращением соединения, представленного следующей далее формулой (XXIV), в оксим известным способом:
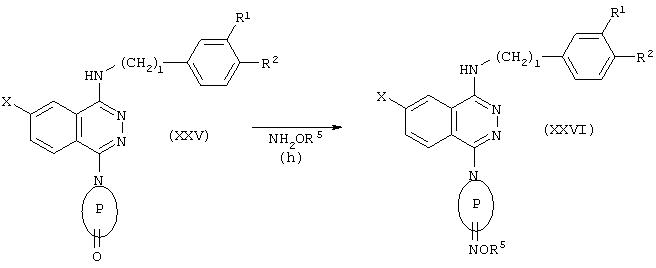
где R1, R2, R5, l и Х принимают значения, определенные выше.
Далее описано действие соединений данного изобретения со ссылкой на Экспериментальные примеры.
1) Ингибирующее действие на фермент cGMP-PDE, полученный из тромбоцитов свиньи
Ингибирующую активность испытываемого соединения на фермент cGMP-PDE, приготовленный из тромбоцитов свиньи, оценивают добавлением раствора испытываемого соединения в DMSO в реакционный раствор, где 1 мкМ cGMP используется в качестве субстрата, в присутствии 1 мМ EGTA в соответствии со способом Tompson et al. Конечная концентрация DMSO в реакционном растворе составляет 1% или менее. Получение cGMP-PDE осуществляют следующим образом. Тромбоциты свиньи добавляют в буфер А (20 мМ Tris/HCl, 2 мМ ацетат магния, 10 мМ 2-меркаптоэтанол, 0,1 мМ EGTA; рН 7,4) и подвергают обработке ультразвуком. Образующуюся суспензию центрифугируют при 100000×g в течение 60 минут, образующийся супернатант переносят в колонку (DEAE-Toyopearl 650S фирмы Tosoh, Tokyo, Japan). После этого колонку промывают буфером А, фермент элюируют с градиентом от 0,075 до 0,25 М NaCl в буфере А, получая фракцию cGMP-PDE. Полученную фракцию подвергают диализу, концентрируют и хранят.

2) Усиливающее действие PDE5 ингибитора в отношении расслабляющего действия нитропруссида на препарат пещеристого тела пениса, выделенного из кролика
Пенис удаляют у белого кролика NZW (массой приблизительно 3 кг), умерщвленного посредством внутривенного введения пентобарбитала (50 мг/кг). После удаления пещеристое тело открывают посредством удаления окружающих тканей, таких как белочная оболочка, получая препарат (приблизительно 10×1,5× 1,5 мм). Этот препарат в трубке Магнуса (Magnus tube) суспендируют в 10 мл питательного раствора Кребса-Хенселейта (Krebs-Henseleit’s nutritive solution) (118,4 мМ NaCl, 4,7 мМ КСl, 2,5 мМ CaCl2, 1,3 мМ MgSO4, 1,2 мM КН2РO4, 25,0 мМ NaHCO3, 11,0 мМ глюкоза, 0,026 мМ EDTA и 0,001 мМ индометацин) при 37°С и в нее барботируют газовую смесь (95% кислорода +5% диоксида углерода). Затем под нагрузкой 2 г измеряют изометрическое напряжение (isometric tension). Для стабилизации сокращения сокращение вызывают добавлением раствора хлорида калия (конечная концентрация 100 мМ), промывку повторяют дважды, снова вызывают сокращение добавлением фенилэфрина (конечная концентрация 10 мкМ) и снова проводят промывку.
Снова трубку наполняют 10 мл раствора Кребса-Хенселейта и добавляют метиловый сложный эфир L-NG-нитроаргинина (конечная концентрация 100 мкМ) для ингибирования образования эндогенного моноксида азота. Сокращение вызывают добавлением фенилэфрина (конечная концентрация 10 мкМ) и добавляют раствор химического соединения при конечной концентрации 3, 30 или 300 нМ. В качестве реакционной среды используют диметилсульфоксид. Спустя 15 минут после добавления химического вещества, для релаксации препарата добавляют нитропруссид (конечная концентрация 300 мкМ). Кроме того, для определения максимальной релаксации добавляют папаверин (конечная концентрация 100 мкМ).
После эксперимента напряжение, полученное в результате добавления папаверина, используют в качестве исходной величины, релаксацию препарата с помощью добавления нитропруссида записывают на диаграмму с использованием DEGIMATIC CALIPER для определения степени релаксации.
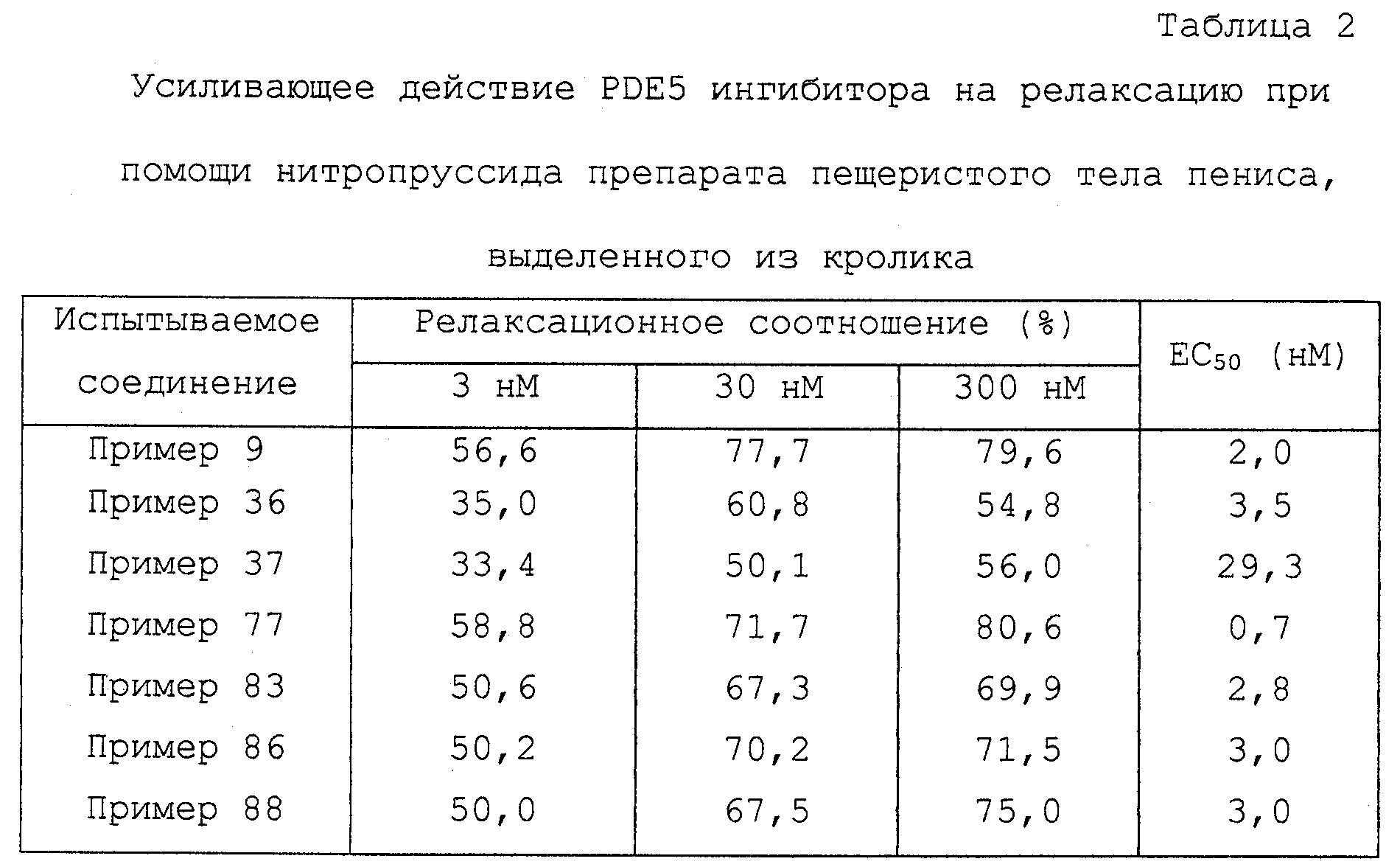
Значения в таблице показывают релаксационное соотношение (%) после добавления нитропруссида к препарату, предварительно обработанному 3, 30 и 300 нМ соединения, и записаны значения, полученные в повторном (двойном) опыте. Кроме того, значение величины EC50 показывает концентрацию соединения, при которой сокращение, вызванное фенилэфрином, релаксирует на 50%, и это значение вычисляют регрессионным анализом на кривой релаксации в двойном эксперименте.
Монооксид азота, образованный из нитропруссида, активирует гуанилатциклазу для промотирования образования cGMP из GTP, релаксируя таким образом пещеристое тело пениса. PDE5 ингибитор усиливает это релаксирующее действие ингибированием деградации cGMP.
Как описано выше, это наглядно показывает, что соединения данного изобретения обладают ингибирующим действием на PDE5 и усиливают релаксирующее действие нитропруссида на образец пещеристого тела пениса кролика зависимым от дозы образом.
Как описано выше, это наглядно показывает, что соединения данного изобретения обладают ингибирующим действием на PDE5 и усиливают релаксирующее действие нитропруссила на образец кавернозной ткани пениса кролика зависимым от дозы образом. То есть данное изобретение полезно в качестве профилактического и терапевтического средства для эректильной дисфункции.
Примеры получения и Примеры приводятся для облегчения понимания данного изобретения, но, само собой разумеется, данное изобретение не ограничивается этими соединениями.
Пример получения 1
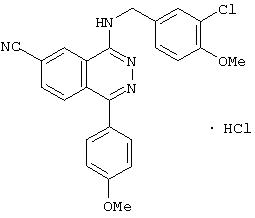
4-(3-Хлор-4-метоксибензил)амино-6-циано-1-[(3R)-3-гидроксипиперидино]фталазин гидрохлорид
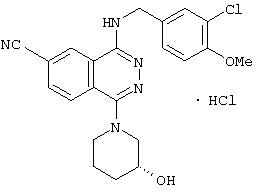
Смесь 1,0 г 1-хлор-4-(3-хлор-4-метоксибензил)амино-6-цианофталазина, 1,92 г (R)-(+)-3-гидроксипиперидина гидрохлорида, 1,80 г диизопропилэтиламина и 12 мл 1-метил-2-пирролидона перемешивают при 170°С в течение 1 часа 15 минут. После охлаждения в реакционный раствор добавляют этилацетат, раствор промывают водой и рассолом. Раствор сушат над безводным сульфатом натрия, растворитель выпаривают и полученный остаток очищают колоночной хроматографией (наполнитель: силикагель). Полученное свободное соединение суспендируют в смеси уксусная кислота/этанол/вода, добавляют 1 N водную соляную кислоту и растворяют при нагревании. После охлаждения образующиеся кристаллы выделяют фильтрованием, получая 860 мг целевого соединения в виде желтого порошка.
MASS (ESI): 424,1 (МН+ ).
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,39-1,50 (1H, м), 1,65-1,78 (1Н, м), 1,75-1,98 (2Н, м), 2,82-2,91 (1H, м), 2,93-3,02 (1H, м), 3,33-3,48 (2Н, м), 3, 79-3,88 (1H, м), 3,85 (3Н, с), 4,72 (2Н, уш.), 7,16 (1H, д, J=8,4 Гц), 7,47 (1Н, дд, J=8,4; 1,6, Гц), 7,62 (1H, д, J=1,6 Гц), 8,31 (1H, д, J=8,4 Гц), 8,48 (1H, д, J=8,4 Гц), 9,38-9,46 (1H, м), 10,27 (1H, уш.).
Пример получения 2
4-(3-Хлор-4-метоксибензил)амино-6-циано-1-[(3S)-3-гидроксипиролидино]фталазин гидрохлорид

Целевое соединение получают по методике Примера получения 1, используя (S)-3-гидроксипирролидин вместо (R)-(+)-3-гидроксипиперидина гидрохлорида.
MASS (ESI): 410,0 (МН+).
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,94-2,10 (2Н, м), 3, 50-3,62 (1H, м), 3,42-3,68 (1H, м), 3,83 (3Н, с), 3,93-4,10 (2Н, м), 4,43-4,50 (1H, м), 4,50-4,64 (2Н, м), 5,30 (1H, уш.), 7,13 (1H, д, J=8,4 Гц), 7,34-7,44 (1H, м), 7, 48-7,56 (1H, м), 8,38-8,46 (1H, м), 8,62-8,74 (1H, м), 9,10-9,32 (1H, м).
Пример получения 3
4-(3-Хлор-4-метоксибензил)амино-6-циано-1-[(2S)-2-гидрокси-метилпирролидино]фталазин гидрохлорид

Целевое соединение получают по методике Примера получения 1, используя (S)-2-гидроксиметилпирролидин вместо (R)-(+)-3-гидроксипиперидина гидрохлорида.
MASS (ESI): 424,1 (МН+).
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,60-2,39 (4Н, м), 3,44-3,53 (1H, м), 3,83 (3Н, с), 3,89-3,99 (1H, м), 4,34-4,70 (3Н, м), 7,12-7,16 (1H, м), 7,38-7,46 (1H, м), 7,52-7,59 (1H, м), 8,40-8,43 (1H, м), 8,43-8,60 (1H, м), 9,23-9,30 (1H, м).
Пример получения 4
4-(3-Хлор-4-метоксибензил)амино-6-циано-1-(3-гидроксиметил-пиперидино)фталазин гидрохлорид
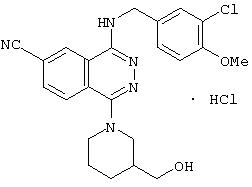
Целевое соединение получают по методике Примера получения 1, используя 3-гидроксиметилпиперидин вместо (R)-(+)-3-гидроксипиперидина гидрохлорида.
MASS (ESI): 438,2 (МН+).
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,13-1,28 (1Н, м), 1,70-1,86 (3Н, м), 1,87-1,99 (1Н, м), 2,67-2,75 (1H, м), 2,86-2,95 (1Н, м), 3, 33-3,50 (3Н, м), 3,51-3,60 (1H, м), 3,16 (3Н, с), 3,85 (3Н, с), 4,71 (2Н, уш.-с), 7,16 (1H, д, J=8,4 Гц), 7,44 (1H, дд, J=8,4; 0,8 Гц), 7,59 (1H, д, J=0,8 Гц), 8,23 (1H, д, J=8,8 Гц), 8,45 (1H, дд, J=8,8; 0,4 Гц), 9,28-9,35 (1H, м), 9,95 (1H, уш.), 14,00 (1H, уш.).
Пример получения 5
4-(3-Хлор-4-метоксифенетил)амино-6-циано-1-(3-гидроксиметил-пиперидино)фталазин гидрохлорид
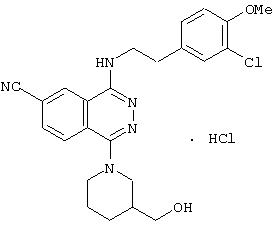
Целевое соединение получают по методике Примера получения 4, используя 1-хлор-4-(3-хлор-4-метоксифенетил)амино-6-цианофталазин вместо 1-хлор-4-(3-хлор-4-метоксибензил)амино-6-цианофталазин.
MASS (ESI): 452,3 (МН+).
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,70-1,90 (2Н, м), 1,90-2,05 (2Н, м), 2,70 (1H, уш.-т), 2,88 (1H, уш.), 2,95-3,08 (2Н, м), 3,25-3,63 (2Н, м), 3,78 (2Н, м), 3,83 (3Н, с), 7,09 (1Н, д, J=8,6 Гц), 7,29 (1H, д, J=8,6 Гц), 7,47 (1H, с), 8,25 (1H, д, J=8,6 Гц), 8,49 (1Н, д, J=8,6 Гц), 9,48 (1Н, с).
Пример получения 6
4-(3-Хлор-4-метоксифенетил)амино-6-циано-1-(4-гидроксиметилпиперидино)фталазин

Целевое соединение получают по методике Примера получения 5, используя 4-гидроксиметилпиперидин вместо 3-гидроксиметилпиперидина.
MASS (ESI): 452,3 (MH+).
1H-ЯМР (400 МГц, CDCl3) δ: 1,51-1,65 (2Н, м), 1,79-1,85 (1Н, м), 1,93 (2Н, м), 2,99-3,09 (4Н, м), 3,56-3,68 (4Н, м), 3,90 (3Н, с), 3,85-3,99 (2Н, м), 4,94 (1Н, уш.-т), 6,88(1Н, д, J=8,4 Гц), 7,13 (1Н, дд, J=2,2; 8,4 Гц), 7,28 (1Н, д, J=2, 2 Гц), 7,94 (1H, д, J=8,4 Гц), 7,98 (1Н, с), 8,13 (1H, д, J=8,4 Гц).
Пример получения 7
4-(3-Хлор-4-метоксибензил)амино-6-циано-1-[метил(2-пиридилметил)амино]фталазин гидрохлорид

Целевое соединение получают по методике Примера получения 1 с тем отличием, что N-метил-[(2-пиридил)метил]амин используют вместо (R)-(+)-3-гидроксипиперидин гидрохлорида.
MASS (ESl): 445.3 (МН+).
1H-ЯМР (400 МГц, DMSO-d6) δ: 2,95 (3Н, с), 3,85 (3Н, с), 4,73-4,79 (4Н, м), 7,16 (1Н, д, J=8,4 Гц), 7,49 (1Н, дд, J=8,4; 2,0 Гц), 7,64 (1Н, д, J=2,0 Гц), 7,65-7,72 (1H, м), 7,83-7,87 (1H, м), 8,18-8,26 (1H, м), 8,52 (1H, дд, J=8,4; 1,2 Гц), 8,60 (1H, д, J=8,4 Гц), 8,74 (1H, д, J=4,8 Гц), 9,53-9,55 (1H, м), 10,64 (1H, уш.).
Пример получения 8
4-(3-Хлор-4-метоксибензил)амино-6-циано-1-{N-метил-[2-(2-пиридил)этил]амино}фталазин гидрохлорид

Целевое соединение получают по методике Примера получения 7 с тем отличием, что N-метил-[2-(2-пиридил)этил]амин используют вместо N-метил-[(2-пиридил)метил]амина.
MASS (ESI): 459,2 (MIT).
1H-ЯМР (400 МГц, DMSO-d6) δ: 3,00 (3Н, с), 3,35 (2Н, т, J=6,4 Гц), 3,76 (2Н, т, J=6,4 Гц), 3,85 (3Н, с), 4,73-4, 77 (2Н, м), 7,18 (1Н, д, J=8,4 Гц), 7,50 (1Н, д, J=8,4 Гц), 7,53-7,64 (1Н, м), 7,65 (1H, с), 7,68-7,77 (1Н, м), 8,10-8,30 (1H, м), 8,16 (1H, д, J=8,6 Гц), 8,44 (1Н, д, J=8,6 Гц), 8,55-8,61 (1H, м), 9, 45-9,51 (1H, м), 10,53 (1H, уш.).
Пример получения 9
4-(3-Хлор-4-метоксифенетил)амино-6-циано-1-(4-метоксипипери-дино)фталазин гидрохлорид

Целевое соединение получают по методике Примера получения 5 с тем отличием, что 4-метоксипиперидина гидрохлорид используют вместо 3-гидроксиметилпиперидина.
MASS (ESI): 452.2 (МН+).
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,66-1,76 (2Н, м), 2,00-2,08 (2Н, м), 2,91-2,97 (2Н, м), 2,99-3,07 (2Н, м), 3,29 (3Н, с), 3, 37-3,49 (3Н, м), 3,70-3,77 (2Н, м), 3,81 (3Н, с), 7,07 (1H, д, J=8,6 Гц), 7,26 (1H, дд, J=8,6, 2,0 Гц), 7,43 (1H, д, J=2,0 Гц), 8,24 (1H, д, J=8,3 Гц), 8,45 (1H, дд, J=8,3; 1,6 Гц), 9,22 (1H, д, J=1, 6 Гц).
Пример получения 10
4-(3-Хлор-4-метоксибензил)амино-6-циано-1-(4-метоксифенил)фталазин гидрохлорид
423 мг тетракис(трифенилфосфин)палладия(0) добавляют в смесь 1,0 г 1-хлор-4-(3-хлор-4-метоксибензил)амино-6-цианофталазина, 423 мг 4-метоксифенилборной кислоты, 30 мл толуола, 30 мл тетрагидрофурана и 30 мл 2 М водного раствора карбоната натрия в атмосфере азота. Смесь перемешивают при 80°С в течение 2 часов и дополнительно при 10°С в течение 15,5 часов. Реакционному раствору дают нагреться до комнатной температуры и экстрагируют его водным раствором хлорида аммония и этилацетатом. Органический слой промывают водным раствором аммиака, водой и рассолом и сушат над безводным сульфатом натрия. Растворитель выпаривают и полученный остаток очищают колоночной хроматографией (наполнитель: силикагель). Полученное связанное соединение растворяют в смеси этилацетат/этанол, добавляют раствор 4 N соляная кислота/этилацетат и образующиеся кристаллы выделяют фильтрованием, получая 460 мг целевого соединения в виде желтого порошка.
MASS (ESI): 431,2 (МН+).
1H-ЯМР (400 МГц, DMSO-d6) δ: 3,85 (3Н, с), 3,87 (3Н, с), 4, 82-4,85 (2Н, м), 7,16-7,21 (3Н, м), 7,49 (1Н, дд, J=8,6; 2,2 Гц), 7,60-7,63 (3Н, м), 8,08 (1Н, д, J=8,4 Гц), 8,45 (1Н, дд, J=8,4; 1,4 Гц), 9,45-9,49 (1Н, м), 10,39 (1H, уш.).
Пример получения 11
4-[(3-Хлор-4-метоксибензил)амино]-1-(4-гидрокси-3-метилпиперидино)-6-фталазинкарбонитрил гидрохлорид
Целевое соединение получают по методике Примера получения 1 с тем отличием, что 4-гидрокси-3-метилпиперидин используют вместо (R)-(+)-3-гидроксипиперидина гидрохлорида.
1H-ЯМР (400 МГц, DMSO-d6) δ: 0,94 (3Н, т, J=8,0 Гц), 1, 59-2,03 (3Н, м), 2,74-3,96 (5Н, м), 3,83 (3Н, с), 4,68 (2Н, д, J=5,2 Гц), 7,15 (1H, д, J=8,4 Гц), 7,43 (1H, д, J=8,0 Гц), 7,58 (1H, с), 8,23 (1H, т, J=8,0 Гц), 8, 45 (1H, д, J=8,4 Гц), 9,29 (1H, с).
Пример получения 12
4-[(3-Хлор-4-метоксибензил)амино]-1-(4-гидрокси-3,3,5,5-тет-раметилпиперидино)-6-фталазинкарбонитрил гидрохлорид
Целевое соединение получают по методике Примера получения 1 с тем отличием, что 4-гидрокси-3,3,5,5-тетраметилпиперидин используют вместо (R)-(+)-3-гидроксипиперидина гидрохлорида.
1 H-ЯМР (400 МГц, DMSO-d6) δ: 0,91 (6Н, с), 1,15 (6Н, с), 2,57 (1Н, д, J=12,4 Гц), 2,95 (1Н, с), 3,21 (2Н, д, J=12,0 Гц), 3,83 (3Н, с), 4,47 (2Н, д, J=5,6 Гц), 7,14 (1Н, д, J=8,4 Гц), 7,47 (1Н, д, J=8,8 Гц), 7,63 (1Н, с), 8,29 (1Н, д, J=8,4 Гц), 8,55 (1Н, д, J=8,4 Гц), 9,52 (1Н, с), 10,63 (1Н, уш.-с).
Получение промежуточного продукта - Пример 1
1-Хлор-4-{[(4-метокси-3-трифторметил)бензил]амино}-6-фтала-зинкарбонитрил

Смесь 10 г 2-трифторметилфенола, 17 г карбоната калия, 150 мл ацетона и 7,7 мл йодметана кипятят с обратным холодильником в течение 2 часов. После охлаждения нерастворимые вещества удаляют фильтрованием и фильтрат упаривают. Полученный остаток растворяют в этилацетате, промывают водой и рассолом, сушат над безводным сульфатом магния, фильтруют и упаривают, получая 12,15 г 2-трифторметиланизола.
Смесь 8,5 г 2-трифторметиланизола и 7,0 г гексаметилентетрамина перемешивают при 90°С в течение 1,5 час в 80 мл трифторуксусной кислоты. Реакционный раствор упаривают. Полученный остаток растворяют в этилацетате и раствор по каплям добавляют в охлажденный на ледяной бане насыщенный раствор гидрокарбоната натрия. Этилацетатный слой выделяют и промывают рассолом, затем сушат над безводным сульфатом магния, фильтруют и упаривают. Полученный остаток очищают колоночной хроматографией (наполнитель: силикагель), получая 5,8 г 3-трифторметил-п-анизальдегида.
Смесь 5,8 г 3-трифторметил-п-анизальдегида, 8,6 мл формальдегида и 13,6 мл муравьиной кислоты перемешивают при 130°С в течение 9 часов. После охлаждения добавляют воду и этилацетат. Этилацетатный слой отделяют и промывают рассолом, затем сушат над безводным сульфатом магния, фильтруют и выпаривают. Полученный остаток очищают колоночной хроматографией (наполнитель: силикагель), получая 3,8 г N-[4-метокси-3-(трифторметил)бензил]формамида.
3,8 г N-[4-метокси-3-(трифторметил)бензил]формамида растворяют в 20 мл этанола, добавляют 2 мл концентрированной соляной кислоты, смесь кипятят в обратным холодильником в течение 3 часов. После охлаждения добавляют диэтиловый эфир, образующиеся кристаллы выделяют фильтрованием, получая 2,5 г 4-метокси-3-(трифторметил)бензиламина гидрохлорида.
3,7 г DBU добавляют к смеси 2,2 г 1,4-дихлорфталазин-6-карбонитрила, 2,5 г 4-метокси-3-(трифторметил)бензиламина гидрохлорида и 25 мл 1-метил-2-пирролидинона, смесь перемешивают при комнатной температуре в течение 1,25 часа. В реакционный раствор добавляют этилацетат, раствор промывают водой и рассолом, сушат над безводным сульфатом магния, фильтруют и упаривают. Полученный остаток очищают колоночной хроматографией (наполнитель: силикагель), получая 1,66 г целевого соединения в качестве менее полярного соединения.
1H-ЯМР (400 МГц, DMSO-d6) δ: 3,86 (3Н, с), 4,74 (2Н, д, J=5,2 Гц), 7,22 (1Н, д, J=9,6 Гц), 7,67-7,71 (2Н, м), 8,20 (1Н, д, J=8,4 Гц), 8, 35 (1Н, дд, J=8,4, 1,4 Гц), 8,50 (1Н, т, J=5,2 Гц), 8,99 (1H, д, J=1,4 Гц).
Таким же образом получают 1-хлор-4-[(3-йод-4-метоксибензил)амино]-6-фталазинкарбонитрил из коммерческого 2-йоданизола; 4-[(3-бром-4-метоксибензил)амино]-1-хлор-6-фталазинкарбонитрил из 3-бром-п-анизальдегида; 1-хлор-4-[(3-фтор-4-метоксибензил)амино]-6-фталазинкарбонитрил из 3-фтор-п-анизальдегида и 1-хлор-4-[(4-метокси-3-метилбензил)амино]-6-фталазинкарбонитрил из 3-метил-п-анизальдегида.
Получение промежуточного продукта - Пример 2
1-Хлор-4-[(3-йод-4-метоксибензил)амино]-6-фталазинкарбонитрил
1H-ЯМР (400 МГц, DMSO-d6) δ: 3,80 (3Н, с), 4,67 (2Н, д, J=5,2 Гц), 6,96 (1H, д, J=8,4 Гц), 7,42 (1H, дд, J=8,4; 2,0 Гц), 7,83 (1H, д, J=2,0 Гц), 8,18 (1H, д, J=8,4 Гц), 8,34 (1H, дд, J=8,4; 1,2 Гц), 8,45 (1H, т, J=5,2 Гц), 8,99 (1H, д, J=1,2 Гц).
Получение промежуточного продукта - Пример 3
4-[(3-Бром-4-метоксибензил)амино]-1-хлор-6-фталазинкарбонитрил
1H-ЯМР (400 МГц, DMSO-d6) δ: 3,82 (3Н, с), 4,70 (2Н, д, J=5,2 Гц), 7,07 (1H, д, J=8,4 Гц), 7,41 (1Н, дд, J=8,4; 2,0 Гц), 7,63 (1Н, д, J=2,0 Гц), 8,20 (1H, д, J=8,4 Гц), 8,34 (1H, дд, J=8,4; 1,2 Гц), 8,47 (1H, т, J=5,2 Гц), 8,99 (1H, д, J=1,2 Гц).
Получение промежуточного продукта - Пример 4
1-Хлор-4-[(3-фтор-4-метоксибензил)амино]-6-фталазинкарбонитрил
1H-ЯМР (400 МГц, DMSO-d6) δ: 3,81 (3Н, с), 4,70 (2Н, д, J=5,4 Гц), 7,11 (1Н, т, J=8, 8 Гц), 7,19 (1H, д, J=8,8 Гц), 7,26 (1H, дд, J=12,8; 2,0 Гц), 8,20 (1H, д, J=8,4 Гц), 8,35 (1H, дд, J=8,4; 0,8 Гц), 8,46 (1H, д, J=5,4 Гц), 9,01 (1H, д, J=0,8 Гц).
Получение промежуточного продукта - Пример 5
1-Хлор-4-[(3-циано-4-метоксибензил)амино]-6-фталазинкарбонитрил
Смесь 20 г 4-метоксибензилхлорида, 26 г фталимида калия и 100 мл диметилформамида перемешивают при 50°С в течение 5 часов. После охлаждения реакционный раствор выливают в ледяную воду и образующиеся осадки выделяют фильтрованием. Осадки промывают водой и сушат, получая 31 г N-(4-метоксибензил)фталимида.
18 г гексаметилентетрамина постепенно добавляют в смесь 31 г N-(4-метоксибензил)фталимида и 100 мл трифторуксусной кислоты, перемешивают при комнатной температуре в течение 1 часа, затем нагревают с обратным холодильником в течение 4 часов. Реакционный раствор охлаждают до 0°С и добавляют воду. Добавляют карбонат калия и образующиеся кристаллы выделяют фильтрованием. Кристаллы сушат, получая 20 г N-(3-формил-4-метоксибензил)фталимида.
5,2 г гидроксиламина гидрохлорида, 12,2 г ацетата натрия и 50 мл воды добавляют в смесь 20 г N-(3-формил-4-метоксибензил)фталимида и 200 мл тетрагидрофурана и перемешивают при комнатной температуре в течение 1 часа. Смесь перемешивают при 60°С в течение 1 часа и затем упаривают. К полученному остатку добавляют воду и нерастворимые вещества выделяют фильтрованием. Осадок промывают диэтиловым эфиром, получая 20 г N-(3-гидроксиимино-4-метоксибензил)фталимида.
6,7 мл уксусного ангидрида добавляют в смесь 20 г N-(3-гидроксиимино-4-метоксибензил)фталимида и 200 мл ксилола и смесь нагревают с обратным холодильником в течение 10 часов. Смеси дают охладиться до комнатной температуры, образующиеся кристаллы выделяют фильтрованием и промывают ксилолом, получая 15 г N-(3-циано-4-метоксибензил)фталимида.
3,9 г гидразинмоногидрата добавляют в смесь 15 г N-(3-циано-4-метоксибензил)фталимида и 200 мл этанола и смесь нагревают с обратным холодильником в течение 3 часов. После охлаждения нерастворимые вещества удаляют фильтрованием. Фильтрат упаривают, к полученному остатку добавляют 1 N водный раствор гидроксида натрия, затем экстрагируют дихлорметаном. Экстракт сушат над безводным сульфатом магния и фильтруют. Фильтрат упаривают, получая 8,0 г 3-циано-4-метоксибензиламина.
1,4-Дихлорфталазин-6-карбонитрил и 3-циано-4-метоксибензиламин перемешивают при комнатной температуре в 1-метил-2-пирролидиноне в присутствии DBU, в результате получая 1-хлор-4-[(3-циано-4-метоксибензил)амино]-6-фталазинкарбонитрил в качестве менее полярного продукта.
1H-ЯМР (400 МГц, DMSO-d6) δ: 3,87 (3Н, с), 4,70 (2Н, д, J=5,6 Гц), 7,20 (1Н, д, J=8,4 Гц), 7,70 (1Н, дд, J=2,4; 8,4 Гц), 7,75 (1Н, д, J=2,4 Гц), 8,19 (1H, д, J=8,4 Гц), 8,34 (1Н, дд, J=1,2; 8,4 Гц), 8,48 (1H, т, J=5,6 Гц), 8,97 (1H, с).
Получение промежуточного продукта - Пример 6
1-Хлор-4-[(3-этил-4-метоксибензил)амино]-6-фталазинкарбонитрил
3,99 г бутоксида калия добавляют в 80 мл раствора 12,7 г метилтрифенилфосфонийбромида в тетрагидрофуране при 0°С, добавляют 7 г N-(3-формил-4-метоксибензил)фталимида и смесь перемешивают при комнатной температуре в течение 1 часа.
Реакционный раствор фильтруют через целит и затем выпаривают. Полученный остаток очищают колоночной хроматографией (наполнитель: силикагель), получая 2,75 г N-(4-мeтокси-3-винилбензил)фталимида.
2,75 г N-(4-метокси-3-винилбензил)фталимида растворяют в 50 мл тетрагидрофурана, добавляют 0,1 г 10% Pd-C и смесь перемешивают в течение 40 минут в атмосфере водорода. Реакционный раствор фильтруют через целит и фильтрат упаривают. Полученный остаток очищают колоночной хроматографией (наполнитель: силикагель), получая 2,55 г N-(3-этил-4-метоксибензил)фталимида.
0,84 мл гидразина моногидрата добавляют в смесь 2,55 г N-(3-этил-4-метоксибензил)фталимида и 60 мл этанола и смесь нагревают с обратным холодильником в течение 1 часа. После охлаждения смесь упаривают и к полученному остатку добавляют 2 N водный раствор гидроксида натрия, после этого смесь экстрагируют дихлорметаном. Экстракт сушат над безводным сульфатом магния и фильтруют. Фильтрат упаривают, добавляют этилацетат и затем нерастворимые вещества фильтруют. Добавляют раствор 4 N соляная кислота/этилацетат, образующиеся кристаллы выделяют фильтрованием, получая 1,75 г 3-этил-4-метоксибензиламина гидрохлорида.
1,4-Дихлорфталазин-6-карбонитрил и 3-этил-4-метоксибензиламина гидрохлорид перемешивают при комнатной температуре в 1-метил-2-пирролидиноне в присутствии DBU, в результате получая 1-хлор-4-[(3-этил-4-метоксибензил)амино]-6-фталазинкарбонитрил в качестве менее полярного соединения.
1H-ЯМР (400 МГц, СDСl3) δ : 1,14 (3Н, т, J=7,5 Гц), 2,60 (2Н, кв, J=7,5 Гц), 3,81 (3Н, с), 4,84 (2Н, с), 6,80 (1Н, д, J=8,2 Гц), 7,25 (1Н, д, J=2,0 Гц), 7,30 (1Н, дд, J=2,0; 8,2 Гц), 8,06 (1Н, д, J=9,0 Гц), 8,27 (1H, д, J=9,0 Гц), 8,42 (1Н, м).
Получение промежуточного продукта - Пример 7
1-Хлор-4-[(3-хлор-4-метилбензил)амино]-6-фталазинкарбонитрил 15 мл раствора 2,0 г 3-хлор-4-метилбензонитрила в тетрагидрофуране по каплям добавляют в 40 мл раствора 453 мг алюмогидрида лития в тетрагидрофуране в атмосфере азота. Смесь нагревают с обратным холодильником в течение 2 часов и 10 минут. Смесь охлаждают с помощью льда и по каплям добавляют 0,45 мл воды, 0,45 мл 15% водного раствора гидроксида натрия и 1,35 мл воды таким образом, чтобы температура раствора сохранялась на уровне 10°С или ниже. Раствор фильтруют через целит и полученный фильтрат сушат, добавляя безводный сульфат натрия. Смесь фильтруют через NH-образующий силикагель, фильтрат упаривают, получая 1,74 г 3-хлор-4-метилбензиламина.
1,4-Дихлорфталазин-6-карбонитрил и 3-хлор-4-метилбензиламин перемешивают при комнатной температуре в 1-метил-2-пирролидиноне в присутствии DBU, в результате получая целевое соединение в качестве менее полярного соединения.
1H-ЯМР (400 МГц, DMSO-d6) δ; 2,29 (3Н, с), 4,73 (2Н, д, J=5,2 Гц), 7,28-7,32 (2Н, м), 7,45 (1Н, д, J=0,8 Гц), 8,20 (1Н, дд, J=8,4; 0,4 Гц), 8,34 (1Н, д, J=8,4; 1,6 Гц), 8,52 (1Н, т, J=5,2 Гц), 9,00 (1Н, м).
Получение промежуточного продукта - Пример 8
1-Хлор-4-[(4-хлор-3-метоксибензил)амино]-6-фталазинкарбонитрил
4-Хлор-3-метоксибензиламинбензиламин гидрохлорид, синтезированный в соответствии со способом, описанным в публикации WО 9518097, и 1,4-дихлорфталазин-6-карбонитрил перемешивают при комнатной температуре в 1-метил-2-пирролидиноне в присутствии DBU, в результате получая 1-хлор-4-[(4-хлор-3-метоксибензил)амино]-6-фталазинкарбонитрил в качестве менее полярного продукта.
1H-ЯМР (400 МГц, DMSO-d6) δ: 3,86 (3Н, с), 4, 76 (2Н, д, J=5,5 Гц), 4,74 (1Н, д, J=4,2 Гц), 6,99 (1Н, дд, J=1,8; 8,1 Гц), 7,22 (1Н, д, J=1,8 Гц), 7,35 (1H, д, J=8,1 Гц), 8,21 (1H, д, J=8,6 Гц), 8,36 (1H, д, J=8,6 Гц), 8,52 (1H, т, J=5,2 Гц), 9, 03 (1H, с).
Получение промежуточного продукта - Пример 9
1-Хлор-4-[(3,4-дихлорбензил)амино]-6-фталазинкарбонитрил
1H-ЯМР (400 МГц, DMSO-d6) δ: 4,76 (2Н, д, J=5,4 Гц), 7,40 (1H, дд, J=8,4, 1,8 Гц), 7,58 (1H, д, J=8,4 Гц), 7,68 (1H, д, J=1,8 Гц), 8,21 (1H, дд, J=8,4; 0,4 Гц), 8,36 (1H, дд, J=8,4, 1,6 Гц), 8,57 (1H, т, J=5,4 Гц), 8,99 (1H, д, J=1,6 Гц).
Получение промежуточного продукта - Пример 10
Бензил-4-фтор-4-гидроксиметил-1-пиперидинкарбоксилат
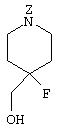
51,1 г метилтолуолфенилфосфонийбромида добавляют в смесь 16,1 г трет-бутоксида калия и 500 мл тетрагидрофурана и затем перемешивают в течение 1 часа 20 минут при комнатной температуре. В смесь добавляют 16,1 г бензил 4-оксо-1-пиперидинкарбоксилата и смесь перемешивают в течение 2 часов 40 минут при комнатной температуре. Реакционный раствор выпаривают, добавляют диэтиловый эфир и фильтруют через целит. Фильтрат промывают водой и рассолом, сушат над безводным сульфатом магния и затем фильтруют. Фильтрат упаривают и полученный остаток подвергают колоночной хроматографии на силикагеле, получая 25,5 г бензил 4-метилен-1-пиперидинкарбоксилата.
14,7 г бензил-4-метилен-1-пиперидинкарбоксилата растворяют в 300 мл метанола, к смеси добавляют 20,4 г моноперкислотной магниевой соли фталевой кислоты и 13,3 г бикарбоната натрия и смесь перемешивают при комнатной температуре в течение 7,5 час. Реакционный раствор упаривают. К полученному остатку добавляют этилацетат, затем промывают водой и рассолом, сушат над безводным сульфатом магния и после этого фильтруют. Фильтрат выпаривают и затем подвергают колоночной хроматографии на силикагеле, получая 11,3 г бензил-1-окса-6-азаспиро[2.5]октан-6-карбоксилата.
Смесь 5 мл пиридина гидрофторида и 20 мл метиленхлорида охлаждают и по каплям в течение 25 минут добавляют 10 мл раствора 4,95 г бензил-1-окса-6-азаспиро[2.5]октан-6-карбоксилата в метиленхлориде так, чтобы температура смеси поддерживалась на уровне 0°С. Смесь перемешивают в течение 35 минут при охлаждении на ледяной бане. Реакционный раствор выливают в смесь насыщенного раствора бикарбоната натрия и льда. Органический слой отделяют, сушат над безводным сульфатом магния и фильтруют. Фильтрат упаривают и затем подвергают колоночной хроматографии на силикагеле, получая 2,84 г целевого соединения.
Получение промежуточного продукта - Пример 11
трет-Бутил-4-гидрокси-4-(1H-1-имидазолилметил)-1-пиперидинкарбоксилат

13,5 г трет-бутил-4-метилен-1-пиперидинкарбоксилата растворяют в 300 мл метанола и 28,3 г моноперкислотной магниевой соли фталевой кислоты и добавляют 8,62 г бикарбоната натрия и смесь перемешивают при комнатной температуре в течение 1 дня. Реакционный раствор фильтруют через целит и полученный фильтрат упаривают. К полученному остатку добавляют этилацетат, смесь затем промывают водой и рассолом, сушат над безводным сульфатом магния и затем фильтруют. Фильтрат упаривают и подвергают колоночной хроматографии (силикагель), получая 12,2 г трет-бутил-1-окса-6-азаспиро[2.5]октан-6-карбоксилата.
4,25 г трет-бутил-окса-6-азаспиро[2.5]октан-6-карбоксилата растворяют в 30 мл диметилформамида, добавляют 5,38 г натрийимидазола и смесь перемешивают при 60°С в течение 3 часов 40 минут. После охлаждения в реакционный раствор добавляют этилацетат и раствор трижды промывают водой, затем рассолом, сушат над безводным сульфатом магния и фильтруют. Фильтрат упаривают и подвергают колоночной хроматографии (силикагель), получая 4,93 г трет-бутил-4-гидрокси-4-(1Н-1-имидазолилметил)-1-пиперидинкарбоксилата.
Получение промежуточного продукта - Пример 12
трет-Бутил-4-гидрокси-4-(1Н-1,2, 4-триазол-1-илметил)-1-пиперидинкарбоксилат
Целевое соединение получают по методике Получения промежуточных продуктов Примера 11, используя 1,2,4-триазолнатрий вместо имидазолнатрия.
Получение промежуточного продукта - Пример 13
Бензил-4-фторметил-4-гидрокси-1-пиперидинкарбоксилат
3,2 г гидрофторида натрия и 610 мг тетра-н-бутиламмонийдигидротрифторида добавляют к 5 г бензил-1-окса-6-азаспиро[2.5]октан-6-карбоксилата и смесь перемешивают при 120°С в течение 7 часов. После охлаждения добавляют метиленхлорид и смесь фильтруют через целит. Фильтрат упаривают и полученный остаток подвергают колоночной хроматографии (силикагель), получая 4,7 г целевого соединения.
Получение промежуточного продукта - Пример 14
4-Гидрокси-4-пиперидинкарбоксамид гидрохлорид
Смешенный раствор 18 мл конц. серной кислоты и 1,8 мл воды охлаждают до 0°С и в раствор понемногу добавляют 5 г 1-бензил-4-гидрокси-4-пиперидинкарбонитрила гидрохлорида. К полученному раствору добавляют смешенный раствор 25 мл конц. серной кислоты и 2,5 мл воды и перемешивают при комнатной температуре в течение 2 часов. Смесь оставляют на ночь в холодильнике. Реакционный раствор выливают в лед и туда небольшими порциями добавляют 47 г гидроксида натрия. Смесь экстрагируют 3 раза смешенным растворителем, состоящим из тетрагидрофурана и этилацетата (1:1). Экстракт промывают рассолом, сушат над безводным сульфатом магния и затем фильтруют. Фильтрат упаривают и подвергают очистке колоночной хроматографией (наполнитель: силикагель), получая 3,19 г 1-бензил-4-гидрокси-4-пиперидинкарбоксамида.
3,19 г 1-бензил-4-гидрокси-4-пиперидинкарбоксамида растворяют в 150 мл метанола и к полученному раствору добавляют 1,5 г 20% водного раствора гидроксида палладия. Смесь подвергают вибрации в течение 4 часов в атмосфере водорода под давлением 4 атмосферы. Реакционный раствор фильтруют через целит и к фильтрату добавляют 5 мл 4 N НСl в диоксане, фильтрат упаривают. Полученный кристаллический остаток промывают диизопропиловым эфиром и выделяют фильтрованием, получая 1,96 г целевого соединения.
Получение промежуточного продукта - Пример 15
N-(3-Хлор-4-метоксибензил)-N-[4-хлор-7-(1H-1-пиразолил)-1-фталадинил]амин

110 мл тионилхлорида по каплям в течение 30 минут добавляют в смесь 100 г 4-фторфталевого ангидрида и 1500 мл метанола. Смесь нагревают с обратным холодильником в течение 8 часов и упаривают. К полученному остатку добавляют ледяную воду, смесь затем экстрагируют этилацетатом. Экстракт промывают рассолом, сушат над безводным сульфатом магния и фильтруют. Фильтрат упаривают, получая 125 г диметил-4-фторфталата.
26 г гидрида натрия в масле в течение 40 минут добавляют к 200 мл раствора 44 г пиразола в 1-метил-2-пирролидиноне. В полученную смесь в течение 30 минут добавляют 125 г диметил-4-фторфталата и перемешивают при комнатной температуре в течение 2 часов. Реакционный раствор охлаждают до 0°С и выливают в ледяную воду. Смесь экстрагируют этилацетатом и промывают насыщенным раствором бикарбоната натрия и рассолом. Смесь сушат над безводным сульфатом магния и фильтруют. Фильтрат упаривают, к полученному кристаллическому остатку добавляют диэтиловый эфир, осадок выделяют фильтрованием, получая 77 г диметил-4-(1H-1-пиразолил)фталата.
22 мл гидразинмоногидрата добавляют в смесь 77 г диметил-4-(1H-1-пиразолил)фталата и 500 мл этанола и нагревают с обратным холодильником в течение 6 часов. После охлаждения полученный осадок выделяют фильтрованием, получая 36 г 6-(1H-1-пиразолил)-1, 4-фталазиндиона.
15 мл диизопропилэтиламина добавляют в смесь 5,0 г 6-(1H-1-пиразолил)-1,4-фталазиндиона и 20 мл оксихлорида фосфора, смесь перемешивают при 110°С в течение 0,5 часа. Реакционный раствор охлаждают до 0°С, добавляют этилацетат и затем небольшими порциями добавляют лед и воду. Реакционный раствор перемешивают при 0°С в течение 0,5 часа и нерастворимые вещества удаляют фильтрованием. Этилацетатный слой отделяют, промывают рассолом, сушат над безводным сульфатом магния и фильтруют. Фильтрат упаривают, к полученному кристаллическому остатку добавляют этилацетат, осадок затем выделяют фильтрованием, получая 3,8 г 1,4-дихлор-6-(1Н-1-пиразолил)фталазина.
14 мл DBU добавляют в смесь 8 г 1, 4-дихлор-6-(1H-1-пиразолил)фталазина, 9,5 г 3-хлор-4-метоксибензиламина гидрохлорида и 30 мл 1-метил-2-пирролидинона и смесь перемешивают при комнатной температуре в течение 1 часа. Смесь дополнительно перемешивают при 60°С в течение 3 часов. Реакционный раствор охлаждают до 0°С, этилацетат добавляют, затем промывают водой и рассолом. Смесь сушат над безводным сульфатом магния, фильтруют и фильтрат упаривают. Полученный остаток очищают колоночной хроматографией (наполнитель: силикагель), в результате получая 2,6 г целевого соединения в качестве менее полярного соединения.
1Н-ЯМР (400 МГц, DMSO-d6) δ: 3,80 (3Н, с), 4,68 (2Н, д, J=6,0 Гц), 6,70 (1Н, т, J=2,0 Гц), 7,09 (1Н, д, J=8,8 Гц), 7,35 (1Н, дд, J=2,0; 8,4 Гц), 7,47 (1Н, д, J=2,0 Гц), 7,91 (1H, д, J=2,0 Гц), 8,18 (1H, д, J=9,2 Гц), 8,32 (1H, т, J=5,6 Гц), 8,50 (1H, дд, J=2,0; 8,8 Гц), 8,68 (1H, д, J=2,4 Гц), 8,78 (1H, д, J=2,0 Гц).
Получение промежуточного продукта - Пример 16
N-(3-Хлор-4-метоксибензил)-N-[4-хлор-7-(1Н-1,2,3-триазол-1-ил)-1-фталазинил]амин
Целевое соединение получают по методике Примера 15 с тем отличием, что 1,2,3-триазол используют вместо пиразола.
1H-ЯМР (400 МГц, CD3OD) δ: 3,82 (3Н, с), 4,72 (2Н, с), 6,97 (1H, д, J=8,4 Гц), 7,34 (1H, дд, J=1,6; 8,4 Гц), 7,44 (1H, д, J=1,6 Гц), 7,99 (1H, д, J=1,2 Гц), 8,34 (1H, д, J=8,8 Гц), 8,52 (1H, дд, J=1,6; 8,8 Гц), 8,72 (1H, д, J=1,2 Гц), 8,81 (1H, д, J=2 Гц).
Получение промежуточного продукта - Пример 17
6-Бром-1-хлор-4-[(3-хлор-4-метоксибензил)амино]фталазин
96,9 мл гидразинмоногидрата добавляют в смесь 20 г 4-бромфталевого ангидрида и 100 мл этанола и смесь нагревают с обратным холодильником в течение 8 часов. После охлаждения образующиеся осадки выделяют фильтрованием, получая 28 г 6-бром-1, 4-фталазиндиона.
15 мл диизопропилэтиламина добавляют к смеси 6,8 г 6-бром-1,4-фталазиндиона и 15 мл оксихлорида фосфора и смесь нагревают с обратным холодильником в течение 1,5 часа. После охлаждения реакционный раствор выливают в ледяную воду, тщательно перемешивают и экстрагируют метиленхлоридом. Водный слой экстрагируют этилацетатом. Объединенный экстракт сушат над безводным сульфатом магния и фильтруют. Фильтрат упаривают и полученный остаток очищают колоночной хроматографией (наполнитель: силикагель), получая 4,3 г 6-бром-1,4-дихлорфталазина.
5,2 мл DBU добавляют в смесь 3,8 г 6-бром-1,4-дихлорфталазина, 3,5 г 3-хлор-4-метоксибензиламина гидрохлорида и 30 мл 1-метил-2-пирролидинона и смесь перемешивают при 100°С в течение 3 часов. После охлаждения в реакционный раствор добавляют воду, затем полученную смесь экстрагируют этилацетатом. Экстракт промывают рассолом, сушат над безводным сульфатом магния, фильтруют и фильтрат упаривают. Полученный остаток очищают колоночной хроматографией (наполнитель: силикагель), получая 1,8 г целевого соединения в качестве менее полярного соединения.
Получение промежуточного продукта - Пример 18
1-(1,1-Диметил-2-пропинил)-4-пиперидинол
24 мг хлорида меди и 15 мг порошкообразной меди добавляют к смешенному раствору 5 мл раствора 7,3 г 4-гидроксипиперидина в диэтиловом эфире (5 мл) и воды (2,5 мл) в атмосфере азота. Смесь охлаждают льдом и добавляют по каплям 2,5 мл раствора 2,7 мл 3-хлор-3-метил-1-бутина в диэтиловом эфире, поддерживая температуру в реакционной среде в интервале от 17 до 22°С. Затем смесь перемешивают при комнатной температуре в течение ночи. Добавляют воду и полученную смесь экстрагируют диэтиловым эфиром 5 раз. Органические слои объединяют и сушат над карбонатом калия, затем над гидроксидом натрия и фильтруют. Фильтрат концентрируют при нормальном давлении. Образующиеся кристаллы выделяют фильтрованием, добавляя смесь этилацетат/гексан, получая 2,54 г целевого соединения.
Получение промежуточного продукта - Пример 19
1-(1, 1-Диметил-2-пропинил)пирролидин
Целевое соединение получают по методике Получения промежуточного продукта Примера 18 из пирролидина и 3-хлор-3-метил-1-бутина.
Получение промежуточного продукта - Пример 20
(2R)-1-Окca-8-азаспиро[4.5]дека-2-илметанол
105,5 г (5S)-5-(гидроксиметил)тетрагидро-2-фуранон растворяют в 1,2 л пиридина, добавляют 380 г тритилхлорида при комнатной температуре и смесь перемешивают при 80°С в течение ночи. После завершения реакции смесь охлаждают, добавляют воду, экстрагируют этилацетатом и затем промывают рассолом. Растворитель удаляют и полученный остаток растворяют в 300 мл хлороформа, после чего к нему добавляют 600 мл силикагеля, растворитель удаляют. Полученный остаток очищают колоночной хроматографией (наполнитель: силикагель), получают 149,3 г (5S)-5-[(тритилокси)метил]тетрагидро-2-фуранона.
26,9 г (5S)-5-[(тритилокси)метил]тетрагидро-2-фуранона растворяют в 200 мл THF, добавляют 300 мл раствора 1 М винилмагнийбромида в THF при комнатной температуре и смесь перемешивают в течение 1,5 часа при нагревании с обратным холодильником. После завершения реакции к смеси добавляют насыщенный водный раствор хлорида аммония при охлаждении льдом, экстрагируют этилацетатом и затем дважды промывают рассолом. Растворитель удаляют и полученный остаток очищают колоночной хроматографией (наполнитель: силикагель), получая 13,0 г (2S)-1-(тритилокси)-5-винил-6-гептен-2,5-диола.
13,0 г (2S)-1-(тритилокси)-5-винил-6-гептен-2,5-диола и 57,2 г толуолсульфонилхлорида растворяют в 200 мл пиридина и перемешивают при 80°С в течение ночи. После завершения реакции в смесь добавляют воду и перемешивают ее при комнатной температуре в течение 10 минут. После экстрагирования 2 раза этилацетатом смесь промывают рассолом и сушат над сульфатом магния. Растворитель удаляют и полученный остаток растворяют в толуоле. После повторного удаления растворителя полученный остаток очищают колоночной хроматографией (наполнитель: силикагель), получая 5,88 г (5R)-5-[(тритилокси)метил]-2, 2-дивинилтетрагидрофурана.
4,68 г (5R)-5-[(тритилокси)метил]-2,2-дивинилтетрагидрофурана, 100 мл 0,5 М 9-BBN и 6,1 г 9-BBN димера суспендируют в 100 мл THF и перемешивают в течение 30 час при нагревании с обратным холодильником. После охлаждения добавляют 50 мл 30% пероксида водорода и 50 мл 3 N гидроксида натрия при охлаждении льдом и перемешивают при 50°С в течение 20 часов. После завершения реакции реакционному раствору дают охладиться до комнатной температуры, после этого его экстрагируют этилацетатом, промывают рассолом и сушат над сульфатом магния. Растворитель удаляют и полученный остаток очищают колоночной хроматографией (наполнитель: силикагель), получая 2,68 г 2-(5R)-2-(2-гидроксиэтил)-5-[(тритилокси)метил]тетрагидро-2-фуранил-1-этанола.
2,68 г 2-(5R)-2-(2-гидроксиэтил)-5-[(тритилокси)метил]тетрагидро-2-фуранил-1-этанола и 12 мл пиридина растворяют в 30 мл дихлорметана, добавляют 11,82 г толуолсульфонилхлорида при охлаждении льдом и перемешивают в течение 2,5 часа. После завершения реакции добавляют 30 мл пиридина и затем смесь концентрируют. После добавления пиридина и воды смесь снова охлаждают льдом и перемешивают в течение 15 минут. Смесь экстрагируют этилацетатом, промывают рассолом и затем сушат над сульфатом магния. Растворитель отгоняют, добавляют толуол, растворитель снова отгоняют и после этого полученный остаток очищают колоночной хроматографией (наполнитель: силикагель), получая 4,17 г 2-(5R)-2-[2-[(4-ме-тилфенил)сульфонил]оксиэтил]-5-[(тритилокси)метил]тетрагидро-2-фуранилэтил-4-метил-1-бензолсульфоната.
4,17 г 2-(5R)-2-[2-[(4-метилфенил)сульфонил]оксиэтил]-5-[(тритилокси)метил]тетрагидро-2-фуранилэтил-4-метил-1-бензолсульфоната и 5,36 г бензиламина растворяют в 80 мл DMF и перемешивают при 110°С в течение 11,5 часов. После завершения реакции добавляют воду, экстрагируют этилацетатом и дважды промывают рассолом и насыщенным водным раствором бикарбоната натрия. Затем смесь сушат над сульфатом магния, растворитель удаляют и полученный остаток очищают колоночной хроматографией (наполнитель: силикагель), получая 2,1 г (2R)-8-бензил-2-[(тритилокси)метил]-1-окса-8-азаспиро[4.5]декана.
2,10 г (2R)-8-бензил-2-[(тритилокси)метил]-1-окса-6-азаспиро[4.5]декана растворяют в 20 мл THF, добавляют 8 мл 4 N раствора соляной кислоты в 1,4-диоксане при охлаждении льдом и затем смесь перемешивают в течение 1 часа. После завершения реакции добавляют воду и насыщенный водный раствор бикарбоната натрия, дважды экстрагируют этилацетатом, промывают насыщенным водным раствором бикарбоната натрия и рассолом и затем сушат над сульфатом магния. Растворитель удаляют и полученный остаток очищают колоночной хроматографией (наполнитель: силикагель), получая 1,03 г [(2R)-8-бензил-1-окса-8-азаспиро[4,5]дека-2-ил]метанола.
1,03 г [(2R)-8-бензил-1-окса-8-азаспиро[4.5]дека-2-ил]метанола и 0,45 г 10% палладия на углероде суспендируют в 30 мл этанола и перемешивают при комнатной температуре в течение 18 часов в атмосфере водорода с давлением 1 атмосфера. Нерастворимые вещества удаляют фильтрованием, растворитель удаляют и сушат, получая 0,76 г целевого соединения.
Получение промежуточного продукта - Пример 21
800 мл раствора 25,0 г трет-бутил-4-оксо-1-пиперидинкарбоксилата в диэтиловом эфире охлаждают в смеси лед/метанол и по каплям добавляют 138 мл раствора аллилмагнийбромида (1 М в диэтиловом эфире). Реакционную смесь перемешивают в течение 3 часов 10 минут. Реакционный раствор выливают в смесь насыщенного водного раствора хлорида аммония и льда. Слой диэтилового эфира выделяют и промывают рассолом. Слой сушат над безводным сульфатом магния и затем фильтруют. Фильтрат упаривают и полученный остаток очищают колоночной хроматографией (наполнитель: силикагель), получая 15,9 г трет-бутил-4-аллил-4-гидрокси-1-пиперидинкарбоксилата.
9,83 г трет-бутил-4-аллил-4-гидрокси-1-пиперидинкарбоксилата растворяют в 60 мл смеси тетрагидрофуран/вода (9:1), добавляют раствор (2,5 мас.%, 2 мл) тетраоксида осмия в трет-бутиловом спирте и 6,68 г N-метилморфолин-N-оксида и смесь перемешивают при комнатной температуре в течение ночи. Реакционный раствор упаривают и полученный остаток распределяют между этилацетатом и водой, промывают рассолом и сушат над сульфатом магния. После фильтрования растворитель выпаривают и полученный остаток очищают колоночной хроматографией (наполнитель: силикагель) (этилацетат/метанол), получая 9,11 г трет-бутил-4-(2,3-дигидроксипропил)-4-гидрокси-1-пиперидинкарбоксилата.
9,11 г трет-бутил-4-(2, 3-дигидроксипропил)-4-гидрокси-1-пиперидинкарбоксилата растворяют в 40 мл пиридина, добавляют 10,0 г хлортрифенилметана и смесь перемешивают при комнатной температуре в течение ночи. Реакционный раствор распределяют между этилацетатом и водой, промывают 2 N соляной кислотой, водой, насыщенным водным раствором бикарбоната натрия и рассолом и сушат над сульфатом магния. После фильтрования растворитель выпаривают и полученный остаток очищают колоночной хроматографией (наполнитель: силикагель; гексан/этилацетат), получая 10,3 г трет-бутил-4-[3-(трет-бутокси)-2-гидроксипропил]-4-гидрокси-1-пиперидинкарбоксилата.
2,59 г трет-бутил-4-[3-(трет-бутокси)-2-гидроксипропил]-4-гидрокси-1-пиперидинкарбоксилата растворяют в 10 мл диметилформамида, добавляют 400 мг гидрида натрия и 823 мг бензилхлорида и смесь перемешивают при комнатной температуре в течение 20 минут. Реакционный раствор выливают в ледяную воду, экстрагируют этилацетатом, промывают водой и рассолом и сушат над сульфатом магния. После фильтрования растворитель выпаривают и полученный остаток очищают колоночной хроматографией (наполнитель: силикагель; гексан/этилацетат), получая 2,66 г трет-бутил-4-[2-(бензилокси)-3-(трет-бутокси)пропил]-4-гидрокси-1-пиперидинкарбоксилата.
2,36 г трет-бутил-4-[2-(бензилокси)-3-(трет-бутокси)пропил]-4-гидрокси-1-пиперидинкарбоксилата растворяют в 40 мл ацетонитрила, добавляют 426 мг аммонийнитрата церия (cerium ammonium nitrate) и смесь перемешивают при комнатной температуре в течение ночи. В реакционный раствор добавляют силикагель и затем раствор упаривают. Остаток очищают посредством адсорбционного силикагеля, загруженного в неадсорбирующую силикагельную колонку, со смесью гексан/этилацетат, получая 547 мг трет-бутил-4-[2-(бензилокси)-3-гидроксипропил]-4-гидрокси-1-пиперидинкарбоксилата.
4,81 г трет-бутил-4-[2-(бензилокси)-3-гидроксипропил]-4-гидрокси-1-пиперидинкарбоксилата растворяют в 20 мл пиридина, добавляют 2,76 г тозилхлорида и смесь перемешивают при комнатной температуре в течение 2 часов. Добавляют 1,00 г тозилхлорида дополнительно и смесь перемешивают при комнатной температуре в течение 30 минут, затем при 50°С в течение 35 минут. Реакционный раствор распределяют между этилацетатом и водой, промывают 1 N соляной кислотой, насыщенным водным раствором бикарбоната натрия и рассолом и сушат над сульфатом магния. После фильтрования растворитель выпаривают и полученный остаток очищают колоночной хроматографией (силикагель; гексан/этилацетат), получая 3,72 г трет-бутил-3-(бензилокси)-1-окca-8-азаспиро[4.5]декан-8-карбоксилата.
6,47 г трет-бутил-3-(бензилокси)-1-окса-8-азаспиро[4.5]декан-8-карбоксилата растворяют в 100 мл тетрагидрофурана, добавляют 1,3 г палладия на углероде и смесь перемешивают в течение ночи в атмосфере водорода. Катализатор удаляют из реакционного раствора фильтрованием, добавляют 1,3 г палладия на углероде и раствор перемешивают в течение ночи в атмосфере водорода. Катализатор удаляют из реакционного раствора фильтрованием, добавляют 2,6 г палладия на углероде и раствор перемешивают в течение ночи в атмосфере водорода под давлением 4,2 атмосферы. Катализатор удаляют из реакционного раствора фильтрованием, растворитель выпаривают и полученный остаток очищают колоночной хроматографией (силикагель; этилацетат/метанол), получая 4,27 г трет-бутил 3-гидрокси-1-окса-8-азаспиро[4.5]декан-8-карбоксилата.
Получение промежуточного продукта - Пример 22
(анти)-3-Окса-9-азабицикло[3.3.1]нонан-7-ол гидрохлорид
2,0 г алюмогидрида лития суспендируют в 200 мл тетрагидрофурана и по каплям добавляют раствор 14,17 г 9-метил-3-окса-9-азабицикло[3.3.1]нонан-7-она в 20 мл тетрагидрофурана при охлаждении льдом. После перемешивания смеси в течение 35 минут в реакционный раствор последовательно добавляют 2,0 мл воды, 2,0 мл 15% водного раствора гидроксида натрия и 6,0 мл воды и смесь перемешивают при комнатной температуре. Реакционный раствор фильтруют, растворитель выпаривают. Полученный остаток растворяют в этилацетате и фильтруют через оксид алюминия. Растворитель выпаривают, получая 10,00 г (анти)-9-метил-3-окса-9-азабицикло[3.3.1]нонан-7-ола в виде желтого воска.
10,0 г (анти)-9-метил-3-окса-9-азабицикло[3.3.1]нонан-7-ола растворяют в 100 мл тетрагидрофурана, добавляют 10,7 мл триэтиламина, 7,2 мл уксусного ангидрида и 0,77 г 4-диметиламинопиридина и смесь перемешивают при 50°С в течение ночи.
Реакционный раствор упаривают, полученный остаток растворяют в этилацетате и фильтруют через оксид алюминия. Фильтрат концентрируют и очищают колоночной хроматографией (оксид алюминия; растворитель: н-гексан/этилацетат), получая 8,68 г (анти)-3-окса-9-азабицикло[3.3.1]нонан-7-илацетата в виде бледно-желтого масла.
8, 68 г (анти)-3-окса-9-азабицикло[3.3.1]нонан-7-илацетата растворяют в 40 мл 1,2-дихлорэтана и добавляют 7,0 мл винилхлорформиата. Смесь перемешивают при комнатной температуре в течение 30 минут и затем нагревают с обратным холодильником в течение 2 часов 35 минут. Реакционный раствор упаривают и очищают колоночной хроматографией (наполнитель: силикагель; растворитель: н-гексан/этилацетат), получая 8,96 г (анти)-3-окса-9-винилоксикарбонил-9-азабицикло[3.3.1]нонан-7-илацетата в виде бледно-желтого масла.
8,96 г (анти)-3-окса-9-винилоксикарбонил-9-азабицикло[3.3.1]нонан-7-илацетата растворяют в 45 мл метанола и добавляют 30 мл воды и 7,3 г карбоната калия. Смесь перемешивают при комнатной температуре в течение 1 часа 30 минут и при 50°С в течение 30 минут. Реакционный раствор упаривают, затем добавляют рассол и смесь экстрагируют этилацетатом. После сушки над безводным сульфатом магния растворитель выпаривают, в результате получая 7,37 г (анти)-3-окса-9-винилоксикарбонил-9-азабицикло[3.3.1]нонан-7-ола в виде бледно-желтого масла.
17 мл 4 N хлористого водорода в диоксане добавляют к 7,37 г (анти)-3-окса-9-винилоксикарбонил-9-азабицикло[3.3.1]нонан-7-ола и смесь перемешивают при комнатной температуре в течение 30 минут. В реакционный раствор добавляют 40 мл этанола и смесь нагревают с обратным холодильником в течение 1 часа. Растворитель выпаривают, к полученному остатку добавляют этилацетат и образующийся осадок выделяют фильтрованием, в результате получая 5,55 г целевого соединения в виде белых игл.
Получение промежуточного продукта - Пример 23
(син)-3-Азабицикло[3.2.1]октан-8-ол гидрохлорид
Целевое соединение получают по методике Получения промежуточного продукта Примера 22 из 3-метил-3-азабицикло[3.2.1]октан-8-она.
Получение промежуточного продукта - Пример 24
(анти)-3-Окса-7-азабицикло[3.3.1]нонан-9-ол гидрохлорид
Целевое соединение получают по методике Получения промежуточного продукта Примера 22 из 7-метил-3-окса-7-азабицикло[3.3.1]нонан-9-она.
Получение промежуточного продукта - Пример 25
(анти)-9-Азабицикло[3.3.1]нонан-3-ол гидрохлорид
Целевое соединение получают по методике Получения промежуточного продукта Примера 22 из 9-метил-9-азабицикло[3.3.1]нонан-3-она.
Получение промежуточного продукта - Пример 26
(экзо)-8-Азабицикло[3.2.1]октан-3-ол гидрохлорид
Целевое соединение получают после ацетилирования по методике Получения промежуточного продукта Примера 22 из (экзо)-8-метил-8-азабицикло[3.2.1]октан-3-ола.
Получение промежуточного продукта - Пример 27
(эндо)-8-Азабицикло[3.2.1]октан-3-ол гидрохлорид
Целевое соединение получают после ацетилирования по методике Получения промежуточного продукта Примера 22 из (эндо)-8-метил-8-азабицикло[3.2.1]октан-3-ола.
Получение промежуточного продукта - Пример 28
(анти)-3-Азабицикло[3.3.1]нонан-9-ол гидрохлорид
1,0 г алюмогидрида лития суспендируют в 100 мл тетрагидрофурана и по каплям добавляют раствор 7,00 г 3-метил-3-азабицикло[3.3.1]нонан-9-она в 20 мл тетрагидрофурана при охлаждении льдом. После перемешивания в течение 50 минут в реакционный раствор последовательно добавляют 1,0 мл воды, 1,0 мл 15% водного раствора гидроксида натрия и 3,0 мл воды и перемешивают при комнатной температуре. После фильтрования реакционного раствора растворитель выпаривают, в результате получают 7,08 г бледно-желтого масла. Масло растворяют в 90 мл тетрагидрофурана, добавляют 9,55 мл триэтиламина и затем смесь перемешивают при охлаждении льдом. В смесь добавляют 6,46 мл уксусного ангидрида и 0,56 г 4-диметиламинопиридина и смесь перемешивают при комнатной температуре в течение 14 час. Добавляют приблизительно 20 мл метанола, после чего реакционный раствор упаривают. К осадку добавляют водный раствор карбоната калия и полученную смесь экстрагируют этилацетатом. Органический слой промывают водой и рассолом и затем сушат над безводным сульфатом натрия. Растворитель выпаривают и полученный остаток очищают колоночной хроматографией (наполнитель: силикагель; растворитель: н-гексан/этилацетат), получая 3,33 г (анти)-3-метил-3-азабицикло[3.3.1]нонан-9-илацетата (бесцветное масло) в качестве менее полярного соединения. Кроме того, получают 2,06 г (син)-3-метил-3-азабицикло[3.3.1]нонан-9-илацетата (бледно-оранжевое масло) в качестве более полярного соединения.
2, 06 г (анти)-3-метил-3-азабицикло[3.3.1]нонан-9-илацетата растворяют в 10 мл 1,2-дихлорэтана, добавляют 2,07 мл винилхлорформиата и смесь перемешивают при комнатной температуре в течение 50 минут. Затем смесь нагревают с обратным холодильником в течение 5 часов 25 минут. Реакционный раствор упаривают, к полученному остатку добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают 1 N соляной кислотой, насыщенным раствором бикарбоната натрия и рассолом и сушат над безводным сульфатом магния. Растворитель выпаривают, получая 2,51 г (анти)-3-винилоксикарбонил-3-азабицикло[3.3.1]нонан-9-илацетата в виде бледно-оранжевого масла.
4,02 г (анти)-3-винилоксикарбонил-3-азабицикло[3.3.1]нонан-9-илацетата растворяют в 36 мл этанола, добавляют 18 мл 1 N водного раствора гидроксида натрия и затем смесь перемешивают при комнатной температуре в течение 1 часа 50 минут. Реакционный раствор упаривают, к полученному остатку добавляют воду, смесь затем экстрагируют этилацетатом. Органический слой промывают водой, насыщенным водным раствором бикарбоната натрия и рассолом и сушат над безводным сульфатом магния. Растворитель выпаривают и затем полученный остаток очищают колоночной хроматографией (наполнитель: силикагель; растворитель: н-гексан/этилацетат), получая 3,09 г (анти)-3-винилоксикарбонил-3-азабицикло[3.3.1]нонан-9-ол в виде желтоватого масла.
7 мл раствора 4 N хлористый водород/диоксан добавляют к 3,09 г (анти)-3-винилоксикарбонил-3-азабицикло[3.3.1]нонан-9-ола и смесь перемешивают при комнатной температуре в течение 50 минут. Реакционный раствор упаривают и к полученному остатку добавляют 30 мл этанола, полученную смесь затем нагревают с обратным холодильником в течение 50 минут. Растворитель выпаривают и затем к полученному остатку добавляют этилацетат. Образующийся осадок выделяют фильтрованием, получая 2,41 г целевого соединения в виде мелочно-белого порошка.
Получение промежуточного продукта - Пример 29
(син)-3-Азабицикло[3.3.1]нонан-9-ол кислотная соль
Целевое соединение получают по методике Получения промежуточного продукта Примера 28 из (син)-3-метил-3-азабицикло[3.3.1]нонан-9-илацетата.
Получение промежуточного продукта - Пример 30
(анти)-2-(3-Азабицикло[3.3.1]нон-9-ил)-1-этанол гидрохлорид
1,0 г алюмогидрида лития суспендируют в 30 мл тетрагидрофурана и по каплям добавляют 25 мл суспензии 3,24 г (анти)-метил(3-азабицикло[3.3.1]нон-9-ил)ацетата в тетрагидрофуране при охлаждении льдом. После перемешивания в течение 35 минут в реакционный раствор последовательно добавляют 1,0 мл воды, 1,0 мл 15% водного раствора гидроксида натрия и 3,0 мл воды и перемешивают при комнатной температуре. Реакционный раствор фильтруют, добавляя целит и безводный сульфат натрия, и растворитель выпаривают. Остаток растворяют в этилацетате, добавляют 5 мл смеси 4 N хлористый водород/этилацетат и образующийся осадок выделяют фильтрованием, получая 2,29 г целевого соединения в виде белого порошка.
Получение промежуточного продукта - Пример 31
1-Хлор-4-[(4-метокси-3-метилбензил)амино]-6-фталазинкарбонитрил
1H-ЯМР (400 МГц, DMSO-d6) δ: 2,10 (3Н, с), 3,73 (3Н, с), 4,64 (2Н, д, J=5,4 Гц), 6,85 (1Н, д, J=8,0 Гц), 7,17-7,21 (2Н, м), 8,15 (1Н, д, J=8,6 Гц), 8,31 (1Н, дд, J=8,6; 1, 2 Гц), 8,35 (1Н, т, J=5,4 Гц), 9,00 (1H, д, J=1,2 Гц).
Пример 1
4-(3-Хлор-4-метоксибензил)амино-6-циано-1-(3-пиридил)фталазин дигидрохлорид

10 мл раствора (1,6 М) н-бутиллития в гексане по каплям добавляют в 50 мл раствора 2, 53 г 3-бромпиридиния в безводном диэтиловом эфире при -70°С или ниже и перемешивают 30 минут. 10 мл раствора 5,21 г хлорида три-н-бутилолова в безводном диэтиловом эфире добавляют к полученной смеси. Реакционному раствору дают нагреться до комнатной температуры в течение 1 часа. Реакционный раствор выливают в рассол и органический слой промывают рассолом. Раствор сушат над безводным сульфатом магния и затем упаривают, получая 3-(1,1,1-три-н-бутилстаннил)пиридин в виде желтого масла.
Смесь 1,80 г 1-хлор-4-(3-хлор-4-метоксибензил)амино-6-цианофталазина, 579 мг тетракис(трифенилфосфин)палладия, 25 мл ксилола и 3 мл 1-метил-2-пирролидинона энергично перемешивают, нагревают с обратным холодильником и в течение 1 часа по каплям добавляют 25 мл раствора 3-(1,1, 1-три-н-бутилстаннил)пиридина, полученного выше, в ксилоле. Реакционный раствор дополнительно нагревают с обратным холодильником в течение 15 минут. Реакционный раствор охлаждают до комнатной температуры, промывают 3 раза водой и один раз рассолом. Смесь очищают колоночной хроматографией (наполнитель: силикагель), получают связанный продукт. Его суспендируют в смешенном растворителе, состоящем из тетрагидрофурана и метанола, затем добавляют раствор 4 N соляная кислота/этилацет и смесь упаривают. Полученный продукт перекристаллизовывают из смеси этилацетат/метанол, получая 1,80 г целевого соединения в виде бесцветного порошка.
MASS (ESI): 402,0 (МН+).
1H-ЯМР (400 МГц, DMSO-d6) δ: 3,85 (3Н, с), 4, 06 (2Н, уш.), 4,89 (2Н, уш.), 7,18 (1Н, д, J=8,0 Гц), 7,53 (1Н, дд, J=8,0; 1,2 Гц), 7,67 (1Н, д, J=1,2 Гц), 7,81-7,90 (1H, м), 8,07 (1Н, дд, J=8,8; 0,4 Гц), 8,38-8,45 (1H, м), 8,46 (1H, дд, J=8,8; 1, 4 Гц), 8,90-9,00 (2Н, м), 9,57 (1H, дд, J=1,4; 0,4 Гц), 10,76 (1H, уш.).
Пример 2
4-(3-Хлор-4-метоксибензил)амино-6-циано-1-(2-пиридил)фталазин дигидрохлорид

Целевое соединение получают по методике Примера 1 с тем отличием, что 2-бромпиридин используют вместо 3-бромпиридина.
MASS (ESI): 402,0 (МН+).
1H-ЯМР (400 МГц, DMSO-d6) δ: 3,83 (3Н, с), 4,86-4,90 (2Н, м), 7,16 (1Н, д, J=8,6 Гц), 7,52 (1H, дд, J=8,6; 2,1 Гц), 7,63-7,69 (2Н, м), 7,97 (1H, д, J=8,5 Гц), 8,08-8,13 (1H, м), 8,47 (1H, дд, J=8,5; 1,4 Гц), 8,72-8,83 (2Н, м), 9,56 (1H, д, J=1,4 Гц), 10,82-10, 92 (1H, м).
Пример 3
4-(3-Хлор-4-метоксибензил)амино-6-циано-1-(4-цианопипериди-но)фталазин гидрохлорид

Смесь 15 г 4-пиперидинкарбоксамида, 16,3 г бензилхлорида, 32,3 г карбоната калия и 200 мл N,N-диметилформамида перемешивают при 80°С в течение 4 часов. Реакционный раствор охлаждают до комнатной температуры, добавляют водный раствор гидроксида натрия и после этого экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и затем упаривают. Полученный кристаллический остаток промывают смесью гексан/этилацетат и выделяют фильтрованием. Получают 12,7 г 1-бензил-4-пиперидинкарбоксамида в виде белых чашуйчатых кристаллов.
5 мл N,N-диметилформамида добавляют в смесь 12,7 г 1-бензил-4-пиперидинкарбоксамида и 60 мл оксихлорида фосфора при охлаждении льдом и перемешивают при комнатной температуре в течение 1,5 часа. Смесь упаривают и полученный остаток растворяют в этилацетате и промывают водным раствором гидроксида натрия и рассолом. После сушки над безводным сульфатом натрия смесь упаривают и полученный остаток очищают колоночной хроматографией (наполнитель: силикагель), получая 11,0 г 1-бензил-4-пиперидинкарбонитрила.
11,0 г 1-бензил-4-пиперидинкарбонитрила растворяют в 100 мл 1,2-дихлорэтана, добавляют 7,1 мл 1-хлорэтилхлорформиата при охлаждении льдом. Смесь перемешивают при комнатной температуре в течение 15 минут и затем нагревают с обратным холодильником в течение 1 часа 20 минут. После выпаривания добавляют 50 мл метанола и смесь нагревают с обратным холодильником в течение 1 часа. Реакционный раствор упаривают, кристаллический остаток промывают этилацетатом и выделяют фильтрованием, получая 8,0 г 4-пиперидинкарбонитрила гидрохлорида в виде белых кристаллов.
Смесь 1,2 г полученного 4-пиперидинкарбонитрила гидрохлорида, 1,0 г 1-хлор-4-(3-хлор-4-метоксибензил)амино-6-цианофталазина, 1,8 г диизопропилэтиламина и 10 мл 1-метил-2-пирролидона перемешивают при 170°С в течение 2 часов 30 минут. После охлаждения в реакционный раствор добавляют этилацетат, после чего промывают водой и рассолом.
После сушки над безводным сульфатом натрия растворитель выпаривают и полученный остаток очищают колоночной хроматографией (наполнитель: силикагель). Полученное свободное соединение растворяют в этилацетате, затем добавляют раствор 4 N соляная кислота/этилацет, полученные кристаллы выделяют фильтрованием, получая 880 мг целевого соединения в виде желтого порошка.
MASS (ESI): 433,2 (МН+).
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,98-2,17 (4Н, м), 3,10-3,33 (5Н, м), 3,86 (3Н, с), 4,70-4,74 (2Н, м), 7,17 (1Н, д, J=8,4 Гц), 7,45 (1Н, дд, J=8,4; 2,0 Гц), 7,61 (1Н, д, J=2, 0 Гц), 8,27 (1Н, д, J=8,4 Гц), 8,47 (1Н, дд, J=8,4; 0,8 Гц), 9,34-9,38 (1H, м), 10,28 (1Н, уш.).
Пример 4
4-(3-Хлор-4-метоксифенетил)амино-6-циано-1-(4-цианопиперидино)фталазин гидрохлорид
Целевое соединение получают по методике Примера 3, используя 1-хлор-4-(3-хлор-4-метоксифенетил)амино-6-цианофталазин вместо 1-хлор-4-(3-хлор-4-метоксибензил)амино-6-цианофталазина.
MASS (ESI): 447,1 (МН+).
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,97-2,18 (4Н, м), 2,94-3,00 (2Н, м), 3,11-3,23 (3Н, м), 3,33-3,40 (2Н, м), 3,72-3,80 (2Н, м), 3,82 (3Н, с), 7,09 (1Н, д, J=8,4 Гц), 7,27 (1Н, дд, J=8,4; 2,0 Гц), 7,44 (1Н, д, J=2,0 Гц), 8,28 (1H, д, J=8,4 Гц), 8,47 (1H, дд, J=8,4; 0,8 Гц), 9,23-9,28 (1H, м), 9,85 (1H, уш.).
Пример 5
1-(4-Аминопиперидино)-4-(3-хлор-4-метоксибензил)амино-6-цианофталазин дигидрохлорид

10,0 г 1-хлор-4-(3-хлор-4-метоксибензил)амино-6-цианофталазина растворяют в 50 мл 1-метил-2-пирролидинона, затем добавляют 43,32 г 4-гидроксипиперидина и 10 мл диизопропилэтиламина и смесь нагревают до 170°С и выдерживают при этой температуре в течение 8 час. После охлаждения добавляют этилацетат и смесь промывают 3 раза водой и один раз рассолом. После сушки над безводным сульфатом магния растворитель выпаривают. Полученный остаток очищают колоночной хроматографией (наполнитель: силикагель), получая 10,1 г 1-(4-гидроксипиперидино)-4-(3-хлор-4-метоксибензил)амино-6-цианофталазин в виде желтых кристаллов.
Затем 30 мл раствора 3,48 г диэтилазодикарбоксилата в тетрагидрофуране добавляют в течение 30 минут к 100 мл раствора 4,2 г 1-(4-гидроксипиперидино)-4-(3-хлор-4-метоксибензил)амино-6-цианофталазина, 2,94 г фталимида и 5,24 г трифенилфосфина в тетрагидрофуране при охлаждении льдом и после этого смесь перемешивают при 4°С в течение 24 часов. Реакционный раствор упаривают, добавляют воду и этилацетат и затем нерастворимые вещества удаляют фильтрованием. Органический слой концентрируют, полученный остаток очищают колоночной хроматографией (наполнитель: силикагель), получая 4,85 г 4-(3-хлор-4-метоксибензил)амино-6-циано-1-(4-фталимидопиперидино)фталазина.
Смесь 4,85 г полученного 4-(3-хлор-4-метоксибензил)амино-6-циано-1-(4-фталимидопиперидино)фталазина, 4 мл гидразинмоногидрата и 40 мл этанола нагревают с обратным холодильником в течение 1 часа. Реакционный раствор упаривают, остаток растворяют в этилацетате, добавляют 1 N соляную кислоту для доведения значения рН до 3 и нерастворимые вещества удаляют фильтрованием. рН водного слоя в фильтрате доводят до 11 с помощью 1 N гидроксида натрия и затем экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над безводным сульфатом натрия, упаривают и после этого очищают колоночной хроматографией (наполнитель: силикагель). Полученный продукт суспендируют в смеси этанол/вода, затем добавляют IN водную соляную кислоту и растворяют при нагревании. После охлаждения полученные кристаллы выделяют фильтрованием, получая 440 мг целевого соединения в виде желтого порошка.
MASS (FAB): 423 (МН+).
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,78-1,92 (2Н, м), 2,03-2,11 (2Н, м), 2,90-3,0 (2Н, м), 3,20-3,34 (1Н, м), 3,54-3,63 (2Н, м), 3,82 (3Н, с), 4,70 (2Н, д, J=5,6 Гц), 7,13 (1Н, д, J=8,4 Гц), 7, 47 (1Н, дд, J=8,4; 2,0 Гц), 7,62 (1Н, д, J=2,0 Гц), 8,17 (1H, д, J=8,4 Гц), 8,35-8,45 (2Н, м), 8,47 (1H, дд, J=8,4; 1,0 Гц), 9,54 (1H, д, J=1,0 Гц), 10,63 (1H, уш.).
Пример 6
4-(3-Хлор-4-метоксибензил)амино-6-циано-1-[4-гидрокси-4-(гидроксиметил)пиперидино]фталазин гидрохлорид

7,9 г 60% гидрида натрия промывают гексаном, затем сушат при пониженном давлении. К полученному раствору добавляют 100 мл диметилсульфоксида и перемешивают при температуре в интервале от 80 до 100°С в течение 30 минут в атмосфере азота. Смесь охлаждают льдом и добавляют 180 мл тетрагидрофурана. К полученному раствору по каплям добавляют 150 мл раствора 4,37 г триметилсульфониййодида в диметилсульфоксиде. После этого смесь перемешивают в течение 30 минут при охлаждении льдом, добавляют 15 г 1-бензил-4-пиперидона, перемешивают в течение 30 минут при охлаждении льдом и затем перемешивают при комнатной температуре в течение 6 часов. В реакционный раствор добавляют воду, затем экстрагируют этилацетатом. Органический слой промывают рассолом и затем сушат над безводным сульфатом натрия, затем очищают хроматографией на силикагеле, получая 6,8 г 6-бензил-1-оксо-6-азаспиро[2.5]октана.
К 100 мл раствора 6,8 г этого 6-бензил-1-оксо-6-азаспиро[2.5]октана в тетрагидрофуране добавляют 100 мл воды и 10 мл перхлорной кислоты и смесь перемешивают при комнатной температуре в течение 7 часов. Смесь охлаждают льдом, добавляют водный раствор карбоната натрия для доведения значения рН до 7 и затем упаривают. К полученному остатку добавляют этилацетат и нерастворимые вещества удаляют фильтрованием. Фильтрат упаривают и затем очищают колоночной хроматографией (наполнитель: силикагель), получая 4 г 1-бензил-4-(гидроксиметил)-4-пиперидинола.
После этого 1,46 г 1-бензил-4-(гидроксиметил)-4-пиперидинола растворяют в 30 мл метанола, добавляют 10 мл уксусной кислоты и 10% Pd-C и затем гидрируют под давлением 4 атмосферы. Реакционный раствор фильтруют через целит, фильтрат упаривают и остаток растворяют в метаноле. Добавляют раствор 4 N соляная кислота/этилацет и затем смесь концентрируют. Полученные кристаллы перекристаллизовывают из смеси метанол/этилацетат, выделяют фильтрованием, получая 880 мг 4-(гидроксиметил)-4-пиперидинола гидрохлорида.
Полученный 4-(гидроксиметил)-4-пиперидинола гидрохлорид подвергают взаимодействию с 1-хлор-4-(3-хлор-4-метоксибензил)амино-6-цианофталазином по методике Примера 4, получая целевое соединение.
MASS (FAB): 454,2 (МН+).
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,46-1,54 (2Н, m), 1,82-1,94 (2Н, m), 3,16-3,30 (6Н, м), 3,84 (3Н, с), 4,68-4,72 (2Н, m), 7,15 (1Н, д, J=8,6 Гц), 7,44 (1H, дд, J=8,6; 2,0 Гц), 7,59 (1H, д, J=2,0 Гц), 8,22 (1H, д, J=8,6 Гц), 8,45 (1H, дд, J=8,6; 1,0 Гц), 9,36 (1H, д, J=1,0 Гц).
Пример 7
4-(3-Хлор-4-метоксибензил)амино-6-циано-1-[(2S)-2-(метоксиметил)пирролидино]фталазин гидрохлорид

Целевое соединение получают по методике Примера получения 1, используя (S)-2-метоксиметилпирролидина вместо (R)-(-)-3-гидроксипиперидин гидрохлорида.
MASS (ESI): 438,1 (МН+).
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,81-1,89 (2Н, m), 1,95-2,03 (1H, m), 2,15-2,24 (1H, м), 3,16 (3Н, с), 3,28-3,37(1H, м), 3, 46-3,58 (2Н, м), 3,84 (3Н, с), 3,87-3,98 (1H, м), 4,44-4,57 (1Н, м), 4,62-4,78 (2Н, м), 7,15 (1Н, д, J=8,6 Гц), 7,47 (1H, дд, J=8,6; 0,4 Гц), 7,61 (1H, д, J=0,4 Гц), 8,41-8,51 (2Н, м), 9,42-9,60 (1H, м), 10,50 (1H, уш.), 13,79 (1H, уш.).
Пример 8
4-(3-Хлор-4-метоксибензил)амино-6-циано-1-фенилфталазин гидрохлорид

Целевое соединение получают по методике Примера получения 10 с тем отличием, что фенилборную кислоту используют вместо метоксифенилборной кислоты.
MASS (ESI): 401,1 (МН+).
1H-ЯМР (400 МГц, DMSO-d6) δ: 3,84 (3Н, с), 4,81-4,85 (2Н, м), 7,15 (1H, д, J=8,6 Гц), 7,48 (1H, дд, J=8,6; 2,1 Гц), 7,60-7,66 (6Н, м), 8,00 (1H, д, J=8,6 Гц), 8,41 (1H, дд, J=8,6; 0,9 Гц), 9,42 (1H, д, J=0,9 Гц).
Пример 9
4-[(3-Хлор-4-метоксибензил)амино]-1-(2-гидрокси-7-азаспиро[3.5]нон-7-ил)-6-фталазинкарбонитрил гидрохлорид

47,2 г метилтолуолфенилфосфонийбромида и 21,9 г трет-бутил-4-оксо-1-пиперидинкарбоксилата добавляют в смесь 14,8 г трет-бутилата калия и 300 мл тетрагидрофурана и перемешивают 40 минут при комнатной температуре. Реакционный раствор упаривают, добавляют диэтиловый эфир и затем фильтруют через целит. Фильтрат промывают водой и рассолом, сушат над безводным сульфатом магния и затем фильтруют. Фильтрат упаривают и полученный остаток подвергают колоночной хроматографии (силикагель), получая 20,8 г трет-бутил-4-метилен-1-пиперидинкарбоксилата.
49,3 г трет-бутил-4-метилен-1-пиперидинкарбоксилата добавляют в смесь 157,2 г сплава цинка с медью и 500 мл диэтилового эфира и по каплям в течение 5,5 часа добавляют 900 мл раствора 181,8 г трихлорацетилхлорида в диметоксиэтане. После перемешивания в течение 30 минут реакционный раствор охлаждают и добавляют насыщенный водный раствор бикарбоната натрия при 0°С или ниже. Смесь фильтруют через целит и упаривают. Полученный остаток экстрагируют этилацетатом. Экстракт промывают рассолом, сушат над безводным сульфатом магния и фильтруют. Фильтрат упаривают и полученный остаток подвергают колоночной хроматографии (силикагель), получая 62,5 г трет-бутил-1,1-дихлор-2-оксо-7-азаспиро[3.5]нонан-7-карбоксилата.
106,1 г цинка в виде порошка добавляют в смесь 62,5 г трет-бутил-1,1-дихлор-2-оксо-7-азаспиро[3.5]нонан-7-карбоксилата и 500 мл насыщенного раствора хлорида аммония в метаноле. Смесь перемешивают в течение 1 часа 20 минут при комнатной температуре и фильтруют через целит. Фильтрат упаривают, добавляют смесь 1 N соляная кислота/этилацетат и органический слой отделяют. Экстракт промывают водой, насыщенным раствором бикарбоната натрия и рассолом, сушат над безводным сульфатом магния и фильтруют. Фильтрат упаривают и полученный остаток подвергают колоночной хроматографии на силикагеле, получая 38,9 г трет-бутил-2-оксо-7-азаспиро-[3.5]нонан-7-карбоксилата.
300 мл этанола охлаждают на льду и растворяют в нем 6,13 г борогидрида натрия. К полученному раствору по каплям в течение 25 минут добавляют 100 мл раствора 38,9 г трет-бутил-2-оксо-7-азаспиро[3.5]нонан-7-карбоксилата в этаноле. Реакционный раствор обрабатывают насыщенным водным раствором хлорида аммония и упаривают. Полученный остаток распределяют между этилацетатом и водой, этилацетатный слой промывают рассолом и сушат над сульфатом магния. После фильтрования растворитель выпаривают и полученный остаток очищают колоночной хроматографией (наполнитель: силикагель, гексан/этилацетат), получая 36,6 г трет-бутил-2-гидрокси-7-азаспиро[3.5]нонан-7-карбоксилата.
1 H-ЯМР (400 МГц, СDСl3) δ: 1,45 (9Н, с), 1,43-1,57 (4Н, m), 1,65-1,72 (2Н, м), 3,27-3,35 (4Н, м), 4,32 (1Н, квинт, J=7,2 Гц).
6,22 г трет-бутил-2-гидрокси-7-азаспиро[3.5]нонан-7-карбоксилата растворяют в 20 мл тетрагидрофурана, к полученному раствору добавляют 80 мл раствора 4 N хлористый водород/диоксан и затем перемешивают при комнатной температуре в течение 1 часа. Реакционный раствор упаривают и полученный остаток растворяют в 20 мл 1-метил-2-пирролидинона, добавляют 4,67 г 1-хлор-4-[(3-хлор-4-метоксибензил)амино]-6-фталазинкарбонитрила и 6,72 г диизопропилэтиламина и затем перемешивают при 160°С в течение 9 часов. Реакционный раствор охлаждают до комнатной температуры, распределяют между этилацетатом и водой и водный слой экстрагируют этилацетатом. Этилацетатные слои объединяют, последовательно промывают водой (5 раз) и рассолом и сушат над сульфатом магния. После фильтрования растворитель выпаривают, полученный остаток очищают колоночной хроматографией (наполнитель: силикагель; этилацетат/метанол) и полученные неочищенные кристаллы измельчают и промывают диэтиловым эфиром, получая 4,86 г желтых кристаллов. Полученный продукт растворяют в 150 мл этанола, добавляют 15 мл раствора 4 N хлористый водород/диоксан и растворитель выпаривают. Полученный остаток растворяют в 150 мл этанола, нагревают до 80°С и вносят в качестве затравки кристаллы, синтезированные отдельно в водном этаноле, и когда кристаллизация инициируется, нагревание прекращают. Раствор оставляют для охлаждения до комнатной температуры и после выделения фильтрованием и промывки этанолом получают 35 г целевого соединения.
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,58-1,66 (2Н, м), 1,68-1,76 (4Н, м), 2,14-2,22 (2Н, м), 3,05-3,16 (4Н, т), 3,83 (3Н, с), 4,12 (1Н, т, J=7,2 Гц), 4,72 (2Н, d, J=5,6 Гц), 7,14 (1Н, d, J=8,8 Гц), 7,45 (1Н, дд, J=8,8; 2,0 Гц), 7,60 (1Н, д, J=2,0 Гц), 8,20 (1H, д, J=8,4 Гц), 8,44 (1Н, дд, J=8,4; 1,2 Гц), 9,46 (1H, с).
Пример 10
4-[(3-Хлор-4-метоксибензил)амино]-1-(4-пиридил)-6-фталазинкарбонитрил

Целевое соединение получают по методике Примера 1.
1H-ЯМР (400 МГц, DMSO-d6) δ: 3,80 (3Н, с), 4,76 (2Н, d, J=5,5 Гц), 7,10 (1H, д, J=8,8 Гц), 7,38 (1H, dd, J=8,8; 2,4 Гц), 7,50 (1H, д, J=2,4 Гц), 7,64 (2Н, д, J=5,6 Гц), 7,94 (1H, д, J=8,8 Гц), 8,20 (1H, д, J=8,8 Гц), 8,52 (1H, dd, J=5,5; 5,5 Гц), 8,73 (2Н, д, J=5,6 Гц), 9,02 (1H, с).
Пример 11
4-[(3-Хлор-4-метоксибензил)амино]-1-(3-оксо-2-окса-8-азаспиро[4.5]дец-8-ил)-6-фталазинкарбонитрил

567 мл раствора 37,8 г трет-бутил-2-оксо-7-азаспиро[3.5]нонан-7-карбоксилата в метаноле охлаждают ледяной водой и по каплям добавляют 43 г 30% водного раствора перокида водорода. В полученный раствор по каплям добавляют 63 мл 1 N водного раствора гидроксида натрия и смесь перемешивают при комнатной температуре в течение 2 часов. Добавляют 1000 мл этилацетата, 600 мл воды и 100 мл насыщенного водного раствора тиосульфата натрия пентагидрата и органический слой отделяют. Экстрагированный раствор промывают рассолом, сушат над безводным сульфатом магния и затем фильтруют. Фильтрат упаривают, получая 28,4 г трет-бутил-3-оксо-2-окса-8-азаспиро[4.5]декан-8-карбоксилата.
1,16 г трет-бутил-3-оксо-2-окса-8-азаспиро[4.5]декан-8-карбоксилата растворяют в 2,3 мл метанола, добавляют 4,6 мл раствора 4 N соляная кислота/этилацетат и смесь перемешивают при комнатной температуре в течение 1 часа. Добавляют 5 мл этилацетата и образовавшиеся кристаллы выделяют фильтрованием, получая 700 мг 3-оксо-2-окса-8-азаспиро[4.5]декана гидрохлорида.
Смесь 657 мг 1-хлор-4-[(3-хлор-4-метоксибензил)амино]-6-фталазинкарбонитрила, 700 мг 3-оксо-2-окса-8-азаспиро[4,5]декана гидрохлорида, 0,44 мл диэтиланилина, 137 мг йодида натрия и 1,7 мл 1-метил-2-пирролидинона перемешивают при 130°С в течение 15 часов 40 минут. После охлаждения реакционный раствор разбавляют 40 мл тетрагидрофурана, 100 мл этилацетата и 15 мл 1-метил-2-пирролидинона и затем промывают насыщенным водным раствором бикарбоната натрия и рассолом. Смесь сушат над безводным сульфатом магния и затем фильтруют. Фильтрат упаривают и полученный остаток очищают колоночной хроматографией (силикагель), получая 713 мг 4-[(3-хлор-4-метоксибензил)амино]-1-(3-оксо-2-окса-8-азаспиро[4,5]дец-8-ил)-6-фталазинкарбонитрила.
1H-ЯМР (400 МГц, CDCl3) δ: 1,88-2,01 (4Н, т), 2,53 (2Н, с), 3,22-3,40 (4Н, м), 3,90 (3Н, с), 4,20 (2Н, с), 4,77 (2Н, д, J=5,2 Гц), 5,20 (1Н, т, J=5,2 Гц), 6,92 (1Н, д, J=8,4 Гц), 7,32 (1Н, дд, J=8,4; 2,0 Гц), 7,46 (1Н, д, J=2,0 Гц), 7,96 (1H, дд, J=8,4; 2,0 Гц), 8,11 (1H, д, J=8,4 Гц), 8,14 (1Н, д, J=0,8 Гц).
Пример 12
4-[(3-Хлор-4-метоксибензил)амино]-1-(2-оксо-7-азаспиро[3.5]нон-7-ил)-6-фталазинкарбонитрил
500 мг 4-[(3-хлор-4-метоксибензил)амино]-1-(2-гидрокси-7-азаспиро[3.5]нон-7-ил)-6-фталазинкарбонитрила суспендируют в 20 мл дихлорметана и 10 мл тетрагидрофурана, затем добавляют 690 мг 1, 1,1-триацетокси-1,1-дигидро-1,2-дибензйодоксазол-3-(1Н)-она и смесь перемешивают при комнатной температуре в течение 15 минут. Добавляют этилацетат, 30 мл насыщенного водного раствора бикарбоната натрия и 2 мл насыщенного водного раствора тиосульфата натрия (·5Н2О). Органический слой отделяют и водный слой экстрагируют этилацетатом. Экстракты объединяют, промывают рассолом, сушат над безводным сульфатом магния и затем фильтруют. Фильтрат упаривают, полученный остаток очищают колоночной хроматографией (наполнитель: силикагель), кристаллизуют из этанола и образовавшиеся кристаллы выделяют фильтрованием при добавлении гексана, получая 420 мг 4-[(3-хлор-4-метоксибензил)амино]-1-(2-оксо-7-азаспиро[3.5]нон-7-ил)-6-фталазинкарбонитрила.
1 H-ЯМР (400 МГц, DMSO-d6) δ: 1,90 (4Н, м), 2,86 (4Н, м), 3,09 (4Н, с), 3,80 (3Н, с), 4,62 (2Н, д, J=5,6 Гц), 7,07 (1Н, д, J=8,5 Гц), 7,33 (1H, д, J=8,8 Гц), 7,44 (1Н, с), 7,89 (1H, т, J=5,6 Гц), 8,09 (1H, д, J=8,0 Гц), 8,19 (1H, d, J=8,0 Гц), 8,88 (1H, с).
Пример 13
4-[(3-Хлор-4-метоксибензил)амино]-1-[4-гидрокси-4-(1H-1-имидазолилметил)пиперидино]-6-фталазинкарбонитрил дигидрохлорид
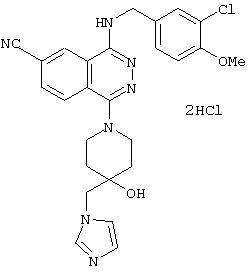
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,49 (2Н, д, J=12,4 Гц), 1,82-1,93 (2Н, м), 3,13 (2Н, т, J=10,8 Гц), 3,37 (2Н, д, J=12, 4 Гц), 3,82 (3Н, с), 4,30 (2Н, с), 4,74 (2Н, д, J=5, 6 Гц), 7,13 (1Н, д, J=8,8 Гц), 7,48 (1H, dd, J=2,0; 8,4 Гц), 7,63 (1H, д, J=2,0 Гц), 7,66-7,71 (2Н, м), 8,18 (1H, д, J=8,4 Гц), 8,48 (1H, д, J=8,4 Гц), 9,10 (1H, с), 9,60 (1H, с).
Пример 14
4-[(3-Хлор-4-метоксибензил)амино]-1-[4-гидрокси-4-(1Н-1,2,4-триазол-1-илметил)пиперидино]-6-фталазинкарбонитрил дигидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ : 1,54 (2Н, d, J=12,8 Гц), 1,82-1,92 (2Н, м), 3,15 (2Н, т, J=11,2 Гц), 3,35 (2Н, д, J=12,8 Гц), 3,82 (3Н, с), 4,29 (2Н, с), 4,73 (2Н, д, J=6,0 Гц), 7,13 (1Н, д, J=8,4 Гц), 7,48 (1Н, дд, J=2,0; 8,4 Гц), 7,62 (1Н, д, J=2,0 Гц), 8,20 (1H, д, J=8,4 Гц), 8,21 (1Н, с), 8,45 (1H, дд, J=1,2; 8,4 Гц), 8,79 (1H, с), 9,56 (1H, с), 10,75 (1H, уш.-с).
Пример 15
1-[4-[(3-Хлор-4-метоксибензил)амино]-6-(1H-1,2,3,4-тетразол-5-ил)-1-фталазинил]-4-пиперидинол
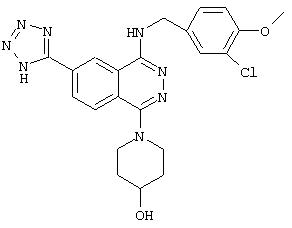
0,55 г азида натрия добавляют в смесь 1,0 г 4-[(3-хлор-4-метоксибензил)амино]-1-(4-гидроксипиперидино)-6-фталазинкарбонитрила, 1,2 г триэтиламина гидрохлорида и 20 мл 1-метил-2-пирролидинона, перемешивают при 100°С в течение 8 часов. Реакционному раствору дают охладиться до комнатной температуры, добавляют воду и образующиеся кристаллы выделяют фильтрованием, получая 1,0 г целевого соединения.
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,58-1,7 (2Н, m), 1,8-1,97 (2Н, m), 2,8-2,98 (2Н, м), 3,3-3,43 (2Н, m), 3,6-3,7 (1H, м), 3,79 (3Н, с), 4,6 (2Н, с), 7,06 (1H, д, J=8 Гц), 7,34 (1H, д, J=8 Гц), 7,45 (1H, с), 7,95 (1Н, d, J=8 Гц), 8,45 (1H, д, J=8 Гц), 8,89 (1H, с).
Пример 16
1-[4-[(3-Хлор-4-метоксибензил)амино]-6-(1-метил-1Н-1,2,3,4-тетразол-5-ил)-1-фталазинил]-4-пиперидинол
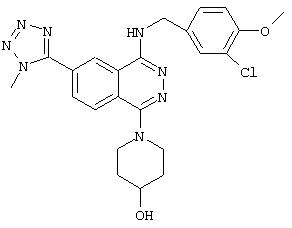
0,037 мл метилйодида добавляют в смесь 0,25 г 1-[4-[(3-хлор-4-метоксибензил)амино]-6-(1Н-1,2,3,4-тетразол-5-ил)-1-фталазинил]-4-пиперидинола, 1,2 г карбоната калия и 5 мл диметилформамида и перемешивают при комнатной температуре в течение 3 часов. К реакционному раствору добавляют воду и осажденные нерастворимые вещества выделяют фильтрованием, затем очищают колоночной хроматографией (наполнитель: силикагель), получая 50 мг целевого соединения.
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,6-1,7 (2Н, m), 1,85-1,95 (2Н, m), 2, 85-2,95 (2Н, м), 3,25-3,45 (2Н, m), 3,6-3,7 (1H, m), 3,80 (3Н, с), 4,48 (3Н, с), 4,61 (2Н, д, J=8,6 Гц), 4,73 (1H, д, J=4,0 Гц), 7,07 (1H, д, J=8,4 Гц), 7,34 (1H, dd, J=2,0; 8,4 Гц), 7,44 (1H, д, J=2, 0 Гц), 8,07 (1H, т, J=5,6 Гц), 8,10 (1H, d, J=8,4 Гц), 8,47 (1H, д, J=8,8 Гц), 9,00 (1H, с).
Пример 17
4-[(3-Хлор-4-метоксибензил)амино]-1-(4-гидроксипиперидино)-6-фталазинкарботиамид

3,7 мл диэтилдитиофосфата добавляют к смеси 2,0 г 4-[(3-хлор-4-метоксибензил)амино]-1-(гидроксипиперидино)-6-фталазинкарбонитрила, 1 мл воды и 2 мл изопропанола и смесь нагревают с обратным холодильником в течение 1 часа. После охлаждения в реакционный раствор добавляют воду и образующиеся кристаллы выделяют фильтрованием. Фильтрат экстрагируют этилацетатом и промывают рассолом, сушат над безводным сульфатом натрия и фильтруют. Фильтрат упаривают и полученный кристаллический остаток объединяют с кристаллами, полученными ранее при фильтровании, в результате получая 1,5 г целевого соединения.
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,6-1,7 (2Н, m), 1,85-2,00 (2Н, м), 2,90-3,1 (2Н, м), 3,3-3,5 (2Н, m), 3,6-3,8 (1Н, m), 3,81 (3Н, с), 4, 68 (2Н, д, J=4 Гц), 7,13 (1Н, д, J=8 Гц), 7,40 (1H, д, J=8 Гц), 7,54 (1Н, с), 8,08 (1H, д, J=8 Гц), 8,3-8,4 (1Н, м), 8,9-9,1 (1H, м), 9,88 (1H, с), 10,33 (1H, с).
Пример 18
1-[4-[(3-Хлор-4-метоксибензил)амино]-6-(4-метил-1,3-тиазол-2-ил)-1-фталазинил]-4-пиперидинол
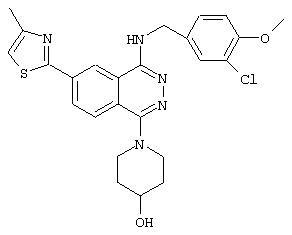
1,5 г 4-[(3-хлор-4-метоксибензил)амино]-1-(4-гидроксипиперидино)-6-фталазинкарбодиамида растворяют в 50 мл диметилформамида, добавляют 1,1 мл хлорацетона и смесь перемешивают при 100°С в течение 4 часов. После охлаждения в реакционный раствор добавляют воду и водный слой удаляют декантацией. Остаток сушат при пониженном давлении и затем очищают хроматографией на силикагеле, получая 200 мг целевого соединения.
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,6-1,7 (2Н, m), 1,85-1,95 (2Н, м), 2,47 (3Н, с), 2, 83-2,94 (2Н, м), 3,3-3,4 (2Н, м), 3,6-3,7 (1Н, м), 3,80 (3Н, с), 4,63 (2Н, д, J=5,6 Гц), 4,72 (1Н, д, J=4,0 Гц), 7,07 (1H, д, J=8,4 Гц), 7,34 (1Н, дд, J=2,0; 8,4 Гц), 7,44 (1H, д, J=2,0 Гц), 7,48 (1H, с), 7,96-8,04 (1H, м), 8,01 (1H, д, J=8,4 Гц), 8,36 (1H, дд, J=1,6; 8,4 Гц), 8,76 (1H, д, J=1,6 Гц).
Пример 19
1-[4-[(3-Хлор-4-метоксибензил)амино]-6-(2-тиенил)-1-фталазинил]-4-пиперидинол гидрохлорид
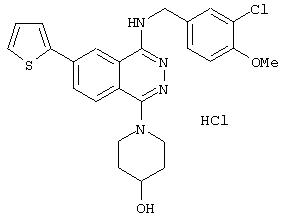
24 мг тетракис(трифенилфосфин)палладия(0) и 1,4 мл 2-(трибутилстаннил)тиофена добавляют к смеси 200 мг 1-[6-бром-4-[(3-бром-4-метоксибензил)амино]-1-фталазинил]-4-пиперидинола и 2 мл толуола. Смесь нагревают с обратным холодильником в течение 2 часов. После охлаждения реакционный раствор выливают в ледяную воду и экстрагируют этилацетатом. Экстрагированный раствор сушат над безводным сульфатом магния и затем фильтруют. Фильтрат упаривают и остаток очищают хроматографией на силикагеле. Полученный продукт превращают раствором 4 N соляная кислота/этилацетат в гидрохлорид, получая 73 мг целевого соединения.
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,67 (2Н, м), 1,92 (2Н, м), 3,00 (2Н, м), 3,45 (2Н, м), 3,74 (1Н, м), 3,82 (3Н, с), 4,73 (2Н, м), 7,13 (1Н, д, J=7,2 Гц), 7,27 (1Н, с), 7,46 (1Н, д, J=7,2 Гц), 7,61 (1Н, с), 7,79 (1Н, д, J=5,6 Гц), 8,03 (1Н, д, J=5,6 Гц), 8,09 (1Н, д, J=8,8 Гц), 8,34 (1Н, d, J=8,8 Гц), 9,20 (1Н, уш.-с).
Пример 20
4-[(3-Хлор-4-метоксибензил)амино]-1-(4-гидроксипиперидино)-6-фталазинкарбальдегидоксим гидрохлорид

10,0 г 4-[(3-хлор-4-метоксибензил)амино]-1-(4-гидроксипиперидино)-6-фталазинкарбонитрила и 5,3 г трет-бутилдиметилхлорсилана растворяют в 80 мл диметилформамида и добавляют 4,8 г имидазола, смесь перемешивают при комнатной температуре в течение ночи. В реакционный раствор добавляют этилацетат, затем поученную смесь промывают один раз водой и дважды рассолом. Смесь сушат над безводным сульфатом магния и фильтруют. Фильтрат упаривают, получая 11,7 г 1-[4-[[1-(трет-бутил)-1, 1-диметилсилил]окси]пиперидино]-4-[(3-хлор-4-метоксибензил)амино]-6-фталазинкарбонитрила.
11,7 г 1-[4-[[1-(трет-бутил)-1, 1-диметилсилил]окси]пиперидино]-4-[(3-хлор-4-метоксибензил)амино]-6-фталазинкарбонитрила растворяют в 150 мл метиленхлорида и охлаждают. 44 мл раствора 1 М гидрированного диизобутилалюминия в толуоле добавляют при -78°С. После нагрева до комнатной температуры смесь перемешивают в течение ночи. Добавляют 100 мл насыщенного водного раствора хлорида аммония и смесь перемешивают при комнатной температуре в течение 0,5 часа. После добавления 40 мл 10% серной кислоты смесь экстрагируют этил-ацетатом. Экстрагированный раствор промывают рассолом, сушат над безводным сульфатом магния и затем фильтруют. Фильтрат упаривают и остаток очищают колоночной хроматографией (наполнитель: силикагель), получая 5,3 г 1-[4-[[(1-(трет-бутил)-1, 1-диметилсилил]окси]пиперидино]-4-[(3-хлор-4-метокси-бензил)амино]-6-фталазинкарбальдегида.
1,5 г 1-[4-[[(1-(трет-бутил)-1,1-диметилсилил]окси]пиперидино] -4-[(3-хлор-4-метоксибензил)амино]-6-фталазинкарбальдегида и 0,35 г гидроксиламина гидрохлорида растворяют в 50 мл метанола и смесь нагревают с обратным холодильником в течение 2 часов. После охлаждения добавляют воду, затем смесь экстрагируют этилацетатом. Экстрагированный раствор промывают рассолом, сушат над безводным сульфатом магния и затем фильтруют. Фильтрат упаривают и остаток очищают колоночной хроматографией (наполнитель: силикагель), получая 1,18 г 1-[4-[[(1-(трет-бутил)-1,1-диметилсилил]окси]пиперидино]-4-[(3-хлор-4-метоксибензил)амино]-6-фталазинкарбальдегидоксима.
1 М раствор фторида тетрабутиламмония в тетрагидрофуране добавляют к 30 мл раствора 1,18 г 1-[4-[[(1-(трет-бутил)-1, 1-диметилсилил]окси]пиперидино]-4-[(3-хлор-4-метоксибензил)амино]-6-фталазинкарбальдегидоксима в тетрагидрофуране. Смесь перемешивают при комнатной температуре в течение ночи. В реакционный раствор добавляют воду и смесь затем экстрагируют этилацетатом. Экстрагированный раствор промывают рассолом, сушат над безводным сульфатом магния и затем фильтруют. Фильтрат упаривают и полученный кристаллический остаток промывают этилацетатом и выделяют фильтрованием, получая 0,34 г целевого соединения. Этот продукт превращают обычным способом в гидрохлорид.
1 H-ЯМР (400 МГц, DMSO-d6) δ: 1,58-1,70 (2Н, m), 1,86-1,95 (2Н, m), 2,92-3,02 (2Н, м), 3,08-3,22 (2Н, м), 3,64-3,73 (1Н, м), 3,82 (3Н, с), 4,61-4,68 (2Н, м), 4,77-4,79 (1Н, м), 7,10 (1Н, д, J=8 Гц), 7,38 (1Н, д, J=8 Гц), 7,51 (1Н, c), 8,06 (1Н, д, J=8 Гц), 8,23 (1Н, д, J=8 Гц), 8,28 (1Н, с), 8,69-8,76 (1Н, м).
Пример 21
4-[(3-Хлор-4-метоксибензил)амино]-1-[(2R)-2-(гидроксиметил)-1-окса-8-азаспиро[4.5]дека-8-ил]-6-фталазинкарбонитрил гидрохлорид

1,08 г 1-хлор-4-[(3-хлор-4-метоксибензил)амино]-6-фталазинкарбонитрила и 0,76 г (2R)-1-окса-8-азаспиро[4.5]дека-2-илметанола растворяют в 20 мл N-метил-2-пирролидона и перемешивают при 160°С в течение 5 часов. После завершения реакции реакционный раствор охлаждают до комнатной температуры, добавляют воду и насыщенный водный раствор бикарбоната натрия, экстрагируют этилацетатом и промывают рассолом три раза. Затем раствор сушат над сульфатом магния, растворитель удаляют и остаток очищают колоночной хроматографией (наполнитель: силикагель), получая 0,60 г кристаллического соединения.
Полученное соединение растворяют в 20 мл этанола, добавляют 1,40 мл раствор 1 N соляная кислота/этанол при комнатной температуре и смесь перемешивают 10 минут. После удаления растворителя остаток обрабатывают диизопропиловым эфиром и затем сушат, получая 555 мг целевого соединения.
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,67-1,98 (8Н, м), 3,15-3,40 (6Н, м), 3,82 (3Н, с), 3,90-3,98 (1Н, м), 4,68-4,77 (2Н, т), 7,14 (1Н, д, J=9 Гц), 7,46 (1Н, дд, J=2,9 Гц), 7,62 (1Н, д, J=2 Гц), 8,23 (1H, д, J=9 Гц), 8,45 (1Н, д, J=9 Гц), 9,50 (1H, с).
Пример 22
(анти)-4-[(3-Хлор-4-метоксибензил)амино]-1-(7-гидрокси-3-окса-9-азабицикло[3.3.1]нон-9-ил)-6-фталазинкарбонитрил гидрохлорид
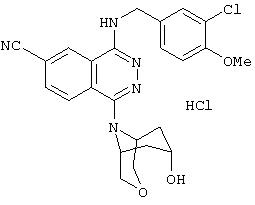
1,5 г 1-хлор-4-[(3-хлор-4-метоксибензил)амино]-6-фталазинкарбонитрила, 1,13 г (анти)-3-окса-9-азабицикло[3.3.1]нонан-7-ол гидрохлорида и 2,16 мл диизопропилэтиламина добавляют к 8 мл 1 М метил-2-пирролидона и смесь перемешивают при 170°С в течение 9 часов 15 минут. В реакционный раствор добавляют воду, смесь экстрагируют этилацетатом и органический слой промывают водой и рассолом. После сушки смеси над безводным сульфатом магния растворитель выпаривают. Остаток очищают колоночной хроматографией (наполнитель: силикагель; растворитель: дихлорметан/метанол), получая 0,085 г желтого масла.
Полученное масло растворяют в этилацетате, затем добавляют 0,05 мл раствора 4 N хлористый водород/этилацетат и смесь перемешивают при комнатной температуре. Образовавшийся осадок выделяют фильтрованием, получая 0,075 г целевого соединения.
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,69-1,78 (2Н, m), 2,46-2,56 (2Н, м), 3,77-3,84 (2Н, м), 3,86 (3Н, с), 3,86-3,95 (3Н, m), 4,04-4,12 (2Н, м), 4,74 (2Н, с), 7,17 (1Н, д, J=8,4 Гц), 7,46 (1Н, дд, J=2,2; 8,4 Гц), 7,61 (1Н, d, J=2,2 Гц), 8,13 (1Н, д, J=8,4 Гц), 8,45 (1H, д, J=8,4 Гц), 9,39 (1Н, м).
Пример 23
(анти)-4-[(3-Хлор-4-метоксибензил)амино]-1-(9-гидрокси-3-азабицикло[3.3.1]нон-3-ил)-6-фталазинкарбонитрил гидрохлорид

1,5 г 1-хлор-4-[(3-хлор-4-метоксибензил)амино]-6-фталазинкарбонитрила, 1,12 г (анти)-3-азабицикло[3,3.1]нонан-9-ола гидрохлорида и 2,18 мл диизопропилэтиламина добавляют к 8 мл N-метил-2-пирролидона и смесь перемешивают при 170°С в течение 9 часов. В реакционный раствор добавляют воду, раствор затем экстрагируют этилацетатом, органический слой промывают водой и рассолом, сушат над безводным сульфатом магния и затем растворитель выпаривают. Добавляют дихлорметан и нерастворимые вещества выделяют фильтрованием, получая 1,23 г бледно-желтого порошка. Полученный порошок суспендируют в этилацетате, добавляют 0,7 мл раствора 4 N хлористый водород/этилацетат и смесь перемешивают при комнатной температуре. Образовавшийся осадок выделяют фильтрованием, получая 1,28 г целевого соединения в виде слабо окрашенного порошка.
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,54 (1H, м), 1, 66-1,75 (2Н, т), 1,86-1,93 (2Н, м), 2,11-2,23 (2Н, т), 2,38 (1H, м), 3,15-3,24 (2Н, м), 3,62-3,70 (2Н, м), 3,75 (1H, м), 3,85 (3Н, с), 4,74 (2Н, с), 7,16 (1H, д, J=8,4 Гц), 7,47 (1H, дд, J=1,8; 8,4 Гц), 7,62 (1H, д, J=1,8 Гц), 8,23 (1H, d, J=8,4 Гц), 8,56 (1Н, дд, J=1,3; 8,4 Гц), 9,49 (1Н, м).
Пример 24
(анти)-4-[(3-Хлор-4-метоксибензил)амино]-1-[9-(2-гидроксиэтил)-3-азабицикло[3.3.1]нон-3-ил]-6-фталазинкарбонитрил гидрохлорид

1,5 г 1-хлор-4-[(3-хлор-4-метоксибензил)амино]-6-фталазинкарбонитрила, 1,29 г (анти)-2-(3-азабицикло[3.3.1]нон-9-ил)-1-этанола гидрохлорида и 2,18 мл диизопропилэтиламина добавляют к 8 мл 1 М метил-2-пирролидона и смесь перемешивают при 170°С в течение 8 часов 40 минут. В реакционный раствор добавляют воду, раствор экстрагируют этилацетатом и органический слой промывают водой и рассолом. Реакционный раствор сушат над безводным сульфатом магния и затем растворитель выпаривают. Остаток очищают колоночной хроматографией (наполнитель: силикагель; растворитель: дихлорметан/метанол) и кристаллизуют из смеси дихлорметан/этилацетат/эфир, получая 1,12 г бледно-желтого порошка. Полученный порошок суспендируют в ацетоне, добавляют 2 мл раствора 4 N хлористый водород/этилацетат и этилацетат и смесь перемешивают при комнатной температуре. Полученный осадок выделяют фильтрованием, получая 0,98 г целевого соединения в виде бледно-желтого порошка.
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,61 (1H, м), 1,66-1,73 (2Н, m), 1,73-1,87 (5Н, м), 1,88-2,00 (2Н, м), 2,42 (1H, м), 3,14-3,23 (2Н, м), 3,49 (2Н, т, J=6,4 Гц), 3,67-3,76 (2Н, м), 3,85 (3Н, с), 4,73 (2Н, с), 7,16 (1H, д, J=8,6 Гц), 7,47 (1Н, дд, J=1,6; 8,6 Гц), 7,62 (1H, д, J=1,6 Гц), 8,24(1Н, д, J=8,4 Гц), 8,55 (1Н, дд, J=1,3; 8,4 Гц), 9,46 (1H, м).
Пример 25
1-(3-Амино-3-метил-1-бутинил)-4-[(3-хлор-4-метоксибензил)амино]-6-фталазинкарбонитрил гидрохлорид

0,39 мл триэтиламина добавляют к смеси 500 мг 1-хлор-4-[(3-хлор-4-метоксибензил)амино]-6-фталазинкарбонитрила, 53 мг йодида меди, 98 мг дихлорбис(трифенилфосфин)палладия (II), 347 мг 3-амино-3-метил-1-бутина и 10 мл диметилформамида и смесь перемешивают при 80°С в течение 3 часов в атмосфере азота. После охлаждения в реакционный раствор добавляют этилацетат, затем воду и конц. водный раствор аммиака и органический слой отделяют. Органический слой промывают разбавленным водным раствором аммиака и рассолом и сушат над безводным сульфатом натрия. Смесь фильтруют и фильтрат упаривают. Полученный остаток очищают колоночной хроматографией с NH-образующим силикагелем, получая 446 мг целевого соединения. Продукт превращают в гидрохлорид обычным способом.
1H-ЯМР (400 МГц, DMSO-d6 ) δ: 1,75 (6Н, с), 3,82 (3Н, с), 4,76 (2Н, д, J=5,6 Гц), 7,10 (1Н, д, J=8,4 Гц), 7,37 (1Н, дд, J=8,4; 2,2 Гц), 7,50 (1Н, д, J=2,2 Гц), 8,31 (1H, дд, J=8,4; 1,4 Гц), 8,35 (1H, д, J=8,4 Гц), 8,83 (1H, т, J=5,6 Гц), 8,92-9,05 (3Н, м), 9,07 (1H, уш.).
Пример 26
4-[(3-Хлор-4-метоксибензил)амино]-1-[4-(метоксиимино)пиперидино]-6-фталазинкарбонитрил гидрохлорид

Смесь 1,19 г 4-[(3-хлор-4-метоксибензил)амино]-1-[4-оксопиперидино]-6-фталазинкарбонитрила, 354 мг метоксиамина гидрохлорида, 1,2 г карбоната натрия и 10 мл этанола нагревают с обратным холодильником в течение 2 часов. После охлаждения в реакционный раствор добавляют солевой раствор, затем экстрагируют этилацетатом, сушат над безводным сульфатом натрия и фильтруют. Фильтрат упаривают и полученный остаток очищают колоночной хроматографией (силикагель), получают 620 мг 4-[(3-хлор-4-метоксибензил)амино]-1-[4-(метоксиимино)пиперидино]-6-фталазинкарбонитрила. Этот продукт растворяют в смешанном растворителе, состоящем из метанола и этанола, и перекристаллизовывают с добавлением 0,35 мл раствора 4N соляная кислота/этилацетат, получая 388 мг 4-[(3-хлор-4-метоксибензил)амино]-1-[4-(метоксиимино)пиперидино]-6-фталазинкарбонитрила гидрохлорида.
1Н-ЯМР (400 МГц, DMSO-d6) δ: 2,50-2,55 (2Н, m), 2,74-2,80 (2Н, м), 3,29-3,35 (4Н, м), 3,77 (3Н, с), 3,85 (3Н, с), 4,72 (2Н, уш.), 7,16 (1Н, д, J=8,4 Гц), 7,45 (1Н, дд, J=8,4; 2,0 Гц), 7,60 (1Н, д, J=2,0 Гц), 8,33 (1H, d, J=8,8 Гц), 8,48 (1H, дд, J=8,8; 0,8 Гц), 9,35 (1Н, д, J=0,8 Гц), 10,19 (1Н, уш.).
Приведенные далее соединения получают с использованием соответствующих исходных продуктов способом, описанным в Примерах получения или Примерах.
Пример 27
4-[(3-Хлор-4-метилбензил)амино]-1-(4-гидроксипиперидино)-6-фталазинкарбонитрил гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,62-1,73 (2Н, m), 1,90-1,99 (2Н, m), 2,32 (3Н, с), 2, 98-3,08 (2Н, м), 3,42-3,50 (2Н, м), 3,72-3,80 (1Н, м), 4,76 (2Н, д, J=5, 6 Гц), 7,36 (2Н, с), 7,57 (1H, с), 8,23 (1Н, д, J=8,4 Гц), 8,47 (1H, дд, J=8,4; 1,2 Гц), 9,37 (1H, д, J=1,2 Гц), 10,21 (1H, уш.).
Пример 28
4-[(3-Хлор-4-метоксибензил)амино]-1-(5-гидроксипергидроцик-лопента[с]пиррол-2-ил)-6-фталазинкарбонитрил

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,40-1,49 (2Н, м), 2,02-2,12 (2Н, м), 2,55-2,64 (2Н, м), 3,24 (4Н, д, J=4,0 Гц), 3,80 (3Н, с), 3,94-4,04 (1H, м), 4,61 (2Н, д, J=5,2 Гц), 4,72 (1H, д, J=5,6 Гц), 7,07 (1H, д, J=8,4 Гц), 7,32 (1H, dd, J=2,0; 8,4 Гц), 7,77-7,83 (1H, м), 8,14-8,23 (2Н, м), 8,66 (1H, д, J=0,8 Гц).
Пример 29
4-[(3-Хлор-4-метоксибензил)амино]-1-[4-(2-гидроксиэтил)-1,2,3,6-тетрагидро-1-пиридинил]-6-фталазинкарбонитрил

1H-ЯМР (400 МГц, DMSO-d6) δ: 2,15-2,22 (2Н, м), 2,27-2,39 (2Н, m), 3,20 (2Н, т, J=5,6 Гц), 3,48-3,60 (2Н, м), 3,69 (2Н, с), 3,80 (3Н, с), 4,47 (1H, т, J=5,6 Гц), 4,61 (2Н, д, J=5,6 Гц), 5,55 (1H, д, J=0,4 Гц), 7,08 (1H, д, J=8,4 Гц), 7,33 (1H, дд, J=2,0; 8,4 Гц), 7,44 (1H, д, J=2,0 Гц), 7,83-7,89 (1H, м), 8,04 (1H, д, J=8,4 Гц), 8,08 (1H, дд, J=1,2; 8,4 Гц), 8,87 (1H, т, J=0,4 Гц).
Пример 30
4-[(3-Хлор-4-метоксибензил)амино]-1-[3-гидроксиметил)тетрагидро-1H-1-пирролил]-6-фталазинкарбонитрил

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,59-1,70 (1Н, м), 1,83-2,02 (2Н, м), 2,31-2,41 (1Н, м), 3,34-3,60 (5Н, м), 4,58 (2Н, J=5,6 Гц), 4,67 (1Н, т, J=5,6 Гц), 7,07 (1H, д, J=8,4 Гц), 7,32 (1H, дд, J=2,0; 8,4 Гц), 7,43 (1H, д, J=2,0 Гц), 7,56-7,62 (1H, м), 8,14 (1H, дд, J=1,6; 8,8 Гц), 8,23 (1H, д, J=8,8 Гц), 8,820 (1H, д, J=1,2 Гц).
Пример 31
4-[(3-Хлор-4-метоксибензил)амино]-1-[4-(гидроксиметил)-1,2,3,6-тетрагидро-1-пиридинил]-6-фталазинкарбонитрил

1H-ЯМР (400 МГц, DMSO-d6) δ: 2,28 (2Н, уш.-с), 3,19-3,26 (2Н, m), 3,73 (2Н, уш.-с), 3,80 (3Н, с), 3,89 (2Н, д, J=4,4 Гц), 4,62 (2Н, д, J=5,6 Гц), 4,78 (1H, т, J=5, 6 Гц), 5,72 (1H, уш.-с), 7,08 (1H, д, J=8,4 Гц), 7,33 (1H, дд, J=2,0; 8,4 Гц), 7,44 (1H, д, J=2,0 Гц), 7,87 (1H, т, J=5,6 Гц), 8,05 (1H, d, J=8,4 Гц), 8,18 (1H, дд, J=1,2; 8,4 Гц), 8,87 (1H, д, J=1,2 Гц).
Пример 32
2-[1-[4-[(3-Хлор-4-метоксибензил)амино]-6-циано-1-фталазинил]-4-пиперидинил]пропионовая кислота гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,08 (3Н, д, J=6,8 Гц), 1,46-1,64 (2Н, м), 1,66-1,83 (3Н, м), 2,22-2,32 (1Н, м), 2,78-2, 90 (2Н, м), 3,54-3,64 (2Н, м), 3,83 (3Н, с), 4,72 (2Н, д, J=6,0 Гц), 7,14 (1Н, д, J=8,4 Гц), 7,46 (1Н, дд, J=2,0; 8,4 Гц), 7,61 (1Н, д, J=2,0 Гц), 8,22 (1H, д, J=8,4 Гц), 8,45 (1Н, дд, J=1,6; 8,4 Гц), 9,49 (1H, с).
Пример 33
2-[1-[4-[(3-Хлор-4-метоксибензил)амино]-6-циано-1-фталазинил]-1,2,3,6-тетрагидро-4-пиридинил]уксусная кислота гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 2,38-2,44 (2Н, м), 3,04 (2Н, с), 3,79-3,83 (2Н, м), 3,83 (3Н, с), 4,72 (2Н, т, J=2,8 Гц), 5,63-5,68 (1Н, м), 7,15 (1Н, д, J=8,8 Гц), 7,46 (1Н, дд, J=2,4; 8,4 Гц), 7,61 (1Н, д, J=2,4 Гц), 8,21 (1H, д, J=8,8 Гц), 8,46 (1H, дд, J=1,2; 8, 4 Гц), 9,45 (1H, с).
Пример 34
2-[1-[4-[(3-Хлор-4-метоксибензил)амино]-6-циано-1-фталазинил]-4-пиперидинил]-2-фторуксусная кислота гидрохлорид
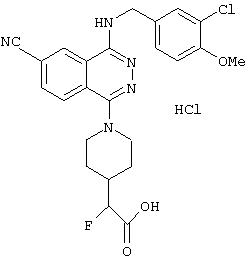
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,60-1,90 (4Н, м), 2,03-2,20 (1H, м), 2,83-2,98 (2Н, м), 3,58-3,65 (2Н, м), 3,83 (3Н, с), 4,73 (2Н, т, J=2,8 Гц), 4,98 (1H, дд, J=4,0; 48,4 Гц), 7,14 (1H, д, J=8,4 Гц), 7,46 (1H, дд, J=2,0; 8,4 Гц), 7,61 (1H, д, J=2,4 Гц), 8,23 (1H, д, J=8,4 Гц), 8,44 (1H, дд, J=1,2; 8,4 Гц), 8,46 (1H, с).
Пример 35
2-[1-[4-[(3-Хлор-4-метоксибензил)амино]-6-циано-1-фталазинил]-4-пиперизил]уксусная кислота гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,44-1,57 (2Н, м), 1,79-1,84 (2Н, м), 1,85-1,96 (1Н, м), 2,25 (2Н, д, J=6,8 Гц), 2,89 (2Н, т, J=12,0 Гц), 3,55 (2Н, д, J=12,0 Гц), 3,84 (3Н, с), 4,70 (2Н, д, J=6,0 Гц), 7,15 (1Н, д, J=8,8 Гц), 7,44 (1Н, дд, J=2,0; 8,4 Гц), 7,94 (1Н, д, J=2,0 Гц), 8,21 (1H, д, J=8,4 Гц), 8,46 (1H, дд, J=1,6; 8,8 Гц), 9,37 (1H, с).
Пример 36
4-[(3-Хлор-4-метоксибензил)амино]-1-[4-(1-фтор-2-гидроксиэтил)пиперидино]-6-фталазинкарбонитрил гидрохлорид
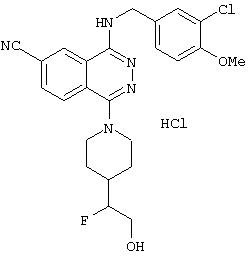
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,56-1,78 (3Н, м), 1,83-1,99 (2Н, м), 2,80-2,91 (2Н, м), 3,51-3,69 (4Н, м), 3,83 (3Н, с), 4,25-4,31 (1/2Н, м), 4,37-4,43 (1/2Н, м), 4,73 (2Н, д, J=5, 6 Гц), 7,14 (1Н, д, J=8,4 Гц), 7,47 (1Н, дд, J=2,0; 8,4 Гц), 7,62 (1Н, д, J=2,0 Гц), 8,22 (1H, д, J=8,4 Гц), 8,45 (1Н, дд, J=1,2; 8,4 Гц), 9,52 (1H, с), 10,58 (1H, с).
Пример 37
4-[(3-Хлор-4-метоксибензил)амино]-1-[4-(2-гидроксиэтокси)пиперидино]-6-фталазинкарбонитрил гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,68-1,77 (4Н, м), 1,98-2,07 (2Н, м), 2,98-3,07 (2Н, м), 3,44-3,52 (2Н, м), 3,56-3,62 (3Н, м), 3,83 (3Н, с), 4,74 (2Н, д, J=5, 6 Гц), 7,13 (1H, д, J=8,4 Гц), 7,48 (1H, дд, J=2,0; 8,4 Гц), 7,627 (1H, д, J=2,0 Гц), 8,23 (1H, д, J=8,4 Гц), 8,45 (1H, дд, J=1, 6; 8,4 Гц), 9,57 (1H, с), 10,68 (1H, уш.-с).
Пример 38
2-[[1-[4-[(3-Хлор-4-метоксибензил)амино]-6-циано-1-фталазинил]-4-пиперизил]окси]уксусная кислота гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,69-1,82 (2Н, м), 1,99-2,10 (2Н, м), 2,98-3,09 (2Н, м), 3,60-3,68 (1Н, м), 3,83 (3Н, с), 4,08 (2Н, с), 4,72 (2Н, д, J=5, 6 Гц), 7,14 (1Н, д, J=8,4 Гц), 7,46 (1H, дд, J=2,4; 8,4 Гц), 7,61 (1H, д, J=2,0 Гц), 8,24 (1H, д, J=8,4 Гц), 8,46 (1H, дд, J=1,2; 8,4 Гц), 9,46 (1H, с), 10,46 (1H, уш.-с).
Пример 39
4-[(3-Хлор-4-метоксибензил)амино]-1-[4-(2-гидрокси-1-метилэтил)пиперидино]-6-фталазинкарбонитрил

1H-ЯМР (400 МГц, DMSO-d6) δ: 0,85 (3Н, д, J=6,4 Гц), 1,40-1,59 (4Н, м), 1,64-1,73 (2Н, м), 2,68-2,79 (2Н, м), 3,33-3,47 (4Н, м), 3,78 (3Н, м), 4,40 (1Н, т, J=5,2 Гц), 4,60 (2Н, д, J=5,6 Гц), 7,06 (1H, д, J=8,4 Гц), 7,31 (1Н, дд, J=2,0; 8,4 Гц), 7,42 (1H, д, J=2,0 Гц), 7,85 (1H, т, J=6,0 Гц), 8,03 (1H, д, J=8,4 Гц), 8,16 (1H, дд, J=1,6; 8, 4 Гц), 8,85 (1H, д, J=0,8 Гц).
Пример 40
2-[7-[4-[(3-Хлор-4-метоксибензил)амино]-6-циано-1-фталазинил]-7-азаспиро[3.5]нон-2-ил]уксусная кислота гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,45-1,53 (2Н, м), 1,66-1,73 (2Н, м), 1,77-1,84 (2Н, м), 1,96-2,04 (2Н, м), 2,34 (2Н, д, J=7,6 Гц), 3,02 (2Н, уш.-с), 3,11 (2Н, уш.-с), 3,82 (3Н, c), 4,67 (2Н, с), 7,11 (1H, д, J=8,4 Гц), 7,40 (1H, дд, J=2,0; 8,4 Гц), 7, 54 (1H, д, J=2,0 Гц), 8,15 (1H, д, J=8,8 Гц), 8,34 (1H, д, J=8,8 Гц), 9,24 (1H, с).
Пример 41
4-[(3-Хлор-4-метоксибензил)амино]-1-[2-(гидроксиметил)пергидро[1.3]диоксоло[4.5-с]пиррол-5-ил]-6-фталазинкарбонитрил гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 3,54-3,67 (2Н, м), 3,80-3,92 (2Н, м), 4,16 (2/3Н, уш.-с), 4,29 (4/3Н, уш.-с), 4,54 (1Н, т, J=5,2 Гц), 4,54-4,62 (1Н, м), 5,16-5,32 (2Н, м), 7,11 (1H, д, J=8,4 Гц), 7,34-7,40 (1Н, м), 7,50 (1H, с), 8,37 (1Н, д, J=8,4 Гц), 8,48-8,58 (1H, м), 9,12-9,21 (1H, м).
Пример 42
4-[(3-Хлор-4-метоксибензил)амино]-1-[4-(1-гидроксиэтил)пиперидино-6-фталазинкарбонитрил гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,07 (3Н, д, J=6,0 Гц), 1,34-1,60 (3Н, м), 1,65-1,76 (2Н, м), 1,86-1, 94 (2Н, м), 2,75-2,86 (2Н, м), 3,55-3,63 (2Н, м), 3,82 (3Н, с), 4,73 (2Н, д, J=5,6 Гц), 7,13 (1Н, д, J=8,8 Гц), 7,48 (1Н, дд, J=2,0; 8,8 Гц), 7,63 (1Н, д, J=2,0 Гц), 8,20 (1H, д, J=8,4 Гц), 8,45 (1Н, дд, J=1,2; 8,4 Гц), 9,56 (1H, с), 10,69 (1H, уш.-с),
Пример 43
4-[(3-Хлор-4-метоксибензил)амино]-1-[4-фтор-4-(гидроксиметил)пиперидино]-6-фталазинкарбонитрил гидрохлорид
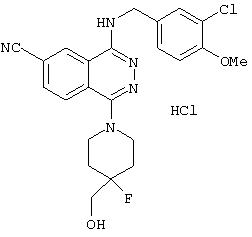
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,69-1,77 (2Н, м), 1,83-2,08 (2Н, м), 3,05-3,16 (2Н, м), 3,48 (2Н, д, J=20,0 Гц), 3,82 (3Н, с), 4,74 (2Н, д, J=5,6 Гц), 7,14 (1H, д, J=8,8 Гц), 7,48 (1H, дд, J=2,0; 8,8 Гц), 7,63 (1H, д, J=2,0 Гц), 8, 26 (1H, д, J=8,4 Гц), 8,46 (1H, дд, J=1,2; 8,4 Гц), 9,57 (1H, с), 10,73 (1H, уш.-с).
Пример 44
4-[(3-Хлор-4-метоксибензил)амино]-1-[4-(гидроксиметил)-4-метоксипиперидино]-6-фталазинкарбонитрил гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,71-1,86 (4Н, м), 3,04-3,16 (2Н, м), 3,16 (3Н, с), 3,41 (2Н, с), 3,83 (3Н, с), 4,72 (2Н, д, J=5,6 Гц), 7,14 (1Н, д, J=8,4 Гц), 7,46 (1Н, дд, J=2,0; 8,4 Гц), 7,61 (1Н, д, J=2,0 Гц), 8,23 (1H, д, J=8,8 Гц), 8,44 (1H, дд, J=1,2; 8,8 Гц), 9,48 (1H, с), 10,46 (1H, уш.-с).
Пример 45
4-[(3-Хлор-4-метоксибензил)амино]-1-(2-гидрокси-6-азаспиро[3,4]окт-6-ил)-6-фталазинкарбонитрил гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,00-1,08 (2Н, м), 1,82-2,04 (4Н, м), 2,19-2,35 (2Н, м), 3,32-3,45 (2Н, м), 3,55-3,60 (2Н, м), 3,80 (3Н, с), 4,04-4,19 (1Н, м), 4,56 (2Н, уш.-с), 7,10 (1Н, д, J=8,4 Гц), 7,37 (1Н, уш.-с), 7,50 (1Н, уш.-с), 8,38 (1Н, д, J=8,4 Гц), 8,45-8,73 (1Н, м).
Пример 46
4-[(3-Хлор-4-метоксибензил)амино]-1-[3-(гидроксиметил)-2,5-дигидро-1Н-1-пирролил]-6-фталазинкарбонитрил гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 3,82 (3Н, с), 4,12 (2Н, с), 4,45-4,83 (6Н, м), 5,84 (1Н, уш.-с), 7,11 (1Н, д, J=9 Гц), 7,33-7,56 (2Н, м), 8,45 (1Н, д, J=9 Гц), 8,66-9,14 (2Н, м).
Пример 47
4-[(3-Хлор-4-метоксибензил)амино]-1-[(3R,4S)-3,4-ди(гидроксиметил) тетрагидро-1Н-1-пирролил]-6-фталазинкарбонитрил гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 2,50-2,57 (2Н, м), 3,38-3,49 (2Н, м), 3,56-3,60 (2Н, м), 3,76-3,87 (4Н, м), 3,81 (3Н, с), 4,55 (2Н, уш.-с), 7,10 (1H, д, J=8,4 Гц), 7,36 (1Н, д, J=7,6 Гц), 7,49 (1H, с), 8,41 (1H, д, J=8,4 Гц), 8,68 (1H, д, J=8,4 Гц), 9,13 (1H, с).
Пример 48
1-[4-[(3-Хлор-4-метоксибензил)амино]-6-циано-1-фталазинил]-4-гидрокси-4-пиперидинкарбоксамид гидрохлорид
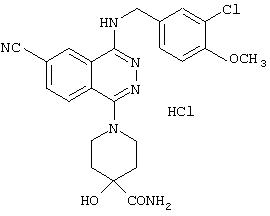
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,56-1,64 (2Н, м), 2,16-2,28 (2Н, м), 3,12-3,24 (2Н, м), 3,32-3,48 (2Н, м), 3,54 (1Н, уш.-с), 3,83 (3Н, с), 4,10-4,30 (1Н, м), 4,74 (2Н, с), 7,13 (1Н, д, J=8,4 Гц), 7,15 (1Н, уш.-с), 7,31 (1H, уш.-с), 7,48 (1Н, д, J=8,4 Гц), 7,64 (1H, с), 8,26 (1H, д, J=8,4 Гц), 8,44 (1H, д, J=8,4 Гц), 9,52-9,60 (1H, м).
Пример 49
[4-(3-Хлор-4-метоксибензил)амино]-1-[4-(фторметил)-4-гидроксипиперидино]-6-фталазинкарбонитрил гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,54-1,64 (2Н, м), 1,80-1,52 (2Н, м), 3,18-3,26 (2Н, м), 3,32-3,44 (4Н, м), 3,83 (3Н, с), 4,22 (2Н, д, J=7,6 Гц), 4,72 (1H, д, J=6,0 Гц), 7,14 (1H, д, J=8,4 Гц), 7,48 (1H, дд, J=8,4; 1,6 Гц), 7,62 (1H, д, J=1,6 Гц), 8,23 (1H, д, J=8, 4 Гц), 8,45 (1H, д, J=8,4 Гц), 9,45 (1H, уш.-с).
Пример 50
4-[(3-Хлор-4-метоксибензил)амино]-1-(4-гидроксииминопиперидино)-6-фталазинкарбонитрил гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 2,50-2,52 (2Н, м), 2,74-2,80 (2Н, м), 3,26-3,35 (4Н, м), 3,85 (3Н, с), 4,71 (2Н, уш.), 7,17 (1Н, д, J=8,8 Гц), 7,45 (1Н, дд, J=8,8; 2,0 Гц), 7,60 (1H, д, J=2,0 Гц), 8,34 (1H, д, J=8,4 Гц), 8,49 (1Н, дд, J=8,4; 0,4 Гц), 9,34 (1H, д, J=0,4 Гц), 10,53 (1H, уш.).
Пример 51
(анти)-2-[3-[4-[(3-Хлор-4-метоксибензил)амино]-6-циано-1-фталазинил]-3-азабицикло[3.3.1]нон-9-ил]уксусная кислота гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,62 (1Н, м), 1,75-2,00 (4Н, м), 2,12 (1Н, м), 2,52 (2Н, д, J=8,1 Гц), 3,16-3,24 (2Н, м), 3,68-3,76 (2Н, м), 3,85 (3Н, с), 4,74 (2Н, с), 7,16 (1Н, д, J=8,6 Гц), 7,48 (1Н, дд, J=1,8; 8,6 Гц), 7,62 (1Н, д, J=1,8 Гц), 8,23 (1H, д, J=8,4 Гц), 8,55 (1Н, дд, J=1,3; 8,4 Гц), 9,48 (1H, м).
Пример 52
(эндо)-4-[(3-Хлор-4-метоксибензил)амино]-1-(3-гидрокси-8-азабицикло[3.2.1]окт-8-ил)-6-фталазинкарбонитрил гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,81-1,88 (2Н, м), 1,90-1,98 (2Н, м), 2,19-2,30 (4Н, м), 3,85 (3Н, с), 4,04 (1H, м), 4, 16-4,26 (2Н, м), 4,71 (2Н, с), 7,16 (1H, д, J=8,6 Гц), 7,46 (1H, д, J=8,6 Гц), 7,61 (1H, с), 8,29 (1H, д, J=8,4 Гц), 8,47 (1H, дд, J=1,3; 8,4 Гц), 9,44 (1H, м).
Пример 53
(син)-4-[(3-Хлор-4-метоксибензил)амино]-1-(9-гидрокси-3-азабицикло[3.3.1]нон-3-ил)-6-фталазинкарбонитрил гидрохлорид

1Н-ЯМР (400 МГц, DMSO-d6) δ: 1,53 (1Н, м), 1,74-1,86 (2Н, м), 1,87-1,93 (2Н, м), 2,05-2,14 (2Н, м), 2,37 (1Н, м), 3,28-3,44 (2Н, м), 3,41-3,61 (2Н, м), 3,68 (1Н, м), 3,85 (3Н, с), 4,73 (2Н, с), 7,15 (1Н, д, J=8, 6 Гц), 7,47 (1Н, д, J=8,6 Гц), 7,62 (1H, с), 8,22 (1H, д, J=8, 6 Гц), 8,54 (1H, д, J=8, 6 Гц), 9,48 (1H, м).
Пример 54
(син)-4-[(3-Хлор-4)амино]-1-(8-гидрокси-3-азабицикло[3.2.1]окт-3-ил)-6-фталазинкарбонитрил гидрохлорид
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,75-1,96 (4Н, м), 2,02-2,09 (2Н, м), 3,06-3,18 (2Н, м), 3,50-3,60 (2Н, м), 3,86 (3Н, с), 3,91 (1Н, т, J=4,8 Гц), 4,73 (2Н, с), 7,16 (1Н, д, J=8,6 Гц), 7,47 (1H, д, J=8,6 Гц), 7,61 (1Н, с), 8,36 (1H, д, J=8,6 Гц), 8,48 (1H, дд, J=1,5; 8,6 Гц), 9,43 (1H, м).
Пример 55
(экзо)-4-[(3-Хлор-4-метоксибензил)амино]-1-(3-гидрокси-8-азабицикло[3.2.1]окт-8-ил)-6-фталазинкарбонитрил гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,68-1,83 (2Н, м), 1,90-2,02 (4Н, м), 3,85 (3Н, с), 3,97 (1H, м), 4,18-4,28 (2Н, м), 4,70 (2Н, с), 7,15 (1H, д, J=8,6 Гц), 7,44 (1H, д, J=8,6 Гц), 7,59 (1H, с), 8,29 (1H, д, J=8,6 Гц), 8,45 (1H, д, J=8,6 Гц), 9,36 (1H, м).
Пример 56
(анти)-4-[(3-Хлор-4-метоксибензил)амино]-1-(9-гидрокси-3-окса-7-азабицикло[3.3.1]нон-7-ил)-6-фталазинкарбонитрил гидрохлорид
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,69-1,76 (2Н, м), 3,24-3,38 (2Н, м), 3,73-3,83 (2Н, м), 3,85 (3Н, с), 3,85-3,93 (2Н, м), 4,11-4,20 (2Н, м), 4,73 (2Н, с), 7,16 (1Н, д, J=8,6 Гц), 7,47 (1Н, д, J=8,6 Гц), 7,62 (1H, с), 8,36 (1Н, д, J=8,4 Гц), 8,52 (1H, д, J=8,4 Гц), 9, 43 (1Н, м).
Пример 57
(анти)-4-[(3-Хлор-4-метоксибензил)амино]-1-(3-гидрокси-9-азабицикло[3.3.1]нон-9-ил)-6-фталазинкарбонитрил гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,38-1,54 (4Н, м), 1,59 (1H, м), 1,90-2,02 (2Н, м), 2,22-2,45 (3Н, м), 3,86 (3Н, с), 3,87 (1H, м), 4,08-4,17 (2Н, м), 4,69 (2Н, с), 7,16 (1H, д, J=8,6 Гц), 7,44 (1H, д, J=8,6 Гц), 7,58 (1H, с), 8,07 (1H, д, J=8,6 Гц), 8,44 (1Н, д, J=8,6 Гц), 9,29 (1H, м).
Пример 58
N1-[3-[4-[(3-Хлор-4-метоксибензил)амино]-6-циано-1-фталазинил]фенил]ацетамид

1H-ЯМР (400 МГц, DMSO-d6) δ: 2,05 (3Н, с), 3,81 (3Н, с), 4,76 (2Н, д, J=6,0 Гц), 7, 09 (1Н, д, J=8,4 Гц), 7,24 (1Н, д, J=8,0 Гц), 7,38 (1Н, дд, J=8,0; 1,6 Гц), 7,45 (1Н, дд, J=8,4; 8,0 Гц), 7,50 (1Н, д, J=1,6 Гц), 7,67 (1H, д, J=8,0 Гц), 7,86 (1H, м), 7,92 (1H, д, J=8,4 Гц), 8,17 (1H, дд, J=8,4; 1,6 Гц), 8,35 (1H, дд, J=6,0; 6,0 Гц), 9,00 (1H, с), 10,09 (1H, с).
Пример 59
1-(3-Аминофенил)-4-[(3-хлор-4-метоксибензил)амино]-6-фтала-зинкарбонитрил гидрохлорид

1Н-ЯМР (400 МГц, DMSO-d6) δ: 3,83 (3Н, с), 4,89 (2Н, уш.-с), 7,16 (1Н, д, J=8,6 Гц), 7,38-7,44 (3Н, м), 7,53 (1Н, дд, J=8,6; 2,0 Гц), 7,58-7,62 (2Н, м), 7,68 (1Н, д, J=2,0 Гц), 8,02 (1Н, д, J=8,4 Гц), 8,45 (1Н, J=8,4 Гц), 9,65 (1Н, с).
Пример 60
N-[3-[4-[(3-Хлор-4-метоксибензил)амино]-6-циано-1-фталази-нил]фенил]метансульфонамид гидрохлорид
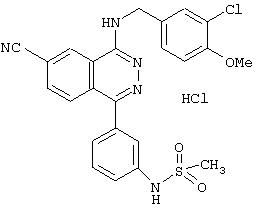
1H-ЯМР (400 МГц, DMSO-d6) δ: 3,06 (3Н, с), 3,84 (3Н, с), 4,86 (2Н, д, J=5,6 Гц), 7,15 (1Н, д, J=8,4 Гц), 7,35 (1Н, д, J=7,6 Гц), 7,43 (1H, д, J=7,6 Гц), 7,50 (1H, уш.-с), 7,53 (1H, дд, J=8,4; 2,0 Гц), 7,55 (1H, дд, J=7,6; 7,6 Гц), 7,66 (1H, д, J=2,0 Гц), 8,03 (1H, д, J=8,8 Гц), 8,44 (1H, д, J=8,8 Гц), 9,60 (1H, уш.-с), 10,14 (1H, уш.-с).
Пример 61
4-[(3-Хлор-4-метоксибензил)амино]-1-[4-(метилсульфинил)фенил]-6-фталазинкарбонитрил гидрохлорид
1H-ЯМР (400 МГц, DMSO-d6) δ: 2,84 (3Н, с), 3,83 (3Н, с), 4,87 (2Н, уш.-с), 7,16 (1H, д, J=8,4 Гц), 7,51 (1H, д, J=8,4 Гц), 7,66 (1H, уш.-с), 7,83 (2Н, д, J=8,4 Гц), 7,92 (2Н, д, J=8,4 Гц), 8,00 (1H, д, J=8,4 Гц), 8,43 (1H, д, J=8,4 Гц), 9,52-9, 60 (1H, м).
Пример 62
4-[(3-Хлор-4-метоксибензил)амино]-1-[4-(метилсульфонил)фенил]-6-фталазинкарбонитрил гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 3,31 (3Н, с), 3,82 (3Н, с), 4,80 (2Н, уш.-с), 7,12 (1Н, д, J=8,8 Гц), 7,43 (1H, дд, J=8,8; 2,0 Гц), 7,56 (1H, д, J=2,0 Гц), 7,90 (2Н, д, J=8,0 Гц), 7,93 (1H, д, J=8,4 Гц), 8,11 (2Н, д, J=8,0 Гц), 8,28 (1H, д, J=8,4 Гц), 9,19-9,22 (1H, м).
Пример 63
4-[(3-Хлор-4-метоксибензил)амино]-1-(4-формилфенил)-6-фтала-зинкарбонитрил гидрохдорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 3,84 (3Н, с), 4,86 (2Н, уш.-с), 7,16 (1H, д, J=8,4 Гц), 7,51 (1H, д, J=8,4 Гц), 7,66 (1Н, уш.-с), 7,86 (2Н, д, J=8,0 Гц), 7,99 (1H, д, J=8,8 Гц), 8,13 (2Н, д, J=8,0 Гц), 8,42 (1H, д, J=8,8 Гц), 9,48-9,53 (1H, м), 10,15 (1H, с).
Пример 64
4-[(3-Хлор-4-метоксибензил)амино]-1-[(4-гидроксиметил)фенил]-6-фталазинкарбонитрил гидрохлорид
1H-ЯМР (400 МГц, DMSO-d6) δ: 3,84 (3Н, с), 4,62 (2Н, с), 4,84 (2Н, уш.-с), 7,16 (1H, д, J=8,4 Гц), 7,49 (1H, дд, J=8,4; 2,0 Гц), 7,55 (2Н, д, J=8, 0 Гц), 7,60 (2Н, д, J=8,0 Гц), 7,65 (1H, д, J=2,0 Гц), 8,02 (1H, д, J=8,4 Гц), 8,43 (1H, д, J=8,4 Гц), 9,50-9,58 (1H, м).
Пример 65
4-[4-[(3-Хлор-4-метоксибензил)амино]-6-циано-1-фталазинил]бензойная кислота

1H-ЯМР (400 МГц, DMSO-d6) δ: 3,84 (3Н, с), 4,76 (2Н, д, J=6,0 Гц), 7,10 (1Н, д, J=8,8 Гц), 7,38 (1Н, дд, J=8,8; 2,0 Гц), 7,50 (1Н, д, J=2,0 Гц), 7,72 (2Н, д, J=8, 4 Гц), 7,91 (1Н, д, J=8,8 Гц), 8,08 (2Н, д, J=8,4 Гц), 8,19 (1Н, дд, J=8,4; 1,6 Гц), 8,44 (1Н, дд, J=6,0, 6,0 Гц), 9,01 (1Н, д, J=1,6 Гц).
Пример 66
4-[(3-Хлор-4-метоксибензил)амино]-1-(1,3-тиазол-2-ил)-6-фталазинкарбонитрил гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 3,80 (3Н, с), 4,82 (2Н, с), 7,13 (1H, д, J=8,4 Гц), 7,42 (1Н, д, J=8,4 Гц), 7,57 (1H, с), 7,94 (1H, д, J=3,6 Гц), 8,11 (1H, д, J=3,6 Гц), 8,46 (1H, д, J=8,4 Гц), 9,20-9,26 (1H, м), 9,70 (1H, д, J=8,4 Гц).
Пример 67
4-[(3-Хлор-4-метоксибензил)амино]-1-(3-гидрокси-3-метил-1-бутинил)-6-фталазинкарбонитрил гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,57 (6Н, с), 3,84 (3Н, с), 4,84 (2Н, с), 7,15 (1H, д, J=8,8 Гц), 7,46 (1H, дд, J=8,8; 2,0 Гц), 7,61 (1H, д, J=2,0 Гц), 8,34 (1H, д, J=8,4 Гц), 8,52 (1H, дд, J=8,4; 0,4 Гц), 9,04 (1H, д, J=0,4 Гц), 10,36 (1H, уш.).
Пример 68
4-[(3-Хлор-4-метоксибензил)амино]-1-(3-гидрокси-1-пропинил)-6-фталазинкарбонитрил гидрохлорид
1H-ЯМР (400 МГц, DMSO-d6) δ: 3,84 (3Н, с), 4,49 (2Н, с), 4,81 (2Н, д, J=4,0 Гц), 7,14 (1Н, д, J=8,4 Гц), 7,43 (1H, дд, J=8,4; 2,4 Гц), 7,58 (1H, д, J=2,4 Гц), 8,35 (1H, д, J=8,8 Гц), 8,48 (1H, дд, J=8,8; 0,8 Гц), 9,28 (1H, д, J=0,8 Гц), 9,92 (1H, уш.).
Пример 69
4-[(3-Хлор-4-метоксибензил)амино]-1-[3, 4-дигидрокси-3-(гидроксиметил)-1-бутинил-6-фталазинкарбонитрил
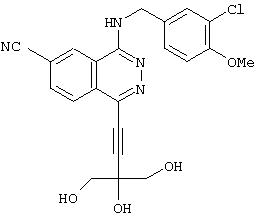
1H-ЯМР (400 МГц, DMSO-d6) δ: 3,54-3,66 (4Н, м), 3,82 (3Н, с), 4,76 (2Н, д, J=5,2 Гц), 4,98 (2Н, т, J=5,2 Гц), 5,62 (1H, с), 7,10 (1H, д, J=8,8 Гц), 7,36 (1Н, дд, J=8,8; 2,0 Гц), 7,49 (1H, д, J=2,0 Гц), 8,29-8,34 (1H, м), 8,51 (1H, т, J=5,2 Гц), 8,96 (1H, с).
Пример 70
4-[(3-Хлор-4-метоксибензил)амино]-1-[3-(диметиламино)-1-пропинил]-6-фталазинкарбонитрил дигидрохлорид
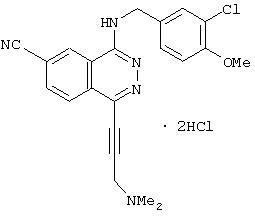
1H-ЯМР (400 МГц, DMSO-d6) δ: 2,91 (6Н, с), 3,83 (3Н, с), 4,52 (2Н, с), 4,83 (2Н, д, J=4,8 Гц), 7,13 (1H, д, J=8,8 Гц), 7,42 (1H, дд, J=8,8; 2,0 Гц), 7,56 (1H, д, J=2,0 Гц), 8,40 (1H, дд, J=8,4; 1,4 Гц), 8,46 (1H, д, J=8,4 Гц), 9,27 (1H, д, J=1,4 Гц), 9,76 (1H, уш.), 11,39 (1H, уш.).
Пример 71
2-[[3-[4-[(3-Хлор-4-метоксибензил)амино]-6-циано-1-фталазинил]-1,1-диметил-2-пропинил]окси]уксусная кислота гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,62 (6Н, с), 3,84 (3Н, c), 4,21-4,24 (2Н, м), 4,77-4,82 (2Н, уш.), 7, 11-7,15 (1H, м), 7,38-7,42 (1H, м), 7,51-7,55 (1Н, м), 8,19-8,24 (1H, м), 8,38-8,42 (1H, м), 9,12-9,16 (1H, м).
Пример 72
4-[(3-Хлор-4-метоксибензил)амино]-1-[3-(2-гидроксиэтокси)-3-метил-1-бутинил]-6-фталазинкарбонитрил гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,61 (6Н, с), 3,55 (2Н, т, J=5,6 Гц), 3,65 (2Н, т, J=5,6 Гц), 3,84 (3Н, с), 4,85 (2Н, д, J=4,8 Гц), 7,14 (1H, д, J=8,6 Гц), 7,46 (1H, дд, J=8,6; 2,2 Гц), 7,61 (1H, д, J=2,2 Гц), 8,30 (1H, д, J=8,4 Гц), 8,48 (1H, дд, J=8,4; 1,6 Гц), 9,42 (1H, д, J=1,6 Гц), 10,41 (1H, уш.).
Пример 73
4-[(3-Хлор-4-метоксибензил)амино]-1-[3-(4-гидроксипиперидино)-3-метил-1-бутинил)-6-фталазинкарбонитрил дигидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,79-2,04 (10Н, м), 2,12-2,23 (1Н, м), 3,04-3,19 (1H, м), 3,26-3,37 (2Н, м), 3,54-3,77 (1H, м), 3,82 (3Н, с), 4,83 (2Н, д, J=5, 6 Гц), 7,12 (1H, д, J=8,4 Гц), 7,43 (1H, дд, J=8,4; 1,2 Гц), 7,56 (1H, д, J=1,2 Гц), 8,38 (1H, дд, J=8,4; 0,8 Гц), 8,43 (1H, д, J=8,4 Гц), 9,30 (1H, д, J=0,8 Гц), 9,91 (1H, уш.), 11,40-11,66 (1H, м).
Пример 74
4-[(3-Хлор-4-метоксибензил)амино]-1-(3-метил-3-тетрагидро-1Н-1-пирролил-1-бутинил)-6-фталазинкарбонитрил дигидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,85 (6Н, с), 1,90-2,08 (4Н, м), 3,30-3,42 (2Н, м), 3,60-3,72 (2Н, м), 3,83 (3Н, с), 4, 80 (2Н, д, J=5,2 Гц), 7,11 (1Н, д, J=8,4 Гц), 7,39 (1H, дд, J=8,4; 2,0 Гц), 7,52 (1H, д, J=2,0 Гц), 8,28 (1H, д, J=8,4 Гц), 8,36 (1H, дд, J=8,4; 0,8 Гц), 9,14 (1H, д, J=0,8 Гц), 9,33 (1H, уш.), 11,89 (1H, м).
Пример 75
1-(4-Гидроксипиперидино)-4-[[4-метокси-3-(трифторметил)бензил]амино]-6-фталазинкарбонитрил гидрохлорид
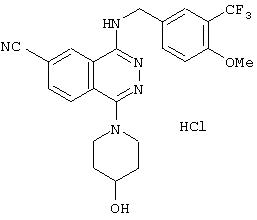
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,62-1,73 (2Н, м), 1,90-1,99 (2Н, м), 2,97-3,07 (2Н, м), 3,40-3,52 (2Н, м), 3,72-3,80 (1H, м), 3,89 (3Н, с), 4,80 (2Н, д, J=5,6 Гц), 7,28 (1H, д, J=8,4 Гц), 7,81-7,85 (2Н, м), 8,24 (1H, д, J=8,4 Гц), 8,47 (1H, дд, J=8,4; 1,2 Гц), 9,53 (1H, д, J=1,2 Гц), 10,29 (1H, уш.), 14,02 (1H, уш.).
Пример 76
1-(4-Гидроксипиперидино)-4-[(3-йод-4-метоксибензил)амино]-6-фталазинкарбонитрил гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,62-1,73 (2Н, м), 1,90-2,00 (2Н, м), 2,98-3,08 (2Н, м), 3,40-3,50 (2Н, м), 3,72-3,80 (1Н, м), 3,82 (3Н, с), 4,68 (2Н, д, J=4,8 Гц), 7,02 (1H, д, J=8,8 Гц), 7,50 (1H, дд, J=8,8; 2,2 Гц), 7,93 (1H, д, J=2,2 Гц), 8,24 (1H, д, J=8,6 Гц), 8,46 (1H, дд, J=8,6; 0,8 Гц), 9,32 (1H, д, J=0,8 Гц), 10,05 (1H, уш.).
Пример 77
4-[(3-Бром-4-метоксибензил)амино]-1-(4-гидроксипиперидино)-6-фталазинкарбонитрил гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,62-1,73 (2Н, м), 1,90-1,99 (2Н, м), 2,98-3,07 (2Н, м), 3,39-3,50 (2Н, м), 3,72-3,80 (1Н, м), 3,84 (3Н, с), 4,71 (2Н, д, J=4,8 Гц), 7,13 (1Н, д, J=8,6 Гц), 7,49 (1Н, дд, J=8,6; 2,2 Гц), 7,75 (1Н, д, J=2,2 Гц), 8,24 (1H, д, J=0,4 Гц), 8,46 (1Н, дд, J=8,4; 0,8 Гц), 9,34 (1H, д, J=0,8 Гц), 10,11 (1H, уш.).
Пример 78
4-[(3-Бром-4-метоксибензил)амино]-1-[3-(гидроксиметил)тетрагидро-1Н-1-пирролил]-6-фталазинкарбонитрил гидрохлорид
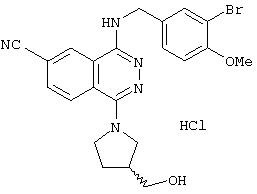
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,72-1,86 (1H, м), 1,99-2,12 (1H, м), 2,39-2,51 (1H, м), 3,42 (1H, дд, J=7,2; 10,8 Гц), 3,48 (1H, дд, J=6,0; 10,8 Гц), 3,60-3,90 (4Н, м), 3,80 (3Н, с), 7,06 (1H, д, J=8,4 Гц), 7,38-7,46 (1H, м), 7,64 (1H, с), 8,40 (1H, дд, J=1,6; 8,8 Гц), 8,65 (1H, д, J=8,0 Гц), 9,18 (1H, с).
Пример 79
4-[(3-Бром-4-метоксибензил)амино]-1-[(3S)-3-(гидроксиметил)тетрагидро-1Н-1-пирролил]-6-фталазинкарбонитрил гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,58-1,76 (3Н, м), 1,92-2,02 (2Н, м), 2,29-2,42 (2Н, м), 3,42-3,60 (2Н, м), 3,78 (3Н, с), 4,58 (2Н, J=6,0 Гц), 4,69 (1Н, т, J=5, 6 Гц), 7,03 (1Н, д, J=8,4 Гц), 7,36 (1Н, дд, J=2,0; 8,4 Гц), 7,57 (1Н, д, J=2,0 Гц), 7,59 (1H, д, J=6,0 Гц), 8,13 (1Н, дд, J=1,2; 8,8 Гц), 8,22 (1H, д, J=8,8 Гц), 8,81 (1H, д, J=0,8 Гц).
Пример 80
4-[(3-Бром-4-метоксибензил)амино]-1-[(3R)-3-(гидроксиметил)тетрагидро-1Н-1-пирролил]-6-фталазинкарбонитрил гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,72-1,86 (1Н, м), 1,99-2,12 (1Н, м), 2,39-2,51 (1Н, м), 3,42 (1Н, дд, J=7,2; 10,8 Гц), 3,48 (1Н, дд, J=6,0; 10,8 Гц), 3,60-3,90 (4Н, м), 3,80 (3Н, с), 7,06 (1Н, д, J=8,8 Гц), 7,38-7,46 (1H, м), 7,65 (1Н, с), 8,40 (1H, д, J=8,8 Гц), 8,59-8,68 (1H, м), 9,26 (1H, с).
Пример 81
4-[(3-Бром-4-метоксибензил)амино]-1-[4-(2-гидроксиэтил)пиперидино]-6-фталазинкарбонитрил гидрохлорид

1H-ЯMP (400 МГц, DMSO-d6) δ: 1,68-1,77 (2Н, м), 1,96-2,07 (2Н, м), 3,02 (2Н, т, J=12,0 Гц), 3,38-3, 59 (6Н, м), 3,80 (3Н, с), 3,81-3,99 (3Н, м), 4,72 (2Н, д, J=6,0 Гц), 7,10 (1H, д, J=8,6 Гц), 7,49 (1H, д, J=8,6 Гц), 7,76 (1H, с), 8,22 (1H, д, J=8,6 Гц), 8,45 (1H, д, J=8,6 Гц), 9,50 (1H, с).
Пример 82
4-[(3-Бром-4-метоксибензил)амино]-1-(2-гидрокси-7-азаспиро[3.5]нон-7-ил)-6-фталазинкарбонитрил гидрохдорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,58-1,66 (2Н, м), 1,68-1,76 (4Н, м), 2,14-2,23 (2Н, м), 3,08 (2Н, уш.-с), 3,13 (2Н, уш.-с), 4,08-4,17 (1Н, м), 4,73 (1H, д, J=5,6 Гц), 7,10 (1H, д, J=8,4 Гц), 7,52 (1H, дд, J=2,0; 8,4 Гц), 7,70 (1H, д, J=2,0 Гц), 8,20 (1H, д, J=8,4 Гц), 8,44 (1H, дд, J=1,6; 8,4 Гц), 9,55 (1H, с).
Пример 83
4-[(3-Бром-4-метоксибензил)амино]-1-[4-фтор-4-(гидроксиметил)пиперидино]-6-фталазинкарбонитрил гидрохлорид
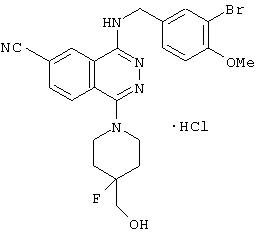
Пример 84
4-[(3-Бром-4-метоксибензил)амино]-1-[4-(гидроксиметил)пиперидино]-6-фталазинкарбонитрил гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,41-1,52 (2Н, м), 1,58-1,69 (1Н, м), 1,79-1,86 (2Н, м), 2,85-2,94 (2Н, м), 3,35-3,40 (2Н, м), 3,59 (2Н, д, J=12,8 Гц), 3,84 (3Н, с), 4,71 (2Н, д, J=5,2 Гц), 7,13 (1Н, д, J=8,4 Гц), 7,50 (1Н, дд, J=8, 4; 2,0 Гц), 7,76 (1Н, д, J=2,0 Гц), 8,22 (1H, д, J=8, 4 Гц), 8,47 (1H, дд, J=8,4; 0,8 Гц), 9,38 (1H, уш.), 10,21 (1H, уш.).
Пример 85
(эндо)-4-[(3-Бром-4-метоксибензил)амино]-1-(3-гидрокси-8-азабицикло[3.2.1]окто-8-ил)-6-фталазинкарбонитрил

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,70-1,95 (4Н, м), 2,14-2,28 (4Н, м), 3,82 (3Н, с), 4,15 (1Н, м), 4,09 (2Н, м), 4,49 (1Н, д, J=2,2 Гц), 4,62 (2Н, д, J=5,5 Гц), 7,05 (1H, д, J=8,6 Гц), 7,38 (1H, дд, J=2,2; 8,6 Гц), 7,60 (1H, д, J=2,2 Гц), 7,72 (1H, т, J=5,5 Гц), 8, 11 (1H, д, J=8,6 Гц), 8,18 (1H, дд, J=1,5; 8,6 Гц), 8, 87 (1H, д, J=1,5 Гц).
Пример 86
1-(4-Гидроксипиперидино)-4-[(4-метокси-3-метилбензил)амино]-6-фталазинкарбонитрил гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,62-1,73 (2Н, м), 1,90-1,99 (2Н, м), 2,15 (3Н, с), 2, 98-3,07 (2Н, м), 3,42-3,50 (2Н, м), 3,72-3,80 (1Н, м), 3,78 (3Н, с), 4,67-4,70 (2Н, м), 6,94 (1Н, д, J=8,2 Гц), 7,28 (1Н, д, J=2,0 Гц), 7,31 (1Н, дд, J=8,2; 2,0 Гц), 8,23 (1Н, д, J=8,4 Гц), 8,47 (1H, дд, J=8,4; 1,2 Гц), 9,45 (1H, д, J=1,2 Гц), 10,39 (1H, уш.).
Пример 87
1-(2-Гидрокси-7-азаспиро[3.5]нон-7-ил)-4-[(4-метокси-3-метилбензил)амино]-6-фталазинкарбонитрил гидрохлорид
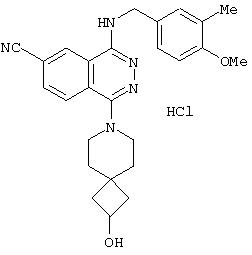
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,57-1,66 (2Н, м), 1,67-1,8 (4Н, м), 2,11 (3Н, с), 2,14-2,23 (2Н, м), 3,07 (2Н, уш.-с), 3,12 (2Н, уш.-с), 3,55-3,61 (1H, м), 4,07-4,17 (1H, м), 4,69 (1H, д, J=5,2 Гц), 6,91 (1H, д, J=8,4 Гц), 7,29 (1H, с), 7,31 (1H, дд, J=2,0; 8,4 Гц), 8,19 (1H, д, J=8,4 Гц), 8,44 (1H, дд, J=1,2; 8,4 Гц), 9,56 (1H, с), 10,59 (1H, уш.-с).
Пример 88
1-[4-Фтор-4-(гидроксиметил)пиперидино]-4-[(4-метокси-3-метилбензил)амино]-6-фталазинкарбонитрил гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,88-2,10 (4Н, м), 2,15 (3Н, с), 3,08-3,17 (2Н, м), 3,40-3,50 (2Н, м), 3,51 (2Н, д, J=19,6 Гц), 3,78 (3Н, с), 4,68 (2Н, д, J=5,2 Гц), 6,94 (1Н, д, J=8,0 Гц), 7,28-7,33 (2Н, м), 8,28 (1Н, д, J=8,4 Гц), 8,47 (1Н, дд, J=8, 4; 1,4 Гц,), 9,42 (1Н, дд, J=1,4 Гц), 10,26 (1H, уш.), 13,96 (1Н, уш.).
Пример 89
1-[4-(Гидроксиметил)пиперидино]-4-[(3-метокси-4-метилбензил)амино]-6-фталазинкарбонитрил гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,41-1,52 (2Н, м), 1,58-1,68 (1H, м), 1,79-1,87 (2Н, м), 2,15 (3Н, с), 2,82-2,93 (2Н, м), 3,30-3,40 (2Н, м), 3, 58 (2Н, д, J=12,8 Гц), 3,78 (3Н, с), 4,67 (2Н, д, J=5,2 Гц), 6,94 (1H, д, J=8,8 Гц), 7,26-7,32 (2Н, м), 8,22 (1H, д, J=8,4 Гц), 8,47 (1H, дд, J=8,4; 0, 8 Гц), 9,36 (1H, уш.), 10,09 (1H, уш.).
Пример 90
(эндо)-1-(3-Гидрокси-8-азабицикло[3.2.1]окто-8-ил)-4-[(4-метокси-3-метилбензид)амино]-6-фталазинкарбонитрил
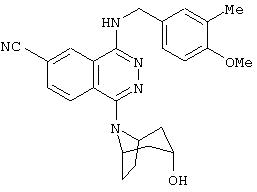
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,79-1,93 (4Н, м), 2,13 (3Н, с), 2,13-2,27 (4Н, м), 3,75 (3Н, с), 4, 03 (1H, м), 4,08 (2Н, м), 4,49 (1H, д, J=2,2 Гц), 4,59 (2Н, д, J=5,3 Гц), 6,87 (1H, д, J=7,9 Гц), 7,16-7,22 (2Н, м), 7,61 (1H, т, J=5,3 Гц), 8,11 (1H, д, J=8,4 Гц), 8,17 (1H, дд, J=1,5; 8,4 Гц), 8,90 (1H, д, J=1,5 Гц).
Пример 91
1-[3-(Гидроксиметил)тетрагидро-1Н-1-пирролил]-4-[(4-метокси-3-метилбензил)амино]-6-фталазинкарбонитрил

1Н-ЯМР (400 МГц, DMSO-d6) δ: 1,67 (1H, м), 2,00 (1H, м), 2,16 (3Н, с), 2,38 (1H, м), 3,36-3,61 (6Н, м), 3,75 (3Н, с), 4,58 (2Н, д, J=5,5 Гц), 4,68 (1H, т, J=5,5 Гц), 6,86 (1H, д, J=8,1 Гц), 7,16-7,22 (2Н, м), 7,50 (1H, т, J=5,3 Гц), 8,15 (1H, дд, J=1,5; 8,6 Гц), 8,24 (1H, дд, J=8,6 Гц), 8,88 (1H, д, J=1,5 Гц).
Пример 92
4-[(3-Фтор-4-метоксибензил)амино]-1-(4-гидроксипиперидино)-6-фталазинкарбонитрил

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,60-1,73 (2Н, м), 1,88-1,97 (2Н, м), 2,86-2,94 (2Н, м), 3,42-3,50 (2Н, м), 3,64-3,71 (1Н, м), 3,80 (3Н, с), 4,62 (2Н, д, J=5,4 Гц), 4,77 (1Н, д, J=2,0 Гц), 7,09 (1H, т, J=8,2 Гц), 7,18 (1Н, д, J=8,2 Гц), 7,23 (1H, дд, J=12,0; 2,0 Гц), 7,84 (1H, т, J=5,4 Гц), 8,04 (1H, д, J=8,4 Гц), 8, 20 (1H, дд, J=8,4; 1,2 Гц), 8,89 (1H, д, J=1,2 Гц).
Пример 93
4-[(4-Хлор-3-метоксибензид)амино]-1-(4-гидроксипиперидино)-6-фталазинкарбонитрил

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,60-1,72 (2Н, м), 1,87-1,96 (2Н, м), 2,86-2,95 (2Н, м), 3,31-3,39 (2Н, м), 3,68 (1Н, м), 3,84 (3Н, с), 4,72 (2Н, д, J=5,5 Гц), 4,74 (1Н, д, J=4,2 Гц), 6,98 (1H, дд, J=1,8; 8,1 Гц), 7,20 (1H, д, J=1,8 Гц), 7,34 (1H, д, J=8,1 Гц), 7,92 (1H, т, J=5,5 Гц), 8,07 (1H, д, J=8,6 Гц), 8,21 (1H, дд, J=1,5; 8,6 Гц), 8,92 (1H, д, J=1,5 Гц).
Пример 94
4-[(3-Циано-4-метоксибензил)амино]-1-(4-гидроксипиперидино)-6-фталазинкарбонитрил гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,6-1,73 (2Н, м), 1,88-2,0 (2Н, м), 2,95-3,08 (2Н, м), 3,4-3, 7 (2Н, м), 3,7-3,8 (1H, м), 3,90 (3Н, с), 4,74 (2Н, д, J=5,6 Гц), 7,27 (1H, д, J=9,2 Гц), 7,79 (1H, дд, J=2,0; 8,8 Гц), 7,87 (1H, д, J=2,0 Гц), 8,24 (1H, д, J=8,4 Гц), 8,47 (1H, дд, J=1,2; 8,4 Гц), 9, 38 (1H, с).
Пример 95
(эндо)-4-[(3-Циано-4-метоксибензил)амино]-1-(3-гидрокси-8-азабицикло[3.2.1]окт-8-ил)-6-фталазинкарбонитрил гидрохлорид
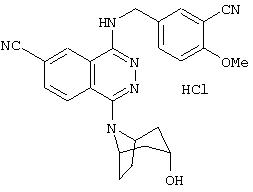
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,9-1,96 (4Н, м), 2,17-2,29 (4Н, м), 3,91 (3Н, с), 4,04 (1Н, м), 4,15 (2Н, м), 4,68 (2Н, с), 7,25 (1Н, д, J=8,6 Гц), 7,74 (1Н, д, J=8,6 Гц), 7,80 (1Н, с), 8,21 (1H, д, J=8,6 Гц), 8,34 (1Н, м), 9,07 (1H, м).
Пример 96
4-[(3-Циано-4-метоксибензил)амино]-1-[3-(гидроксиметил)тетрагидро-1Н-1-пирролил]-6-фталазинкарбонитрил гидрохлорид
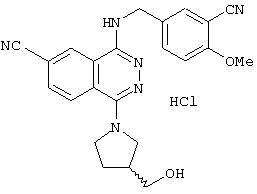
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,84 (1H, м), 2,09 (1H, м), 2,48 (1H, м), 3,40-3,55 (2Н, м), 3,64-3, 90 (4Н, м), 3,91 (3Н, с), 4,59 (2Н, м), 7,24 (1H, д, J=8,8 Гц), 7,74 (1H, д, J=8,8 Гц), 7,79 (1H, с), 8,42 (1H, д, J=9,3 Гц), 8,70 (1H, м), 9,15 (1H, м).
Пример 97
4-[(3-Этил-4-метоксибензил)амино]-1-(4-гидроксипиперидино)-6-фталазинкарбонитрил гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,14 (3Н, т, J=7,5 Гц), 1,63-1,74 (2Н, м), 1,90-2,01 (2Н, м), 2,57 (2Н, q, J=7, 5 Гц), 2,97-3,08 (2Н, м), 3,40-3,54 (2Н, м), 3,75 (1H, м), 3,79 (3Н, с), 4,69 (2Н, с), 6,95 (1H, д, J=8,2 Гц), 7,26-7,35 (2Н, м), 8,25 (1H, д, J=8,6 Гц), 8,18 (1H, дд, J=1,3; 8,6 Гц), 9,44 (1H, м).
Пример 98
4-[(3-Хлор-4-метоксифенетил)амино]-1-(2-гидрокси-7-азаспиро[3.5]нон-7-ил)-6-фталазинкарбонитрил гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,58-1,66 (2Н, м), 1,67-1,78 (4Н, м), 2,14-2,23 (2Н, м), 2,92-3,01 (2Н, м), 3,07 (2Н, с), 3,11 (2Н, с), 3,70-3,82 (3Н, м), 3,80 (3Н, с), 4,08-4,18 (1H, м), 7,06 (1Н, д, J=8,4 Гц), 7,26 (1Н, дд, J=2,0; 8,4 Гц), 7,43 (1Н, д, J=2,0 Гц), 8,19 (1H, д, J=8,4 Гц), 8,44 (1Н, дд, J=1,2; 8,4 Гц), 9,55 (1H, с), 10,47 (1H, уш.-с), 13,9 (1H, уш.-с).
Пример 99
4-[(3-Хлор-4-метоксифенетил)амино]-1-[4-(2-гидроксиэтокси)пиперидино]-6-фталазинкарбонитрил гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,68-1,77 (2Н, м), 2,00-2,06 (2Н, м), 2,76 (2Н, т, J=8,0 Гц), 3,03 (2Н, т, J=12,0 Гц), 3,32 (10Н, м), 3,75 (2Н, д, J=8,0 Гц), 3,81 (3Н, с), 7,07 (1Н, д, J=8,6 Гц), 7,25 (1Н, д, J=8,6 Гц), 7,43 (1Н, с), 8,24 (1Н, д, J=8,6 Гц), 8,45 (1Н, д, J=8,6 Гц), 9,32 (1Н, с).
Пример 100
4-[(3-Хлор-4-метоксифенетил)амино]-1-[4-фтор-4-(гидроксиме-тил)пиперидино]-6-фталазинкарбонитрил
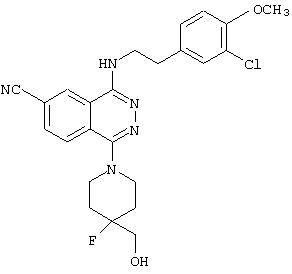
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,82-2,06 (4Н, м), 2,83-2,94 (2Н, м), 3,04-3,14 (2Н, м), 3,24-3,30 (1Н, м), 3,49 (2Н, дд, J=10,2; 6,0 Гц), 3, 54-3,60 (1Н, м), 3,64-3,70 (2Н, м), 3,80 (3Н, с), 5,03 (1Н, дд, J=6,0; 6,0 Гц), 7,05 (1Н, д, J=12,6 Гц), 7,19 (1H, дд, J=12,6; 2,0 Гц), 7,32 (1H, д, J=2,0 Гц), 7,40-7,45 (1H, м), 8,08 (1H, д, J=8,4 Гц), 8,18 (1H, д, J=8,4 Гц), 8,82 (1H, уш.с).
Пример 101
(эндо)-4-[(3-Хлор-4-метоксифенетил)амино]-1-(3-гидрокси-8-азабицикло[3.2.1]окт-8-ил)-6-фталазинкарбонитрил

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,78-1,94 (4Н, м), 2,14-2,28 (4Н, м), 2,92 (2Н, т, J=7,0 Гц), 3,67 (2Н, кв, J=7, 0 Гц), 3,82 (3Н, с), 4,04 (1Н, м), 4,09 (2Н, м), 4,49 (1Н, д, J=1,8 Гц), 7,06 (1Н, д, J=8,4 Гц), 7,20 (1Н, дд, J=2,2; 8,4 Гц), 7,27 (1Н, м), 7,33 (1H, д, J=2,2 Гц), 8,11 (1Н, д, J=8,6 Гц), 8,17 (1H, дд, J=1, 5; 8,6 Гц), 8,80 (1H, д, J=1,5 Гц).
Пример 102
4-[(3-Хлор-4-метоксифенетил)амино]-1-[3-(гидроксиметил)тетрагидро-1Н-1-пирролил]-6-фталазинкарбонитрил

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,68 (1Н, м), 2,00 (1Н, м), 2,40 (1Н, м), 2,92 (2Н, т, J=7,5 Гц), 3,37-3,70 (8Н, м), 3, 82 (3Н, с), 4,69 (1Н, д, J=5,3 Гц), 7,06 (1Н, д, J=8,6 Гц), 7,16 (1Н, м), 7,20 (1Н, дд, J=2,0; 8,6 Гц), 7,33 (1Н, д, J=2,0 Гц), 8,15 (1H, дд, J=1,3; 8,6 Гц), 8,25 (1H, д, J=8,6 Гц), 8,78 (1H, м).
Пример 103
4-[(3,4-Дихлорбензил)амино]-1-(4-гидроксипиперидино)-6-фталазинкарбонитрил гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,61-1,72 (2Н, м), 1,90-2,00 (2Н, м), 3,01-3,18 (2Н, м), 3,40-3,52 (2Н, м), 3,72-3,80 (1H, м), 4,75 (2Н, д, J=5,2 Гц), 7,49 (1H, дд, J=8,6; 2,0 Гц), 7,66 (1H, д, J=8,6 Гц), 7,79 (1H, д, J=2,0 Гц), 8,25 (1H, д, J=8,6 Гц), 8,47 (1H, дд, J=8,6; 1,0 Гц), 9,36 (1H, д, J=1,0 Гц), 10,24 (1H, уш.).
Пример 104
1-[6-Бром-4-[(3-хлор-4-метоксибензил)амино]-1-фталазинил]-4-пиперидинол гидрохлорид
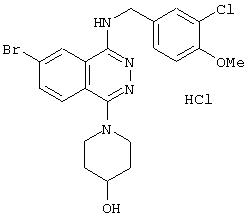
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,59-1,68 (2Н, м), 1,85-1,94 (2Н, м), 2,94-3,08 (2Н, м), 3,45-3,55 (2Н, м), 3,70-3,76 (1Н, м), 3,83 (3Н, с), 4,69 (2Н, д, J=4,8 Гц), 7,14 (1Н, д, J=8,4 Гц), 7,44 (1H, д, J=8,4 Гц), 7,59 (1Н, с), 8,01 (1H, д, J=8,8 Гц), 8,26 (1H, д, J=8,8 Гц), 9,18 (1H, с).
Пример 105
1-[4-[(3-Хлор-4-метоксибензил)амино]-6-(1H-1-пиразолил)-1-фталазинил]-4-пиперидинол гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,6-1,75 (2Н, м), 1,85-2,0 (2Н, м), 2,95-3,1 (2Н, м), 3,3-3,55 (2Н, м), 3,7-3,8 (1H, м), 3,82 (3Н, с), 4,68-4,77 (2Н, м), 6,72 (1Н, м), 7,14 (1H, д, J=8,4 Гц), 7,48 (1H, д, J=7,6 Гц), 7,63 (1H, с), 7,93 (1H, д, J=1,6 Гц), 8,22 (1H, д, J=8,8 Гц), 8,61 (1H, дд, J=1,6; 8,8 Гц), 8,97 (1H, с), 9,46 (1H, м).
Пример 106
7-[4-[(3-Хлор-4-метоксибензил)амино]-6-(1H-1-пиразолил)-1-фталазинил]-7-азаспиро[3.5]нонан-2-ол гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,55-1,68 (2Н, м), 1,68-1,80 (4Н, м), 2,14-2,25 (2Н, м), 3,0-3,2 (4Н, м), 3,82 (3Н, с), 4,14 (1H, геп., J=7,2 Гц), 4,72 (2Н, м), 6,72 (1H, т, J=2 Гц), 7,14 (1H, д, J=8,4 Гц), 7,47 (1H, д, J=8,4 Гц), 7,62 (1H, с), 7,93 (1H, д, J=1,6 Гц), 8,20 (1H, д, J=9,2 Гц), 8,60 (1H, дд, J=2,0; 9,2 Гц), 8,94 (1H, д, J=2,4 Гц), 9,43 (1H, с).
Пример 107
[1-[4-[(3-Хлор-4-метоксибензил)амино]-6-(1H-1-пиразолил)-1-фталазинил]-4-фтор-4-пиперидинил]метанол гидрохлорид
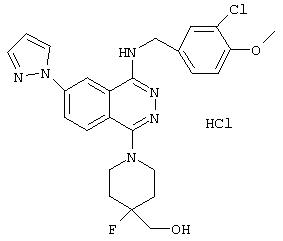
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,85-2,0 (2Н, м), 1,95-2,1 (2Н, м), 3,05-3,2 (2Н, м), 3,4-3,6 (2Н, м), 3,51 (2Н, д, J=20 Гц), 3,83 (3Н, с), 4,74 (2Н, д, J=5,2 Гц), 6,72 (1Н, т, J=1,6 Гц), 7,14 (1H, д, J=8,8 Гц), 7,48 (1Н, д, J=8,4 Гц), 7,64 (1H, с), 7,93 (1H, д, J=1,6 Гц), 8,25 (1H, д, J=9,2 Гц), 8,61 (1H, дд, J=2, 0;9,2 Гц), 8,95 (1H, с), 9,44 (1H, c).
Пример 108
1-[4-[(3-Бром-4-метоксибензил)амино]-6-(1H-1-пиразолил)-1-фталазинил]-4-пиперидинол гидрохлорид
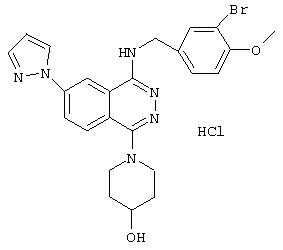
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,6-1,74 (2Н, м), 1,87-2,0 (2Н, м), 2,9-3,1 (2Н, м), 3,4-3,55 (2Н, м), 3,7-3,8 (1Н, м), 3,81 (3Н, с), 4,65-4,8 (2Н, м), 6,72 (1H, м), 7,10 (1Н, д, J=8,8 Гц), 7,53 (1H, д, J=8,0 Гц), 7,79 (1H, с), 7,93 (1H, д, J=1,2 Гц), 8,21 (1H, д, J=8,8 Гц), 8,61 (1H, д, J=8,8 Гц), 9,00 (1H, д, J=2,8 Гц), 9,51 (1H, с).
Пример 109
1-[4-[(3-Хлор-4-метоксибензил)амино]-6-(1Н-1,2, 3-триазол-1-ил)-1-фталазинил]-4-пиперидинол гидрохлорид

1 H-ЯМР (400 МГц, DMSO-d6) δ: 1,62-1,75 (2Н, м), 1,9-2,0 (2Н, м), 3,0-3,1 (2Н, м), 3,3-3,58 (2Н, м), 3,7-3,8 (1H, м), 3,83 (3Н, с), 4,73 (2Н, д, J=5,6 Гц), 7,15 (1H, д, J=8,8 Гц), 7, 46 (1H, д, J=8,4 Гц), 7,62 (1H, с), 8,13 (1H, м), 8,32 (1H, д, J=8,8 Гц), 8,68 (1H, д, J=9,2 Гц), 9,17 (1H, с), 9,56 (1H, с).
Пример 110
4-[(3-Хлор-4-метоксибензил)амино]-1-(4-гидроксипиперидино)-6-фталазинкарбальдегид О6-метилоксим гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,60-1,70 (2Н, м), 1,87-1,70 (2Н, м), 2,96-3,05 (2Н, м), 3,30-3,50 (2Н, м), 3,68-3,78 (1Н, м), 3,83 (3Н, с), 3,99 (3Н, с), 4,66-4,73 (2Н, м), 7,14 (1H, д, J=8 Гц), 7,42 (1Н, дд, J=2; 8 Гц), 7,57 (1Н, д, J=2 Гц), 8,13 (1H, д, J=8 Гц), 8,28 (1Н, д, J=8 Гц), 8,39 (1H, с), 8,94 (1H, уш.-с).
Пример 111
4-[(3-Хлор-4-метоксибензил)амино]-1-(4-гидроксипиперидино)-6-фталазинкарбальдегид О6-этилоксим гидрохлорид
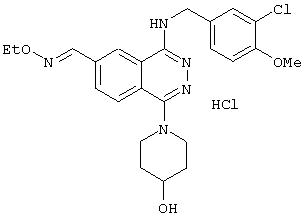
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,28 (3Н, т, J=6 Гц), 1,60-1,73 (2Н, м), 1,87-1,98 (2Н, м), 2,94-3,06 (2Н, м), 3,39-3,52 (2Н, м), 3,68-3,78 (1H, м), 3,83 (3Н, с), 4,25 (2Н, кв, J=6 Гц), 4,67-4,74 (2Н, м), 7,13 (1Н, д, J=9 Гц), 7,42 (1H, д, J=9 Гц), 7,58 (1H, с), 8,13 (1H, д, J=8 Гц), 8,30 (1H, д, J=8 Гц), 8,39 (1H, с), 8,97 (1H, с).
Пример 112
4-[(3-Хлор-4-метоксибензил)амино]-1-(4-гидроксипиперидино)-6-фталазинкарбальдегид О6-бензилоксим гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,59-1,71 (2Н, м), 1,87-1,96 (2Н, м), 2,94-3,05 (2Н, м), 3,37-3,51 (2Н, м), 3,68-3,78 (1H, м), 3,82 (3Н, с), 4,67-4,76 (2Н, м), 5,27 (2Н, с), 7,13 (1H, д, J=9 Гц), 7,29-7,48 (6Н, м), 7,59 (1H, с), 8, 12 (1H, д, J=9 Гц), 8,29 (1H, д, J=9 Гц), 8,45 (1H, с), 9,04 (1H, уш.-с).
Пример 113
4-[(3-Хлор-4-метоксибензил)амино]-1-[3-фтор-3-(гидроксиметил)тетрагидро-1Н-1-пирролил]-6-фталазинкарбонитрил гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 2,09-2,28 (2Н, м), 3,50-4,05 (6Н, м), 3,81 (3Н, с), 4, 66 (2Н, с), 7,11 (1Н, д, J=8,0 Гц), 7,43 (1H, д, J=8,0 Гц), 7,58 (1Н, с), 8,43 (1H, д, J=8,4 Гц), 8,53 (1H, с), 9,45 (1H, с).
Пример 114
4-[(3-Хлор-4-метоксибензил)амино]-1-(3-гидрокси-1-окса-8-азаспиро[4.5]дека-8-ил)-6-фталазинкарбонитрил гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,65-1,85 (3Н, м), 1,87-2,01 (2Н, м), 3,16-3,63 (8Н, м), 3,82 (3Н, с), 4,32 (1H, с), 4, 73 (2Н, д, J=4,8 Гц), 7,13 (1Н, д, J=8,4 Гц), 7,48 (1H, д, J=8,0 Гц), 7,62 (1H, с), 8,23 (1H, д, J=8,0 Гц), 8,44 (1H, д, J=8,0 Гц), 9,57 (1H, с), 10,78 (1H, с).
Пример 115
4-[(3-Хлор-4-метоксибензил)амино]-1-[2-(1-гидроксициклопентил)-1-этинил]-6-фтадазинкарбонитрил
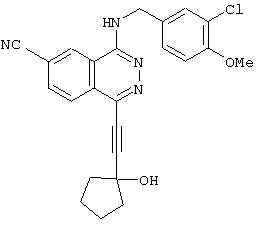
1H-ЯМР (400 МГц, DMSO-d6) δ: 1,69-1,86 (4Н, м), 1,97-2,04 (4Н, м), 3,82 (3Н, с), 4,75 (2Н, д, J=5,4 Гц), 5,60 (1H, с), 7,10 (1H, д, J=8,8 Гц), 7,36 (1H, дд, J=8,8; 1,2 Гц), 7,49 (1H, д, J=1,2 Гц), 8,19 (1H, д, J=8,8 Гц), 8,31 (1H, дд, J=8,8; 0,6 Гц), 8,52 (1H, т, J=5,4 Гц), 8,97 (1H, д, J=0,6 Гц).
Пример 116
4-[(3-Хлор-4-метоксибензил)амино]-1-[2-(1-гидроксициклопентил)этил]-6-фталазинкарбонитрил гидрохлорид

690 мг 4-[(3-хлор-4-метоксибензил)амино]-1-[2-(1-гидроксициклопентил)-1-этинил]-6-фталазинкарбонитрила растворяют в 200 мл тетрагидрофурана, добавляют 50 мг 10% Pd-C и смесь перемешивают в течение 0,5 часа в атмосфере водорода. Реакционный раствор фильтруют через целит и фильтрат упаривают. Полученный остаток очищают колоночной хроматографией (наполнитель: силикагель), получая 400 мг 4-[(3-хлор-4-метоксибензил)амино]-1-[2-(1-гидроксициклопентил)этил]-6-фталазинкарбонитрила. Этот продукт обычным способом превращают в гидрохлорид.
1H-ЯMP (400 МГц, DMSO-d6) δ: 1,47-1,78 (8Н, м), 1,89-1,94 (2Н, м), 3,24-3,33 (2Н, м), 3,84 (3Н, с), 4,74 (2Н, д, J=4,4 Гц), 7,15 (1Н, д, J=8,4 Гц), 7,45 (1Н, дд, J=8,4; 2,0 Гц), 7,60 (1Н, д, J=2,0 Гц), 8,46 (1H, д, J=8,8 Гц), 8,55 (1Н, дд, J=8,8; 1,2 Гц), 9,40 (1H, уш.).
Приведенные далее соединения получают таким же образом.
Пример 117
4-[(3-Хлор-4-метоксибензил)амино]-1-(3-гидрокси-3-метилбутил)-6-фталазинкарбонитрил гидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,17 (6Н, с), 1,73-1,80 (2Н, м), 3,17-3,24 (2Н, м), 3,80 (3Н, с), 4,78 (2Н, д, J=4,4 Гц), 7,10 (1Н, д, J=8,4 Гц), 7,48 (1Н, дд, J=8,4; 1,8 Гц), 7,62 (1Н, д, J=1,8 Гц), 8,43 (1H, д, J=8,6 Гц), 8,51 (1Н, дд, J=8,6; 1,2 Гц), 9,63 (1H, уш.), 10,30 (1H, уш.).
Пример 118
1-(3-Амино-3-метилбутил)-4-[(3-хлор-4-метоксибензил)амино]-6-фталазинкарбонитрил дигидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 1,37 (6Н, с), 2,00-2,19 (2Н, м), 3,21-3,56 (2Н, м), 3,84 (3Н, с), 4, 78 (2Н, д, J=4,4 Гц), 7,15 (1H, д, J=8,4 Гц), 7,46 (1H, д, J=8,4 Гц), 7,61 (1H, с), 8,15-8,29 (4Н, м), 8,48 (1Н, д, J=8,8 Гц), 8,56 (1H, д, J=8,8 Гц), 9,38 (1H, уш.).
Пример 119
4-[(3-Хлор-4-метоксибензил)амино]-1-[3-(диметиламино)пропил]-6-фталазинкарбонитрил дигидрохлорид

1H-ЯМР (400 МГц, DMSO-d6) δ: 2,11-2,19 (2Н, м), 2,74 (3Н, с), 2,75 (3Н, с), 3,16-3,29 (4Н, м), 3,85 (3Н, с), 4,80 (2Н, д, J=5,2 Гц), 7,16 (1H, д, J=8,4 Гц), 7,48 (1H, дд, J=8,4; 2,0 Гц), 7,63 (1H, д, J=2,0 Гц), 8,49 (1H, д, J=8,4 Гц), 8,56 (1H, дд, J=8,4; 1,4 Гц), 9,47 (1H, д, J=1,4 Гц), 10,56 (2Н, уш.).
Пример 121
трет-Бутиловый эфир {1-[4-(3-хлор-4-метоксибензиламино)-6-цианофталазин-1-ил]-1,2,3,6-тетрагидропиридин-4-ил}уксусной кислоты
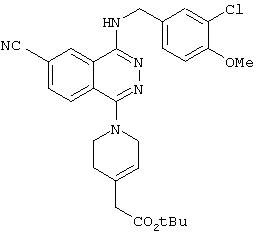
1H-ЯМР (400 МГц, СDСl3) δ (м.д.): 1,47 (9Н, с), 2,38-2,45 (2Н, м), 3,00 (2Н, с), 3,36 (2Н, т, J=6,0 Гц), 3,74 (3Н, с), 3,81 (2Н, с), 5,05 (2Н, с), 5,62 (1Н, с), 6,76 (1Н, д, J=8,4 Гц), 7,14-7,20 (1Н, м), 7,48-7,56 (2Н, м), 7,97-8,08 (2Н, м).
Пример 122
трет-Бутиловый эфир 4-трет-бутоксикарбонилметоксипиперидин-1-карбоновой кислоты

К двухфазной смеси трет-бутилового эфира 4-гидроксипиперидин-1-карбоновой кислоты (10,1 г) и гидросульфата тетрабутиламмония (3,40 г) в толуоле (100 мл) и 4 N NaOH (50 мл) добавляют трет-бутилбромацетат (14,6 г) и перемешивают 4 часа при комнатной температуре. Добавляют NaOH (15 г) и трет-бутилбромацетат (9,8 г) и перемешивают 13 часов 50 минут. Добавляют трет-бутилбромацетат (4,9 г) и перемешивают 2 часа при 35°С, а затем 24 часа 30 минут при 50°С. Реакционную смесь разбавляют этилацетатом и промывают водой и насыщенным раствором соли, органический слой сушат над сульфатом магния. После концентрирования остаток очищают колоночной хроматографией на силикагеле (гексан/этилацетат) с получением трет-бутилового эфира 4-трет-бутоксикарбонилметоксипиперидин-1-карбоновой кислоты (18,9 г), содержащего трет-бутилбромацетат.
1H-ЯМР (400 МГц, CDCl3) δ (м.д.): 1,49 (18Н, с), 1,50-1,61 (2Н, м), 1,80-1,89 (2Н, м), 3,04-3,12 (2Н, м), 3,50-3,59 (1Н, м), 3,73-3,81 (2Н, м), 3,99 (2Н, с).
Пример 123
трет-Бутиловый эфир пиперидин-4-илоксиуксусной кислоты гидрохлорид

К раствору трет-бутилового эфира 4-трет-бутоксикарбонилметоксипиперидин-1-карбоновой кислоты (11,0 г) в этилацетате (20 мл) добавляют 4 N хлористый водород в этилацетате (40 мл) и перемешивают 40 минут при комнатной температуре. Органический растворитель выпаривают при пониженном давлении и остаток суспендируют в эфире. трет-Бутиловый эфир пиперидин-4-илоксиуксусной кислоты гидрохлорид выделяют фильтрацией.
1H-ЯМР (400 МГц, ДМСО-d6) δ (м.д.): 1,40 (9H, с), 1,62-1,73 (2Н, м), 1,88-1,97 (2Н, м), 2,91-2,96 (2Н, м), 3,05-3,17 (2Н, м), 3,56-3,65 (1Н, м), 4,00 (2Н, с).
Пример 124
трет-Бутиловый эфир {1-[4-(3-хлор-4-метоксибензиламино)-6-цианофталазин-1ил]пиперидин-4-илокси}уксусной кислоты
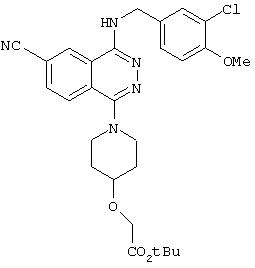
К раствору 1-хлор-4-(3-хлор-4-метоксибензиламино)-6-фталазин-6-карбонитрила (1,44 г) в NNP (10 мл) добавляют гидрохлорид трет-бутилового эфира пиперидинил-4-илоксиуксусной кислоты (3,02 г) и N,N-диизопропилэтиламин (3,10 г) и перемешивают 2 часа 20 минут при 170°С. Реакционную смесь разбавляют этилацетатом и промывают водой и насыщенным раствором соли, органический слой сушат над сульфатом магния. После концентрирования остаток очищают колоночной хроматографией на силикагеле (гексан/этилацетат) с получением трет-бутилового эфира {1-[4-(3-хлор-4-метоксибензиламино)-6-цианофталазин-1-ил]пиперидин-4-илокси}уксусной кислоты (625 мг).
1H-ЯМР (400 МГц, СDСl3) δ (м.д.): 1,49 (9Н, с), 1,50-1,60 (2Н, м), 1,75-1,86 (2Н, м), 2,00-2,08 (2Н, м), 3,04-3,12 (2Н, м), 3,40-3,48 (1Н, м), 3,72 (3Н, с), 4,00-4,04 (2Н, м), 5,15 (2Н, c), 6,74 (1Н, д, J=8,4 Гц), 7,58 (1Н, с), 7,63 (1Н, д, J=8,0 Гц), 7,99-8,07 (3Н, м).
Пример 125
трет-Бутиловый эфир {7-[4-(3-хлор-4-метоксибензиламино)-6-цианофталазин-1-ил]-7-азаспиро[3.5]нон-2-ил}уксусной кислоты

1H-ЯМР (400 МГц, СDСl3) δ (м.д.): 1,44 (9H, с), 1,46-1,54 (2Н, м), 1,70-1,76 (2Н, м), 1,79-1,84 (2Н, м), 2,04-2,12 (2Н, м), 2,36-2,38 (2Н, м), 2,58-2,64 (1Н, м), 3,04-3,10 (2Н, м), 3,12-3,18 (2Н, м), 3,78 (3Н, с), 4,00-4,04 (2Н, м), 4,94 (2Н, с), 6,76-6,80 (1Н, м), 7,40-7,46 (2Н, м), 7,94-8,08 (3Н, м).
Реферат
Изобретение относится к производным фталазина общей формулы (I) или их фармацевтически приемлемым солям, или гидратам, где R1 и R2 являются одинаковыми или отличаются друг от друга и каждый представляет атом галогена, С1-С4алкильную группу, которая может быть замещена атомом галогена, гидроксильную группу или С1-С4алкоксигруппу, которая может быть замещена атомом галогена, или цианогруппу; Х представляет цианогруппу, атом галогена, гидроксииминогруппу, необязательно О-замещенную С1-С4алкильной группой, или гетероарильную группу, выбранную из тиазолильной, тиенильной, пиразолильной, триазолилильной и тетразолильной групп, которые могут быть замещены С1-С4алкильной группой; Y представляет циклические аминогруппы i)- v), охарактеризованные в п.1 формулы изобретения; vi) этинильную или этильную группу, замещенную С1-С4алкильной группой, которая, в свою очередь, замещена рядом заместителей, указанных в п.1 формулы изобретения; vii) необязательно замещенную фенильную группу; viii) пиридильную или тиазолильную группу. Эти соединения ингибируют циклическую фосфодиэстеразу V типа и могут быть применены в качестве средств для эректильной дисфункции. Изобретение также относится к профилактическому и терапевтическому средству для эректильной дисфункции, которое содержит в качестве активного ингредиента вышеуказанные соединения изобретения. Объектом изобретения является и терапевтическое средство для эректильной дисфункции, которое включает в качестве активного ингредиента соединение формулы (VII), его фармакологически приемлемую соль или гидрат, где l’ представляет целое число от 1 до 3; R6 атом галогена, С1-С4алкильную группу, которая может быть замещена атомом галогена, или цианогруппу; Х1 представляет цианогруппу или атом галогена; Y1представляет группы i) - v), охарактеризованные в п.20 формулы изобретения. Кроме того, предложены способ получения отдельных представителей соединений общей формулы (I), фармацевтическая композиция для лечения эректильной дисфункции и способ лечения эректильной дисфункции. 6 с. и 21 з.п. ф-лы, 2 табл.

Формула




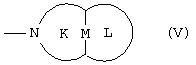

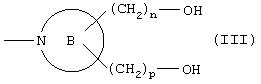




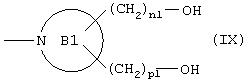

Комментарии