Триазинсодержащие анионные соединения и фармацевтическая композиция на их основе - RU2170731C2
Код документа: RU2170731C2
Чертежи

Описание
Настоящее изобретения относится к новым анионным соединениям, содержащим триазиновое кольцо, которые используются при лечении вирусных инфекций и, в частности, инфекций, вызванных респираторным синцитиальным вирусом человека (РСВЧ). Настоящее изобретение также относится к способам лечения вирусных инфекций и к фармацевтическим композициям для этого.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Респираторный синцитиальный вирус человека (РСВЧ) был впервые в 1956 году широко распространен по всему миру. Он является важной
причиной заболевания верхних и нижних дыхательных путей, вызывая болезнь у младенцев и у детей младшего возраста, давая в результате приблизительно 100000 госпитализаций и 5000 смертей в Соединенных
Штатах Америки ежегодно (Chanock, R.М., Kim, H.K., Brandt, C.D. and Parrott, R.H. 1982. Respiratory syncytial virus, pp. 471-489, in Viral Infections of Humans, Second Edition, A.S. Evans, editor
(Plenum Press, NY). Glezen, W.P., Taber, L.H., Frank, A.L. and Kasel, J. A. , 1986. Risk of primary infection and reinfection with respiratory syncytial virus. Am. J. Dis. Chil. 140; 543-546.
MacDonald, N.E., Hall, C.B. , Suffin, S.C., Alexson, C., Harris, P.J., and Manning J. A. 1982. Respiratory syncytial virus infection in infants with congenital heart disease. New England Journal of
medicine 307; 397-400.
Около 30% госпитализированных маленьких детей с острым респираторным заболеванием имеют инфекцию, вызванную респираторным синцитиальным вирусом человека. У детей более старшего возраста и у взрослых эта болезнь является менее острой. РСВЧ, по-видимому, является одной из главных причин (наравне с гриппом) заболеваемости и смертности у пожилых людей (Fleming, D.M., and Cross, K. W. , 1993. Respiratory syncytial virus or influenza? Lancet 342; 1507-1510).
Инфекции, вызванные респираторным синцитиальным вирусом, могут относиться ко всем сегментам дыхательных путей и обычно связаны с повышенной температурой, кашлем, насморком и утомляемостью, и диагностируются клинически как бронхит, воспаление бронхиол, пневмония, крупозное воспаление легких или вирусная инфекция. У детей более старшего возраста и у взрослых вирус обычно ограничивается репликацией в верхних дыхательных путях. Младенцы могут болеть в более острой форме, когда вирус распространяется в легкие. Заболевание легких может быть хроническим.
Первичное инфицирование респираторным синцитиальным вирусом происходит в начале жизни, обычно, в возрасте до 4 лет. Среди детей, болезнь, вызванная этим вирусом, имеет тенденцию происходить не менее раза в год в виде скорее резко выраженных приступов продолжительностью в несколько месяцев. Эпидемии являются резко ограниченными по времени, обычно в течение от 3 до 5 месяцев. При исследованиях в семьях, дети - учащиеся младших классов часто приносят вирус домой, инфицируя более младших членов семьи более серьезно, чем остальных членов семьи. Клинические последствия инфекции являются более серьезными при первом соприкосновении и становятся мягче у более старших индивидуумов, которые являются иммунологически защищенными.
Эффекты респираторного синцитиального вируса могут проявляться в виде от незаметной инфекции до острой пневмонии и смерти. Воспаление дыхательных путей является ответственным за большинство симптомов. Полное выздоровление в большинстве случаев происходит через одну- три недели с продуцированием антител, которые являются персистентными в течение всей жизни. В Соединенных Штатах Америки около 30% младенцев в возрасте одного года и 95% пятилетних детей имеют в крови антитела к респираторному синцитиальному вирусу. Повторная инфекция у младенцев постарше, у детей и взрослых с антителами дает в большинстве случаев слабо выраженные заболевания верхних дыхательных путей в форме простуды. У младенцев и детей младшего возраста инфекцию лечат рибавирином, противовирусным агентом широкого спектра действия. Использование этого вещества сильно ограничено из-за токсичности. Существует, следовательно, большая потребность в новом терапевтическом агенте для лечения инфекции, вызванной РСВЧ.
В патенте США 5359131 описаны стильбены сульфоновой кислоты, которые блокируют инфицирование клеток вирусом простого герпеса (ВПГ), вирусом иммунодефицита человека (ВИЧ) и цитомегаловирусом (ЦМВ).
Настоящее изобретение относится к новым анионным соединениям, содержащим триазиновое кольцо, которые обладают противовирусным действием, и, в частности, активностью в отношении респираторного синцитиального вируса человека (РСВЧ).
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее
изобретение относится к новым
соединениям, выбранным из соединений общей формулы I:

где
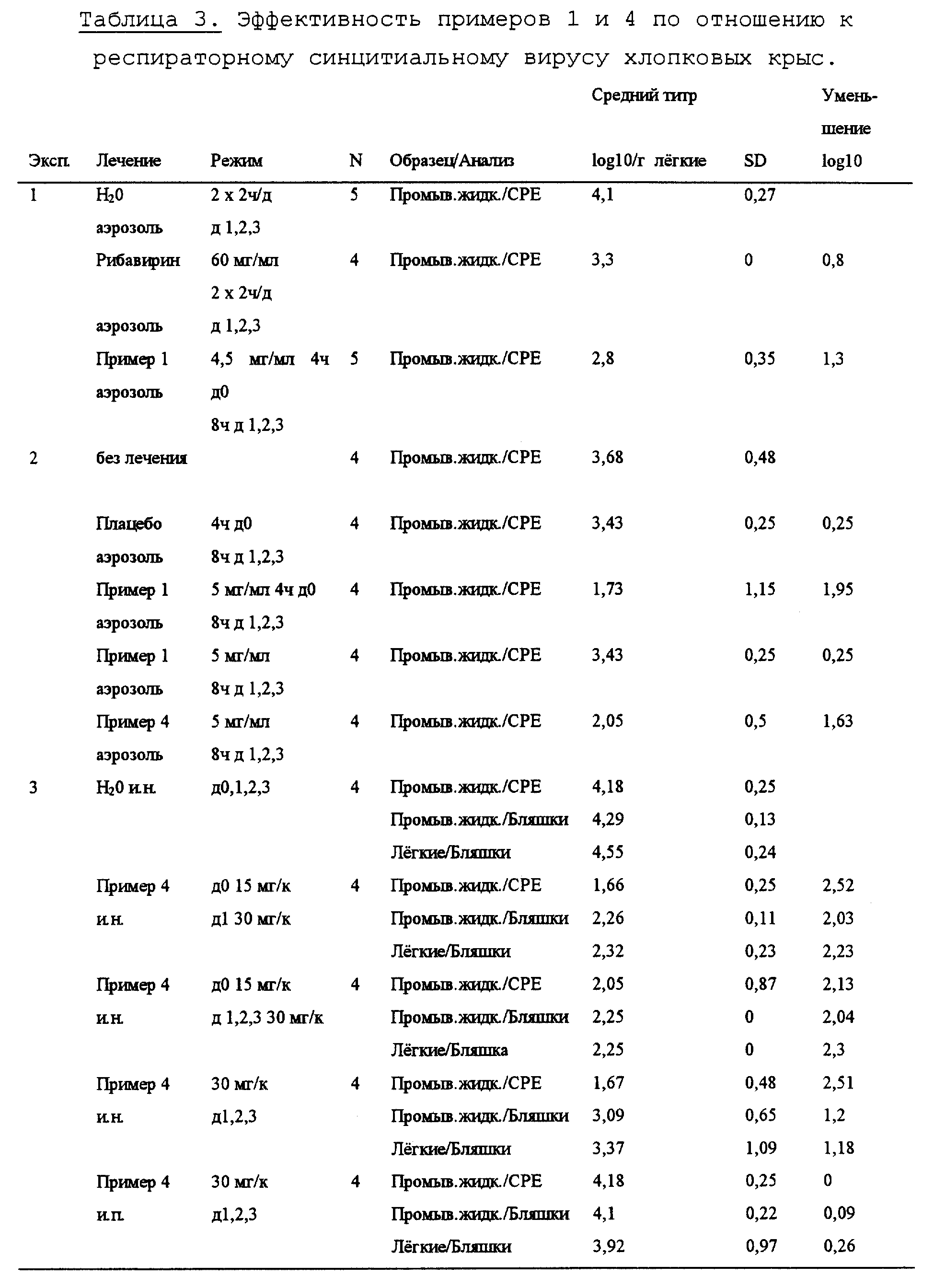
A представляет собой радикал, выбранный из группы, включающей
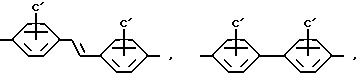

C' выбран из -SO3 H, -OSO3H, -OH или COOH;
В' является -NH, NR1 или 0;
R1 выбран из H, (C1-C6) низшего алкила с прямой или разветвленной цепью, где атомы углерода могут быть необязательно замещены Cl, Br, F, OH или CN;
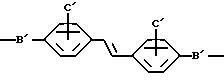
X представляет Cl, F или радикал

U' выбран из группы, включающей -SO2, -CO, -NC(O) или -NC (S);
W' выбран из радикалов:

Y представляет -(CH2)n-;
n равно 0-6;
m равно 0-2;
Z выбран из H, CH3, CF3, -CH2-(галоген), где галогеном является Cl, Br, F или I, -CH2OH, -COOH, -COO(C1-C6) низшего алкила с прямой или разветвленной цепью, -CONR2R2, СN или

и
R2, в каждом случае, независимо выбраны из H или (C1-C6) низшего алкила; или их фармацевтически приемлемые соли и эфиры.
Подразумевается, что в случаях, где m=0, пятичленные кольца указываются как W'.
Фармацевтически приемлемые соли соединений по настоящему изобретению являются такими солями, у которых катионы по существу не являются токсичными при дозе, вводимой для достижения желаемого эффекта, и не обладают независимой заметной фармакологической активностью. В качестве иллюстрации, эти соли включают соли щелочных металлов, например, Na или K; щелочноземельных металлов, таких как Ca или Mg; легких металлов группы IIIA, включая Al; и органических первичных, вторичных и третичных аминов и аммония. Предпочтительными являются соли натрия.
ПОДРОБНОЕ ОПИСАНИЕ
ИЗОБРЕТЕНИЯ
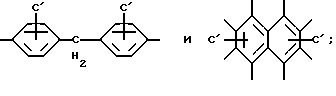
Среди группы соединений, определенных формулой I, некоторые подгруппы соединений являются широко предпочтительными. Широко предпочтительными являются такие соединения или их
фармацевтически приемлемые
соли, где A представляет
Особенно предпочтительными являются соединения, где
C'=-SO3H, B'=-NH, Y=-CH2-, Z=-CH2OH
Наиболее предпочтительными являются соединения, где
C'=-SO3H, B'=-NH, Y=-CH2CH2 -, Z=-CONH2
Наиболее высоко предпочтительными являются соединения, где A представляет
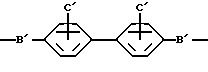
и C'=-SO3H, B=-NH, Y=-CH2CH2-, Z=-CONH2
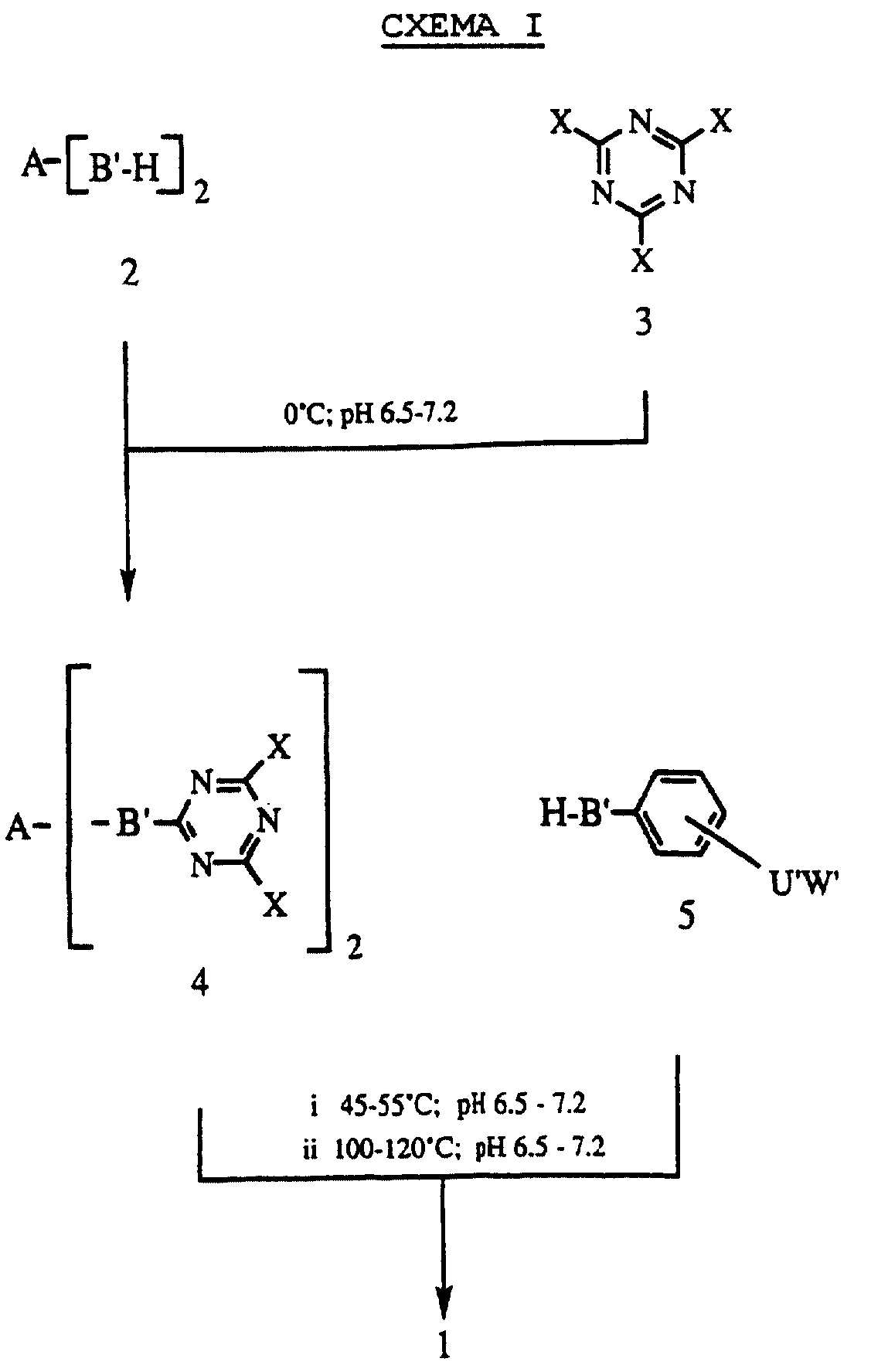
Новые соединения по настоящему изобретению могут быть получены в соответствии со следующими схемами. Обращаясь к Схеме 1, конденсация 2, где A и В' указаны выше, с триазинами, имеющими структуру 3, где X является Cl, F или Br, при температуре около 0oC и pH от около 6,5 до около 7,2 дает промежуточные соединения 4. Последующая реакция соединений формулы 4 с соединениями формулы 5, где U', В' и W' являются определенными выше, при температуре от около 45oC до около 55oC и pH 6,5-7,2, с последующим нагреванием при 100-120oC и при pH 6,5- 7,2 дает желаемые продукты формулы I, выше, которые указаны на схемах I и II как 1.
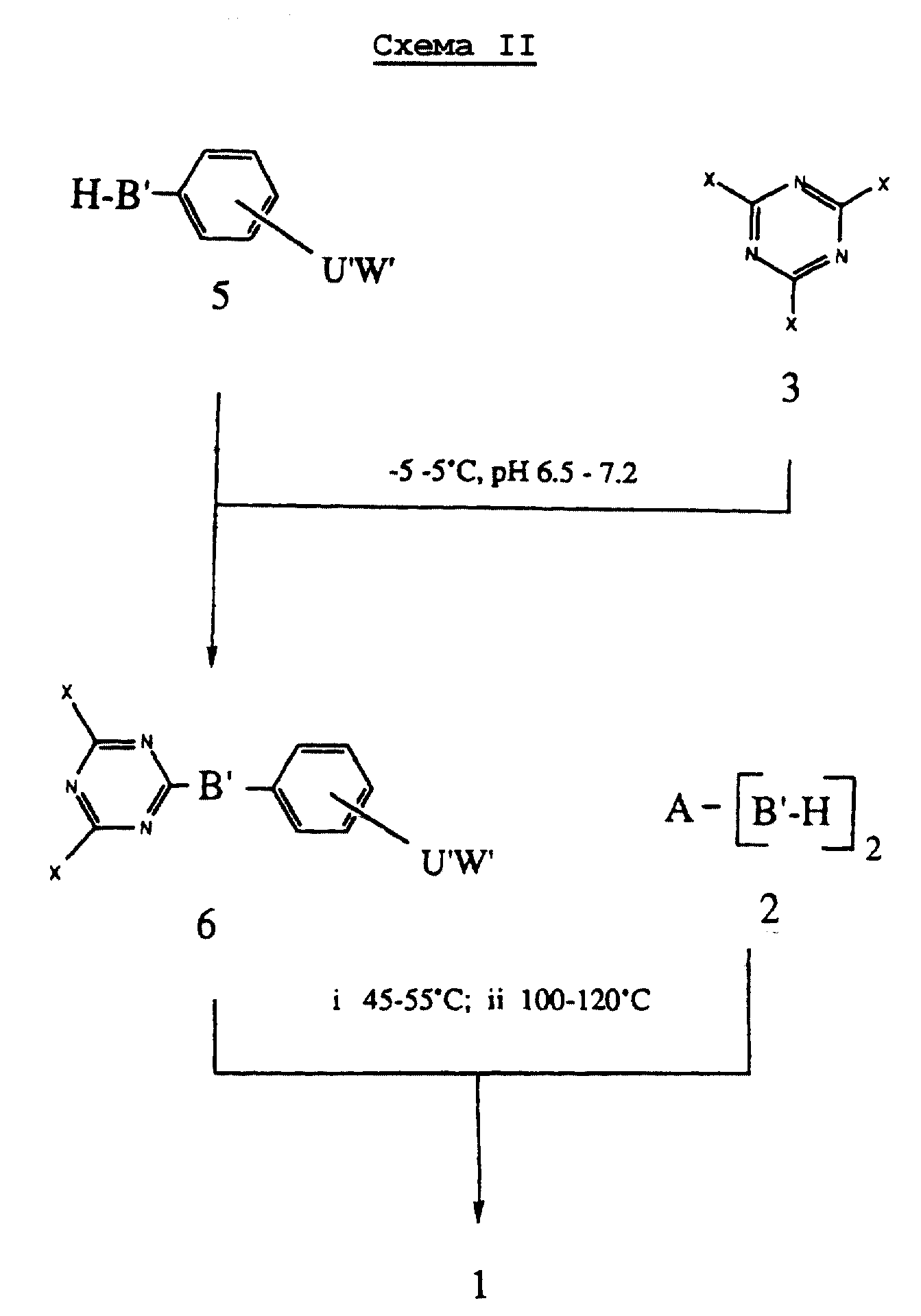
При альтернативном подходе к соединениям формулы I, как показано на Схеме II, взаимодействие триазина 3, где X является Cl, Br или F, с соединениями 5, где В' и W' указаны выше, при температуре от около -5 до около 5oC и pH 6,5- 7,2, дает продукты конденсации 6. Взаимодействие 6, где В' и W' указаны выше, и X является Cl, Br или F, с 2, где A и В' определены выше, при температуре от около 45oC до около 55oC и pH от около 6,5 до около 7,2, с последующим нагреванием от около 100oC до около 120oC и pH 6,5-7,2, дает 1.
Постадийная конденсация исходных соединений 2, как показано на Cхеме I, и 5, как показано на Схеме II, с триазинами 3, где X является Cl, Br или F, которые реагируют подобным образом в водных и в водно-органических средах в присутствии соответствующих оснований, таких как гидроксиды, карбонаты, фосфаты или бикарбонаты натрия или калия. Фосфатный буфер при pH 7,0 является предпочтительным.
Первая стадия конденсации проводится при pH в пределах от около 4 до около 8, предпочтительно при pH от около 6,5 до около 7,2 и при температурах от около -10oC до около 30oC, предпочтительно, от около -5oC до около 5oC. Обмен второго атома галогена в производных триазина осуществляется в том же диапазоне значений pH и при температуре от около 10 до около 70oC, предпочтительно при температуре от около 45 до около 55oC. Обмен третьего атома галогена у производных триазина осуществляется в том же самом диапазоне значений pH и при температурах от около 80oC до около 150oC, предпочтительно от около 100oC до 120oC.
Обмен второго или третьего атомов галогена у производных триазина формулы 6 (Схема II) осуществляется также в органической среде в присутствии органических оснований, таких как триалкиламины, включая триэтиламин, диизопропилэтиламин или N-(низший)алкилпиперидин.
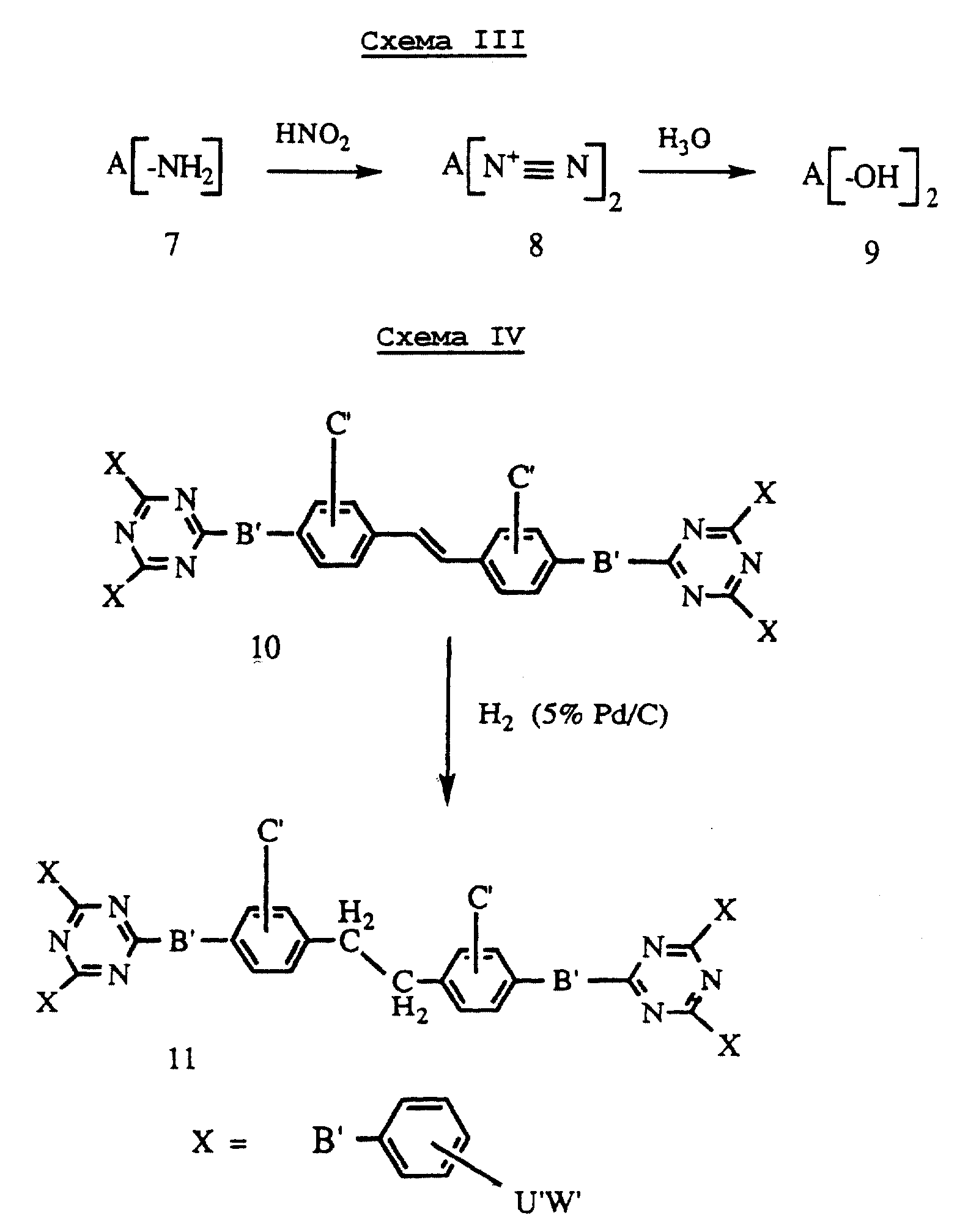
Исходные продукты для использования в общих процессах синтеза, описанных в Схемах I и II, являются коммерчески доступными или могут быть синтезированы в соответствии с H. Adkins, Е. F. Steinbring, Е. Pickering. J. Amer. Chem. Soc., v. 46, p.1917(1924), G. В. Pat. N 1194388 (June 10, 1970) и патент США N 5359131 (Октябрь 25, 1994). Исходные соединения Формулы 2, где В' является кислородом, могут быть получены из замещенного соединения формулы 2 (B'=-NH2), как показано на Схеме III.
Первичные ароматические амины 7, где A указано выше, подвергают взаимодействию с азотистой кислотой или с другими химическими реагентами (например, с органическим эфиром азотистой кислоты) для диазотирования первичного амина с получением диазониевых солей 8, которые подвергают гидролизу до соединений формулы 9, содержащих фенольные группы.
Согласно Схеме IV, соединения (10) стильбенового ряда могут быть преобразованы в соединения (11) дибензильного ряда в условиях каталитического восстановления (водород - Pd/C) или в подобных условиях восстановления, известных в данной области для преобразования замещенных стильбеновых соединений в дибензильные соединения. [Huang-Minlon, J. Amer. Chem. Soc. (1948) 70, 2802].
Соединения (12 и 13) формулы I с Z=-COOH могут быть получены путем основного гидролиза из соединений (14) при pH от 7,5 до 10,0, предпочтительно 8,0-8,5, и при температуре от 80 до 150oC, предпочтительно, от 100 до 120oC (Схема V).
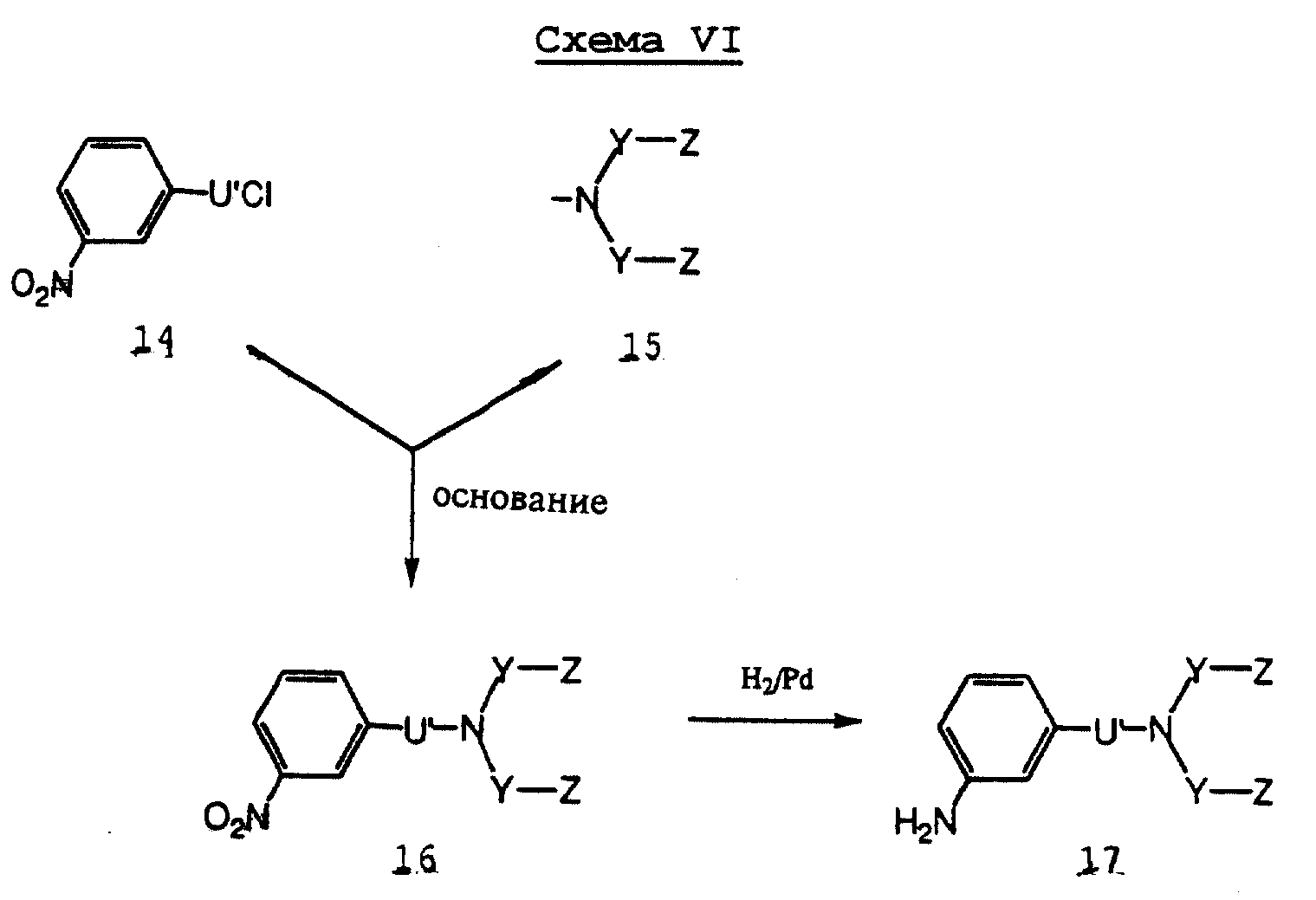
м-Аминобензамиды 17, где U' представляет -SO2 или -CO, Y и Z определены выше, синтезируют в соответствии со Схемой VI.
Имиды 15 преобразуют в м-нитросульфонаты 16, используя подходящий вариант способов амидирования или тосилирования (T.W. Greene, P.G.M. Wuts, Protective Groups in Organic Chemistry, JohnWiley & Sons, New York 1991, pp. 349-379). Нитросоединения 1б затем восстанавливают до аминосоединений 17 путем каталитической гидрогенизации (водород-Pd/C).
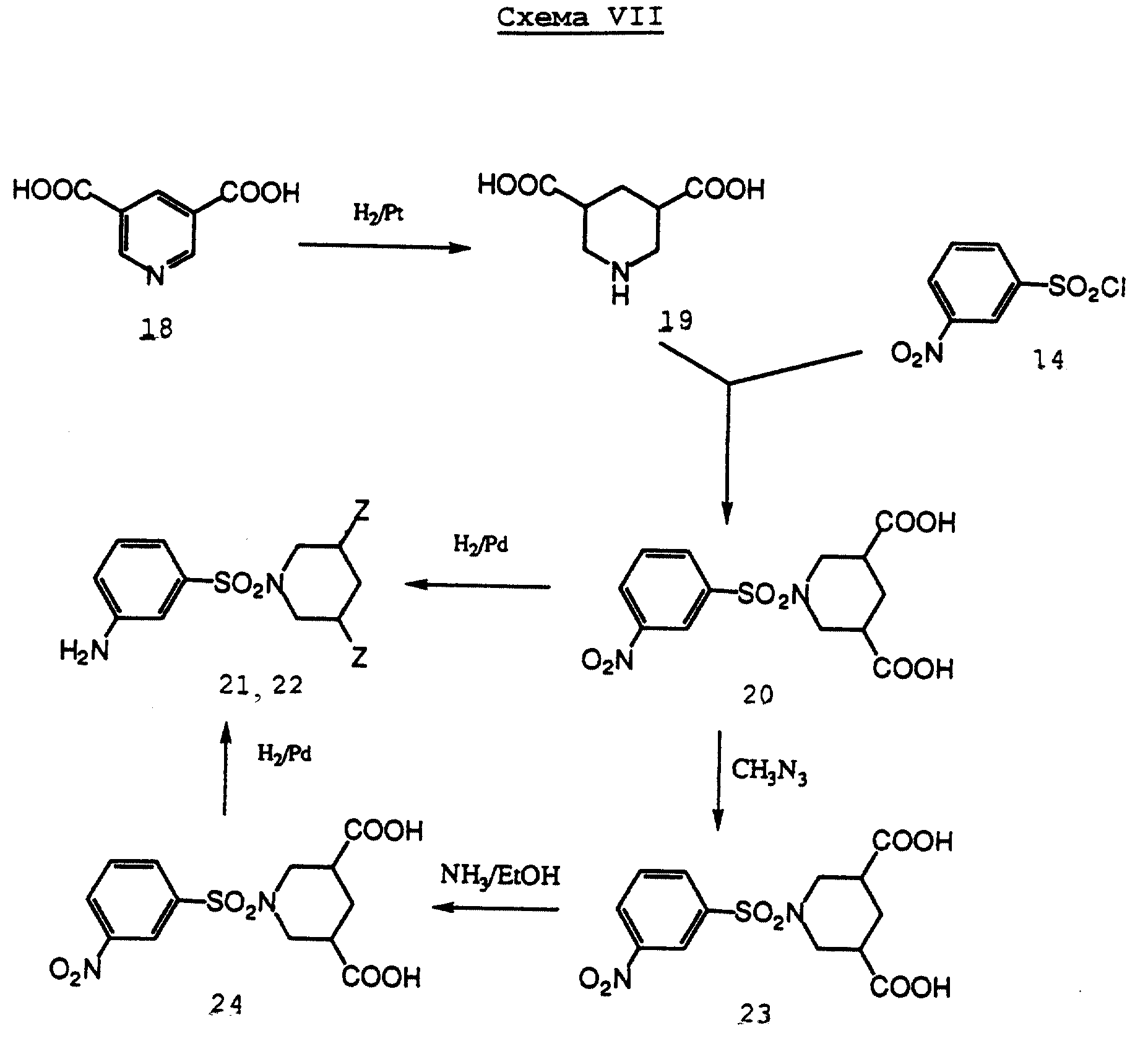
Пиперазиновые производные 21, 22, где Z является -COOH или -CONH2, синтезируют в соответствии со Схемой VII из 3,5-пиперидинкарбоновой кислоты 18. Восстановление ароматического кольца и м-нитротосилирование пиперидинового производного 19 ведет к соединению 20, которое либо восстанавливается до карбоксилсодержащего соединения 21, либо преобразуется в карбамоилсодержащее соединение 22 путем этерификации или аммонолиза.
Настоящее изобретение также включает способы лечения млекопитающего, предпочтительно, человека, прививку против вирусной инфекции, способы, включающие введение млекопитающему, страдающему от действия такой инфекции, одного или нескольких соединений по настоящему изобретению и/или одного или нескольких фармацевтически приемлемых солей соединений. Вирусные инфекции, излечиваемые с помощью соединений и способов по настоящему изобретению, включают такие инфекции, которые вносятся респираторным синцитиальным вирусом человека, вирусом простого герпеса, цитомегаловирусом человека и вирусом гриппа, в частности, паравирусом гриппа 3.
Соединения по настоящему изобретению могут вводиться нуждающемуся в них млекопитающему любым предписанным способом, включая интраназальный, оральный, наружный, трансдермальный, парентеральный и интраперитональный. Ясно, что лечение млекопитающего, предпочтительно, человека, будет требовать различных дозировок активного соединения и различных режимов лечения, в зависимости от различных факторов, включая возраст, пол, вес, общее состояние здоровья и степень заболевания данного индивидуума, дозировка и режим должны быть определены соответствующим лечащим врачом. Эффективное противовирусное количество соединений, которые должны вводиться, обычно будет находиться в пределах от около 0,5 мг/кг до около 500 мг/кг от веса тела животного в виде одной или нескольких дозировок в день. Дозировки предпочтительно даются в виде дробных доз от двух до четырех раз в день или в виде формы, обеспечивающей замедленный выход. Для наиболее крупных млекопитающих общая дневная доза составляет от около 1 до 100 мг, предпочтительно, от около 2 до 80 мг. Дозированные формы, пригодные для внутреннего использования, содержат от около 0,5 до 500 мг активного соединения в однородной смеси с твердым или жидким фармацевтически приемлемым носителем. Этот режим дозировки может быть установлен для обеспечения оптимальной терапевтической реакции. Например, несколько дробных доз могут вводиться ежедневно, либо доза может пропорционально уменьшена, если это показано необходимостью терапевтической ситуации. Соединения по настоящему изобретению могут вводиться с другими противовирусными агентами или без них.
Настоящее изобретение также включает фармацевтические композиции, которые могут быть использованы с этими способами лечения. Фармацевтические композиции могут содержать одно или несколько соединений по настоящему изобретению или их фармацевтически приемлемые соли и один или несколько фармацевтически приемлемых носителей, разбавителей, наполнителей, связующих, ароматизирующих агентов и так далее. Для орального введения, композиции, содержащие соединения по настоящему изобретению, включают твердые или жидкие композиции, такие как капсулы, драже, лепешки, пилюли, таблетки, порошки, сиропы, растворы, суспензии и эмульсии. Твердые формы могут быть инкапсулированы в твердых или мягких желатиновых капсул и могут содержать обычно используемые фармацевтически различные наполнители, волокна, вспомогательные вещества, разбавители, смазывающие вещества, разрыхлители, суспендирующие или стабилизирующие агенты, и связывающие агенты, включающие, но не ограничивающиеся ими, стеарат магния, лаурилсульфат натрия, микрокристаллическую целлюлозу, поливинилпирролидон, желатин, альгиновую кислоту, аравийскую камедь, цитрат натрия, комплексные силикаты, карбонат кальция, глицин, декстрин, сахарозу, сорбит, фосфат кальция, дикальцийфосфат, сульфат кальция, лактозу, каолин, маннитол, хлорид натрия, тальк, сухой крахмал (например, крахмал из кукурузы, картофеля или тапиоки) и порошкообразный сахар. Препараты также могут включать антиоксиданты, например, витамин Е, аскорбиновую кислоту, ВНТ и ВНА. Такие фармацевтические препараты могут, например, содержать от около 0,05 вплоть до около 90% активного ингредиента в сочетании с носителем, чаще, между около 5% и 60% по массе.
Подходящие наполнители для жидких пероральных препаратов включают такие разбавители, как вода и спирты, такие как этанол, бензиловый спирт и полиэтиленовые спирты, с поверхностно-активным веществом, суспендирующим агентом или эмульгирующим агентом или без них. Дисперсии могут быть приготовлены в глицерине, жидких полиэтиленгликолях или в их смесях в маслах. При обычных условиях хранения и использования, эти препараты содержат консерванты для предотвращения роста микроорганизмов.
Соединения по настоящему изобретению также могут вводиться парентерально в виде дозированной формы для инъекции в физиологически приемлемом разбавителе, таком как стерильные жидкости или их смеси с водой, включая воду, солевой раствор, водный раствор декстрозы и другие фармацевтически приемлемые растворы сахаров, спирты, такие как этанол, изопропанол или гексадециловый спирт, гликоли, такие как пропиленгликоль или полиэтиленгликоль, кетали глицерина, такие как 2,2-диметил-1,3- диоксолан-4-метанол, простые эфиры, такие как поли(этиленгликоль)400, фармацевтически приемлемое масло, жирная кислота, эфир жирной кислоты или глицерид, или ацетилированный глицерид жирной кислоты при добавлении или без добавления фармацевтически приемлемого поверхностно-активного вещества, такого как мыло или детергент, суспендирующего агента, такого как пектин, карбомеры, метилцеллюлоза, гидроксипропилметилцеллюлоза или карбоксиметилцеллюлоза, эмульгирующего агента или фармацевтических вспомогательных веществ. Во всех случаях, форма должна быть стерильной и должна быть жидкой до такой степени, чтобы обеспечивать легкое набирание в шприц. Она должна быть стабильной при условиях производства и хранения и должна быть защищена от разрушающего действия микроорганизмов, таких как бактерии и грибки.
Фармацевтически приемлемые масла, которые пригодны для использования в рассматриваемом препарате, включают такие масла из нефти, животного, растительного или синтетического происхождения, включая арахисовое масло, соевое масло, кунжутное масло, хлопковое масло, оливковое масло, подсолнечное масло, вазелин и минеральное масло. Жирные кислоты, которые могут использоваться, включают олеиновую кислоту, стеариновую кислоту и изостеариновую кислоту, при этом пригодные для использования эфиры жирных кислот могут включать этилолеат и изопропилмиристат. Подходящие мыла включают соли жирных кислот и щелочных металлов, аммония и триэтаноламина. Приемлемые детергенты включают катионные детергенты, например, диметилдиалкиламмоний галогениды, алкилпиридиний галогениды и алкиламиноацетаты, и анионные детергенты, такие как алкил, арил и олефинсульфонаты, алкил, олефин, эфир и моноглицеридсульфаты, и сульфосукцинаты. Пригодные для использования неионные детергенты могут включать оксиды жирных аминов, алканоламиды жирных кислот и полиоксиэтиленполипропиленовые сополимеры. Амфотерные детергенты могут включать алкил-бета-аминопропионаты и четвертичные соли 2-алкилимидазолина, и их смеси.
Парентеральные композиции по настоящему изобретению предпочтительно содержат от около 0, 5% до около 25% по весу активных соединений, описанных здесь, в растворе. Парентеральные препараты в форме стерильных растворов или суспензий для инъекций будут также предпочтительно содержать от около 0,05% до около 5% суспендирующего агента в изотонической среде. Могут быть добавлены буферы и консерванты. Может быть также добавлено соответствующее поверхностно-активное вещество. Эти поверхностно-активные вещества могут включать эфиры полиэтиленсорбитан жирных кислот, такие как сорбитанмоноолеат, и высокомолекулярные аддукты этиленоксида с гидрофобным основанием, получаемые путем конденсации пропиленоксида с пропиленгликолем.
Фармацевтические композиции по настоящему изобретению также включают композиции, пригодные для наружного и трансдермального употребления. Такие препараты могут включать накожное нанесение соединений по настоящему изобретению в системе растворителей, предназначенной для усиления трансдермального поглощения, включая этанол или диметил- сульфоксид, вместе или без наполнителей. Предпочтительно, эти рассматриваемые наружные и трансдермальные композиции включают добавление соединений по настоящему изобретению в повязку из резервуара и пористой мембраны или в пластырь из разнообразных твердых матриц. Трансдермальные пластыри такого типа описаны в патентах США NN 3742951, 3797494, 3996934, 4031894, 4573996 и 4956171.
Интраназальные препараты и лекарства по настоящему изобретению могут вводиться в виде капель в нос или в виде интраназального спрея, такого как ингалятор. Препараты могут включать любое сочетание фармацевтически приемлемых компонентов, которые являются пригодными для использования в интраназальном препарате, включая стерильную воду, солевой раствор, стабилизирующий агент, такой как полиэтиленгликоль, имеющий молекулярный вес в диапазоне от около 200 до 7500, или их смеси.
Соединения по настоящему изобретению могут быть использованы для лечения вирусных инфекций либо профилактического, либо терапевтического. Для профилактического использования соединения может быть введено интраназально в виде спрея, или в виде капель ежедневно для предотвращения инфицирования вирусом, в частности, РСВ. Продолжительность времени, в течение которого должно проводиться лечение, будет отражать вероятность инфицирования конкретным вирусным агентом и может зависеть от эпидемической ситуации и факторов риска, которым подвергается данный пациент. Соединения, вводимые таким путем, могут быть в различных концентрациях от 0,1 до 30 мг/мл, получаемый объем изменяется от 0,1 до 1 мл/ноздря. Альтернативно, соединения могут вводиться в организм путем перорального и внутривенного дозирования. Для терапевтического использования соединения могут вводиться местно в легкие в виде аэрозоля или могут вводиться системно путем перорального или внутривенного дозирования. Такое дозирование может вводиться в течение периода времени, необходимого для подавления вирусной инфекции.
Соединения по настоящему изобретению и их получение станет понятным далее с помощью последующих неограничивающих примеров. Промежуточные продукты реакций, продукты и возможные побочные продукты анализируют с помощью тонкослойной хроматографии (ТСХ) на силикагеле, с использованием пропан-2- ола/этилацетата/4% аммония в воде (8:1:1, объем/объем) в качестве растворителя и высокоэффективную жидкостную хроматографию с обращенной фазой (ВЭЖХ - ОФ) [колонка: Vydac C18 (4,6 мм х 25 см), 5 мм; подвижная фаза: A - ацетонитрил, B - 0,1 М аммонийацетат в воде (pH 5,5), C-метанол; градиент: от смеси A-B-C (20: 65:15, объем/объем) до смеси A-B-C (20:55:25, объем/объем) в течение 10 минут] . Препаративная ВЭЖХ-ОФ производится на системе для градиентной ВЭЖХ Rainin, с использованием препаративной колонки Vydac C18 Peptide/Protein (10 мм, 22 мм х 25 см); подвижная фаза: A - метанол/0,1 М аммонийацетат в воде (pH 5,5) (1:4, объем/объем), B - метанол/ацетонитрил (1:4, объем/объем); градиент: 18-32% B в течение 10 минут.
Пример 1
Динатриевая соль 4,4'-бис[4,6-ди[3-аминофенил-N,
N-бис(2- карбамоилэтил)сульфонилимино] -1,3,5-триазин-2-иламино] - стильбен-2,2'-дисульфоновой кислоты
Раствор хлорангидрида циануровой кислоты (3,87 г, 21 ммоль) в диоксане (25 мл)
добавляют
к фосфатному буферу (100 мл, 0,3 М, pH 7) с перемешиванием при температуре -3 - 0oC.
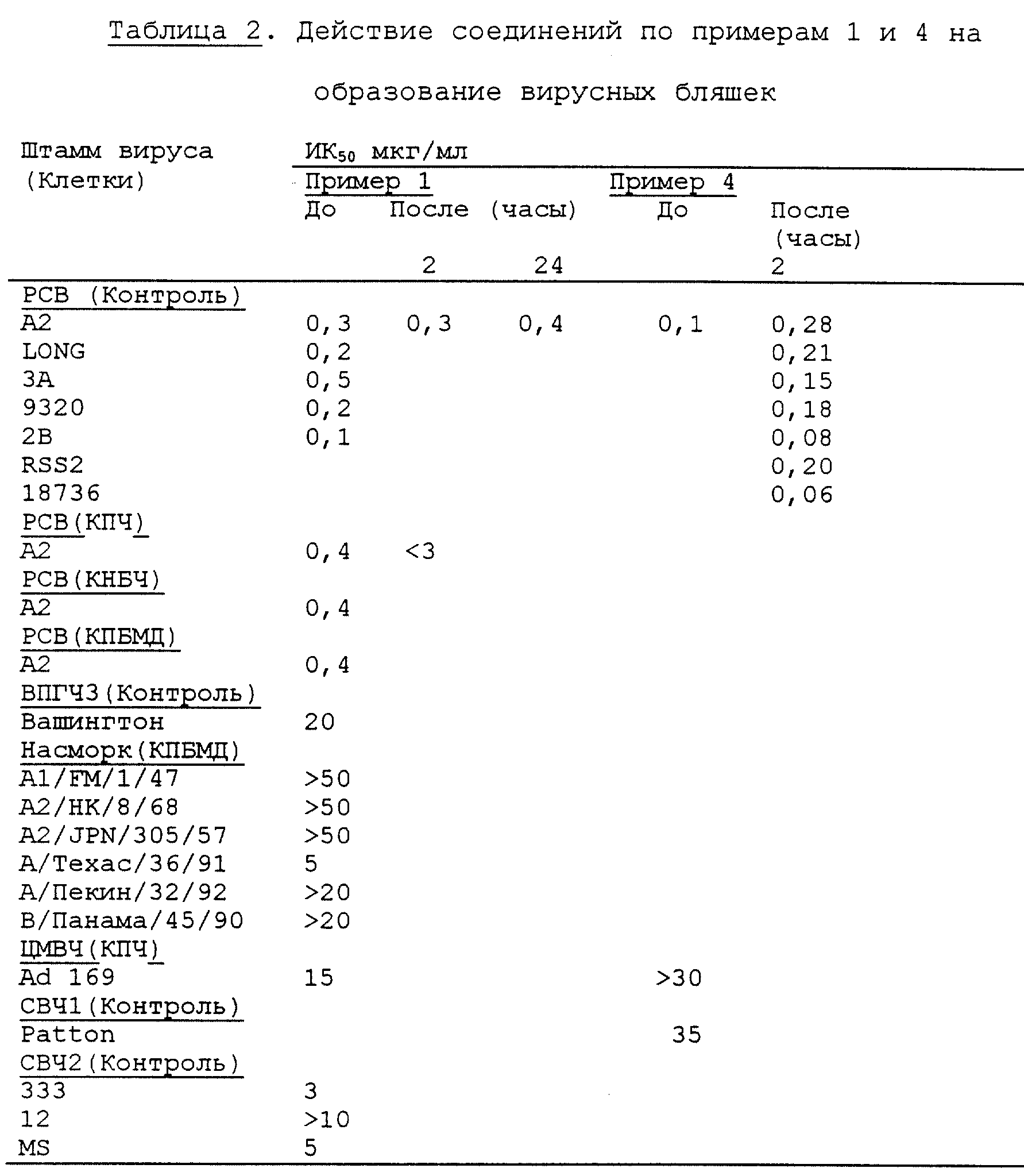
Затем добавляют раствор 4,4'-диаминостильбен-2,2'- дисульфоновой кислоты (3, 70 г, 10 ммоль) в 1 н. NaOH (20 мл) в течение 20-минутного периода и pH поддерживают при 6,5-7,2 путем добавления 1 н. NaOH. Перемешивание продолжают в течение последующего 1 часа при той же температуре и pH, при этом реакцию контролируют на степень завершенности с помощью аналитической ВЭЖХ (выход 95%). Добавляют раствор 3-аминофенил-N,N-бис(2-карбамоилэтил)сульфонилимина (13,20 г, 42 ммоль) (Патент Великобритании 1194388; Июль 10, 1970) в диметилсульфоксиде (ДМСО) (100 мл) в течение 20-минутного периода и температуру поднимают до 50oC. Перемешивание продолжают в течение 2,5 часов при той же температуре, а затем в течение 40 часов при 100-110oC, поддерживая pH при 6,6-7,2 путем добавления 1 н. NaOH. Как только реакция завершается, что определяют с помощью аналитической ВЭЖХ (или ТСХ), смесь охлаждают до 20oC и подкисляют 5,6 н. хлористоводородной кислотой до pH 2. Добавляют хлорид натрия (60 мл, 4 М) и выпавший в осадок продукт фильтруют, повторно растворяют в минимальном объеме воды путем добавления 1 н. NaOH до pH 7 и повторно высаживают путем добавления хлорида натрия. Выпавший осадок фильтруют, промывают холодной водой (20 мл), пропан-2-олом (40 мл), ацетоном (60 мл) и сушат в вакууме при 50oC. Выход 13,0 г (72%); т.пл. > 250oC, разл. ; УФ (вода): 273 нм ( logε 5,11), 350 нм ( logε 4,89); MC(ES) (m/z): М-2 887,9; MB 1821,2.
Пример 2
Динатриевая соль 4,4'-бис[4,6-ди[3-аминофенил-N, N-бис(2- карбамоилэтил)сульфонилимино] -1,3,
5-триазин-2-иламино] - стильбен-2,2'-дисульфоновой кислоты
Суспензию динатриевой соли 4,4'-диаминостильбен-2,2'- дисульфоновой кислоты (1,21 г, 2,92 ммоль) и 2-хлор-4,6-ди [3-аминофенил-N,
N-бис (2- карбамоилэтил) сульфонилимино] -1,3,5-триазина (пример 6) (4,47 г, 6,44 ммоль) в сульфолане (70 мл) и диизопропилэтиламине (1,5 мл) нагревают в запаянной тонкостенной стеклянной пробирке до
115oC. Нагревание продолжают в течение 40 часов. Как только реакция завершается, что определяют с помощью аналитической ВЭЖХ (или ТСХ), смесь
охлаждают до 30oC, добавляют 1 н.
NaOH (6,6 мл) и продукт высаживают путем добавления пропан-2-ола (200 мл). Выпавший в осадок фильтруют, промывают ацетоном (30 мл) и повторно растворяют в минимальном объеме воды, и повторно
высаживают путем добавления этанола. Выпавший осадок после фильтрования промывают эфиром (30 мл) и сушат в вакууме при 50oC. Выход 4,84 г (91%).
Пример 3
Динатриевая соль 4,4'-бис[4,6-ди[3-аминофенил-N, N-бис(2- карбамоилэтил)сульфонилимино] -1,3,5-триазин-2-иламино] -стильбен-2,2' -дисульфоновой кислоты
Указанное в заголовке соединение
получают, используя общие условия примера 1, где 2,4,6-трифтор-1,3,5-триазин (304 мг, 2,25 ммоль) взаимодействует с 4,4'-диаминостильбен-2,2'-дисульфоновой кислотой (455 мг, 1,10 ммоль) в течение 1
часа, а затем с 3-аминофенил-N,N-бис(2-карбамоилэтил)сульфонилимином (1,45 г, 4,62 ммоль) (Патент Великобритании 1194388; Июнь 10, 1970), с последующей очисткой и получением желаемого соединения (1,
21
г, 61%).
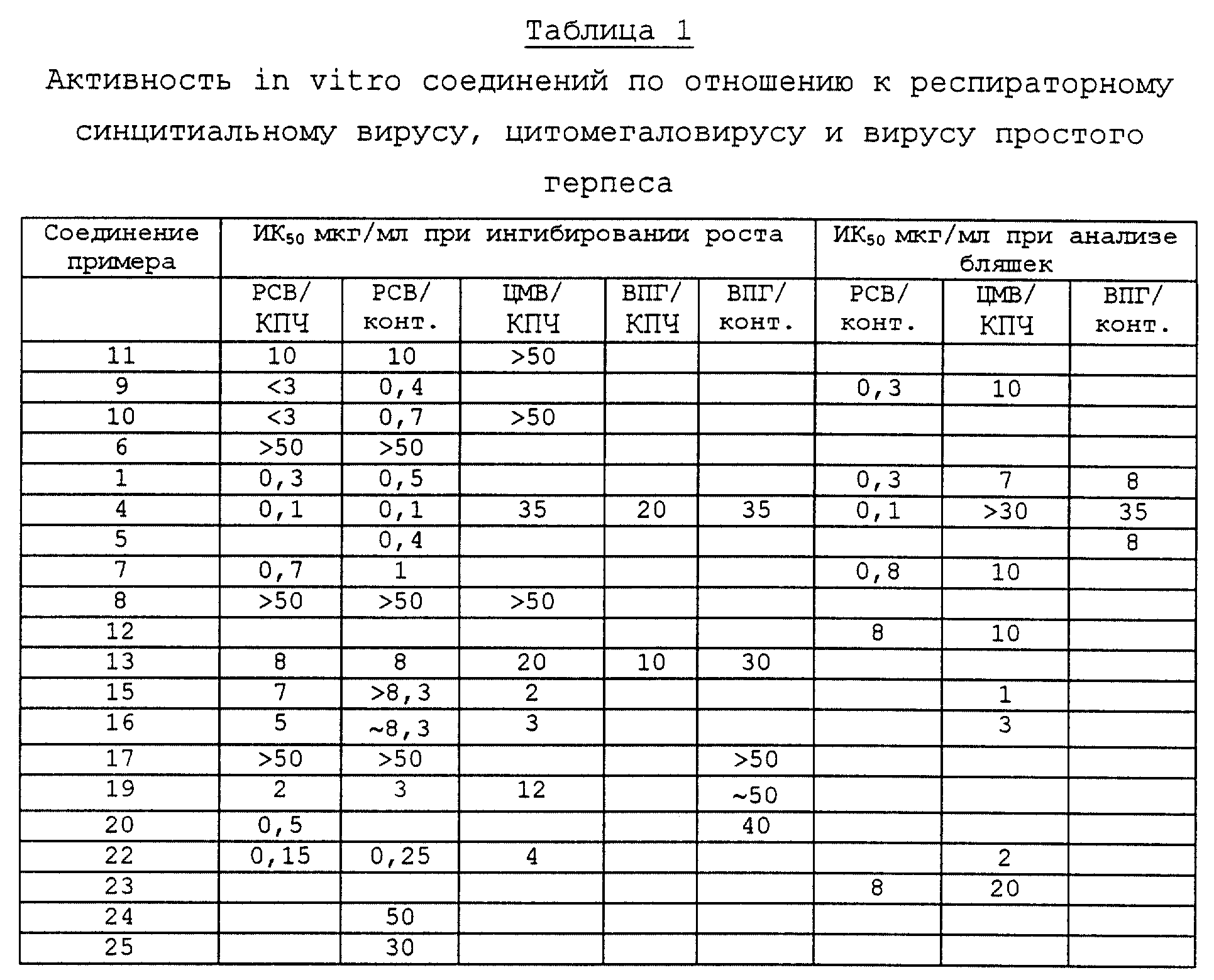
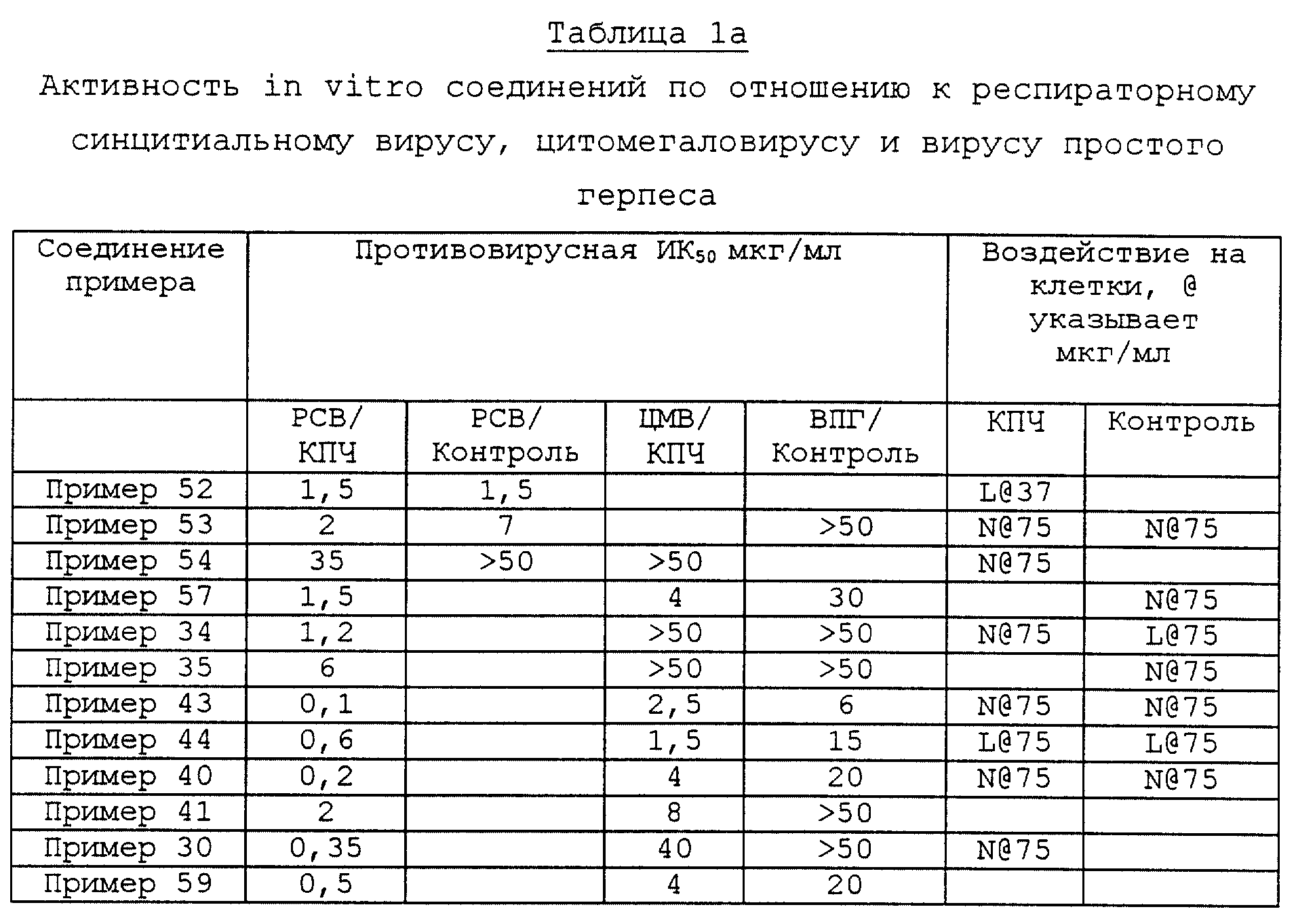
Соединения, синтезированные с помощью способов по примерам 1-3, являются идентичными, как показано ВЭЖХ, УФ и масс-спектрами.
Пример 4
Динатриевая
соль 4,4'-бис[4,6-ди[3- аминофенил-N, N-бис(2-карбамоилэтил)сульфонилимино]-1,3,5- триазин-2-иламино]-бифенил-2,2'-дисульфоновой кислоты
Указанное в заголовке соединение получают в
соответствии со способом по примеру 2, используя динатриевую соль 4,4'- диаминобифенил-2,2'-дисульфоновой кислоты (1,02 г, 2,62 ммоль) и 2-хлор-4,6-ди[3-аминофенил-N,
N-бис(2-карбамоилэтил)- сульфонилимино] -1,3,5-триазин (пример 6) (4,26 г, 5,76 ммоль) в 60 мл ДМСО-сульфолане (1:3, объем/объем) и диизопропилэтиламине (1,2 мл). Продукт получают в виде бесцветного
твердого вещества (3,90 г, 83%); т.пл. >250oC, разл.; УФ (вода): 272 нм (logε 4,86); MC(ES) (m/z): М-2 874,1; MB 1794,2.
Пример 5
Динатриевая соль 4,4'-бис[4,6-ди[3-аминофенил-]-N,N-бис(2- гидроксиэтил)сульфонилимино]-1,3,5-триазин-2-иламино]- стильбен-2,2'-дисульфоновой кислоты
Указанное в заголовке соединение
получают
в соответствии со способом, используемым при осуществлении примера 2, применяя 4,4'-диаминостильбен-2,2'-дисульфоновую кислоту (28 мг, 0,075 ммоль) и 95 мг (0,15 ммоль) 2-хлор-4,
6-ди[3- аминофенил-N,
N-бис(3-гидроксиэтил)сульфонилимино]-1,3,5- триазин (пример 6) в сульфолане (20 мл) и диизопропилэтиламин (35 мл) при 110oC в течение 18 часов. Охлажденную реакционную
смесь смешивают с
деионизированной водой (40 мл) и раствор сырого продукта очищают путем препаративной ВЭЖХ-ОФ. Фракции, содержащие желаемый продукт, объединяют, органические растворители выпаривают
в вакууме (10 мм
рт.ст.) при 30oC, и продукт концентрируют, обессоливают и отделяют на октадециловом (C18) картридже (900 мг, получен от Burdick & Jackson). Картридж промывают водой
(30 мл), и
продукт повторно экстрагируют метанолом (50 мл). Выпаривание метанола дает 12 мг (11%) желаемого продукта; т. пл. >250oC, разл.; УФ (вода): 273 нм (logε 4,97); 350
нм
(logε 4,81); MC(ES) (m/z): М-2 779,0; MB 1604,0.
Пример 6
2-Хлор-4,6-ди[3-аминофенил-N, N-бис(2-карбамоилэтил)- сульфонилимино]-1,3,5-триазин
Раствор хлорангидрида циануровой кислоты (4,2 г, 22,7 ммоль) в диоксане (55 мл) добавляют по каплям, перемешивая, к фосфатному буферу (120 мл, 0,3 М, pH 7) и измельченному льду (10 г) при температуре
-2o - 0oC. К полученной в результате мелкодисперсной суспензии добавляют по каплям в течение 30 минут раствор 3-аминофенил-N,N-бис(2-карбамоилэтил)сульфонилимина (15,0 г, 47,8
ммоль) (Патент Великобритании 1194388; Июнь 10, 1970) в N,N-диметилформамиде (125 мл) и pH поддерживают при 6,5-7,2 путем добавления 1 н. NaOH. Перемешивание продолжают в течение еще 1 часа (0oC, pH 7,0) и температуру поднимают до 55oC. Перемешивание продолжают в течение 2,5 часа, при этом реакцию контролируют на степень завершенности с помощью аналитической ВЭЖХ (или
ТСХ). Как только реакция завершается, что определяется с помощью аналитической ВЭЖХ (или ТСХ), смесь охлаждают до 0oC, добавляют воду (160 мл), и выпавший в осадок продукт фильтруют,
промывают холодной водой (50 мл), ацетоном (50 мл) и сушат в вакууме при температуре 4 0oC. Выход 14,5 г (86%); т. пл. > 250oC, разл.; УФ (ДМСО): 282 нм ( logε 4,
77); MC(Cl) (m/z): MH 740,1.
Пример 7
Динатриевая соль 4-[4,6-ди[3-аминофенил-N,N-бис(2-карбамоилэтил) сульфонилимино] -1,3,5-триазин-2-иламино]
-4'-[4-хлор-6- [3-аминофенил-N,
N-бис(2-карбамоилэтил)сульфонилимино] -1,3,5- триазин-2-иламино] стильбен-2,2'-дисульфоновой кислоты
Раствор хлорангидрида циануровой кислоты (205 мг, 1,12
ммоль) в диоксане (1,5 мл)
добавляют к фосфатному буферу (10 мл, 0,3 М, pH 7) при перемешивании при температуре -3-0oC. Добавляют раствор динатриевой соли 4,4'-диаминостильбен-2,
2'-дисульфоновой кислоты (225 мг, 0,54
ммоль) в фосфатном буфере (3 мл), и поддерживают pH 6,5-7,2 путем добавления 1 н. NaOH. Перемешивание продолжают в течение еще 1 часа при той же температуре и
pH, при этом реакцию контролируют на
степень завершенности с помощью аналитической ВЭЖХ (выход 97%). Добавляют раствор 3-аминофенил-N,N-бис(2-карбамоилэтил)- сульфонилимина (700 мг, 2,23 ммоль) в N,
N-диметилформамиде (10 мл) в течение 10
минут, и температуру поднимают до 60oC. Перемешивание продолжают в течение 3 часов при той же температуре и 20 часов при температуре 100-110oC, поддерживая pH 6,6-7,2 путем
добавления 1 н. NaOH. Как только реакция завершается, что определяют с помощью аналитической ВЭЖХ (или ТСХ), смесь охлаждают до 20oC и подкисляют 5,6
н. соляной кислотой до pH 2, добавляют
хлорид натрия (5 мл, 4 М) и выпавший в осадок продукт фильтруют, промывают холодной водой (2 мл) и сушат в вакууме при температуре 40oC. Две порции
раствора сырого продукта (около 1 г) в
деионизированной воде (250 мл) очищают по отдельности с помощью препаративной ВЭЖХ-ОФ. Фракции, содержащие желаемый продукт, объединяют, органические
растворители выпаривают в вакууме (10 мм рт.ст. )
при температуре 30oC и продукт концентрируют, обессоливают и отделяют на октадециловом (C18) картридже (900 мг, получен от Burdick &
Jackson). Картридж промывают водой (30 мл), и
продукт повторно эктрагируют метанолом (50 мл). Упаривание метанола приводит к 268 мг (32%) желаемого продукта; т.пл. >250oC, разл. ;
УФ (вода): 273 нм ( logε 4,83); 350 нм (
logε 4,44); MC(ES) (m/z): М-2 749,15; MB 1544,3.
Пример 8
Динатриевая соль 4,4'-бис[4-хлор-6-[3-аминофенил-N,
N-бис(2- карбамоилэтил)сульфонилимино] -1,3,
5-триазин-2-иламино]- стильбен-2,2'-дисульфоновой кислоты
Раствор хлорангидрида циануровой кислоты (0,91 г, 4,95 ммоль) в диоксане (8 мл)
добавляют к фосфатному буферу (30 мл, 0,3 М pH 7) при
перемешивании при температуре -3 - 0oC.
Добавляют раствор динатриевой соли 4,4'-диаминостильбен- 2,2'-дисульфоновой кислоты (1,00 г, 2,41 ммоль) в деионизированной воде (9 мл), и pH поддерживают при 6,5-7,2 путем добавления 1 н. NaOH. Перемешивание продолжают в течение еще 1 часа при той же температуре и pH, при этом реакцию контролируют на степень завершенности с помощью аналитической ВЭЖХ (выход 98%). Добавляют раствор 3-аминофенил-N,N-бис(2-карбамоилэтил)- сульфонилимина (1,57 г, 5,0 ммоль) в N, N-диметилформамиде (25 мл) в течение 10 минут и температуру поднимают до 50oC. Перемешивание продолжают в течение 6 часов при той же температуре, поддерживая pH при 6,6-7,2 путем добавления 1 н. NaOH. Как только реакция завершается, что определяют с помощью аналитической ВЭЖХ (или ТСХ), смесь охлаждают до 0oC и подкисляют 5,6 н. соляной кислотой до pH 2. Добавляют хлорид натрия (5 мл, 4 М) и выпавший в осадок продукт фильтруют, промывают холодной водой (8 мл), ацетоном (20 мл) и эфиром (20 мл) и сушат в вакууме при температуре 40oC. Выход 2,37 г (80%), т.пл. > 300oC, разл. ; УФ (вода): 273 нм ( logε 4,57); 350 нм ( logε 4,42); MC(ES) (m/z): М-2 610,1; MB 1266,2.
Пример 9
Динатриевая соль 4-[4,6-ди[3-аминофенил-N,N-бис(2-карбамоилэтил)
сульфонилимино] -1,3,5-триазин-2-иламино] -4'-[4-[3-аминофенил-N,N-бис (2-карбамоилэтил)сульфонилимино]
-6-[3-аминофенил-N-(2-карбамаилэтил)- N'-(3-пропионовая кислота)]-1,3,
5-триазин-2-иламино]стильбен-2,2' -дисульфоновой кислоты и
ПРИМЕР 10
Динатриевая соль 4-[4,6-ди[3-аминофенил-N,
N-бис(2- карбамоилэтил)сульфонилимино] -1,3,5-триазин-2-иламино]
-4'-[4-[3- аминофенил-N-N-бис(2-карбамоилэтил)сульфонилимино] -6-[3- аминофенил-N,N-бис(3-пропионовая кислота)]-1,3,
5-триазин-2- иламино]стильбен-2,2'-дисульфоновой кислоты
К раствору
соединения по примеру 1 (200 мг, 0,11 ммоль) в деионизированной воде (20 мл) добавляют 1 н. NaOH (300 мл) и смесь
нагревают до кипения. Реакционную смесь оставляют нагреваться в течение 3 часов,
охлаждают до 0oC и подкисляют 5,6 н. соляной кислотой до pH 2. Добавляют хлорид натрия (10 мл, 4 М) и
выпавший в осадок продукт фильтруют, промывают холодной водой (2 мл) и сушат в вакууме
при температуре 40oC. Раствор сырого продукта (около 180 мг) в дистиллированной воде (125 мл) очищают
путем препаративной ВЭЖХ-ОФ. Фракции, содержащие желаемый продукт (пример 9),
объединяют, органические растворители выпаривают в вакууме (10 мм рт.ст.) при температуре 30oC и продукт
концентрируют, обессоливают и отделяют на октадециловом (C18) картридже (900 мг,
получен от Burdick & Jackson). Картридж промывают водой (30 мл) и продукт повторно эктрагируют метанолом (50
мл). Выпаривание метанола дает 24 мг (12%) желаемого продукта; т.пл. >250oC, разл.; УФ (вода): 273 нм ( λογε 5,02); 350 нм ( logε 4,76); MC(ES)
(m/z): M-2 888,3; MB 1822,6.
Второй продукт (пример 10) выделяют из другой фракции, содержащей желаемое соединение (пример 10), путем ВЭЖХ-ОФ-разделения, используя при этом такие же методы концентрирования, обессоливания и отделения на октадециловом (C18) картридже, как описанные в примере 9. Выход 18 мг (9%), т.пл. >250oC, разл. ; УФ (вода): 273 нм ( logε 4,92); 350 нм ( logε 4,69); MC(ES) (m/z): М-2 889,2; MB 1824,4.
Пример 11
Динатриевая соль 4,4'-бис[4,6-ди[3-аминофенил-N,
N-бис(2- карбамоилэтил)сульфонилимино] -1,3,5-триазин-2-иламино] - бибензил-2,2'-дисульфоновой кислоты
Раствор соединения по примеру 1 (30 мг) в 30 мл воды-метанола (1:1, объем/объем)
перемешивают с палладием на угле (10% Pd) в атмосфере водорода в течение 5 дней. Реакционную смесь фильтруют и
растворитель выпаривают. Продукт отделяют путем препаративной ВЭЖХ-ОФ. Фракции,
содержащие желаемый продукт, объединяют, органические растворители выпаривают в вакууме (10 мм рт. ст. ) при температуре
30oC и продукт отделяют на октадециловом (C18) картридже (300 мг,
получен от Burdick & Jackson). Картридж промывают водой (30 мл) и продукт повторно эктрагируют метанолом (50 мл).
При упаривании метанола остается 16 мг (50%) желаемого продукта; т.пл. >
250oC, разл.; УФ (вода): 274 нм ( logε 4,96); MC(ES) (m/z): М-2 889,2; MB 1824,4.
Пример 12
Динатриевая соль 4,4'-бис[4,6-ди[4-аминофенил-N,
N-бис(2- карбамоилэтил)сульфонилимино] -1,3,5-триазин-2-иламино] - стильбен-2,2'-дисульфоновой кислоты
Указанное
в заголовке соединение получают в соответствии со способом, применяемым при
синтезе по примеру 2, используя 4,4'-диаминостильбен-2,2'-дисульфоновую кислоту (48 мг, 0,125 ммоль) и 2-xлop-4,
6-ди[4-aминoфeнил-N, N-биc(2- кapбaмоилэтил)сульфонилимино] -1,3,5-триазин (пример 18)
(230 мг, 0,310 ммоль) в диметилсульфоксиде (12 мл) и диизопропилэтиламине (260 мл). Продукт получают в виде
бесцветного твердого продукта (173 мг, 77%); т.пл. > 250oC, разл. ; УФ
(вода): 296 нм ( logε 4,94); 352 нм ( logε 4,57); MC(ES) (m/z): M-2 883,2; MB 1822,
4.
Пример 13
Динатриевая соль 4,4'-биc[4,6-ди[4-aминoфeнил-N,
N-биc(2- карбамоилэтил)сульфонилимино] -1,3,5-триазин-2-иламино] - дифенил-2,2'-дисульфоновой кислоты
Указанное в заголовке соединение получают в соответствии со способом, используемым при
синтезе по примеру 2, применяя динатриевую соль 4,4'-диаминобифенил-2,2'-дисульфоновой кислоты (113 мг, 0,33
ммоль) и 2-хлор-4,6-ди[4-аминофенил-N, N-бис (2-карбамоилэтил)сульфонилимино] -1,3,
5-триазин (пример 18) (535 мг, 0,72 ммоль) в 25 мл ДМСО-сульфолане (2:3, объем/объем) и диизопропилэтиламине (350
мл). Продукт получают в виде бесцветного твердого продукта (450 мг, 76%); т.пл.
> 250oC, разл.; УФ (вода): 296 нм ( logε 5,13); MC(ES) (m/z): М-2 874,4; MB 1794,
8.
Пример 14
2-Хлор-4,6-ди(3'-сульфоамидоанилин)-1,3,
5-триазин
Раствор хлорангидрида циануровой кислоты (2,37 г, 12,9 ммоль) в ацетоне (25 мл) добавляют по каплям,
перемешивая, к фосфатному буферу (60 мл, 0,3 М pH 7) при температуре -2-0oC. К полученной в результате мелкодисперсной суспензии добавляют по каплям в течение 20 минут раствор
м-сульфаниламида (4,35 г, 25,3 ммоль) в ацетоне (30 мл), и поддерживают pH при 6,5- 7,2
путем добавления 1 н. NaOH. Перемешивание продолжают в течение последующих 30 минут (0oC, pH 7,0) и
температуру поднимают до 55oC. Перемешивание продолжают в течение 3 часов,
при этом реакцию контролируют на степень завершенности с помощью ВЭЖХ (или ТСХ). Как только реакция завершается,
что определяют с помощью аналитической ВЭЖХ (или ТСХ), смесь охлаждают до 0o
C, добавляют воду (100 мл), и выпавший в осадок продукт фильтруют, промывают холодной водой (50 мл), сушат на
фильтре и очищают путем растворения в горячем ацетоне (40 мл) и высаживают бензолом (150
мл). Продукт фильтруют, промывают пропан-2-олом (20 мл) и эфиром (30 мл), сушат в вакууме при температуре
30oC. Выход 3,72 г (64%); т.пл. > 250oC, разл; УФ (MeOH): 277 нм
( logε 4,68); MC(Cl) (m/z): МН 456,0.
Пример 15
Динатриевая соль 4,
4'-бис[4,6-ди[3-аминофенилсульфониламидо] - 1,3,5-триазин-2-иламино]стильбен-2,2'-дисульфоновой
кислоты
Указанное в заголовке соединение получают в соответствии со способом, используемым при
получении по примеру 2, применяя динатриевую соль 4,4'-диаминостильбен-2,2'-дисульфоновой
кислоты (216 мг, 0,52 ммоль) и 2-хлор-4,6-ди(3'-сульфоамидоанилин)-1,3,5- триазин (пример 14) (524 мг, 1,15
ммоль) в сульфолане (15 мл) и диизопропилэтиламине (250 мл), в течение 40 часов при
температуре 115oC. После охлаждения до 20oC, реакционную смесь разбавляют эфиром (100 мл) и
добавляют 1 н. NaOH (2,08 мл). После центрифугирования, остаток перемешивают с
пропан-2-олом (50 мл) до тех пор, пока кристаллизация не завершится. Твердый продукт центрифугируют, промывают метанолом
(2 х 30 мл) и эфиром (2 х 30 мл) и сушат в вакууме при температуре 30oC. Выход (570 мг, 92%); т. пл. > 250oC разл.; УФ (вода): 273 нм ( logε 4,76); 350 ( logε
4,52).
Пример 16
Динатриевая соль 4,4'-бис[4,
6-ди[3-аминофенилсульфонилимидо] - 1,3,5-триазин-2-иламино]дифенил-2,2'-дисульфоновой кислоты
Указанное в заголовке
соединение получают в соответствии со способом, используемым при получении
по примеру 2, применяя 4,4'-диаминодифенил-2,2'-дисульфоновую кислоту (208 мг, 0,60 ммоль) и 2-хлор-4,
6-ди(3'-сульфоамидоанилин)-1,3,5-триазин (пример 14) (607 мг, 1,33 ммоль) в сульфолане (20 мл) и
диизопропилэтиламине (850 мл), в течение 40 часов при температуре 115oC. После охлаждения до
20oC, реакционную смесь разбавляют эфиром (150 мл) и добавляют 1 н. NaOH (2,40 мл).
После центрифугирования, остаток перемешивают с пропан-2-олом (50 мл) до тех пор, пока кристаллизация не
завершится. Твердый продукт центрифугируют, промывают метанолом (40 мл) и эфиром (2 х 20 мл) и
сушат в вакууме при температуре 30oC. Выход (505 мг, 72%); т.пл. > 250oC,
разл.; УФ (вода): 276 нм ( logε 4,93).
Пример 17
4,
4'-Дигидроксидифенил-2,2'-дисульфоновая кислота
К суспензии 4,4'-диаминодифенил-2,2'-дисульфоновй кислоты (4,
44 мг, 12,9 ммоль) в воде (20 мл) добавляют раствор карбоната натрия (8,6 мл, 1,5
М) путем нагревания до тех пор, пока не получат прозрачный раствор. После охлаждения до 5oC к этому
раствору добавляют раствор нитрита натрия (1,78 г, 12,9 ммоль) в воде (3 мл). Полученный
в результате раствор добавляют по каплям при перемешивании к раствору концентрированной серной кислоты (3,8 мл)
в воде (13 мл) и к измельченному льду (10 г) при температуре -5 - -2oC.
Перемешивание продолжают в течение последующих 30 минут, и реакционную смесь нагревают до 65oC. Эту
температуру поддерживают до тех пор, пока продолжается выделение азота. Смесь охлаждают
до 10oC и нейтрализуют сухим карбонатом натрия и раствор выпаривают до остатка. Остаток сушат в
вакууме при температуре 50oC, смешивают с этанолом (225 мл) и фильтруют. Фильтрат
выпаривают и сушат в вакууме при температуре 40oC. Выход 3,88 (87%); т.пл. > 250oC, разл. ; УФ (0,05 н. NaOH): 252 нм ( logε 4,16), 311 нм ( logε 3,40);
MC(ES) (m/z): (M-H)-1 345,0; MB 346,0.
Пример 18
2-Хлор-4,
6-ди[4-аминофенил-N, N-бис(2-карбамоилэтил)- сульфонилимино]-1,3,5-триазин
Указанное в заголовке
соединение получают по способу, используемому при получении по примеру 6, применяя
4-аминофенил- N,N-бис(карбамоилэтил)сульфонилимин (3,3 г, 10,5 ммоль) (Патент Великобритании 1194388; Июнь 10, 1970)
и хлорангидрид циануровой кислоты (1,0 г, 5,4 ммоль). Продукт получают в виде
бесцветного твердого вещества (3,5 г, 88%); т. пл. > 250oC, разл. ; УФ (ДМСО): 303 нм ( logε 4,
84); MC(Cl) (m/z): MH 740,1.
Пример 19
Динатриевая соль
4,4'-бис[4,6-ди[3-аминофенил-N, N-бис(2- карбамоилэтил)сульфонилимино]-1,3,5-триазин-2-илокси]- дифенил-2,
2'-дисульфоновой кислоты
Суспензию 4,4'-дигидроксидифенил-2,2'-дисульфоновой кислоты
(пример 17) (131 мг, 0,34 ммоль) и 2-хлор-4,6-ди[3- аминофенил-N,N-бис(2-карбамоилэтил)сульфонилимино] -1,
3,5- триазина (Пример 6) (550 мг, 0,74 ммоль) в сульфолан-N, N- диметилформамиде (15 мл, 2:1
объем/объем) и NaOH (1 н., 1,48 мл) нагревают в запаянной тонкостенной стеклянной пробирке до 115oC. Нагревание продолжают в течение 50 часов. Как только реакция завершается, что определяют
с помощью аналитической ВЭЖХ (или ТСХ), смесь охлаждают до 20oC и продукт высаживают
путем добавления пропан-2-ола (70 мл), промывают на фильтре холодным этанолом (15 мл) и сушат в вакууме
при температуре 40oC. Две порции раствора сырого продукта (около 0,6 г) в
деионизированной воде (200 мл) очищают по отдельности путем препаративной ВЭЖХ-ОФ. Фракции, содержащие желаемый
продукт, объединяют, органические растворители выпаривают в вакууме (10 мм рт.ст.) при
температуре 30oC, и продукт концентрируют, обессоливают и отделяют на октадециловом (C18) картридже
(900 мг, получен от Burdick & Jackson). Картридж промывают водой (30 мл) и
продукт повторно эктрагируют метанолом (50 мл). При упаривании метанола остается 171 мг (28%) желаемого продукта; т.
пл. > 250oC, разл.; УФ (вода): 272 нм ( logε 4,86);
MC(ES) (m/z): M-2 875,2; MB 1796,4.
Пример 20
Динатриевая соль 5,5'-диметил-4,4'бис[4,
6-ди[3-аминофенил-N, N-бис(2-карбамоилэтил)сульфонилимино] -1,3,
5-триазин-2-иламино] дифенил-2,2'-дисульфоновой кислоты
Соединение получают в соответствии со способом, используемым при
получении (пример 2), применяя динатриевую соль 5,5'-диметил-4,4'
-диаминодифенил-2,2'-дисульфоновой кислоты (206 мг, 0,49 ммоль) и 2-хлор-4,6-ди[3'-аминофенил)-N, N-бис(2-карбамоилэтил)
сульфонилимино]-1,3,5-триазин (пример 6) (805 мг, 1,08 ммоль) в 30 мл
ДМСО-сульфолане (1:1, объем/объем) и диизопропилэтиламине (200 мл) в течение 50 часов при температуре 115oC. Продукт
после ВЭЖХ-очистки получают в виде бесцветного твердого продукта (191
мг, 22%); т. пл. > 250oC, разл.; УФ (вода): 274 нм ( logε 5,08); MC(ES) (m/z): М-2 8883,3; MB
1822,6.
Пример 21
2-Хлор-4,
6-ди[3-аминофенил-N, N-бис(3-гидроксиэтил)- сульфонилимино] -1,3,5-триазин
Раствор хлорангидрида циануровой кислоты (135 мг, 0,73 ммоль) в
диоксане (55 мл) добавляют по каплям при
перемешивании к фосфатному буферу (120 мл, 0,3 М, pH 7) и измельченному льду (10 мг) при температуре от -2 до 0oC. К полученной в результате
мелкодисперсной суспензии добавляют по каплям в
течение 20 минут раствор 3-аминофенил-N,N-бис(2-гидроксиэтил)сульфонилимина (365 мг, 1,40 ммоль) в N, N-диметилформамиде (125 мл) и поддерживают pH 6,
5-7,2 путем добавления 1 н. NaOH. Перемешивание
продолжают в течение еще 1 часа (0oC, pH 7,0) и температуру повышают до 55oC. Перемешивание продолжают в течение 2,5 часов, при
этом реакцию контролируют на степень
завершенности с помощью аналитической ВЭЖХ (или ТСХ). Как только реакция завершается, что определяют с помощью аналитической ВЭЖХ (или ТСХ), смесь охлаждают до
0oC, добавляют воду (160 мл)
и выпавший в осадок продукт фильтруют, промывают холодной водой (50 мл), ацетоном (50 мл) и сушат в вакууме при температуре 40oC. Выход 395 мг (89%),
т.пл. > 250oC, разл.;
УФ (ДМСО): 284 нм.
Пример 22
Динатриевая соль 4,4'-бис[4,6-ди[3-аминофенил-N, N-бис(2- гидроксиэтил)сульфонилимино] -1,3,
5-триазин-2-иламино] - дифенил-2,2'-дисульфоновой
кислоты
Соединение получают в соответствии со способом, используемым при получении по примеру 2, применяя 4,4'-диаминодифенил-2,
2'-дисульфоновую кислоту (28 мг, 0,08 ммоль) и 115 мг (0,17
ммоль) 2-хлор-4,6-ди[3-аминофенил)- N, N-бис(3-гидроксиэтил)сульфонилимино]-1,3,5-триазина (пример 21) в сульфолане (10 мл) и
диизопропилэтиламине (25 мл) при температуре 110oC в течение
18 часов. Продукт после ВЭЖХ-очистки получают в виде бесцветного твердого вещества (16 мг, 13%); т.пл. > 250oC,
разл.; УФ (вода): 272 нм ( logε 4,88); MC(ES) (m/г): М-2 776,0; MB 1534,0.
Пример 23
Динатриевая соль 9,9-диоксо-2,7-бис[4,6-ди[3-аминофенил-N,
N- бис(2-карбамоилэтил)сульфонилимино] -1,3,5-триазин-2-иламино]
-дибензотиофен-3,6-дисульфоновой кислоты
Указанное в заголовке соединение получают в соответствии со способом, используемым
при получении по примеру 1, применяя раствор хлорангидрида
циануровой кислоты (59 мг, 0,32 ммоль), 9,9-диоксо-2,7-диаминодибензотиофен-3,6-дисульфоновую кислоту (77 мг, 0,16 ммоль) и 2-хлор-4,
6-ди[4-аминофенил-N, N-бис (2-карбамоилэтил)сульфонилимино]-1,3,
5-триазин (пример 6) (300 мг, 0,96 ммоль) в диоксане (15 мл) и фосфатном буфере (20 мл, 0,3 М, pH 7) при температуре 110oC в
течение 18 часов. Продукт после ВЭЖХ-очистки получают в виде
бесцветного твердого вещества (64 мг, 11%); т.пл. > 250oC, разл. ; MC(ES) (m/z): М-2 905,1; MB 1858,2.
Пример 24
Динатриевая соль 4,
4'-бис[4-хлор-6-ди[4-амино-N' -[3-аминофенил-N,N-бис(2-карбамоилэтил)сульфонилимино] бензамид] -1,3,5-триазин-2-иламино]стильбен-2,2'-дисульфоновой
кислоты
Соединение получают в соответствии
со способом, используемым при получении по примеру 2, применяя 4,4'-диаминостильбен-2,2'-дисульфоновую кислоту (20 мг, 0,054 ммоль) и 112 мг (0,12
ммоль) 2,4-дихлор-6- [4-амино-N'-[3-аминофенил-N,
N-бис(2-карбамоилэтил) сульфонилимино] бензамид-1,3,5-триазина (пример 26) в сульфолане (20 мл) и диизопропилэтиламине (38 мл) при температуре 110oC в течение 18 часов. Продукт после
ВЭЖХ-очистки получают в виде бесцветного твердого вещества (20 мг, 23%); т.пл. > 250oC, разл.; УФ (вода): 295 нм (logε 4,54), 354
(logε 4,39); MC(ES) (m/z): M-2 727,1; MB 1482,2.
Пример 25
Динатриевая соль 4,4'-бис[4,6-ди[4-амино-N'-[3-аминофенил-N, N-бис(2-гидроксиэтил)сульфонилимино]
бензолсульфонамид] - 1,3,
5-триазин-2-иламино] стильбен-2,2'-дисульфоновой кислоты
Указанное в заголовке соединение получают в соответствии со способом, используемым при получении по примеру
2, применяя 4,
4'-диаминостильбен-2,2'- дисульфоновую кислоту (20 мг, 0,054 ммоль) и 203 мг (0,22 ммоль) 2-хлор-4,6-ди[4-амино-N'- [3-аминофенил-N,N-бис(2-гидроксиэтил)сульфонилимино]
-бензолсульфонамид] -1,3,
5-триазин (пример 27) в сульфолане (20 мл) и диизопропилэтиламине (38 мл) при температуре 110oC в течение 18 часов. Продукт после ВЭЖХ-очистки получают в виде
бесцветного твердого вещества
(30 мг, 25%); т. пл. > 250oC, разл. ; УФ (вода): 295 нм ( logε 5,21), 350 ( logε 4,69); MC(ES) (m/z): M-2 1089,3; MB 2226,6.
Пример 26
2,4-Дихлор-6-[4-aмино-N'-[3-аминофенил-N,N-бис(2- карбамоилэтил)сульфонилимино]бензамид]-1,3,5-триазин
Раствор хлорангидрида циануровой кислоты (56 мг, 0,3
ммоль) в диоксане добавляют
при перемешивании к фосфатному буферу (12 мл, 0,3 М, pH 7) при температуре -2oC. К полученной в результате суспензии добавляют по каплям раствор
4-амино-N'-[3-аминофенил-N,
N- бис(2-карбамоилэтил)сульфонилимино] бензамида (130 мг, 0,3 ммоль) в N,N-диметилформамиде (2 мл), и поддерживают pH 6,5-7,2 путем добавления 1 н. NaOH. Перемешивание
продолжают в течение еще 1 часа
(0oC, pH 7,0), затем добавляют воду (20 мл) и выпавший в осадок продукт фильтруют, промывают холодной водой (10 мл), ацетоном (5 мл) и сушат в вакууме при
температуре 20oC с
получением 108 мг (62%) желаемого продукта; т.пл. >250oC, разл.; УФ (ДМСО): 285 нм.
Пример 27
2-Хлор-4,
6-ди[4-амино-N'-[3-аминофенил-N,
N-бис(2- гидроксиэтил)сульфонилимино]бензолсульфонамид]-1,3,5-триазин
Указанное в заголовке соединение получают в соответствии со способом, используемым при
получении по примеру 6, применяя
4- амино-N'-[3-гидроксиэтил)сульфонилимино] бензолсульфонамид (125 мг, 0,31 ммоль) и хлорангидрид циануровой кислоты (28 мг, 0,15 ммоль). Продукт получают в виде
бесцветного твердого вещества (105 мг,
74%); т.пл. > 250oC, разл.; УФ (ДМСО): 298 нм.
Пример 28
4,4'-Динитро-2,2'-дифениловая кислота
2,
2'-Дифениловую кислоту (Aldrich, 50,0 г, 206
ммоль) по частям добавляют к 500 мл 3:1 90% HNO3/H2SO4, поддерживая температуру, не превышающую 10oC.
Прозрачный раствор перемешивают на ледяной бане в
течение одного часа, затем осторожно гасят примерно 750 г льда. Белый твердый продукт, который показывает отношение изомеров как 2:1, отделяют с
помощью вакуумного фильтрования. Эту смесь очищают с
помощью хроматографии, пропуская через 1,5 кг силикагеля, взвешенного в 8:2 изопропанол/гидроксид аммония и элюируя с этой же смесью растворителей.
Продукт выходит из колонки первым, практически
выходя вместе с фронтом растворителей. Побочный изомер выходит из колонки позже (смотри P.R. 232-11). Фракции продукта концентрируют на роторном
испарителе. Концентрированный раствор подкисляют до pH
1 HCl и фильтруют, получая 31,9 г 4,4'-динитродифениловую кислоту.
300 МГц ЯМР (ДМСО d6): δ 7,55 (1H, д, J=8,7); 8,45 (1H, дд, J=2,5, 8,7); 8,68 (1H, д, J= 2,5). 13 (1H, ушир с). CHN: Теоретически: C: 48,60%; H: 2,77%; N: 8,10%. Теоретически рассчитано с 0,75 молями воды. Найдено: C: 48,68%; H: 2,72%; N: 7, 42%.
Пример 29
4,4'-Диамино-2,
2'-дифениловая кислота 4,4'-Динитро-2,2'-дифениловую кислоту (Пример 28, 10,0 г, 30,1 ммоль; P.R. 232-9) суспендируют в 90 мл воды и титруют до
pH 7 насыщенным NaHCO3 (может быть
использован NaOH). Добавляют 10% Pd/C (0,5 г; Aldrich) и смесь восстанавливают при давлении 30 фунтов/дюйм2 в течение одного часа. Катализатор
удаляют путем фильтрования и фильтрат
концентрируют до ~ 20 мл. Осторожно добавляют ацетон (40 мл) к концентрированному раствору, вызывая осаждение продукта в виде динатриевой соли. Ее собирают путем
вакуумного фильтрования и сушат в
вакууме, получая 9 г 4,4'-диамино-2,2'-дифениловой кислоты в виде динатриевой соли. 300 МГц ЯМР (D2O): δ 4,70 (-NH2, с); 6,71 (1H, дд,
J=2,4, 8,25); 6,79 (1H, д, J=2,4);
7,00 (1H, д, J=8,25). Теоретически: C: 49,64%; H: 3,72%; N: 8,27% (Рассчитано с 1,25 молями воды). Найдено: C: 49,55%; H: 3,72%; N: 7,90%.
Пример
30
Динатриевая соль 4,4'-бис
(4,6-бис{3-[бис-(2- карбамоилэтил)-сульфамоил] фениламино}-1,3,5-триазин-2- иламино]дифенил-2,2'-дикарбоновой кислоты
Суспензию динатриевой соли 4,
4'-диаминодифениловой кислоты (Пример 29,
66 мг, 0,19 ммоль) и 2-хлор-4,6-ди[3-аминофенил-N, N-бис (2-карбамоилэтил)сульфонилимино]-1,3,5-триазина (Пример 6) (300 мг, 0,40 ммоль) в сульфолане (10 мл)
и диизопропилэтиламине (0,3 мл) нагревают
в запаянной тонкостенной стеклянной пробирке до 115oC. Нагревание продолжают в течение 50 часов. Как только реакция завершается, что определяют с
помощью аналитической ВЭЖХ (или ТСХ),
смесь охлаждают до 20oC, и продукт высаживают путем добавления пропан-2-ола (70 мл), промывают на фильтре с холодным этанолом (15 мл) и сушат в вакууме
при температуре 40oC. Две
части раствора сырого продукта (около 0,3 г) в деионизированной воде (200 мл) очищают по отдельности путем препаративной ВЭЖХ-ОФ. Фракции, содержащие желаемый
продукт, объединяют, органические
растворители выпаривают в вакууме (10 мм рт.ст.) при температуре 30oC и продукт концентрируют, обессоливают и отделяют на октадециловом (C18) картридже
(900 мг, получен от Burdick &
Jackson). Картридж промывают водой (20 мл) и продукт повторно экстрагируют метанолом (40 мл). При упаривании метанола остается 112 мг (34%) желаемого продукта;
т.пл. > 250oC, разл.;
MC(ES) (m/z): М-2 840,2; MB 1724,4.
Пример 31
3-Аминофенил-N,N-бис(2-метоксикарбонилэтил)сульфонилимин
3-Аминобензолсульфонамид (3 г, 17,4 ммоль)
растворяют в нитробензоле (55 мл) при температуре 100oC. Затем температуру понижают до 90oC и добавляют метилакрилат (5 мл, 55,5 ммоль)
и Triton В (0,4 мл, 40% в MeOH).
Реакционный сосуд снабжают сильным холодильником и дают возможность ему работать в течение 20 часов. ТСХ показывает степень завершения реакции. Добавляют раствор HCl
(30 мл, 1М в диэтиловом эфире) к
реакционной смеси, получая липкое масло. Его растворяют в 50% этилацетат/гексане и загружают в колонку, набитую силикагелем. Желаемый продукт элюируют гексаном.
Растворитель выпаривают с получением 3,
9 г (65%) желаемого продукта; (m/z): MH 343,2, т.пл. 59-60oC.
Пример 32
3-Аминофенил-N,
N-бис(2-метилкарбонилэтил)сульфонилимин
К раствору метиламина (10
мл, 8,03 М, 33% в этаноле) добавляют раствор 3-аминофенил-N,N-бис(2-метоксикарбонилэтил)сульфонилимина (Пример 31, 0,5 г, 1,
45 ммоль) в этаноле (10 мл), перемешивая при комнатной температуре. Через
24 часа ТСХ показывает завершение реакции. К реакционной смеси добавляют воду и соединение экстрагируют хлороформом и сушат
над сульфатом натрия (50 мг). Выход составляет 300 мг (60%)%; MC(ES) (m/z)
345,2 (M+H)+
Пример 33
3-[[3-(4-{ 3-[Бис-(2-метилкарбамоилэтил)сульфамоил] -фениламино}
-6-хлор-[1,3,5]триазин-2-иламино)бензолсульфонил]- (2-метилкарбамоилэтил)амино]
-N-метилпропионамид
К фосфатному буферу (15 мл, pH 7) при температуре 0oC добавляют раствор
хлорангидрида циануровой кислоты (550 мг, 2,98 ммоль) в диоксане (4 мл). К смеси,
имеющей цвет и консистенцию молока, добавляют раствор 3-аминофенил-N, N-бис(2- метилкарбамоилэтил)сульфонилимина
(Пример 32, 2,0 г, 5,84 ммоль) в диметилформамиде (25 мл), при этом поддерживают pH 6,
5-7,2 путем добавления 1 н. раствора гидроксида натрия. После добавления температуру повышают до 55oC в
течение 2 часов, в этой точке анализ с помощью ВЭЖХ показывает завершение реакции.
Смесь разбавляют водой (100 мл), насыщают хлоридом натрия и экстрагируют этилацетатом (4 х 150 мл). Концентрируют
объединенные экстракты до вязкого масла (3,5 г), которое обрабатывают ацетонитрилом
(30 мл) и оставляют на ночь в холодильнике. Смолистый выпавший осадок перемешивают с эфиром (20 мл) до тех пор, пока
весь осадок не превратится в мелкий порошок, который отделяют с помощью
фильтрования. Получают твердый продукт янтарного цвета (1,8 г, выход 78%); т.пл. > 250oC, разл.; MC(ES) (m/z)
795,7 (М+H)+
Пример 34
Динатриевая соль 4,
4'-бис-[[4,6-бис-[[3-[[бис-[3-(метиламино)- 3-оксопропил] амино] сульфонил] фенил]амино]-1,3,5-триазин-2-ил]амино] [1,
1'-дифенил]-2,2'-дисульфоновой кислоты
Смесь 3-[[3-(4-{
3-[бис-(2-метилкарбамоилэтил)сульфамоил] фениламино}-6-хлор-[1,3,5] триазин-2-иламино)бензолсульфонил] -(2-метилкарбамоилэтил)амино]
-N-метилпропионамида (Пример 33, 200 мг, 0,25 ммоль), динатриевой
соли 4,4'-диаминодифенил- 2,2'-дисульфоновой кислоты (41 мг, 0,11 ммоль) и диизопропилэтиламина (50 мл, 0,28 ммоль) в
диметилсульфоксиде (4 мл) нагревают в герметично закрытой пробирке при
температуре 110oC в течение 25 часов. Процедура отделения, подобная описанной выше, дает белый твердый продукт (40 мг,
19%); т.пл. > 250oC, разл.; MC(ES) (m/z) 930,5
(М-2); MB 1908,1.
Пример 35
Динатриевая соль 4,4'-бис-(4,6-бис-{
3-[бис-(2- метилкарбамоилэтил)сульфамоил] фениламино}-[1,3,5]триазин-2- иламино)дифенил]-2,
2'-дикарбоновой кислоты
К раствору 3-[[3-(4-{3-[бис-(2-метилкарбамоилэтил)-сульфамоил] фениламино}
-6-хлор-[1,3,5] триазин-2-иламино)-бензолсульфонил]- (2-метилкарбамоилэтил)амино]
-N-метилпропионамида (Пример 33, 200 мг, 0,25 ммоль), добавляют динатриевую соль 4,4' -диаминодифенил-2,
2'-дикарбоновой кислоты (37 мг, 0,12 ммоль) в диметилсульфоксиде (4 мл), раствор (37 мг, 0,12
ммоль) в фосфатном буфере (3 мл, pH 7). Смесь нагревают при температуре 110oC в течение 24
часов. После охлаждения, добавляют воду (100 мл) и смесь разделяют на препаративной колонке ВЭЖХ.
Выход 60 мг (27%) белого твердого продукта; т.пл. > 250oC, разл.; MC(ES) (m/z) 894,5
(М-2); MB 1836,0.
Пример 36
Диметиловый эфир 4,4'-бис-(4,
6-бис-{3-[бис-(2-карбамоилэтил) сульфамоил] фениламино}-[1,3,5]триазин-2-иламино)дифенил] -2,
2'-дикарбоновой кислоты
Смесь 2-хлор-4,6-ди[3-аминофенил-N, N-бис(2-карбамоилэтил)
сульфонилимино] -1,3,5-триазина (Пример 6, 200 мг, 0,27 ммоль), диметиловый эфир2 4,4'-диамино-2,
2'-дифениловой кислоты (38 мг, 0,13 ммоль) и диизопропилэтиламина (55 мл, 0,31 ммоль)
нагревают при температуре 110oC в течение 30 часов. После охлаждения, добавляют изопропиловый спирт (50
мл). Выпавший осадок фильтруют, промывают изопропиловым спиртом. Сухой твердый
продукт (190 мг) очищают путем ВЭЖХ с получением белого твердого продукта (53 мг, 24% выход); т.пл. > 250oC, разл.; MC(ES) (m/z) 854,8 (М+2H)2+; MB 1707,8.
Пример 37
3-Нитрофенил-N,N-бис(2-гидроксипропил)сульфонилимин
К перемешиваемому раствору
диизопропаноламина (50,0 г, 75 ммоль) в воде (500 мл) добавляют
м-нитробензолсульфонилхлорид (57,1 г, 35 ммоль). Смесь энергично перемешивают в течение 25 часов при комнатной температуре. Полученную в
результате суспензию фильтруют, твердый продукт промывают
H2O (2 х 400 мл), сушат и повторно кристаллизуют из смеси этилацетата/гексанов с получением желаемого продукта в виде белых
кристаллов. Выход составляет 65,8 г (88%); т. пл. 114-116oC;1H ЯМР (CDCl3, 300 МГц) δ 8,67 (д, J=5,1 Гц, 1H), 8,44 (д, 1H), 8,15 (д, J=6,0 Гц, 1H), 7,77 (м,
1H), 4,78 (с, 2H), 4,18 (м, 2H), 3,10 (д, J=5,9 Гц, 4H), 1,16
(дд, 6H); MC(ES) (m/z) 319,5 (М+H)+
Пример 38
3-Аминофенил-N,N-бис(2-гидроксипропил)сульфонилимин
Раствор 3-нитрофенил-N, N-бис(2-гидроксипропил) сульфонилимина
(Пример 37, 10,0 г, 31,4 ммоль) в метаноле (100 мл) гидрируют над палладиевым катализатором (10% Pd/C, 1 г) в течение 1,5 часов.
Полученную в результате смесь фильтруют через слой Целита,
растворитель выпаривают и полученное вязкое масло очищают с помощью колоночной хроматографии на силикагеле, элюируя смесью этилацетат/гексан
4:1. Желаемый продукт получают в виде бледно-желтых
кристаллов. Выход составляет 8,2 г (90,5%); ЯМР (CDCl3, 300 МГц) δ 7,28 (д, 1H), 7,13 (м, 1H), 7,09 (м, 1H), 6,86 (д, 1H), 4,20 (м,
1H), 4,13 (дд, 1H), 3,37 (дд, 1H), 3,02 (д, 2H),
2,80 (дд, 1H), 1,16 (дд, 6H); MC(ES) (m/z) 289,5 (М+H)+
Пример 39
2-Хлор-4,6-бис-{ 3-[бис-(2-гидроксипропил)сульфамоил]
- фениламино} -[1,3,5]-триазин
Указанное
в заголовке соединение получают в соответствии со способом по примеру 33, применяя хлорангидрид циануровой кислоты (160 мг, 0,87 ммоль),
3-аминофенил-N, N-бис(2-гидроксипропил)сульфонилимин (700 мг,
2,0 ммоль), диоксан (3 мл), фосфатный буфер (10 мл, 0,3 М, pH 7), N,N-диметилформамид (5 мл) и 1 н. NaOH. Продукт высаживают из
охлажденной реакционной смеси водой в виде янтарно-желтого вязкого
масла, центрифугируют, промывают водой и сушат в высоком вакууме с получением 640 мг (93%) хлортриазина. т.пл. > 250oC, разл.; MC(ES) (m/z) 687,7, 689,7 (М+H)+
Пример 40
Динатриевая соль 4,4'-бис-(4,6-бис-{ 3-[бис-(2-гидроксипропил) сульфамоил] фениламино} -[1,3,5]
-триазин-2-иламино)дифенил] -2,2'- дисульфоновой кислоты
Смесь 2-хлор-4,
6-бис-{ 3-[бис-(2-гидроксипропил) сульфамоил]фениламино} -1,3,5-триазина (Пример 39, 300 мг, 0,44 ммоль), динатриевой
соли 4,4'-диаминодифенил-2,2'-дисульфоновой кислоты (77 мг, 0,2 ммоль), 2 мл ДМСО,
2 мл фосфатного буфера (1 н. pH 7) и 0,25 мл 1 н. NaOH подвергают СВЧ-нагреву (PROLABO, одномодовый режим) при
температуре 110oC в течение 2 часов. После охлаждения реакционную смесь без
извлечения подвергают препаративной ВЭЖХ в системе вода/ацетонитрил на YMC Prodigy C18 полимерной колонке.
Продукт получают в виде бесцветного твердого вещества (170 мг, 50,2%); т.пл. >
250oC, разл.; MC(ES) (m/z) 822,3 (М-2H)2-; MB 1691,9 (MB+2Na).
Пример 41
Динатриевая соль 4,4'-бис-(4,6-бис-{ 3-[бис-(2-гидроксипропил)
сульфамоил]фениламино}-[1,3,5]-триазин-2-иламино)дифенил]-2,2' -дикарбоновой кислоты
Смесь 2-хлор-4,6-бис-{
3-[бис-(2-гидроксипропил)сульфамоил] фениламино} -1,3,5-триазина (Пример 39, 178
мг, 0,25 ммоль), дигидрохлорид 4,4'-диамино-2,2'-дифениловой кислоты (35 мг, 0,11 ммоль), 3 мл ДМСО, 0,5 мл фосфатного
буфера (1 н., pH 7) и 0,5 мл 1 н. NaOH нагревают в печи в герметично закрытой
пробирке в течение 18 часов, затем без извлечения подвергают препаративной ВЭЖХ с получением 90 мг (50,5%) желаемого
продукта. Т.пл. > 250oC, разл.; MC(ES) (т/г) 788,1 (М+2H)2+; MB 1619,8 (MB+2Na).
Пример 42
2-Хлор-4,
6-бис-(3-[бис-карбамоилметил-1-сульфамоил]-фениламино} -[1,3,5] -триазин
Указанное в заголовке соединение получают в
соответствии со способом по примеру 33, применяя хлорангидрид циануровой
кислоты (0,42 г, 2,27 ммоль), 3-аминофенил-N, N-бис- карбамоилметилсульфонилимин (CL 55675, 1,43 г, 5,0 ммоль), диоксан (3 мл),
фосфатный буфер (10 мл, 0,3 М, pH 7), N,N-диметилформамид (4 мл) и 1 н.
NaOH. Реакционная смесь является гетерогенной во время всей процедуры. Образовавшийся розовый осадок центрифугируют, промывают
несколько раз водой, повторно растворяют в минимальном количестве ДМФ и
повторно высаживают водой. Конечное разделение и сушка дают 0,7 г (45,1%) желаемого продукта; т.пл. > 250oC,
разл.; MC(ES) (m/z) 683,7, 685,7 (M+H)+
Пример 43
Динатриевая соль 4',4-бис-{4,6-бис-[3-[бис-карбамоилметил-1- сульфамоил] фениламино]-[1,3,5]-триазин-2-иламино}дифенил-2,
2' -дисульфоновой кислоты
Указанное в заголовке соединение
получают в соответствии со способом по примеру 40, применяя 2- хлор-4,6-бис-{3-[бис-(карбамоилметил-1-сульфамоил] фениламино} -[1,
3,5] -триазин (Пример 42, 500 мг, 0,73 ммоль), динатриевую соль 4,
4'-диаминодифенил-2,2'-дисульфоновой кислоты (114 мг, 0,29 ммоль), 2,5 мл ДМСО, 2,5 мл фосфатного буфера (1 н., pH 7) и 1,0 мл 1 н.
NaOH. СВЧ-нагревание (PROLABO одномодовый режим) продолжают в
течение 1 ч при температуре 105oC. Полученную в результате смесь подвергают препаративной ВЭЖХ, которая дает 50 мг (10,2%)
продукта в виде розового твердого продукта; т.пл. > 250oC, разл.; MC(ES) (m/z) 818,2 (М-2H)2-; MB 1683,7 (MB+2Na).
Пример 44
Динатриевая соль 4',
4-бис-{4,6-бис-[3-[бис-карбамоилметил-1- сульфамоил)фениламино]-[1,3,
5]-триазин-2-иламино}дифенил-2,2' -дикарбоновой кислоты
Указанное в заголовке соединение получают в соответствии со
способом по примеру 40, применяя 2-хлор-4,
6-бис-{3-[бис- (карбамоилметил-1-сульфамоил] фениламино} -[1,3,5] -триазин (Пример 42, 500 мг, 0,73 ммоль), дигидрохлорид 4,4'-диамино- 2,2'-дифениловой
кислоты (100 мг, 0,29 ммоль), 2,5 мл ДМСО, 2,5
мл фосфатного буфера (1 н., pH 7) и 1,0 мл 1 н. NaOH. СВЧ-нагревание (PROLABO одномодовый режим) продолжают в течение 1 часа при температуре 105oC. Полученную в результате смесь подвергают
препаративной ВЭЖХ, которая дает 20 мг (4,3%) продукта в виде розового твердого вещества; т.пл. > 250oC, разл.; MC(ES) (m/z) 784,0
(М+2H)2+; MB 1619,8 (MB+2Na).
Пример 45
1-(3-Нитробензолсульфонил)пиперидин-3,5-дикарбоновая кислота
Раствор 3,5-пиридиндикарбоновой кислоты (3,34 г, 20
ммоль) в 50 мл воды и 10 мл концентрированного
аммонийхлорида гидрируют в аппарате Парра при давлении 22 футов/дюйм2 над 1 г рутениевого катализатора (5% рутения на порошке окиси алюминия)
в течение 48 часов. После фильтрования
катализатора и удаления растворителя сырую 3,5-пиперидиндикарбоновую кислоту растворяют в 60 мл 1 н. NaOH и нагревают с 6,6 г (30 ммоль)
м-нитробензолсульфохлорида. Реакционную смесь перемешивают при
комнатной температуре и поддерживают pH 9,5 путем добавления 1 н. NaOH до тех пор, пока не прекратится выпадение осадка. Реакционную
смесь перемешивают в течение еще 1,5 часов, образовавшийся осадок
фильтруют, и фильтрат подкисляют концентрированной HCl до pH 2-3. Образовавшийся белый осадок фильтруют, промывают водой и сушат в
высоком вакууме в течение ночи с получением 5,3 г (74%) желаемого
продукта.1H ЯМР (ДМСО-d6, 300 МГц) δ 8,55 (д, 1H), 8,40 (с, 1H), 8,15 (д, 1H), 7,95 (т, 1H), 3,14 (м,
4H), 1,65 (м, 2H), 1,45 (м, 2H); MC(ES) m/z 359 (М+H)+
Пример 46
Диметиловый эфир 1-(3-нитробензолсульфонил)пиперидин-3,5- дикарбоновой кислоты
Суспензию
1-(3-нитробензолсульфонил)пиперидин-3, 5-дикарбоновой кислоты (Пример 45, 3,6
г, 10 ммоль) в ТГФ (200 мл) обрабатывают при температуре 0oC избытком диазометана и перемешивают при этой
температуре до тех пор, пока суспензия не превратится в прозрачный ярко-желтый
раствор. Реакционную смесь нагревают при комнатной температуре, фильтруют, выпаривают и очищают путем колоночной
хроматографии на силикагеле с получением 2,5 г (64%) бесцветных кристаллов желаемого
продукта.1H ЯМР (CDCl3, 300 МГц) δ 8,65 (с, 1H), 8,49 (д, 1H), 8,11 (д, 1H), 7,81 (т,
1H), 3,73 (с, 6H), 3,40 (м, 4H), 2,95 (м, 2H), 2,05 (т, 2H); MC(ES) m/z 387,2
(М+H)+
Пример 47
Диамид 1-(3-нитробензолсульфонил)пиперидин-3,5-дикарбоновой кислоты
Раствор диметилового эфира 1-(3-нитробензолсульфонил)- пиперидин-3,
5-дикарбоновой кислоты (Пример 46, 2,5 г, 6,5 ммоль) в 200 мл метанола насыщают аммонием при температуре 0oC,
герметизируют и оставляют при комнатной температуре в течение 7 дней.
Полученный в результате желтый раствор концентрируют до объема 100 мл, образовавшийся осадок фильтруют, промывают метанолом и
сушат с получением 1,8 г (77,7%) продукта в виде бледно-кремовых
кристаллов. MC(ES) m/z 357,1 (М+H)+
Пример 48
1-(3-Аминобензолсульфонил) пиперидин-3,5-дикарбоновая
кислота
Раствор 1-(3-нитробензолсульфонил)пиперидин-3,
5-дикарбоновой кислоты (Пример 45, 2,5 г, 4,2 ммоль) в 150 мл метанола гидрируют в аппарате Парра при давлении 25 фунт/дюйм2
над 0,15 г палладиевого катализатора (10% палладия на угле) в
течение 1 часа. Фильтрование катализатора и удаление растворителя дает 1,8 г (79%) желаемого продукта в виде белого твердого продукта.
MC(ES) m/z 329,1 (М+H)+
Пример 49
Диамид 1-(3-аминобензолсульфонил)пиперидин-3,5-дикарбоновой кислоты
Раствор диамида 1-(3-нитробензолсульфонил) пиперидин-3,
5-дикарбоновой кислоты (Пример 47, 1,5 г, 4,2 ммоль) в 300 мл
метанола гидрируют в аппарате Парра при давлении 25 фунт/дюйм2 над 0,1 г палладиевого катализатора (10% палладия на угле) в
течение 1,5 часа. Фильтрование катализатора и удаление
растворителя дает 1,26 г (92%) желаемого продукта в виде светло-серого твердого продукта. MC(ES) m/z 327,1 (М+H)+
Пример
50
2-Хлор-4,6-бис-[3-(3,
5-дикарбамоилпиперидин-1-сульфонил) -фениламино]-[1,3,5]-триазин
Раствор хлорангидрида циануровой кислоты (280 мг, 1,5 ммоль) в диоксане (5 мл) добавляют при
перемешивании к фосфатному буферу
(10 мл, 0,3 М pH 7) при температуре 0-2oC. К полученной в результате суспензии добавляют по каплям раствор диамида 1-(3-аминобензолсульфонил)пиперидин-3,
5-дикарбоновой кислоты (Пример 49, 1,
0 г, 3,1 ммоль) в N,N-диметилформамиде (5 мл), и поддерживают pH при 6,5-7,2 путем добавления 1 н. NaOH. После завершения добавления, реакционную смесь нагревают
до 50-55oC и перемешивают
при этой температуре в течение 2 часов (до тех пор, пока ВЭЖХ не покажет завершение реакции), затем охлаждают до комнатной температуры, разбавляют водой, выпавший
продукт фильтруют, промывают холодной
водой (10 мл), ацетоном (5 мл) и сушат в вакууме при температуре 20oC с получением 845 мг (74,2%) желаемого продукта; т.пл. > 250oC,
разл.; MC(ES) m/z 765,0 (М+H); MB 764,
2.
Пример 51
2-Хлор-4,6-бис-[3-(3,5-дикарбоксилпиперидин-1-сульфонил)- фениламино]-[1,3,5]-триазин
Указанное в заголовке
соединение получают в соответствии со
способом по примеру 50, применяя хлорангидрид циануровой кислоты (280 мг, 1,5 ммоль), 1-(3-аминобензолсульфонил)-пиперидин- 3,5-дикарбоновую кислоту (Пример 48,
1,0 г, 3,1 ммоль), диоксан (3 мл),
фосфатный буфер (10 мл, 0,3 М, pH 7), N, N-диметилформамид (5 мл) и 1 н. NaOH. После завершения реакции смесь охлаждают до комнатной температуры, разбавляют водой,
подкисляют HCl до pH 5, выпавший
продукт фильтруют, промывают холодной водой (10 мл) и сушат в вакууме при температуре 20oC с получением 845 мг (74,2%) желаемого продукта; т.пл. >
250oC, разл.; MC(ES) m/z
769,0 (М+H); MB 767,8.
Пример 52
Динатриевая соль (E)-2,2'-(1,2-этендиил)бис[5-[[4,6-бис[[3- [[3,
5-бис(аминокарбонил)-1-пиперидинил]сульфонил]амино]-1,3, 5-триазин-2-ил]амино]
бензолсульфоновой кислоты
Суспензию динатриевой соли 4,4'-диаминостильбен-2,2'-дисульфоновой кислоты (0,41 г, 0,
1 ммоль) и 2-хлор-4,6-бис-[3-(3,5-дикарбамоилпиперидин-1-сульфонил)
фениламино]-[1,3,5]-триазин (Пример 50) (1,62 г, 0,21 ммоль) в сульфолане (3 мл) и диметилформамиде (5 мл) нагревают в присутствии
диизопроилэтиламина (0,08 мл) в герметично закрытой тонкостенной
стеклянной пробирке при температуре 115oC. Нагревание продолжают в течение 40 часов. Как только взаимодействие завершается,
что определяют с помощью аналитической ВЭЖХ (или ТСХ), смесь
охлаждают до 30oC, добавляют 1 н. NaOH (0,5 мл) и продукт высаживают путем добавления пропан-2-ола (50 мл). Выпавший осадок
фильтруют, промывают ацетоном (30 мл) и повторно растворяют в
минимальном объеме воды, и повторно высаживают путем добавления этанола. Осадок после фильтрования промывают эфиром (30 мл) и сушат в
вакууме при температуре 50oC. Выход составляет 1,59 г
(85%); MC(ES) m/z 911,7 (М-2H)2-; MB 1869,9 (2Na).
Пример 53
Динатриевая соль 4', 4-бис-{ 4,
6-бис-[3-(3,5- дикарбамоилпиперидин-1-сульфонил)фениламино] -[1,3,5]
триазин- 2-иламино}дифенил-2,2'-дисульфоновой кислоты
Указанное в заголовке соединение получают в соответствии со
способом по примеру 53, применяя динатриевую соль 4,4'-диаминодифенил-2,
2'-дисульфоновой кислоты (40 мг, 0,1 ммоль) и 2-хлор-4,6-бис-[3-(3,5-дикарбамоилпиперидин-1-сульфонил) -фениламино]-[1,3,
5]триазин (Пример 50) (176 мг, 0,23 ммоль) в 60 мл ДМСО-сульфолане (1:3,
объем/объем) и диизопропилэтиламине (0,08 мл). Продукт получают в виде твердого продукта кремового цвета (153 мг, 83%); т. пл.
> 250oC, разл.; MC(ES) (m/z) 898,3 (М-2H)2-;
MB 1843,9 (M+2Na).
Пример 54
1,2', 1'', 1'''-[(2,2'-Дисульфо[1,1'-дифенил] -4,4'-диил)- бис[имино-1,
3,5-триазин-6,2,4-триилбис(имино-3,1-фениленсульфонил)] тетракис[3,
5-пиперидиндикарбоновая кислота]
Указанное в заголовке соединение получают в соответствии со способом по примеру 52,
применяя динатриевую соль 4,4'-диаминодифенил-2,2'-дисульфоновой кислоты
(270 мг, 0,68 ммоль) и 2-хлор-4,6-бис-[3-(3,5-дикарбоксилпиперидин-1-сульфонил) фениламино]-[1,3,5]триазин (Пример 51) (1,1 г,
1,43 ммоль) в 60 мл ДМСО-сульфолане (1:1, объем/объем) и
диизопропилэтиламине (1,2 мл). Продукт, после высаживания путем добавления пропан-2-ола, фильтруют, промывают ацетоном (30 мл), сушат,
повторно растворяют в минимальном объеме воды и повторно
высаживают путем подкисления (HCl) до pH 1-2. Желаемый продукт получают в виде твердого продукта кремового цвета (1,0 г, 80%); т.пл. >
250oC, разл.; MC(ES) (m/z) 902,2 (M-2H)2- MB 1807,8.
Пример 55
3-Нитрофенил-N,N-бис(2-гидроксиэтил)сульфониламин
Диэтаноламин (Aldrich; 25,0 г,
0,238 моль) растворяют в 55 мл 9:1 метиленхлорид/ТГФ и
охлаждают до 5oC. За период в 10 минут добавляют раствор 3-нитробензолсульфонилхлорида (Aldrich; 25,0 г, 0,113 моль) в 35 мл ТГФ.
Ледяную баню удаляют; реакционную смесь перемешивают в
течение еще 30 минут. Затем растворители сливают и остаток распределяют между водой (100 мл) и этилацетатом (150 мл). Водный слой экстрагируют
тремя порциями этилацетата по 25 мл. Объединенный
органический слой сушат над MgSO4, фильтруют через слой окиси кремния и концентрируют в вакууме. Продукт кристаллизуют без продолжения
выпаривания и фильтруют с получением 17,4 г (53,2%)
белых игольчатых кристаллов. Т. пл. 99-100oC. MC(ES) m/z 291,2 (М+H)1+.
Пример 56
3-Аминофенил-N,
N-бис(2-гидроксиэтил)сульфониламин
Нитросоединение (Пример 55, 17,2 г, 59,3 ммоль) и 1,72 г 10% Pd/C суспендируют в 170 мл этанола. Смесь восстанавливают при давлении 40 фунт/дюйм2
водорода в течение двух часов. Катализатор
отфильтровывают и прозрачный бесцветный фильтрат выпаривают досуха с получением 15,4 г (98% выход) соответствующего аминосоединения. MC(ES) m/z 261,0
(М+H)1+.
Пример 57
Динатриевая соль 4,4'-бис-(4,6-бис-{3-[бис-(2- гидроксиэтил)сульфамоил)фениламино} -[1,3,5] -триазин-2-иламино) дифенил-2,2'-дикарбоновой
кислоты
Раствор трихлоритриазина (1,55 г, 8,4
ммоль) в 20 мл диоксана добавляют к 60 мл буфера при pH 7 при температуре 0oC. К полученной в результате мелкодисперсной суспензии
добавляют по каплям раствор 4,4'-диамино-2,2'-дифениловой
кислоты (P.R. 232-10; 1,55 г, 4,0 ммоль) в 10 мл воды, поддерживая pH 6,5-7,1 путем добавления 1 н. NaOH. Как только прибавление заканчивают
и pH стабилизируется, реакционной смеси дают нагреться до
температуры окружающей среды. Добавляют раствор диэтанолсульфонамида (2,6 г, 10 ммоль) в 20 мл диоксана и твердый бикарбонат натрия (0,84 г,
10 ммоль) и полученную в результате смесь нагревают с
обратным холодильником (92oC) в течение двух дней. Прозрачный желтый раствор охлаждают и слой диоксана сливают. Продукт осаждают из
водного раствора и собирают путем вакуумного фильтрования,
получая 3,16 г желаемого продукта, приблизительно 60%-ной чистоты, путем ВЭЖХ в виде белого аморфного твердого продукта. Т. пл. >
250oC, разл.; MC(ES) (m/z) 732,5 (М+2H)2+;
MB 1507,6 (M+2Na).
Пример 58
3-Аминофенил-N,N-бис(3-гидроксипропил)сульфонилимин
Раствор
3-аминофенил-N, N-бис(2-метоксикарбонилэтил) -сульфонилимина (Пример 31, 150
мг, 0,4 ммоль) в ТГФ (15 мл) добавляют к раствору LiAlH4 (3 мл, 1 М в ТГФ) при перемешивании в атмосфере азота
при температуре 0oC. Через 45 минут ТСХ показывает завершение
реакции. К раствору добавляют раствор аммонийхлорида (15 мл, 1 М) и образуется белый выпавший осадок, а раствор делается
желтым. Желтоватый раствор декантируют и белый осадок промывают этилацетатом.
Органический слой сушат над сульфатом натрия и выпаривают на роторном испарителе с получением желаемого продукта в виде
желтого масла. Выход составляет 110 мг (95,6%), (m/z): MH 289,2.
Пример 59
Динатриевая соль 4,4'-бис[4,6-ди[3-аминофенил-N, N-бис(3- гидроксипропил)сульфонилимино]-1,3,
5-триазин-2-иламино] дифенил-2,2'-дисульфоновой кислоты
Указанное в заголовке
соединение получают, используя общие условия Примера 1, где хлорангидрид циануровой кислоты (92 мг, 0,50 ммоль)
взаимодействует с динатриевой солью 4,4'-диаминодифенил-2,2' -дисульфоновой кислоты (93
мг, 0,24 ммоль) в течение 1 часа, а затем с 3-аминофенил-N,N-бис (3-гидроксипропил) сульфонилимином (708 мг, 2,
5 ммоль) (Пример 58). Как только реакция завершается, что показывает аналитическая ВЭЖХ
(или ТСХ), смесь охлаждают до 20oC, и продукт высаживают путем добавления пропан-2-ола (40 мл),
промывают на фильтре с холодным пропан-2-олом (15 мл) и сушат в вакууме при температуре
40oC. Две порции раствора сырого продукта (около 0,35 г) в деионизированной воде (200 мл) очищают по
отдельности путем препаративной ВЭЖХ-ОФ. Фракции, содержащие желаемый продукт,
объединяют, органические растворители выпаривают в вакууме (10 мм рт.ст.) при температуре 30oC, и продукт
концентрируют, обессоливают и отделяют на октадециловом (C18) картридже (900 мг,
получен от Burdick & Jackson). Картридж промывают водой (40 мл), и продукт повторно эктрагируют метанолом (60
мл). При упаривании метанола остается 162 мг (40%) желаемого продукта; т.пл.
> 300oC, разл.; MC(ES) (m/z): M-2 822,4; MB 1690,8.
ДЕЙСТВИЕ СОЕДИНЕНИЙ ПРИ ИССЛЕДОВАНИИ CHИЖЕНИЯ ВЫХОДА ВИРУСА.
Соединения исследуются на биологическую активность в опытах по уменьшению выхода вируса. Клетки-хозяева (обозначаемые как КПЧ для фибробластов крайней плоти человека, и, в качестве контроля, обычно используемая клеточная линия Африканской зеленой мартышки, в Таблицах 1 и 1а) размещают по 4 • 104 клеток/лунка в культурной среде с 2% фетальной бычьей сыворотки или 2% сыворотки теленка в 96-луночных планшетах (0,1 мл/лунка) и инкубируют в течение ночи. Соединения добавляют в отдельные лунки, получая конечные концентрации, заключающиеся в пределах от 50 до 0,1 мкг/мл при двукратных стадиях концентрирования. Через 1 час добавляют вирус, и инкубацию продолжают в течение 4 дней с РСВ или ЦМВ и в течение 2 дней - с ВИЧ. В конце эксперимента определяют количество образовавшегося вируса и вычисляют уменьшение выхода при различных концентрациях соединения. Это позволяет оценить концентрацию соединения, дающую 50% сокращения роста вируса (ИК50).
В таблицах 1 и 1а (сводка биологической активности) представлена активность соединений при исследовании снижения выхода вируса.
ДЕЙСТВИЕ СОЕДИНЕНИЙ ПРИ ИССЛЕДОВАНИИ СНИЖЕНИЯ ВИРУСНЫХ БЛЯШЕК
Соединения
исследуют на способность ингибировать образование вирусных бляшек. Клетки-хозяева, как
показано в Таблицах 1, 1a и 2, размещают по 10 клеток/лунка в 6-луночных планшетах и инкубируют в течение ночи.
Затем следует одна из двух процедур. При нормальной (перед лечением) процедуре
культурную среду заменяют 1 мл среды, содержащей соединение в заданной концентрации. Вирус (приблизительно 100
бляшко-образующих единиц в 40 мкл) добавляют через 1 час. Еще через 1 час среду заменяют
на 4 мл среды, содержащей соединение, подлежащее исследованию при заданной концентрации. Затем клетки
инкубируют в течение времени, достаточном для того, чтобы дать возможность формирования вирусных
бляшек. Возможно добавлять соединение только после того, как начнется инфицирование (последующее
лечение). В этом случае культурную среду заменяют на 1 мл среды, содержащей примерно 100
бляшко-образующих единиц. Через 1 час ее заменяют 2 мл среды роста. Через еще один период времени, указанный в
Таблице 2, добавляют еще 2 мл, содержащие соединение. В любом случае, число бляшек в
ряду лунок, содержащих набор концентраций соединения, сравнивают с их числом в лунке, где нет соединения, и
определяют ИК50 графически, с помощью полученных данных и путем определения
концентрации соединения, дающей 50% сокращение числа вирусных бляшек.
В Таблицах 1, 1a и 2 представлены данные по противовирусной активности при анализе бляшек. Как видно, соединения по примерам 1 и 4 являются активными против всех исследуемых штаммов РСВ, в концентрации примерно 0,1-0,7 мкг/мл. Активность также можно наблюдать по отношению к определенным членам других семейств вирусов (в диапазоне 3-20 мкг/мл). Эти результаты подтверждают и дополняют данные анализов уменьшения выхода, указывая на то, что эти соединения являются сильнодействующими и специфичными ингибиторами РСВ.
Таблица 1. Ингибирующие концентрации, которые ингибируют рост на 50% (уменьшение выхода) и образование бляшек, определяют как описано в тексте. Используемые штаммы вирусов представляют собой РСВ (A2), ЦМВ (Ad 169), ВПГ1 (Patton).
Используемые клетки-хозяева представляют собой фибробласты крайней плоти человека (КПЧ) и контрольные клетки.
Ингибирующие концентрации, которые на 50% ингибируют рост (уменьшение выхода) и образование бляшек, определяют как описано в тексте. Используемые штаммы вирусов представляют собой РСВ (A2), ЦМВ (Ad 169), ВПГ1 (Patton). Используемые клетки-хозяева представляют собой фибробласты крайней плоти человека (КПЧ) и контрольные клетки.
N - не проявляется воздействия на монослой клеток, фиксированных в спирте и окрашенных красителем кристалл фиолетовый.
L - появление более яркой интенсивности окраски (по сравнению с контролями) монослоя клеток, фиксированных в спирте и окрашенных красителем кристалл фиолетовый, при указанной концентрации соединения, но не при половинной концентрации.
В протоколе предварительной обработки сливающиеся клетки в 6- луночных чашках обрабатывают различными концентрациями соединения в течение 1 часа. Вирус (примерно 100 бое) добавляют в малый объем, и считают бляшки после инкубации (РСВ, ЦМВ и ПВГЧ (паравирус гриппа человека, тип 3, штамм Вашингтон), 5-8 дней; вирус гриппа и простого герпеса, 2 дня). При обработке после инфицирования, клетки сначала инфицируют в течение 1 часа, и среду (содержащую неадсорбированные вирусы) удаляют. Среду, содержащую соединение при различных концентрациях, добавляют через 2 часа или 24 часа после окончания периода инфицирования. Используемые клетки включают контроль (клетки Африканской зеленой мартышки), КПЧ (клетки фибробластов крайней плоти человека), КНБЧ (клетки нейробластомы человека), КПБМД (клетки почки быка Madin-Darby) и КПСМД (клетки почки собаки Madin-Darby).
МЕХАНИЗМ ДЕЙСТВИЯ
Для лучшего понимания механизма действия определяют время
жизненного цикла вирусов, когда соединения по примеру 1 оказывает свое
действие. Это достигается путем добавления и удаления соединения в различные моменты времени по отношению к инфицированию и
достижения при этом влияния на синтез белков вируса. Контрольные клетки
инфицируют на льду в течение 1 часа, неадсорбированный вирус удаляют, а затем инфицированные клетки инкубируют при температуре
37oC в течение 18 часов (на льду осуществляется адсорбция
вируса, но слияние не будет происходить до тех пор, пока температура не поднимется до 18oC или выше). Через 18 часов
инкубации при температуре 37oC (когда объем продолжающегося
синтеза белков управляется РНК вирусом), в течение 2 часов добавляют35C метионин, клетки лизируются и меченные белки
анализируют на гелях SDS-PAGE. Затем обнаруживаются вирусные белки N,
P и M. Если соединения по примеру 1 добавляют в количестве 10 мкг/мл непосредственно после адсорбции вируса и перед повышением
температуры инкубации до 37oC, синтез белков вируса полностью
предотвращается. Однако, когда соединение по примеру 1 добавляют хотя бы через 5 минут инкубации при 37oC, влияние
на синтез белков вируса не происходит. Следовательно, ингибируемым
процессом является процесс слияния или какая-либо непосредственно следующая за ним стадия, которая является необходимой для
последующей экспрессии вирусного гена.
Известно, что РСВ-инфицируемые клетки в тесном контакте будут сливаться, образуя синцитий, и что этот процесс зависит только от вирусных белков F, SH и G (Heminway B.R., Yu Y., Tnaka Y., Perrine K.G., Gustafson E., Bernstein J. M. , Galinski M.S. 1994. Analysis of respiratory syncytial virus F, G and SH proteins in cell fusion. Virology 200; 801-805). Образование синцития не должно затрагивать функции вируса, такие как удаление оболочки или транскрипцию, которые обычно следуют за этим и которые являются необходимыми для дальнейшей экспрессии вирусного гена.
Чтобы определить, ингибируют ли соединения по настоящему изобретению слияние или последующую стадию, их тестируют на способность предотвращать образование синцития у клеток, предварительно инфицированных РСВ. Это осуществляют с помощью инфицирования контрольных клеток путем трехкратного инфицирования в течение 1 часа, заменяя затем исходную среду свежей средой. Через 6 часов инкубации добавляют соединение. Через 24 и 48 часов инфицированные клетки исследуют под микроскопом, чтобы определить степень образования синцития. Различия в степени образования синцития, вызываемые присутствием соединения, являются легко заметными, а соединения легко классифицируются в терминах их сильнодействия при таком анализе. Реальные значения ИК50, как установлено с помощью этого метода, являются близкими друг к другу. Они составляют 0,3 и 0,05 мкг/мл для соединений 16 и 17, соответственно. Способность этих соединений ингибировать образование синцития показывает, что они действуют на стадии слияния жизненного цикла вируса.
СОЕДИНЕНИЯ ПО ПРИМЕРАМ 1 И 4 ПРЕДОТВРАЩАЮТ РОСТ РСВ IN VIVO. Для оценки противо-РСВ потенциала соединений in vivo используют инфекцию РСВ у хлопковых крыс вслед за приемом лекарства в виде аэрозоля малых частиц (АМЧ). (Gilbert В.Е., Wyde P.R., Wilson S.Z., and Meyerson L.R. 1993. SP-303 small particle aerosol treatment of influenza A virus infection in mice and respiratory virus infection in cotton rats. Antiviral Research 21; 37-45).
Соединения по настоящему изобретению исследуют в этой системе, чтобы определить, могут ли они ингибировать рост РСВ у хлопковых крыс. В эксперименте 1 (смотри Таблицу 3) животных инфицируют интраназально РСВ A2 (день 0), что приводит к респираторной инфекции. Рибавирин используют в виде 60 мг/мл в воде в распылителе и вводят в течение 2 часов дважды в день в дни 1, 2 и 3 после инфицирования. Соединение 16 используют в виде 4 и 5 мг/мл в 25 мМ NaHCO3 в распылителе и вводят в течение 4 часов перед инфицированием и в течение 8 часов в каждый из дней 1, 2 и 3. Плацебо является вода, используемая в том же самом режиме, что и соединение 16.
Животных забивают в день 4, легкие промывают и определяют титры РСВ в промывочной жидкости. В эксперименте 2 инфицированные нелеченные животные и животные, подвергающиеся действию аэрозоля из 25 мМ NaHCO3, служат в качестве контроля. Соединения по примерам 1 и 4 приготавливают в виде 5 мг/мл в 25 мМ NaHCO3. Одну группу обрабатывают соединением по примеру 1 в течение 4 часов перед инфицированием в день 0 и в течение 8 часов в каждый из дней 1, 2 и 3 (профилактический режим). Одну группу обрабатывают соединением по примеру 1 в течение 8 часов только в каждый из дней 1, 2 и 3 (терапевтический режим). Последнюю группу обрабатывают соединением по примеру 4 в течение 8 часов в каждый из дней 1, 2 и 3 (терапевтический режим). В день 4 всех животных забивают, легкие промывают и определяют титры РСВ в промывочной жидкости. В эксперименте 3 плацебо является вода, вводимая интраназально раз в день. Соединение по примеру 4 исследуют путем интраназального введения путем дозирования перед прививкой и на следующий день после нее (дни 0 и 1), путем дозировки перед прививкой и в дни 1- 3, и путем дозировки только после прививки в дни 1-3. Соединение также исследуют, вводя интраперитонально. На 4 день всех животных забивают, их легкие промывают и определяют титры РСВ в промывочной жидкости. Это делают путем определения конечной точки разбавления, которая оказывает цитопатологическое действие (ЦПД) в контрольных клетках, а также путем анализа бляшек на контрольных клетках. Легкие также гомогенизируют и определяют титры вирусов легких путем центрифугирования и осаждения материала частиц (1000 g, 10 минут) и используя разбавления супернатантов при анализе бляшек. Можно увидеть, что соединения примеров 1 и 4 ингибируют РСВ in vivo.
Реферат
Описываются новые триазинсодержащие анионные соединения общей формулы (I), где А представляет радикал, выбранный из группы, включающей а, в, с, d; С' выбран из SO3H или СООН; В' выбран из NR1 или О, где R1 выбран из H или (C1-C6) алкила с прямой или разветвленной цепью; Х выбран из Сl или радикала F, где U' выбран из группы, включающей -SO2- или -СО-, -NHC(O) или -NHC(S)-; W выбран из радикалов i) или ii), где Y представляет -(СН2)n; n = 0-6; m = 0-2; Z выбран из H, СН2ОН, СООН или CONR2R2, где R2 в каждом случае независимо выбран из H или (С1-С6)алкила, или их фармацевтически приемлемые соли или сложный эфир. Соединения пригодны для лечения вирусных инфекций, в частности, инфекций, вызванных респираторным синцитиальным вирусом. Описывается также фармацевтическая композиция на их основе. 2 с. и 40 з.п. ф-лы, 4 табл.

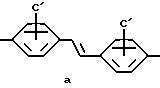

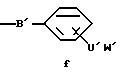
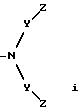
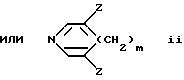
Формула

где А представляет радикал, выбранный из группы, включающей
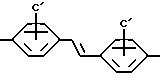




С' выбран из -SO3Н или СООН;
В' выбран из NR1 или О, где R1 выбран из H или (C1-C6) алкила с прямой или разветвленной цепью;
X выбран из Cl или радикала
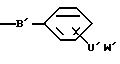
где U' выбран из группы, включающей -SO2- или -СО-, -NHC(O)- или -NHC(S)-;
W выбран из радикалов:

где Y представляет -(СН2 )n-;
n равно 0-6;
m равно 0-2;
Z выбран из H, CH2OH, СООН или CONR2R2, где R2 в каждом случае независимо выбран из H или (C1-С6)алкила,
или их фармацевтически приемлемые соли или сложный эфир.
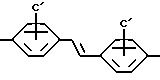
где С' является -SO3H;
W' является радикалом:

где Y является -CH2-;
Z = -CH2OH;
U', X, Y, n и m являются такими, как указано в п.1,
или его фармацевтически приемлемая соль или сложный эфир.

где С' является -SO3Н;
W' является радикалом:
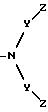
где Y является -СН2CH2-;
Z = -CONH2;
U', X, Y, n и m являются такими, как указано в п.1,
или его фармацевтически приемлемая соль или сложный эфир.

где А представляет радикал, выбранный из группы, включающей
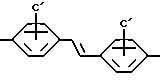
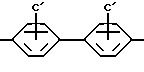


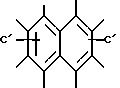
где С' выбран из -SO3Н или СООН;
В' выбран из NR1 или О, где R1 выбран из H или (C1-C6) алкила с прямой или разветвленной цепью;
Х выбран из Сl или радикала
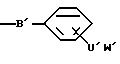
где U' выбран из группы, включающей -SO2- или -СО-, -NНС(О)- или -NHC(S)-;
W выбран из радикалов:

где Y представляет -(CH2 )n-;
n = 0 - 6;
m = 0 - 2;
Z выбран из H, СН2ОН, СООН или CONR2R2, где R2 в каждом случае независимо выбран из H или (С1-С6)алкила,
или его фармацевтически приемлемую соль или сложный эфир и один или несколько фармацевтически приемлемых носителей или наполнителей.
13.02.1996 - все пункты формулы изобретения;
27.01.1997 - примеры 28-59.

Комментарии