Способ получения производных гуанидина или их таутомеров или их солей - SU1003752A3
Код документа: SU1003752A3
Описание
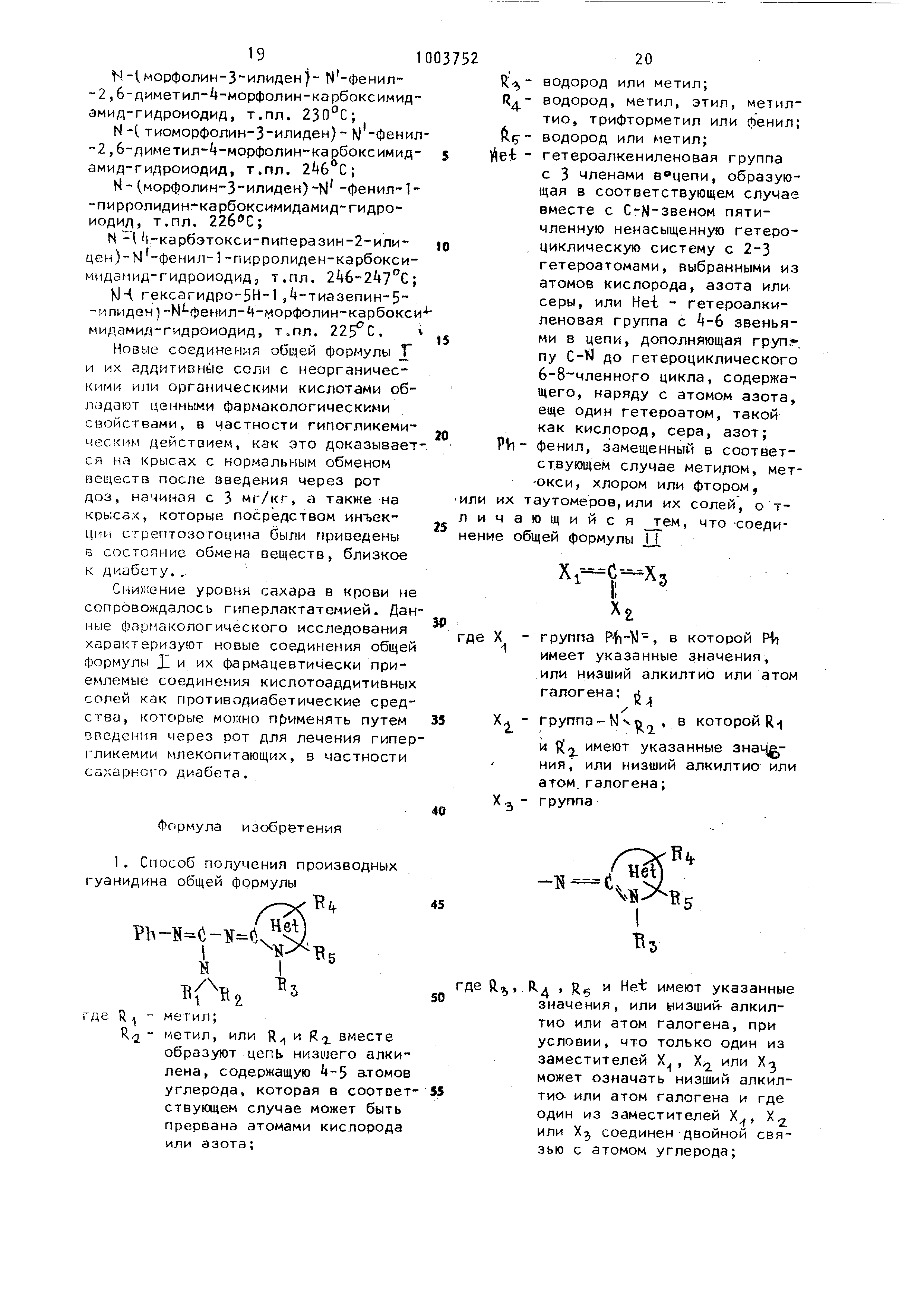
(54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ,ГУАНИДИНА ИЛИ их ТАУТОМЕРОВ,ИЛИ ИХ СОЛЕЙ Изобретение относится к способу получения новых производных гуанидина общей.формулы . где R, - метил; и .R вместе R- - метил или Ri разуют цепь низшего алкил содержащую 4-5 атомов угл рода, которая в соответст щем случае мохсет быть пре рвана атомами кислорода и азота; R- - водород или метил; R. - водород, метил, этил, мет тио, трибтфметил или фенил; Rr - водород или метил; гетероалке жленовая группа с 3 членами в цепи, образующая в соответствующем-сдучае вместе с C-N-звеном пятичленную ненасыщенную гетероциклическую систему с 2-3 гетероатомами , выбранными из атомов кислорода, азота или серы, или Het - гетероалкиленовая группа с 4-6 звеньями в цепи, дополняющая группу C-N до гетероциклического 6-8-членного цикла, содержащего наряду с атомом азота еще один гетероатом, такой как кислород, сера, азот; фенил,замещенный в соответствующем случае метилом,метокси, хлором или фтором, или ихтауетомеров ,или их солей,которые обладают ценными фармацевтическими свойствами и могут найти применение в медицине, . ен способ получения гуанидивзаимодействия аминов с алкилизотиомочевиной f1 или галоидформиламидинами f2j. Реакцию,как пра вило.пройодят в органическом растворителе при нагревании в избытке ами4ча . Цель изобретения - получение производных гуанидина или их таутомеро или их солей, обладающих гипогликемическим действием. Цель (Эстигается способом получения произ| одных гуанидина формулы Т или их таутомеров, или их солей, заключающимся в том, что соединение об|дей формулы Х-- -и . 1 I/ Лд I где Х - группа Pf)-N, в которой P4i имеет указанные значения, ил низший алкилтио или атом га логена , /R-i X А группа - N , в которой RI и Ri имеют указанные зна чения. или низшии алкилтио или атом галогена; группа где Й., f. , Rr и Hefc Имеют указаниы значения или низший алкилтио или атОм га логена, при условии, что только один из заместителей Х , Х„ или X3 может означат низший алкилтио или атом галогена и где один из заместителей Х, Х или Х соедине двойной связью с ато мом угле,рода, подвергают взаимодействию с избытком соединений формулы PhNH, или на
при температуре от комнатной до температуры кипения реакционной массы, причем используемые соединения общих
где Ха. алкилтиогруппа,
и реакцию ведут с амином формулы
, кзк правило, используют спирт формул 7ТТ содержат отсутствующую в исходном соединении общей формулы азотсодержащую группу X. , Х, и целевой продукт выделяют в свободном виде или в виде таутомеров или их солей.в Соединения общей формулы 1I в зависимости от значений X. или Х, могут иметь формулу 4 НеГ Ph-K C-N- I Х BS где Х. - низшая алкилтио или атом Г)логена; Ph, R,,Rg.,Het и C-N имеют указанные значения, или могут быть соединениями общей формулы 1, где Хз - низшая aлкилт lo. Соединения формул Паи IIЬ можно использовать в виде солей, предпочтительно в качестве гидрогалогенидов . Реакции обмена соединений формулы сГ соединением формулы ТI Г осуществляют предпочтительно в апротонных растворителях. Примерами предпочтительно применяемых растворит ей могут служить эфир, например диэтиловый и тетрагидрофуран, низкомолекулярные алифатические кетоны и слокный эфир, например ацетон, метилэтилкетон и этилацетат, ароматические углеводороды, например бензол, толуол или ксилол, а также ацетонитрил. Особенно Предпочтительно Проводить реакцию обмена в диэтиловом эфире или ацетонитриле. Если же в качестве исходного соединения общей формулы II используют соединение формулы В качестве растворителя, предпо1 тительно низкомолекулярный алканол, например этанол, изопропанол или тре тичный бутанол. Предпочтительно реакцию ведут так же в эфире, например диэтиловом эфире , или тетрагидрофуране,или ацетоЧитриле , при температурах от комнатной до температуры кипения реакционной массы. Реакции можно проводить при более высоких температурах и закрытом реакционном сосуде под давлением , например, в тугоплавкой трубке или автоклаве. Производные гуанидинов общей формулы J. получают в виде их солей, которые посредством, например, гидроли за в щелочной среде могут быть преоб разованы в соответствующие свободные основания. При реакции обмена соединений общей формулы UQ с амином общей формулы , амин предпочтительно используют в стехиометрическом избытке, например, в молярном соотношении 1:(1-2,0) и более. При использовании лишь незначительного избытка амина или кислотоаддитивной соли целесообразно добавлять дополни тельное стехиометрически эквивалентное количество третичного алкиламина например триэтиламина или N-ЭТИЛдиизопропиламина , с целью увеличения скорости реакции. Исходные вещества известны или, если они новые, их можно получить из вестными способами. Соединения общей формулы , в которой Х означает низкомолекулярну алкилтиогруппу, можно получить, например , из соответствующих тиомочевин общей формулы р,,,,4«Д $ АЗ если их подвергать реакции обмена с указанным алкилирующим средством фо мулы , в которой R означает низ комолекулярную алкильную группу, например метильную или этильную группу и означает Vi-толуолсульфонатную, метансульфонатную, фторсульфонатную или низкомрлекулярную алкилсульфатную например метилсульфатную, группу, пред почтительно галоген, например хлор или бром., Соединения формулы I it) , в которой Х в каместве отщепляемой группы означает галоген, предпочтительно хлор, получают по известному способу, подвергая изоцианиддигалогенид формулы ру(,3 реакции обмена с амином формулы HNR,,R, в присутствии триалкиламина, например триэтиламина, в инертном апротонном безводномрастворителе Соединения общей формулы , в которой отщепляемая группа означает , например, галоген, можно легко преобразовать известным способом в соединения формулы JT b , в которой Ха, означает низкомолекулярную алкоксигруппу . В зависимости от условий осуществления способа и исходных веществ получают конечные продукты в .свободной форме или в виде их солей, в частности кислотоаддитивных. Кислотоаддитивные соли новых соединений можно известным способом превратить в свободные соединения, например, основными средствами, например щелочами или ионообменниками. Полученные свободные основания могут образовывать соли с органическим или неорганическими кислотами . Для получения кислотоаддитивных солей применяются, в частности, такие кислоты, которые пригодны для формирования применимых в терапии солей , например следующие кислоты - галогензамещенные водородные, серные, фосфорные, азотная, хлорная, алифатические ,.алициклические, ароматические или гетероциклические карбоновые кислоты или сульфокислоты, например муравьиная , уксусная, пропионовап, янтарная , гликолевая, молочная, яблочная , винная, лимонная, аскорбиновая,/ малеиновая, гидроксималеиновая или пировиноградная кислоты, фенилуксусная , бензойная,Н-аминобензойная, антраниловая, -гидроксибензойная, салициловая или )1-аминоса ициловая, эмбоновая кислоты, метанбульфокислота , этансульфокислота, гидроксиэтансульфокислота , этиленсульфокислота, галогензамещенная бензолсульфокислота толуолсульфокислота, нафталинсульфокислота или сульфаниловая кислота, метионин, триптофан, лизин или аргинин . Эти или другие соли новых соединений , например пикраты, могут служить также для очистки полученных свободных оснований,если перевести свободные основания в соли, отделить их и снова высвободить из солей основания Пример 1. В охлажденный до раствор 24,2 г (0,1 моль 2,5-ДИ метил-3 изоксазолидинимин-гидроиодида в 120 мл ацетонитрила добавля ют по каплям с перемешиванием 21,25 (0,21 моль) триэтиламина. При дальнейшем охлах(дении добавляют по пор .циям 22,7 г (0,1 моль) N-фенил- -мо фолинкарбоксимидоилхлорида, причем температура реакции поддерживается равной . После окончания добавления реакционную массу перемешивают еще в течение 0,5 ч при и в течение 1 ч при комнатной температуре Реакционную смесь фильтруют, остаток на фильтре промывают небольшим количеством ацетонитрила и фильт рат упаривают в вакууме. Остаток сме шивают с ледяным 2 н. натровим щелоком и неоднократно экстрагируют хлороформом . Объединенные, промытые дО нейтральной реакции водой фазы хлоро форма после сушки над сульфатом натрия упаривают и получают сырой N- (2,5 диметил-3 изоксазолидинилиден) -N -фенил- -морфолин-карбоксимидамид Фумарат, полученный посредством реакции с фумаровой кислотой, плавится после перекристаллизации из этанол/ /этилацетата при 192-193 С. Пример 2. Аналогично примеру 1, исходя из 12,1 г (0,05 моль) 2,5-Диметил-3 изоксазол динимин-гидр иодида, 11,13 г (0,03 моль) N-фенил-1-пиперидин-карбоксимидоилхлорида; 10,63 г (0,105 моль) триэтиламина и 60 мл ацетонитрила, получают сырой N-( 2,5-Диметил-3-изоксаз6лидинилиден )- к1-фенил-1 -пиперидин-карбоксим амид. Полученный из него с помощью фумаровой кислоты фумарат плавится при 171,5-173 0 после перекристаллизации из изопропанол/этилацетата. Пример 3. Аналогично примеру 1, исходя из 11,t г (0,05 моль) 2-метил-3-йзоксазолидинимин-гидроиодида; 11,23 г (0,05 моль) М-фенил- -морфолин-карбоксимидоилхлорида 10,63 г (0,105 моль) триэт|/1ламина и 60 мл ацетонитрила, получают сырой N1- (2-метил-З-изоксазолидииилиден )-N -фeнил-t-мopфoлин-кapбoкcимидaмид (т,пл. 80-8о С, из петролейного эфира ). Полученный из него с помощью фумаровой кислоты фумарат плавится при 1б7 1б8С после перекристаллизации из этанол/эфира. Пример . Аналогично примеру 1, исходя из 12,8 г (0,05 моль) 2,5|5-триметил-З-изоксазолидинимин-гидроиодида; 11,25 г (0,05 моль) N-фeнил-4-мopфoлин-кapбoкcимидoилхлорида; 10,63 г (0,105 моль) триэтиламина и 60 мл ацетонитрила, получают сырой N4 2,5,5-триметил-2-изоксазолидинилиден )- -фенил-4-морфолинкарбоксимидпмид . Полученный из него с помощью фумаровой кислоты фумарат плавится при 203-20 С после перекристаллизации из этанол/эфира. Пример 5. В раствор, содержащий 12,26 г (0,05 ,М-тетраметилен-N -фенил-хлорформамидиний хлорида (соответствует фенилимино-хлоругольная кислота-пирролидиниламид-гидрохлорида и 12,1 г (о,05 моль) 2,5-Диметил-3 изоксазолидинилимин-гидроиодида в 50 мл ацетонитрила , добавляют с перемешиванием и охлаждением г (0,15 моль) триэтиламина. Температуру реакции поддерживают равной С. Реакционную смесь перемешивают в течение 15 ч при комнатной температуре, а затем фильтруют. Фильтрат выпаривают в вакууме и фильтруют остаток с хлороформом через силикагель с диаметром зерен 0,063-0,200 мм. Фракции, содержащие необходимый продукт, объединяют и промывают ледяным натрооым щелоком и водой. Фазу хлороформа сушат через Сульфат натрия и выпаривают в вакуу ,мв, примем получают сырой Н - (2,5-Диметил-3-изоксазолидинилиден )- W Фенил- 1-пирролидин-карбоксимидамид.Полученный из него с помощью малеиновой кислоты малеат плавится при 114Иб С после перекристаллизации из зтилацетат/изопропа нола. Пример 6. а) При размешивании к 200 мл изопропанола прибавляют 19,5 г (0,05 моль) N -(1,3-Диметил-2-имияазолидинилиден )-N -фенилкарбамимидотиометиловый эфир-гидроиодида и 10,66 г (0,15 моль) пирролидина. Реакционную смесь кипятят в течение 30 ч с обратным холодильником и затем выпаривают. Остаток переносят в хлороформ и 1 н. натровый щелок. Промытая водой и высушенная сульфатом натрия органическая фаза выпаривается и остаток смешивают со смесью хлороформ/метанол/концентрированный ам910 миак в соотношении (0:10:1, фил1гтрует ся через силикагель с диаметром зерен 0,,200 мм. Фракции, содержащие целевые продукты, выпаривают в вакууме. Полученный сырой bl-(l ,3-диметил-2-имидазолидинилиден -Н -фенил-1 -Пирролидин-карбоксимидамид пере , водят путем взаимодействия с малеиновой кислотой в малеат, который плавится при 126-127 С после перекристаллизации из этилацетат/изопропанола. Исходный продукт, N-(1,3-диметил-2-имидазолидинилиден )-М-фенилкарбами мидо-тиометиловый эфир-гидроиодид). получают следующим способом. б)В раствор ,1 г 0,5 моль). МN Диметилэтилендиамина в 300 мл толуола добавляют по каплям при перемешивании в течение 1 ч раствор 52,9 бромциана в 300 мл толуола. Реакционную смесь перемешивают в течение 2 ч при ЗОС. Реакционную массу охлЗж дают, до комнатной температуры, фильл; руют и промывают остаток простым эфиром. Полученный после сушки в вакууме сырой 1,3-диметил-2-имино-имидазолидин-гидробромид плавится при 153-160 0. в) Взвесь 58,2 г (0,3 моль) 1,3-ДИ метил-2-иминоимидазолидин-гидробромида в мл хлороформа смешивается при перемешивании при с 30, г (0,3 моль) триэтиламина. Затем добавляют по каплям раствор lO, г Т0,3 моль) фенилизотиоцианата в 235 мл хлороформа и кипятят.реакционную смесь с обр атным холодильником в течение 15 ч. После охлаждения его промывают водой, сушат над сульфатом натрия и выпаривают в оакууме. Получают сырую N- 1 3-ДИметил-2-имидазолидинилиден|-М -фенилтиомочевину , которая после перекристаллизации из этанола плавится при 195-19fc. г Во взвесь ,8 г (0,1 моль) Н-(1,3 Диметил-2-имидазолидинилиден/-Н Фв илтиомочевины о 1б5 мл тетрагидрофурана добавляют по каплям с перемешиванием при комнатной температуре раствор 21,3 г (0,15 моль метилиодида в 35 мл тетрагидрофурана. Перемешивают в течение 15ч при комнатг ной температуре и затем переносят реакционную смесь в 1бО мл простого эфира . Осадок отфильтровывают, промывают простым эфиром и сушат в вакууме. ПолученныйVj- (1,3-диметил-2-имидазолидинилиден )-| -фрнилкар6амимидо-тио5210 метиловыйэфир-гидроиодид плавится при . Пример а Раствор 19,6 г N-СЗ метил-|- (1 ,3,|)тиадиазолин-2-илиден -N-фенилкарбамимидо-тиометиловый эфир-гидроиодида и 10,7 г пирролидина в 150 мл изопропанола кипятят в течение 15 ч с обратным холодильником. Затем реакционную смесь выпаривают до сухости и остаток хроматографируют через короткую, наполненную силикагелем колонну . Вначале элюируют хлороформом и затем смесью хлороформа и ацетона ) Последние фракции объединяют , размешивают с простым эфиром и полученный гидроиодид с помощью ионообменника преобразуют в гидрохлорид, Полученный Ы-ГЗ-метил- -СТ ,3,(-тиаДиазолин-2-илиден -Н-фенил- -пирролидин-карбоксимидамид-гидрохлорид плавится при 217-218Т. разложение/. Используемый в качестве исходного соединения Ы- 3-метил- -( 1 ,3, ;-тиаДиазолин-2-илиден -Ы-фенилкарбамимидотиометиловый эфир-гидроиодид получают следующим путем. б) Взвесь 52,7 г 2-имино-З- метил-f - ( 1 ,3 ,)-тиадиазолин-гидроиодида и 24,3 г калий-трет-бутилата в 500 мл те.трагидрофурана перемешивают в течение 1 ч при комнатной температуре и фильтруют через слой диатомовой зем ли. В фильтрат добавляют по каплям в течение 5 мин 29,3 г фенилизотиоцианата и перемешивают в течение t6 ч при комнатной температуре. Затем реакционную ,смесь выпаривают до сухого состояния, остаток смешивают с простым эфиром, фильтруют и еще раз перемешивают с горячим изопропанолом. Получают М- з-метил- -(1 ,3 ,)-тиадиа- золин-2-илиденЗ-м-фенилтиомочевину, т.пл. 17 -17SC. в) Раствор 25,5 г полученного соединения в 300 мл ацетонитрила смешивают с i3, г метилиодида. Раствор нагревают в течение 30 мин с обратным холодильником. Выделен ные при охлаждении кристаллы фильтруют, промывают сначала ацетонитрилом, затем простым эфиром и сушат. Таким образом получают N-f З-метил-4- (1 ,3,) -тиадиазолин-2-илиден}-Н-фенилкарбамимидотиометиловый эфир-гидроиодид, т.пл. (разложение), Пример 8, а) Раствор 17,6 г 2-амино-5-метил-1 ,3 , -тиадиазола в 350 мл изопропанола смешивают с 65,1 г этилиодида. Реакционную массу нагревают о течени 15 мин с обратным холодильником. Затем реакционную смесь выпаривают досуха , кристаллический остаток смешивают с уксусноэтиловым эфиром и раст воритель отфильтровывают-. Кристаллический остаток промывают сначала уксусноэтиловым эфиром, затем простым эфиром и сушат. Прлучоют 2-имино-3,5 -диметил-4-(1,3,1-тиодиазолин-гидро иодид с т.пл. 208 с (разложение). Аналогично можно получить следующие соли 2-иминосоединений: 2-имино-3-метил-5 этил- -(1 ,3 )-тиaдиaзoлин-г идpoиoдид , т.пл. 137138°С (разложение;; .-имино-3-метил-5 трифторметил ( 1)-типдиазолин-гидроиодид, т.пл. 187-188C (разложение ; 2.-имино-3-метил-5-метилмеркапто (1,3,)тилдиазолин-гидроиодид, т.пи. 205-206С; 2 ИМино-3-метил- -фенил-4-тиазолин-гидроиодид , т.пл. (разложение ) ; 2-имино-З,5-Диметил- -тиазолингидроиодид , т.пл. С; 2-имино-1 ,3-диметил- -1мидазолингидроиодид , т.пл. 126-J27°Ci 2-имино-3-метил- ноксазолин-гидро иодид, т.пл. 191-192 0 (разложение) 2-имино-3,,5-триметил- -оксазо169-171 лин-гидроиодид, т.пл. 2-имино-З ,5-Диметил-+-(1 ,3,)-ок диазолин-гидроиодид,Т.ПЛ. 1б9 С (разложение); Пример 9. Согласно примеру 76, но с применением эквимолекуляр ного количества полученного в примере 8 2-иминосоединения при реакции обмена с эквимолекулярным количеством фенилизотиоцианата получают сле дующие тиомочевины: ,5-Диметил- - (1 ,3 ,)-тиадиазо лин-2-илиден -М -фенилтиомочевина, т.пл. 175-17б°С; М- з метил-5-этил- - (1 ,3,+)-тиадиазолин-2-илиден -М -фенилтиомочев на, т.пл. 135-136 С; М-СЗ-метил-5-метилмеркапто-4- (1 ,3 ,)-тиадиазолин-2-илиден -М -ф нилтиомочевина, т.пл. 1бО-1б1°С; N-(3-мeтил- -тиaзoлин-2-илидeн)-N-фенилтиомочевина , т.пл. 17+-1 N-(3 метил- -Ленил- -тиазолин-2-илиден )-N-фенилтиомочевина, т.пл. 183-18 С; 1 212 Iv-(З ,5 Димётил- -тиазолин-2-илиден )- N-фенилтиомочевина, т.пл. 185186 С; . N (1 ,3-Диметил-«-имидазолин-2-или : дан)- j-фенилтиомочевина, т.пл. 221222° С; N-(3-метил- -оксазолин-2-илиден -N -фенилтиомочевина, т.пл. 1б9-170с; N -.(3 ,,5-ттриметил-4-оксазолин-2-илиден )-N -фенилтиомочевина, т.пл. 192-192,5°С. Аналогично получают из 2-имино-3 аллил- -тиазолин-гидрОиодида и фенилизоцианата М-(3-аллил- -тиазолин-2-илиден ) -N -фенилтиомочевину , т.пл. 129,5-130,5°С; 2-имино-З-метил-тиазолидин-гидроиодида и фенилизоцианата М-(3-метия-тиaзoлидин-2-илидeн )-N -фенилтиомочевину , т.пл. 17р-172С. Пример 10. Согласно примеру 7 в, но с применением приведенных в примере 9 мочевин в соответствующих раствориle.-. получают метиловые эфир-гидроиодиды: в изопропаноле 5 диметил- (1,3,)-тиадиазолин-2-илиден - м Фенилкарбамимидо-тиометиловый эфир-гидроиодид , т.пл. 13 -135 С; в тетрагидрофуране Ь|- 3-метил-5-этил - - (1 ,3,)-тиадиазолин-2-илиден - Ь)-фенилкарбамимидо-тиометиловый эфир-гидроиодид, красное масло; в тетрагидрофуране М- 3-метил-5-ме тилмерканто- -( 1 ,3 ,)-тиaдиaзoлин-2-илиден - N-фенилкарбамимидо-тиомети1овый эфир-гидроиодид, т.пл. 1бО161°С; в тетрагидрофуране N-(3 мeтил- -тиазолин-2-илиден )- М-фенилкарбамимидо-тиометиловый эФир-гидроиодид, т.пл. 17 -175°С; в тетрагидрофуране N-(З-метил- -фенил- -тиазолин-2-илиден )1 - .N-фенилкарбамимидо-тиометиловый эфир-гидроиодид , т.пл. 183-184 С; В тетрагидрофуране М-(3.5-Диметил-4-тиазолин-2-илиден )-N -фенилкарбамимидо-тиометиловый эфир-гидроиодид , т.пл. 185-186 C; в ацетонитриле N-(1,3-Диметил-А-имидазолин-2-илиден )-N -фенилкарбамимидо-тиометиловый эфир-гидроиодид, т.пл. 221 22. С; в изопропаноле N-(3-мeтил-4-oкcaзолин-2-илиден )-N -фенилкарбамимидо-тиометиловый эфир-гидроиодид, т.пл. 1i+0-1 1 C;
в изопропаиоле N-(3 ,,5 тримвтил-4-оксазолин-2-илиден )N -фенилкарбамимидо-тиометиловым эфир-гидроиодид, т.пл. 192-192,
в тетрагидрофуране Н-СЗ.+.З-триметил-+-оксазолин-2-илиден ) -N -фенилкарбамимидо-тиометиловый эфир-гидроиодид , т.пл. 139-Ill С.
П р и м е р 11. Согласно примеру 7 а соотоетствующие метилтиогидрот иодиды из примера 10, а также соответствующие амины общей формулы HNR fl{ в молярном соотношении 1:3 преобразуются в кипящем с обратным холодильником изопропаноле, третичном бутаноле или этаноле в следующие соединения в виде гидроиодидов. Как таковые гидроиодиды изолируют с помощью анионообменной смолы, преобразуют в гидрохлориды или при необходимости с помощью водного раствора щелочи преобразуются о свободные основания . Посредством реакции обмена свободных оснований с соответствующей кислотой можно также получить и другие соли.
N- ,5-Диметил-А-(1 ,3,)-тиадиазолин-2-илиден -М -фенил-1-пирролидин-карбоксимидамид . (свободное основание ), т.пл. 98-99 С;
М- 3-метил-5-этил- -(1,3,)-тиадиозолин-2-илиденЗ-Н -фенил-1-пирролидин-карбоксимидамид (свободное основание ) , т.пл. - .
N-T 3-метил-5-метилмеркапто-4-, -(1,3,0-тиадиазолин-2-илиден -М -феНИЛ-1-пирролидин-карбоксимидамид (свободное основание), т.пл. 98-99,;
М-{3-метил- -тиазолин-2-илиденЗ-М-фенил-1-пирролидин-карбоксимидакГид .. (свободное основание),т.пл. 129-130 0
Н-(3-мЪтил- -фенил- -тиазолин-2-илиден )-М -фенил-1-пирролидин-карбоксимидамид гидрохлоридJ, т.пл. 190197 С;
М -(35-Диметил- -тиазолин-2-илийден )-N-фенил-1-пирролидин-карбоксимидамид гидрохлорид j, т.пл. 220,5221 ,
Н - Cl ,3-диметил- -имидазолин-2-или 1ен)- N-фенил-1-пирролидин-карбокси-; мидамид-2НС, т.пл. 17( С (разложение ) ;
1 - 13-метил-«-оксазолин-2-илиден) - N-фенил-1-пирролидин-карбоксимидамид (св одное основание), т.пл. 9.5-95,5С;
N-(3,f ,5-триметил- -оксазолин-2-илиден )- N-фенил-1-пирролидинкарбоксимидамид (гидрохлорид, т.пл. 16Ы63°С;
N -ГЗ-метил-t- (1 ,3 ,) -тиадиазолин-2-или дан J- N-фенил-диметиламинокарбоксимидамид (основание), т.пл.
Н -(,3 15-триметил- -оксазолин-2-илидoн )-N-фeнилпиppoлидин-кapбоксимидамид (гидрохлорид), т.пл. 225226 0;
1 ,5-Диметил- -(1 ,3,5)-тиадиазолин-2-илиденЗ- N-фенилдиметиламинокарбоксимидамид (гидрохлорид), т.пл. 238-239, С (разложение);
|у(- (3,,5-тpимeтил- -oкcaзoлин-2-илидeн ), - N-фениЛдиметиламино-карбоксимидамид (Свободное основаниеJf, т.пл. 84-S6°C.
Пример 12. Раствор г 2-имино-З-метил-тиазолидинаоВ 10,3 г W-этил-диизопропиламина в 50 мл ацетонитрила в течение 15 мин добавляют каплями при комнатной температуре в раствор ,Q г Ы-фенил- -морфолин-карбоксимидоилхлорида в 50 мл ацетонитрила . Затем перемешивают в течение 2 ч при комнатной температуре и после этого в течение 3 ч с обратным холодильником. Реакционную смесь выпаривают до осушки, кристаллический остаток замешивают с изопропанолом, фильтруют растворитель и полученный твердый продукт смешивают в течение 30 мин с водой, фильтруют, промывают сначала водой, затем изопропанолом и сушат Полученный N-(3-метил-тиазолидин-2-илиден ) -N -фенил- -морфолинкарбоксимидамид плавится при 1t, ,5С.
Пример 13.Из18,5г 2-имино-3-метил-5-трифторметил- -М- (1 ,3 , -тиадиазолин-гидроиодида 10%-ним натровым щелоком высвобождают основание экстрагируют хлористым метиленом, сушат сульфатом магния и выпаривают. Полученное основание и 7,6 гК1-этилдиизопропиламина растворяют в 50 мл а етонитрила и в течение 15 мин добавляют каплями а раствор 11,Я г М-фенил-4-морфолин-карбоксимидоилхлорида в 50 мл Ацетонитрила. Затем в течение А ч перемешивают при комнатной температуре, реакционную смесь выпаривают до осушки, остаток смешивают с простым эфиром, фильтруют, эфирную вытяжку выпаривают и остаток после выпаривания хроматографируют через короткую, наполненную кизельгуром колонну. Элюируют сначала хлористым метиленом, затем смесью хлористого метилена с ацетоном в соотношении 97:3. Средние фракции объединяют , их смешивают с небольшим количеством гексана, фильтруют, промыва от гексаном и сушат. Полученный Н- 3 метил-5 Трифторметил-+-(1 ,3 ,) -тиадиазолин-2-илиденJ-N-фенил-4-нор фолин-карбоксимидамид плавится п0и по,з-11.с. 1к Из Н,6 г 2-имино Пример -3-метил- -(1 ,3, -тиадиазолинтидроиодида натровым щелоком высвобождают основание, включают в хлористый метилен, сушат безводным сульфатом магния и выпаривают. Полученное основание и г этил-диизопропилами на растворяют в 50 мл ацетонитрила и в течение 15 мин добавляют по каплям раствор 11,2 г Н-фенил- -морфоЛин1 ;арбоксимидоилхлорида в 50 мл ацетонитрила . Затем в течение 1 ч перемешивают при комнатной температуре и в течение 3 ч с обратным холодильником . Реакционную смесь выпаривают до осушки и остаток выпаривания хроматографируют через наполненную кизельгуром колонну. Элюируют хлороформом, и полученное основание с помощью спир та, насыщенного хлористым водородом, преобразуют в гидрохлорид. После перекристаллизации из ацетонитрил-уксусного эфира получают чистый N- 3-метил- (1 ,3,)-тиадиазолин-2-или- 1ен -Н-фенил- -морфолин-карбоксимидамид-гидрохлорид с ,201 ,5-2U2,5Ci Пример 15. Аналогично примеру 1 из 8,0 г 2-имино-3-метил-4 ( из Л)тиадиазолина и 16,7 rN-фенил- 1 пиперндин-карбоксимидоилхлорида получают N- 3-мети -4-С1 ,3,)-тиадиазолин-2-илиденЗ- N-фeнил-1-пиперидии-карбоксимидамид , т.пл. ,. Пример 16. Аналогично примеру из 6,3 г 2-имино-3-метил-|-тиазолина и 11,2 г К -фенил-4-морфолин-карбоксимидоилхлорйда получаютМ -(3 -метил-|-тиазолин-2-илиден)-М-фенил- -морфолин-карбоксимидамид , т.оЛ.209 210С. . . Пример 17. 12,0г 2-имино-3 ,5-диметил-А-(1 ,3,t) -оксадиазолингидроиодида подвергают реакции обмена с 11,2 г N-6eмил-4- opфoлин-кapбoкcимидоилхлорида . Реакционную смесь пере мешивают при комнатной температуре в течение 16 ч. Реакционную смесь выпаривают и хроматографируют через наполненную силикагелем колонну. Злюируют сначала хлороформом, затем смесью хлороформа с ацетоном в соотношении 95:5 и смесью хлороформа с ацетоном в соотношении 95:5. Из последних фракций получают глдрохлорид, который смешивают с натровым щелоком. Вначале маслянистое основание вскоре кристаллизуется, Полученный .5 диметил- -(1,3,)-оксадиазолин-2-илиденЗ-М -фенил- -морфолин-карбоксимидамид плавится при 117-118°С. Пример 18. В 200 мл тетрагидрофурана и 111 мл 20%-ного раствора фосгена в толуоле (0,21 моль) добавляют с перемешиванием г (,0,21 моль N-фeнил-N ,N -тетраметилентиомочевину , причем температура не должна превышать 35°С, Перемешивают еще в течение 15 мин при 20 С, oxлaждaюt до 10° С и смешивают реакционную смесь (суспензию Ы,М-тетраметилен-Ы-фенил-хлорформамидиНИИ-хлорида ) со 100 мл ацетонитрила и г (0,21 моль) 2,5-Диметил-З-изоксазолидинимин-гидроиодида , После добавления по каплям 6,8 г (0,6 моль) триэтиленамина пои 10-15 С взвесь перемешивают еще в течение 12 ч при 20С. Фильтруют, выпаривают фильтрат в вакууме и растворяют остаток в ледяной 2 н. соляной кислоте . Сырой N-(2,5 Димeтил-3-изoкcaзoлидинилидeн - W-фенил-1-пирролидинкарбоксимидамид-гидрохлорид экстрагируют хлороформом и экстракт хлороформа промывают 2 н. натровым щелоком и водой, сушат через сульфат натрия и выпаривают. Получают сырой N-(. 2,5-диметил-3 изоксазолидинилиден )- hJ -фенил-1-пирролидин-карбоксимидамид . Получаемый из него с малеиновой кислотой малеат плавится при (из этилацетата). Вариант. Упрощение способа заключается в том, чтр в раствор пирролидина в эфире или тетрагидрофуране добавляют по каплям фенилизотиоцианат , в образовавшуюся взвесьti-фенил-Н ,М -тетраметилентиомочевины вводят эквивалентное количество фосгена и далее обрабатывают реакционную, смесь, как описано. Пример 19. В раствор 8,7 г (0,05 моль| фенилизоцианиддихлорида в 120 мл ацетонитрила добавляют каппями с перемешиванием при температуре от -10 до смесь 3.6 г (0,05 моль) пирролидина и 15.2 г 171 ( 0, моль) триэтиламина. Реакционную смесь перемешивают еще в течение 15 мин при О С и затем добавляют 12,1 г (0,03 мол{1) 2,5-Диметил-З-изо ксазолидинимин-гидроиодида, причем температура не должна превышать 10 С Взвесь перемешивают в течение 1 ч np 20°С. Фильтруют, выИаривают фильтрат и распределяют остаток между хлороформом- и 2 н. натровым щелоком. Нейт рально промытая водой и высушенная сульфатом натрия хлороформная фаза в паривается, и получают сырой N-|2 5 -диметил-3-изоксазолидинилиден -М-фенил-1-пирролидин-карбоксимидамид . Получаемыи из него с малеиновои кисЛотои сырой малеат очищают фильтрова нием через силикагель с крупностью зерен .0,063-0,2 мм смесью растворите ля хлороформа с метанолом в соотношении 95:5. Чистый N-(|2,5-Диметил-3-изоксазолидинилиден )- | -фенил-1 -п .ирролидин-карбоксимидамид-малеат плавится после перекристаллизации из этилацетата при 112-114 С. i Пример 20. Взвесь 3 г1 -й-мети1 -морфолин-3-илиден | -Н-фенил-5-метил-изотиомочевина-гидроиодида в 25 .мл ацетонитрила смешивают, перемешивая; с 2,5 г морфолина. Смесь кипятят в масляной ванне с обратным холодильником в течение 36 ч. Ацетонитрил выпаривают при пониженном дав . лении и остаток перекристаллизовывают из смеси изопропанола и этилового ют иа меси иаиприпанилс и .илиии, и эфира уксусной кислоты. ПолучаютN- (г -метил-морфолин-3-илиден)-М-фенил-4-морфолин-карбоксИмидамид-гидроиодида , который после перекристаллизации из смеси ацетона и этилового эфира уксусной кислоты плавится при 165° С. Исходное вещество для указанного синтеза получают следующим образом. Раствор 23 г Л-метил-морфолин-3рна в 100 мл безводного хлористого метилена перемешивают с охлаждением с 30 г триэтилоксоний-фторбората в 100 мл хлористого метилена. Реакционную смесь перемешивают в течение 16 ч в атмосфере азота. Затем в смесь в течение 3 ч вводят аммиак. Реакционную смесь оставляют на 30 ч при комнатной температуре, и раствор л выпаривают на водяной ванне при иС при пониженном давлении. Сырой -меТИЛ-З-ИМИНО-МОРФОЛИН растворяют в 100 мл ацетонитрила и, перемешивая при комнатной температуре, смешивают 5218 с 2k г фенилйзотиоцианата в 60 мл ацетонитрила. Смесь перемешивают и концентрируют в течение Ш ч, причем выделяется кристаллический продукт . Его перекристаллизовывают из смеси изопропанола и этилосо| о эфира уксусной кислоты. Получают N-ftt-метил-морфолин-3-илиден )-М -фенилтио-. . мочевину,которая плавится при 121-122 С. N-(-иетил-морфолин-3-илиден )-Ы-фенилтиомочевины 0 мл диоксана смешивают, перемешивая ,по каплям с 10 г метилиодида « 30 мл диоксана. Смесь нагревают на ванне в течение 3 ч. Диоксан получают при пониженном давлении и остаток перекристаллизовывают из смеси ацетона и этилового эфира ук Получают М- -метил-морфолин-3-илиден )-Ы-фенило метил-. -изотиомочевина-г;идроиодид, который плавится при ., Пример 21.Смесь 3,6 г N-фенил-1 - (морфолинил) -S -метилизотиомочевина-гидроиодида и 2 г 2-амино-2-тиазолина в 30 мл ацетонитрила кипятят с обратным холодильником в течение 8 ч. Растворитель выпаривают при пониженном давлении, остаток превращают с помощью щелочи в основание и экстрагируют хлористым метиленом. Сырое основание хроматографируют на силикагеле в этиловом эфире уксусной кислоты и колонну элюируют этиловым эфиром уксусной КИСЛОТЫ, содержащим возрастающие количества метанола. Поздние фракции дают масляное основа которое обрабатывают хлористым водородом в изопропаноле. Получают 1-(А-морфолинил)-ы-фенил-М-(2-тиазолинил )-формамидин-гидрохлорид, который после перекристаллизации из смеси метанола и диэтилового эфира плавится при 225-227С. П р и м е р 22. Аналогично примерам 1-21 получают следуюи1ие соединения : Н- тиоморфолин-З-илиден)-N -фенил- |-морфолин-карбоксим1 дамид-гидроиодид , т.пл. , N-(тиоморфолин-3-илиден)- N-4-дифенил-1-пиперидин-карбоксимидамидгидроиодид , т.пл. , N-(морфолин-3-илиден)- N -фенил-t-морфолин-карбоксимидамид-гидроиодид . т.пл. 228®С; j М-(морфолин-3-илиден - -фенил- пиперидин-карбоксимидамид-гидроиодид , т.пл.. .202С; 191 Н- морфолин-З-илиден)- N-фенил-2 ,6-диметил- -морфолин-карбоксимидамид-гидроиодид , т.пл. 230°С; N-( тиоморфолин-3-илиден) М-фенил -2,6-диметил-4-морфолин-карбоксимидамид-гидроиодид , т.пл. С; - (морфолин-3 илиден)-Ы -фенил-1-пирролидин:карбоксимидамид-гидроиодид , т.пл. 22бС; N -I 1-карбэтокси-пиперазин-2-илис;ен )-Ы-фенил-1 -пирролиден-карбоксимидамид-гидроиодид , т.пл. 2k6 2kJ°C, bJ4 гексагидро-5Н-1 ,-тиазепин-5-илиден ) -Н фенил- г1Орфолин-карбокси мидамид-гидроиодид, т.пл. 22 С. Новые соединения общей формулы JT и их аддитивнь1е соли с неорганическими или органическими кислотами обладают ценными фармакологическими свойствами, в частности гипогликемическим действием, как это доказывает ся на крысах с нормальным обменом веществ после введения через рот доз, начиная с 3 мг/кг, а также на крысах, которые посредством инъекции сгрептозотоцина были приведены в состояние обмена веществ, близкое к диабету.. Снижение уровня сахара в крови не сопровождалось гиперлактатемией. Дан ные фармакологического исследования характеризуют новые соединения общей формулы X и их фармацевтически приемлемые соединения кислотоаддитивных солей как противодиабетические средства , которые MowHo применять путем введения через рот для лечения гипер гликемии млекопитающих, в частности CoxapHoio диабета. Формула изобретения 1. Способ получения производных гуанидина общей формулы . b-:s( , Де R метил; метил, или R и RT. вместе образуют цепь низшего алкилена , содержащую -5 атомов углерода, которая в соответ ствующем случае может быть прервана атомами кислорода или азота; водород или метил; водород, метил, этил, метилтио , трифторметил или фенил; водород или метил; гетероалкениленовая группа с 3 членами , образующая в соответствующем случае вместе с С-М звеном пятичленную ненасыщенную гетероциклическую систему с 2-3 гетероатомами, выбранными из атомов кислорода, азота или серы, или Hei - гетероалкиленовая группа с -6 звеньями в цепи, дополняющая групг, пу C-N до гетероциклического 6-8 членного цикла, содержащего , наряду с атомом азота, еще один гетероатом, такой как кислород, сера, азот; фенил, замещенный в соответствующем случае метилом, мет-окси , хлором или фтором, аутомеров,или их солей, о тщийся гем, что соедией формулы JJ. Х - С----Хз группа Pfi-M-, в которой F4f имеет указанные значения, или низший алкилтио или атом галогена; группа-Ыч , в которой R и . имеют указанные знаЦ,ния , или низший алкилтио или атом.галогена; группа л . R5 имеют указанные значения, или низший- алкилтио или атом галогена, при условии, что только один из заместителей Х , Х или X-j может означать низший алкилтио . или атом галогена и один из заместителей Х, или Xj, соединен двойной зью с атомом углерода;
211003752 22
подвергают взаимоде1 ствию с избяткомщих формул j 1.1 содержат отсутствуюсоепинений общих формулjTl; щую в исходном соединении общей форPhT H , HNR,R,MAMмулы U азотсодержащую группу Х, Х,
/ iVBi свободном виде или в виде таутомё-
щ А Р° солей.
.Источники информации,
I 5 -принятые во внимание при экспертизе
-R1, Патент СССР № 382280,
.10 кл. С 07 С 129/12, опублик. 1973.
при температуре от комнатной до тем-2. Von Е. Kuhte. Umsetzungen von
пературы кипения реакционной массы,Isocyanlddinatogen. - Ang. Chem.,
причем используемые соединения об-19б9 81, 18-32.
или Хз и целевой продукт выделяют в









Реферат

Формула



Комментарии