Пробиотические штаммы для применения в лечении или профилактике остеопороза - RU2636027C2
Код документа: RU2636027C2
Чертежи





Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится по меньшей мере к одному пробиотическому штамму, выбранному из Lactobacillus paracasei, или по меньшей мере одному пробиотическому штамму, выбранному из Lactobacillus paracasei в комбинации по меньшей мере с одном пробиотическим штаммом, выбранным из Lactobacillus plantarum, для применения в лечении или профилактике остеопороза, или для применения с целью повышения абсорбции ионов Ca2+ у млекопитающего, предпочтительно у человека.
Уровень техники
Остеопороз является заболеванием, при котором кости становятся хрупкими и более подверженными переломам. Обычно снижается плотность костей, которая определяется количеством кальция и минералов в кости. Остеопороз является наиболее распространенным типом заболеваний костей. Примерно у половины женщин в возрасте старше 50 лет развивается перелом костей бедра, запястья, или позвонков (костей позвоночника) в течение жизни. Кость является живой тканью. Существующая кость постоянно замещается новой костной тканью. Остеопороз развивается, когда организм неспособен формировать достаточную костную ткань, когда слишком много существующей костной ткани реабсорбируется организмом, или при комбинации этих факторов. Кальций является одним из важных минералов, необходимых для формирования кости. При недостаточном употреблении кальция и витамина D или при недостаточной абсорбции кальция, поступающего с пищей, кости могут стать хрупкими и более подверженными переломам. Снижение эстрогена у женщин при менопаузе и снижение тестостерона у мужчин является ведущей причиной потери костной массы. Переломы, вызванные остеопорозом, являются серьезной проблемой для здоровья, и приводят к огромной экономической нагрузке на систему здравоохранения. Риск развития связанного с остеопорозом перелома в течение жизни является высоким в странах Запада (около 50% у женщин и 20% у мужчин), и переломы связаны со значительной смертностью и заболеваемостью. Кортикальное вещество кости составляет примерно 80% костной ткани в организме, и в некоторых исследованиях было показано, что кортикальное вещество является главной детерминантой прочности кости, и таким образом, склонности к переломам. Потеря костной массы в возрасте старше 65 лет обусловлена главным образом потерей кортикального вещества, а не губчатого вещества кости (Lancet, 2010, May 15; 375 (9727): 1729-36).
Скелет ремоделируется остеобластами (ОБ), формирующими кость, и остеокластами (ОК), резорбирующими кость. Макрофагальный колониестимулирующий фактор (M-CSF) повышает пролиферацию и выживание клеток-предшественников ОК, а также осуществляет повышающую регуляцию экспрессии активатора рецептора нуклеарного фактора кВ (RANK) в ОК. Это позволяет RANK лиганду (RANKL) связываться и начинать сигнальный каскад, приводящий к формированию ОК. Эффект RANKL может быть ингибирован остеопротегерином (ОПГ), который является рецептором-ловушкой для RANKL.
Связь между воспалением и потерей костной ткани хорошо изучена, и резорбция кости остеокластами при аутоиммунных заболеваниях управляется воспалительными цитокинами, продуцируемыми активированными Т-клетками. Кроме того, в некоторых исследованиях показано, что неспецифическое системное воспаление, о котором свидетельствую умеренно повышенные сывороточные уровни высокочувствительного С-реактивного белка (вчСРБ), связано с низкой минеральной плотностью костной ткани, повышенной резорбцией кости и увеличенным риском переломов. Дефицит эстрогена, развивающийся после менопаузы, приводит к повышению образования и удлинению выживания остеокластов. Полагают, что это обусловлено рядом факторов, включая потерю иммуносупрессивных эффектов эстрогена, что приводит к повышенной продукции цитокинов, стимулирующих остеокластогенез, и прямых эффектов эстрогена на ОК. В соответствии с этими данными, блокада воспалительных цитокинов ФНО-альфа и ИЛ-1 приводит к снижению маркеров резорбции костной ткани у женщин в раннем постменопаузальном периоде.
В недавние годы интенсивно изучалось значение кишечной микробиоты (КМ) для здоровья и заболеваний. КМ состоит из триллионов бактерий, которые вместе содержат в 150 раз больше генов, чем человеческий геном. Она приобретается при рождении, и хотя и является отдельной структурой, явно совместно эволюционирует с человеческим геномом, и может считаться многоклеточным органом, который сообщается с хозяином и влияет на него множеством способов. Состав КМ модулируется рядом факторов окружающей среды, такими как рацион и применение антибиотиков. Молекулы, продуцируемые кишечными бактериями, могут быть как благоприятными, так и вредными, и как известно, влияют на эндокринные клетки в кишечнике, энтеральную нервную систему, проницаемость кишечника и иммунную систему. Утверждается, что нарушение микробного состава вовлечено в ряд воспалительных состояний внутри и вне кишечника, включая болезнь Крона, язвенный колит, ревматоидный артрит, рассеянный склероз, диабет, пищевые аллергии, экзему и астму, а также ожирение и метаболический синдром.
Пробиотические бактерии определяются как живые микроорганизмы, которые при применении в адекватных количествах обеспечивают благоприятное влияние на организм-носитель, и как полагают, изменяют состав кишечной микробиоты. Предполагаемые механизмы, лежащие в его основе, являются многочисленными, включая повышенную растворимость и абсорбцию минералов, усиленную барьерную функцию и модуляцию иммунной системы.
В Gilman et al, «The effect of Probiotic Bacteria on Transepithelial Calcium Transport and Calcium uptake in Human Intestinal-like Caco-2 cells», Curr. Issues Intestinal Microbial. 7: 1-6 («Влияние пробиотических бактерий на трансэпителиальный транспорт кальция и поглощение кальция в Сасо-2 клетках, подобных клеткам тонкой кишки человека») тестировали влияние штамма Lactobacillus salivarius (UCC 118) и штамма Bifidobacterium infantis (UCC 35624) на поглощение кальция и трансэпителиальный транспорт кальция в культуре Сасо-2 клеток, подобных клеткам тонкой кишки человека. Указанные штаммы не оказывали влияния на трансэпителиальный транспорт кальция в полностью дифференцированных Сасо-2 клетках в возрасте 16 суток. Поглощение кальция в монослоях Сасо-2 клеток спустя 24 часа существенно повышалось в клетках, подвергшихся воздействию Lactobacillus salivarius.
WO 99/02170 описывает применение лактобацилл в препарате не ферментированных энтеральных композиций для облегчения или повышения абсорбции минералов из рациона, таких как кальций, цинк, железо и магний. Экспериментами, выполненными в нем, поддерживающими заявленную абсорбцию, является in vitro модель транспортировки кальция с применением интестинальных линий Сасо-2 (карциногенной клеточной линии).
KR 101279852 раскрывает композиции для профилактики или лечения остеопороза, содержащие кальций и магний, в дополнение к специфическим штаммам молочнокислых бактерий, таких как Streptococcus thermophilus с номером депонированного штамма КСТС 11870ВР, Lactobacillus rhamnosus с номером депонированного штамма КСТС 11868ВР, и Lactobacillus paracasei с номером депонированного штамма КСТС11866ВР.
В данной области техники остается потребность в эффективных способах профилактики и лечения остеопороза у человека.
Сущность изобретения
Настоящее изобретение относится в одном аспекте по меньшей мере к одному пробиотическому штамму, выбранному из Lactobacillus paracasei, или по меньшей мере одному пробиотическому штамму, выбранному из Lactobacillus paracasei в комбинации по меньшей мере с одном пробиотическим штаммом, выбранным из Lactobacillus plantarum, для применения в лечении или профилактике остеопороза, или для применения с целью повышения абсорбции ионов Са2+ у млекопитающего, предпочтительно у человека.
Краткое описание фигур
Фиг. 1 раскрывает транспорт Са2+, тестированный с различными бактериальными штаммами, как описано в Эксперименте 1 и 2.
Фиг. 2 раскрывает оставшийся внутриклеточный Ca в клетках спустя 2 часа, как описано в Экспериментах 1 и 2.
Фиг. 3 описывает дизайн эксперимента и массу тела из эксперимента 3. Изложен дизайн эксперимента (А). У мышей в возрасте восемь недель применяли несущую среду (veh), отдельный Lactobacillus (L) штамм (L. para) или смесь трех штаммов (L. mix) в течение 6 недель, начиная за две недели до овариэктомии или имитации операции. Штаммы лактобацилл давали в питьевой воде в концентрации 109 колониеобразующих единиц (КОЕ) на мл, в то время как контрольные мыши получали питьевую воду с несущей средой. В конце исследования у мышей в возрасте 14 недель собирали ткани для последующего анализа. Овариэктомия приводила к ожидаемому повышению массы тела, по сравнению с мышами с имитацией операции, у которых не отмечено изменений после применения пробиотиков (В). Результаты приведены в виде среднего значения ± СКО (n=9-10), **р<0,01. С помощью критерия Стьюдента сравнивали овариэктомию и имитацию операции.
На Фигуре 4 показано, что пробиотики защищают мышей от индуцированной овариэктомией потери кортикальной костной ткани. У мышей в возрасте восьми недель применяли несущую среду (veh), отдельный Lactobacillus (L) штамм (L. para) или смесь трех штаммов (L. mix) в течение 6 недель, начиная за две недели до овариэктомии или имитации операции, для изучения профилактического влияния на индуцированную овариэктомией потерю костной ткани. В конце эксперимента анализировали выделенные бедренные кости с помощью микрокомпьютерной томографии высокого разрешения и периферической количественной компьютерной томографии (пККТ). Приведены примерные мкКТ изображения одной кортикальной секции от групп с имитацией операции и овариэктомией, получавших несущую среду и L. mix (А). Минеральную плотность кости в кортикальном слое (МПК) (В) и кортикальную область (С) измеряли путем пККТ в среднем диафизальном участке бедренной кости. Результаты приведены в виде среднего значения ± СКО (n=9-10), **р<0,01, *р<0,05. С помощью критерия Стьюдента сравнивали овариэктомию и имитацию операции, *р<0,05, проводили тест ANOVA с последующим применением апостериорного критерия Даннета внутри групп, групп с овариэктомией и применением L. Рага и L. mix против группы со овариэктомией и применением несущей среды.
Фиг. 5 раскрывает, что пробиотики снижают экспрессию воспалительных цитокинов и отношение RANKL/ОПГ в кортикальном слое кости. QRT-PCR анализ экспрессии генов, которые, как известно, стимулируют резорбцию костной ткани; (А) Фактор некроза опухоли - альфа (ФНО-α), (В) Интерлейкин-1-бета (ИЛ-1-β), (С) Интерлейкин-6 (ИЛ-6), (D) отношение активатора рецептора лиганда нуклеарного фактора каппа-В (RANKL) и остеопротегерина (ОПГ), и индивидуальные графики для (Е) ОПГ, (F) RANKL и генов, которые, как известно, стимулируют формирование костной ткани; (G) Osterix, (Н) коллаген I типа a1 (ColIa1) и (I) остеокальцин в кортикальном слое кости у 14-недельных мышей после овариэктомии (ovx), получавших либо несущую среду (veh), либо смесь трех пробиотических штаммов Lactobacillus (L. mix) в течение 6 недель, начиная за две недели перед овариэктомией или имитированной операцией, для изучения профилактического эффекта лечения пробиотиками в отношении индуцированной овариэктомией потери костной ткани. Результаты приведены в виде среднего значения ± СКО (n=9-10), *р<0,05. С помощью критерия Стьюдента сравнивали овариэктомию и имитацию операции.
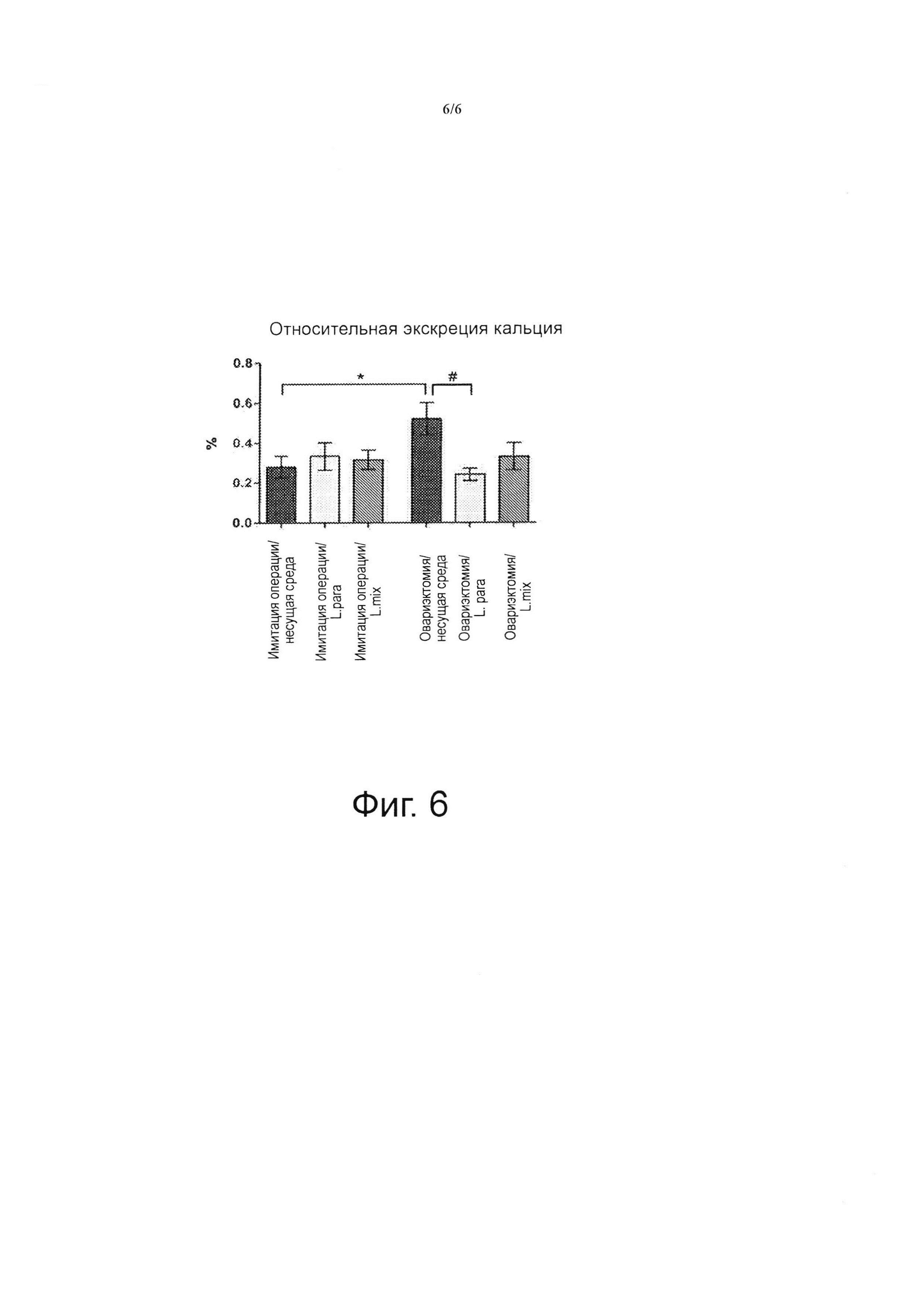
Фиг. 6 раскрывает, что относительная экскреция кальция повышается после овариэктомии у мышей, получавших несущую среду, но не у мышей, получавших L. para или L. mix. Кальций и креатинин измеряли в сыворотке и моче 14-недельных мышей, получавших несущую среду (veh), отдельный Lactobacillus (L) штамм (L. para) или смесь трех штаммов (L. mix) в течение 6 недель, начиная за две недели до овариэктомии или имитации операции. Относительную экскрецию кальция с мочой рассчитывали по формуле FECa= (уровень кальция в моче × сывороточный уровень креатинина) / (сывороточный уровень кальция × уровень креатинина в моче). Результаты приведены в виде среднего значения ± СКО, n=5-10 в каждой группе. *р<0,05. С помощью критерия Стьюдента сравнивали овариэктомию и имитацию операции, *р<0,05, проводили тест ANOVA с последующим применением апостериорного критерия Даннета внутри групп, групп с овариэктомией и применением L. Para и L. mix против группы со овариэктомией и применением несущей среды.
Раскрытие изобретения
Настоящее изобретение относится в одном варианте осуществления по меньшей мере к одному пробиотическому штамму, выбранному из Lactobacillus paracasei, или по меньшей мере одному пробиотическому штамму, выбранному из Lactobacillus paracasei в комбинации по меньшей мере с одном пробиотическим штаммом, выбранным из Lactobacillus plantarum, для применения в лечении или профилактике остеопороза, или для применения с целью повышения абсорбции ионов Са2+ у млекопитающего, предпочтительно у человека.
Настоящее изобретение относится в одном варианте осуществления по меньшей мере к одному пробиотическому штамму для применения в лечении или профилактике остеопороза путем предотвращения потери кортикальной костной ткани, путем предотвращения потери минеральной плотности костей, и путем предотвращения резорбции костей.
Кортикальная костная ткань составляет примерно 80% от кости в организме, и в некоторых исследованиях было показано, что кортикальная костная ткань является главной детерминантой прочности кости, и следовательно, склонности к переломам. В экспериментах из настоящего изобретения было показано, что пробиотический штамм Lactobacillus paracasei, по отдельности или в комбинации со штаммами видов Lactobacillus plantarum, предотвращает потерю кортикальной костной ткани. Также в экспериментах из настоящего изобретения было показано, что применение пробиотиков изменяет иммунный статус в кости, приводя к ослаблению резорбции костной ткани. Кроме того, в экспериментах из изобретения также было показано, что минеральная плотность кости не снижается в группе, получавшей пробиотики, по сравнению с группой, получавшей несущую среду (Фигуры 4А-С). Минеральная плотность кости в кортикальном слое была выше во обеих группах получавших пробиотики, по сравнению с группой, получавшей несущую среду (р<0,05, Фигура 4В).
Настоящее изобретение относится по меньшей мере к одному пробиотическому штамму, выбранному из Lactobacillus paracasei, или по меньшей мере одному Lactobacillus paracasei в комбинации по меньшей мере с одним пробиотическим штаммом, выбранным из Lactobacillus plantarum, для применения в лечении или профилактике остеопороза, для профилактики снижения минеральной плотности кости, для предотвращения потери костной ткани у млекопитающего, предпочтительно, у человека.
Настоящее изобретение относится по меньшей мере к одному пробиотическому штамму, выбранному из Lactobacillus paracasei, или по меньшей мере одному Lactobacillus paracasei в комбинации по меньшей мере с одним пробиотическим штаммом, выбранным из Lactobacillus plantarum, для применения в профилактике снижения минеральной плотности кости, для предотвращения потери костной ткани у млекопитающего, предпочтительно, у человека.
В одном варианте осуществления настоящего изобретения по меньшей мере два или больше штаммов Lactobacillus plantarum применяют совместно в комбинации по меньшей мере с одним штаммом Lactobacillus paracasei. В другом варианте осуществления по меньшей мере два или больше, например, три или больше штаммов Lactobacillus paracasei применяют совместно в комбинации по меньшей мере с одним штаммом Lactobacillus plantarum.
В одном варианте осуществления изобретения пробиотический штамм является живым, инактивированным или мертвым. В одном варианте осуществления изобретения указанные штаммы присутствуют в композиции, содержащей дополнительно по меньшей мере один носитель. Носитель может быть любым носителем, обычно применяемым, например, в формах биологически активной добавки к пище. Носитель может быть любым носителем на основе злаков, таким как носитель из овсяной муки или ячменный носитель, который можно применять в качестве функциональной пищи или любого другого вида пищи. Носитель может быть водой или любым другим водным растворителем, в котором пробиотический штамм смешивают перед употреблением.
В одном варианте осуществления изобретения в композицию добавляют дополнительный Са2+ в форме, например, соли, например, карбоната кальция, хлорида кальция, солей кальция и лимонной кислоты, глюконата кальция, глицерофосфата кальция, лактата кальция, оксида кальция, сульфата кальция. Рекомендуемое суточное потребление (РСП) Са2+ составляет 800 мг. Количество Са2+ в композиции может быть в диапазоне 10-40% от РСП, предпочтительно, в диапазоне 15-30% от РСП. Таким образом, количество Са2+, например, в форме соли в композиции может быть в диапазоне 80-320 мг, предпочтительно, 120-240 мг. Количество Ca, добавляемого в композицию, можно регулировать до любого количества в вышеуказанном диапазоне, так чтобы композиция была стабильной и обеспечивала свои благоприятные эффекты.
Композиция может быть сухой не ферментированной композицией или ферментированной композицией. В случае сухой не ферментированной композиции ферментация осуществляется после употребления композиции индивидуумом, т.е. в желудочно-кишечном тракте. Кроме того, штаммы могут присутствовать в композиции в виде лиофилизированных штаммов.
Пробиотический штамм Lactobacillus paracasei может быть выбран из Lactobacillus paracasei 8700:2, DSM 13434, и Lactobacillus paracasei 02:A, DSM 13432, a пробиотический штамм Lactobacillus plantarum может быть выбран из Lactobacillus plantarum 299, DSM 6595, Lactobacillus plantarum 299v, DSM 9843, Lactobacillus plantarum HEAL 9, DSM 15312, Lactobacillus plantarum HEAL 19, DSM 15313, и Lactobacillus plantarum HEAL 99, DSM 15316.
Lactobacillus paracasei 8700:2, DSM 13434, и Lactobacillus paracasei 02:A, DSM 13432, были депонированы 10 апреля 2000 в Deutsche Sammlung von Mikroorganimsen und Zellkulturen GmbH.
Lactobacillus plantarum HEAL 9, DSM 15312, Lactobacillus plantarum HEAL 19, DSM 15313, и Lactobacillus plantarum HEAL 99, DSM 15316 были депонированы в Deutsche Sammlung von Mikroorganimsen und Zellkulturen GmbH 28 ноября 2002.
Lactobacillus plantarum 299v, DSM 9843 был депонирован 21 марта 1995, a Lactobacillus plantarum 299, DSM 6595 был депонирован 5 июля 1991 в Deutsche Sammlung von Mikroorganimsen und Zellkulturen GmbH.
В одном варианте осуществления изобретения композиция, включающая по меньшей мере один штамм, может быть выбрана из группы, состоящей из пищевого продукта, биологически активной добавки к пище, медицинского продукта питания, функционального продукта питания и питательного продукта.
В случае, если указанная композиция является пищевым продуктом, она может быть выбрана из группы, включающей напитки, йогурты, соки, мороженое, хлеб, бисквиты, злаки, питательные батончики и спрэды.
Когда любой из вышеупомянутых штаммов применяют в композиции, такой как биологически активная добавка к пище, добавляемый носитель(и) известен специалисту в данной области техники. Любые другие ингредиенты, которые обычно используют в биологически активных добавках к пище, известны специалисту в данной области техники, и могут также быть добавлены обычным способом вместе со штаммами.
В одном варианте осуществления вышеупомянутый штамм(ы) пробиотиков присутствует в композиции в количестве примерно от 1×106 до 1×1014 КОЕ, предпочтительно от 1×108 до 1×1012 КОЕ, и более предпочтительно, от 1×109 до 1×1011КОЕ. Штаммы могут также применяться по отдельности в вышеуказанном количестве воды или любого другого водного растворителя, в котором штаммы добавляют или смешивают перед употреблением.
Изобретение пригодно для применения у млекопитающих, предпочтительно у людей, таких как пожилые люди, женщины в постменопаузальном периоде и женщины в пременопаузальном периоде, у которых существует или может возникнуть проблема потери костной ткани, снижения минеральной плотности костей и повышения потери костной ткани или резорбции костей.
Здоровые люди, естественно, также могут извлекать пользу из изобретения для сохранения здоровья и предотвращения развития остеопороза.
Эксперименты
Эксперимент 1
Материалы и методы
«Транспортные растворы», общий объем 6 мл.
Транспортные растворы содержали сбалансированный солевой раствор Хэнкса (HBSS) с Са и Mg, Hepes (2%), глутамином (4 мМ), D-глюкозой (3,5 г/л) и CaCl2×2Н2O (1,47 г/л). Анализ раствора выявил содержание [Ca2+] 10,65 мМ.
«Базовый раствор»
Готовили подобно транспортному раствору, но без добавления экзогенного кальция.
Анализ этого раствора показан содержание [Са2+] 1,22 мМ.
Эксперимент 1:
1. Контроль только транспортного раствора.
2. Лиофилизированные Lactobacillus plantarum 299v. 0,788 мг, что соответствовало 4,02×108 бактерий/6 мл транспортного раствора.
3. Lactobacillus plantarum 299v. 4,02×108 бактерий/6 мл транспортного раствора.
4. Lactobacillus plantarum 299v. 4,95×108 бактерий/6 мл транспортного раствора.
5. Lactobacillus HEAL 19, 4,95×108 бактерий/6 мл транспортного раствора.
6. AMJ 1277. 4,95×108 бактерий/6 мл транспортного раствора. AMJ 1277 является мутантной формой Lactobacillus plantarum 299v.
Эксперимент 2:
1. CNCM I-2332, Lactobacillus acidophilus (La10); + 4,95×108 бактерий/6 мл транспортного раствора.
2. Lactobacillus plantarum 299v. 4,02×10 бактерий/6 мл транспортного раствора.
3. Контроль - только транспортный раствор.
Все штаммы, за исключением La10, культивировали в аэробных условиях в 30 мл MRS (30°С, 210 об/мин). La10 культивировали при 37°С и покрывали стерильным фильтрованным азотом перед герметизацией. Число инокулированных клеток составило 3×108 на флакон. Бактерии предварительно культивировали в течение ночи, и они находились в экспоненциальной фазе при инокуляции. Клетки собирали при ОП600=0,1-0,5, и для каждого штамма собирали объем, соответствующий 4,02×10 клеток. Образцы центрифугировали при 5000 об./мин, 3 минуты, надосадочную жидкость выливали, и клетки ресуспендировали в NaCl (0,9%). Клетки вновь центрифугировали, и удаляли надосадочную жидкость. Отмытый осадок ресуспендировали в транспортном растворе.
Клетки Сасо-2 промывали фосфатным буферным раствором (2 раза) перед анализом.5CaCl2 (74 Бк/мл) добавляли в транспортные растворы. Затем добавляли смесь в объеме 0,5 мл, апикально на Сасо-2 клетки, растущие на вкладышах. В каждой лунке получали 6,7×107 бактерий на мл. В основную камеру добавляли только базальный раствор (1,5 мл), содержащий только эндогенный [Са2+] в HBSS (1,22 мМ). Суспензиями и контролями воздействовали на Сасо-2 клетки в течение 2 часов. Затем их удаляли аспирацией, и клетки промывали охлажденным на льду буферным раствором для промывания 3 раза в соответствии со способом, описанным в WO 99/02170. Сасо-2 клетки затем лизировали в 0,5 мл NaOH (0,5 М). Растворы в базальных камерах собирали для анализа транспорта с помощью сцинтиллятора (Tri-carb 2800TR, Perkin Elmer). В лизатах анализировали содержание5Ca, а также содержание белка. Все измеренные величины для транспорта/поглощения Са2+ были нормализованы по содержанию белка в соответствующих клетках. Все ячейки проверяли до и после инкубации аналитическими растворами на трансэпителиальную резистентность (TEER). Не наблюдалось различий TEER до и после испытаний. TEER измеряли, чтобы убедиться, что нет утечки в эпителии. Разница в резистентности после испытания могла свидетельствовать о том, что внутриклеточные связи повреждены используемыми растворами.
Результаты
Для проведения сравнения результатов экспериментов 1 и 2, данные по транспорту и поглощению у изученных штаммов нормализовали по контрольному раствору без бактерий. Все результаты, таким образом, были представлены в процентах от контроля (подобно тому, как было сделано в WO 00/02170). Необходимо также отметить, что эксперименты 1 и 2 были выполнены на 16 и 21 сутки культивирования клеток, соответственно. В целом, наблюдалось, что среднеквадратические отклонения полученных результатов являются относительно большими. Это может быть обусловлено некоторой формой агрегации бактерий и Са2+, приводящей к изменению доступности Са2+. Это не наблюдалось у лиофилизированных бактерий, где среднеквадратические отклонения были относительно малыми, по сравнению с остальными образцами.
Транспорт Са2+
Результаты эксперимента 1 показали существенное улучшение транспорта Са2+, когда присутствовал штамм AMJ 1277 (134,7±18,9%, р=0,002), см. Фиг. 1. Ни один из других штаммов (Lp299v лиофилизированный и жизнеспособный, Lp299, Lp HEAL 19) не имел существенных различий в транспорте Са2+, см. Таблицу 1. В эксперименте 2 при тестировании La10 и Lp299v не было выявлено существенных различий в транспорте Ca2+, при сравнении образцов с Lp299 против контроля без бактерий (р=0,2). Для La10 отмечалось легкое снижение транспорта Са2+ в присутствии тех же самых бактерий (79,5±19,3%), и это изменение было достоверным (р=0,049).
Поглощение Са2+
Представленные данные по поглощению показали количество Са2+ в клетках спустя 2 часа. Для получения данных по действительному поглощению нужно добавить количества внутриклеточного Са2+ к количеству Са2+, выявленного в латеральных компартментах. Сумма этих данных описывает общее количество Са2+, транспортированного через апикальную мембрану. Результаты этих экспериментов в целом показывают снижение внутриклеточного [Са2+] в присутствии бактерий, по сравнению с контрольными растворами, не содержащими бактерий, см. Фигуру 2. Однако, только различия между лиофилизированным и живым Lp299v были значимыми (р=0,04 и р=0,02). Отмечаем, что промежуточные уровни внутриклеточного Са2+ составляют лишь небольшой процент, по сравнению с транспортируемыми количествами Са2+. Благодаря этому, продемонстрированный эффект поглощения Са2+ не оказывал такого влияния, как эффекты в отношении транспорта. Это можно наблюдать для лиофилизированного и живого Lp 299v, у которого было более высокое содержание внутриклеточного [Са2+], но не было показано улучшения транспорта.
Заключение
В присутствии штамма AMJ1277, мутанта Lactobacillus plantarum 299v, наблюдался повышенный транспорт и даже общее поглощение кальция, по сравнению с контролем и остальными штаммами. Таким образом, наблюдалась разница между штаммами.
Эксперимент 3
Мышиная модель с овариэктомией и лечением пробиотиками
Овариэктомия (ovx) приводит к потере костной ткани, связанной с изменением иммунного статуса. Целью этого эксперимента было определение того, может ли применение пробиотиков защищать мышей от потери костной ткани, индуцированной овариэктомией. У мышей применяли один штамм Lactobacillus (L), L. paracasei DSM 13434 (L. para), или смесь трех штаммов, L. paracasei DSM 13434, L. plantarum DSM 15312 и DSM 15313 (L. mix) в питьевой воде в течение 6 недель, начиная за две недели перед овариэктомией.
Мышей-самок C57BL/6N в возрасте шести недель получали от Charles River (Германия). Мышей помешали в стандартные условия содержания животных при контролируемой температуре (22°С) и периоде освещения (12 часов света, 12 часов темноты), и обеспечивали свободный доступ к свежей воде и не содержащему сои гранулированному корму R70 (Lactam в АВ, Стокгольм, Швеция). Модель овариэктомии (ovx) для остеопороза включена в указания FDA по доклинической и клинической оценке агентов, используемых для лечения постменопаузального остеопороза. Лечение пробиотиками начинали за две недели до овариэктомии в исследовании профилактического эффекта применения пробиотиков в отношении индуцированной овариэктомией потери костной ткани. У мышей применяли либо единственный штамм Lactobacillus (L), L paracasei DSM 13434 (L. para), либо смесь трех штаммов, L. paracasei DSM 13434, L. plantarum DSM 15312 и DSM 15313, обозначаемую как L. mix, в течение 6 недель. Штаммы пробиотиков выбирали на основе их противовоспалительных свойств. Штаммы лактобацилл применяли в питьевой воде в концентрации 109 колониеобразующих единиц (КОЕ)/мл, в то время как контрольные мыши получали питьевую воду с несущей средой. Бутылки с водой заменяли каждый полдень. Выживание штаммов лактобацилл проверяли регулярно, и спустя 24 часа концентрация падала в 10 раз, примерно до 108 КОЕ/мл. Каждая мышь выпивала в среднем 4,5 мл воды в сутки. Спустя две недели применения пробиотиков, у мышей проводили либо имитацию операции, либо овариэктомию, при ингаляционной анестезии изофлюраном (Forene; Abbot Scandinavia, Сольна, Швеция). Спустя четыре недели после операции собирали кровь из подкрыльцовой вены под анестезией кеталаром/домитором, а затем мышей умерщвляли цервикальной дислокацией. Ткани для выделения РНК немедленно извлекали и подвергали мгновенному замораживанию в жидком азоте для последующего анализа. Кости извлекали и фиксировали в 4% параформальдегиде. Все эксперименты на животных были разрешены местным Этическим комитетом по исследованиям на животных в Университете Гетеборга.
Периферическая количественная компьютерная томография (пККТ)
Компьютерную томографию проводили с pQCT ХСТ RESEARCH М (версия 4.5 В, Norland, Форт-Аткинсон, Висконсин, США), работающим с разрешением 70 пм. Параметры кортикального слоя кости анализировали ex vivo в среднедиафизальной области бедренной кости.
Анализ мкКТ высокого разрешения
Анализы КТ высокого разрешения проводили на дистальном отделе бедренной кости с применением 1172 модели КТ (Bruker micro-CT, Аартселаар, Бельгия). Получали изображения бедренной кости с рентгеновской трубкой напряжением 50 кВ и током 201 мкА, с 0,5 мм алюминиевым фильтром. Угол вращения сканирования составил 180°, а угловое приращение 0,70°. Размер объемного элемента составил 4,48 пм изотропно. Применяли NRecon (версия 1.6.9) для выполнения восстановления после сканирования. В бедренной кости выбирали губчатую зону проксимально к дистальной зоне роста для анализов в подходящем интересующем объеме (за исключением кортикальной зоны), начиная на расстоянии 538,5 пм от зоны роста, и продолжая на дополнительное продольное расстояние 134,5 пм в проксимальном направлении. Кортикальные измерения проводили в диафизальном участке бедренной кости, начиная на расстоянии 3,59 мм от зоны роста, и продолжая на дополнительное продольное расстояние 134,5 пм в проксимальном направлении. Для анализа МПК оборудование калибровали с керамическими стандартными образцами.
Выделение РНК и ПЦР в режиме реального времени
Общую РНК выделяли из кортикального слоя кости (концы бедренной кости удаляли, и костный мозг вымывали ФБР перед замораживанием) и костного мозга с применением реагента TriZol (Invitrogen, Лидинго, Швеция). РНК подвергали обратной транскрипции на кДНК с применением Набора для высокоактивной обратной транскрипции кДНК (#4368814, Applied Biosystems, Стокгольм, Швеция). Анализы РВ-ПЦР проводили с применением системы детекции последовательностей ABI Prism 7000 Sequence Detection System (РЕ Applied Biosystems). Мы применяли предварительно разработанные анализы РВ-ПЦР от Applied Biosystems (Швеция) для анализа уровней мРНК ИЛ-6 (Mm00446190_m1), ИЛ-1β (Mm00434228_m1), ФНОα (Mm00443258_m1), RANKL (Mm00441908_m1), ОПГ (Mm00435452_m1), Runx2 (Mm00501580_m1), Col1a1 (Mm00801666_g1), остеокальцина (Mm01741771_g1) и ТФРβ (Mm03024053_m1). Содержание мРНК для каждого гена рассчитывали с применением «метода стандартной кривой» (Руководство пользователя 2; РЕ Applied Biosystems), и приспосабливали для экспрессии 18S 94308329) рибосомальной РНК.
Анализ крови
Анализы проводили в соответствии с инструкциями производителя по анализу кальция в сыворотке и моче (QuantiChrom™ Calcium Assay Kit (DICA-500), Bioassays systems, Хэйворд, Калифорния, США), креатинина в сыворотке и моче (Mouse Creatinine Kit, Crystal Chem, Даунерс-Гроув, Иллинойс, США). В качестве маркера резорбции кости определяли сывороточные уровни фрагментов коллагена I типа с применением ИФА набора RatLaps ELISA kit (Nordic Bioscience Diagnostics, Херлев, Дания). Сывороточные уровни остеокальцина, маркера формирования кости, определяли с применением набора для иммунорадиометрического анализа мышиного остеокальцина (Immutopics, Сан-Клементе, Калифорния).
Проточная цитометрия
Клетки костного мозга собирали путем промывания 5 мл ФБР полости бедренной кости с помощью шприца. После центрифугирования при 515 g в течение 5 минут, осадок клеток ресуспендировали в Трис-буферном 0,83% растворе NH4Cl (рН 7,29) в течение 5 минут для лизиса эритроцитов, а затем промывали в ФБР. Клетки костного мозга ресуспендировали в среде для культивирования RPMI (РАА Laboratories, Пашинг, Австрия) перед применением. Рассчитывали общее количество лейкоцитов в костном мозге с применением автоматического счетчика клеток (Sysmex, Гамбург, Германия). Для анализов проточной цитометрии клетки окрашивали антителами к CD4, конъюгированными с аллофикоцианином, для детекции Т-хелперных клеток (Beckton-Dickinson), и антителами к CD8 цитотоксическим Т-клеткам, конъюгированными с флюоресцеин-изотиоцианатом (FITC) (Beckton-Dickinson), или антителами к Gr-1/Ly-6G, конъюгированными с перидинин-хлорофилловыми белками (PerCP) (BioLegend) для удаления гранулоцитов, и FITC-конъюгированными антителами к CD11b для детекции OCL клеток-предшественников (Beckton-Dickinson). Клетки затем подвергали анализу возбужденной флуоресценции сортированных клеток (FACS) на FACSCalibur (BD Pharmingen, Франклин-Лейке, Нью-Йорк, США), и анализировали с применением программного обеспечения FlowJo. Результаты выражены в виде распространенности клеток в %.
Статистический анализ
Все результаты статистического анализа представлены в виде среднего значения ± СКО. Разницу между группами рассчитывали с применением непарного Т-анализа. Сравнение множества групп рассчитывали с применением однофакторного дисперсионного анализа (ANOVA) с последующим тестом Даннета для коррекции множественных сравнений. Двухсторонний критерий p<0,05 считали значимым.
Результаты - Лечение пробиотиками защищает мышей от индуцированной овариэктомией потери кортикальной костной ткани и повышенной резорбции кости
Для определения профилактического эффекта лечения пробиотиками при индуцированной овариэктомией потере костной ткани, у мышей в возрасте восьми недель применяли несущую среду (veh), единственный штамм лактобацилл (L) (L. para) или смесь трех штаммов (L. mix) в течение шести недель, начиная за две недели перед овариэктомией или имитацией операции (Фигура 3А). Массу матки использовали в качестве показателя эстрогенового статуса, и овариэктомия приводила к ожидаемому уменьшению массы матки, которое было схожим при всех видах лечения (Таблица 2). Кроме того, при овариэктомии повышалась масса тела, масса жировой ткани и масса тимуса во всех экспериментальных группах (Фигура 3В, Таблица 2).
У мышей, получавших несущую среду, овариэктомия снижала минеральную плотность кортикального слоя кости и площадь поперечного сечения кортикального слоя кости в средне-диафизальном участке бедренной кости (р<0,01, Фигура 4А-С). Важно, что овариэктомия не снижала минеральную плотность кортикального слоя кости или площадь поперечного сечения кортикального слоя кости у мышей, леченных L. para или L. mix (Фигура 4А-С). Минеральная плотность кортикального слоя кости была выше у мышей с овариэктомией, леченных L. para или L. mix, по сравнению с мышей с овариэктомией, леченных несущей средой (р<0,05, Фигура 4В). Чтобы определить, вызван ли профилактический эффект пробиотиков в отношении кортикального слоя кости влиянием на резорбцию кости, анализировали сывороточные уровни С-концевых телопептидов (RatLaps). При овариэктомии повышались уровни RatLaps у мышей, леченных несущей средой (+45±11%, р<0,05, по сравнению с имитацией операции), но не у получавших L. para (20±9%, недостоверно) или L. mix (23±9%, недостоверно). Лечение пробиотиками не оказывало существенного влияния на формирование костной ткани, о чем свидетельствовал сывороточный уровень остеокальцина (данные не показаны). Параметры губчатого слоя кости (BV/TV и МПК губчатого слоя) в дистальном метафизальном участке бедренной кости существенно снижались при овариэктомии во всех экспериментальных группах (р<0,05, Таблица 1). Эти наблюдения демонстрируют, что лечение пробиотиками защищает мышей от индуцированной овариэктомией потери кортикального слоя кости и повышения резорбции кости.
Пробиотики снижают экспрессию воспалительных цитокинов и отношение RANKL/ОПГ в кортикальном слое кости.
Для изучения механизма влияния лечения пробиотиками на индуцированную овариэктомией потерю кортикальной костной ткани, мы определяли транскрипты мРНК, связанные с костью, в кортикальном слое кости (Фигура 5). Уровни мРНК ФНОα, воспалительного цитокина, продуцируемого миелоидными клетками, стимулирующего остеокластогенез, и ИЛ-1β понижающего регулятора эффектов ФНОα в кости, существенно снижались при лечении пробиотиками, по сравнению с лечением несущей средой у мышей после овариэктомии (ФНОα - 46%, р<0,05; ИЛ-1β - 61%, р<0,05%, Фигуры 5А и 5В). Экспрессия ИЛ-6 не отличалась в экспериментальных группах, хотя отмечалась тенденция к снижению экспрессии в группе, леченной пробиотиками (-20%, р=0,12, Фигура 5С).
Отношение RANKL/остеопротегерин (ОПГ) является главной детерминантой остеокластогенеза, и следовательно, резорбции кости. Важно, что лечение пробиотиками снижало отношение RANKL/ОПГ (-45%, р<0,05, по сравнению с лечением несущей средой, Фигура 5D), и это было вызвано повышением экспрессии ОПГ (ОПГ, +28%, p<0,05 и RANKL, +1%, не достоверно, Фигура 5Е, F). Напротив, на уровни мРНК трех генов, ассоциированных с остеобластами, Osterix, Col1a1 и остеокальцина, не оказывало влияния лечение пробиотиками (Фигура 5G-H).
Иммунный статус костного мозга
Некоторые противовоспалительные эффекты, проявляемы пробиотическими бактериями, как полагают, опосредованы индукцией регуляторных Т-клеток (Treg). FACS анализ костного мозга показал, что распространенность Treg (CD4+ CD25+ Foxp3+) клеток снижалась после овариэктомии в группе, получавшей несущую среду, но не у мышей, получавших пробиотики (Таблица 2). Treg клетки являются зависимыми от ТФРβ для их индукции и поддержки, и экспрессия ТФРβ повышалась в костном мозге у мышей после овариэктомии, леченных пробиотиками, по сравнению с мышами после овариэктомии, леченными несущей средой (+77±19%, р<0,01).
Также исследовали, модулирует ли лечение пробиотиками распространенность клеток - предшественников остеокластов (preOCL) в костном мозге. На распространенность preOCL (CD11b+Gr1-) в костном мозге не оказывала влияния овариэктомия в какой-либо из экспериментальных групп (Таблица 2).
Минеральный метаболизм
Относительная экскреция кальция с мочой (FECa= (уровень кальция в моче × креатинина в плазме) / (уровень кальция в плазме × уровень креатинина в моче)) увеличивалась после овариэктомии у мышей, леченных несущей средой (+86%, р<0,05%, Фигура 6). Индуцированное овариэктомией повышение FECa полностью предотвращалось при лечении пробиотиками, позволяя сделать предположение о повышении отложения Ca (Фигура 6). Отмечалась тенденция к повышению сывороточных уровней кальция после овариэктомии у мышей, леченных несущей средой, но не у мышей, леченных пробиотиками (+13%, р=0,05, Таблица 3). На отношение Са/креатинина в моче не оказывала влияния овариэктомия в какой-либо из экспериментальных групп (Таблица 3).


Таблица 2. Масса эстроген-чувствительных органов и иммунные клетки в костном мозге у мышей в возрасте восьми недель. Параметры губчатого слоя кости анализировали посредством КТ высокого разрешения в дистальном метафизальном участке бедренной кости; объем губчатого слоя кости в виде процентов от объема ткани (BV/TV); минеральная плотность губчатого слоя кости (BMD). Клетки костного мозга в бедренной кости окрашивали с антителами, распознающими CD4, Foxp3, CD25, CD11b и Gr1. Значения представляют проценты Treg (CD4+Foxp3+CD25+) или preOCL (CD11b+Gr1-) в общей популяции костного мозга. Результаты показаны в виде среднего значения ± СКО, n=6-10 для каждой группы. **р<0,01, *р<0,05, Т-критерий Стьюдента для овариэктомии против имитации операции, # р<0,05, ANOVA-Даннет в группах.

Таблица 3. Минеральный метаболизм. Кальций и креатинин определяли в сыворотке и моче мышей в возрасте 14-недель. Результаты приведены в виде среднего значения ± СКО, n=5-10 в каждой группе. **р<0,01, *р<0,05, (*) р=0,05. Применяли Т-критерий Стьюдента для сравнения овариэктомии и имитации операции, # р<0,05, ANOVA-Даннет в группах.
В итоге, данные из настоящего изобретения показали, что пробиотики в питьевой воде снижают индуцированную овариэктомией потерю кортикального слоя кости, позволяя сделать предположение о терапевтическом потенциале пробиотиков в лечении постменопаузального остеопороза. Кроме того, результаты подтверждают роль кишечной микробиоты в регуляции массы костной ткани.
Лечение L. para и the L. mix защищало мышей от индуцированной овариэктомией потери кортикальной костной ткани и повышения резорбции кости. Минеральная плотность кортикального слоя кости была выше при лечении L. para и L. mix, по сравнению с лечением несущей средой после овариэктомии. Относительная экскреция кальция с мочой и уровень маркера резорбции RatLaps повышались после овариэктомии в группе, получавшей несущую среду, но не у мышей, леченных L. para или L. mix. Таким образом, пробиотики ингибируют индуцированную овариэктомией экскрецию кальция с мочой. Лечение пробиотиками снижало экспрессию двух воспалительных цитокинов, ФНОα и ИЛ-1β, и повышало экспрессию ОПГ в кортикальном слое кости у мышей после овариэктомии. Кроме того, овариэктомия снижала распространенность регуляторных Т-клеток (CD4+CD25+Foxp3+) в костном мозге мышей, леченных несущей средой, но не мышей, леченных пробиотиками. Таким образом, пробиотики ингибируют индуцированное овариэктомией снижение распространенности регуляторных Т-клеток в костном мозге. Кроме того, пробиотики повышают экспрессию ТФРβ в костном мозге, и ингибируют индуцированное овариэктомией повышение маркера резорбции RatLap. В итоге, лечение L. para или L. mix предотвращает индуцированную овариэктомией потерю кортикального слоя кости. Результаты изобретения показывают, что это лечение пробиотиками изменяет иммунный статус в костной ткани, как продемонстрировано снижением экспрессии воспалительных цитокинов и повышением экспрессии ОПГ, приводящим к ослаблению резорбции костной ткани у мышей после овариэктомии.
Эксперимент 4
В этом эксперименте будет исследовано, влияют ли вышеуказанные пробиотики на вышеуказанные параметры (т.е. массу кортикальной костной ткани, минеральную плотность кости, резорбцию кости) у мышей-самок, уже перенесших овариэктомию, и, таким образом, уже со сниженной массой костной ткани. Овариэктомия у мышей-самок является хорошо изученной моделью постменопаузальной потери костной ткани у женщин. Схема эксперимента указана ниже.
Мыши после овариэктомии→4 недели→Лечение пробиотиками в течение 6 недель→конец.
Пробиотики будут в питьевой воде, и начнут лечение ими спустя 4 недели после овариэктомии. Доза составит 109 КОЕ/мл/сутки, а овариэктомия будет осуществлена в возрасте 9-10 недель. После окончания эксперимента будет проведен анализ (КТ) кости для измерения плотности и толщины, а также анализ сыворотки и костных маркеров.
Реферат
Группа изобретений относится к биотехнологии. Предложено применение пробиотического штамма Lactobacillus paracasei 8700:2, DSM 13434 и применение штамма Lactobacillus paracasei 8700:2, DSM 13434 в комбинации, по меньшей мере, с одним из штаммов Lactobacillus plantarum для лечения или профилактики остеопороза, лечения или профилактики костной ткани или для повышения абсорбции ионов Сау млекопитающего. Предложено применение пробиотического штамма Lactobacillus paracasei 8700:2, DSM 13434 в комбинации с Lactobacillus plantarum HEAL 9, DSM 15312 и Lactobacillus plantarum HEAL 19, DSM 15313 для лечения или профилактики остеопороза, лечения или профилактики костной ткани или для повышения абсорбции ионов Сау млекопитающего. Изобретения обеспечивают снижение потери кортикального слоя кости в лечении постменопаузального остеопороза. 3 н. и 21 з.п. ф-лы, 6 ил., 3 табл., 4 пр.

Комментарии