Питательные композиции и детские смеси, включающие bifidobacterium animalis подвида lactis и необязательно смесь олигосахаридов, для индукции кишечной микробиоты, которая похожа на микробиоту младенцев, находящихся на грудном вскармливании - RU2758856C2
Код документа: RU2758856C2
Чертежи



Описание
Область применения изобретения
Настоящее изобретение относится к питательным композициям для младенцев и детей младшего возраста и их воздействию на здоровье младенцев. В частности, оно относится к детской смеси, включающей определенный пробиотик для индукции кишечной микробиоты, которая похожа на микробиоту у младенцев, вскармливаемых исключительно человеческим грудным молоком (HBM).
Предпосылки создания изобретения
Когда матери не могут кормить грудью младенцев, детская смесь обеспечивает подходящую альтернативу естественному грудному вскармливанию человеческим грудным молоком. Питательные композиции для младенцев и детей младшего возраста часто поступают в продажу в виде порошков для растворения в воде или в некоторых случаях — в виде готового к употреблению напитка или концентрированных жидких композиций. Эти композиции предназначены для удовлетворения большинства или всех потребностей в питании младенцев или детей младшего возраста.
Однако известно, что человеческое грудное молоко представляет собой неоспоримый «золотой стандарт» питания младенцев. Производители детских смесей много раз пытались обеспечить питательные эффекты для здоровья, аналогичные или близкие к полезному воздействию человеческого грудного молока.
Материнское молоко рекомендовано всем младенцам. Однако в некоторых случаях грудное вскармливание является недостаточным или неэффективным по медицинским причинам, или мать отказывается от грудного вскармливания. Для этих ситуаций были разработаны детские смеси. Кроме того, разрабатываются обогатители для обогащения материнского молока или детской смеси определенными ингредиентами.
Однако во многих случаях исследования показали, что детская смесь не обеспечивает в отношении организма воздействие, идентичное тому, которое обеспечивается человеческим грудным молоком. Например, у младенцев, находящихся на вскармливании детской смесью, и младенцев, находящихся на вскармливании человеческим грудным молоком (HBM), может наблюдаться различная кишечная микробиота.
Раннее детство, особенно первые недели, первые 3 месяца, 6 месяцев или 12 месяцев жизни, являются критически важными для установления баланса кишечной микробиоты.
Известно, что модуляция кишечной микробиоты в младенчестве в перспективе может оказать большое влияние на будущее состояние здоровья организма. Например, кишечная флора может оказывать влияние на развитие ожирения на более поздних этапах жизни, на развитие эффективной иммунной системы на более поздних этапах жизни или на нормальный рост.
Аналогично здоровая кишечная флора является показателем здоровья младенца, а измененная кишечная микробиота может быть показателем (и/или причиной) аномальных состояний здоровья, таких как диарея, недостаточное всасывание питательных веществ, колики, нарушение сна и нарушение роста и развития.
Известно, что способ родоразрешения может повлиять на исходную кишечную микробиоту младенцев: было показано, что младенцы, рожденные посредством кесарева сечения, имеют другую кишечную микробиоту по сравнению с младенцами, рожденными посредством вагинальных родов.
Известно, что на активацию конкретной микробиоты, помимо прочих ингредиентов, особенно могут повлиять неперевариваемые углеводы (пребиотики). Например, было показано, что определенные галактоолигосахариды (ГОС) и/или определенные фруктоолигосахариды (ФОС) могут стимулировать рост и распространение бифидобактерий в кишечнике, особенно у младенцев.
Однако кишечная микробиота и ее эволюция во время развития младенца представляют собой тонкий баланс между наличием и уровнем распространения (количеством) многих популяций кишечных бактерий. Некоторые кишечные бактерии относят к категории «в целом полезных», а другие — «в целом вредных» (или патогенных) из-за их воздействия на общее состояние здоровья младенца.
Определенные виды «в целом полезных» бактерий, такие как бифидобактерии, могут быть представлены в недостаточной степени у младенцев, находящихся на вскармливании традиционной детской смесью, по сравнению с таковыми у младенцев, находящихся на грудном вскармливании. Аналогично некоторые популяции бактерий считаются патогенными, и необходимо поддерживать низкий уровень их распространения в кишечной микробиоте.
Действительно, младенцы, находящиеся на вскармливании детскими смесями, могут не пользоваться преимуществами, которые дает натуральная, хорошо сбалансированная кишечная микрофлора (кишечная микробиота), которая наблюдается у младенцев, вскармливаемых исключительно или преимущественно человеческим грудным молоком. Действительно, такая натуральная микробиота, наблюдаемая у находящихся на грудном вскармливании младенцев, является хорошо контролируемой с течением времени (развитие со временем) и очень сложной. Многие таксономические категории микроорганизмов сосуществуют в очень сложной микросреде кишечника, и все они присутствуют в последовательно формирующихся пропорциях. При определении микробиоты младенцев и детей младшего возраста следует учитывать количественные и качественные параметры. Более того, дополнительную сложность придает изменение кишечной микробиоты со временем.
Хотя многие исследования позволили определить способы активизации роста и преобладания конкретных полезных бактерий в кишечнике младенцев, при этом мало что известно о способах индукции микробиоты, напоминающей таковую у младенцев на грудном вскармливании.
Существует потребность в стимулировании и/или индукции у младенцев, вскармливаемых детской смесью, общей микробиоты, которая похожа на микробиоту младенцев на грудном вскармливании.
Существует потребность в стимулировании и/или индукции у младенцев, вскармливаемых детской смесью, с течением времени микробиоты, которая развивается подобно микробиоте младенцев на грудном вскармливании.
Существует также потребность в предоставлении младенцам, вскармливаемым детской смесью, наилучшего питания, способствующего развитию микробиоты, которая похожа на микробиоту младенцев на грудном вскармливании, в краткосрочной перспективе, в течение вмешательства во вскармливание, и/или в долгосрочной перспективе, после вмешательства во вскармливание.
Существует потребность в индукции у младенцев, вскармливаемых детской смесью, оптимального в краткосрочной или долгосрочной перспективе состояния здоровья на протяжении вскармливания, индуцирующего и/или стимулирующего развитие микробиоты, сходной или похожей на микробиоту младенцев на грудном вскармливании; такое состояние здоровья включает в себя оптимальный рост с течением времени и оптимальное развитие иммунной системы, а также предотвращение метаболических нарушений.
Существует потребность в компенсации субоптимальной микробиоты, наблюдающейся у младенцев на грудном вскармливании. Существует потребность в восстановлении баланса такой микробиоты.
Существует потребность в индукции и/или стимулировании у младенцев, вскармливаемых детской смесью, развития определенных семейств, родов, видов или штаммов бактерий в кишечнике, чтобы получить микробиоту, которая похожа на микробиоту младенцев на грудном вскармливании.
Существует потребность в подавлении и/или угнетении у младенцев, вскармливаемых детской смесью, развития определенных семейств, родов, видов или штаммов бактерий в кишечнике, чтобы получить микробиоту, которая похожа на микробиоту младенцев на грудном вскармливании.
Существует потребность в угнетении развития и роста патогенных бактерий, или вредных бактерий, в кишечнике младенцев и детей младшего возраста.
Существует потребность в избирательном воздействии или уменьшении роста патогенных бактерий в кишечнике младенцев и детей младшего возраста при стимуляции или по меньшей мере без изменения роста полезных кишечных бактерий.
Существует потребность в усилении оптимального баланса в общей кишечной микробиоте младенцев, особенно путем угнетения или подавления роста патогенных бактерий, в течение первых недель жизни, когда устанавливается такой баланс.
Существует потребность в усилении такого оптимального баланса путем хорошо переносимых, мягко воздействующих средств, не имеющих или практически не имеющих побочных эффектов.
Изложение сущности изобретения
Изобретение относится к питательной композиции для младенцев и детей младшего возраста, такой как детская смесь или смесь для прикармливаемых детей, предпочтительно детская смесь. Композиция включает в себя пробиотик Bifidobacterium animalis вида lactis. Этот пробиотик стимулирует или индуцирует кишечную микробиоту, которая похожа на микробиоту младенцев, вскармливаемых исключительно человеческим грудным молоком (так называемых «младенцев на исключительном грудном вскармливании»), по сравнению с младенцами, вскармливаемыми преимущественно традиционной детской смесью, не включающей в себя пробиотика Bifidobacterium animalis вида lactis. Возраст младенцев или детей младшего возраста может составлять от 0 до 36 месяцев, предпочтительно от 0 до 12 месяцев.
Краткое описание фигур
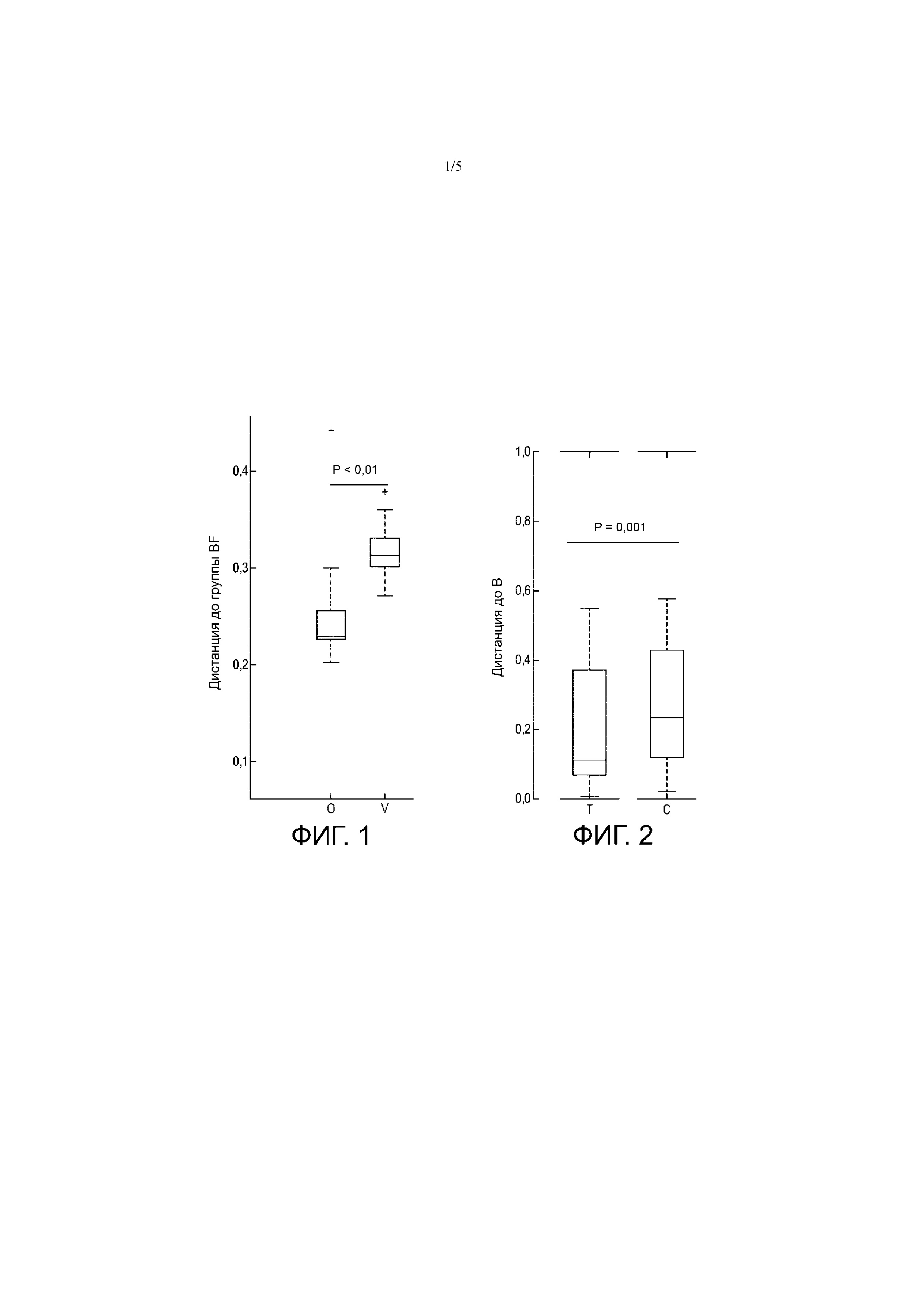
Фиг. 1 - демонстрирует средневзвешенную дистанцию по Unifrac между группами, получавшими разные смеси (V = контрольная смесь; O = смесь B. lactis), и группой с грудным вскармливанием. Чем ближе дистанция к нулю, тем ближе к группе с грудным вскармливанием.
Фиг. 2 - демонстрирует средневзвешенную дистанцию по Unifrac между группами T и C, получавшими разные смеси, и группой B на грудном вскармливании. Группа T: с пробиотиком B. lactis; Группа C: контроль без пробиотика B. lactis. Чем ближе дистанция к нулю, тем ближе к группе с грудным вскармливанием B.
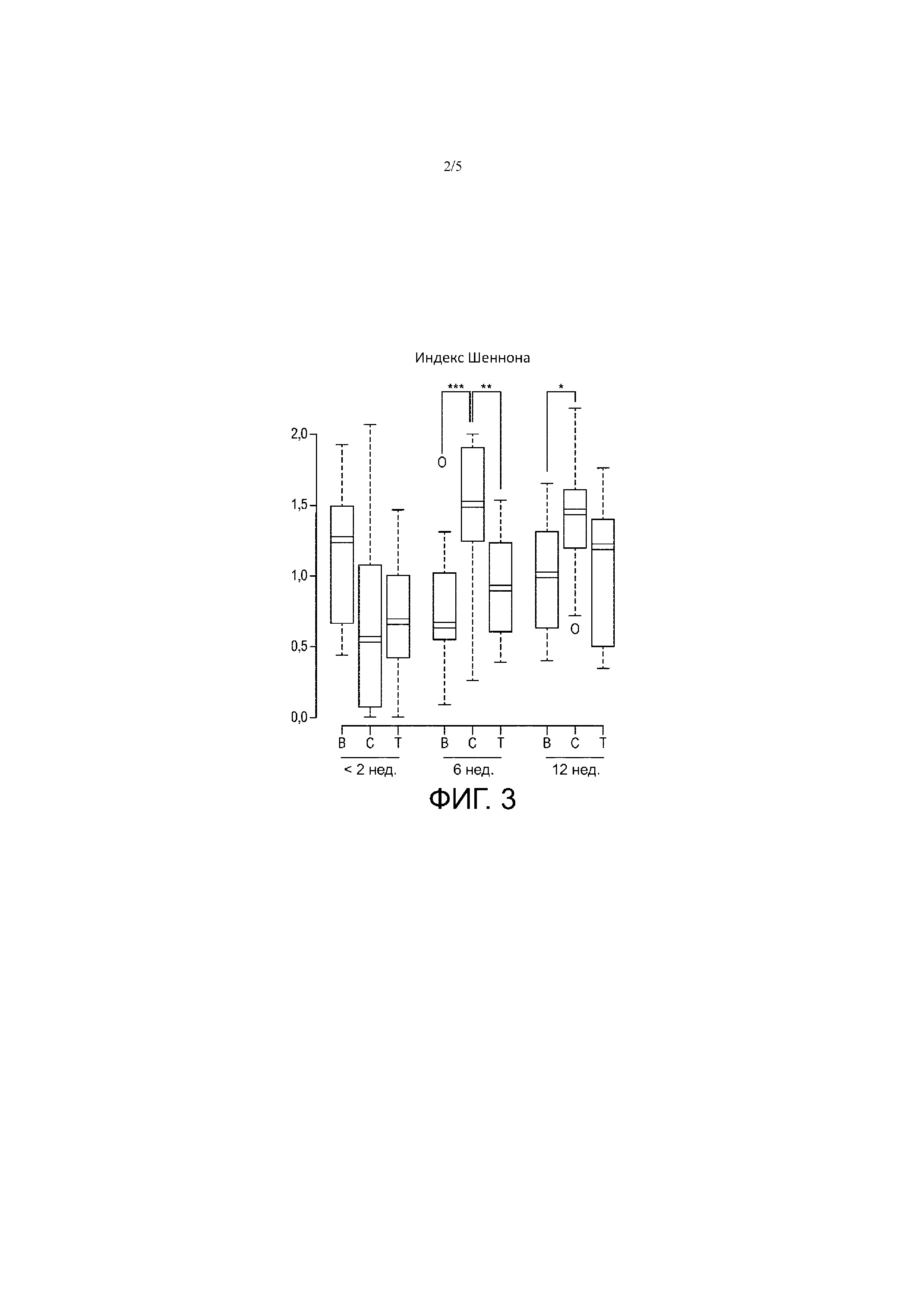
Фиг. 3 - Коробчатые диаграммы анализов альфа-разнообразия по трем временным точкам для трех групп вскармливания. P-значение: *, < 0,05; **, < 0,01 ***, < 0,001 (группа T: с пробиотиком B. lactis; группа C: контроль без пробиотика B. lactis; группа B: грудное вскармливание).
Фиг. 4 - количество бактериальных эквивалентов, измеренное методом количественной ПЦР в фекалиях младенцев, получавших указанную смесь (C = контроль; T = исследуемая смесь с пробиотиком B. lactis) или получавших грудное вскармливание (группа B) в начале исследования (<2 нед.) и в возрасте шести недель (6 нед.) и двенадцати недель (12 нед). Результаты количественной ПЦР представлены в виде средних значений + станд. ош. для количества бактериальных клеток на г фекалий. Пунктирная линия — предел обнаружения. Планки погрешностей — стандартное отклонение.
Фиг. 5 - доля младенцев в указанных внизу трех группах вскармливания, которые имели указанный на оси абсцисс цвет стула, в возрасте < 2 нед. (исходное состояние) и 12 нед. (правая панель). (группа T: с пробиотиком B. lactis; группа C: контроль без пробиотика B. lactis; группа B: грудное вскармливание)
Фиг. 6 - количество бифидобактерий (log КОЕ бифидобактерий на г фекалий) у младенцев на 3, 10, 28 и 84 дни в каждой исследуемой группе (исследуемая смесь/вагинальные роды; исследуемая смесь/кесарево сечение; контрольная смесь/вагинальные роды; контрольная смесь/кесарево сечение).
Описание изобретения
Определения
В настоящем документе следующие термины имеют приведенные ниже определения.
Термин «младенец» означает ребенка в возрасте до 12 месяцев.
Выражение «ребенок младшего возраста» означает ребенка в возрасте от одного до трех лет (также называется ребенком, начинающим ходить).
«Младенец или ребенок младшего возраста, рожденный посредством кесарева сечения» означает, что ребенок был рожден посредством кесарева сечения. Это означает, что младенец не был рожден посредством вагинальных родов.
«Недоношенный» или «преждевременно родившийся» относится к младенцу или ребенку младшего возраста, который родился не в срок. По существу, этот термин относится к младенцу, рожденному до 37-й недели беременности.
Выражение «питательная композиция» означает композицию, которой вскармливают субъекта. Указанная питательная композиция обычно предназначена для энтерального, перорального, парентерального или внутривенного применения и обычно включает источник липидов или жиров и источник белков. Предпочтительно питательная композиция предназначена для перорального применения.
Выражение «гипоаллергенная питательная композиция» означает питательную композицию, которая с малой вероятностью может вызывать аллергические реакции.
Выражение «искусственная композиция» означает смесь, полученную с помощью химических и/или биологических средств, которая может быть химически идентична смеси природного происхождения, присутствующей в молоке млекопитающих.
Выражение «детская смесь» означает продукт питания, специально предназначенный для применения в пищу младенцами в течение первых четырех–шести месяцев жизни и сам по себе удовлетворяющий потребности в питании этой категории лиц (статья 1.2 Директивы Европейской комиссии 91/321/EEC от 14 мая 1991 г. о детских смесях и смесях для прикармливаемых детей).
Выражение «начальная детская смесь» означает продукт питания, специально предназначенный для применения в пищу у младенцев в течение первых четырех месяцев жизни.
Выражение «смесь для прикармливаемых детей» означает продукт питания, специально предназначенный для применения в пищу у младенцев старше четырех месяцев и составляющий основной жидкий компонент в рационе питания этой категории лиц, который предполагает постепенно увеличиваемое разнообразие.
Выражение «детское питание» означает продукт питания, специально предназначенный для применения в пищу у младенцев в течение первых лет жизни.
Термин «обогатитель» относится к жидким или сухим питательным композициям, подходящим для смешивания с грудным молоком или детской смесью.
Термин «период отлучения от груди» означает период, в течение которого в рационе питания младенца материнское молоко замещают другой пищей.
Под «материнским молоком» (также «человеческое грудное молоко», HBM) следует понимать грудное молоко или молозиво матери.
В настоящем документе термин «олигофруктоза» относится к олигомерам фруктозы. Это может быть длинная цепь или короткая цепь в зависимости от степени полимеризации олигофруктозы (числа мономеров). Предпочтительно олигофруктоза изобретения представляет собой короткоцепочечную олигофруктозу, наиболее предпочтительно она имеет степень полимеризации от 2 до 10, например степень полимеризации от 2 до 8.
В настоящем документе термин «sn-2-пальмитат» относится к пальмитиновой кислоте в положении sn-2 триглицерида, с которым она связана.
«Триглицерид с высоким содержанием sn-2-пальмитата» относится к триглицериду (ТГ), содержащему более 30% пальмитиновых кислот в положении sn-2. Например, в продаже доступен ингредиент с высоким содержанием sn-2-пальмитата от компании Lipid Nutrition, который называется Betapol™ B-55. Это смесь триглицеридов, полученная из растительного масла, в которой по меньшей мере 54% пальмитиновой кислоты находятся в положении sn-2 молекулы глицерина.
«Альфа-лактальбумин» относится к высококачественному легкоперевариваемому сывороточному белку, который составляет 20–25% от общего количества белка человеческого грудного молока (HBM) и является основным белком, присутствующим в HBM. Структура альфа-лактальбумина состоит из 123 аминокислот и 4 дисульфидных мостиков, а молекулярная масса этого белка составляет 14,2 килодальтона. Благодаря высокому содержанию незаменимых аминокислот, особенно триптофана, альфа-лактальбумин идеально подходит для детских смесей с пониженным содержанием белка.
Термин «пребиотик» означает неперевариваемые углеводы, которые благоприятно влияют на хозяина, избирательно стимулируя рост и/или активность полезных для здоровья бактерий, таких как бифидобактерии, в толстом кишечнике человека (Gibson GR, Roberfroid MB. Dietary modulation of the human colonic microbiota: introducing the concept of prebiotics. J Nutr. 1995;125:1401–12).
Термин «пробиотик» означает препараты из клеток микроорганизмов или компоненты клеток микроорганизмов, которые оказывают благоприятный эффект на здоровье или самочувствие организма-хозяина. (Salminen S, Ouwehand A. Benno Y. et al. “Probiotics: how should they be defined” Trends Food Sci. Technol. 1999:10, 107–10). Клетки микроорганизмов, по существу, представляют собой бактерии или дрожжи.
Под термином «КОЕ» следует понимать колониеобразующую единицу.
Термины «младенцы или дети младшего возраста с исключительно грудным вскармливанием»/«находящиеся исключительно на грудном вскармливании»: в целом обозначает младенцев, у которых подавляющее большинство питательных веществ и/или энергии поступает из человеческого грудного молока («подавляющее большинство» может составлять по меньшей мере 90%, или по меньшей мере 95%, или по меньшей мере 99%).
Термин «младенцы/дети младшего возраста, вскармливаемые преимущественно детской смесью» имеет общий смысл и относится к младенцам или детям младшего возраста, у которых источники питательных веществ и/или энергии поступают преимущественно из искусственной детской смеси, смеси для прикармливаемых детей или молочной смеси для детей от 1 до 3 лет. «Преимущественно» означает по меньшей мере 50% этих питательных веществ и/или энергии или по меньшей мере 75%.
Если не указано иное, все приводимые процентные соотношения представляют собой мас.%.
Ниже представлено более подробное описание изобретения. Следует отметить, что различные аспекты, признаки, примеры и варианты осуществления, описанные в настоящей заявке, могут быть совместимыми и/или комбинироваться друг с другом
Дополнительно в контексте изобретения термины «включающий» или «включает в себя» не исключают других возможных элементов. Композиция настоящего изобретения, включая многие варианты осуществления, описанные в настоящем документе, может включать в себя существенные элементы и ограничения изобретения, описанные в настоящем документе, а также любые дополнительные или необязательные ингредиенты, компоненты или ограничения изобретения, описанные в настоящем документе, или иные в зависимости от потребностей, состоять или, по существу, состоять из них.
Подробное описание изобретения
Как правило, детская смесь в готовой к употреблению жидкой форме (например, после растворения порошка) обеспечивает 60–70 ккал/100 мл. Детская смесь, как правило, включает в себя на 100 ккал: около 1,8–4,5 г белка; около 3,3–6,0 г жира (липидов); около 300–1200 мг линолевой кислоты; около 9–14 г углеводов, выбранных из группы, состоящей из лактозы, сахарозы, глюкозы, глюкозного сиропа, крахмала, мальтодекстринов и мальтозы и их комбинаций; и незаменимые витамины и минеральные вещества. Преобладающий углевод в детской смеси может представлять собой лактозу. Например, жидкая детская смесь может содержать около 67 ккал/100 мл. В некоторых вариантах осуществления детская смесь может включать в себя около 1,8–3,3 г белка на 100 ккал. Детская смесь может быть представлена в форме порошка, который можно растворять в готовой к употреблению жидкости путем добавления количества воды, которое приводит к получению, например, жидкости, с показателем около 67 ккал/100 мл.
Детская смесь также может включать в себя нуклеотиды, выбранные из цитидин-5’-монофосфата (ЦМФ), уридин-5’-монофосфата (УМФ), аденозин-5’-монофосфата (АМФ), гуанозин-5’-монофосфата (ГМФ) и инозин-5’-монофосфата (ИМФ) и их смесей. Детская смесь также может включать в себя лютеин, зеаксантин, фруктоолигосахариды, галактоолигосахариды, сиалиллактозу и/или фукозиллактозу. В детскую смесь можно включать длинноцепочечные полиненасыщенные жирные кислоты, такие как докозагексаеновая кислота (DHA) и арахидоновая кислота (АА). Детская смесь также может включать в себя свободные аминокислоты. Детская смесь также может включать другие ингредиенты, хорошо известные в данной области.
В одном варианте осуществления детская смесь настоящего изобретения включает в себя около 5–6 г на 100 ккал жира (триглицеридов), с по меньшей мере около 7,5 мас.% этого жира, например около 7,5–12,0%, состоящего из пальмитиновой кислоты в положении sn-2 триглицерида. В некоторых вариантах осуществления около 7,8–11,8%, около 8,0–11,5 мас.%, около 8,5–11,0% или около 9,0–10,0 мас.% жира представляют собой пальмитиновую кислоту в положении sn-2 триглицерида.
В некоторых вариантах осуществления пальмитиновая кислота составляет от около 15 до около 25%, например от около 15 до около 20 мас.%, от общего содержания жирных кислот в смеси, и по меньшей мере от около 30%, например от около 35 до около 43%, от общего содержания пальмитиновой кислоты находится в положении sn-2.
В некоторых вариантах осуществления детская смесь дополнительно включает в себя по меньшей мере одну жирную кислоту омега-6 и по меньшей мере одну жирную кислоту омега-3 в соотношении около 6 к около 1. В одном варианте осуществления по меньшей мере одна жирная кислота омега-6 составляет от около 10 до около 15 мас.% от общего содержания жирных кислот, и по меньшей мере одна жирная кислота омега-3 составляет от около 1,2% до около 3,6% от общего содержания жирных кислот. В некоторых вариантах осуществления детская смесь включает в себя по меньшей мере одну жирную кислоту омега-6, составляющую от около 2 до около 4% от общей массы, и по меньшей мере одну жирную кислоту омега-3, составляющую от около 0,3% до около 0,6% от общей массы.
Жир в детской смеси настоящего изобретения включает в себя разнообразные триглицериды, как правило, присутствующие в молоке и/или детской смеси. Наиболее распространенными остатками жирных кислот в триглицеридах являются пальмитиновая и олеиновая кислоты. Помимо олеиновой и пальмитиновой кислот присутствующие остатки жирных кислот включают, без ограничений, линолевую кислоту, альфа-линолевую кислоту, лауриновую кислоту, миристиновую кислоту, докозагексаеновую кислоту и арахидоновую кислоту.
Недавние клинические исследования с участием младенцев показали, что питательные смеси, содержащие по меньшей мере одну жирную кислоту омега-6 и по меньшей мере одну жирную кислоту омега-3 в соотношении около 6 к около 1, повышают накопление DHA в эритроцитах и плазме крови. Сбалансированное соотношение около 6 : 1 жирной кислоты омега-6 и жирной кислоты омега-3 также может обеспечивать долговременные полезные эффекты для здоровья, включая защиту от сердечно-сосудистых заболеваний. Такой баланс будет достигаться путем составления композиций настоящего изобретения с источниками жира из растительных масел, которые в своем составе имеют жирные кислоты омега-6, такие как, например, соевое масло и подсолнечное масло, и которые в своем составе имеют жирные кислоты омега-3, такие как рапс, канола, льняное семя, чиа, перлла или грецкие орехи. Для обеспечения модифицированной смеси жиров будет применяться уникальная смесь жиров с 5 разными маслами
В одном варианте осуществления детская смесь настоящего изобретения включает в себя от около 1,8 до около 2,2 г общего количества белка на 100 ккал, например от около 1,8 до около 2,1 г или от около 1,9 до около 2,1 г белка на 100 ккал, причем от около 0,3 до около 0,4 г/100 ккал белка представляют собой альфа-лактальбумин. Детская смесь настоящего изобретения может быть представлена в форме готовой к употреблению жидкости или может представлять собой жидкий концентрат или порошкообразную смесь, которые можно растворять в готовой к употреблению жидкости путем добавления количества воды, которое приводит к получению жидкости с около 67 ккал/100 мл. Детская смесь настоящего изобретения включает все ингредиенты, которые требуются в соответствии с законодательством США или ЕС, включая, без ограничений, определенные витамины, минеральные вещества и незаменимые аминокислоты. Она также может включать в себя нуклеотиды, такие как ЦМФ, УМФ, АМФ, ГМФ и ИМФ, лютеин, зеаксантин и другие ингредиенты, известные в данной области.
Олигосахариды
В одном варианте осуществления питательная композиция изобретения включает в себя по меньшей мере один олигосахарид или олигосахариды. Олигосахарид может представлять собой единственный олигосахарид или смесь (разных) олигосахаридов. Смесь олигосахаридов в настоящем документе обозначается как «олигосахарид» или «олигосахариды» или «смесь олигосахаридов». Такие олигосахариды могут представлять собой, например, полифруктозу, фруктоолигосахариды (ФОС), длинноцепочечные фруктоолигосахариды, короткоцепочечные фруктоолигосахариды (например, со степенью полимеризации (DP) от 2 до 8), инулин, галактоолигосахариды, сиалилированные олигосахариды, фукозилированные олигосахариды, N-ацетилированные олигосахариды и их смесь.
Смесь олигосахаридов
В одном варианте осуществления олигосахариды изобретения присутствуют в композиции в количестве от 0,5 до 10 г/100 ккал, предпочтительно от 1 до 5 г/100 ккал, наиболее предпочтительно от 2 до 4 г/100 ккал. В некоторых конкретных вариантах осуществления питательная композиция может включать в себя смесь олигосахаридов в количестве от 0,5 до 3,1 г/100 ккал, либо в количестве от 0,6 до 3,1 г/100 ккал, либо в количестве от 0,6 до 2,0 г/100 ккал, либо в количестве от 0,7 до 2,0 г/100 ккал, либо в количестве от 0,8 до 1,8 г/100 ккал, либо в количестве от 0,9 до 1,7 г/100 ккал, либо в количестве от 1,0 до 1,5 г/100 ккал, либо в количестве от 1,0 до 1,6 г/100 ккал.
В одном варианте осуществления олигосахариды присутствуют в композиции в количестве по меньшей мере 0,5 мас.%, 1 мас.%, по меньшей мере 5 мас.% или по меньшей мере 10 мас.%. В одном варианте осуществления олигосахариды присутствуют в композиции в количестве от 0,5 мас.% до 10 мас.% или от 1 мас.% до 5 мас.%.
В одном аспекте изобретения питательная композиция включает смесь олигосахаридов в количестве от 1% или 2,5% до 15 мас.%. В альтернативном варианте осуществления питательная композиция включает смесь олигосахаридов в количестве от 3 до 15 мас.%, либо в количестве от 3 до 10 мас.%, либо в количестве от 3,5 до 9,5 мас.%, либо в количестве от 4 до 9 мас.%, либо в количестве от 4,5 до 8,5 мас.%, либо в количестве от 5,0 до 7,5 мас.%, либо в количестве от 5 до 8 мас.%.
В одном предпочтительном варианте осуществления олигосахариды представляют собой смеси сиалилированных олигосахаридов и галактоолигосахаридов (ГОС).
В одном варианте осуществления смесь олигосахаридов включает N-ацетилированные олигосахариды, галактоолигосахариды (ГОС) и сиалилированные олигосахариды.
В одном варианте осуществления композиция включает:
• N-ацетилированные олигосахариды: от 0,001 до 1 мас.%, предпочтительно от 0,003 мас.% до 0,3 мас.%;
• галактоолигосахариды: от 1 до 10 мас.%, предпочтительно от 3 мас.% до 6 мас.%;
• сиалилированные олигосахариды: от 0,005 до 1 мас.%, предпочтительно от 0,01 мас.% до 0,4 мас.%.
N-ацетилированные олигосахариды: в одном наиболее предпочтительном варианте осуществления олигосахарид композиции изобретения состоит из или включает в себя по меньшей мере один N-ацетилированный олигосахарид, по меньшей мере один галактоолигосахарид и по меньшей мере один сиалилированный олигосахарид.
N-ацетилированный олигосахарид представляет собой олигосахарид, содержащий N-ацетилированный остаток. Подходящие N-ацетилированные олигосахариды смеси олигосахаридов питательной композиции в соответствии с настоящим изобретением включают GalNAcβ1,3Galβ1,4Glc и Galβ1,6GalNAcβ1,3Galβ1,4Glc, а также любую их смесь. N-ацетилированные олигосахариды могут быть приготовлены посредством действия глюкозаминидазы и/или галактозаминидазы на N-ацетилглюкозу и/или N-ацетилгалактозу. Аналогично для этой цели можно использовать N-ацетилгалактозилтрансферазы и/или N-ацетилгликозилтрансферазы. N-ацетилированные олигосахариды также могут быть получены с помощью технологии ферментации с применением соответствующих ферментов (рекомбинантных или природных) и/или микробиологической ферментации. В последнем случае микроорганизмы могут экспрессировать свои природные ферменты и субстраты, или могут быть созданы микроорганизмы, вырабатывающие соответствующие субстраты и ферменты. Можно применять культуры микроорганизмов одного вида или смешанные культуры. Образование N-ацетилированных олигосахаридов можно инициировать акцепторными субстратами, начиная с любой степени полимеризации (DP) от DP = 1 и далее. Другой вариант представляет собой химическое преобразование кетогексозы (фруктозы) в свободной либо связанной с олигосахаридом (например, лактулоза) форме в N-ацетилгексозамин или в олигосахарид, содержащий N-ацетилгексозамин, как описано в Wrodnigg, T.M, Dtutz, A.E, Angew. Chem. Int. Ed. 1999: 38: 827–828.
Галактоолигосахарид представляет собой олигосахарид, включающий две или более молекулы галактозы, которые не заряжены и не содержат остатка N-ацетила.
Выражения «галактоолигосахарид» и ГОС можно применять взаимозаменяемо. Они относятся к олигосахариду, включающему две или более незаряженных молекул галактозы и не содержащему остатка N-ацетила (т.е. они представляют собой нейтральные олигосахариды). В конкретном варианте осуществления указанные две или более молекул галактозы соединены β-1,2-, β-1,3-, β-1,4- или β-1,6-связью. В другом варианте осуществления «галактоолигосахарид» и ГОС также включают в себя олигосахариды, включающие одну молекулу галактозы и одну молекулу глюкозы (т.е. дисахариды), соединенные β-1,2-, β-1,3- или β-1,6-связью.
Подходящие галактоолигосахариды смеси олигосахаридов питательной композиции в соответствии с настоящим изобретением включают в себя Galβ1,3Galβ1,4Glc, Galβ1,6Galβ1,4Glc, Galβ1,3Galβ1,3Galβ1,4Glc, Galβ1,6Galβ1,6Galβ1,4Glc, Galβ1,3Galβ1,6Galβ1,4Glc, Galβ1,6Galβ1,3Galβ1,4Glc, Galβ1,6Galβ1,6Galβ1,6Glc, Galβ1,3Galβ1,3Glc, Galβ1,4Galβ1,4Glc и Galβ1,4Galβ1,4Galβ1,4Glc, а также любую их смесь. Синтезированные галактоолигосахариды, такие как Galβ1,6Galβ1,4Glc, Galβ1,6Galβ1,6Galβ1,6Glc, Galβ1,3Galβ1,4Glc, Galβ1,6Galβ1,6Galβ1,4Glc, Galβ1,6Galβ1,3Galβ1,4Glc, Galβ1,3Galβ1,6Galβ1,4Glc, Galβ1,4Galβ1,4Glc и Galβ1,4Galβ1,4Galβ1,4Glc и их смеси, доступны в продаже под товарными знаками Vivinal ® и Elix’or®. Другими поставщиками олигосахаридов являются компании Dextra Laboratories, Sigma-Aldrich Chemie GmbH и Kyowa Hakko Kogyo Co., Ltd. В альтернативном варианте осуществления для получения нейтральных олигосахаридов можно применять специфические гликозилтрансферазы, такие как галактозилтрансферазы.
Сиалилированный олигосахарид представляет собой олигосахарид, содержащий остаток сиаловой кислоты с ассоциированным зарядом. К подходящим сиалилированным олигосахаридам смеси олигосахаридов питательной композиции в соответствии с настоящим изобретением относятся сиалиллактоза, α2,3-сиалиллактоза (3SL), α2,6-сиалиллактоза (6SL), NeuAcα2-3Galβ1-4Glc, NeuAcα2-6Galβ1-4Glc, NeuAcα2,3Galβ1,4Glc и NeuAcα2,6Galβ1,4Glc, а также любая их смесь.
Сиалилированный(-ые) олигосахарид(-ы) можно выбрать из группы, содержащей 3' сиалиллактозу (3-SL), 6’ сиалиллактозу (6-SL) и любую их комбинацию. В некоторых вариантах осуществления изобретения композиция включает в себя 3-SL и 6-SL. В некоторых конкретных вариантах осуществления соотношение 3’-сиалиллактозы (3-SL) и 6’-сиалиллактозы (6-SL) может находиться в диапазоне от 5 : 1 до 1 : 10, либо от 3 : 1 до 1 : 1, либо от 1 : 1 до 1 : 10. В некоторых конкретных вариантах осуществления сиалилированный олигосахарид композиции представляет собой 6’-сиалиллактозу (6-SL).
Эти сиалированные олигосахариды можно выделить из естественного источника, такого как молоко животных, методами хроматографии или фильтрации. В альтернативном варианте осуществления изобретения их также можно получить с помощью биотехнологических средств с применением специфических сиалилтрансфераз, либо посредством методики ферментации на основе ферментов (рекомбинантных или естественных ферментов), либо посредством методики микробной ферментации. В последнем случае уже существующие микроорганизмы могут экспрессировать свои естественные ферменты и субстраты, или могут быть созданы микроорганизмы, вырабатывающие соответствующие субстраты и ферменты. Можно применять культуры микроорганизмов одного вида или смешанные культуры. Образование сиалилолигосахаридов можно инициировать акцепторными субстратами, начиная с любой степени полимеризации (DP) от DP = 1 и далее. Альтернативно сиалиллактозы можно получать посредством химического синтеза из лактозы и свободной N’-ацетилнейраминовой кислоты (сиаловой кислоты). Сиалиллактозы также доступны в продаже, например, от компании Kyowa Hakko Kogyo, Япония.
Источник пребиотиков/олигосахаридов
Олигосахариды можно выделить из любого источника. Предпочтительно олигосахариды выделяют, очищают или концентрируют из коровьего молока. В альтернативном варианте осуществления все или некоторые из олигосахаридов получают полностью или частично средствами биоинженерии.
Можно применять традиционные технологии фракционирования и обогащения фракций коровьего молока в олигосахаридах из коровьего молока (такие традиционные технологии включают в себя колонную экстракцию, фильтрацию с помощью смол, нанофильтрацию, специальную ферментную обработку бета-галактозидазой, осаждение белков, кристаллизацию и отделение лактозы и т.п.). Некоторые фракции коровьего молока, обогащенные олигосахаридами, доступны в продаже или описаны (например, в патенте EP2526784 A1, способ которого можно применять для получения смеси олигосахаридов, применяемой в настоящем изобретении).
Конкретные варианты осуществления
Некоторые конкретные смеси олигосахаридов по прогнозу являются особенно подходящими для изобретения.
Питательная композиция настоящего изобретения может включать в себя по меньшей мере 0,01 мас.% N-ацетилированного(-ых) олигосахарида(-ов), по меньшей мере 2,0 мас.% галактоолигосахарида(-ов) и по меньшей мере 0,02 мас.% сиалилированного(-ых) олигосахарида(-ов).
В некоторых вариантах осуществления питательная композиция в соответствии с настоящим изобретением может включать в себя по меньшей мере 0,01 мас.%, либо по меньшей мере 0,02 мас.%, либо по меньшей мере 0,03 мас.%, либо по меньшей мере 0,04 мас.%, либо по меньшей мере 0,05 мас.%, либо по меньшей мере 0,06 мас.%, либо по меньшей мере 0,07 мас.% N-ацетилированного(-ых) олигосахарида(-ов). В некоторых вариантах осуществления она может включать в себя от 0,01 до 0,07 мас.% N-ацетилированного(-ых) олигосахарида(-ов), например от 0,01 до 0,05 мас.% N-ацетилированного(-ых) олигосахарида(-ов) или от 0,01 до 0,03 мас.% N-ацетилированного(-ых) олигосахарида(-ов).
Дополнительно питательная композиция может включать в себя по меньшей мере 2 мас.%, либо по меньшей мере 3 мас.%, либо по меньшей мере 4 мас.%, либо по меньшей мере 5 мас.%, либо по меньшей мере 5,5 мас.%, либо по меньшей мере 6 мас.%, либо по меньшей мере 7 мас.%, либо по меньшей мере 8 мас.% галактоолигосахарида(-ов). В некоторых вариантах осуществления она может включать в себя от 5 до 8 мас.% галактоолигосахарида(-ов), например от 5,75 до 7 мас.% галактоолигосахарида(-ов) или от 5,85 до 6,5 мас.% галактоолигосахарида(-ов). Конкретным примером является количество 5,95 мас.% олигосахарида(-ов).
Наконец, питательная композиция может включать в себя по меньшей мере 0,02 мас.%, либо по меньшей мере 0,03 мас.%, либо по меньшей мере 0,04 мас.%, либо по меньшей мере 0,05 мас.%, либо по меньшей мере 0,06 мас.%, либо по меньшей мере 0,07 мас.%, либо по меньшей мере 0,08 мас.%, либо по меньшей мере 0,09 мас.% сиалилированных олигосахаридов. В некоторых вариантах осуществления она может включать в себя от 0,02 до 0,09 мас.% сиалилированного(-ых) олигосахарида(-ов), например от 0,02 до 0,08 мас.% сиалилированного(-ых) олигосахарида(-ов), либо от 0,02 до 0,07 мас.% сиалилированного(-ых) олигосахарида(-ов), либо от 0,003 до 0,07 мас.% сиалилированного(-ых) олигосахарида(-ов).
В конкретном варианте осуществления питательная композиция в соответствии с настоящим изобретением может включать в себя от 0,01 до 0,07 мас.% N-ацетилированного(-ых) олигосахарида(-ов), от 2,0 до 8,0 мас.% галактоолигосахарида(-ов) и от 0,02 до 0,09 мас.% сиалилированного(-ых) олигосахарида(-ов).
Еще в одном конкретном варианте осуществления питательная композиция в соответствии с настоящим изобретением может включать в себя от 0,01 до 0,03 мас.% N-ацетилированного(-ых) олигосахарида(-ов), 5,95 мас.% галактоолигосахарида(-ов) и от 0,02 до 0,09 мас.% сиалилированного(-ых) олигосахарида(-ов).
В другом варианте осуществления питательная композиция может включать в себя по меньшей мере 0,0015 г/100 ккал N-ацетилированного(-ых) олигосахарида(-ов), по меньшей мере 0,70 г/100 ккал галактоолигосахарида(-ов) и по меньшей мере 0,0045 г/100 ккал сиалилированного(-ых) олигосахарида(-ов).
В некоторых конкретных вариантах осуществления питательная композиция может включать в себя по меньшей мере 0,0015 г/100 ккал, либо по меньшей мере 0,002 г/100 ккал, либо по меньшей мере 0,0025 г/100 ккал, либо по меньшей мере 0,003 г/100 ккал, либо по меньшей мере 0,0035 г/100 ккал, либо по меньшей мере 0,004 г/100 ккал, либо по меньшей мере 0,0045 г/100 ккал, либо по меньшей мере 0,005 г/100 ккал N-ацетилированного(-ых) олигосахарида(-ов). В некоторых вариантах осуществления питательная композиция может включать в себя от 0,0015 до 0,005 г/100 ккал N-ацетилированного(-ых) олигосахарида(-ов), например от 0,0015 до 0,045 г/100 ккал N-ацетилированного(-ых) олигосахарида(-ов) или от 0,002 до 0,0045 г/100 ккал N-ацетилированного(-ых) олигосахарида(-ов).
Дополнительно питательная композиция может включать в себя по меньшей мере 0,70 г/100 ккал, либо по меньшей мере 0,74 г/100 ккал, либо по меньшей мере 0,8 г/100 ккал, либо по меньшей мере 0,85 г/100 ккал, либо по меньшей мере 0,90 г/100 ккал, либо по меньшей мере 0,95 г/100 ккал, либо по меньшей мере 1,0 г/100 ккал, либо по меньшей мере 1,05 г/100 ккал, либо по меньшей мере 1,10 г/100 ккал, либо по меньшей мере 1,20 г/100 ккал, либо по меньшей мере 1,50 галактоолигосахарида(-ов). В некоторых вариантах осуществления она может включать в себя от 0,70 до 1,5 г/100 ккал галактоолигосахарида(-ов), например от 0,70 до 1,20 г/100 ккал галактоолигосахарида(-ов) или от 0,74 до 1,2 г/100 ккал галактоолигосахарида(-ов).
Наконец, питательная композиция может включать в себя по меньшей мере 0,0045 г/100 ккал, либо по меньшей мере 0,005 г/100 ккал, либо по меньшей мере 0,0055 г/100 ккал, либо по меньшей мере 0,006 г/100 ккал, либо по меньшей мере 0,0065 г/100 ккал, либо по меньшей мере 0,007 г/100 ккал, либо по меньшей мере 0,0075 г/100 ккал, либо по меньшей мере 0,008 г/100 ккал, либо по меньшей мере 0,0085 г/100 ккал сиалилированного(-ых) олигосахарида(-ов). В некоторых вариантах осуществления она может включать в себя от 0,0045 до 0,0085 г/100 ккал сиалилированного(-ых) олигосахарида(-ов), например от 0,0045 до 0,008 г/100 ккал сиалилированного(-ых) олигосахарида(-ов) или от 0,0045 до 0,0075 г/100 ккал сиалилированного(-ых) олигосахарида(-ов).
В конкретном варианте осуществления питательная композиция может включать в себя от 0,0015 до 0,005 г/100 ккал N-ацетилированного(-ых) олигосахарида(-ов), от 0,70 до 1,5 г/100 ккал галактоолигосахарида(-ов) и от 0,0045 до 0,0085 г/100 ккал сиалилированного(-ых) олигосахарида(-ов).
В другом конкретном варианте осуществления питательная композиция может включать в себя от 0,0015 до 0,0045 г/100 ккал N-ацетилированного(-ых) олигосахарида(-ов), от 0,74 до 1,2 г/100 ккал галактоолигосахарида(-ов) и от 0,0045 до 0,0075 г/100 ккал сиалилированного(-ых) олигосахарида(-ов).
В конкретном преимущественном варианте осуществления смесь олигосахаридов питательной композиции в соответствии с изобретением включает в себя от 0,1 до 4,0 мас.% N-ацетилированного(-ых) олигосахарида(-ов), от 92,0 до 98,5 мас.% галактоолигосахарида(-ов) и от 0,3 до 4,0 мас.% сиалилированного(-ых) олигосахарида(-ов).
В одном аспекте изобретения питательная композиция включает в себя смесь олигосахаридов в количестве от 2,5 до 15 мас.%. В альтернативном варианте осуществления питательная композиция включает смесь олигосахаридов в количестве от 3 до 15 мас.%, либо в количестве от 3 до 10 мас.%, либо в количестве от 3,5 до 9,5 мас.%, либо в количестве от 4 до 9 мас.%, либо в количестве от 4,5 до 8,5 мас.%, либо в количестве от 5,0 до 7,5 мас.%, либо в количестве от 5 до 8 мас.%.
В некоторых конкретных вариантах осуществления питательная композиция может включать в себя смесь олигосахаридов в количестве от 0,5 до 3,1 г/100 ккал, либо в количестве от 0,6 до 3,1 г/100 ккал, либо в количестве от 0,6 до 2,0 г/100 ккал, либо в количестве от 0,7 до 2,0 г/100 ккал, либо в количестве от 0,8 до 1,8 г/100 ккал, либо в количестве от 0,9 до 1,7 г/100 ккал, либо в количестве от 1,0 до 1,5 г/100 ккал, либо в количестве от 1,0 до 1,6 г/100 ккал.
Питательная композиция настоящего изобретения может включать в себя по меньшей мере 0,01 мас.% N-ацетилированного(-ых) олигосахарида(-ов), по меньшей мере 2,0 мас.% галактоолигосахарида(-ов) и по меньшей мере 0,02 мас.% сиалилированного(-ых) олигосахарида(-ов).
В некоторых вариантах осуществления питательная композиция в соответствии с настоящим изобретением может включать в себя по меньшей мере 0,01 мас.%, либо по меньшей мере 0,02 мас.%, либо по меньшей мере 0,03 мас.%, либо по меньшей мере 0,04 мас.%, либо по меньшей мере 0,05 мас.%, либо по меньшей мере 0,06 мас.%, либо по меньшей мере 0,07 мас.% N-ацетилированного(-ых) олигосахарида(-ов). В некоторых вариантах осуществления она может включать в себя от 0,01 до 0,07 мас.% N-ацетилированного(-ых) олигосахарида(-ов), например от 0,01 до 0,05 мас.% N-ацетилированного(-ых) олигосахарида(-ов) или от 0,01 до 0,03 мас.% N-ацетилированного(-ых) олигосахарида(-ов).
Дополнительно питательная композиция может включать в себя по меньшей мере 2 мас.%, либо по меньшей мере 3 мас.%, либо по меньшей мере 4 мас.%, либо по меньшей мере 5 мас.%, либо по меньшей мере 5,5 мас.%, либо по меньшей мере 6 мас.%, либо по меньшей мере 7 мас.%, либо по меньшей мере 8 мас.% галактоолигосахарида(-ов). В некоторых вариантах осуществления она может включать в себя от 5 до 8 мас.% галактоолигосахарида(-ов), например от 5,75 до 7 мас.% галактоолигосахарида(-ов) или от 5,85 до 6,5 мас.% галактоолигосахарида(-ов). Конкретным примером является количество 5,95 мас.% олигосахарида(-ов).
Наконец, питательная композиция может включать в себя по меньшей мере 0,02 мас.%, либо по меньшей мере 0,03 мас.%, либо по меньшей мере 0,04 мас.%, либо по меньшей мере 0,05 мас.%, либо по меньшей мере 0,06 мас.%, либо по меньшей мере 0,07 мас.%, либо по меньшей мере 0,08 мас.%, либо по меньшей мере 0,09 мас.% сиалилированных олигосахаридов. В некоторых вариантах осуществления она может включать в себя от 0,02 до 0,09 мас.% сиалилированного(-ых) олигосахарида(-ов), например от 0,02 до 0,08 мас.% сиалилированного (-ых) олигосахарида(-ов), либо от 0,02 до 0,07 мас.% сиалилированного(-ых) олигосахарида(-ов), либо от 0,003 до 0,07 мас.% сиалилированного(-ых) олигосахарида(-ов).
В конкретном варианте осуществления питательная композиция в соответствии с настоящим изобретением может включать в себя от 0,01 до 0,07 мас.% N-ацетилированного(-ых) олигосахарида(-ов), от 2,0 до 8,0 мас.% галактоолигосахарида(-ов) и от 0,02 до 0,09 мас.% сиалилированного(-ых) олигосахарида(-ов).
Еще в одном конкретном варианте осуществления питательная композиция в соответствии с настоящим изобретением может включать в себя от 0,01 до 0,03 мас.% N-ацетилированного(-ых) олигосахарида(-ов), 5,95 мас.% галактоолигосахарида(-ов) и от 0,02 до 0,09 мас.% сиалилированного(-ых) олигосахарида(-ов).
В другом варианте осуществления питательная композиция может включать в себя по меньшей мере 0,0015 г/100 ккал N-ацетилированного(-ых) олигосахарида(-ов), по меньшей мере 0,70 г/100 ккал галактоолигосахарида(-ов) и по меньшей мере 0,0045 г/100 ккал сиалилированного(-ых) олигосахарида(-ов).
В некоторых конкретных вариантах осуществления питательная композиция может включать в себя по меньшей мере 0,0015 г/100 ккал, либо по меньшей мере 0,002 г/100 ккал, либо по меньшей мере 0,0025 г/100 ккал, либо по меньшей мере 0,003 г/100 ккал, либо по меньшей мере 0,0035 г/100 ккал, либо по меньшей мере 0,004 г/100 ккал, либо по меньшей мере 0,0045 г/100 ккал, либо по меньшей мере 0,005 г/100 ккал N-ацетилированного(-ых) олигосахарида(-ов). В некоторых вариантах осуществления питательная композиция может включать в себя от 0,0015 до 0,005 г/100 ккал N-ацетилированного(-ых) олигосахарида(-ов), например от 0,0015 до 0,045 г/100 ккал N-ацетилированного(-ых) олигосахарида(-ов) или от 0,002 до 0,0045 г/100 ккал N-ацетилированного(-ых) олигосахарида(-ов).
Дополнительно питательная композиция может включать в себя по меньшей мере 0,70 г/100 ккал, либо по меньшей мере 0,74 г/100 ккал, либо по меньшей мере 0,8 г/100 ккал, либо по меньшей мере 0,85 г/100 ккал, либо по меньшей мере 0,90 г/100 ккал, либо по меньшей мере 0,95 г/100 ккал, либо по меньшей мере 1,0 г/100 ккал, либо по меньшей мере 1,05 г/100 ккал, либо по меньшей мере 1,10 г/100 ккал, либо по меньшей мере 1,20 г/100 ккал, либо по меньшей мере 1,50 галактоолигосахарида(-ов). В некоторых вариантах осуществления она может включать в себя от 0,70 до 1,5 г/100 ккал галактоолигосахарида(-ов), например от 0,70 до 1,20 г/100 ккал галактоолигосахарида(-ов) или от 0,74 до 1,2 г/100 ккал галактоолигосахарида(-ов).
Олигосахариды/BMOS
В одном варианте осуществления изобретения композиция включает в себя «олигосахариды коровьего молока» (в настоящем документе используется сокращение BMOS или «смесь BMOs»), которые представляют собой следующую смесь (фракцию коровьего молока, обогащенную некоторыми олигосахаридами).
BMOS содержит (концентрация в итоговой композиции, например, детской смеси, в пересчете на сухую массу) приблизительно:
N-ацетилированные олигосахариды: от 0,006 до 0,24 масс.%;
галактоолигосахариды: от 5,52 до 5,91 мас.%;
сиалилированные олигосахариды: от 0,018 до 0,24 мас.%.
Галактоолигосахариды могут представлять собой доступные в продаже Vivinal GOS от компании Friesland Campina (Нидерланды).
В конкретном варианте осуществления питательная композиция включает в себя от 2,5 до 15,0 мас.% смеси BMOS.
В другом варианте осуществления питательная композиция включает в себя по меньшей мере 0,01 мас.% N-ацетилированного(-ых) олигосахарида(-ов), по меньшей мере 2,0 мас.% галактоолигосахарида(-ов) и по меньшей мере 0,02 мас.% сиалилированного(-ых) олигосахарида(-ов).
В одном варианте осуществления композиция включает в себя по меньшей мере один N-ацетилированный олигосахарид, и/или по меньшей мере один галактоолигосахарид, и/или по меньшей мере один сиалилированный олигосахарид. В одном варианте осуществления композиция включает в себя по меньшей мере один N-ацетилированный олигосахарид, и по меньшей мере один галактоолигосахарид, и по меньшей мере один сиалилированный олигосахарид.
В одном варианте осуществления смесь BMOS включает в себя от 0,1 до 4,0 мас.% N-ацетилированного(-ых) олигосахарида(-ов), от 92,0 до 98,5 мас.% галактоолигосахарида(-ов) и от 0,3 до 4,0 мас.% сиалилированного(-ых) олигосахарида(-ов).
В одном варианте осуществления смесь BMOS получают из молока животного, такого как коровье молоко или буйволиное молоко.
Питательная композиция может включать в себя по меньшей мере 0,0045 г/100 ккал, либо по меньшей мере 0,005 г/100 ккал, либо по меньшей мере 0,0055 г/100 ккал, либо по меньшей мере 0,006 г/100 ккал, либо по меньшей мере 0,0065 г/100 ккал, либо по меньшей мере 0,007 г/100 ккал, либо по меньшей мере 0,0075 г/100 ккал, либо по меньшей мере 0,008 г/100 ккал, либо по меньшей мере 0,0085 г/100 ккал сиалилированного(-ых) олигосахарида(-ов). В некоторых вариантах осуществления она может включать в себя от 0,0045 до 0,0085 г/100 ккал сиалилированного(-ых) олигосахарида(-ов), например от 0,0045 до 0,008 г/100 ккал сиалилированного(-ых) олигосахарида(-ов) или от 0,0045 до 0,0075 г/100 ккал сиалилированного(-ых) олигосахарида(-ов).
В конкретном варианте осуществления питательная композиция может включать в себя от 0,0015 до 0,005 г/100 ккал N-ацетилированного(-ых) олигосахарида(-ов), от 0,70 до 1,5 г/100 ккал галактоолигосахарида(-ов) и от 0,0045 до 0,0085 г/100 ккал сиалилированного(-ых) олигосахарида(-ов).
В другом конкретном варианте осуществления питательная композиция может включать в себя от 0,0015 до 0,0045 г/100 ккал N-ацетилированного(-ых) олигосахарида(-ов), от 0,74 до 1,2 г/100 ккал галактоолигосахарида(-ов) и от 0,0045 до 0,0075 г/100 ккал сиалилированного(-ых) олигосахарида(-ов).
В конкретном преимущественном варианте осуществления смесь олигосахаридов питательной композиции в соответствии с изобретением включает в себя от 0,1 до 4,0 мас.% N-ацетилированного(-ых) олигосахарида(-ов), от 92,0 до 98,5 мас.% галактоолигосахарида(-ов) и от 0,3 до 4,0 мас.% сиалилированного(-ых) олигосахарида(-ов).
В публикациях WO2006087391 и WO2012160080 представлены некоторые примеры получения смесей BMOS.
Другие олигосахариды/олигофруктоза (ОФ)
Детская смесь настоящего изобретения может включать в себя по меньшей мере около 0,4 г или по меньшей мере 0,7 г олигофруктозы на 100 ккал композиции. В некоторых вариантах осуществления она включает в себя от около 0,4 до около 0,9 г, от около 0,4 до около 0,7 г, от около 0,4 до около 0,5 г, от около 0,7 до около 0,8 г или от около 0,7 до около 0,9 г олигофруктозы на 100 ккал.
В некоторых вариантах осуществления олигофруктоза имеет степень полимеризации от 2 до 10. В некоторых вариантах осуществления по меньшей мере 80%, 90%, 95%, 99% или 100% олигофруктозы имеют степень полимеризации от 2 до 8 (в диапазоне от 2 до 8).
В одном варианте осуществления композиция изобретения включает в себя
- по меньшей мере 3 г/л или по меньшей мере 5 г/л олигофруктозы (ОФ), если композиция представляет собой готовую к употреблению жидкую композицию, или
- достаточное количество олигосахарида для получения соответственно по меньшей мере 3 г/л или 5 г/л олигофруктозы в композиции после растворения, если указанная питательная композиция представляет собой энергетическую или концентрированную композицию.
В некоторых вариантах осуществления питательная композиция изобретения включает в себя по меньшей мере 0,4 г ОФ/100 ккал композиции, или по меньшей мере 0,7 г, или по меньшей мере 0,75 г, или по меньшей мере 0,8 г, или по меньшей мере 0,9 г ОФ/100 ккал композиции.
С учетом результатов, продемонстрированных в примерах, общепризнанным является то, что высокое количество олигофруктозы обеспечивает более сильный эффект. Однако может существовать верхний предел полезного эффекта олигофруктозы, когда появляется неблагоприятный побочный эффект. Такой верхний предел может, например, составлять 2,2 г/100 ккал, 2,0 г/100 ккал, 1,8 г/100 ккал, 1,5 г/100 ккал или 1,2 г/100 ккал. Предпочтительно композиция изобретения включает в себя 5 г ОФ/л, или 0,75 или 0,9 г ОФ/100 ккал композиции, или, наконец, такие количества.
Другие пребиотики
Композиция изобретения может включать в себя указанные или дополнительные неперевариваемые олигосахариды (например пребиотики). Они, как правило, присутствуют в количестве от 0,3 до 10 мас.% от общей массы композиции.
Пребиотики, как правило, являются неперевариваемыми в том смысле, что они не расщепляются и не всасываются в желудке или тонком кишечнике и, таким образом, остаются в интактном виде при переходе в толстый кишечник, в котором они селективно ферментируются полезными бактериями. Примеры пребиотиков включают в себя некоторые олигосахариды, такие дополнительные фруктоолигосахариды (ФОС) и/или галактоолигосахариды (ГОС). Можно использовать комбинацию пребиотиков, такую как 90% ГОС с 10% короткоцепочечных фруктоолигосахаридов. Другая комбинация пребиотиков представляет собой 70% короткоцепочечных фруктоолигосахаридов и 30% инулина (длинноцепочечного ФОС). Оба этих пребиотика, а также олигофруктоза (ОФ) доступны в продаже, в частности, у компании BENEO (Beneo GmbH, Maximilianstrasse, 68165, г. Мангейм, Германия).
Пробиотики
Композиция изобретения включает в себя Bifidobacterium animalis вида lactis (B. lactis), представляющий собой пробиотик.
В одном варианте осуществления пробиотик B. lactis представляет собой доступный в продаже препарат BB12, предлагаемый компанией CHr. Hansen (Дания). В одном варианте осуществления пробиотик представляет собой Bifidobacterium animalis вида lactis (B. lactis) CNCM I-3446.
Дозировка пробиотиков может составлять, например, от 105 до 1012 КОЕ на грамм композиции, предпочтительно в количестве, достаточном для обеспечения синергетического эффекта с олигосахаридами (например, BMOS) композиции, предпочтительно от 106 до 108 КОЕ/г композиции.
Белки/альфа-лактальбумин
Композиция изобретения включает в себя источник белка. Такой источник белка может, например, обеспечивать от 1,6 до 3 г белка/100 ккал. В одном варианте осуществления, предназначенном для преждевременно родившихся младенцев, такое количество может составлять от 2,4 до 4 г/100 ккал или более 3,6 г/100 ккал. В одном варианте осуществления количество может быть ниже 2,0 г на 100 ккал, например ниже 1,8 г на 100 ккал.
Тип белка не считается в высокой степени критическим для настоящего изобретения при условии, что соблюдены минимальные требования к содержанию незаменимых аминокислот и обеспечен удовлетворительный рост. Однако конкретные белки могут обеспечивать наиболее подходящий субстрат для микробиоты. Таким образом, можно применять источники белка на основе молочной сыворотки, казеина и их смесей, а также источники белка на основе сои. Что касается сывороточных белков, то источник белка может быть основан на кислой сыворотке, или сладкой молочной сыворотке, или их смесях и может включать в себя альфа-лактальбумин и бета-лактальбумин в любых желаемых пропорциях.
В источнике белка предпочтительно преобладают белки молочной сыворотки (более 50% белков происходят от сывороточных белков). В одном варианте осуществления белок композиции представляет собой нативные белки или преимущественно (более 90%) нативные белки.
Белки могут быть нативными или гидролизованными, либо они могут представлять собой смесь нативных и гидролизованных белков. Под термином «нативный» подразумевается, что основная часть белков является нативной, т.е. их молекулярная структура не изменена, например не изменено по меньшей мере 80% белков, например не изменено по меньшей мере 85% белков, предпочтительно не изменено по меньшей мере 90% белков, еще более предпочтительно не изменено по меньшей мере 95% белков, например не изменено по меньшей мере 98% белков. В конкретном варианте осуществления 100% белков не изменено.
Термин «гидролизованный» в контексте настоящего изобретения означает белок, который был гидролизован или расщеплен на составляющие его аминокислоты.
Белки могут быть полностью, в существенной степени или частично гидролизованными. Может быть желательно вводить частично гидролизованные белки (степень гидролиза от 2 до 20%), например, младенцам, предположительно подверженным риску развития аллергии на коровье молоко. При необходимости применения гидролизованных белков процесс гидролиза может проводиться по желанию и известным в данной области способом. Например, гидролизаты сывороточного белка можно приготовить ферментативным гидролизом фракции молочной сыворотки в одну или более стадий. Если фракция молочной сыворотки, применяемая в качестве исходного материала, по существу, не содержит лактозы, то установлено, что в процессе гидролиза блокировка лизина белка проявляется в гораздо меньшей степени. Это позволяет снизить степень блокирования лизина с около 15% от массы общего лизина до менее около 10% от массы общего лизина; например, около 7% от массы общего лизина, что значительно улучшает питательное качество источника белка.
В одном предпочтительном варианте осуществления белки композиции гидролизованы, полностью гидролизованы, в существенной степени гидрозированы или частично гидролизованы. Степень гидролиза (DH) белка может находиться в диапазоне от 8 до 40, или от 20 до 60, или от 20 до 80, или она может составлять более 10, 20, 40, 60, 80 90. Следует понимать, что гидролизованные белки могут оказывать на аллергию несколько действий: гидролизованные белки могут быть менее аллергенными, вызывая, таким образом, меньше иммунных аллергических реакций. Гидролизованные белки, особенно небольшие пептиды (длиной менее 20, 10 или 5 аминокислот), могут индуцировать толерантность при пероральном введении, влияя, таким образом, на будущий аллергический статус субъекта. Следует понимать, что гидролизованные белки можно преимущественно комбинировать с фукозилированным(-ыми) олигосахаридом(-ами) настоящего изобретения, обеспечивая двойной эффект, возможно синергический эффект, действуя по меньшей мере на 2 разных уровня при установлении аллергических симптомов или аллергического статуса.
В одном варианте осуществления изобретения по меньшей мере 70% белков гидролизовано, предпочтительно по меньшей мере 80% белков гидролизовано, например по меньшей мере 85% белков гидролизовано, еще более предпочтительно по меньшей мере 90% белков гидролизовано, например по меньшей мере 95% белков гидролизовано, в частности по меньшей мере 98% белков гидролизовано. В конкретном варианте осуществления 100% белков гидролизовано.
В одном варианте осуществления гидролизованные белки являются единственным источником белка (т.е. 100% или по меньшей мере 90% белка гидролизовано).
В одном варианте осуществления гидролизованные белки являются основным источником белка (т.е. по меньшей мере 50%, предпочтительно 60% белков гидролизовано).
В одном варианте осуществления питательная композиция изобретения включает в себя альфа-лактальбумин в количестве по меньшей мере 0,2, или 0,3, или 0,4 г/100 ккал, или по меньшей мере 1,7 г, или 2,0, или 2,3, или 2,6 г/л. Считается, что наличие альфа-лактальбумина в определенном количестве усиливает воздействие олигофруктозы, обеспечивая, например, необходимый питательный субстрат для микробиоты.
Можно предположить, что гидролизованный белок легче переваривается и, следовательно, вступает в синергетическое соотношение с формированием кишечной микробиоты, которая похожа на микробиоту младенцев, находящихся на грудном вскармливании, особенно в случае ослабленных младенцев.
Предпочтительная матрица питательной композиции
Композиция в соответствии с изобретением может представлять собой искусственную питательную композицию. Это может быть детская смесь, начальная детская смесь, смесь для недоношенных детей, смесь для прикармливаемых детей, или обогатитель, такой как обогатитель грудного молока, или добавка. Композиция изобретения предпочтительно представляет собой детскую смесь, или обогатитель, или добавку для употребления в первые 4 или 6 месяцев жизни.
Жир/высокое содержание sn-2-пальмитата
В одном варианте осуществления питательная композиция включает в себя триглицериды с высоким содержанием sn-2-пальмитата, предпочтительно триглицериды, имеющие более 33% пальмитиновых кислот в положении sn-2.
В одном варианте осуществления питательная композиция настоящего изобретения включает в себя около 5–6 г на 100 ккал жира (триглицеридов) с по меньшей мере около 7,5 мас.% этого жира, например около 7,5–12,0%, состоящего из пальмитиновой кислоты в положении sn-2 триглицерида.
В одном варианте осуществления изобретения композиция включает в себя по меньшей мере 7,5%, предпочтительно 8%, более предпочтительно по меньшей мере 9,6% жира, который представляет собой sn-2-пальмитат.
В некоторых вариантах осуществления около 7,8–11,8%, около 8,0–11,5 мас.%, около 8,5–11,0% или около 9,0–10,0 мас.% жира представляют собой пальмитиновую кислоту в положении sn-2 триглицерида.
В некоторых вариантах осуществления пальмитиновая кислота составляет от около 15 до около 25%, например от около 15 до около 20 мас.%, от общего содержания жирных кислот в смеси, и по меньшей мере от около 30%, например от около 35 до около 43%, от общего содержания пальмитиновой кислоты находится в положении sn-2.
В некоторых вариантах осуществления питательная композиция дополнительно включает в себя по меньшей мере одну жирную кислоту омега-6 и по меньшей мере одну жирную кислоту омега-3 в соотношении около 6 к около 1. В одном варианте осуществления по меньшей мере одна жирная кислота омега-6 составляет от около 10 до около 15 мас.% от общего содержания жирных кислот, и по меньшей мере одна жирная кислота омега-3 составляет от около 1,2% до около 3,6% от общего содержания жирных кислот. В некоторых вариантах осуществления детская смесь включает в себя по меньшей мере одну жирную кислоту омега-6, составляющую от около 2 до около 4% от общей массы, и по меньшей мере одну жирную кислоту омега-3, составляющую от около 0,3% до около 0,6% от общей массы.
Жир в питательной композиции настоящего изобретения включает в себя разнообразные триглицериды, как правило, присутствующие в молоке и/или питательной композиции. Наиболее распространенными остатками жирных кислот в триглицеридах являются пальмитиновая и олеиновая кислоты. Помимо олеиновой и пальмитиновой кислот присутствующие остатки жирных кислот включают, без ограничений, линолевую кислоту, альфа-линолевую кислоту, лауриновую кислоту, миристиновую кислоту, докозагексаеновую кислоту и арахидоновую кислоту.
В продаже доступна композиция Betapol™ B-55 от компании Lipid Nutrition, которая представляет собой смесь триглицеридов, полученную из растительного масла, в которой по меньшей мере 54% пальмитиновой кислоты находится в положении sn-2 молекулы глицерина. В одном варианте осуществления содержание жира в композиции изобретения составляет около 40–50 мас.% Betapol™ B-55, например от около 43 до около 45 мас.%. Для специалистов в данной области очевидно, что процентное содержание используемого жира с высоким содержанием sn-2-пальмитата и общее количество sn-2-пальмитата в смеси может варьироваться и что можно использовать другое масло, содержащее sn-2-пальмитат, без отступления от сущности и объема изобретения.
Хотя кормление младенца смесью с высоким процентным содержанием sn-2-пальмитата способствует образованию более мягкого стула и росту бифидобактерий в толстом кишечнике, комбинация высокого содержания sn-2-пальмитата с олигофруктозой обеспечивает существенно лучшее смягчение стула, при этом обеспечивается оптимальный баланс кишечной микробиоты и усиливается угнетение или снижение нагрузки патогенных бактерий в толстом кишечнике у младенцев, находящихся на вскармливании смесью.
Эффект для здоровья
Композиция изобретения оказывает положительное воздействие на микробиоту младенцев или детей младшего возраста. Такой положительный эффект может включать в себя подавление, снижение или ингибирование роста патогенных бактерий и/или усиление, увеличение или стимуляцию роста полезных бактерий.
Эффект для здоровья композиции изобретения включает в себя стимуляцию или индукцию кишечной микробиоты, которая похожа на микробиоту младенцев, вскармливаемых исключительно человеческим грудным молоком, по сравнению с микробиотой младенцев, вскармливаемых преимущественно традиционной питательной композицией (или детской смесью), не включающей указанного пробиотика. Такой эффект достигается у младенцев или детей младшего возраста от 0 до 36 месяцев, необязательно от 0 до 12 месяцев.
Данный эффект для здоровья можно наблюдать после нескольких дней или недель применения композиции, например, после 4 недель, или 6 недель, или 8 недель применения. Однако время до наблюдения индуцированной микробиоты может составлять 4, 6, 8 недель.
В этом контексте данный эффект для здоровья делает микробиоту младенцев или детей младшего возраста похожей на микробиоту младенцев или детей младшего возраста, которые находятся (исключительно) на грудном вскармливании. Особенно это наблюдается при сравнении младенцев по сравнению с младенцами или детьми младшего возраста, которые не получают композицию изобретения.
Индуцированная микробиота является специфичной по 2 измерениям. С количественной точки зрения, кишечная флора включает в себя больше полезных бактерий и меньше неполезных или вредных бактерий. С качественной точки зрения, разнообразие таксонов бактерий больше напоминает микробиоту младенцев на грудном вскармливании.
Композиция изобретения обеспечивает положительные для здоровья эффекты за счет угнетения, уменьшения и/или ингибирования роста популяций патогенных бактерий и/или большей индукции полезных бактерий, в количественном и качественном измерении. Такая здоровая кишечная микробиота в конечном счете связана с надлежащим всасыванием питательных веществ, адекватным ростом, уменьшением колик, уменьшением инфекции, уменьшением диареи и оптимальным состоянием кишечника.
Эффект для здоровья, вызванный композицией изобретения, можно в одном варианте осуществления охарактеризовать как включающий в себя увеличение популяции B. animalis и/или Bifidobacterium, и/или B. Longum и/или Lactobacillus, и/или подавление популяций Coprobacillus и/или Streptococcus.
Влияние изобретения может быть профилактическим (например, предотвращение дисбаланса кишечной микробиоты, предотвращение кишечных инфекций, поддержание здоровой кишечной микробиоты, введение здоровой кишечной микробиоты) или лечебным (восстановление здоровой кишечной микробиоты при ее нарушении, помощь в устранении или сокращении популяций патогенных бактерий в кишечнике, введение здоровой микробиоты после ожидаемых нарушений, например из-за диареи или инфекций).
Эффект для здоровья в отношении младенца можно измерить различными способами, как показано в приведенном ниже примере. Однако в одном варианте осуществления влияние на микробиоту измеряют по среднему распределению дистанций по UNIFRAC (см. ниже).
В одном варианте осуществления эффект для здоровья, «стимулирующий или индуцирующий кишечную микробиоту, которая похожа на микробиоту младенцев, вскармливаемых исключительно человеческим грудным молоком», дополнительно характеризуется стимуляцией или индукцией кишечной микрофлоры, имеющей филогенетическую дистанцию до микробиоты младенцев на грудном вскармливании менее 0,3 единицы (измерение методом Unifrac), предпочтительно менее 0,25 единицы.
Целевая группа младенцев
В одном варианте осуществления изобретения целевая группа младенцев или детей младшего возраста рождена с ослабленной или несбалансированной микробиотой или с дисбиозом микробиоты. Например, такие младенцы могут быть недоношенными младенцами, младенцами, рожденными маленькими для своего гестационного возраста или рожденными посредством кесарева сечения, госпитализированными младенцами или младенцами, пролеченными или получающими лечение антибиотиками.
В одном варианте осуществления младенцы или дети младшего возраста родились в срок. Все младенцы могут получать пользу от изобретения, поскольку все младенцы являются или могут быть в определенном возрасте подвержены возникновению дисбаланса кишечной микробиоты. В одном варианте осуществления младенцы или дети младшего возраста родились преждевременно (являются недоношенными). В одном варианте осуществления младенцы или дети младшего возраста родились маленькими для своего гестационного возраста. В одном варианте осуществления младенцы или дети младшего возраста были рождены посредством вагинальных родов. В одном варианте осуществления младенцы или дети младшего возраста были рождены посредством кесарева сечения. Ожидается, что композиция изобретения может быть еще полезнее для младенцев, рожденных с возможным нарушением кишечной микробиоты, или ослабленных младенцев (таких как преждевременно родившиеся младенцы и/или младенцы, рожденные посредством кесарева сечения). Кроме того, ожидается, что композиция изобретения может быть еще полезнее для младенцев, у которых наблюдаются кишечные расстройства (такие как диарея, инфекции или колики) после рождения, например, в течение первых 4 недель после рождения.
В вариантах осуществления изобретения младенцы родились маленькими для своего гестационного возраста, или были рождены посредством кесарева сечения, или имеют несбалансированную или аномальную кишечную микробиоту, или страдают кишечной инфекцией; необязательно вышеуказанные состояния являются объектом воздействия композиции изобретения при возрасте младенцев 0–6 месяцев. Без стремления к ограничению какой-либо теорией считается, что младенцы младшего возраста получают еще большую пользу от изобретения, особенно если младенцы имеют (или подвержены риску иметь) несбалансированную кишечную микробиоту и/или у них наблюдается ослабленное состояние здоровья (примерами которого являются вышеприведенные состояния).
У таких младенцев или детей младшего возраста приобретение кишечной микробиоты, которая похожа на кишечную микробиоту младенцев на грудном вскармливании (предпочтительно младенцев на исключительно грудном вскармливании), представляет особый интерес. Действительно, это обеспечивает их значительным количеством благоприятных для здоровья элементов, которые могут быть полезными, особенно для этих ослабленных младенцев.
В одном варианте осуществления возраст младенцев или детей младшего возраста составляет 0–6 месяцев, или 0–12 месяцев, или 0–36 месяцев. Ожидается, что композиция изобретения может быть еще полезнее для новорожденных младенцев (в возрасте 0–4 недели или 0–8 недель), поскольку их кишечный тракт может быть более ослабленным.
Следующие примеры представлены для иллюстрации определенных вариантов осуществления и признаков настоящего изобретения, но их не следует толковать как ограничивающих объем настоящего изобретения.
Предполагаемый режим кормления
В одном варианте осуществления композицию изобретения дают (или предписывают давать, или назначают) младенцу или детям младшего возраста в течение 2, 4, 8, 12 недель или в течение по меньшей мере 2, 4, 8, 12 недель. В предпочтительных вариантах осуществления ее дают (или предписывают давать, или назначают) в течение первых 4, 8 или 12 недель жизни младенца. Считается, что раннее начало (при рождении или вскоре после рождения) является предпочтительным для обеспечения предполагаемого воздействия.
Ожидается, что здоровье будет более крепким или сформируется быстрее при использовании композиции изобретения в качестве исключительного источника питания. В одном варианте осуществления эффект для здоровья наблюдается, если композиция изобретения покрывает 50% или более или 75% или более потребности в питании (например, потребности в энергии) целевой группы младенцев или детей младшего возраста.
Пример 1
В таблице 1 представлены примеры композиции изобретения.
Таблица 1
Вышеуказанные композиции из таблицы 1 дополнительно содержат соответственно пробиотик Bifidobacterium animalis вида lactis (BB12 или альтернативно CNCM I-3446) в количестве 106(контрольная смесь), 108(смесь sn2), 109 (смесь sn2 + 3 г ОФ), 1010 (смесь Sn2 + 5 г ОФ) КОЕ/г композиции.
Ниже в таблице 2 приведены дополнительные примеры питательной композиции для применения в соответствии с настоящим изобретением. Эти композиции приводятся исключительно в качестве иллюстрации. Источник белка представляет собой смесь 60% MSWP28 и 40% казеина.
Таблица 2
Пример 2. Клиническое исследование
Структура исследования
В Индии проводили многоцентровое проспективное рандомизированное контролируемое двойное слепое клиническое исследование параллельно для двух групп. В качестве референтной группы была включена нерандомизированная группа с исключительно грудным вскармливанием. Главными критериями включения в исследовании для всех младенцев были здоровье, рождение в срок, возраст менее 3 месяцев при привлечении к исследованию и необходимость во вскармливании смесью из-за невозможности грудного вскармливания (рандомизированные группы) или исключительно грудное вскармливание (референтная группа). Рандомизирование младенцев происходило в одну из 2 экспериментальных групп.
1. Субъекты, получающие начальную смесь, содержащую Bifidobacterium animalis вида lactis NCC 2818 (= B. lactis CNCM I-3446) в возрасте от 14 дней до 3 месяцев и до 6 месяцев (группа O). Детская смесь для группы O представляет собой питательную композицию изобретения.
2. Субъекты, получающие начальную смесь той же композиции, но без B. lactis в возрасте от 14 дней до 3 месяцев и до 6 месяцев (группа V) (не композиция изобретения, а традиционная детская смесь).
Референтная группа получала исключительно грудное вскармливание от рождения до возраста 6 месяцев (группа BF)
Использованная «начальная смесь» представляла собой традиционную начальную смесь (детскую смесь, предназначенную для младенцев 0–6 месяцев), сходную с детской смесью «контроль» в примере 1, за исключением того, что она не содержала изначально пробиотика Bifidobacterium animalis вида lactis (= B. lactis).
Образцы кала собирали в 4-месячном возрасте, хранили в холодильнике при 4°C не более 10 часов после дефекации и замораживали при -80°C до проведения анализа микробиоты.
Анализ фекальной микробиоты
Исследовали композицию фекальной микробиоты у 17 (группа O), 15 (группа V) и 16 (группа BF) младенцев.
Композицию фекальной микробиоты измеряли путем пиросеквенирования вариабельных участков генов 16S РНК, присутствующих в микробной популяции. Для извлечения ДНК из образцов кала использовали Qiacube (QIAgen). Праймеры были разработаны, как предложено ранее [Hamady, M., Walker, J. J., Harris, J. K., N. et al.(2008), Error-correcting barcoded primers for pyrosequencing hundreds of samples in multiplex, Nat. Methods, 5:235–237], чтобы обеспечить амплификацию вариабельных участков с V1 по V3 гена 16S, обладающих высоким уровнем таксономической информативности. Проводили мультиплексное пиросеквенирование с использованием методик штрихкодирования. Считывания высокого качества выявляли и анализировали с помощью аналитического пакета QIIME [Caporaso, J.G., Kuczynski, J., Stombaugh, J. et al. (2010), QIIME allows analysis of high-throughput community sequencing data, Nat Methods, 7(5):335–6]. Результаты считывания объединяли в операционные таксономические группы (OTU) с идентичностью 97% и дополнительно классифицировали с использованием RDP-классификатора [Wang, Q., Garrity, G. M., Tiedje, J. M. and Cole, J. R. (2007), Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy, Appl. Environ. Microbiol., 73:5261–5267]. Взвешенную дистанцию по Unifrac (которая учитывает филогенетическое расстояние между OTU) вычисляли для разных образцов, используя пакет QIIME. Далее в пределах каждой группы анализировали распределение дистанций для каждого образца в сравнении с образцами группы грудного вскармливания. Статистическую значимость определяли по U-критерию Манна-Уитни.
В альтернативном варианте осуществления сходство могли оценивать многопараметрическим упорядочением с проверкой гипотезы на основе процедур рандомизации (например, канонический корреспондентный анализ (CCA), анализ избыточности (RDA)) или многовариантного параметрического или непараметрического теста (например, Adonis, ANOSIM, многопараметрический дисперсионный анализ). Прогнозируются сходные результаты.
Результаты
Глобальная композиция микробиоты младенцев, получавших смесь с B. lactis (группа O), отличалась от группы, получавшей контрольную смесь, и филогенетически была более близкой к группе, получавшей грудное вскармливание (фиг. 1). В частности, группа, получавшая смесь с B. lactis (группа O), имела повышенное содержание B. animalis и сниженное содержание Coprobacillus и Streptococcus по сравнению с группой, получавшей контрольную смесь.
Пример 3. Клиническое исследование
Исследование с вмешательством во вскармливание. К участию в исследовании с вмешательством во вскармливание привлекали 115 здоровых младенцев, рожденных в срок, со средним возрастом 5 дней. Младенцы от матерей, которые решили не кормить ребенка грудью, были рандомизированы либо в группу начальной детской смеси (контрольная смесь C, n = 37, 1,8 г белка/100 ккал; соотношение сыворотки/казеина 70 : 30), либо в группу той же смеси, но с добавлением пребиотика (BMOS) с общей концентрацией олигосахарида 5,7 ± 1,0 г/100 г порошковой смеси (8 г/л растворенной смеси) и пробиотика (B. lactis штамм CNCM-I-3446 с 1 x 107 КОЕ/г порошковой смеси; 1,4 x 107 КОЕ/л растворенной смеси) (исследуемая смесь T, n = 39) в течение 12-недельного периода вскармливания. Младенцев от матерей, которые решили кормить ребенка исключительно грудью, включили в группу грудного вскармливания (группа B, n = 39), которая служила физиологической референтной группой. Термин BMOS, использованный в данном исследовании, соответствует определению в настоящем изобретении.
Характеристики кала. В проведенном согласно протоколу анализе за время наблюдения количество дефекаций уменьшилось с 4,9 до 2,4 дефекаций в день, без различий между группами (p > 0,4). В ходе исследования вскармливания младенцы из группы T, но не из группы C продемонстрировали долю желтоватых, а не зеленоватых фекалий, эквивалентную таковой в группе B (фиг. 5). Цветовое сходство является индикатором сходной/близкой микробиоты.
Микробиологический анализ кала: количественная ПЦР в реальном времени. Образцы кала были собраны у младенцев до первого применения продукта, а также в возрасте 6 и 12 недель, когда они находились на установленном режиме вскармливания. В проведенном согласно протоколу анализе на каждую группу и временную точку были доступны образцы кала от 18–23 младенцев. Образцы кала собирали для каждой временной точки, хранили в холодильнике при 4°C не более 10 часов после дефекации и замораживали при -80°C до проведения анализа микробиоты. Общую ДНК выделяли, используя набор QIAamp DNA Stool Mini Kit (QIAGEN), в соответствии с инструкциями производителя, за исключением того, что была добавлена серия стадий механического разрушения (11 × 45 с) с помощью аппарата FastPrep и пробирок Lysing Matrix B (MP Biochemicals). Для таксономической дифференциации использовали генные праймеры 16S рРНК. Общее количество бифидобактерий от момента привлечения к исследованию и до 6-недельного возраста увеличивалось во всех трех группах, после чего оставалось неизменным до 12-недельного возраста (фиг. 4A). По сравнению с младенцами группы C младенцы группы T демонстрировали более выраженное увеличение титра Bifidobacterium на 0,8 log. В группе T итоговый титр бифидобактерий в фекалиях составил 0,8 x 1010 бактерий/г кала, что достоверно выше, чем в группе C и в группе B. Количество Bacteroides и lactobacilli в кале оказалось в 10 раз выше и в 10 раз ниже соответственно у младенцев группы C по сравнению с младенцами группы T (данные не показаны и фиг. 4B).
Чтобы обеспечить дополнительную детализацию по роду Bifidobacterium, использовали набор праймеров для количественной ПЦР, основанный на гене groEL, позволяющий обнаружить 12 видов Bifidobacterium B. bifidum и B. longum (фиг. 4C и 4D).
Композиция микробиоты: индекс разнообразия. Анализ микробиоты дополнили пиросеквенированием генов 16S рРНК. Вариабельный участок 16S с V1 по V3 подвергали ПЦР-амплификации и секвенировали на приборе Roche 454 GS-FLX-Titanium Sequencer. Необработанные данные секвенирования анализировали, используя программные пакеты Mothur v.1.33.0 (Schloss, P. D., S. L. Westcott, T. Ryabin, J. R. Hall, M. Hartmann, E. B. Hollister, R. A. Lesniewski, B. B. Oakley, D. H. Parks, C. J. Robinson, J. W. Sahl, B. Stres, G. G. Thallinger, D. J. Van Horn and C. F. Weber (2009). “Introducing mothur: Open-source, platform-independent, community-supported software for describing and comparing microbial communities”. Applied and Environmental Microbiology 75(23): 7537–7541.) и QIIME v.1.8 (Caporaso,J.G., Kuczynski,J., Stombaugh,J., Bittinger,K., Bushman,F.D., Costello,E.K. et al. (2010b) QIIME allows analysis of high-throughput community sequencing data. Nat Methods 7: 335–336). Выполняли выделение OTU de novo с идентичностью 97%, и таксономическое распределение репрезентативных последовательностей OTU осуществляли с использованием RDP Classifier по референтной базе данных Greengenes v.13.8. Те же последовательности подвергали выравниванию с использованием PyNast по эталонам из ядра базы Greengenes. Полученные множественные выравнивания затем фильтровали с построением филогенетического дерева с помощью FastTree. После фильтрации по качеству вычисляли филогенетические расстояния между всеми образцами на основе дистанций UniFrac. После анализа и исключения субъектов с неполными наборами данных получали композиции фекальной микробиоты для всех трех временных точек по меньшей мере для 13 младенцев в группе. На фиг. 3 сравнивается α-разнообразие для всех трех групп в исходном состоянии и через 6 и 12 недель вскармливания (вычисление с помощью пакета Calypso, http://bioinfo.qimr.edu.au/calypso). В исходном состоянии три группы вскармливания достоверно не различались по разнообразию микроорганизмов (по индексу Шеннона). В возрасте 6 недель младенцы группы C демонстрировали более высокий индекс разнообразия из-за увеличения как богатства, так и однородности по сравнению с младенцами группы T и группы B. В возрасте 12 недель группа C, но не группа T отличалась от группы B по разнообразию и богатству. Взвешенную дистанцию по Unifrac (которая учитывает филогенетическое расстояние между OTU) вычисляли для разных образцов, используя пакет QIIME. Далее в пределах каждой группы анализировали распределение дистанций для каждого образца в сравнении с образцами группы грудного вскармливания. Статистическую значимость определяли по U-критерию Манна-Уитни (фиг. 2). Глобальная композиция микробиоты младенцев, получавших смесь с B. lactis и BMOS (группа T), отличалась от группы, получавшей контрольную смесь (C), и филогенетически была более близкой к группе, получавшей грудное вскармливание (B).
Пример 4. Дальнейшее клиническое исследование
Вмешательство во вскармливание; рандомизированное двойное слепое контролируемое исследование
В многоцентровом рандомизированном контролируемом двойном слепом исследовании, проведенном в Южной Африке, проверяли влияние детской смеси, обогащенной пребиотиком, т.е. смесью олигосахаридов из коровьего молока (BMOS), полученной из фильтрата молочной сыворотки (содержащей галактоолигосахариды и молочные олигосахариды, такие как 3’- и 6’-сиалиллактоза), и пробиотиком Bifidobacterium animalis подвида lactis (B. lactis), штамм CNCM I-3446, на концентрацию Bifidobacteria в кишечнике младенцев, родившихся как посредством вагинальных родов, так и посредством кесарева сечения, на ранних сроках жизни. Дополнительно оценивали безопасность новой рецептуры. Термин BMOS, использованный в данном исследовании, соответствует определению в настоящем изобретении.
В данном многоцентровом исследовании всего 430 здоровых младенцев, родившихся в срок у ВИЧ-положительных матерей, которые решили кормить своего ребенка исключительно смесью с рождения (≤3-дневного возраста), были рандомизированы по 4 параллельным группам. В популяцию полного анализа (FAS) вошел всего 421 младенец, получавший любую исследуемую смесь.
Первые две группы состояли из младенцев, родившихся посредством кесарева сечения, назначенных в группу исследуемой детской смеси (n = 92) (начальная смесь с BMOS при общем содержании олигосахаридов 5,8 ± 1,0 г/100 г порошковой смеси (8 г/л растворенной смеси) + B. lactis (1 × 107 КОЕ/г)) или контрольной детской смеси (n = 101), а вторые две группы состояли из младенцев, родившихся вагинальным способом, рандомизированных по таким же группам исследуемой смеси (n = 115) или контрольной смеси (n = 113), от привлечения к исследованию и до возраста 6 месяцев.
Первичным результатом по эффективности было количество бифидобактерий в кале в возрасте 10 дней, а первичным результатом по безопасности был ежедневный набор веса (г/день) в возрастной период от 10 дней до 4 месяцев.
В возрасте 10 дней количество бифидобактерий в кале в группе исследуемой смеси было достоверно выше, чем в группе контрольной смеси среди младенцев, родившихся посредством кесарева сечения (медиана [диапазон] log: 9,41 [6,30–10,94] КОЕ/г по сравнению с 6,30 [6,30–10,51] КОЕ/г, критерий Вилкоксона, p = 0,002), но не среди младенцев, родившихся вагинальным способом (медиана [диапазон] log: 10,06 [5,93–10,77] КОЕ/г по сравнению с 9,85 [6,15–10,79] КОЕ/г, p = 0,126). Нижняя граница 2-стороннего 95% доверительного интервала различий в среднем ежедневном наборе веса между группами исследуемой смеси и контрольной смеси составила более -3 г/день как среди младенцев, родившихся посредством кесарева сечения, так и родившихся вагинальным способом, и это указывает, что рост младенцев, получавших исследуемую смесь, был не хуже, чем у младенцев, получавших контрольную смесь.
В возрасте 10 дней и 4 недель pH кала младенцев, вскармливаемых исследуемой смесью, был существенно ниже, чем у получавших контрольную смесь, независимо от типа родов: для вагинальных родов: 4,93 по сравнению с 5,59 p < 0,001 (10 дней) и 5,01 по сравнению с 5,71 p < 0,001 (4 недели), для кесарева сечения: 5,14 по сравнению с 5,65 p = 0,009 (10 дней), 5,06 по сравнению с 5,75 p < 0,001 (4 недели). В возрасте 3 месяцев этот эффект закисления сохранялся только у младенцев, родившихся посредством кесарева сечения. Детская смесь, обогащенная пребиотиком BMOS и пробиотиком B. lactis, индуцировала сильный бифидогенный эффект для обоих типов родов, но наиболее сильная коррекция от наблюдаемого при рождении низкого уровня Bifidobacterium наблюдалась у младенцев, родившихся посредством кесарева сечения. Обогащенная детская смесь снижала pH кала и улучшала фекальную микробиоту как у младенцев, родившихся естественным путем, так и у родившихся посредством кесарева сечения.
Подробные результаты (см. также фиг. 6)
В популяции FAS количество Bifidobacterium в возрасте 28 дней и 3 месяцев (84 дня) также было существенно более высоким в группе исследуемой смеси, чем в группе контрольной смеси, среди младенцев, родившихся посредством кесарева сечения (квадраты на фиг. 6). В возрасте 28 дней медианы [диапазон] логарифма количества бифидобактерий составляли 10,15 [6,30–10,96] КОЕ/г и 9,00 [6,30–10,77] КОЕ/г в группах исследуемой смеси и контрольной смеси соответственно (непараметрический критерий Вилкоксона, p = 0,001). В возрасте 84 дней медианы [диапазон] логарифма количества бифидобактерий составляли 10,40 [6,50–10,79] КОЕ/г и 9,67 [6,30–10,50] КОЕ/г в группах исследуемой смеси и контрольной смеси соответственно (непараметрический критерий Вилкоксона, p < 0,001).
Среди родившихся вагинальным способом младенцев (треугольники на фиг. 6) в группе исследуемой смеси также наблюдалось достоверное увеличение количества Bifidobacterium в возрасте 28 дней и 84 дней по сравнению с группой контрольной смеси. В возрасте 28 дней медианы [диапазон] логарифма количества бифидобактерий составляли 10,25 [6,75–10,98] КОЕ/г и 9,66 [6,30–10,31] КОЕ/г в группах исследуемой смеси и контрольной смеси соответственно (непараметрический критерий Вилкоксона, p < 0,001). В возрасте 84 дней медианы [диапазон] логарифма количества бифидобактерий составляли 10,45 [8,22–10,96] КОЕ/г и 9,95 [6,30–10,17] КОЕ/г в группах исследуемой смеси и контрольной смеси соответственно (непараметрический критерий Вилкоксона, p < 0,001).
Общее количество бактерий в возрасте 3 и 10 дней в группах исследуемой смеси и контрольной смеси достоверно не отличались, независимо от типа родов (данные не показаны). Однако в возрасте 4 недель общее количество бактерий было более высоким в группах исследуемой смеси при обоих типах родов, а в возрасте 3 месяцев оно было выше в группе исследуемой смеси только среди младенцев, родившихся вагинальным способом (данные не показаны).
В группах исследуемой смеси обнаруживаемые виды бифидобактерий имелись у более высокой доли младенцев, чем в группах контрольной смеси, вплоть до 4 недель (данные не показаны). Виды lactobacillus обнаруживались у более высокой доли младенцев возрастом 4 недель и 3 месяцев, у соответственных групп младенцев, родившихся посредством кесарева сечения и вагинальным способом, в группах исследуемой смеси по сравнению с группой контрольной смеси. В возрасте 10 дней, 4 недель и 3 месяцев B. lactis обнаруживались у достоверно более высокой доли младенцев в группах исследуемой смеси по сравнению с группами контрольной смеси (данные не показаны). Виды E. coli и Staphylococcus, Enterobacteria и Klebsiella обнаруживались у достоверно более высокой доли младенцев в группе контрольной смеси, чем в группе исследуемой смеси (данные не показаны).
Реферат
Изобретение относится к питательной композиции для младенцев или детей младшего возраста. Предложено применение питательной композиции для младенцев или детей младшего возраста, включающей пробиотик Bifidobacterium animalis вида lactis, для стимуляции или индукции кишечной микробиоты, которая похожа на микробиоту младенцев, вскармливаемых исключительно человеческим грудным молоком, по сравнению с микробиотой младенцев, вскармливаемых преимущественно традиционной питательной композицией, не включающей указанного пробиотика, у младенцев или детей младшего возраста от 0 до 36 месяцев, необязательно от 0 до 12 месяцев. Причем указанная стимуляция или индукция кишечной микробиоты, которая похожа на микробиоту младенцев, вскармливаемых исключительно человеческим грудным молоком, дополнительно характеризуется стимуляцией или индукцией кишечной микробиоты, имеющей филогенетическую дистанцию до микробиоты младенцев на грудном вскармливании менее 0,3 единицы (измеренной методом Unifrac), предпочтительно менее 0,25 единицы. При этом указанный пробиотик Bifidobacterium animalis вида lactis представляет собой CNCM I-3446. Применение питательной композиции по вышеуказанному назначению обеспечивает здоровую кишечную флору у младенцев или детей младшего возраста. 13 з.п. ф-лы, 6 ил., 2 табл., 4 пр.

Комментарии