Новые молочнокислые бактерии и содержащие их составы - RU2683225C2
Код документа: RU2683225C2
Чертежи




Описание
Настоящее изобретение относится к новым молочнокислым бактериям, их аналогам или фрагментам, а также к содержащим их составам, в частности для использования в качестве пробиотиков и/или для гигиены тела и лечения. Более конкретно, настоящее изобретение относится к использованию новых молочнокислых бактерий и/или содержащих их составов для лечения и/или профилактики всех заболеваний, которые могут быть вызваны Staphylococcus aureus или Pseudomonas aeruginosa.
Кроме того, в настоящем изобретении представлен инновационный биологический продукт в виде признанных в целом безопасными (GRAS) микроорганизмов, молочнокислых бактерий, которые могут использоваться как антибактериальные добавки, обладающие специфическим действием, для профилактики и местного лечения кожных инфекционных заболеваний и для ускорения лечения хронических ран.
Кроме того, настоящее изобретение относится к использованию микроорганизма по настоящему изобретению или его аналога или фрагмента в составах, фармацевтических косметических или медицинских продуктах, а также в средствах для дезинфекции кожи или поверхности.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Основной функцией кожи является защита подлежащих тканей от внешней среды. Таким образом кожа препятствует, среди прочего, проникновению патогенных микроорганизмов внутрь тела. Кожа и слизистые оболочки как правило заселены разнообразными микроорганизмами, которые часто живут как комменсалы в относительно стабильном составе на поверхности кожи и поддерживают ее защитную функцию. В идеальном случае бактерии, положительно влияющие на здоровье, будут преобладать над одновременно присутствующими вредными микроорганизмами. Если баланс системы нарушается, негативное воздействие на здоровье и самочувствие человека практически неизбежно.
Посредством связывающих белков патогенные микроорганизмы способны специфически прилипать к структурами эпидермиса. Например, известно, что у патогенного штамма Staphylococcus aureus имеется адгезин, с помощью которого микроорганизм может прилипать к фибронектиновым структурам (Bingham, R.J. et al., 2008, O’Neill, E. et al., 2008).
Как правило, патогенные микроорганизмы обладают высокой способностью прилипать к хозяину, что таким образом объясняет повышенную вирулентность. Наличие микроскопических ран или других повреждений верхнего слоя кожи повышает риск инвазии патогенных микроорганизмов.
Кроме того, бактериальные инфекции раневых поверхностей, особенно при заживлении ран, могут приводить к осложнениям. Прежде всего имеется риск того, что острая рана не заживет и станет хронической. Микрофлора таких хронических ран очень сложная, и известно, что множество микроорганизмов могут оказывать вредное влияние на процесс заживления ран (Davies et al., 2004, Kirketerp-Moller et al., 2008).
Было установлено, что основными патогенами, присутствующими в ранах, являются аэробные бактерии, например Pseudomonas aeruginosa и Staphylococcus aureus. Воспалительная фаза заживления раны обычно служит для борьбы с потенциально патогенными микроорганизмами и для регенерации клеток. Однако у пациентов с подавленным иммунитетом и сниженной воспалительной реакцией раны часто заживают плохо или не поддаются лечению. Такая ослабленная иммунная реакция больше не может обеспечить эффективную защиту против основных присутствующих в ранах бактерий, поэтому бактерии проникают внутрь раны и образуют колонии в виде биопленки (James et al., 2008).
К защитной системе хозяина устойчивы не только биопленки, но также и планктонные клетки и микроколонии (Fux et al., 2005, Sheldon, 2005). Из-за ослабленной иммунной системы биопленка задерживает процесс заживления раны в фазе воспаления, что приводит к повышению концентрации матриксных металлопротеинов, таких как например эластаза, плазмин и тромбин, которые в свою очередь разрушают факторы роста и их рецепторы, которые необходимы для заживления (Mast и Schultz, 1996).
Кроме того, повышенные концентрации свободных радикалов кислорода и воспалительных цитокинов приводят к серьезному повреждению клеток хозяина (James et al., 2003, Moseley et al., 2004).
В технике описаны терапевтические средства, способные уничтожать биопленку и таким образом бороться с причинами хронических и незаживающих ран.
УРОВЕНЬ ТЕХНИКИ
Согласно существующему уровню техники, раневые инфекции также лечат посредством комплексной терапии антибиотиками, которая не всегда приводит к излечению, поскольку вышеуказанные организмы, присутствующие в ранах, не восприимчивы к такому лечению благодаря их механизмам адаптации и приобретения устойчивости, в том числе их способности образовывать биопленку. Существуют средства для ухода за кожей, такие как рН-оптимизированные гели для душа, очищающие лосьоны, масла для душа и лосьоны для тела, служащие для профилактического предотвращения повреждения кожи, особенно у пациентов с подавленным иммунитетом, например пациентов с атопическими дерматитами, экземой, себорейными дерматитами.
Основной патоген S. aureus является вызывающим болезнь патогеном, который до 7 месяцев может выживать без питательных веществ. Он выживает на ручках корзин для белья и дверных ручках, выключателях света, покрытиях пола и стенках кровати (Julia Bidder, 2010). Он не вызывает симптомов у здоровых людей, но если иммунная система ослаблена, как в случае раневых инфекций, микроорганизм будет пролиферировать и вызывать плохо излечиваемые воспаления, кожные язвы, фурункулы, легочные инфекции, инфекции мочевых путей и опасную для жизни токсичность крови, глазные инфекций, инфекции среднего уха. Инфекции могут мигрировать практически в любой орган. Некоторые факторы могут способствовать инфицированию бактериями Staphylococcus aureus, например ослабленная иммунная система, сахарный диабет, существующие поражения кожи (десквамация или нейродермит), травмы кожи (например вследствие несчастных случаев, хирургического вмешательства, катетеризации), пролежни у пожилых людей и прикованных к постели пациентов, тучность пациентов, чья кожа является влажным резервуаром для развития бактериальных инфекций.
Антибиотик метициллин больше не эффективен против метициллин-устойчивых штаммов S. aureus (MRSA). На практике это означает, что эти штаммы являются полирезистентными, устойчивыми к трем или более антибиотикам. Только так называемые резервные антибиотики помогают в настоящее время против этих штаммов. Немецкие клиники оценивают повышение стоимости лечения MRSA-пациентов от 1600 до 4300 евро в день (Julia Bidder, 2010).
Pseudomonas aeruginosa является другим основным патогеном, который также часто встречается при нозокомиальных инфекциях и обладает устойчивостью ко многим антибиотикам благодаря своему метаболизму и структуре клеточной мембраны. Р. aeruginosa вызывает почти 10% всех внутрибольничных инфекций и является одним из самых распространенных нозокомиальных микроорганизмов в Германии. Спектр заболеваний, вызываемых этими бактериями, является обширным. Одним из главных провоцирующих факторов является гемолитическая способность, а также патогенные факторы, такие как экзотоксин А (АДФ-рибозилтрансфераза) и цитотоксины - экзобелок S и экзобелок U, продуцирующие бактерии. Наиболее распространенным проявлением является пневмония и фиброзно-кистозная дегенерация, которые могут быть особенно опасны для пациентов с подавленным иммунитетом и больных СПИДом. Также могут вызываться инфекции мочевых путей, энтероколит, менингит, наружный отит ("ухо пловца"), ожоговые инфекции и кератит у пользующихся контактными линзами.
Молочнокислые бактерии в основном используются как пробиотические бактерии для защиты от желудочно-кишечных заболеваний, вызываемых патогенами, поскольку кроме молочной кислоты они часто продуцируют антибактериальные вещества. Эти молочнокислые бактерии (Lactobacillales, лактобактерии или молочнокислые бактерии) образуют группу грамположительных бактерий, которые всегда являются анаэробными или чаще всего аэротолерантными и характеризуются тем, что они расщепляют сахар до молочной кислоты (молочнокислое брожение). Группа Lactobacillales включает семейства Lactobacillaceae, Aerococcaceae, Carnobacteriaceae, Enterococcaceae, Leuconostocaceae и Streptococcaceae. Виды Bifidobacterium bifidum ранее относили к лактобактериям (Lactobacillus bifidum), но согласно и меющейся в настоящее время информации они филогенетически не являются близкородственными. Однако, с точки зрения метаболизма они все еще относятся к молочнокислым бактериям. Молочнокислые бактерии также имеют большое значение в пищевой промышленности, где они используются для получения молочных продуктов, но также могут быть вредными (например на пивоваренных заводах). Молочнокислые бактерии относятся к непатогенным бактериям.
В технике также известно применение пробиотических бактерий в средствах для мытья посуды (например WO 2010/130563), благодаря чему можно уменьшить вредное воздействие моющего средства на кожу. Это также оказывает благоприятное воздействие на кожу.
Уже известно использование микроорганизмов в косметических средствах для ухода за кожей. Так, например, в US 6,790,434 описано использование таких микроорганизмов в косметических средствах для ухода за кожей в сочетании с растительными экстрактами из внеклеточного матрикса, чтобы препятствовать повреждению кожи под действием УФ-излучения. Однако, в этом источнике не раскрыто использование данных микроорганизмов в моющих и чистящих средствах.
Кроме того, известно использование некоторых видов Bacillus в санитарных чистящих средствах. Так, в WO 97/25865 описано использование видов Bacillus в санитарных чистящих средствах, поскольку они предотвращают репродуцирование патогенов и способны расщеплять органические загрязнения. Однако, там не описывается использование микроорганизмов, имеющих благоприятное воздействие на кожу.
В то же время, в WO 2005/117921 раскрыта лекарственная форма для перорального применения пробиотических бактерий, которая содержит по меньшей мере один род пробиотических микроорганизмов, при этом лекарственная форма и/или бактерии имеет/имеют покрытие, которое содержит эфир целлюлозы.
Целью настоящего изобретения является создание средства или состава для экстренного или профилактического лечения раневых инфекций, кожных заболеваний и/или раздражения кожи, не имеющего недостатков или изъянов известного уровня техники.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Указанная цель достигается независимьми пунктами формулы изобретения. Предпочтительные варианты следуют из зависимых пунктов формулы изобретения.
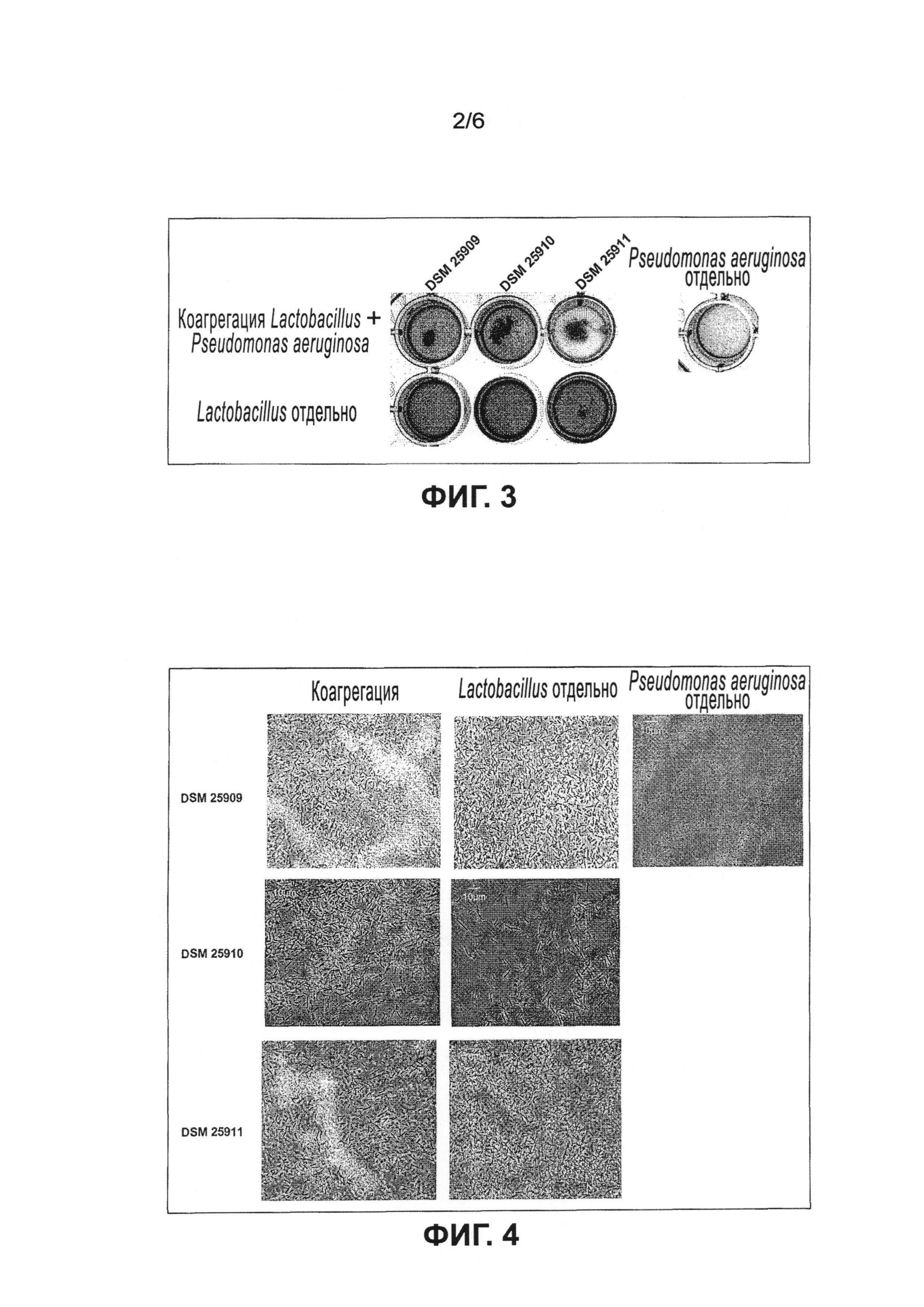
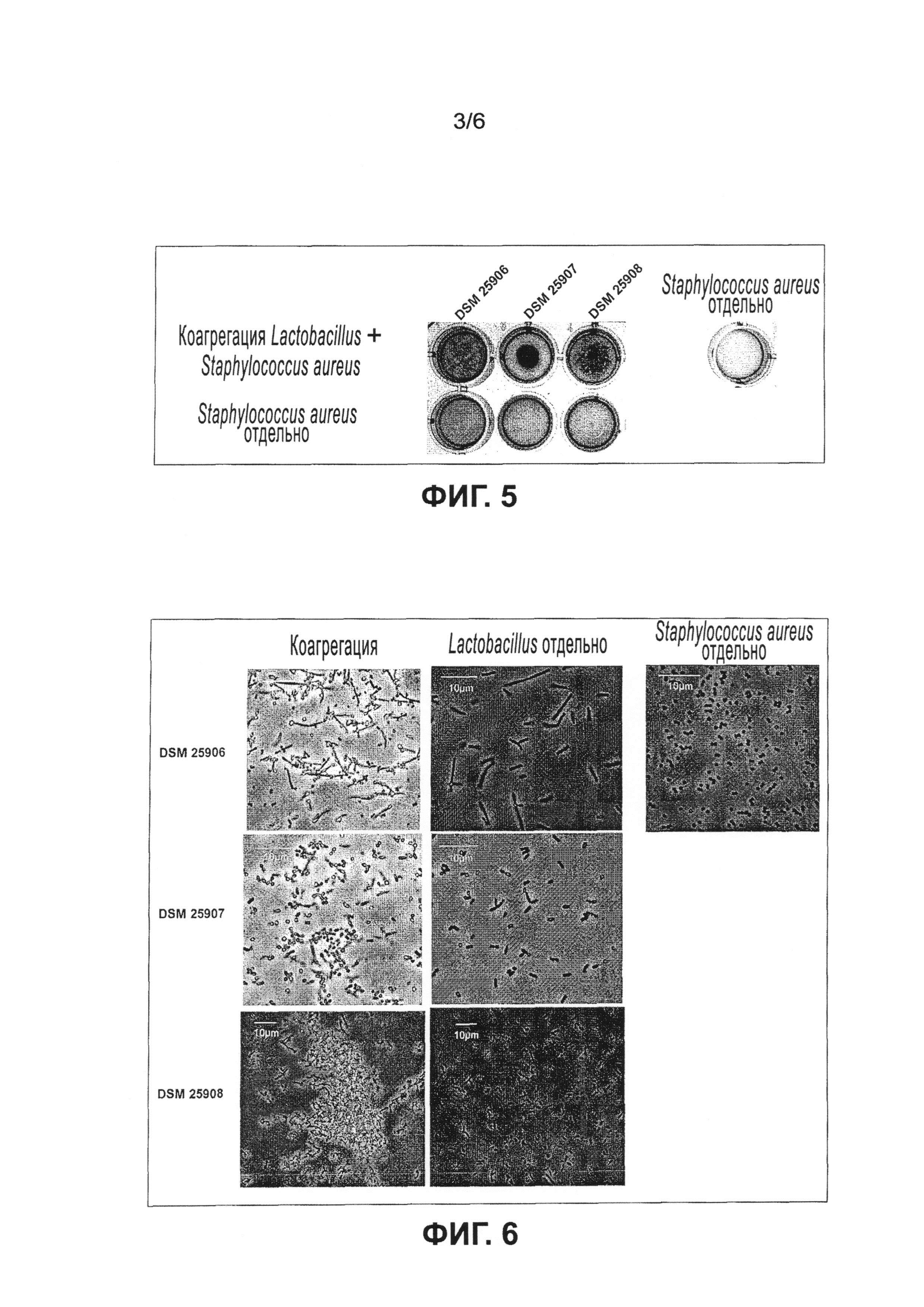
Настоящее изобретение относится к микроорганизму, принадлежащему группе молочнокислых бактерий, его аналогу, фрагменту, производному, мутанту или их сочетанию, причем микроорганизм, его аналог, фрагмент, производное, мутант или их сочетание может коагрегировать по меньшей мере с одним патогенным микроорганизмом, который выбран из группы, содержащей Staphylococcus aureus и Pseudomonas aeruginosa. Полной неожиданностью было то, что могут быть получены молочнокислые бактерии, которые агрегируют с инфекционными бактериальными штаммами, в частности посредством коагрегации с ними, и таким образом уменьшают локальную концентрацию микроорганизмов, угнетают их рост или даже убивают или предотвращают образование биопленки. Это является новшеством по отношению к известному уровню техники и имеет важные преимущества по сравнению с известными в технике традиционными методами лечения, поскольку. отсутствует необходимость лечения антибиотиками, вместо этого могут использоваться молочнокислые бактерии. Кроме того, получение специфических молочнокислых бактерий является недорогой альтернативой производству антибиотиков и последующей стоимости лечения ими. Лечение молочнокислыми бактериями, которые специально получены против этих микроорганизмов и не вызывают последующей устойчивости микроорганизмов, представляет собой уникальный подход к борьбе против патогенных микроорганизмов.
В настоящем изобретении коагрегация означает специфическую адгезию или связывание друг с другом генетически различных бактериальных штаммов, тогда как коадгезия относится в частности к адгезии или связыванию генетически идентичных бактериальных штаммов. В связи с этим, еще большей неожиданностью было то, что молочнокислые бактерии могут связываться с патогенными бактериями, благодаря чему, в частности путем специфического связывания, происходит их коагрегация.
Изобретение относится в частности к микроорганизму или его аналогу, фрагменту, производному, мутанту или их сочетанию, способность которых коагрегировать по меньшей мере с одним патогенным микроорганизмом сохраняется даже после биологической, химической или физической обработки. Способность предпочтительного микроорганизма, его аналога, фрагмента, производного, мутанта или их сочетания коагрегировать по меньшей мере с одним патогенным микроорганизмом предпочтительно сохраняется даже при значениях рН приблизительно между 3 и 8. В предпочтительном варианте микроорганизм, его аналог, фрагмент, производное, мутант или их сочетание в частности способны ингибировать образование биопленки по меньшей мере одного патогенного микроорганизма.
В частности предпочтительно, чтобы микроорганизм или его аналог, фрагмент, производное, мутант или их сочетание был выбран из группы, содержащей Lactobacillus lactis, Lactobacillus helveticus, Lactobacillus jensenii, Lactobacillus acidophilus, Lactobacillus bulgaricus, Lactobacillus amylovorus, Lactobacillus delbrueckii, Lactobacillus casei, Lactobacillus crispatus, Lactobacillus gasseri, Lactobacillus johnsonii, Lactobacillus paracasei, Lactobacillus pentosus, Lactobacillus rhamnosus, Lactobacillus curvatus, Lactobacillus plantarum, Lactobacillus brevis, Lactobacillus buchneri, Lactobacillus fructivorans, Lactobacillus hilgardii, Lactobacillus fermentum, Lactobacillus reuteri, Lactobacillus viridescens, Bifidobacterium bifidum или их аналоги, производные, фрагменты иди мутанты.
Могут использоваться вышеописанные микроорганизмы или их аналоги, фрагменты, производные, мутанты или их сочетания, которые выбраны из группы, содержащей следующие микроорганизмы, депонированные в Немецкой коллекции микроорганизмов и клеточных культур под следующими номерами: DSM 25906, DSM 25907, DSM 25908, DSMZ 25909, DSM 25910, DSM 25911, DSM 25912, DSM 25913, DSM 25914 и DSMZ 25915.
В другом аспекте изобретение относится к составу, содержащему по меньшей мере один микроорганизм или его аналог, фрагмент, производное, мутант или их сочетание. В настоящем изобретении термин "состав может" использоваться как синоним термина "рецептура". Предпочтительный состав может также содержать основу или наполнитель, выбранные из группы, содержащей косметически, фармацевтически и дерматологически приемлемые основы и наполнители.
Состав предпочтительно может быть в форме порошка, карандаша, аэрозольного спрея, помпового спрея, крема, дисперсии, эмульсии, пены, мази, спрея, аэрозоля, салфеток, лосьона, суспензии, раствора, геля или может быть нанесен на подложку. Наиболее предпочтительны в частности составы в форме крема для кожи, лосьона для очистки кожи или кожной мази.
В предпочтительном варианте состав может быть твердым, жидким, вязким или в виде аэрозоля. Кроме того, предпочтительные крем для кожи, лосьон для очистки кожи или кожная мазь могут быть твердьми, жидкими, вязкими или в виде аэрозоля.
Предпочтительный состав может также содержать пробиотики, антисептики или другие антибактериальные активные вещества, благодаря чему предпочтительный состав может быть фармацевтическим, ветеринарным, косметическим или пищевым составом.
В другом предпочтительном варианте состав также содержит наполнитель, поверхностно-активные вещества, ферменты, органические и/или неорганические пероксисоединения, пероксидные активаторы, водорастворимые органические растворители, комплексообразующие соединения, электролиты, регуляторы рН, загустители, грязеотталкивающие активные ингредиенты, оптические отбеливатели, ингибиторы поседения, ингибиторы переноса красителя, регуляторы пены и/или другие красящие вещества.
Кроме того, предпочтительный состав может содержать по меньшей мере одно вещество, выбранное из групп:
а. активные ингредиенты, оказывающие положительное влияние на состояние кожи, в частности активные ингредиенты, положительно влияющие на старческую кожу, в частности в сочетании с биохинонами, в частности с убихинонами Q10, креатином, креатинином, карнитином, биотином, изофлавоном, кардиолипином, липоевой кислотой, антифризными белками, арктиином, хмелем и хмель-солодовыми экстрактами;
b. промоторы восстановления структуры соединительной ткани, в частности изофлавоноиды;
с. активные ингредиенты для поддержания функций кожи при сухой коже, в частности витамин С, биотин, карнитин, креатин, пропионовая кислота, экстракт зеленого чая, эвкалиптовое масло, мочевина и минеральные соли, в частности NaCl, морские минеральные вещества и осмолиты;
d. активные ингредиенты, оказывающие успокаивающее и/или положительное воздействие на раздраженную кожу, в частности серикозиды, различные экстракты солодки, ликохалконы, в частности ликохалкон А, силимарин, силифос и/или декспантенол.
Предпочтительно микроорганизм находится в составе в инактивированной, жизнеспособной или нежизнеспособной форме. Кроме того, микроорганизм может находиться в составе предпочтительно в инкапсулированной, высушенной распылением и/или лиофилизированной форме. Также предпочтительно микроорганизм может находиться в составе в частности в виде клеточного лизата. В предпочтительном варианте содержание микроорганизма в составе составляет от 0,001 до 10 вес.%, предпочтительно от 0,005 до 5 вес.%, наиболее предпочтительно от 0,01 до 3 вес.%.
Изобретение относится также к способу идентификации и/или отбора молочнокислой бактерии, способной коагрегировать с патогенным микроорганизмом, выбранным из группы, содержащей Staphylococcus aureus и Pseudomonas aeruginosa, при этом способ содержит по меньшей мере следующие стадии:
а. инкубацию патогенного микроорганизма для получения биопленки;
b. добавление исследуемой молочнокислой бактерии и инкубацию полученной смеси для стимулирования коагрегации патогенного микроорганизма и исследуемой молочнокислой бактерии;
с. отделение несвязанных молочнокислых бактерий посредством удаления супернатанта и
d. Исследование биопленки на наличие коагрегированных молочнокислых бактерий.
Данный способ предпочтительно может также содержать дополнительную стадию изучения ингибирования биопленки, образуемой патогенными микроорганизмами, при этом исследуемые молочнокислые бактерии добавляют во время инкубации образующего пленку патогенного микроорганизма.
Кроме того, в предпочтительном варианте данный способ может также содержать дополнительную и проводимую после удаления несвязанных клеток стадию количественного анализа образования пленки с помощью измерения оптической плотности в сравнении с контрольным образцом, в который исследуемые молочнокислые бактерии не добавлялись.
Согласно другому аспекту изобретение относится к применению состава предпочтительно для получения фармацевтического препарата, медицинского продукта или косметического средства для лечения или профилактики кожных заболеваний, в частности стафилококкового ожогоподобного кожного синдрома, контагиозного импетиго, поверхностного фолликулита, импетигинизации, абсцессов кожи, фурункулов, карбункулов, абсцессов, флегмон, сухой кожи, кожного зуда, покраснения кожи, раздраженной кожи, очень жирной кожи, акне, диабетической стопы, пролежней, нейродермита, острого лимфаденита, пилонидальной кисты, дермоидной фистулы, пилонидального синуса, кокцидиозного свища, кокцидозной кисты, локальных инфекций кожи и подкожной ткани, пиодермии, гнойничкового дерматита, инфекционного дерматита, гнойного дерматита, дерматита и экземы, атопической экземы, себорейной экземы, опрелости, аллергтческого контактного дерматита, себорейного дерматита, эксфолиативного дерматита, токсического контактного дерматита, простого хронического лишая, пруриго, зуда и других форм дерматита, папулосквамозных кожных заболеваний, псориаза, парапсориаза, болезней придатков кожи, рубцовой алопеции, декальвирующего фолликулита, а также других болезней кожи и подкожной ткани, варикозных язв, травм кожи, царапин и струпьев, ран после несчастных случаев или хирургических операций.
В предпочтительном варианте состав может применяться для получения чистящего или дезинфицирующего средства для обработки поверхностей. Кроме того, состав предпочтительно может также применяться для получения продукта, который используется в области гигиены тела, медицинских препаратов и профилактики.
Состав предпочтительно применяется для получения лосьона, взбалтываемой смеси, порошка, гидрогеля, крема, препарата типа "cresa", мази, жирной мази или пасты для нанесения на поверхность кожи.
Было установлено, что состав предпочтительно может применяться для получения антибактериальной добавки, обладающей специфическим действием для местного лечения кожных инфекций и ускорения заживления хронических ран. Состав предпочтительно может применяться в целях профилактики или лечения. Кроме того, предпочтительно состав применяют местно.
Согласно другому аспекту изобретение относится к комплекту для гигиенического ухода, содержащему заявленные микроорганизмы или состав и устройства или оборудование для гигиены тела, средства для полоскания и/или пасты.
В предпочтительном варианте изобретение может использоваться как антибактериальная добавка к аэрозолю или моющему раствору для животных, в частности собак, лошадей, кошек и грызунов (кроликов, зайцев, хомяков, морских свинок), а также для коммерческих животных, таких как куры, свиньи и крупный рогатый скот, с целью значительного снижения бактериальной нагрузки на кожу, шерсть и перья.
Таким образом, настоящее изобретение также относится к микроорганизмам, в частности молочнокислым бактериям, их аналогам, мутантам, производным или фрагментам, а также к содержащим их составам, используемым в частности для лечения или профилактики болезней у младенцев, детей дошкольного возраста, детей, здоровых людей, пожилых людей, людей с подавленным иммунитетом, людей с патологическими поражениями кожи (включающими в частности эксфолиативный дерматит новорожденных, контагиозное импетиго, поверхностный фолликулит, импетигинизацию, абсцессы кожи, фурункулы (фурункулез), карбункулы (абсцессы), флегмоны, сухую кожу, кожный зуд, покраснение кожи, раздраженную кожу, очень жирную кожу, акне, диабетическую стопу, пролежни, нейродермит, острый лимфаденит, пилонидальную кисту (включая дермоидную фистулу, пилонидальный синус, копчиковую фистулу, копчиковый синус), другие локальные инфекции кожи и подкожной ткани (такие как пиодермия, гнойничковый дерматит, инфекционный дерматит, гнойный дерматит), также различные виды дерматита и экземы (такие как атопическая экзема, себорейная экзема, опрелости, аллергический контактный дерматит, себорейный дерматит, эксфолиативный дерматит, токсический контактный дерматит, простой хронический лишай, пруриго, зуд и другие формы дерматитов), они также могут использоваться для лечения папулезных кожных заболеваний (псориаза, парапсориаза), болезней придатков кожи (таких как рубцовая алопеция, в том числе декальвирующий фолликулит), и других болезней кожи и подкожной ткани (например, варикозных язв), для лечения людей с имеющимся дефектом кожи (например, с сухой кожей), травмами кожи (таких как корки, раны, включая полученные в результате несчастных случаев или хирургических операций) или болезней у коммерческих животных и домашних питомцев.
Предпочтительные микроорганизмы, а именно микроорганизмы, которые принадлежат к группе молочнокислых бактерий, их аналоги, производные, мутанты и фрагменты обладают способностью специфически коагрегировать, предпочтительно специфически связываться по меньшей мере с одним патогенным микроорганизмом, который выбран из группы Staphylococcus aureus и/или Pseudomonas aeruginosa. Было полной неожиданностью, что предпочтительные молочнокислые бактерии не коагрегируют или не связываются с комменсальными кожными бактериями или микроорганизмами, такими как Corynebacterium jeikeium, Micrococcus luteus, Propionibacterium acnes или в частности Staphylococcus epidermidis. Например, Staphylococcus epidermidis является наиболее обычным комменсальным организмом кожной флоры. Этот вид, взаимодействующий с различными микроорганизмами, найденными в или на коже, представлен во флоре здоровой кожи многих млекопитающих и находится с ней в бактериальном равновесии, по меньшей мере на здоровой коже. Следовательно, воздействие на эту бактерию, например, посредством агрегации, и следовательно воздействие на другие микроорганизмы, служащие для гигиены тела, не является предпочтительным в пределах объема настоящего изобретения.
Другими словами, предпочтительные молочнокислые бактерии специфически коагрегируют с патогенными бактериями Staphylococcus aureus и/или Pseudomonas aeruginosa. Ничего подобного в технике не известно. В известном уровне техники описаны только молочнокислые бактерии, которые также связываются с комменсальными микроорганизмами, так что они не могут использоваться, не вызывая побочных эффектов. В отличие от них, предпочтительные молочнокислые бактерии не связываются или не коагрегируют с комменсальными кожными бактериями или другими патогенными микроорганизмами, которые населяют кожную флору. В соответствии с еще одним предпочтительным вариантом молочнокислые бактерии по настоящему изобретению не имеют возможности связываться с комменсальными микроорганизмами на коже.
Специалистам известно, что здоровая кожа плотно заселена микроорганизмами, такими как бактерии и грибки в виде комменсалов или симбионтов. Эти микроорганизмы являются естественным компонентом поверхности кожи и в общем обозначаются термином "кожная флора". Микроорганизмы, входящие в состав кожной флоры, являются важным фактором для самозащиты кожи и тела в целом от патогенных организмов и являются частью биокупола. В связи с этим, особым преимуществом является то, что предпочтительные молочнокислые бактерии не нарушают равновесия кожной флоры, а только связываются с патогенными бактериями Staphylococcus aureus и/или Pseudomonas aeruginosa и/или коагрегируют с ними.
Эти микроорганизмы в частности имеют особые адгезионные свойства и образуют коагрегаты с патогенными микроорганизмами Staphylococcus aureus и/или Pseudomonas aeruginosa. Однако также предпочтительно молочнокислые бактерии также специфически коагрегируют с другими патогенными видами микроорганизмов Staphylococcus или Pseudomonas или по меньшей мере взаимодействуют с ними.
В не меньшей степени микроорганизмы по настоящему изобретению имеют свойства препятствовать образованию биопленки. Благодаря тому, что предпочтительные молочнокислые бактерии коагрегируют с патогенными бактериями и/или проявляют по отношению к ним адгезионные свойства, патогенные микроорганизмы могут быть маскированы, что приводит к устранению многих патогенных факторов и, таким образом, к уменьшению бактериальной нагрузки и/или ингибированию образования биопленки, например посредством маскировки и/или связывания соответствующих поверхностных адгезинов патогенной бактерии.
Хотя в частности изобретение относится к группе молочнокислых бактерий, однако идея настоящей патентной заявки является универсальной. Заявленные микроорганизмы обладают общим свойством или действием. Совокупность структурных или функциональных общих свойств имеет следствием функциональную взаимосвязь между коагрегацией с Staphylococcus aureus и/или Pseudomonas aeruginosa, несвязыванием комменсальных микроорганизмов кожи и предотвращением образования биопленки и/или разрушением биопленки, образованной Staphylococcus aureus и/или Pseudomonas aeruginosa. Таким образом, эти общие свойства являются не случайным сочетанием свойств, а наоборот, общие характерные свойства заявленных микроорганизмов, так сказать, с успехом позволяют применять и характеризует применимость данных микроорганизмов для этой цели.
Предпочтительные микроорганизмы, в частности молочнокислые бактерии, выбраны из группы, содержащей Lactobacillus lactis, Lactobacillus helveticus, Lactobacillus jensenii, Lactobacillus acidophilus, Lactobacillus bulgaricus, Lactobacillus amylovorus, Lactobacillus delbrueckii, Lactobacillus casei, Lactobacillus crispatus, Lactobacillus gasseri, Lactobacillus johnsonii, Lactobacillus paracasei, Lactobacillus pentosus, Lactobacillus rhamnosus, Lactobacillus curvatus, Lactobacillus plantarum, Lactobacillus brevis, Lactobacillus buchneri, Lactobacillus fructivorans, Lactobacillus hilgardii, Lactobacillus fermentum, Lactobacillus reuteri, Lactobacillus viridescens, Bifidobacterium bifidum или их аналоги, производные, фрагменты или мутанты, указанные микроорганизмы связаны друг с другом своим функциональным сходством, а единая идея изобретения состоит в том, что они обладают общими свойствами и/или действием, а именно что они специфически коагрегируют с патогенными бактериями Staphylococcus aureus и/или Pseudomonas aeruginosa, не связываются с какими-либо комменсальными микроорганизмами кожи и/или слизистых оболочек, а также предотвращают образование биопленки Staphylococcus aureus и/или Pseudomonas aeruginosa. Эти молочнокислые бактерии в частности включают в себя микроорганизмы, их аналоги, фрагменты, производные, мутанты или сочетания, выбранные из группы, содержащей следующие микроорганизмы, депонированные в Немецкой коллекции микроорганизмов и клеточных культур под кодовыми номерами: DSM 25906, DSM 25907, DSM 25908, DMZ 25909, DSM 25910, DSM 25911, DSM 25912, DSM 25913, DSM 25914 и DSMZ 25915. Было полной неожиданностью, что оказалось возможным идентифицировать группу молочнокислых бактерий, которые имели идентичные полезные свойства. До сих пор не было описано никаких бактерий, в частности молочнокислых бактерий, которые сочетают все указанные свойства и, в то же время, не являются патогенными и не приводят к каким-либо повреждениям естественной кожной флоры или не воздействуют на нее. Также было установлено, что применение предпочтительных молочнокислых бактерий в виде состава или как-либо иначе предотвращает связывание и заражение клеток-хозяев бактериями Staphylococcus aureus и/или Pseudomonas aeruginosa. Причина этого до сих пор неизвестна, но должна быть установлена в дополнительных экспериментах.
Другим неожиданным преимуществом предпочтительных микроорганизмов, в частности молочнокислых бактерий, является то, что их также можно использовать профилактически. Другими словами, молочнокислые бактерии и/или содержащий их состав можно профилактически наносить на подверженную риску область кожи и/или применять в подверженной риску группе людей или животных без нанесения какого-либо вреда коже или кожной флоре. Известно, например, что у людей, которые вынуждены быть прикованными к постели в течение длительного периода времени, в точках пережатия образуются открытые раны. Начальные эксперименты показали, что профилактическое лечение указанных участков может предотвратить образование открытых ран или по меньшей мере может защитить от дополнительной инфекции, вызываемой Staphylococcus aureus и/или Pseudomonas aeruginosa.
В контексте предпочтительных вариантов настоящего изобретния под кожей подразумевают в частности внешний орган тела человека или животного, который отделяет внутреннюю часть от внешнего мира. В настоящем изобретении область кожи включает в предпочтительных вариантах компоненты верхнего слоя кожи, кориум или дерму и подкожную ткань. Верхний слой кожи (эпидермис) согласно настоящему изобретению также состоит из следующих слоев: роговой слой (лат.- stratum comeum), прозрачный слой (stratum lucidum), зернистый слой (stratum granulosum), шиповатый слой (stratum spinosum) и/или базальный слой (stratum basale). В настоящем изобретении каждая модификация клеток в данной области является модификацией клеток в области кожи. Дерма или кориум, который согласно настоящему изобретению также может быть компонентом области кожи предпочтительно состоит из волокон соединительной ткани и служит для обеспечения питания и опоры для эпидермиса. В настоящем изобретении капиллярная кровеносная система в граничащей с эпидермисом зоне также относится к области кожи, как и сальные и потовые железы. В настоящем изобретении дерма может подразделяться на сосочковый слой (stratum papillare) и сетчатый слой (stratum reticulare). Кроме того, в настоящем изобретении область кожи может быть любой областью, то есть она может располагаться в любом месте в или на подкожной ткани (субкутис) или ткани внутри полости тела или любого органа или составной части органа. В настоящем изобретении кожей может быть тканевый барьер, отделяющий орган от соседних структур. Кроме того, в концепции изобретения подразумевается, что область кожи может также включать придатки кожи, такие как волосы, сальные железы, гладкие мышцы, ногти, роговидные отростки и потовые железы, в частности эккриновые и апокриновые потовые железы, а также молочные железы. Любые клеточные изменения, в частности клеточный рост, который отличается от нормального, можно лечить средствами по настоящему изобретению, предпочтительно не ограничиваясь внешней областью кожи. Вместе с тем, области кожи в настоящем изобретении могут также включать толстую кожу, такую как на пальцах или подошвах, или наружный покров и связанные с ним придатки кожи.
Переносимость молочнокислых бактерий кожи является необходимым условием для успешного лечения кожных инфекций и бактериальных инфекций ран или других болезней или симптомов, когда имеются микроорганизмы из стафилококковой и псевдомональной групп.
Предпочтительный состав может содержаться в частности в мыле, лосьоне, порошке, в синтетическом моющем средстве, пене, помаде, эмульсии, аэрозоле, креме, геле, шампуне, жидком мыле или дезодоранте. Также предпочтительно состав может использоваться в частности как пробиотик, который можно добавлять в моющее средство, средство для полоскания, чистящее средство или дезинфицирующее средство (например мыло, порошки, пасты, растворы, эмульсии, лосьоны), средство для стирки и/или дезинфекции полотенец, шампуни, средства для промывания кожи, волос и/или кожи головы или для нанесения на кожу, волосы и/или кожу головы, кремы, мази, лосьоны для очистки кожи и/или для ухода за кожей, растворы (например капли, аэрозоли, средства для полоскания), используемые для глаз, ушей, рта, носа или горла, а также состав может содержаться в бинтах или раневых повязках с целью препятствования оседанию патогенных микроорганизмов, связывания их, удаления их в виде агрегатов и/или ингибирования или уничтожения их и таким образом уменьшать их количество.
Было полной неожиданностью, что преимущества состава по настоящему изобретению можно было еще увеличить посредством включения его в вышеуказанные фармацевтические формы. Специалистам знакомы другие способы приготовления лекарственных препаратов для введения состава по настоящему изобретению в основу, такую как например эмульсия или другие продукты для нанесения на кожу, например жидкие формы, которые предпочтительно могут быть безводными или водными, при этом согласно изобретению могут разделяться на однофазные и многофазные системы. Кроме того, могут использоваться полужидкие безводные или водные формы, при этом также их можно разделить на однофазные и многофазные системы, в которых также возможны полужидкие формы, содержащие воду. Предпочтительно могут также использоваться твердые формы, липофильные или гидрофильные. В дополнение к вышеперечисленным формам, примеры таких форм включают, например, мази на основе жиров, пены, порошки, карандаши, гель-кремы, водно-дисперсионные гели, водные эмульсии, лосьоны, мази, аэрозоли и кремы. Специалистам известно, что такие основы могут, во-первых, разделяться на питательные/полезные и свежие и легкие в зависимости от ощущения на коже, и во-вторых, в зависимости от вязкости их можно разделить на основы с низкой вязкостью и основы с высокой вязкостью, поскольку гидрогели или гидрокремы и/или эмульсии масло/вода или эмульсии вода/масло имеют высокую вязкость. Когда используются жидкие формы для нанесения, их можно подразделить, как показано выше, на водные и безводные системы. Что касается безводных систем, наиболее предпочтительны неполярные системы, полярные системы без эмульгаторов и полярные системы с эмульгаторами. Что касается водных систем, предпочтительны однофазные системы, такие как растворы и микроэмульсии; что касается многофазных систем, предпочтительны сложные эмульсии вода/масло или масло/вода. Что касается систем твердое вещество/жидкость, предпочтительные формы включают в себя суспензии или системы жидкость/твердое вещество/жидкость, такие как суспензионные системы/эмульсионные системы. Специалистам известны различные способы получения таких основ. Касательно эмульсий масло/вода, основные фармацевтические субстанции включают эмульгаторы масло/вода, эмульгаторы вода/масло, жидкие гидрофильные компоненты и жидкие липофильные компоненты. Касательно эмульсий вода/масло, основные фармацевтические субстанции включают эмульгаторы вода/масло, эмульгаторы масло/вода, жидкие или полужидкие липофильные компоненты, гелеобразующие агенты, жидкие гидрофильные компоненты и/или соли.
Что касается предпочтительных полужидких основ, для различных применений предпочтительны как безводные системы, так и водные системы. Безводные системы могут содержать неполярные системы или полярные системы без эмульгаторов, такие как липогели, олеогели или полиэтиленгликолевые гели, и/или могут содержать неполярные системы с эмульгаторами на основе абсорбции масло/вода или вода/масло. Водные системы могут предпочтительно содержать однофазные системы, такие как гидрогели или микроэмульсионные гели или многофазные системы, такие как кремы масло/вода, кремы вода/масло или амфифильные системы. Предпочтительные полужидкие препараты являются пастообразными препаратами для нанесения на кожу в диапазоне температур между комнатной температурой и температурой кожи или для нанесения на слизистые оболочки, при этом они оказывают местное действие, перенося активные компоненты или оказывая смягчающее или защитное действие на кожу. Предпочтительные препараты включают мази в узком понимании, кремы, гели и/или пасты. В дополнение к мазям, кремам, гелям и пастам, в качестве полужидких прозрачных однофазных систем могут также использоваться олеогели. Из патента США 6,187,323 или Aiache et al., 2001 специалистам известны различные безводные составы для изготовления полужидких систем, в том числе, например, состав из олеогеля и гидрогеля, который согласно настоящему изобретению можно назвать двойным гелем. Кроме того, согласно настоящему изобретению в качестве основ могут использоваться гидродисперсионные гели или различные липиды. При использовании липидов, для создания липидных фаз в дисперсионных системах могут использоваться кремнийорганические или органические углеродные соединения, при этом органические углеродные соединения можно обеспечить, например, с помощью негидролизуемых липидов, гидролизуемых липидов (глицеринов) или восковых эфиров. Преимущества таких систем включают в себя повышение упругости и эластичности кожи, а также способность повышать выход веществ и их степень проникновения в зависимости от липидного состава. Специалистам будет известно, какие из липидов они должны использовать для повышения или понижения степени проникновения, например, в пределах временного параметра.
Дополнительные предпочтительные основы включают в себя, например, гидродисперсионные гели и/или микрокапсулы, микрошарики или таблетки (макрогранулы). Указанные основы служат для повышения стабильности и обеспечивают минимальный период нанесения на кожу. Предпочтительные полужидкие однофазные системы могут быть приготовлены с помощью следующих основных фармацевтических субстанций: жидкие гидрофильные компоненты, в частности вода и(поли)спирты, гидрофильные гелеобразующие вещества, солеобразующие вещества и эмульгаторы вода/масло, эмульгаторы масло/вода, жидкие, полужидкие или твердые липофильные компоненты, а также липофильные гелеобразующие вещества и компоненты. Специалистам известно, как им нужно будет скомбинировать эти субстанции, чтобы достигнуть определенного действия.
Специалистам будут также известны другие фармацевтические препараты для кожных средств. Например, согласно настоящей патентной заявке, это все фармацевтические соединения, раскрытые авторами Daniels и Knie в JDDG; 2007, 5:367-383. Специалисты знают, что разные фармацевтические препараты оказывают на кожу различное действие и будут наносить на кожу галеновые составы в различных количествах. Содержание JDDG; 2007, 5:367-383, таким образом, включено в описание идеи настоящей патентной заявки. Согласно изобретению предпочтительные продукты включают в себя, например, липофильные или гидрофильные растворы, липофильные или гидрофильные эмульсии, липофильные или гидрофильные суспензии, специальные жидкие препараты, гидрофобные или гидрофильные мази, водоэмульсионные мази, липофильные, гидрофильные или амфифильные кремы, гидрогели, гидрофобные или гидрофильные пасты и/или порошки.
Эксперименты показали, что предпочтительные молочнокислые бактерии, в частности клетки lactobacillus, образуют коагрегаты при контакте с клетками Staphylococcus aweus и/или Pseudomonas aeruginosa. Образование коагрегатов в частности препятствует проникновению Staphylococcus aureus и/или Pseudomonas aeruginosa в кожные раны или их заселению на коже и образованию колоний, а также созданию, прилипанию и формированию биопленок. Клетки Staphylococcus aureus и/или Pseudomonas aeruginosa, в частности их клеточная поверхность, маскируются молочнокислыми бактериями, в частности клетками lactobacillus, так что клетки Staphylococcus aureus и/или Pseudomonas aeruginosa предпочтительно уже не могут связываться с эпителиальными клетками кожи. Поскольку Staphylococcus aureus и/или Pseudomonas aeruginosa не могут связываться с эпителиальными клетками кожи, не возникают воспалительные реакции и/или уменьшается или предотвращается раздражение кожи. Клетки Staphylococcus aureus и/или Pseudomonas aeruginosa, в частности их клеточная поверхность, связываются молочнокислыми бактериями, в частности клетками lactobacillus. Затем образуются клеточные коагрегаты, состоящие из клеток lactobacillus и/или клеток Staphylococcus aureus и/или клеток Pseudomonas aeruginosa, которые более легко и с большей эффективностью можно удалить (смыть) с кожи, ран и поверхностей в целом (с поверхностей меха, перьев, стальных, пластмассовых и металлических поверхностей) по сравнению с клетками Staphylococcus aureus и/или Pseudomonas aeruginosa, присутствующими отдельно или в небольших агрегатах.
Согласно настоящему изобретению пробиотические микроорганизмы содержат клетки, которые оказывают благоприятное воздействие на человеческий и/или животный организм. Предпочтительный состав используется как пробиотический состав и содержит молочнокислые бактерии, которые оказывают благоприятное воздействие на человеческий и/или животный организм. Благоприятное воздействие может заключаться в частности в улучшении кожной флоры. В частности, нежелательные микроорганизмы кожной флоры, такие как Staphylococcus aureus и/или Pseudomonas aeruginosa, могут быть ингибированы посредством прямого взаимодействия пробиотических микроорганизмов и нежелательных микроорганизмов, а также в частности посредством непрямого взаимодействия, основанного на угнетении метаболизма нежелательных микроорганизмов в результате выделения продуктов пробиотических микроорганизмов. Эксперименты показали, что не наблюдается роста патогенных микроорганизмов Staphylococcus aureus и/или Pseudomonas aeruginosa, т.е. после коагрегации с предпочтительнымих молочнокисльми бактериями клеточная масса больше не воспроизводится, а вместо этого клетки маскируются, связываются в коагрегаты и/или убиваются.
Аналоги, мутанты, производные и фрагменты описанных в настоящем изобретении молочнокислых бактерий, которые получают в частности посредством биологической, химической или физической обработкой молочнокислых бактерий, неожиданно проявляют полезные свойства даже после обработки. Молочнокислые бактерии предпочтительно выбраны из группы, содержащей Lactobacillus lactis, Lactobacillus helveticus, Lactobacillus jensenii, Lactobacillus acidophilus, Lactobacillus bulgaricus, Lactobacillus amylovorus, Lactobacillus delbrueckii, Lactobacillus casei, Lactobacillus crispatus, Lactobacillus gasseri, Lactobacillus johnsonii, Lactobacillus paracasei, Lactobacillus pentosus, Lactobacillus rhamnosus, Lactobacillus curvatus, Lactobacillus plantarum, Lactobacillus brevis, Lactobacillus buchneri, Lactobacillus fructivorans, Lactobacillus hilgardii, Lactobacillus fermentum, Lactobacillus reuteri, Lactobacillus viridescens, Bifidobacterium bifidum, и предпочтительно выбраны из группы, содержащей следующие микроорганизмы, депонированные в Немецкой коллекции микроорганизмов и клеточных культур под номерами: DSM 25906, DSM 25907, DSM 25908, DSMZ 25909, DSM 25910, DSM 25911, DSM 25912, DSM 25913, DSM 25914 и DSMZ 25915.
Кроме того, неожиданным оказалось то, что молочнокислые бактерии, их фрагменты, производные, мутанты, аналоги и сочетания сохраняли свои полезные свойства даже после физического, химического и/или биологического киллинга. Например, предпочтительные штаммы, а именно DSM 25906, DSM 25907, DSM 2598, DSMZ 25909, DSM 25910, DSM 25911, DSM 25912, DSM 25913, DSM 25914 и DSMZ 25915, вызывают коагрегацию патогенов, предотвращают образование биопленки, а также не связывают какие-либо комменсальные микроорганизмы, даже после тепловой обработки при 70°С в течение 20 минут или после обработки ультразвуком. Таким образом, молочнокислые бактерии, их фрагменты, производные, мутанты, аналоги и сочетания могут быть также с успехом представлены в предпочтительном варианте состава в погибшем виде. Следовательно можно значительно увеличить стабильность и продлить годность состава. Кроме того, состав можно также использовать в других областях применения, где невозможно использование жизнеспособных микроорганизмов. Было полной неожиданностью, что молочнокислые бактерии в составе могут быть инактивированными, жизнеспособными или нежизнеспособными и тем не менее сохраняющими способность специфически связываться и/или коагрегировать с патогенными микроорганизмами. Состав может с успехом использоваться в качестве пищевого продукта, пищевой добавки или фармацевтического средства, лекарственного препарата, косметического средства, добавки к чистящему средству, а также в качестве корма или напитка для животных.
Предпочтительный состав содержит молочнокислые бактерии по настоящему изобретению или их аналоги, фрагменты, мутанты или производные, которые способны коагрегировать по меньшей мере с одним патогенным микроорганизмом, выбранным из группы, содержащей Staphylococcus aureus и/или Pseudomonas aeruginosa, при этом состав используется для гигиены тела, физиотерапии и/или в качестве профилактического средства.
Предпочтительные микроорганизмы являются представителями рода или группы молочнокислых бактерий, т.е. грамположительных бактерий, которые продуцируют молочную кислоту посредством сбраживания глюкозы. Микроорганизмы по настоящему изобретению характеризуются с одной стороны тем, что они способны специфически коагрегировать по меньшей мере с одним патогенным микроорганизмом, выбранным из группы, содержащей Staphylococcus aureus и/или Pseudomonas aeruginosa. Такое связывание приводит к образованию агрегатов, состоящих из микроорганизмов по настоящему изобретению и специфически связанных патогенных микроорганизмов. Благодаря образованию коагрегатов патогенные микроорганизмы можно легко целенаправленно механически удалить, например смыванием, что было невозможно с помощью известных в прошлом средств. Клеточные коагрегаты, содержащие клетки Lactobacillus и/или Staphylococcus aureus и/или Pseudomonas aeruginosa, можно более просто и с большей эффективностью удалить (смыть) с кожи, ран и поверхностей в целом (с поверхностей меха, перьев, стальных, пластмассовых и металлических поверхностей) по сравнению с клетками Staphylococcus aureus и/или Pseudomonas aeruginosa, присутствующими отдельно или в небольших агрегатах.
В настоящем изобретении, а также в области микробиологии и гигиены в целом, в частности в области микробиологии, относящейся к человеку и гигиене тела, термин «специфическое связывание» или «коагрегация» означает взаимное распознавание и адгезию клеток, принадлежащих к генетически разным типам клеток. На поверхности своих клеток бактерии экспрессируют рецепторы и адгезиновые структуры для других типов клеток, которые используются для адгезии между клетками. Данная адгезия играет значительную роль в заселении патогенными микроорганизмами, а также комменсальными микроорганизмами, поэтому вмешательство в адгезию может привести к далеко идущим последствиям. Благодаря тому, что микроорганизмы по настоящему изобретению имеют способность специфически связываться, в частности коагрегировать по меньшей мере с одним микроорганизмом из группы Staphylococcus aureus и/или Pseudomonas aeruginosa, они образуют агрегаты, состоящие из микроорганизмов по настоящему изобретению и патогенных микроорганизмов. Образующиеся коагрегаты можно легко удалить, например промыванием поверхности, кожи, тканей и/или каких-нибудь других мест или резервуаров колонизации, что однозначно приводит к уменьшению числа патогенных микроорганизмов. Кроме того, посредством маскировки поверхностных структур патогенных микроорганизмов предотвращается и/или уменьшается первичная и/или вторичная адгезия к поверхностям, коже, тканям и/или другим местам или резервуарам колонизации. Если клетки связываются друг с другом и образуют агрегаты, этот процесс называется в частности агрегацией. Если в таком формировании агрегатов участвуют клетки только одного вида, этот процесс называется аутоагрегацией или самоагрегацией. Если в формировании агрегатов участвуют по меньшей мере два различных вида клеток, этот процесс известен в частности как коагрегация.
В настоящем изобретении под "специфическим связыванием по меньшей мере одного патогенного микроорганизма" в частности понимают свойство микроорганизмов по настоящему изобретению связывать по меньшей мере один вид бактерий из группы, содержащей Staphylococcus aureus и/или Pseudomonas aeruginosa.
Согласно предпочтительному варианту микроорганизмов по настоящему изобретению, они также характеризуются тем, что их способность специфически связываться по меньшей мере с одним патогенным микроорганизмом существует даже после биологической, химической или физической обработки, например после термической обработки как минимум при 70°С. Другими словами, предпочтительные молочнокислые бактерии предпочтительно могут быть включены в предпочтительный состав, так как их способность к специфическому взаимодействию или связыванию с патогенными бактериями, в частности Staphylococcus aureus и/или Pseudomonas aeruginosa, не нарушается и следовательно может возникать связывание или взаимодействие.
Наиболее предпочтительными могут быть инактивированные или нежизнеспособные клетки молочнокислых бактерий, поскольку у таких клеток молочнокислых бактерий отсутствует метаболическая активность.
В соответствии с другим предпочтительным свойством молочнокислых бактерий, в дополнение к свойству, описанному выше, микроорганизмы по настоящему изобретению могут также характеризоваться термической устойчивостью, а именно способностью специфически связываться по меньшей мере с одним патогенным микроорганизмом, выбранным из группы Streptococcus pyogenes, а также они могут выдерживать обработку при высокой температуре, предпочтительно по меньшей мере близкой к 60°С, более предпочтительно не менее 65°С и еще более предпочтительно не менее 70°С, в течение по меньшей мере 20 минут, предпочтительно 25 минут и более предпочтительно примерно не меньше 30 минут, и сохранять свою способность к коагрегации с указанными патогенными микроорганизмами.
Предпочтительный вариант состава содержит молочнокислые бактерии, которые являются инактивированными, жизнеспособными или убитыми, или их части и фрагменты, например продукты ферментативного или механического расщепления (например с помощью френч-пресса и др.), или продукты метаболизма этих бактерий, поскольку они по-прежнему обладают способностью к коагрегации и/или предотвращению образования биопленки. Также предпочтительно использование молочнокислых бактерий в инкапсулированной, высушенной распылением и/или лиофилизированной форме, т.е. в предпочтительном составе они могут присутствовать в инкапсулированной, высушенной распылением и/или лиофилизированной форме. Кроме того, может быть предпочтительно использовать молочнокислые бактерии в виде обработанных ферментами клеток.
Кроме того предпочтительно, если способность молочнокислых бактерий по настоящему изобретению специфически связываться с патогенными микроорганизмами сохраняется даже при рН между приблизительно 3 и 8. Это означает, что молочнокислые бактерии могут находиться в среде, имеющей рН от 3 до 8, и тем не менее иметь возможность связывать Staphylococcus aureus и/или Pseudomonas aeruginosa. Специалистам известно, что кожа имеет слабокислый показатель рН. В связи с этим, наиболее предпочтительно, чтобы предпочтительные молочнокислые бактерии также проявляли свою способность к коагрегации со Staphylococcus aureus и/или Pseudomonas aeruginosa в широком диапазоне рН. рН кожи может меняться, например под воздействием косметических продуктов или в различных областях тела. Предпочтительные молочнокислые бактерии преимущественно могут проявлять свои свойства в широком диапазоне рН и/или иметь предпочтительные свойства в предпочтительном диапазоне. Таким образом, предпочтительные молочнокислые бактерии могут с успехом использоваться универсально в различных областях тела.
Кроме того, объектом настоящего изобретения является состав, в частности инновационный пробиотик, который также обладает коагрегационными свойствами после обработки протеазами (например трипсином, обработанным ТФХК (тозил-фенилаланин-хлорметилкетон) трипсином, лизоцимом, протеиназой К, проназой, тромбином, пептид-N-гликозидазой, химотрипсином, папаином).
Молочнокислые бактерии по настоящему изобретению неожиданно проявляют коагрегационные свойства в частности со Staphylococcus aureus и/или Pseudomonas aeruginosa в широком диапазоне температур, приблизительно 25-42°С.
Специалистам понятно, что в этом случае, а также во всех формулировках диапазона, указанных в настоящем изобретении, характеризуемых такими терминами как "около" или "приблизительно", с выражениями "около" или "прибл./приблизительно" нет необходимости указывать точный числовой диапазон, и даже если имеются небольшие отклонения вверх или вниз относительно указанного числа, они находятся в пределах объема настоящего изобретения.
Связывание молочнокислых бактерий по настоящему изобретению с патогенными микроорганизмами, указанными выше, приводит к ингибированию роста этих патогенных микроорганизмов.
Неожиданным было то, что в результате связывания патогенных микроорганизмов и молочнокислых бактерий по настоящему изобретению агрегаты, которые представлены в виде осадка, образуются в частности после 5-100 минут при комнатной температуре без перемешивания.
Основными аэробными патогенными бактериями в ранах являются в частности Staphylococcus aureus и/или Pseudomonas aeruginosa. Воспалительная фаза заживления ран обычно служит для борьбы с потенциально патогенными микроорганизмами и для регенерации клеток. Однако, у пациентов с подавленным иммунитетом и слабой воспалительной реакцией часто образуются незаживающие раны. Такая ослабленная иммунная реакция больше не может эффективно бороться с первичными бактериями раны, и следовательно бактерии проникают в рану и образуют колонии в виде биопленки. Устойчивыми к защитной системе хозяина являются не только эти биопленки, но также планктонные клетки или микроколонии.
В предпочтительном варианте предпочтительные молочнокислые бактерии, их аналоги, фрагменты, мутанты, производные или сочетания предпочтительно обладают по меньшей мере одним из следующих свойств: а) термоустойчивостью или устойчивостью после биологической, химической и/или физической обработки или b) способностью ингибировать образование биопленки Staphylococcus aureus и/или Pseudomonas aeruginosa. Полной неожиданностью было то, что молочнокислые бактерии по настоящему изобретению сохраняли свою способность специфически связываться с Staphylococcus aureus и/или Pseudomonas aeruginosa даже после биологической, химической и/или физической обработки.
Другим свойством молочнокислых бактерий по настоящему изобретению является способность ингибировать образование биопленки Staphylococcus aureus и/или Pseudomonas aeruginosa. Эти бактерии образуют очень стойкие биопленки, которые устойчивы к ультразвуку, моющим средствам, протеазам или нагреванию, а также к антибактериальным препаратам. Микроорганизмы по настоящему изобретению обладают свойством ингибировать образование биопленок Staphylococcus aureus и/или Pseudomonas aeruginosa. Благодаря ингибированию образования биопленок эти патогенные бактерии больше не могут колонизировать биологические поверхности или неорганические поверхности и следовательно больше не могут вызывать заболевания.
Таким образом, в настоящем изобретении под "ингибированием образования биопленок Staphylococcus aureus и/или Pseudomonas aeruginosa" понимается в частности свойство молочнокислых бактерий по настоящему изобретению взаимодействовать с Staphylococcus aureus и/или Pseudomonas aeruginosa, то есть связываться с ними или иначе воздействовать на них таким образом, чтобы они больше не могли образовывать биопленку.
Согласно предпочтительному варианту микроорганизмы по настоящему изобретению могут таким образом обладать по меньшей мере одним из указанных свойств, то есть устойчивостью к биологической, химической и/или физической обработке, термоустойчивостью, способностью к специфическому связыванию, коагрегации с Staphylococcus aureus и/или Pseudomonas aeruginosa. Предпочтительные сочетания свойств включают, например, устойчивость к биологической, химической и/или физической обработке, термоустойчивость и способность связываться с Staphylococcus aureus и/или Pseudomonas aeruginosa или устойчивость к биологической, химической и/или физической обработке, термоустойчивость и ингибирование образования биопленок Staphylococcus aureus и/или Pseudomonas aeruginosa.
В данном случае, как уже указывалось, нужно понимать, что выражение "микроорганизм, принадлежащей к роду или группе молочнокислых бактерий" включает в себя также производные, мутанты, аналоги или фрагменты микроорганизма, которые сохраняют характеристики и/или особенности или свойства микроорганизмов по настоящему изобретению. Молочнокислые бактерии по настоящему изобретению предпочтительно являются бактериями вида Lactobacillus gasseri, Lactobacillus crispatus и Lactobacillus ingluviei.
Соответственно, заявлен "мутант или производное" вышеупомянутых микроорганизмов, принадлежащих к роду молочнокислых бактерий, в частности мутант или производное вида Lactobacilli, имеющий те же характеристики, которые заявлены для молочнокислых бактерий по настоящему изобретению и в частности для тех же штаммов. Это относится по меньшей мере к способности к специфической коагрегации по меньшей мере с одним патогенным микроорганизмом, выбранным из группы, содержащей Staphylococcus aureus и/или Pseudomonas aeruginosa. Кроме того, предпочтительным должно быть по меньшей мере одно из следующих свойств: (i) устойчивость способности к специфическому связыванию к биологической, химической и/или физической обработке, в частности к термической обработке при более 70°С в течение по меньшей мере 30 минут; (ii) отсутствие связывания с Staphylococcus epidermidis или другими комменсальными микроорганизмами кожи; (iii) способность специфически связываться по меньшей мере с одним патогенным, образующим биопленку микроорганизмом; (iv) способность ингибировать образование биопленки Staphylococcus aureus или Pseudomonas aeruginosa; (v) способность специфически связываться при рН 3-8. Такие предпочтительные производные можно получить, например, посредством генной инженерии. В настоящем изобретении термин "полученные посредством генной инженерии" включает в себя в частности все хорошо знакомые специалистам в области генной инженерии способы модификации нуклеиновых кислот in vitro и in vivo, позволяющие вызвать с помощью технологий рекомбинантных ДНК генетическую модификацию и модифицировать гены.
Соответственно, настоящее изобретение в частности включает также фрагменты молочнокислых бактерий по настоящему изобретению, которые сохраняют свойства молочнокислых бактерий по настоящему изобретению. В настоящем изобретении "фрагмент" является в частности клеточным компонентом микроорганизмов по настоящему изобретению и предпочтительно частью клеточной мембраны. Из известного уровня техники специалистам достаточно хорошо известны способы получения фракций клеточных мембран.
Микроорганизмы по настоящему изобретению являются предпочтительно изолированными или очищенными, где термин "изолированные" означает в частности, что молочнокислые бактерии извлечены из своей культуральной среды, включая например их естественную среду. Термин "очищенные" не означает абсолютной чистоты.
Предпочтительно, кроме микроорганизмов по настоящему изобретению в жизнеспособной форме, в объем настоящего изобретения также входят инактивированные формы микроорганизмов по настоящему изобретению. Термин "инактивированная форма" в настоящем описании означает инактивированные или мертвые клетки, которые в частности больше не способны к образованию колоний в культуральных планшетах. Специалистам хорошо известны подходящие способы инактивации (например биологические, химические или физические способы инактивации). В данном случае, однако, могут также использоваться микроорганизмы в лиофилизированной форме. Лиофилизированные клетки можно заставить снова расти после соответствующего культивирования в жидкой или твердой среде.
В настоящем изобретении термины "инактивированные формы" или "неактивная форма" и "производные", "аналоги" или "мутанты" также включает в себя супернатанты клеточных культур и/или брожения, лизаты, фракции или экстракты микроорганизмов по настоящему изобретению, где лизаты, фракции или экстракты предпочтительно обладают свойствами молочнокислых бактерий, при этом термин "лизат", также как и термин "экстракт", в частности относится к растворам или водным суспензиям клеток микроорганизма по настоящему изобретению, содержащим макромолекулы, такие как например ДНК, РНК, белки, пептиды, липиды, углеводороды и др., а также обломки клеток. Предпочтительно, лизат также включает клеточную стенку или компоненты клеточной стенки. Способы получения лизатов, достаточно хорошо известные специалистам, включают в себя, например, использование "французского пресса" или ферментативного лизиса, шаровой мельницы со стеклянными или железными шариками. Клетки можно разрушить ферментативными, физическими или химическими способами. Примерами ферментативного лизиса клеток могут быть отдельные ферменты, а также смеси ферментов, например протеаза, протеиназа К, липаза, гликозидаза; химический лизис можно вызвать с помощью ионофоров, детергентов, таких как додецилсульфат натрия, кислот или оснований; физические способы можно также реализовать используя высокое давление, например французский пресс, осмотическое давление, температуру или чередование тепла и холода. Кроме того, химические, физические и ферментативные способы также можно комбинировать.
"Инактивированные формы" или "неактивные формы" и "производные", "аналоги" или "мутанты" микроорганизмов по настоящему изобретению предпочтительно имеют такие же свойства, как и вышеуказанные штаммы. "Инактивированные формы" или "неактивные формы" и "производные" или "аналоги" предпочтительно больше не проявляют метаболической активности.
Аналоги микроорганизмов по настоящему изобретению представляют собой лизат или фрагменты. Фрагменты микроорганизмов по настоящему изобретению являются частью клеток, например клеточными мембранами, макромолекулами, такими как ДНК, РНК, белками, пептидами, липидами, углеводородами, и т.д., а также обломками клеток. Специалисты без особых усилий могут дополнить содержание таких терминов как "аналоги", "фрагменты", "производные" и "мутанты", а также интерпретировать указанные в настоящем изобретении термины. Для получения мутантов, производных, фрагментов и аналогов предпочтительных микроорганизмов специалисты могут обратиться к обычной доступной литературе, где описаны способы, которые могут использоваться для получения мутантов, производных, фрагментов и аналогов.
Мутанты и/или генетически измененные варианты или производные могут быть получены, например, посредством технологий рекомбинантных ДНК (клонирование, секвенирование, трансформация рекомбинантных нуклеиновых кислот), а также физического мутагенеза, например, с помощью ультрафиолетового излучения, или посредством химических реагентов, например с помощью этилметансульфоната (ЭМС). Варианты с положительными свойствами можно отобрать либо целенаправленно, либо посредством анализа множества образованных мутантов. Генетически измененные мутанты включают в себя клетки микроорганизмов по настоящему изобретению, а их бактериальные хромосомы и/или плазмиды содержат в себе рекомбинантные нуклеиновые кислоты. Модификации посредством точечных мутаций, а также спонтанные мутации без какого-либо прямого воздействия на гены, также могут оказывать влияние на экспрессию/транскрипцию/трансляцию.
Аналоги и фрагменты могут быть термически инактивированными (мертвыми) или лиофилизированными формами микроорганизмов по настоящему изобретению, имеющими такие же или улучшенные свойства, например благодаря увеличению площади поверхности. Даже после лиофилизации (сушки вымораживанием) при некоторых условиях клетки могут все еще быть жизнеспособными. Эти клетки можно инактивировать посредством специального хранения при различных температурах.
Инактивированные клетки могут иметь, например, неповрежденные или нарушенные клеточные мембраны, но они не могут проявлять никакой метаболической активности. Способы получения инактивированных клеток могут включать в себя, например, обработку стеклянными шариками, где действие усилия сдвига между клетками или стеклянными шариками приводит к разрушению клеток. Дополнительные физические способы, такие как французский пресс, гомогенизация при высоком давлении, шаровая мельница или процессы замерзания-оттаивания и обработка в автоклаве также приводят к инактивации и получению фрагментов микроорганизмов по настоящему изобретению, как и обработка УФ-излучением, автолиз или специальное хранение при различных температурах.
В настоящем изобретении, термин "клетки Lactobacillus" может относится как к молочнокислым бактериям или лактобактериям, так и включать в себя микроорганизмы, которые для сбраживания молочной кислоты нуждаются в углеводородах, в частности в глюкозе и лактозе, и используют для биосинтеза путь Эмбдена-Мейергофа. Клетки Lactobacillus таксономически относятся к семейству Lactobacteriaceae. Они являются грамположительными, неспорообразующими и, как правило, неподвижными. Клетки Lactobacillus живут в анаэробной среде, но являются аэротолерантными, хотя не содержат каких-либо геминов (цитохрома, каталазы) (Schleifer et al.. System. Appl. Microb. 18, 461-467 (1995) или Ludwiq et al.. System. Appl. Microb. 15, 487-501 (1992)). Клетки и/или виды Lactobacillus можно определять на основе механизма утилизации углеводородов, в частности с помощью API-теста (Biomerieux Co.), и посредством секвенирования 16s РНК. Согласно настоящему изобретению это могут быть в частности виды, которые могут применяться для гомоферментативного молочнокислого брожения или гетероферментативного молочнокислого брожения. Также предпочтительными являются клетки Lactobacillus, выбранные из группы, содержащей Lactobacillus lactis, Lactobacillus helveticus, Lactobacillus jensenii, Lactobacillus acidophilus, Lactobacillus bulgaricus, Lactobacillus amylovorus, Lactobacillus delbrueckii, Lactobacillus casei, Lactobacillus crispatus, Lactobacillus gasseri, Lactobacillus johnsonii, Lactobacillus paracasei, Lactobacillus pentosus, Lactobacillus rhamnosus, Lactobacillus curvatus и Lactobacillus plantarum (все гомоферментативные), также Lactobacillus brevis, Lactobacillus buchneri, Lactobacillus fructivorans, Lactobacillus hilgardii, Lactobacillus fermentum, Lactobacillus reuteri, Lactobacillus viridescens и Bifidobacterium bifidum (все гетероферментативные).
В предпочтительном варианте, микроорганизмы по настоящему изобретению выбраны из Lactobacillus gasseri, lactobacillus gasseri, Lactobacillus gasseri, Lactobacillus crispatus, Lactobacillus crispatus, Lactobacillus crispatus, Lactobacillus crispatus, Lactobacillus crispatus, Lactobacillus crispatus и Lactobacillus ingluviei, депонированных в Немецкой коллекции микроорганизмов и клеточных культур (DSMZ) в Брауншвейге под номерами DSM 25906, DSM 25907, DSM 25908, DSMZ 25909, DSM 25910, DSM 25911, DSM 2591, DSM 25913, DSM 25914 и DSMZ 25915. Вышеупомянутое депонирование в DSMZ осуществлено в соответствии с Будапештским договором о международном признании депонирования микроорганизмов для целей патентной процедуры.
Как указывалось выше, настоящее изобретение также относится к составам, предпочтительно содержащим жизнеспособные микроорганизмы или их аналоги, мутанты, производные или фрагменты, а также предпочтительно по меньшей мере одну основу или наполнитель, которые выбраны по меньшей мере из следующего: косметически приемлемые основы или наполнители, фармацевтически приемлемые основы или наполнители или дерматологически приемлемые основы или наполнители.
В настоящем изобретении термин "состав" в частности относится к любому составу, содержащему по меньшей мере один микроорганизм по настоящему изобретению или его фрагмент, производное, аналог или мутанта, а также дополнительно другие ингредиенты, такие как основы или наполнители, или дополнительно другие активные ингредиенты и соли. Косметически, фармацевтически и дерматологически приемлемые наполнители, основы или добавки означает, что они содержат любые вещества, которые обычно используются в области косметологии, фармацевтики или стоматологии с целью косметического или фармацевтического применения, использования или активирования активного ингредиента или состава, то есть в данном случае, по меньшей мере одного микроорганизма или его аналога, производного, мутанта или фрагмента.
Предпочтительно состав может содержать не только один из микроорганизмов по настоящему изобретению или его аналог, мутант, производное или фрагмент, но также и смесь микроорганизмов по настоящему изобретению или смесь их аналогов, производных, мутантов или фрагментов или смесь микроорганизмов по настоящему изобретению и их фрагментов, производных, мутантов или аналогов.
Предпочтительно состав может быть в твердой, жидкой или вязкой форме или в виде аэрозоля и может использоваться, например, в форме порошков, таблеток, растворов, гранул, суспензий, эмульсий, капсул, паст, гелей, спреев и др., то есть в любой форме, пригодной для применения. Также предпочтительно состав дополнительно содержит пробиотики, антисептики или другие антибактериальные вещества и предпочтительно, но необязательно, сахариды и консерванты, ароматизаторы, заменители сахара, витамины, минеральные вещества и др. В документе ЕР 2133414 А1 перечислен ряд ингредиентов, которые могут использоваться для предпочтительных составов; дана прямая ссылка на эту публикацию. Кроме того, в предпочтительном составе могут присутствовать наполнители, вещества для регулирования потока, реологические модификаторы, умягчители, стабилизаторы, инициаторы или реактивные поперечно-связанные мономеры, например в предпочтительном составе могут присутствовать метакрилаты.
Состав по настоящему изобретению используется в частности для гигиены тела, физиотерапии и профилактики и содержит по меньшей мере один микроорганизм по настоящему изобретению или его производное, мутант, фрагмент или аналог.
Состав и/или микроорганизм может также использоваться в качестве дезинфицирующего средства, например как средство для дезинфекции поверхности, такое в частности, как средство для очистки контактных линз.
Дозировка и применение состава по настоящему изобретению зависит от соответствующего использования и соответствующего пациента, в частности от возраста, веса, общего здоровья и др., и определяется возможностями и оценкой специалистов, которые будут использовать состав.
Состав по настоящему изобретению может быть косметическим средством, лекарственным средством или фармацевтическим препаратом. Состав предпочтительно содержит молочнокислые бактерии в количестве от 0,001 до 10 вес. %, предпочтительно от 0,005 до 5 вес. %, наиболее предпочтительно от 0,1 до 3 вес. %. Было полной неожиданностью, что использование количества от 0,001 до 10 вес. % приводит в частности к тому, что состав можно использовать в течение более длительного периода, времени, при этом он остается стабильным. Если молочнокислые бактерии используются в количестве от 0,005 до 5 вес. %, это положительно влияет на реологические свойства состава и приводит к тому, что состав имеет меньшую вязкость, и соответственно он лучше распределяется по коже и его легче вводить в ротовую полость. Использование молочнокислых бактерий в количестве 0,1 до 3 вес. % приводит к тому, что компоненты состава лучше сцепляются друг с другом и имеется возможность обеспечить гомогенный состав за меньшее рабочее время, что в свою очередь ведет к уменьшению стоимости производства. Однако ясно, что для конкретного применения могут также использоваться другие количества, отличающиеся от тех, что указаны в настоящем описании.
Как объяснялось выше, состав и/или микроорганизм по предпочтительному варианту может использоваться в области гигиены тела для агрегации, то есть связывания с вышеупомянутыми патогенными микроорганизмами. Образованные коагрегаты можно затем легко удалить путем смывания, в частности при использовании суспензии, таким образом успешно достигается уменьшение числа патогенных микроорганизмов. Следовательно, для этой цели молочнокислые бактерии и/или содержащий их состав можно использовать различным образом. Например, они могут использоваться в гелях для душа, лосьонах для душа, лосьонах для тела, жидком мыле, мыле, маслах для душа или в растворах для дезинфекции, в фильтрующих системах дыхательного оборудования, аэрозолях для носа, чистящих растворах для контактных линз, в салфетках или чистящих салфетках. Следовательно, настоящее изобретение также относится ко всем продуктам, которые используются в области гигиены тела, лекарственных препаратов и профилактики и которые содержат молочнокислые бактерии по настоящему изобретению. Также описанные выше варианты соответствующим образом используются в области обработки, лечения и профилактики млекопитающих. Микроорганизмы и/или содержащий их состав могут следовательно использоваться различными способами.
В частности, состав по настоящему изобретению и/или микроорганизмы по настоящему изобретению используются препочтительно для получения лекарственных препаратов для лечения или профилактики сахарного диабета, кожных заболеваний, травм кожи, инфекционно-токсического шока, эксфолиативного дерматита новорожденных, а также токсикоинфекций, вызываемых энтеротоксинами, фурункулов, карбункулов, синусита, остеомиелита, такого как сепсис, и впоследствии менингита и/или миокардита и перикардита, вызываемых Staphylococcus aureus, и пневмонии с фиброзно-кистозной дегенерацией, инфекций мочевых путей, энтероколита, менингита, наружного отита, инфекций ожоговых ран, вызываемых Pseudomonas aeruginosa.
Микроорганизмы по настоящему изобретению и содержащие их составы обеспечивают доступные средства, с помощью которых можно успешно проводить лечение и/или профилактику этих болезней. Микроорганизмы и/или содержащие их составы могут использоваться в медицине и в частности, как указывалось выше, ветеринарии, для лечения собак, обезьян, кошек, лошадей и грызунов (зайцев, кроликов, хомяков, морских свинок), а также коммерческих животных, таких как куры, свиньи и крупный рогатый скот, овцы, козы, и других домашних и коммерческих животных.
Состав по настоящему изобретению и/или микроорганизмы, их фрагменты, производные или мутанты могут в частности использоваться как пищевые добавки, гигиенические средства, как содержащие микроорганизмы гигиенические средства или фармацевтические препараты. Такие гигиенические средства могут также быть в виде, например, комплектов, которые в дополнение к устройствам или оборудованию для гигиенических процедур, средствам для полоскания, пастам и др. могут также содержать микроорганизмы по настоящему изобретению или содержащие их составы.
Настоящее изобретение также относится к способу идентификации и/или отбора микроорганизмов рода Lactobacillus, обладающих свойствами согласно изобретению, при этом способ содержит по меньшей мере следующие стадии: а) инкубацию образца патогенного микроорганизма, выбранного из Staphylococcus aureus и/или Pseudomonas aeruginosa для получения биопленки, b) добавление исследуемого микроорганизма рода Lactobacillus и инкубациюя образца для образования специфической связи между патогенным микроорганизмом и исследуемым микроорганизмом рода Lactobacillus, с) отделение несвязанных микроорганизмов рода Lactobacillus посредством удаления супернатанта и d) исследование биопленки на наличие связанных и агрегированных микроорганизмов рода Lactobacillus.
В предпочтительном варианте пособ по настоящему изобретению также содержит стадию изучения ингибирования образования биопленки патогенных микроорганизмов. При этом исследуемые микроорганизмы рода Lactobacillus добавлялись во время инкубации патогенного микроорганизма, образующего биопленку. После удаления несвязанных клеток образование биопленки предпочтительно определяли количественно путем измерения оптической плотности, в частности после окрашивания кристаллическим фиолетовым, в сравнении с контрольным образцом, в который исследуемые микроорганизмы не добавлялись.
Очевидно, что в пределах настоящего изобретения вышеуказанные и описанные далее особенности могут использоваться не только в данном конкретном сочетании, но также самостоятельно.
Идея настоящей патентной заявки характеризуется следующими особенностями:
- уход от того, что является обычным в технике,
- указание новой цели,
- наличие срочной необходимости решения проблемы, которая не была решена в течение длительного времени, но решена в изобретении,
- предыдущие неудачные попытки, предпринятые техническим миром,
- простота решения свидетельствует об изобретательском уровне, так как в частности заменяет более сложные идеи,
- развитие научных методов шло в различных направлениях,
- достижение, которое ведет к дальнейшему развитию,
- ошибочные технические концепции, касающиеся решения соответствующих проблем (предубеждение против технического прогресса) таких как усовершенствование, повышение производительности, удешевление, экономия времени, материала, стадии производства, стоимость или сложность получения исходных материалов, повышение надежности, устранение недостатков, повышение качества, отсутствие необходимости обслуживания, более высокая эффективность, высокий выход, увеличение технических возможностей, обеспечение других средств, открытие другого пути, открытие новой области, лучшее решение проблемы, запасные средства, альтернативы, возможность экономии, автоматизация или миниатюризация или расширение ресурсов лекарственных средств,
- счастливая случайность в результате выбора одной конкретной возможности из множества возможностей, результат не мог быть предсказан, поэтому это счастливая случайность, которая может быть запатентована,
- ошибки в технической литературе и/или очень противоречивое изложение предмета изобретения,
- новая область технологии,
- комбинированное изобретение, то есть скомбинированы различные известные элементы, чтобы получить комбинацию, обладающую неожиданным действием,
- выдача лицензий,
- благодарность техническому миру, и
- экономическая эффективность.
В частности, предпочтительные варианты изобретения обладают по меньшей мере
одним или несколькими из вышеуказанных преимуществ.
ПЕРЕЧЕНЬ ЧЕРТЕЖЕЙ
Настоящее изобретение будет пояснено далее на примерах и чертежах с условием, что оно ими не ограничивается.
Фиг. 1 - специфическое связывание и/или агрегация микроорганизмов по одному из иллюстративных вариантов настоящего изобретения (DSM 25906, DSM 25907, DSM 25908) с биопленкой, образованной Staphylococcus aureus (анализ связывания) после трехкратной промывки несвязанных клеток и, для сравнения, дополнительных штаммов Lactobacillus, не входящих в состав настоящего изобретения и не способных связываться с Staphylococcus aureus (штамм 1 Lactobacillus, штамм 2 Lactobacillus, штамм 3 Lactobacillus); количественный анализ связывания и/или агрегации помеченных КФДА (карбоксифлуоресцеин диацетат) штаммов Lactobacillus по настоящему изобретению с биопленкой в 96-луночном планшете для микротитрования на основе измерения флуоресценции (485/535 нм).
Фиг. 2 - специфическое связывание и/или агрегация микроорганизмов по другому из иллюстративных вариантов настоящего изобретения (DSM 25909, DSM 25910, DSM 25911) с биопленкой, образованной Pseudomonas aeruginosa (анализ связывания) после трехкратной промывки несвязанных клеток и, для сравнения, дополнительных штаммов Lactobacillus, не входящих в состав настоящего изобретения и не способных связываться с Staphylococcus aeruginosa (штамм 1 Lactobacillus, штамм 2 Lactobacillus, штамм 3 Lactobacillus); количественный анализ связывания и/или агрегации помеченных КФДА (карбоксифлуоресцеин диацетат) штаммов Lactobacillus по настоящему изобретению с биопленкой в 96-луночном планшете для микротитрования на основе измерения флуоресценции (485/535 нм).
Фиг. 3 - макроскопический контроль специфического связывания микроорганизмов по иллюстративному варианту настоящего изобретения (DSM 25909, DSM 25910, DSM 25911) с клетками Pseudomonas aeruginosa после коагрегации и отдельно штаммы Lactobacillus по настоящему изобретению и штамм-мишень в системе фотодокументирования.
Фиг. 4 - микроскопический контроль специфического связывания микроорганизмов по иллюстративному варианту настоящего изобретения (DSM 25909, DSM 25910, DSM 25911) с клетками Pseudomonas aeruginosa после коагрегации и отдельно штаммы Lactobacillus по настоящему изобретению и штамм-мишень. Микрофотография (фазовый контраст, увеличение 1000×).
Фиг. 5 - макроскопический контроль специфического связывания микроорганизмов по иллюстративному варианту настоящего изобретения (DSM 25906, DSM 25907, DSM 25908) с клетками Staphylococcus aureus после коагрегации и отдельно штаммы Lactobacillus по настоящему изобретению и штамм-мишень в системе фотодокументирования.
Фиг. 6 - микроскопический контроль специфического связывания микроорганизмов по иллюстративному варианту настоящего изобретения (DSM 25906, DSM 25907, DSM 25908) с клетками Staphylococcus aureus после коагрегации и отдельно штаммы Lactobacillus по настоящему изобретению и штамм-мишень. Микрофотография (фазовый контраст, увеличение 1000×).
Фиг. 7 - специфическая агрегация микроорганизмов по иллюстративному варианту настоящего изобретения (DSM 25909, DSM 25910, DSM 25911) с Pseudomonas aeruginosa (DSM 22644), Staphylococcus epidermides (DSM 20044), Corynebacterium jeikeium (DSM 7171) и Micrococcus luteus (DSM 20030) при исследовании коагрегации; количественный анализ агрегации посредством измерения оптической плотности при 600 нм отдельно микроорганизма-мишени, отдельно штаммов Lactobacillus и образцов их коагрегации.
Фиг. 8 - специфическая агрегация микроорганизмов по иллюстративному варианту настоящего изобретения (DSM 25906, DSM 25907, DSM 25908) с Staphylococcus aureus (DSM 18587), Staphylococcus epidermides (DSM 20044), Corynebacterium jeikeium (DSM 7171) и Micrococcus luteus (DSM 20030) при исследовании коагрегации; количественный анализ агрегации посредством измерения оптической плотности при 600 нм отдельно микроорганизма-мишени, отдельно штаммов Lactobacillus и образцов их коагрегации.
Фиг. 9 - специфическая агрегация микроорганизмов по иллюстративному варианту настоящего изобретения (DSM 25906, DSM 25907, DSM 25908), обработанных и необработанных трипсином, со Staphylococcus aureus (DSM 18587) при анализе коагрегации; количественный анализ агрегации посредством измерения оптической плотности при 600 нм отдельно микроорганизма-мишени, отдельно штаммов Lactobacillus и образцов их коагрегации.
Фиг. 10 - специфическая агрегация микроорганизмов по иллюстративному варианту настоящего изобретения (DSM 25906 и DSM 25907) с Staphylococcus aureus (DSM 18587) и Staphylococcus aureus (DSM 20232) при анализе коагрегации; количественный анализ агрегации посредством измерения оптической плотности при 600 нм отдельно микроорганизма-мишени, отдельно штаммов Lactobacillus и образцов их коагрегации.
Фиг. 11 - ингибирование образования биопленки микроорганизмов по иллюстративному варианту настоящего изобретения (DSM 25914 и DSM 25915), где биопленка образована Staphylococcus aureus, после 6 часов инкубации с суспензией Lactobacillus, промытой в ФБС (фосфатно-буферном солевом растворе), термоинактивированной суспензией Lactobacillus и супернатантом термоинактивированной суспензии Lactobacillus, количественный анализ биопленки посредством окрашивания кристаллическим фиолетовым в 96-луночном планшете для микротитрования и измерения оптической плотности при 590 нм.
Фиг. 12 - ингибирование образования биопленки микроорганизмов по иллюстративному варианту настоящего изобретения (DSM 25912 и DSM 25913), где биопленка образована Pseudomonas aeruginosa, после 6 часов инкубации с суспензией Lactobacillus, промытой в ФБС (фосфатно-буферном солевом растворе), термоинактивированной суспензией Lactobacillus и супернатантом термоинактивированной суспензии Lactobacillus; количественный анализ биопленки посредством окрашивания кристаллическим фиолетовым в 96-луночном планшете для микротитрования и измерения оптической плотности при 590 нм.
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Пример 1
Для идентификации и отбора микроорганизмов по настоящему изобретению различные штаммы из банка штаммов Lactobacillus тестировались с помощью четырехстадийного процесса скрининга, в котором они сначала проверялись на способность связываться с патогенными микроорганизмами кожи (далее упоминаемьми как "микроорганизмы-мишени") (анализ связывания), а затем штаммы, определенные на первой стадии, тестировались в анализе коагрегации в масштабе планшета для микротитрования, при этом коагрегация с соответствующим организмом-мишенью оценивалась качественно с помощью бинокулярного стереомикроскопа. Кроме того, изучалась степень коагрегации, а также стабильность связывания с микроорганизмом-мишенью, что в конечном итоге привело к идентификации микроорганизмов по настоящему изобретению (Lactobacillus)
Анализ связывания
С целью количественного определения связывающей активности выбранных штаммов Lactobacillus был разработан анализ связывания, позволяющий количественно определять связывание штаммов Lactobacillus с патогенными микроорганизмами в 96-луночном планшете. Связывающая активность клеток Lactobacillus с организмами-мишенями коррелирует с коагрегационной активностью и/или коагрегационной способностью. Это проверено экспериментально. В связи с этим, на фиг. 2 показан пример коагрегации штаммов Lactobacillus DSM 25909, DSM 25910, DSM 25911 с Pseudomonas aeruginosa DSM 22644, а на фиг.1 показаны штаммы Lactobacillus DSM 25906, DSM 25907, DSM 25908 и Staphylococcus aureus DSM 22644.
Способ измерения основан на специфическом связывании штаммов по настоящему изобретению со штаммом-мишенью в биопленке. Для анализа заданные количества штаммов по настоящему изобретению помечались флуоресцентным красителем (раствором КФДА (карбоксифлуоресцеин диацетат) компании Invitrogen) и смешивались с заданным количеством организмов-мишеней, связанных в биопленку. После многократной промывки измеряли послесвечение связанных со штаммом-мишенью штаммов по настоящему изобретению с помощью флуоресцентного фотометра.
Для проведения данных экспериментов микроорганизмы-мишени Pseudomonas aeruginosa (DSMZ 22644) и Staphylococcus aureus (DSMZ 18587) культивировали стандартными способами с использованием ТСБ (триптиказо-соевого бульона) для Pseudomonas aeruginosa и ТСД (среды на основе триптиказо-соевого бульона с дрожжевым экстрактом) для Staphylococcus aureus.
Штаммы Lactobacillus культивировали в анаэробных условиях в среде MRS при 37°C(de Man etal., 1960).
Для подготовки микроорганизмов-мишеней клетки собирали после начала стационарной фазы роста, три раза промывали в фосфатно-буферном солевом растворе (ФБС, рН 7,4) и помещали в ФБС. Затем 100 мкл суспензии помещали в каждую лунку 96-луночного планшета для микротитрования
Во время 6-часовой инкубации в аэробных условиях штаммы-мишени образовывали биопленку. После инкубации несвязанные клетки удаляли посредством трехкратной промывки фосфатно-буферным солевым раствором (ФБС, рН 7,4).
Для подготовки штаммов Lactobacillus после культивирования в течение 24 часов их собирали и три раза промывали с помощью ФБС, помещали в ФБС и флуоресцентно метили добавлением раствора КФДА (карбоксифлуоресцеин диацетат) (Invitrogen).
Для проведения анализа связывания в каждую лунку к штамму-мишени, связанному в биопленке, добавляли 100 мкл суспензии Lactobacillus. Параллельно готовились контрольные образцы, в которые суспензия Lactobacillus не добавлялась. После инкубации в течение 1 часа при 30°С в инкубаторе и отделения несвязанных клеток образцы три раза промыли в ФБС. После каждого промывания измеряли флуоресценцию в планшетном фотометре-флуориметре (Em (возбуждение) 485 nm/Ех (излучение) 535 nm).
Увеличение флуоресценции (Em 485 nm/Ex 535 nm) в образцах, содержащих штаммы Lactobacillus, по сравнению с контрольными образцами, не содержащими клетки Lactobacillus, коррелировало с количеством клеток Lactobacillus, связанных с биопленкой. Измеренная после связывания клеток Lactobacillus флуоресценция соответствовала интенсивности связывания. Чем выше эта величина, тем лучше связывание помеченных клеток Lactobacillus со штаммами-мишенями, связанными в биопленку, и тем выше связывающая активность тестируемых клеток Lactobacillus.
Эксперименты показали, что в анализе связывания тестируемых штаммов Lactobacillus после удаления несвязанных клеток и трехкратной промывки флуоресценция увеличилась в 3-17 раз в результате связывания помеченных клеток Lactobacillus с организмами-мишенями/штаммами-мишенями Pseudomonas aeruginosa и/или Staphylococcus aureus, содержащимися в биопленке. В качестве примера для микроорганизмов по настоящему изобретению, на фиг. 2 показаны результаты анализа связывания Lactobacillus DSM 25909, DSM 25910 и DSM 25911 с Pseudomonas aeruginosa, а на фиг. 1 - DSM 25906, DSM 25907 и DSM 25908 с Staphylococcus aureus. Кроме того, на фиг. 1 и 2 для сравнения показаны данные для штаммов Lactobacillus, не входящих в состав настоящего изобретения (штаммы 1 и 2 Lactobacillus), которые не способны специфически связываться с организмами-мишенями.
Пример 2
Анализ коагрегации
Следующая проверка в емкости 0,8 мл и/или 24-луночном планшете использовалась для иллюстрации коагрегационной активности выбранных штаммов Lactobacillus.
В данном методе коагрегационные свойства Lactobacillus и штамма-мишени изучались отдельно, а в конце изучалась коагрегация Lactobacillus и штамма-мишени после их смешивания. Этот анализ проводился как макроскопически с использованием фотографий 24-луночного планшета, так и при помощи микроскопа.
Для проведения данных тестов микроорганизмы-мишени Pseudomonas aeruginosa (DSMZ 22644) и Staphylococcus aureus (DSMZ 18587) культивировались согласно стандартным протоколам с использованием ТСБ (триптиказо-соевого бульона) для Pseudomonas aeruginosa и ТСД (среды на основе триптиказо-соевого бульона с дрожжевым экстрактом) для Staphylococcus aureus.
Штаммы Lactobacillus культивировались в анаэробных условиях при 37°С в среде MRS (de Man et al., 1960).
Для исследования микроорганизмов-мишеней после 16 часов клетки собирали, три раза промывали с помощью фосфатно-буферного солевого раствора (ФБС, рН 7,4) и доводили концентрацию до OD600=4 (оптическая плотность при 600 нм)
Для исследования штаммов Lactobacillus после 16 часов их собирали, три раза промывали с помощью ФБС, а затем помещали в емкость с ФБС, при этом их концентрация доводилась до OD600=8.
Для проведения анализа коагрегации 400 мкл помеченных микроорганизмов-мишеней помещали в каждую лунку 24-луночного планшета вместе с 400 мкл суспензии Lactobacillus. Параллельно приготовили контрольные образцы, содержащие 400 мкл соответствующего организма-мишени и 400 мкл ФБС (контрольный образец 1) или 400 мкл соответствующей суспензии Lactobacillus и 400 мкл ФБС (контрольный образец 2). После инкубации в течение 30 минут при 25°С на настольном перемешивающем устройстве образцы изучались макроскопически с помощью системы фотодокументирования, а также с помощью микроскопа посредством переноса 3 мкл из центра каждой лунки на предметное стекло микроскопа.
Для количественного анализа коагрегации образовавшиеся коагрегаты отделяли путем центрифугирования (10 сек, 300 г). Затем 10 мкл супернатанта перемещали в 96-луночный плоскодонный планшет и в планшетном фотометре измеряли оптическую плотность при 600 нм.
Для расчета коагрегационной активности в процентах использовалась следующая формула:

Для вычисления коагрегационной активности в процентах использовались оптическая плотность (OD) микроорганизма-мишени, штаммов Lactobacillus и образцов коагрегации.
Эксперименты показали, при при коагрегации в смеси из выбранных штаммов Lactobacillus с микроорганизмами-мишенями/штаммами-мишенями Staphylococcus aureus и/или Pseudomonas aeruginosa происходит образование комков (агрегатов), которые можно видеть макроскопически в виде темных областях в лунках. В лунках, содержащих отдельно штаммы-мишени и/или штаммы Lactobacillus по настоящему изобретению, агрегаты не образовывались. Это можно видеть по отсутствию темных областей в лунке. На фиг. 5 показаны макроскопические результаты в образцах коагрегации выбранных штаммов Lactobacillus и микроорганизма-мишени/штамма-мишени Staphylococcus aureus, а на фиг. 3 показаны результаты для штамма-мишени Pseudomonas aeruginosa. При наблюдении с помощью микроскопа у всех штаммов Lactobacillus по настоящему изобретению обнаружено определенное сродство к соответствующим штаммам-мишеням, что приводит к различному размеру коагрегатов, наблюдаемых в микроскопе при изучении коагрегации. На фиг. 4 показаны результаты микроскопического изучения образцов коагрегации выбранных штаммов Lactobacillus с микроорганизмами-мишенями/штаммами-мишенями Pseudomonas aeruginosa, а на фиг. 6 - и/или с Staphylococcus aureus.
Пример 3
Далее были проведены эксперименты, показывающие влияние протеаз на штаммы Lactobacillus по настоящему изобретению и их агрегационные свойства по отношению к микроорганизмам-мишеням.
Штаммы Lactobacillus по настоящему изобретению и штаммы-мишени были подготовлены, как описано в Примере 2.
Штаммы Lactobacillus по настоящему изобретению обработали протеазами, как показано в настоящем описании на примере трипсина. После подготовки штаммов Lactobacillus их обработали трипсином при 37°С в течение 60 минут (12,4 единиц/мг, Sigma). Затем клетки снова дважды промыли ФБС и количественно определили агрегационные свойства, как описано в Примере 2.
Данные эксперименты показали, что после обработки протеазой агрегация штаммов Lactobacillus по настоящему изобретению составляет 50-76% в анализе коагрегации с микроорганизмом-мишенью/штаммом-мишенью Pseudomonas aeruginosa и/или Staphylococcus aureus. В качестве примера, на фиг. 9 показаны результаты анализа коагрегации Lactobacillus DSM 25906, DSM 25907 и DSM 25908 по настоящему изобретению, обработанных и необработанных трипсином, с Staphylococcus aureus.
Пример 4
Были проведены эксперименты с дополнительными комменсальными микроорганизмами кожи, чтобы показать специфичность агрегационных свойств штаммов Lactobacillus по настоящему изобретению по отношению к микроорганизмам-мишеням. Были выбраны Staphylococcus epidermides (DSM 20044), Corynebacterium jeikeium (DSM 7171) и Micrococcus luteus (DSM 20030). Штаммы Lactobacillus по настоящему изобретению и микроорганизмы-мишени культивировались и изучались, как описано в Примере 2.
Для проведения этих тестов все исследуемые микроорганизмы-мишени, то есть Pseudomonas aeruginosa (DSMZ 22644), Staphylococcus aureus (DSMZ 18587), Staphylococcus epidermides (DSM 20044), Corynebacterium jeikeium (DSM 7171) и Micrococcus luteus (DSM 20030), культивировались в соответствии со стандартными протоколами с использованием ТСБ (триптиказо-соевого бульона) для Pseudomonas aeruginosa и ТСД (среды на основе триптиказо-соевого бульона с дрожжевым экстрактом) для Staphylococcus aureus (DSMZ 18587), Staphylococcus epidermides (DSM 20044), Corynebacterium jeikeium (DSM 7171) и Micrococcus luteus (DSM 20030).
Обработка штаммов-мишеней и анализ коагрегации проводились, как описано в Примере 2.
Эксперименты показали, что агрегация штаммов Lactobacillus по настоящему изобретению с исследуемьми дополнительными штаммами-мишенями не происходит, наоборот, наблюдалась высокая специфичность. На фиг. 8 показаны результаты анализа коагрегации Lactobacillus DSM 25906, DSM 25907 и DSM 25908 с Staphylococcus aureus, а на фиг.7 показаны результаты для Lactobacillus DSM 25909, DSM 25910 и DSM 25911 с Pseudomonas aeruginosa.
Пример 5
Кроме того, были проведены тесты с другими микроорганизмами кожи того же рода и вида с целью определения связывающей способности и/или агрегационной способности штаммов Lactobacillus по настоящему изобретению по отношению к микроорганизмам-мишеням того же рода и вида. Для этой цели, чтобы с помощью теста подтвердить их агрегационную способность по отношению к микроорганизмам-мишеням, был выбран Staphylococcus aureus (DSMZ 20232).
Для этого штаммы Lactobacillus по настоящему изобретению и микроорганизмы-мишени культивировали и изучали, как описано в Примере 2.
Для проведения этих тестов все исследуемые микроорганизмы-мишени, а именно в данном примере Staphylococcus aureus (DSMZ 18587) и Staphylococcus aureus (DSMZ 20232), культивировались в соответствии со стандартными протоколами с использованием ТСД (среды на основе триптиказо-соевого бульона с дрожжевым экстрактом).
Обработку штаммов-мишеней и анализ коагрегации проводили, как описано в Примере 2.
Данные эксперименты показали, что штаммы Lactobacillus по настоящему изобретению способны связываться и/или агрегировать также с другими микроорганизмами того же рода и вида. На фиг. 10 показаны результаты анализа коагрегации Lactobacillus DSM 25906 и DSM 25907, используемых в качестве примера микроорганизмов по настоящему изобретению, со Staphylococcus aureus DSMZ 18587 и DSMZ 20232.
Пример 6
Ингибирование биопленки
Для идентификации и отбора микроорганизмов по настоящему изобретению, путем скрининга в масштабе микротитрационного планшета исследовались различные штаммы из банка Lactobacillus. Целью скрининга было определение возможности предотвращения образования биопленки патогенными микроорганизмам кожи (также упоминаемыми в настоящем описании как "микроорганизмы-мишени"). Степень проявления способности предотвращать образование биопленки количественно сравнивали со способностью микроорганизмов-мишеней образовывать биопленку, когда на них не оказывается никакого влияния, и анализировали, и таким образом идентифицировали микроорганизмы по настоящему изобретению {Lactobacillus).
Для изучения действия штаммов Lactobacillus и/или их фракций на образование биопленки патогенными микроорганизмами-мишенями Staphylococcus aureus (DSM 18587) или Pseudomonas aeruginosa (DSM 22644), их добавляли непосредственно к микроорганизмам-мишеням в начале образования биопленки и инкубировали 6 или менее часов. После того как несвязанные клетки удалили, а биопленку дважды промыли с помощью ФБС, биопленку измеряли путем окрашивания всего образца кристаллическим фиолетовьм и последующего измерения оптической плотности.
Для проведения этих тестов штаммы-мишени культивировали согласно стандартному протоколу, как описано выше, а штаммы Lactobacillus культивировали в анаэробных условиях на среде MRS (Мозера-Рогоза-Шарпа).
Для подготовки штаммов Lactobacillus, их дважды промывали с помощью ФБС и помещали в ФБС.
После промывки с помощью ФБС некоторые из штаммов Lactobacillus были термоинактивированы посредством пастеризации в течение 30 минут при 70°С.
Кроме того, часть из термоинактивированных штаммов Lactobacillus использовали для получения супернатантов после промывки с помощью ФБС. Для этого проводили центрифугирование суспензии, а затем использовали супернатанты.
Для подготовки штаммов-мишеней их культивировали и накапливали до наступления средней фазы экспоненциально роста, а затем их концентрацию довели до OD600нм(мл-1)=3.5, дважды промыли с помощью ФБС и поместили в ФБС.
Для проведения анализа образования биопленки штаммы Lactobacillus добавили непосредственно к микроорганизмам-мишеням в начале образования биопленки и инкубировали в анаэробных условиях при 37°С в течение 6 часов. Параллельно обрабатывались контрольные образцы, в которые суспензия Lactobacillus не добавлялась. После удаления планктонных клеток и промывки биопленки ее количество определяли путем окрашивания кристаллическим фиолетовым (0,1%, Merck) связанных микроорганизмов-мишеней с или без Lactobacillus и/или фракциями Lactobacillus. Для этого связанные клетки соответствующих образцов после окрашивания кристаллическим фиолетовым растворяли с использованием уксусной кислоты, а затем помещали в суспензию и измеряли оптическую плотность при 590 нм. Уменьшение оптической плотности при 590 нм по сравнению с контрольными образцами микроорганизмов-мишеней, в которых отсутствовали лактобактерии, коррелировало со способностью препятствовать образованию биопленки. Данное уменьшение представлено как выраженное в процентах ингибирование образования биопленки по отношению к микроорганизмам-мишеням без лактобактерии. В качестве примера организмов по настоящему изобретению, на фиг. 11 показаны результаты ингибирование биопленки Staphylococcus aureus штаммами Lactobacillus DSM 25914 и DSM 25915, а на фиг. 12 - биопленки Pseudomonas aeruginosa штаммами DSM 25912 и DSM 25913. Эксперименты показали, что ингибирование образования биопленки Staphylococcus aureus и/или Pseudomonas aeruginosa штаммами Lactobacillus no настоящему изобретению составляет 56-93% при инактивации метаболической активности штаммов Lactobacillus и/или их фракций или без нее.
В приведенных экспериментах и примерах показан только отбор предпочтительных микроорганизмов, при котором общие полезные свойства всех предпочтительных микроорганизмов были подтверждены экспериментально. Из приведенных примеров и чертежей специалистам будет понятно, как воспроизвести настоящее изобретение и, например, воспроизвести общие полезные свойства предпочтительных микроорганизмов.
Ссылки
Davies СЕ, Hili KE, Wilson MJ, Stephens P, Hili CM, Harding KG and Thomas DW (2004)
Use of 16S ribosomal DNA PCR and denaturing gradient gel electrophoresis for analysis of the microfloras of healing and nonhealing chronic venous leg ulcurs. JClin Microbiol 42, 3549-57.
Fux, CA, Costerton, JW, Stewart, PS, Stoodley P (2005) Survival strategies of infectious biofilms. Trends in Microbiology 13, 34-40.
James Т, Hughes MA, Cherry GW, Taylor RP. Evidence ofoxidative stress in chronic venous ulcers. Wound Repair Regen 2003; 11 (3): 172-6.
James GA, Swogger E, Wolcott R, Pulcini E, Secor P, Sestrich J, Costerton JW, Stewart PS (2008) Biofilms in chronic wounds. Wound Repair Regen 16,37-44.
Kirketerp-Møller К, Jensen P∅, Fazli M, Madsen KG, Pedersen J, Moser, C, Tolker-Nielsen, T, Høiby N, Givskov M, and Bjamsholt Т (2008) Distribution, Organization, and Ecology of Bacteria in Chronic Wounds. J Clin Microbiol 46, 2717-2722.
Mast BA, Schultz GS. Interactions ofcytokines, growth factors, and proteases in acute and chronic wounds. Wound Repair Regen 1996; 4(4): 411-20.
Moseley R, Hilton JR, Waddington RJ, Harding KG, Stephens P, Thomas DW. Comparison ofoxidative stress biomarker profiles between acute and chronic wound environments. Wound Repair Regen 2004; 12(4): 419-29.
Sheldon AT (2005) Antiseptic "resistance": real or perceived threat? Clin. Infect. Dis. 40, 1650-1656.
Julia Bidder, M RSA, http://www.focus.de/gesundheit/arzt-klinik/klinik/tid-9019/mrsa-krank-durch-die-klinik_aid_262385.html, 26.02.2010
Bingham R.J.; Rudino-Pinera E.; Meenan N.A. G.; Schwarz-Linek U.; Turkenburg J.P.; Hook M.; Garman E.F.; Potts J.R. Proc. Natl. Acad. Sei. U.S.A. 2008, 105, 12254-12258.
O’Neill E.; Pozzi C.; Hauston P.; Humphreys H.; Robinson D.A.; Loughman A.; Foster T.J.; O’Gara J.P. J. Bacteriol. 2008, 190, 3835-3850.
de Man et al., (1960) "A medium for the Cultivation of Lactobacilli", J. Appl. Bact. 23 (130-135)
Реферат
Изобретение относится к вариантам штамма молочнокислых бактерий рода Lactobacillus и применению указанных штаммов. Предложен штамм молочнокислых бактерий рода Lactobacillus DSM 25906, штамм молочнокислых бактерий рода Lactobacillus DSM 25907, штамм молочнокислых бактерий рода Lactobacillus DSM 25908, штамм молочнокислых бактерий рода Lactobacillus DSM 25914, штамм молочнокислых бактерий рода Lactobacillus DSM 25915. Указанные штаммы коагрегируют по меньшей мере с одним патогенным микроорганизмом Staphylococcus aureus. Предложенные штаммы по отдельности или в комбинации могут быть использованы в антибактериальных составах против Staphylococcus aureus. Указанные составы могут быть применены для получения фармацевтического препарата или медицинского продукта для лечения или профилактики кожных заболеваний и заболеваний подкожной ткани, вызванных Staphylococcus aureus, или для получения чистящего или дезинфицирующего средства для обработки поверхностей против Staphylococcus aureus, или для получения продукта против Staphylococcus aureus, используемого в области гигиены тела, медицинских препаратов и профилактики, или для получения лосьона, взбалтываемой смеси, порошка, гидрогеля, крема, препарата типа "cresa", мази, жирной мази или пасты для нанесения на поверхность кожи, или для получения антибактериальной добавки, обладающей специфическим действием против Staphylococcus aureus для местного лечения кожных инфекций и ускорения заживления хронических ран. Указанные штаммы по отдельности или в комбинации или указанные составы могут быть использованы в составе комплекта для гигиенической обработки против Staphylococcus aureus. Предложен также способ идентификации и/или отбора указанной молочнокислой бактерии, обладающей свойством коагрегации с Staphylococcus aureus. 14 н. и 21 з.п. ф-лы, 12 ил., 6 пр.

Комментарии