3-замещенные оксиндольные производные в качестве модуляторов калийных каналов, фармацевтическая композиция, способ лечения - RU2165925C2
Код документа: RU2165925C2
Чертежи








Описание
Данная заявка частично продолжает заявку США N 08/477047, поданную 7 июня 1995 года, которая полностью включена в описание.
Настоящее изобретение касается новых замещенных 3-фенилоксиндольных производных, которые являются модуляторами кальций-активируемых калийных каналов большой проводимости (Макси-К) и поэтому используются для защиты нейронных клеток, особенно при лечении или профилактике ишемического удара. Настоящее изобретение также обеспечивает способ лечения новыми оксиндольными производными и их фармацевтические составы.
Калийные каналы играют ключевую роль в регуляции клеточного мембранного потенциала и модуляции клеточной возбудимости. Калийные каналы главным образом регулируются напряжением, клеточным метаболизмом и рецепторно-опосредованными процессами [Cook, N.S., Trends in Pharmacol. Sciences (1988), 9, 21; Quast, U., et al, Trends in Pharmacol. Sciences (1989), 10, 431]. Кальций-активируемые калийные каналы (KCa) являются широкой группой ионных каналов, которые используют в своей деятельности зависимость от внутриклеточных ионов кальция. Деятельность KCa-каналов регулируется внутриклеточными [Ca2+] , мембранным потенциалом и фосфорилацией. На основе их одноканальных проводимостей в симметрических растворах K+KCa-каналы делятся на три подкласса: высокой проводимости (макси-K) > 150 pS; средней проводимости 50-150 pS; малой проводимости < 50 pS. Кальций-активируемые калийные каналы высокой проводимости (Макси-K) присутствуют во многих возбуждаемых клетках, включая нейроны, сердечные клетки и различные типы гладких мышечных клеток [Singer, J. et al., Pflugers Archiv. (1987) 408, 98; Baro, I., et al., Pflugers Archiv. (1989) 414 (Suppl. 1), S168; Ahmed, F. et al., Br.J. Pharmacol. (1984) 83, 227].
Ионы калия играют главную роль в управлении остаточным мембранным потенциалом в большинстве возбудимых клеток и поддерживают трансмембранное напряжение около равновесного потенциала K+(Ek) порядка - 90 мВ. Было показано, что открытие калийных каналов сдвигает клеточный мембранный потенциал к равновесному калийному мембранному потенциалу (Ek), приводя к гиперполяризации клетки [Cook, M.S., Trends in Pharmacol. Sciences (1988), 9, 21]. Гиперполяризованные клетки проявляют пониженную реакцию на потенциально разрушающие дополяризационные раздражители. Макси-K-каналы, которые регулируются обоими напряжениями и внутриклеточными ионами Ca2+, действуют, ограничивая деполяризацию и поступление кальция, и могут быть особенно эффективны при блокировании разрушающих раздражителей. Поэтому клеточная гиперполяризация путем открытия Макси-K-каналов может привести к защите нейронных клеток в условиях ишемии.
Сообщалось о ряде синтетических и встречающихся в природе соединений, способных открывать Макси-K-каналы. Avena-пирон, экстрагированный из овсов avena-sativa с использованием липидной двухслойной методики, оказался агентом, открывающим макси-K-канал [Межд. заявка WO 93/08800, опубл. 13 мая 1993] . В качестве агента, открывающего макси-K-канал, вместе с очень ограниченными электрофизиологическими опытами был описан 6-бром-8-(метиламино)имидазо[1,2-a]пиразин-2-карбонитрил (SCA-40) [Laurent, F. et al. Br. J. Pharmacol. (1993) 108, 622-626]. Было найдено, что флавонид флоретин увеличивает открывающую способность кальций-активируемых калийных каналов миелинированных нервных волокон Xenopus laevis [Koh, D-S., et al., Neuroscience Lett. (1994) 165, 167-170].
Ряд замещенных оксиндолов был описан в качестве невроанаболических агентов [Kuch, H. et al., пат. США N 4542148 выд. 17 сентября 1985 и 4614739 выд. 30 сентября 1986].
В европейской заявке EP-477819, опубл. 4 января 1992 и соответствующем пат. США N 5200422, выд. 6 апреля 1993 Оллесену с сотр. в качестве агентов, открывающих макси-K-каналы, описан ряд производных бензимидазола с использованием одноканального и полноклеточного опытов на гладких мышечных клетках аорты. О дальнейших работах сообщалось в Olesen et al., European J. Pharmacol. (1994) 251, 53-59.
В настоящее время ишемический удар стоит на третьем месте в ряду причин взрослой инвалидности и смерти в США и Европе. За последнее десятилетие появились некоторые терапевтические методы минимизации обусловленных ударом повреждений мозга с использованием ингибиторов AMPA/каината, N-метил-D-аспартата (NMDA) и ингибиторов повторного всасывания аденозина. Объектом данного изобретения являются новые соединения, способные модулировать калийные каналы, которые могут применяться для снижения повреждения нейронов при ишемическом ударе.
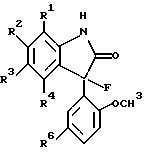
Настоящее изобретение обеспечивает новые оксиндольные производные общей формулы

где R, R1, R2, R3, R4, R5 и R6 определены ниже или их нетоксичные фармацевтически приемлемые соли, сольваты или гидраты, которые открывают кальций-активируемые K+-каналы высокой проводимости, известные как макси-K или BK-каналы. Настоящее изобретение также обеспечивает фармацевтические составы, включающие указанные оксиндольные производные, и способ лечения расстройств, чувствительных к активности открытия калийных каналов, таких, как ишемия, судороги, астма, недержание мочи и травматическое поражение мозга.
Настоящее изобретение относится к новым оксиндольным производным, которые являются потенциальными агентами, открывающими
кальций-активируемые K+-каналы высокой проводимости (BK-каналы), и имеющими формулу

где R - это водород, гидроксил или фтор;
R1, R2, R3 и
R4 - каждый - это независимо водород, C1-4алкил, галоген, трифторметил, фенил, п-метилфенил или п-трифторметилфенил; или R1 и R2, R2 и R3, или R3 и R4 - взятые вместе образуют бензольное кольцо;
R5 - это водород или C1-4алкил; и
R6 - это хлор или трифторметил;
или их нетоксичные фармацевтически приемлемую соль, сольват или гидрат.
Настоящее изобретение также обеспечивает способ лечения или смягчения расстройств, связанных с BK-каналами, особенно ишемии, судорог, астмы, недержания мочи и травматического поражения мозга, который включает введение совместно с подходящим наполнителем, носителем или разбавителем терапевтически эффективного количества соединения формулы I или его нетоксичных фармацевтически приемлемую соль, сольвата или гидрата.
Термин "C1-4алкил", употребляемый здесь и в формуле изобретения (если это не оговорено особо), означает алкильную группу с нормальной или разветвленной цепью, такую как метил, этил, пропил, изо-пропил, бутил, изо-бутил, трет-бутил. Предпочтительно, эти группы содержат от 1 до 2 атомов углерода. Если это не оговорено особо, термин "галоген", употребляемый здесь и в формуле изобретения, включает бром, хлор, иод и фтор, тогда как термин "галогенид" включает бромид, хлорид и иодид-анион.
Так как соединения по настоящему изобретению могут иметь асимметрический атом углерода в положении 3 оксиндольного кольца, то настоящее изобретение включает рацемат, равно как и индивидуальные энантиомерные формы соединения формулы I, описанного здесь и в формуле изобретения. Использование единственного обозначения, такого, как (3R) или (3S), включает только один стереоизомер. Смеси изомеров могут быть разделены на индивидуальные изомеры согласно известным методам, например фракционной кристаллизацией, адсорбционной хроматографией или другими подходящими способами разделения. Полученные рацематы могут быть разделены на антиподы обычным способом после введения подходящих солеобразующих группировок, например путем образования смеси диастереомерных солей с оптически активными солеобразующими агентами, разделения смеси диастереомерных солей и превращения разделенных солей в свободные соединения. Возможные энантиомерные формы также могут быть разделены фракционированием на жидкостных хроматографических колонках высокого давления с хиральной фазой. Альтернативно, оптически активные энантиомеры соединений формулы I могут быть получены стереоселективными синтетическими способами; некоторые из них здесь описаны. Использование оптически активных реагентов в сочетании с подходящими промежуточными продуктами, описанными здесь, может привести к требуемому энантиомеру соединения формулы I.
Термин "нетоксичная фармацевтически приемлемая соль", употребляемый здесь и в формуле изобретения, включает нетоксичные основные аддитивные соли с неорганическими основаниями. Подходящими неорганическими основаниями являются щелочи и основания, содержащие щелочноземельные металлы, включающие катионы металлов, таких, как натрий, калий, магний, кальций и им подобные.
Некоторые соединения по настоящему изобретению могут существовать в несольватированных формах, равно как и в сольватированных формах, включая гидратированные формы, такие, как моногидрат, дигидрат, гемигидрат, тригидрат, тетрагидрат и подобные. Продукты могут быть истинными сольватами, тогда как в других случаях продукты могут просто содержать добавочный сольвент или быть смесью сольвата и добавочного сольвента. Для специалиста в данной области было бы желательно, чтобы сольватированные формы были эквивалентны несольватированным формам и охватывались настоящим изобретением.
В способе по данному изобретению термин "терапевтически эффективное количество" означает общее количество каждого активного компонента в способе, которое является достаточным для заметного улучшения состояния пациента, т. е. лечения острых явлений, характеризуемого открывающими агентами кальций-активируемых K-каналов высокой проводимости или увеличением скорости лечения таких явлений. Применительно к индивидуальному активному ингредиенту, вводимому отдельно, термин относится к одиночному ингредиенту. Применительно к комбинации термин относится к объединенным количествам активных ингредиентов, приводящих к терапевтическому эффекту, вводимым в комбинации постепенно или одновременно. Термины "лечить, лечащий, лечение", как они употребляются здесь и в формуле изобретения, означают предотвращение или уменьшение заболеваний, повреждения тканей и/или симптомов, связанных с дисфункцией клеточной мембранной поляризуемости и проводимости.
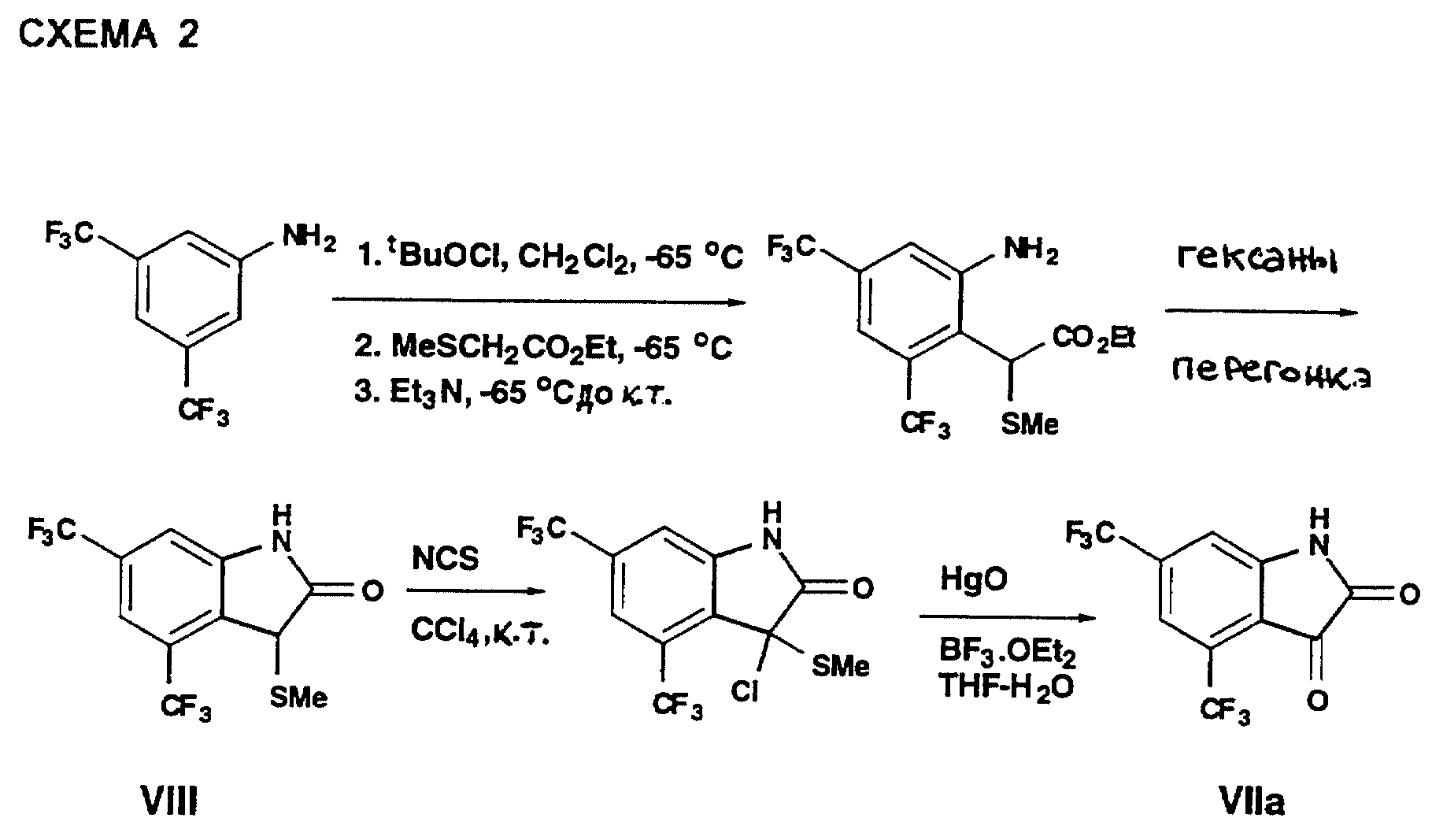
Соединения формулы I могут быть получены различными способами, такими, как показаны в приведенных здесь примерах, схемах реакций и различными другими, очевидными специалисту в данной области. Различные оксиндольные производные формулы I могут с успехом быть получены из изатиновых промежуточных продуктов, которые хорошо известны, общим методом, показанным на Схеме 1 и в особом примере на Схеме 2.
В способе получения изатиновых промежуточных продуктов формулы VII может использоваться ряд известных и хорошо изученных методов, такие, как описанные в Sandmeyer, T., Helv. Chim. Acta 2, 234 (1919); Stolle, R., J. Pr. Chem. 105, 137 (1922) и Gassman, P. , et al., J. Org. Chem., 42, 1344, (1977). Однако более предпочтительным методом получения изатинов формулы VII, исходя из соответствующим образом замещенных анилинов формулы V, является описанный в Hawawasam, P., et al., Tetrahedron Lett., 35, 7303 (1994) и показанный на Схеме 1. Этот метод является нечувствительным к электронной природе заместителей в ароматическом кольце и отличается предсказуемым региохимическим контролем.
Было бы желательно, чтобы аминогруппа анилинового соединения формулы V была бы подходящим образом защищена N-пивалоильной и N-(трет-бутокси)карбонильной группами для прямого металлирования в o-положение. При образовании дианионов можно использовать реакцию с примерно 1,2 эквивалентами диэтилоксалата при низких температурах, например -78oC для введения α-кетоэфирного заместителя в o-положение к защищенной аминогруппе анилинового производного с образованием соединения формулы VI. Удаление защитной группы с последующей самопроизводной циклизацией с успехом приводит к изатину формулы VII. Далее по Схеме 1 дианионы N-пивалоил-анилинов или N-(трет-бутокси)карбониланилинов с успехом получаются при использовании порядка 2,2-2,4-кратного избытка различных бутиллитиевых реагентов, таких, как н-бутил, втор-бутил и трет-бутиллитиевые реагенты в ТГФ при температуре от 0 до -40oC в течение от 2 до 7 часов.
В обычном способе к раствору дианиона при размешивании в токе азота при -78oC добавляют 1,2 эквивалента сухого диэтилоксалата. После перемешивания в течение 30-45 минут реакцию прекращают 1 н. HCl и разбавляют эфиром для получения соединения формулы VI. Хотя промежуточный α-кетоэфирный продукт формулы VI может быть очищен в целях описания, этот шаг не является необходимым, и с сырого продукта успешно может быть снята защита, давая изатин с великолепным общим выходом. Снятие N-(трет-бутокси)карбонильной или пивалоильной защиты можно проводить с использованием 3н. HCl/ТГФ или 12 н. HCl/ДМЭ соответственно при температуре кипения. После удаления летучих растворителей изатины обычно осаждают из водных растворов и выделяют фильтрованием.
Альтернативный метод получения изатинов для получения 4,6-бис(трифторметил)изатина формулы VIIa с использованием метода Гассмана с сотр. показан на Схеме 2.
Как показано на Схеме 2 N-хлорирование 3,5-бис(трифторметил)анилина свежеприготовленным трет-бутилгипохлоритом с последующим добавлением этил(метилтио)ацетата и триэтиламина дает аминоэфир, который при нагревании в кипящих гексанах подвергается циклизации с образованием (метилтио)индолона формулы VIII. Хлорирование соединения формулы VIII N-хлорсукцинимидом (ХСИ) дает соответствующий α-хлор(метилтио)индолон, который при гидролизе с HgO-BF3·Et2O в ТГФ-H2 O дает требуемый изатин формулы VIIa.
Изатины формулы VII, полученные описанными выше способами по Схеме 1 и 2 или хорошо известными из литературы способами, превращают в гидроксииндолоны формулы IIa и IIb, как показано на Схеме 3. Добавление раствора реактива Гриньяра либо ариллития в ТГФ, полученного in situ из анизола, к натриевой соли изатина формулы VII, подходящим образом полученной с NaH в ТГФ, дает требуемые гидроксииндолоны формулы IIa. Большинство гидроксииндолонов очищают либо перекристаллизацией, либо обработкой подходящими органическими растворителями. Деметилирование метилового эфира соединения формулы IIa BBr3 в CH2Cl2 в тщательно контролируемых условиях от -78oC до 0oC дает требуемые фенолы формулы IIb. Было найдено, что не следует нагревать реакционную массу выше 0oC, а по завершении реакции следует нейтрализовать массу насыщенным раствором NaHCO3, после чего подкислить разбавленной HCl перед экстракцией органическим растворителем с образованием гидроксииндолонов формулы IIb.
Альтернативный прямой способ получения гидроксииндолонов формулы IIb реализуется при добавлении к изатинам формулы VII фенолятов магния, как это показано на Схеме 4.
В отличие от процесса, описанного Схемой 3, включающего реакцию присоединения реактива Гриньяра с последующим деметилированием полученного метилового эфира, свободный фенол формулы IIb прямо получается по этому альтернативному пути. Способ по Схеме 4, который включает реакцию фенолятов магния, полученных смешением требуемого фенола и этилмагнийбромида с изатинами формулы VII в метиленхлориде, толуоле или ДМФА дает требуемый гидроксииндолон формулы IIb. Далее было найдено, что ряд электронодефицитных фенолятов магния могут быть добавлены к изатинам формулы VII в ходе удобной однооперационной реакции, прямо образуя гидроксииндолоны формулы IIb.
Если требуется приготовить индолоны формул IIIa и IIIb, соответствующий гидроксииндолон формулы IIa можно селективно дегидроксилировать триэтилсиланом и трифторуксусной кислотой (ТФУК), как показано на Схеме 5.
Отщепление кислорода проводят в кипящем дихлорэтане в течение нескольких дней; добавляют дополнительное количество ТФУК для уменьшения потерь. Более предпочтительно проводить отщепление кислорода в запаянной трубке с триэтилсиланом и ТФУК при 110-120oC. Специалистами в данной области отмечено, что скорость отщепления кислорода зависит от электронной природы заместителя, присутствующего в гидроксииндолоне формулы IIa и незамещенном соединении; электроноизбыточные соединения формулы IIa лишаются кислорода намного легче по сравнению с электронодефицитными соединениями формулы IIa. Деметилирование метилового эфира соединения формулы IIIa BBr3 в CH2Cl2 в тщательно контролируемых условиях от -78oC до 0oC дает требуемый фенол формулы IIIb.
В другом способе получения индолона формулы IIIa, показанном на Схеме 6, обходят использование триэтилсилана и ТФУК при температуре 110-120oC в течение нескольких дней. Процесс, приведенный на Схеме 6, иллюстрирует получение особого индолона формулы IIIc, где R1, R3 и R4 - это водороды, R2 - это трифторметил и R6 - это хлор. Так хлорирование продажной 2-метоксифенилуксусной кислоты SO2Cl2 в уксусной кислоте дает 5-хлор-2-метоксифенилуксусную кислоту, которую превращают в метиловый эфир формулы X с использованием диметилсульфата и безводного K2CO3 в CH3CN. Реакция енолята калия эфира формулы X с 4-фтор-3-нитробензотрифторидом в присутствии одного эквивалента аддитивного бис(триметилсилил)амида калия (KHMDS) в ТГФ при -78oC приводит к образованию синего раствора енолята калия формулы XI, и обработка кислотой реакционной массы дает требуемый эфир формулы XI с выходом 75%. При восстановлении нитрогруппы в соединении формулы XI железом в уксусной кислоте получающийся анилино-эфир самопроизвольно циклизуется с образованием требуемого индолона формулы IIIc с выходом 84% на перекристаллизованный продукт.
Если требуется получить фториндолоны формулы IV, в реакции с диэтиламинотрифторидом серы (ДАТС) используют соответствующие гидроксииндолоны формулы IIa, как это показано на Схеме 7. Предпочтительно проводить реакцию с ДАТС в органическом растворителе, таком как метиленхлорид при температуре от -78oC до 0oC. Ценным является то, что гидроксииндолон формулы IIa здесь дает соответствующий фториндолон формулы IV.
Чистые энантиомерные формы фториндолона формулы IV могут быть легко получены разделением рацемической смеси с использованием методов жидкостной хроматографии высокого давления с хиральной фазой, как это здесь описано, или иными хорошо известными методами.
Если требуется получить чистую энантиомерную форму гидроксииндолона формулы IIa или IIb, то селективно окисляют соответствующий индолон формулы IIIa с использованием подходящего продажного хирального (+)-(2R, 8aS)- или (-)-(2S, 8aR)-(камфорсульфонил)оксазиридина формулы IXa или IXb соответственно, как это показано на Схеме 8.
В Схеме 8 гидроксилирование индолона формулы IIIa проводят обработкой бис(триметилсилил)амида калия (KHMDS) в ТГФ и полученную калийную соль енольной формы индолона формулы IIIa окисляют хиральным оксазиридином IXa или IXb при -78oC с постепенным нагреванием до 0oC и последующей нейтрализацией ледяной уксусной кислотой с образованием с высоким выходом и высокой энантиомерной чистотой соответствующего требуемого гидроксииндолона формулы IIc или IId соответственно, как это определено в хиральном растворителе (L)-трифторметилфенилкарбиноле с применением ЯМР. В процессе гидроксилирования по Схеме 8 особенно предпочтительно использование дегазированного ТГФ в атмосфере аргона для предотвращения гидроксилирования молекулярным кислородом и сохранения высокой степени асимметричности гидроксилирования. В конечном счете, метиловый эфир гидроксииндолонов формулы IIc и IId может быть деметилирован BBr3 в метиленхлориде с образованием соответствующих фенолов формулы IIe и IIf соответственно. В особом примере, описанном здесь, соединение из Примера 12 и соединение из Примера 13, каждое было получено с энантиомерной чистотой более чем 95%.
В предпочтительном исполнении изобретения соединения формулы II имеют формулу
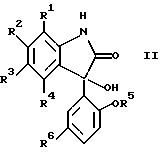
где R1, R2, R3 и R4 - независимо каждый это водород, метил, галоген или трифторметил и, если R1, R3 и R4 - водороды, то R2 - это фенил, п-метилфенил или трифторметилфенил; или R1 и R2, R2 и R3 или R3 и R4, взятые вместе, образуют бензольное кольцо;
R5 - это водород или метил; R6 - это хлор или трифторметил; или их нетоксичная фармацевтически приемлемая соль, сольват или гидрат.
В другом предпочтительном исполнении изобретения соединения формулы III имеют формулу
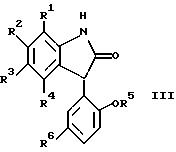
где R1, R2, R3 и R4 - независимо каждый это водород, метил, галоген или трифторметил и, если R1, R3 и R4 - водороды, то R2 - это фенил, п-метилфенил или трифторметилфенил; или R1 и R2, R2 и R3 или R3 и R4, взятые вместе, образуют бензольное кольцо;
R5 - это водород или метил; R6 - это хлор или трифторметил; или их нетоксичная фармацевтически приемлемая соль, сольват или гидрат.
В еще более предпочтительном исполнении изобретения соединения формулы IV имеют формулу

где R1, R2, R3 и R4 - независимо каждый это водород, метил, галоген или трифторметил и, если R1, R3 и R4 - водороды, то R2 - это фенил, п-метилфенил или трифторметил; или R1 и R2, R2 и R3 или R3 и R4, взятые вместе, образуют бензольное кольцо;
R5 - это C1-4алкил, R6 - это хлор или трифторметил; или их нетоксичная фармацевтически приемлемая соль, сольват или гидрат.
С другой стороны, настоящее изобретение дает способ лечения или профилактики расстройств посредством открытия кальций-активируемых K+-каналов высокой проводимости (BK-каналов) у млекопитающих, включающий введение указанным млекопитающим терапевтически эффективного количества соединения формулы I или его нетоксичной фармацевтически приемлемой соли, сольвата или гидрата. Предпочтительно, соединения формулы I используются в лечении ишемии, судорог, астмы, недержания мочи и травматического повреждения мозга и других расстройств, чувствительных к активации деятельности BK-каналов. Наиболее предпочтительно использование соединений формулы I для лечения церебральной ишемии.
Кроме того, данное изобретение обеспечивает фармацевтические составы, включающие, по меньшей мере, одно соединение формулы I в сочетании с фармацевтическим разбавителем, наполнителем или растворителем.
Биологическая активность.
Калийные (K+) каналы представляют структурно и функционально разнообразное семейство K+-селективных канальных белков, повсеместно находящихся в клетках, имеющих центральное место в регуляции ряда ключевых клеточных функций [Rudy, B., Neuroscience: 25, 729-749 (1988)]. Будучи широко распространенными как класс, K+-каналы различным образом распространены как индивидуальные представители этого класса и как семейства [Gehlert, D.R., et al. , Neuroscience: 52, 191-205 (1993)]. В общем, активация K+-каналов в клетках, и особенно в возбудимых клетках, таких, как нейроны и мышечные клетки, приводит к гиперполяризации клеточной мембраны, или в случае деполяризованных клеток - к реполяризации. В дополнение к действию в качестве эндогенного блокатора мембранного напряжения, K+-каналы отвечают за важные действия в клетке, такие, как изменения внутриклеточной концентрации АТФ или внутриклеточной концентрации кальция (Ca2+). Центральная роль K+-каналов в регуляции многочисленных клеточных функций делает их особенно важными объектами терапевтического воздействия [Cook, N. S. , Potassium channels: Structure, classification, function and therapeutic potential. Ellis Horwood, Chinchester (1990)] . Один класс K+-каналов, кальций-активируемые K+-каналы высокой проводимости (Макси-K или BK-каналы) регулируются трансмембранным напряжением, внутриклеточным Ca2+ и набором других факторов, таких, как степень фосфорилации канального протеина [Latorre, R., et al., Ann. Rev. Physiol. 51: 385-399 (1989)]. Высокая одноканальная проводимость BK-каналов (обычно > 150 pS) и высокая степень специфичности к K+ показывает, что небольшое число каналов может основательно влиять на мембранную проводимость и клеточную возбудимость. Кроме того, увеличение способности к открытию с увеличением внутриклеточного Ca2+ указывает на вовлечение BK-каналов в модуляцию Ca2+-зависимых явлений, таких, как выделение и мышечное сокращение [Asano, M. , et al., J. Pharmacol. Exp. Ther., 267, 1277-1285 (1993)].
Агенты, открывающие BK, влияют на клеточные эффекты, увеличивая способность к открытию этих каналов [McKay, M.C., et al., J. Neurophysiol., 71: 1873-1882 (1994); Olesen, S. -P. Exp. Opin. Invest. Drugs, 3: 1181-1188 (1994)] . Это увеличение открытия индивидуальных BK-каналов в общем итоге приводит к гиперполяризации клеточных мембран, особенно в деполяризованных клетках, достигаемой значительным увеличением общеклеточной BK-опосредованной проводимости.
Способность соединений, описанных в данном изобретении, открывать BK-каналы и увеличивать общеклеточные выходные (K+ ) BK-опосредованные токи была определена в условиях снятия напряжения измерением их способности увеличивать у клонированных млекопитающих (mSlo или hSlo) BK-опосредованный выходной ток, ксеногенно выраженный в овоцитах Xenopus [Butler, A., et al., Science, 261: 221-224 (1993); Dworetzky, S.I., et al., Mol. Brain. Res. 27: 189-193 (1994)] . Два BK образуют практически структурно идентичные гомологические протеины, и было показано, что они являются фармакологически идентичными в наших тестах. Для выделения BK-тока из исходного (фонового, не-BK) тока использовался особый токсин-блокатор BK-каналов ибериотоксин (IBTX) [Galvez, A. , et al., J. Biol. Chem., 265: 11083-11090 (1990)] в сверхвысокой концентрации (50 нМ). Относительное распределение тока BK-каналов в общем выходном токе было определено вычитанием остаточного тока в присутствии IBTX (не-BK тока) из профилей тока, полученных во всех других условиях эксперимента (контроль, лекарство и промывка). Было определено, что при исследуемой концентрации взятые соединения не влияют на исходные не-BK токи в овоцитах. Все соединения тестировались по меньшей мере на 5 овоцитах при единственной концентрации 20 uM; действие выбранных соединений формулы I на BK-ток выражалось в процентах IBTX-чувствительного тока и приведено в табл. 1. Измерения проводились с использованием стандартной двухэлектродной методики снятия напряжения [Stuhmer, W., et al., Methods in Enzymology, 207: 319-339 (1992)]; диаграммы снятия напряжения состояли из стадий деполяризации длительностью 500-750 мс от несущего потенциала -60 до +140 мВ с шагом 20 мВ. Экспериментальная среда (модифицированный раствор Барта) состояла из (мМ): NaCl (88), Na2CO3 (2,4), KCl (1,0), HEPES (10), MgSO4 (0,82), Ca(NO3)2 (0,33), CaCl2 (0,41); pH 7,5.
Соединение из Примера 3 также было исследовано одноканальными наружно-иссеченными бляшками как из COS-клеток, мгновенно зараженными mSlo, так и бляшками овоцитов, выжимающими hSlo, и было найдено, что оно эффективно увеличивает открывающую способность в обеих системах при концентрации 1 мкМ. Другие соединения исследовались с использованием полноклеточной и одноканальной контактно-пластырной методики в клетках НЕК 293, мгновенно выжимающих hSlo BK-каналы на высоких уровнях, например, соединения из Примеров 14, 37 и 38, и было найдено, что они являются очень сильными и эффективными агентами, открывающими hSlo BK-каналы в условиях записи с полноклеточным и внутри- и наружно-иссеченным контактным пластырем.
Для определения способности этих соединений снижать клеточную потерю, вызванную нейронной ишемией, использовалось стандартное моделирование постоянной фокальной ишемии на грызунах, включающее закупорку центральной церебральной артерии у крыс со спонтанной гипертонией (ЗЦЦА-модель). [Tamura, A., et al., J. Cerebral Blood Flow and Metabolism, 1, 53-60, (1981)].
Выбранные соединения были охарактеризованы на модели фокального удара, включающей закупорку центральной церебральной артерии (ЗЦЦА) у крыс со спонтанной гипертонией. Эта процедура привела к достоверно большому объему нейронного инфаркта, который был измерен путем определения исчезновения жизненного окрашивания в нескольких срезах мозга через 24 часа после ЗЦЦА. В настоящем опыте соединения вводились внутривенно или внутрибрюшинно через 2 часа после закупорки. Например, в данной модели, соединение из Примера 4 снизило объем кортикального инфаркта примерно на 18% при внутривенном введении (0,03 мг/кг) и примерно на 26% при внутрибрюшинном введении (10 мг/кг) в виде одного шарика через 2 часа после закупорки центральной церебральной артерии по сравнению с обработанными 2% ДМСО, 98% PG контрольными крысами. Также в данной модели, соединение из Примера 14 снизило объем кортикального инфаркта примерно на 18% при внутривенном введении в виде двух шариков через 2 часа после закупорки центральной церебральной артерии по сравнению с обработанными 2% ДМСО, 98% PG контрольными крысами.
Результаты вышеприведенных опытов in vitro и in vivo показывают, что соединения по настоящему изобретению являются сильными агентами, открывающими кальций-активируемые K+-каналы высокой проводимости (макси-K или BK-каналы). Так, соединения по настоящему изобретению используются для лечения расстройств у человека, возникающих из-за дисфункции клеточной мембранной поляризации и проводимости и, предпочтительно, показаны к применению для лечения ишемии, судорог, астмы, недержания мочи и травматического поражения мозга и других расстройств, чувствительных к активации деятельности BK-каналов. Наиболее предпочтительно применение соединений формулы I для лечения церебральной ишемии.
Поэтому соединения формулы I или их фармацевтические составы используются при лечении, смягчении или устранении расстройств или других расстройств, связанных с BK-каналами. Такие расстройства включают ишемию, судороги, астму, недержание мочи и другие расстройства, чувствительные к действию агентов, открывающих калийные каналы.
В другом исполнении данное изобретение включает фармацевтические составы, включающие по меньшей мере одно соединение формулы I в сочетании с фармацевтическим наполнителем, носителем или разбавителем.
В следующем исполнении данное изобретение относится к способу лечения или профилактики расстройств, реагирующих на открытие калийных каналов у млекопитающих, который включает введение указанным млекопитающим терапевтически эффективного количества соединения формулы I или его нетоксичной фармацевтически приемлемой соли, сольвата или гидрата.
В другом исполнении данное изобретение относится к способу лечения ишемических состояний у млекопитающих, который включает введение указанным млекопитающим терапевтически эффективного количества соединения формулы I или его нетоксичной фармацевтически приемлемой соли, сольвата или гидрата.
Для терапевтического использования фармакологически эффективные соединения формулы I обычно вводятся в виде фармацевтического состава, включающего как главный (один из главных) ингредиент по меньшей мере одно из таких соединений в сочетании с твердым или жидким фармацевтически приемлемым носителем и, по выбору, с фармацевтически приемлемыми разбавителями и наполнителями с использованием стандартных и общепринятых методик.
Фармацевтические составы включают подходящие дозированные формы для перорального, парентального (включая подкожное, внутримышечное, чрескожное и внутривенное введение), бронхиального введения и введения через нос. Так, если используется твердый носитель, препарат может быть в виде таблеток, покрытых твердой желатиновой оболочкой капсул, порошка, пилюли или в форме пастилки или леденца. Твердый носитель может содержать подходящие наполнители, такие, как связующие, наполнители, смачиватели для таблетирования, диспергаторы, увлажнители и другие агенты. Таблетки, если требуется, могут быть покрыты оболочкой с использованием подходящих методик. Если используется жидкий носитель, препарат может быть в виде сиропа, эмульсии, мягкой желатиновой капсулы, стерильного сосуда для инъекций, водной и неводной жидкой суспензии или может быть сухим продуктом для разведения перед использованием водой или другим подходящим растворителем. Жидкие препараты могут содержать подходящие добавки, такие, как суспендирующие агенты, эмульгаторы, увлажнители, неводные растворители (включая съедобные масла), консерванты, равно как и отдушки и/или красители. Для парентерального введения растворитель обычно включает стерильную воду, по меньшей мере - главную часть, хотя могут использоваться и солевые растворы, растворы глюкозы и подобные. Также можно применять суспензии для инъекций, в которых используются подходящие суспендирующие агенты. При приготовлении парентеральных дозированных форм также можно добавлять подходящие консерванты, буферные агенты и подобные. Особенно полезно введение соединения формулы I непосредственно в парентальные препараты. Фармацевтические составы готовят с использованием соответствующих методик, подходящих для требуемого препарата, содержащего нужные количества активного ингредиента, т. е. соединения формулы I в соответствии с данным изобретением. См. , например, Remington's Pharmaceutical Science. Mack Publishing Comp., Easton, PA, 17th edition, 1985.
Дозировка соединений формулы I для достижения терапевтического эффекта зависит не только от таких факторов, как возраст, вес и пол пациента и способа введения, но также от требуемой степени активации деятельности калийных каналов и силы используемого конкретного соединения для лечения данного расстройства или заболевания. Также отмечается, что лечение и дозировка отдельным соединением может проводиться в виде стандартных дозированных форм, устанавливаемых специалистами в данной области, учитывая относительный уровень активности. Решение в отношении используемой частой дозировки (и числа введений в день) входит в компетенцию лечащего врача и может варьироваться делением дозы в конкретных условиях для получения требуемого терапевтического эффекта.
Подходящей дозой соединения формулы I или его фармацевтического состава для млекопитающих, включая человека, страдающих от любых явлений, описанных здесь, является количество активного ингредиента от порядка 0,1 до 100 мг/кг веса тела. Для парентерального введения доза может быть в пределах от 1 до 10 мг/кг веса тела при внутривенном введении. Активный компонент предпочтительно вводится равными дозами от 1 до 4 раз в сутки. Однако вводятся и меньшие дозы, а также дозировка может быть постепенно увеличена до достижения определяемого в ходе лечения оптимального для реципиента значения.
Однако следует понимать, что количество действительно вводимого соединения определяется лечащим врачом в свете обстоятельств, включающих состояние, выбор вводимого соединения, путь введения, возраст, вес, чувствительность данного пациента, тяжесть симптомов.
Нижеследующие примеры иллюстрируют, никоим образом не ограничивая, данное изобретение, так как возможны многие разновидности изобретения в духе данного изобретения.
ОПИСАНИЕ ОСОБЫХ ИСПОЛНЕНИЙ
В нижеследующих примерах все температуры указаны в градусах Цельсия. Температуры плавления определены на
капиллярном приборе Галленкампа (Gallencamp) для измерения температур плавления; температуры кипения измерены при указанных давлениях (мм рт.ст.), и все значения являются нескорректированными. Спектры
ПМР и ЯМР (13C) записаны на приборе Bruker AC 300, а спектры ЯМР (19F) записаны на приборе Bruker AM 300, оснащенном QNP-датчиком. Все спектры записаны в указанных растворителях,
и химические сдвиги даны в единицах δ, отсчитанных от внутреннего стандарта тетраметилсилана (ТМС); константы межпротонного расщепления даны в герцах (Гц). Типы сигналов обозначены следующим
образом: с - синглет, д - дублет, т - триплет, кв - квадруплет, м - мультиплет, ш - широкий сигнал, дд - дублет дублетов, шд - широкий дублет, дт - дублет триплетов, шс - широкий синглет, дкв - дублет
квадруплетов. Инфракрасные (ИК) спектры в KBr от 4000 до 400 см-1 записаны на спектрометре Perkin Elmer 781, калиброванном по поглощению пленки полистирола при 1601 см-1 и даны в
обратных сантиметрах (см-1). Оптическое вращение [α]5 определено на
поляриметре Perkin Elmer 41 в указанных растворителях. Масс-спектры низкого разрешения (МС) и молекулярные ионы (MH+) или (M-H-) были определены на приборе Pinnigen TSQ 7000.
Данные элементного анализа приведены в массовых процентах.
Нижеследующие синтезы N 1-5 иллюстрируют важные способы получения промежуточных продуктов и методы получения продуктов по данному изобретению. Также должно быть очевидным для специалиста в данной области, что соответствующие замены в веществах и способах, описанных здесь, образуют примеры, приводимые ниже и входят в рамки данного изобретения.
Синтез N 1
6-(Трифторметил)-1H-индол-2,3-дион
Чистую смесь 82,4 г (0,51 моль) 3-аминобензотрифторида и 123 г (0,56 моль) (Boc)2O
выдерживают при 80oC в течение 2-3 часов до прекращения выделения CO2. После самоохлаждения смеси tBuOH отгоняют на роторном испарителе. Полученное белое твердое вещество
перекристаллизовывают из гексанов. Получают 119 г (89%) N-(трет-бутоксикарбонил)аминобензотрифторида в виде белых иголок.
К холодному (-78oC перемешиваемому раствору 52,25 г (0,2 моль N-Boc-аминобензотрифторида в 200 мл ТГФ в атмосфере азота в течение 20 минут прибавляют 338 мл (0,44 моль) 1,3 М раствора втор-бутиллития в циклогексане. Полученный желтый неполный раствор нагревают до -45 - -40oC и выдерживают 2 часа. Полученный толстый желтый осадок дианиона охлаждают до -78oC и быстро прибавляют 35,1 г (0,24 моль) чистого сухого диэтилоксалата. Полученный оранжево-коричневый раствор перемешивают при -78oC в течение 1 часа. Реакционную массу разбавляют 200 мл эфира, нейтрализуют 150 мл 3 н. HCl и оставляют нагреваться до комнатной температуры. Отделяют органический слой, промывают водой, раствором соли и осушают Na2SO4. После упаривания растворителя получают 80,7 г золотисто-желтого масла, которое после экспресс-хроматографии (силикагель/CH2Cl2) дает 61,1 г (85%) чистого кетоэфира.
ИК-спектр (пленка, см-1): 3320, 1740, 1670, 1540, 1370, 1340, 1250,
1140;
Спектр ПМР (300 МГц, CDCl3) δ, м.д. 1,40 (3H, т, J = 7,1 Гц), 1,51 (9H, с), 4,45 (2H, кв, J = 7,1 Гц), 7,25 (1H, д, J = 8,3 Гц), 7,79 (1H, д, J = 8,3 Гц), 8,86 (1H, с),
10,40 (1H, шс); МС m/e 362 (MH+).
Перемешиваемый раствор 57 г (0,158 моль) кетоэфира в 1 л ТГФ кипятят с обратным холодильником с 250 мл 3 н. HCl в течение 6 часов. Смесь оставляют охлаждаться и отгоняют ТГФ на роторном испарителе. Полученную оранжевую суспензию охлаждают, отфильтровывают твердый продукт, промывают водой и высушивают на воздухе в течение суток. Получают 29,6 г (87%) 6-(трифторметил)изатина с т.пл. 196-198oC.
ИК-спектр (KBr, см-1): 3100, 1750, 1710, 1320, 1170, 1125; Спектр ПМР (300 МГц, ДМСО-d6 ) δ, м.д. 7,09 (1H, с), 7,39 (1H, д, J = 7,7 Гц), 7,68 (1H, д, J = 7,7 Гц), 11,26 (1H, шс); MC m/e 216 (MH+).
Анализ C9H4F3NO2:
вычислено: C 50,28; H 1,91; N 6,47,
найдено: C 50,25; H 1,87; N 6,51.
Нижеследующий изатин получен подобным способом.
5-(Трифторметил)-1H-индол-2,3-дион: т.пл. 188-190oC.
Синтез N 2
4,6-бис-(трифторметил)-1H-индол-2,3-дион
К перемешиваемому холодному (-65oC)
раствору 4,58 г (20 ммоль) 3,5-бис-(трифторметил)анилина в 25 мл безводного CH2Cl2 по каплям прибавляют 2,2 г (20 ммоль) свежеприготовленного t-BuOCl. Через 10 минут добавляют 2,
68 г (20 ммоль) чистого этил(метилтио)ацетата и смесь перемешивают при -65oC в течение 1 часа. Прибавляют 2,68 г (20 ммоль) триэтиламина, после чего смесь оставляют нагреваться до комнатной
температуры. Реакционную смесь разбавляют водой, органический слой отделяют и упаривают на роторном испарителе. Маслообразный остаток (6,35 г) растворяют в гексанах и кипятят несколько часов и дают
остыть. Бежевый твердый осадок отфильтровывают и промывают гексанами. Получают 3,67 г чистого (метилтио)индолонового промежуточного продукта.
К перемешиваемому раствору 2,95 г (9,4 ммоль) (метилтио)индолона в 150 мл ТХУ добавляют 1,31 г (9,8 ммоль) N-хлорсукцинимида. Смесь перемешивают 6,5 часов при комнатной температуре. Суспензию фильтруют, промывают ТХУ и упаривают фильтрат на роторном испарителе при 25-30oC. Оставшееся светло-коричневое масло растворяют в минимальном объеме (~5-10 мл) ТХУ и выдерживают на ледяной бане. Осевшие остатки сукцинимида отфильтровывают и промывают гексанами. Упариванием фильтрата получают 3,56 г красно-коричневого масла α-хлороксиндола, который используют на следующей стадии без дальнейшей очистки.
К перемешиваемой суспензии HgO в 100 мл смеси ТГФ-H2O 4:1 добавляют 1,16 мл (9,4 ммоль) чистого BF3·OEt2. Прибавляют раствор в ТHF (20 мл) 3,56 г α- хлороксиндола и перемешивают смесь в течение 2-3 дней. Суспензию фильтруют через броунмиллеритовую пластину и фильтрат промывают насыщенным раствором соли, после чего осушают Na2 SO4. После упаривания ТГФ получают 3,2 г сырого изатина, который перекристаллизовывают из эфира, получая 1,27 г 4,6-бис-(трифторметил)-1H-индол-2,3-диона с т.пл. 200-203oC.
ИК-спектр (KBr, см-1): 1778, 1748, 1278, 1138; Спектр ПМР (300 МГц, ДМСО-d6) δ, м. д. 7,40 (1H, с), 7,61 (1H, с), 11,52 (1H, с); МС m/e 284 (MH+).
Следующие изатины были получены согласно описанным в литературе способам: Maginnity, P.M., et al., J. Am. Chem. Soc. 73, 3579, (1951); Marvel, C. S., et al., Organic Synthesis Coll. Vol. 1, 327-330.
4-(трифторметил)-1H-индол-2,3-дион: т.пл. 210-212oC
7-(трифторметил)-1H-индол-2,3-дион: т.пл. 190-192oC
4,6-дихлор-1H-индол-2,
3-дион: т.пл. 258-260oC
Следующие изатины также могут быть получены способами, указанными в источниках
1H-Бенз[g] индол-2,3-дион: т.пл. 256-259oC (дек.)
[Cassebaum, H., Chem. Ber., 90, 2876 (1957)].
1H-Бенз[f] индол-2,3-дион: т.пл. 250-255oC (дек.) [Etienne, A., et al., Bull. Soc. Chem. Fr., 6, 743-748 (1954)].
1H-Бенз[e] индол-2,3-дион: т.пл. 252-254oC (дек.) (Wendelin, W., et al., J. Het Chem., 24, 1381 (1987)].
6-Фенил-1H-индол-2,3-дион: т.пл. 230-235oC [Sadler, P.W., J. Org. Chem., 21, 169 (1956)].
6-Иод-1H-индол-2,3-дион: т.пл. 196-198oC [Von Langenbeck, W., et al., J. Prakt. Chem., 4, IV, 136-146 (1956)].
Синтез N 3
Общий способ получения 1,3-дигидро-3-гидрокси-3-(2-гидроксиарил)-2H-индол-2-онов:

Способ А: К перемешиваемому холодному (-20oC) раствору натриевой соли изатина в ТГФ в атмосфере азота прибавляют раствор 1-2 эквивалентов 2-метоксиарильного реактива Гриньяра в ТГФ. Смесь оставляют нагреваться до комнатной температуры и выдерживают (1-2 часа) до полного превращения изатина. Реакционную смесь разбавляют эфиром, охлаждают на ледяной бане и затем нейтрализуют 1 н. HCl. Отделяют органический слой, промывают 0,5 н. NaOH, водой, раствором соли и осушают Na2SO4. Сырой твердый продукт выделяют после упаривания растворителя и обрабатывают CH2Cl2. Получают чистые 1,3-дигидро-3-гидрокси-3-(2-метоксиарил)-2H-индол-2-оны с выходами 70-95%.
Деметилирование метилового эфира вышеуказанного продукта проводят BBr3 в CH2Cl2. К холодному (-78oC) перемешиваемому раствору 1,3-дигидро-3-гидрокси-3-(2-метоксиарил)-2H-индол-2-она в безводном CH2 Cl2 в атмосфере азота прибавляют 1 М раствор (3 эквивалента) BBr3 в CH2Cl2. Смесь нагревают на ледяной бане и выдерживают (1-2 часа) до исчезновения по ТСХ исходного вещества. Реакционную массу нейтрализуют насыщенным NaHCO3, затем подкисляют 1 н. HCl. Если продукт растворим в CH2Cl2, то отделяют органический слой, промывают раствором соли и осушают MgSO4. Если продукт нерастворим в CH2Cl2, то органический слой упаривают на роторном испарителе при комнатной температуре и водный остаток экстрагируют этилацетатом. Экстракт промывают раствором соли и осушают Na2SO4. Упаривание органического растворителя дает 1, 3-дигидро-3-гидрокси-3-(2-гидроксиарил)-2H-индол-2-оны. Сырой продукт очищают либо обработкой, либо перекристаллизацией из подходящего растворителя. Получают чистый продукт с выходом 80-95%.
Способ Б: Готовят броммагний фенолят путем взаимодействия 1 эквивалента раствора фенола в эфире с 1 эквивалентом эфирного раствора этилмагнийбромида при 0oC с дальнейшим саморазогреванием смеси до комнатной температуры. Полученную суспензию броммагний фенолята в эфире досуха упаривают на роторном испарителе при 25oC, после чего растворяют в безводном CH2Cl2. К раствору броммагний фенолята прибавляют раствор 1 эквивалента изатина в CH2Cl2, и смесь перемешивают при комнатной температуре до тех пор, пока изатин полностью не израсходуется (1-24 часа). Реакционную массу нейтрализуют насыщенным раствором NH4Cl, либо 1 н. HCl, после чего экстрагируют CH2Cl2. Сырой продукт очищают либо обработкой, либо перекристаллизацией из подходящего растворителя. Получают чистые 1,3-дигидро-3-гидрокси-3-(2-гидроксиарил)-2H-индол-2-оны.
Синтез N 4
Общий способ
получения 1,3-дигидро-3-гидрокси-3-(2-гидроксиарил)-2H-индол-2-онов:
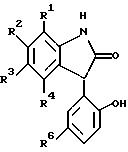
Чистую перемешиваемую смесь 1 эквавалента 1,3-дигидро-3-гидрокси-3-(2-метоксиарил)-2H-индол-2-она, 3 эквивалентов триэтилсилана и 3 эквивалентов ТФУК нагревают до 110-120oC в закрытой трубке в течение 1-3 дней до полного отщепления кислорода по ТСХ. Избыток триэтилсилана и ТФУК отгоняют на роторном испарителе, а остаток подвергают экспресс-хроматографии (силикагель, 3% метанола в CH2Cl2 ). Получают продукт отщепления кислорода 1,3-дигидро-3-(2-метоксиарил)-2H-индол-2-она (80-90%). Деметилирование метилового эфира проводят 3 эквивалентами BBr3 при температуре от -78oC до 0oC с последующей обработкой, как это описано в Синтезе N 3, с получением указанного в заголовке продукта.
Синтез N 5
Общий способ получения 1,
3-дигидро-3-фтор-3-(2-метоксиарил)-2H-индол-2-онов:
К холодному (-78oC) перемешиваемому раствору или суспензии 3-арил-1,3-дигидро-3-гидрокси-2H-индол-2-она в атмосфере азота добавляют по каплям трифторид диэтиламиносеры (ДАТС). Полученную смесь оставляют нагреваться до 0oC. За ходом реакции следят по ТСХ. Реакционную смесь разбавляют при 0oC водой. Если продукт растворим в CH2Cl2, то органический слой отделяют, промывают раствором соли и осушают MgSO4. Если продукт нерастворим или частично растворим в CH2Cl2, то органический слой упаривают на роторном испарителе при комнатной температуре и водный остаток экстрагируют этилацетатом. Экстракт промывают раствором соли и осушают Na2SO4. Упаривание органического растворителя дает 3-арил-1, 3-дигидро-3-фтор-2H-индол-2-оны. Сырой продукт очищают либо обработкой, либо перекристаллизацией из подходящего растворителя. Получают чистый продукт с выходом 90-95%.
Синтез N 6
Метил (5-хлор-2-метоксифенил)ацетат
К холодному (5oC) неполному раствору 25 г (0,15 моль) 2-метоксифенилуксусной кислоты в 500 мл ледяной уксусной кислоты в течение 30 минут
по каплям прибавляют 30,5 г (18 мл, 0,225 моль) чистого SO2Cl2. Смесь перемешивают при комнатной температуре в течение 16 часов, после чего при интенсивном перемешивании выливают
в 2,5 л холодной воды. Полученному белому осадку дают отстояться в течение 2-3 часов при комнатной температуре, затем отфильтровывают, промывают водой и высушивают в течение суток на воздухе. Получают
19,8 г (66%) 5-хлор-2-метоксифенилуксусной кислоты.
Перемешиваемую суспензию 10 г (0,05 моль) 5-хлор-2-метоксифенилуксусной кислоты, 8,3 г (0,06 моль) безводного K2CO3 и 7,6 г (0,06 моль) диметилсульфата в 60 мл безводного CH3CN 2 часа кипятят с обратным холодильником в атмосфере азота. Реакционную смесь оставляют остывать и избыток диметилсульфата нейтрализуют 1 мл триэтиламина, после чего фильтруют. Фильтрат упаривают на роторном испарителе, остаток суспендируют в воде и экстрагируют эфиром, промывают насыщенным NaHCO3, водой раствором соли и осушают Na2SO4. Фильтрация и упаривание эфира дает бесцветное масло, которое перегоняют в вакууме. Получают 10,1 г (94%) метил (5-хлор-2-метоксифенил)ацетата с т.кип. 96-98oC/0,5 торр.
ИК-спектр (KBr, см-1): 1742, 1250, 1150, 1128; Спектр ПМР (300 МГц, CDCl3) δ, м. д. 3, 56 (2H, с), 3,66 (3H, с), 3,76 (3H, с), 8,75 (1H, д, J = 8,6 Гц), 7,13 (1H, д, J = 2,5 Гц), 7,17 (1H, дд, J = 8,6 и 2,5 Гц); MC m/e 215 (MH+).
Пример 1
(±
)-3-(5-хлор-2-метоксифенил)-1,3-дигидро-3-гидрокси- 6-(трифторметил)-2H-индол-2-он
Т. пл. 207-210oC; ИК-спектр (KBr, см-1) 3400, 1730, 1320, 1250, 1125, 1170; Спектр ПМР
(300 МГц, ДМСО-d6) δ, м.д. 3,41 (3H, с), 6,91 (1H, д, J = 0,73 Гц), 6,94 (1H, с), 7,05 (2H, м), 7,19 (1H, д, J = 8,2 Гц), 7,35 (1H, дд, J = 8,6 и 2,7 Гц), 7,80 (1H, д, J = 2,7 Гц),
10,67 (1H, с); Спектр13C ЯМР (75 МГц, ДМСО-d6) δ, м.д. 55,95, 74,25, 105,21, 113,52, 118,45, 122,28, 124,27, 124,46, 126,83, 128,70, 129,47 (кв), 131,31, 136,60, 143,88,
154,30, 177,29, МС m/e 358 (MH+).
Анализ C16H11ClF3NO3:
вычислено: C 53,72; H 3,09; N, 3,83,
найдено: C 53,43;
H, 2,99; N, 3,83.
Пример 2
(±)-3-(5-хлор-2-метоксифенил)-1,3-дигидро-6-(трифторметил)- 2H-индол-2-он
Перемешиваемую суспензию 2,02 г (5 ммоль)
метил-(5-хлор-2-метоксифенил)[2-нитро-4-(3-фторметил)фенил] ацетата и 1,18 г (20 ммоль) железного порошка в 25 мл ледяной уксусной кислоты кипятят с обратным холодильником в течение 1 часа. Суспензию
оставляют охлаждаться, после чего при интенсивном перемешивании выливают в 100 мл холодной воды. Продукт экстрагируют эфиром (2 х 50 мл), промывают 50 мл 6 н. HCl, водой, раствором соли и осушают
NazSO4. После упаривания эфира получают 1,8 г бежевого твердого вещества, которое обрабатывают эфиром. Получают 1,61 г (95%) требуемого продукта в виде грязно-белого твердого вещества с
т.пл. 210-213oC.
ИК-спектр (KBr, см-1) 3200, 1710, 1320, 1250, 1170, 1120, 1050; Спектр ПМР (300 МГц, ДМСО-d6) δ, м.д. 3,57 (3H, с), 4,91 (1H, с), 7,02 (1H, д, J = 8,8 Гц), 7,06 (2H, м), 7,21 (1H, дд, J = 7,7 и 0,6 Гц), 7,35 (2H, m), 10,77 (1H, с); Спектр13С ЯМР (75 МГц, ДМСО-d6) δ, м.д. 48,25, 56,07, 105,05, 113,58, 118,26, 122,42, 124,18, 126,03, 127,38, 128,60 (кв), 128,70, 130,65, 134,37, 143,58, 156,09, 176,73; MS m/e 342 (MH+).
Анализ C16H11ClF3NO2:
вычислено: C 56,24; H 3,24; N 4,09,
найдено: C 56,37; H 3,25; N 4,07.
Пример 3
(±)-3-(5-Хлор-2-гидроксифенил)-1,
3-дигидро-3-гидрокси-6-(трифторметил)-2H-индол-2-он
Т. пл. 210-213oC; ИК-спектр (KBr, см-1) 3300, 1725, 1320, 1250, 1170, 1140; Спектр ПМР (300 МГц, ДМСО-d6)
δ, м.д. 6,61 (1H, дд, J = 8,5 и 2,6 Гц), 6,81 (1H, с), 7,02 (1H, с), 7,05 (1H, д, J = 7,7 Гц), 7,17 (2H, м), 7,71 (1H, д, J = 2,7 Гц), 9,72 (1H, с), 10,60 (1H, с); Спектр13C ЯМР (75
МГц, ДМСО-d6) δ, м. д. 74,37, 105,17, 116,48, 118,30, 122,34, 124,32, 125,92, 126,84, 128,33, 129,14, 129,26 (кв), 136,87, 144,11, 152,37, 177,30; МС m/e 344 (MH+).
Анализ C15H9ClF3NO3:
вычислено: C 52,42; H 2,64; N 4,08,
найдено: C 52,19; H 2,57; N 3,97.
Пример 4
(±)-3-(5-Хлор-2-гидроксифенил)-1,3-дигидро-6-(трифторметил)- 2H-индол-2-он
К холодному (-78oC) раствору 1,37 г (4 ммоль) (±)-3-(5-Хлор-2-метоксифенил)-1,
3-дигидро-6-(трифторметил)-2H-индол-2-она в 20 мл безводного CH2Cl2 прибавляют 12 мл (12 ммоль) 1 М раствора BBr3 в метиленхлориде. Смесь оставляют нагреваться до
комнатной температуры и выдерживают 2 часа. Реакционную массу нейтрализуют насыщенным раствором NaHCO3, после чего подкисляют 1 н. HCl. Отделяют органический слой, промывают его водой,
раствором соли и осушают MgSO4. Упариванием CH2Cl2 получают грязно-белое твердое вещество, которое обрабатывают теплым CH2Cl2. Выделяют 1,21 г
(93%) указанного в заголовке вещества с т.пл. 266-268oC.
ИК-спектр (KBr, см-1) 3320, 1690, 1310, 1250, 1160, 1125; Спектр ПМР (300 МГц, ДМСО-d6) δ, м.д. 4,85 (1H, с), 6,75 (1H, д, J = 8,6 Гц), 7,04 (1H, с), 7,11 (1H, д, J = 7,7 Гц), 7,17 (1H, дд, J = 8,6 и 2,6 Гц), 7,22 (1H, д, J = 8,0 Гц), 7,26 (1H, д, J = 2,4 Гц), 9,82 (1H, с), 10,73 (1H, с), Спектр13C ЯМР (75 МГц, ДМСО-d6) δ, м.д. 48,47, 104,94, 116,84, 118,16, 122,27, 124,20, 125,61, 126,06, 128,41, 130,76, 128,05, 134,72, 143,69, 154,26, 176,92; МС m/e 328 (MH+).
Анализ C15H9ClF3NO2
вычислено: C 54,98; H 2,77; N 4,27,
найдено: C 54,84; H 2,64; N 4,16.
Пример 5
(±)-3-(5-Хлор-2-гидроксифенил)-1,3-дигидро-3-гидрокси-5-(трифторметил)-2H-индол-2-он
Т. пл. 156-158oC; ИК-спектр (KBr, см-1) 3350,
1740, 1325, 1260, 1160, 1120; Спектр ПМР (300 МГц, ДМСО-d6) δ, м.д. 6,62 (1H, д, J = 8,5), 6,80 (1H, с), 6,98 (1H, д, J = 8,1 Гц), 7,09 (1H, д, J = 1,2 Гц), 7,17 (1H, дд, J = 8,5 и 2,
7 Гц), 7,56 (1H, дд, J = 8,1 и 1,2 Гц), 7,73 (1H, д, J = 2,7 Гц), 9,73 (1H, с), 10,72 (1H, с); Спектр13C ЯМР (75 МГц, ДМСО-d6) δ, м.д. 74,37, 109,44, 116,52, 120,16, 121,
75 (кв), 122,37, 126,42, 126,75, 128,37, 129,28, 133,33, 146,94, 152,36, 177,56, 126,93; МС m/e 344(MH+).
Анализ С15H9СlF3NO3:
вычислено: C 52,42; H 2,64; N 4,08,
найдено: C 52,19; H 2,48; N 4,13.
Пример 6
(±)-3-(5-Хлор-2-гидроксифенил)-4,6-дихлор-1,
3-дигидро-3-гидрокси-2H-индол-2-он
Т.пл. 232-235oC; ИК-спектр (KBr, см-1) 3400, 1730, 1275; Спектр ПМР (300 МГц, ДМСО-d6) δ, м.д. 6,61 (1H, д, J = 8,5
Гц), 6,79 (1H, д, J = 1,7 Гц), 6,81 (1H, с), 6,94 (1H, д, J = 1,7 Гц), 7,14 (1H, дд, J = 8,5 и 2,7 Гц), 7,71 (1H, д, J = 2,7 Гц), 9,71 (1H, с), 10,71 (1H, с); Спектр13C ЯМР (75 МГц,
ДМСО-d6) δ, м.д. 74,77, 108,31, 116,32, 121,22, 122,07, 127,55, 128,20, 128,39, 130,40, 134,05, 146,26, 152,27, 176,89; МС m/e 344 (MH+).
Анализ C14H8Cl3NO3:
вычислено: C 48,80; H 2,34; N 4,06,
найдено: C 48,70; H 2,35; N 4,01.
Пример 7
(±
)-3-(5-Хлор-2-гидроксифенил)-1,3-дигидро-3-гидрокси-7-(трифторметил)-2H-индол-2-он
Т. пл. 205-207oC; ИК-спектр (KBr, см-1) 3250, 1745, 1340, 1240, 1175, 1120; Спектр ПМР
(300 МГц, ДМСО-d6) δ, м.д. 6,59 (1H, д, J = 8,5 Гц), 6,99 (1H, т, J = 7,7 Гц), 7,10 (1H, д, J = 7,1 Гц), 7,16 (2H, дд, J = 8,5 и 2,7 Гц), 7,44 (1H, д, J = 7,8 Гц), 7,72 (1H, д, J = 2,
7 Гц), 9,79 (1H, с), 10,79 (1H, с); Спектр13C ЯМР
(75 МГц, ДМСО-d6) δ, м.д. 73,41, 110,10 (кв), 116,37, 121,43, 122,27, 125,16, 125,61, 126,83, 127,53, 128,30, 129,37,
134,40, 140,72, 152,38, 178,02; МС m/e 344 (MH+).
Анализ C15H9ClF3NO3·0,2H2O:
вычислено: C 51,88; H 2,
73; N 4,03,
найдено: C 51,87; H 2,75; N 3,98.
Пример 8
(±)-3-(5-Хлор-2-гидроксифенил)-1,3-дигидро-3-гидрокси-4-(трифторметил)-2H-индол-2-он
Т. пл.
239-242oC; ИК-спектр (KBr, см-1) 3300, 1725, 1330, 1250, 1170, 1140; Спектр ПМР (300 МГц, ДМСО-d6) δ, м.д. 6,56 (1H, д, J = 8,5 Гц), 6,76 (1H, с), 7,07-7,13 (3H,
м), 7,39 (1H, т, J = 7,9 Гц), 7,66 (1H, с), 9,57 (1H, с), 10,71 (1H, с); Спектр13C ЯМР (75 МГц, ДМСО-d6) δ, м.д. 127,77, 127,95, 128,76, 129,57, 129,73, 145,00, 152,40,
176,89, 74,93, 113.23, 116,01, 118,26, 121,60, 121,84, 125,50 (кв); МС m/e 344 (MH+).
Анализ C15H9ClF3NO3:
вычислено: C
52,42; H 2,64; N 4,08,
найдено: C 52,16; H 2,87; N 4,06.
Пример 9
(±)-1,3-Дигидро-3-гидрокси-3-[2-гидрокси-5-(трифторметил)фенил]
-6-трифторметил-2H-индол-2-он
Т. пл. 175-177oC; Спектр ПМР (300 МГц, ДМСО-d6) δ, м.д. 6,77 (1H, д, J = 8,3 Гц), 7,02-7,09 (2H, м), 7,19 (1H, д, J = 7,7 Гц), 7,51
(1H, д, J = 8,3 Гц), 8,08 (1H, с), 10,40 (1H, с), 10,67 (1H, с); МС m/e 378 (MH+).
Анализ C16H9F6NO3:
вычислено: C 50,
94; H 2,40; N 3,71,
найдено: C 50,85; H 2,34; N 3,76.
Пример 10
(±)-3-(5-Хлор-2-гидроксифенил)-1,3-дигидро-3-гидрокси-4,6-бис(трифторметил)-2H-индол-2-он
ИК-спектр (KBr, см-1) 3700-2500, 1740, 1280, 1170, 1130; Т.пл. 191-193oC; Спектр ПМР (300 МГц, ДМСО-d6)

Анализ C16H8ClF6NO3·0,2H2O:
вычислено: C 46,24; H 2,05; N 3,37,
найдено: C 46,24;
H 2,18; N 3,27.
Пример 11
(-)-3-(5-Хлор-2-метоксифенил)-1,3-дигидро-3-гидрокси-6-(трифторметил)-2H-индол-2-он
К холодному (-78oC) перемешиваемому раствору
342 мг (1 ммоль) (±)-3-(5-хлор-2-метоксифенил)-1,3-дигидро-6-(трифторметил)-2H-индол-2-она в 3 мл сухого дегазированного ТГФ в атмосфере аргона по каплям прибавляют 2,2 мл (1,1 ммоль) 0,5 М
толуольного раствора бис(триметилсилил)амида калия. Полученный светло-желтый раствор енолята калия перемешивают при -78oC, в течение 30 минут. В течение 5 минут при -78oC к
раствору енолята калия по каплям прибавляют раствор 252 мг (1,1 ммоль) (1S)-(+)-(10-камфорсульфонил)оксазиридина в 2 мл сухого дегазированного ТГФ. Смесь перемешивают 1 час, после чего дают ей
нагреться на ледяной бане до 0-5oC. Реакционную смесь нейтрализуют 0,1 мл ледяной уксусной кислоты, разбавляют 25 мл эфира, после чего прибавляют 10 мл насыщенного раствора NH4
Cl. Отделяют органический слой, промывают насыщенным раствором NaHCO3, водой, раствором соли и осушают Na2SO4. После фильтрования и упаривания растворителя получают 0,
54 г сырого продукта, который обрабатывают эфиром для удаления нерастворимого побочного (камфорсульфонил)имина путем фильтрации. Упариванием фильтрата получают 0,39 г слегка загрязненного побочными
продуктами вещества. Сырой продукт обрабатывают кипящим CH2Cl2. Получают 230 мг чистого гидроксииндолона. Концентрированием маточного раствора с повторной обработкой CH2Cl2 получают дополнительно 72 мг, и того 302 мг (84%) объединенных порций продукта с т. пл. 244-245oC; [α]
ИК-спектр (KBr, см-1) 3300-3100, 1722, 1320, 1250, 1125; Спектр ПМР (300 МГц,
ДМСО-d6) δ, м.д. 3,42 (3H, с), 6,90 (1H, с), 6,93 (1H, д, J = 8,7 Гц), 7,04 (1H, д, J = 7,7 Гц), 7,05 (1H, с), 7,19 (1H, д, J = 7,7 Гц), 7,35 (1H, дд, J = 8,7 и 2,7 Гц), 7,79 (1H, д,
J = 2,7 Гц), 10,67 (1H, шс); МС m/e 358 (MH+).
Анализ C16H11ClF3NO3:
вычислено: C 53,72; H 3,10; N 3,92,
найдено: C 53,77; H 2,95; N 3,95.
Пример 12
(+)-3-(5-Хлор-2-метоксифенил)-1,3-дигидро-3-гидрокси-6-(трифторметил)-2H-индол-2-он
К перемешиваемому холодному (-78oC) раствору 170 мг (0,475 ммоль) (-)-3-(5-хлор-2-метоксифенил)-1,3-дигидро-3-гидрокси-6-(трифторметил)-2H-индол-2-она, полученного в Примере 11, в 10 мл безводного CH2Cl2
по каплям прибавляют 1,4 мл 1 М раствора BBr3 в метиленхлориде. Полученную смесь нагревают на ледяной бане и выдерживают 2 часа. Реакционную массу нейтрализуют насыщенным NaHCO3,
после чего подкисляют 1 н. HCl. Мутный органический слой отделяют, упаривают на роторном испарителе, растворяют в 25 мл этилацетата, после чего объединяют с водным слоем. Этилацетатный слой отделяют,
промывают водой, раствором соли и осушают Na2SO4. После фильтрации и упаривания получают 198 мг сырого продукта, который подвергают экспресс-хроматографии (силикагель, 10%-й
метанол в хлороформе). Получают 164 мг (100%) чистого соединения, указанного в заголовке, в виде белого твердого вещества с т.пл. 200-201oC. [α]
ИК-спектр (KBr, см-1) 3540, 3350, 1725, 1320, 1160,
1130; Спектр ПМР (300 МГц, ДМСО-d6) δ, м.д. 6,60 (3H, д, J = 8,5 Гц), 6,82 (1H, шс), 7,02 (1H, с), 7,05 (1H, д, J = 7,6 Гц), 7,17 (2H, м), 7,71 (1H, д, J = 2,7 Гц), 9,75 (1H, шс), 10,
61 (1H, с); МС m/e 344 (MH+).
Анализ C15H9ClF3NO3:
вычислено: C 52,42; H 2,64; N 4,08,
найдено: C 52,62; H 2,
48; N 4,04.
Пример 13
(-)-3-(5-Хлор-2-гидроксифенил)-1,3-дигидро-3-гидрокси-6-(трифторметил)-2H-индол-2-он
Т. пл. 198-200oC; [α]
Анализ C15H9ClF3NO3:
вычислено: C 52,42; H 2,64; N 4,08,
найдено: C 52,40; H 2,29; N 4,01.
Пример 14
(±)-3-(5-Хлор-2-метоксифенил)-1,3-дигидро-3-фтор-6-(трифторметил)-2H-индол-2-он
Т. пл. 168-170oC; ИК-спектр (KBr, см-1) 3200,
1734, 1320, 1268, 1132; Спектр ПМР (300 МГц, CDCl3) δ, м.д. 3,53 (3H, с), 6,76 (1H, дд, J = 8,7 и 1,0 Гц), 7,14 (3H, д, J = 2,0 Гц), 7,18 (1H, дд, J = 7,8 и 2,0 Гц), 7,26 (1H, д, J =
7,8 Гц), 7,33 (1H, дд, J = 8,7 и 2,6 Гц), 7,78 (1H, дд, J = 2,6 и 1,0 Гц), 9,00 (1H, с); Спектр19F ЯМР (282 МГц, CDCl3) δ, м.д. -63,10 (6-CF3), -159,87 (3-F);
МС m/e 360 (MH+).
Анализ C16H10ClF4NO2:
вычислено: C 53,43; H 2,80; N 3,89,
найдено: C 53,44; H 2,79; N 3,
84.
Пример 15
(±)-3-(5-Хлор-2-гидроксифенил)-1,3-дигидро-3-гидрокси-2H-бенз[g] индол-2-он
Т. пл. 170-172oC; Спектр ПМР (300 МГц, ДМСО-d6
) δ, м.д. 6,58 (1H, д, J = 8,5 Гц), 6,66 (1H, с), 7,02 (1H, д, J = 8,2 Гц), 7,14 (1H, дд, J = 8,5 и 2,6 Гц), 7,42 (1H, д, J = 8,2 Гц), 7,45-7,53 (2H, м), 7,76 (1H, д, 1H, J = 2,6 Гц), 9,57 (1H,
шс), 11,03 (1H, с), 7,85 (1H, дд, J = 7,2 и 2,1 Гц), 8,10 (1H, д, J = 7,2 Гц); МС m/e 324 [(M-H)-].
Анализ C18H12ClNO3·0,25H2O:
вычислено: C 65,46; H 3,82; N 4,24,
найдено: C 65,48; H 3,60; N 3,89.
Пример 16
(±)-3-(5-Хлор-2-гидроксифенил)-1,
3-дигидро-6-фенил-2H-индол-2-он
Т. пл. 221-225oC (дек.); Спектр ПМР (300 МГц, ДМСО-d6) δ, м.д. 6,78 (1H, д, J = 9,1 Гц), 6,99 (1H, д, J = 7,6 Гц), 7,05 (1H, д, J
= 6,6 Гц), 7,12-7,16 (3H, м), 7,34 (1H, т, J = 7,3 Гц), 7,44 (2H, т, J = 7,2 Гц), 7,58 (2H, д, J = 7,6 Гц), 9,83 (1H, с), 10,59 (1H, с); МС m/e 336 (MH+).
Анализ C20H14ClNO2·H2O:
вычислено: C 68,29; H 4,01; N 3,98,
найдено: C 68,47; H 3,81; N 3,89.
Пример 17
(±
)-3-(5-Хлор-2-гидроксифенил)-1,3-дигидро-2H-бенз[g]индол-2-он
Т. пл. 211-215oC (дек.); Спектр ПМР (300 МГц, ДМСО-d6) δ, м.д. 4,97 (1H, с), 6,80 (1H, д, J = 8,9
Гц), 7,10-7,17 (3H, с), 7,46-7,53 (3H, м), 7,87 (1H, д, J = 7,5 Гц), 8,10 (1H, д, J = 8,0 Гц), 9,83 (1H, с), 11,25 (1H, с); МС m/e 308 (M-H-).
Анализ C18H12ClNO2·H2O:
вычислено: C 65,96; H 4,31; N 4,27,
найдено: C 65,87; H 3,99; N 3,88.
Пример 18
(±
)-3-(5-Хлор-2-метоксифенил)-1,3-дигидро-3-фтор-6-фенил-2H-индол-2-он
ИК-спектр (KBr, см-1) 1338, 3200, 1738, 1266, 1120, 766, 693; Спектр ПМР (300 МГц, CDCl3) δ,
м.д. 3,56 (3H, с), 6,76 (1H, д, J = 8,7 Гц), 7,11 (1H, с), 7,14 (1H, д, J = 2,3 Гц), 7,20 (1H, д, J = 7,9 Гц), 7,31 (1H, дд, J = 8,6 и 2,3 Гц), 7,37 (1H, д, J = 7,0 Гц), 7,43 (2H, м), 7,54 (2H, д, J =
6,9 Гц), 7,80 (2H, д, J = 2,5 Гц): Спектр19F ЯМР (282 МГц, CDCl3) δ, м.д. -156,62, (3-F); МС m/e 366 (M-H-).
Пример 19
(±
)-3-(5-Хлор-2-метоксифенил)-1,3-дигидро-3-фтор-6-иод-2H-индол-2-он
Т.пл. 205-210oC; ИК-спектр (KBr, см-1) 3600-3200, 1736, 1266; Спектр ПМР (300 МГц, CDCl3)
δ, м.д. 3,55 (3H, с), 6,74 (1H, д, J = 9,8 Гц), 6,80 (1H, дд, J = 7,8 и 2,5 Гц), 7,26 (1H, с), 7,28-7,35 (2H, м), 7,66 (2H, шс), 7,74 (1H, д, J = 2,1 Гц); Спектр19F ЯМР (282 МГц,
CDCl3) δ, м.д. -28,75 (?) (3-F); МС m/e 416 (M-H-).
Пример 20
(±)-3-(5-Хлор-2-гидроксифенил)-1,3-дигидро-6-(4-метилфенил)-2H-индол-2-он
Т. пл. 277-279oC; ИК-спектр (KBr, см-1) 3200, 1686; Спектр ПМР (300 МГц, ДМСО-d6) δ м.д. 2,32 (3H, с), 4,78 (1H, с), 6,81 (1H, д, J = 9,1 Гц), 6,97 (1H, д,
J = 7,7 Гц), 7,03 (1H, д, J = 9,1 Гц), 7,09 (1H, д, J = 1,4 Гц), 7,12-7,16 (2H, м), 7,24 (2H, д, J = 8,5 Гц), 7,47 (2H, д, J = 8,1 Гц), 9,87 (1H, с), 10,58 (1H, с); МС m/e 348 (M-H-).
Пример 21
(±)-3-(5-(Хлор-2-метоксифенил)-1,3-дигидро-3-фтор-7-трифторметил)-2H-индол-2-он
Т. пл. 230-233oC; ИК-спектр (KBr, см-1) 3230,
1754, 1322, 1212, 1128; Спектр ПМР (300 МГц, CDCl3) δ м.д. 3,52 (3H, с), 6,73 (1H, д, J = 8,5 Гц), 7,08 (1H, т, J = 8,1 Гц), 7,24 (1H, с), 7,31 (1H, дд, J = 8,5 и 2,1 Гц), 7,51 (1H,
д, J = 7,4 Гц), 7,62 (1H, шс), 7,76 (1H, д, J = 2,1 Гц); Спектр19F ЯМР (282 МГц, CDCl3) δ, м.д. -63,03 (7-CF3), -159,54 (3-F); МС m/e 358 (M-H-).
Анализ C16H10ClF4NO2:
вычислено: C 53,43; H 2,80; N 3,89,
найдено: C 53,09; H 2,88; N 3,78.
Пример 22
(±)-3-(5-Хлор-2-гидроксифенил)-1,3-дигидро-2H-бенз[e]индол-2-он
Т. пл. 158-160oC; Спектр ПМР (300 МГц, ДМСО-d6) δ, м.д. 5,17 (1H, шс), 7,13 (1H, д, J
= 6,5 Гц), 7,21-7,24 (3H, м), 7,29-7,31 (2H, м), 7,83 (3H, м), 10,63 (1H, с), 6,79 (1H, шс); МС m/e 308 (M-H-).
Анализ C18H13ClNO2·1,
25H2O:
вычислено: C 65,07; H 4,40; N 4,22,
найдено: C 65,70; H 4,38; N 4,08.
Пример 23
(±)-3-(5-Хлор-2-метоксифенил)-1,
3-дигидро-3-фтор-5-метил-2H-индол-2-он
Т. пл. 193-195oC; ИК-спектр (KBr, см-1) 1732, 3200, 1270, 1216; Спектр ПМР (300 МГц, CDCl3) δ, м.д. 2,22 (3H, с),
3,53 (3H, с), 6,74 (1H, д, J = 8,4 Гц), 6,77 (1H, д, J = 7,5 Гц), 6,87 (1H, с), 7,07 (1H, д, J = 8,0 Гц), 7,29 (1H, дд, J = 8,8 и 2,5 Гц), 7,77 (1H, д, J = 2,5 Гц), 8,16 (1H, шс); Спектр19
F ЯМР (282 МГц, CDCl3) δ, м.д. -157,38, (3-F); МС m/e 304 (M-H-).
Анализ C16H13ClFNO2:
вычислено: C 62,86; H 4,
29; N 4,58,
найдено: C 62,67; H 4,29; N 4,49.
Пример 24
(±)-3-(5-Хлор-2-метоксифенил)-1,3-дигидро-3-фтор-4,6-бис(трифторметил)-2H-индол-2-он
Т. пл.
262-264oC; ИК-спектр (KBr, см-1) 3200, 1750, 1316, 1280, 1202, 1140; Спектр ПМР (300 МГц, CDCl3) δ, м.д. 3,38 (3H, с), 6,63 (1H, дд, J = 8,7 и 1,1 Гц), 7,21 (1H,
дд, J = 8,7 и 2,5 Гц), 7,29 (1H, с), 7,33 (1H, с), 7,63 (1H, д, J = 2,1 Гц), 10,91 (1H, шс); Спектр19F ЯМР (282 МГц, CDCl3) δ, м.д. -60,00 (CF3), -63,40
(CF3), -163,42, (3-F); МС m/e 426 (M-H-).
Анализ C17H9ClF7NO2:
вычислено: C 47,74; H 2,12; N 3,27,
найдено: C 47,58; H 2,18; N 3,19.
Пример 25
(±)-3-(5-Хлор-2-метоксифенил)-1,3-дигидро-3,5-дифтор-2H-индол-2-он
Т. пл. 205-207oC; ИК-спектр (KBr,
см-1) 3200, 1732, 1272, 1218, 1144; Спектр ПМР (300 МГц, CDCl3) δ, м.д. 3,53 (3H, с), 6,75 (1H, дд, J = 8,8 и 1,1 Гц), 6,78-6,84 (2H, м), 6,95-7,02 (1H, м), 7,31 (1H, дд,
J = 8,7 и 2,6 Гц), 7,75 (1H, д, J = 2,1 Гц), 8,48 (1H, шс); Спектр19F ЯМР (282 МГц, CDCl3) δ, м.д. -119,53 (5-F), -158,81 (3-F); МС m/e 308 (M-H-).
Анализ C15H10ClF2NО2:
вычислено: C 58,17; H 3,25; N 4,52,
найдено: C 58,02; H 3,45; N 4,41.
Пример 26
(±)-5-Бром-3-(5-хлор-2-метоксифенил)-1,3-дигидро-3-фтор-2H-индол-2-он
Т. пл. 206-208oC; ИК-спектр (KBr, см-1) 3200, 1738, 1300, 1262, 1216, 1126, 820; Спектр ПМР
(300 МГц, CDCl3) δ, м.д. 3,53 (3H, с), 6,75 (1H, д, J = 8,2 Гц), 6,78 (1H, д, J = 7,4 Гц), 7,17 (1H, с), 7,32 (1H, дд, J = 8,5 и 2,3 Гц), 7,41 (1H, д, J = 8,2 Гц), 7,74 (1H, д, J = 2,
4 Гц), 8,37 (1H, шс); Спектр19F ЯМР (282 МГц, CDCl3) δ,, м.д. -158,55, (3-F); МС m/e 368 (M-H-).
Анализ C15H10
BrClFNO2:
вычислено: C 48,61; H 2,72; N 3,78,
найдено: C 48,71; H 2,36; N 3,58.
Пример 27
(±)-3-(5-Хлор-2-гидроксифенил)-1,
3-дигидро-6-[4-(трифторметил)фенил] -2H-индол-2-он
Т. пл. 221-225oC; ИК-спектр (KBr, см-1) 3278, 1686, 1326, 1276; Спектр ПМР (300 МГц, ДМСО-d6) δ,
м.д. 4,81 (1H, с), 6,77 (1H, д, J = 8,4 Гц), 7,04 (1H, д, J = 7,6 Гц), 7,10 (1H, д, J = 1,3 Гц), 7,14 (1H, д, J = 2,6 Гц), 7,18-7,23 (3H, м), 7,77-7,84 (3H, м), 9,83 (1H, с), 10,64 (1H, с); МС m/e 402
(M-H-).
Анализ C21H13ClF3NO2·0,25H2O:
вычислено: C 61,78; H 3,33; N 3,43,
найдено: C 61,97;
H 3,63; N 3,62.
Пример 28
(±)-3-(5-Хлор-2-гидроксифенил)-1,3-дигидро-2H-индол-2-он
Т. пл. 256-258oC; ИК-спектр (KBr, см-1) 3300, 3200,
1680, 820, 750; Спектр ПМР (300 МГц, ДМСО-d6) δ, м.д. 4,75 (1H, с), 6,78 (1H, д, J = 8,6 Гц), 6,85 (2H, т, J = 8,1 Гц), 6,92 (1H, д, J = 7,2 Гц), 7,08 (1H, д, J = 2,5 Гц), 7,11-7,17
(2H, м), 8,78 (1H, с), 10,46 (1H, с); Спектр13C ЯМР (75 МГц, ДМСО-d6) δ, м.д. 48,04, 109,09, 116,87, 121,31, 122,20, 123,72, 126,61, 127,64, 130,01, 142,78, 154,40, 177,
17, 127,99, 130,05; МС m/e 260 (MH+).
Анализ C14H10ClNO2:
вычислено: C 64,75; H 3,88; N 5,39,
найдено: C 64,63; H 3,93; N
5,23.
Пример 29
(±)-3-(5-Хлор-2-метоксифенил)-1,3-дигидро-3-гидрокси-5-(трифторметил)-2H-индол-2-он
Т. пл. 218-220oC; ИК-спектр (KBr, см-1) 3350, 1730, 1325, 1260, 1150, 1120; Спектр ПМР (300 МГц, ДМСО-d6) δ, м.д. 3,41 (3H, с), 6,88 (1H, с), 6,93 (1H, д, J = 8,8 Гц), 7,01 (1H, д, J = 8,1 Гц), 7,09 (1H, д, J = 1,
6 Гц), 7,35 (1H, дд, J = 8,7 и 2,7 Гц), 7,56 (1H, дд, J = 8,1 и 1,1 Гц), 7,80 (1H, д, J = 2,7 Гц), 10,77 (1H, с); Спектр13C ЯМР (75 МГц, ДМСО-d6) δ, м.д. 55,97, 74,26,
109,51, 113,61, 120,06, 120,11, 121,8 (м, CF3), 124,50, 126,37, 126,94, 128,72, 131,38, 133,10, 146,70, 154,31, 177,55; МС m/e 358 (MH+).
Анализ C16
H11ClF3NO3:
вычислено: C 53,72; H 3,10; N 3,92,
найдено: C 53,51; H 3,00; N 3,91.
Пример 30
(±
)-5-Бром-3-(5-хлор-2-метоксифенил)-1,3-дигидро-3-гидрокси-2H-индол-2-он
Т.пл. 245-247oC; ИК-спектр (KBr, см-1) 3450-3200, 1712, 1246; Спектр ПМР (300 МГц, ДМСО-d6) δ, м.д. 3,42 (3H, с), 6,79 (2H, д, J = 8,3 Гц), 6,91 (1H, д, J = 7,1 Гц), 6,93 (1H, с), 7,31-7,36 (1H, м), 7,76 (1H, д, J = 2,7 Гц), 10,50 (1H, с); Спектр13C ЯМР (75 МГц,
ДМСО-d6) δ, м.д. 55,95, 74,60, 111,25, 112,82, 113,49, 124,41, 126,25, 126,85, 128,59, 131,58, 131,68, 134,62, 142,34, 154,32, 177,12; МС m/e 370 (MH+).
Анализ C15H11BrClNO3:
вычислено: C 48,88; H 3,01; N 3,80,
найдено: C 49,52; H 3,03; N 3,58.
Пример 31
(±
)-3-(5-Хлор-2-гидроксифенил)-4,6-дихлор-1,3-дигидро-2H-индол-2-он
Т.пл. 238-240oC; ИК-спектр (KBr, см-1) 3400, 1694, 1318; Спектр ПМР (300 МГц, ДМСО-d6)
δ м.д. 4,83 (1H, шс), 6,70 (1H, шс), 6,82 (1H, с), 7,01 (1H, с), 7,14 (1H, дд, J = 8,7 и 2,4 Гц), 7,4 (1H, шс), 9,70 (1H, шс), 10,82 (1H, с); МС m/e 328 (MH+).
Пример 32
(±)-3-(5-Хлор-2-метоксифенил)-1,3-дигидро-3-гидрокси-6-иод-2H-индол-2-он
Т. пл. 209-211oC; Спектр ПМР (300 МГц, ДМСО-d6) δ, м.д. 3,42
(3H, с), 6,62 (1H, д, J = 7,7 Гц), 6,73 (1H, с), 6,91 (1H, д, J = 8,8 Гц), 7,13 (1H, д, J = 1,4 Гц), 7,18 (1H, дд, J = 7,7 и 1,4 Гц), 7,32 (1H, дд, J = 8,8 и 2,7 Гц), 7,75 (1H, д, J = 2,7 Гц), 10,46
(1H, с); Спектр13C ЯМР (75 МГц, ДМСО-d6) δ, м. д. 55,99, 74,34, 94,43, 113,48, 117,55, 124,36, 125,60, 126,76, 128,48, 129,99, 131,75, 132,06, 144,60, 154,33, 177,28; МС
m/e 416 (MH+).
Анализ C15H11ClJNO3·0,25CH2Cl2:
вычислено: C 41,93; H 2,65; N 3,21,
найдено:
C 41,98; H 2,73; N 3,19.
Пример 33
(±)-3-(5-Хлор-2-гидроксифенил)-1,3-дигидро-6-иод-2H-индол-2-он
Т.пл. 199-203oC (дек.), МС m/e 386 (MH+
).
Анализ C14H9ClJNO2·H2O:
вычислено: C 39,04; H 2,71; N 3,14,
найдено: C 38,82; H 2,40; N 3,04.
Пример 34
(±)-3-(5-Хлор-2-метоксифенил)-1,3-дигидро-3-гидрокси-2H-бенз[f] индол-2-он
Т. пл. 305-307oC (дек.); ИК-спектр (KBr, см-1) 3356, 1728, 1248;
Спектр ПМР (300 МГц, ДМСО-d6) δ, м.д. 3,32 (3H, с), 6,79 (1H, с), 6,89 (1H, д, J = 8,7 Гц). 7,14 (1H, с), 7,24 (1H, т, J = 7,0 Гц), 7,32 (1H, д, J = 2,7 Гц), 7,35-7,41 (2H, м), 7,75
(2H, т, J = 8,5 Гц), 7,85 (1H, д, J = 2,7 Гц), 10,71 (1H, с); МС m/e 357 (M+NH4+).
Пример 35
(±)-3-(5-Хлор-2-гидроксифенил)-1,
3-дигидро-3-гидрокси-2H-бенз[f] индол-2-он
Т. пл. 160-165oC (дек. ); ИК-спектр (KBr, см-1) 3400, 1706; Спектр ПМР (300 МГц, CDCl3-CD3OD) δ,
м.д. 6,71 (1H, дд, J = 7,4 и 1,4 Гц), 7,03 (1H, с), 7,05 (1H, д, J = 2,6 Гц), 7,12 (1H, с), 7,22 (2H, м), 7,29 (1H, д, J = 8,1 Гц), 7,38 (2H, т, J = 8,2 Гц), 7,64-7,69 (3H, м); МС m/e 324 (M-H-).
Пример 36
(±)-3-(5-Хлор-2-гидроксифенил)-1,3-дигидро-2H-бенз[f]индол-2-он
Т. пл. 254-256oC (дек. ); ИК-спектр (KBr, см-1) 3300,
1690, 1250, 740; Спектр ПМР (300 МГц, ДМСО-d6) δ, м.д. 4,88 (3H, с), 6,75 (1H, д, J = 8,6 Гц), 7,15 (1H, с), 7,18 (1H, д, J = 2,7 Гц), 7,22-7,27 (2H, м), 7,37 (1H, т, J = 8,1 Гц), 7,
42 (1H, с), 7,55 (2H, т, J = 9,4 Гц), 9,75 (1H, с), 10,77 (1H, с); МС m/e 308 (M-H-).
Пример 37
(3S)-(+)-(5-Хлор-2-метоксифенил)-1,
3-дигидро-3-фтор- 6-(трифторметил)-2H-индол-2-он
Рацемическую смесь соединений из Примера 14 разделяют на энантиомеры на аналитической ВЭЖХ-колонке Chiracel-OD (250 х 4,6 мм) с использованием
в качестве элюента смеси гексаны/изо-пропанол 9:1 при скорости элюирования 0,75 мл/мин. Детекция осуществляется диодным УФ-детектором HP 1090 при длине волны 220 нм. Первый из элюируемых из колонки
энантиомеров имеет время удержания около 8,22 минуты и является (+)-энантиомером. В препаративных масштабах (до 1 г рацемата) разделение можно производить за один ввод на препаративной ВЭЖХ-колонке
Chiracel-OD (5 х 50 см) с использованием в качестве элюента смеси гексаны/изо-пропанол 9:1 при скорости элюирования 85 мл/мин с разделением по нулевой линии. Перекристаллизацией энантиомера из смеси
метиленхлорида с гексанами дает кристаллы, пригодные для однокристального PCA. Учитывая аномальное рассеяние на атоме хлора, абсолютной конфигурацией асимметрического углеродного атома (+)-энантиомера
является S-конфигурация. Энантиомер имеет характеристики ТСХ, спектров ЯМР, ИК и масс-спектров, аналогичные характеристикам рацемата. Указанное в заголовке соединение имеет т. пл. 198-200oC
и [α]
Пример 38
(3R)-(-)-(5-Хлор-2-метоксифенил)-1,3-дигидро-3-фтор- 6-(трифторметил)-2H-индол-2-он
Рацемическую смесь соединений из Примера 14 разделяют на энантиомеры на аналитической ВЭЖХ-колонке
Chiracel-OD (250 х 4,6 мм) с использованием в качестве элюента смеси гексаны/изо-пропанол 9:1 при скорости элюирования 0,75 мл/мин. Детекция осуществляется диодным УФ-детектором HP 1090 при длине
волны 220 нм. В процессе разделения, описанном в Примере 37, второй из элюируемых из колонки энантиомеров имеет время удержания около 11,58 минуты и является (-)-энантиомером указанного в заголовке
соединения. В препаративных масштабах (до 1 г рацемата) разделение можно производить за один ввод на препаративной ВЭЖХ-колонке Chiracel-OD (5 х 50 см) с использованием в качестве элюента смеси
гексаны/изо-пропанол 9: 1 при скорости элюирования 85 мл/мин с разделением по нулевой линии. Перекристаллизацией энантиомера из смеси метиленхлорида с гексанами дает кристаллы, пригодные для
однокристального PCA. Учитывая аномальное рассеяние на атоме хлора, абсолютной конфигурацией асимметрического углеродного атома (-)-энантиомера является R-конфигурация. Энантиомер имеет характеристики
ТСХ, спектров ЯМР, ИК и масс-спектров, аналогичные характеристикам рацемата. Указанное в заголовке соединение имеет т.пл. 199-201oC и [α]
Реферат
Данным изобретение охватываются новые замещенные 3-фенилоксиндольные производные формулы I, где R - водород, гидроксил или фтор; R1, R2 , R3 и R4 каждый представляет собой независимо водород, C1-4алкил, галоген, трифторметил, фенил, п-метилфенил или п-трифторметилфенил; или R1, R2, R2 и R3, или R3 и R4 вместе образуют бензольное кольцо; R5 - водород или C1-4алкил; R6 - хлор или трифторметил; или его нетоксичная фармацевтически приемлемая соль, сольват или гидрат, которые являются агентами, открывающими кальций-активируемые калийные каналы высокой проводимости и используются при лечении расстройств, реагирующих на открытие калийных каналов. Также обеспечивается способ лечения новыми оксиндольными производными и фармацевтическая композиция на их основе. 3 с. и 28 з.п. ф-лы, 1 табл.

Формула

R - водород, гидроксил или фтор;
R1, R2, R3 и R4 каждый представляет собой независимо водород, C1-4 алкил, галоген, трифторметил, фенил, п-метилфенил или п-трифторметилфенил; или R1 и R2, R2 и R3, или R3 и R4 вместе образуют бензольное кольцо;
R5 - водород или C1-4 алкил;
R6 - хлор или трифторметил;
или его нетоксичная фармацевтически приемлемая соль, сольват или гидрат.

где R1, R2, R3 и R4 независимо каждый представляет собой водород, C1-4 алкил, галоген или трифторметил и, если R1 и R4 - водород, то R2 и R3 - фенил, п-метилфенил или трифторметилфенил; или R1 и R2, R2 и R3 или R3 и R4 вместе образуют бензольное кольцо;
R5 - водород или C1-4 алкил; и
R6 - хлор или трифторметил;
или его нетоксичная фармацевтически приемлемая соль, сольват или гидрат.

где R1, R2, R3 и R4 независимо каждый представляет собой водород, C1-4 алкил, галоген или трифторметил и, если R1 и R4 - водород, то R2 или R3 - фенил, п-метилфенил или трифторметилфенил; или R1 и R2, R2 и R3 или R3 и R4 вместе образуют бензольное кольцо;
R5 - водород или C1-4 алкил; R6 - хлор или трифторметил,
или его нетоксичная фармацевтически приемлемая соль, сольват или гидрат.

где R1, R2, R3 и R4 независимо каждый представляет собой водород, C1-4 алкил, галоген или трифторметил и, если R1 и R4 - водород, то R2 или R3 - фенил, п-метилфенил или трифторметил; или R1 и R2, R2 и R3 или R3 и R4 вместе образуют бензольное кольцо;
R5 - C1-4 алкил;
R6 - хлор или трифторметил;
или его нетоксичная фармацевтически приемлемая соль, сольват или гидрат.
(±)-3-(5-хлор-2-метоксифенил)-1, 3-дигидро-3-гидрокси-6-(трифторметил)-2Н-индол-2-он;
(±)-3-(5-хлор-2-метоксифенил)-1,3-дигидро-6-(трифторметил)-2Н-индол-2-он;
(±)-3-(5-хлор-2-гидроксифенил)-1, 3-дигидро-3-гидрокси-6-(трифторметил)-2Н-индол-2-он;
(±)-3-(5-хлор-2-гидроксифенил)-1,3-дигидро-6-(трифторметил)-2Н-индол-2-он;
(±)-3-(5-хлор-2-гидроксифенил)-4, 6-дихлор-1,3-дигидро-3-гидрокси-2Н-индол-2-он;
(±)-3-(5-хлор-2-гидроксифенил)-1,3-дигидро-3-гидрокси-7-(трифторметил)-2Н-индол-2-он;
(±)-3-(5-хлор-2-гидроксифенил)-1, 3-дигидро-3-гидрокси-4-(трифторметил)-2Н-индол-2-он;
(±)-1,3-дигидро-3-гидрокси-3-[2-гидрокси-5-(трифторметил)фенил] -6-(трифторметил)-2Н-индол-2-он;
(± )-3-(5-хлор-2-гидроксифенил)-1,3-дигидро-3-гидрокси-4,6-бис-(трифторметил)-2Н-индол-2-он;
(-)-3-(5-хлор-2-метоксифенил)-1,3-дигидро-3-гидрокси-6-(трифторметил)-2Н-индол-2-он;
(+)-3-(5-хлор-2-гидроксифенил)-1,3-дигидро-3-гидрокси-6-(трифторметил)-2Н-индол-2-он;
(-)-3-(5-хлор-2-гидроксифенил)-1,3-дигидро-3-гидрокси-6-(трифторметил)-2Н-индол-2-он;
(± )-3-(5-хлор-2-метоксифенил)-1,3-дигидро-3-фтор-6-(трифторметил)-2Н-индол-2-он;
(3S)-(+)-(5-хлор-2-метоксифенил)-1,3-дигидро-3-фтор-6-(трифторметил)-2Н-индол-2-он;
(3R)-(-)-(5-хлор-2-метоксифенил)-1,3-дигидро-3-фтор-6-(трифторметил)-2Н-индол-2-он;
(±)-3-(5-хлор-2-гидроксифенил)-1,3-дигидро-3-гидрокси-2H-бенз[g] индол-2-он;
(± )-3-(5-хлор-2-гидроксифенил)-1,3-дигидро-6-фенил-2Н-индол-2-он;
(±)-3-(5-хлор-2-гидроксифенил)-1,3-дигидро-2Н-бенз[g]индол-2-он;
(±)-3-(5-хлор-2-метоксифенил)-1, 3-дигидро-3-фтор-6-фенил-2Н-индол-2-он;
(±)-3-(5-хлор-2-метоксифенил)-1,3-дигидро-3-фтор-6-иод-2Н-индол-2-он;
(±)-3-(5-хлор-2-гидроксифенил)-1, 3-дигидро-6-(4-метилфенил)-2Н-индол-2-он;
(±)-3-(5-хлор-2-метоксифенил)-1,3-дигидро-3-фтор-7-(трифторметил)-2Н-индол-2-он;
(±)-3-(5-хлор-2-гидроксифенил)-1, 3-дигидро-2Н-бенз[e]индол-2-он;
(±)-3-(5-хлор-2-метоксифенил)-1,3-дигидро-3-фтор-5-метил-2Н-индол-2-он;
(±)-3-(5-хлор-2-метоксифенил)-1,3-дигидро-3-фтор-4, 6-бис-(трифторметил)-2Н-индол-2-он;
(±)-5-бром-3-(5-хлор-2-метоксифенил)-1,3-дигидро-3-фтор-2Н-индол-2-он;
(±)-3-(5-хлор-2-гидроксифенил)-1, 3-дигидро-6-[4-(трифторметил)фенил] -2Н-индол-2-он;
(±)-3-(5-хлор-2-гидроксифенил)-1,3-дигидро-2Н-индол-2-он;
(±)-5-бром-3-(5-хлор-2-метоксифенил)-1, 3-дигидро-3-гидрокси-2Н-индол-2-он;
(±)-3-(5-хлор-2-гидроксифенил)-4,6-дихлор-1,3-дигидро-2Н-индол-2-он;
(±)-3-(5-хлор-2-метоксифенил)-1, 3-дигидро-3-гидрокси-6-иод-2Н-индол-2-он;
(±)-3-(5-хлор-2-гидроксифенил)-1,3-дигидро-6-иод-2Н-индол-2-он;
(±)-3-(5-хлор-2-метоксифенил)-1, 3-дигидро-3-гидрокси-2Н-бенз[f] индол-2-он;
(±)-3-(5-хлор-2-гидроксифенил)-1,3-дигидро-3-гидрокси-2Н-бенз[f] индол-2-он; и
(±)-3-(5-хлор-2-гидроксифенил)-1, 3-дигидро-2Н-бенз[f]индол-2-он;
21. Соединение по п.20, выбранное из группы, которая включает
(±)-3-(5-хлор-2-гидроксифенил)-1,3-дигидро-6-(трифторметил)-2Н-индол-2-он;
(±)-3-(5-хлор-2-гидроксифенил)-1,3-дигидро-3-гидрокси-6-(трифторметил)-2Н-индол-2-он;
(±)-3-(5-хлор-2-метоксифенил)-1,3-дигидро-3-фтор-6-(трифторметил)-2Н-индол-2-он;
(3S)-(+)-(5-хлор-2-метоксифенил)-1,3-дигидро-3-фтор-6-(трифторметил)-2Н-индол-2-он;
(3R)-(-)-(5-хлор-2-метоксифенил)-1,3-дигидро-3-фтор-6-(трифторметил)-2Н-индол-2-он;
(± )-3-(5-хлор-2-гидроксифенил)-1,3-дигидро-3-гидрокси-2Н-бенз[g] индол-2-он;
(±)-3-(5-хлор-2-гидроксифенил)-1,3-дигидро-6-фенил-2Н-индол-2-он; и
(± )-3-(5-хлор-2-гидроксифенил)-1,3-дигидро-2Н-бенз[e]индол-2-он;
22. Фармацевтическая композиция для лечения расстройств, реагирующих на агенты, открывающие кальций-активируемые калийные каналы высокой проводимости, включающая терапевтически эффективное количество соединения по п.1 в сочетании с фармацевтически приемлемым носителем или разбавителем.

Комментарии