Производные оксиндолов или их фармацевтически приемлемые соли - RU2073671C1
Код документа: RU2073671C1
Чертежи
Описание
Настоящая заявка является частичным продолжением находящейся на рассмотрении заявки серийный N 07/340 113, поданной 18 апреля 1989 года.
Настоящее изобретение относится к новым производным 3-замещенных 2-оксиндолов, которые являются ингибиторами простагландин Н2 синтазы, 5-липоксигеназы и биосинтеза интерлейкина-1.
Соединения изобретения являются полезными в качестве ингибиторов простагландин Н2 синтазы и биосинтеза интерлейкина-1, самих по себе, а также в качестве анальгетических, противовоспалительных и противоаритмических агентов при лечении хронических воспалительных заболеваний. Настоящее изобретение также относится к фармацевтическим композициям, содержащим указанные производные 3-замещенных 2-оксиндолов; к способам ингибирования простагландин Н2 синтазы и биосинтеза интерлейкина-1 и к лечению хронических воспалительных заболеваний у млекопитающих с помощью указанных соединений. Кроме того, настоящее изобретение относится к некоторым новым карбоновым кислотам, полезным в качестве промежуточных продуктов, при получении 3-замещенных 2-оксиндолов настоящего изобретения и к способу получения производных 3-замещенных 2-оксиндолов.
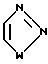
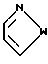
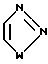
В патенте США N 5 469 942 описаны некоторые 2-оксиндол-1-карбоксамиды формулы:
где Х является Н, фтором, хлором, бромом, (C1-C4)-алкилом, (C3-C7)-циклоалкилом, (С1-C4 )-алкокси, (С1-C4)-алкилтио, трифторметилом,
(С1-C4)-алкилсульфинилом, (C1-C4)-алкилсульфонилом, нитро, фенилом, (С2-C4)-алканоилом, бензоилом, тоноилом, (С1-C4)-алканамидо, бензамидо или N, N диалкилсульфамоилом, имеющим 1 3 атома углерода в каждом из указанных алкилов; Y является Н, фтором, хлором, бромом, (C1 C4)-алкилом, (C3 - C7)-циклоалкилом, (C1 C4)-алкокси, (С1-C4)-алкилтио и трифторметилом; R1 является (C1 C8)-алкилом, (C3 C7)-циклоалкилом, (C4 - C7)-циклоалкенилом, фенилом, замещенным фенилом, фенилалкилом, имеющим 1 3 атома углерода в указанном алкиле, замещенным /фенокси/алкилом, содержащим 1 3 атома углерода в указанном алкиле, /тиофенокси/ алкилом, содержащим 1 3 атома углерода в указанном алкиле, нафтилом, бицикло (2.2.1) гептан-2-илом, бицикло (2.2.1)гепт-5-ен-2-илом или -(СН2)n-Q-Ro' n равно нулю, 1 или 2; Q является двухвалентным радикалом, происходящим из фурана, тиофена, пиррола, пиразола, имидазола, тиазола, изотиазола, оксазола, изоксазола, 1,2,3-тиадиазола, 1,3,4-тиадиазола, 1,2,5-тиадиазола, тетрагидрофурана, тетрагидротиофена, тетрагидропирана, тетрадротиопирана, пиридина, пиримидина, пиразина, бензо(в) фурана и бензо(г) тиофена; Ro является Н или (C1 - C3)-алкилом; и является (C1 C6)-алкилом, (C3 - C7)-циклоалкилом, бензилом, фурилом, тиенилом, пиридилом или
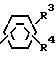
где R3 и R4 каждый является Н, фтором, хлором, (С1-C4)-алкилом, (C1 C4)-алкокси или трифторметилом.
В этом патенте также описано, что указанные 2-аксиндол-1-карбоксамиды являются ингибиторами циклооксигеназы и липоксигеназы, обладают анальгетической активностью у млекопитающих и являются полезными при лечении боли и облегчения симптомов хронических заболеваний, таких как воспаление и боль, связанные с ревматоидным артритом и остеоартритом.
В
патенте США N 4556672 описаны некоторые 3-алилзамещенные 2-оксиндол-1-карбоксамиды формулы:
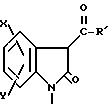
где Х, Y и R1 имеют значения, указанные ранее для соединений патента США N 4569942. Соединения патента США N 4556672 описаны как имеющие такую же активность, как и соединения патента США N 4569942, указанную выше.
В патенте США N 4861794 описано использование соединений формулы:
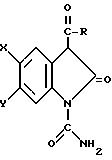
и из фармацевтически приемлемых основных солей, где Х является Н, Сl или F, Y является Н или Сl, а R является бензилом или тионилом, для ингибирования биосинтеза интерлейкина-1 (ИЛ-1) и для лечения вызванных ИЛ-1 расстройств и дисфункций.
В заявке на патент РСТ серийный N РСТ US 88/03658, поданной 18 октября 1988 года, описаны нестероидные противовоспалительные
агенты формулы:
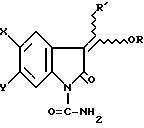
где каждый из X и Y является водородом, фтором или хлором; R1 является 2-тиенилом или бензилом; R1 является алканоилом, циклоалкилкарбонилом, фенилалканоилом, бензоилом и некоторыми замещенными бензоильными группами, теноилом, омега-алкокси-карбонилалканоилом, алкоксикарбонилом, феноксикарбонилом, 1-алкоксикарбонилокси, алкилсульфонилом, метилфенилсульфонилом и диалкилфосфонатом.
Уже сообщалось, что интерлейкин-1 (ИЛ-1) стимулирует ресорбцию кости как in vitro тaк и in vivo, Hayward M.U.Fiedler-Hagy Cn. Агенты и действия, 22, 251 254 (1987). Также сообщалось здесь, что ИЛ-1, между прочим, индуцирует продуцирование простагландина Е2 (ПГЕ2), ПГЕ2 является стимулятором резорбции кости и участвует в потере кости. Смотри Hayward M. и Caggiano T.J.annual Reports in Medicinae Chemistry, 22, Sect. IV, Chapter 17, 169 178 (1987). Остеопороз определяется как ослабление потери минеральных составляющих кости, что в результате приводит к более высокой скорости перелома. Смотри Hayward M. и Caggiano T.J. выше, и приведенные здесь ссылки.
Уже сообщалось, что интерлейкин-1 включается в патогенез многих заболеваний. Смотри Sinarello C.A. J. Clin Jmmunjc 5, 287 237 (1985), содержание которых приводится здесь в качестве уровня техники. Кроме того, было обнаружено, что повышение уровня ИЛ-1 подобного материала ассоциируются с псориазом. Caмp, R.S. al. J.Jmmunal 137, 3469 3474 т (1986).
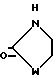
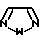
Настоящее изобретение обеспечивает новые 3-замещенные 2-оксиндольные соединения формулы:
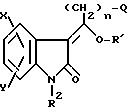
и их фармацевтически приемлемые соли,
где Х является Н, F, Cl, Br, (1C1-C6)-алкилом, (C3-C8)-циклоалкилом, NO2, CF3, CN, CH, S(O)mR3, OR4, COR4 или CONR4R5.
Y
является H, F, CL, Br, (C1-C2(2АЛКИЛОМ6 (C3-C8)-циклоалкилом, ТO2, CF3, CN, S(O)gR17, OR18, COR18 или
CONR18R19,
R1 является Н, алканоилом с 2 10 атомами углерода, циклоалкилкарбонилом с 5 7 атомами углерода, фенилалканоилом с 7 10 атомами углерода,
хлорбензоилом, метоксибензоилом, теноилом, омега-алкоксикарбонилалканоилом, указанная алкоксигруппа содержит 1 3 атома углерода, а указанная алканоильная группа содержит 3 5 атомов углерода,
алкоксикарбонилом с 2 10 атомами углерода, феноксикарбонилом, 1-(ациклокси)-алкилом, где ацил имеет 1 4 атома углерода, 1-(алкоксикабонилокси) алкилом, где указанная алкоксигруппа имеет 2 5 атомов
углерода, а указанный алкил имеет 1 4 атома углерода, алкилом с 1 3 атомами углерода, алкилсульфонилом с 1 3 атомами углерода, метилфенилсульфонилом или деалкилфосфонатом, где каждый из указанных
алкилов содержит 1 3 атома углерода;
R2 является СOR6, CONR7R8 (С1-C6)-алкилом, (С3-C8)-циклоалкилом,
фенилом или моно-, или дизамещенным фенилом, где заместитель или заместители каждый является Сl, Br, F (C1-C6)-алкилом, (С1-C6)-алкокси или СF3;
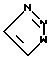
Q является
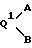
А является Н, F, Cl, Br. I, CF3 , OR9, S(O)pR10, COOR11, CONR9R11, CN, NO2, COR10, CH2OR11, OCOR10, NR9R11, N(R9)COR11, SO2NR9R11
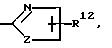
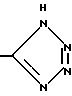
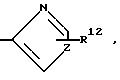
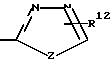
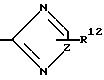
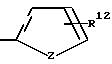
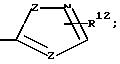
B является Н, F, Cl, Br, I, CF3, OR19, S(O)tR14, COOR15, CONR13R15, CN, NO2, COR14, CH2OR15, OCOR14, NR13R15, N(R13)COOR15 или SO2NR13R15
при условии, что А и В не могут быть оба Н или А и В, взятые вместе, соединенные с одним и тем же углеродом кольца Q, и равны оксо, или когда А не является Н и имеет указанные ранее значения или является (C1-C4)-алкилом;
A1 является F, Cl, Br, J, CF3, OR9, S(O)pR10, COOR11, CONR9R11, CN, NO2, COR10, CH2OR11, OCOR10, NR9R11, N(R9 )COOR11, или SO2NR9R11
Q1 является
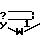
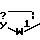
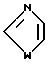
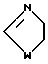
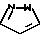
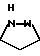
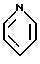
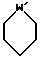
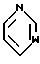
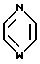
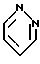
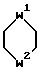
Q2 является
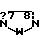
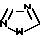
м; n, p, q и t каждый равен нулю, 1 или 2;
W1 и Z каждый является О, S или NR11;
W1 и W2 каждый является О, S или NR10 при условии, что когда один из W1 или W2 является О, S или NR10, другой является О или S, R3, R10, R6 , R14 и R17 каждый является (С С)-алкилом или фенилом; R5, R8, R11, R15 и R19 каждый является Н, (С1-C6)-алкилом или фенилом; R4, R7, R9, R13 и R18 каждый является Н или (C1-C6)-алкилом; и является Н, F, Cl, Br, CF3 или (C1-C6)-алкилом.
Хотя приведенные выше соединения формулы I показаны как энолы, простые и сложные эфиры энолов, должно быть понятно, что когда R1 является Н, соединения формулы I могут быть в их таутомерной кетонной форме. То есть,
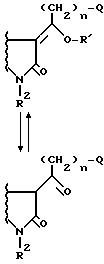
Все такие таутомерные формы входят в область настоящего изобретения и приложенной формулы изобретения и изображаются формулой I. Далее заместители у экзоциклической двойной связи в положении 3 соединений формулы I могут быть син, анти или смесью обоих. Cледовательно соединения формулы I, имеющие структуры
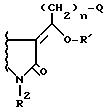
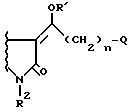
и их смеси входят в область настоящего изобретения и все такие изомеры описываются формулой I и входят в область приложенной формулы изобретения.
Соединения формулы I, у которых R1 является другим, чем Н, являются пролекарствами соединений формулы I, у которых R1 является Н, и их солей.
Термин "пролекарство" относится к соединениям, которые являются предшественниками лекарств, которые после введения и абсорбции млекопитающими, выделяют лекарство in vivo с помощью некоторых метаболических процессов.
После желудочно-кишечной абсорбции пролекарства гидролизуются in vivo в соответствующие соединения формулы I, где R является Н, или их соли. Поскольку пролекарства изобретения не являются энольными кислотами, сводится к минимуму экспозиция желудочно-кишечного тракта родственным кислотным соединением.
Предпочтительная группа соединений настоящего изобретения составлена соединениями формулы I выше, где R1 является Н. Другой
предпочтительной группой соединений является группа соединений формулы I, у которых Х и Y каждый является Н, F, Cl, NO2 (С1-C3)-алкилом или CF3. Еще одной
предпочтительной группой соединений является группа соединений формулы I, у которых R2 является COR6, CONR7R8 или (С1-C6)-алкилом, где
R6, R7 и R8 имеют указанные ранее значения. Другой предпочтительной группой соединений настоящего изобретения является группа соединений формулы I, где Q является
Q1, a Q1 является
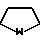
Другой предпочтительной группой соединений являются соединения формулы I, в которых Q является Q1, где Q1 является
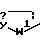
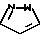
W является О или S; a W1 является О или S. Другая предпочтительная группа соединений состоит из соединений, у которых Q является Q2, где Q2 является
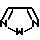
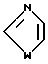
Более предпочтительной группой соединений являются соединения, у которых Q является Q1, где Q1 является
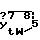
а W является Q или S. Особенно предпочтительные соединения являются теми, у которых R1 является Н; Х и Y каждый является Н, F, Cl, NO2 (С1-C3)-алкилом или СF3; R2 является COR6, CONR7T8 или (C1-C6)-алкилом, где R6, R7 и R8 имеют указанные ранее значения; а Q является Q1, где Q1 является
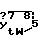
где W имеет указанные ранее значения, или Q является Q1, где Q1 является
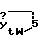
где W является Q или S, или Q является Q, где Q1 является
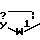
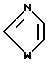
где W является Q или S и W1 является Q или S или Q является Q2, где Q2 является
где W является S. Еще более предпочтительными соединениями являются те из непосредственно приведенных выше, у которых является S, R2 является CONR7R8 и R7 и R8 являются Н. Еще более предпочтительными являются указанные соединения, у которых Х является Н, Cl или CF3; Y является Н, Cl или F; A является Cl, Br, F, CF, SCH3, OCH3 или CH2OCH3; и В является Н, Cl, Br или СН3. Другими особенно предпочтительными соединениями являются указанные соединения, у которых n равно нулю или 1, когда n равно нулю, эти соединения являются более предпочтительными.
Еще одной предпочтительной группой соединений являются соединения формулы I и соединения, указанные выше, как предпочтительные, более предпочтительные и особенно предпочтительные, у которых А является Н, F, Cl, Br, CF3, OR9, CN, NO2, COR10, CH2OR11, N(R9)COR11, а В является Н, F, Cl, Br, CF3, OR13, CN, NO2, COR14, CH2OR15 или N(R13)COR15, где R9, R10, R11, R13, R14 и R15 имеют указанные ранее значения, или А и В, взятые вместе, связанные с одним и тем же углеродом кольца Q1 и равны оксо, или когда А не является Н, В имеет указанные ранее значения или является (С1-C3)-алкилом; и А1 является F у еще более предпочтительных соединений, являющихся такими соединениями, у которых R6 является CH3; R7 является Н и R8 является Н или (C1-C4)-алкилом.
Соединения формулы I выше, у которых R1 является Н, являются активными как ингибиторы простагландин Н2 синтазы (циклооксогеназы), как ингибиторы 5-липоксигеназы и как ингибиторы биосинтеза интерлейкина-1 (ИЛ-1) у млекопитающих. Соединения формулы I в дополнение к их полезности как такие ингибиторы являются полезными как анальгетики, противовоспалительные и антиаритритные агенты при лечении хронических воспалительных заболеваний у млекопитающих.
Настоящее изобретение также обеспечивает фармацевтические композиции, содержащие соединения формулы I. Далее настоящим изобретением обеспечиваются способы ингибирования простагландин Н2 синтазы и биосинтеза интерлейкина-1 у млекопитающих при введении эффективного количества соединений формулы I указанному млекопитающему. Настоящим изобретением также обеспечивается способы лечения вызванных интерлейкином-1 расстройств и иммунных дисфункций и/или хронических воспалительных заболеваний у млекопитающих при введении указанным млекопитающим эффективного количества соединения формулы I. В рамках настоящего изобретения такие хронические заболевания включают, но не ограничиваются ими, псориаз, ревматоидный артрит и остеоартрит.
Кроме того, настоящее изобретение обеспечивает новые карбоновые кислоты формулы
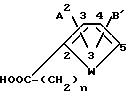
и их соли, у которых А2 является Н; В1 находится в положении 4 и является S(O)p, R16 или СOOCH3, или В1 находится в положении 5 и является SO2NHCH3 или В1 находится в положении 4 или 5 и является СON(CH3)2
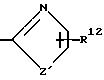
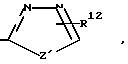
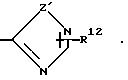
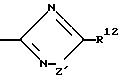
n' равно нулю; p' равно 1;
W3 является S; Z1 является О или S, R12 является Н, Cl, Br, CF3 или (C1-C6)-алкилом; и R16 является (С1-C6)-алкилом.
Соединения формулы II являются полезными в качестве промежуточных продуктов при получении некоторых соединений формулы I.
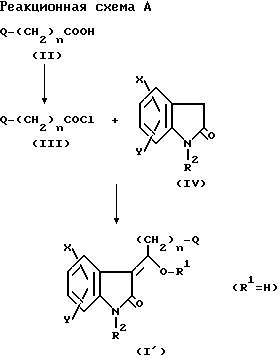
Кроме того, настоящее изобретение обеспечивает новый способ получения некоторых соединений
формулы I, выше у которых R1 является Н, а R2 является R20 как определено ниже, который заключается во взаимодействии соединения формулы
Q-(CH2
)n COOH (II),
где Q и n имеют указанные ранее значения для соединения формулы I с молярным избытком 1,1'-карбонилдиимидазола в инертном реакционном растворителе в инертной
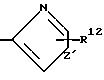
атмосфере и взаимодействии продукта в присутствии основного агента с производным 2-оксиндола формулы
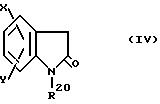
где Х и Y определены выше для соединений формулы I, а R20 является COR6 CONR7R8 фенилом или моно- или дизамещенным фенилом, в котором заместителем или заместителями являются Cl, F, Br, (C1-C6)-алкилом, (C1-C6)-алкокси или CF3, где R6, R7 и R8 определены выше для соединений формулы I, при температуре около 0 50oС в инертном реакционном растворителе в инертной атмосфере.
Способ получения соединений формулы I, у которых R1 является Н, показан на реакционной схеме А выше и описан ниже. Замещенные 2-оксиндольные соединения формулы IV получают по методикам, описанным в патентах США 3634453, 4556672, 4569 942, 4695571 в ЕП 175551 и приведенных здесь ссылках. Их содержание приведено здесь в качестве уровня техники. Карбоновые кислоты формулы получают, как описано ниже, и активируют при взаимодействии соединения формулы II с молярным избытком тионилхлорида, необязательно в присутствии инертного реакционного растворителя. Подходящими инертными реакционными растворителями являются те, которые будут, по крайней мере, частично растворять один или все реагенты или продукт. Полученное в результате карбонилхлоридное соединение формулы III растворяется в инертном реакционном растворителе и его медленно прибавляют к раствору, охлажденному до примерно 0oС, состоящему из примерно эквимолекулярного количества замещенного 2-оксиндола формулы IV и молярного избытка основного агента в инертном реакционном растворителе. Реакционный инертный растворитель описан выше, но на практике обычно используют полярный апротонный растворитель, такой как N,N-диметилформамид, N, N-диметилацетамид, N-метилпирролидон или диметилсульфоксид. Предпочтительным растворителем является диметилформамид. Может быть использовано широкое разнообразие основных агентов в реакции между карбонилхлоридом формулы III и замещенным 2-оксиндолом формулы IV. Однако предпочтительными основными агентами являются третичные амины, такие как триметиламин, триэтиламин, трибутиламин, N-метилморфолин, N-метилпиперидин, пиридин и 4-/N,N-диметиламино/пиридин, особенно предпочтительным основным агентом является 4-/N, N-диметиламино/пиридин. После прибавления карбонилхлоридного соединения формулы III к замещенному 2-оксиндолу формулы IV реакционной смеси дают нагреться до примерно 25oС и продолжают реакцию при этой температуре. Время реакции составляет от примерно 30 мин до 2 ч. По окончании реакции реакционную смесь подкисляют, а затем извлекают продукт, например, фильтрацией. Затем продукт можно промыть, высушить и снова очистить стандартными методами, такими как перекристаллизация.
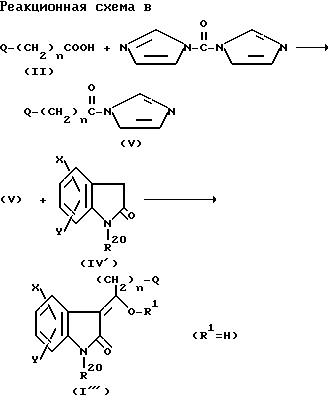
Альтернативно соединения формулы I, в которых R является Н, могут быть получены по новому способу изобретения, показанному на реакционной схеме В и описанному ниже. Карбоновые кислоты формулы Н, полученные как описано ниже, вводят в реакцию с небольшим молярным избытком 1,1-карбонилдиимидазола в инертном реакционном растворителе. Реакцию проводят при температуре около 25oС и перемешивают в инертной атмосфере. Реакцию проводят в течение примерно 2 ч, после чего всю реакционную смесь прибавляют к смеси, состоящей из примерно эквимолекулярного количества замещенного 2-оксиндольного соединения формулы IV, полученного, как описано выше, в присутствии молярного избытка основного агента в инертом реакционном растворителе, в инертной атмосфере. Подходящими инертными реакционными растворителями являются те, что описаны выше для реакционной схемы А, а предпочтительным для использования здесь растворителем является N, N-диметилформамид. Инертную атмосферу получают при проведении реакции в инертном газе, таком как азот или аргон. Подходящими основными агентами являются тем, что описаны выше для реакционной схемы А, а предпочтительными основными агентами являются 4-/N,N-диметиламино/пиридин и триэтиламин.
Другой способ, полезный для получения соединений формулы I, в который R1 является
Н, заключается в присоединении заместителя
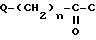
в положение 3 требуемого 2-оксиндольного соединения формулы:
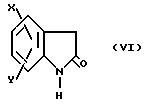
при взаимодействии соединения формулы VI с производным соответствующих кислоты формулы Н выше по методике, описанной в патенте США 4556672. Полученные в результате соединения формулы
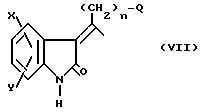
затем превращают в соответствующие соединения формулы I' выше по методикам, описанным в патентах США 3634453, 4556672, 4569942, 4695571 в ЕП 175551 и приведенных здесь ссылках.
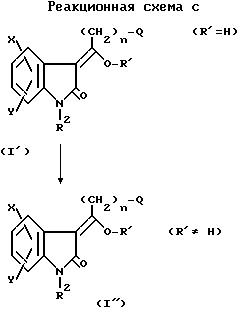
Имеется два способа, которые могут быть применены для синтеза соединений формулы I, в которой R1 является другим, чем водород (формула I'' в реакционной схеме С). Первый способ заключается в обработке раствора соответствующего замещенного 2-оксиндола формулы I' выше и эквимолекулярного количества триэтиламина в инертном реакционном растворителе, таком как хлороформ, при 0oС с эквимолекулярным количеством, плюс небольшой избыток необходимого хлорангидрида кислоты, хлорформата, оксаниевой соли или алкилирующего агента. Через 2 ч реакционной смеси дают нагреться до комнатной температуры и оставляют на 2 3 ч. Если исходный оксиндол не прореагировал полностью, смесь охлаждают до 0oС, прибавляют дополнительный ацилирующий или алкилирующий агент и повторяют процесс до тех пор, пока не израсходуется весь исходный оксиндол.
Продукт отделяют от реакционного растворителя фильтрованием и промывают 1н. соляной кислотой, затем распределяют в органическом растворителе и насыщенном растворе бикарбоната натрия. Органический слой сушат, фильтруют и концентрируют в вакууме. Полученный в результате продукт очищают перекристаллизацией или хроматографией.
Вторая процедура, полезная и при получении соединений настоящего изобретения, у которых R1 не является водородом, заключается в контактировании в безводном инертном реакционном растворителе, таком как ацетон, соответственно замещенного 2-оксиндола формулы I' с трехкратным молярным избытком необходимого алфа-хлоралкилкарбоната, пятикратным молярным избытком йодида натрия и двукратным молярным избытком безводного карбоната калия (высушенного в глубоком вакууме при 165oС в течение 1 ч) и нагревании указанной реакционной смеси при кипячении с обратным холодильником в течение 16 ч.
Реакционную смесь охлаждают, разбавляют водой и экстрагируют продукт не смешивающимся с водой растворителем, таким как диэтиловый эфир или хлороформ. Объединенные экстракты сушат, фильтруют и фильтрат концентрируют в вакууме. Полученный в результате сырой продукт очищают перекристаллизацией и/или хроматографией.
Некоторые карбоновые кислоты формулы II являются известными
и карбоновые кислотные соединения формулы II включают новые карбоновые кислоты формулы II', полученные известными способами или по способам, аналогичным известным методикам. Такие способы могут
включать получение соответствующих сложных эфиров или нитридов соответствующих карбоновых кислот, которые в случае гидролиза по известным методикам дают интересующие карбоновые кислоты. Такие способы
описаны: Taylor, E.C. at al. J O.C.50:1002 (1985); Noto, R. et al. J. Chem. Soc. P.T. 11, 689 (1987); Schick, J.W. et al. J. Am. Chem. Soc. 70: 286 (1948); Carpenter, A. J. et al. Tetrahedron 41:3808
(1985); Gronowitz, S. et al. Arkiv. for Kemi. 21:265 (1963); Benkeser, R. A. et al. J.O.C. 38: 3660 (1973); Corral, C. et al. Heterocycles 23:1431 (1985); Iriarte, J. et al. J. Het. Chem. 13: 393
(1976); Reinecke, M.G. et al. Synthesis, 327 (1980); Lawesson, S.O. Arkiv. for Kemi. 11:317 (1957); Gronowitz, S. Arkiv. for Kemi. 8:87 (1955); Knight, D.W. et al. J. Chem. Soc. P.T.I. 791 (1983);
Gronowitz, S. Arkiv. for Kemi. 12:239 (1958); Sice, J. Am. Chem. Soc. 75: 3697 (1953); Bohlmann, F. et al. Chem. Ber. 106:497 (1973); Thames, S. F. et al. J. Het. Chem. 3:104 (1966); Arndt, F. et al.
Chem. Ber. 94:1757 (1961); Cymerman-Craig, J. et al. J. Chem.Soc. 237 (1954); Lora-Tamayo, M. et al. Anales Real Soc. Espan. Fis. Quim. Ser. B 62:187 (1966); Nemec, N. et al. Coll. Czech. Chem. Comm.
39:3527 (1974); Janda, M. et al. Coll. Czech. Chem. Comm. 27: 1191 (1962); Carpenter, A. J. et al. Tetrahedron Letters 26:1777 (1985); Satonaka, H. Bull. Chem. Soc. Japan 56:2463 (1983); Kinoshita, T.
et al. Bull. Chem. SOc. Japan 48:1865 (1975); Schwertner, E. et al. CA 88: 105790c (1978); Takaya, T. et al. bull. Chem. Soc. Japan 41:2086 Takaya, T. et al. Bill. Chem. Soc. Japan 41:2086 (1968); Kim,
H. et al. J. Med. Chem. 29: 1374 (1986); Dostert, P. et al. Eur. J. Med. Chem. Chim. Ther. 17:437 (198); Sato, N. et al. J. Heterocyclis Chem. 19:407 (1982); Ladruee, D. et al. Heterocycles 22: 299
(1984); Leanxa, W.J. et al. JACS 75:4086 (1953); Barlin, G.B. et al. Aust. J. Chem. 30:2319 (1977); Gregory, G.I. et al. JCS P. T. 1: 47 (1973); Moriarty, R.M. et al. JACS 89:5958 (1967); Ross, J.M.
et al. JACS 86: 2861 (1964); Goerdeler, J. et al. Chem. Ber. 99:1618 (1966); Demaree, P. et al. Can. J. Chem. 55:243 (1977); U.S. Patent 4,001,238; Kawazu, M. et al. J. Med. Chem. 15:914 (1972);
Buckle, D.R. et al. JCS P.T. 1: 627 (1982); Naikm S.R. et al. JOC 38:4353 (1973); Okada, M. et al. Marcomolecules 19: 503 (1986); Jndetti, M.A. et al. CA 92:76268p (1980); Neth. Appl. 6,503,440, Sept.
20, 1965; Kenley, R.A. et al. CA 101:90841f (1984);
Schmidt, U. et al. CA 96:104572m (1982); Lukes, R. et al.Cjem. listy 51: 1510 (1957); Krowicki, K. et al. JOC 52:3493-3501 (1987); Goya, P.
et al. Heterocycles 24:3451 (1986); Montero, J.L. et al. J. Heterocyclic Chem. 15: 929 (1978); Yasuda, N. et al. J. Heterocyclic Chem. 24:303 (1987); Hosmane, R.S. et al. Heterocycles 24:2743 (1986);
Rapoport, H. et al. Environ. Health Persp. 67: 41 (1986); Kravchenko, T.B. et al. CA 107:18953t (1987); Stanovnik, B. et al. Heterocycles 12:761 (1979); Smithm R. C. et al. Biochem. Oharmacol. 36:1457
(1987); Bosso, C. et al. Org. Mass Spectrom. 20:263 (1985); Takagi, T. et al. CA 83:164172x (1975); Bende, Z. et al. CA98:89254e (1983); Sarodnick, G. et al. CA101:38426k (1984); Fletton, R.A. et al.
CA107:39474k (1987); Solomon, D.M. et al. Heterocycles 26:651 (1987); Erlenmeyer, H. et al. Helv. Chim. Acta 27:1432 (1944); CA98:95673 (1983); U.S. Patent 4, 437, 876; Hundle, B. S. et al.
Biochemistry 26:4505 (1987); Marutani, Y. et al. CA104: 19320q (1986); Golubev, A.A. et al. CA107:236584x (1987); Higuchi, M. et al. CA104: 215392t (1986); Nakagawa, M. et al. Tetrahedron Letters 27:
6087-6090 (1986); Pereira, M.A. et al. CA101:165001t (1984); Fujii, S. et al. CA102: 45788d (1985); Bredereck, H. et al. Chem. Ber. 97:1414 (1964); Howe, R. K. et al. CA95:80933f (1981); Ibarra, C.A.
et al. Tetrahedron Letters 26:243 (1985);
Hoppe, D. Justus Liebigs Ann. Chem:1843 (1976); Evans, D.L. et al. JOC 44: 497 (1979); Ozaki, Y. et al. Synthesis (1979) 216; Ehler, K.W. et al.
CA87: 136361x (1977); Scolastico, C. et al. Synthesis:850 (1985); Corsico Coda, A. et al. Heterocycles 26:745 (1987); Fields, R. et al. CA90:152072w (1979); Farina, F. et al. Heterocyclec 24:2587
(1986); Manaev, Y.A. et al. CA98: 71993k (1983); Beck, J.R. CA107:23332b (1987); Ajki, I. et al. CA107: 176057r (1987); Beck, J.R. et al. J. Heteroceclic Chem. 24:267 (1987); Sato, T. et al.
CA107:39807w (1987), Ege, G. et al. Chem. Ber. 120:1375 (1987); Klein, H. J. et al. CA102:203932c (1985); Perevalov, V.R. et al. CA101: 171198d (1984); Hamilton, H.W. C.A. 107; 59059a (1987);
Sabate-Alduy, C. et al. CA 87, 23137k (1977); Bastide, J. et al. Tetrahedron 30:3355 (1974); Chrzaszawska, A. Lodz. Tow. Navk, Wydz. 111, 112:119 (1967) (CA 71:124091r (1969)); British Patent 705,950
(CA4S:2233 (1955)); and Se Nardo, M. CA 87: 118063x (1977);
Cоединения формулы I, в который R1 является Н, являются кислотными и они образуют основные соли. Все такие основные соли
входят в область изобретения и они могут быть получены традиционными методами. Например, они могут быть получены при простом контактировании кислотных и основных веществ, обычно в стехиометрическом
соотношении, или в водной, или в неводной или в частично водной среде, как соответствует. Соли извлекают или фильтрованием, или осаждением нерастворителем с последующей фильтрацией, или выпариванием
растворителя, как подходит, или в случае водных растворов, лиофилизацией. Типичные соли соединений формулы I, которые могут быть получены, являются солями первичных, вторичных и третичных аминов,
солями щелочных металлов и солями щелочно-земельных металлов. Особенно ценными являются соли этаноламина, диэтаноламина, триэтаноламина.
Основные агенты, особенно пригодные для образования солей, принадлежат как к органическому, так и к неорганическому типу и они включают органические амины, гидроксиды щелочных металлов, карбонаты щелочных металлов, бикарбонаты щелочных металлов, гидриды щелочных металлов, алкоксиды щелочных металлов, гидроксиды щелочно-земельных металлов, карбонаты щелочно-земельных металлов, гидриды щелочно-земельных металлов и алкоксиды щелочно-земельных металлов. Типичными примерами таких оснований являются первичные амины, такие как н-пропиламин, н-бутиламин, анилин, циклогексиламин, бензиламин, п-толуидин, этаноламин и глюкамин; вторичные амины, такие как диэтиламин, диэтаноламин, N-метилглюкамин, N-метиланилин, морфолин, пирролидин и пиперидин; третичные амины, такие как триэтиламин, пирролидин, и пиперидин; третичные амины, такие как триэтиламин, триэтаноламин, N,N-диметиламилин, N-этилпиперидин и N-метилфорфолин: гидроксиды, такие как гидроксид натрия, алкоксиды, такие как этоксид натрия и метоксид калия; гидриды, такие как гидрид кальция и гидрид натрия; карбонаты, такие как карбонат калия и карбонат натрия.
Способность соединений формулы I ингибировать биосинтез интерлейкина-1 показана в процедуре, описанной ниже.
CЗН/HeN мышей (Чарльз Райвер, Уилмингтон, Массачусеттс) умерщвляют шейной дислокацией и их брюшную полость опрыскивают 70%-ным этанолом, чтобы предотвратить бактериальное загрязнение полученных в последствии клеточных препаратов. В брюшину каждой мыши вводят 8 мл/RPMI (RPMI-1640 среда (Хазелтон Рисерч Продактс. Инк. Ленекса, Канзас), Канзас) содержащей 5% FCS (Фетальная сыворотка теленка, которая была скринирована на хорошую отзывчивость к ИЛ-1 в тимоцитном анализе (Хиклон Лабораториз, Логан, Ута) и на низкую спонтанную пролиферацию в отсутствии ИЛ-1) пенициллин-стрептомицин (100 единиц/мл 100 мкг/мл) и глютамин (2 мм). Брюшину смешивают в общую массу, чтобы помочь высвободить клетки. Затем делают надрез через кожу брюшины, чтобы раскрыть лежащий под ней мышечный слой. Удаляют перитонеальную жидкость иглой 20 калибра путем вставки иглы острием вниз через обнаженный мышечный слой точно ниже грудины. Перитонеальную жидкость от шести мышей объединяют в пластиковую коническую пробирку и проводят микроскопическое исследование на бактериальное загрязнение. Незагрязненную жидкость центрифугируют при примерно 600хg в течение 6 мин и декантируют надосадочный слой. Объединяют клеточные шарики из 5 6 пробирок и повторно суспендируют все в 20 мл RP MI-FCS3. Затем выясняют число клеток, используя гемацитометр, и определяют жизнеспособность клеток окрашиванием Трипан блю, также используя гемацитомер. Клетки потом разбавляют до концентрации 3•106 клеток/мл, используя RPMI-FC. В ячейки пластины с 35 мм ячейками вносят 1 мл указанной выше суспензии клеток. Клетки инкубируют 2 ч при 37oС в атмосфере 5% CO2, чтобы вызвать прикрепление макрофагов к стенкам ячеек. Удаляют надосадочный слой, создавая интенсивное кружение суспензии в ячейках и декантируя. Прикрепившиеся клетки (т. к. макрофаги) дважды промывают RPMI-SF4. В ячейки, содержащие прикрепившиеся клетки, прибавляют 1 мл изучаемых соединений в концентрациях от 0,1 до 100 мгм/мл в RРМI-SF или 1 мл RPMI-SF в качестве контроля. Затем в каждую ячейку прибавляют 100 мкл Р вRPMI-SF (1 мг/5 мл).
1 RPMI-1640 cреда, содержащая 5% фетальной сыворотки теленка
4 RPMI, содержащая пенициллин-стрептомицин (100 единиц/мл 100 мкг/мл/ и глютамин (2 мМ).
5 Тонко очищенный липополисахарид из Salmonella minnesota который был проконтролирован, чтобы определить, что СЗН/HeJ мыши не дают ответа на него. в RPMI-SF (1 мг/5 мл). Пластины инкубируют при 37oС в атмосфере 5% CO2 в течение 24 ч. Надосадочные жидкости удаляют и анализируют на ИЛ-1 сразу или же после охлаждения или замораживания для последующего анализа.
Надосадочные жидкости анализировали количественно на ИЛ-1 в соответствии с аналитическими рецепторами связывания, описанными ниже. Стандартную кривую строят следующим образом, EZ 4 6,1 клетки тимуса мыши (10 - 15•106 клеток) в 0,4 мл связующего буфера (RPMI 1640, 5% FCS, 25 мМ НЕРЕS, 0,01% NaNO3, pH 7,3)прибавляют, варьируя количества немеченного мышиного rIZ-Iα рекомбинант IZ-Iα продуцированный в Eseherichia coli от опубликованной последовательности аминокислот 115 270 для IZ-Iα, Lomeclico, P.M. et al. Nature 312, 458 462, 1984) (40 пг до 49 нг в 0,5 мл буфера) и инкубируют 1 ч при 4oС при непрерывном встряхивании, после чего прибавляют 0,8 нг (0,1 мл) человеческого125I-rIZ-Iβ (Нью Инглэнд Нуклеар, Бостон, Массачусеттс) и продолжают встряхивать еще 3 ч. Образцы фильтруют на устройстве Йеда (Линса Ко. Тель-Авив, Израиль) через стекловолокнистые фильтры Ватман (С2. 4 см) блокированный с 0,5% порошковым молоком в течение 2 ч при 37oС и один раз промывают 3 мл охлажденного льдом буфера. Фильтры подсчитывают в гамма-счетчике Сирла и неспецифическое связывание рассматривают как связывание в присутствии 200 нг немеченного r-IZ-Iα. Калибровочная кривая Хилла строится как график log(Y) (100-Y) по отношению к logC, где Y представляет собой процент контроля125I-rIZ-Iα связывания.
Линия, спрямленная по методу наименьших квадратов, соответствует величинам Y между 20 и 80% Затем для количественного определения уровней ИЛ-1 в надосадочных жидкостях, полученных как описано выше, разбавленные надосадочные жидкости заменяют rIZ-Iα в приведенном выше протоколе, и используют измеренный процент величин связывания для определения концентраций ИЛ-1 из стандартного графика Хилла. Каждое разбавление анализируют дважды и обычно используют только те разбавления, у которых величины Y находятся между 20 и 80% чтобы рассчитать средние уровни ИЛ-1.
Способность соединений формулы I ингибировать протагландин H2 синтазу и 5-липоксигеназу показана в следующей процедуре анализа. Применяя описанную ниже процедуру, измеряют уровни известных продуктов простагландин H2 синтазы и 5-липоксигеназы для клеток, обработанных изучаемым соединением для ингибирования протагландин Н2 синтазы и/или 5-липоксигеназы, которое доказывается снижением количества или отсутствие известных продуктов этих ферментов.
Клетки RBZ-I, поддерживаемые в монослое, выращивают в течение 1 2 дней в культуре Спиннера в минимальной основной среде (Игла) с солями Ирла плюс 15% фетальной коровьей сыворотки, дополненной раствором антибиотик/антимикотик (Гибко) согласно методу Jackschik B.A. et al. Nature 287:51 52 (1980). Клетки дважды промывают и повторно суспендируют в холодной РМI 1640 до плотности клеток 4•106 клеток/мл. Затем 0,25 мл аликвота изучаемого соединения при желаемой концентрации в RPMI 1640 уравновешивают при 37oС в течение 5 мин. К уравновешенному аликвоту прибавляют 0,25 мл аликвота предварительно подогретой клеточной суспензии и смесь инкубируют при 37oС в течение 5 мин. Прибавляют 10 мл раствора, содержащего 14-С-арахидоновой кислоты и А-23187 (ионофора кальция, Сигма Кемикал) и смесь инкубируют при 37oС в течение еще 5 мин. Затем прибавляют 267 мкл ацетонитрила 0,3% уксусной кислоты и смесь оставляют стоять на льду в течение 30 мин. Перемешивают содержимое пробирки, осветляют центрифугированием (3000 об/мин, 10 мин), декантируют надосадочную жидкость и повторно центрифугируют 2 мин в микропробирке с высокой скоростью. После этого анализируют 100 мкл аликвота нaдосадочного слоя с помощью высокоэффективной жидкостной хроматографии на колонке Перкин-Эльмер-Н5 (3 микрона), используя градиент системы ацетонитрил, Н2O c 0,1% трифторуксусной кислоты и скорость потока 2 мл/мин. Определение радиоактивности выполнено на приборе по определению радиоактивности Бертольд ЛБ504, снабженном проточной ячейкой 800 мкл, смешивающей 2,4 мл/мин Омнифлауэр (торговое название Нью Инглэнд Нуклеар, Бостон, Массачусеттс) на выходе из колонки. Количественную оценку радиоактивности осуществляют с использованием компьютерного интегратора Спектра Физикс SP4200. Полученные таким образом данные используют в программе данные-снижение, где интегрирование единицы каждого продукта рассчитываются как процент от суммы интегрированых единиц и сравниваются со средними контрольными уровнями.
Соединения формулы I обладают анальгетической активностью. Эта активность показана на мышах путем показа блокирования брюшного вытягивания, вызванного введением 2-фенил-1,4-бензохинона (ФБХ). Использованный способ основан на методике Siegmund et al. Proc.Soc. Exp.Biol.Hed. 95, 729 731 (1957), как приспособлено для большого расхода материала в единицу времени (смотри, кроме того Milne and T. womey, Agents and actions, 10, 31, 37 (1980)). Всех мышей не кормили всю ночь перед введением лекарства и испытаниями.
Соединения формулы I растворяют или суспендируют в носителе, состоящем из этанола (5% ), эмульфора 620 (смесь полиэтоксилированных сложных эфиров жирных кислот, 5%) и солевого раствора (90%). Этот носитель также служит в качестве контроля. Дозы взяты по логарифмической шкале (а именно, 032, 1,0, 3,3, 10, 32 мг/кг). Путь введения является оральным, концентрации меняются, остается постоянным объем дозировки 10 мл/кг веса тела. Вышеупомянутый метод Милна и Твоми используют для определения эффективности и мощности. Мыши, обpаботанные орально испытуемым соединением, через час получают интраперитонеально 2 мг/кг ФБХ. Индивидуально мышь затем немедленно помещают в теплую прозрачную клетку и начинают через 5 мин после введения ФБХ регистрировать число брюшных сокращений в течение следующих 5 мин. Рассчитывается степень анальгетической защиты (% МРЕ) на основе подавления брюшинного сокращения по отношению к данным для конкурентных контрольных животных в опыте в тот же день. По крайней мере, четыре таких определения (N=5) обеспечивают данные дозы доза-ответ для получения МРЕ50, лучший оценке дозы, которая снижает брюшные сокращения на 50% от уровня контроля.
Соединения формулы I также обладают противовоспалительной активностью. Эта активность показана на крысах с помощью метода, основанного на стандартном тесте с карагенином, вызывающим одеому лапы крысы Winter et al. Proc. Soc. Exp. Biol. Med. 111, 544 (1963)).
Подсчитывают и взвешивают неанастезированных взрослых самцов белых крыс с массой тела от 150 до 190 г и помечают чернилами правую боковую лодыжку. Каждую лапу погружают в ртуть точно до чернильной метки. Ртуть находится в стеклянном цилиндре, соединенным с преобразователем давления Статама. Выход из преобразователя поддерживается через контрольный элемент микровольтметра. Регистрируется объем ртути, перемещенный погруженной лапой. Лекарства дают с питьем. Через час после введения лекарства индуцируют одеому инъекций 0,05 мл 1% -ного раствора карагинина в подошвенную ткань помеченной лапы. Сразу после этого измеряют объем конечности, в которую была сделана инъекция. Увеличение объема конечности через 3 ч после инъекции карагина составляет индивидуальный противовоспалительный ответ.
Анальгетическая активность соединений формулы I делает их полезными для срочного введения их млекопитающим для контроля боли при травме. Кроме того, соединения формулы I являются полезными для хронического введения млекопитающим для облегчения симптомов хронических заболеваний, таких как воспаление ревматоидного артрита, и болей, ассоциированных с остеоартритами и другими мышечно-скелетными расстройствами.
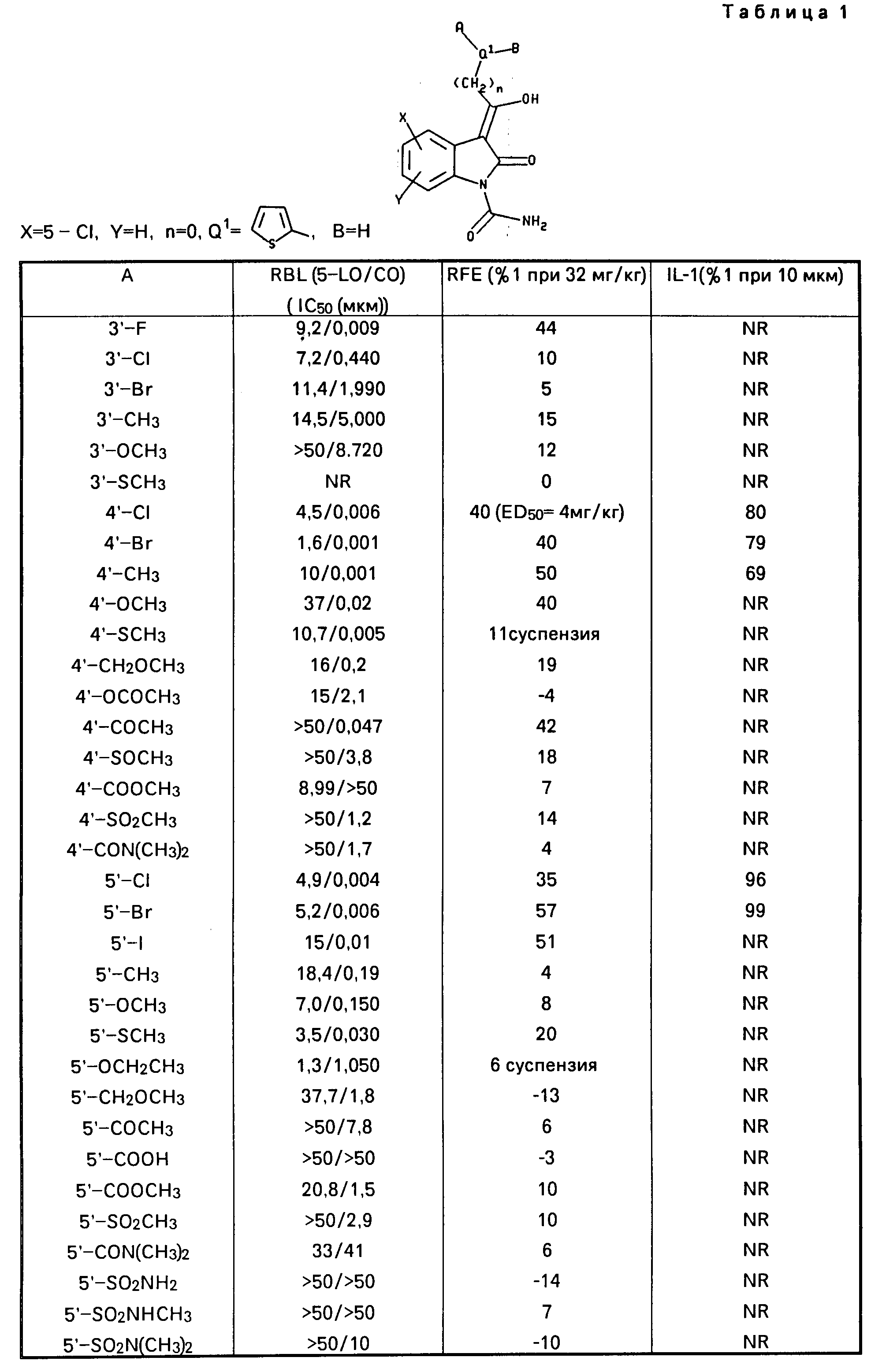
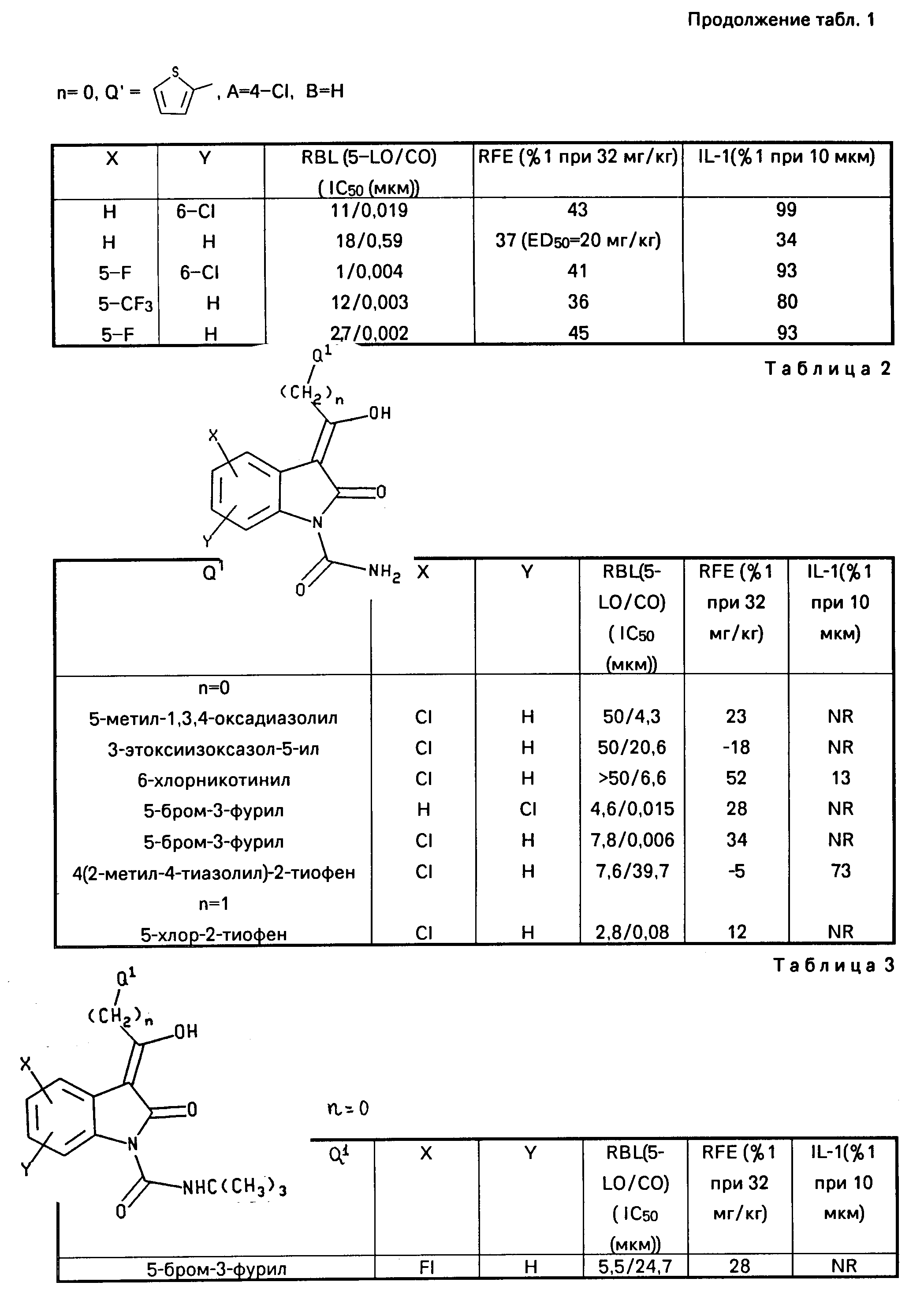
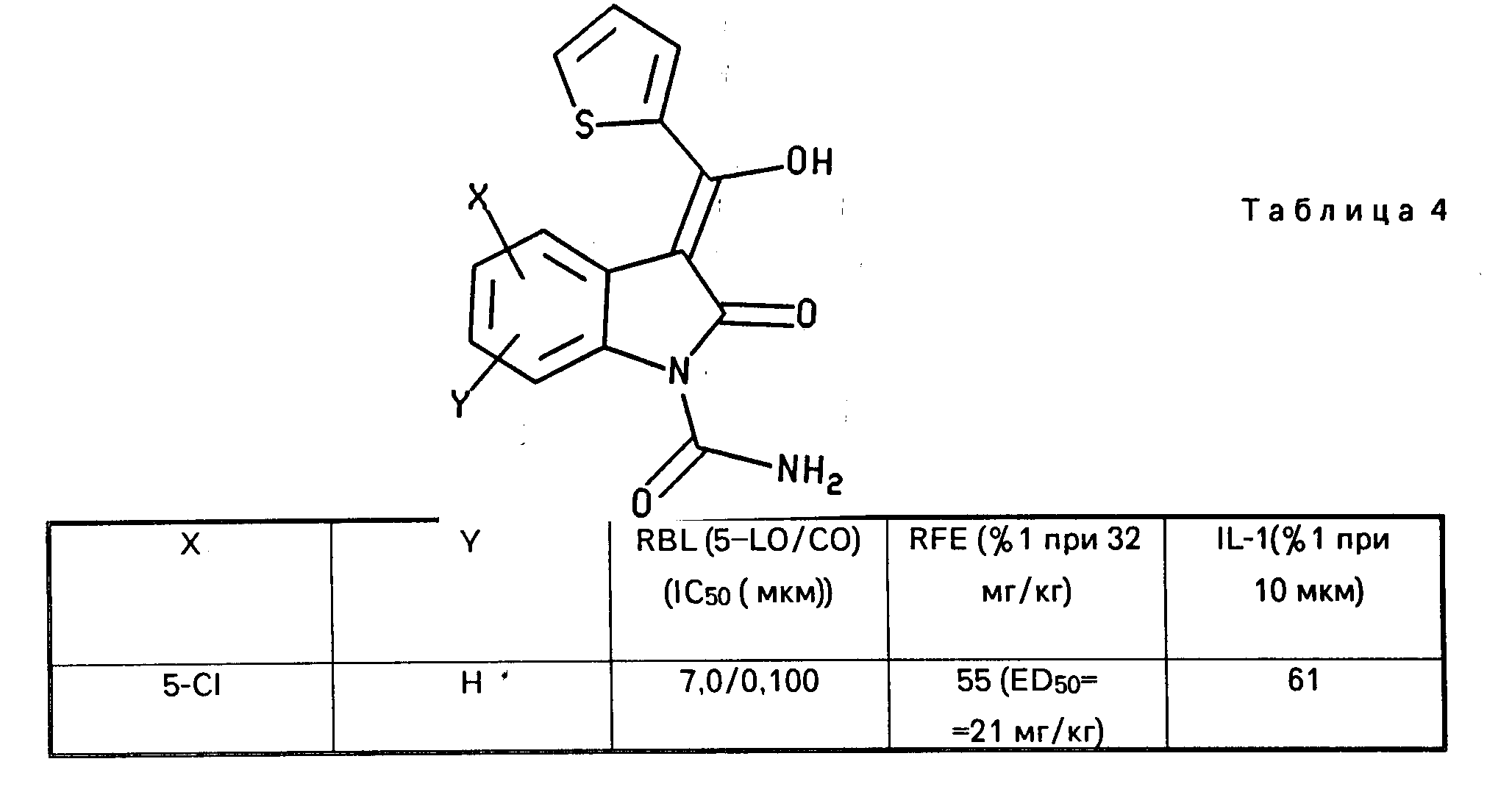
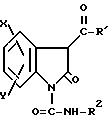
Ниже приводятся таблицы 1 4, в которых приводятся данные для соединений настоящего изобретения (табл. 1 3) и соединений известного уровня (табл.4).
В указанных таблицах "NR" обозначает "не данных".
Способность соединений формулы I ингибировать биосинтез ИЛ-1 делает их полезными в качестве ингибитора биосинтеза ИЛ-1 вообще. Она также делает из полезными при лечении медиированных ИЛ-1 расстройств и иммунных дисфункций к у млекопитающих. Указанные медиированные ИЛ-1 расстройства включают, но не ограничиваются ими, расстройства метаболизма в костях и соединительных тканях, такие как остеопороз, периодонтитная болезнь и рубцы тканей. Медиированные ИЛ-1 иммунные дисфункции включают, но не ограничиваются ими, аллергию и псориаз.
Способность соединений формулы I ингибировать простагландин Н синтазу делает их полезными в качестве ингибиторов простагландин Н2 синтазы вообще, поскольку функционирование этого фермента, как известно, включает патогенез артритных сочленений у млекопитающих.
Когда соединения формулы I или их фармацевтически приемлемые соли используют в качестве ингибитора ИЛ-1, ингибитора простагландин Н2 синтазы, анальгетического агента или противовоспалительного агента, они могут быть введены млекопитающему или один, или, предпочтительно, в сочетании с фармацевтически приемлемыми носителями или разбавителями в фармацевтической композиции в соответствии со стандартной фармацевтической практикой. Соединения могут быть введены орально или парентерально. Парентеральное введение включает внутривенное, внутримышечное, интраперитонеальное, подкожное или местное введение.
В фармацевтической композиции, состоящей из соединения формулы I или его фармацевтически приемлемой соли, массовое отношение носителя к активному ингредиенту обычно находится в интервале от 1:4 до 4:1, а предпочтительно от 1: 2 до 2:1. Однако в любом данном случае выбранное отношение будет зависеть от таких факторов, как растворимость активного ингредиента, ожидаемая дозировка и точный путь введения.
При оральном использовании соединений формулы I настоящего изобретения соединения могут быть введены, например, в виде таблеток или капсул или в виде водных растворов или суспензий. В случае таблеток для орального введения носители, которые обычно используют, включают лактозу и кукурузный крахмал и смазки, такие как стеарат магния, обычно добавляют. Для орального введения в виде капсул полезными разбавителями являются лактоза и высушенный кукурузный крахмал. Когда для орального введения требуются водные суспензии, активный ингредиент объединяют с эмульгирующими и суспендирующими агентами. При желании могут быть добавлены подслащиватели и/или отдушки. Для внутримышечного, интраперитонального подкожного и внутривенного использования обычно готовят стерильные растворы активного ингредиента и pH растворов должен быть соответственно установлен или забуферирован. Для внутривенного использования должна контролироваться общая концентрация солюта, чтобы препарат был изотоническим.
При использовании соединения формулы I или его соли
на людях ежедневная дозировка обычно будет определяться лечащим врачом. Кроме того, дозировка будет варьироваться в зависимости от возраста, веса и индивидуальной реакции пациента, а также от тяжести
симптомов пациента и мощности конкретного вводимого соединения. Однако для острого введения для снятия боли доза, дающая эффективный анальгетический ответ, в большинстве случаев будет составлять от
примерно 5 мг до 500 мг, в зависимости от необходимости (например, каждые 4
24 ч). При хроническом введении для облегчения (лечения) воспаления и боли, ингибирования биосинтеза ИЛ/1 и/или
ингибирования протагландин Н2 синтазы в большинстве случаев эффективная доза будет составлять от примерно 5 мг до 1,0 г в день, а предпочтительно от 50 до 500 мг в день, в виде единичной
или раздельных доз. С другой стороны, может быть необходимым использование дозировок вне этих пределов в некоторых случаях.
Следующие примеры иллюстрируют настоящее изобретение и не должны рассматриваться как ограничивающие его область каким-либо образом.
Пример 1. 4-Метилсульфинил-2-тиофенкарбоновая кислота.
Охлаждают до температуры ледяной бани при перемешивании раствор 2,46 г (14,1 ммоль) 4-метилтило-2-теофеноксикабоновой кислоты (полученной, как описано в примере 28) в 150 мл дихлорметана и 10 мл метанола. К охлажденному реакционному раствору медленно прибавляют 120 мл дихлорметанового раствора 2,82 г (13,9 ммоль) м-хлорпербензойной кислоты (технической, 80-85%). После 1 ч реакция по существу заканчивается с образованием бесцветного осадка. Осадок отфильтровывают и сушат, получая 1,18 г (6,20 ммоль) целевого соединения в виде бесцветного твердого продукта, т.пл. 188 190oС. Концентрированный маточник хроматографируют (на силикагеле), чтобы получить дополнительные 0,83 г (4,36 ммоль) целевой 4-метилсульфинил-2-тиофенкарбоновой кислоты, общий выход 75% (10,56 ммоль).
Анализ:
Вычислено, для С6H6O3S2
C 37,88; H 3,18
Найдено, С 37,89; Н 3,18.
ЕIMS (м/Z): 190 (M+, 45%) и 175 (- СН3).
IH ЯМР (ДМСО-d6) дельта, 13,4 (1Н, обмениваемый), 8,27 (1Н, д, J=1,5 Гц), 7,96 (1Н, д, J=1,5 Гц) и 2,86 (3Н, с). 13 СЯМР (ДСМО-d6) дельта, 162, 1, 146,4, 137,2, 131,7, 128,9 и 42,2.
ИК-спектр (бромистый калий): 3420, 2550, 1705, 1245, 1015 см-1.
Пример 2. 5-(N-метиламиносульфонил)-2-тиофенкарбоновая кислота.
Готовят диизопропиламид лития путем медленного прибавления 17,5 мл (43,8 ммоль) 2,5 М н-бутиллития в гексане к 200 мл охлажденного 2-пропанол/cухой лед/тетрагидрофуранового
раствора 7,0 мл (50,0 ммоль) диизопропиламина, поддерживая температуру реакции ниже -60oС. Через 5 мин реакционный раствор нагревают до комнатной температуры в течение 30 мин, а затем снова
охлаждают до температуры ниже -70oС. Медленно прибавляют 100 мл тетрагидрофуранового раствора 3,54 г (20,0 ммоль) 2-/N-метиламиносульфонил/-тиофена (полученного согласно Slocum S.W. et al.
J.O.C. 38, 4189, 1973) при температуре реакции, контролируемой ниже -70oС. По окончании прибавления реакционную смесь перемешивают 30 мин, а затем барботируют через раствор избыток двуокиси
углерода. Затем раствор нагревают до 5oС и закаливают 50 мл 1н. гидроксида натрия. К водному тетрагидрофурановому раствору прибавляют порцию 300 мл диэтилового эфира и разделяют фазы в
делительной воронке. Органический слой экстрагируют 50 мл 1н. гидроксида натрия. Объединяют оба основных водных раствора, промывают 50 мл диэтилового эфира и подкисляют концентрированной соляной
кислотой. Подкисленную водную смесь экстрагируют 2 х 100 мл диэтилового эфира. Эфирный раствор промывают рассолом, сушат над сульфатом магния, фильтруют и концентрируют в вакууме, получают 3,38 г (15,
3 ммоль) целевой тиофенкарбоновой кислоты в виде бесцветного твердого продукта, т.пл. 145-148oС. Общий выход составляет 76%
Анализ: Вычислено, для С6H7NO2 C 32,57; H 3,19; N 6,33.
Найдено, C 32,43; H 3,08; N 6,30.
EIMS (м/Z): 221 (M+, основание), 191 (М+HMe, 98), 157 (неизвестный 95%), 127
(неизвестный, 45%) и 115 (неизвестный, 73%)
IН ЯМР (ДМСО-d6) дельта, 7,92 (1Н, обмениваемый), 7,74 (1Н, д, J=4,0 Гц), 7,58 (1Н, д, J=4,0 Гц) и 2,51 (3Н, д, J=5,2 Гц);
ИК-спектр (бромистый калий): 3400 плечо, 3000 плечо, 1680, 1170 см-1.
Пример 3. 5-Иодо-2-тиофенкарбоновая кислота.
Целевое н соединение было описано Schik J.W.et al. J.Am. Chem. Soc. 70: 286 (1948) и получено согласно следующей процедуре. Медленно прибавляют через шприц 25 мл (62,5 ммоль) 2,5 М гексанового раствора н-бутиллития к охлажденному (сухой лед пропанал-2) тетрагидрофурановому раствору (100 мл) 9,0 мл (64,2 ммоль) диизопропиламина. Раствор выдерживают при температуре ниже -60oС во время прибавления н-бутиллития. По окончании прибавления удаляют охлаждающую баню и дают раствору нагреться до комнатной температуры (22oС), а затем снова охлаждают ниже -60oС. В охлажденную реакционную колбу медленно прибавляют 3,2 г (25,0 ммоль) 2-тиофенкарбоновой кислоты, растворенной в 100 мл тетрагидрофурана. Через 30 мин после окончания прибавления 2-тиофенкарбоновой кислоты в реакционную смесь конденсируют примерно 17,2 г (87,8 ммоль) иодтрифторметана. Через 5 мин убирают охлаждающую баню и реакционную смесь нагревают до 0oС и закаливают 50 мл воды. Щелочной водный раствор промывают 500 мл диэтилового эфира. Эфирный раствор экстрагируют 50 мл 1н. гидроксида натрия и два объединенных водных раствора промывают эфиром. Щелочной раствор подкисляют и экстрагируют три раза по 100 мл диэтилового эфира. Органический раствор сушат над безводным сульфатом магния затем фильтруют и концентрируют, получают сырой твердый продукт. Частичная очистка достигается при переосаждении твердого продукта из горячего водного этанола, получают 3,79 г слабо загрязненного целевого продукта в виде смеси темно-красного раствора и желтых кристаллов. Перекристаллизация твердой смеси дает 2, 18 г (8,58 ммоль, выход 34% ) чистого целевого соединения в виде светло-желтых игл, т.пл. 132 134oС (гексаны).
Анализ: Вычислено, для С5H3IO2 S С 23,64; Н 1,19.
Найдено, С 23,86; Н 1,10.
EIMS (м/Z): 254 (М+, основание), 237 (М+-OH, 79%), 209 (M+-CO2H, 5%), 127
(M+-1,18%) и 82 (C4H2S 36%);
IН ЯМР (СДСl3) дельта, 7,50 (1Н, д, J=3,9 Гц) и (1Н, д, J=3,9 Гц); ИК-спектр (СНСl3); 2977 плеча,
2565, 1679 и 1410 см-1.
Пример 4. 5-[(N,N-диметиламино)карбонил]-2-тиофенкарбоксальдегид.
К раствору 2,75 (17,61 ммоль) 5-формаил-2-тиофенкарбоновой кислоты
(полученной согласно методике Карпентера с сотр. Tetrahedron 41:3808, 1985) в 75 мл тетрагидрофурана прибавляют 3,71 г (22,88 ммоль) 1,1'-карбонилдиимидазола, раствор перемешивают 2,5 ч в атмосфере
сухого аргона и обрабатывают избытком газообразного диметиламина. Раствор концентрируют в вакууме до масла, которое растворяют в 100 мл этилацетата и экстрагируют 2 х 50 мл н. соляной кислоты, затем 2
х 50 мл 5%-ного бикарбоната натрия. Каждый водный слой снова промывают 2x50 мл этилацетата и сушат объединенные органические слои (сульфат магния). Концентрирование в вакууме дает 2,42 г (75%)
светло-желтого твердого продукта. ЕIMS(м/Z): 183 (М+, 82%) 154 (М+-CНО, 7%), 139 (М+(CH3)2N основание) и III/M+-(CH3)NCO
59%);
IН ЯМР (СДСl3) дельта, 9,91 (1Н, с), 7,67 (1Н, д, J=4,0 Гц, 7,35 (1Н, д, J= 4,0 Гц), 3,13 (6Н, шир.с). Этот материал используют непосредственно без дальнейшей
очистки.
Пример 5. 5-[(N,N-диметиламино)карбонил)]-2-тиофенкарбоновая кислота.
Прибавляют 2,39 г (13,04 ммоль) в виде части сырого 5-[(N, N-диметиламино)карбонил)]-2-тиофенкарбоксиальдегида к перемешиваемой суспензии оксида серебра, приготовленного при добавлении 2,29 г (57,13 ммоль) гидроксида натрия к 5,85 г (34,44 ммоль) нитрата серебра в 100 мл воды. После 15 мин перемешивания при комнатной температуре и фильтрации через слой диатомитовой земли фильтрат подкисляют от pH 12 до pН 2 концентрированной соляной кислотой и экстрагируют этилацетатом. Экстракты сушат (сульфат магния) и концентрируют в вакууме, получают 2,01 г (77%). Аналитический образец получают при тщательном растирании с теплым этилацетатом, т.пл. 158 - 159oС.
Анализ: Вычислено, для С8H9NO3S C 48,23; H 4,55; N 7,03.
Найдено, C 48,30; H 4,42; N 6,79. EIMS (м/Z): 199 (M+, 68%), 155 (M+-(CH3)2 основание III(M+-(CH3)2NCO, 44%);
IН ЯМР (ДМСО-d6) дельта, 7,66 (1Н, д,
J=4,0 Гц), 7,46 (1Н, д, J=4,0 Гц, 3,09 (6Н, с);
ИК-спектр (бромистый калий): 3430, 1710, 1594, 1246 см-1
Пример 6. 4-[(N,
N-диметиламино)карбонил]-2-тиофенкарбоксальдегид.
К раствору 1,24 г (7,94 ммоль) 2-формил-4-тиофенкарбоновой кислоты (приготовленной по методике Gronowitz S. et al. Arkiv for Kemi 21:265 (1963)) в 50 мл тетрагидрофурана прибавляют 1,80 г (11,10 ммоль) 1,1'-карбонилдиимидазола, раствор перемешивают 1,5 ч в сухом аргоне и обрабатывают избытком газообразного диметиламина. Раствор концентрируют в вакууме до масла, которое растворяют в 60 мл этилацетата и экстрагируют 1х30 мл 1 н. соляной кислоты, затем 1х30 мл 5%-ного бикарбоната натрия. Каждый из водных экстрактов снова промывают 2х50 мл этилацетата и объединенные органические слои сушат (сульфат магния). Концентрация в вакууме дает 1,15 г (79%) каштанового твердого продукта. EIMS (м/Z): 183 (M+, 31%), 155 (M+-CO, 38%), 139 (M+-(CH3)2N основание) и III (M+-(CH3)2-NCO, 25%);IН ЯМР (ДМСО-d6) дельта, 9,89 (1Н, д, J=1,4 Гц), 7,89 (1Н, д, J=1,5, 1,4 Гц), 7,86 (1Н, д, J=1,5 Гц), 3,08 (6Н, с).
Этот материал используют непосредственно без дополнительной очистки.
Пример 7. 4-[(N,N-диметиламино)карбонил]-2-тиофенкарбоновая кислота.
Прибавляют 1,12 г (6,11 ммоль) сырого 4-[(N,N-диметиламино)карбонил]-2-тиофенкарбоксальдегида к перемешиваемой суспензии оксида серебра, приготовленного прибавлением 1,08 г (26,90 ммоль) гидроксида натрия к 2,74 г (16,14 ммоль) нитрата серебра в 40 мл воды. После 15 мин перемешивания смесь фильтруют через диатомитовую землю, подкисляют от pH 12 до pH 2 концентрированной соляной кислотой и насыщают хлористым натрием (твердым). После экстракции 3 х 75 мл этилацетата сушат экстракты сульфатом магния и концентрируют их в вакууме, получают 1,10 г (90) светло-желтых кристаллов. Аналитический образец получают при тщательном растирании с теплым этилацетатом, т. пл. 112 114oС.
Анализ: Вычислено, для C8H9NO3S С 48,23; Н 4,55; N 7,03.
Найдено, С 48,07; H 4,58; N 6,86.
EIMS (м/Z): 199 (M+, 26%), 181 (M+-H2O, 7%), 155 (M+-(CH3)2 основание);
IН ЯМР (ДМСО-d6 дельта, 8,09 (1Н, д, J=1,8 Гц), 7,74 (1Н, д, J=1,8 Гц), 2,98 (6H, д, J=13,0 Гц);
ИК-спектр (бромистый калий): 3388, 1706, 1594, 1250, 1186 cм-1.
Пример 8. Метил-2-формил-4-тиофенкарбоксилат.
Целевое соединение было описано Gronowitz S. et al. Arkiv for Kemi 21: 265 (1963) и получено в соответствии со следующей методикой. Прибавляют 1,32 г (9,30 ммоль) метилиодида к перемешиваемой суспензии 1,21 г (27,12 ммоль) 2-формил-4-тиофенкарбоновой кислоты (приготовленной по методике Gronowitz S. et al. Arkiv Kemi 21:265 (1963)) и 2,87 г (27,12 ммоль) бикарбоната натрия в 40 мл диметилформамида. После перемешивания в течение ночи при комнатной температуре смесь выливают в 200 мл воды, насыщают твердым хлористым натрия и экстрагируют этилацетатом. Объединенные экстракты промывают рассолом, сушат (сульфат магния) и концентрируют в вакууме, получают 1,20 г (91%), т.пл. 110 112o.
EIMS (м/Z): 170 (M+, 84), 139 (M+ CH3O, основание), Ш(M+-CH5O2C, 29%);
IН ЯМР (СДСl3) дельта, 9,90 (1Н, д, 1,5 Гц), 8,41 (1Н, с), 8,13 (1Н, д, J=1,5 Гц), 3,88 (3Н, с).
Пример 9. 4-Mетоксикарбонил-2-тиофенкарбоновая кислота.
Обрабатывают при перемешивании раствор 823 мм (4,84 ммоль) метил-2-формил-4-тиофенкарбоксилата в 50 мл ацетона 5 мл реактива Джонса. По окончании прибавления смесь перемешивают при комнатной температуре в течение 30 мин, избыток окислителя разлагают изопропанолом и смесь фильтруют через диатомитовую землю. Ацетон удаляют в вакууме, остаток растворяют в 30 мл этилацетата и раствор сушат над сульфатом магния. Концентрируют в вакууме, получают 880 мг (98%) беловатого твердого продукта. Аналитический образец получают при тщательном растирании с небольшим количеством этилацетата, т.пл. 141 143oС.
Анализ: Вычислено, для С7H6O4S C 45,15; H 3,25.
Найдено, C 45,09; H 3,14.
EIMS (м/Z): 186 (M+, 42%), 155 (M+-CH3O, oснование);
IН ЯМР (ДМСО-d6) дельта, 8,59 (1Н, д, J=1,2 Гц), 7,91
(1Н, д, J=1,2 Гц), 3,81 (3Н, с);
ИК-спектр (бромистый калий): 3419, 1706, 1681 см-1.
Пример 10. Метил-5-формил-2-тиофенкарбоксилат.
Целое соединение описано Gronowitz S. et al. Arkiv for Kemi 21:265 (1963) и было получено согласно следующей методике. Прибавляют 4,36 г (30,74 ммоль) метилиодида к суспензии 4,00 г (25,61 ммоль) 5-формил-2-тиофенкарбоновой кислоты (полученной по методике Carpenter A.J. et al. Tetrahedron 41: 3808 (1985)) и 9,50 г (89,65 ммоль) в 75 мл N,N-диметилформамида при перемешивании. После перемешивания в течение ночи при комнатной температуре смесь выливают в 350 мл воды, насыщают твердым хлористым натрием и экстрагируют этилацетатом. Объединенные экстракт промывают рассолом, сушат (сульфат магния) и концентрируют в вакууме, получают 3,83 г (88%) серого твердого продукта т.пл. 85 87oС.
EIMS (м/S): 170 (M+, 95%), 139 (M+CH3O, основание), 111 (M+-CH3O2C, 64% );
IН ЯМР (ДМСО-d6) дельта, 9,94 (1Н, с), 7,81 (1Н, д, J=3,9 Гц), 7,71 (1Н, д, J=3,9 Гц), 3,91
(3Н, c).
Пример 11. 5-Метаксикарбонил-2-теофенкарбоновая кислота.
Целевое соединение было описано Ben Keser R.A. et al. J.O.C. 38, 3660 (1973) и в британском патенте 705950 и было получено по следующей методике. Обрабатывают при перемешивании раствор 2,00 г (11,75 ммоль) метил-5-формил-2-тиофенкарбоксилата в 100 мл ацетона прибавляя по каплям, 9 мл реактива Джонса. По окончании прибавления смесь перемешивают при комнатной температуре в течение часа, избыток окислителя разлагают изопропанолом и фильтруют смесь через диатомитовую землю. Ацетон удаляют в вакууме. Остаток растворяют в 75 мл этилацетата и сушат раствор над сульфатом магния. После фильтрации и концентрирования получают 1,60 г (73%) желтого твердого продукта.
Аналитический образец получают при тщательном растирании с теплым этилацетатом, т.пл. 186 189oC.
Анализ: Вычислено, для C7H6O4S С 45,15; Н 3,25.
Найдено, C 45,12; H 3,09.
EIMS (м/Z): 186 (M+, 70%), 169 (M-OH), 7%), 155 (M-CH3O, основание):
IН ЯМР (ДМСО-d6)
дельта, 7,78 (1Н, д, J=4,0 Гц), 7,72 (1Н, д, J=4,0 Гц), 3,85 (3Н, С);
ИК-спектр (бромистый калий): 3416, 1712, 1666, 1258 см-1
Пример 12.
5-Mетоксикарбонил-2-тиофенкарбоновая кислота, гидразид.
Кипятят 2 ч с обратным холодильником при перемешивании суспензию 1,86 г (10,0 ммоль) 5-метоксикарбонил-2-тиофенкарбоновой кислоты в 20 мл тионилхлорида. Охлаждают раствор до комнатной температуры и концентрируют в вакууме. Затем растворяют этот твердый продукт в 25 мл хлороформа и прибавляют по каплям к охлажденному (5oС) раствору 800 мг (25 ммоль) безводного гидразина в 25 мл хлороформа в тиосфере аргона. По окончании прибавления смесь перемешивают 1 ч при комнатной температуре, затем выпаривают досуха в вакууме. Оставшийся твердый продукт суспендируют в 25 мл воды, перемешивают 15 мин и фильтруют, получают 1,79 г (90%) беловатого твердого продукта. Аналитический образец готовят перекристаллизацией из этанола, т.пл. 198 200oС.
Анализ: Вычислено, для С7H8N

Найдено, C 41,88; H 3,91; N 13,86. EIMS (м/Z): 200 (M, 26%), 169 (M+-CH3O или H3
, основание);
IН ЯМР (ДМСО-d6) дельта, 10,05 (1Н, шир.с), 7,77 (1Н, д, J=3,9 Гц), 7,71 (1Н, д, J= 3,9 Гц), 4,56 (2Н, шир.с), 3,82 (3Н, с); ИК-спектр (бромистый калий):
3319, 3285, 1723, 1618, 1264, 746 см-1.
Пример 13. Метил-5-(5-метил-1,3,4-оксадиазол-2-ил)-2-тиофенкарбоксилат.
Кипятят с обратным холодильником в течение
4 ч 548 мг (2,74 ммоль) гидразида 5-метоксикарбонил-2-тиофенкарбоновой кислоты и 372 мг (3,01 ммоль) солянокислого этила цетимидата в 10 мл пиридина, охлаждают до комнатной температуры и выпаривают в
вакууме. Растворяют остаточный маслянистый продукт в этилацетате и промывают водой, 1 н. соляной кислотой и 5% бикарбонатом натрия. Этилацетатный раствор сушат (сульфат магния) и выпаривают в вакууме,
получают 242 мг (39% ) светло-каштанового твердого продукта, т.пл. 142 - 150oС. Этот материал используют непосредственно без дополнительной очистки. Точная масса: 224, 0253. Вычислено 224,
0256. ЕIMS (м/Z): 224 (M+, основание), 193 (M+-CH3O, 33%), 169 (C7H5O3S 83%);
IН ЯМР (ДМСО-d6) дельта, 7,
88 (1Н, д, J=3,9 Гц), 7,80 (1H, д, J=3,9 Гц), 3,87 (3Н, с), 2,58 (3H, c), ИК-спектр (бромистый калий): 1705, 1571, 1291, 1101, 751 cм-1.
Пример 14. 5-(5-Метил-1,3, 4-оксадиазол-2-ил)-2-тиофенкарбоновая кислота.
Смесь 100 мг (0,45 ммоль) метил-5-(5-метил-1,3,4-оксадиазол-2-ил)-2-тиофенкарбоксилата в 3 мл 2 н. гидроксида натрия разбавляют 1 мл метанола и перемешивают 2 ч при комнатной температуре. Раствор фильтруют для удаления следов нерастворимых продуктов и подкисляют до pH 3 концентрированной соляной кислотой. Осадок собирают и сушат на воздухе, получают 67 мг (71%) светло желтого твердого продукта, т.пл. 281 -284oС.
Анализ: Вычислено, для C8H6N2O3S C 45,70; H 2, 88; N 13,33.
Найдено, С 45,81; Н 2,81; N 13,26.
EIMS(м/Z): 210 (M+, основание), 193 (M+-OH, 3%), 168 (неизвестен, 8%), 155 (С6H3O3 56%); IНЯМР (ДМСО-d6) дельта, 7,79 (1Н, д, J=3,9 Гц), 7,77 (1Н, д, J=3,9 Гц), 2,57 (3Н, с);
ИК-спектр (бромистый калий): 3443, 1693, 1599, 1574, 1264, 744
см-1.
Пример 15. Метил-4-ацетил-2-тиофеникарбоксилат.
Прибавляют 783 мг (5,51 ммоль) метилиодида при перемешивании к суспензии 782 мг (4,59 ммоль)
4-ацетил-2-тиофеникарбоновой кислоты (полученной согласно Satonata H. Bull. CHem. Soc. Japan 56:2463 (1983)) и 1,70 г (16,08 ммоль) карбоната натрия в 25 мл диметилформамида. После перемешивания в
течение ночи при комнатной температуре смесь выливают в 125 мл воды, насыщают твердым хлористым натрием и экстрагируют 3х50 мл этилацетата объединенные экстракты промывают рассолом, сушат над
сульфатом магния и концентрируют в вакууме, получают 761 мг (90%) беловатого твердого продукта, т.пл. 94 96oС EIMS (м/Z): 184 M+, 74), 169 (M+-CH3,
основание), 153 (M+-CH3 0,51);
IН ЯМР (ДМСО-d6) дельта, 8,17 (1Н, д, J=1,5 Гц, 8б13 (1Н, д, J=1,5 Гц), 3,88 (3Н, с), 2,51 (3Н, с).
Пример 16. Метил-4-бромацетил-2-тиофенкарбоксилат.
Работают по методике, описанной в Japan Kokai Tokkyo koho yp 60 11, 487 CA 103:22580 (1985), прибавляют по каплям раствор 4,29 г (26, 87 ммоль) в 40 мл хлороформа при перемешивании к раствору 4,95 г (26,87 ммоль) метил-4-ацетил-2-тиофенкарбоксилата, полученного в примере 15, в 150 мл хлороформа, содержащего 4 капли 50% (объем/объем) 48% бромистоводородной кислоты/ледяной уксусной кислоты. После 10 мин при 40oС раствор охлаждают до комнатной t, концентрируют в вакууме и остаток тщательно растирают с 25 мл метанола. После фильтрации получают 4,96 г (63%) беловатого твердого продукта, т.пл. 112 114oС.
EIMS(м/Z): 264/262 (M+,11%), 233/231 (M+-CH3O, 11%),
171/169 M+-CH2Br, основание);
IН ЯМР (СДСl3) дельта, 8,31 (1Н, д, J=1,5 Гц), 8,17 (1Н, д, J=1,5 Гц), 4,29 (2Н, с), 3,90 (3Н, с).
Пример 17. Монобромид метил-4-(2-метилтиазол-4-ил)-2-тиофенкарбоксилата.
Кипятят с обратным холодильником 2 ч раствор 398 мг (1,51 ммоль) метил-4-бромацетил-2-тиофенкарбоксилата, полученного по примеру 16 и 125 мг (1,66 ммоль) тиоацетамида 15 мл ацетона. Смесь охлаждают до комнатной температуры, фильтруют и остаток сушат в вакууме получают 375 мг (77%) белого продукта, т.пл. 224 225oС.
Анализ: Вычислено, для C10H9NO2S2•HBr C 37,50; H 3,15; N 4,36.
Найдено, С 37,53; Н 3,00; N 4, 28.
EIMS (м/S): 239 (M+, основание), 208 (M+0CH3O, 65%), 198 (M+0C2H3, 76%);
IН ЯМР (ДМСО-d6) дельта, 8,25 (1Н, д, J=1,5 Гц), 8,22 (1Н, д, J=1,5 Гц), 7,98 (1Н, с), 5,98 (обменивающийся), 3,82 (3Н, с), 2,68 (3Н, с);
ИК-спектр (бромистый калий): 3091, 1703, 1285 см-1
.
Пример 18. 4-(2-Mметилтиазол-4-ил)-2-тиофенкарбоновая кислота.
Смесь 3,20 г (10,0 ммоль) метил-4-(2-метилтиазол-4-ил)-2-тиофенкарбоксилата моногидробромида, полученного по методике примера 17, в 50 мл 2 н. гидроксида натрия разбавляют 15 мл метанола и кипятят с обратным холодильником 1 ч. Метанол удаляют в вакууме и оставшийся водный раствор подкисляют до pH 3 концентрированной соляной кислотой. Смесь экстрагируют 3х50 мл этилацетата и сушат над сульфатом магния, экстракты концентрируют, получают 2,12 г (94% ) белого твердого продукта. Аналитический образец получают при тщательном растирании с теплым этилацетатом, т.пл. 195 7oC.
Анализ: Вычислено, для С9H7NO2S2 С 47,98; Н 3, 13; N 6,22.
Найдено, C 47,84; H 3,01; N 6,14.
EIMS (м/Z): 225 (M+, основание), 208 (M+-OH, 1%), 184 (M+-C2H3,
90%);
ИК-спектр (бромистый калий): 3103, 1676, 1284 см-1.
Пример 19. Оксим метил-5-формил-2-тиофенкарбоксилата.
Раствор 6,26 г (36,78 ммоль) метил-5-формил-2-тиофенкарбоксилата, полученного по методике примера 10, 3,07 г (44,1 ммоль) солянокислого гидроксиламина и 3,49г (44,41 ммоль) пиридина в 200 мл этанола кипятят с обратным холодильником в течение 2 ч. Удаляют этанол в вакууме, остаток растворяют в эфире и промывают водой. Органический слой сушат над сульфатом магния и выпаривают, получают желтый твердый продукт. Тщательное растирание с небольшим количеством эфира дает целевое соединение в виде белого твердого продукта (4,93 г, 72), т.пл. 164 7oС. Оксим. E соотношение: (82:18).
Анализ: Вычислено, для C7H7NO3S C 45,39; H 3,81; N 7,56.
Найдено, С 45,41; H 3,69; N 7,48.
EIMS (м/Z): 185 (M+, 97%), 154
(M+-CH3O, основание),
IН ЯМР (ДМСО-d6) дельта, изомер: 12,52 (1H, шир.с), 7,99 (1Н, с), 7,77 (1Н, д, J= 4,0 Гц), 7,50 (2Н, д, J=4,0 Гц), 3,83 (3Н,
с): E изомер: 11,66 (1Н, шир. с), 8,38 (1Н, с), 7,74 (1Н, д, J=4,0 Гц), 7,34 (1Н, д, J=4,0 Г2), 3,82 (3Н, с); ИК-спектр (бромистый калий): 3400, 1649, 918 см-1.
Пример 20. Метил-5-циано-2-тиофенкарбоксилат.
Целевое соединение было описано Secroix B. et al. J.Chem.Res. (M), 1848 (1978) и получено по следующей методике. Кипятят с обратным холодильником в течение ночи при перемешивании смесь 4,87 г (26,29 ммоль) оксима, метил-5-формил-2-тиофенкарбоксилата, полученного по методике примера 19, в 60 мл уксусного ангидрида. Раствор охлаждают до комнатной температуры, выливают в 400 мл воды и энергично встряхивают. Смесь экстрагируют 3х100 мл эфира и экстракты промывают 3х50 мл 10%-ного гидроксида калия. Объединенные органические слои сушат над сульфатом магния и концентрируют, получают 3,50 г (80%) беловатого твердого продукта, т.пл. 76 78oC.
EIMS (м/Z): 167 (M+, 34%) и 136 (M+-CH3
O, основание);
IН ЯМР (ДМСО-d6) дельта, 8,03 (1Н, д, J=4,2 Гц), 7,88 (12Н, д, J=4,2 Гц), 3,87 (3Н, с); ИК-спектр (бромистый калий): 2228, 1726 см-1;
Пример 21. Метил-5-N-оксикарбоксимидамидо-2-тиофенкарбоксилат.
Кипятят с обратным холодильником в течение 45 мин смесь 901 мг (5,39 ммоль) метил-5-циано-2-тиофенкарбокситала, полученного по методике примера 20, 412 мг (5,93 ммоль) соляно-кислого гидроксиламина и 553 мг (6,74 ммоль) ацетата натрия в 25 мл смеси 5:1 этанол-вода. Этанол удаляют в вакууме и отфильтровывают кристаллический осадок. Дополнительный продукт выделяют из охлажденного фильтрата, суммарный выход 932 мг (86) светло желтых кристаллов, т.пл. 144 146oС.
Анализ: Вычислено, для C7H8N2O3S C 41,99; Н 4,03; N 13,99.
Найдено, С 42,24; Н 3,91; N 13,59.
EIMS (м/Z): 200 (M+, основание), 185
(M+-CH3, 83%), 169 (M+-CH3O, 60%);
IН ЯМР (ДМСО-d6) дельта, 9,97 (1Н, с), 7,72 (1Н, д, J= 4,0 Гц), 7,51 (1Н, д, J=4,0 Гц), 6,
11 (2Н, шир.с), 3,80 (3Н, с); ИК-спектр (бромистый калий): 3491, 1725 и 1636 см-1.
Пример 22. Метил-5-/5-метил-1,2,4-оксадиазол-3-ил/-2-тиофенкарбоксилат.
Кипятят с обратным холодильником в течение 24 ч при перемешивании 734 мг (3,67 ммоль) метил-5-/N-окси/карбоксимидиамидо-2-тиофенкарбоксилата, полученного по методике примера 21, и 1,12 г (11,0 ммоль) уксусного ангидрида в 25 мл толуола. Растворитель удаляют в вакууме и остаток тщательно растирают с малым количеством толуола, получают 547 мг (67%) беловатого твердого продукта т.пл. 134 136oC.
EIMS (м/Z): 224 (M+, 99%), 193 (M+-CH3O, основание), (183 (M+-C2H3 58%), 152 (C6H2
NO2S 89%);
IН ЯМР (ДМСО-d6) дельта, 7,77 (1Н, д, J=4,0 Гц) 3,89 (3Н), 2,64 (3Н)с); ИК-спектр (бромистый калий): 1720, 1597 и 887 см-1. Этот материал
используют непосредственно без дополнительной очистки.
Пример 23. 5-/5-Метил-1,2,4-оксадиазол-3-ил/-2-тиофенкарбоновая кислота.
Смесь 86 мг (0,38 ммоль) метил-5-/5-метил-1,2,4-оксадиазол-3-ил/-2-тиофенкарбоксилата, полученного по методике примера 22, в 3 мл 2 н. гидроксида натрия разбавляют 1 мл метанола и нагревают до 60oС в течение 10 мин. Раствор охлаждают до комнатной температуры, разбавляют 2 мл воды и подкисляют до pH 2 концентрированной соляной кислотой. После 30 мин стояния выделяются кристаллический хлопьевидный продукт, который медленно отделяется, его фильтруют и сушат в вакууме, получают 45 мг (56) целевого продукта, т. пл. 218 220oС.
Анализ: Вычислено, для С8H6 N2O3S C 45,70; H 2,88; N 13,33.
Найдено, С 45,69; Н 2,81; N 13,06.
EIMS (м/Z): 210 (M+, 89%), 169 (M+-C2H3 основание), 152 (С6Н2NO2S 27%).
IН ЯМР (ДМСО-d6) дельта, 7,77 (2Н, с), 2,65 (3Н, с);
ИК-спектр (бромистый
калий): 3429, 1668 и 889 см-1.
Пример 24. Метил-5-/трифторметил-1,2,4-оксадиазол-3-ил/-2-тиофенкарбоксилат.
Кипятят с обратным холодильником в течение 1 ч
при перемешивании 833 мг (4,16 ммоль) метил-5-/N-окси/карбоксимидамидо-2-тиофенкабоксилата, полученного по методике примера 21, и 2,62 г (12,48 ммоль) ангидрида трифторуксусной кислоты в 25 мл
толуола. Растворитель выпаривают в вакууме, остаток тщательно растирают с небольшим количеством толуола и фильтруют, получают 400 мг (35% ) белых кристаллов, т.п. 126 127oC. Продукт
используют непосредственно без дополнительной очистки. Точная масса: 277,9998;
Вычислено: 277,9974;
EIMS (м/Z): 278 (M, 67%), 247 (M-CH3O, основание), 152 (С6
H2O2S 41%);
IН ЯМР (CДСl3) дельта, 7,81 (2Н, с), 3,91 (3Н, с); ИК-спектр (бромистый калий): 1712, 1255, 912 см-1
Пример 25.
5-/5-Трифторметил-1,2,4-оксадиазол-3-ил/2-тиофенкарбоновая кислота.
Cмесь 100 мг (0,36 ммоль) метил-5-/5-трифторметил-1,2,4-оксадиазол-3-ил/-2-тиофенкарбоксилата, полученного по методике примера 24, в 3 мл 2 н. гидроксида натрия разбавляют 1 мл метанола и нагревают до 50oС в течение 10 мин. Раствор охлаждают до комнатной температуры, разбавляют 3 мл воды и подкисляют до pH 2 концентрированной соляной кислотой. После стояния в течение 1 ч отфильтровывают беловатые кристаллы и сушат в вакууме, получают 41 мг (43%) белых кристаллов, т.пл. 175 177oC.
Анализ: Вычислено, для С8H3F3NO2S C 36,37; H 1,14; N 10,61.
Найдено, C 36,65; H 1,18; N 10,24.
EIMS (м/Z): 264 (M, основание), 247 (M+-OH, 43%), 169 (M+-C2F3N 24%);
IН ЯМР (ДМСО-d6) дельта, 7,94 (1Н, д, J=4,0 Гц), 7,83
(1Н, д, J=4,0 Гц);
ИК-спектр (бромистый калий): 3430 плечо, 1661, 1208, 847 см-1.
Пример 26. Гидробромид метил-4-/тиазол-4-ил/-2-тиофенкарбоксилата.
Кипятят с обратным холодильником раствор 1,25 г (4,75 ммоль) метил-4-/бромацетил/-2-тиофенкарбоксилата, полученного по методике примера 16, и 436 мг (7,13 ммоль) тиоформамида в 35 мл ацетона в течение 1 ч. Смесь слегка охлаждают и фильтруют, получают 941 мг (65%) желтого твердого продукта. Аналитический образец перекристаллизовывают из этанола, т.пл. 201 202oС.
Анализ: Вычислено, для С9Н7NO2S2•HBr C 35,80; H 2,63; N 4,58.
Найдено, С 35,31; Н 2,60; N 4,48.
EIMS
(м/Z): 225 (M+, основание), 194 (M+-CHNO, 92%), 267 (C8H7O2 25%);
IН ЯМР (ДМСО-d6) дельта, 9,18 (1Н, д, J=1,7 Гц),
8,31 (1Н, д, J=1,2 Iц), 8,30 (1Н, д, J= 1,2 Гц), 8,21 (1Н, д, J=1,7 Гц), 4,50 (1Н, обмениваемый), 3,85 (3Н, с); ИК-спектр (бромистый калий): 3054, 1711, 1272, 778 см-1.
Пример 27. Смесь 500 мг (1,63 ммоль) гидробромида метил-/тиазол-4-ил)-2-тиофенкарбоксилата, полученного по методике примера 26, в 8 мл 2 н. гидроксида натрия разбавляют 1 мл метанола и кипятят с обратным холодильником 30 мин. Метанол удаляют в вакууме и остаточный водный раствор подкисляют до pH 2 концентрированной соляной кислотой. Смесь экстрагируют этилацетатом и высушенные сульфатом магния экстракты концентрируют, получают 318 мг (92%) светло-желтого твердого продукта, т.пл. 183 185oС.
Анализ: Вычислено, для С8Н5NO2 S2 С 45,48; H 2,39; N 6,63.
Найдено, C 45,42; H 2,39; N 6,46.
EIMS (м/Z): 211 (M+, основание), 194 (М+-OH, 23%) и 184 (С7
H4O2 80%);
IН ЯМР (ДМСО-d6) дельта, 9,16 (1Н, д, J=1,2 Гц), 8,23 (2Н, шир.с), 8,16 (1Н, д, J=1,2 Гц); ИК-спектр (бромистый калий): 3440 плечо, 3110,
1691, 1285 cм-1
Пример 28. 4-Mетилтио-2-тиофенкарбоновая кислота.
Готовят диизопропиламид лития, медленно прибавляя 31,0 мл (77,5 ммоль) 2,5 М н-бутиллития в
гексанах к 200 мл тетрагидрофуранового раствора 11,0 мл (78,5 ммоль) диизопропиламина, охлажденного на бане с 2-пропанолом /сухим льдом, температуру реакции поддерживают ниже -60oС. Через
15 мин реакционный раствор нагревают до комнатной температуры в течение 30 мин, затем снова охлаждают до температуры ниже -70oС. Медленно прибавляют 100 мл тетрагидрофуранового раствора 9,9
г (76,0 ммоль) 3-метилтиотиофена (полученного по методике Henrio G. et al. Tetrahedron 33, 191 (1977), контролируя температуру реакции ниже -70oС. После окончания прибавления реакционную
смесь перемешивают в течение 15 мин, затем через раствор барботируют избыток двуокиси углерода. Затем раствор нагревают до 10oС и закаливают 100 мл воды. После нескольких минут
перемешивания реакционную смесь выливают в делительную воронку и экстрагируют порцией 500 мл диэтилового эфира. Органический слой экстрагируют 100 мл 1 н. гидроксида натрия, затем объединяют оба
основных раствора, промывают 100 мл диэтилового эфира и подкисляют концентрированной соляной кислотой. Подкисленную водную смесь затем экстрагируют 2х250 мл диэтилового эфира. Эфирный раствор
промывают рассолом, сушат над сульфатом магния, фильтруют и концентрируют в вакууме, получают 11,75 г (67,4 ммоль) желтого твердого продукта, который по данным ЯМР представляет собой смесь 3: 2
изомеров (4- и 3-) целевой тиофенкарбоновой кислоты. Этот сырой продукт перемешивают 30 мин с порцией 50 мл диэтилового эфира, затем фильтруют и концентрируют фильтрат в вакууме, получают 8,68 г (49,8
ммоль) твердого продукта, который содержит более 80% (оценено ЯМР) целевой 4-метилтио-2-тиофенкарбоновой кислоты. Перекристаллизация из хлороформа дает 4,11 г (23,6 ммоль) светло-желтого твердого
продукта, т. пл. 118 120oС (лит.т.пл. 123 124oС), который содержит 95% 4-метилтио-2-тиофенкарбоновой кислоты (чистота оценена с помощью ЯМР). Общий выход составляет 31%
Пример 29. 5-/N,N-диметиламиносульфонил/-2-тиофенкарбоновая кислота.
Готовят диизопропиламид лития, медленно прибавляя 10,5 мл (26,5 ммоль) 2,5 М н-бутиллития в гексанах к 200 мл
тетрагидрофуранового раствора 5,0 мл (35,7 ммоль) диизопропиламина, охлажденного на бане 2-пропанол/сухой лед, температуру реакции поддерживают ниже -60o. Через 5 мин реакционную смесь
нагревают до комнатной температуры в течение 30 мин, а затем охлаждают снова до температуры ниже -70oС. Медленно прибавляют 100 мл тетрагидрофуранового раствора 3,4 г (17,8 ммоль) 2-/N,
N-диметиламиносульфонил/тиофена, приготовленного согласно методике Slocum S.W. et al. J.O.C. 38, 4189, 1973, поддерживая температуру реакции ниже -70oС. После окончания прибавления
реакционную смесь перемешивают в течение 30 мин, а затем барботируют через раствор избыток двуокиси углерода. Затем раствор нагревают до 0oС и закаливают 50 мл 1 н. гидроксида натрия.
Добавляют порцию 300 мл диэтилового эфира к водно-тетрагидрофурановому раствору и разделяют фазы в делительной воронке. Органический слой экстрагируют 50 мл 1 н. гидроксида натрия. Объединяют оба
основных раствора, промывают 50 мл диэтилового эфира и подкисляют концентрированной соляной кислотой. Кислотную водную смесь экстрагируют 2х100 мл диэтилового эфира. Эфирный раствор промывают рассолом,
сушат над сульфатом магния, фильтруют и концентрируют в вакууме, получают 3,66 г (15,6 ммоль) целевого продукта тиофенкарбоновой кислоты в виде бесцветного твердого продукта, т.пл. 184 186oС (лит.т.пл. 170 172oC). Общий выход составляет 87%
Пример 30. 5-Аминосульфонил-2-тиофенкарбоновая кислота.
Готовят диизопропиламид лития, медленно
прибавляя 26,5 мл (66,3 ммоль) 2,5 М н-бутиллития в гексанах к охлажденному на бане 2-пропанол/сухой лед тетрагидрофурановому (200 мл) раствору 11,0 мл (78,5 ммоль) диизопропиламина, поддерживая
температуру реакции ниже -60oС. Через 5 мин реакционный раствор нагревают до комнатной температуры в течение 30 мин, затем снова охлаждают до температуры ниже -70oС. Медленно
прибавляют 100 мл тетрагидрофуранового раствора 3,26 г (20,0 ммоль) 2-аминосульфонилтиофена (приготовленного по методике Slocum S.W. et al. OC 38, 4189, 1973), контролируя температуру реакционной
смеси ниже -70oС. После окончания прибавления реакционную смесь перемешивают в течение 30 мин, затем барботируют через раствор избыток диоксида углерода. Затем раствор нагревают до 2oС и закаливают 50 мл 1 н. гидроксида натрия. Прибавляют порцию 300 мл диэтилового эфира к водному тетрагидрофурановому раствору и разделяют фазы в делительной воронке. Органический слой
экстрагируют 50 мл 1 н. гидроксида натрия. Объединяют оба основных раствора, промывают 50 мл диэтилового эфира и подкисляют концентрированной соляной кислотой. Подкисленную водную смесь экстрагируют
2х100 мл диэтилового эфира. Эфирный раствор промывают рассолом, сушат над сульфатом магния, фильтруют и концентрируют в вакууме, получают 2,56 г (12,4 ммоль) целевой тиофенкарбоновой кислоты в виде
бесцветного твердого продукта. Перекристаллизация из воды дает 1,79 г (8,6 ммоль) каштанового твердого продукта, т. пл. 228 231oС (лит. т.пл. 231 232oС). Общий выход составляет
43%
Пример 31. 5-Хлор-3-/3-хлор-2-теноил/-2-оксиндол-1-карбоксамид.
Прибавляют избыток тионилхлорида (3,5 мл, 48,0 ммоль) к 0,85 г (5,2 ммоль) 3-хлор-2-тиофенкарбоновой
кислоты (приготовлена по методике Cavial C. et al. Heterocycles 23:1431, 1985), растворенном в 50 мл толуола, и перемешивают при комнатной температуре. После прибавления раствор кипятят с обратным
холодильником в течение 3 ч для получения 3-хлор-2-тиофенкарбонилхлорида. Коцентрирование реакционного раствора дает хлорангидрид кислоты в виде белого твердого продукта. Затем хлорангидрид кислоты
растворяют в 4 мл диметилформамида и медленно прибавляют к охлажденному на бане лед/вода перемешиваемому раствору 1,0 г (4,71 ммоль) 5-хлор-2-оксиндол-1-карбоксамида и 1,3 г (10,5 ммоль) 4-/N,
N-диметиламино/пиридина в 10 мл N,N-диметилформамида. Через 45 мин раствору дают нагреться до комнатной температуры, а через 2 ч обрабатывают его, выливая в смесь лед /6 н. соляная
кислота.
Образуется желтый осадок. Осадок отфильтровывают, промывают водой и сушат, получают 1,3 г загрязненного продукта в виде желтого твердого продукта. Перекристаллизация из смеси 2:1 уксусной
кислота/гептан дает 0,77 г (2,2 ммоль) целевого продукта в виде желтых игл, т.пл. 222 224oC. Общий выход продукта составляет 42%
Анализ: Вычислено, для С14H8
Cl2N2O3S C 47,34; H 2,27; N 7,89.
Найдено, С 47,59; Н 2,20; N 7,92.
EIMS (м/S): 354 (356) 358 (M+, 12% ), 311 (313/315 (M+-CHNO, 31%), 276/278/M+-CHClNO 14% ), 193/195 (M+-CHNO-C4H3ClS основание), 145/247/ C5H2ClOS 34%).
IН ЯМР (ДМСО-d6) дельта, 8,18 (1Н, шир.с, обмениваемый), 8,11 (1Н, д, J= 8,5 Гц), 7,91 (1Н, д, J=5,3 Гц), 7,80 (1Н, д, J=2 Гц), 7,60 (1Н, шир.с), обмениваемый), 7,23 (1Н, дд, J=8,5 Гц, 2 Гц) и 7,19 (1Н, д, J=5,3 Гц).
13C ЯМР (ДМСО-d6) дельта, 167,1, 161,2, 152,5, 134,7, 129,4, 129,3, 127,8, 127,7, 125,7, 125,1, 124,0, 121,2, 116,1 и 104,1.
ИК-спектр (бромистый калий): 3386, 1732, 1618, 1575, 1375, 1274 и 1196 cм-1.
Пример 32. 5-Хлор-3-/4-хлор-2-теноил/-2-оксиндол-1-карбоксамид 1,63 г (10,0 ммоль) 4-хлор-2-тиофенкарбоновой кислоты (полученной по способу Iriarte, J. et al. J.Het.Chem. 13:393, 1976) растворяют в 10 мл тионилхлорида и нагревают до кипения с обратным холодильником. После такого кипячения в течение 1,5 ч избыток тионилхлорида выпаривают, в результате чего остается 1,88 г неочищенного 4-хлор-2-тиофенкарбонилхлорида в виде темно-коричневого масла. Этот хлорангидрид растворяют в 10 мл N,N-диметилформамида и медленно добавляют к 40 мл охлажденного (в смеси лед-вода) N,N-диметилформамидного раствора 1,75 г (8,33 ммоль) 5-хлор-2-оксиндол-1-карбоксамида и 3,05 г (25, 0 ммоль) 4-(N,N-диметиламино) пиридина. Реакцию завершают в течение часа. Смесь выливают в 100 мл 1 н. соляной кислоты, что вызывает образование осадка. Неочищенный твердый продукт отфильтровывают, сушат и перекристаллизовывают до получения 1,89 г (5,3 ммоль, выход 64%) указанного в заглавии соединения в виде желтых иголок с т.плавления 212 214oС (2-бутанон).
Элементный анализ для С14H8Cl2N2O3S
Рассчитано, C 47,34; H 2,27; N 7,89.
Найдено, C 47,08; H 2,22; N 7,81.
EIMS (м/Z) 354/356/358 ( M+, 5%), 311/313/315 (M+-CONH, 25%), 193/195 (M+-CONH, C4H3Cl основной) и 145/147 (C5H2
OIOS),
IН ЯМР (ДМСО-d6) d 3,38 (1H, д, J= 1 Гц), 8,06 (1Н, шир.с), 8,05 (1Н, д, J=8,5 Гц), 7,75 (1Н, шир.с) 6б97 (1Н), шир.д. J=8,5 Гц) и 5,94 (1Н, шир.с, в обмене).
ИК (КBr): 3380, 3220 шир. 1741, 1620, 1540, 1575, 1375, 1270, 1195 и 1180 см-1.
Пример 33. 5-Хлор-3-(5-хлор-2-теноил)-2-оксиндол-1-карбоксамид.
2,44 г (15,0 ммоль) коммерческого образца 5-хлор-2-тиофенкарбоновой кислоты и 10 мл тионилхлорида подвергают взаимодействию по способу примера 32. Выход неочищенного 5-хлор-2-тиофенкарбонилхорида составил 2,64 г в виде маслянистого твердого продукта. Затем этот материал соединяют с 2,42 г (11,5 ммоль) 5-хлор-2-оксиндол-1-карбоксамида в присутствии 3,52 г (28,8 ммоль) 4-/N, N-диметиламино/пиридина как в примере 32. В результате обработки получают 4,33 г сырого неочищенного продукта. После сушки и перекристаллизации получают 2,99 г (8,42 ммоль, выход 73%) указанного в заглавии соединения в виде желтых кристаллов, т.плавления 220 222oС /2-бутанон/.
Элементный анализ:
Рассчитано, для С14H8Cl2N2O3S C 47,34; H 2,27; N 7,89.
Найдено, С 47,32; Н 2,21; N 7,80.
АСЕ/EIMS /м/Z/: 354/356/358/M+, 22% ), 311/313/315 (M+-CONH, 60%), 193/195 (M+CONH-C4H3ClS, основной) и 145/147/ C2H5ClO
IН ЯМР (ДМСО-d6) d 8,31 (1H, д, J=3,5 Гц),
8,05 (1Н, шир.с), 8,01 (1Н, д, J=8 Гц), 7,09 (1Н, шир.д. J=3,5 Гц), 6,89 (1Н, шир.д. J=8 Гц) и 4,86 (1Н, шир.с, в обмене).
ИК (КВr): 3640, 1745, 1640, 1565, 1380, 1355, 1280 и 805 см-1.
Пример 34. 5-Хлор-3-/3-бром-2-теноил/-2-оксиндол-1-карбоксамид.
По способу примера 31, 2,07 г (10,0 ммоль) 3-бром-2-тиофенкарбоновой кислоты (полученной по способу Reincke, M.G. et al. Synthesi- 327, 1980) подвергают взаимодействию с 1,1 мл (15,0 ммоль) тионилхлорида до получения 2,27 г неочищенного хлорангидрида в виде твердого продукта. 10 мл диметилформамидного раствора 2,27 г (10,0 ммоль) 3-бром-2-тиофенкарбонилхлорида подвергают взаимодействию по способу примера 32 с 1,75 г (8,33 ммоль) 5-хлор-2-оксиндол-1-карбоксамида в присутствии 3,05 г (25,0 ммоль) 4-/N,N-диметиламино/-пиридина в 40 мл N,N-диметилформамида. После обработки получают 3,28 г темно-оранжевого твердого вещества. После перекристаллизации этого твердого продукта получают 1,63 г (4,08 ммоль, выход 41%) указанного в заглавии соединения в виде оранжевого кристаллического вещества, т.пл. 216 217oС (2 бутанон).
Элементный
анализ:
Рассчитано, для C14H8BrClN2O3S С 42,08; H 2,02; N 7,01.
Найдено, C 42,15; H 2,05; N 7,0.
АСЕ-EIMS (м/Z): 398/400/402 (M+, 8% ), 355/357/359 (M+-CHNO, 21% 276/278/M+-CHNO-Br, 13% ), 193/195 (M-CHNO)-C4H3BrS 89% и 69, неизвест. основной).
IН ЯМР (ДМСО-d6) кето-форма: d 8,25 (1H, шир.с, в обмене), 8,10 (1Н, д, J=8,5 Гц), 7,87 (1Н, д, J=5 Гц), 7,81 (1Н, шир.д. J=1,5 Гц), 7,54 1Н, шир.с. в обмене) 7,21
(2Н, м), и 5,7 (1Н, шир.с, в обмене); енольная форма: d 10,27 (1H, шир.с, в обмене), 8,19 (1Н, шир.с, в обмене) 8,13 (1Н, д, J=8,5 Гц 7,91 (1Н, д, J= 5 Гц), 7,81 (1Н, шир.д. J= 1,5 Гц), 7,60 (1Н,
шир.с в обмене), 7,25 (1Н, дв.д J=8,5 Гц) и 7,23 (1Н, д, J=5 Гц)
13C ЯМР (ДМСО-d6) d 167,0, 162,2, 152,4, 134,6, 131,4, 130,2, 129,8, 127,6, 125,5, 124,9, 121,1, 116,0,
111,5 и 103,8
ИК (KBr): 3375, 3217 шир. 1726, 16170 1583, 1752, 1374, 1267 и 1196 cм-1.
Пример 35. 5-Хлор-2-/4-бром-2-теноил/-2-оксиндол-1-карбоксамид.
По способу примера 32 2,48 г (12,0 ммоль) 4-бром-2-тиофенкарбоновой кислоты (полученной по способу Zawesson S: J Arkiv for Kemi 11: 317, 1957) и 10 мл тионилхлорида объединяют и нагревают. В результате реакции получают 2,99 г 4-бром-2-тиофенкарбонилхлорида в виде темного масла. По способу примера 32 хлорангидрид, 2,11 г (10,0 ммоль) 5-хлор-2-оксиндол-1-карбоксамида и 3,67 г (30,0 ммоль) 4-(N,N-диметиламино)пиридина подвергают взаимодействию в N,N-диметилформамиде до получения 4,03 г неочищенного оранжевого твердого продукта. После перекристаллизации получают 2,67 г (6,68 ммоль, выход 66,8%) указанного в заглавии соединения в виде желтых твердых кристаллов, т.пл. 217 219oС) с разложением (2-бутанон).
Элементный анализ:
Рассчитано, для С14H8BrClN2O3S C 42,08; H 2,02; N 7,01.
Найдено, С 42,07; H 2,00; N 7,04.
EIMS (м/Z): N398/400/402/ (M+, 1%)
355/357/359 (M+-CHNO, 8%), 193/195 (M+-CHNO-C4H3Br, основной) и 189/191 (C6H2BrOS 35%);
IН ЯМР (ДМСО-d6)
d 8,41 (1H, д, J=1,6 Гц), 8,06 (1Н, шир.д. J=1,2 Гц), 8,05 (1Н, д, J=8,5 Гц), 7,86 (1Н, шир.с), 6,98 (1Н, дд J=8,5 Гц, 1,2 Гц) и 6,05 (шир.с, в обмене).
ИК (KBr) 3384, 3228 шир, 1741, 1620, 1588, 1573, 1375, 1269, 1193 и 1180 см-1.
Пример 36. 5-Хлор-3-/5-бром-2-теноил/-2-оксиндол-1-карбонксамид.
По способу примера 32 2,07 г (10,0 ммоль) коммерческой 5-бром-2-тиофенкарбоновой кислоты подвергают взаимодействию с 10 мл тионилхлорида до получения 2,35 г неочищенного 5-бром-2-тиофенкарбонилхлорида в виде красного масла. Весь неочищенный хлорангидрид соединили с 1,76 г (8,33 ммоль) 5-хлор-2-оксиндол-1-карбоксамида по способу примера 32, используя 3,05 г (25,0 ммоль) 4-N, N-диметиламинопиридина и 50 мл N,N-диметилформамида. После обработки кислотой получают твердый продукт, который после перекристаллизации дает 1,77 г (4,43 ммоль, выход 53%) указанного в заглавии соединения в виде красно-коричневых кристаллов. Т.пл. 228 229oС (тетрагидрофуран).
Элементный анализ:
Рассчитано, для С14H8BrClN2O3S C 42,08; H 2,02; N 7,01.
Найдено, С 42,25; H 1,97; N 6,77.
АСЕ-EIMS (м/Z): 397/399/401 (M+, 5% ), 354/356/358 (M+-CHNO, 17%) и 193/195 (M+-CONH=C4H3Br
основной)
IН ЯМР (ДМСО-d6) d 8,19 (1H, д, J=4 Гц) 8,08 (1Н, д, J=8,5 Гц), 8,06 (1Н, шир. с), 7,29 (1Н, шир.д. J=4 Гц), 7,02 (1Н, шир.д. J=8,5 Гц) и 6,24 (1Н, шир.с, в
обмене).
ИК (KBr): 3386, 3208 шир. 1750, 1569, 1375, 1344, 1203 и 794 см-1.
Пример 37. 5-Хлор-3-/5-иодо-2-теноил/-2-оксиндол-1-карбоксамид.
По способу примера 32 1,96 г (7,72 ммоль) 5-иодо-2-тиофенкарбоновой кислоты (полученной по способу примера 3) смешивают с 10 мл тионилхлорида, и нагревают с обратным холодильником. В результате реакции получают 2,10 г неочищенного 5-ионо-2-тиофенкарбонилхлорида в виде желтого твердого вещества. Этот желтый продукт растворяют в 10 мл N,N-диметилформамида и медленно добавляют к 40 мл N, N-диметилформамидного раствора 1,75 г (8,33 ммоль) 5-хлор-2-оксиндол-1-карбоксамида и 3,05 г (25 ммоль) 4-(N,N-диметиламино)пиридина по способу примера 32. После обработки получают 3,18 г неочищенного продукта в виде оранжевого твердого продукта. После перекристаллизации из тетрагидрофурана получают 1,47 г (3,29 ммоль, выход 40%) чистого указанного в заглавии соединения в виде чисто оранжевых кристаллов, т.пл. 230 232oС.
Элементный анализ:
Рассчитано, для С14H8ClIN2O3S C 37,65; H 1,81; N 6,27.
Найдено, С 37,93; H 1,73; N 6,13.
EIMS (м/Z): 446/448 (M+-CHNO, 13%) 237 (C5H2IO 39%) и 193/195 (M+-CONH-C4H3 IS
основной):
IН ЯМР (ДМСО-d6) d 8,05 (1H, д, J=8,5 Гц), 8,00 (1Н, шир.с) 7,92 (1Н, д, J= 4,0 Гц), 7,38 (1н, шир.д, J=4,0 Гц), 7,01 (1Н, шир.д, J=8,5 Гц) и 5,37 (1Н, шир.с в
обмене)
НК (KBr): 3389 шир. 3216 шир. 1749, 1565 и 1373 см-1
Пример 38. 5-Хлор-3-/4,5-дибром-2-теноил/-2-оксиндол-1-карбоксамид.
По способу примера 32 2, 86 г (10,0 ммоль) коммерческий 4,5-дибром-2-тиофенкарбоновой кислоты добавляют к 10 мл тионилхлорида до получения гетерогенной смеси. Нагревание реакционной смеси помогает гомогенизации раствора. После концентрирования реакционного раствора получают 3,15 г неочищенного 4,5-дибром-2-тиофенкарбонилхлориа в виде коричневого масла. Неочищенный хлорангидрид растворенный в 10 мл N,N-диметилформамида медленно добавляют к 1,76 г (8,33 ммоль) 5-хлор-2-оксин дол-1-карбоксамида и 3,05 г (25,0 ммоль) 4-/N,N-диметиламино/пиридина в 40 мл N,N-диметилформамида в условиях примера 32. После обработки получают 2,82 г оранжевого твердого продукта, который перекристаллизовывают из 2-бутанола до получения 1,61 г (3,37 ммоль, выход 40% ) чистого указанного в заглавии соединения в виде желтого твердого продукта. Т. пл. 229 31oС.
Элементный анализ для С14H7Br2ClN22O3S
Рассчитано, С 35,14; Н 1,47; N 5,85.
Найдено, С 35,34; H 1,34; N 5,66.
АСЕ/EIMS/м/Z): 476/478/480/482 (M+, 4%) 433/435/437/439 (M+-CHNO 23%) 267/269/271 (C5HBr2OS
28%) и 193/195 (M+-CONH-C4H2H2B2S основной);
IН ЯМР (ДМСО-d6) d 8,62 (1H, c), 8,14 (1H, шир.с) 8б05 (1Н, д, J=8,5
Гц) 6,93 (1Н, шир.д. J=8,5 Гц) и 6,86 (1Н, шир.с, в обмене)
ИК (KBr): 3397, 3238 шир. 1748, 1614, 1574, 1375, 1193 и 816-1
Пример 39.
5-хлор-3-/4-метилтио-2-теноил/-2-оксиндол-1-карбоксамид.
Указанное в заглавии соединение получают по способу примера 32. При взаимодействии 1,74 г (10,0 ммоль) 4-метилтио-2-тиофенкарбоновой кислоты (полученной по способу примера 28) с 10 мл тионилхлорида получают 2,02 г 4-метилтио-2-тиофен-карбонилхлорида в виде твердого желтого продукта. Хлорангидрид соединяют с 1,75 г (8,33 ммоль) 5-хлор-2-оксинол-1-карб-оксамида в присутствии 3,05 г (25 ммоль) 4-(N,N-диметиламино)пиридина по примеру 32. После обработки получают 4,56 г оранжевого твердого продукта. После перекристаллизации его получают 1,40 г (3,82 ммоль, 46%) чистого указанного в заглавии соединения в виде желто-оранжевого твердого продукта, т.плавления 216 19oС (тетрагидрофуран).
Элементный анализ:
Рассчитано, для С15H11ClN2O3S2
C 49,11; H 3,02; N 7,64.
Найдено, С 49,06; H 3,09; N 7,53.
EIMS (м/Z): 366 (368 (M+, 6% ), 323/325 (M+-CONH, 20%), 193 /195 (M+-CONH-C5H6S 43%), 157
(C6H5O 66%) и 130 (C5H6 основной)
IН ЯМР (ДМСО-d6) d 8,09 (1H, д, J=8,5 Гц) 8,05 (1Н, шир.с) 7,98 (1Н, шир.с) 7,51 (1Н, шир.с)
7,08 (1Н, шир, д J=8,5 Гц) 6,16 (1Н, шир.с, в обмене) и 2,52 (3Н, с)
ИК (KBr) 3387, 3220 шир, 1741, 1616, 1588, 1376, 1195 и 1185 см-1
Пример 40.
5-Хлор-3-/5-метилтио-2-теноил/-2-оксиндол-1-карбоксамид.
Указанное в заглавии соединение получают по способу примера 32. 1,74 г (10,0 ммоль) образца 5-метилтио-2-тиофенкарбоновой кислоты (полученной по способу Knight, S. W. et al. J.Chem. Soc. P.T.J. 791 (1983)) превращают в 1,93 г соответствующего хлорангидрида при взаимодействии с 10 мл тионилхлорида. Хлорангидрид подвергают непосредственному взаимодействию с 1,75 г (8,33 ммоль) 5-хлор-2-оксиндол-1-карбоксамида в присутствии 3,05 (25 ммоль) 4-(N, N-диметиламино)пиридина по способу примера 32. После обработки водной кислотой получают 3,02 г оранжевого твердого продукта. После перекристаллизации неочищенного твердого оранжевого продукта из тетрагидрофурана получают 1,32 г (3,57 ммоль, 43% выход) чистого 5-хлор-3-/метил-тио-2-теноил)-2-оксиндол-1-карбоксамида в виде оранжевого твердого продукта. Определение точки плавления показало, что материал плавится вначале при 180oС, затем повторно отверждается и затем плавится снова при 247 250oС (с разложением).
Элементный анализ:
Рассчитано, для С15H11ClN2O3S2 C 49,11; H 3,02; N 7,64.
Найдено, C 48,92; H 2,98; N 7,52.
EIMS (м/Z): 366/368 (M+ 16% ), 323/325 (M+-CONH, 23% ), 193 - 195 (M+-CONH-C5H6S2 30%), 157 (C6H5OS2 83%) и 130 (C5H6S2 основной)
IН ЯМР
(ДМСО-d6) d 8,11 (1H, д, J=3,9 Гц), 8,09 (1Н, д, J=8,5 Гц) 7,96 (1Н, шир.с), 7,12 (1Н, шир.д. J=3,9 Гц) 7,08 (1Н, шир.м), 5,43 (1Н, шир.с) и 2,63 (3Н, с)
ИК (KBr): 3362, 3191 шир
1729, 1600, 1565, 1374, 1348 и 1190 см-1.
Пример 41. 5-Хлор-3-/3-метокси-2-теноил/-2-оксиндол-1-карбоксамид.
2,00 (12,69 ммоль) образца 3-метокси-2-тиофенкарбоновой кислоты (полученной по способу Gronowitz.S. Arkiv for Kemi 12:239, 1958) подвергают взаимодействию с 10 мл тионилхлорида по способу примера 32. После выпаривания избытка тионилхлорида остается 2,17 г 3-метокси-2-тиофенкарбонилхлорида в виде твердых кристаллов, т.пл. 86 88oС. Хлорангидрид соединяют с 2,1 6 г (10,24 ммоль) 5-хлор-2-оксиндол-1-карбоксамида в присутствии 3,30 г (27 ммоль) 4-/N, N-диметиламино/пиридина по способу примера 32. Гашение водной кислотой с последующим фильтрованием приводит к получению желтого твердого продукта, который очищают перекристаллизацией до получения 1,04 г (2,96 ммоль, выход 29% ) 5-хлор-3-(3-метокси-2-теноил)-2-оксиндол-1-карбоксамида в виде твердого продукта желтого цвета, т.пл. 272 274oС (уксусная кислота).
Элементный анализ
Рассчитано, для С15H11ClN2O4S
C 51,36; H 3,16; N 7,99.
Найдено, С 50,97; H 3, 20; N 7,81.
EIMS (м/Z): 350/352 (M+, 13%), 307/309/M+-CONH, 21%), 193/195 (M+-CONH-C5H6OS. 92%), 141 (C6H5
O2S 79%) и 114 (С5H6O2S основной)
IH ЯМР (ДМСО-d6) d 8,28 (1H, шир.с), 8,13 (1Н, д, J=8 Гц) 7,92 (1Н, д, J= 5 Гц), 7,69 (1Н,
шир.с), 7,56 (1Н, шир.с в обмене) 7,23 (1Н, дв.д J=8,1,5 Гц), 7,19 (1Н, д, J=5 Гц) и 3,88 (3Н, с).
ИК (ЕВГ): 3375, 3230 шир. 17450 1574, 1383 и 1074 см-1
Пример
42. 5-Хлор-3-/4-метокси-2-теноил/-2-оксиндол-1-карбоксамид.
Указанное в заглавии соединение получают по способу примера 32, 1,30 г (8,22 ммоль) 4-метокси-2-тиофенкарбоновой кислоты (полученной по способу Gronowitz, S. Arkiv. for Kemi 12: 239, 1958) превращают в 1,19 г чистого хлорангидрида (т. кипения 58 60oС, 0,03 мм) с 10 мл тионилхлорида. Хлорангидрид соединяют с 1, 18 г (5,61 ммоль) 5-хлор-2-оксиндол-1-карбоксамида в присутствии 1,73 г (14,15 ммоль) 4-/N,N-диметиламино/пиридина до получения 1,88 г неочищенного продукта после кислотной обработки.
После перекристаллизации получают 1,39 г (3,96 ммоль, выход 71%) чистого 5-хлор-3-(4-метокси-2-теноил)-2-оксиндол-1-карбоксамида в виде твердого желтого продукта, т. пл. 221 223oС
(уксусная кислота)
Анализ: Рассчитано, для С15H11N2O4S C 51,36; H 3,16; N 7,99.
Найдено, С 51,16; Н 3,11; N 7,84.
EIMS /м/Z/: 350/352 (M+, 27%), 307/309/M+-CONH, 71%/ 193/195 (M+-CONH-C5H6OS основной), 141 (С6H5O2S 52%)) и 114
(С5H6O2S 50%)
IН ЯМР (ДМСО-d6) d 8,08 (1H, д, J=8 Гц), 7,92 (1Н, шир.с.), 7,76 (1Н, шир. с. ), 7,10 (1Н, шир.д. J=8 Гц), 6,93 (1Н,
шир.с.), 5,36 (1Н, шир.с. в обмене) и 3,80 (3Н, с.),
ИК (KBr): 3388, 3216 шир. 1746, 1613, 1588, 1378 и 1189 см-1.
Пример 43. 5-Хлор-3-/5-метокси-2-теноил/-2-оксиндол-1-карбоксамид.
Указанное в заглавии соединение получают по способу примера 32. При взаимодействии 10 мл тионилхлорида с 1,75 г (11,06 ммоль) 5-метокси-2-тиофенкарбоновой кислоты (полученной по способу Sice, J.J.Am.Chem.Soc. 75:3697 (1953)) получают 1,83 г соответствующего хлорангидрида в виде коричневого масла. При соединении 5-метокси-2-тиофенкарбонилхлорида с 1,82 г (8,63 ммоль) 5-хлор-2-оксиндол-1-карбоксамиде в присутствии 2,66 г (21,76 ммоль) 4-(N, N-диметиламино)пиридина получают 3,11 г неочищенного продукта в виде желтого твердого продукта. После перекристаллизации из уксусной кислоты получают 0,87 г чистого 5-хлор-3-/5-метокси-2-теноил/-2-оксиндол-1-карбоксамида в виде твердого продукта желтого цвета т.пл. 180 182oС.
Анализ:
Рассчитано, для С15H11ClIN2O4S С 51,36; H 3,16; N 7,99.
Найдено, С 51,15; H 3,07; N 7, 77.
EIMS (м/Z): 350/352/M+ 22%), 307/309/M+-CONH, 81%), 193/195 (M+-CONH-C5H6OS, 75%), 141 (C6H5O2S 98%) и 114 (C5H6O2S основной)
IH ЯМР (ДМСО-d6) d 8,11 (1H, д, J=8,5 Гц), 8,04 (1Н, шир. с), 7,90 (1Н, шир.с), 7,12 (1Н, шир.с),
6,52 (1Н, шир.с), 4,92 (1Н, шир.с), и 4,0 (3Н, с).
ИК (KBr): 3393, 3200 шир. 1755, 1605, 1585, 1544, 1489, 1423, 1301 и 1052 cм-1.
Пример 44. 5-Хлор-3-/5-этокси-2-теноил/-2-оксиндол-1-карбоксамид.
Указанное в заглавии соединение получают по способу примера 32. При взаимодействии 1,39 г (8,07 ммоль) 5-этокси-2-тиофенкарбоновой кислоты (полученной по способу Siec, J.J.Am.Chem.Soc. 75:3697,1953) с 10 мл тионилхлорида получают 1,05 г (5,51 ммоль, выход (68%) чистого хлорангидрида после перегонки (т. кип. 72 75oС (0,1 мм) в виде низкоплавкого твердого продукта. Ацилирование 0,94 г (4,46 ммоль) 5-хлор-2-оксиндол-1-карбоксамида с 1,02 г (5,35 ммоль) 5-этокси-2-тиофенкарбонилхлорида в присутствии 1,37 г (11,23 ммоль) 4-(N,N-диметламина) пиридина приводит к получению 1,50 г неочищенного твердого продукта. После перекристаллизации неочищенного твердого продукта в уксусной кислоте получают 0,20 г (0,55 ммоль, 12% выход) чистого указанного в заглавии соединения в виде желтого твердого продукта.
Т. пл. 183 185oС.
Анализ:
Рассчитано, для C16H13ClN2O4 C 52,67; H 3,59; N 7,68.
Найдено, С 52,70; Н 3,49; N 7,60.
EIMS (м/Z): 366 (M+,
основной) 321 (323 (M+-CONH, 80% ), 193 195 (M+-CONH-C6H8O 74%), 155 (C7H7O2S 72%) и 128 (C6Н8OS
78%)
IH ЯМР (ДМСО-d6) d 8,10 (1H, д, J=8,5 Гц) 7,04 Гц) (1Н, шир.с), 7,90 (1Н, шир.с), 7,10 (1Н, шир.с), 6,50 (1Н, шир.с), 4,63 (1Н, шир.с. в обмене), 4,26 (2Н, шир.кв.
J=7 Гц) и 1,40 (3Н, т, J=7 Гц)
ИК (KBr): 3394, 3209 шир, 1752, 1609, 1585, 1481, 1375, 1352 и 1296 см-1.
Пример 45. 5-Хлор-3-/4-ацетокси-2-теноил/-2-оксиндол-1-карбоксамид.
Указанное в заглавии соединение получают по способу примера 32. При взаимодействии 15 мл тионилхлорида с 3,59 г (19,23 ммоль) 4-ацетокси-2-тиофенкарбоновой кислоты (полученной по способу Bohlmann FV. et al. Chem.Ber. 106:497, 1973) получают желтое масло. 3,32 г (16,32 ммоль) образца 4-ацетокси-2-тиофенкарбонилхлорида соединяют с 2,85 г (13,52 ммоль) 5-хлор-2-оксиндол-1-карбоксамида в присутствии 4,16 г (34,07 ммоль) 4-(N,N-диметиламино) пиридина до получения 5,40 г неочищенного желтого продукта. После очистки перекристаллизацией получают 4,18 г (11,02 ммоль, 82%) неочищенного указанного в заглавии соединения в виде желтого твердого продукта. Т. пл. 222 224oС (уксусная кислота).
Анализ:
Рассчитано, для С16H11ClN2O5S C 50,73; H 2,93; N 7,40.
Найдено, C 50,53; H 2,89; N 7,22.
EIMS (м/Z): 378
(M+, 3%), 355 (337 (M+-CONH, 12%), 293/295 (M+-CONH-COCH2, 9%) 193/195 (M+-CONH-C6H6O2 основной) 169 (С7H5O3S, 24%)
IH ЯМР (ДМСО-d6) d 8,15 (1H, д, J=1,5 Гц), 8,07 (1Н, д, J=8,5 Гц) 8,01 (1Н, шир.с.), 7,72 (1Н, шир.с) 7,03 (1Н, шир.д. J=8,5 Гц),
5,03 (1Н, шир.с. в обмене) 2,29 (3Н, с)
ИК (KBr): 3389, 3117 шир.1773, 1742, 1618, 1589, 1369 и 1210 см-1.
Пример 46. 5-Хлор-3-(5-ацетил-2-теноил)-2-оксиндол-1-карбоксамид.
Указанные в заглавии соединение получают по способу примера 32. Вначале 2,0 г (11,75 ммоль) 5-ацетил-2-тиофенкарбоновой кислоты (полученной по способу Thames, S.T. et al. J.Het.Aum 3:104, 1966) обрабатывают 15 мл тионилхлорида. После выпаривания избытка тионилхлорида получают смолистый остаток, который тщательно растирают с четыреххлористым углеродом до получения 0,92 г (4,88 ммоль, выход 42%) 5-ацетил-2-тиофенкарбонилхлорида в виде светло-оранжевого твердого продукта. Т. плавления 78 80oС. Затем 0,90 г (4,77 ммоль) хлорангидрида подвергают взаимодействию с 0,83 г (3,95 ммоль) 5-хлор-2-оксиндол-1-карбоксамида в присутствии 1,22 г (9,97 ммоль) 4-(N,N-диметиламино)пиридина до получения 1,42 г (3,91 ммоль, 99%) чистого указанного в заглавии соединения после обработки водной кислотой и сушки в виде оранжево-желтого твердого продукта. Т. плавления 218 21oС.
Анализ:
Рассчитано, для C16H11ClN2O4S C 52,97; H 3,06; N 7,71.
Найдено, C 52,76; H 3,01; N 7,58.
EIMS (м/Z): 362 (364 (M+, 1%), 319/321 (M1-CONH, 7%) 193/195 (M+-CONH-C6H6OS, 58%) и 153 (С7H5O2S основной)
IH ЯМР
(ДМСО-d6) d 8,08 (1H, д, J=8,5 Гц), 8,07 (1Н, д, J=4 Гц), 8,01 (1Н, шир.д. J=1,5 Гц) 7,92 (1Н, д, J=4 Гц), 7,07 (1Н, дд, 8,5 Гц) 5,22 (1Н, шир.с в обмене) и 2,60 (3Н, с)
ИК (KBr):
3379, 3170 шир. 1734, 1672, 1607, 1599, 1573, 1354, 1264 и 1194 см-1.
Пример 47. 5-Хлор-3-/4-метилсульфонил-2-теноил/-2-оксиндол-1-карбоксамид.
Указанное в заглавии соединение получают по способу примера 32. При взаимодействии 10 мл тионилхлорида с 1,39 г (6,7 ммоль) 4-метилсульфонил-2-тиофенкарбоновой кислоты, полученной по способу Arndt F. et al. Chem.Ber 94: 1757 (1961), получают 1,54 г неочищенного хлорангидрида в виде твердого продукта. Все количество 4-метилсульфонил-2-тиофенкарбонилхлорида соединяют с 1,28 г (6,1 ммоль) 5-хлор-2-оксиндол-1-карбоксамида в присутствии 2,24 г (18,3 ммоль) 4-(N,N-диметиламино)пиридина. После обработки кислотой получают 2,28 г неочищенного продукта в виде оранжевого твердого продукта. После перекристаллизации из 2-бутанона получают две порции не совсем чистого желтого кристаллического продукта с суммарной массой 2,18 г. После дальнейшей очистки перекристаллизацией получают 1,19 г (2,98 ммоль, выход 49%) чистого 5-хлор-3-/4-метилсульфонил-2-теноил/-2-оксиндол-1-карбоксамида в виде желтого кристаллического вещества, т. пл. 228 230oС (уксусная кислота).
Анализ:
Рассчитано, для С15H11ClN2O5S2 C 45,17; H 2,17; N 7,02.
Найдено, C 45,05; H 2,68; N 6,83.
EIMS (M/Z): 398/400 (M+, 3%), 355/357 (M+-CHNO, 24%) 193/195 (M+-CHNO-C5H6O2S2 основной) и 189 (С6H5 O3S2 39%).
IH ЯМР (ДМСО-d6) d 8,83 (1H, д, J=1 Гц), 8,43 (1Н, шир.с) 8,12 (1Н, шир. д. J=1,5 Гц), 8,03 (1Н, д, J=8,5 Гц), 6,91 дв.д. J=8,5 1, 5 Гц), 5,05 (1Н, в обмене) и 3,24 (3Н, с).
ИК (KBr): 3380, 3206 шир, 3084, 1732, 1574, 1311 и 1138 см-1.
Пример 48. 5-Хлор-3-/5-метилсульфонил-2-теноил/-2-оксиндол-1-карбоксамид.
Указанное в заглавии соединение получают по способу примера 32 2,06 г (10,0 ммоль) образца 5-метилсульфонил-2-тиофенкарбоновой кислоты (полученной по способу Cymerman. Craing J. et al. J.Chem.Soc. 237, 1954) подвергают взаимодействию с 10 мл тионилхлорида до получения 2,14 г неочищенного хлорангидрида в виде твердого продукта. При взаимодействии 1,75 г (8,33 ммоль) 5-хлор-2-оксиндол-1-карбоксамида с 5-метил-сульфонил-2-тиофенкарбонилхлорида в присутствии 3,05 г (25,0 ммоль) 4-(N, N-диметиламино) пиридина до получения 3,17 г неочищенного продукта после кислотной обработки. После одной перекристаллизации из уксусной кислоты получают 2,31 г (5,80 ммоль, 70% выход) чистого 5-хлор-3-/5-метилсульфонил-2-теноил/-2-оксиндол-1-карбоксамида в виде темно-оранжевого твердого продукта. Т.пл. 212 214oС.
Анализ:
Рассчитано, для С15
H11ClN3O5S2 C 45,17; H 2,78; N 7,02.
Найдено, C 54,15; H 2,78; N 6,75.
EIMS (м/Z): 398/400 (M+, 2%), 355/357
(M+-CHNO, 21%), 193/195 (M+-CHNO-C5H6NO2S2 основной) и 189 (C6H5O3S 23%)
IH ЯМР
(ДМСО-d6) d 8,34 (1H, д, J=4 Гц), 8,06 (1Н, д, J=1,5 Гц), 7,99 (1Н, д, J= 8,5 Гц), 7,69 (1Н, шир.д. J=4,0 Гц), 6,89 (1H, дв.д, J=8,5 1,5 Гц), 5,76 (1Н, шир.с, в обмене) и 3,32 (3Н, с)
ИК (KBr), 3366, 3162 шир. 1732, 1580, 1318 и 1148 см-1.
Пример 49. 5-Хлор-3-(5-(N,N-диметилсульфонамидо)-2-теноил)-2-оксиндол-1
карбоксамид.
Указанное в заглавии соединение получают по способу примера 32. При взаимодействии 10 мл тионилхлорида с 2,35 г (10,0 ммоль) 5-(N,N-диметилсульфонамидо)-2-тиофенкарбоновой кислоты (полученной по способу примера 29) получают 2,58 г неочищенного хлорангидрида в виде твердого продукта. 2,54 г образца 5-/N,N-диметилсульфонамидо/-2-тиофенкарбонилхлорида соединяют с 1,75 г (8,33 ммоль) 5-хлор-2-оксиндол-1-карбоксамида, используя избыток 3,05 г (25,0 ммоль) 4-(N,N-диметиламино)пиридина до получения 3,55 г неочищенного продукта в виде твердого оранжевого продукта. После перекристаллизации неочищенного продукта получают 2,40 г (5,61 ммоль, выход 67%) чистого указанного в заглавии продукта в виде желто-оранжевого твердого продукта, т. плавления 227 30oС (2-бутанон).
Анализ: Рассчитано, для С16H14ClN3O5S2 C 44,91; H 3,30; N 9,82.
Найдено, C 45,02; H 3,26; N 9, 62.
EIMS (M/Z): 427 (429 (+, 2%), 384 (386 (M+-CHNO, 18%), 218 (C7H8NO3S 26% ) и 193/195 (M+-CHNO-C6H9NO2S основной)
IH ЯМР
(ДМСО-d6) d 8,50 (1H, д, J=3,9) 8,13 (1Н, д, J=1,5 Гц) 8,06 (1Н, д, J= 8,5 Гц), 7,60 (1Н, д, J=3,9 Гц), 6,96 (1Н, дв.д J=8,5 1,5
Гц), 5,65 (1Н, шир.с. в обмене) и 2,71 (6Н, с).
ИК (KBr): 3454 шир, 3336, 1729, 1595, 1566, 1335, 1209 и 1155 cм-1.
Пример 50. 5-Хлор-3-/4-метоксиметил-2-теноил/-2-оксиндол-1-карбоксамид.
Указанное в заглавии соединение получают по способу примера 32. 1,40 г (8,13 ммоль) образца 4-метоксиметил-2-тиофенкарбоновой кислоты (полученной по способу Nemec N. et al. Coll Crech.Chem.Comm 39:3527, 1974) обрабатывают 10 мл тионилхлорида до получения неочищенного хлорангидрида. Фракционной перегонкой выделяют 0,89 г чистого 4-метоксиметил-2-тиофенкарбонилхлорида, т. кипения 65 67oС (0,05 мм). При взаимодействии 0,88 г (4,61 ммоль) хлорангидрида с 0,81 г (3,84 ммоль) 5-хлор-2-оксиндол-1-карбоксамида в присутствии 1,18 г (9,67 ммоль) 4-/N,N-диметиламино/пиридина получают 1,27 г оранжевого твердого продукта, выделенного после обработки водной кислотой. После перекристаллизации оранжевого твердого продукта с последующей хроматографической обработки на силикагеле получают 0,32 г (0,88 ммоль, 23% выход) чистого 5-хлор-3-(4-метоксиметил-2-теноил)-2-оксиндол-1-карбоксамида в виде зеленовато-желтого твердого продукта, т. пл. 193-195oС.
Анализ:
Рассчитано, для С16
H13ClN2O4S C 52,67; H 3,59; N 7,68.
Найдено, C 51,56; H 3,38; N 7,51.
EIMS (м/Z): 364/366 (M+, 21%) 332/334 (M+ -CH3OH, 12%), 321/323 (M+-CHNO, 20%), 289/291 (M+-CHNO, -CH3OH, 56%) 193/195 (M+-CHNO-C6H8O), основной и 155 (С7 H7O2S 44%).
IH ЯМР (ДМСО-d6) d (1H, д, J=8,5 Гц), 7,98 (7,90 (1Н, шир.с), 7,71 (1Н, шир.с), 7,10 (1Н, шир.д. J=8,5 Гц) 4,86 (1Н, шир.с, в
обмене), 4,42 (2Н, с), и 3,30 (3Н, с)
ИК (KBr) 3391, 3222 шир. 1744, 1615, 1587, 1574, 1380 и 1195 см-1.
Пример 51. 5-Хлор-3-/5-метоксиметил-2-теноил/-2-оксиндол-1-карбоксамид.
Указанное в заглавии соединение получают по способу примера 32. 2,06 г (11,96 ммоль) образца 5-метоксиметил-2-тиофенкарбоновой кислоты (полученной по способу Jauda M. et al. Coll. Crech.Chem.Comm 27:1191, 1962) нагревают с 20 мл тионилхлорида. После завершения реакции избыток тионилхлорида выпаривают, а остаток отгоняют до получения 1,83 г (9,60 ммоль, 80%) чистого 5-метоксиметил-2-тиофенкарбонилхлорида в виде бесцветного масла, т. кипения 62 67oС (0,05 мм). После взаимодействия хлорангидрида (всего) с 1,68 г (8,00 ммоль) 5-хлор-2-оксиндол-1-карбоксамида в присутствии 2,46 г (20,16 ммоль) 4-/N, N-диметиламино/пиридина получают 2,61 г оранжевого твердого продукта после обработки кислотой. После перекристаллизации продукта получают 0,98 г (2,69 ммоль, выход 34%) чистого указанного в заглавии соединения в виде коричневого твердого продукта, т. плавления 203 205oС (2-бутанон).
Анализ:
Рассчитано, для С16H13ClN3O4S C 52,67; H 3,59; N 7,68.
Найдено, C 52,88; H 3,64; N 7,55.
EIMS (м/Z): 364 (366 (M+, 19% ) 321 /323 (M+-CHNO, 27% ) 289/291 (M+-CHNO-CH3OH, 20%), 193/195 (M+-CHNO-C6H8OS основной) и 155 (C7H7O2S 76%).
IH ЯМР (ДМСО-d6) d 8,08 (1H, д, J=8,5 Гц) 7,87 (1 или 2 Н, шир.с) 7,10 (1
или 2Н, шир.с), 4,89 (1Н, шир.с, в обмене) 4,63 (1Н, с), и 3,32 (3Н, с)
ИК (KBr): 3382, 3205 шир. 1752, 1605, 1584 и 1287 см-1.
Пример 52. 5-Хлор-3-/5-N, N-диметилкарбамидо-2-теноил/-2-оксиндол-1- карбоксамид.
По способу примера 32, 1,25 г (6,27 ммоль) 5-(N,N-диметиламино/карбонил/-2-тиофенкарбоновой кислоты), полученной по способу примера 5, превращают в 1,32 г (6,08 ммоль, выход 97%) соответствующего хлорангидрида, т. пл. 109 111oС, при взаимодействии с избытком тионилхлорида. Соединение 5-[(N, N-диметиламино)карбонил]-2-тиофенкарбонилхлорида с 1,06 г (5,05 ммоль) 5-хлор-2-оксиндол-1-карбоксамида в присутствии 1,56 г (12,73 ммоль) 4-/N, N-диметиламино/пиридина дает оранжевый твердый продукт после кислотной обработки.
После перекристаллизации твердого продукта получают 0,80 г (2,05 ммоль, выход 40%) чистого указанного в заглавии соединения в виде оранжевого твердого продукта, т. плавления 219 220oС (уксусная кислота).
Анализ:
Рассчитано, для С17H14ClN3O4S C 52,11; H 3,60; N 10,72.
Найдено, С 51,85; H 3,49; N 10,42.
EIMS (м/Z): 391/393 (M+, 6%) 348/350 (M+-CONH, 10%), 193/195 (M+-CONH-C7H8OS
основной) и 182 (С3H8NO2S 56%)
IH ЯМР (ДМСО-d6) d 8,08 (1H, д, J=8,5 Гц), 8,00 (1Н, д, J=4,0 Гц) 7,96 (1Н0 шир. с) 7,48 (1Н, д, J=4,0 Гц,
7,07 Гц), 7,08 (1Н, д, J=8,5 Гц) 6,20 (1Н, шир.с в обмене) и 3,13 (6Н, шир.с).
ИК (KBr): 3372, 3224, 1726, 1604, 1392 и 1193 см-1.
Пример 53. 5-Хлор-3-/3-фтор-2-теноил/-2-оксиндол-1-карбоксамид.
Избыток тионилхлорида (3,0 мл 41,1 ммоль) и 0,89 г (6,10 ммоль) 3-фтор-2-тиофенкарбоновой кислоты (полученной по способу Сorral, C. et al, Heterocycles 23: 1431, 1985) смешивают в 10 мл толуола и подвергают взаимодействию по способу примера 31. Это дает соответствующий хлорангидрид в виде желтого масла после обработки. Желтый хлорангидрид растворяют в 3 мл N,N-диметиформамида и подвергают взаимодействию с 1,28 (6,10 ммоль) 5-хлор-2-оксиндол-1-карбоксамида в присутствии 1,64 г (13,42 ммоль) 4-/N,N-диметиламино/пиридина в 5 мл N,N-диметилформамида. После обработки получают 1,7 г желтого твердого продукта. После перекристаллизации этого материала получают 0,65 г (выход 31%) указанного в заглавии соединения в виде желтых иголок, т. пл. 235 240oС (уксусная кислота).
Анализ:
Рассчитано, для С14H8ClFN2O3S C 49,64; H 2,38; N 8,27.
Найдено, С 49,64; H 2,32; N 8,43.
ACE/EIMS /м/Z/ 338/340 (M+, 10% ) 295/297 (M+-CHNO, 45%), 193/195 (M+-CHNO-C4H3FS
основной) и 129 (С5H2FOS 70%)
IН ЯМР (ДМСО-d6) d 9,15 (1Н, шир. с. в обмене) 8,28 (1Н, шир.с. в объеме) 8,10 (1Н, д, 8,5 Гц) 7,88 (1Н, дв.в J=5,1 4,
3 Гц) 7,81 (1Н, д, J=1,5 Гц), 7,60 (1Н, шир.с. в обмене) 7,21 (1Н, дв.д J=8,5 1,5 Гц) и 7,11 (1Н, д, J=5,2 Гц).
13С ЯМР (ДМСО-d6) d 176,1 160,2 158, и 154,6 152,6
134,2 129,2 127,6 125,4 125,2 120,8 117,4 115,9 114,9 и 114,7 и 103,0
ИК (KBr): 3400, 3240 шир, 1750, 1625; 1585, 1390, 1290, 1205 и 930 см-1.
Пример 54. 5-Хлор-3-/3-метилтио-2-теноил/-2-оксиндол-1-карбоксамид.
3-метилтио-2-тиофенкарбоновую кислоту (полученную по способу Carpenter, A.J. et al. Tetraludron Jetter 26:1777, 1985) (2,61 г, 15,0 ммоль) подвергают взаимодействию с 10 мл тионилхлорида до получения 2083 г неочищенного 3-метилтио-2-тиофенкарбонилхлорида в виде светло-желтого твердого продукта. Затем хлорангидрид соединяют с 2,57 г (12,2 ммоль) 5-хлор-2-оксиндол-1-карбоксамида в присутствии 4,47 г (36,6 ммоль) 4-(N,N-диметиламино)пиридина по способу примера 32 до получения 3,73 г неочищенного продукта в виде оранжевого твердого продукта. Этот продукт частично счищают перекристаллизацией из 2-бутанона до получения 1,44 г зеленовато желтого твердого продукта. Чистое указанное в заглавии соединение получают при второй перекристаллизации из этилацетата 0,92 г (2,51 ммоль) выход 21%) в виде твердого желтого продукта. Чистое соединение вначале плавится при 178oС, затем повторно отверждается, и снова плавится при температуре выше 275oС (с разложением).
Анализ:
Рассчитано, для С15H11ClN2O3S2 C 49,11; H 3,02;
N 7,64.
Найдено, C 49,22; H 2,98; N 7,57.
EIMS (м/Z): 366/369 (M+, 8%), 193/195 (M+-CONH-C5H6S2 48%) 157 (C6H5OS2 92%) и 130 (C5H6S2 основной)
IH ЯМР (ДМСО-d6) d 8,26 (1H, шир.с, в обмене), 8,11 (1Н, д, J=8,5 Гц), 7,
87 (1Н, д, J= 4,5 Гц), 7,71 (1Н, шир.с) 7,58 (1Н, шир.с, в обмене) 7,26 (1Н, д, J=4,5 Гц), 7,21 (1Н, шир.д. J=8,5 Гц) и 2,43 (3Н, с)
ИК (EBr): 3388, 3198 шир. 1727, 1670, 1611, 1571, 1367,
1265, 1191 и 805 см-1.
Пример 55. 5-Хлор-3-/4-ацетил-2-теноил/-2-оксиндол-1-карбоксамид.
0,78 г (4: 59 ммоль) образца 4-ацетил-2-тиофенкарбоновой кислоты (полученной по способу Satonaka, H. Bull.Chem.Soc.Japan 56:2463, 1983) соединяют с 0,95 г (5,85 ммоль) 1,1'-карбонилдиимидазола в 10 мл диметилформамида и перемешивают при комнатной температуре в атмосфере азота. Спустя 2 ч, содержимое реактора переносят в дополнительную воронку и медленно добавляют к извести 0,88 г (4,18 ммоль) 5-хлор-2-оксиндол-1-карбоксамида и 1,38 г (111,28 ммоль) -4-N, N-диметиламино-пиридина в 30 мл N,N-диметилформамида перемешиваемого при 5oС (ледяная баня в инертной атмосфере. Содержимое реактора перемешивают пятнадцать минут при 5oС после завершения добавления, а затем 24 ч при комнатной температуре. Реакционную смесь выливают в 110 мл 0,3 н. соляной кислоты, что вызывает выпадение в осадок зеленовато-желтого твердого продукта. После фильтрования с последующей промывкой 3 н. соляной кислотой и водой получают неочищенный продукт, который дважды перекристаллизовывают из уксусной кислоты до получения 0,34 г (0,94 ммоль, выход 22%) чистого 5-хлор-3-/4-ацетил-2-теноил/-2-оксиндол-1-карбоксамида в виде зеленовато-желтого сольватированного комплекса с 0,2 эквивалентами уксусной кислоты, т. плавления 230 233oС.
Анализ:
Рассчитано, для С16H11ClN2O4S C 52,55; H 3,17; N 7,47.
Найдено, С 52,24; H 2,88; N 7,61.
EIMS
(м/Z): 362/364 (M+, 9%) 319/321 (M+-CONH, 43%), 193/195 (M+-CONH-C6H6OS, основной) и 153 (С7H5O2S 79%)
IH ЯМР (ДМСО-d6) d 8,64 (1Н, шир.с) 8,47 (1Н, д, J=1,3 Гц) 8,07 (1Н, д, J= 8,5 Гц), 8,00 (1Н, шир.с) 7,07 (1Н, шир.д J=9,5 Гц) 5,94 (1Н, шир.с, в обмене) и 2,52 (3Н, с)
ИК (KBr): 3387, 3230 шир. 1743, 1692, 1623, 1592, 1577, 1384, 1272 и 1192 см-1.
Пример 56. 5-Хлор-3-/4-метилсульфинил-2-теноил/-2-оксиндол-1 - карбоксамид.
Указанное соединение получают по способу примера 55. Ацильное активирование 1,64 г (8,6 ммоль) 4-метилсульфинил-2-тиофенкарбоновой кислоты (полученной по способу примера 1), 1,65 г (10 ммоль) 1, 1'-карбонилдиимидазола приводит к получению реакционно-способного промежуточного соединения, которое используют непосредственно и соединяют с 1,65 г (7,8 ммоль) 5-хлор-2-оксиндол-1-карбоксамида в присутствии 2,87 г (23,5 ммоль) 4-(N,N-диметиламино)пиридина до получения неочищенного желтого продукта. После тщательного растирания желтого твердого продукта с 2-бутаноном получают 1,67 г (4,36 ммоль, выход 56%) чистого 5-хлор-3-(4-метилсульфинил-2-тенолил)-2-оксиндол-1-карбоксамида в виде желтого твердого вещества. Т. плавления 204 206oС.
Анализ:
Рассчитано, для С15H11ClN2O4S2 C 47,06; H 2,90; N 7,32.
Найдено, C 47,11; H 2,91; N 7,27.
EIMS (м/Z): 382/384
(M+, 7%), 339/341 (M+-CHNO, 16%), 193/195 (M+-CHNO-C5H6OS2 основной) и 173 (С6H5O2S2
31%)
IH ЯМР (ДМСО-d6) d 8,36 (1Н, шир.с) 8,27 (1Н, шир.с) 8,11 (1Н, д, J=8,5 Гц), 7,99 (1Н, шир.с) 7,13 (1Н, шир.д, J=8,5 Гц) и 2,88 (3Н, с).
ИК (KBr): 3385, 3220 шир, 1721, 1612, 1573, 1376 и 1193 см-1.
Пример 57. 5-Хлор-3-/5-сульфонамидо-2-теноил/-2-оксиндол-1-карбоксамид.
1,48 г (7,2 ммоль) образца 5-сульфонамидо-2-тиофенкарбоновой кислоты, полученной по способу примера 30 превращают в ацилимидазол в реакции с 1,39 г (8,6 ммоль) 1,1'-карбонилдиимидазол. Промежуточный ацилимидазол соединяют непосредственно с 1,26 г (6,0 ммоль) 5-хлор-2-оксиндол-1-карбоксамида в присутствии 2,2 г (18,0 ммоль) 4-(N,N-диметиламино)-пиридина до получения 2,34 г неочищенного оранжевого твердого продукта. После перекристаллизации получают 1,22 г (3,05 ммоль, выход 51%) чистого 5-хлор-3-/5-сульфонамидо-2-теноил/-2-оксиндол-1-карбоксамида в виде желто-зеленого твердого продукта, т. плавления 227 229oС (уксусная кислота).
Анализ:
Рассчитано, для С14H10ClN3O5S2 C 42,06; H 2,52; N 10,51.
Найдено, C 41,78; H 2,48; N 10,51.
EIMS (м/Z) 399/401 (M+, 2%) 356/358 (M+-CHNO, 23%) 193/195 (M+-CHNO-C4H5NO2S2
основной) и 190 (С5H4NO3S2 53%)
IH ЯМР (ДМСО-d6) d 8,23 (1H, д, J=4 Гц) 8,05 (1Н, шир.д. J=1,5 Гц), 8,02 (1Н, д, J=8,5 Гц) 7,
71 (шир.с, в обмене) 7,49 (1Н, д, J=4 Гц), 6,95 (1Н, дв. д. J=8,5 1,5 Гц) и 5,56 (шир. с, в обмене)
ИК (KBr): 3393, 3250, 3109 шир. 1722, 1600, 1569, 1345, 1203 и 1150 см-1.
Пример 58. 5-Xлор-3-/5-/N-метилсульфонамидо/-2-теноил/-2-оксиндол-1- карбоксамид.
Указанное в заглавии соединение было получено по способу примера 55. Ацильное активирование 2,21 г (10,0 ммоль) 5-/N-метилсульфонамидо/-2-тиофенкарбоновой кислоты, полученной как указано в примере 2, 1,95 г (12,0 ммоль) 1,1'-карбонилдиимидазола приводит к получению соответствующего ацилимидазольного промежуточного в 20 мл N,N-диметилформамида. Этот раствор переносят и медленно добавляют к 1075 г (8,33 ммоль) 5-хлор-2-оксиндол-1-карбоксамида в 40 мл N, N-диметилформамида с 3,05 г (25,0 ммоль) 4-(N,N-диметиламино)пиридина. После кислотной обработки реакция завершается получением 2,6 г желтовато-оранжевого твердого продукта. После перекристаллизации из уксусной кислоты получают 1,80 г (4,59 ммоль, выход 55%) чистого указанного в заглавии соединения в виде желтого твердого продукта, т.пл. 225 227oС.
Анализ:
Рассчитано, для С15H12N3O5S2 C 43,53; H 2,92; N 10,15.
Найдено, С 43,49; Н 2,86; N 10,15.
EIMS (м/Z): 413/415
(M+, 2%), 370 (372 (M+-CHNO, 20%), 205 (C6H7 68%) и 193/195 (M+-CHNO-C5H7 основной)
IH ЯМР (ДМСО-d6) d 8,32 (1Н, д, J= 4 Гц), 8,08 (1Н, д, J=1,5 Гц), 8,05 (1Н, д, J=8,5 Гц) 7,71 (шир.с. в обмене) 7,53 (1Н, д, J=4 Гц), 6,97 (1Н, дв. д. J=8,5 1,5 Гц), 5,77 (1Н, шир.с. в обмене) и 2,54 (3Н,
с)
ИК (KBr) 3433 шир. 3323 шир, 1731, 1607, 1566 и 1151 см-1.
Пример 59. 5-Xлор-3-/5-карбокси-2-теноил/-2-оксиндол-1-карбоксамид.
Указанное в заглавии соединение получают по способу примера 55. 1,0 г (5,81 ммоль) образца коммерческого 2,5-тиофендикарбоновой кислоты подвергают взаимодействию с 1,88 г (11,62 ммоль) 1,1'-карбонилдиимидазола в 15 мл N, N-диметилформамида до получения активированного ацилимидазола. Медленное добавление ацилимидазола к 1,11 г (5,28 ммоль) 5-хлор-2-оксиндол-1-карбоксамида и 1,92 г (15,68 ммоль) 4-/N, N-диметиламино/пиридина в N,N-диметилформамиде приводит к получению желто-зеленого твердого продукта после кислотной обработки. Окончательная очистка достигается из горячей суспензии указанного в заглавии соединения в уксусной кислоте. Это приводит к получению 1,51 г (4,14 ммоль, 78% выход) 5-хлор-3-/5-карбокси-2-теноил/-2-оксиндол-1-карбоксамида в виде желтого твердого продукта, т. плавления 274 287oС.
Анализ:
Рассчитано, для С15H9ClN2O5S C 49,39; H 2,49; N 7,68.
Найдено, С 49,19; H 2,45; N 7, 38.
EIMS (м/Z): 364/366 (M+, 171) 321/232 (M+-CHNO, 73%), 193/195 (M+-CHNO-C5H4O2S 98%) и 186 (неизв. основной)
IН ЯМР (ДМСО-d6) d 8,10 (1Н, д, J=4 Гц), 8,09 (1Н, д, J=8,5 Гц) 8,03 (1Н, шир.д, J=1,5 Гц), 7,74 (1Н, д, J=4 Гц) и 7,08 (1Н, дв.д J=8,5 1,5 Гц).
ИК (KBr):
3388, 3276, 1718, 1695, 1551 и 1273 cм-1
Пример 60. 5-Xлор-3-/4-метоксикарбонил-2-теноил/-2-оксиндол-1 - карбоксамид.
Указанное в заглавии соединение получают по способу примера 55. Раствор 1,50 г (8,06 ммоль) 4-метоксикарбонил-2-тиофенкарбоновой кислоты (полученной по способу примера 9) в 15 мл N,N-диметилформамида добавляют 1,57 г (9,67 ммоль) 1, 1'-карбониллиимидазола. Спустя два часа, содержимое реактора медленно добавляют к 1,54 г (7,32 ммоль) 5-хлор-2-оксиндол-1-карбоксамида и 2,66 г (21,75 ммоль) 4-(N,N-диметиламино)пиридина в N, N-диметилформамиде. После кислотной обработки реакционного раствора с последующим фильтрованием его сушат и тщательно растирают с горячей уксусной кислотой, в результате чего получают 1,88 г (4,97 ммоль, 68% выход) указанного в заглавии соединения в виде желтого твердого продукта, т. плавления 244 246oС.
Анализ:
Рассчитано, для C16H11
ClN2O5S С 50,73; Н 2,93; N 7,40.
Найдено, С 50,52; Н 2,86; N 7,12.
EIMS /м/Z/: 378/380 (M+, 1%), 355/337 (M+-CONH, 7%)
193/195 (M+-CONH-C6H5O2 основной) 169 (С7H5O3S 35%)
IH ЯМР (ДМСО-d6) d 8,59 (1H, д, J=1,4 Гц),
8,48 (1Н, шир.с) 8,06 (1Н, д, J=8,5 Гц) 8,05 (1Н, шир.с), 7,02 (шир.д. J=8,5 Гц), 4,64 (1Н, шир.с в обмене) и 3,82, с.
ИК (KBr): 3383, 3217 шир. 1746, 1590, 1375, 1279 и 745 см-1.
Пример 61. 5-Xлор-3-/5-метоксикарбонил-2-теноил/-2-оксиндол-1 - карбоксамид.
По способу примера 55 и N,N-диметиилформамидный раствор 1,25 г (6,71 ммоль) 5-метоксикарбонил-2-тиофенкарбоновой кислоты (полученной по способу примера 11) добавляют к 1,19 г (7,35 ммоль) 1,1'-карбонилдиимидоазола до получения активированного ацильного промежуточного соединения. Реакционный раствор этого промежуточного соединения медленно добавляют к 1,29 г (6,10 ммоль) 5-хлор-2-оксиндол-1-карбоксамида и 2,02 г (16,54 ммоль) 4-/N,N-диметиламино/пиридина также в N, N-диметилформамиде. После кислотной обработки с последующим фильтрованием, сушкой и перекристаллизацией получают 1,29 г (3,41 ммоль, выход 56% ) указанного в заглавии соединения в виде желтого твердого продукта т. плавления 219 221oC (уксусная кислота).
Анализ:
Рассчитано, для С16H11ClN2O5S C 50,73; H 2,93; N 7,
40.
Найдено, С 50,76; Н 2,84; N 7,38.
EIMS (с/Z): 378/380 (M+, 2%), 335/337 (M+-CONH, 11%), 193/195 (M+-CONH-C6H5O2S основной) и 169 (С7H5O3S 46%)
IH ЯМР (ДМСО-d6) d 8,16 (1Н, д, J=3,9 Гц), 8,05 (1Н, д, J=8,5 Гц), 8,03 (1Н, шир.с),
7,78 (1Н, д, J=3,9 Гц), 7,02 (1Н, дв.д J=8,5 2,3 Гц), 5,55 (1Н, шир.с, в обмене) и 3,84 (3Н, с).
ИК (KBr): 3388, 3216 шир, 1730, 1589, 1290 и 745 cм-1.
Пример 62. 5-Xлор-3-/4-N, N-диметилкарбамидо-2-теноил/-2-оксиндол-1 - карбоксамид.
Указанное в заглавии соединение получают по способу примера 55. 1,70 г (8,56 ммоль) образца 4-[(N, N-диметиламино)карбонил] -2-тиофенкарбоновой кислоты (полученной по способу примера 5) подвергают взаимодействию с 1,77 г (10,90 ммоль) 1,1'-карбонилдиимидазола до получения ацилимидазольного промежуточного соединения, которое медленно добавляют к диметилформамидному раствору 1,64 г (7,80 ммоль) 5-хлор-2-оксиндол-1-карбоксамида и 2,57 г (21,02 ммоль) 4-/N, N-диметиламино/пиридина. После кислотной обработки, с последующим фильтрованием получают оранжевое твердое вещество, которое дважды перекристаллизовывают из уксусной кислоты до получения 0,86 г (2,19 ммоль, выход 28%) чистого указанного в заглавии соединения в виде желтого сольватированного комплекса с 0,2 эквивалентами уксусной кислоты, т.пл. 240 - 232oС.
Анализ:
Рассчитано, для С17H14ClN3O4S x 0,2 C2H4O2 C 51,75; H 3,69; N 10,41.
Найдено, C 51,58; H 3,46; N 10,42.
EIMS
(м/Z) 391/393/M+, 26% 348/350 (M+-CONH, 20%), 193/195 (M+-CONH-C7H8NOS основной) и 182 (C8H8NO2S 46%)
1H ЯМР (ДМСО-d6) d 8,16 (1Н, шир.с), 8,08 (1Н, д, 8,5 Гц) 8,04 (1Н: шир. с), 7,95 (1Н; шир.с), 7,10 (1Н, шир.д, J=8,5 Гц) 6,38 (1Н, шир.с. в объеме), 3,07 (3Н, шир.с) и 2,98 (3Н,
шир.с)
ИК (KBr): 3390, 3233, 1744, 1622, 1375 и 1195 см-1.
Пример 63. 5-Xлор-3-/4-/2-метил-4-тиазолил/-2-теноил/-2-оксиндол-1 - карбоксамид.
Указанное в заглавии соединение получают по способу примера 55. 1,25 г (5,55 ммоль) образца 4-/2-метил-4-тиазолил/-2-тиофенкарбоновой кислоты (полученной по способу примера 18) превращают в ацилимидазол при взаимодействии с 0,98 г (6,05 ммоль) 1,1'-карбонилдиимидазола в 15 мл N,N-диметилформамида. После завершения реакции этот раствор переносят в дополнительную воронку и медленно добавляют 1,06 г (5,04 ммоль) 5-хлор-2-оксиндол-1-карбоксамида и 1,66 г (13,59 ммоль) 4-(N,N-диметиламино)пиридина в 50 мл N, N-диметилформамида. Кислотная обработка с последующей фильтрацией и тщательным растиранием с 2-бутаноном дает 0,50 г (1,20 ммоль), указанного в заглавии соединения в виде желтого твердого продукта, т.пл. 238 241oС.
Анализ:
Рассчитано, для С18H12ClN3O3S2 C 51,73; H 2,90; N 10,06.
Найдено, C 51,63; H 2,95; N 9,75.
EIMS (м/Z): 417''419
(M+, 1%), 374/376 (M+-CONH, 8%), 208 (C9H9NOS 34%), 193/195 (M+-CONH-C8H7 208%) и 181 (С8H7NS2 основной)
1Н ЯМР (ДМСО-d[) d 8,44 (1Н, шир.с) 8,13 (1Н, шир.с), 8,09 (1Н, д, J=8,4 Гц), 7,94 (1Н, шир.с) 7,79 (1Н, с), 7,10 (1Н, д, J=8,4 Гц) 4,88 (1Н, шир.с. в обмене) и 2,
71 (3Н, с).
ИК (KBr): 3385, 2919, 1747, 1587, 1374, 1196 и 729 см[.
Пример 64. 5-Xлор-3-/5-бром-2-фураноил/-2-оксиндол-1-карбоксамид.
По способу примера 32 1,91 г (10,0 ммоль) коммерческой 5-бром-2-фуранкарбоновой кислоты растворяют в 10 мл тионил хлорида и нагревают при кипячении с обратным холодильником в атмосфере азота в течение 1 ч, и полученный хлорангидрид выделяют. 40 мл N,N-диметилформамидного раствора, 1,75 г (8,3 ммоль) 5-хлор-2-оксиндол-1-карбоксамида и 3,05 г (25 ммоль) 4-/N,N-диметиламино/пиридина подвергают взаимодействию с 2,09 г (10, ммоль) 5-бром-2-фуранкарбонилхлорида в 10 мл N,N-диметилформамида. После протекания реакции в течение 45 мин полученную смесь подкисляют, выливая с 250 мл 1н. НСl. Полученный продукт перекристаллизовывают из уксусной кислоты, промывают уксусной кислотой, гексаном и сушат в течение ночи в вакууме при комнатной температуре. Полученный продукт сушат затем на кипящим с обратным холодильником изопропанолом в условиях высокого вакуума до получения 1,37 г указанного в заглавии соединения.
Анализ:
Рассчитано, для С[H[BrClN[O[ C 43,84; H 2,10; N 7,30.
Найдено, C 43,94; H 2,02; N 7,16.
EIMS /м/Z/: 382/384 (M[, 10% ) 339/341 (M[-CONH, 35%) и 193/195/M[-CONH-C[H[BrO, основной)
[Н ЯМР (ДМСО-d[) d 8,50 (в обмене)
8,08 (1Н, д, J=8,5 Гц) 8,00 (1Н, шир. с) 7,81 (1Н, д, J=3,5 Гц), 7,63 (1Н, в обмене), 7,16 (1Н, шир.д.) J=8,5 Гц), 6,90 (1Н, д, J=3,5 Гц) и 5,04 (в обмене).
ИК (KBr): 3382, 3220, 17350 17230 1620, 1587, 1533, 1464, 1379 и 1022 см[.
Пример 65. 5-Xлор-3-/6-хлорникотиноил/-2-оксиндол-1-карбоксамид.
Указанное в заглавии соединение получают по способу примера 55. Ацилактивирование 823 мг (5,22 ммоль) коммерческого образца 6-хлорникотиновой кислоты 924 мг (5,70 ммоль) 1,1'-карбонилдиимидазола приводит к получению соответствующего реакционноспособного ацилимидазольного промежуточного соединения, которое используют непосредственно и соединяют с 1,00 г (4,75 ммоль) 5-хлор-2-оксиндол-1-карбоксамида в присутствии 1,57 г (12,85 ммоль) 4-(N, N-диметиламино)пиридина до получения неочищенного зеленовато-коричневого твердого продукта. После перекристаллизации этого твердого продукта получают 400 мг (1,14 ммоль, выход 24%) зеленовато-желтого твердого продукта, т. плавления 236 238[С (уксусная кислота).
Анализ:
Рассчитано, для С[H[ClNO[ C 51,45; H 2,59; N 12,00.
Найдено, C 51,54; H 2,54; N 11,69.
EIMS(м/Z): 349/351/353 (M[, 8% ), 306/308/310 (M[-CONH, 64%), 193/195 (M[-CONH, C[H[Cl, основной) и 140/142 (C[H[ClNO, 61%)
[Н ЯМР (ДМСО-d[) d 9,56 (1Н, д,
J=2,3 Гц) 8,37 (шир.с в обмене) 8,07 (1Н, д, J=8,5 Гц) 8,01 (1Н, дв.д J=8,2 2,3 Гц), 7,94 (1Н, д, J=2,3 Гц), 7,60 (1Н, д, J=8,1 Гц) 7,41 (шир.с в обмене) 7,11 (1Н, дв.д J=8,5 2,3 Гц) и 4,93 (шир.с в
обмене)
ИК (KBr): 3390, 3210 и шир. 1730, 1580, 1380, 1290, 1110 и 820 см[.
Пример 66. 5-Фтор-3-/4-хлор-2-теноил/-2-оксиндол-1-карбоксамид.
Указанное в заглавии соединение получают по способу примера 55. 329 мг (2,02 ммоль) 4-хлор-2-тиофенкарбоновой кислоты (полученной по способу Jriarte J. et al. K. Het. Chem. 393, 1976) соединяют с 358 мг (2,21 ммоль) 1,1'-карбонилдииидазола в 5 мл N,N-диметиформамида и промежуточный имидазол соединяют непосредственно с 357 мг (1,84 ммоль) 5-хлор-2-оксиндол-1-карбоксамида в присутствии 60 мл (4,96 ммоль) 4-(N,N-диметиламино)пиридина. Полученный неочищенный желтый продукт перекристаллизовывают и получают 189 мл (0,558 ммоль, выход 30%) твердого вещества желтого цвета. Т. плавления 224 226[С (уксусная кислота).
Анализ:
Рассчитано, для С[H[ClFN[O[S C 49,64; H 2,38; N 8,27.
Найдено, C 49,41; H 2,28; N 8,12.
EIMS/м/Z/: 338/340 (M[, 4%) 295/297 (M[-CONH, 19%), 177 (M[-CONH-C[H[ClS основной) и 145/147 (C[H[ClOS 39%).
[H ЯМР (ДМСО-d[) d 8,80 (шир.с. в обмене, 8,42 (1Н, д, J=1,8 Гц) 8,04 (1Н, дв. д J= 9,0 5,8 Гц), 7,80
(,1Н, дв.д J=10,5 2,1 Гц) 7,74 (1Н, шир.с) 7,30 (шир.с) в обмене (6,74 1Н, ддд, J=10,1 9,0 2,1 Гц) и 5,0 (шир.с в обмене)
ИК (KBr): 3392, 3242 (шир.) 3112, 1743, 1588, 1381, 1182 и 838
см[.
Пример 67. 5-Tрифторметил-3-/4-хлор-2-теноил/-2-оксиндол-1-карбоксамид.
Для получения указанного в заглавии соединения используют способ примера 55. 388 мг (2,38 ммоль) образца 4-хлор-2-тиофенкарбоновой кислоты (полученной по способу Jriarte, J.et al. J.Het.Chem. 13, 393, 1976) превращают в ацилимидазол при взаимодействии с 420 мг (2,59 ммоль) 1, 1'-карбoнилдимидазола. Промежуточный 4-хлор-2-тиофен-/1-имидазо/карбоксамид соединяют непосредственно с 486 мг (1,99 ммоль) 5-трифторметил-2-оксиндол-1-карбоксамида в присутствии 657 мг (5,37 ммоль) 4-/N,N-диметиламино/пиридина до получения 634 мг (1,63 ммоль, 82%) указанного в заглавии соединения в виде желтого твердого продукта т. плавления 164 166[С.
Анализ:
Рассчитано, для С[H[ClF[N[O[S C 46,34; H 2,07; N 7,21.
Найдено, C 46,29; H 2,07; N 7,79.
EIMS /м/Z/: 388/390 (M[, 7% ) 345/345 (M[-CONH, 25%), 227 (M[-CONH-CH[H[Cl основной) и 145/147/C[H[ClOS, 26%).
[H ЯМР (ДМСО-d[) d 9,10 (шир.с, в обмене 8,63 (1Н, д, J=1,1 Гц), 8,46 (1Н, с), 8,20 (1Н, д), J=8,20 (1H, д, J=8,4 Гц), 7,69 (1Н, д, J=1,1 Гц) 7,30
(шир.с. в обмене) 7,20 (1Н, дв.д J=8,4 1,4 Гц и 5,28 (шир.с в обмене)
ИК (KBr): 3397, 3233 (шир.), 1747, 1583, 1324, 1270, 1188 и 1122 см=[.
Пример 68. 6-Xлор-3-/4-хлор-2-теноил/-2-оксиндол-1-/N-этил/карбоксамид.
Указанное в заглавии соединение получают по способу примера 55. Ацилактивирование 381 (мг (2,34 ммоль) 4-хлор-2-тиофенкарбоновой кислоты (полученной по способу Iriarte J. et al. I.Het.Chem. 13, 393, 1976) c 412 мг (2,54 ммоль) 1,1'-карбонилдиимидазола приводит к получению соответствующего реакционно-способного ацилимидазола, который используют непосредственно, и соединяют с 466 мг (1,95 ммоль) 6-хлор-2-оксиндол-1-/N,N-этил/карбоксамида в присутствии 644 мг (5,27 ммоль) 4-(N, N-диметиламино)пиридина до получения 445 мг (59% ) неочищенного желтого твердого продукта. После перекристаллизации получают чистое указанное в заглавии соединение (200 мг, 0,522 ммоль, выход 27% ) в виде желтого кристаллического твердого вещества. Т.пл. 164 166[C (уксусная кислота).
Анализ:
Рассчитано, для С[H[Cl[N[O[S C 50,14; H 3,16; N 7,31.
Найдено, C 49,95; H 3,01; N 7,21.
EIMS (м/Z): 382/384/386 (M[, 5%), 311/313/315 (M[-C[H[NO 21%) 193/195 (M[-C[H[NO, C[H[ClS основной) и 145/147 (C[H[ClOS 40%)
[H ЯМР (ДМСО-d[) d 9,43
(шир. с в обмене), 8,34 (1Н, д, J=1,8 Гц), 8,12 (1Н, д, J=1,9 Гц) 8,04 (1Н, д, J=8,2 Гц), 7,74 (1Н, шир.с), 7,04 (1Н, дв.д J= 8,2,1, 9 Гц) 4,92 (шир.с, в обмене) 3,29 (2Н, шир.кв, J=7,3 Гц) и 1,13 (3Н,
т, J=7,3 Гц)
ИК (KBr): 3336, 3084, 1720, 1530, 1375, 1196 и 809 см[.
Пример 69. 5-Фтор-3-/4-хлор-2-теноил/-2-оксиндол-1-/N-трет-бутил/-карбоксамид.
Для получения указанного в заглавии соединения используют способ примера 55. 390 мг (2,40 ммоль) образца 4-хлор-2-тиофенкарбоновой кислоты (полученной по способу Iriarte J. et al. J.Het.Chem. 13, 393, 1976) подвергают взаимодействию с 481 мг (2,60 ммоль) 1,1'-карбонилдиимидазола до получения ацилимидазольного промежуточного соединения, которое медленно добавляют к раствору в N,N-диметилформамида 500 мг (2,00 ммоль) 5-фтор-2-оксиндол-1-N-трет-бутил/карбоксамида и 659 мг (5,39 ммоль) 4-(N,N-диметиламино) пиридина. Кислотная обработка с последующей перекристаллизацией дает указанное в заглавии соединение (260 мг, 0,66 ммоль, выход 33%) в виде желтого твердого продукта, т.пл. 202 5[С /уксусная кислота/.
Анализ:
Рассчитано, для С[H[CFN[O[S C 54,75; H 4,08; N 7,
10.
Найдено, C 54,21; H 3,76; N 6,94.
EIMS (м/Z): 394/396 (M[, 1%) 295/297 (M[-C[H[NO, 28%) 177 (M[-C[-H[NO-C[H[ClS основной) и 145/147 (C[H[ClOS 24%)
[H ЯМР
(ДМСО-d[) d 9,55 (шир.с, в обмене) 8,37 (1Н, д, 1,11 Гц) 8,05 (1Н, дв.д J=9,0 5,2 Гц) 7,81 (1H, дв.д J=10,5 2,0 Гц) 7,73 (1Н, шир.с) 6,73 (1Н, ддд J=10,5 9,0 2,0 Гц) 7,73 (1Н, шир.с) 6,73 (1Н, ддд,
J=10,5 9,0 2,0 Гц) 4,13 (шир. с в обмене) и 1,38 (9Н, с)
ИК (KBr): 3305, 3075, 29880 1721, 1615, 1548, 1193 и 835 cм[.
Пример 70. 6-Xлор-3-/4-хлор-2-теноил/-2-оксиндол-1-карбоксамид.
Для получения указанного в заглавии соединения использовали способ примера 55. 463 мг (2,85 ммоль) 4-хлор-2-тиофенкарбоновой кислоты (полученной по способу Iriarte, J.et al. J.Het.Chem. 130, 393, 1976) превращают в ацилимидазол при взаимодействии с 500 мг (3,09 ммоль) 1,1'-карбонилдиимидазола. Промежуточный 4-хлор-2-тиофен-1-имидазокарбоксамид соединяют непосредственно с 500 мг (2,37 ммоль) 6-хлор-2-оксиндол-1-карбоксамида в присутствии 783 мг (6,41 ммоль) 4-(N,N-диметиламино)пиридина до получения 665 мг неочищенного зеленовато-желтого твердого вещества. После перекристаллизации получают 450 мг (1,27 ммоль, выход 53%) чистого указанного в заглавии соединения в виде желтого твердого продукта. Т.пл. 231 3[С (уксусная кислота).
Анализ:
Рассчитано, для С[H[Cl[N[O[S С 47,34; H 2,27; N 7,89.
Найдено, C 47,11; H 2,11; N 7,73.
EIMS (м/Z): 354/356/358 (M[, 5% ) 311/313/315 (M[-CONH, 15%) 193/195 (M[-CONH-C[H[ClS, основной) и 145/147 (C[H[ClOS 49%).
[H ЯМР (ДМСО-d[) d 8,80 (шир.с, в обмене) 8,31 (1Н, д, J=1,1 Гц), 8,10 (1Н, д, J= 2,2 Гц) 8,03 (1Н, д, J=8,2 Гц) 7,74 (1Н, шир.с) 7,36 (шир.с, в обмене) 7,04 (1Н, дв.д J=8,2 2,2 Гц) и 5,32 (шир.с. в обмене).
ИК (KBr): 3398, 3191 (шир), 1749, 1726, 1587, 1368, 1196 и 807 см[.
Пример 71. 3-/4-Xлор-2-теноил/-2-оксиндол-1-карбоксамид.
Указанное в заглавии соединение получают по способу примера 55. 831 мг (5,11 ммоль) 4-хлор-2-тиофенкарбоновой кислоты (полученной по способу Iriarte, J. et al. J.Het.Chem. 13, 393, 1976) соединяют с 897 мг (5,53 ммоль) 1,1'-карбонилдиимидазола в 5 мл N,N-диметилформамида, и промежуточный имидазолил соединяют непосредственно с 750 мг (4,26 ммоль) 2-оксиндол-1-карбоксамида в присутствии 1,40 г (11,49 ммоль) 4-/N,N-диметиламино/пиридина. Полученный неочищенный желтый твердый продукт (803 мг, 59% выход) перекристаллизовывают из уксусной кислоты до получения 376 мг (1,17 ммоль, выход 27%) пушистых желтых кристаллов, т. плавления 221 - 223[С.
Анализ:
Рассчитано, для С[H[ClN[O[S C 52,42; H 2,83; N 8,74.
Найдено, С 52,04; Н 2,62; N 8,51.
EIMS (м/Z): 320/322 (M[, 3%) 277/279 (M[-CONH, 6%) 159 (M[-CONH-C[H[Cl, основной) и 145/147 (C[H[ClOS 50%).
[H ЯМР (ДМСО-d[) d: 8,10 (1Н, шир.с), 8,09 (1Н, д, J=8,5 Гц), 7,95 (шир. с) 7,83 (шир.с) 7,75 (шир.с) 7,30 (шир) 7,08 (шир) и 4,92 (шир.с в обмене).
ИК (KBr): 3392, 3243 (шир) 3117, 1744, 1591, 1379, 1268 и 1183 см[.
Пример 72. 5-Фтор-6-хлор-3-/4-хлор-2-теноил/-2-оксиндол-1-карбоксамид.
Указанное в заглавии соединение получают, используя способ примера 55. 427 мг (2,62 ммоль) образца 4-хлор-2-тиофенкарбоновой кислоты (полученной по способу Iriarte J. et al. J.Het.Chem. 13, 393, 1976) подвергают взаимодействию с 461 мг (2,84 ммоль) 1,1'-карбонилдиимидазола в 5 мл N,N-диметилформамида до получения активированного ацилимидазола. Медленное добавление ацилимидазола к 500 мг (2,19 ммоль) 5-фтор-6-хлор-2-оксиндол-1-карбоксамида и 721 мг (5,90 ммоль) 4-/N, N-диметиламино/пиридина в N,N-диметилформамиде приводит к получению неочищенного желтого продукта (635 мг, 78) после кислотной обработки. После перекристаллизации из уксусной кислоты получают желто-коричневый кристаллический твердый продукт (390 мг, 1,05 ммоль, выход 48% ), т.пл. 235 237[С.
Анализ:
Рассчитано, для С[H[ClFN[O[S C 45,05; H 1,89; N 7,51.
Найдено, C 44,81; H 1,87; N 7,44.
EIMS (м/Z): 372/374/376 (M[, 7%), 329/331/333 (M[-CONH, 23%) 211/213 (M[-CONH-C[H[Cl, основной) и 145/147 (C[H[ClOS, 33%).
[Н ЯМР (ДМСО-d[) d: 9,00 (шир.с в обмене) 8,62 (1Н, д, J=1,2 Гц), 8,14 (1Н, д, J= 7,2 Гц), 8,02 (1Н, д, J=11,2 Гц), 7,69 (1Н, д, J=1,2 Гц), 7,25 шир.с), в обмене) им 4,32 (шир.с. в обмене).
ИК (KBr): 3386, 3231, 1715, 1610, 1580, 1464, 1366 и 1183 см[.
Пример 73. 6-Хлор-3-/5-бром-3-фуроил/-2-оксиндол-1-карбоксамид.
Указанное в заглавии соединение получают по способу примера 55. 750 мг (3,93 ммоль) 5-бром-3-фуранкарбоновой кислоты (полученной по способу Amaral L. et al. J. O. C. 41, 2350, 1976) превращают в ацилимидазол при взаимодействии с 690 мг (4,25 ммоль) 1,1'-карбонилдимидазола. Промежуточный 5-бром-3-фуран-/1-имидазо/карбоксамид непосредственно соединяют с 689 мг (3,27 ммоль) 6-хлор-2-оксиндол-1-карбоксамида в присутствии 1,08 г (8,83 ммоль) 4-(N, N-диметиламино)пиридина до получения 500 мг (выход 40%) неочищенного зеленовато-желтого твердого продукта. После перекристаллизации получают 143 мг (0,37 ммоль, 11% выход) чистого указанного в заглавии соединения в виде зеленоватого твердого продукта, т. плавления 232 234[С (уксусная кислота).
Анализ:
Рассчитано, для С[H[BrClN[O[ C 43,83; H 2,10; N 7,30.
Найдено, C 43,54; H 2,00; N 7,19.
EIMS (м/Z):
382/384/386 (M[, 11%) 339/341/343 (M[-CONH, 30%), 260/262 (M[-CONH-Br, 90% ), 232/234 (неизв. 90%) 193/194 ([-CONH-C[H[BrO, 92%) и 173/175 (C[H[BrO[ основной)
[Н ЯМР (ДМСО-d[) d 8,43 (шир.с,
в обмене) 8,40 (1Н, шир.с), 8,14 (1Н, д, J= 1,8 Гц) 7,92 (1Н, д, J=8,2 Гц) 7:54 (шир.с. в обмене), 7,15 (1Н, дв.д J= 8,2 1,9 Гц) 6,96 (1Н, д, J=1,8 Гц) и 4,04 шир.с. в обмене).
ИК (KBr): 3470, 3389, 3305 (шир, 1757, 1718, 1579, 1387, 1198, 1122 и 015 cм[.
Пример 74. 5-Фтор-3-/5-бром-3-фуроил/-2-оксиндол-1-/N-трет-бутил/-карбоксамид.
Для получения указанного в заглавии соединения используют способ примера 55. 641 мг (3,36 ммоль) образца 5-бром-3-фуранкарбоновой кислоты (полученной по способу Amarae, L. et al. J.O.C. 41, 2350 (1976)) подвергают взаимодействию с 590 мг (3,64 ммоль) 1,1'-карбонилдиимидазола до получения ацилимидазольного промежуточного, которое медленно добавляют к N,N-диметилформамидного раствора 700 мг (2,80 ммоль) 5-фтор-2-оксиндол-1- (N-трет-бутил)-карбоксамида и 923 мг (7,56 ммоль) -4-/N,N-диметиламино/-пиридина.
Кислотная обработка дает неочищенное указанное в заглавии соединение (777 мг, 66% выход) в виде желто-коричневого твердого продукта. После перекристаллизации получают 256 мг (0,60 ммоль, 22% выход) грязно-белого твердого кристаллического продукта, т. плавления 190 2[С (ацетонитрил).
Анализ:
Рассчитано, для С[H[BrN[O[ C 51,08; H 3,81; N 6,62.
Найдено, С 50,98; H 3,57; N 6,62.
EIMS (м/Z): 423/235 (M[, 1%)
323/325 (M[-C[H[O, 35%), 244 (M[-C[H[O-Br, основной) 216 (неизв. 95%) и 57 (С[H[, 99%)
[H ЯМР (ДМСО-d[) d: 9,07 (шир.с, в обмене), 8,44 (1Н, д, J=1,4 Гц), 8,10 (1Н, дв.д. J=9,0 4,1 Гц), 7,67
(1Н, дв.д. J=9,5 2,8 Гц), 6,96 (1Н, д, J=1,4) 6,91 (1Н, ддд J=9,5, 9,0 2,8 Гц), 3,93 (шир.с, в обмене и 1,36 (9Н, с)
ИК (KBr): 3300, 3205, 2960, 1720, 1550, 1179 и 820 см[.
Пример 75. 5-Xлор-3-/5-бром-3-теноил/-2-оксиндол-1-карбоксамид.
Указанное в заглавии соединение получают по способу примера 55. 100 г (4,83 ммоль) 5-бром-3-тиофенкарбоновой кислоты (полученной по способу, описанному в J. Am. Chem. Soc. 76, 2445, 1954) соединяют с 848 мг (5,23 ммоль) 1,1'-карбонилдиимидазола в 5 мл N,N-диметилформамида и промежуточный имидазолил соединяют непосредственно с 848 мг (4,02 ммоль) 5-хлор-2-оксиндол-1-карбоксамида в присутствии 1,33 г (10,89 ммоль) -4-(N,N-диметиламино)пиридина. Полученный неочищенный зеленый продукт (1,22 г, 76% выход) перекристаллизовывают до получения 540 мг (1,35 ммоль, 34%) желтого твердого продукта, т.плавления 239 240[С (уксусная кислота).
Анализ:
Рассчитано, для С[H[BrN[O[S С 42,07;
H 2,02; N 7,01.
Найдено, С 42,26; H 1,98; N 6,99.
EIMS (м/Z): 398/400/402 (M[, 39% ), 355/357/359 (M[-CONH, основной) 276/278 (M[-CONH-Br, 30%) и 193/195
(M[-CONH-C[H[HгS 75%)
[Н ЯМР (ДМСО-d[) d: 8,36 (шир.с, в обмене) 8,09 (1Н, д, J=8,7 Гц, 8,08 (1Н, д, J=1,6 Гц), 7,85 (1Н, д, J=2,0 Гц), 7,52 (шир.с, в обмене) 7,49 (1Н, д, J=1,6 Гц), 7,16 (1Н,
дд, J=8,5 2,0 Гц) и 3,73 (шир.с. в обмене)
ИК (KBr): 3389, 3218 (шир), 1744, 1585, 1391, 1272 и 1194 см[.
Пример 76. 5-Xлор-3-/5-хлор-2-тиофенацетил/-2-оксиндол-1-карбоксамид.
Указанное в заглавии соединение получают, используя способ примера 55. 1,00 г (5,66 ммоль) 5-хлор-2-тиофенуксусной кислоты, полученный по способу Ford et al. J.Am.Chem.Soc. 72, 2109, 1950) подвергают взаимодействию с 995 мг (6,13 ммоль) 1,1'-карбонилдиимидазола в 5 мл N,N-диметилформамида до получения активированного ацилимидазола. Медленное добавление ацилимидазола к 994 мг (4,72 ммоль) 5-хлор-2-оксиндол-1-карбоксамида и 1,44 г (11,79 ммоль) 4-(N,N-диметиламино)пиридина в N,N-диметилформамиде приводит к получению неочищенного коричневато-серого твердого продукта (1,52 г, 87% выход). После перекристаллизации их уксусной кислоты получают указанное в заглавии соединение в виде серого кристаллического твердого продукта (387 мг, 1,05 ммоль, выход 22%) Т. плавления 238 41[С.
Анализ:
Рассчитано, для С[H[Cl[N[O[S C 48,74; H 2,68; N 7,51.
Найдено, C 48,79; H 2,73; N 7, 59.
EIMS (м/Z): 368/370/372 (M[, 4% ) 324/326/328 (M[-CONH, 4%) 237/239 (M[-C[H[ClS, 49% ) и 194/195 (М[-CONH-C[H[ClS основной) 8,07 (1Н, д, J=8,5 Гц) 7,80 (1Н, д, J=2,6 Гц), 7,12 (1Н,
дв.д, J=8,5 2,6 Гц) 6,94 (1Н, д, J=4,1 Гц), 6,90 (1Н, д, J=4,1 Гц), 4,43 (2Н, с) и 3,71 (шир.с. в обмене)
ИК (KBr): 3392, 3249 (шир), 1724, 1695, 1664, 1582, 1381, 1287, 1202, 995 и 847
см[.
Пример 77. 5-Xлор-3-/5-метилтио-1,3,4-оксадиазол-2-ил/-2-оксиндол-1- карбоксамид.
По способу примера 32,30 мл N,N-диметилформамидный раствор 958 мг (4,55 ммоль) 5-хлор-2-оксиндол-1-карбоксамида и 1,50 г (12,28 ммоль) 4-(N,N-диметиламино)пиридина подвергают взаимодействию с 975 мг (5,46 ммоль) 5-метилтио-1,3,4-оксадиазол-2-карбонилхлорида (патент США 4001238). После кислотной обработки получают неочищенное оранжевое твердое соединение (1,25 г, 78% выход). Суспендируют в горячей ледяной уксусной кислоте, фильтруют и получают чистое указанное в заглавии соединение (710 мг, 2,01 ммоль, 44%) в виде ярко-желтого твердого продукта. Т. плавления 297 79[С.
Анализ:
Рассчитано, для С[H[ClN[O[S C 44,26; H 2,57; N 15,88.
Найдено, C 44,37; H 2,52; N 15,66.
EIMS (м/Z): 352/354 (M[, 4% ) 309/311 (M[-CONH, 12%) и 193/195 (M[-CONH-C[H[N[OS основной)
[Н ЯМР (ДМСО-d[) d с 8,54 (шир.с, в
обмене), 8,00 (1Н, д, J=8,6 Гц) 7,86 (1Н, д, J=2,5 Гц) 7,18 (шир,с. в обмене), 6,95 (1Н, дв.д. J=8,6 2,5 Гц) 4,04 (шир.с. в обмене) и 2,72 (3Н, с).
ИК (KBr): 3496, 3348, 3107, 1728, 1551, 1442, 1306, 1216 и 849 см[.
Пример 78. Метил-3-этокси-5-изоксазолкарбоксилат.
Перемешиваемую суспензию 3,53 г (24,67 ммоль) коммерческого образца метил-3-гидрокси-5-изоксазолкарбоксилата в 50 мл метиленхлорида обрабатывают по каплям раствором триэтилоксонийтетрафторбората (5,62 г, 29,60 ммоль) растворенного в 30 мл метиленхлорида при комнатной температуре. После перемешивания в течение ночи раствор промывают водой (2 х 30 мл), 5% бикарбонатом натрия (230 мл) и еще раз водой. Органический слой сушат над сульфатом магния и выпаривают в вакууме до получения указанного в заглавии соединения (3,61 г, выход 86%) в виде светло-желтого твердого продукта, т.пл. 77 79[C.
[Н ЯМР (ДМСО-d[) d c 6,65 (1Н, с), 3,93 (2Н, кв, J=7,
4 Гц), 3,87 (3Н, с) и 1,21 (3Н, т, J=7,4 Гц)
EIMS (м/Z): 171 (M[ 48% ), 156 (M[-CH[, 4%), 143 (C[H[NO[ 31%), 112 (C[H[NO[ 12%) и 69 (С[H[NO) основной.
ИК (KBr): 3105, 1744, 1611, 1441, 1241, 1106, 974 и 797 см[.
Пример 79. 3-Этокси-5-изоксазолкарбоновая кислота.
Перемешиваемый раствор метил-3-этокси-5-изоксазолкарбоксилата, полученный по способу примера 78 (3,00 г, 17,53 ммоль) в 75 мл 2н. гидроксида натрия перемешивают при комнатной температуре в течение 10 мин, охлаждают в бане со льдом и подкисляют до pH 3 концентрированной соляной кислотой. Осевший твердый продукт собирают фильтрованием. Оставшийся целевой продукт выделяют, насыщая водный фильтрат хлористым натрием и экстрагируя этилацетатом (3х100 мл). Таким образом получают 2, 46 г (выход 89%) указанного в заглавии соединения. Образец перекристаллизовывают из ацетонитирила, т.пл. 210 213 [С.
Анализ:
Рассчитано, для С[H[NO[ C 45,80; H 4,32; N 8,
87.
EIMS (м/Z): 157 (M[-CH[, 22%), 129 (C[H[NO[, 70%), 112 (C[H[NO[, 15%) и 69 (С[H[NO, основной) 1Н ЯМР (ДМСО-d[) d\ 6,51 (1Н, с), 3,91 (2Н, кв. J=7,4 Гц) и 1,20 (3Н, т, J=7,4 Гц)
ИК (KBr): 3136 (шир.), 1726, 1626, 1238 и 984 см[.
Пример 80. 5-Xлор-3-/3-этоксиизоксазол-5-ил/-2-оксиндол-1-карбоксамид.
Указанное в заглавии соединение получают по способу примера 55. 1,50 г (9,55 ммоль) 3-этокси-5-изоксазолкарбоновой кислоты, полученной по способу примера 79, подвергают взаимодействию с 1,68 г (10,34 ммоль) 1,1'-карбонилдиимидазола до получения ацилимидазольного промежуточного соединения, которое медленно добавляют к N,N-диметилформамидному раствору 1,68 г (7,96 ммоль) 5-хлор-2-оксиндол-1-карбоксамида и 2,62 г (21,48 ммоль) 4-(N, N-диметиламино)пиридина. После кислотной обработки получают неочищенное указанное в заглавии соединение в виде оранжево-желтого твердого продукта (2,43 г, выход 87%). Его суспендируют в горячей ледяной уксусной кислоте, а затем фильтруют, получая чистое указанное в заглавии соединение в виде ярко-желтого твердого продукта (1,75 г, 5,00 ммоль, выход 63%). Т. плавления 260 262[C.
Анализ:
Рассчитано, для С[H[ClN\O\ C 51,51; H 3,46; N 12,01.
Найдено, C 51,57; H 3,22; N 11,89.
EIMS (м/Z): 349/351 (М\ 10%), 306/308 (M\-CONH,
45%), 235/237 (M\-C\H\ NO\ 20%) и 193/195 (M\-CONH, C\H\NO\ 44%)
Н ЯМР (ДМСО-d\) d 8,76 (шир.с, в обмене) 8,01 (1Н, д, J=8,6 Гц), 7,97 (1Н, д, J= 2,2 Гц), 7,30 (шир.с, в обмене), 6,96 (1Н,
дв.д J=8,6 2,2 Гц), 6,30 (1Н, с), 4,98 (шир.с) в обмене) 3,86 (2Н, кв. J=7,4 Гц) и 1,21 (3Н, т, J=7,4 Гц)
ИК (KBr) 3315, 3228 (шир.), 1748, 1673, 1549, 1370, 843 и 819 cм\
Пример 81.
Метил-5-/3-метил-1,2,4-оксадиазол-5-ил/-2-тиофенкарбоксилат.
Перемешиваемую суспензию 5-метоксикарбонил-2-тиофенкарбоновой кислоты (1,50 г, 8,06 ммоль) в 15 мл тионилхлорида кипятят с обратным холодильником в течение двух часов. Раствор охлаждают до комнатной температуры и концентрируют в вакууме до получения почти бесцветного масла, которое перекристаллизовывают в вакууме. Этот твердый продукт растворяют в 5 мл хлороформа и добавляют по каплям при комнатной температуре к перемешиваемой смеси ацетамидоксима (получение по способу Eloy, et al. Heln.Chim.Acta 45, 441, 1961) (657 мг, 8,86 ммоль) и триэтиламина (897 мг, 1,24 мл, 8,86 ммоль) в 30 мл хлороформа. После завершения добавления раствор перемешивают при комнатной температуре в течение одного часа и промывают водой (2х20 мл). Органический слой сушат (сульфат магния), выпаривают и остаток тщательно растирают с толуолом до получения промежуточного О-/2-метоксикарбонил-5-теноил) ацетамиоксима, 1,55 г (80% выход), в виде белого твердого продукта, т.пл. 150 152С.
Н ЯМР (ДМСО-d\) d 8,03 (1H, д, J=7,9 Гц), 7,83 (1Н, д, J=3,9 Гц), 7,83 (1Н, д, J= 3,9 Гц), 6,54 (шир.с. в обмене), 3,85 (3Н, с), и 1,80 (3Н, с). Этот материал используют без дополнительной очистки.
Часть 1,43 г (5,90 ммоль) О-/2-метоксикарбонил-5-теноил/-ацетамидоксима суспендируют в 75 мл толуола и нагревают до кипячения с обратным холодильником в течение ночи. Растворитель удаляют в вакууме, и остаток тщательно растирают с небольшим количеством толуола до получения 1,10 г (83%) указанного в заглавии соединения в виде грязно-белого кристаллического твердого продукта, т.пл. 154 156\С. Этот материал используют непосредственно без дополнительной очистки.
Точная масса: 224,0241.
Рассчитано: 224,0256
EIMS (м/Z): 224 (M\ 98%) и 193 (M\-CH\O, основной) Н ЯМР (ДМСО-d\) d 8,01 (1Н, д, J=4,3 Гц) 7,92 (1Н, д, J=4,3 Гц) 3,88 (3Н, с) и 2,41 (3Н, с).
Пример 82. 5-/3-Метил-1,2,4-оксадиазол-5-ил/-2-тиофенкарбоновая кислота.
Смесь метил 5-/3-метил-1,2,4-оксадиазол-5-ил)-2-тиофенкарбокстилата, полученного по способу примера 81 (1,09 г, 4,86 ммоль) в 35 мл 2 н. гидроксида натрия разбавляют 5 мл этанола и нагревают до 65\С в течение тридцати минут. Этот раствор охлаждают в ледяной бане и подкисляют до pH 2 концентрированной соляной кислотой. После фильтрации и сушки получают 870 мг (выход 85% ) указанного в заглавии соединения в виде грязно-белого твердого продукта. Аналитический образец перекристаллизовывают из метанола, т.пл. 226 228С.
Анализ:
Рассчитано, для С\H\N\O\S C 45,70; H 2,88; N 13,33.
Найдено, C 45,57; H 2,75; N 13,37.
EIMS (м/Z): 210 (M\ основной) и 153 (M\-C\H\O, 99%) H ЯМР (ДМСО-d\) d 7,97 (1H, д, J=3,9 Гц), 7,82 (1Н, д, J=3,9 Гц) и 2,49 (3Н, с).
ИК (KBr): 3112 (шир) 1699, 1289, 1112 и 840 см\
Реферат
Настоящее изобретение относится к новым производным 3-замещенных 2-оксиндолов (I), которые являются ингибиторами простагландин H2 синтазы, 5-липоксигеназы и биосинтеза интерлейкина-1.
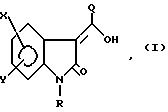
где X, Y = H, Cl, F, Br, C1 - C6 алкил, СF3; R = CONR1R2;
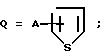
R1, R2 = H, C1 - C6 алкил;
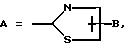
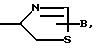
F, Cl, Br, I, OR3,S(O)nR4, COOR5, CONR3R5, COR4, CN, NO2, CH2OR5, OCOR4, SO2NR3R5, NR3 R5, N(R3)COR5; R3=H, C1 - C6 алкил; R4=C1 - C6 алкил; R5=H,C1 - C6 алкил; n =0, 1, 2; B = H, F, Cl, Br, CF3, C1 - C6 алкил. 2 с. и 5 з.п. ф-лы, 4 табл.
Формула
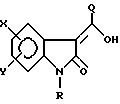
где Х и Y Н, F, Cl, Br, C1-C6-алкил, CF3;
R -CONR1R2, где R1, R2 H, C1-C6-алкил,
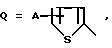
где
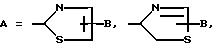
F, Cl, Br, I, OR3, S(O)nR4, COOR5, CONR3R5, COR4, CN, NO2, CH2OR5, OCOR4, SO2NR3R5, NR3R5, N(R3)COR5,
где R3 H, C1-C6-алкил;
R4=C1-C6-алкил;
R5 H, C1-C6-алкил;
n 0, 1, 2;
В Н, F, Cl, Br, CF3, C1-C6-алкил, или Q -
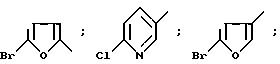
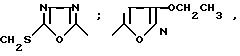
или их фармацевтически приемлемые соли.
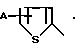
3. Соединение по п.2, где А С1.
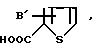
или его соль, где B1 находится в 4 положении и представляет SOR16 или COOCH3, или B1 находится в 5 положении и представляет SO2NHCH3, или B1 находится в 4 или 5 положении и представляет CON(CH3)2
где В H, F, Cl, Br, CF3 или С1-C6-алкил;
R16 C1-C4-алкил.

Комментарии