Способ получения 2,3-дизамещенных 1-гидрокси-1h-индол-5,6-дикарбонитрилов - RU2641006C1
Код документа: RU2641006C1
Описание
Изобретение относится к способу получения новых азот- и кислородсодержащих гетероциклических соединений, а именно 2,3-дизамещенных 1-гидрокси-1H-индол-5,6-дикарбонитрилов, которые могут быть использованы в качестве прекурсоров для синтеза биологически активных веществ, лекарственных препаратов, фталоцианинов, гексазоцикланов.
Данные соединения являются новыми, и из уровня техники нам не известны способы получения таких соединений.
Задачей изобретения является разработка способа получения 2,3-дизамещенных 1-гидрокси-1H-индол-5,6-дикарбонитрилов общей структурной формулы
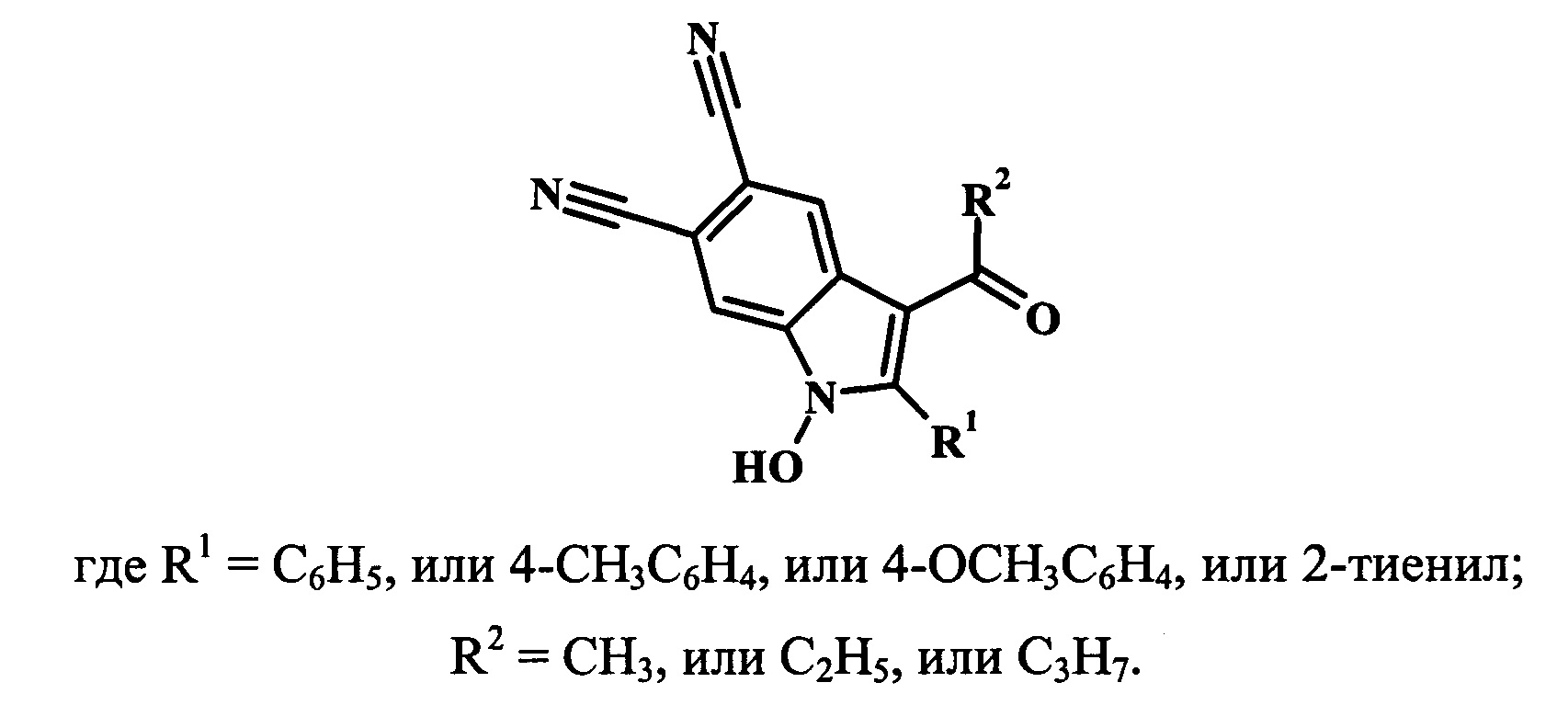
Поставленная задача достигается тем, что способ синтеза 2,3-дизамещенных 1-гидрокси-1H-индол-5,6-дикарбонитрилов включает две стадии. На первой стадии 2-замещенные 1-гидрокси-1H-индол-5,6-дикарбонитрилы взаимодействуют с ангидридами алифатических карбоновых кислот (уксусный, пропионовый, масляный ангидриды) в присутствии борфтортриэфирата BF3Et2O с образованием соответствующих производных индол-5,6-дикарбонитилов. На второй стадии эти производные индол-5,6-дикарбонитилов взаимодействуют с карбонатом калия в среде изо-пропилового спирта с последующим подкислением разбавленной соляной кислотой с получением целевых 2,3-дизамещенных 1-гидрокси-1H-индол-5,6-дикарбонитрилов.
Вышеуказанные соединения получают следующей реакцией:


при условиях, описанных ниже.
На первой стадии 2-замещенные 1-гидрокси-1H-индол-5,6-дикарбонитрилы нагреваются в среде соответствующего ангидрида (уксусный, пропионовый, масляный ангидриды) при температуре 55…70°C в течение 5-20 мин. Затем полученную реакционную массу охлаждают, растворяют в десятикратном избытке холодной воды. Выпавший осадок соответствующих производных индол-5,6-дикарбонитилов отфильтровывают, промывают водой и перекристаллизовывают из ацетонитрила. Сушат на воздухе.
На второй стадии к раствору соответствующих производных индол-5,6-дикарбонитилов в изо-пропиловом спирте прибавляют карбонат калия, мольное соотношение 1:2-3, соответственно, и перемешивают при температуре 60…75°C в течение 0.5-1.5 ч, затем реакционную массу охлаждают, разбавляют десятикратным избытком 5-15%-ого раствора соляной кислоты. Выпавший осадок 2,3-дизамещенных 1-гидрокси-1H-индол-5,6-дикарбонитрилов отфильтровывают и перекристаллизовывают из спирта. Сушат на воздухе.
Все приведенные отличительные признаки являются существенными, и только заявляемая совокупность признаков позволяет достичь технического результата.
Строение полученных соединений подтверждено методами ИК, ЯМР Н1, ЯМР С13 спектроскопией и масс-спектрометрией.
Изобретение иллюстрируется следующими примерами.
Пример 1. 3-ацетил-1-гидрокси-2-фенил-1H-индол-5,6-дикарбонитрил
К 2 мл уксусного ангидрида прибавляют 0.002 моль 1-гидрокси-2-фенил-1H-индол-5,6-дикарбонитрил и 0.004 моль (0.5 мл) борфтортриэфирата BF3Et2O и нагревают при температуре 55°C при постоянном перемешивании в течение 5 мин. Затем реакционную массу охлаждают, растворяют в 20 мл холодной воды. Выпавший осадок отфильтровывают, промывают водой и перекристаллизовывают из ацетонитрила. Сушат на воздухе. Далее к раствору 0.002 моль 3-ацетил-1-(ацетилокси)-2-фенил-1H-индол-5,6-дикарбонитрила в 10 мл изо-пропилового спирта прибавляют 0.004 моль карбоната калия и перемешивают при температуре 60°C в течение 0.5 ч. Полученную реакционную массу охлаждают, разбавляют десятикратным избытком 5-15%-ного раствора соляной кислоты, образовавшийся осадок 3-ацетил-1-гидрокси-2-фенил-1H-индол-5,6-дикарбонитрила отфильтровывают и перекристаллизовывают из спирта. Получают 0.48 г (80% от теории) 3-ацетил-1-гидрокси-2-фенил-1H-индол-5,6-дикарбонитрила - кристаллический осадок белого цвета, Т. пл. 252-254°C. ИК (ν/cm-1): 3453 (ОН), 2234 (CN), 1642 (C=O), 1607 (Ar). Масс-спектр (ЭУ, 70 эВ), m/z (%): 301 [М]+ (27), 286 (66), 270 (100), 259 (18), 215 (15). ЯМР1H (DMSO-d6, J/Hz): 22.00 (s, 3H, Ac), 7.52-7.71 (m, 5H, Ph), 8.42 (s, 1H, H (7)), 8.83 (s, 1H, H (4)), 12.41 (br. s., 1H, ОН). ЯМР13C (DMSO-d6): 29.77, 106.82, 107.19, 111.21, 116.42, 116.75 117.09, 123.65, 127.85, 128.30, 128.45 (2C), 130.36, 130.69 (2C), 133.13, 147.12, 192.93 (C=O). Найдено (%): C, 71.59; H, 3.65; N, 13.92. C18H11N3O2. Вычислено (%): C, 71.75; H, 3.68; N, 13.95.
Пример 2. 3-ацетил-1-гидрокси-2-(4-метилфенил)-1H-индол-5,6-дикарбонитрил
К 2 мл уксусного ангидрида прибавляют 0.002 моль 1-гидрокси-2-(4-метилфенил)-1H-индол-5,6-дикарбонитрил и 0.004 моль (0.5 мл) борфтор-триэфирата BF3Et2O и нагревают при температуре 60°C при постоянном перемешивании в течение 10 мин. Затем реакционную массу охлаждают, растворяют в 20 мл холодной воды. Выпавший осадок отфильтровывают, промывают водой и перекристаллизовывают из ацетонитрила. Сушат на воздухе. Далее к раствору 0.002 моль 3-ацетил-1-(ацетилокси)-2-(4-метилфенил)-1H-индол-5,6-дикарбонитрила в 10 мл изо-пропилового спирта прибавляют 0.004 моль карбоната калия и перемешивают при температуре 65°C в течение 0.5 ч. Полученную реакционную массу охлаждают, разбавляют десятикратным избытком 5-15%-ного раствора соляной кислоты, образовавшийся осадок 3-ацетил-1-гидрокси-2-(4-метилфенил)-1Н-индол-5,6-дикарбонитрила отфильтровывают и перекристаллизовывают из спирта. Получают 0.52 г (83% от теории) 3-ацетил-1-гидрокси-2-(4-метилфенил)-1H-индол-5,6-дикарбонитрила - кристаллический осадок белого цвета, Т. пл. 256-258°C. ИК (ν/cm-1): 3493 (ОН), 2234 (CN), 1645 (C=O), 1610 (Ar). Масс-спектр (ЭУ, 70 эВ), m/z (%): 315 [М]+ (100), 300 (98), 284 (39), 283 (24), 254 (28). ЯМР1Н (DMSO-d6, J/Hz): 2.00 (s, 3H, Ас), 2.43 (s, 3H, Me), 7.42 (d, J=8.1, 2Н, Н (3'), Н (5')), 7.59 (d, J=8.8, 2Н, Н (2'), Н (6')), 8.40 (s, 1Н, Н (7)), 8.81 (s, 1Н, Н (4)), 12.36 (br. s., 1Н, ОН). ЯМР13С (DMSO-d6): 21.10, 29.88, 106.70, 106.99, 111.10, 116.56, 116.87, 117.22, 123.75, 124.89, 128.24, 129.04 (2С), 130.71 (2С), 133.26, 140.20, 147.52, 193.11. Найдено (%): С, 72.23; Н, 4.13; N, 13.30. C19H13N3O2. Вычислено (%): С, 72.37; Н, 4.16; N, 13.33.
Пример 3. 3-ацетил-1-гидрокси-2-(4-метоксифенил)-1H-индол-5,6-дикарбонитрил
К 2 мл уксусного ангидрида прибавляют 0.002 моль 1-гидрокси-2-(4-метоксифенил)-1H-индол-5,6-дикарбонитрил и 0.004 моль (0.5 мл) борфтортриэфирата BF3Et2O и нагревают при температуре 60°C при постоянном перемешивании в течение 15 мин. Затем реакционную массу охлаждают, растворяют в 20 мл холодной воды. Выпавший осадок отфильтровывают, промывают водой и перекристаллизовывают из ацетонитрила. Сушат на воздухе. Далее к раствору 0.002 моль 3-ацетил-1-(ацетилокси)-2-(4-метоксифенил)-1H-индол-5,6-дикарбонитрила в 10 мл изо-пропилового спирта прибавляют 0.004 моль карбоната калия и перемешивают при температуре 65°C в течение 1 ч. Полученную реакционную массу охлаждают, разбавляют десятикратным избытком 5-15%-ного раствора соляной кислоты, образовавшийся осадок 3-ацетил-1-гидрокси-2-(4-метоксифенил)-1Н-индол-5,6-дикарбонитрила отфильтровывают и перекристаллизовывают из спирта. Получают 0.54 г (82% от теории) 3-ацетил-1-гидрокси-2-(4-метоксифенил)-1H-индол-5,6-дикарбонитрила - кристаллический осадок белого цвета, Т. пл. 262-264°C. ИК (ν/cm-1): 3492 (ОН), 2228 (CN), 1627 (С=O), 1608 (Ar), 1252, 1027 (О-Ме). Масс-спектр (ЭУ, 70 эВ), m/z (%): 331 [М]+ (98), 316 (84), 315 (61), 314 (68), 300 (100), 289 (38), 270 (38), 228 (29), 201 (14), 43 (6). ЯМР1Н (DMSO-d6, J/Hz): 2.03 (s, 3H, Ac), 3.86 (s, 3H, OMe), 7.16 (d, J=8.8, 2H, Н (3'), Н (5')), 7.53 (d, J=8.8, 2Н, Н (2'), H (6')), 8.40 (s, 1Н, Н (7)), 8.81 (s, 1Н, Н (4)), 12.34 (br. s., 1Н, ОН).. ЯМР13С (DMSO-d6): 29.74, 55.36, 106.71, 107.01, 111.07, 113.99 (2С), 116.24, 116.81, 117.14, 119.50, 123.76, 128.11, 132.35 (2С), 133.17, 147.28, 160.82, 193.09. Найдено (%): С, 68.75; Н, 3.92; N, 12.65. C19H13N3O3. Вычислено (%): С, 68.88; Н, 3.95; N, 12.68.
Пример 4. 3-ацетил-1-гидрокси-2-(тиофен-2-ил)-1H-индол-5,6-дикарбонитрил
К 2 мл уксусного ангидрида прибавляют 0.002 моль 1-гидрокси-2-(2-тиенил)-1H-индол-5,6-дикарбонитрил и 0.004 моль (0.5 мл) борфтортриэфирата BF3Et2O и нагревают при температуре 65°C при постоянном перемешивании в течение 15 мин. Затем реакционную массу охлаждают, растворяют в 20 мл холодной воды. Выпавший осадок отфильтровывают, промывают водой и перекристаллизовывают из ацетонитрила. Сушат на воздухе. Далее к раствору 0.002 моль 3-ацетил-1-(ацетилокси)-2-(тиофен-2-ил)-1H-индол-5,6-дикарбонитрила в 10 мл изо-пропилового спирта прибавляют 0.004 моль карбоната калия и перемешивают при температуре 65°C в течение 1 ч. Полученную реакционную массу охлаждают, разбавляют десятикратным избытком 5-15%-ного раствора соляной кислоты, образовавшийся осадок 3-ацетил-1-гидрокси-2-(тиофен-2-ил)-1H-индол-5,6-дикарбонитрила отфильтровывают и перекристаллизовывают из спирта. Получают 0.48 г (78% от теории) 3-ацетил-1-гидрокси-2-(тиофен-2-ил)-1H-индол-5,6-дикарбонитрила - кристаллический осадок светло-желтого цвета, Т. пл. 302-304°C. ИК (ν/cm-1): 3102 (ОН), 2232 (CN), 1658 (С=O), 1577 (Ar). Масс-спектр (ЭУ, 70 эВ), m/z (%): 307 [М]+ (22), 291 (38), 276 (100), 43 (11). ЯМР1Н (DMSO-d6, J/Hz): 2.20 (s, 3H, Ac), 7.33 (d.d, J=4.9, 3.7, 1H, H (4')), 7.66 (dd, J=3.7, 1.0, 1H, H (3')), 8.04 (dd, J=4.9, 1.0, 1H, H (5')), 8.40 (s, 1H, H (7)), 8.77 (s, 1H, H (4)), 12.63 (br. s., 1H, ОН). ЯМР13C (DMSO-d6): 29.58, 106.87, 107.45, 112.23, 116.47, 116.76, 117.10, 123.38, 126.14, 127.67, 128.28, 131.81, 133.24, 133.70, 139.76, 193.17. Найдено (%): С, 62.41; H, 2.93; N, 13.65. C16H9N3O2S. Вычислено (%): С, 62.53; H, 2.95; N, 13.67.
Пример 5. 1-гидрокси-3-пропил-2-(n-толил)-1H-индол-5,6-дикарбонитрил
К 2 мл пропионового ангидрида прибавляют 0.002 моль 1-гидрокси-2-(4-метилфенил)-1H-индол-5,6-дикарбонитрил и 0.004 моль (0.5 мл) борфтортриэфирата BF3Et2O и нагревают при температуре 65°C при постоянном перемешивании в течение 15 мин. Затем реакционную массу охлаждают, растворяют в 20 мл холодной воды. Выпавший осадок отфильтровывают, промывают водой и перекристаллизовывают из ацетонитрила. Сушат на воздухе. Далее к раствору 0.002 моль 5,6-дициано-3-пропил-2-(n-толил)-1H-индол-1-ил пропионата в 10 мл изо-пропилового спирта прибавляют 0.004 моль карбоната калия и перемешивают при температуре 70°C в течение 1 ч. Полученную реакционную массу охлаждают, разбавляют десятикратным избытком 5-15%-ного раствора соляной кислоты, образовавшийся осадок 1-гидрокси-3-пропил-2-(n-толил)-1H-индол-5,6-дикарбонитрила отфильтровывают и перекристаллизовывают из спирта. Получают 0.5 г (76% от теории) 1-гидрокси-3-пропил-2-(n-толил)-1H-индол-5,6-дикарбо-нитрила - кристаллический осадок белого цвета, Т. пл. 181-183°C. ИК (ν/cm-1): 3103 (ОН), 2231 (CN), 1654 (С=O), 1609, 1552 (Ar). Масс-спектр (ЭУ, 70 эВ), m/z (%): 329 [M]+ (31), 313 (31), 300 (77), 284 (100), 254 (30), 57 (12). ЯМР1Н (DMSO-d6, J/Hz): 0.88 (t, J=7.3, 3H, Me), 2.33 (q, J=7.3, 2H, CH2), 2.43 (s, 3H, Me), 7.41 (d, J=8.1, 2H, Н (3'), H (5')), 7.52 (d, J=8.1, 2Н, Н (2'), H (6')), 8.40 (s, 1Н, (7)) 8.82 (s, 1Н, (4)), 12.33 (br. s., 1Н, ОН). ЯМР13С (DMSO-d6): 8.13, 21.01, 34.19, 106.63, 106.97, 110.74, 116.31, 116.80, 117.13, 123.74, 125.07, 128.27, 129.06 (2С), 130.45 (2С), 133.14, 140.13, 146.79, 196.25. Найдено (%): С, 72.69; Н, 4.55; N, 12.73. C20H15N3O2. Вычислено (%): С, 72.94; Н, 4.59; N, 12.76.
Пример 6. 1-гидрокси-3-пропил-2-(тиофен-2-ил)-1H-индол-5,6-дикарбонитрил
К 2 мл припионового ангидрида прибавляют 0.002 моль 1-гидрокси-2-(2-тиенил)-1H-индол-5,6-дикарбонитрил и 0.004 моль (0.5 мл) борфтортриэфирата BF3Et2O и нагревают при температуре 65°C при постоянном перемешивании в течение 15 мин. Затем реакционную массу охлаждают, растворяют в 20 мл холодной воды. Выпавший осадок отфильтровывают, промывают водой и перекристаллизовывают из ацетонитрила. Сушат на воздухе. Далее к раствору 0.002 моль 5,6-дициано-3-пропил-2-(тиофен-2-ил)-1H-индол-1-ил пропионата в 10 мл изо-пропилового спирта прибавляют 0.004 моль карбоната калия и перемешивают при температуре 75°C в течение 1 ч. Полученную реакционную массу охлаждают, разбавляют десятикратным избытком 5-15%-ного раствора соляной кислоты, образовавшийся осадок 1-гидрокси-3-пропил-2-(тиофен-2-ил)-1H-индол-5,6-дикарбонитрила отфильтровывают и перекристаллизовывают из спирта. Получают 0.47 г (74% от теории) 1-гидрокси-3-пропил-2-(тиофен-2-ил)-1H-индол-5,6-дикарбонитрила - кристаллический осадок светло-желтого цвета, Т. пл. 150-152°C. ИК (ν/cm-1): 3129 (ОН), 2239 (CN), 1657 (С=O), 1604 (Ar). Масс-спектр (ЭУ, 70 эВ), m/z (%): 321 [М]+ (19), 305 (30), 292 (37), 276 (100), 57 (22). ЯМР1Н (DMSO-d6, J/Hz): 0.97 (t, J=7.0, 3H, Me), 2.57 (q, J=7.0, 2H, CH2), 7.34 (d.d, J=4.9, 3.7, 1Н, H (4')), 7.65 (d, J=3.7, 1H, H (3')), 8.04 (d, J=4.9, 1H, H (5')), 8.38 (s, 1H, H (7)), 8.76 (s, 1H, H (4)), 12.62 (br. s., 1H, ОН). ЯМР13C (DMSO-d6): 8.30, 34.17, 106.70, 107.31, 111.92, 116.44, 116.77, 117.10, 123.31, 126.47, 127.69, 128.30, 131.62, 133.21, 133.26, 139.13, 196.47. Найдено (%): C, 63.41; H, 3.42; N, 13.05. C17H11N3O2S. Вычислено (%): C, 63.54; H, 3.45; N, 13.08.
Пример 7. 3-бутирил-1-гидрокси-2-(n-толил)-1H-индол-5,6-дикарбонитрил
К 2 мл масляного ангидрида прибавляют 0.002 моль 1-гидрокси-2-(4-метилфенил)-1H-индол-5,6-дикарбонитрил и 0.004 моль (0.5 мл) борфтортриэфирата BF3Et2O и нагревают при температуре 70°C при постоянном перемешивании в течение 20 мин. Затем реакционную массу охлаждают, растворяют в 20 мл холодной воды. Выпавший осадок отфильтровывают, промывают водой и перекристаллизовывают из ацетонитрила. Сушат на воздухе. Далее к раствору 0.002 моль 3-бутирил-5,6-дициано-2-(n-толил)-1H-индол-1-ил бутирата в 10 мл изо-пропилового спирта прибавляют 0.004 моль карбоната калия и перемешивают при температуре 75°C в течение 1.5 ч. Полученную реакционную массу охлаждают, разбавляют десятикратным избытком 5-15%-ного раствора соляной кислоты, образовавшийся осадок 3-бутирил-1-гидрокси-2-(n-толил)-1H-индол-5,6-дикарбо-нитрила отфильтровывают и перекристаллизовывают из спирта. Получают 0.51 г (75% от теории) 3-бутирил-1-гидрокси-2-(n-толил)-1H-индол-5,6-дикарбонитрила - кристаллический осадок белого цвета, Т. пл. 147-149°C. ИК (ν/cm-1): 3154 (ОН), 2230 (CN), 1644 (С=O), 1606 (Ar). Масс-спектр (ЭУ, 70 эВ), m/z (%): 343 [М]+ (31), 327 (22), 300 (100), 284 (90), 254 (29). ЯМР1Н (DMSO-d6, J/Hz): 0.65 (t, J=7.2, 3H, Me), 1.44 (q, J=7.2, 2H, CH2), 2.29 (t, J=7.2, 3H, Me), 2.44 (s, 3H, Me), 7.42 (d, J=8.07, 2H, Н (3'), H (5')), 7.52 (d, J=8.07, 2H, H (2'), Н (6')), 8.40 (s, 1Н, Н (7)), 8.82 (s, 1Н, H (4)), 12.36 (s, 1H, ОН). Найдено (%): С, 73.33; H, 4.96; N, 12.21. C21H17N3O2. Вычислено (%): С, 73.45; H, 4.99; N, 12.24.
Пример 8. 3-бутирил-1-гидрокси-2-(тиофен-2-ил)-1H-индол-5,6-дикарбонитрил
К 2 мл масляного ангидрида прибавляют 0.002 моль 1-гидрокси-2-(2-тиенил)-1H-индол-5,6-дикарбонитрил и 0.004 моль (0.5 мл) борфтортриэфирата BF3Et2O и нагревают при температуре 70°C при постоянном перемешивании в течение 20 мин. Затем реакционную массу охлаждают, растворяют в 20 мл холодной воды. Выпавший осадок отфильтровывают, промывают водой и перекристаллизовывают из ацетонитрила. Сушат на воздухе. Далее к раствору 0.002 моль 3-бутирил-5,6-дициано-2-(тиофен-2-ил)-1H-индол-1-ил бутирата в 10 мл изопропилового спирта прибавляют 0.004 моль карбоната калия и перемешивают при температуре 75°C в течение 1.5 ч. Полученную реакционную массу охлаждают, разбавляют десятикратным избытком 5-15%-ного раствора соляной кислоты, образовавшийся осадок 3-бутирил-1-гидрокси-2-(тиофен-2-ил)-1H-индол-5,6-дикарбонитрила отфильтровывают и перекристаллизовывают из спирта. Получают 0.48 г (71% от теории) 3-бутирил-1-гидрокси-2-(тиофен-2-ил)-1H-индол-5,6-дикарбонитрила-кристаллический осадок светло-желтого цвета, Т. пл. 153-155°C. ИК (ν/cm-1): 3104 (ОН), 2235 (CN), 1662 (С=O), 1611, 1556 (Ar), 1050 (С-О). Масс-спектр (ЭУ, 70 эВ), m/z (%): 335 [М]+ (34), 319 (12), 318 (13), 292 (100), 276 (41), 275 (85), 259 (15), 246 (15), 247 (16), 71 (32), 43 (14). ЯМР1Н (DMSO-d6, J/Hz): 0.75 (t, J=7.4, 3H, Me) 1.52 (sex, J=7.4, 2H, CH2) 2.52 (t, J=7.4, 2H, CH2), 7.35 (dd, J=4.8, 3.7, 1Н, H (4')), 7.65 (dd, J=3.7, 1.2, 1H, H (3')), 8.06 (dd, J=4.8, 1.2, 1H, H (5')), 8.42 (s, 1H, H (7)), 8.78 (s, 1H, H (4)), 12.63 (br. s., 1H, ОН). ЯМР13C (DMSO-d6): 13.55 (Me), 17.57 (CH2), 42.73 (CH2), 106.75, 107.37, 112.17, 116.45 116.77 117.08, 123.34, 126.37, 127.67, 128.20, 129.56, 131.64, 133.17, 139.08, 196.10 (C=O). Найдено (%): С, 64.31; H, 3.88; N, 12.50. C18H13N3O2S. Вычислено (%): С, 64.46; H, 3.91; N, 12.53.
Техническим результатом изобретения является получение новых химических соединений достаточной степени чистоты, которые могут быть использованы в качестве прекурсоров для синтеза биологически активных веществ, лекарственных препаратов, фталоцианинов, гексазоцикланов.
Реферат
Изобретение относится к способу получения новых 2,3-дизамещенных 1-гидрокси-1H-индол-5,6-дикарбонитрилов, в которых R=CH, или 4-CHCH, или 4-OCHCH, или 2-тиенил, R=CH, или CH, или CH, которые могут быть использованы в качестве прекурсоров для синтеза биологически активных веществ, лекарственных препаратов, фталоцианинов, гексазоцикланов. Способ получения 2,3-дизамещенных 1-гидрокси-1H-индол-5,6-дикарбонитрилов включает две стадии. На первой стадии 2-замещенные 1-гидрокси-1H-индол-5,6-дикарбонитрилы взаимодействуют с ангидридами алифатических карбоновых кислот (уксусным, пропионовым, масляным ангидридом) в присутствии борфтортриэфирата (BFEtO). На второй стадии полученные соответствующие 3-ацилзамещенные 2-арил(гетерил)-1H-индол-5,6-дикарбонитрилы взаимодействуют с карбонатом калия в среде изопропилового спирта с последующим подкислением и получением целевых 2,3-дизамещенных 1-гидрокси-1H-индол-5,6-дикарбонитрилов. 8 пр.
Формула


Комментарии