Иммуномодулирующие олигосахариды - RU2388478C2
Код документа: RU2388478C2
Описание
Область изобретения
Настоящее изобретение относится к способу лечения и/или профилактики иммунных заболеваний, включающему в себя введение олигосахаридов.
Описание предшествующего уровня техники
Иммунная система располагает различными возможными путями взаимодействия с антигеном. Решающей стадией для типа иммунного ответа является стимуляция различных популяций Т-клеток. Так называемые Th1-клетки преимущественно продуцируют цитокины, которые стимулируют клеточный иммунный ответ (IFN-γ, IL-12, IL-2). Напротив, Th2-клетки преимущественно продуцируют IL-4, IL-5 и IL-10. Эти цитокины запускают опосредованную IgE аллергическую реакцию и воспаление и также считаются участвующими в рекрутинге, пролиферации, дифференцировке, поддержании и выживании эозинофилов (т.е. лейкоцитов, которые принимают эозиновый краситель), что может привести к эозинофилии. Эозинофилия представляет собой признак многих заболеваний, опосредованных Th2, таких как астма, аллергия и атопический дерматит. Цитокины, связанные с Th1 и Th2, действуют антагонистически, и реакции Th1/Th2 в нормальных физиологических условиях находятся в хорошо регулируемом равновесии - не преобладает ни реакция Th1, ни Th2. При дисбалансе преобладание иммунных реакций типа Th1 или Th2 играет роль при нескольких патологических состояниях или ответственно за них.
Избыточный иммунный Th1-ответ в конечном счете может привести к аутоиммунитету, разрушению материала собственного организма индивидуума, например инсулинозависимому сахарному диабету, рассеянному склерозу, болезни Крона, обыкновенной пузырчатке, аутоиммунной тромбоцитопенической пурпуре, аутоиммунной гемолитической анемии.
Избыточный Th2-ответ ведет к крайней чувствительности к инородным компонентам, которые не должны вызывать какую-либо иммунную реакцию, например, к аллергиям и связанным с ней заболеваниям, таким как атопический дерматит, астма, профессиональная астма, пищевая аллергия (например, аллергия к коровьему молоку, арахису и аллергии к другим орехам, аллергию к люпину), аллергический ринит (например, пыльцевая аллергия), аллергия к клещам пыли и другие формы гиперчувствительности, подобные системной анафилаксии и острой сыпи.
Относительный сдвиг в сторону повышенного Th2-ответа и/или сниженного Th1-ответа обнаруживается в ситуациях стресса любого вида, который в последующем приводит к смещению в сторону Th2-ответа. Такой относительный сдвиг, например, наблюдается при старении иммунной системы, у пациентов при раке, хронических инфекциях, при избыточной физической нагрузке, социальных конфликтах или высоких рабочих нагрузках, воздействии токсичных компонентов или облучения и при метаболическом стрессе, ведущем к алиментарной дистрофии, кахексии или алиментарной дистрофии, вызванной анорексией (Janeway (2001) Immunobiology 5thedition, Garland publishing ISBN 0-8153-3642-x; Roitt et al. (2001) Immunology 6thedition, Harcourt publishing limited, ISBN-0-7234-31892).
Бифидогенные эффекты считают ответственными, например, за уменьшение и/или профилактику бактериальной инфекции. Известно, что олигосахариды могут проявлять бифидогенный эффекты.
Было описано, что кислые олигосахариды оказывают благоприятные эффекты. В WO 02/42484 описаны гидролизаты эстерифицированного пектина для лечения инфекции и/или профилактики адгезии вредных веществ к эукариотическим клеткам. В DE 4223613 описан способ получения ненасыщенных уронидов из подобных пектинам веществ посредством анаэробной ферментации с использованием, например, пектат-лиазы. Получение можно использовать для медицинского лечения интоксикации тяжелыми металлами.
Были также описаны комбинации кислых и нейтральных олигосахаридов. В ЕР 1105002 описана пребиотическая композиция, включающая в себя трансгалактоолигосахариды, инулин и олигосахариды галактуроновой кислоты. В патенте США № 6576251 описана комбинация сиалированного олигосахарида (дисиалолакто-Т-тетраозы) и галактоолигосахаридов для профилактики симптомов, связанных с адгезией организмов, таких как вирус гриппа. В WO 01/60378 описаны смеси ненасыщенного гидролизата пектина и нейтральных олигосахаридов для профилактики адгезии патогенов к эпителиальным поверхностям.
Известны детские питательные смеси, содержащие липид, белок, сахариды, витамин и по меньшей мере одно соединение, выбранное из ди- или более высокого порядка сахарида, содержащего галактозу, ее производное, сахарид, содержащий N-ацетилнейраминовую кислоту и ее производное (ЕР 1332759).
Краткое описание сущности изобретения
До настоящего времени предполагалось, что введение (кислых) олигосахаридов обеспечивает благоприятный эффект стимуляцией бифидогенной флоры и предотвращением адгезии патогенов к эпителиальным тканям.
Авторы изобретения неожиданно обнаружили, что на системные маркеры функции иммунной системы влияет введение (кислых) олигосахаридов. Эта находка открывает новую область применения олигосахаридов, в частности, по поводу заболеваний, которые в лучшем случае можно лечить модуляцией иммунной системы. Под «модуляцией», или «модулированием», подразумевается увеличение или уменьшение определенного характера, качества, активности, вещества или реакции. Другими словами, неожиданно было обнаружено, что кислые олигосахариды и нейтральные олигосахариды способны стимулировать системный иммунный ответ.
Авторы также неожиданно обнаружили, что различные олигосахариды оказывают различные стимулирующие эффекты на иммунную систему. Было обнаружено, что введение кислых олигосахаридов (относительно) стимулирует Th1-ответ и снижает высвобождение Th2-цитокина (например, IL-10, IL-4 и IL-5). Было также обнаружено, что введение комбинации кислого олигосахарида и нейтрального олигосахарида синергически стимулирует иммунную систему, в частности, снижая Th2-ответ и повышая Th1-ответ.
В еще одном аспекте согласно изобретению было обнаружено, что олигосахариды можно успешно использовать для восстановления дисбаланса ответов Th1/Th2 и для лечения и профилактики расстройств, которые связаны с дисбалансом Th1/Th2.
В частности, неожиданно было обнаружено, что введение кислого олигосахарида необязательно в комбинации с нейтральным олигосахаридом способно восстановить дисбаланс Th1/Th2 и/или поддержать благоприятный баланс Th1/Th2. Было обнаружено, что кислый олигосахарид, предпочтительно в комбинации с нейтральным олигосахаридом, способен стимулировать реакцию Th1. Авторы считают также, что введение кислых и нейтральных олигосахаридов стимулирует Th3, т.е. усиливает активность регуляторных Т-клеток. Считается, что стимуляция реакции Th1 частично достигается ингибированием Th2-ответа.
Следовательно, настоящее изобретение предоставляет собой способ
- модулирования иммунной системы;
- стимуляции развития иммунной системы, в частности, у человека в возрасте от 0 до 1 года;
- усиления системного иммунного ответа;
- лечения и/или профилактики дисбаланса Th1/Th2; и/или
- лечения и/или профилактики заболеваний, которые в лучшем случае можно лечить путем модуляции иммунной системы;
причем способ включает в себя введение кислого олигосахарида, предпочтительно кислого и нейтрального олигосахарида, предпочтительнее кислого олигосахарида и двух химически отличных нейтральных олигосахаридов.
Другими словами, можно, таким образом, сказать, что кислый олигосахарид оказывает благоприятный эффект на воспалительные цитокины (Th1-ответ). Кроме того, комбинация кислого олигосахарида и нейтрального олигосахарида оказывает благоприятный эффект на воспалительные цитокины (Th2-ответ).
Подробное описание
Настоящее изобретение относится к способу лечения и/или профилактики расстройства, связанного с иммунной системой, у млекопитающего, причем указанный способ включает в себя введение указанному млекопитающему композиции, включающей в себя терапевтически эффективное количество кислого олигосахарида и нейтрального олигосахарида, т.е. применению кислого олигосахарида и нейтрального олигосахарида при изготовлении композиции для лечения и/или профилактики расстройства, связанного с иммунной системой, у млекопитающего.
В еще одном аспекте настоящее изобретение относится к применению кислого олигосахарида и нейтрального олигосахарида при изготовлении композиции для усиления иммунного ответа у млекопитающего и/или способе модуляции иммунной системы.
В еще одном аспекте настоящее изобретение относится к пищевой композиции, включающей в себя от 5 до 50 эн.% липида, от 10 до 60 эн.% белка, от 15 до 90 эн.% углевода и предпочтительно имеющей калорийную плотность от 0,5 до 2 ккал/мл, кислый олигосахарид и нейтральный олигосахарид, причем кислый олигосахарид включает в себя по меньшей мере одну концевую единицу уроновой кислоты; и указанный олигосахарид выбран из группы, состоящей из целлобиозы, целлодекстрина, В-циклодекстрина, неперевариваемого декстрина, гентиоолигосахарида, глюкоолигосахарида, изомальтоолигосахарида, изомальтозы, изомальтриозы, панозы, лейкрозы, палатинозы, теандерозы, D-агатозы, D-ликсогексулозы, лактосахарозы, α-галактоолигосахарида, β-галактоолигосахарида, трансгалактоолигосахарида, лактулозы, 4'-галактозиллактозы, синтетического галактоолигосахарида, фруктанов типа левана, фруктанов типа инулина, 1f-β-фруктофуранозилнистозы, ксилоолигосахарида, лафинозы, лактосахарозы и арабиноолигосахарида.
В еще одном аспекте настоящее изобретение относится к способу лечения и/или профилактики расстройства, связанного с иммунной системой, выбранного из аутоиммунных расстройств, наследственного или вызванного определенными причинами иммунодефицита, поддержки для вакцинации, аллергии 1 типа, аллергии 2 типа и аллергии 3 типа, причем способ включает в себя введение указанному млекопитающему композиции, содержащей терапевтически эффективное количество кислого олигосахарида.
Некоторые заболевания, которые считаются вызванными/опосредованными в значительной степени Th2-иммунным ответом, индукцией IL-4/IL-5-цитокина и/или эозинофилией (и, соответственно, реагирующими на лечение в соответствии с настоящим изобретением), включают в себя астму, аллергический ринит, системную красную волчанку, синдром Ommen (синдром гиперэозинофилии). Имеются примеры невирусных и неопухолевых, опосредованных Th2 заболеваний, по поводу которых ясно нельзя было прогнозировать эффективное лечение заболеваний, опосредованных Th2, способом согласно изобретению. Особенно предпочтительные способы согласно изобретению предназначены для лечения заболеваний, связанных с эозинофилией, таких как астма и аллергический ринит.
Терапевтически эффективное количество для лечения конкретного расстройства специалист в данной области может определить обычным способом посредством исследований по поиску дозы.
Расстройство, связанное с иммунной системой
Было обнаружено, что введение кислого олигосахарида, предпочтительно в комбинации с нейтральным олигосахаридом, обеспечивает благоприятный системный эффект на организм субъекта. «Системный» означает воздействие на весь организм в результате (системной) циркуляции крови и/или лимфы.
В одном аспекте настоящее изобретение связано со способом модуляции и/или усиления иммунной системы, причем указанный способ включает в себя введение кислого и нейтрального олигосахаридов. Этот способ можно подходящим образом использовать в способе создания баланса Th1/Th2-ответа, в частности, путем стимуляции Th1-ответа. Следовательно, композиции, содержащие настоящий олигосахарид(ы), которые, как указано, например, стимулируют созревание иммунной системы, усиливают устойчивость к патогенам путем усиления иммунной системы и/или поддерживают иммунную систему, являются частью изобретения.
В еще одном аспекте настоящее изобретение связано со способои лечения и/или профилактики расстройства, связанного с иммунной системой, причем указанный способ включает в себя введение указанному млекопитающему композиции, включающей в себя терапевтически эффективное количество кислого олигосахарида.
В еще одном аспекте настоящее изобретение связано со способом усиления иммунного ответа у млекопитающего, причем указанный способ включает в себя введение млекопитающему композиции, содержащей кислый олигосахарид, необязательно в комбинации с нейтральным олигосахаридом.
Было особенно неожиданным то, что энтеральное введение настоящих олигосахаридов обеспечивает благоприятные системные эффекты. Следовательно, настоящий способ предпочтительно включает в себя энтеральное, еще предпочтительнее пероральное введение кислого олигосахарида или кислого и нейтрального олигосахарида.
В еще одном варианте осуществления способ согласно изобретению относится к введению олигосахаридов младенцам, предпочтительно человеку в возрасте от 0 до 6 лет, предпочтительно в возрасте от 0 до 1 года. Поскольку эта группа имеет особый дисбаланс соотношения Th1/Th2 (во многих случаях преобладает Th2), настоящий способ можно подходящим образом использовать для восстановления этого дисбаланса у этой популяции. Считают также, что введение кислого олигосахарида, предпочтительно в комбинации с нейтральным олигосахаридом, улучшает созревание желудочно-кишечного тракта новорожденных, делая настоящий способ и композицию особенно подходящими для введения недоношенным младенцам. В предпочтительном варианте осуществления настоящий способ относится к стимуляции созревания иммунной системы у человека в возрасте от 0 до 6 лет, предпочтительно от 0 до 1 года.
Другие предпочтительные признаки композиции, такие как содержание белка, углеводов, липидов, осмоляльность, вязкость и калорийная плотность композиции, которую можно подходящим образом использовать в этом способе, описаны ниже.
Расстройство, связанное с иммунной системой, предпочтительно выбрано из аутоиммунных расстройств, наследственного или вызванного определенными причинами иммунодефицита, поддержки для вакцинации, аллергии 1 типа, аллергии 2 типа, аллергии 3 типа и аллергии 4 типа.
Аутоиммунные расстройства, которые можно подходящим образом лечить, включают в себя системную красную волчанку, хронический гломерулонефрит, узелковый полиартериит, постстрептококковый острый гломерулонефрит, болезнь Грэйвса, тяжелую миастению, устойчивый к инсулину диабет, тироидит Хашимото, гемолитическую анемию, пернициозную анемию, синдром Гудпасчура, обычную пузырчатку, аутоиммунную тромбоцитопеническую пурпуру, острый ревматизм, смешанную эссенциальную криоглобулинемию, аутоиммунную пернициозную анемию, аутоиммунную болезнь Эдисона, витилиго, гипогликемию, волчаночную сыпь новорожденных, IDDM (инсулинозависимый сахарный диабет), ревматоидный артрит, рассеянный склероз, псориаз, склеродермию, болезнь Крона, IBD (воспалительную болезнь кишечника), нейропатию, предпочтительно устойчивый к инсулину диабет.
Состояния наследственного или вызванного определенными причинами иммунодефицита, которые можно подходящим образом лечить, включают в себя старение иммунной системы, аутизм, алиментарную дистрофию, вызванную хроническими заболеваниями, такими как рак, COPD (хроническое обструктивное легочное заболевание), СПИД, артрит, диабет, анорексию, кахексию, дисфагию, почечную недостаточность, облучение, пациентов, страдающих хроническими изъязвлениями и стрессом, конкретнее, социальным стрессом, хронической инфекцией или курением, от загрязнения воздуха, облучения, химиотерапии.
Ввиду того, что стимуляция иммунной системы имеет особое значение у субъектов, страдающих синдромом приобретенного иммунодефицита (СПИДом), и/или инфекцией вирусом иммунодефицита человека (ВИЧ), в предпочтительном варианте осуществления настоящее изобретение, в частности, связано со способом лечения и/или профилактики СПИД и/или ВИЧ-инфекции, причем указанный способ включает в себя энтеральное введение кислых олигосахаридов, предпочтительно в комбинации с настоящими нейтральными олигосахаридами согласно изобретению. Настоящее изобретение также связано со способом лечения и/или профилактики диареи у субъектов, страдающих СПИДом и/или ВИЧ-инфекцией, причем указанный способ включает в себя энтеральное введение кислых олигосахаридов, предпочтительно в комбинации с настоящими нейтральными олигосахаридами согласно изобретению. Кислый олигосахарид согласно изобретению предпочтительно предоставляется субъекту, страдающему СПИДом и/или ВИЧ-инфекцией, в составе питательной матрицы, т.е. композиции, включающей в себя жир, белок и углевод.
Аллергии, которые можно подходящим образом лечить, включают в себя аллергии 1 типа: атопию, астму, сенную лихорадку, экзему, пищевую аллергию, лекарственную аллергию. Аллергии 2 типа: гемолитическую болезнь новорожденных, аутоиммунную гемолитическую анемию, анкилозирующий спондилит, острый передний увеит. Аллергии 3 типа: реакцию Артюса, сывороточную болезнь. Аллергии 4 типа: гиперчувствительность замедленного типа, контактную чувствительность, чревную болезнь.
Было также обнаружено, что настоящий способ можно подходящим образом использовать для процессов поддержки для вакцинации, например усиления эффектов процесса вакцинации. Они включены в термин «расстройства, связанные с иммунной системой». Кислые олигосахариды, предпочтительно в комбинации с нейтральными олигосахаридами, предпочтительно (перорально) вводятся перед, во время и/или после вакцинации. В частности, можно подходящим образом усилить эффекты вакцинации для дифтерийно-столбнячно-коклюшной вакцины, вакцины против полиомиелита, вакцины против кори/эпидемического паротита/краснухи, пневмококкового конъюгата, конъюгата Haemophilus B, вакцины против гепатита В, гепатита А, вакцины против ветряной оспы и гриппа.
В предпочтительном варианте настоящий способ относится к лечению и/или предотвращению алиментарной дистрофии, атопии, астмы или COPD.
Настоящее изобретение относится также к применению кислых полисахаридов при изготовлении композиции для лечения и/или профилактики расстройства, связанного с иммунной системой, выбранного из аутоиммунных расстройств, наследственного или вызванного определенными причинами иммунодефицита (предпочтительно не СПИДа), поддержки для вакцинации, аллергии 1 типа, аллергии 2 типа и аллергии 3 типа.
Кислые олигосахариды
Термин «кислый олигосахарид» относится к олигосахаридам, включающим в себя по меньшей мере одну кислотную группу, выбранную из группы, состоящей из N-ацетилнейраминовой кислоты, N-гликолоилнейраминовой кислоты, свободной или эстерифицированной карбоновой кислоты, группы серной кислоты и группы фосфорной кислоты. Кислый олигосахарид предпочтительно представляет собой полигексозу. Предпочтительно, если по меньшей мере одна из указанных выше кислотных групп расположена у концевой гексозной единицы кислого олигосахарида. Предпочтительно, если кислый олигосахарид имеет структуру, изображенную на схеме 1, где концевая гексоза (слева) предпочтительно включает в себя двойную связь. Предпочтительно, если кислый олигосахарид содержит карбоновую кислоту у концевой гексозной единицы, где указанная группа карбоновой кислоты может быть свободной или эстерифицированной. Способы получения эстерифицированных пектиновых гидролизатов, которые можно подходящим образом использовать в настоящем способе и композиции, представлены в WO 01/60378 и/или WO 02/42484, которые включены в настоящее описание в качестве ссылки.
Гексозные единицы, отличные от концевой гексозной единицы (единиц), предпочтительно представляют собой единицы уроновой кислоты, еще предпочтительнее, единицы галактуроновой кислоты. Группы карбоновой кислоты на этих единицах могут быть свободными или (частично) эстерифицированными, а предпочтительно, по меньшей мере на 10% метилированы (см. ниже).
Схема 1 - Полимерные кислые олигосахариды
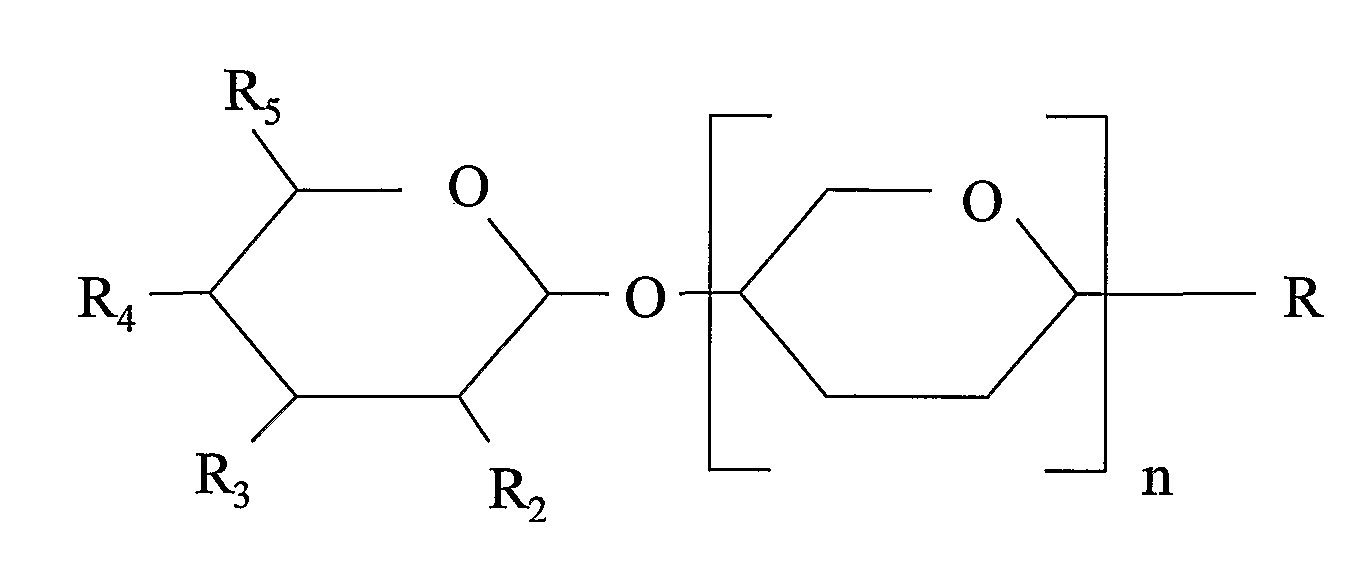
где
R предпочтительно выбран из группы, состоящей из водорода, гидрокси или кислотной группы, предпочтительно гидрокси; и
по меньшей мере один радикал, выбранный из группы, состоящей из R2, R3, R4 и R5, представляет собой N-ацетилнейраминовую кислоту, N-гликолоилнейраминовую кислоту, свободную или эстерифицированную карбоновую кислоту, группу серной кислоты и группу фосфорной кислоты, а остальные радикалы - из R2, R3, R4 и R5 представляют собой гидрокси и/или водород. Предпочтительно один радикал, выбранный из группы, состоящей из R2, R3, R4 и R5, представляет собой N-ацетилнейраминовую кислоту, N-гликолоилнейраминовую кислоту, свободную или эстерифицированную карбоновую кислоту, группу серной кислоты или группу фосфорной кислоты, а остальные радикалы представляют собой гидрокси и/или водород. Еще предпочтительнее, когда один радикал, выбранный из группы, состоящей из R2, R3, R4 и R5, представляет собой свободную или эстерифицированную карбоновую кислоту, а остальные радикалы из R2, R3, R4 и R5 представляют собой гидрокси и/или водород; и n представляет собой целое число и относится к количеству гексозных единиц (см. также приведенный ниже раздел «Степень полимеризации»), которая может представлять собой любую гексозную единицу, n может представлять собой целое число от 1 до 5000. Предпочтительно, когда гексозная единица (единицы) представляет собой единицу уроновой кислоты.
Наиболее предпочтительно, когда R1, R2 и R3 представляют собой гидрокси, R4 представляет собой водород, R5 представляет собой карбоновую кислоту, n представляет собой любое число от 1 до 250, предпочтительно от 1 до 10, а гексозная единица представляет собой галактуроновую кислоту.
Выявление, измерение и анализы предпочтительных кислых олигосахаридов, используемых в настоящем способе, представлены в ранее поданной заявителем патентной заявке, относящейся к кислым олигосахаридам, т.е. WO 0/160378, которая включена в настоящее описание в качестве ссылки.
Предпочтительно, чтобы кислый олигосахарид имел одну, предпочтительно, две концевые единицы уроновой кислоты, которые могут быть свободными или эстерифицированными. Предпочтительно, чтобы концевая единица уроновой кислоты была выбрана из группы, состоящей из галактуроновой кислоты, глюкуроновой кислоты, гулуроновой кислоты, идуроновой кислоты, маннуроновой кислоты, рибуроновой кислоты и алтуроновой кислоты. Эти единицы могут быть свободными или эстерифицированными. В еще более предпочтительном варианте осуществления концевая гескозная группа имеет двойную связь, которая предпочтительно расположена между положением С4 и С5 концевой гескозной единицы. Предпочтительно, чтобы одна из концевых гексозных единиц включала в себя двойную связь. Концевая гексоза (например, уроновая кислота) предпочтительно имеет структуру в соответствии со схемой 2.
Схема 2 - Предпочтительная концевая гексозная кислотная группа

где
R предпочтительно выбран из группы, состоящей из водорода, гидрокси или кислотной группы, предпочтительно гидрокси (см. выше); и
по меньшей мере один радикал, выбранный из группы, состоящей из R2, R3, R4 и R5, представляет собой N-ацетилнейраминовую кислоту, N-гликолоилнейраминовую кислоту, свободную или эстерифицированную карбоновую кислоту, группу серной кислоты и группу фосфорной кислоты, а остальные радикалы из R2, R3, R4 и R5 представляют собой гидрокси и/или водород. Предпочтительно, чтобы один радикал, выбранный из группы, состоящей из R2, R3, R4 и R5, представлял собой N-ацетилнейраминовую кислоту, N-гликолоилнейраминовую кислоту, свободную или эстерифицированную карбоновую кислоту, группу серной кислоты или группу фосфорной кислоты, а остальные радикалы из R2, R3, R4 и R5 представляли бы собой свободную или эстерифицированную карбоновую кислоту, а остальные радикалы из R2, R3, R4 и R5 представляли бы собой гидрокси и/или водород; и n представляет собой целое число и относится к количеству гексозных единиц (см. также приведенный ниже раздел «Степень полимеризации»), которые могут быть любой гексозной единицей, n может представлять собой целое число от 1 до 5000, представляющее собой количество гексозных единиц, причем указанные гексозные единицы предпочтительно представляют собой единицы уроновой кислоты, еще предпочтительнее, представляют собой единицы галактуроновой кислоты. Группы карбоновой кислоты на этих единицах могут быть свободными или (частично) эстерифицированными и предпочтительно являются по меньшей мере частично метилированными. Наиболее предпочтительно, чтобы R2 и R3 представляли собой гидрокси, R4 представлял собой водород, а R5 представлял собой свободную или эстерифицированную карбоновую кислоту.
В еще одном варианте осуществления используется смесь кислых олигосахаридов, которые имеют различную СП (степень полимеризации) и/или включают в себя и ненасыщенную, и насыщенную концевую гексозную единицу. Предпочтительно, чтобы по меньшей мере 5%, предпочтительнее 10%, еще предпочтительнее по меньшей мере 25%, концевых гексозных единиц кислого олигосахарида представляли собой ненасыщенную гексозную единицу (см., например, схему 2). Поскольку каждый отдельный кислый олигосахарид предпочтительно включает в себя только одну ненасыщенную концевую гексозную единицу, предпочтительно, чтобы не более чем 50% концевой гексозной единицы представляли собой ненасыщенную гексозную единицу (т.е. включали двойную связь).
Смесь кислых олигосахаридов предпочтительно содержит от 2 до 50% ненасыщенных гексозных единиц на основании общего количества гексозных единиц, предпочтительно от 10 до 40%.
Кислый олигосахарид, используемый в настоящем способе, имеет степень полимеризации (СП) от 1 до 5000, предпочтительно от 1 до 1000, предпочтительнее от 2 до 250, еще предпочтительнее от 2 до 50, наиболее предпочтительно от 2 до 10. Если используется смесь кислых олигосахаридов с различными степенями полимеризации, то средняя СП смеси кислых олигосахаридов предпочтительно составляет от 2 до 1000, предпочтительнее от 3 до 250, еще предпочтительнее от 3 до 50. См. также схему 1, где сумма “n” и концевая единица (т.е. n+1) представляет собой степень полимеризации. Было обнаружено, что более низкая СП олигосахаридов улучшает вкусовые характеристики и приводит к получению продукта пониженной вязкости, если кислый олигосахарид вводится в жидкой форме. Кислый олигосахарид может представлять собой однородный или неоднородный углевод.
Кислые олигосахариды, используемые в изобретении, предпочтительно получают из пектина, пектата, альгината, хондроитина, гиалуроновых кислот, гепарина, гепарана, бактериальных углеводов, сиалогликанов, фукоидана, фукоолигосахаридов или каррагинана, предпочтительно из пектина или альгината. Кислые олигосахариды можно получить способами, описанными в документе WO 01/60378, который включен в настоящее описание в качестве ссылки.
Альгинаты представляют собой линейные неразветвленные полимеры, содержащие остатки β-(1→4)-связанной D-маннуроновой кислоты и α-(1→4)-связанной L-глюкуроновой кислоты с широким диапазоном молекулярных масс (100-100000 остатков). Подходящие источники альгината включают в себя альгинаты морских водорослей и бактерий.
Пектин делится на 2 основные категории: высокомолекулярный пектин, который характеризуется степенью метоксилирования выше 50%, и низкометоксилированный пектин, имеющий степень метоксилирования ниже 50%. Используемый здесь термин «степень метоксилирования» (также именуемый DE или «степенью эстерификации») предназначен для обозначения степени, в которой были эстерифицированы (например, метилирование) группы карбоновых кислот, содержащиеся в цепи полигалакутороновой кислоты. Настоящий кислый олигосахарид предпочтительно получают из высокометоксилированного пектина.
Кислые олигосахариды предпочтительно характеризуются степенью метоксилирования выше 20%, предпочтительно выше 50%, еще предпочтительнее, выше 70%. Кислые олигосахариды предпочтительно имеют степень метоксилирования выше 20%, предпочтительно выше 50%, еще предпочтительнее, выше 70%.
Кислый олигосахарид предпочтительно вводится в количестве от 10 мг до 100 г/д, предпочтительно от 100 мг до 50 г/д, еще предпочтительнее от 0,5 до 20 г/д.
Натуральные олигосахариды
Используемый в настоящем изобретении термин «натуральные олигосахариды» относится к сахаридам, которые имеют степень полимеризации монозных единиц, превышающую 2, предпочтительнее превышающую 3, еще предпочтительнее превышающую 4, наиболее предпочтительно превышающую 10, которые не только частично перевариваются в кишечнике под действием кислот или пищеварительных ферментов, присутствующих в верхних отделах пищеварительного тракта человека (тонкая кишка и желудок), но которые ферментируются кишечной флорой человека, а предпочтительно лишены кислотных групп. Нейтральный олигосахарид структурно (химически) отличается от кислого олигосахарида. Используемый в настоящем изобретении термин «нейтральные олигосахариды» относится к сахаридам, которые имеют степень полимеризации олигосахарида от 60 монозных единиц, предпочтительно ниже 40, еще предпочтительнее ниже 20, наиболее предпочтительно ниже 10.
Термин «монозные единицы» относится к единицам, имеющим закрытую кольцевую структуру, предпочтительно гексозную, например пиранозную или фуранозную формы.
Нейтральный олигосахарид предпочтительно включает в себя по меньшей мере 90%, предпочтительнее по меньшей мере 95% монозных единиц, выбранных из группы, состоящей из маннозы, арабинозы, фруктозы, фукозы, рамнозы, галактозы, β-В-галактопиранозы, рибозы, глюкозы, ксилозы и их производных, рассчитанных на общее количество содержащихся в них монозных единиц.
Подходящие нейтральные олигосахариды предпочтительно ферментируются флорой кишечника. Олигосахарид предпочтительно выбран из группы, состоящей из целлобиозы (4-О-β-D-глюкопиранозил-D-глюкозы), целлодекстринов ((4-О-β-D-глюкопиранозил)n-D-глюкозы), В-циклодекстринов (циклических молекул α-1-4-связанной D-глюкозы; α-циклодекстрингексамера, β-циклодекстрингептамера и γ-циклодекстриноктамера), неперевариваемого декстрина, гентиоолигосахаридов (смеси β-1-6-связанных остатков глюкозы, некоторых 1-4 связей), глюкоолигосахаридов (смеси α-D-глюкозы), изомальтоолигосахаридов (линейных α-1-6-связанных остатков глюкозы с некоторыми 1-4 связями), изомальтозы (6-О-α-D-глюкопиранозил-D-глюкозы); изомальтриозы (6-О-α-D-глюкопиранозил-(1-6)-α-D-глюкопиранозил-D-глюкозы), панозы (6-О-α-D-глюкопиранозил-(1-6)-α-D-глюкопиранозил-(1-4)-D-глюкозы), лейкрозы (5-О-α-D-глюкопиранозил-D-фруктопиранозида), палатинозы или изомальтулозы (6-О-α-D-глюкопиранозил-D-фруктозы), теандерозы (О-α-D-глюкопиранозил-(1-6)-О-α-D-глюкопиранозил-(1-2)-В-D-фруктофуранозида), D-агатозы, D-ликсогексулозы, лактосахарозы (О-β-D-галактопиранозил-(1-4)-О-α-D-глюкопиранозил-(1-2)-β-D-фруктофуранозида), α-галактоолигосахаридов, включая раффинозу, стахиозу и другие соевые олигосахариды (О-α-D-галактопиранозил-(1-6)-α-D-глюкопиранозил-β-D-фруктофуранозида), β-галактоолигосахаридов или трансгалактоолигосахаридов (β-D-галактоопиранозил-(1-6)-[β-D-глюкопиранозил]n-(1-4)-α-D-глюкозы), лактулозы (4-О-β-D-галактопиранозил-D-фруктозы), 4'-галактозиллактозы (О-D-галактопиранозил-(1-4)-О-β-D-глюкопиранозил-(1-4)-D-глюкопиранозы), синтетического галактоолигосахарида (неогалактобиозы, изогалактобиозы, галсахарозы, изолактозы I, II и III), фруктанов - типа Левана (β-D-(2→6)-фруктофуранозил)n-α-D-глюкопипиранозида), фруктанов - типа инулина (β-D-(2→1)-фруктофуранозил)n-α-D-глюкопипиранозида), 1f-β-фруктофуранозилнистозы (β-D-(2→1)-фруктофуранозил)n-В-D-фруктофуранозида), ксилоолигосахаридов (B-D-(1→4)-ксилозы)n, лафинозы, лактосахарозы и арабиноолигосахаридов.
В соответствии еще с одним предпочтительным вариантом осуществления нейтральный олигосахарид выбран из группы, состоящей из фруктанов, фруктоолигосахаридов, неперевариваемых декстринов, галактоолигосахаридов (включая трансгалактоолигосахариды), ксилоолигосахаридов, арабиноолигосахаридов, глюкоолигосахаридов, манноолигосахаридов, фукоолигосахаридов и их смесей. Наиболее предпочтительно, когда нейтральный олигосахарид выбран из группы, состоящей декстринов, галактоолигосахаридов и трансгалактоолигосахаридов.
Подходящие олигосахариды и способы их получения, кроме того, описаны в документе (Laere, K.J.M., Degradation of structurally different non-digestible oligosaccharides by intestinal bacteria: glycosylhydrolases of Bi. adolescentis. PhD-thesis (2000), Wageningen Agricultural University, Wageningen, The Netherlands), полное содержание которого включено в настоящее описание в качестве ссылки.
Трансгалактоолигосахариды (TOS) продаются, например, под торговой маркой VivinalTM (Borculo Domo Ingredients, Netherlands).
Неперевариваемый декстрин, который можно получить в результате пиролиза кукурузного крахмала, включает в себя глюкозидные связи α(1→4) и α(1→6), которые присутствуют в нативном крахмале, и содержит связи 1→2 и 1→3 и левоглюкосан. Вследствие этих структурных характеристик неперевариваемый декстрин содержит хорошо развитые, разветвленные частицы, которые частично гидролизуются пищеварительными ферментами человека.
Многочисленные другие коммерческие источники неперевариваемых олигосахаридов общедоступны и известны специалисту в данной области. Например, трансгалактоолигосахарид имеется от Yakult Honsha Co., Tokyo, Japan. Олигосахарид соевых бобов имеется от Calpis Corporation и распространяется Ajinomoto U.S.A. Inc., Teanneck, N.J.
В еще одном предпочтительном варианте осуществления настоящий способ включает в себя введение 2 химически отличных олигосахаридов. Было обнаружено, что введение кислых олигосахаридов в комбинации с двумя химически отличными нейтральными олигосахаридами обеспечивает оптимальный эффект. Настоящий способ предпочтительно включает в себя введение
- кислого олигосахрида (см. выше);
- нейтрального олигосахарида на основе галактозы (>50% монозных единиц представляют собой галактозу), предпочтительно выбранный из группы, состоящей из галактоолигосахарида и трансгалактоолигосахарида; и
- олигосахаридов на основе фруктозы и/или глюкозы (>50% монозных единиц представляют собой фруктозу и/или глюкозу, предпочтительно фруктозу), предпочтительно инулин, фруктан и/или фруктоолигосахарид, наиболее предпочтительно длинноцепочечный фруктоолигосахарид (средняя СП от 10 до 60).
Эта композиция особенно подходит для введения младенцам в возрасте от 0 до 1 года.
В еще одном варианте осуществления настоящий способ включает в себя введение 2 структурно (химически) отличных олигосахаридов, причем 2 структурно (химически) отличных олигосахарида отличаются типом их гликозидных связей.
Предпочтительно способ включает в себя введение двух химически отличных нейтральных олигосахаридов, причем указанные химически отличные олигосахариды имеют различную СП и/или различную среднюю СП, предпочтительно различную среднюю СП. В другом варианте осуществления введение химически отличных нейтральных олигосахаридов с различной средней СП обеспечивает даже более оптимальный иммуномодулирующий эффект. Предпочтительно, нейтральный олигосахарид на основе галактозы имеет среднюю СП от 2 до 10, а нейтральный олигосахарид на основе фруктозы и/или глюкозы имеет среднюю СП от 10 до 60.
Нейтральный олигосахарид предпочтительно вводят в количестве от 10 мг до 100 г/д, предпочтительно от 100 мг до 50 г/д, еще предпочтительнее от 0,5 до 20 г/д.
Кислые и нейтральные олигосахариды синергического действия
Было обнаружено, что кислые и нейтральные олигосахариды оказывают синергический иммуностимулирующий эффект. Следовательно, настоящий способ предпочтительно включает в себя введение терапевтически эффективного количества кислых олигосахаридов и нейтральных олигосахаридов.
Смесь кислых и нейтральных олигосахаридов предпочтительно вводится в количестве от 10 мг до 100 г/д, предпочтительно от 100 мг до 25 г/д, еще предпочтительнее от 0,5 до 20 г/д.
Предпочтительная комбинация кислых олигосахаридов и нейтральных олигосахаридов включает в себя кислые олигосахариды, показанные на схеме 2, где
R представляет собой водород, гидрокси или кислотную группу; а радикал, выбранный из группы, состоящей из R2, R3, R4 и R5, представляет собой свободную или эстерифицированную карбоновую кислоту, а остальные радикалы из R2, R3, R4 и R5 представляют собой гидрокси и/или водород; и галактоолигосахарид и/или трансгалактоолигосахарид.
Предпочтительно кислые и нейтральные олигосахариды вводятся в массовом соотношении от 0,01:1 до 1:0,01, предпочтительно в массовом соотношении от 0,1:1 до 1:0,1.
LCPUFA
В предпочтительном варианте осуществления настоящий способ включает в себя введение длинноцепочечной полиненасыщенной кислоты (LCPUFA). Поскольку считается, что они действуют на иммунную систему через механизм, отличный от механизма действия кислых олигосахаридов или нейтральных олигосахаридов, олигосахариды в комбинации с LCPUFA считаются действующими синергически. Настоящий способ предпочтительно включает в себя введение от 0,1 до 100 г/д LCPUFA, предпочтительнее, от 1 до 25 г/д LCPUFA.
Пищевые продукты
Было обнаружено, что кислые олигосахариды и, в частности, синергическая смесь кислых и нейтральных олигосахаридов может благоприятно использоваться в пищевых продуктах, таких как детское питание и лечебное питание. Такая пища предпочтительно включает в себя липиды, белок и углеводы и предпочтительно вводится в жидкой форме. Используемый в настоящем изобретении термин «жидкая пища» включает в себя сухую пищу (например, порошки), которая сопровождается инструкциями, с тем, чтобы смешать указанную смесь сухой пищи с подходящей жидкостью (например, водой). Следовательно, настоящее изобретение также относится к питательной композиции, которая предпочтительно включает в себя от 5 до 50 эн.% липида, от 10 до 60 эн.% белка, от 15 до 90 эн.% углевода и кислые олигосахариды согласно изобретению, предпочтительно в комбинации с нейтральными олигосахаридами. Предпочтительно, чтобы питательная композиция согласно изобретению предпочтительно содержала от 10 до 30 эн.% липида, от 15 до 40 эн.% белка и от 25 до 75 эн.% углевода (эн.% представляет собой низкоэнергетическую процентную долю и представляет собой относительный вклад, который каждый ингредиент вносит в общую калорийность препарата).
Такая пища предпочтительно представлена в жидкой форме и имеет ограниченную вязкость. Было обнаружено, что пищевые продукты, содержащие кислые олигосахариды, необязательно в комбинации с нейтральными олигосахаридами, обеспечивают жидкую питательную смесь с достаточно низкой вязкостью, так что ее можно использовать, например, в качестве детского питания и жидкого лечебного питания, которые можно подавать через трубку или соломинку, сохраняя низкую вязкость. В предпочтительном варианте осуществления настоящая композиция имеет вязкость ниже 600 мПа, предпочтительно менее 250 мПа, предпочтительнее ниже 50 мПа, наиболее предпочтительно менее 25 мПа при скорости сдвига 100 с-1 при 20°С. В настоящем документе термин «вязкость» относится физическому параметру, который определяется в соответствии со следующим способом.
Вязкость можно определить, используя реометр Carri-Med CSL. Используемая форма имеет вид конуса (акриловый конус 6 см, 2 градуса), и зазор между пластиной и формой устанавливается на 55 мкм. Линейная непрерывная наклонная скорость сдвига используется от 0 до 150 с-1 за 20 с.
Предпочтительно используются растительные липиды. Растительный липид представляет собой предпочтительно по меньшей мере липид, выбранный из группы, состоящей из соевого масла, кокосового масла, масла сафлора красильного, масла подсолнечника, кукурузного масла, масла канолы и лецитинов. При желании можно также добавить животные жиры, такие как молочные жиры.
Белки, используемые в питательном препарате, предпочтительно выбраны из группы белков животных, кроме человека (таких как молочные белки, мясные белки и яичные белки), растительных белков (таких как соевый белок, пшеничный белок, рисовый белок и гороховый белок), свободных аминокислот и их смесей. Особенно предпочтительны белки коровьего молока, такие как казеин, и пшеничные белки.
Источник перевариваемого углевода можно добавить к питательной смеси. Он предпочтительно обеспечивает примерно от 40% до примерно 80% энергии питательной композиции. Можно использовать любой подходящий источник углеводов, например сахарозу, лактозу, глюкозу, фруктозу, твердые вещества кукурузного сиропа и мальтодекстрины и их смеси.
Композиция согласно изобретению предпочтительно по существу свободна от жизнеспособных бифиногенных бактерий.
Неоднородность образующихся фекальных масс (например, твердые фекальные массы, недостаточный объем фекальных масс, диарея) представляет собой большую проблему у многих маленьких детей и больных лиц, которые получают жидкую пищу. Было обнаружено, что проблемы, связанные с фекальными массами, можно уменьшить введением олигосахаридов согласно изобретению в жидкую пищу, которая имеет осмоляльность от 50 до 500 мОсм/кг, предпочтительнее от 100 до 400 мОсм/кг.
В связи с указанным выше важно также, чтобы жидкая пища не имела избыточной калорийной плотности, однако все же обеспечивала достаточное количество калорий для питания субъекта. Следовательно, жидкая пища предпочтительно имеет калорийную плотность от 0,1 до 2,5 ккал/мл, еще предпочтительнее, калорийную плотность от 0,5 до 1,5 ккал/мл.
Питательная смесь для кормления грудных детей
Было обнаружено, что композицию согласно изобретению можно эффективно использовать в питательной смеси для кормления грудных детей. Такая питательная смесь для кормления грудных детей включает в себя липиды, белки и углеводы и предпочтительно вводится в жидкой форме. Используемый в настоящем изобретении термин «жидкая пища» включает в себя сухую пищу (например, порошки), которая снабжена инструкциями, с тем, чтобы смешать указанную смесь сухой пищи с подходящей жидкостью (например, водой).
Следовательно, настоящее изобретение также относится к питательной смеси для кормления грудных детей, которая предпочтительно включает в себя от 5 до 60 эн.% липида, от 5 до 40 эн.% белка, от 15 до 90 эн.% углевода и комбинацию олигосахаридов и LC-PUFA согласно изобретению. Питательная смесь согласно изобретению для кормления грудных детей предпочтительно содержит от 30 до 60 эн.% липида, от 6 до 15 эн.% белка и от 25 до 75 эн.% углевода (эн.% представляет собой низкоэнергетическую процентную долю и представляет собой относительное количество, которое каждый ингредиент вносит в общую калорийную ценность препарата).
Предпочтительно используется комбинация растительных липидов и по меньшей мере одно масло, выбранное из группы, состоящей из рыбьего жира, и содержащих омега-3 овощей, водорослей или бактериального масла.
Белки, используемые в питательном препарате, предпочтительно выбраны из группы белков животных, кроме человека (таких как молочные белки, мясные белки и яичные белки), растительных белков (таких как соевый белок, пшеничный белок, рисовый белок и гороховый белок), свободных аминокислот и их смесей. Источник азота, полученный из коровьего молока, в частности белки коровьего молока, такие как казеин, и пшеничные белки, являются особенно предпочтительными.
Источник перевариваемого углевода можно добавить к питательной смеси. Он предпочтительно обеспечивает примерно от 40% до примерно 80% энергии питательной композиции. Можно использовать любой подходящий источник углеводов, например сахарозу, лактозу, глюкозу, фруктозу, твердые вещества кукурузного сиропа и мальтодекстрины и их смеси.
В соответствии с особенно предпочтительным вариантом осуществления питательная смесь согласно изобретению для кормления грудных детей содержит от 7 до 12 энергетических % белка; от 40 до 55 энергетических % углеводов и от 35 до 50 энергетических % жира. Поскольку эта композиция особенно подходит для использования при снижении аллергической реакции у грудного ребенка, белок питательной смеси для кормления грудных детей предпочтительно выбран из группы, состоящей из гидролизованного молочного белка (например, гидролизованного казеина или гидролизованного пшеничного белка), растительного белка и/или аминокислот. Использование этих белков дополнительно снижало аллергические реакции грудного ребенка.
Неоднородность образующихся фекальных масс (например, твердые фекальные массы, недостаточный объем фекальных масс, диарея) представляет собой большую проблему у многих маленьких детей, которые получают жидкую пищу. Было обнаружено, что проблемы, связанные с фекальными массами (например, диарею), можно уменьшить введением олигосахаридов по настоящему изобретению в жидкую пищу, которая имеет осмоляльность от 50 до 500 мОсм/кг, предпочтительнее от 100 до 400 мОсм/кг.
В особенно предпочтительном варианте осуществления настоящее изобретение также предоставляет композицию, которая особенно подходит для применения в способе согласно изобретению. Эта композиция имеет высокую степень сходства с естественным человеческим молоком и по функциональности, и по молекулярной структуре. Следовательно, композиция особенно подходит в качестве питательной смеси для кормления грудных детей. Композиция согласно изобретению содержит жиры, углеводы, белки и от 0,5 до 1 г растворимых неперевариваемых олигосахаридов на 100 мл жидкого продукта, предпочтительно от 0,7 до 0,9 г/10 мл. Кроме того, композиция содержит на 100 мл продукта от 0,4 до 0,7 г трансгалактоолигосахаридов (неперевариваемой [галактозо]n-глюкозы, включающей в себя β-связанные сахариды; где n представляет собой целое число от 1 до 60, т.е. 2, 3, 4, 5, 6,..., 59, 60; предпочтительно n выбрано из 2, 3, 4, 5, 6, 7, 8, 9 или 10); и от 0,01 до 0,1 г инулина (неперевариваемого полисахаридного углевода, включающего в себя цепь по меньшей мере из 10 β-связанных фруктозных единиц); и от 0,04 до 0,3 г кислых олигосахаридов, как изображено на схеме 2. Жидкий продукт согласно изобретению потребитель может подходящим образом получить из порошкообразного продукта. Жидкий продукт согласно изобретению предпочтительно содержит ингредиенты и имеет характеристики, как описано здесь выше и ниже, и может с благоприятным эффектом использоваться в описанных здесь способах.
Олигосахариды
Кислый олигосахарид предпочтительно включен в настоящую композицию в соответствии с изобретением а количестве, превышающем 0,1 мас.%, предпочтительно превышающем 0,2 мас.%, предпочтительнее превышающем 0,5 мас.%, и еще предпочтительнее превышающем 1 мас.% на основании общей сухой массы композиции. Хотя введение значительных количеств олигосахаридов в целом не приведет к нежелательным побочным эффектам, композиция согласно изобретению имеет содержание олигосахарида ниже 20 мас.%, предпочтительнее, ниже 10 мас.%, еще предпочтительнее, ниже 5 мас.%.
Нейтральный олигосахарид предпочтительно включен в настоящую композицию в соответствии с изобретением в количестве, превышающем 0,1 мас.%, предпочтительно превышающем 0,2 мас.%, предпочтительнее превышающем 0,5 мас.%, и еще предпочтительнее превышающем 1 мас.% на основании общей сухой массы композиции. Хотя введение значительных количеств олигосахаридов в целом не приведет к нежелательным побочным эффектам, композиция согласно изобретению имеет содержание олигосахарида ниже 20 мас.%, предпочтительнее, ниже 10 мас.%, еще предпочтительнее, ниже 5 мас.%.
Было обнаружено, что композиция согласно изобретению синергически стимулирует иммунную систему. Следовательно, композицию согласно изобретению можно подходящим образом использовать в способе для лечения и/или профилактики инфекции, причем указанный способ включает в себя пероральное введение человеку, предпочтительно грудному ребенку, такой композиции. Стимуляцией иммунной системы и содействием здоровой кишечной флоры настоящая композиция также оказывает системный, противоинфекционный эффект. Следовательно, кислые олигосахариды согласно изобретению, предпочтительно в комбинации с нейтральными олигосахаридами согласно изобретению, могут с преимуществом использоваться для лечения и/или профилактики кишечных инфекций и/или инфекций дыхательных путей. В еще одном предпочтительном варианте осуществления олигосахарид(ы) вводятся перорально в составе пищевой матрицы, как описано выше.
Ввиду того, что стимуляция иммунной системы имеет особенное значение у субъектов, страдающих раком, в частности у тех пациентов, которые подвергаются или подвергались химиотерапии, облучению, и у пациентов с кахексией (как обычно случается в терминальной фазе рака), настоящее изобретение обеспечивает способ лечения этих субъектов, причем указанный способ включает в себя энтеральное введение кислых олигосахаридов согласно изобретению, предпочтительно в комбинации с нейтральными олигосахаридами согласно изобретению. Такой кислый олигосахарид предпочтительно обеспечивается этим субъектам в составе питательной матрицы, т.е. композиции, включающей в себя жир, белок и углевод.
ПРИМЕРЫ
Пример 1
Структура эксперимента
Эффект рационов, включающих в себя кислые олигосахариды, необязательно в комбинации с нейтральными олигосахаридами, испытывали на реакции гиперчувствительности замедленного типа (DTH), которая представляет собой показатель Th1-иммунного ответа, и она определяется измерением увеличения отека уха после местной провокационной пробы с антигеном.
Используемые кислые олигосахариды (AcOl) с СП от 2 до 10 получали способом, описанным в WO 02/42484 (см. пример 1). Испытывали рационы, содержащие 1 мас.%, 2,5 мас.%, 5 мас.% и 10 мас.% AcOl на основе общей массы рациона. Смесь нейтральных олигосахаридов (GF), содержащую галактоолигосахариды (GOS)(Vivinal-GOSTM (Borculo Domo Ingredients, Netherlands) и фруктоолигосахариды (FOS) (Raftiline HPTM, Orafti, Tienen, Belgium), использовали при соотношении массы GOS:FOS 9:1. Испытывали рационы, содержащие 1, 2,5 и 5 мас.% GF на основе общей массы рациона. Эффекты комбинации кислых и нейтральных олигосахаридов (GF и ACOl) испытывали в рационе, содержащем 1 мас.% GF и 1 мас.% AcOl на основе общей массы рациона.
Все данные представлены в виде процентных долей относительно контрольных величин, т.е. относительные величины группы с добавлением олигосахаридов по сравнению с группой, получавшей контрольный рацион (без олигосахаридов).
Животные и рационы
Самки мышей C57B1/6 в возрасте 6 нед. (Harlan Nederland BV, Horst, the Netherlands) содержали группами в условиях регулярного режима света/темноты по 12 ч. Размер групп составлял 10 животных на группу и 3 животных в группах отрицательного контроля. Животным давали полусинтетический рацион (Research Diet Services, Wijk bij Duustede, the Netherlands). Контрольные рационы готовили в соответствии со спецификацией AIN93G (Reeves et al. (1993) Development and Testing of the AIN93 purified diets for rodents: results on growth kidney calcification and bone mineralisation in rats and mice. J Nutrition 123(11): 1923-31), рационы с добавлением олигосахаридов были основаны на этих спецификациях. Содержание углеводов в рационах с добавками поддерживали на постоянном уровне обменом общих углеводов на олигосахариды на основе массы. Отдельные углеводные компоненты были замещены соответственно их обычному соотношению в рационе. Углеводы в обычном рационе состоят из кукурузного крахмала (40% общей массы), декстринированного кукурузного крахмала (13,2%), сахарозы (10%) и целлюлозы (5%).
Протокол вакцинации
Вакцинацию начинали после периода 2-4 нед. адаптации к новым условиям содержания и рационам. В 0-й день (д) образец крови брали перед вакцинацией. На 1-й д первую вакцинацию проводили подкожно. После 3 нед. брали образец крови (21-й д), и проводили активную вакцинацию (22-й д). Через 9 д после инъекции повторной иммунизации (31-й д) исходную толщину уха измеряли наружным микрометром Digimatic (Mitutoyo, Veenedaal, the Netherlands), и реакцию гиперчувствительности замедленного типа (DTH) вызывали в/к (внутрикожной) инъекцией раствора антигена в ушные козелки. Через 24 ч (32-й д) измеряли реакцию DTH, брали образец крови, и мышей умерщвляли. Селезенки выделяли и препарировали для повторной стимуляции ex-vivo.
Вакцинации состояли из 100 мкл в/к (внутрикожных) инъекций смеси 1:1 раствора антигена и адъюванта Stimune (Specol, Cedi-diagnostics BV, Lelystad, th Netherlands). Раствор антигена представлял собой разведенную 1:100 гриппозную вакцину (Influvac) 2002/2003 (Solvay Pharamceuticals, Weesp, the Netherlands) в PBS. Influvac представляет собой трехвалентную белковую вакцину, содержащую 3×30 мкг/мл гемагглютинина трех различных штаммов вируса гриппа.
Для реакций DTH мышам в/к инъецировали 25 мкл диализированного Influvac в оба уха в качестве провокационной пробы DTH.
Клеточные культуры
Спленоциты выделяли из селезенок, используя сетчатые фильтры с мелкими ячеистыми отверстиями (Becton Dickinson, Erembodegem, Belgium). Эритроциты лизировали 5-минутной инкубацией на льду. После промывания культуральной средой без фенольного красного клетки подсчитывали (Coulter Counter, Beckman Coulter, the Netherlands) и держали на льду. Культуры устанавливали, используя 0,1 мкг/мл диализированного Influvac в качестве стимула. Клетки высевали в 96-луночные культуральные планшеты в количестве 1×106 клеток на лунку. Культуральная среда состояла из RPMI-1640 с буфером HEPES и 2 мМ L-глутамина (Invitrogen, Merelbeke, Belgium) с 10% фетальной телячьей сыворотки (FCS). Культуры инкубировали в течение 5 дней при 37°С при 5% СО2. Затем надосадочные жидкости собирали и замораживали при -80°С на время проведения до анализа. Пролиферацию клеток измеряли в параллельных культурах по включению3Н-тимидина, который добавляли к культурам в течение последних 18 ч в количестве 0,4 мкКи/лунку. Через 5 дней клетки собирали, используя коллектор клеток Filtermate (Perkin Elmer, Zaventem, Belgium), и подсчитывали на счетчике Micro-Beta (Perkin Elmer, Zaventem, Belgium). Радиоактивный распад измеряли в течение 1 мин на лунку, и количество импульсов в 1 мин (имп./мин) регистрировали как показатель скорости пролиферации.
Цитокины анализировали в надосадочных жидкостях культур, стимулированных Influvac. IL-2, IL-5, IL-10 и IFN-гамма измеряли, используя устройство Bio-Plex со смешанным на заказ набором шариков для упомянутых цитокинов (Bio-Rad, Veenendaal, the Netherlands). Цитокины измеряли в соответствии с инструкциями изготовителя. IL-4 измеряли методом ELISA, используя набор для определения мышиного IL-4 Pharmingen OptEIA (Becton Dickinson, Erembodegem, Belgium), в соответствии с инструкцией изготовителя.
Результаты
Реакция DTH на кислые олигосахариды
Рационы, содержащие дозировки 1 мас.%, 2,5 мас.% и 5 мас.% AcOl, вызывали статистически значимое увеличение реакции DTH, проявляя зависимое от дозы увеличение (см. таблицу 1). Наблюдавшийся эффект указывает на преимущество использования кислых олигосахаридов в способе согласно изобретению.
Реакция DTH на кислые и нейтральные олигосахариды
Комбинация 1 мас.% GF и 1 мас.% AcOl вызывала статистически значимое увеличение DTH (см. таблицу 2). Поскольку эффект значимо выше, чем реакции DTH от рационов, содержащих одни кислые или нейтральные олигосахариды, эти результаты указывают на синергический эффект, обеспечиваемый введением кислых и нейтральных олигосахаридов. Наблюдаемый эффект указывает на преимущество применения комбинации кислых и нейтральных олигосахаридов в данном способе.
Influvac-специфическая пролиферация, вызванная кислыми олигосахаридами
Применение рационов, содержащих 2,5 мас.% и 5 мас.% кислых олигосахаридов (AcOl), вызывало значимый снижающий эффект на специфическую для Influvac пролиферацию ex-vivo (см. таблицу 3). Наблюдаемый эффект указывает на преимущество использования кислых олигосахаридов в данном способе.
Influvac-специфическая пролиферация, вызванная комбинацией кислых и нейтральных олигосахаридов
Применение комбинации 1 мас.% GF и 1 мас.% AcOl вызвало значимый снижающий эффект на антиген-специфическую пролиферацию (см. таблицу 3). Поскольку эффект значимо улучшился в отношении реакций DTH от рационов, содержащих одни кислые или нейтральные олигосахариды, то эти результаты указывают на синергический эффект, обеспечиваемый введением кислых и нейтральных олигосахаридов. Наблюдаемый эффект указывает на преимущество использования комбинации кислых и нейтральных олигосахаридов в способе согласно изобретению. Сниженная пролиферация указывает на уменьшение Th2-ответа и эффект уравновешивания Th1/Th2, вызванные данным способом.
Баланс Th1/Th2: Профили цитокинов после введения кислых олигосахаридов
Профили цитокинов измеряли в надосадочных жидкостях культур influvac-специфических спленоцитов. Данные представлены в виде процентных долей относительно величин группы вакцинированного контроля (т.е. не получавшей олигосахариды). По сравнению с контролями, рационы, содержащие 2,5 мас.% и 5 мас.%, приводили к уменьшению цитокинов IL-4, IL-5 и IL-10, связанных с Th-2, в то время как уровень цитокина IL-2, связанного с Th-2, возрос, а IFN-γ значимо не снижался (см. таблицу 4). Эти результаты указывают на уравновешивающий Th1/Th2 эффект кислых олигосахаридов и указывает на преимущество использования кислых олигосахаридов в настоящем способе, например, для лечения и/или профилактики заболеваний с относительно низким иммунитетом Th1.
Баланс Th1/Th2: Профили цитокинов после введения кислых и нейтральных олигосахаридов
По сравнению с контролями, введение комбинации 1 мас.% GF и 1 мас.% AcOl привело к снижению уровней цитокинов IL-4, IL-5 и IL-10, связанных с Th-2, в то время как уровень цитокина IL-2, связанного с Th-2, возрос, а IFN-γ значимо не снижался (см. таблицу 4, где данные представлены в виде процентной доли относительно величин вакцинированной контрольной группы (т.е. не получавших олигосахариды)). Эти результаты указывают на уравновешивающий Th1/Th2 эффект комбинации кислых и нейтральных олигосахаридов и указывает на преимущество использования кислых олигосахаридов в настоящем способе, например, для лечения и/или профилактики заболеваний с относительно низким иммунитетом Th1. В частности, соотношение IL-4/IFN отражает баланс Th1/Th2. Другими словами, более низкое соотношение указывает на стимуляцию Th1 и/или ингибирование Th2, и в любом случае указывает на уравновешивающий Th1-Th2 эффект настоящих олигосахаридов.
Реферат
Изобретение относится к лекарственным средствам и касается применения кислого олигосахарида и нейтрального олигосахарида для изготовления композиции для лечения и/или предупреждения у млекопитающего расстройства, связанного с иммунной системой, содержащей терапевтически эффективное количество кислого олигосахарида и нейтрального олигосахарида, где кислый олигосахарид имеет среднюю степень полимеризации от 2 до 10 и получен из пектина или альгината; и нейтральный олигосахарид выбран из группы, состоящей из фруктоолигосахаридов, галактоолигосахаридов (трансгалактоолигосахаридов), и их смесей. Также раскрыты композиции для лечения и/или предупреждения у млекопитающего расстройства, связанного с иммунной системой. Композиции по изобретению позволяют синергически стимулировать иммунную систему, в частности, снижая Th2-ответ и повышая Th1-ответ. 4 н. и 9 з.п. ф-лы, 4 табл.
Формула
кислый олигосахарид имеет среднюю степень полимеризации от 2 до 10 и получен из пектина или альгината; и
нейтральный олигосахарид выбран из группы, состоящей из фруктоолигосахаридов, галактоолигосахаридов (трансгалактоолигосахаридов), и их смесей.
кислый олигосахарид имеет среднюю степень полимеризации от 2 до 10 и получен из пектина или альгината; и
нейтральный олигосахарид выбран из группы, состоящей из фруктоолигосахаридов, галактоолигосахаридов и их смесей.

Комментарии