Способ получения амида - SU1651786A3
Код документа: SU1651786A3
Описание
S))-CHj-- CH(NH-C/0/-Het) .. . СН2-0-С (О)



Реферат
Изобретение касается производства амидов гетероциклических веществ, в частности получения соединении общей I K4-CH2- CH(NH-C/0/-Het)-СН (.„ .ОН)-СН2-СН(.,)-С(0)-ШК,, где Неt-группа CJI CH-|Cli Cll-(M:-CHtCH-NRq. X или 5-С1; , С,С -алкил; R, С Co-циклоалкил; R С С -алкил, диметнлннннл, галоидвннил, шдрокси- -С С -алкил, R C Cg-алкил шш морфо линоэтил, проявляющих гипотенэив1тую активность, связанную со способностью ингибировать расщепление ангиотен- зииогена под действием ренина. Цель изобретения - создание новых более актив й х веществ указанного класса. Синтез дедут реакцией соединеш я

Формула
с амином III NH2R3 гДе Het, К,Кг см, выше, в среде низшего ал
канола при комнатной температуре и выделением целевого продукта в сво Изобретение относится к способу
получения новых простых амиДов индо- лas которые проявляют гипотензивную
активность у млекопитающих, в том числе и человека, связанную с их спо
собностыо ннгибировать расщепление ангиотензиногена под действием реннг на.
Цель изобретения « синтез новых амидных производных индола, проявляющих более эффективное ингибирова
СН2. CH-«-R2
бодном виде. Новые соединения прояв
ляют более эффективное ингибирование ренина, чем полипептиды. А табл.
С
ние ренина по сравнению с полипеп- гидами
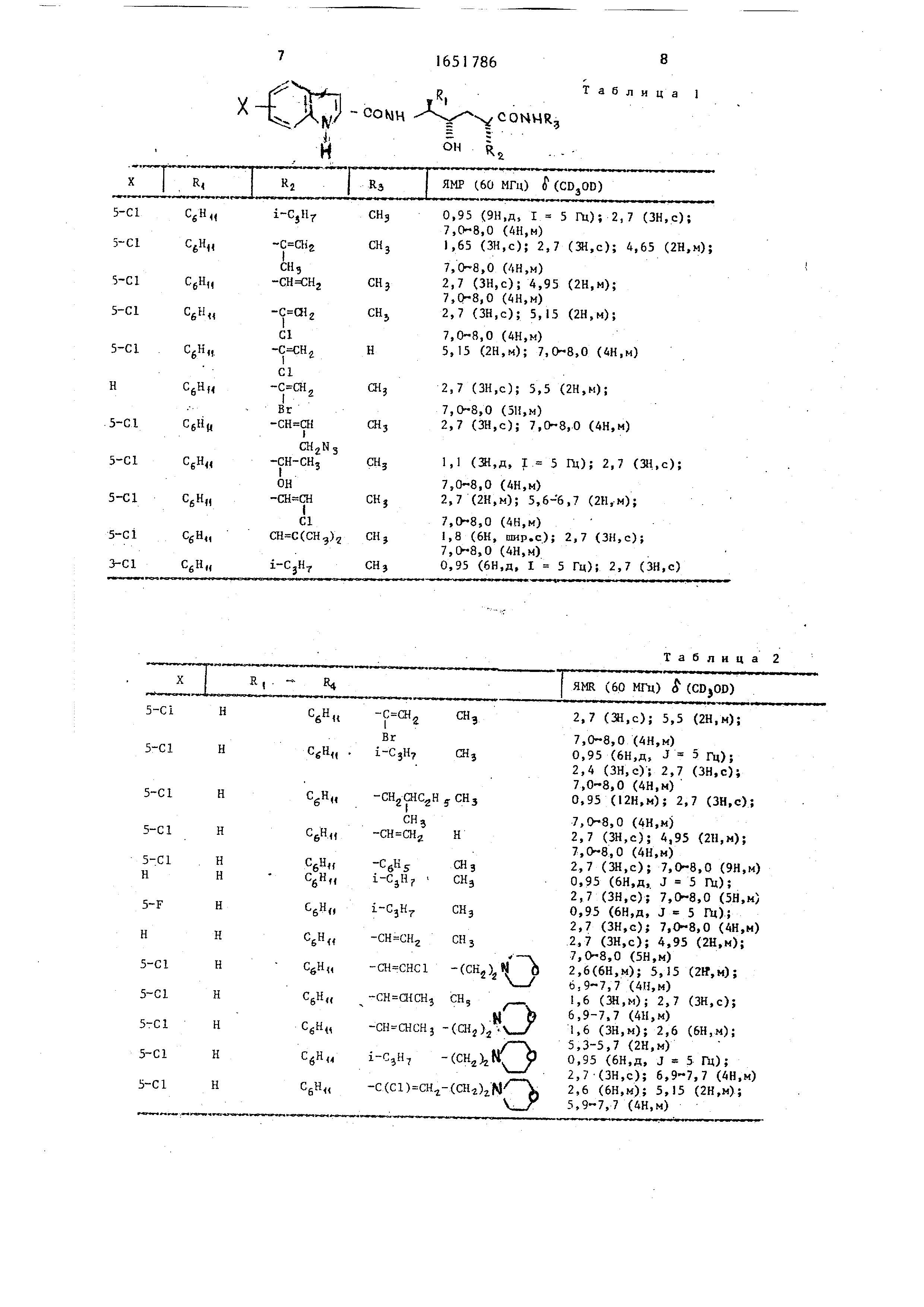
Пример I. 2R, 4S, логексил-5(5 хлориндол -2 -ил-кар- бониламино)4-гидрокси-2-(2 -хлор-
2/-пропенил)-№ метилгексамид (Het - 5-хлориндол-2-ил; R - циклогексил; R2 - С(С1)СН2 и Кг - СН3.
А. 2К,48,58-6-Циклогексил-5- (5 -хлориндол) -21 -ил-карбониламино)0
ел
V
оо
О5
ы
3
-2- (2 -хлор-2 пропенил )-) -гексацо-
лактон.
К 25, мл хлористого- метилена при прибавляют 165,5 мг (0,5 ммоль)
2R, 48,53-б-циклогексил-5-амино-2- (2 -хлор -2 -пропеншО Утексанолак- тона хлоргидрата, 50,6 мгt
(0,5 ммоль) N-метилморфолнна, 97,8 мг (0,5 ммоль) 5-хлориндол-2-
карбоновой кислоты, 67,5 мг (0,5 ммоль) Ытидроксибензотриазола И 103 мг (0,5 ммоль) дициклогексил-
карбодиимида, а затем полученную реакционную смесь перемешивают при комнатной температуре в течение ном
чи. Реакционную смесь фильтруют и фильтрат упаривают досуха Остаток перерастврряют в этилацетате, про
мыв агат последовательно водой, насьг щепным раствором бикарбоната натрия
и соляным раствором, а затем сушат н-ап сульфатом магния. Растворитель
удаляют, а остаток, 280 мг, хрома тографируют на силикагеле с исполь- зованием хлороформа в качестве
элюента и получают 226 мг целевого продукта
В. 2К,48,53 6-Циклогексил-5-
-(5 -хлориндол-2 ил карбониламичо) -4тидрокси 2 (2-- хлор-2- проленил) N-метил г е кс ан ами д
Раствор, содержащий 226 .мг про- дукта, полученного в примере А, в
10 мл метанола насыщают газом ме типамином с последующим выдерживани
реакционной смеси при комнатной тем пературе в течение 1,5 ч Реакцион
ную смесь упаривают досуха, а остат порошкуют простым эфиром с выходом 155 г требуемого продукта,
ЯМР-анализ (CDjOD) ft, м.д.: 2,7 (ЗН,с); 5,15 (2Н,м); 7,0-8,0 (4,Н,м
Пример 2.Используют мето- дику примера Аи В, в результате взаимодействия соответствующих исходных
реагентов получают соединени приведенные в табл, .
К 10 мл хлористого метилена при 0°С прибавляют 20 мг (0,1 ммоль)
З- хлориндол-З-карбо новой кислоты 30 мг (0,1 ммоль) 2R,48,58-6-цикло-
гексил-5-амино-2-(2 метилпропил)- -У гексанолактона хлоргидрата, 15 мкл (0,1 ммоль) диэтилового эфир
ци-чнофосфорной кислоты и 42 мкл (0,3 ммоль) триэтиламина0 Диметил-
формамид (1 мл) прибавляют к реакци
0 «j
0 5
Q
0
5
7864
ной смеси с последующим перемешива- нием при комнатной температуре в те
чение ночи. Реакционную смесь упаривают досуха и растворяют в этилаце-
тате с последующим промыванием последовательно водой (2 раза), насыщенным
бикарбонатом натрия (2 раза) и солевым раствором. Полученный раствор
сушат сульфатом натрия и упаривают до масла, 51 мг.
В. 2Е,48,53-6-Циклогексил-5-(5- -хлориндол -3 - ил-карбониламино)- 4-
тидрокси-2-(2 метилпропил)-Ы-ме- тилгексанамид
Раствор, содержащий продукт примера А, в 10 мл метанола насыщают
метиламином при комнатной температуре , а затем полученную реакционную
смесь перемешивают при комнатной температуре в течение 2:ча Затем
смесь упаривают с получением 61 мг пены, которую хроматографируют на
силикагеле с использованием в качестве элюента смеси метанол:хлороформ
Фракции, содержащие требуемый продукт, соединяют и концентрируют
с выходом 14 мг целевого продукта.
ЯМР-спектр (CD3OD), Ј, м.д.:
0,95 (6Н, д, J 5 ГЦ); 2,7 (ЗН,с); 7,0-8 (4Н,м).
Пример 4. При использовании
методики примера 3 в результате взаимодействия соответствующих исходных
реагентов получают следующие соединения, приведенные в табл. 2.
Пример 3. 2К,48,58-6-Цикло- гексил-5(5 -хлориндол-3 -ил-карбо- ниламино)-4-гидрокси-2-(2 -метил-
Пропил)- N-метилгексанамид (Het - 5 хлориндол- 3-ил; R, - циклогексил; RЈ - изопропил; R СН.
A. 2R,48,58-6-Циклогексил-5- -(З -хлориндОл-З -ил-карбониламино)-
-2-(2 -метилпропил)- -гексанолактон .
Способность предлагаемых соединений
действовать в качестве гипотензивных средств при ингибировании ренина можно видеть из следуюцего
теста, проведенного in vitro.
Ингибирование ангиотензиноген-
расщепляющей активности ренина in vitro.
Забор плазмы крови осуществляют
у здорового лабораторного персонала, которую затем соединяют и хранят пока
не потребуется в замороженном ви-
де.Перед использованием порцию плаз- №1 размораживают и центрифугируют, а
полученный супернатант смешивают с ингибиторами протеазы и буфферируют
до рН 7,4. Затем ингибиторы ренина, взятые в различных концентрациях,
прибавляют к отдельным аликвотам су пернатанта плазмы. Полученные смеси
(310 лямбда) инкубируют в течение 3 ч при 37°С вместе с контрольными
смесями, не содержащими ингибиторов ренина. После инкубации смеси быстро
охлаждают в ледяной воде, и каждый из образцов анализируют на выход ангиотензина 1 при использовании
антитела ангиотензина . Выход ан- гиотензина , полученный в присутствии
ингибиторов ренина, сравнивают с полученным без него и затем рассчи-
тывают степень ингибнрования. Исполь- зуя данные, полученные на основании
двойных инкубации каждого из тести руемых ингибиторов, взятых в различных концентрациях, рассчитывают
концентрацию ингибитора в инкубационной смеси, необходимую для получения
50% ингибирования ангиотензиноген- расщепляющего действия ренина для
каждого из испытуемых ингибиторов.
Ангиотензин 1 в охлажденных инку
бационных смесях проверяют радиоиммунным анализом с использованием компонентов
из комплекта для проведения радиоиммуного анализа ренина, поставляемого фирмой hecton Dickinson and
Со (Orangeburg, N.Y.).
В табл.4 представлены данные, характеризующие
ингибирование соединениями человеческого ренина, выраженные в виде значений
цектрации препарата, ингибирования 50%.
Стандартом, используемым для сравнения
, является пепстатин, который имеет величину 1С5о Ю мкМ. Соединения
.получаемые по изобретению и пред- ставляющие собой простые ацелирован-
ные аминокислотные производные, в противоположность полипептидам обнаруживают значительное улучшение.
1С50, т.е. кон- требуемой для
Формула изобретения
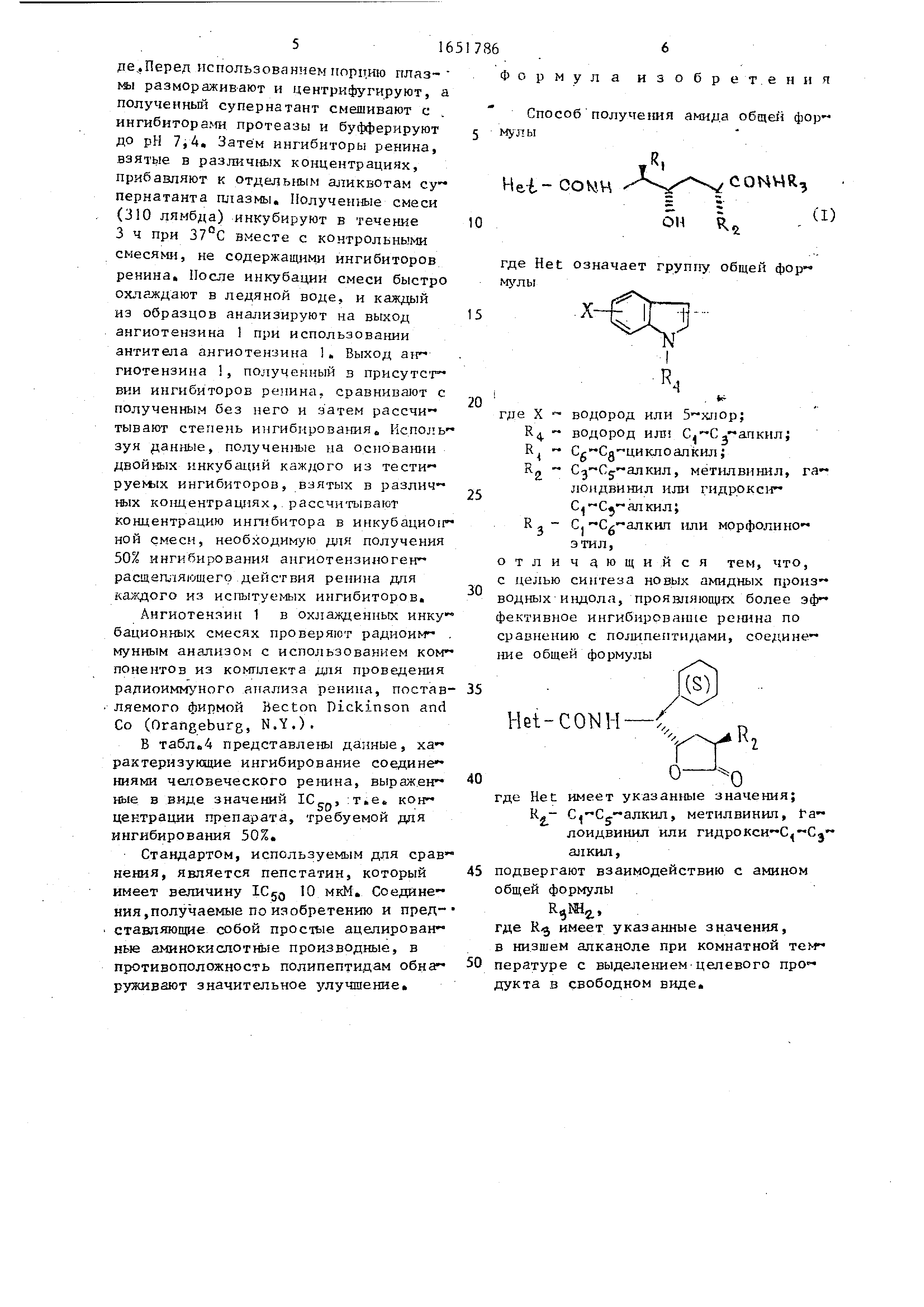
Способ получения амида общей формулы
.R,
Hei- 00 ЬЖ
м
COHWR,
10
ОН
(I)
где Het означает группу общей формулы
15
5
0
где X - водород или 5-хлор;
Кл. - водород или С -С V ал кил;
Cg-Сд циклоалкил;
С -С -алкил, метилвинил, галоидвинил или гидрокси-
С С}-ал кил;
С.-Cg-алкил или морфолиноэтил ,
ч а. ю щ и и с я тем, что,
синтеза новых амидных производных
индола, проявляющих более эффективное ингибирование ренина по
сравнению с полипептидами, соединение общей формулы
R4 -
R2
R3
о т л и
с целью
35
Het-С ON H
40
о-
о
где Het имеет указанные значения;
К.- C -Cj-алкил, метилвинил, га-
лоидвинил или гидрокси-С -Сдал кил,
подвергают взаимодействию с амином
общей формулы
R61%,
где R-J имеет указанные значения, в низшем алканоле при комнатной тем-
пературе с выделением целевого продукта в свободном виде.
Таблица



Комментарии