Замещенные индолы - RU2255087C2
Код документа: RU2255087C2
Описание
Изобретение относится к новым замещенным индолам, способу их получения и их применению в качестве лекарственных средств.
В заявке WO 94/12478 среди прочих описываются производные индола, ингибирующие агрегацию тромбоцитов. В заявке WO 94/08962 описываются антагонисты рецептора фибриногена, которые ингибируют связывание фибриногена и агрегацию тромбоцитов.
NFkB является гетеродимерным фактором транскрипции, который может активировать большое количество генов, кодирующих, среди прочих, провоспалительные цитокины, такие как IL-1, IL-2, TNFα или IL-6. NFkB находится в цитозоле клеток, комплексуясь с его встречающимся в природе ингибитором IkB. Стимуляция клеток, например, посредством цитокинов, приводит к фосфорилированию и последующему протеолитическому расщеплению IkB. Это протеолитическое расщепление ведет к активации NFkB, который затем переходит в ядро клетки и там активирует большое количество провоспалительных генов.
При заболеваниях, таких как ревматический артрит (при воспалении), остеоартрит, астма, инфаркт миокарда, болезни Альцгеймера или атеросклероз, NFkB является активизированным сверх нормы. Торможение NFkB является также полезным при лечении рака, так как оно используется там для усиления лечения цитостатиками. Было показано, что лекарственные средства, такие как глюкокортикоиды, салицилаты или соли золота, которые используются при лечении ревматизма, ингибируя, встраиваются в различные положения сигнальной цепи, активирующей NFkB, или непосредственно интерферируют с транскрипцией генов.
Первым этапом в названных сигнальных каскадах является расщепление IkB. Это фосфорилирование регулируется специфической IkB-киназой. До сих пор не известны ингибиторы, ингибирующие специфическую IkB-киназу.
С целью получения эффективных соединений для лечения ревматического артрита (при воспалении), остеоартрита, астмы, инфаркта миокарда, болезней Альцгеймера, раковых заболеваний (потенцирование цитотоксической терапии) или атеросклероза, было показано, что производные индола согласно изобретению являются сильными и очень специфичными ингибиторами IkB-киназы.
Таким образом, изобретение касается соединения формулы I

и/или стереоизомерной формы соединения формулы I, и/или физиологически приемлемой соли соединения формулы I, причем один из заместителей R1, R2, R3 и R4 обозначает остаток формулы II,

где D обозначает -С(О)-, -S(O)- или -S(O)2-,
R7 обозначает атом водорода или -(C1-C4)-алкил,
R8 обозначает R9 или характеристический остаток аминокислоты,
R9 обозначает
1. арил, где арил является незамещенным или замещенным,
2. гетероарил с 5 до 14 членов в кольце, где гетероарил является незамещенным или замещенным,
3. гетероцикл с 5 до 12 членов в кольце, где гетероцикл является незамещенным или замещенным, или
4. -(C1-С6)-алкил, где алкил является неразветвленным или разветвленным и незамещенным, или, независимо друг от друга, одно-, двух- или трехкратно замещенным
4.1 арилом, где арил является незамещенным или замещенным,
4.2 гетероарилом с 5 до 14 членов в кольце, где гетероарил является незамещенным или замещенным,
4.3 гетероциклом с 5 до 12 членов в кольце, где гетероцикл является незамещенным или замещенным,
4.4 -O-R10,
4.5 =O,
4.6 галогеном,
4.7 -CN,
4.8 –СF3,
4.9 -S(O)x -R10, где х является целым числом ноль, 1 или 2,
4.10 -C(O)-O-R10,
4.11 –C(O)-N(R10)2,
4.12 –N(R10 )2,
4.13 -(С3-С6)-циклоалкилом,
4.14 остатком формулы

или
4.15 остатком формулы
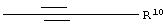
R10 обозначает а) атом водорода,
b) -(C1-C6)-алкил, где алкил является незамещеным или, независимо друг от друга, от одно- до трехкратно замещенным
1 арилом
2 гетероарилом с 5 до 14 членов в кольце,
3 гетероциклом с 5 до 12 членов в кольце,
4 галогеном,
5 -N-(С1-С6)n-алкилом, где n обозначает целое число ноль, 1 или 2, и алкил незамещен или, независимо друг от друга, одно-, двух- или трехкратно замещен галогеном или -С(О)-ОН, или
6 -С(О)-ОН
c) арил,
d) гетероарил с 5 до 14 членов в кольце,
e) гетероцикл с 5 до 12 членов в кольце, и для случая (R10)2
R10 имеет значения, независимо друг от друга, от а) до е),
Z обозначает
1. арил, где арил является незамещенным или замещенным,
2. гетероарил с 5 до 14 членов в кольце, где гетероарил является незамещенным или замещенным,
3. гетероцикл с 5 до 12 членов в кольце, где гетероцикл является незамещенным или замещенным, или
4. -C-(O)-R11, где
R11 обозначает
1. -O-R10 или
2. -N(R10)2, или
R7 и R8 образуют вместе с атомом азота и атомом углерода, с которым они, в случае необходимости, связаны, гетероциклическое кольцо формулы IIа,

где D, Z и R11 имеют значения как в формуле II,
А обозначает атом азота или остаток –СН2-,
В обозначает атом кислорода, атом серы, атом азота или остаток –СН2-,
Х обозначает атом кислорода, атом серы, атом азота или остаток –СН2-,
Y обозначает атом кислорода, атом серы, атом азота или остаток –CH2-, или
Х и Y вместе образуют остаток фенила, 1,2-диазина, 1, 3-диазина или 1,4-диазина,
причем циклическая система, образованная посредством N, А, X, Y, В и атома углерода, содержит не более одного атома кислорода, Х не является атомом кислорода, атомом серы или атомом азота, если А является атомом азота, содержит не более одного атома серы, содержит 1, 2, 3 или 4 атома азота и причем одновременно не присутствуют атом кислорода и атом серы, причем циклическая система, образованная посредством N, А, X, Y, В и атома углерода, является незамещенной или, независимо друг от друга, от одно- до трехкратно замещенной-(C1-C8 )-алкилом, незамещенным или от одно- до двукратно замещенным
1.1 -ОН,
1.2 -(C1-C8)-алкокси-группой,
1.3 галогеном,
1.4 –NO2,
1.5 –NH2,
1.6 –СF3,
1.7 метилендиокси-группой,
1.8 -С(O)-СН3,
1.9 -СН(O),
1.10 -CN,
1.11 -С(О)-ОН,
1.12 -C(O)-NH2,
1.13 -(C1-C4)-алкоксикарбонилом,
1.14 фенилом,
1.15 фенокси-группой,
1.16 бензилом,
1.17 бензилокси-группой или
1.18 тетразолилом, или
1.19 -ОН
R8 и Z образуют вместе с атомами углерода, с которыми они, в случае необходимости, связаны, гетероциклическое кольцо формулы IIс,

где D, R7 и R10 имеют значения как в формуле II,
Т обозначает атом кислорода, атом серы, атом азота или остаток –СН2-,
W обозначает атом кислорода, атом серы, атом азота или остаток –СН2-,
V отсутствует или обозначает атом кислорода, атом серы, атом азота или остаток –СН2-, или
Т и V или V и W вместе образуют фенильный остаток, остаток 1,2-диазина, 1,3-диазина или 1,4-диазина, причем циклическая система, образованная посредством N, Т, V, W и двух атомов углерода, содержит не более одного атома кислорода, не более одного атома серы, и 1, 2, 3 или 4 атома азота, причем одновременно не присутствуют атом кислорода и атом серы, и причем циклическая система, образованная посредством N, Т, V, W и двух атомов углерода, является незамещенной или, независимо друг от друга, от одно- до трехкратно замещенной заместителями, определенными выше под п.1.1 до 1.18 и, в случае необходимости, другие заместители R1, R2, R3 и R4, независимо друг от друга, обозначают
1. атом водорода,
2. галоген,
3. арил, где арил является незамещенным или замещенным,
4. гетероарил с 5 до 14 членов в кольце, где гетероарил является незамещенным или замещенным,
5. гетероцикл с 5 до 12 членов в кольце, где гетероцикл является незамещенным или замещенным,
6. -(C1-С6 )-алкил,
7. -CN,
8. -O-R10,
9. –N(R10)2,
10. -S(O)x-R10, где х является целым числом ноль, 1 или 2, или
11. –CF3,
R5 обозначает
1. атом водорода,
2. -ОН или
3. =O, и
R6 обозначает
1. арил, где арил является незамещенным или замещенным,
2. гетероарил с 5 до 14 членов в кольце, где гетероарил является незамещенным или от одно- до трехкратно замещенным, или
3. гетероцикл с 5 до 12 членов в кольце, где гетероцикл является незамещенным или от одно- до трехкратно замещенным.
Предпочтительным является соединение формулы I, причем один из заместителей R1, R2, R3 и R4 обозначает остаток формулы II, где
D обозначает -С(О)-,
R7 обозначает атом водорода или -(C1-C4)-алкил,
R8 обозначает
1. -(C1-C4 )-алкил, где алкил является неразветвленным или разветвленным и, независимо друг от друга, одно- или двукратно замещенным
1.1 гетероарилом с 5 до 14 членов в кольце, где гетероарил является незамещенным или замещенным,
1.2 гетероциклом с 5 до 12 членов в кольце, где гетероцикл является незамещенным или замещенным,
1.3 -O-R10
1.4 -S(O)x-R10, где х является целым числом ноль, 1 или 2,
1.5 –N(R10)2,
1.6 остатком формулы

или
1.7 остатком формулы

или
2. характерный остаток аминокислоты,
R9 обозначает
1. R8,
2. -(C1-C4)-алкил, где алкил является неразветвленным или разветвленным и, независимо друг от друга, одно-, двух- или трехкратно замещенным
2.1 арилом, где арил является незамещенным или замещенным,
2.2 галогеном,
2.3 -CN или
2.4 –СF3, или
3. арил, где арил является незамещенным или замещенным,
R10 обозначает а) атом водорода,
b) -(C1-C6)-алкил, где алкил является незамещеным или, независимо друг от друга, от одно- до трехкратно замещенным
1. арилом
2. гетероарилом с 5 до 14 членов в кольце,
3. гетероциклом с 5 до 12 членов в кольце,
4. галогеном,
5. -N-(С1-С6)n-алкилом, где n обозначает целое число ноль, 1 или 2, и алкил незамещен или, независимо друг от друга, одно-, двух- или трехкратно замещен галогеном или -С(O)-ОН, или
6. -С(О)-ОН,
с) арил,
d) гетероарил с 5 до 14 членов в кольце,
е) гетероцикл с 5 до 12 членов в кольце, и для случая (R10)2
R10 имеет значение, независимо друг от друга, от а) до е),
Z обозначает
1. 1,3, 4-оксадиазол, где 1,3,4-оксадиазол является незамещенным или от одно- до трехкратно замещенным –NH2, -ОН или -(C1-C4)-алкилом, или
2. -C(O)-R11, где
R11 обозначает
1. -O-R10 или
2. –N(R10)2,
R7 и R8 образуют вместе с атомом азота и углерода, с которым они, в случае необходимости, связаны, цикл формулы IIа из группы: пиррол, пирролин, индол, пирролидин, пиридин, пиперидин, пиперилен, пиридазин, пиримидин, пиразин, пиперазин, пиразол, имидазол, пиразолин, имидазолин, пиразолидин, имидазолидин, оксазол, пурин, изоксазол, 2-изоксазолидин, изоксазолидин, морфолин, изотиазол, тиазол, тиадиазол, бензимидазол, тиоморфолин, изотиазолидин, индазол, хинолин, триазол, фталазин, хиназолин, хиноксалин, птеридин, тетрагидрохинолин, изохинолин, 1,2,3,5-оксатиадиазол-2-оксиды, тетразол, оксадиазолоны, изоксазолоны, триазолоны, оксадиазолидиндионы, триазолы, которые замещены F, -CN, -СF3 или -С(О)-О-(C1-C4)-алкилом, 3-гидроксипирро-2,4-дионы, 5-оксо-1, 2,4-тиадиазолы и тетрагидроизохинолин, или
R8 и Z образуют вместе с атомами углерода, с которыми они, в случае необходимости, связаны, цикл формулы IIс из группы: пиррол, пирролин, пирролидин, пиридин, пиперидин, пиперилен, пиридазин, пиримидин, пиразин, пиперазин, пиразол, имидазол, пиразолин, 1,3,4-оксадиазол, имидазолин, пиразолидин, имидазолидин, оксазол, изоксазол, 2-изоксазолидин, изоксазолидин, морфолин, изотиазол, тиазол, изотиазолидин, тетразол, тиоморфолин, индазол, тиадиазол, бензимидазол, хинолин, триазол, фталазин, хиназолин, хиноксалин, пурин, птеридин, индол, тетрагидрохинолин, триазолоны, тетрагидроизохинолин, 1,2,3,5-оксатиадиазол-2-оксиды, оксадиазолоны, изоксазолоны, оксадиазолидиндионы, триазолы, которые замещены F, -CN, -CF3 или -С(О)-О-(С1-С4)-алкилом, 3-гидроксипирро-2,4-дионы, 5-оксо-1,2,4-тиадиазолы и изохинолин, и, в случае необходимости, другие заместители R1, R2, R3 и R4, независимо друг от друга, обозначают
1. атом водорода,
2. галоген,
3. арил, где арил является незамещенным или замещенным,
4. гетероарил с 5 до 14 членов в кольце, где гетероарил является незамещенным или замещенным,
5. гетероцикл с 5 до 12 членов в кольце, где гетероцикл является незамещенным или замещенным,
6. -(С1-С6)-алкил,
7. -CN,
8. –CF3,
9. -OR10,
10. –N(R10)2 или
11. -S(O)x-R10, где х является целым числом ноль, 1 или 2,
R5 обозначает атом водорода и
R6 обозначает
1. фенил, независимо друг от друга, одно- или двукратно замещенный
1.1 -CN,
1.2 –CF3,
1.3 галогеном,
1.4 -O-R10,
1.5 –N(R10)2,
1.6 -NH-C(O)-R11,
1.7 -S(O)x-R10, где х является целым числом ноль, 1 или 2,
1.8 C(O)-R11 или
1.9 -(C1-C4)-алкил-NН2,
2. гетероарил с 5 до 14 членов в кольце, где гетероарил является незамещенным или, независимо друг от друга, одно-, двух- или трехкратно замещенным заместителями, определенными выше под п.1.1 до 1.9 или
3. гетероцикл с 5 до 12 членов в кольце, где гетероцикл является незамещенным или, независимо друг от друга, одно-, двух- или трехкратно замещенным заместителями, определенными выше под п.1.1 до 1.9.
Особенно предпочтительно соединение формулы I, причем один из заместителей R1, R2, R3 и R4 обозначает остаток формулы II, где
D обозначает -С(О)-,
R7 обозначает атом водорода,
Z обозначает -С(О)-ОН или -C(O)-NH2,
R8 обозначает
1. -(C1-C4)-алкил, где алкил является неразветвленным или разветвленным и, независимо друг от друга, одно- или двукратно замещенным
1.1 -S(O)-R10, причем R10 имеет вышеуказанное значение,
1.2 –N(R10)2, причем R10 имеет вышеуказанное значение, или
1.3 пиррол, или
2. характерный остаток аминокислоты, R10 обозначает а) атом водорода,
b) -(C1-C6)-алкил, где алкил является незамещенным или, независимо друг от друга, от одно- до трехкратно замещенным галогеном,
с) фенил, где фенил является незамещенным или, независимо друг от друга, от одно- до трехкратно замещенным галогеном или -(C1 -C4)-алкилом, для случая (R10)2 имеет R10, независимо друг от друга, значение от а) до с),
в случае необходимости, другие заместители R1, R2, R3 и R4 обозначают атом водорода,
R5 обозначает атом водорода,
R6 обозначает фенил или пиридин, и
R9 обозначает
1. атом водорода
2. -(С1-С4)-алкил, где алкил является неразветвленным или разветвленным и, независимо друг от друга, одно-, двух- или трехкратно замещенным -С(О)-ОН, -ОН или
-C(O)-NH2, или
3. фенил, где фенил является незамещенным или, независимо друг от друга, от одно- до трехкратно замещенным галогеном или -(C1-C4)-алкилом.
Под понятием “галоген” имеют в виду фтор, хлор, бром или иод.
Под понятиями “-(C1-C8)-алкил”, “-(C1-С6)-алкил” или “-(C1-C4)-алкил” имеют в виду углеводородные остатки, углеродные цепи которых являются неразветвленными или разветвленными и содержат от 1 до 8, от 1 до 6 или от 1 до 4 атомов углерода. Циклические алкильные остатки являются, например, от 3- до 6-членными моноциклами, как циклопропил, циклобутил, циклопентил или циклогексил.
Под определением “R7 и R8 образуют вместе с атомом азота и атомом углерода, с которым они, по мере необходимости, связаны, гетероциклическое кольцо формулы IIа” имеют в виду остатки, которые образуются из пиррола, пирролина, пирролидина, имидазола, пиразола, оксазола, изоксазола, тетразола, изоксазолина, изоксазолидина, морфолина, тиазола, изотиазола, изотиазолина, пурина, изотиазолидина, тиоморфолина, пиридина, пиперидина, пиразина, пиперазина, пиримидина, пиридазина, индола, изоиндола, индазола, бензимидазола, фталазина, хинолина, изохинолина, хиноксалина, хиназолина, циннолина, птеридина, триазолонов, тетразола, 1,2,3, 5-оксатиадиазол-2-оксидов, оксадиазолонов, изоксазолонов, оксадиазолидиндионов, триазолов, замещенных F, -CN, -СF3 или -С(О)-О-(C1-C4)-алкилом, 3-гидроксипирро-2, 4-дионов, 5-oкco-1,2,4-тиадиазолов, имидазолидина, -карболина и бензанеллированных производных этих гетероциклов.
Под понятием “арил” понимают ароматические углеродные остатки с 6-14 атомами углерода в кольце. Арильные остатки -(С6-С14) обозначают, например, фенил, нафтил, например, 1-нафтил, 2-нафтил, бифенилил, например, 2-бифенилил, 3-бифенилил и 4-бифенилил, антрил или флуоренил. Бифенилильные остатки, нафтильные остатки и, особенно, фенильные остатки являются, предпочтительно, арильными остатками. Арильные остатки, особенно фенильные остатки, однократно или многократно, предпочтительно однократно, двукратно или трехкратно могут быть замещены одинаковыми или разными остатками, предпочтительно остатками из ряда: -(C1 -C8)-алкил, особенно -(C1-C4)-алкил, -(C1-C8 )-алкокси-группа, особенно -(C1-C4)-алкокси-группа, галоген, нитро-группа, амино-группа, трифторметил, гидроксил, гидрокси-(C1-C4)-алкил, как гидроксиметил или 1-гидроксиэтил, или 2-гидроксиэтил, метилендиокси-группа, этилендиокси-группа, формил, ацетил, циано-группа, гидроксикарбонил, аминокарбонил, -(C1-C4)-алкоксикарбонил, фенил, фенокси-группа, бензил, бензилокси-группа, тетразолил. Соответственно, к ним относятся, например, такие остатки, как арилалкил или арилкарбонил. Арилалкильные остатки обозначают, особенно, бензил, а также 1- и 2-нафтилметил, 2-, 3- и 4-бифенилилметил и 9-флуоренилметил. Замещенные арилалкильные остатки обозначают, например, замещенные в арильной части одним или несколькими -(C1-С8)-алкильными остатками, особенно -(C1-C4)-алкильными остатками, бензильные остатки и нафтилметильные остатки, например, 2-, 3- и 4-метилбензил, 4-изобутилбензил, 4-трет.-бутилбензил, 4-октилбензил, 3,5-диметилбензил, пентаметилбензил, 2-, 3-, 4-, 5-, 6-, 7- и 8-метил-1-нафтилметил, 1-, 3, 4-, 5-, 6-, 7- и 8-метил-2-нафтилметил, замещенные в арильной части одним или несколькими -(C1-C8)-остатками алкокси-группы, особенно -(C1-C4)-остатками алкокси-группы, бензильные остатки и нафтилметильные остатки, например, 4-метоксибензил, 4-неопентилоксибензил, 3,5-диметоксибензил, 3,4-метилен-диоксибензил, 2,3,4-триметоксибензил, нитробензильные остатки, например, 2-, 3- и 4-нитробензил, замещенные галогеном бензильные остатки, например, 2-, 3- и 4-хлор- и 2-, 3- и 4-фторбензил, 3,4-дихлорбензил, пентафторбензил, трифторметил-бензильные остатки, например, 3- и 4-трифторметилбензил или 3, 5-бис(трифторметил)бензил.
В монозамещенных фенильных остатках заместитель может находиться в положении 2, положении 3 или положении 4. Двукратно замещенный фенил может быть замещен в положении 2,3, положении 2,4, положении 2,5, положении 2,6, положении 3,4 или в положении 3,5. В трехкратно замещенных фенильных остатках заместители могут находиться в положении 2,3,4, положении 2,3, 5, положении 2,4,5, положении 2,4,6, положении 2,3,6 или в положении 3,4,5.
Пояснения к арильным остаткам относятся, соответственно, к двухвалентным ариленовым остаткам, например к фениленовым остаткам, которые могут присутствовать, например, в виде 1,4-фенилена или в виде 1, 3-фенилена.
Фенилен-(C1-C6)-алкил представляет собой, в особенности, фениленметил (-С6Н4-СН2-) и фениленэтил, (C1 -C6)-алкилен-фенил представляет собой, в особенности, метиленфенил (-СН2-С6 H4). Фенилен-(С2-С6)-алкенил представляет собой, в особенности, фениленэтенил и фениленпропенил.
Понятие “гетероарил с 5 до 14 членов в кольце” обозначает остаток одной моноциклической или полициклической ароматической системы с 5 до 14 членами в кольце, содержащей 1, 2, 3, 4 или 5 гетероатомов в качестве членов в кольце. Примерами гетероатомов являются N, О и S. Если содержатся несколько гетероатомов, они могут быть одинаковыми или разными. Гетероарильные остатки также могут быть замещены однократно или многократно, предпочтительно однократно, двукратно или трехкратно одинаковыми или разными остатками из ряда: -(C1-C8)-алкил, особенно -(C1-C4)-алкил, -(С1 -С8)-алкокси-группа, особенно -(C1-C4)-алкокси-группа, галоген, нитро-группа, -N(R10)2-группа, трифторметил, гидроксил, гидрокси-(C1 -C4)-алкил, как гидроксиметил или 1-гидроксиэтил, или 2-гидроксиэтил, метилендиокси-группа, формил, ацетил, циано-группа, гидроксикарбонил, аминокарбонил, -(C1-C4 )-алкоксикарбонил, фенил, фенокси-группа, бензил, бензилокси-группа, тетразолил. Предпочтительно гетероарил с 5 до 14 членами в кольце обозначает моноциклический или бициклический ароматический остаток, который содержит 1, 2, 3 или 4, особенно 1, 2 или 3 одинаковых или разных гетероатомов из ряда N, О и S, и который может быть замещен 1, 2, 3 или 4, особенно от 1 до 3, одинаковыми или разными заместителями из ряда: -(C1-С6)-алкил, -(C1 -С6)-алкокси-группа, фтор, хлор, нитро-группа, -N(R10)2-группа, трифторметил, гидроксил, гидрокси-(C1-C4)-алкил, -(C1-C4 )-алкоксикарбонил, фенил, фенокси-группа, бензилокси-группа и бензил. Особенно предпочтительно гетероарил обозначает моноциклический или бициклический ароматический остаток с 5 до 10 членами в кольце, особенно 5-членный или 6-членный моноциклический ароматический остаток, который содержит 1, 2 или 3, особенно 1 или 2, одинаковых или разных гетероатома из ряда N, О и S, и который может быть замещен 1 или 2 одинаковыми или разными заместителями из ряда: -(C1-C4)-алкил, галоген, гидроксил, -N(R10)2-группа, -(C1-C4 )-алкокси-группа, фенил, фенокси-группа, бензилокси-группа и бензил.
Понятие “гетероцикл с 5 до 12 членов в кольце” обозначает моноциклический или бициклический 5-членный - 12-членный гетероцикл, частично или полностью насыщенный. Примерами гетероатомов являются N, О и S. Гетероцикл является незамещенным или замещенным по одному или нескольким углеродным атомам, или по одному или нескольким гетероатомам, одинаковыми или разными заместителями. Эти заместители были определены выше для остатка гетероарила. В особенности гетероцикл замещен однократно или многократно, например, однократно, двукратно, трехкратно или многократно, по углеродным атомам одинаковыми или разными остатками из ряда: -(С1-С8)-алкил, например, -(C1-C4)-алкил, -(C1-С8)-алкокси-группа, например, -(C1-C4)-алкокси-группа, как метокси-группа, фенил-(C1-C4)-алкокси-группа, например, бензилокси-группа, гидроксил, оксо-группа, галоген, нитро-группа, амино-группа или трифторметил, и/или замещен по атому(ам) азота в гетероцикле-(C1-C8)-алкилом, например, -(C1-C4)-алкилом как метил или этил, в случае необходимости, замещенным фенилом или фенил-(C1-C4)-алкилом, например, бензилом.
Азотсодержащие гетероциклы могут также представлять собой N-оксиды или четвертичные соли.
Примерами понятий “гетероарил с 5 до 14 членов в кольце” или “гетероцикл с 5 до 12 членов в кольце” являются остатки, образованные от пиррола, фурана, тиофена, имидазола, пиразола, оксазола, изоксазола, тиазола, изотиазола, тетразола, 1,2,3,5-оксатиадиазол-2-оксидов, триазолонов, оксадиазолонов, изоксазолонов, оксадиазолидиндионов, триазолов, которые замещены F, CN, -СF3 или -С(О)-О-(C1 -C4)-алкилом, 3-гидроксипирро-2,4-дионов, 5-оксо-1,2, 4-тиадиазолов, пиридина, пиразина, пиримидина, индола, изоиндола, индазола, фталазина, хинолина, изохинолина, хиноксалина, хиназолина, циннолина, -карболина и бензанеллированных, циклопента-, циклогекса- или циклогепта-анеллированных производных этих гетероциклов. Особенно предпочтительны остатки: 2- или 3-пирролил, фенилпирролил, как 4- или 5-фенил-2-пирролил, 2-фурил, 2-тиенил, 4-имидазолил, метил-имидазолил, например 1-метил-2-, -4-или -5-имидазолил, 1,3-тиазол-2-ил, 2-пиридил, 3-пиридил, 4-пиридил, 2-, 3- или 4-пиридил-N-оксид, 2-пиразинил, 2-, 4- или 5-пиримидинил, 2-, 3- или 5-индолил, замещенный 2-индолил, например, 1-метил-, 5-метил-, 5-метокси-, 5-бензилокси-, 5-хлор- или 4,5-диметил-2-индолил, 1-бензил-2- или -3-индолил, 4,5,6,7-тетрагидро-2-индолил, циклогепта[b]-5-пирролил, 2-, 3- или 4-хинолил, 1-, 3- или 4-изохинолил, 1-оксо-1,2-дигидро-3-изохинолил, 2-хиноксалинил, 2-бензофуранил, 2-бензотиенил, 2-бензоксазолил или бензотиазолил, или дигидропиридинил, пирролидинил, например 2- или 3-(N-метилпирролидинил), пиперазинил, морфолинил, тиоморфолинил, тетрагидротиенил или бензодиоксоланил.
Общая структурная формула α-аминокислот следующая:

α-Аминокислоты отличаются друг от друга остатком R, который согласно изобретению обозначен как “характерный остаток” аминокислоты.
В случае, когда R8 обозначает характерный остаток аминокислоты, предпочтительно используются остатки следующих встречающихся в природе α-аминокислот: глицин, аланин, валин, лейцин, изолейцин, фенилаланин, тирозин, триптофан, серин, треонин, цистеин, метионин, аспарагин, глутамин, лизин, гистидин, аргинин, глутаминовая кислота и аспарагиновая кислота. Особенно предпочтительными являются гистидин, триптофан, серин, треонин, цистеин, метионин, аспарагин, глутамин, лизин, аргинин, глутаминовая кислота и аспарагиновая кислота. Далее, также предпочтительными являются характерные остатки аминокислоты, которые используются в качестве остатка R8, не встречающихся в природе аминокислот, таких как 2-аминоадипиновая кислота, 2-аминомасляная кислота, 2-аминоизомасляная кислота, 2,3-диаминопропионовая кислота, 2,4-диаминомасляная кислота, 1,2,3, 4-тетрагидроизохинолин-1-карбоновая кислота, 1,2,3,4-тетрагидроизохинолин-3-карбоновая кислота, 2-аминопимелиновая кислота, фенилглицин, 3-(2-тиенил)-аланин, 3-(3-тиенил)-аланин, 2-(2-тиенил)-глицин, 2-аминогептановая кислота, пипеколиновая кислота, гидроксилизин, саркозин, N-метилизолейцин, 6-N-метиллизин, N-метилвалин, норвалин, норлейцин, орнитин, алло-изолейцин, алло-треонин, алло-гидроксилизин, 4-гидроксипролин, 3-гидроксипролин, 3-(2-нафтил)-аланин, 3-(1-нафтил-аланин), гомофенилаланин, гомоцистеин, гомоцистеиновая кислота, гомотриптофан, цистеиновая кислота, 3-(2-пиридил)-аланин, 3-(3-пиридил)-аланин, 3-(4-пиридил)-аланин, 2-амино-3-фениламинопропионовая кислота, 2-амино-3-фениламиноэтилпропионовая кислота, фосфинотрицин, 4-фторфенилаланин, 3-фторфенилаланин, 4-фторфенилаланин, 3-фторфенилаланин, 3-фторфенилаланин, 2-фторфенилаланин, 4-хлорфенилаланин, 4-нитрофенилаланин, 4-аминофенилаланин, циклогексилаланин, цитруллин, 5-фтортриптофан, 5-метокситриптофан, метионин-сульфон, метионин-сульфоксид или –NH-NR10-С(O)N(R10)2, которые, в случае необходимости, также являются замещенными. У природных, а также у не встречающихся в природе аминокислот, имеющих такие функциональные группы, как амино-группа, гидроксильная группа, карбоксильная группа, меркапто-группа, гуанидил, имидазолил или индолил, эти группы также могут быть защищены.
В качестве пригодных защитных групп используются предпочтительно N-защитные группы, используемые для этого в химии пептидов, например, защитные группы уретанового типа, бензилоксикарбонил (Z), трет-бутилоксикарбонил (Воc), 9-флуоренилоксикарбонил (Fmoc), аллилоксикарбонил (Aloc) или типа амидов кислот, особенно формил, ацетил или трифторацетил, а также алкильного типа, например, бензил. В случае остатка имидазола в R8 в качестве защитной группы служит, например, производное сульфоновой кислоты формулы IV, используемое для образования сульфонамида в качестве защитной группы азота имидазола, которая, особенно в присутствии оснований, как гидроксид натрия, опять может отщепляться. Исходные вещества для химических взаимодействий известны или могут легко получаться по описанным в литературе методикам.
Далее, изобретение касается способа получения соединения формулы I и/или стереоизомерной формы соединения формулы I и/или физиологически совместимой соли соединения формулы I, отличающегося тем, что а) соединение формулы IV,

где Рg представляет собой пригодную защитную группу (например, сложный метиловый эфир), амидную группу или гидроксильную группу, и Z, R7 и R8 имеют значение как в формуле I, подвергают взаимодействию с хлоридом кислоты или активированным сложным эфиром соединения формулы III,

причем D1 обозначает -СООН или сульфонилгалоген, и R5, R6 и R9 имеют значения как в формуле 1, в присутствии основания или, в случае необходимости, водоотнимающего средства в растворе и после отщепления защитной группы переводят в соединение формулы I, или
b) соединение формулы IVa,

где R7 и R8 имеют значения как в формуле I, и Е представляет собой N-амино-защитную группу, присоединяется своей карбоксильной группой через промежуточную цепь L к полимерной смоле общей формулы PS, при этом образуется соединение фомулы V,

которое после селективного отщепления защитной группы Е подвергают взаимодействию с соединением формулы III, причем R5, R6и R9 имеют значения как в формуле I, в присутствии основания или, в случае необходимости, водоотнимающего средства, до получения соединения формулы VI,

и соединение формулы VI после отщепления материала-носителя переводят в соединение формулы I, или
с) соединение формулы I переводят в физиологически совместимую соль.
По варианту способа а) карбоксильные группы соединений формулы IVa снабжают защитной группой Рg, такое селективное получение производных карбоновых кислот осуществляется способами, описанными в Houben-Weyl ″Methoden der Org. Chemie″, Band 15/1. В варианте способа b) амино-группы исходных соединений формул снабжают защитной группой Е, такое селективное получение производных аминогрупп осуществляется способами, описанными в Houben-Weyl ″Methoden der Org. Chemie″, Band 15/1. В качестве пригодной защитной группы Рg предпочтительно используют карбокси-защитные группы, употребляемые для этого в химии пептидов, например, защитные группы типа сложных алкиловых эфиров, как метил-, этил-, трет.-бутил, изопропил-, бензил-, флуоренилметил-, аллил-, типа сложных ариловых эфиров, как фенил-, амидного типа, как амид- или бензгидриламин. В качестве пригодной защитной группы Е предпочтительно используют N-защитные группы, употребляемые для этого в химии пептидов, например, защитные группы уретанового типа, как бензилоксикарбонил (Z), трет-бутилоксикарбонил (Воc), 9-флуоренилоксикарбонил (Fmoc) и аллилоксикарбонил (Aloc) или типа амидов кислот, особенно формил, ацетил или трифторацетил, алкильного типа, как бензил. Особенно пригодными для этого является также (триметил-силил)этоксикарбонильная (Теос) группа (Р.Kocienski, Protecting Groups, Thieme Verlag, 1994).
Получение производных индолкарбоновых кислот осуществляется способами, описанными в Houben-Weyl "Methoden der Org. Chemie", Band E6-2A или Е6-2В. Так, для получения производных индолкарбоновых кислот формулы III предпочтительно могут подвергаться взаимодействию гидразинобензойные кислоты и арил- или гетероарилкетоны, в присутствии полифосфорной кислоты в качестве растворителя при 145°С. Получение необходимых гидразинбензойных кислот осуществляется известными специалисту способами, например, из соответствующих анилинов бензойной кислоты, арил- или гетероарилкетоны также получают доступными для специалиста способами, например, из соответствующих хлорангидридов или нитрилов посредством взаимодействия с, например, металлоорганическими соединениями.
Для конденсации соединений формулы IV с соединениями формулы III используют предпочтительно сами по себе хорошо известные специалисту методы связывания химии пептидов (смотри, например, Houben-Weyl, Methoden der Organischen Chemie, Band 15/1 и 15/2, Georg Thiem Verlag, Stuttgart, 1974). В качестве средств конденсации или реагентов связывания имеют в виду такие соединения, как карбонилдиимидазол, карбодиимиды, как дициклогексилкарбодиимид или диизопропилкарбодиимид (DIC), O-((циано(этоксикарбонил)-метилен) амино)-N,N,N’,N’-тетраметилурониум-тетрафторборат (TOTU) или ангидрид пропилфосфоновой кислоты (РРА).
Конденсация может быть проведена в стандартных условиях. При конденсации необходимо, чтобы имеющиеся не реагирующие аминогруппы были защищены посредством обратимых защитных групп. Это относится равным образом к не участвующим в реакции карбоксильным группам, которые во время конденсации предпочтительно находятся в виде -(С1-С6)-алкиловых сложных эфиров, бензиловых сложных эфиров или трет.-бутиловых сложных эфиров. Защита аминогрупп является излишней, если аминогруппы еще находятся в форме предварительной стадии, как нитрогруппы или цианогруппы, и образуются только после конденсации посредством гидрирования. После конденсации, имеющиеся защитные группы отщепляют пригодным способом. Например, NО2-группы (гуанидиновая защита в аминокислотах), бензилоксикарбонильные группы и бензильные группы в бензиловых сложных эфирах могут быть удалены гидрированием. Защитные группы трет.-бутильного типа отщепляются в кислых условиях, в то время как остаток 9-флуоренилметилоксикарбонила удаляется с помощью вторичных аминов.
Полимерный носитель, обозначенный в формулах V и VI “PS”, является сшитой полистирольной смолой со связующим звеном, обозначенным в виде промежуточной цепи “L”. Это связующее звено имеет пригодную функциональную группу, например, амин, известно, например, как амидная смола Rink, или ОН-группу, и известно, например, как смола Wang или оксимная смола Kaiser. Альтернативно могут использоваться другие полимерные носители, такие как стекло, хлопок или целлюлоза с различными промежуточными цепями L.
Промежуточная цепь, обозначенная L, ковалентно связана с полимерным носителем и допускает обратимую, амидоподобную или сложноэфирную связь с соединением формулы IVa, которая в течение дальнейшего взаимодействия со связанным соединением формулы IVa остается стабильной; однако под действием сильно кислых условий реакции, например, смешивания с трифторуксусной кислотой, имеющаяся в связующем звене группа опять высвобождается. Высвобождение желаемого соединения общей формулы I от связующего звена может происходить по различным положениям в ходе реакции.
А. Общий способ связывания защищенных аминокарбоновых кислот формулы IVa на твердом носителе:
Синтез проводили в реакторах с реакционным объемом по 15 мл. Каждый реактор заполняли 0,179 г смолы Rink-Amid-AM (Fmoc-Rink-Amid AM/ Nova-Biochem; загрузка 0,56 ммоль/г; т.е. 0,1 ммоль/реактор). Для отщепления Fmoc-защитной группы от смолы в каждый реактор добавляли 30%-ный раствор пиперидин/ДМФ и смесь встряхивали на протяжении 45 минут. Затем фильтровали и смолу 3 раза промывали диметилформамидом (ДМФ).
Для связывания защищенной аминокислоты добавляли к обработанной таким образом смоле по одному 0,5 молярному раствору соответствующей Fmoс-аминокислоты (0,3 ммоль в ДМФ), раствор HOBt (0,33 ммоль в ДМФ) и раствор DIC (0,33 ммоль в ДМФ), и смесь 16 часов встряхивали при 35°С. Затем смолу многократно промывали ДМФ.
Для проверки связывания отбирали некоторые шарики смолы и подвергали тесту по Кайзеру; во всех случаях тест был отрицательным.
Отщепление Fmoс-защитных групп осуществляли, как указано выше, 30%-ным раствором пиперидин/ДМФ.
Для связывания индолкарбоновых кислот добавляли 0,1 молярный раствор соответствующей 4- или 5-замещенной кислоты (0,4 ммоль в ДМФ), 0,5 молярный раствор реагента связывания TOTU (0,44 ммоль в ДМФ) и 0,5 молярный раствор этилдиизопропиламина (DIPEA) (0,6 ммоль в ДМФ), и смесь 16 часов встряхивали при 40°С. Затем смолу многократно промывали ДМФ.
Для контроля реакции отбирали некоторые шарики смолы и подвергали тесту по Кайзеру.
Для отщепления желаемых веществ от твердого носителя смолу многократно промывали дихлорметаном. Затем добавляли раствор для отщепления (50% дихлорметана и 50% смеси из 95% трифторуксусной кислоты (TFA), 2% Н2О, 3% триизопропилсилана) и смесь встряхивали 1 час при комнатной температуре. Смесь фильтровали и фильтрат концентрировали вплоть до высушивания. Осадок осаждали диэтиловым эфиром и фильтровали.
Твердые осадки содержали желаемые продукты наиболее высокой чистоты или фракционировались, например, препаративной жидкостной хроматографией высокого давления с обращенной фазой (элюенты: A: H2O/0,1% TFA, В; ацетонитрил/0,1% TFA). Лиофилизация полученных фракций дает желаемые продукты.
Получение физиологически совместимых солей из соединений формулы I, способных к солеобразованию, включая их стереоизомерные формы, осуществляется известными способами. Карбоновые кислоты образуют с основными реагентами, как гидроксиды, карбонаты, гидрокарбонаты, алкоголяты, а также аммиак или органические основания, например, триметил- или триэтиламин, этаноламин или триэтаноламин, или также основные аминокислоты, как лизин, орнитин или аргинин, устойчивые соли щелочных металлов, щелочноземельных металлов или, в случае необходимости, замещенные соли аммония. Поскольку соединения формулы I имеют основные группы, можно также получать с сильными кислотами стабильные аддитивные соли кислот. Для этого рассматривают как неорганические, так и органические кислоты, такие как соляная, бромистоводородная, серная, фосфорная, метансульфоновая, бензолсульфоновая, п-толуолсульфоновая, 4-бромбензолсульфоновая, циклогексиламидосульфоновая, трифторметилсульфоновая, уксусная, щавелевая, винная, янтарная или трифторуксусная кислота.
Изобретение касается также лекарственных средств, отличающихся эффективным содержанием по крайней мере одного соединения формулы I и/или одной физиологически приемлемой соли соединения формулы I и/или, в случае необходимости, одной стереоизомерной формы соединения формулы I, вместе с фармацевтически пригодным и физиологически совместимым носителем, добавкой и/или другими биологически активными и вспомогательными веществами.
Благодаря фармакологическим свойствам соединения согласно изобретению пригодны для профилактики и лечения всех заболеваний, протекание которых обусловлено повышенной активностью IkB-киназы. К ним относятся, например, хронические заболевания двигательного аппарата, как воспалительные, иммунологически или обменом веществ обусловленные острые и хронические артриты, артропатии, ревматический артрит, или дегенеративные артропатии как остеоартрозы, спондилезы, атрофия хряща после травмы сустава или длительного положения покоя сустава после повреждения мениска или коленной чашечки, или разрывов связок, или заболевания соединительной ткани, как коллагенозы и околозубные заболевания, миалгии и нарушения костного обмена веществ, или заболевания, обусловленные сверхэкспрессией фактора α опухолевого некроза (TNFα) или повышенной концентрацией TNFα, как истощение, рассеяный склероз, черепно-мозговая травма, болезнь Крона и язвы кишечника, или заболевания как атеросклероз, стенозы, ульцерация, болезни Альцгеймера, сокращение мышц, раковые заболевания (потенцирование цитотоксической терапии), инфаркт миокарда, подагра, сепсис, септический шок, эндотоксический шок, вирусные инфекции как грипп, гепатит, тяжелые вирусные инфекции (HIV-инфекции), СПИД, или заболевания, вызванные аденовирусами или герпесвирусами, паразитарные инфекции как малярия или лепра, грибковые или дрожжевые инфекции, воспаления мозговых оболочек, хронические воспалительные легочные заболевания как хронический бронхит или астма, острые респираторные дистрессовые синдромы, острый синовит, туберкулез, псориаз, диабет, лечение острых или хронических реакций отторжения органа реципиента против трансплантированного органа, хронические заболевания “трансплантат против хозяина” и воспалительные заболевания сосудов.
Лекарственные средства согласно изобретению принимают в целом орально или парентерально. Возможно также ректальное или трансдермальное применение.
Изобретение касается также способа получения лекарственного средства, отличающегося тем, что по крайней мере одно соединение формулы I доводят с фармацевтически пригодным и физиологически приемлемым носителем и, в случае необходимости, другими пригодными биологически активными веществами, добавками или вспомогательными веществами до пригодной формы введения.
Пригодными твердыми или галеновыми препаративными формами являются, например, грануляты, порошки, драже, таблетки, (микро)капсулы, суппозитории, сиропы, соки, суспензии, эмульсии, капли или растворы для инъекций, а также препараты с замедленным высвобождением биологически активного вещества, для получения которых используются обычные вспомогательные вещества такие, как носители, распылители, связующие, вещества для покрытий, агенты набухания, вещества, придающие скользкость или смазки, вкусовые добавки, подсластители и агенты растворения. В качестве часто используемых вспомогательных веществ называют карбонат магния, диоксид титана, лактозу, маннит и другие сахара, тальк, молочный белок, желатин, крахмал, целлюлозу и ее производные, животные и растительные масла, как рыбий жир, подсолнечное, арахисовое или кунжутное масло, полиэтиленгликоль и растворитель, как, например, стерильная вода, и одно- или многоатомные спирты как глицерин. Предпочтительно фармацевтические препараты изготавливают и принимают в разовых дозах, причем каждая разовая доза содержит в качестве активной составной части определенную дозу соединения формулы I согласно изобретению. Для твердых разовых доз как таблетки, капсулы, драже или суппозитории, эта доза может составлять примерно вплоть до 1000 мг, предпочтительно примерно от 50 мг до 300 мг, и для инъекционных растворов в форме ампул примерно вплоть до 300 мг, предпочтительно примерно от 10 мг до 100 мг. Для лечения взрослых пациентов весом около 70 кг, в зависимости от эффективности соединения согласно формуле I, показана суточная доза примерно от 20 мг до 1000 мг биологически активного вещества, предпочтительно примерно от 100 мг до 500 мг. При известных условиях, однако, также могут быть использованы большие или меньшие суточные дозы. Прием суточной дозы может осуществляться как посредством одноразового приема в форме отдельной разовой дозы, или же нескольких меньших разовых доз, так и посредством многократного приема разделенных доз в определенные интервалы.
Целевые продукты, как правило, определяют посредством масс-спектрометрических методов (FAB-, ESI-MS). Температуру обозначают в градусах Цельсия, КТ (RT) обозначает комнатную температуру (22°С до 26°С). Используемые сокращения или пояснены, или соответствуют общепринятым соглашениям.
Примеры
Получение замещенных индолкарбоновых кислот
Вариант А) способа
2,3-дифенил-1Н-индол-5-карбоновая кислота
1,96 г (10 ммоль) деоксибензоина и 1,52 г 4-гидразинобензойной кислоты мелко растирали в ступке и затем сплавляли в открытой колбе 15 минут при 160°С. Охлажденный расплав смешивали со 100 мл уксусной кислоты и 30 мл концентрированной соляной кислоты и нагревали 3 часа с обратным холодильником. При смешивании охлажденного раствора с водой выпадал продукт 1, 3-дифенил-1Н-индол-5-карбоновая кислота. Отсасывали, затем промывали осадок водой и сушили. Для очистки перемешивали сырой продукт с теплым толуолом, отсасывали и повторно сушили. Получали 2, 3-дифенил-1Н-индол-5-карбоновую кислоту.
Вариант В) способа
2-пиридин-4-ил-1Н-индол-5-карбоновая кислота
Смешивали 20 г P2O5 с 12, 5 мл Н3РO4 (85%), причем реакционная смесь сильно нагревалась. Сообразно этому, реакционную смесь охлаждали до 60°С и добавляли 8,90 г (65,84 ммоль) 4-пропионилпиридина и 4,20 г (27,60 ммоль) 4-гидразинобензойной кислоты. Затем перемешивали 45 мин при 145°С. Реакционную смесь выливали в воду, после чего выпадал продукт желтого цвета 2-пиридин-4-ил-1Н-индол-5-карбоновая кислота. Этот осадок отсасывали и промывали водой до нейтральной реакции. 2-пиридин-4-ил-1Н-индол-5-карбоновую кислоту, полученную таким образом с количественным выходом, использовали без дальнейшей очистки для связывания с производными аминокислот.
Связывание производных аминокислот с замещенными производными индолкарбоновых кислот.
Вариант С) способа
Пример 1
(1-карбамоил-3-фенил-пропил)-амид 2,3-дифенил-1Н-индол-5-карбоновой кислоты:
0,16 г (0,5 ммоль) 2, 3-дифенил-1Н-индол-5-карбоновой кислоты (смотри вариант А) способа) растворяли при комнатной температуре в 10 мл осушенного диметилформамида (ДМФ) и друг за другом добавляли 0,11 г (0,5 ммоль) гидрохлорида L-гомофенилаланинамида, 0,16 г TOTU (O-[(циано(этоксикарбонил)метилиден)амино)-1,1,3,3-тетраметил]урониум-тетрафторборат) и 0,14 мл (1 ммоль) диизопропиламина. Перемешивали 6 часов при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении, и осадок растворяли в этиловом эфире уксусной кислоты. Органическую фазу последовательно промывали водой, насыщенным раствором карбоната натрия, водой и насыщенным раствором поваренной соли, сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Получали (1-карбамоил-3-фенил-пропил)-амид 2,3-дифенил-1Н-индол-5-карбоновой кислоты с температурой плавления 120°С-125°С.
Пример 7:
(1-карбамоил-3-пиррол-1-ил-пропил)-амид 3-метил-2-пиридин-4-ил-1Н-индол-5-карбоновой кислоты
0,13 г (0,5 ммоль) 3-метил-2-пиридин-4-ил-1Н-индол-5-карбоновой кислоты (смотри вариант А) способа) растворяли при комнатной температуре в 10 мл осушенного диметилформамида (ДМФ) и друг за другом добавляли 0,083 г (0,5 ммоль) амида 4-(1-пирролил)-L-2-бензилоксикарбониламино-масляной кислоты, 0,16 г (0,5 ммоль) TOTU (O-[(циано-(этоксикарбонил)метилиден)амино)-1,1,3, 3-тетраметил]урониум-тетрафторборат) и 0,14 мл (1 ммоль) этилдиизопропиламина. Перемешивали 6 часов при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении и осадок растворяли в этиловом эфире уксусной кислоты. Органическую фазу последовательно промывали водой, насыщенным раствором карбоната натрия, водой и насыщенным раствором поваренной соли, сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Очистку осуществляли посредством препаративной ВЭЖХ (HPLC).
а: 4-(1-пирролил)-L-2-бензилоксикарбониламиномасляная кислота
К продутому аргоном раствору 1,25 г (5,0 ммоль) Nα-Z-L-2,4-диаминомасляной кислоты в 60 мл воды добавляли 0,66 г (5,0 ммоль) 2,5-диметокситетрагидрофурана вслед за 1,7 мл ледяной уксусной кислоты и перемешивали 12 часов при 20°С. Реакционную смесь многократно экстрагировали этилацетатом, объединяли органические фазы, сушили сульфатом натрия и фильтрат концентрировали при пониженном давлении. Сырой продукт очищали посредством флэш-хроматографии на кизельгеле (СН2Сl2/СН3ОН/СН3СООН : 100/5/1). После отделения элюента получали 1,3 г (87%) 4-(1-пирролил)-L-2-бензилоксикарбониламино-масляной кислоты.
b: Амид 4-(1-пирролил)-L-2-бензилоксикарбониламино-масляной кислоты 1,2 г (4,0 ммоль) 4-(1-пирролил)-L-2-бензилоксикарбониламино-масляной кислоты и 0,61 г (4,0 ммоль) аммониевой соли N-гидроксибензотриазола растворяли вместе в 10 мл ДМФ, при 0°С смешивали с 0,82 г (4,0 ммоль) N,N’-дициклогексилкарбодиимида и 0,68 мл (4,0 ммоль) N-этил-диизопропиламина, перемешивали 30 мин при 0°С и 3 часа при 20°С. Выпавшую мочевину отсасывали и фильтрат выпаривали до высушивания. Сырой продукт очищали посредством хроматографии на кизельгеле (CH2Cl2/СН3ОН/СН3СООН: 100/5/1). Выход 0,89 г (74%).
с: Амид 4-(1-пирролил)-L-2-амино-масляной кислоты
0,80 г (2,65 ммоль) амида 4-(1-пирролил)-L-2-бензилоксикарбонил-амино-масляной кислоты, растворенного в 20 мл метанола, смешивали в атмосфере инертного газа с 80 мг катализатора (10% Pd-C), затем вплоть до полного отщепления Z-защитной группы вводили водород. После отфильтровывания катализатора и выпаривания фильтрата получали 0,4 г (90,5%) амида 4-(1-пирролил)-L-2-амино-масляной кислоты.
2. Вариант D) способа
Пример 3:
(1-карбамоил-2-фенилсульфонил-этил)-амид 2-пиридин-4-ил-1Н-индол-5-карбоновой кислоты
К 0,20 г (0,84 ммоль) 2-пиридин-4-ил-1Н-индол-5-карбоновой кислоты добавляли 0,21 г (1,07 ммоль) 2-амино-З-фенилсульфонил-пропионовой кислоты в 40 мл ДМФ, и при 0°С добавляли 0,66 г (1,27 ммоль) бензотриазол-1-илокси-трипирролидино-фосфониум-гексафторфосфата и 0,37 мл (2,12 ммоль) N-этил-N,N-диизопропиламина и перемешивали 2 часа при 20°С. Раствор концентрировали при пониженном давлении и очищали посредством колоночной хроматографии среднего давления (CH2Cl2/СН3ОН как 9:1). Таким образом получали 0,19 г (54%) (1-карбамоил-2-фенилсульфонил-этил)-амида 2-пиридин-4-ил-1Н-индол-5-карбоновой кислоты.
Пример 9
Амид 3-фениламиноэтил-2-[(2-пиридин-4-ил-1Н-индол-5-карбонил)-амино]-пропионовой кислоты

а) L-2-амино-З-фениламиноэтилпропионовая кислота
54,8 г (0,209 моль) трифенилфосфина суспендировали в 600 мл ацетонитрила и охлаждали при исключении влаги до -35° С-45°С. Затем при этой температуре прибавляли в течение 50 минут по каплям 36,4 г (0,209 моль) диэтилового эфира азодикарбоновой кислоты. Перемешивали еще 15 мин при -35°С. К этой смеси прикапывали раствор 50 г (0,209 моль) N-бензилоксикарбонил-L-серина в 500 мл ацетонитрила, при этом не допускали повышения температуры сверх -35°С. Затем продолжали реакцию 12 часов при 5°С и нагревали до комнатной температуры. Реакционный раствор освобождали от растворителя при пониженном давлении, и сырой продукт очищали хроматографией среднего давления на кизельгеле (дихлорметан (ДХМ) (DCM)/ацетонитрил: 25/1). После отделения растворителя получали 20,8 г (выход 45%) чистого N-бензилокси-карбонил-L-серин-β-лактона (смотри также Оrg. Synth. 1991 (70) 1ff.) в виде тонких иголок. Суммарная формула С11Н11NO4; молекулярная масса (М.М.) (M.W.)=221,2; MS (M+H) 222,1.
К 7,3 мл (57,36 ммоль) N-этиланилина в 250 мл ацетонитрила добавляли в защитной атмосфере аргона 15,5 мл (63,51 ммоль) N,O-бис(триметилсилил)ацетамида и перемешивали 3 часа при 50°С. Затем добавляли при 20°С раствор вышеназванного лактона (10,7 г, 48,37 ммоль), растворенный в 250 мл ацетонитрила, и 17 час нагревали с обратным холодильником. После отделения растворителя осадок смешивали с насыщенным раствором карбоната натрия, причем значение рН раствора не превышало 9. Водную суспензию промывали небольшим количеством диэтилового эфира и затем подкисляли концентрированной соляной кислотой до значения рН от 6 до 7, и буфером NaHPO4 доводили значение рН до 5. Затем водный раствор многократно экстрагировали этиловым эфиром уксусной кислоты. После выпаривания растворителя получали желаемый продукт с выходом 45% (7, 4 г). Суммарная формула C19H22N2O4; M.M.=342,4; MS (M+H) 343,2.
К 75 мл метанола прикапывали при -10°С 6,5 мл (89,1 ммоль) тионилхлорида и 30 мин перемешивали. Затем добавляли 8,6 г (25,12 ммоль) растворенной в 75 мл метанола L-2-аминоэтил-3-фениламинопропионовой кислоты, перемешивали 30 минут при -10°С и далее 3 часа при комнатной температуре. После выпаривания растворителя осадок поглощали этиловым эфиром уксусной кислоты и промывали раствором карбоната натрия. После выпаривания растворителя и очистки посредством флэш-хроматографии (н-гептан/этиловый эфир уксусной кислоты 7:3) получали 4,43 г (50% выход) метилового эфира L-2-аминоэтил-3-фениламинопропионовой кислоты. Суммарная формула C20 H24N2O4; M.M.=356,4; MS (M+H) 357,3.
Для отщепления защитной группы 4,4 г (12,35 ммоль) производного, защищенного Z-группой, растворяли в 500 мл метанола, прибавляли в атмосфере инертного газа 100 мг катализатора (10% Pd(OH)2-C), и, вплоть до полного отщепления Z-защитной группы, вводили водород. После отфильтровывания катализатора и выпаривания фильтрата получали 2,8 г L-2-аминоэтил-3-фениламино-пропионовую кислоту (количественно). Суммарная формула C12H18N2 O2; M.M.=223,3; MS (M+H) 223,1.
Стадия b) способа
0,63 г (2,64 ммоль) 2-пиридин-4-ил-1Н-индол-5-карбоновой кислоты, полученной, как в варианте В) способа, суспендировали в 150 мл ДМФ и последовательно добавляли 1,01 г (3,08 ммоль) TOTU и 0,63 мл (3,71 ммоль) этилдиизопропиламина. Перемешивали 20 мин при комнатной температуре и добавляли к образовавшемуся прозрачному раствору 0,73 г (3,28 ммоль) метилового эфира (S)-2-амино-3-фениламинэтилпропионовой кислоты, полученного согласно а). После 15 часов перемешивания концентрировали при пониженном давлении и отделяли метиловый эфир основного соединения посредством флэш-хроматографии на кизельгеле (ДХМ: МеОН=19:1). Выход 0,44 г, суммарная формула C26H26N4O3; М.М.=442,2; MS (M+H) 443, 3.
0,22 г (0,497 ммоль) полученного таким образом метилового эфира растворяли в 100 мл метанола, охлаждали до 0°С и затем 1,5 часа вводили аммиак. Раствор оставляли на ночь при комнатной температуре и затем выпаривали метанол. Сырой продукт очищали посредством флэш-хроматографии на кизельгеле (ДХМ: МеОН=19:1). Выход 0,096 г (45,2%). C25H25N5 O2; M.M.=427,2; MS (M+H) 428,3.
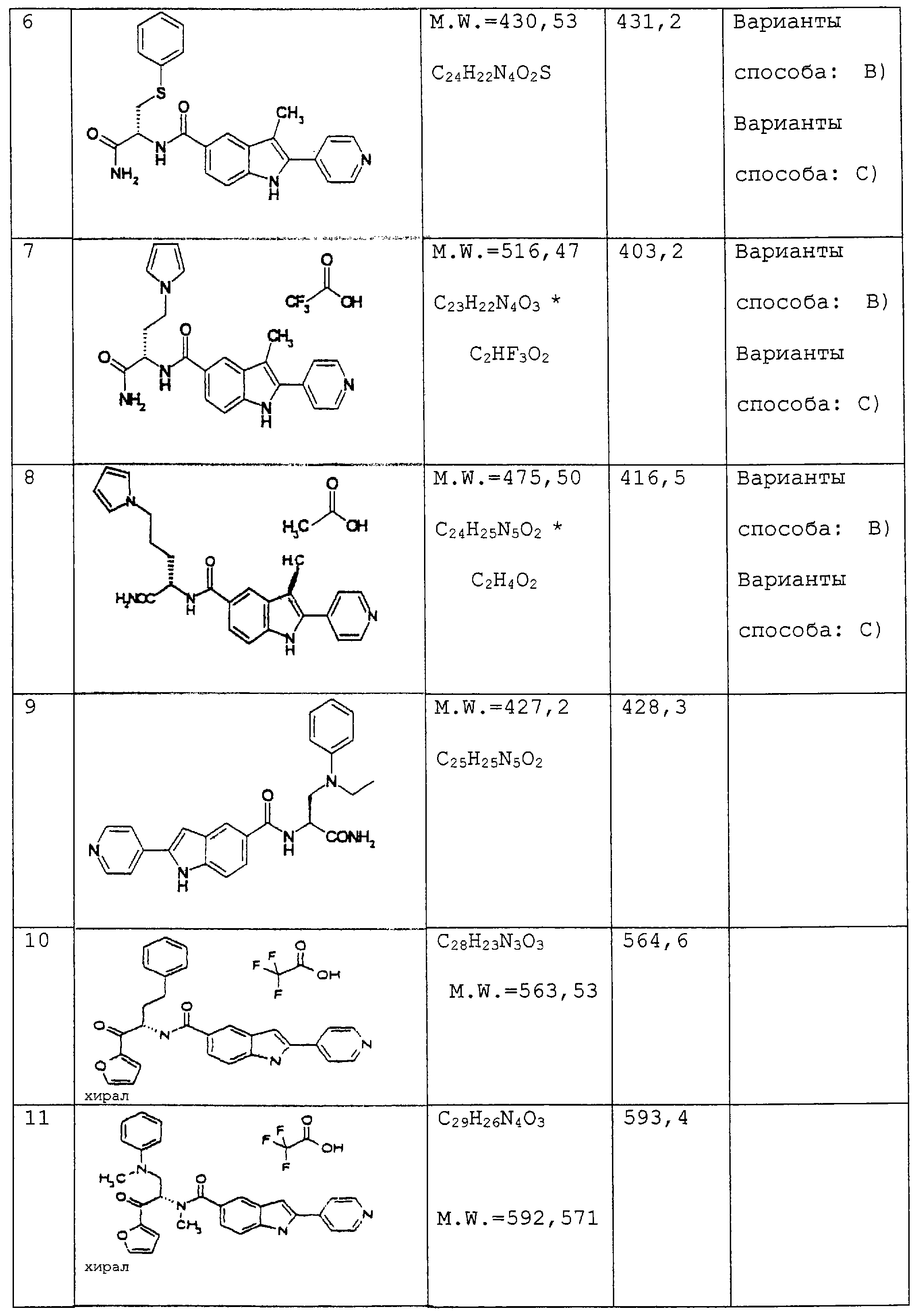
В таблице 1 соединения получали аналогично способам А)-D).





Фармакологические примеры:
Активность IkB-киназы определяли с помощью ELISA, состоящего из одного биотинилированного субстратного пептида, который содержит аминокислотную последовательность в протеине IkB из серина 32 до 36, и одного специфического поли- или моноклонального антитела (например, от New England Biolabs, Beverly, MA, USA, Kat.: 9240), которое связано только с фосфорилированной формой пептида IkB. Этот комплекс иммобилизовывали на связывающий антитела 96-луночный планшет (с наслоенным протеином А) и определяли с одним конъюгатом из биотинсвязывающего протеина и пероксидазы хрена (HRP) (например, стрептавидин-HRP). Активность можно количественно определить в соответствии со стандартной кривой с субстратным фосфопептидом.
Проведение:
Для получения комплекса киназы 10 мл HeLa S3-экстракта клеток S 100 разбавляли 40 мл 50 мМ HEPES, рН 7,5, помещали в 40% сульфат аммония и инкубировали на льду в течение 30 минут. Осажденный гранулят растворяли в 5 мл SEC-буфера (50 мМ HEPES, рН 7,5, 1 мМ дитиотреитола ДТТ, 0,5 мМ этилендиаминтетраацетата ЭДТА (EDTA), 10 мМ 2-глицерофосфата), центрифугировали при 20.000 х g 15 минут и фильтровали через фильтр с порами 0,22 мкм. Пробу подавали в 320 мл Superose-6 колонку ВЭЖХ (Amersham Pharmacia Biotech AB, Uppsala, Schweden), которая была уравновешена SEC-буфером и действовала при 4°С с величиной потока 2 мл/мин. Фракции, время пробега которых совпадало со временем пробега стандартной молекулярной массы 670 кДа, соединяли для активации. Активации достигали посредством 45-минутной инкубации с 100 нМ МЕКК1Δ, 250 мкМ МgАТФ, 10 мМ МgСl2, 5 мМ дитиотреитола (ДТТ), 10 мМ 2-глицерофосфата, 2,5 мкМ микроцистина-LR при 37°С. Активированный фермент хранили при -80° С.
Тестируемые вещества (2 мкл), растворенные в ДМСО, инкубировали 30 минут при 25°С с 43 мкл активированного фермента (разбавлен 1:25 в реакционном буфере: 50 мМ HEPES, рН 7,5, 10 мМ MgCl2, 5 мМ ДТТ, 10 мМ β-глицерофосфата, 2,5 мкМ микроцистина-LR). Затем добавляли 5 мкл субстратного пептида (биотин-(СН2)6-DRHDSGLDSMKD-CONH2 ) (200 мкМ), инкубировали один час и прекращали процесс посредством 150 мкл 50 мМ HEPES, рН 7,5, 0,1% бычьего сывороточного альбумина БСА (BSA), 50 мМ ЭДТА, антитела [1:200]. 100 мкл ингибированной реакционной смеси или стандартные ряды, включающие фосфопептид, (биотин-(СН2)6-DRHDS[РО3 ]GLDSMKD-CONH2) переводили затем на 96-луночный планшет с протеином-А (Pierce Chemical Co., Rockford, IL, USA) и 2 часа инкубировали при встряхивании. После 3-стадийного промывания субстратом, связывающим белок (PBS), добавляли 100 мкл 0,5 мкг/л стрептавидин-HRP (пероксидазы хрена) (разбавленной в 50 мМ HEPES/ 0,1% БСА) в течение 30 минут. После 5-стадийного промывания PBS добавляли 100 мкл субстрата ТМВ (Kirkegaard & Perry Laboratories, Gaithersburg, MD, USA) и прекращали развитие цвета добавлением 100 мкл 0,18 М серной кислоты. Адсорбцию измеряли при 450 нм. Стандартную кривую получали посредством линейной регрессии, соответствующей 4-параметровой зависимости доза - активность. На основе этой стандартной кривой количественно определяли активность фермента или его ингибирование посредством тестируемых веществ.
Методы РКА, РКС, СК II.
сАМР (цикл. аденозинмонофосфат) - зависимую протеинкиназу (РКА), протеинкиназу С (РКС) и казеинкиназу II (СК II) с соответствующим набором тестов от Upstate Biotechnologie согласно предписанию изготовителя определяли при концентрации АТФ (АТР) 50 мкМ. Вместо фосфоцеллюлозного фильтра для отмывания использовали многослойные планшеты (Multi-Screen-Platten) (миллипоры; фосфоцеллюлоза MS-PH, Kat. MAPHNOB 10) с соответствующей системой отсасывания. Затем планшеты измеряли в сцинцилляционном счетчике Wallac MicroBeta. По мере надобности использовали 100 мкМ тестируемого вещества.
Каждое вещество тестировали дважды. Из средних значений (фермент с веществами и без веществ) вычитали среднее значение чистого опыта (без фермента) и рассчитывали % ингибирования. Определения IC50 проводили с программным пакетом GraFit 3.0. Результаты приведены в таблице 2.
Реферат
Изобретение относится к новым замещенным индолам формулы I:

и/или стереоизомерная форма соединения формулы I и/или физиологически приемлемая соль соединения формулы I, причем R3 обозначает остаток формулы II,

где D обозначает -С(O)-; R7 обозначает Н, или -(С1-С4)-алкил; R8 обозначает а) характерный остаток аминокислоты из группы: фенилаланин или гомофенилаланин, причем фенильный остаток незамещен или замещен галогеном, или b) -(С1-С4)-алкил, где алкил является неразветвленным или разветвленным и b)1) независимо друг от друга одно- или двукратно замещенным остатком пиррол, причем остаток является незамещен или замещен галогеном, b)2) независимо друг от друга одно- или двукратно замещенным остатком -S(O)x-R10, где х является целым числом ноль, 1 или 2, или b)3) независимо друг от друга одно- или двукратно замещенным остатком – N(R10 )2; R10 обозначает а) Н, b) -(С1-С6)-алкил, где алкил является незамещенным или от одно- до трехкратно замещенным галогеном, c) фенил, где фенил является незамещенным или от одно- до трехкратно замещенным галогеном, в случае (R10)2 остатки R10 независимо друг от друга имеют значения а), b), с); Z обозначает а) остаток из группы гетероциклов, включающей бензотиадиазин, пиррол, пиридин, пиримидин, пиразин, имидазол, пиразол, оксазол, изоксазол, тиазол, изотиазол, тетразол, оксадиазолон, триазол, причем гетероциклы являются незамещенными или от одно- до трехкратно замещенными –NH2,=O, алкоксикарбонилом или аминокарбонилом или b) -C(O)-R11, где R11 обозначает 1. -O-R10 или 2. -N(R10)2; R9 обозначает а) Н, b) (С1-С6 )-алкил, где алкил является неразветвленным или разветвленным и, независимо друг от друга, одно-, двух- или трехкратно замещенным фенилом или =O, c) фенил, причем фенил является незамещенным или замещенным галогеном; R1, R2 и R4 обозначают Н; R5 обозначает Н, R6 обозначает а) фенил, причем фенил является незамещенным или замещенным –NH2, b) пиридин, или c) пиримидин, причем, пиридин или пиримидин являются незамещенными или замещенными группами –NH2, -NH-СН3. Соединения I являются специфическими ингибиторами IkB-киназы. 2 з.п. ф-лы, 3 табл.
Формула



Комментарии