Модуляторы атф-связывающих кассетных транспортеров - RU2512682C2
Код документа: RU2512682C2
Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По данной заявке испрашивается приоритет на основании патентных заявок США № 61/112152 и 61/112145, обе из которых поданы 6 ноября 2008 года. Полное содержание этих заявок включено в настоящее описание в полном объеме.
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к модуляторам АТФ-связывающих кассетных ("ABC") транспортеров или их фрагментов, включая регулятор трансмембранной проводимости при муковисцидозе ("CFTR"), композициям на их основе и связанным с ними способам. Кроме того, настоящее изобретение относится к способам лечения опосредованных АВС-транспортером заболеваний, использующим вышеуказанные модуляторы.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
ABC-транспортеры представляют собой семейство мембранных белков-переносчиков, которые регулируют транспорт большого числа фармакологических средств, потенциально токсичных лекарственных средств и ксенобиотиков, а также анионов. ABC-транспортеры представляют собой гомологичные мембранные белки, которые связывают и используют клеточный аденозинтрифосфат (АТФ) для проявления своей специфической активности. Некоторые из этих транспортеров были раскрыты в качестве резистентных ко многим лекарственным средствам белков (подобно гликопротеину MDR1-P, или MRP1, белку, ассоциированному с множественной лекарственной резистентностью), защищающих злокачественные раковые клетки от химиотерапевтических средств. На сегодняшний день, было идентифицировано 48 ABC-транспортеров, которые были распределены по 7 классам, исходя из идентичности их последовательности и функционирования.
ABC-транспортеры регулируют целый ряд важных физиологических процессов внутри живого организма и обеспечивают защиту от вредных соединений окружающей среды. Вследствие этого, они представляют собой важные потенциальные мишени для лекарственных средств в случае лечения заболеваний, связанных с дефектами транспортера, предотвращения переноса лекарственного средства из клетки-мишени и вмешательства в другие заболевания, в которых модуляция активности АВС-транспортера может быть полезной.
Одним представителем семейства АВС-транспортеров, обычно связанным с заболеванием, является цАМФ/АТФ-опосредованный анионный канал, CFTR. CFTR экспрессируется в целом ряде типов клеток, включая абсорбирующие и секреторные эпителиальные клетки, где он регулирует анионный поток через мембрану, а также активность других ионных каналов и белков. В эпителиальных клетках нормальное функционирование CFTR является необходимым для поддержания транспорта электролитов по всему организму, включая дыхательную и пищеварительную ткань. CFTR состоит из приблизительно 1480 аминокислот, которые кодируют белок, составленный из тамдемной дупликации трансмембранных доменов, при этом каждый содержит шесть трансмембранных спиралей и связывающий нуклеотид домен. Два трансмембранных домена связаны большим, полярным, регуляторным (R)-доменом с множественными сайтами фосфорилирования, которые регулируют активность канала и направленную миграцию клеток.
Был идентифицирован и сесквенирован ген, кодирующий CFTR (см. Gregory, R.J. et al. (1990) Nature 347: 382-386; Rich, D.P. et al. (1990) Nature 347: 358-362), (Riordan, J.R. et al. (1989) Science 245: 1066-1073). Дефект в этом гене вызывает мутации в CFTR, приводящие к муковисцидозу ("CF"), наиболее распространенному фатальному генетическому заболеванию у людей. Муковисцидоз поражает приблизительного каждого из 2500 детей мдадшего возраста в США. Если взять население США в целом, то вплоть до 10 миллионов людей являются носителями одной копии дефектного гена без очевидных пагубных последствий. В противоположность этому, индивидуумы с двумя копиями гена, ассоциируемого с CF, страдают от вызывающих слабость и летальных воздействий CF, включая хроническое заболевание легких.
У пациентов с муковисцидозом, мутации в CFTR, эндогенно экспрессируемом в респираторных эпителиях, ведут к снижению секреции аниона на поверхности апикальной мембраны, вызывая дисбаланс в переносе ионов и жидкости. Возникающее снижение в переносе аниона способствует повышению накопления слизи в легком и сопутствующим этому бактериальным инфекциям, которые, в конечном счете, вызывают смерть у пациентов с CF. Помимо респираторного заболевания, пациенты с CF обычно страдают проблемами, связанными с желудочно-кишечным трактом и недостаточностью поджелудочной железы, что при отсутствии лечения приводит к смерти. Кроме того, большая часть мужчин с муковисцидозом - бесплодны, а среди женщин с муковисцидозом снижается фертильность. В противоположность серьезным последствиям наличия двух копий гена, ассоциируемого с CF, индивидуумы с одной копией гена, ассоциируемого с CF, демонстрируют повышенную резистентность к холере и дегидратации, являющейся следствием диареи, что, возможно, объясняет относительно высокую частоту наличия гена CF среди населения.
Анализ последовательности гена CFTR хромосом CF обнаружил целый ряд мутаций, вызывающих болезнь (Cutting, G. R. et al. (1990) Nature 346:366-369; Dean, M. et al. (1990) Cell 61:863:870; and Kerem, B-S. et al. (1989) Science 245:1073-1080; Kerem, B-S et al. (1990) Proc. Natl. Acad. Sci. USA 87:8447-8451). На сегодняшний день было идентифицировано >1000 вызывающих заболевание мутаций в гене CF (http://www.genet.sickkids.on.ca/cftr/). Наиболее широко распространенной мутацией является делеция фенилаланина в положении 508 аминокислотной последовательности CFTR, и ее обычно называют ΔF508-CFTR. Эта мутация случается в приблизительно 70% случаев муковисцидоза и связана с серьезным заболеванием.
Делеция остатка 508 в ΔF508-CFTR мешает осуществлению правильной укладки рождающегося белка. Это приводит к неспособности мутантного белка выйти из ER (эндоплазматического ретикулума) и мигрировать в плазматическую мембрану. В результате этого количество каналов, присутствующих в мембране, оказывается значительно меньше, чем наблюдается в клетках, экспрессирующих CFTR дикого типа. Помимо нарушения направленной миграции, мутация приводит к повреждению воротного механизма ионных каналов. Вместе, снижение количества каналов в мембране и нарушение воротного механизма ионных каналов ведут к снижению транспорта анионов через эпителии, что, в свою очередь, ведет к недостаточному переносу ионов и жидкости. (Quinton, P.M. (1990), FASEB J. 4: 2709-2727). Исследования показали, однако, что сниженные количества ΔF508-CFTR в мембране являются функциональными, хотя и меньше, чем у CFTR дикого типа. (Dalemans et al. (1991), Nature Lond, 354: 526-528; Denning et al., supra; Pasyk and Foskett (1995), J. Cell. Biochem. 270: 12347-50). Помимо ΔF508-CFTR, другие вызывающие заболевание мутации в CFTR, которые приводят к нарушению направленной миграции, синтеза и/или воротного механизма ионных каналов, могут быть активированы или ингибированы с целью изменения секреции анионов и корректирования прогрессирования и/или степени тяжести заболевания.
Хотя CFTR переносит целый ряд молекул помимо анионов, очевидно, что эта его роль (перенос анионов) является лишь одним элементом в важнейшем механизме транспортировки ионов и воды через эпителий. Другие элементы включают эпителиальный Na+ канал, ENaC, Na+/2Cl-/К+ сотранспортер, Na+-К+-АТФ-азный насос и вазолатеральные мембранные K+ каналы, которые ответственны за поглощение хлорида в клетке.
Эти элементы работают вместе, обеспечивая достижение направленного транспорта через эпителий посредством их селективной экспрессии и локализации внутри клетки. Абсорбция хлорида происходит благодаря скоординированной активности ENaC и CFTR, присутствующим на апикальной мембране, и Na+-К+-АТФ-азному насосу и Cl- каналам, экспрессируемым на базолатеральной поверхности клетки. Вторичный активный транспорт хлорида с люминальной стороны ведет к накоплению внутриклеточного хлорида, который может затем пассивно покинуть клетку через Cl- каналы, приводя к векторному транспорту. Расположение Na+/2Cl-/К+ сотранспортера, Na+-К+-АТФ-азного насоса и вазолатеральных мембранных K+ каналов на базолатеральной поверхности и CFTR на люминальной стороне координируют секрецию хлорида через CFTR на люминальной стороне. Поскольку вода, вероятно, никогда активно не переносится сама по себе, ее поток через эпителий зависит от очень маленьких трансэпителиальных осмотических градиентов, генерируемых объемным потоком натрия и хлорида.
Помимо муковисцидоза, модуляция активности CFTR может быть полезной для лечения других заболеваний, не вызываемых непосредственно мутациями в CFTR, таких как секреторные заболевания и другие заболевания, связанные с фолдингом белка [укладкой белков в спиральную структуру], опосредованные CFTR. Эти болезни включают, но ими не ограничиваясь, хроническую обструктивную болезнь легких (COPD), болезнь сухих глаз и синдром Шегрена.
COPD характеризуется ограничением проходимости дыхательных путей, которое является прогрессирующим и не полностью обратимым. Ограничение проводимости дыхательных путей обусловлено гиперсекрецией слизи, эмфиземой и бронхиолитом. Активаторы мутантного CFTR или CFTR дикого типа предлагают потенциальное лечение гиперсекреции слизи и нарушения мукоцилиарного клиренса, что является обычным при COPD. В частности, увеличение секреции анионов через CFTR может облегчить транспорт жидкости в поверхностную жидкость дыхательных путей, что приводит к гидратации слизи и оптимизации вязкости перцилиарной жидкости. Это может привести к повышению мукоцилиарного клиренса и снижению тяжести симптомов, связанных с COPD. Болезнь сухих глаз характеризуется снижением продуцирования слезной жидкости и аномальными профилями липида, белка и слизи слезной пленки. Имеется много причин для появления сухого глаза, некоторые из которых включают возраст, последствия операции глаз c целью коррекции зрения с использованием лазера, артрит, лекарственные препараты, химический/термический ожоги, аллергии и болезни, такие как муковисцидоз и синдром Шегрена. Увеличение секреции аниона через CFTR может усилить транспорт жидкости из клеток эндотелия роговицы и секреторных желез, окружающих глаз, повышая гидратацию роговицы. Это может способствовать смягчению симптомов, связанных с болезнью сухих глаз. Синдром Шегрена является аутоиммунным заболеванием, в котором иммунная система атакует влагопродуцирующие железы по всему организму, включая глаза, рот, кожу, респираторную ткань, печень, влагалище и кишку. Симптомы включают сухой глаз, рот и влагалище, а также болезнь легких. Болезнь также связывают с ревматоидным артритом, системной красной волчанкой, системным (прогрессирующим) склерозом и полимиозит/дерматомиозитом. Нарушенная миграция белка, как считают, вызывает болезнь, для которой варианты лечения ограничены. Модуляторы активности CFTR могут гидратировать различные органы, пораженные болезнью, и способствовать смягчению симптомов, связанных с заболеванием.
Как обсуждалось выше, считают, что делеция остатка 508 в ΔF508-CFTR мешает осуществлению правильной укладки рождающегося белка, что приводит к неспособности этого мутантного белка выйти из ER и мигрировать в плазматическую мембрану. В результате этого, недостаточные количества зрелого белка присутствуют в плазматической мембране и транспорт хлорида внутри эпителиальных тканей существенно снижается. На самом деле, этот клеточный феномен нарушения процессинга в ER ABC-транспортеров посредством ER аппарата, как было показано, лежит в основе не только заболевания CF, но и целого ряда других изолированных и наследственных болезней. Имеется два пути, которые могут привести к нарушению функционирования ER аппарата, это либо потеря связи с ER экспортом белков, ведущая к деградации, либо накопление в ER этих дефектных/не способных к укладке в спиральную структуру белков [Aridor M., et al., Nature Med., 5(7), pp.745-751 (1999); Shastry, B.S., et al., Neurochem. International, 43, pp.1-7 (2003); Rutishauser, J., et al., Swiss Med Wkly, 132, pp.211-222 (2002); Morello, J.P. et al., TIPS, 21, pp.466-469 (2000); Bross P., et al., Human Mut., 14, pp.186-198 (1999)]. Заболеваниями, связанными с первым классом нарушения функции ER, являются муковисцидоз (обусловленный наличием не способных к правильной укладке молекул белка ΔF508-CFTR, как обсуждено выше), наследственная эмфизема (обусловленная α1-антитрипсином; не Piz варианты), наследственный гемохроматоз, недостаточности факторов свертывания крови и фибринстабилизирующего фактора, такие как дефицит белка C, наследственный ангионеврологический отек 1 типа, дефекты в процессинге липидов, такие как семейная гиперхолестеринемия, хиломикронемия 1 типа, абеталипопротеинемия, лизосомные болезни, такие как болезнь клеточных включений (муколипидоз)/псевдо-Хюрлера, мукополисахаридозы (обусловленные лизосомальными ферментами процессинга), болезнь Сандхоффа/Тея-Сакса (обусловленная β-гексозаминидазой), болезнь Криглера-Няйяра II типа (обусловленная UDP-глюкуронил-сиалик-трансферазой), полиэндокринопатия/гиперинсулинемия, сахарный диабет (обусловленный инсулиновым рецептором), карликовость Ларона (обусловленная рецептором гормона роста), дефицит милеопероксидазы, первичный гипопаратиреоидизм (обусловленный препропаратиреоидным гормоном), меланома (обусловленная тирозиназой). Болезнями, связанными с последним классом нарушения функции ER, являются гликогеноз CDG 1 типа, наследственная эмфизема (обусловленная α1-антитрипсином (PiZ вариант), врожденный гипертиреоидизм, несовершенный остеогенез (обусловленный проколлагеном I, II, IV типа), наследственная гипофибриногенемия (обусловленная фибриногеном), недостаточность ACT (обусловленная α1-антихимотрипсином), несахарный диабет (DI), нейрофизиологический DI (обусловленный гормон вазопрессин/V2-рецептором), нефрогенный DI (обусловленный аквапорином II), синдром Шарко-Мари-Тута (обусловленная периферическим миелиновым белком 22), болезнь Пелицеуса-Мерцбахера, нейродегенеративные болезни, такие как болезнь Альцгеймера (обусловленная βAPP и пресенилинами), болезнь Паркинсона, боковой амиотрофический склероз, прогрессирующий супрануклеарный паралич, болезнь Пика, некоторые неврологические нарушения, связанные с обменом полиглутамина, такие как болезнь Гентингтона, спинномозговая атаксия I типа, спинально-бульбарная мышечная атрофия, Дентаторубральная и паллидолюисовая атрофия и миотоническая дистрофия, а также губчатые энцефалопатии, такие как наследственная болезнь Крейтцфельдта-Якоба (обусловленная дефектом в процессинге прионного белка), болезнь Фабри (обусловленная лизосомальной α-галактозидазой A) и синдром Штраусслера-Шейнкера (обусловленный дефектом в процессинге Prp).
Помимо позитивной регуляции активности CFTR, снижение секреции анионов модуляторами CFTR может быть полезным для лечения секреторных диарей, в которых транспорт эпителиальной воды драматически возрастает в результате активированного стимулятором секреции транспорта хлорида. Механизм включает элевацию цАМФ и стимуляцию CFTR.
Хотя существует множество причин для возникновения диареи, главные последствия диарейных заболеваний, являющихся результатом избыточного транспорта хлорида, являются общими для всех и включают дегидратацию, ацидоз, нарушение роста и смерть.
Острые и хронические диареи являются острой медицинской проблемой во многих странах мира. Диареи, обе вышеуказанные, как правило, возникают при недостаточности или нарушении питания, и являются главной причиной смерти (5000000 смертей/год) у детей младше пяти лет.
Секреторные диареи также являются опасным состоянием для пациентов с синдромом приобретенного иммунного дефицита (СПИД) и хроническим воспалительным заболеванием толстой кишки (IBD). Каждый год у 16 миллионов путешественников по развивающимся странам из промышленно развитых стран обнаруживают диарею, причем серьзность заболевания и число случаев диареи варьируется в зависимости от страны и региона, выбранного для путешествия.
Диарея у животных, содержащихся в хлеву, и домашних животных, таких как коровы, свиньи и лошади, овца, козы, кошки и собаки, также известная как понос, является основной причиной смерти у этих животных. Диарея может быть результатом любого резкого перехода из одного состояния в другое, такого как отнятие ребенка от груди или физическое движение, а также в ответ на целый ряд бактериальных и вирусных инфекций и обычно случается в пределах первых нескольких часов жизни животного.
Наиболее распространенной бактерией, вызывающей диарею, является энтеропатогенная E.coli (ETEC), имеющая K99 pilus антиген. Общие вирусные причины диареи включают ротавирус и коронавирус. Другие возбудители инфекции включают Cryptosporidium, giardia lamblia и сальмонеллу, среди других.
Симптомы ротавирусной инфекции включают экскрецию жидких фекалий, дегидратацию и слабость. Коронавирус вызывает более тяжелую болезнь у новорожденных животных, и эта инфекция имеет более высокий коэффициент смертности, чем ротавирусная инфекция. Часто, однако, молодое животное может быть инфицировано более чем одним вирусом или комбинацией вирусных и бактериальных микроорганизмов одновременно. Такая ситуация драматически усусубляет серьезность заболевания.
Таким образом, существует потребность в модуляторах активности АВС-транспортеров и композициях, их содержащих, которые могут быть использованы для модуляции активности АВС-транспортера в клеточной мембране млекопитающего.
Существует потребность в способах лечения опосредованных АВС-транспортером заболеваний, использующих модуляторы активности АВС-транспортеров.
Существует потребность в способах модуляции активности АВС-транспортера в ex vivo клеточной мембране млекопитающего.
Существует потребность в модуляторах активности CFTR, которые могут быть использованы для модуляции активности CFTR в клеточной мембране млекопитающего.
Существует потребность в способах лечения CFTR-опосредованных заболеваний, использующих такие модуляторы активности CFTR.
Существует потребность в способах модуляции активности CFTR в ex vivo клеточной мембране млекопитающего.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩЕСТВА ИЗОБРЕТЕНИЯ
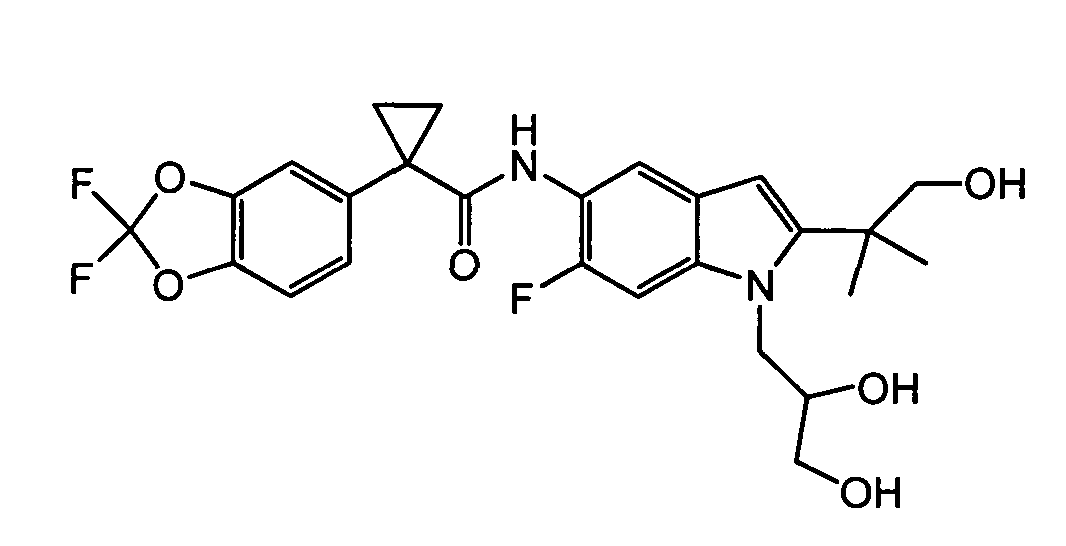
Авторами настоящего изобретения было обнаружено, что соединения по данному изобретению и содержащие их фармацевтически приемлемые композиции являются полезными в качестве модуляторов активности АВС-транспортеров, в частности, активности CTFR. Эти соединения представляют собой
В некоторых вариантах соединение представляет собой
В других вариантах соединение представляет собой
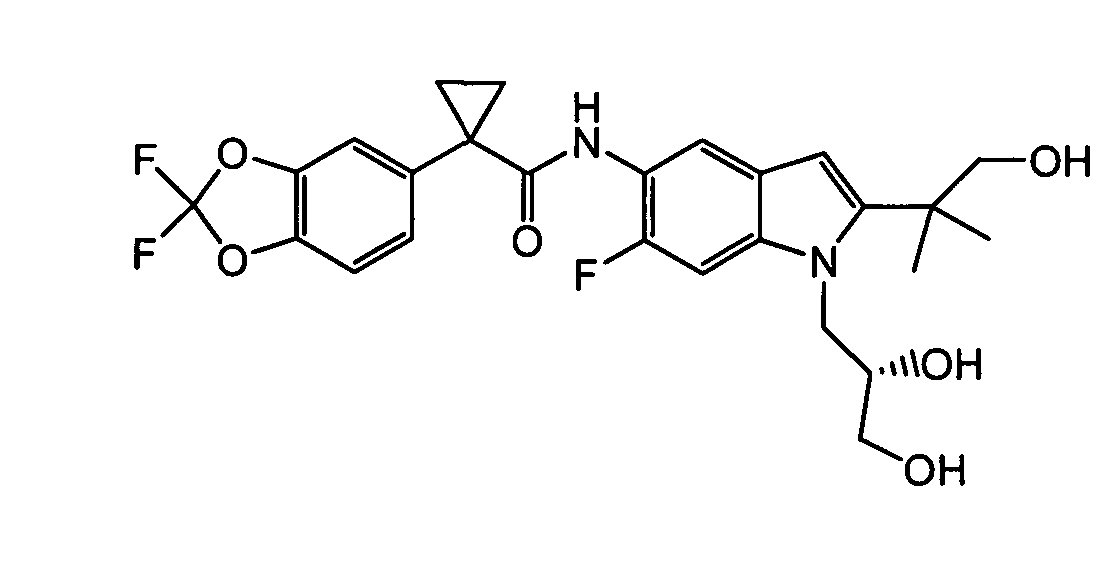
В следующих вариантах соединение представляет собой
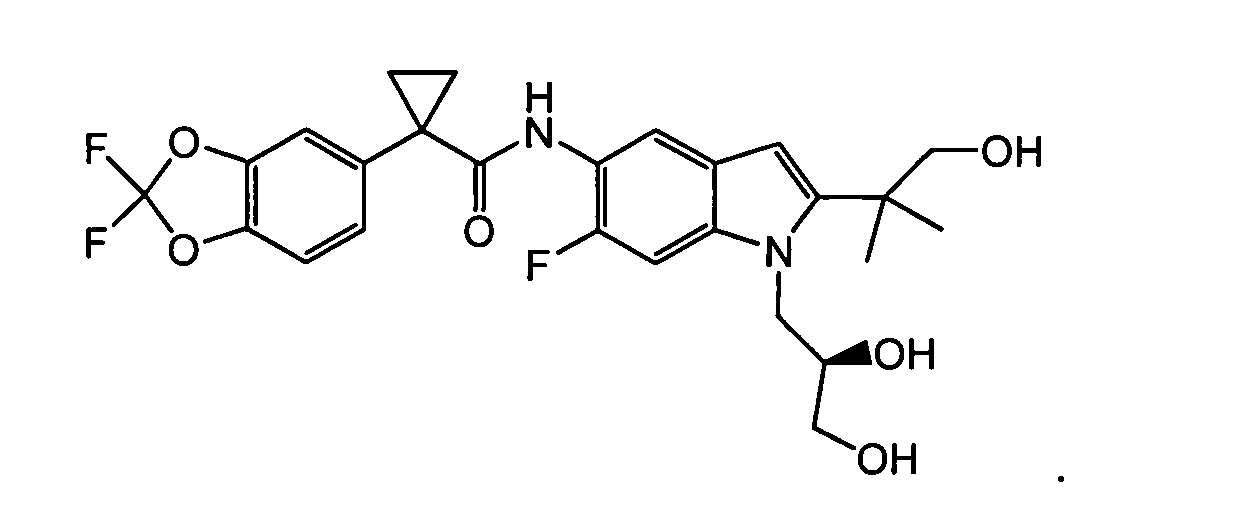
Соединения и фармацевтически приемлемые композиции используют для лечения или смягчения степени тяжести целого ряда заболеваний, расстройств или состояний, включая, но ими не ограничиваясь, муковисцидоз, наследственную эмфизему, наследственный гемохроматоз, недостаточности факторов свертывания крови и фибринстабилизирующего фактора, такие как дефицит белка С, наследственный ангионеврологический отек 1 типа, дефекты в процессинге липидов, такие как семейная гиперхолестеринемия, хиломикронемия 1 типа, абеталипопротеинемия, лизосомные болезни, такие как болезнь клеточных включений/псевдо-Хюрлера, мукополисахаридозы, болезнь Сандхоффа/Тея-Сакса, болезнь Криглера-Найяра II типа, полиэндокринопатия/гиперинсулинемия, сахарный диабет, карликовость Ларона, дефицит милеопероксидазы, первичный гипопаратиреоидизм, меланома, гликогеноз CDG 1 типа, наследственная эмфизема, врожденный гипертиреоидизм, несовершенный остеогенез, наследственная гипофибриногенемия, недостаточность ACT, несахарный диабет (di), нейрофизиологический, нефрогенный, синдром Шарко-Мари-Тута, болезнь Пелицеуса-Мерцбахера, нейродегенеративные заболевания, такие как болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз, прогрессирующий супрануклеарный паралич, болезнь Пика, некоторые неврологические нарушения, связанные с обменом полиглутамина, такие как болезнь Гентингтона, спинномозговая атаксия I типа, спинально-бульбарная мышечная атрофия, дентаторубральная и паллидолюисовая атрофия и миотоническая дистрофия, а также губчатые энцефалопатии, такие как наследственная болезнь Крейтцфельдта-Якоба, болезнь Фабри, синдром Штраусслера-Шейнкера, хроническое обструктивное заболевание легких (COPD), болезнь сухих глаз и синдром Шегрена.
Неожиданно было обнаружено, что соединения по данному изобретению обладают терапевтически полезными свойствами.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. ОПРЕДЕЛЕНИЯ
В настоящем описании, если не оговорено иначе, используются нижеследующие определения.
Используемый в настоящем описании термин "ABC-транспортер" означает белок ABC-транспортера или его фрагмент, содержащий по меньшей мере один связующий домен, и этот вышеуказанный белок или его фрагмент присутствует in vivo или in vitro. Используемый в настоящем описании термин "связующий домен" означает домен на ABC-транспортере, который может связываться с модулятором. См., например, Hwang, T. C. et al., J. Gen. Physiol. (1998): 111(3), 477-90.
Используемый в настоящем описании термин "CFTR" означает регулятор трансмембранной проводимости при муковисцидозе или его мутацию, способный регулировать активность, включающий, но не ограничиваясь ими, ΔF508 CFTR и G551D CFTR (см., например, http://www.genet.sickkids.on.ca/cftr/, для мутаций CFTR).
Используемый в настоящем описании термин "модуляция" означает увеличение или уменьшение, например, активности на измеримую величину. Соединения, которые модулируют активность ABC-транспортера, такую как активность CFTR, увеличивая активность ABC-транспортера, например, анионного канала CFTR, называют агонистами. Соединения, которые моделируют активность ABC-транспортера, такую как активность CFTR, снижая активность ABC-транспортера, например, анионного канала CFTR, называют антагонистами. Агонист взаимодействует с ABC-транспортером, таким как анионный канал CFTR, повышая способность рецептора передавать внутриклеточный сигнал в ответ на связывание эндогенного лиганда. Антагонист взаимодействует с ABC-транспортером, таким как анионный канал CFTR, и конкурирует с эндогенным лигандом(ами) или субстратом(ами) за сайт(ы) связывания на рецепторе, снижая тем самым способность рецептора передавать внутриклеточный сигнал в ответ на связывание эндогенного лиганда.
Выражение "лечение или снижение степени тяжести заболевания, опосредованного ABC-транспортером" относится как к лечениям заболеваний, которые непосредственно вызваны активностями ABC-транспортера и/или CFTR, так и смягчению симптомов течения заболеваний, не вызванных непосредственно активностями ABC-транспортеров и/или анионного канала CFTR. Примеры заболеваний, симптомы которых могут подвергаться воздействию активности ABC-транспортера и/или CFTR, включают, но не ограничиваясь ими, муковисцидоз, наследственную эмфизему, наследственный гемохроматоз, недостаточности факторов свертывания крови и фибринстабилизирующего фактора, такие как дефицит белка C, наследственный ангионевротический отек типа 1, дефекты в процессинге липидов, такие как семейная гиперхолестеринемия, хиломикронемия 1 типа, абеталипопротеинемия, лизосомные болезни, такие как болезнь клеточных включений/псевдо-Хюрлера, мукополисахаридозы, болезнь Сандхоффа/Тея-Сакса, болезнь Криглера-Найяра II типа, полиэндокринопатия/гиперинсулинемия, сахарный диабет, карликовость Ларона, дефицит милеопероксидазы, первичный гипопаратиреоидизм, меланома, гликогеноз CDG 1 типа, наследственная эмфизема, врожденный гипертиреоидизм, несовершенный остеогенез, наследственная гипофибриногенемия, недостаточность ACT, несахарный диабет (DI), нейрофизиологический DI, нефрогенный DI, синдром Шарко-Мари-Тута, болезнь Пелицеуса-Мерцбахера, нейродегенеративные заболевания, такие как болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз, прогрессирующий супрануклеарный паралич, болезнь Пика, некоторые неврологические нарушения, связанные с обменом полиглутамина, такие как болезнь Гентингтона, спинномозговая атаксия 1 типа, спинально-бульбарная мышечная атрофия, дентаторубральная и паллидолюисовая атрофия и миотоническая дистрофия, а также губчатые энцефалопатии, такие как наследственная болезнь Крейтцфельдта-Якоба, болезнь Фабри, синдром Штраусслера-Шейнкера, хроническое обструктивное заболевание легких (COPD), болезнь сухих глаз и синдром Шегрена.
Для этого изобретения химические элементы идентифицированы в соответствии с Периодической системой химических элементов, CAS версия, Handbook of Chemistry and Physics, 75th Ed. Кроме того, общие принципы органической химии описаны в "Organic Chemistry", Thomas Sorrell, University Science Books, Sausolito: 1999, and “March's Advanced Organic Chemistry”, 5th Ed., Smith, M.B. and March, J., John Wiley & Sons, New York: 2001, полное содержание которых тем самым включено в настоящее описание в виде ссылки.
Как описано в настоящем описании, соединения по данному изобретению могут быть необязательно замещены одним или несколькими заместителями, такими как иллюстрированы в общих чертах выше или представлены конкретными классами, подклассами и разновидностью данного изобретения.
Используемый в настоящем описании термин «алифатик» охватывает термины «алкил», «алкенил», «алкинил», каждый из которых является необязательно замещенным, как изложено ниже.
Как используется в настоящем описании, “алкильная” группа относится к насыщенной алифатической углеводородной группе, содержащей 1-12 (например, 1-8, 1-6 или 1-4) углеродных атомов. Алкильная группа может быть прямой или разветвленной. Примеры алкильной группы включают, но этим не ограничиваясь, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, н-пентил, н-гептил или 2-этилгексил. Алкильная группа может быть замещенной (т.е. необязательно замещенной) одним или несколькими заместителями, такими как галоген, фосфо, циклоалифатический заместитель [например, циклоалкил или циклоалкенил], гетероциклоалифатический заместитель [например, гетероциклоалкил или гетероциклоалкенил], арил, гетероарил, алкокси, ароил, гетероароил, ацил [например, (алифатик)карбонил, (циклоалифатик)карбонил или (гетероциклоалифатик(карбонил], нитро, циано, амидо [например, (циклоалкилалкил)карбониламино, арилкарбониламино, аралкилкарбониламино, (гетероциклоалкил)карбониламино, (гетероциклоалкилалкил)карбониламино, гетероарилкарбониламино, гетероаралкилкарбониламино, алкиламинокарбонил, циклоалкиламинокарбонил, гетероциклоалкиламинокарбонил, ариламинокарбонил или гетероариламинокарбонил], амино [например, алифатикамино, циклоалифатикамино или гетероциклоалифатикамино], сульфонил [например, алифатик-SO2-], сульфинил, сульфанил, сульфокси, мочевина, тиомочевина, сульфамоил, сульфамид, оксо, карбокси, карбамоил, циклоалифатикокси, гетероциклоалифатикокси, арилокси, гетероарилокси, аралкилокси, гетероарилалкокси, алкоксикарбонил, алкилкарбонилокси или гидрокси. Без ограничения, некоторые примеры замещенных алкилов включают карбоксиалкил (такой как НООС-алкил, алкоксикарбонилалкил и алкилкарбонилоксиалкил), цианоалкил, гидроксиалкил, алкоксиалкил, ацилалкил, аралкил, (алкоксиарил)алкил, (сульфониламино)алкил (такой как (алкил-SO2-амино)алкил), аминоалкил, амидоалкил, (циклоалифатик)алкил или галогеналкил.
Как используется в настоящем описании, “алкенильная” группа относится к алифатической углеродной группе, которая содержит 2-8 (например, 2-12, 2-6 или 2-4) углеродных атомов и по меньшей мере одну двойную связь. Подобно алкильной группе, алкенильная группа может быть прямой или разветвленной. Примеры алкенильной группы включают, но ими не ограничиваясь, аллил, изопренил, 2-бутенил и 2-гексенил. Алкенильная группа может быть необязательно замещена одним или несколькими заместителями, такими как галоген, фосфо, циклоалифатический заместитель [например, циклоалкил или циклоалкенил], гетероциклоалифатик [например, гетероциклоалкил или гетероциклоалкенил], арил, гетероарил, алкокси, ароил, гетероароил, ацил [например, (алифатик)карбонил, (циклоалифатик)карбонил или (гетероциклоалифатик)карбонил], нитро, циано, амидо [например, (циклоалкилалкил)карбониламино, арилкарбониламино, аралкилкарбониламино, (гетероциклоалкил)карбониламино, (гетероциклоалкилалкил)карбониламино, гетероарилкарбониламино, гетероаралкилкарбониламино, алкиламинокарбонил, циклоалкиламинокарбонил, гетероциклоалкиламинокарбонил, ариламинокарбонил или гетероариламинокарбонил], амино [например, алифатикамино, циклоалифатикамино, гетероциклоалифатикамино или алифатиксульфониламино], сульфонил [например, алкил-SO2-, циклоалифатик-SO2- или арил-SO2-], сульфинил, сульфанил, сульфокси, мочевина, тиомочевина, сульфамоил, сульфамид, оксо, карбокси, карбамоил, циклоалифатикокси, гетероциклоалифатикокси, арилокси, гетероарилокси, аралкилокси, гетероаралкокси, алкоксикарбонил, алкилкарбонилокси или гидрокси. Без ограничения, некоторые примеры замещенных алкенилов включают цианоалкенил, алкоксиалкенил, ацилалкенил, гидроксиалкенил, аралкенил, (алкоксиарил)алкенил, (сульфониламино)алкенил (такой как (алкил-SO2-амино)алкенил), аминоалкенил, амидоалкенил, (циклоалифатик)алкенил или галогеналкенил.
Используемый в настоящем описании термин "алкинильная" группа относится к алифатической углеродной группе, которая содержит 2-8 (например, 2-12, 2-6 или 2-4) углеродных атомов и имеет по меньшей мере одну тройную связь. Алкинильная группа может быть прямой или разветвленной. Примеры алкинильной группы включают, но ими не ограничиваются, пропаргил и бутинил. Алкинильная группа может быть необязательно замещенной одним или несколькими заместителями, такими как ароил, гетероароил, алкокси, циклоалкилокси, гетероциклоалкилокси, арилокси, гетероарилокси, аралкилокси, нитро, карбокси, циано, галоген, гидрокси, сульфо, меркапто, сульфанил [например, алифатиксульфанил или циклоалифатиксульфанил], сульфинил [например, алифатиксульфинил или циклоалифатиксульфинил], сульфонил [например, алифатик-SO2-, алифатикамино-SO2- или циклоалифатик-SO2-], амидо [например, аминокарбонил, алкиламинокарбонил, алкилкарбониламино, циклоалкиламинокарбонил, гетероциклоалкиламинокарбонил, циклоалкилкарбониламино, ариламинокарбонил, арилкарбониламино, аралкилкарбониламино, (гетероциклоалкил)карбониламино, (циклоалкилалкил)карбониламино, гетероаралкилкарбониламино, гетероарилкарбониламино или гетероариламинокарбонил], мочевина, тиомочевина, сульфамоил, сульфамид, алкоксикарбонил, алкилкарбонилокси, циклоалифатический заместитель, гетероциклоалифатический заместитель, арил, гетероарил, ацил [например, (циклоалифатик)карбонил или (гетероциклоалифатик)карбонил], амино [например, алифатикамино], сульфокси, оксо, карбокси, карбамоил, (циклоалифатик)окси, (гетероциклоалифатик)окси или (гетероарил)алкокси.
Используемый в настоящем описании термин "амидо" охватывает как "аминокарбонил", так и "карбониламино". Эти термины, при использовании в одиночку или в связи с другой группой, относятся к амидогруппе, такой как -N(Rx)-C(О)-Ry или -C(О)-N(Rx)2, при использовании на конце, и -C(О)-N(Rx)- или -N(Rx)-C(О)- при использовании внутри, в которой Rx и Ry такие, как определены ниже. Примеры амидогрупп включают алкиламидо (такую как алкилкарбониламино или алкиламинокарбонил), (гетероциклоалифатик)амидо, (гетероаралкил)амидо, (гетероарил)амидо, (гетероциклоалкил)алкиламидо, ариламидо, аралкиламидо, (циклоалкил)алкиламидо или циклоалкиламидо.
Используемый в настоящем описании термин "амино" группа относится к -NRxRy, в которой каждый из Rx и Ry представляет собой независимо водород, алифатическую группу, циклоалифатическую группу, (циклоалифатик)алифатическую группу, арил, аралифатическую группу, гетероциклоалифатическую группу, (гетероциклоалифатик)алифатическую группу, гетероарил, карбокси, сульфанил, сульфинил, сульфонил, (алифатик)карбонил, (циклоалифатик)карбонил, ((циклоалифатик)алифатик)карбонил, арилкарбонил, (аралифатик)карбонил, (гетероциклоалифатик)карбонил, ((гетероциклоалифатик)алифатик)карбонил, (гетероарил)карбонил или (гетероаралифатик)карбонил, при этом каждая из них является определенной в настоящем описании и необязательно замещенной. Примеры аминогрупп включают алкиламино, диалкиламино или ариламино. Если термин "амино" не является концевой группой (например, алкилкарбониламино), то он представляется группой -NRx-. Rx имеет такое же определение, как определено выше.
Используемый в настоящем описании термин "арильная" группа, используемый в одиночку или как часть большей составляющей группы как в случае "аралкил", "аралкокси" или "арилоксиалкил", относится к моноциклическим (например, фенил); бициклическим (например, инденил, нафталинил, тетрагидронафтил, тетрагидроинденил); и трициклическим (например, флуоренил, тетрагидрофлуоренил или тетрагидроантраценил, антраценил) структурам, в которых моноциклическая структура является ароматической или в которых по меньшей мере один из циклов в бициклической или трициклической структуре является ароматическим. Бициклические и трициклические группы включают бензоконденсированные 2-3-членные карбоциклические структуры. Например, бензоконденсированная группа включает фенил, конденсированный с двумя или большим числом C4-8 карбоциклических частей. Арил является необязательно замещенным одним или несколькими заместителями, включая алифатический [например, алкил, алкенил или алкинил]; циклоалифатический; (циклоалифатик)алифатик; гетероциклоалифатик; (гетероциклоалифатик)алифатик; арил; гетероарил; алкокси; (циклоалифатик)окси; (гетероциклоалифатик)окси; арилокси; гетероарилокси; (аралифатик)окси; (гетероаралифатик)окси; ароил; гетероароил; амино; оксо (на неароматическом карбоцикле бензоконденсированного бициклического или трициклического арила); нитро; карбокси; амидо; ацил [например, (алифатик)карбонил; (циклоалифатик)карбонил; ((циклоалифатик)алифатик)карбонил; (аралифатик)карбонил; (гетероциклоалифатик)карбонил; ((гетероциклоалифатик)алифатик)карбонил; или (гетероаралифатик)карбонил]; сульфонил [например, алифатик-SO2- или амино-SO2-]; сульфинил [например, алифатик-S(O)- или циклоалифатик-S(O)-]; сульфанил [например, алифатик-S-]; циано; галоген; гидрокси; меркапто; сульфокси; мочевина; тиомочевина; сульфамоил; сульфамид; или карбамоил. Альтернативно, арил может быть незамещенным.
Неограничиваюшие примеры замещенных арилов включают галогенарил [например, моно-, ди- (такие как п,м-дигалогенарил), и (тригалоген)арил]; (карбокси)арил [например, (алкоксикарбонил)арил, ((аралкил)карбонилокси)арил и (алкоксикарбонил)арил]; (амидо)арил [например, (аминокарбонил)арил, (((алкиламино)алкил])аминокарбонил)арил, (алкилкарбонил)аминоарил, (ариламинокарбонил)арил и (((гетероарил)амино)карбонил)арил]; аминоарил [например, ((алкилсульфонил)амино)арил или ((диалкил)амино)арил]; (цианоалкил)арил; (алкокси)арил; (сульфамоил)арил [например, (аминосульфонил)арил]; (алкилсульфонил)арил; (циано)арил; (гидроксиалкил)арил; ((алкокси)алкил)арил; (гидрокси)арил, ((карбокси)алкил)арил; (((диалкил)амино)алкил)арил; (нитроалкил)арил; (((алкилсульфонил)амино)алкил)арил; ((гетероциклоалифатик)карбонил)арил; ((алкилсульфонил)алкил)арил; (цианоалкил)арил; (гидроксиалкил)арил; (алкилкарбонил)арил; алкиларил; (тригалогеналкил)арил; п-амино-м-алкоксикарбониларил; п-амино-м-цианоарил; п-галоген-м-аминоарил; или (м-(гетероциклоалифатик)-о-(алкил)арил.
Используемый в настоящем описании термин "аралифатик", такой как "аралкильная" группа, относится к алифатической группе (например, C1-4 алкильная группа), которая замещена арильной группой. "Алифатик", "алкил" и "арил" такие, как определены в настоящем описании. Примером аралифатической группы, такой как аралкильная группа, является бензил.
Используемый в настоящем описании термин "аралкильная" группа относится к алкильной группе (например, C1-4 алкильная группа), которая замещена арильной группой. Как "алкил", так и "арил" были определены выше. Примером аралкильной группы является бензил. Аралкил является необязательно замещенным одним или несколькими заместителями, такими как алифатическая группа [например, алкил, алкенил или алкинил, включая карбоксиалкил, гидроксиалкил или галогеналкил, такой как трифторметил], циклоалифатик [например, циклоалкил или циклоалкенил], (циклоалкил)алкил, гетероциклоалкил, (гетероциклоалкил)алкил, арил, гетероарил, алкокси, циклоалкилокси, гетероциклоалкилокси, арилокси, гетероарилокси, аралкилокси, гетероаралкилокси, ароил, гетероароил, нитро, карбокси, алкоксикарбонил, алкилкарбонилокси, амидо [например, аминокарбонил, алкилкарбониламино, циклоалилкарбониламино, (циклоалкилалкил)карбониламино, арилкарбониламино, аралкилкарбониламино, (гетероциклоалкил)карбониламино, (гетероциклоалкилалкил)карбониламино, гетероарилкарбониламино или гетероаралкилкарбониламино], циано, галоген, гидрокси, ацил, меркапто, алкилсульфанил, сульфокси, мочевина, тиомочевина, сульфамоил, сульфамид, оксо или карбамоил.
Используемый в настоящем описании термин “бициклическая структура” включает 8-12 (например, (9-, 10- или 11)-членные структуры, которые образуют два цикла, в которых два цикла имеют по меньшей мере один атом совместно (например, 2 атома совместно). Бициклические структуры включают бициклоалифатические структуры (например, бициклоалкил или бициклоалкенил), бициклогетероалифатические структуры, бициклические арилы и бициклические гетероарилы.
Как используется в настоящем описании, “карбоцикл” или “циклоалифатическая” группа охватывает “циклоалкильную” группу и “циклоалкенильную” группу, причем каждая из них является необязательно замещенной, как изложено ниже.
Как используется в настоящем описании, “циклоалкильная” группа относится к насыщенной карбоциклической моно- или бициклической (конденсированной или соединенной мостиковой связью) структуре из 3-10 (например, 5-10) углеродных атомов. Примеры циклоалкильных групп включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, адамантил, норборнил, кубил, октагидроинденил, декагидронафтил, бицикло[3.2.1]октил, бицикло[2.2.2]октил, бицикло[3.3.1]нонил, бицикло[3.3.2]децил, бицикло[2.2.2]октил, адамантил или ((аминокарбонил)циклоалкил)циклоалкил.
Используемая в настоящем описании “циклоалкенильная” группа относится к неароматической карбоциклической структуре из 3-10 (например, 4-8) углеродных атомов, имеющей одну или несколько двойных связей. Примеры циклоалкенильных групп включают циклопентенил, 1,4-циклогексадиенил, циклогептенил, циклооктенил, гексагидроинденил, октагидронафтил, циклогексенил, циклопентенил, бицикло[2.2.2]октенил или бицикло[3.3.1]ноненил.
Циклоалкильная или циклоалкенильная группа может быть необязательно замещенной одним или несколькими заместителями, такими как фосфор, алифатическая группа [например, алкил, алкенил или алкинил], циклоалифатическая группа, (циклоалифатик)алифатик, гетероциклоалифатик, (гетероциклоалифатик)алифатик, арил, гетероарил, алкокси, (циклоалифатик)окси, (гетероциклоалифатик)окси, арилокси, гетероарилокси, (аралифатик)окси, (гетероаралифатик)окси, ароил, гетероароил, амино, амидо [например, (алифатик]карбониламино, (циклоалифатик)карбониламино, ((циклоалифатик)алифатик)карбониламино, (арил)карбониламино, (аралифатик)карбониламино, (гетероциклоалифатик)карбониламино, ((гетероциклоалифатик)алифатик)карбониламино, (гетероарил)карбониламино, или (гетероаралифатик)карбониламино], нитро, карбокси [например, HOOC-, алкоксикарбонил или алкилкарбонилокси], ацил [например, (циклоалифатик)карбонил, ((циклоалифатик)алифатик)карбонил, (аралифатик)карбонил, (гетероциклоалифатик)карбонил, ((гетероциклоалифатик)алифатик)карбонил или (гетероаралифатик)карбонил], циано, галоген, гидрокси, меркапто, сульфонил [например, алкил-SO2- и арил-SO2-], сульфинил [например, алкил-S(O)-], сульфанил [например, алкил-S-], сульфокси, мочевина, тиомочевина, сульфамоил, сульфамид, оксо, или карбамоил.
Используемый в настоящем описании термин "гетероцикл" или "гетероциклоалифатик" охватывает гетероциклоалкильную группу и гетероциклоалкенильную группу, при этом каждая из них является необязательно замещенной, как изложено ниже.
Используемый в настоящем описании термин "гетероциклоалкильная” группа относится к 3-10-членной моно- или бициклической (конденсированной или соединенной мостиковой связью) (например, 5-10-членная моно- или бициклическая) насыщенной структуре, в которой один или несколько из циклических атомов представляют собой гетероатом (например, N, O, S или их комбинацию). Примеры гетероциклоалкильной группы включают пиперидил, пиперазил, тетрагидропиранил, тетрагидрофурил, 1,4-диоксоланил, 1,4-дитианил, 1,3-диоксоланил, оксазолидил, изоксазолидил, морфолинил, тиоморфолил, октагидробензофурил, октагидрохроменил, октагидротиохроменил, октагидроиндолил, октагидропиридинил, декагидрохинолинил, октагидробензо[b]тиофенеил, 2-окса-бицикло[2.2.2]октил, 1-аза-бицикло[2.2.2]октил, 3-аза-бицикло[3.2.1]октил и 2,6-диокса-трицикло[3.3.1.03,7]нонил. Моноциклическая гетероциклоалкильная группа может быть конденсирована с фенильной частью с образованием структур, таких как тетрагидроизохинолин, которые можно классифицировать как гетероарилы.
Используемый в настоящем описании термин "гетероциклоалкенильная" группа относится к моно- или бициклической (например, 5-10-членная моно- или бициклическая) неароматической структуре, содержащей одну или несколько двойных связей, и в которой один или несколько из циклических атомов представляют собой гетероатом (например, N, O или S). Моноциклические и бициклические гетероциклоалифатические структуры нумеруют согласно стандартной химической номенклатуре.
Гетероциклоалкильная или гетероциклоалкенильная группа может быть необязательно замещена одним или несколькими заместителями, такими как фосфор, алифатическая группа [например, алкил, алкенил или алкинил], циклоалифатическая группа, (циклоалифатик)алифатическая группа, гетероциклоалифатическая группа, (гетероциклоалифатик)алифатическая группа, арил, гетероарил, алкокси, (циклоалифатик)окси, (гетероциклоалифатик)окси, арилокси, гетероарилокси, (аралифатик)окси, (гетероаралифатик)окси, ароил, гетероароил, амино, амидо [например, (алифатик)карбониламино, (циклоалифатик)карбониламино, ((циклоалифатик)алифатик)карбониламино, (арил)карбониламино, (аралифатик)карбониламино, (гетероциклоалифатик)карбониламино, ((гетероциклоалифатик)алифатик)карбониламино, (гетероарил)карбониламино или (гетероарилалифатик)карбониламино], нитро, карбокси [например, HOOC-, алкоксикарбонил или алкилкарбонилокси], ацил [например, (циклоалифатик)карбонил, ((циклоалифатик)алифатик)карбонил, (аралифатик)карбонил, (гетероциклоалифатик)карбонил, ((гетероциклоалифатик)алифатик)карбонил или (гетероаралифатик)карбонил], нитро, циано, галоген, гидрокси, меркапто, сульфонил [например, алкилсульфонил или арилсульфонил], сульфинил [например, алкилсульфинил], сульфанил [например, алкилсульфанил], сульфокси, мочевина, тиомочевина, сульфамоил, сульфамид, оксо или карбамоил.
Используемый в настоящем описании термин "гетероарильная" группа относится к моноциклической, бициклической или трициклической структуре, содержащей от 4 до 15 атомов в циклической структуре, в которой один или несколько из циклических атомов представляют собой гетероатом (например, N, O, S или их комбинацию) и в которой моноциклическая структура является ароматической или в которой по меньшей мере один из циклов в бициклической или трициклической структуре является ароматическим. Гетероарильная группа включает бензоконденсированную циклическую структуру, содержащую от 2 до 3 циклов. Например, бензоконденсированная группа включает бензо, конденсированный с одной или двумя 4-8-членными гетероциклоалифатическими составляющими частями (например, индолизил, индолил, изоиндолил, 3H-индолил, индолинил, бензо[b]фурил, бензо[b]тиофенил, хинолинил или изохинолинил). Некоторые примеры гетероарила представляют собой азетидинил, пиридил, 1H-индазолил, фурил, пирролил, тиенил, тиазолил, оксазолил, имидазолил, тетразолил, бензофурил, изохинолинил, бензтиазолил, ксантен, тиоксантен, фенотиазин, дигидроиндол, бензо[1,3]диоксол, бензо[b]фурил, бензо[b]тиофенил, индазолил, бензимидазолил, бензтиазолил, пурил, циннолил, хинолил, хиназолил, циннолил, фталазил, хиназолил, хиноксалил, изохинолил, 4H-хинолизил, бензо-1,2,5-тиадиазолил или 1,8-нафтиридил.
Без ограничения, моноциклические гетероарилы включают фурил, тиофенил, 2H-пирролил, пирролил, оксазолил, тазолил, имидазолил, пиразолил, изоксазолил, изотиазолил, 1,3,4-тиадиазолил, 2H-пиранил, 4H-пранил, пиридил, пиридазил, пиримидил, пиразолил, пиразил или 1,3,5-триазил. Моноциклические гетероарилы нумеруют согласно стандартной химической номенклатуре.
Без ограничения, бициклические гетероарилы включают индолизил, индолил, изоиндолил, 3H-индолил, индолинил, бензо[b]фурил, бензо[b]тиофенил, хинолинил, изохинолинил, индолизинил, изоиндолил, индолил, бензо[b]фурил, бензо[b]тиофенил, индазолил, бензимидазил, бензтиазолил, пуринил, 4H-хинолизил, хинолил, изохинолил, циннолил, фталазил, хиназолил, хиноксалил, 1,8-нафтиридил или птеридил. Бициклические гетероарилы нумеруют согласно стандартной химической номенклатуре.
Гетероарил является необязательно замещенным одним или несколькими заместителями, такими как алифатическая группа [например, алкил, алкенил или алкинил]; циклоалифатическая группа; (циклоалифатик)алифатическая группа; гетероциклоалифатическая группа; (гетероциклоалифатик)алифатическая группа; арил; гетероарил; алкокси; (циклоалифатик)окси; (гетероциклоалифатик)окси; арилокси; гетероарилокси; (аралифатик)окси; (гетероаралифатик)окси; ароил; гетероароил; амино; оксо (на неароматическом карбоцикле или гетероцикле бициклического или трициклического гетероарила); карбокси; амидо; ацил [например, алифатиккарбонил; (циклоалифатик)карбонил; ((циклоалифатик)алифатик)карбонил; (аралифатик)карбонил; (гетероциклоалифатик)карбонил; ((гетероциклоалифатик)алифатик)карбонил; или (гетероаралифатик)карбонил]; сульфонил [например, алифатиксульфонил или аминосульфонил]; сульфинил [например, алифатиксульфинил]; сульфанил [например, алифатиксульфанил]; нитро; циано; галоген; гидрокси; меркапто; сульфокси; мочевина; тиомочевина; сульфамоил; сульфамид; или карбамоил. Альтернативно, гетероарил может быть незамещенным.
Неограничивающие примеры замещенных гетероарилоа включают (галоген)гетероарил [например, моно- и ди-(галоген)гетероарил]; (карбокси)гетероарил [например, (алкоксикарбонил)гетероарил]; цианогетероарил; аминогетероарил [например, ((алкилсульфонил)амино)гетероарил и ((диалкил)амино)гетероарил]; (амидо)гетероарил [например, аминокарбонилгетероарил, ((алкилкарбонил)амино)гетероарил, ((((алкил)амино)алкил)аминокарбонил)гетероарил, (((гетероарил)амино)карбонил)гетероарил, ((гетероциклоалифатик)карбонил)гетероарил и ((алкилкарбонил)амино)гетероарил]; (цианоалкил)гетероарил; (алкокси)гетероарил; (сульфамоил)гетероарил [например, (аминосульфонил)гетероарил]; (сульфонил)гетероарил [например, (алкилсульфонил)гетероарил]; (гидроксиалкил)гетероарил; (алкоксиалкил)гетероарил; (гидрокси)гетероарил; ((карбокси)алкил)гетероарил; (((диалкил)амино)алкил]гетероарил; (гетероциклоалифатик)гетероарил; (циклоалифатик)гетероарил; (нитроалкил)гетероарил; (((алкилсульфонил)амино)алкил)гетероарил; ((алкилсульфонил)алкил)гетероарил; (цианоалкил)гетероарил; (ацил)гетероарил [например, (алкилкарбонил)гетероарил]; (алкил)гетероарил и (галогеналкил)гетероарил [например, тригалогеналкилгетероарил].
Используемый в настоящем описании термин "гетероаралифатик" (такой как гетероаралкильная группа) относится к алифатической группе (например, C1-4 алкильная группа), которая замещена гетероарильной группой. "Алифатик", "алкил" и "гетероарил" были определены выше.
Используемый в настоящем описании термин "гетероаралкильная" группа относится к алкильной группе (например, C1-4 алкильная группа), которая замещена гетероарильной группой. Как "алкил", так и "гетероарил" были определены выше. Гетероаралкил является необязательно замещенным одним или несколькими заместителями, такими как алкил (включая карбоксиалкил, гидроксиалкил и галогеналкил, такой как трифторметил), алкенил, алкинил, циклоалкил, (циклоалкил)алкил, гетероциклоалкил, (гетероциклоалкил)алкил, арил, гетероарил, алкокси, циклоалкилокси, гетероциклоалкилокси, арилокси, гетероарилокси, аралкилокси, гетероаралкилокси, ароил, гетероароил, нитро, карбокси, алкоксикарбонил, алкилкарбонилокси, аминокарбонил, алкилкарбониламино, циклоалкилкарбониламино, (циклоалкилалкил)карбониламино, арилкарбониламино, аралкилкарбониламино, (гетероциклоалкил)карбониламино, (гетероциклоалкилалкил)карбониламино, гетероарилкарбониламино, гетероаралкилкарбониламино, циано, галоген, гидрокси, ацил, меркапто, алкилсульфанил, сульфокси, мочевина, тиомочевина, сульфамоил, сульфамид, оксо или карбамоил.
Используемые в настоящем описании термины "циклическая часть" и "циклическая группа" относятся к моно-, би- и трициклическим структурам, включая циклоалифатическую, гетероциклоалифатическую структуру, арил или гетероарил, каждая из которых была определена ранее.
Используемый в настоящем описании термин "бициклическая структура с внутренним мостиком" относится к бициклической гетероциклоалифатической структуре или бициклической циклоалифатической структуре, в которой циклы соединены мостиковой связью. Примеры бициклических структур с внутренним мостиком включают, но не ограничиваясь ими, адамантанил, норборнанил, бицикло[3.2.1]октил, бицикло[2.2.2]октил, бицикло[3.3.1]нонил, бицикло[3.2.3]нонил, 2-оксабицикло[2.2.2]октил, 1-азабицикло[2.2.2]октил, 3-азабицикло[3.2.1]октил и 2,6-диокса-трицикло[3.3.1.03,7]нонил. Бициклическая структура с внутренним мостиком может быть необязательно замещенной одним или несколькими заместителями, такими как алкил (включая карбоксиалкил, гидроксиалкил и галогеналкил, такой как трифторметил), алкенил, алкинил, циклоалкил, (циклоалкил)алкил, гетероциклоалкил, (гетероциклоалкил)алкил, арил, гетероарил, алкокси, циклоалкилокси, гетероциклоалкилокси, арилокси, гетероарилокси, аралкилокси, гетероаралкилокси, ароил, гетероароил, нитро, карбокси, алкоксикарбонил, алкилкарбонилокси, аминокарбонил, алкилкарбониламино, циклоалкилкарбониламино, (циклоалкилалкил)карбониламино, арилкарбониламино, аралкилкарбониламино, (гетероциклоалкил)карбониламино, (гетероциклоалкилалкил)карбониламино, гетероарилкарбониламино, гетероаралкилкарбониламино, циано, галоген, гидрокси, ацил, меркапто, алкилсульфанил, сульфокси, мочевина, тиомочевина, сульфамоил, сульфамид, оксо или карбамоил.
Используемый в настоящем описании термин "ацильная" группа относится к формильной группе или Rx-C(O)- (такой как алкил-C(О)-, также называемой "алкилкарбонил"), где Rx и "алкил" были определены ранее. Ацетил и пивалоил являются примерами ацильных групп.
Используемый в настоящем описании термин "ароил" или "гетероароил" относится к арил-C(O)- или гетероарил-C(O)-. Арильная и гетероарильная часть ароила или гетероароила является необязательно замещенной, как определено ранее.
Используемый в настоящем описании термин "алкокси" группа относится к алкил-О- группе, где "алкил" был определен ранее.
Используемый в настоящем описании термин "карбамоильная" группа относится к группе, имеющей структуру -О-CO-NRxRy или -NRx-CO-O-Rz, в которой Rx и Ry были определены выше и Rz может быть алифатической группой, арилом, аралифатической группой, гетероциклоалифатической группой, гетероарилом или гетероаралифатической группой.
Используемый в настоящем описании термин "карбокси" группа относится к -COOH, -COORx, -OC(О)H, -OC(О)Rx, при использовании в качестве концевой группы; или -OC(О)- или -C(О)О-, при использовании в качестве внутренней группы.
Используемый в настоящем описании термин "галогеналифатическая" группа относится к алифатической группе, замещенной 1-3 галогенами. Например, термин "галогеналкил" включает группу -CF3.
Используемый в настоящем описании термин "меркапто" группа относится к -SH.
Используемый в настоящем описании термин "сульфо" группа относится к -SO3H или -SO3Rx при использовании на конце или -S(О)3- при использовании внутри.
Используемый в настоящем описании термин "сульфамидная" группа относится к структуре -NRx-S(О)2-NRxRz при использовании на конце и -NRx-S(О)2-NRy- при использовании внутри, где Rx, Ry и Rz были определены выше.
Используемый в настоящем описании термин "сульфонамидная" группа относится к структуре -S(О)2-NRxRy или -NRx-S(О)2-Rz при использовании на конце; или -S(О)2-NRx или -NRx-S(О)2- при использовании внутри, где Rx, Ry и Rz такие, как определены выше.
Используемый в настоящем описании термин "сульфанильная" группа относится к -S-Rx при использовании на конце и -S- при использовании внутри, где Rx был определен выше. Примеры сульфанилов включают алифатик-S-, циклоалифатик-S-, арил-S- или т.п.
Используемый в настоящем описании термин "сульфинильная" группа относится к -S(О)-Rx при использовании в конце и -S(О)- при использовании внутри, где Rx был определен выше. Типичные сульфинильные группы включают алифатик-S(O)-, арил-S(O)-, (циклоалифатик(алифатик))-S(О)-, циклоалкил-S(O)-, гетероциклоалифатик-S(O)-, гетероарил-S(O)-, или т.п.
Используемый в настоящем описании термин "сульфонильная" группа относится к -S(О)2-Rx при использовании в конце и -S(О)2- при использовании внутри, где Rx был определен выше. Типичные сульфонильные группы включают алифатик-S(О)2-, арил-S(О)2-, (циклоалифатик(алифатик))-S(О)2-, циклоалифатик-S(О)2-, гетероциклоалифатик-S(О)2-, гетероарил-S(О)2-, (циклоалифатик(амидо(алифатик)))-S(О)2- или т.п.
Используемый в настоящем описании термин "сульфокси" группа относится к -O-SO-Rx или -SO-O-Rx, при использовании на конце и -O-S(O)- или -S(О)-О- при использовании внутри, где Rxбыл определен выше.
Используемый в настоящем описании термин "галоген" или "галогенидная" группа относится к фтору, хлору, брому или йоду.
Используемый в настоящем описании "алкоксикарбонил", который входит в группу, характеризуемую термином "карбокси", используемый в одиночку или в связи с другой группой, относится к группе, такой как алкил-O-C(O)-.
Используемый в настоящем описании термин "алкоксиалкил" относится к алкильной группе, такой как алкил-О-алкил-, где алкил такой, как определен выше.
Используемый в настоящем описании термин "карбонил" относится к -C(О)-.
Используемый в настоящем описании термин "оксо" относится к =О.
Используемый в настоящем описании термин "фосфо" относится к фосфинатам и фосфонатам. Примеры фосфинатов и фосфонатов включают -P(О)(RP)2, где RP представляет собой алифатическую группу, алкокси, арилокси, гетероарилокси, (циклоалифатик)окси, (гетероциклоалифатик)окси, арил, гетероарил, циклоалифатическую группу или амино.
Используемый в настоящем описании термин "аминоалкил" относится к структуре (Rx)2N-алкил-.
Используемый в настоящем описании термин "цианоалкил" относится к структуре (NC)-алкил-.
Как используется в настоящем описании термин "мочевинная" группа относится к структуре -NRx-CO-NRyRz и термин "тиомочевинная" группа относится к структуре -NRx-CS-NRyRz при использовании на конце и -NRx-CO-NRy- или -NRx-CS-NRz- при использовании внутри, где Rx, Ry и Rz были определены выше.
Используемый в настоящем описании термин "гуанидиновая" группа относится к структуре -N=C(N(RxRy))N(RxRy) или -NRx-C(=NRx)NRxRy, где Rx и Ry такие, как определены выше.
Используемый в настоящем описании термин "амидино" группа относится к структуре -C=(NRx)N(RxRy), где Rx и Ry такие, как определены выше.
В общем случае термин "соседний" относится к расположению заместителей на группе, которая содержит два или большее число атомов углерода, в которой заместители присоединены к соседним углеродным атомам.
В общем случае термин "сдвоенный" относится к расположению заместителей на группе, которая содержит два или большее число атомов углерода, в которой заместители присоединены к одному и тому же атому углерода.
Термины "на конце" и "внутри" относятся к расположению группы в пределах заместителя. Группа является концевой, если эта группа присутствует на конце заместителя, не связанного дополнительно с остатком химической структуры. Карбоксиалкил, т.е. RxO(О)C-алкил является примером карбоксигруппы, используемой на конце. Группа является внутренней, если эта группа присутствует в середине заместителя химической структуры. Алкилкарбокси (например, алкил-C(О)О- или алкил-OC(O)-) и алкилкарбоксиарил (например, алкил-C(О)О-арил- или алкил-O(CO)-арил-) являются примерами карбоксигрупп, используемых внутри.
Используемый в настоящем описании термин "алифатическая цепь" относится к разветвленной или прямой алифатической группе (например, алкильные группы, алкенильные группы или алкинильные группы). Прямая алифатическая цепь имеет структуру -[CH2]v-, где v равно 1-12. Разветвленная алифатическая цепь представляет собой прямую алифатическую цепь, которая замещена одной или несколькими алифатическими группами. Разветвленная алифатическая цепь имеет структуру -[CQQ]v-, где каждый Q представляет собой независимо водород или алифатическую группу; однако Q должен быть алифатической группой в по меньшей мере одном случае. Термин "алифатическая цепь" включает алкильные цепи, алкенильные цепи и алкинильные цепи, где алкил, алкенил и алкинил такие, как определены выше.
Выражение "необязательно замещенный” используют взаимозаменяемо с выражением "замещенный или незамещенный". Как описано в настоящем описании, соединения по данному изобретению могут быть необязательно замещенными одним или несколькими заместителями, такими как иллюстрированы в общих чертах выше, или представлены конкретными классами, подклассами и разновидностью данного изобретения. Как описано в настоящем описании, переменные R1, R2 и R3 и другие переменные, содержащиеся в формулах, описанных в настоящем описании, охватывают конкретные группы, такие как алкил и арил. Если не оговорено особо, каждая из конкретных групп для переменных R1, R2 и R3 и других переменных, содержащихся в них, может быть необязательно замещена одним или несколькими заместителями, описанными в настоящем описании. Каждый заместитель конкретной группы дополнительно необязательно замещен 1-3 заместителями, такими как галоген, циано, оксо, алкокси, гидрокси, амино, нитро, арил, циклоалифатическая, гетероциклоалифатическая группа, гетероарил, галогеналкил и алкил. Например, алкильная группа может быть замещена алкилсульфанилом и алкилсульфанил может быть необязательно замещен 1-3 заместителями, такими как галоген, циано, оксо, алкокси, гидрокси, амино, нитро, арил, галогеналкил и алкил. В качестве дополнительного примера, циклоалкильная часть (циклоалкил)карбониламино может быть необязательно замещена 1-3 заместителями, такими как галоген, циано, алкокси, гидрокси, нитро, галогеналкил и алкил. В тех случаях когда две алкоксигруппы связаны с одним и тем же атомом или соседними атомами, две алкоксигруппы могут образовать цикл вместе с атомом(ами), с которым(и) они связаны.
В общем, термин "замещенный" независимо от того, предшествует ли ему термин “необязательно” или нет, относится к замене водородных радикалов в данной структуре радикалом определенного заместителя. Конкретные заместители описаны выше в определениях и ниже в описании соединений и их примерах. Если не оговорено иначе, необязательно замещенная группа может иметь заместитель в каждом замещаемом положении группы, и в тех случаях, когда более чем одно положение в любой данной структуре может быть замещено более чем одним заместителем, выбранным из определенной группы, заместитель в каждом положении может быть либо одинаковым, либо отличным друг от друга. Циклический заместитель, такой как гетероциклоалкил, может быть связан с другим циклом, таким как циклоалкил, образуя спиробициклическую структуру, например, оба цикла имеют один общий атом. Как очевидно среднему специалисту в данной области, комбинации заместителей, предусматриваемые данным изобретением, представляют собой те комбинации, которые приводят к образованию стабильных или химически возможных соединений.
Выражение “стабильное или химически возможное”, используемое в настоящем описании, относится к соединениям, которые, по существу, не изменяются, когда их подвергают воздействию условий, предусматривающих их получение, обнаружение и, предпочтительно, их выделение, очистку и их использование для одной или большего числа целей, раскрываемых в настоящем описании. В некоторых вариантах стабильное соединение или химически возможное соединение представляет собой соединение, которое, по существу, не изменяется при хранении его при температуре 40°С или ниже, в отсутствие влаги или других химически активных условий, в течение по меньшей мере недели.
Используемое в настоящем контексте выражение “эффективное количество” определяют как количество, необходимое для достижения позитивного лечебного результата у пациента, подлежащего лечению, и это количество обычно определяют, исходя из возраста, площади поверхности, массы тела и состояния пациента. Взаимоотношение дозировок для животных и людей (исходя из миллиграммов на квадратный метр поверхности тела) описано Freireich et al., Cancer Chemother. Rep., 50: 219 (1966). Площадь поверхности тела может быть приблизительно определена, исходя из роста и массы тела пациента. См., например, Scientific Tables, Geigy Pharmaceuticals, Ardsley, New York, 537 (1970). Используемый в настоящем описании термин “пациент” относится к млекопитающему, включая человека.
Если не оговорено иначе, то структуры, описанные в настоящем описании, как предполагают, также включают все изомерные (например, энантиомерные, диастереомерные и геомерические (или конформационные) формы структуры; например, R- и S-конфигурации для каждого асимметрического центра, (Z)- и (E)-изомеры относительно двойной связи и конформационные (Z)- и (E)-изомеры. Следовательно, отдельные стереохимические изомеры, а также энантиомерные, диастереомерные и геометрические (или конформационные) смеси соединений по данному изобретению находятся в пределах объема данного изобретения. Если не оговорено иначе, то все таутомерные формы соединений по данному изобретению находятся в пределах объема данного изобретения. Кроме того, если не оговорено иначе, то структуры, описанные в настоящем описании, как предполагают, также включают соединения, которые отличаются только присутствием одного или нескольких изотопно обогащенных атомов. Например, соединения, имеющие настоящие структуры, за исключением замены водорода на дейтерий или тритий, или замены углерода на13С или14С-обогащенный углерод, также не выходят за рамки объема данного изобретения. Такие соединения используют, например, в качестве аналитических инструментов или зондов в количественных определениях биологической активности (например, лекарственного препарата), или в качестве лечебных средств.
Соединения по данному изобретению используют в качестве модуляторов АВС-транспортеров и используют для лечения заболеваний, опосредованных АВС-транспортерами.
II. СОЕДИНЕНИЯ
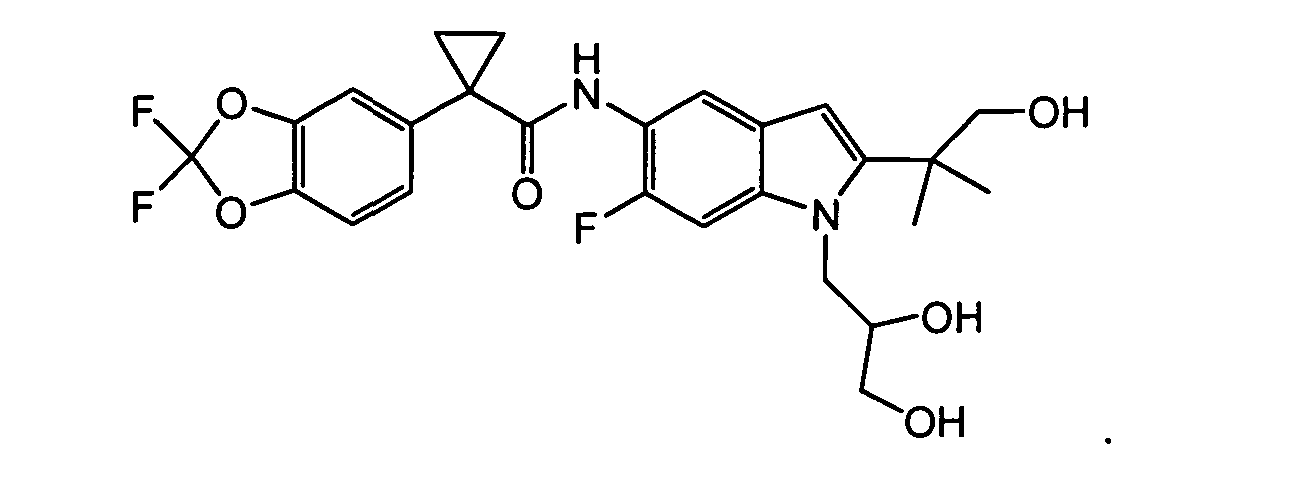
Соединения по данному изобретению представляют собой
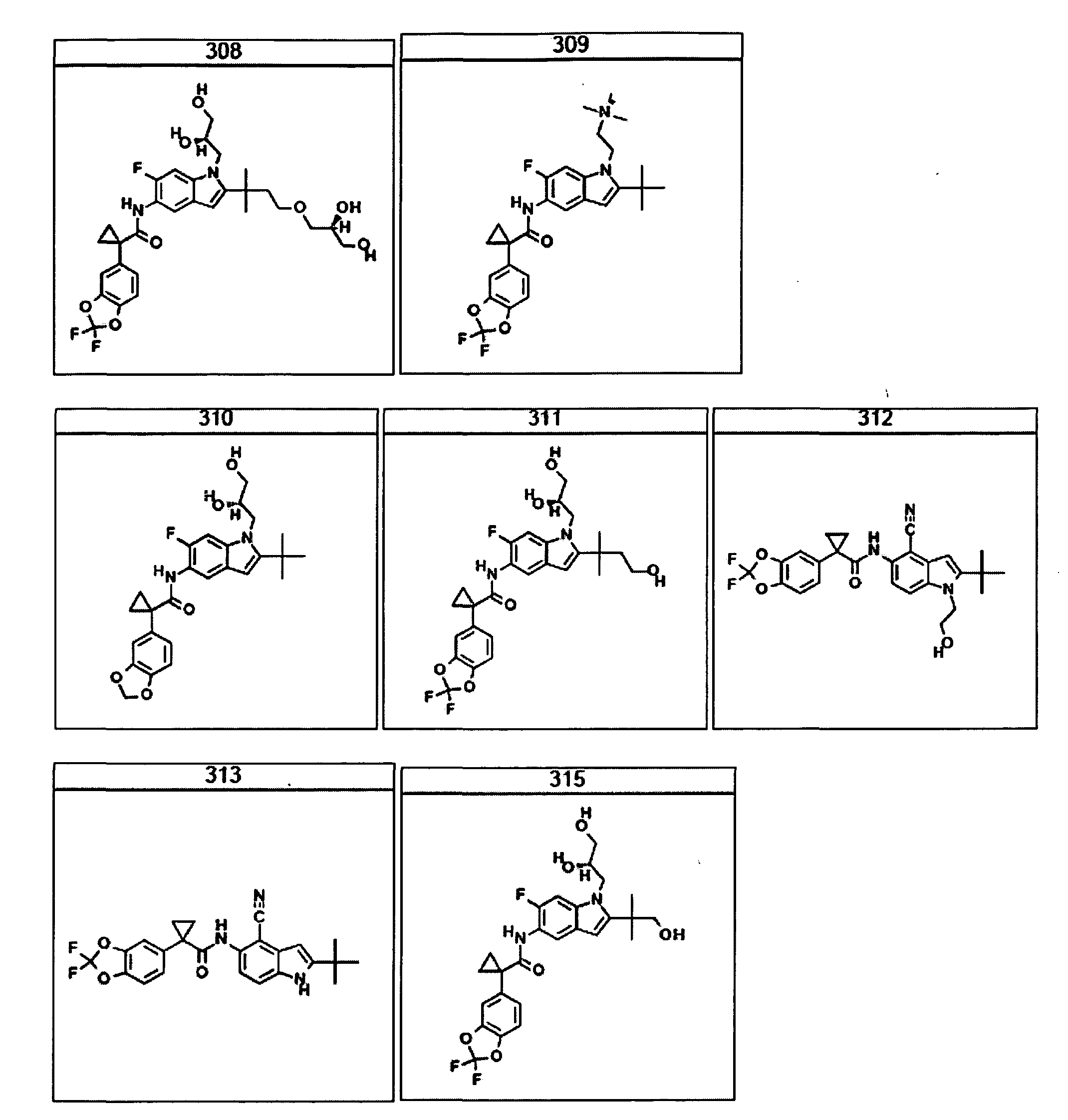
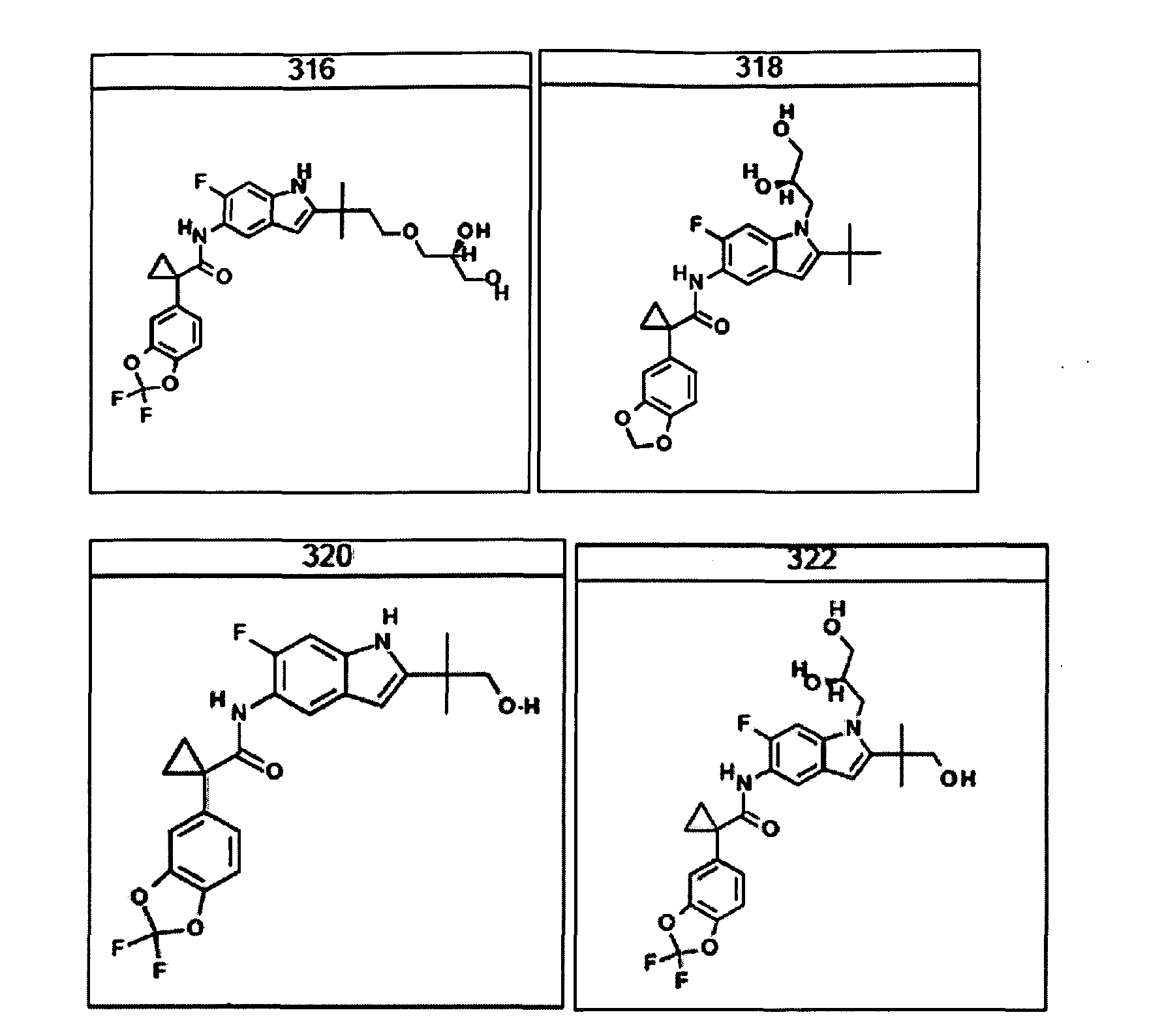
В другом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей (i) соединение по данному изобретению; и (ii) фармацевтически приемлемый носитель. В другом варианте композиция дополнительно содержит дополнительное средство, выбранное из муколитического средства, бронходилататора, антибиотика, дезинфицирующего средства, противовоспалительного средства, корректора CFTR или питательного средства. В другом варианте композиция дополнительно содержит дополнительное средство, выбранное из соединений, раскрытых в заявке на патент США № 11/165818, опубликованной в виде заявки на патент США № 2006/0074075, поданной 24 июня 2005 года и включенной в настоящее описание в полном объеме в виде ссылки. В другом варианте композиция дополнительно включает N-(5-гидрокси-2,4-дитрет-бутилфенил)-4-оксо-1H-хинолин-3-карбоксамид. Эти композиции используют для лечения заболеваний, описанных ниже, включая муковисцидоз. Эти композиции, кроме того, используют в наборах, описанных ниже.
В другом аспекте настоящее изобретение относится к способу увеличения количества функциональных АВС-транспортеров в мембране клетки, включающему стадию контактирования указанной клетки с соединением, выбранным из
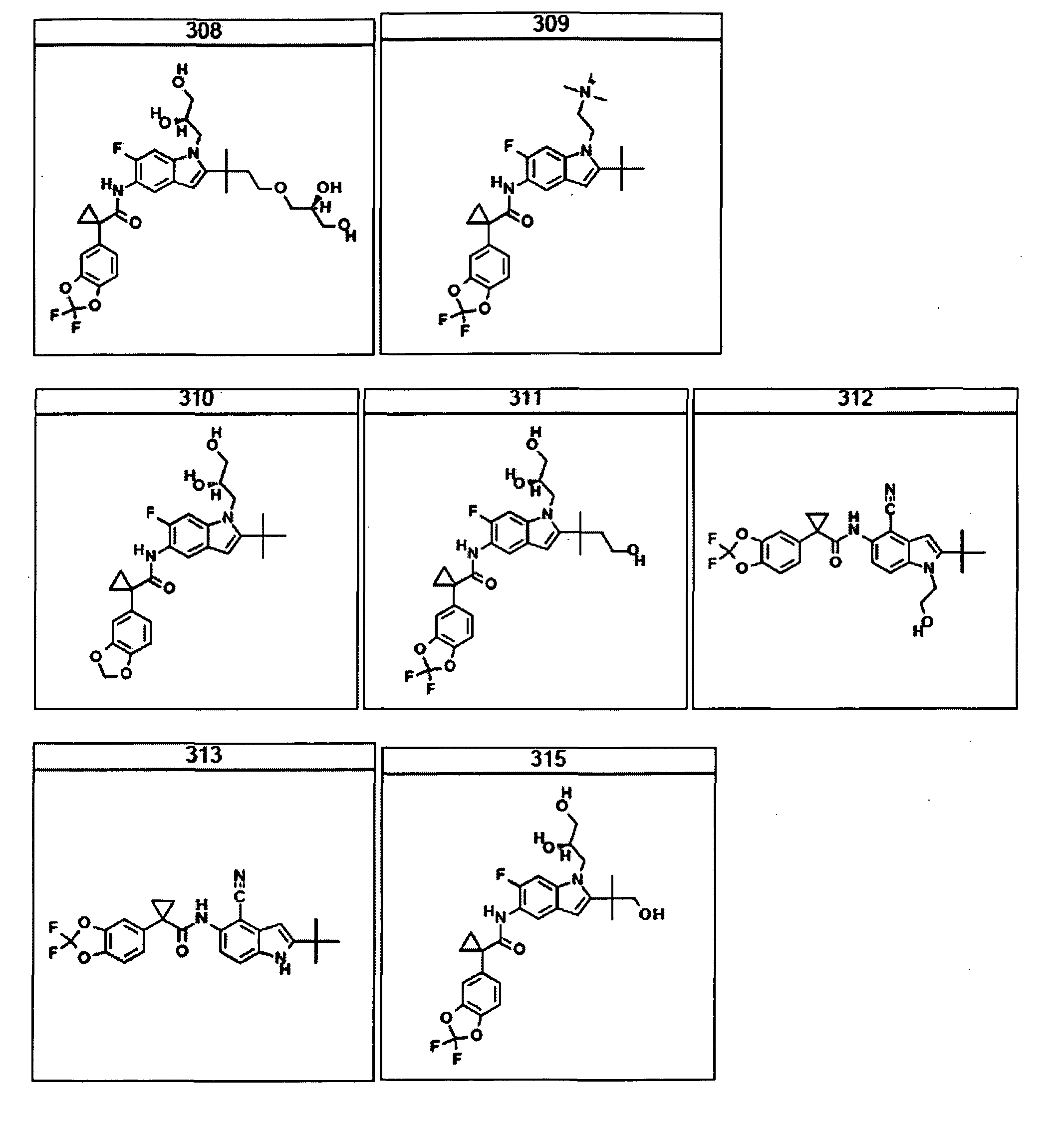


В одном варианте такого способа указанное состояние, заболевание или нарушение выбрано из муковисцидоза, наследственной эмфиземы, наследственного гемохроматоза, недостаточностей факторов свертывания крови и фибринстабилизирующего фактора, таких как дефицит белка С, наследственный ангионеврологический отек 1 типа, дефектов в процессинге липидов, таких как семейная гиперхолестеринемия, хиломикронемия 1 типа, абеталипопротеинемия, лизосомных болезней, таких как болезнь клеточных включений/псевдо-Хюрлера, мукополисахаридозы, болезнь Сандхоффа/Тея-Сакса, болезнь Криглера-Найяра II типа, полиэндокринопатия/гиперинсулинемия, сахарный диабет, карликовость Ларона, дефицит милеопероксидазы, первичный гипопаратиреоидизм, меланома, гликогеноз CDG 1 типа, наследственная эмфизема, врожденный гипертиреоидизм, несовершенный остеогенез, наследственная гипофибриногенемия, недостаточность ACT, несахарный диабет (di), нейрофизиологический di, нефрогенный DI, синдром Шарко-Мари-Тута, болезнь Пелицеуса-Мерцбахера, нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз, прогрессирующий супрануклеарный паралич, болезнь Пика, некоторых неврологических расстройств, связанных с обменом глутамина, таких как болезнь Гентингтона, спинномозговая атаксия I типа, спинально-бульбарная мышечная атрофия, дентаторубральная и паллидолюисовая атрофия и миотоническая дистрофия, а также губчатых энцефалопатий, таких как наследственная болезнь Крейтцфельдта-Якоба, болезнь Фабри, синдром Штраусслера-Шейнкера, хроническое обструктивное заболевание легких (COPD), болезнь сухих глаз и синдром Шегрена.
В другом аспекте настоящее изобретение относится к набору для использования его для измерения активности ABC-транспортера или его фрагмента в биологическом образце in vitro или in vivo, содержащему
(i) первую композицию, содержащую соединение, выбранное из
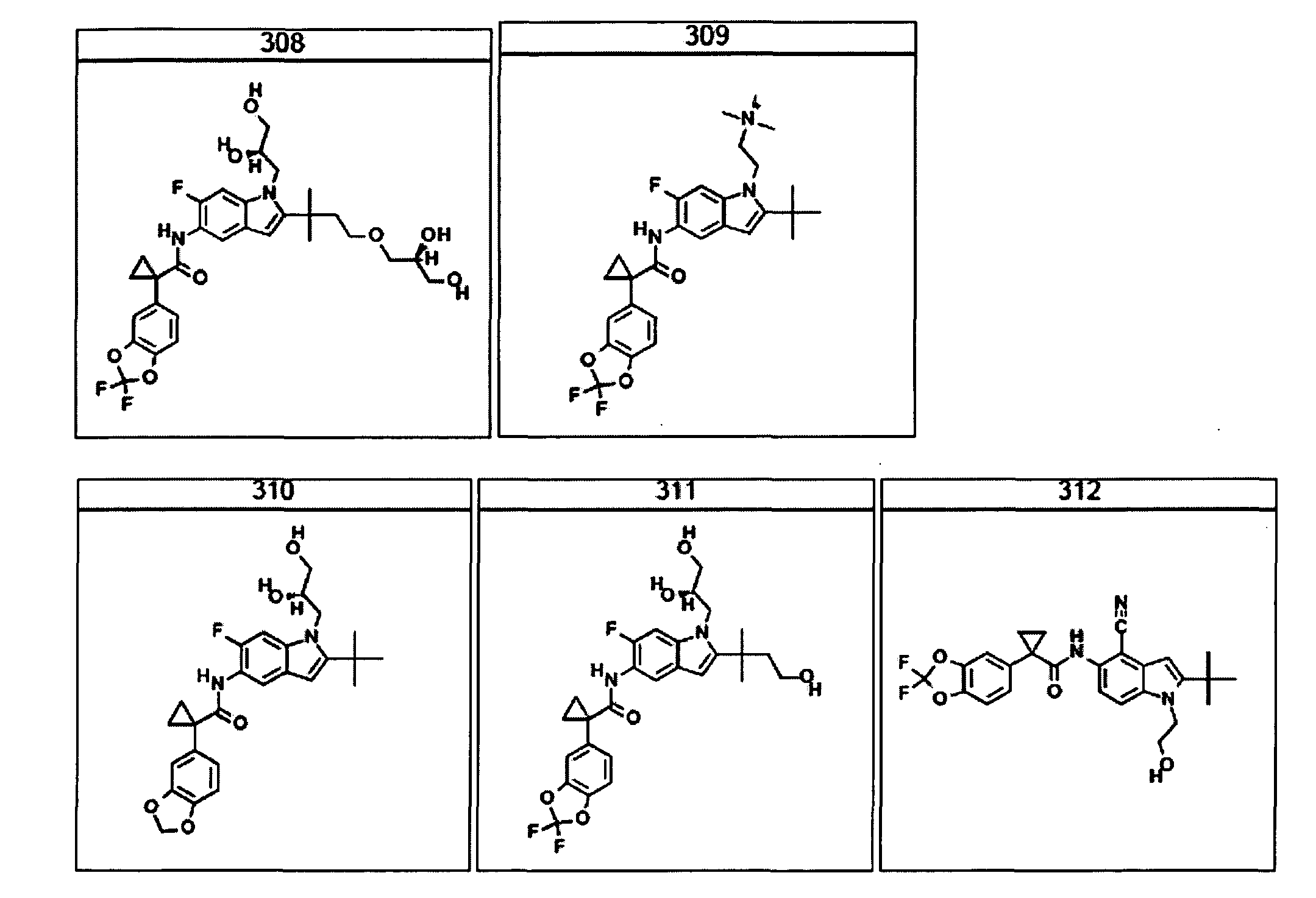

(b) измерение активности указанного ABC-транспортера или его фрагмента.
В одном варианте набор дополнительно содержит инструкции для (а) контактирования дополнительной композиции с биологическим образцом; (b) измерения активности указанного ABC-транспортера или его фрагмента в присутствии указанного дополнительного соединения и (с) сравнение активности ABC-транспортера в присутствии дополнительного соединения с плотностью ABC-транспортера в присутствии вышеуказанной первой композиции.
В одном варианте набор используют для измерения плотности CFTR.
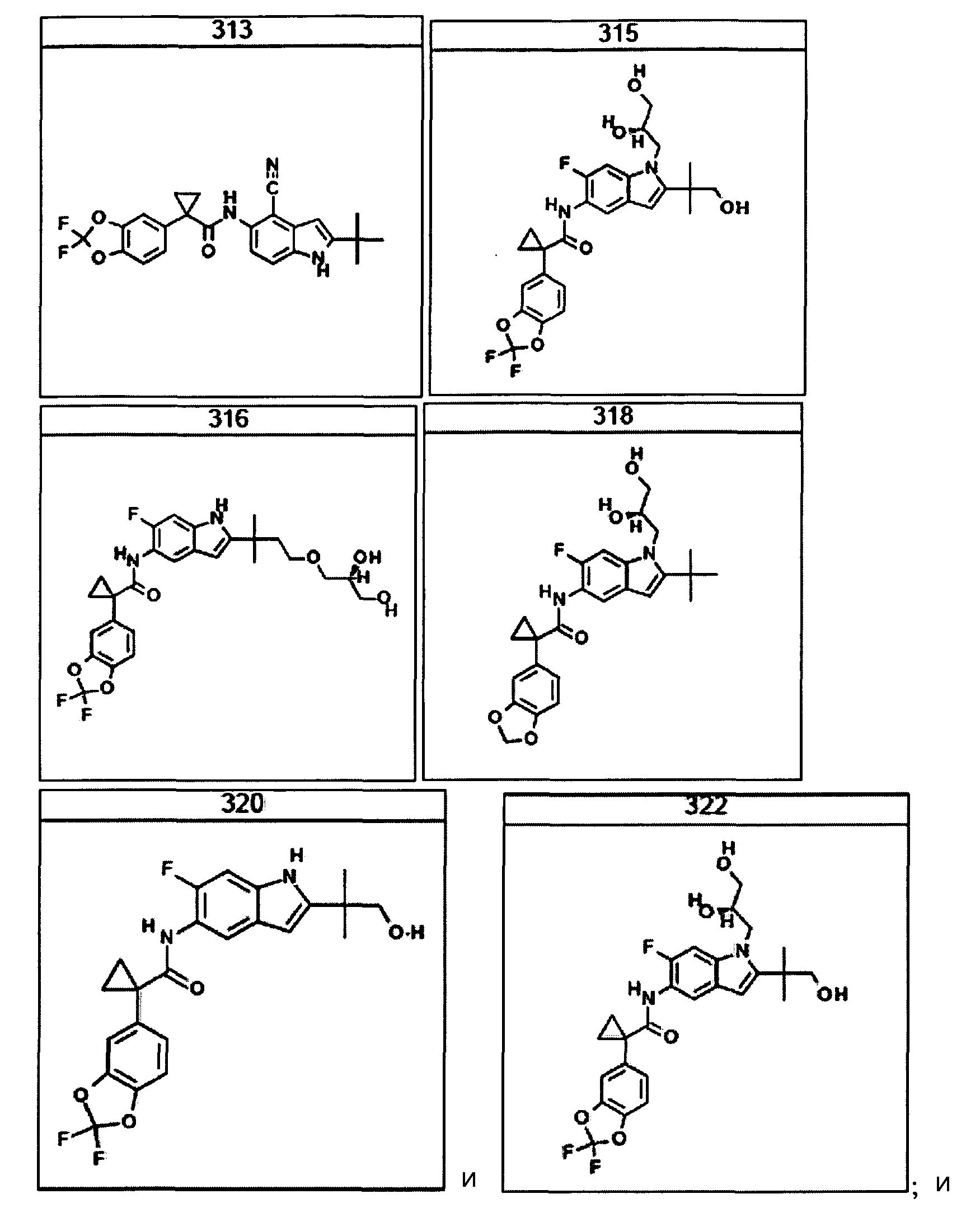
В некоторых вариантах из всех представленных выше аспектов соединение представляет собой
В других вариантах из всех представленных выше аспектов соединение представляет собой
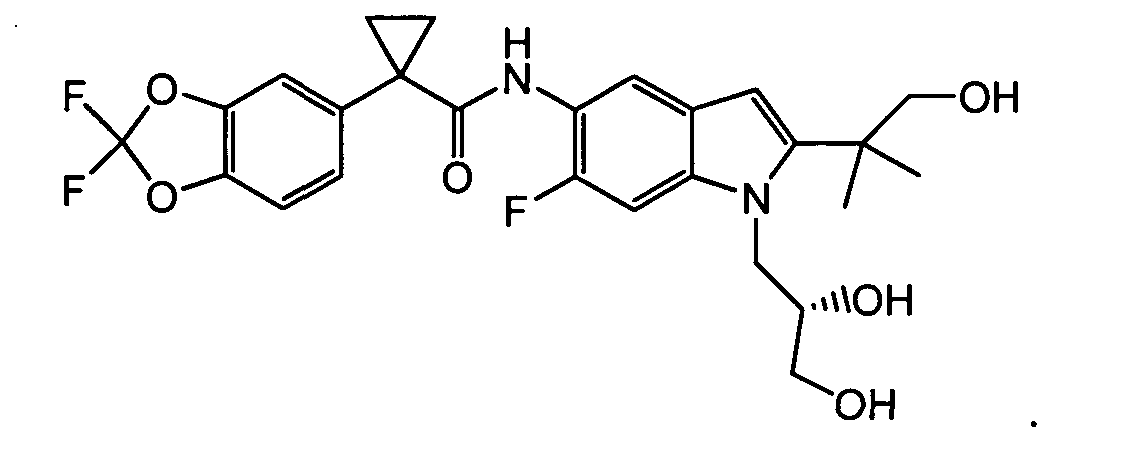
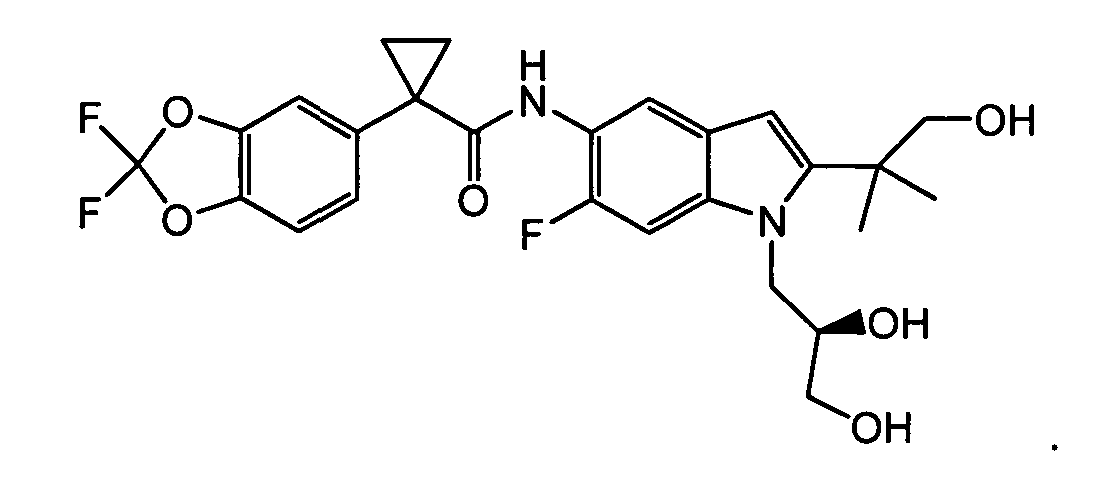
В следующих вариантах из всех представленных выше аспектов соединение представляет собой
IV. ОБЩИЕ СХЕМЫ СИНТЕЗА
Соединения по данному изобретению могут быть легко синтезированы из коммерчески доступных или известных исходных продуктов известными способами. В настоящем описании предлагаются типичные пути синтеза для получения соединений по данному изобретению.
V. ГОТОВЫЕ ЛЕКАРСТВЕННЫЕ ФОРМЫ, ВВЕДЕНИЕ И ИСПОЛЬЗОВАНИЕ
Соответственно, в другом аспекте настоящего изобретения предлагаются фармацевтически приемлемые композиции, и эти композиции содержат любое из соединений, описанных в настоящем описании, и необязательно содержат фармацевтически приемлемый носитель, адъювант или наполнитель. В некоторых вариантах эти композиции необязательно дополнительно содержат одно или несколько дополнительных лечебных средств.
Кроме того, следует иметь в виду, что некоторые из соединений по данному изобретению могут находиться в свободной форме для лечения или, где это уместно, в виде его фармацевтически приемлемого производного или пролекарства. Согласно данному изобретению фармацевтически приемлемое производное или пролекарство включает, но не ограничиваясь ими, фармацевтически приемлемые соли, сложные эфиры, соли таких сложных эфиров, или любой другой аддукт или производное, которое после введения пациенту, нуждающемуся в таком введении, способно обеспечить, непосредственно или косвенно, соединение, описанное, в общем, в данном контексте, или его метаболит или остаток.
Используемый в настоящем описании термин "фармацевтически приемлемая соль" относится к солям, которые, в пределах обоснованной медицинской оценки, являются подходящими для использования в контакте с тканями людей и низшими животными без проявления какой-либо неспецифической токсичности, раздражения, аллергической реакции и т.п., и соответствуют разумному соотношению польза/риск. "Фармацевтически приемлемая соль" означает любую нетоксичную соль или соль сложного эфира соединения по данному изобретению, которая, после введения реципиенту, способна обеспечить, либо непосредственно, либо косвенно, соединение по данному изобретению или его активный метаболит или остаток.
Фармацевтически приемлемые соли хорошо известны в данной области. Например, S.M. Berge, и др. подробно описывает фармацевтически приемлемые соли в J. Pharmaceutical Sciences, 1977, 66, 1-19, содержание которой включено в настоящее описание в виде ссылки. Фармацевтически приемлемые соли соединений по данному изобретению включают соли, полученные исходя из подходящих неорганических и органических кислот и оснований. Примеры фармацевтически приемлемых нетоксичных аддитивных солей кислоты представляют собой соли аминогруппы, образованные с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота, серная кислота и перхлорная кислота, или с органическими кислотами, такими как уксусная кислота, щавелевая кислота, малеиновая кислота, винная кислота, лимонная кислота, янтарная кислота или малоновая кислота, или путем использования других способов, используемых в данной области, таких как ионный обмен. Другие фармацевтически приемлемые соли включают такие соли, как адипат, альгинат, аскорбат, аспартат, бензосульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептонат, глицерофосфат, глюконат, гемисульфат, гептаноат, гексаноат, гидроиодид, 2-гидрокси-этансульфонат, лактобионат, лактат, лаурат, лаурилсульфат, малат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, стеарат, сукцинат, сульфат, тартрат, тиоционат, п-толуолсульфонат, ундеканоат, валерат и т.п. Соли, полученные из подходящих оснований, включают соли щелочных металлов, щелочно-земельных металлов, аммония и соли N+(C1-4алкил)4. Это изобретение также предусматривает кватернизацию любых содержащих основной азот групп соединений, раскрытых в настоящем описании. Такой кватернизацией можно получить растворимые или диспергируемые в воде или масле продукты. Репрезентативные соли щелочных или щелочно-земельных металлов включают соли натрия, лития, калия, кальция, магния и т.п. Дополнительные фармацевтически приемлемые соли включают, когда это необходимо, нетоксичные катионы аммония, четвертичного аммония и амина, образованные, используя противоионы, такие как галогенид, гидроксид, карбоксилат, сульфат, фосфат, нитрат, низший алкилсульфонат и арилсульфонат.
Как описано выше, фармацевтически приемлемые композиции по данному изобретению дополнительно содержат фармацевтически приемлемый носитель, адъювант или наполнитель, который, как используется в настоящем контексте, включает любой и все растворители, разбавители, или другой жидкий наполнитель, диспергирующие или суспендирующие добавки, поверхностно-активные вещества, изотонические средства, загустители или эмульгирующие средства, консерванты, твердые связующие, смазки и т.п., которые являются подходящими для требуемой конкретной лекарственной формы. В Remington's Pharmaceutical Sciences, Sixteenth Edition, E.W. Martin (Mack Publishing Co., Easton, Pa., 1980) раскрываются различные носители, используемые для приготовления фармацевтически приемлемых композиций и известные технологии для их получения. За исключением тех случаев, когда какая-либо обычная среда-носитель несовместима с соединениями по данному изобретению, а именно, провоцируя тем самым проявление какого-либо нежелательного биологического действия, или ее иного возможного взаимодействия губительным образом с какими-либо другим(ими) компонентом(ами) фармацевтически приемлемой композиции, использование обычной среды-носителя, как предполагают, находится в пределах объема данного изобретения. Некоторые примеры веществ, которые могут использоваться в качестве фармацевтически приемлемых носителей, включают, но ими не ограничиваются, иониты, оксид алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как человеческий сывороточный альбумин, буферные вещества, такие как фосфаты, глицин, сорбиновую кислоту или сорбат калия, смеси частичных глицеридов насыщенных растительных жирных кислот, воду, соли или электролиты, такие как сульфат протамина, динатрий гидрофосфат, гидрофосфат калия, хлорид натрия, соли цинка, коллоидный кремнезем, трисиликат магния, поливинилпирролидон, полиакрилаты, воски, блок-сополимеры этилен-оксипропилен, ланолин, сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу и ее производные, такие как натрий-карбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; порошкообразный трагакант; солод; желатин; тальк; наполнители, такие как масло какао и воски для суппозитория; масла, такие как арахисовое масло, хлопковое масло; сафлоровое масло; кунжутное масло; оливковое масло; кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль или полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буферные вещества, такие как гидроксид магния и гидроксид алюминия; альгиновую кислоту; апирогенную воду; изотонический солевой раствор, раствор Рингера; этиловый спирт и фосфатные буферные растворы, а также другие нетоксичные совместимые смазки, такие как лаурилсульфат натрия и стеарат магния, а также красители, средства, способствующие высвобождению; вещества для покрытия, подслащивающие, вкусовые и ароматизирующие вещества, консерванты и антиоксиданты, могут также присутствовать в композиции, согласно мнению составителя рецептуры.
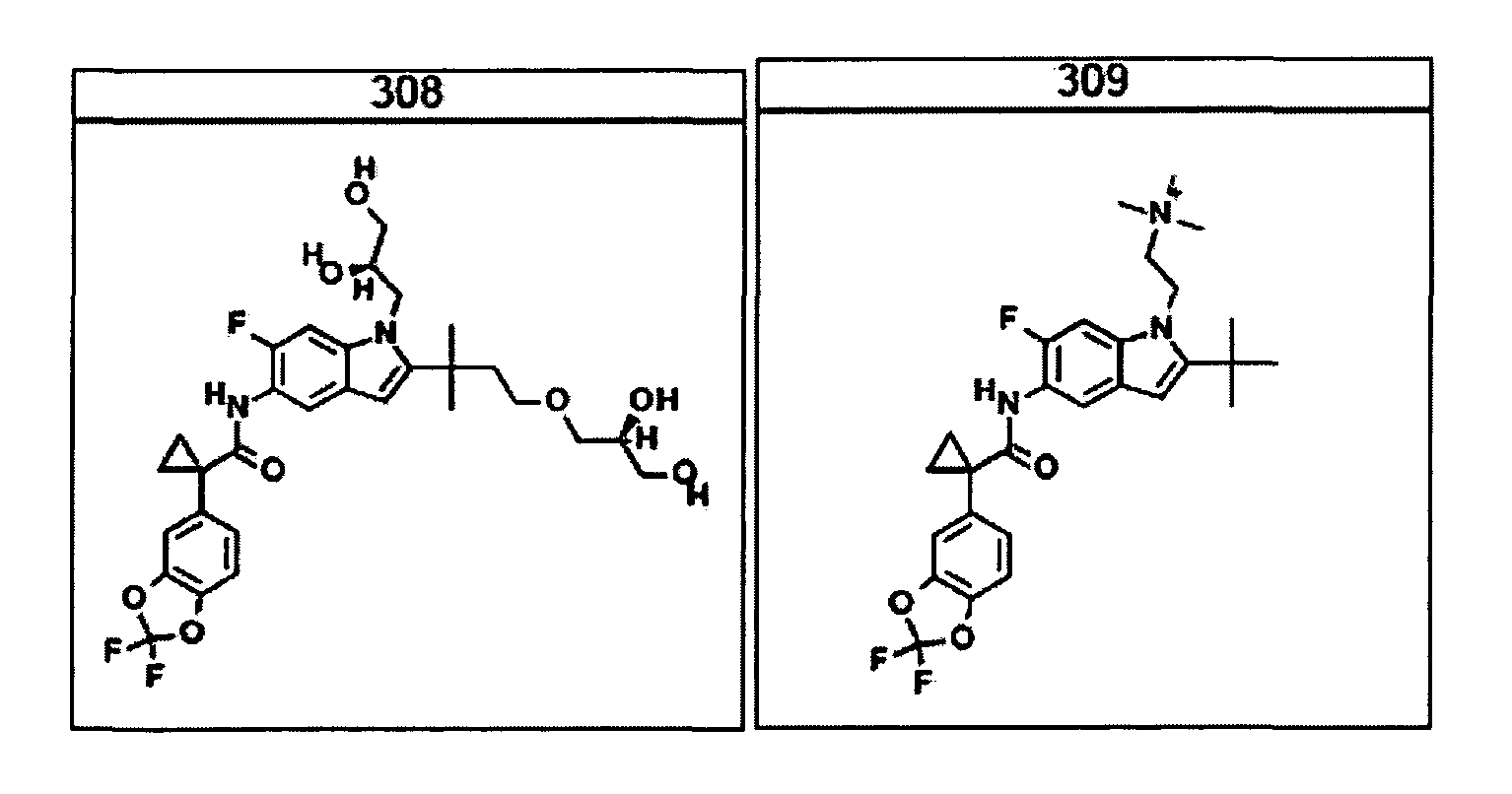
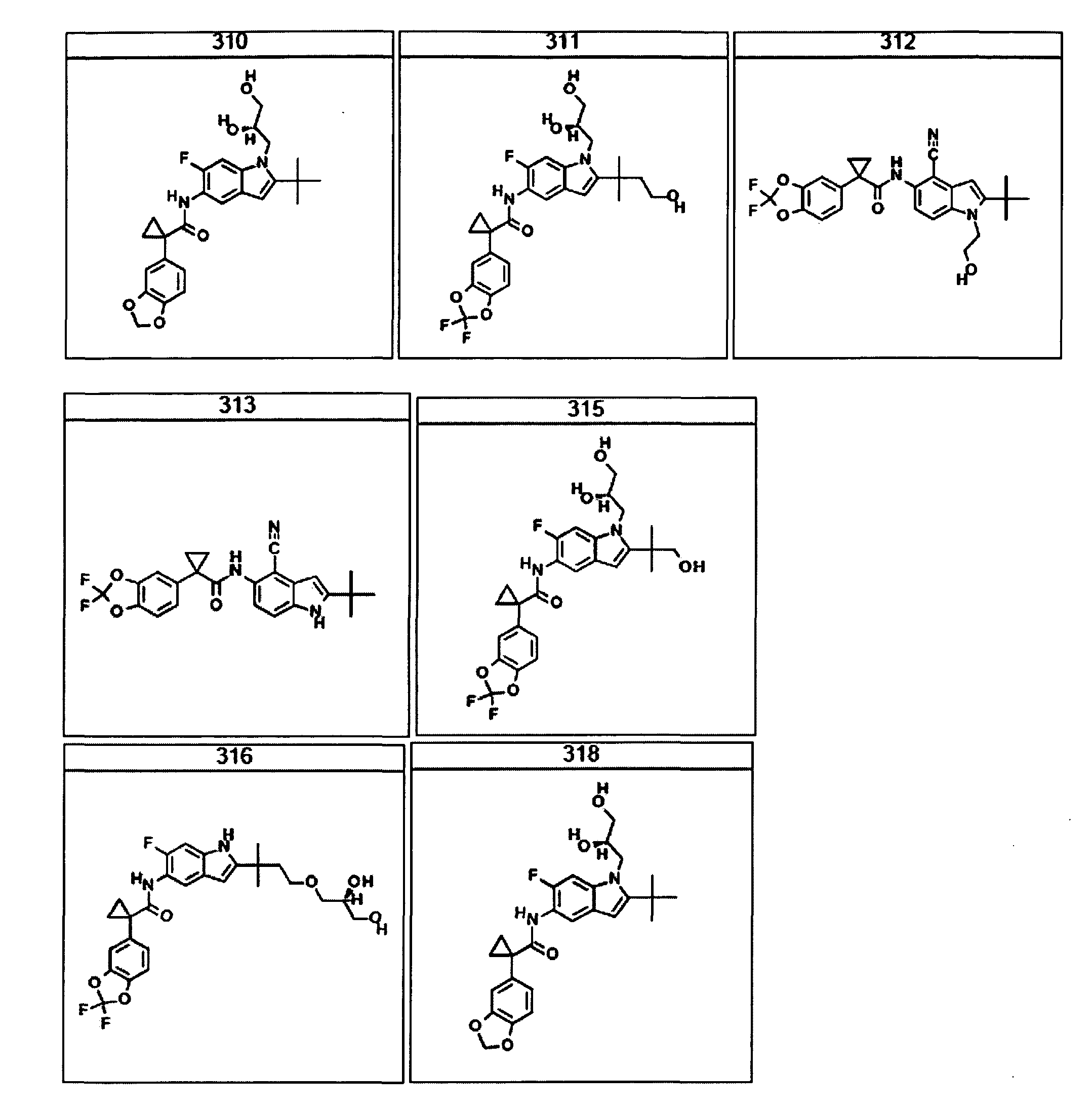
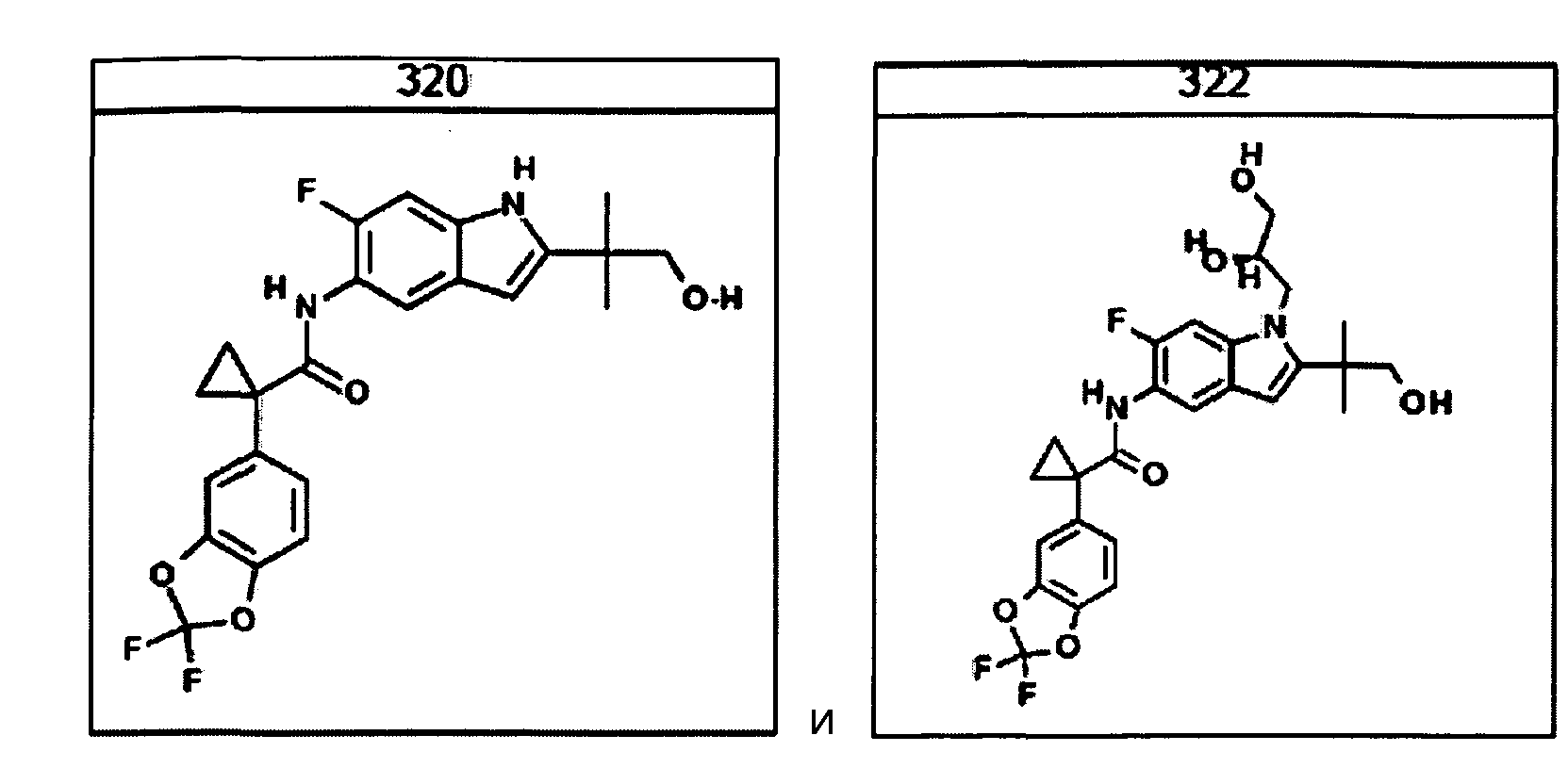
В очередном аспекте настоящее изобретение предлагает способ лечения состояния, заболевания или расстройства, в патологию которого вовлечена активность ABC-транспортера. В некоторых вариантах настоящее изобретение предлагает способ лечения состояния, заболевания или расстройства, в патологии которого задействована недостаточность активности ABC-транспортера, и этот способ включает введение композиции, содержащей соединение, выбранное из 308-312, 313, 315, 316, 318, 320 и 322, субъекту, предпочтительно млекопитающему, нуждающемуся в таком лечении.
В некоторых предпочтительных вариантах настоящее изобретение предлагает способ лечения муковисцидоза, наследственной эмфиземы, наследственного гемохроматоза, недостаточностей факторов свертывания крови и фибринстабилизирующего фактора, таких как дефицит белка С, наследственный ангионеврологический отек 1 типа, дефектов в процессинге липидов, таких как семейная гиперхолестеринемия, хиломикронемия 1 типа, абеталипопротеинемия, лизосомных болезней, таких как болезнь клеточных включений/псевдо-Хюрлера, мукополисахаридозы, болезнь Сандхоффа/Тея-Сакса, болезнь Криглера-Найяра II типа, полиэндокринопатия/гиперинсулинемия, сахарный диабет, карликовость Ларона, дефицит милеопероксидазы, первичный гипопаратиреоидизм, меланома, гликогеноз CDG 1 типа, наследственная эмфизема, врожденный гипертиреоидизм, несовершенный остеогенез, наследственная гипофибриногенемия, недостаточность ACT, несахарный диабет (DI), нейрофизиологический DI, нефрогенный DI, синдром Шарко-Мари-Тута, болезнь Пелицеуса-Мерцбахера, нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз, прогрессирующий супрануклеарный паралич, болезнь Пика, некоторых неврологических расстройств, связанных с обменом глутамина, таких как болезнь Гентингтона, спинномозговая атаксия I типа, спинально-бульбарная мышечная атрофия, дентаторубральная и паллидолюисовая атрофия и миотоническая дистрофия, а также губчатых энцефалопатий, таких как наследственная болезнь Крейтцфельдта-Якоба (обусловленная дефектом в процессинге прионного белка), болезнь Фабри, синдром Штраусслера-Шейнкера, секреторная диарея, поликистоз почек, хроническое обструктивное заболевание легких (COPD), болезнь сухих глаз и синдром Шегрена, включающий стадию введения указанному млекопитающему эффективного количества композиции, содержащей соединение, выбранное из 308-312, 313, 315, 316, 318, 320 и 322, или его предпочтительный вариант, представленный выше.
Согласно альтернативному предпочтительному варианту настоящее изобретение предлагает способ лечения муковисцидоза, включающий стадию введения указанному млекопитающему эффективного количества композиции, содержащей соединение, выбранное из 308-312, 313, 315, 316, 318, 320 и 322, или его предпочтительный вариант, представленный выше.
Согласно изобретению "эффективное количество" соединения или фармацевтически приемлемой композиции представляет собой то количество, которое эффективно для лечения или снижения степени тяжести одного или нескольких заболеваний, таких как муковисцидоз, наследственная эмфизема, наследственный гемохроматоз, недостаточности факторов свертывания крови и фибринстабилизирующего фактора, такие как дефицит белка С, наследственный ангионеврологический отек 1 типа, дефекты в процессинге липидов, такие как семейная гиперхолестеринемия, хиломикронемия 1 типа, абеталипопротеинемия, лизосомные болезни, как, например, болезнь клеточных включений/псевдо-Хюрлера, мукополисахаридозы, болезнь Сандхоффа/Тея-Сакса, болезнь Криглера-Найяра II типа, полиэндокринопатия/гиперинсулинемия, сахарный диабет, карликовость Ларона, дефицит милеопероксидазы, первичный гипопаратиреоидизм, меланома, гликогеноз CDG 1 типа, наследственная эмфизема, врожденный гипертиреоидизм, несовершенный остеогенез, наследственная гипофибриногенемия, недостаточность ACT, несахарный диабет (DI), нейрофизиологический DI, нефрогенный DI, синдром Шарко-Мари-Тута, болезнь Пелицеуса-Мерцбахера, нейродегенеративные заболевания, такие как болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз, прогрессирующий супрануклеарный паралич, болезнь Пика, некоторые неврологические расстройства, связанные с обменом глутамина, такие как болезнь Гентингтона, спинномозговая атаксия I типа, спинально-бульбарная мышечная атрофия, дентаторубральная и паллидолюисовая атрофия и миотоническая дистрофия, а также губчатые энцефалопатии, такие как наследственная болезнь Крейтцфельдта-Якоба, болезнь Фабри, синдром Штраусслера-Шейнкера, секреторная диарея, поликистоз почек, хроническое обструктивное заболевание легких (COPD), болезнь сухих глаз и синдром Шегрена.
Соединения и композиции согласно способу по данному изобретению можно вводить, используя любое количество и любой путь введения, эффективные для лечения или снижения степени тяжести одного или нескольких заболеваний, таких как муковисцидоз, наследственная эмфизема, наследственный гемохроматоз, недостаточности факторов свертывания крови и фибринстабилизирующего фактора, такие как дефицит белка С, наследственный ангионеврологический отек 1 типа, дефекты в процессинге липидов, такие как семейная гиперхолестеринемия, хиломикронемия 1 типа, абеталипопротеинемия, лизосомные болезни, такие как болезнь клеточных включений/псевдо-Хюрлера, мукополисахаридозы, болезнь Сандхоффа/Тея-Сакса, болезнь Криглера-Найяра II типа, полиэндокринопатия/гиперинсулинемия, сахарный диабет, карликовость Ларона, дефицит милеопероксидазы, первичный гипопаратиреоидизм, меланома, гликогеноз CDG 1 типа, наследственная эмфизема, врожденный гипертиреоидизм, несовершенный остеогенез, наследственная гипофибриногенемия, недостаточность ACT, несахарный диабет (di), нейрофизиологический DI, нефрогенный DI, синдром Шарко-Мари-Тута, болезнь Пелицеуса-Мерцбахера, нейродегенеративные заболевания, такие как болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз, прогрессирующий супрануклеарный паралич, болезнь Пика, некоторые неврологические расстройства, связанные с обменом полиглутамина, такие как болезнь Гентингтона, спинномозговая атаксия I типа, спинально-бульбарная мышечная атрофия, дентаторубральная и паллидолюисовая атрофия и миотоническая дистрофия, а также губчатые энцефалопатии, такие как наследственная болезнь Крейтцфельдта-Якоба, болезнь Фабри, синдром Штраусслера-Шейнкера, секреторная диарея, поликистоз почек, хроническое обструктивное заболевание легких (COPD), болезнь сухих глаз и синдром Шегрена.
Требуемое точное количество может варьироваться от субъекта к субъекту, в зависимости от биологического вида, возраста и общего состояния субъекта, степени тяжести инфицирования, конкретного средства, способа его введения и т.п. Соединения по данному изобретению предпочтительно используют для получения унифицированной лекарственной формы для облегчения введения и достижения единообразия дозирования. Выражение "стандартная лекарственная форма", используемое в настоящем описании, относится к физически дискретной единице средства, подходящей для пациента, подлежащего лечению. Очевидно, однако, что решение относительно суммарного суточного употребления соединений и композиций по данному изобретению обычно принимается лечащим врачом в пределах обоснованной медицинской оценки. Конкретный уровень эффективной дозы для любого конкретного пациента или организма обычно зависит от целого ряда факторов, включая нарушение, подлежащее лечению, и степень тяжести этого нарушения; активность конкретного используемого соединения; конкретную используемую композицию; возраст, массу тела, общее состояние здоровья, пол и режим питания пациента; время введения, способ введения, и скорость экскреции конкретного используемого соединения; продолжительность лечения; лекарственные средства, используемые в комбинации или совпадающие с приемом конкретного используемого соединения, и подобные факторы, известные в медицинских областях. Термин "пациент", используемый в настоящем описании, подразумевает животное, предпочтительно млекопитающее и наиболее предпочтительно человека.
Фармацевтически приемлемые композиции по данному изобретению можно вводить людям и другим животным перорально, ректально, парентерально, интрацистернально, интравагинально, интраперитонеально, местно (в виде порошков, мазей или капель), трансбуккально, в виде перорального или назального спрейя, или т.п., в зависимости от степени тяжести инфекции, подлежащей лечению. В некоторых вариантах для получения желательного лечебного действия соединения по данному изобретению могут вводиться перорально или парентерально при уровнях дозы от около 0,01 мг/кг до около 50 мг/кг и предпочтительно от около 1 мг/кг до около 25 мг/кг массы тела субъекта в день, один или несколько раз в день.
Жидкие лекарственные формы для перорального введения включают, но ими не ограничиваются, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Помимо активных соединений, жидкие лекарственные формы могут содержать инертные разбавители, обычно используемые в данной области, такие как, например, вода или другие растворители, солюбилизирующие средства и эмульгирующие средства, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, хлопковое, арахисовое, кукурузное, зародышей пшеницы, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот и сорбитана, и их смеси. Помимо инертных разбавителей, композиции для перорального введения могут также содержать вспомогательные формообразующие вещества, такие как увлажняющие средства, эмульгирующие и суспендирующие средства, подслащивающие, вкусовые и ароматизирующие добавки.
Препараты для инъекции, например стерильные инъецируемые водные или масляные суспензии, могут быть приготовлены согласно известным в данной области способам с использованием подходящих диспергирующих или увлажняющих средств и суспендирующих средств. Стерильный инъецируемый препарат может быть также в виде стерильного инъецируемого раствора, суспензии или эмульсии в нетоксичном парентерально приемлемом разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. Среди приемлемых наполнителей и растворителей, которые могут быть использованы, вода, раствор Рингера, Фармокопея США и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды обычно используют стерильные нелетучие масла. Для этой цели может быть использовано любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, для препарата, предназначенного для инъекции, используют жирные кислоты, такие как олеиновая кислота.
Готовые лекарственные формы для инъекции могут быть стерилизованы, например фильтрацией через удерживающий бактерии фильтр или путем включения стерилизующих средств в форме стерильных твердых композиций, которые могут быть растворены или диспергированы в стерильной воде или другой подходящей для инъекции стерильной среде до использования.
Для достижения пролонгирующего действия соединения по данному изобретению зачастую требуется замедлить всасывание соединения из подкожной или внутримышечной инъекции. Этого можно достичь, используя жидкую суспензию кристаллического или аморфного вещества со слабой растворимостью в воде. В этом случае скорость всасывания соединения зависит от его скорости растворения, которая, в свою очередь, может зависеть от размера кристалла и кристаллической формы. Альтернативно, замедленная абсорбция парентерально вводимого соединения достигается путем растворения или суспендирования соединения в масляном наполнителе. Инъецируемые формы замедленного всасывания получают путем формирования микроинкапсулированных матриц соединения в биодеградируемых полимерах, таких как полилактид-полигликолид. Скорость высвобождения соединения может контролироваться в зависимости от отношения соединения к полимеру и природы конкретного используемого полимера. Примеры других биодеградируемых полимеров включают поли(орто-сложные эфиры) и поли(ангидриды). Кроме того, готовые лекарственные формы пролонгированного действия для инъекции получают инкапсулированием соединения в липосомах или микроэмульсиях, которые совместимы с тканями живого организма.
Композиции для ректального или вагинального введения представляют собой предпочтительно суппозитории, которые можно получить смешиванием соединений по данному изобретению с подходящими не вызывающими раздражение наполнителями или носителями, такими как масло какао, полиэтиленгликоль или воск для суппозитория, которые являются твердыми при температуре окружающей среды, но жидкими при температуре тела и поэтому плавятся в ректальной или вагинальной полости и высвобождают активное соединение.
Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых лекарственных формах, активное соединение смешивают с по меньшей мере одним инертным, фармацевтически приемлемым наполнителем или носителем, таким как цитрат натрия или двукальциевая фосфатная соль и/или a) наполнителями или модифицирующими добавками, такими как крахмалы, лактоза, сахароза, глюкоза, маннит и кремниевая кислота, b) связующими, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и акация, c) увлажняющими веществами, такими как глицерин, d) дезинтегрирующими средствами, такими как агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, некоторые силикаты и карбонат натрия, e) замедляющими растворение средствами, такими как парафин, f) ускорителями всасывания, такими как соединения четвертичного аммония, g) увлажняющими средствами, такими как, например, цетиловый спирт и глицеринмоностеарат, h) абсорбентами, такими как каолин и бентонитовая глина, и i) смазками, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смесями. В случае капсул, таблеток и пилюль, лекарственная форма может также содержать буферные вещества.
Твердые композиции подобного типа могут быть также использованы в качестве наполнителей в мягких и твердых желатиновых капсулах с лекарственным средством, использующих такие наполнители, как лактоза и молочный сахар, а также высокомолекулярные полиэтиленгликоли и т.п. Твердые лекарственные формы в виде таблеток, драже, капсул, пилюль и гранул можно получить с покрытиями и оболочками, такими как энтеросолюбильные покрытия и другие покрытия, общеизвестными в области технологии приготовления лекарственных средств. Они могут необязательно содержать опалесцирующие средства и могут также представлять собой композицию, которая высвобождает активный компонент(ы) только, или предпочтительно, в определенной части кишечного тракта, необязательно, замедленным способом. Примеры встраивающих композиций, которые могут быть использованы, включают полимерные вещества и смолы. Твердые композиции подобного типа также могут быть использованы в качестве наполнителей в мягких и твердых желатиновых капсулах с лекарственным средством, использующих такие наполнители, как лактоза и молочный сахар, а также высокомолекулярные полиэтиленгликоли и т.п.
Активные соединения могут также находиться в микроинкапсулированной форме с одним или несколькими наполнителями, отмеченными выше. Твердые лекарственные формы в виде таблеток, драже, капсул, пилюль и гранул можно получить с покрытиями и оболочками, такими как энтеросолюбильные покрытия, покрытия с контролируемым высвобождением активного соединения и другие покрытия, известные в области технологии приготовления лекарственных средств. В таких твердых лекарственных формах активное соединение может быть смешано с по меньшей мере одним инертным разбавителем, таким как сахароза, лактоза или крахмал. Такие лекарственные формы могут также содержать, как это имеет место в обычной практике, дополнительные вещества, помимо инертных разбавителей, например, смазки для таблетирования и другие вспомогательные добавки для таблетирования, такие как стерат магния и микрокристаллическая целлюлоза. В случае капсул, таблеток и пилюль, лекарственные формы могут также содержать буферные вещества. Они могут необязательно содержать опалесцирующие средства и, кроме того, могут представлять собой композицию, которая высвобождает активный компонент(ы) только, или предпочтительно, в определенной части кишечного тракта, необязательно, замедленным способом. Примеры встраивающих композиций, которые могут быть использованы, включают полимерные вещества и воски.
Лекарственные формы для местного или трансдермального введения соединения по данному изобретению включают мази, пасты, кремы, лосьоны, гели, порошки, растворы, аэрозоли, ингаляционные средства или пластыри. Активный компонент смешивают в стерильных условиях с фармацевтически приемлемым носителем и любыми необходимыми консервантами или буферами, которые могут потребоваться. Предполагается, что глазной препарат, ушные капли и глазные капли также находятся в пределах объема данного изобретения. Кроме того, настоящее изобретение предусматривает использование трансдермальных пластырей, которые обладают дополнительным преимуществом, заключающимся в обеспечении контролируемой доставки соединения в организм. Такие лекарственные формы получают путем растворения или диспергирования соединения в надлежащей среде. Усилители всасывания могут быть также использованы для увеличения потока соединения через кожу. Скорость может контролироваться либо путем обеспечения мембраны, регулирующей скорость всасывания, либо путем диспергирования соединения в полимерной матрице или геле.
Как описано в общих чертах выше, соединения по данному изобретению используют в качестве модуляторов ABC-транспортеров. Таким образом, не вникая в рассмотрение каких-либо теоретических обоснований, соединения и композиции, в частности, используют для лечения или снижения степени тяжести заболевания, состояния или нарушения, где гиперактивность или пассивность ABC-транспортеров оказывается вовлеченной в патологию заболевания, состояния или нарушения. В тех случаях, когда гиперактивность или пассивность ABC-транспортера вовлечена в патологию конкретного заболевания, состояния или нарушения, это конкретное заболевание, состояние или нарушение может именоваться как "опосредованное ABC-транспортером заболевание, состояние или нарушение". Соответственно, в другом аспекте, настоящее изобретение предлагает способ лечения или снижения тяжести заболевания, состояния или нарушения, где гиперактивность или пассивность ABC-транспортера вовлечена в патологическое состояние.
Активность соединения, используемого в данном изобретении в качестве модулятора ABC-транспортера, можно оценить согласно способам, описанным, в основном, в данной области и в Примерах настоящего описания.
Следует иметь в виду, что соединения и фармацевтически приемлемые композиции по данному изобретению могут быть использованы в комбинированных лечениях, то есть, соединения и фармацевтически приемлемые композиции можно применять одновременно с, до или после одной или нескольких других желательных терапий или лечебных процедур. Конкретную комбинацию лечений (терапий или процедур), которую используют согласно комбинированной схеме лечения, обычно проводят с учетом совместимости проведения желательных терапий и/или лечебных процедур и ожидаемого лечебного действия. Следует также иметь в виду, что используемые терапии могут обеспечивать достижение желаемого лечебного действия в отношении одного и того же расстройства (например, заявляемое соединение может вводиться одновременно с другим средством, используемым для лечения такого же расстройства) или они могут обеспечивать достижение действий различного характера (например, регуляция уровня каких-либо побочных действий). Как использовано в настоящем описании, дополнительные терапевтические средства, которые обычно применяют для лечения или профилактики конкретного заболевания или состояния, известны как "подходящие при заболевании или состоянии, подлежащем лечению".
Количество дополнительного лечебного средства, присутствующего в композициях по данному изобретению, составляет обычно не больше того количества, которое обычно вводят с композицией, содержащей указанное дополнительное лечебное средство в качестве единственного активного средства. Предпочтительно количество дополнительного лечебного средства в раскрытых в настоящем описании композициях обычно колеблется в пределах от 50% до 100% от количества, обычно присутствующего в композиции, содержащей указанное дополнительное средство в качестве единственного терапевтически активного средства.
Соединения по данному изобретению или фармацевтически приемлемые композиции на их основе могут быть также включены в композиции для покрытия имплантируемого медицинского инструмента, такого как протезы, искусственные клапаны, сосудистые трансплантаты, стенты и катетеры. Соответственно, настоящее изобретение, в другом аспекте, включает композицию для покрытия имплантируемого инструмента, содержащую соединение по данному изобретению, описанное, в основном, выше и представленное в настоящем описании в классах и подклассах, и носитель, подходящий для покрытия указанного имплантируемого инструмента. В следующем аспекте настоящее изобретение включает имплантируемый инструмент, покрытый композицией, содержащей соединение по данному изобретению, описанное, в основном, выше и представленное в настоящем описании классами и подклассами, и носитель, подходящий для покрытия указанного имплантируемого медицинского инструмента. Подходящие покрытия и общее получение имплантируемых медицинских инструментов, снабженных покрытием, описаны в патентах США № 6099562; 5886026 и 5304121. Покрытия представляют собой обычно биосовместимые полимерные материалы, такие как гидрогелевый полимер, полиметилдисилоксан, поликапролактон, полиэтиленгликоль, полимолочная кислота, полимер этилен-винилацетат, и их смеси. Покрытия могут быть необязательно дополнительно покрыты подходящим верхним слоем из фторсиликона, полисахаридов, полиэтиленгликоля, фосфолипидов или их комбинаций для придания композиции свойств контролиемого высвобождения.
Другой аспект данного изобретения относится к модуляции активности ABC-транспортера в биологическом образце или у пациента (например, in vitro или in vivo), и этот способ включает введение пациенту или контактирование указанного биологического образца с соединением формулы I или композицией, содержащей вышеуказанное соединение. Термин "биологический образец", используемый в настоящем описании, включает, без ограничения, клеточные культуры или их экстракты; биоптат, полученный изъятием у млекопитающего, или его экстракт; и кровь, слюну, мочу, фекалии, сперму, слезы или другие жидкости, содержащиеся в организме, или их экстракты.
Модуляцию активности ABC-транспортера в биологическом образце используют для целого ряда целей, которые известны специалисту средней квалификации в данной области. Примеры таких целей включают, но ими не ограничиваясь, исследование роли ABC-транспортеров в биологических и патологических явлениях; и сравнительную оценку новых модуляторов ABC-транспортеров.
В очередном варианте предлагается способ модуляции активности анионного канала in vitro или in vivo, включающий стадию контактирования указанного канала с соединением, выбранным из 308-312, 313, 315, 316, 318, 320 и 322. В предпочтительных вариантах анионный канал представляет собой хлоридный канал или бикарбонатный канал. В других предпочтительных вариантах анионный канал представляет собой хлоридный канал.
Согласно альтернативному варианту настоящее изобретение предлагает способ увеличения количества функциональных ABC-транспортеров в мембране клетки, включающий стадию контактирования указанной клетки с соединением, выбранным из 308-312, 313, 315, 316, 318, 320 и 322. Термин "функциональный ABC-транспортер", используемый в настоящем описании, означает ABC-транспортер, который способен транспортировать активность. В предпочтительных вариантах вышеуказанный функциональный ABC-транспортер представляет собой CFTR.
Согласно другому предпочтительному варианту, активность ABC-транспортера определяют, измеряя трансмембранный потенциал напряжения. Способ измерения потенциала напряжения сквозь мембрану в биологическом образце может использовать любой из известных способов в данной области, такой как оптический метод измерения мембранного потенциала или другие электрофизиологические методы.
Оптический метод измерения мембранного потенциала использует чувствительные к напряжению FRET датчики, описанные Gonzalez и Tsien (см., Gonzalez, J.E. and R.Y. Tsien (1995) "Voltage sensing by fluorescence resonance energy transfer in single cells" Biophys. J. 69(4): 1272-80, и Gonzalez, J.E. and R.Y. Tsien (1997) "Improved indicators of cell membrane potential that use fluorescence resonance energy transfer" Chem Biol 4(4): 269-77), в комбинации с аппаратурой для измерения изменений флуоресценции, такой как Voltage/Ion Probe Reader (VIPR) (см., Gonzalez, J.E., K. Oades, et al. (1999) "Cell-based assays and instrumentation for screening ion-channel targets" Drug Discov Today 4(9): 431-439).
Эти чувствительные к напряжению испытания основаны на изменении в резонансном переносе энергии флуоресценции (FRET) между растворимым в мембране, чувствительным к напряжению красителем, DiSBAC2(3), и флуоресцентным фосфолипидом, CC2-DMPE, который присоединен к наружной створке плазматической мембраны и действует как донор FRET. Изменения в мембранном потенциале (Vm) заставляют отрицательно заряженный DiSBAC2(3) перераспределяться сквозь плазматическую мембрану, и при этом величина переноса энергии от CC2-DMPE изменяется, соответственно. Изменения во флуоресцентном излучении можно контролировать, используя VIPR™ II, который представляет собой интегрированный жидкостной манипулятор и флуоресцентный детектор, предназначенный для проведения скринингов с участием клеток в 96- или 384-луночных микротитрационных планшетах.
В другом аспекте настоящее изобретение предлагает набор для использования его для измерения активности ABC-транспортера или его фрагмента в биологическом образце in vitro или in vivo, содержащий (i) композицию, содержащую соединение, выбранное из 312, 313, 315, 316, 318, 320 и 322 или любой из вышеупомянутых вариантов; и (ii) инструкции для a.) контактирования композиции с биологическим образцом и b.) измерения активности указанного ABC-транспортера или его фрагмента. В одном варианте набор дополнительно содержит инструкции для a.) контактирования дополнительной композиции с биологическим образцом; b.) измерения активности указанного ABC-транспортера или его фрагмента в присутствии указанного дополнительного соединения и c.) сравнения активности ABC-транспортера в присутствии дополнительного соединения с плотностью ABC-транспортера в присутствии соединения, выбранного из 308-312, 313, 315, 316, 318, 320 и 322. В предпочтительных вариантах набор используют для измерения плотности CFTR.
Для более полного понимания описанного в данном контексте изобретения предлагаются нижеследующие примеры. Очевидно, что эти примеры приводятся только с иллюстративной целью и их не следует рассматривать как огранивающие каким-либо образом данное изобретение.
VI. ПОЛУЧЕНИЯ И ПРИМЕРЫ
Общий способ I: Строительный блок карбоновой кислоты
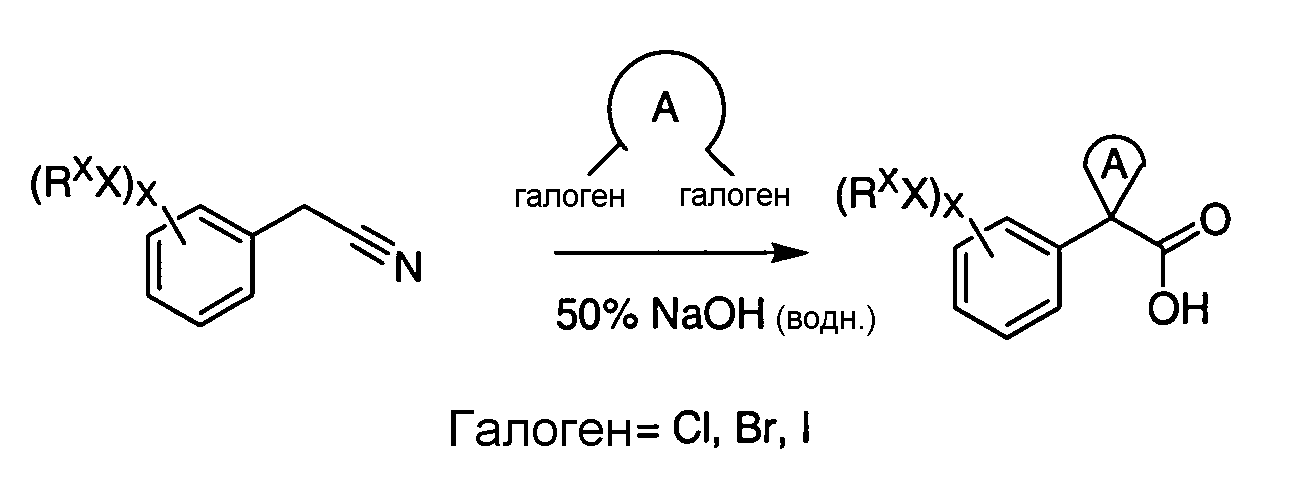
Бензилтриэтиламмонийхлорид (0,025 эквивалента) и соответствующее дигалогенидное соединение (2,5 эквивалента) добавляют к замещенному фенилацетонитрилу. Смесь нагревают при 70°C и затем к смеси медленно добавляют 50% гидроксид натрия (10 эквивалентов). Реакционную смесь перемешивают при 70°C в течение 12-24 часов, обеспечивая при этом полное образование циклоалкильной части, и затем нагревают при 130°C в течение 24-48 часов, гарантируя при этом полное превращение нитрила в карбоновую кислоту. Реакционную смесь темно-коричневого/черного цвета разбавляют водой и экстрагируют дихлорметаном три раза для удаления побочных продуктов. Щелочной водный раствор подкисляют концентрированной хлористоводородной кислотой до рН менее чем 1 и осадок, который начал образовываться при рН 4, отфильтровывают и промывают 1M хлористоводородной кислотой два раза. Твердое вещество растворяют в дихлорметане и экстрагируют два раза 1M хлористоводородной кислотой и один раз насыщенным водным раствором хлорида натрия. Органический раствор сушат над сульфатом натрия и упаривают досуха, получая циклоалкилкарбоновую кислоту. Выход и чистота конечного продукта обычно выше, чем 90%.
Пример 1: 1-Бензо[1,3]диоксол-5-илциклопропанкарбоновая кислота
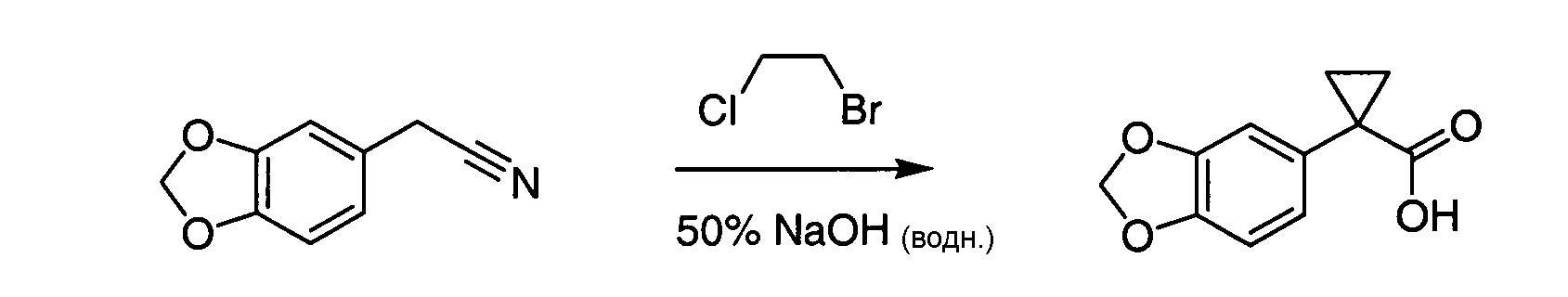
Смесь 2-(бензо[d][1,3]диоксол-5-ил)ацетонитрила (5,10 г, 31,7 ммоль), 1-бром-2-хлорэтана (9,00 мл, 109 ммоль) и бензилтриэтиламмонийхлорида (0,181 г, 0,795 ммоль) нагревают при 70°C и затем к смеси медленно добавляют 50% (масс./масс.) водный гидроксид натрия (26 мл). Реакционную смесь перемешивают при 70°C в течение 24 часов и затем нагревают при 130°C в течение 48 часов. Темно-коричневую реакционную смесь разбавляют водой (400 мл) и экстрагируют один раз равным объемом этилацетата и один раз равным объемом дихлорметана. Щелочной водный раствор подкисляют концентрированной хлористоводородной кислотой до рН менее чем 1 и осадок отфильтровывают и промывают 1M хлористоводородной кислотой. Твердое вещество растворяют в дихлорметане (400 мл) и экстрагируют дважды равными объемами 1M хлористоводородной кислоты и один раз насыщенным водным раствором хлорида натрия. Органический раствор сушат над сульфатом натрия и упаривают досуха, получая твердое вещество, окрашенное в белый, но не совсем белый, цвет (5,23 г, 80%). ESI-MS (масс-спектрометрия с электрораспылительной ионизацией) m/z вычислено 206,1, найдено 207,1 (M+1)+. Время удерживания 2,37 минут.
1H ЯМР (400 МГц, ДМСО-d6) δ 1,07-1,11 (м, 2H), 1,38-1,42 (м, 2H), 5,98 (с, 2H), 6,79 (м, 2H), 6,88 (м, 1Н), 12,26 (с, 1Н).
Пример 2: 1-(2,2-дифторбензо[1,3]диоксол-5-ил)циклопропанкарбоновая кислота
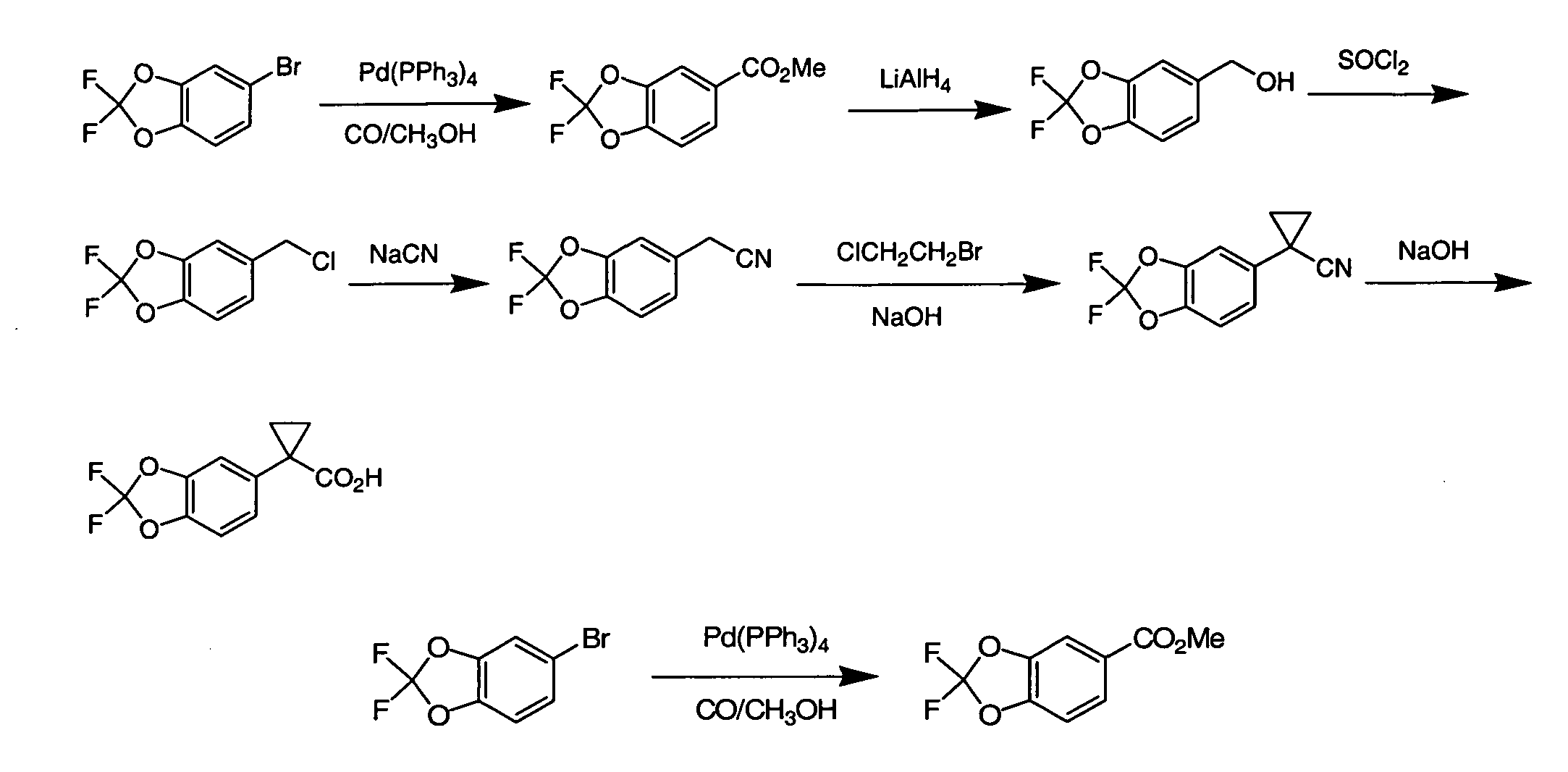
Метиловый эфир 2,2-дифторбензо[1,3]диоксол-5-карбоновой кислоты
Раствор 5-бром-2,2-дифторбензо[1,3]диоксола (11,8 г, 50,0 ммоль) и тетракис(трифенилфосфин)палладия(0) [Pd(PPh3)4, 5,78 г, 5,00 ммоль] в метаноле (20 мл), содержащий ацетонитрил (30 мл) и триэтиламин (10 мл), перемешивают в атмосфере моноксида углерода (55 фунт/кв.дюйм) при 75°C (температура масляной бани) в течение 15 часов. Охлажденную реакционную смесь фильтруют и фильтрат упаривают досуха. Остаток очищают колоночной хроматографией на силикагеле, получая неочищенный метиловый эфир 2,2-дифторбензо[1,3]диоксол-5-карбоновой кислоты (11,5 г), который используют непосредственно на следующей стадии.
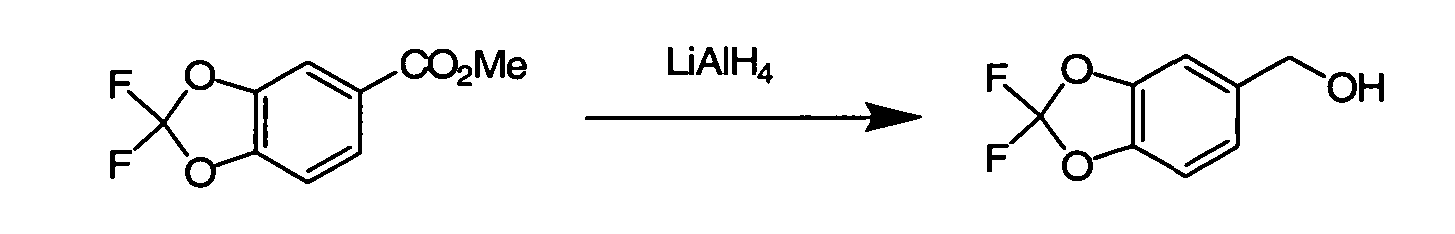
(2,2-Дифторбензо[1,3]диоксол-5-ил)метанол
Неочищенный метиловый эфир 2,2-дифторбензо[1,3]диоксол-5-карбоновой кислоты (11,5 г), растворенный в 20 мл безводного тетрагидрофурана (ТГФ), медленно добавляют к суспензии литийалюминийгидрида (4,10 г, 106 ммоль) в безводном ТГФ (100 мл) при 0°C. Затем смесь нагревают до комнатной температуры. После перемешивания смеси при комнатной температуре в течение 1 часа, реакционную смесь охлаждают до 0°C и обрабатывают водой (4,1 г), а затем гидроксидом натрия (10% водный раствор, 4,1 мл). Полученную взвесь фильтруют и промывают ТГФ. Объединенный фильтрат упаривают досуха и остаток очищают колоночной хроматографией на силикагеле, получая (2,2-дифторбензо[1,3]диоксол-5-ил)метанол (7,2 г, 38 ммоль, 76% за две стадии) в виде бесцветного масла.
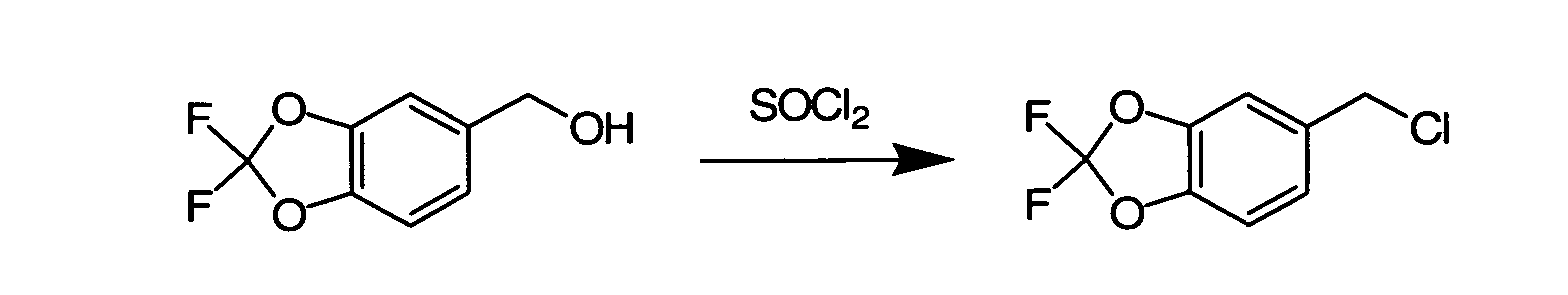
5-хлорметил-2,2-дифторбензо[1,3]диоксол
Тионилхлорид (45 г, 38 ммоль) медленно добавляют к раствору (2,2-дифторбензо[1,3]диоксол-5-ил)метанола (7,2 г, 38 ммоль) в дихлорметане (200 мл) при 0°C. Полученную смесь перемешивают на протяжении ночи при комнатной температуре и затем упаривают досуха. Остаток распределяют между водным раствором насыщенного бикарбоната натрия (100 мл) и дихлорметаном (100 мл). Отделенный водный слой экстрагируют дихлорметаном (150 мл) и органический слой сушат над сульфатом натрия, фильтруют и упаривают досуха, получая неочищенный 5-хлорметил-2,2-дифторбензо[1,3]диоксол (4,4 г), который используют непосредственно на следующей стадии.

(2,2-Дифторбензо[1,3]диоксол-5-ил)ацетонитрил
Смесь неочищенного 5-хлорметил-2,2-дифторбензо[1,3]диоксола (4,4 г) и цианида натрия (1,36 г, 27,8 ммоль) в диметилсульфоксиде (50 мл) перемешивают при комнатной температуре на протяжении ночи. Реакционную смесь выливают в лед и экстрагируют этилацетатом (300 мл). Органический слой сушат над сульфатом натрия и упаривают досуха, получая неочищенный (2,2-дифторбензо[1,3]диоксол-5-ил)ацетонитрил (3,3 г), который используют непосредственно на следующей стадии.
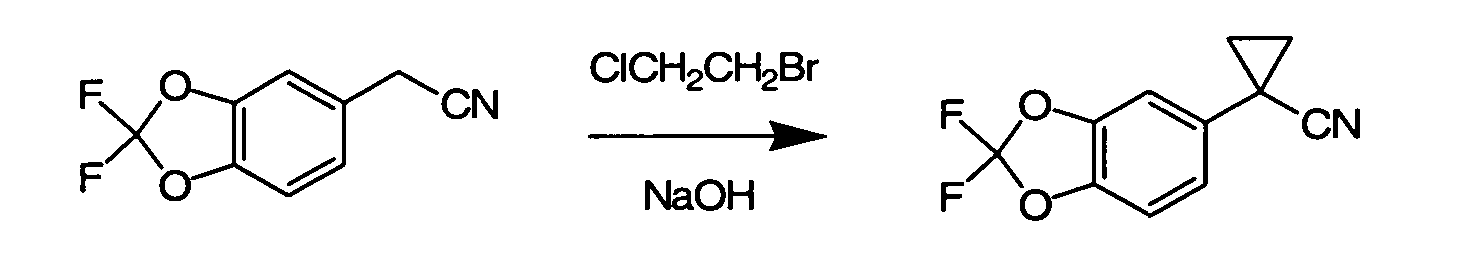
1-(2,2-Дифторбензо[1,3]диоксол-5-ил)циклопропанкарбонитрил
Гидроксид натрия (50% водный раствор, 10 мл) медленно добавляют к смеси неочищенного (2,2-дифторбензо[1,3]диоксол-5-ил)ацетонитрила, бензилтриэтиламмонийхлорида (3,00 г, 15,3 ммоль) и 1-бром-2-хлорэтана (4,9 г, 38 ммоль) при 70°C.
Смесь перемешивают на протяжении ночи при 70°C, прежде чем реакционную смесь разбавляют водой (30 мл) и экстрагируют этилацетатом. Объединенные органические слои сушат над сульфатом натрия и упаривают досуха, получая неочищенный 1-(2,2-дифторбензо[1,3]диоксол-5-ил)циклопропанкарбонитрил, который используют непосредственно на следующей стадии.
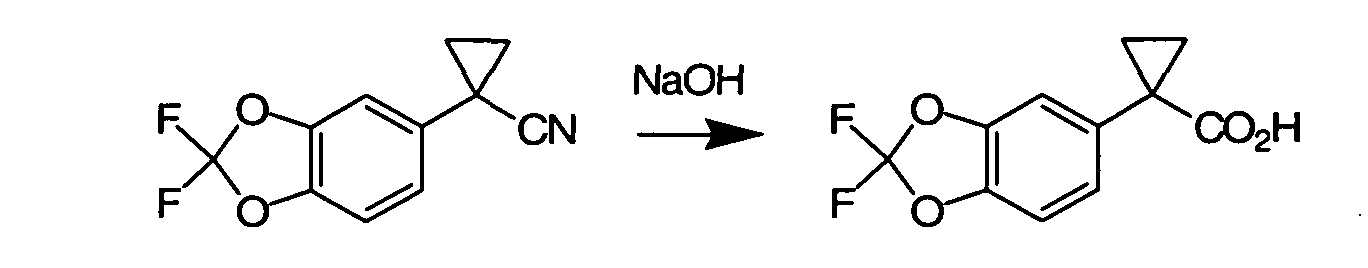
1-(2,2-Дифторбензо[1,3]диоксол-5-ил)циклопропанкарбоновая кислота
1-(2,2-Дифторбензо[1,3]диоксол-5-ил)циклопропанкарбонитрил (неочищенный с последней стадии) кипятят с обратным холодильником в 10% водном гидроксиде натрия (50 мл) в течение 2,5 часов. Охлажденную реакционную смесь промывают диэтиловым эфиром (100 мл) и водную фазу подкисляют до pH 2 с помощью 2M хлористоводородной кислоты. Осажденное твердое вещество отфильтровывают, получая 1-(2,2-дифторбензо[1,3]диоксол-5-ил)циклопропанкарбоновую кислоту в виде белого твердого вещества (0,15 г, 1,6% за четыре стадии).
ESI-MS m/z вычислено, 242,04, найдено 241,58 (M+1)+;
1H ЯМР (CDCl3) δ 7,14-7,04 (м, 2H), 6,98-6,96 (м, 1Н), 1,74-1,64 (м, 2H), 1,26-1,08 (м, 2H).
Нижеследующая таблица 2 содержит перечень строительных блоков карбоновой кислоты, которые коммерчески доступны или получены одним их трех способов, описанных выше:
Пример 3: 5-трет-Бутил-1Н-индол-6-иламин
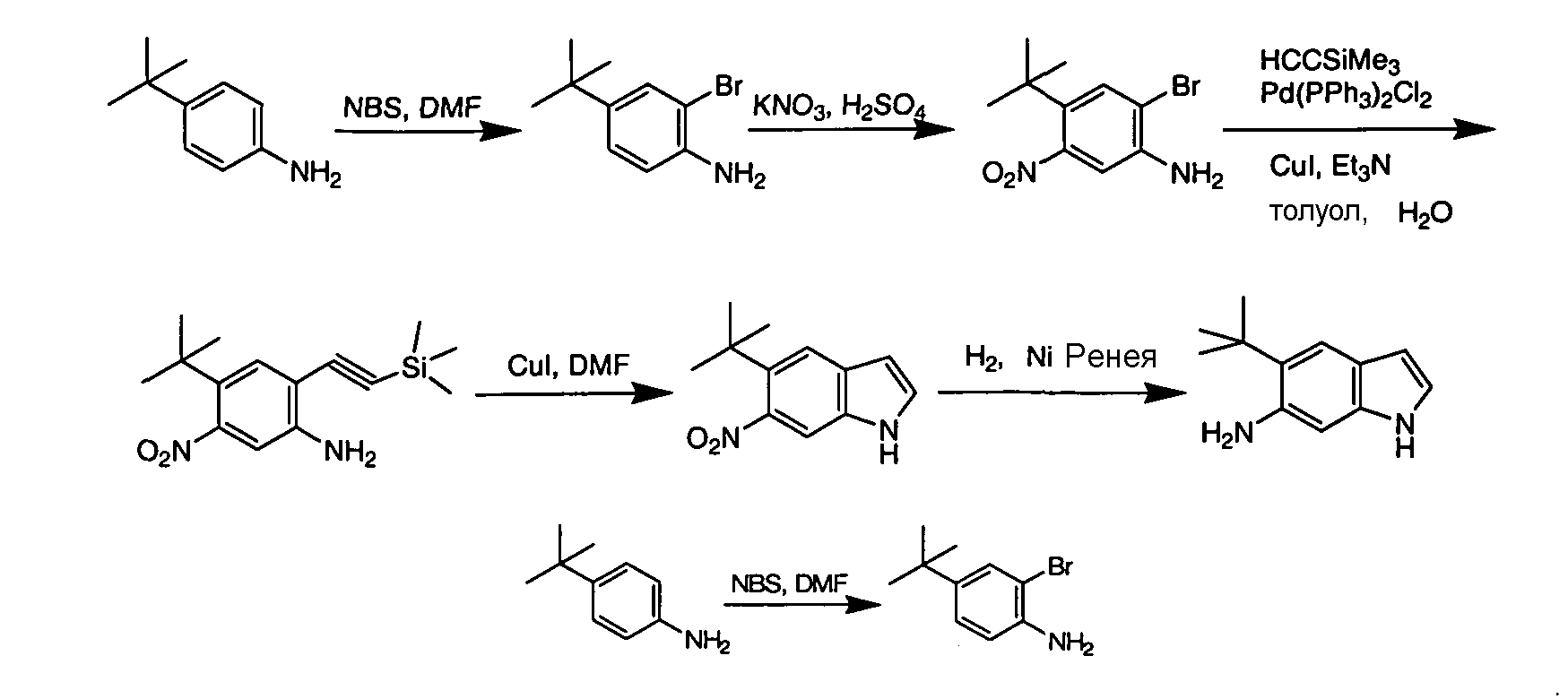
2-Бром-4-трет-бутилфениламин
К раствору 4-трет-бутилфениламина (447 г, 3,00 моль) в ДМФА (DMF) (500 мл) добавляют по каплям NBS (531 г, 3,00 моль) в ДМФА (500 мл) при комнатной температуре. После завершения добавления реакционную смесь разбавляют водой и экстрагируют EtOAc. Органический слой промывают водой, насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Неочищенный продукт непосредственно используют на следующей стадии без дополнительной очистки.
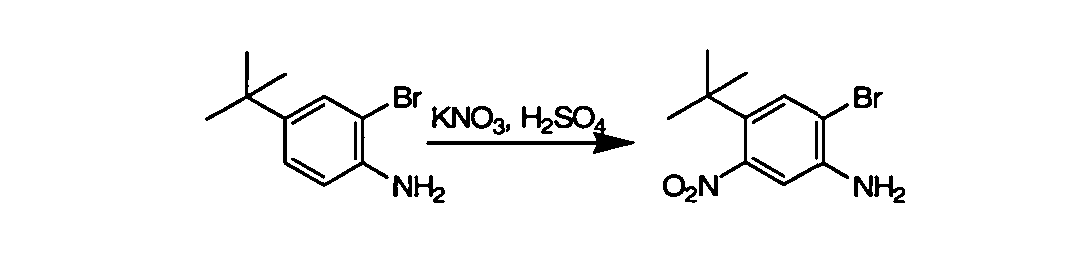
2-Бром-4-трет-бутил-5-нитрофениламин
2-Бром-4-трет-бутилфениламин (160 г, 0,71 моль) добавляют по каплям к H2SO4(410 мл) при комнатной температуре, получая прозрачный раствор. Затем этот прозрачный раствор охлаждают до температуры от -5 до -10°C. По каплям добавляют раствор KNO3 (83 г, 0,82 моль) в H2SO4(410 мл), в то время как температуру поддерживают между -5 и -10°C. После завершения добавления реакционную смесь выливают в смесь лед/вода и экстрагируют EtOAc. Объединенные органические слои промывают 5% Na2CO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Остаток очищают колоночной хроматографией (смесь этилацетат/петролейный эфир 1:10), получая 2-бром-4-трет-бутил-5-нитрофениламин в виде желтого твердого вещества (150 г, 78%).
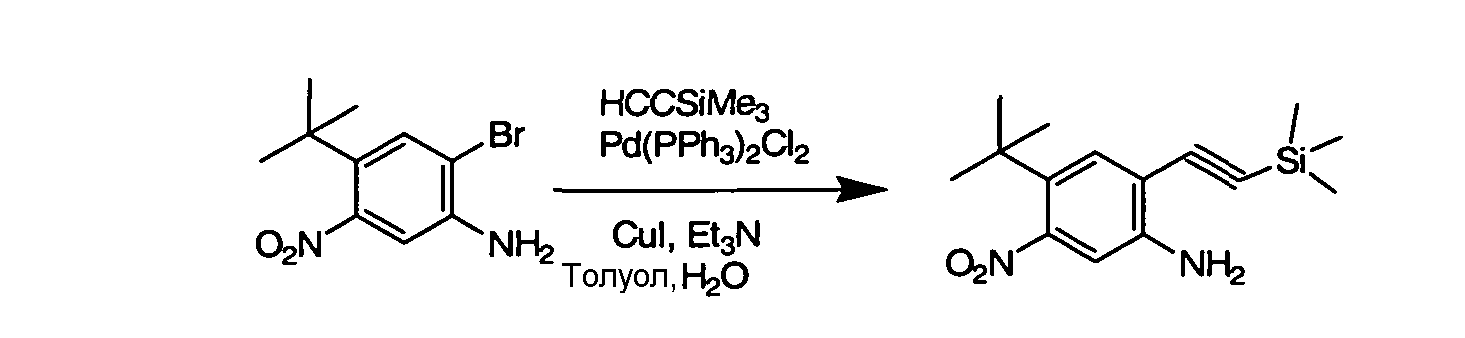
4-трет-Бутил-5-нитро-2-триметилсиланилэтинилфениламин
К смеси 2-бром-4-трет-бутил-5-нитрофениламина (27,3 г, 100 ммоль) в толуоле (200 мл) и воде (100 мл) добавляют Et3N (27,9 мл, 200 ммоль), Pd(PPh3)2Cl2 (2,11 г, 3,00 ммоль), CuI (950 мг, 0,500 ммоль) и триметилсилилацетилен (21,2 мл, 150 ммоль) в атмосфере азота. Реакционную смесь нагревают при 70°C в герметически закрытой колбе высокого давления в течение 2,5 ч, охлаждают до комнатной температуры и фильтруют через нетолстый слой целита. Осадок на фильтре промывают EtOAc. Объединенный фильтрат промывают 5% раствором NH4OH и водой, сушат над Na2SO4 и концентрируют. Неочищенный продукт очищают колоночной хроматографией (смесь 0-10% этилацетата/петролейный эфир), получая 4-трет-бутил-5-нитро-2-триметилсиланилэтинилфениламин в виде коричневой вязкой жидкости (25 г, 81%).
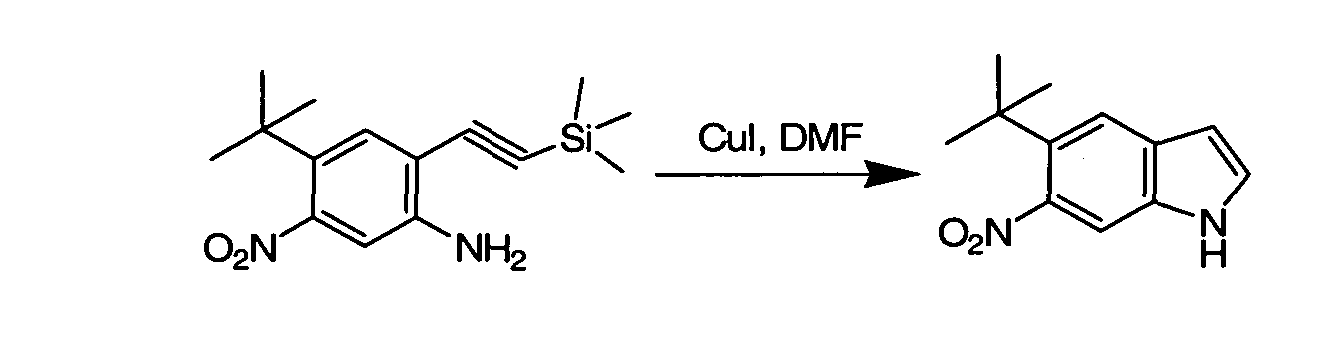
5-трет-Бутил-6-нитро-1H-индол
К раствору 4-трет-бутил-5-нитро-2-триметилсиланилэтинилфениламина (25 г, 86 ммоль) в ДМФА (100 мл) добавляют CuI (8,2 г, 43 ммоль) в атмосфере азота. Смесь нагревают при 135°C в герметически закрытой колбе высокого давления на протяжении ночи, охлаждают до комнатной температуры и фильтруют через нетолстый слой целита. Осадок на фильтре промывают EtOAc. Объединенный фильтрат промывают водой, сушат над Na2SO4 и концентрируют. Неочищенный продукт очищают колоночной хроматографией (смесь 10-20% этилацетата/гексан), получая 5-трет-бутил-6-нитро-1H-индол в виде желтого твердого вещества (13 г, 69%).
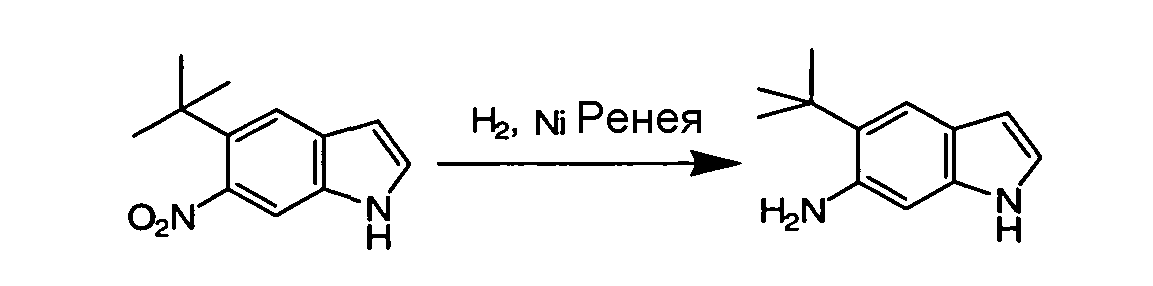
5-трет-Бутил-1H-индол-6-иламин
Никель Ренея (3 г) добавляют к 5-трет-бутил-6-нитро-1H-индолу (15 г, 67 ммоль) в метаноле (100 мл). Смесь перемешивают в атмосфере водорода (1 атм) при 30°C в течение 3 ч. Катализатор отфильтровывают. Фильтрат сушат над Na2SO4 и концентрируют. Неочищенное темно-коричневое вязкое масло очищают колоночной хроматографией (смесь 10-20% этилацетата/петролейный эфир), получая 5-трет-бутил-1H-индол-6-иламин в виде серого твердого вещества (11 г, 87%).
1H ЯМР (300 МГц, ДМСО-d6) δ 10,3 (ушир.с, 1Н), 7,2 (с, 1Н), 6,9 (м, 1Н), 6,6 (с, 1Н), 6,1 (м, 1Н), 4,4 (ушир.с, 2H), 1,3 (с, 9H).
Пример 4: 5-Амино-2-трет-бутил-1H-индол-4-карбонитрил
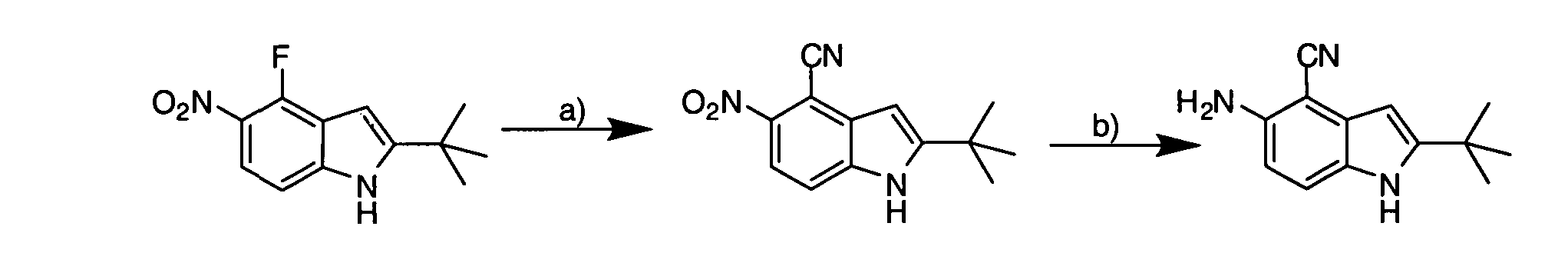
а) KCN, ДМСО; b) Pd/C, EtOAc.
Стадия a: 2-трет-бутил-5-нитро-1H-индол-4-карбонитрил
К раствору 2-трет-бутил-4-фтор-5-нитро-1H-индола (4,0 г, 17 ммоль) в ДМСО (30 мл) добавляют KCN (3,4 г, 51 ммоль). Смесь перемешивают при 70°C в течение 3 часов, и выливают в воду (80 мл) и экстрагируют этилацетатом (50 мл × 3). Объединенные органические слои промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной хроматографией на силикагеле (7% EtOAc в петролейном эфире), получая 2-трет-бутил-5-нитро-1H-индол-4-карбонитрил (2,2 г, 53%).
1H ЯМР (ДМСО, 300 МГц) δ 12,23 (ушир.с, 1Н), 8,09 (д, J=9,0 Гц, 1Н), 7,75 (д, J=9,0 Гц, 1Н), 6,50 (с, 1Н), 1,38 (с, 9Н). MS (ESI) m/z: 244,2 [M+H+].
Стадия b: 5-амино-2-трет-бутил-1H-индол-4-карбонитрил
К раствору 2-трет-бутил-5-нитро-1H-индол-4-карбонитрила (550 мг, 2,3 ммоль) в EtOAc (10 мл) добавляют Ni Ренея (0,1 г) в атмосфере азота. Смесь перемешивают в атмосфере водорода (1 атм.) при комнатной температуре в течение 1 ч. Катализатор отфильтровывают через целит и фильтрат упаривают в вакууме, получая 5-амино-2-трет-бутил-1H-индол-4-карбонитрил (250 мг, 51%).
1H ЯМР (ДМСО, 300 МГц) δ 10,93 (ушир.с, 1Н), 7,25 (д, J=8,7 Гц, 1Н), 6,49 (д, J=8,7 Гц, 1Н), 5,94 (д, J=2,1 Гц, 1Н), 5,40 (ушир.с, 2Н), 1,30 (с, 9Н). MS (ESI) m/z: 214,0 [M+H+].
Пример 6: N-(2-трет-бутил-4-циано-1H-индол-5-ил)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамид
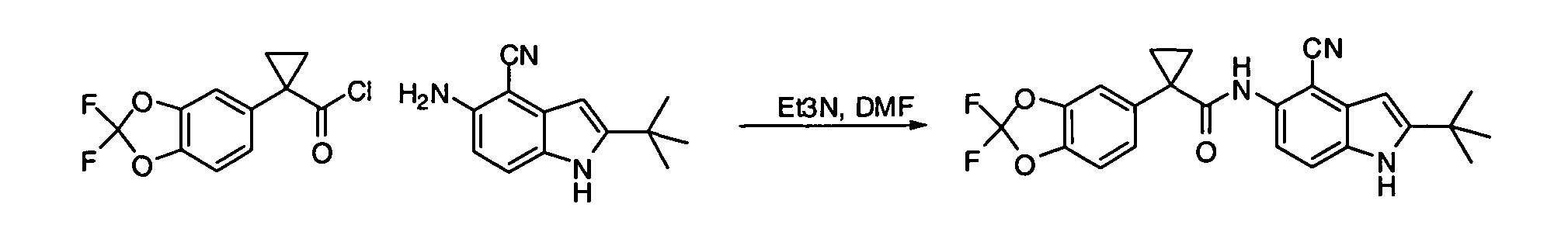
Стадия a: N-(2-трет-бутил-4-циано-1H-индол-5-ил)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамид
1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбонилхлорид (26 мг, 0,1 ммоль) добавляют к раствору 5-амино-2-трет-бутил-1H-индол-4-карбонитрила (21 мг, 0,1 ммоль) и триэтиламина (41,7 мкл, 0,3 ммоль) в ДМФА (1 мл). Реакционную смесь перемешивают при комнатной температуре на протяжении ночи, затем фильтруют и очищают ВЭЖХ с обращенной фазой, получая продукт, N-(2-трет-бутил-4-циано-1H-индол-5-ил)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамид. ESI-MS m/z вычислено 437,2, найдено 438,7 (M+1)+. Время удерживания 2,10 минут.
1H ЯМР (400 МГц, ДМСО-d6) δ 11,48 (с, 1Н), 8,88 (с, 1Н), 7,52 (д, J=8,5 Гц, 2H), 7,41 (д, J=8,3 Гц, 1Н), 7,32 (дд, J=1,5, 8,3 Гц, 1Н), 7,03 (д, J=8,6 Гц, 1Н), 6,21 (д, J=1,8 Гц, 1Н), 1,51-1,49 (м, 2H), 1,36 (с, 9H), 1,18-1,16 (м, 2H).
Пример 7: N-(2-трет-бутил-4-циано-1-(2-гидроксиэтил)-1H-индол-5-ил)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамид
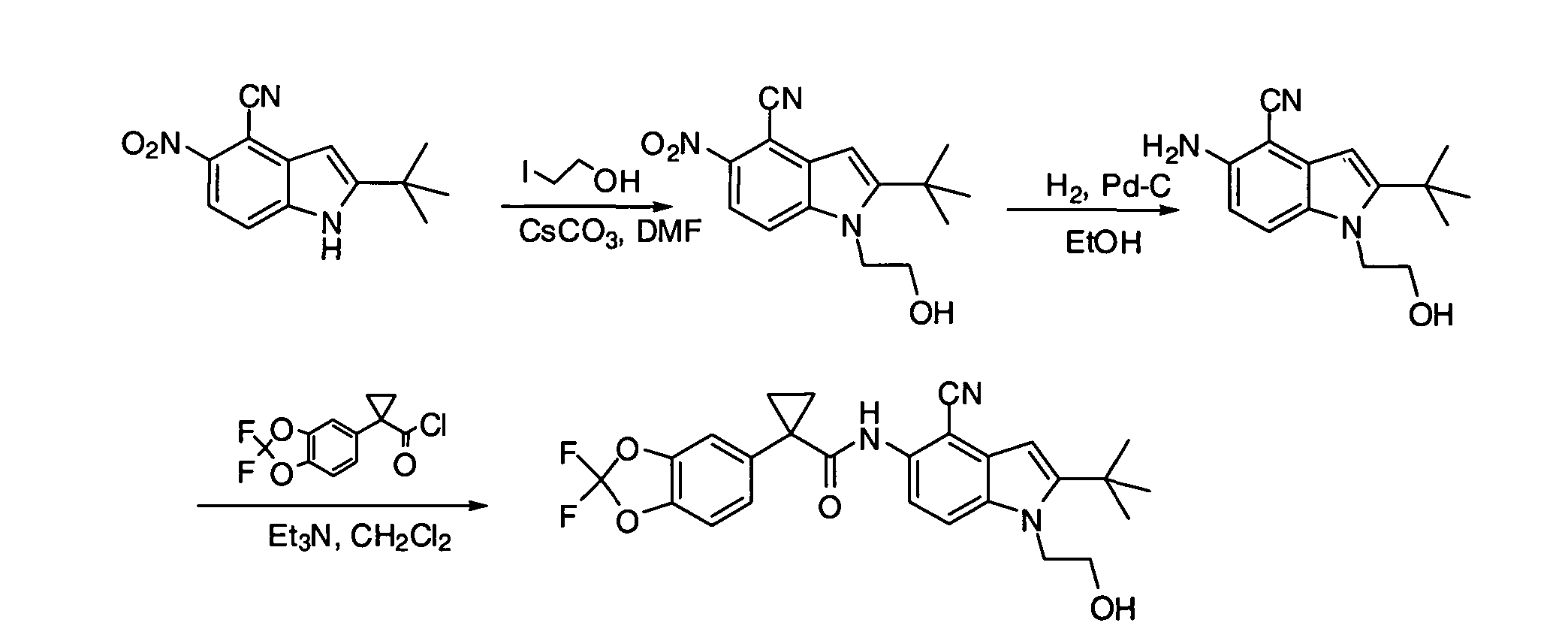
Стадия a: 2-трет-бутил-1-(2-гидроксиэтил)-5-нитро-1H-индол-4-карбонитрил
Смесь 2-трет-бутил-5-нитро-1H-индол-4-карбонитрила (200 мг, 0,82 ммоль), 2-йодэтанола (77 мкл, 0,98 ммоль), карбоната цезия (534 мг, 1,64 ммоль) и ДМФА (1,3 мл) нагревают до 90°C на протяжении ночи. Затем добавляют дополнительное количество 2-йодэтанола (77 мкл, 0,98 ммоль) и реакционную смесь перемешивают при 90°C в течение 3 дней. Реакционную смесь распределяют между этилацетатом и водой. Водный слой промывают этилацетатом и затем объединенные этилацетатные слои промывают водой (×3) и насыщенным раствором соли, сушат над MgSO4 и концентрируют. Остаток очищают колоночной хроматографией (50-100% CH2Cl2 - гексаны), получая продукт в виде желтого твердого вещества (180 мг, чистота ~25% согласно ЯМР, продукт элюирует совместно с исходным продуктом индола). ESI-MS m/z вычислено 287,1, найдено 288,5 (M+1)+. Время удерживания 1,59 минут.
1H ЯМР (400 МГц, ДМСО-d6) δ 12,23 (с, 1Н), 8,14 (д, J=9,1 Гц, 1Н), 8,02 (д, J=9,1 Гц, 1Н), 6,60 (с, 1Н), 5,10 (т, J=5,5 Гц, 1Н), 4,55 (т, J=6,3 Гц, 2H), 3,78-3,73 (м, 2H) и 1,49 (с, 9H) ppm.
Стадия b: 5-амино-2-трет-бутил-1-(2-гидроксиэтил)-1H-индол-4-карбонитрил
К раствору 2-трет-бутил-1-(2-гидроксиэтил)-5-нитро-1H-индол-4-карбонитрила (180 мг, 0,63 ммоль) в этаноле (6 мл) в атмосфере N2 добавляют Pd-C (5% масс., 18 мг). Реакционную смесь продувают N2 (газ) и затем H2 (газ) и перемешивают в атмосфере H2 (атм.) при комнатной температуре в течение 1,5 часов. Реакционную смесь фильтруют через целит и концентрируют, получая продукт (150 мг, 93%). ESI-MS m/z вычислено 257,2, найдено 258,5 (M+1)+. Время удерживания 1,26 минут.
Стадия c: N-(2-трет-бутил-4-циано-1-(2-гидроксиэтил)-1H-индол-5-ил)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамид
1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбонилхлорид (196 мг, 0,75 ммоль) добавляют к раствору 5-амино-2-трет-бутил-1-(2-гидроксиэтил)-1H-индол-4-карбонитрила (150 мг, 0,58 ммоль) и триэтиламина (242 мкл, 1,74 ммоль) в дихлорметане (2 мл). Реакционную смесь перемешивают при комнатной температуре на протяжении ночи. Реакционную смесь разбавляют дихлорметаном и экстрагируют 1N раствором HCl (×2), насыщенным раствором NaHCO3 (×2), насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют. Остаток растворяют в ДМСО и очищают ВЭЖХ с обращенной фазой, получая продукт, N-(2-трет-бутил-4-циано-1-(2-гидроксиэтил)-1H-индол-5-ил)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамид.
ESI-MS m/z вычислено 481,2, найдено 482,5 (M+1)+. Время удерживания 1,99 минут.
1H ЯМР (400 МГц, ДМСО-d6) δ 8,93 (с, 1Н), 7,71 (д, J=8,8 Гц, 1Н), 7,51 (с, 1Н), 7,42 (д, J=8,3 Гц, 1Н), 7,33 (д, J=1,6 Гц, 1Н), 7,08 (д, J=8,8 Гц, 1Н), 6,28 (с, 1Н), 5,05 (т, J=5,6 Гц, 1Н), 4,42 (т, J=6,8 Гц, 2H), 3,70-3,65 (м, 2H), 1,51-1,48 (м, 2H), 1,44 (с, 9H), 1,19-1,16 (м, 2H).
Пример 8: 2-(2-трет-бутил-5-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-6-фтор-1H-индол-1-ил)-N,N,N-триметилэтанаминийхлорид
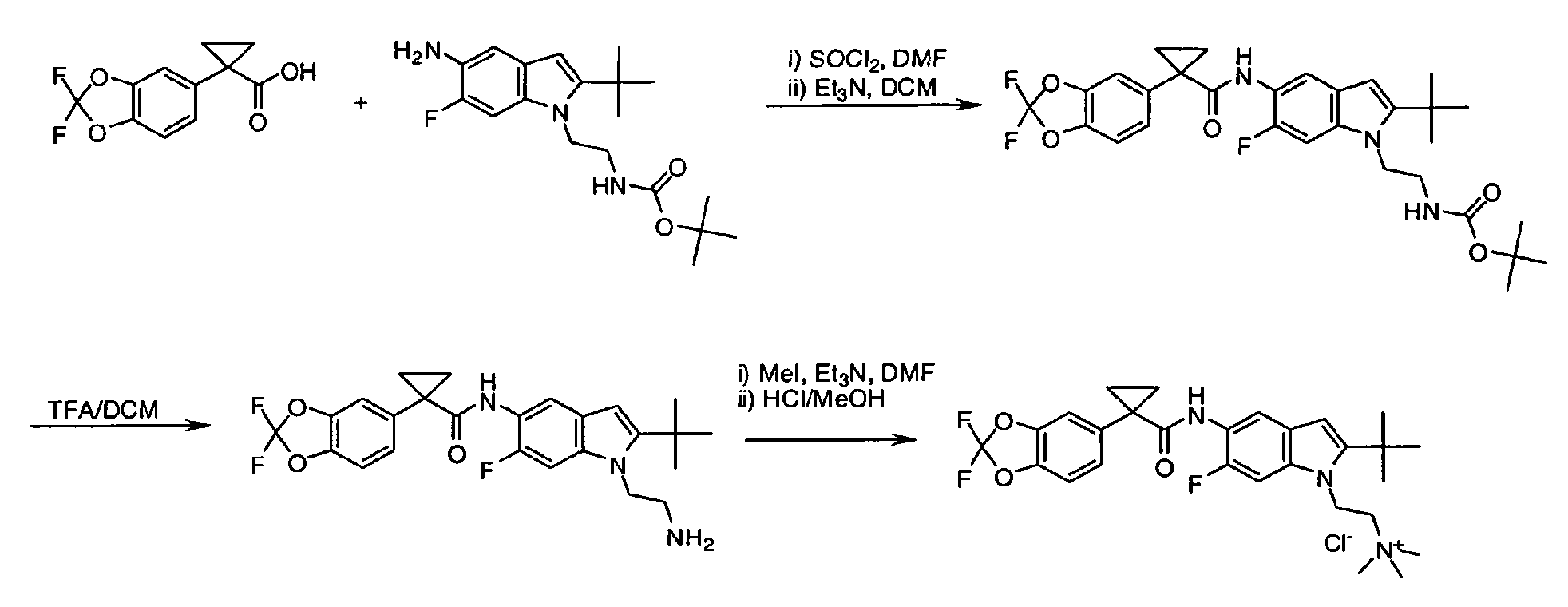
Стадия a: трет-Бутил 2-(2-трет-бутил-5-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-6-фтор-1H-индол-1-ил)этилкарбамат
К 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоте (90,14 мг, 0,3722 ммоль) в тионилхлориде (81,28 мкл, 1,117 ммоль) добавляют N,N-диметилформамид (8,204 мкл, 0,1064 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 30 минут, прежде чем удалить из нее в вакууме избыточный тионилхлорид и N,N-диметилформамид, получая хлорангидрид кислоты. Затем хлорангидрид кислоты растворяют в дихлорметане (1,5 мл) и медленно добавляют к раствору трет-бутил 2-(5-амино-2-трет-бутил-6-фтор-1H-индол-1-ил)этилкарбамата (156,1 мг, 0,4467 ммоль) и триэтиламина (155,6 мкл, 1,117 ммоль) в дихлорметане (1,5 мл). Полученную реакционную смесь перемешивают при комнатной температуре в течение 21 часа. Реакционную смесь разбавляют дихлорметаном (5 мл) и промывают 1N водным HCl (5 мл) и насыщенным водным раствором NaHCO3 (5 мл). Органический слой сушат над Na2SO4, фильтруют и упаривают при пониженном давлении. Неочищенный продукт очищают колоночной хроматографией на силикагеле (смесь 0-30% этилацетата в гексане), получая трет-бутил 2-(2-трет-бутил-5-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-6-фтор-1H-индол-1-ил)этилкарбамат в виде белого твердого вещества (140 мг, 66%). ESI-MS m/z вычислено 573,2, найдено 574,7 (M+1)+. Время удерживания 2,41 минут.
1H ЯМР (400,0 МГц, ДМСО) δ 8,35 (с, 1Н), 7,53 (с, 1Н), 7,44-7,41 (м, 2Н), 7,34-7,29 (м, 2Н), 7,13-7,10 (м, 1Н), 6,17 (с, 1Н), 4,24-4,20 (м, 2Н), 3,20-3,17 (м, 2Н), 1,48-1,45 (м, 2H), 1,41 (с, 18H) и 1,15-1,12 (м, 2H) ppm.
Стадия b: N-(1-(2-аминоэтил)-2-трет-бутил-6-фтор-1H-индол-5-ил)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамид
К раствору трет-бутил 2-(2-трет-бутил-5-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-6-фтор-1H-индол-1-ил)этилкарбамата (137,5 мг, 0,24 ммоль) в дихлорметане (1,8 мл) добавляют трифторуксусную кислоту (444 (мкл, 5,8 ммоль) и смесь перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь разбавляют дихлорметаном и промывают насыщенным водным раствором NaHCO3 (3 мл) и насыщенным раствором соли (3 мл). Органический слой сушат над Na2SO4, фильтруют и упаривают при пониженном давлении. Неочищенный продукт очищают колоночной хроматографией на силикагеле (смесь 0-10% метанола в дихлорметане), получая N-(1-(2-аминоэтил)-2-трет-бутил-6-фтор-1H-индол-5-ил)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамид в виде белого твердого вещества (93,7 мг, 82%). ESI-MS m/z вычислено 473,19, найдено 474,5 (M+1)+. Время удерживания 1,61 минут.
Стадия c: 2-(2-трет-бутил-5-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-6-фтор-1H-индол-1-ил)-N,N,N-триметилэтанаминийхлорид
К прозрачному раствору N-(1-(2-аминоэтил)-2-трет-бутил-6-фтор-1H-индол-5-ил)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамида (50 мг, 0,1056 ммоль) в N,N- диметилформамиде (1 мл), добавляют метилиодид (336,8 мг, 147,7 мкл, 2,37 ммоль) и триэтиламин (106,9 мг, 147,2 мкл, 1,05 ммоль) и смесь нагревают при 80°C в течение 2 часов. Неочищенный продукт очищают ВЭЖХ с обращенной фазой. 22 мг этого продукта растворяют в 1,25 M HCl в метаноле (112 мкл, 0,14 ммоль) и нагревают при 60°C в течение 1 часа. Реакционную смесь охлаждают до комнатной температуры. Продукт сначала сушат и затем растворяют в дихлорметане и сушат снова. Эту процедуру повторяют четыре раза, получая 2-(2-трет-бутил-5-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-6-фтор-1H-индол-1-ил)-N,N,N-триметилэтанаминийхлорид. ESI-MS m/z вычислено 516,25, найдено 516,7 (M+1)+. Время удерживания 1,69 минут.
1H ЯМР (400,0 МГц, ДМСО) δ 8,43 (с, 1Н), 7,53 (с, 1Н), 7,45-7,41 (м, 2Н), 7,36-7,31 (м, 2Н), 6,27 (с, 1Н), 4,74-4,70 (м, 2Н), 3,57-3,53 (м, 2Н), 3,29 (с, 9Н), 1,48-1,42 (м, 11H) и 1,15 (дд, J=3,9, 6,8 Гц, 2H) ppm.
Пример 9: 2-(4-(трет-бутилдиметилсилилокси)-2-метилбутан-2-ил)-6-фтор-5-нитро-1H-индол
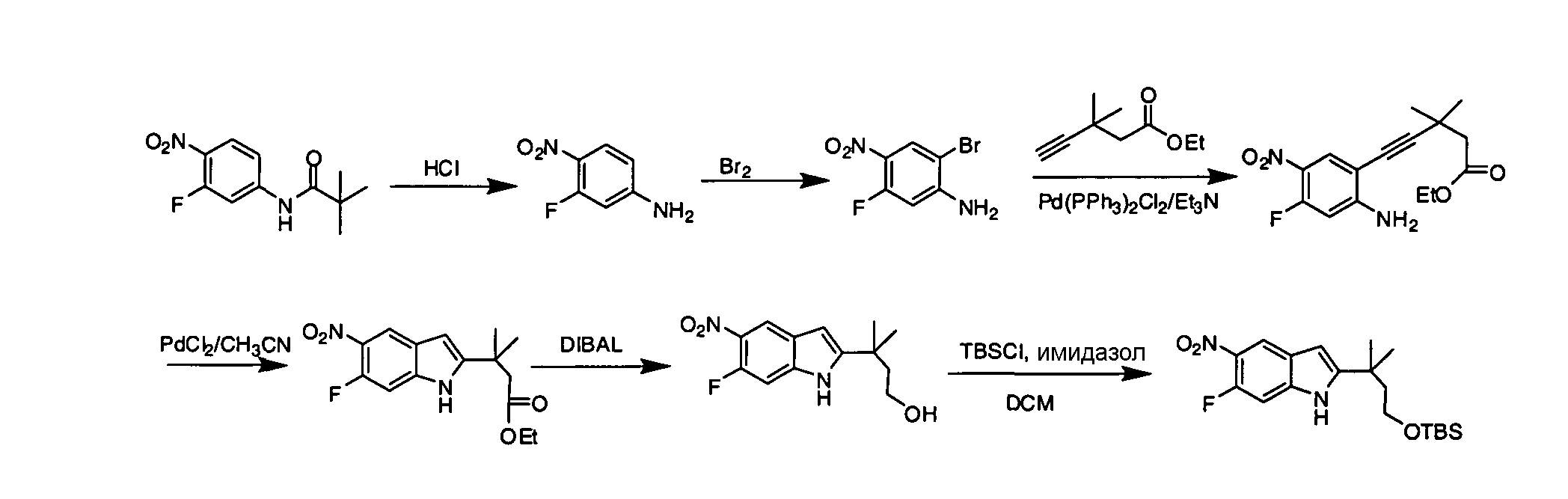
Стадия a: 3-фтор-4-нитроанилин
Смесь N-(3-фтор-4-нитрофенил)-2,2-диметилпропионамида (87,0 г, 0,36 моль) в CH2Cl2 (400 мл) и 6N хлористоводородной кислоты (800 мл) нагревают при температуре кипения с обратным холодильником в течение 2 часов. Реакционную смесь охлаждают до комнатной температуры. Реакционную смесь разбавляют 1000 мл этилацетата и порциями добавляют карбонат калия (500,0 г). Водный раствор отделяют и органический слой промывают насыщенным раствором соли и сушат над безводным Na2SO4. Растворитель удаляют выпариванием при пониженном давлении; остаток очищают колоночной хроматографией на силикагеле (смесь петролейный эфир/этилацетат 30:1), получая 3-фтор-4-нитроанилин (56,0 г, 99%).
1H ЯМР (300 МГц, CDCl3) δ 8,07 (т, J=8,7 Гц, 1Н), 7,86 (дд, J=2,1, 13,2 Гц, 1Н), 7,59 (ушир.с, 2Н), 7,22 (с, 1Н).
Стадия b: 2-бром-5-фтор-4-нитроанилин
К раствору 3-фтор-4-нитроанилина (56 г, 0,36 моль) в уксусной кислоте (500 мл) добавляют по каплям бром (17,7 мл, 0,36 моль) на протяжении 1 часа. Реакционную смесь перемешивают в течение 1 часа при 0-5°C на бане со льдом. Реакционную смесь подщелачивают насыщенным Na2CO3 и экстрагируют этилацетатом (200 мл × 3). Объединенные органические слои промывают насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении, получая остаток, который очищают колоночной хроматографией на силикагеле (смесь петролейный эфир/этилацетат 10:1), получая 2-бром-5-фтор-4-нитроанилин (45,6 г, 84%) в виде желтого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 8,29 (д, J=7,6 Гц, 1Н), 6,53 (д, J=12,4 Гц, 1Н), 4,94 (ушир.с, 2H).
Стадия c: этил 5-(2-амино-4-фтор-5-нитрофенил)-3,3-диметилпент-4-иноат
К раствору 2-бром-5-фтор-4-нитроанилина (45,7 г, 0,19 моль) и этил 3,3-диметилпент-4-иноата (88,3 г, 0,57 моль) в Et3N (700 мл) добавляют Pd(PPh3)2Cl2 (13,8 г, 0,02 моль) и CuI (3,6 г, 0,02 моль) в атмосфере N2. Реакционную смесь перемешивают при 70°C в течение 8 часов. Реакционную смесь разбавляют 500 мл этилацетата и 1500 мл воды. Органический слой отделяют и водную фазу экстрагируют этилацетатом (500 мл × 3), объединенные органические слои промывают насыщенным раствором соли и сушат над безводным Na2SO4, фильтруют и упаривают при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле (смесь петролейный эфир/этилацетат 10:1), получая этил-5-(2-амино-4-фтор-5-нитрофенил)-3,3-диметилпент-4-иноат (34,5 г, 57%).
1H ЯМР (300 МГц, CDCl3) δ 8,05 (д, J=8,1 Гц, 1Н), 6,36 (д, J=13,2 Гц, 1Н), 5,60 (ушир.с, 2Н), 4,16 (кв, J=7,2 Гц, 2Н), 2,51 (с, 2Н), 1,40 (с, 6Н), 1,28 (т, J=7,2 Гц, 3H).
Стадия d: этил 3-(6-фтор-5-нитро-1H-индол-2-ил)-3-метилбутаноат
Смесь этил 5-(2-амино-4-фтор-5-нитрофенил)-3,3-диметилпент-4-иноата (34,5 г, 0,11 моль) и PdCl2(10,4 г, 58,6 нмоль) в CH3CN (350 мл) нагревают при температуре кипения с обратным холодильником в течение 1,5 часов. Реакционную смесь охлаждают до комнатной температуры. Добавляют этилацетат (300 мл), осадок отфильтровывают и промывают метанолом. Фильтрат концентрируют при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле (смесь петролейный эфир/этилацетат 40:1), получая этил 3-(6-фтор-5-нитро-1H-индол-2-ил)-3-метилбутаноат (34,0 г, 98%) в виде темно-желтого твердого вещества.
1H ЯМР (300 МГц, CDCl3) δ 10,11 (ушир.с, 1Н), 8,30 (д, J=7,2 Гц, 1Н), 7,14 (д, J=11,7 Гц, 1Н), 6,35 (д, J=1,5 Гц, 1Н), 4,17 (кв, J=7,2 Гц, 2Н), 2,69 (с, 2Н), 1,51 (с, 6H), 1,25 (т, J=7,2 Гц, 3H).
Стадия e: 3-(6-фтор-5-нитро-1H-индол-2-ил)-3-метилбутан-1-ол
К раствору этил 3-(6-фтор-5-нитро-1H-индол-2-ил)-3-метилбутаноата (34 г, 0,11 моль) в сухом CH2Cl2 (400 мл) добавляют по каплям DIBAL-H (283,4 мл, 0,27 моль) на протяжении 2 часов при -78°C. Реакционную смесь перемешивают в течение 10 часов при -78°C и затем гасят добавлением воды (200 мл). Осадок отфильтровывают и промывают метанолом. Фильтрат экстрагируют CH2Cl2 (200 мл × 3), объединенные органические слои промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (смесь петролейный эфир/этилацетат 50:1), получая 3-(6-фтор-5-нитро-1H-индол-2-ил)-3-метилбутан-1-ол (6,6 г, 22%).
1H ЯМР (400 МГц, CDCl3) δ 9,35 (ушир.с, 1Н), 8,30 (д, J=7,6 Гц, 1Н), 7,11 (д, J=12,0 Гц, 1Н), 6,35 (д, J=1,2 Гц, 1Н), 3,74 (т, J=6,4 Гц, 2Н), 1,9 (т, J=6,4 Гц, 2H), 1,4 (с, 6H).
Стадия f: 2-(4-(трет-бутилдиметилсилилокси)-2-метилбутан-2-ил)-6-фтор-5-нитро-1H-индол
К раствору 3-(6-фтор-5-нитро-1H-индол-2-ил)-3-метилбутан-1-ола (6,6 г, 25 ммоль) в CH2Cl2 (80 мл) добавляют TBSCl (3,7 г, 25 нмоль) и имидазол (4,2 г, 62 нмоль) при 0°C. Реакционную смесь перемешивают при комнатной температуре в течение 12 часов. Осадок отфильтровывают и промывают метанолом. Фильтрат концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (смесь петролейный эфир/этилацетат 10:1), получая целевой продукт в виде коричневого твердого вещества (5,0 г, 53%).
1H ЯМР (300 МГц, CDCl3) δ 9,80 (ушир.с, 1Н), 8,30 (д, J=7,2 Гц, 1Н), 7,05 (д, J=11,7 Гц, 1Н), 6,33 (т, J=1,2 Гц, 2Н), 3,7 (т, J=6,0 Гц, 2Н), 1,91 (т, J=6,0 Гц, 2H), 1,42 (с, 6H), 0,94 (с, 9H), 0,12 (с, 6Н). MS (ESI) m/z (M+H+): 381,1.
Пример 10: Бензил 2,2-диметилбут-3-иноат
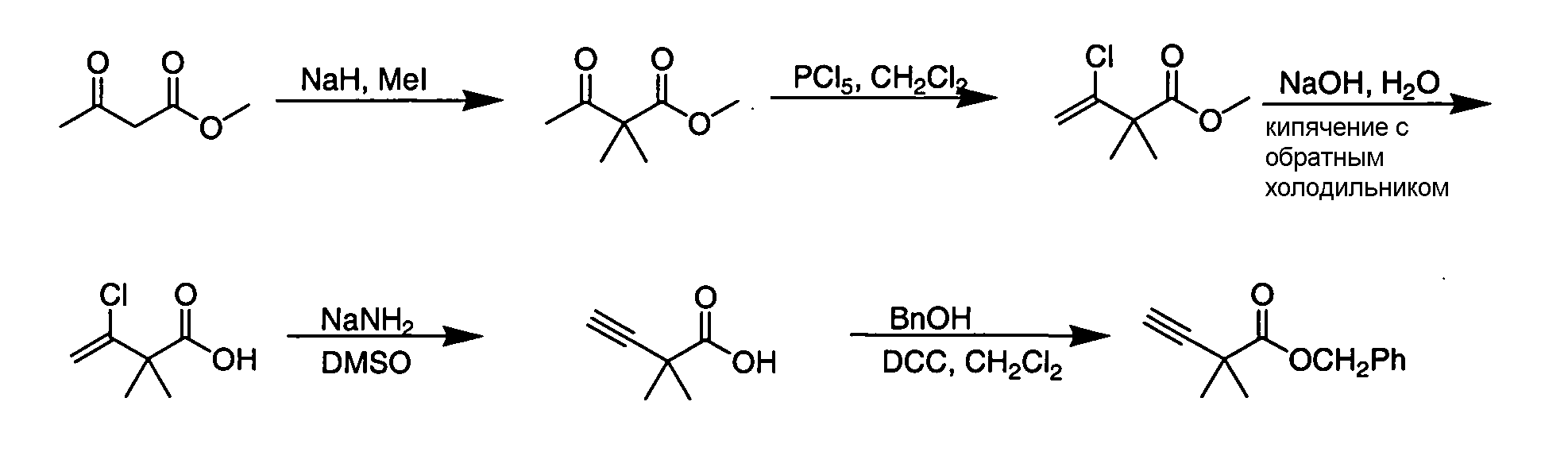
Стадия a: метил 2,2-диметил-3-оксобутаноат
К суспензии NaH (28,5 г, 0,718 моль, 60%) в ТГФ (270 мл) добавляют по каплям раствор метилового эфира 3-оксомасляной кислоты (78,6 г, 0,677 моль) в ТГФ (70 мл) при 0°C. Смесь перемешивают в течение 0,5 часов при 0°C. MeI (99,0 г, 0,698 моль) добавляют по каплям при 0°C. Полученную смесь нагревают до комнатной температуры и перемешивают в течение 1 часа. NaH (28,5 г, 0,718 моль, 60%) добавляют порциями при 0°C и полученную смесь продолжают перемешивать в течение 0,5 ч при 0°C. Затем по каплям при 0°C добавляют MeI (99,0 г, 0,698 ммоль). Реакционную смесь нагревают до комнатной температуры и перемешивают на протяжении ночи. Смесь выливают в талую воду. Органический слой отделяют. Водную фазу экстрагируют EtOAc (300 мл × 3). Объединенные органические слои сушат и упаривают при пониженном давлении, получая метил 2,2-диметил-3-оксобутаноат (52 г, 53%), который используют непосредственно на следующей стадии.
Стадия b: метил 3-хлор-2,2-диметилбут-3-еноат
К суспензии PCl5 (161 г, 0,772 моль) в дихлорметане (600 мл) добавляют по каплям метил 2,2-диметил-3-оксобутаноат (52 г, 0,361 моль, неочищенный с последней стадии) при 0°C, с последующим добавлением приблизительно 20 капель сухого ДМФА. Смесь нагревают при температуре кипения с обратным холодильником на протяжении ночи. После охлаждения реакционную смесь медленно выливают в талую воду. Органический слой отделяют и водную фазу экстрагируют дихлорметаном (300 мл × 3). Объединенные органические слои промывают насыщенным водным раствором NaHCO3 и сушат над безводным Na2SO4. Растворитель выпаривают, получая продукт, метил 3-хлор-2,2-диметилбут-3-еноат, который используют без дополнительной очистки (47 г, 82%).
Стадия c: 3-хлор-2,2-диметилбут-3-еновая кислота
Смесь метил 3-хлор-2,2-диметилбут-3-еноата (42,0 г, 0,26 моль) и NaOH (12,4 г, 0,31 моль) в воде (300 мл) нагревают при температуре кипения с обратным холодильником на протяжении ночи. После охлаждения реакционную смесь экстрагируют диэтиловым эфиром. Органический слой содержит 20 г метил 3-хлор-2,2-диметилбут-3-еноата (48% регенерированного). Водный слой подкисляют холодным 20% раствором HCl и экстрагируют простым эфиром (250 мл × 3). Объединенные органические слои сушат и упаривают при пониженном давлении, получая 3-хлор-2,2-диметилбут-3-еновую кислоту (17 г, 44%), которую используют непосредственно на следующей стадии.
Стадия d: 2,2-диметилбут-3-иновая кислота
В трехгорлую колбу (500 мл) добавляют NaNH2 (17,8 г, 0,458 ммоль, гранулы) и ДМСО (50 мл). Смесь перемешивают при комнатной температуре до тех пор, пока не перестанет выделяться NH3 (газ). Раствор 3-хлор-2,2-диметилбут-3-еновой кислоты (17,0 г, 114 ммоль) в ДМСО (50 мл) добавляют по каплям при 0°C. Смесь нагревают и перемешивают при 50°C в течение 5 часов, затем перемешивают при комнатной температуре на протяжении ночи. Смесь выливают в холодный 20% раствор HCl и затем экстрагируют три раза простым эфиром. Эфирные экстракты сушат над безводным Na2SO4 и концентрируют, получая отношение 6:1 исходного продукта и продукта алкина. Остаток снова сушат, используя простой эфир и Na2SO4 и снова подвергают воздействию вышеуказанных реакционных условий. Реакционную смесь обрабатывают таким же образом, получая 2,2-диметилбут-3-иновую кислоту (12,0 г, 94%).
Бензил 2,2-диметилбут-3-иноат
К перемешиваемому раствору 2,2-диметилбут-3-иновой кислоты (87,7 г, 0,782 ммоль) и бензилового спирта (114,6 г, 0,938 моль) в дихлорметане (800 мл) добавляют DCC (193,5 г, 0,938 ммоль) при -20°C. Реакционную смесь перемешивают при комнатной температуре на протяжении ночи и затем растворитель выпаривают в вакууме. Остаток очищают хроматографией на силикагеле (в качестве элюента смесь 2% этилацетата в петролейном эфире), получая бензил 2,2-диметилбут-3-иноат (100 г, выход 59%).
1H ЯМР (CDCl3,400 МГц) δ 7,37-7,36 (м, 5Н), 5,19 (с, 2Н), 2,28 (с, 1Н), 1,52 (с, 6Н).
Пример 11: 2-(1-(трет-бутилдиметилсилилокси)-2-метилпропан-2-ил)-6-фтор-5-нитро-1H-индол
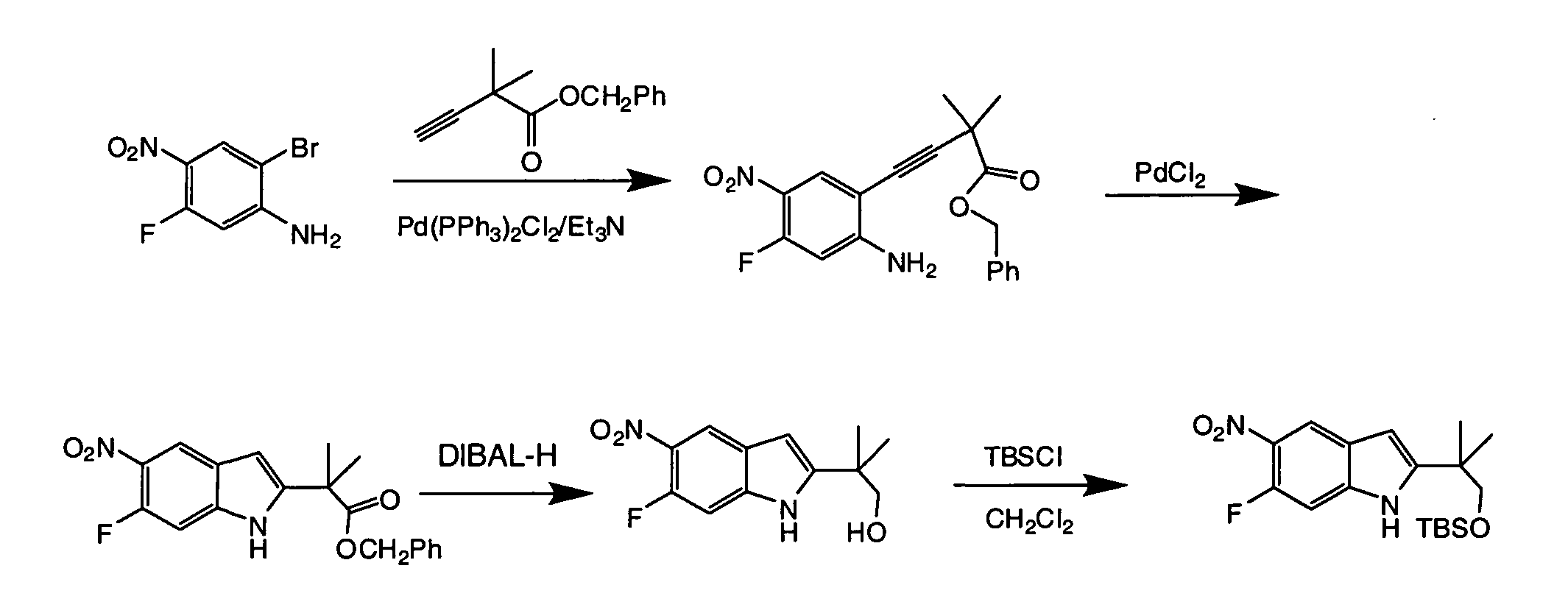
Стадия a: бензил 4-(2-амино-4-фтор-5-нитрофенил)-2,2-диметилбут-3-иноат
К раствору 2-бром-5-фтор-4-нитроанилина (23,0 г, 0,1 моль) в Et3N (250 мл) добавляют бензил 2,2-диметилбут-3-иноат (59,0 г, 0,29 моль), CuI (1,85 г) и Pd(PPh3)2Cl2 (2,3 г) при комнатной температуре. Смесь перемешивают при 80°C на протяжении ночи. После охлаждения до комнатной температуры реакцию гасят водой и водный слой экстрагируют этилацетатом (100 мл × 3). Объединенный органический слой сушат над безводным Na2SO4, растворитель выпаривают в вакууме. Остаток очищают хроматографией на силикагеле (смесь 10% этилацетата в петролейном эфире), получая бензил 4-(2-амино-4-фтор-5-нитрофенил)-2,2-диметилбут-3-иноат (20,0 г, 56%).
1H ЯМР (400 МГц, CDCl3) δ 8,05 (д, J=8,4 Гц, 1Н), 7,39-7,38 (м, 5Н), 6,33 (д, J=13,2 Гц, 1Н), 5,20 (с, 2Н), 4,89 (ушир.с, 2Н), 1,61 (с, 6Н).
Стадия b: бензил 2-(6-фтор-5-нитро-1H-индол-2-ил)-2-метилпропаноат
К раствору бензил 4-(2-амино-4-фтор-5-нитрофенил)-2,2-диметилбут-3-иноата (20,0 г, 56 ммоль) в ацетонитриле (100 мл) добавляют PdCl2 (5,0 г, 28 ммоль) при комнатной температуре. Смесь перемешивают при 80°C на протяжении ночи. Смесь фильтруют и растворитель выпаривают в вакууме, остаток очищают хроматографией на силикагеле (смесь 10% EtOAc в петролейном эфире), получая бензил 2-(6-фтор-5-нитро-1H-индол-2-ил)-2-метилпропаноат (18,0 г, 90%).
1H ЯМР (300 МГц, CDCl3) δ 8,96 (ушир.с, 1Н), 8,33 (д, J=7,2 Гц, 1Н), 7,35-7,28 (м, 5Н), 7,08 (д, J=11,7 Гц, 1Н), 6,47 (с, 1Н), 5,18 (с, 2Н), 1,69 (с, 6Н).
Стадия c: 2-(6-фтор-5-нитро-1H-индол-2-ил)-2-метилпропан-1-ол
К раствору бензил 2-(6-фтор-5-нитро-1H-индол-2-ил)-2-метилпропаноата (18,0 г, 0,05 моль) в CH2Cl2 (100 мл) добавляют DIBAL-H (12 мл) при -78°C. Смесь перемешивают в течение 1 ч при той же температуре и нагревают до комнатной температуры. Реакцию гасят водой и водный слой экстрагируют EtOAc (100 мл × 3). Объединенные органические слои сушат над безводным Na2SO4, растворитель выпаривают в вакууме. Остаток очищают хроматографией на силикагеле (смесь 10% EtOAc в петролейном эфире), получая 2-(6-фтор-5-нитро-1H-индол-2-ил)-2-метилпропан-1-ол (10,0 г, 77%).
1H ЯМР (300 МГц, CDCl3) δ 9,37 (с, 1Н), 8,32 (д, J=7,2 Гц, 1Н), 7,11 (д, J=11,7 Гц, 1Н), 6,36 (с, 1Н), 3,73 (д, J=5,1 Гц, 2Н), 1,97 (т, J=5,1 Гц, 1Н), 1,39 (с, 6Н).
Стадия d: 2-(1-(трет-бутилдиметилсилилокси)-2-метилпропан-2-ил)-6-фтор-5-нитро-1H-индол
К перемешиваемому раствору 2-(6-фтор-5-нитро-1H-индол-2-ил)-2-метилпропан-1-ола (10,0 г) в CH2Cl2 добавляют TBSCl (8,9 г), имидазол (8,1 г, 0,12 моль) при комнатной температуре. Смесь перемешивают на протяжении ночи. Растворитель выпаривают в вакууме и остаток очищают хроматографией на силикагеле (смесь 10% EtOAc в петролейном эфире), получая 2-(1-(трет-бутилдиметилсилилокси)-2-метилпропан-2-ил)-6-фтор-5-нитро-1H-индол (5,3 г, 38%).
1H ЯМР (300 МГц, CDCl3) δ 9,51 (с, 1Н), 8,31 (д, J=7,5 Гц, 1Н), 7,02 (д, J=11,7 Гц, 1Н), 6,32 (с, 1Н), 3,63 (с, 2Н), 1,35 (с, 6Н), 0,99 (с, 9Н), 0,11 (с, 6Н).
Пример 12: 6-фтор-1,1-диметил-7-нитро-2,3-дигидро-1H-пирроло[1,2-a]индол, (R)-3-(1-((2,2-диметил-1,3-диоксолан-4-ил)метил)-6-фтор-5-нитро-1H-индол-2-ил)-3-метилбутан-1-ол, 2-(4-(((R)-2,2-диметил-1,3-диоксолан-4-ил)метокси)-2-метилбутан-2-ил)-1-(((R)-2,2-диметил-1,3-диоксолан-4-ил)метил)-6-фтор-5-нитро-1H-индол, 3-(6-фтор-5-нитро-1H-индол-2-ил)-3-метилбутан-1-ол и (R)-2-(4-((2,2-диметил-1,3-диоксолан-4-ил)метокси)-2-метилбутан-2-ил)-6-фтор-5-нитро-1H-индол
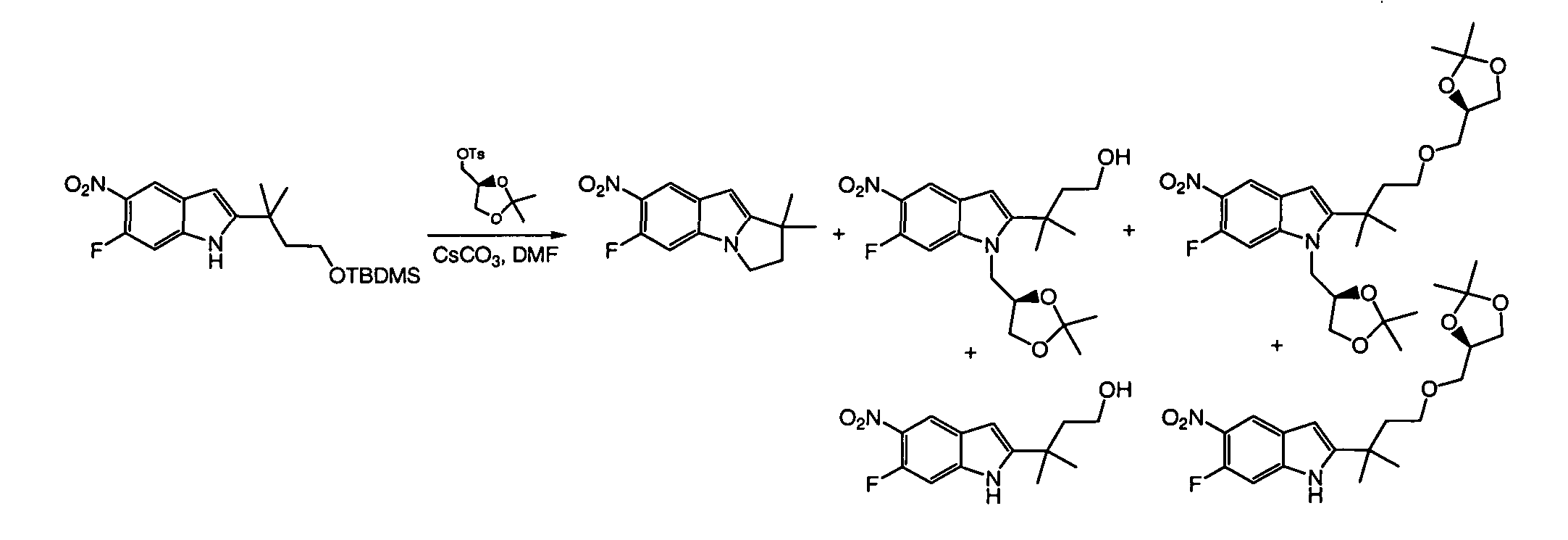
Стадия a: 6-фтор-1,1-диметил-7-нитро-2,3-дигидро-1H-пирроло[1,2-a]индол, (R)-3-(1-((2,2-диметил-1,3-диоксолан-4-ил)метил)-6-фтор-5-нитро-1H-индол-2-ил)-3-метилбутан-1-ол, 2-(4-(((R)-2,2-диметил-1,3-диоксолан-4-ил)метокси)-2-метилбутан-2-ил)-1-(((R)-2,2-диметил-1,3-диоксолан-4-ил)метил)-6-фтор-5-нитро-1H-индол, 3-(6-фтор-5-нитро-1H-индол-2-ил)-3-метилбутан-1-ол и (R)-2-(4-((2,2-диметил-1,3-диоксолан-4-ил)метокси)-2-метилбутан-2-ил)-6-фтор-5-нитро-1H-индол
К раствору 2-(4-(трет-бутилдиметилсилилокси)-2-метилбутан-2-ил)-6-фтор-5-нитро-1H-индола (1,9 г, 5,0 ммоль) и (S)-(2,2-диметил-1,3-диоксолан-4-ил)метил 4-метилбензолсульфоната (2,86 г, 10,0 ммоль) в ДМФА (10 мл) добавляют Cs2CO3 (4,88 г, 15,0 ммоль). Смесь нагревают при 90°C в течение 24 часов. Реакционную смесь распределяют между этилацетатом и водой. Водный слой экстрагируют этилацетатом и объединенные органические слои промывают насыщенным раствором соли и сушат над MgSO4. После удаления растворителя остаток очищают колоночной хроматографией (смесь 10-50% этилацетата - гексан), получая 6-фтор-1,1-диметил-7-нитро-2,3-дигидро-1H-пирроло[1,2-a]индол (600 мг, 48%). ESI-MS m/z вычислено 248,1, найдено 249,2 (M+1)+. Время удерживания 2,00 минуты; 2-(4-(((R)-2,2-диметил-1,3-диоксолан-4-ил)метокси)-2-метилбутан-2-ил)-1-(((R)-2,2-диметил-1,3-диоксолан-4-ил)метил)-6-фтор-5-нитро-1H-индол (270 мг, содержащий некоторое количество (R)-2-(4-((2,2-диметил-1,3-диоксолан-4-ил)метокси)-2-метилбутан-2-ил)-6-фтор-5-нитро-1H-индола). ESI-MS m/z вычислено 494,2 и 380,2, найдено 495,4 и 381,4 (M+1)+. Время удерживания 2,12 и 1,92 минут; (R)-3-(1-((2,2-диметил-1,3-диоксолан-4-ил)метил)-6-фтор-5-нитро-1H-индол-2-ил)-3-метилбутан-1-ол (1,0 г, содержащий некоторое количество 3-(6-фтор-5-нитро-1H-индол-2-ил)-3-метилбутан-1-ола). ESI-MS m/z вычислено 380,2 и 266,1, найдено 381,2 и 267,2 (M+1)+. Время удерживания 1,74 и 1,48 минут.
Пример 13: (R)-2-(1-((2,2-диметил-1,3-диоксолан-4-ил)метил)-6-фтор-5-нитро-1H-индол-2-ил)-2-метилпропан-1-ол и 3-(6-фтор-5-нитро-1H-индол-2-ил)-3-метилбутан-1-ол
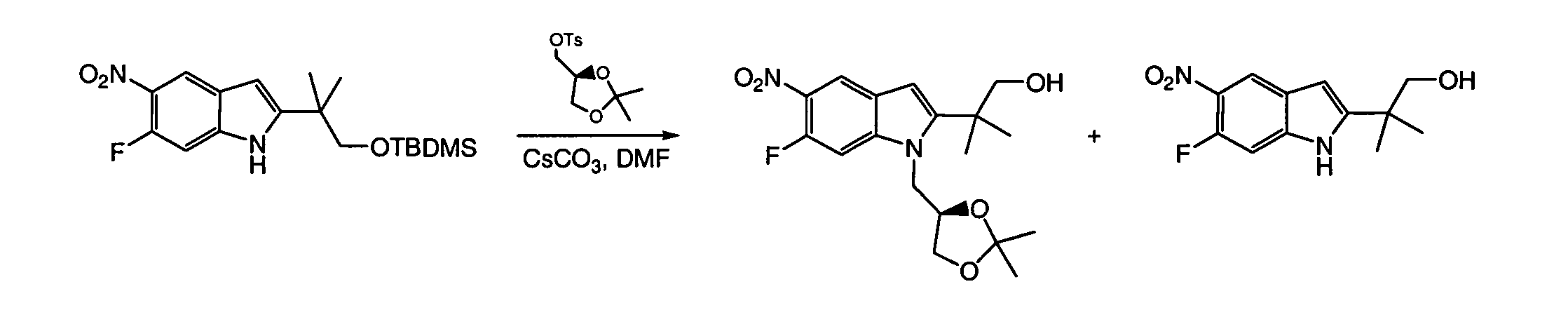
Смесь, содержащую (R)-2-(1-((2,2-диметил-1,3-диоксолан-4-ил)метил)-6-фтор-5-нитро-1H-индол-2-ил)-2-метилпропан-1-ол и 3-(6-фтор-5-нитро-1H-индол-2-ил)-3-метилбутан-1-ол, получают, следуя вышепредставленной процедуре, исходя из 2-(1-(трет- бутилдиметилсилилокси)-2-метилпропан-2-ил)-6-фтор-5-нитро-1H-индола. (R)-2-(1-((2,2-диметил-1,3-диоксолан-4-ил)метил)-6-фтор-5-нитро-1H-индол-2-ил)-2-метилпропан-1-ол. ESI-MS m/z вычислено 366,2, найдено 367,2 (M+1)+. Время удерживания 1,71 минут; 3-(6-фтор-5-нитро-1H-индол-2-ил)-3-метилбутан-1-ол, ESI-MS m/z вычислено 252,1, найдено 253,4 (M+1)+. Время удерживания 1,42 минут.
Пример 14: (R)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(1-(2,3-дигидроксипропил)-6-фтор-2-(4-гидрокси-2-метилбутан-2-ил)-1H-индол-5-ил)циклопропанкарбоксамид
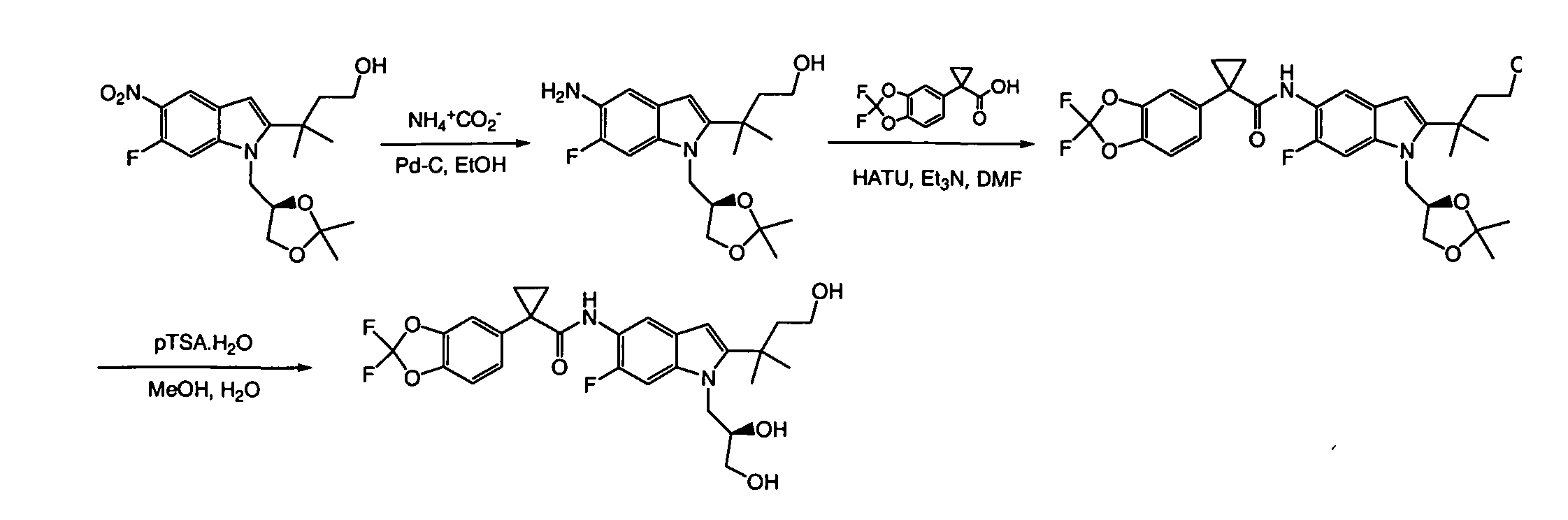
Стадия a: (R)-3-(5-амино-1-((2,2-диметил-1,3-диоксолан-4-ил)метил)-6-фтор-1H-индол-2-ил)-3-метилбутан-1-ол
К раствору (R)-3-(1-((2,2-диметил-1,3-диоксолан-4-ил)метил)-6-фтор-5-нитро-1H-индол-2-ил)-3-метилбутан-1-ола, содержащему некоторое количество 3-(6-фтор-5-нитро-1H-индол-2-ил)-3-метилбутан-1-ола (500 мг, 1,3 ммоль), в этаноле (10 мл) добавляют формиат аммония (500 мг, 7,9 ммоль) и Pd/C (10%, 139 мг, 0,13 ммоль). Смесь кипятят с обратным холодильником в течение 5 мин. Pd-катализатор удаляют фильтрацией через целит и промывают этанолом. Фильтрат упаривают досуха и очищают колоночной хроматографией (смесь 30-50% этилацетата-гексаны), получая (R)-3-(5-амино-1-((2,2-диметил-1,3-диоксолан-4-ил)метил)-6-фтор-1H-индол-2-ил)-3-метилбутан-1-ол (220 мг, 48%, содержит некоторое количество 3-(5-амино-6-фтор-1H-индол-2-ил)-3-метилбутан-1-ола). ESI-MS m/z вычислено 350,2, найдено 351,4 (M+1)+. Время удерживания 0,94 минут.
Стадия b: (R)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(1-((2,2-диметил-1,3-диоксолан-4-ил)метил)-6-фтор-2-(4-гидрокси-2-метилбутан-2-ил)-1H-индол-5-ил)циклопропанкарбоксамид
К смеси 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоты (183 мг, 0,75 ммоль), (R)-3-(5-амино-1-((2,2-диметил-1,3-диоксолан-4-ил)метил)-6-фтор-1H-индол-2-ил)-3-метилбутан-1-ола, содержащего некоторое количество 3-(5-амино-6-фтор-1H-индол-2-ил)-3-метилбутан-1-ола (220 мг, 0,63 ммоль), и HATU (287 мг, 0,75 ммоль) в ДМФА (3,0 мл) добавляют триэтиламин (0,21 мл, 1,5 ммоль). Реакционную смесь перемешивают при комнатной температуре на протяжении ночи и затем распределяют между этилацетатом и водой. Водный слой экстрагируют этилацетатом и объединенные органические слои промывают насыщенным раствором соли и сушат над MgSO4. После удаления растворителя остаток очищают колоночной хроматографией (смесь 20-40% этилацетата-гексаны), получая (R)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(1-((2,2-диметил-1,3-диоксолан-4-ил)метил)-6-фтор-2-(4-гидрокси-2-метилбутан-2-ил)-1H-индол-5-ил)циклопропанкарбоксамид (315 мг, 87%, содержит некоторое количество 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(6-фтор-2-(4-гидрокси-2-метилбутан-2-ил)-1H-индол-5-ил)циклопропанкарбоксамида). ESI-MS m/z вычислено 574,2 найдено 575,7 (M+1)+. Время удерживания 2,08 минут.
Стадия c: (R)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(1-(2,3-дигидроксипропил)-6-фтор-2-(4-гидрокси-2-метилбутан-2-ил)-1H-индол-5-ил)циклопропанкарбоксамид
К раствору (R)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(1-((2,2-диметил-1,3-диоксолан-4-ил)метил)-6-фтор-2-(4-гидрокси-2-метилбутан-2-ил)-1H-индол-5-ил)циклопропанкарбоксамида, содержащего некоторое количество 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(6-фтор-2-(4-гидрокси-2-метилбутан-2-ил)-1H-индол-5-ил)циклопропанкарбоксамида (315 мг, 0,55 ммоль), в метаноле (3 мл) и воде (0,3 мл) добавляют п-TsOH.H2O (21 мг, 0,11 ммоль). Смесь нагревают при 80°C в течение 30 минут. Реакционную смесь распределяют между этилацетатом и водой и водный слой экстрагируют этилацетатом дважды. Объединенные органические слои промывают насыщенным раствором NaHCO3 и насыщенным раствором соли и сушат над MgSO4. После удаления растворителя остаток очищают колоночной хроматографией (смесь 20-80% этилацетата - гексаны), получая (R)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(1-(2,3-дигидроксипропил)-6-фтор-2-(4-гидрокси-2-метилбутан-2-ил)-1H-индол-5- ил)циклопропанкарбоксамид (92 мг, 31%). ESI-MS m/z вычислено 534,2, найдено 535,5 (M+1)+. Время удерживания 1,72 минут.
1H ЯМР (400 МГц, ДМСО-d6) δ 8,32 (с, 1Н), 7,53 (д, J=1,0 Гц, 1Н), 7,43-7,31 (м, 4Н), 6,17 (с, 1Н), 4,97-4,92 (м, 2Н), 4,41 (дд, J=2,4, 15,0 Гц, 1Н), 4,23 (т, J=5,0 Гц, 1Н), 4,08 (дд, J=8,6, 15,1 Гц, 1Н), 3,87 (с, 1Н), 3,48-3,44 (м, 1Н), 3,41-3,33 (м, 1Н), 3,20 (дд, J=7,4, 12,7 Гц, 2Н), 1,94-1,90 (м, 2Н), 1,48-1,45 (м, 2Н), 1,42 (с, 3Н), 1,41 (с, 3Н) и 1,15-1,12 (м, 2Н) ppm.
Пример 15: 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(2-(4-((S)-2,3-дигидроксипропокси)-2-метилбутан-2-ил)-1-((R)-2,3-дигидроксипропил)-6-фтор-1H-индол-5-ил)циклопропанкарбоксамид и(S)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(2-(4-(2,3-дигидроксипропокси)-2-метилбутан-2-ил)-6-фтор-1H-индол-5-ил)циклопропанкарбоксамид
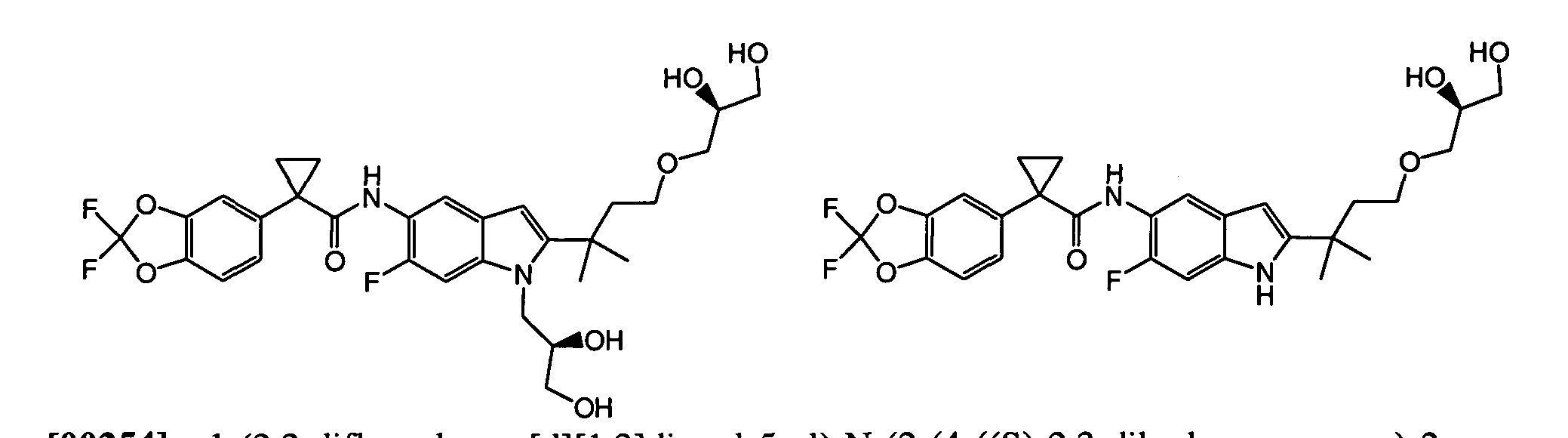
1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(2-(4-((S)-2,3-дигидроксипропокси)-2-метилбутан-2-ил)-1-((R)-2,3-дигидроксипропил)-6-фтор-1H-индол-5-ил)циклопропанкарбоксамид и (S)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(2-(4-(2,3- дигидроксипропокси)-2-метилбутан-2-ил)-6-фтор-1H-индол-5-ил)циклопропанкарбоксамид
1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(2-(4-((S)-2,3-дигидроксипропокси)-2-метилбутан-2-ил)-1-((R)-2,3-дигидроксипропил)-6-фтор-1H-индол-5-ил)циклопропанкарбоксамид и (S)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(2-(4-((S)-2,3-дигидроксипропокси)-2-метилбутан-2-ил)-6-фтор-1Н-индол-5-ил)циклопропанкарбоксамид получают, следуя схеме, аналогичной вышепредставленной, исходя из 2-(4-(((R)-2,2-диметил-1,3- диоксолан-4-ил)метокси)-2-метилбутан-2-ил)-1-(((R)-2,2-диметил-1,3-диоксолан-4-ил)метил)-6-фтор-5-нитро-1H-индола, содержащего некоторое количество (R)-2-(4-((2,2-диметил-1,3-диоксолан-4-ил)метокси)-2-метилбутан-2-ил)-6-фтор-5-нитро-1H-индола). 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(2-(4-((S)-2,3-дигидроксипропокси)-2-метилбутан-2-ил)-1-((R)-2,3-дигидроксипропил)-6-фтор-1H-индол-5-ил)циклопропанкарбоксамид, ESI-MS m/z вычислено 608,2, найдено 609,5 (M+1)+. Время удерживания 1,67 минут.
1H ЯМР (400 МГц, DMSO-d6) δ 8,32 (с, 1H), 7,53 (с, 1H), 7,43-7,31 (м, 4H), 6,19 (с, 1H), 4,95-4,93 (м, 2H), 4,51 (д, J=5,0 Гц, 1H), 4,42-4,39 (м, 2H), 4,10-4,04 (м, 1H), 3,86 (с, 1H), 3,49-3,43 (м, 2H), 3,41-3,33 (м, 1H), 3,30-3,10 (м, 6H), 2,02-1,97 (м, 2H), 1,48-1,42 (м, 8H) и 1,13 (дд, J=4,0, 6,7 Гц, 2H) ppm;
(S)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(2-(4-(2,3-дигидроксипропокси)-2-метилбутан-2-ил)-6-фтор-1H-индол-5-ил)циклопропанкарбоксамид, ESI-MS m/z вычислено 534,2, найдено 535,5 (M+1)+. Время удерживания 1,81 минуты.
1H ЯМР (400 МГц, ДМСО-d6) δ 10,91 (д, J=1,5 Гц, 1H), 8,30 (с, 1H), 7,53 (с, 1H), 7,42-7,33 (м, 3H), 7,03 (д, J=10,9 Гц, 1H), 6,07 (д, J=1,6 Гц, 1H), 4,56 (д, J=5,0 Гц, 1H), 4,43 (т, J=5,7 Гц, 1H), 3,51-3,46 (м, 1H), 3,31-3,13 (м, 6H), 1,88 (т, J=7,3 Гц, 2H), 1,48-1,45 (м, 2H), 1,31 (с, 6H) и 1,15-1,12 (м, 2H) ppm.
Пример 16: 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(6-фтор-2-(1-гидрокси-2-метилпропан-2-ил)-1H-индол-5-ил)циклопропанкарбоксамид
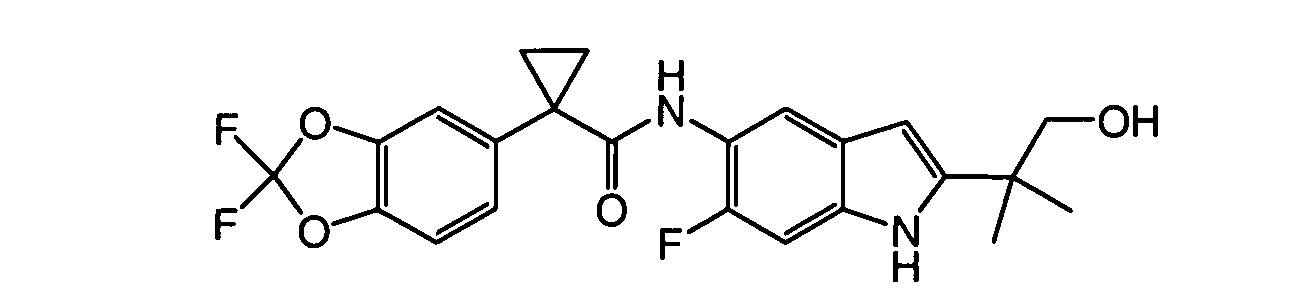
1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(6-фтор-2-(1-гидрокси-2-метилпропан-2-ил)-1H-индол-5-ил)циклопропанкарбоксамид
1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(6-фтор-2-(1-гидрокси-2-метилпропан-2-ил)-1H-индол-5-ил)циклопропанкарбоксамид получают, следуя схеме, аналогичной вышеупомянутой, исходя из смеси, содержащей (R)-2-(1-((2,2-диметил-1,3-диоксолан-4-ил)метил)-6-фтор-5-нитро-1H-индол-2-ил)-2-метилпропан-1-ол и 3-(6-фтор-5-нитро-1H-индол-2-ил)-3- метилбутан-1-ол. ESI-MS m/z вычислено 446,2, найдено 447,5 (M+1)+. Время удерживания 1,88 минут.
1H ЯМР (400 МГц, CDCl3) δ 8,68 (с, 1H), 8,20 (д, J=7,7 Гц, 1H), 7,30-7,21 (м, 3H), 7,12 (д, J=8,2 Гц, 1H), 6,94 (д, J=11,2 Гц, 1H), 6,18 (с, 1H), 3,64 (с, 2H), 1,75 (дд, J=3,8, 6,8 Гц, 2H), 1,34 (с, 6H) и 1,14 (дд, J=3,9, 6,9 Гц, 2H) ppm.
Пример 17: (R)-1-(2,2-Дифторбензо[d][1,3]диоксол-5-ил)-N-(1-(2,3-дигидроксипропил)-6-фтор-2-(1-гидрокси-2-метилпропан-2-ил)-1H-индол-5-ил)циклопропанкарбоксамид
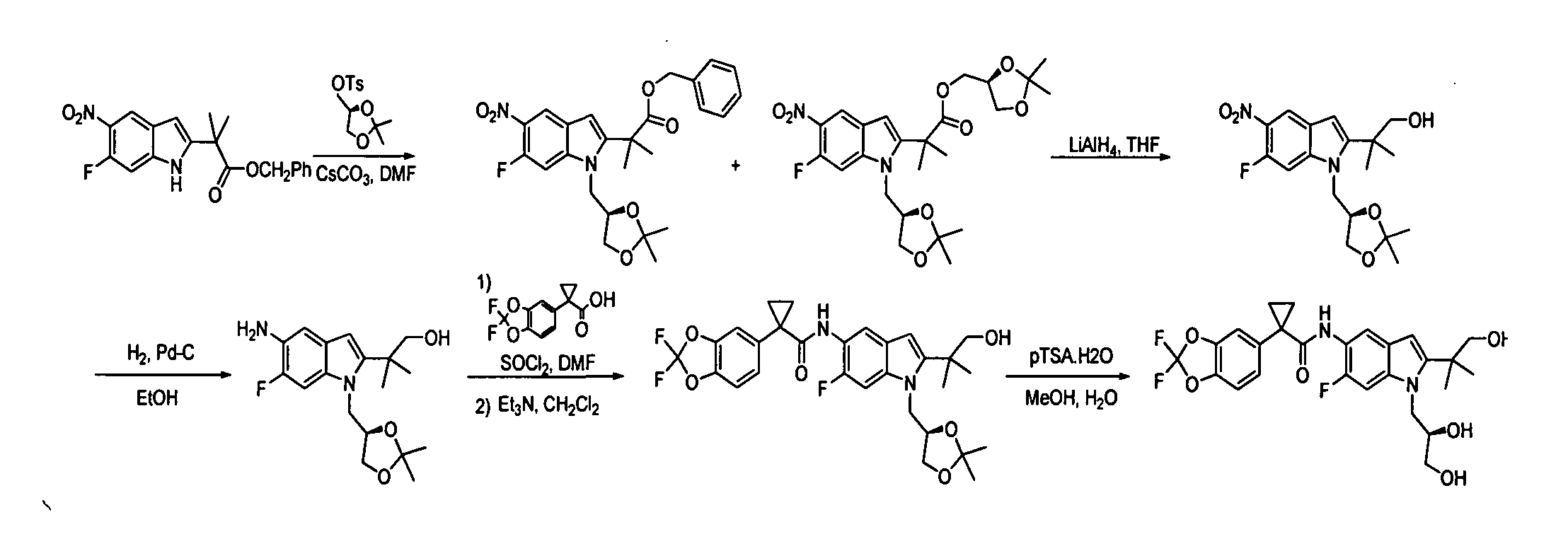
Стадия a: (R)-Бензил 2-(1-((2,2-диметил-1,3-диоксолан-4-ил)метил)-6-фтор-5-нитро-1H-индол-2-ил)-2-метилпропаноат и ((S)-2,2-диметил-1,3-диоксолан-4-ил)метил 2-(1-(((R)-2,2-диметил-1,3-диоксолан-4-ил)метил)-6-фтор-5-нитро-1H-индол-2-ил)-2-метилпропаноат
Карбонат цезия (8,23 г, 25,3 ммоль) добавляют к смеси бензил 2-(6-фтор-5-нитро-1H-индол-2-ил)-2-метилпропаноата (3,0 г, 8,4 ммоль) и (S)-(2,2-диметил-1,3-диоксолан-4-ил)метил 4-метилбензолсульфоната (7,23 г, 25,3 ммоль) в ДМФА (17 мл). Реакционную смесь перемешивают при 80°C в течение 46 часов в атмосфере азота. Затем смесь распределяют между этилацетатом и водой. Водный слой экстрагируют этилацетатом. Объединенные этилацетатные слои промывают насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют. Неочищенный продукт, вязкое коричневое масло, которое содержит оба из продуктов, представленных выше, используют непосредственно на следующей стадии без дополнительной очистки. (R)-Бензил 2-(1-((2,2- диметил-1,3-диоксолан-4-ил)метил)-6-фтор-5-нитро-1H-индол-2-ил)-2-метилпропаноат, ESI-MS m/z вычислено 470,2, найдено 471,5 (M+1)+. Время удерживания 2,20 минут. ((S)-2,2-Диметил-1,3-диоксолан-4-ил)метил 2-(1-(((R)-2,2-диметил-1,3-диоксолан-4-ил)метил)-6-фтор-5-нитро-1H-индол-2-ил)-2-метилпропаноат, ESI-MS m/z вычислено 494,5, найдено 495,7 (M+1)+. Время удерживания 2,01 минут.
Стадия b: (R)-2-(1-((2,2-диметил-1,3-диоксолан-4-ил)метил)-6-фтор-5-нитро-1H-индол-2-ил)-2-метилпропан-1-ол
Неочищенную реакционную смесь, полученную на стадии (a), растворяют в ТГФ (42 мл) и охлаждают на бане со смесью лед-вода. По каплям добавляют LiAlH4 (16,8 мл 1M раствора, 16,8 ммоль). После завершения добавления реакционную смесь перемешивают в течение дополнительных 5 минут. Реакцию гасят добавлением воды (1 мл), 15% раствора NaOH (1 мл) и затем воды (3 мл). Смесь фильтруют через целит и твердое вещество промывают ТГФ и этилацетатом. Фильтрат концентрируют и очищают колоночной хроматографией (смесь 30-60% этилацетата - гексаны), получая продукт в виде коричневого масла (2,68 г, 87% за 2 стадии). ESI-MS m/z вычислено 366,4, найдено 367,3 (M+1)+. Время удерживания 1,68 минут.
1H ЯМР (400 МГц, ДМСО-d6) δ 8,34 (д, J=7,6 Гц, 1H), 7,65 (д, J=13,4 Гц, 1H), 6,57 (с, 1H), 4,94 (т, J=5,4 Гц, 1H), 4,64-4,60 (м, 1H), 4,52-4,42 (м, 2H), 4,16-4,14 (м, 1H), 3,76-3,74 (м, 1H), 3,63-3,53 (м, 2H), 1,42 (с, 3H), 1,38-1,36 (м, 6H) и 1,19 (с, 3H) ppm.
Стадия c: (R)-2-(5-амино-1-((2,2-диметил-1,3-диоксолан-4-ил)метил)-6-фтор-1H-индол-2-ил)-2-метилпропан-1-ол
(R)-2-(1-((2,2-диметил-1,3-диоксолан-4-ил)метил)-6-фтор-5-нитро-1H-индол-2-ил)-2-метилпропан-1-ол (2,5 г, 6,82 ммоль) растворяют в этаноле (70 мл) и реакционную смесь продувают N2. Затем добавляют Pd-C (250 мг, 5% масс.). Реакционную смесь снова продувают азотом и затем перемешивают в атмосфере H2 (атм). После 2,5 часа, согласно ЖХ-МС, наблюдают лишь частичное превращение в продукт. Реакционную смесь фильтруют через целит и концентрируют. Остаток снова подвергают воздействию вышеупомянутых условий. Спустя 2 часа ЖХ-МС указывает на полное превращение в продукт. Реакционную смесь фильтруют через целит. Фильтрат концентрируют, получая продукт в виде черного твердого вещества (1,82 г, 79%). ESI-MS m/z вычислено 336,2, найдено 337,5 (M+1)+. Время удерживания 0,86 минут.
1H ЯМР (400 МГц, ДМСО-d6) δ 7,17 (д, J=12,6 Гц, 1H), 6,76 (д, J=9,0 Гц, 1H), 6,03 (с, 1H), 4,79-4,76 (м, 1H), 4,46 (с, 2H), 4,37-4,31 (м, 3H), 4,06 (дд, J=6,1, 8,3 Гц, 1H), 3,70-3,67 (м, 1H), 3,55-3,52 (м, 2H), 1,41 (с, 3H), 1,32 (с, 6H) и 1,21 (с, 3H) ppm.
Стадия d: (R)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(1-((2,2-диметил-1,3-диоксолан-4-ил)метил)-6-фтор-2-(1-гидрокси-2-метилпропан-2-ил)-1H-индол-5-ил)циклопропанкарбоксамид
ДМФА (3 капли) добавляют к перемешиваемой смеси 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоты (1,87 г, 7,7 ммоль) и тионилхлорида (1,30 мл, 17,9 ммоль). Через 1 час образуется прозрачный раствор. Раствор концентрируют в вакууме и снова концентрируют и затем добавляют толуол (3 мл) и смесь снова концентрируют. Стадию с толуолом повторяют еще раз и остаток подвергают воздействию высокого вакуума на протяжении 10 минут. Затем хлорангидрид кислоты растворяют в дихлорметане (10 мл) и добавляют к смеси (R)-2-(5-амино-1-((2,2-диметил-1,3-диоксолан-4-ил)метил)-6-фтор-1H-индол-2-ил)-2-метилпропан-1-ола (1,8 г, 5,4 ммоль) и триэтиламина (2,24 мл, 16,1 ммоль) в дихлорметане (45 мл). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь промывают 1N раствором HCl, насыщенным раствором NaHCO3 и насыщенным раствором соли, сушат над MgSO4 и концентрируют, получая продукт в виде черного пенистого твердого вещества (3 г, 100%). ESI-MS m/z вычислено 560,6, найдено 561,7 (M+1)+. Время удерживания 2,05 минут.
1H ЯМР (400 МГц, ДМСО-d6) δ 8,31 (с, 1H), 7,53 (с, 1H), 7,42-7,40 (м, 2H), 7,34-7,30 (м, 3H), 6,24 (с, 1H), 4,51-4,48 (м, 1H), 4,39-4,34 (м, 2H), 4,08 (дд, J=6,0, 8,3 Гц, 1H), 3,69 (т, J=7,6 Гц, 1H), 3,58-3,51 (м, 2H), 1,48-1,45 (м, 2H), 1,39 (с, 3H), 1,34-1,33 (м, 6H), 1,18 (с, 3H) и 1,14-1,12 (м, 2H) ppm.
Стадия e: (R)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(1-(2,3-дигидроксипропил)-6-фтор-2-(1-гидрокси-2-метилпропан-2-ил)-1H-индол-5-ил)циклопропанкарбоксамид
(R)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(1-((2,2-диметил-1,3-диоксолан-4-ил)метил)-6-фтор-2-(1-гидрокси-2-метилпропан-2-ил)-1H-индол-5-ил)циклопропанкарбоксамид (3,0 г, 5,4 ммоль) растворяют в метаноле (52 мл). Добавляют воду (5,2 мл), а затем п-TsOH.H2O (204 мг, 1,1 ммоль). Реакционную смесь нагревают при 80°C в течение 45 минут. Раствор концентрируют и затем распределяют между этилацетатом и насыщенным раствором NaHCO3. Этилацетатный слой сушат над MgSO4 и концентрируют. Остаток очищают колоночной хроматографией (смесь 50-100% этилацетата - гексаны), получая продукт в виде пенистого твердого вещества, окрашенного в кремовый цвет. (1,3 г, 47%, ee >98% согласно SFC [сверхкритическая флюидная хроматография]). ESI-MS m/z вычислено 520,5, найдено 521,7 (M+1)+. Время удерживания 1,69 минут.
1H ЯМР (400 МГц, ДМСО-d6) δ 8,31 (с, 1H), 7,53 (с, 1H), 7,42-7,38 (м, 2H), 7,33-7,30 (м, 2H), 6,22 (с, 1H), 5,01 (д, J=5,2 Гц, 1H), 4,90 (т, J=5,5 Гц, 1H), 4,75 (т, J=5,8 Гц, 1H), 4,40 (дд, J=2,6, 15,1 Гц, 1H), 4,10 (дд, J=8,7, 15,1 Гц, 1H), 3,90 (с, 1H), 3,65-3,54 (м, 2H), 3,48-3,33 (м, 2H), 1,48-1,45 (м, 2H), 1,35 (с, 3H), 1,32 (с, 3H) и 1,14-1,11 (м, 2H) ppm.
Пример 18:(S)-1-(2,2-Дифторбензо[d][1,3]диоксол-5-ил)-N-(1-(2,3-дигидроксипропил)-6-фтор-2-(1-гидрокси-2-метилпропан-2-ил)-1H-индол-5-ил)циклопропанкарбоксамид
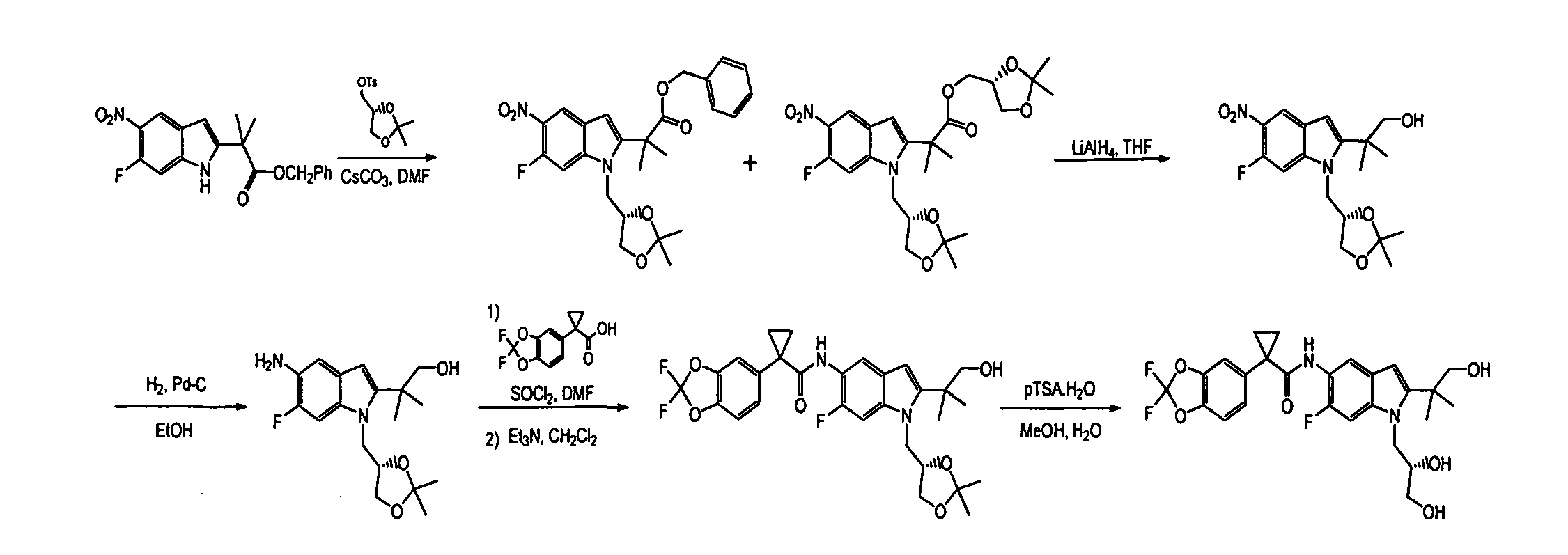
Карбонат цезия (2,74 г, 8,4 ммоль) добавляют к смеси бензил 2-(6-фтор-5-нитро-1H-индол-2-ил)-2-метилпропаноата (1,0 г, 2,8 ммоль) и (S)-(2,2-диметил-1,3-диоксолан-4-ил)метил 4-метилбензолсульфоната (3,21 г, 11,2 ммоль) в ДМФА (5,6 мл). Реакционную смесь перемешивают при 80°C в течение 64 часов в атмосфере азота. Затем смесь распределяют между этилацетатом и водой. Водный слой экстрагируют этилацетатом. Объединенные этилацетатные слои промывают насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют. Неочищенный продукт, вязкое коричневое масло, которое содержит оба из продуктов, представленных выше, используют непосредственно на следующей стадии без дополнительной очистки. (S)-Бензил 2-(1-((2,2- диметил-1,3-диоксолан-4-ил)метил)-6-фтор-5-нитро-1H-индол-2-ил)-2-метилпропаноат, ESI-MS m/z вычислено 470,2, найдено 471,5 (M+1)+. Время удерживания 2,22 минут. ((R)-2,2-Диметил-1,3-диоксолан-4-ил)метил 2-(1-(((S)-2,2-диметил-1,3-диоксолан-4-ил)метил)-6-фтор-5-нитро-1H-индол-2-ил)-2-метилпропаноат, ESI-MS m/z вычислено 494,5, найдено 495,5 (M+1)+. Время удерживания 2,03 минут.
Стадия b: (S)-2-(1-((2,2-Диметил-1,3-диоксолан-4-ил)метил)-6-фтор-5-нитро-1H-индол-2-ил)-2-метилпропан-1-ол
Смесь неочищенной реакционной смеси (S)-бензил 2-(1-((2,2- диметил-1,3-диоксолан-4-ил)метил)-6-фтор-5-нитро-1H-индол-2-ил)-2-метилпропаноата и ((R)-2,2-диметил-1,3-диоксолан-4-ил)метил 2-(1-(((S)-2,2-диметил-1,3-диоксолан-4-ил)метил)-6-фтор-5-нитро-1H-индол-2-ил)-2-метилпропаноата растворяют в ТГФ (15 мл) и охлаждают на бане со смесью лед-вода. По каплям добавляют LiAlH4 (2,8 мл 1M раствора, 2,8 ммоль). После завершения добавления реакционную смесь перемешивают в течение 5 минут. Реакцию гасят добавлением воды (0,5 мл), 15% раствора NaOH (0,5 мл) и затем воды (1,5 мл). Смесь фильтруют через целит и твердое вещество промывают ТГФ и этилацетатом. Фильтрат концентрируют и очищают колоночной хроматографией (смесь 30-60% этилацетата - гексаны), получая продукт в виде коричневого масла (505 мг, 49% за 2 стадии). ESI-MS m/z вычислено 366,4, найдено 367,3 (M+1)+. Время удерживания 1,68 минут.
1H ЯМР (400 МГц, ДМСО-d6) δ 8,34 (д, J=7,6 Гц, 1H), 7,65 (д, J=13,5 Гц, 1H), 6,57 (с, 1H), 4,94 (т, J=5,4 Гц, 1H), 4,64-4,60 (м, 1H), 4,52-4,42 (м, 2H), 4,14 (дд, J=6,2, 8,4 Гц, 1H), 3,74 (дд, J=7,0, 8,3 Гц, 1H), 3,63-3,53 (м, 2H), 1,42 (с, 3H), 1,37 (м, 6H) и 1,19 (с, 3H) ppm.
Стадия c: (S)-2-(5-амино-1-((2,2-диметил-1,3-диоксолан-4-ил)метил)-6-фтор-1H-индол-2-ил)-2-метилпропан-1-ол
(S)-2-(1-((2,2-диметил-1,3-диоксолан-4-ил)метил)-6-фтор-5-нитро-1H-индол-2-ил)-2-метилпропан-1-ол (500 мг, 1,4 ммоль) растворяют в этаноле (15 мл) и реакционную смесь продувают N2. Затем добавляют Pd-C (50 мг, 5% масс.). Реакционную смесь продувают снова азотом и затем перемешивают в атмосфере H2 (атм.). Через 1 час согласно ЖХ-МС наблюдают только частичное превращение в продукт. Реакционную смесь фильтруют через целит и концентрируют. Остаток вновь подвергают воздействию условий, упомянутых выше. Через 1 час ЖХ-МС указывает на полное превращение в продукт. Реакционную смесь фильтруют через целит. Фильтрат концентрируют, получая продукт в виде черного твердого вещества (420 мг, 91%). ESI-MS m/z вычислено 336,2, найдено 337,5 (M+1)+. Время удерживания 0,90 минут.
1H ЯМР (400 МГц, ДМСО-d6) δ 7,17 (д, J=12,6 Гц, 1H), 6,76 (д, J=9,0 Гц, 1H), 6,03 (с, 1H), 4,78 (ушир.с, 1H), 4,46 (с, 2H), 4,41-4,27 (м, 3H), 4,06 (дд, J=6,1, 8,3 Гц, 1H), 3,70-3,67 (м, 1H), 3,53 (дд, J=10,7, 17,2 Гц, 2H), 1,40 (с, 3H), 1,32 (с, 6H) и 1,21 (с, 3H) ppm.
Стадия d: (S)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(1-((2,2-диметил-1,3-диокслоан-4-ил)метил)-6-фтор-2-(1-гидрокси-2-метилпропан-2-ил)-1H-индол-5-ил)циклопропанкарбоксамид
ДМФА (3 капли) добавляют к перемешиваемой смеси 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоты (187 мг, 0,8 ммоль) и тионилхлорида (0,13 мл, 1,8 ммоль). Через 30 минут образуется прозрачный раствор. Небольшое количество смешивают с пиперидином с целью проверки того, произошло ли образование хлорангидрида кислоты. Раствор концентрируют на роторном испарителе и затем добавляют толуол (1 мл) и смесь концентрируют снова. Стадию с толуолом повторяют еще раз и остаток подвергают обработке в высоком вакууме в течение 10 минут. Затем хлорангидрид кислоты растворяют в дихлорметане (2 мл и добавляют к смеси (S)-2-(5-амино-1-((2,2-диметил-1,3-диоксолан-4-ил)метил)-6-фтор-1H-индол-2-ил)-2-метилпропан-1-ола (200 мг, 0,6 ммоль) и триэтиламина (0,25 мл, 1,8 ммоль) в дихлорметане (4 мл). Реакционную смесь перемешивают при комнатной температуре в течение 45 минут. Реакционную смесь промывают 1N раствором HCl, насыщенным раствором NaHCO3 и насыщенным раствором соли, сушат над MgSO4 и концентрируют, получая продукт в виде черного пенистого твердого вещества (320 мг, 96%). ESI-MS m/z вычислено 560,6, найдено 561,5 (M+1)+. Время удерживания 2,05 минут.
1HЯМР (400 МГц, ДМСО-d6) δ 8,31 (с, 1H), 7,53 (с, 1H), 7,42-7,40 (м, 2H), 7,34-7,30 (м, 3H), 6,24 (с, 1H), 4,84 (т, J=5,5 Гц, 1H), 4,51-4,46 (м, 1H), 4,41-4,32 (м, 2H), 4,08 (дд, J=6,0, 8,3 Гц, 1H), 3,71-3,67 (м, 1H), 3,58-3,50 (м, 2H), 1,48-1,45 (м, 2H), 1,40 (с, 3H), 1,34-1,33 (м, 6H), 1,18 (с, 3H) и 1,14-1,12 (м, 2H) ppm.
Стадия e: (S)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(1-(2,3-дигидроксипропил)-6-фтор-2-(1-гидрокси-2-метилпропан-2-ил)-1H-индол-5-ил)циклопропанкарбоксамид
(S)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(1-((2,2-диметил-1,3-диоксолан-4-ил)метил)-6-фтор-2-(1-гидрокси-2-метилпропан-2-ил)-1H-индол-5-ил)циклопропанкарбоксамид (290 г, 0,5 ммоль) растворяют в метаноле (5 мл). Добавляют воду (0,5 мл), а затем п-TsOH.H2O (20 мг, 0,1 ммоль). Реакционную смесь нагревают при 80°C в течение 45 минут. Затем раствор распределяют между этилацетатом и насыщенным раствором NaHCO3. Этилацетатный слой сушат над MgSO4 и концентрируют. Остаток очищают колоночной хроматографией (50-100% этилацетата - гексаны), получая продукт в виде пенистого твердого вещества, окрашенного в кремовый цвет. (146 мг, 54%, ee >97% согласно SFC). ESI-MS m/z вычислено 520,5, найдено 521,5 (M+1)+. Время удерживания 1,67 минут.
1HЯМР (400 МГц, ДМСО-d6) δ 8,31 (с, 1H), 7,53 (д, J=1,1 Гц, 1H), 7,42-7,37 (м, 2H), 7,33-7,30 (м, 2H), 6,22 (с, 1H), 5,01 (д, J=5,0 Гц, 1H), 4,91 (т, J=5,5 Гц, 1H), 4,75 (т, J=5,8 Гц, 1H), 4,42-4,38 (м, 1H), 4,10 (дд, J=8,8, 15,1 Гц, 1H), 3,90 (с, 1H), 3,64-3,54 (м, 2H), 3,48-3,33 (м, 2H), 1,48-1,45 (м, 2H), 1,35 (с, 3H), 1,32 (с, 3H) и 1,14-1,11 (м, 2H) ppm.
Пример 19: (R)-1-(бензо[d][1,3]диоксол-5-ил)-N-(2-трет-бутил-1-(2,3-дигидроксипропил)-6-фтор-1H-индол-5-ил)циклопропанкарбоксамид
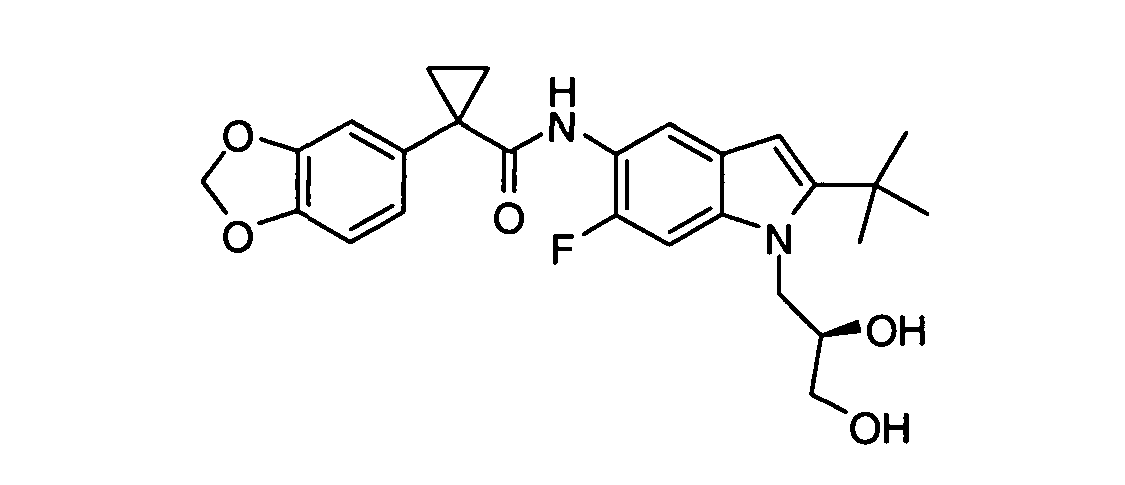
(R)-1-(бензо[d][1,3]диоксол-5-ил)-N-(2-трет-бутил-1-(2,3-дигидроксипропил)-6-фтор-1H-индол-5-ил)циклопропанкарбоксамид получают, используя экспериментальную методику, аналогичную примеру 72, из 1-(бензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоты и 2-трет-бутил-6-фтор-5-нитро-1H-индола.
Пример 20: (S)-1-(бензо[d][1,3]диоксол-5-ил)-N-(2-трет-бутил-1-(2,3-дигидроксипропил)-6-фтор-1H-индол-5-ил)циклопропанкарбоксамид
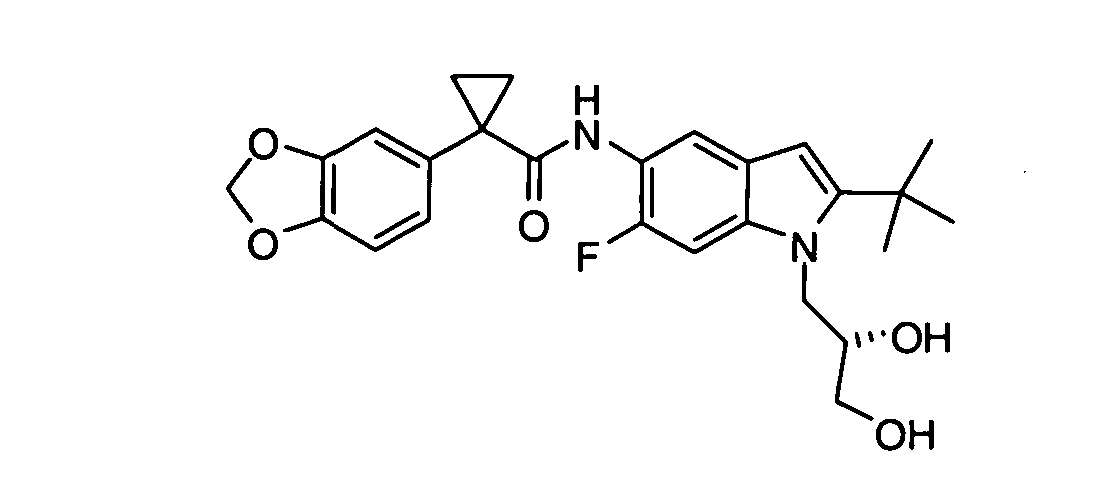
(S)-1-(бензо[d][1,3]диоксол-5-ил)-N-(2-трет-бутил-1-(2,3-дигидроксипропил)-6-фтор-1H-индол-5-ил)циклопропанкарбоксамид получают, используя экспериментальную методику, аналогичную примеру 72, из 1-(бензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоты и 2-трет-бутил-6-фтор-5-нитро-1H-индола.
Специалист средней квалификации в химических областях может использовать примеры и схемы наряду с известными синтетическими методологиями для синтеза соединений по данному изобретению, включая соединения, представленные ниже в Таблице 3.
Пример 21: Испытания с целью обнаружения и измерения корригирующих свойств заявляемых соединений в отношении ΔF508-CFTR
Оптические методы измерения мембранного потенциала для оценки модулирующих свойств соединений в отношении ΔF508-CFTR.
Анализ использует чувствительные к напряжению флуоресцентные красители для измерения изменений в (транс)мембранном потенциале, используя планшет-ридер с детектированием с помощью флуоресцентной метки (например, FLIPR HI, Molecular Devices, Inc.) в качестве устройства индикации увеличения функциональности ΔF508-CFTR в клетках NIH 13T3. Движущей силой ответной реакции выступает создание градиента хлоридного иона в связи с активацией канала посредством стадии добавления одной жидкости, после того как клетки предварительно были подвергнуты обработке соединениями и затем нагружены красителем, чувствительным к напряжению.
Идентификация корригирующих соединений
Для идентификации небольших молекул, которые корректируют дефект в направленной миграции, связанный с ΔF508-CFTR; был разработан формат анализа HTS с одним добавлением. Аналитические планшеты, содержащие клетки, инкубируют в течение ~2-4 часов в инкубаторе тканевой культуры при 37°C, 5% CO2, влажности 90%. После адгезии клеток к дну лунок аналитических планшетов клетки готовы для воздействия на них соединения.
Клетки инкубируют с бессывороточной среде в течение 16-24 часов в культуральном инкубаторе при 37°C, 5% СО2, влажности 90% в присутствии или в отсутствие (отрицательный контроль) испытуемого соединения. Затем клетки промывают 3× раствором Кребса-Рингера и нагружают перераспределяющимся красителем, чувствительным к напряжению. Для активации ΔF508-CFTR в каждую лунку добавляют 10 мкМ форсколина и средство, потенциирующее CFTR, генистеин (20 мкМ), наряду со средой, не содержащей Cl-. Добавление среды, не содержащей Cl-, стимулирует отток Cl-в ответ на активацию ΔF508-CFTR, и полученную деполяризацию мембраны контролируют оптическим методом, используя красители, чувствительные к напряжению.
Идентификация потенциирующих соединений
Для идентификации средств, потенциирующих ΔF508-CFTR, был разработан формат анализа HTS с двойным добавлением. Этот HTS анализ использует флуоресцентные красители, чувствительные к напряжению, для измерения изменений в мембранном потенциале на FLIPR III в качестве устройства индикации увеличения стробирования (проводимости) в AF508 CFTR в температурно-скорректированных ΔF508-CFTR клеток NIH 3T3. Движущей силой для ответной реакции является возникновение градиента иона Cl- в связи с активацией канала форсколином на стадии добавления одной жидкости, используя планшет-ридер с детектированием по флуресцентной метке, такой как FLIPR III, после того как клетки предварительно были подвергнуты обработке потенциирующими соединениями (или контроль с обработкой ДМСО-наполнителем) и затем нагружены перераспределяющимся красителем.
Растворы:
Проводящий раствор #1: (в мМ) NaCl 160, KC1 4,5, CaCl2 2, MgCl2 1, HEPES 10, pH 7,4, доведенный с помощью NaOH.
Не содержащий хлорида проводящий раствор: Хлоридные соли в проводящем растворе #1 замещены глюконатными солями.
Клеточная культура
Фибробласты мыши линии NIH3T3, стабильно экспрессирующие ΔF508-CFTR, используют для оптических измерений мембранного потенциала. Клетки выдерживают при 37°C в 5% CO2 и влажности 90% в модифицированной по способу Дульбекко среде Игла, дополненной 2 мМ глутамина, 10% фетальной бычьей сыворотки, 1 × NEAA, β-ME, 1 × пенициллин/стрептомицин и 25 мМ HEPES в 175 см2культуральных флаконах. В случае всех анализов оптическим методом клетки высевают при плотности ~20000/лунка в 384-луночных покрытых матригелем планшетах и культивируют в течение 2 часов при 37°C до культивирования их при 27°C в течение 24 часов для анализа на выявление потенциирующего действия. В случае анализа на выявление корригирующего действия клетки культивируют при 27°C или 37°C с или без соединений в течение 16-24 часов.
Электрофизиологические методы анализа для оценки моделирующих свойств соединений в отношении ΔF508-CFTR
1. Анализ в камере Уссинга
Эксперименты в камере Уссинга проводят на поляризованных эпителиальных клетках дыхательных путей, экспрессирующих ΔF508-CFTR для получения дополнительных характеристик модуляторов ΔF508-CFTR, идентифицированных в анализах оптическим методом. Эпителии дыхательных путей, не пораженных или пораженных CF, изолируют из бронхиальной ткани, культивируют, как описано ранее (Galietta, L.J.V., Lantero, S., Gazzolo, A., Sacco, O., Romano, L., Rossi, G.A., & Zegarra-Moran, O. (1998} In Vitro Cell. Dev. Biol. 34, 478-481), и помещают на Costar® Snapwell™ фильтрах, которые предварительно покрывают NIH3T3-кондиционированной средой. Через четыре дня апикальную среду удаляют и клетки выращивают на поверхности раздела воздух-жидкость в течение >14 дней до использования. Это приводит к образованию монослоя полностью дифференцированных цилиндрических клеток, которые являются реснитчатыми, свойства которых характерны для эпителия дыхательных путей. Не пораженные CF HBE изолируют у некурящих, которые не имеют никакого известного заболевания легких. CF-HBE изолируют у пациентов, гомозиготных в отношении ΔF508-CFTR.
HBE, выращенные на вставках клеточной культуры Costar® Snapwell™, монтируют в камере Уссинга (Physiologic Instruments, Inc., San Diego, CA) и измеряют трансэпителиальное сопротивление и ток короткого замыкания в присутствии градиента Cl- (Isc),от базолатерального до апикального, используя систему фиксации потенциала (Department of Bioengineering, University of Iowa, IA). Вкратце, HBE исследуют в условиях записи в режиме фиксации потенциала (Vh0ld = 0 мВ) при 37°C. Базолатеральный раствор содержит (в мМ) 145 NaCl, 0,83 K2HPO4, 3,3 KH2PO4, 1,2 MgCl2, 1,2 CaCl2, 10 глюкозы, 10 HEPES (pH, доведенный до 7,35 с помощью NaOH) и апикальный раствор содержит (в мМ) 145 Na глюконата, 1,2 MgCl2, 1,2 CaCl2, 10 глюкозы, 10 HEPES (pH доведенный до 7,35 с помощью NaOH).
Идентификация корригирующих соединений
Типичный протокол использует градиент концентрации Cl, от базолатеральной до апикальной мембраны. Для установления этого градиента, нормальный раствор Рингера используют на базолатеральной мембране, в то время как апикальный NaCl заменяют эквимолярным глюконатом натрия (титрованным до pH 7,4 с помощью NaOH), получая большой градиент концентрации Cl- через эпителий. Все эксперименты осуществляют с интактными монослоями. Для полной активации ΔF508-CFTR, форсколин (10 мкМ), ингибитор PDE, IBMX (100 мкМ) и средство, потенциирующее CFTR, генистеин (50 мкМ) добавляют с апикальной стороны.
Как наблюдалось в других типах клеток, инкубация при низких температурах клеток FRT и человеческих бронхиальных эпителиальных клеток, изолированных у страдающих CF пациентов (CF-HBE), экспрессирующих ΔF508-CFTR, увеличивает функциональную плотность CFTR в плазматической мембране. Для определения активности корригирующих соединений клетки инкубируют с испытуемым соединением в течение 24-48 часов при 37°C и затем промывают 3× перед проведением записи. цАМФ- и генистеин-опосредованный Isc в клетках, обработанных соединением, нормализуют к 37°C контролям и выражают в виде процентной активности от активности CFTR в wt-HBE. Предварительная инкубация с корригирующим соединением значимо увеличивает цАМФ- и генистеин-опосредованный ISC по сравнению с 37°C контролями.
Идентификация потенциирующих соединений
Типичный протокол использует градиент концентрации Cl-, от базолатеральной до апикальной мембраны. Для установления этого градиента нормальный раствор Рингера используют на базолатеральной мембране, в то время как апикальный NaCl заменяют эквимолярным глюконатом натрия (титрованным до pH 7,4 с помощью NaOH), получая большой градиент концентрации Cl- через эпителий. Форсколин (10 мкМ) и все испытуемые соединения добавляют с апикальной стороны вставок клеточной культуры. Эффективность предполагаемых потенциирующих ΔF508-CFTR средств сравнивают с эффективностью известного потенциирующего средства, генистеином.
2. Записи, получаемые методом пэтч-кламп
Полный ток Cl- в ΔF508-NIH3T3 клетках контролируют, используя запись методом пэтч-кламп в конфигурации перфорированного пэтча, описанную ранее (Rae, J., Cooper, K., Gates, P., & Watsky, M. (1991) J. Neurosci. Methods 37, 15-26). Записи методом пэтч-кламп в режиме фиксации потенциала осуществляют при 22°C, используя пэтч-кламп усилитель Axopatch 200B (Axon Instruments Inc., Foster City, CA). Пипеточный раствор содержит (в мМ) 150 N-метил-D-глюкамина (NMDG)-Cl, 2 MgCl2, 2 CaCl2, 10 EGTA, 10 HEPES и 240 мкг/мл амфотерицина-B (pH, доведенный до 7,35 с помощью HC1). Внеклеточная среда содержит (в мМ) 150 NMDG-Cl, 2 MgCl2, 2 CaCl2, 10 HEPES (pH, доведенный до рН 7,35 с помощью HC1). Генерация импульсов, сбор данных и анализ осуществляют, используя персональный компьютер (PC), снабженный интерфейсом Digidata 1320 A/D в связи с Clampex 8 (Axon Instruments Inc.). Для активации ΔF508-CFTR, 10 мкМ форсколина и 20 мкМ генистеина добавляют в ванну и каждые 30 сек контролируют вольт-амперную характеристику.
Идентификация корригирующих соединений
Для определения активности корригирующих соединений в отношении увеличения плотности функционального ΔF508-CFTR в плазматической мембране, заявители используют вышеописанные техники записи в конфигурации перфорированного пэтча, измеряя плотность электрического тока после 24-часовой обработки корригирующими соединениями. Для полной активации ΔF508-CFTR к клеткам добавляют 10 мкМ форсколина и 20 мкМ генистеина. В условиях записи, используемых заявителями, плотность электрического тока после 24-часовой инкубации при 27°C оказалась выше плотности электрического тока, наблюдаемой после 24-часовой инкубации при 37°C. Эти результаты соответствуют известным действиям низкотемпературной инкубации на плотность ΔF508-CFTR в плазматической мембране. Для определения влияния корригирующих соединений на плотность тока CFTR клетки инкубируют с 10 мкМ испытуемого соединения в течение 24 часов при 37°C и получаемую плотность тока сравнивают с 27°C- и 37°C-контролями (% активности). До проведения записи клетки промывают 3× внеклеточной регистрирующей средой для удаления какого-либо оставшегося испытуемого соединения. Предварительная инкубация с 10 мкМ корригирующих соединений значимо увеличивает цАМФ- и генистеин-зависимый ток по сравнению с 37°C-контролями.
Идентификация потенциирующих соединений
Кроме того, используя техники записи методом пэтч-кламп в конфигурации перфорированного пэтча, исследуют способность средств, потенциирующих ΔF508-CFTR, увеличивать макроскопический ток Cl- ΔF508-CFTR (IΔF508) в клетках NIH3T3, стабильно экспрессирующих ΔF508-CFTR. Потенциирующие средства, идентифицированные при анализах оптическим методом, вызывают дозазависимое увеличение IΔF508 с аналогичной активностью и эффективностью, наблюдаемыми в анализах оптическим методом. Во всех исследуемых клетках обратный потенциал до и во время применения потенциирующего средства составлял около -30 мВ, который представляет рассчитанный ECl(-28 мВ).
Клеточная культура
Фибробласты мыши линии NIH3T3, стабильно экспрессирующие ΔF508-CFTR, используют для записей методом пэтч-кламп в конфигурации цельной клетки. Клетки выдерживают при 37°C в 5% CO2 и влажности 90% в модифицированной по способу Дульбекко среде Игла, дополненной 2 мМ глутамина, 10% фетальной бычьей сыворотки, 1 × NEAA, P-ME, 1 × пенициллин/стрептомицин и 25 мМ HEPES в 175 см2 культуральных флаконах. Для записей методом пэтч-кламп в конфигурации цельной клетки 2500-5000 клеток высевают на покрытых поли-L-лизином покровных стеклах и культивируют в течение 24-48 часов при 27°C до их использования для испытания активности потенциирующих средств; и инкубируют с или без корригирующего соединения при 37°C для измерения активности корригирующих средств.
3. Записи одиночного канала
Активность стробирования wt-CFTR и температурно-скорректированного ΔF508-CFTR, экспрессированного в клетках NIH3T3, наблюдают, используя записи, получаемые методом пэтч-кламп в конфигурации inside-out [наружная сторона иссекаемого кусочка мембраны внутри пипетки], как описано ранее (Dalemans, W., Barbry, P., Champigny, G., Jallat, S., Dott, K., Dreyer, D., Crystal, R.G., Pavirani, A., Lecocq, J-P., Lazdunski, M. (1991) Nature 354, 526-528), используя Axopatch 200B пэтч-кламп усилитель (Axon Instruments Inc.). Пипетка содержит (в мМ): 150 NMDG, 150 аспарагиновой кислоты, 5 CaCl2, 2 MgCl2, 10 HEPES (pH, доведенный до 7,35 с помощью Трис-основания). Ванна содержит (в мМ): 150 NMDG-Cl, 2 MgCl2, 5 EGTA, 10 TES и 14 Трис-основания (pH, доведнный до 7,35 с помощью HCl). После иссечения как wt-, так и ΔF508-CFTR активируют, добавляя 1 мМ Mg-АТФ, 75 нМ каталитической субъединицы цАМФ-зависимой протеинкиназы (PKA; Promega Corp. Madison, WI) и 10 мМ NaF для ингибирования протеинфосфотаз, которые предотвращают снижение тока. Потенциал пипетки поддерживают при 80 мВ. Активность канала анализируют из мембранных фрагментов-пэтчей, содержащих ≤2 активных каналов. Максимальное число одновременных открытий определяет число активных каналов во время хода эксперимента. Для определения амплитуды тока единичного канала, данные, записанные со 120 сек, активности ΔF508-CFTR фильтруют в режиме "off-line" при 100 Гц и затем используют для построения растровых амплитудных гистограмм, которые приводят в соответствие с функциями мультигауссиана, используя программное обеспечение Bio-Patch Analysis (Bio-Logic Comp. France). Общий микроскопический ток и вероятность открытого состояния (P0) определяют, начиная со 120 сек активности канала. P0 определяют, используя программу обеспечения Bio-Patch или из соотношения P0=I/i(N), где I - средний ток, i - амплитуда тока единичного канала и N - число активных каналов в пэтче [фрагменте мембраны].
Клеточная культура
Фибробласты мыши NIH3T3, стабильно экспрессирующие ΔF508-CFTR, используют для записи методом пэтч-кламп, основанном на изолировании специальной пипеткой фрагмента-пэтча клеточной мембраны. Клетки выдерживают при 37°C в условиях 5% CO2 и влажности 90% в модифицированной по способу Дульбекко среде Игла, дополненной 2 мМ глутамина, 10% фетальной бычьей сыворотки, 1 × NEAA, P-ME, 1 × пенициллин/стрептомицин и 25 мМ HEPES в 175 см2 культуральных флаконах. Для записей единичного канала 2500-5000 клеток высевают на покрытых поли-L-лизином покровных стеклах и культивируют в течение 24-48 часов при 27°C перед использованием.
Соединения по данному изобретению, как было обнаружено, демонстрируют корригирующую активность, измеренную в испытании, описанном выше.
Соединения по данному изобретению используют в качестве модуляторов АТФ-связывающих кассетных транспортеров. Используя методики, описанные выше, активности, т.е. EC50, соединений по данному изобретению, как было измерено, составляют от около 3,8 нМ до около 13,5 мкМ. Кроме того, используя способы, описанные выше, эффективности соединений по данному изобретению, как было определено, составляют от около 35% до около 110%.
В таблице 4 используют нижеследующие обозначения:
EC50: "+++" означает <2 мкМ; "++" предполагает значение от 2 мкМ до 5 мкМ; "+" предполагает значение от 5 мкМ до 25 мкМ.
Эффективность в %: "+" означает <25%; "++" предполагает значение между 25% и 100%; "+++" означает >100%.
Другие вариантыосуществления изобретения
Следует иметь в виду, что несмотря на описанное выше изобретение в связи с его подробным описанием, вышеизложенное описание, как подразумевается, носит иллюстративный характер и никоим образом не ограничивает объем данного изобретения, который определяется объемом нижеследующей формулы изобретения. Другие аспекты, преимущества и модификации данного изобретения не выходят за рамки объема нижеприведенной формулы изобретения.
Реферат
Изобретение относится к соединению, которое представляет собой следующую структуру:Соединение используют в способе in vitro повышения количества функцинальных ABC-транспортеров в мембране клетки in vitro, путем контактирования этого соединения с указанной клеткой. 2 н. и 1 з.п. ф-лы, 4 табл., 20 пр.
Формула
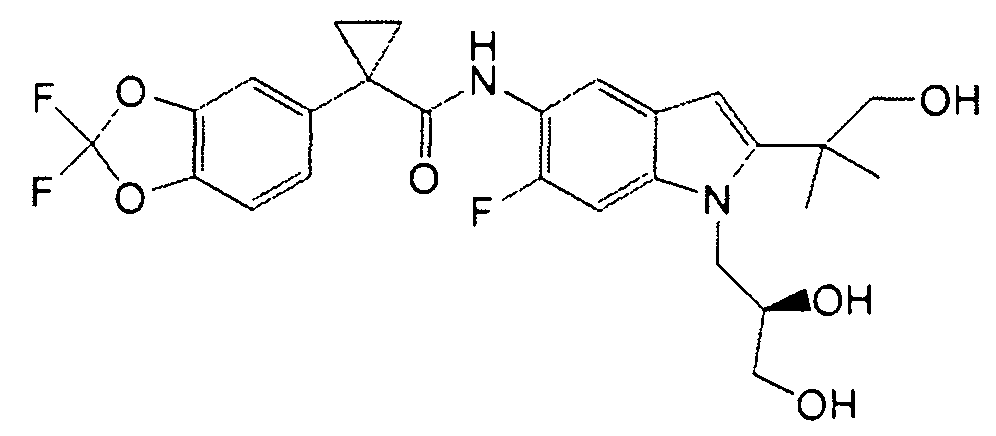
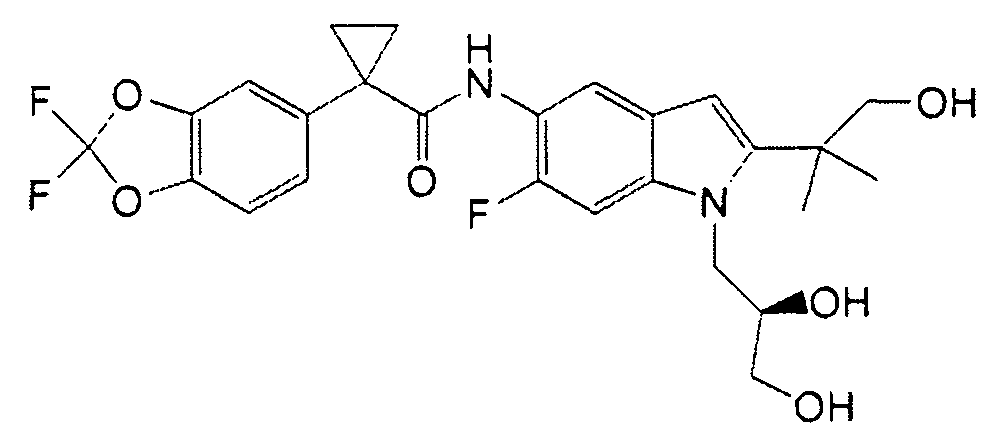
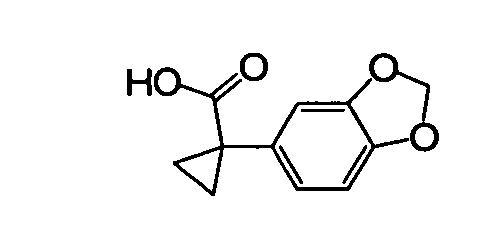
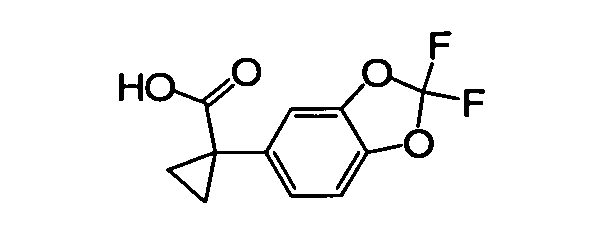

Комментарии