Липидная смесь для детского питания - RU2488283C2
Код документа: RU2488283C2
Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к области детского питания.
Уровень техники
Качество и количество поступающих в раннем детском возрасте питательных веществ оказывает самое непосредственное влияние на последующий рост, конституцию, состояние здоровья и самочувствие и имеет важные долговременные последствия в отношении развития органов и функций, рисков подверженности заболеваниям, а также познавательной способности в более позднем возрасте.
В человеческом грудном молоке (НВМ) около 50% калорий рациона обеспечивается в виде молочного жира. Жир грудного молока (HMF) на около 30-40 г/л состоит из липидов. Из них приблизительно 98% являются триглицеридами, 0,3-1% - фосфолипидами и 0,4% - холестерином [WO 05/051091, WO 06/114791].
(Пищевые) липиды, такие как обнаруживаемые в НВМ, являются незаменимыми в качестве основных структурных элементов для, например, нормального роста и развития клеточных мембран и тканей, а также играют важную роль при обеспечении, например, процессов сигнальной трансдукции и многих биохимических и биосинтетических путей. Многие липиды и особенно триглицериды являются частью каждодневного рациона человека.
Триглицеридные жиры, или триглицериды, являются основным источником энергии для новорожденных младенцев (Hamosh и др., Pediatrics 1985, 75 (дополнительное издание): 146-150). Помимо обеспечения от 40% до 50% суммарной калорийности женского молока или смеси для детского питания, триглицериды являются необходимыми для нормального развития, так как они предоставляют жирные кислоты, требующиеся для развития мозга, являются неотъемлемой частью клеточных мембран и носителем для жирорастворимых витаминов и гормонов в молоке. Кроме того, эти энергоемкие триглицериды могут запасаться в организме в почти неограниченных количествах в отличие от углеводов и белков, способность к накоплению которых является ограниченной.
Триглицеридная композиция HMF уникальна по качественному и количественному составу жирных кислот. HMF отличается общим содержанием пальмитиновой кислоты (С16:0) около 17-25%, из которых около 70% находится в sn-2 положении триглицеридов [WO 05/051091]. Помимо этого, большие количества ненасыщенных жирных кислот, особенно мононенасыщенных жирных кислот, таких как олеиновая кислота (С18:1), которые является очень важными для питания и развития младенцев, могут содержаться в sn-1 и sn-3 положениях.
Что касается растительных жиров, то их положения sn-1 и sn-3 содержат большие количества насыщенных жирных кислот и вследствие этого они не являются подходящими для питания младенцев. Поэтому усовершенствованные рецептуры смесей для питания младенцев включают структурированные жиры, приготавливаемые таким образом, чтобы воспроизводить уникальную структуру и характеристики HMF.
Существенным питательным компонентом НВМ являются фосфолипиды. Хотя фосфолипидная композиция остается неизменной и не зависящей от рациона питания матери, уровень содержания фосфолипидов в НВМ с возрастом младенца изменяется.
Фосфолипиды представлены пятью основными соединениями: сфингомиелином (SM), фосфатидилхолином (PC), фосфатидилэтаноламином (РЕ), фосфатидилсерином (PS) и фосфатидилинозитолом (PI) [Thompkinson DK и др. Comprehensive Reviews In Food Science And Food Safety 6: 79-102 (2007)].
Некоторые фосфолипиды, и особенно извлекаемые из сои, применяются в качестве биологически активных добавок, с употреблением которых связываются различные благоприятные для здоровья эффекты. Эти благоприятные эффекты включает улучшение познавательных функций, улучшение памяти и концентрации, сохранение композиции клеточных мембран и положительный вклад в общее самочувствие. Фосфолипиды и лецитины являются источниками холина, кроме того, они повышают биологическую доступность других питательных веществ и препаратов.
Уровни содержания в НВМ полиненасыщенных жирных кислот (PUFA) колеблются в широких пределах в зависимости от вида жира, употребляемого матерью. При этом по сравнению с жиром коровьего молока в НВМ присутствует довольно широкий спектр жирных кислот и представлено высокое содержание ненасыщенных жирных кислот, в частности, линолевой кислоты. С другой стороны, в рецептуры, основанные на коровьем молоке, добавляются смеси растительных масел с тем, чтобы обеспечить достаточное содержание PUFA, включая линолевую кислоту и другие подобные.
Также важную роль в питании развивающихся младенцев и существенные роли в функционировании всех физиологических систем и циклов человеческого организма играют глицерофосфолипиды, сфингомиелин, холестерин и их производные, даже при том, что в НВМ они обнаруживаются в относительно небольших количествах.
Младенцам, которые не могут вскармливаться грудью, или которые не должны получать НВМ, или тем, для кого НВМ является недоступным, требуются заменители грудного молока. Самыми подходящими альтернативами женского молока являются смеси для питания младенцев. Такие промышленно изготавливаемые рецептуры основываются на коровьем молоке или получаются из растительного источника, такого как соя, и стремятся имитировать композицию и биологические свойства НВМ. В этих известных заменителях делается попытка воспроизвести триглицеридное содержание НВМ.
Раскрытие изобретения
Цель настоящего изобретения состоит в том, чтобы обеспечить улучшенную композицию заменителя женского молока, содержащую необходимые обнаруживаемые в HMF структурные элементы, содержащие триглицериды, фосфолипиды и жирные кислоты, обладающую способностью оказывать полезные эффекты, связанные с умственным и физическим развитием младенца, наряду с полезными эффектами, связанными с развитием и функционированием желудочно-кишечного тракта младенца.
Изобретение, таким образом, обеспечивает композицию, содержащую, по меньшей мере, один триглицерид, по меньшей мере, один фосфолипид и, по меньшей мере, одну длинноцепочечную полиненасыщенную жирную кислоту (LC-PUFA); при этом указанный, по меньшей мере, один триглицерид является соединением формулы I:
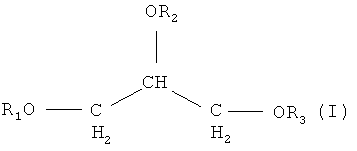
где R1, R2 и R3 могут быть одинаковыми или различными и каждый из них независимо выбирается из Н или ацильной группы, при этом ацильная группа выбирается из остатков насыщенной жирной кислоты, мононенасыщенной жирной кислоты и длинноцепочечной полиненасыщенной жирной кислоты (LC-PUFA);
указанный, по меньшей мере, один фосфолипид является соединением формулы II:
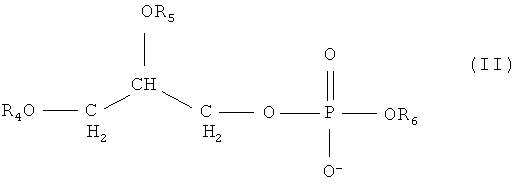
где каждый из R4 и R5 является заместителем, независимо принимающим значения R1, R2, R3, и где
R6 выбирается из холина, инозитола, этаноламина и серина;
и где, по меньшей мере, около 1% LC-PUFA конъюгировано в композиции с указанным, по меньшей мере, одним фосфолипидом.
Изобретение, кроме того, обеспечивает применения композиций изобретения.
Осуществление изобретения
В первом аспекте изобретения обеспечивается композиция, содержащая, по меньшей мере, один триглицерид, по меньшей мере, один фосфолипид и, по меньшей мере, одну длинноцепочечную полиненасыщенную жирную кислоту (LC-PUFA); при этом указанный, по меньшей мере, один триглицерид является соединением формулы I:

где R1, R2 и R3 могут быть одинаковыми или различными и каждый из них независимо выбирается из Н или ацильной группы, при этом ацильная группа выбирается из остатков насыщенной жирной кислоты, мононенасыщенной жирной кислоты и длинноцепочечной полиненасыщенной жирной кислоты (LC-PUFA); при этом указанный, по меньшей мере, один фосфолипид является соединением формулы II:

где каждый из R4 и R5 является заместителем, независимо принимающим значения R1, R2, R3, и где
R6 выбирается из холина, инозитола, этаноламина и серина;
и где, по меньшей мере, около 1% LC-PUFA конъюгировано в композиции с указанным, по меньшей мере, одним фосфолипидом.
Композиция (смесь) изобретения обычно содержит смесь указанных триглицеридов формулы I, указанных фосфолипидов формулы II и LC-PUFA (в свободной форме и в конъюгированной форме). Смесь изобретения обычно содержит два или более триглицеридов формулы I, два или более фосфолипидов формулы II и LC-PUFA, при этом смесь обычно содержит (i) свободные LC-PUFA, (ii) LC-PUFA, конъюгированные с триглицеридами (R1 и/или R2 и/или R3), и (iii) LC-PUFA, конъюгированные с фосфолипидами (R4 и/или R5).
В одном воплощении указанная LC-PUFA является одной или обеими из омега-3 или омега-6 жирных кислот. В одном конкретном воплощении указанная LC-PUFA содержит докозагексаеновую кислоту (DHA) и/или арахидоновую кислоту (АА).
В одном воплощении содержание по массе АА превышает содержание по массе DHA. В следующем воплощении величина соотношения содержаний по массе между АА и DHA составляет по меньшей мере около 1,1. В следующем воплощении соотношение содержаний по массе между АА и DHA составляет по меньшей мере около 1,3. В еще одном воплощении соотношение содержаний по массе между АА и DHA составляет, по меньшей мере, около 1,5. В следующем воплощении соотношение содержаний по массе между АА и DHA составляет, по меньшей мере, около 2. В еще одном воплощении соотношение содержаний по массе между АА и DHA составляет, по меньшей мере, около 3. В другом воплощении соотношение содержаний по массе между АА и DHA составляет, по меньшей мере, около 10.
В следующем воплощении R5 является остатком LC-PUFA. В другом воплощении указанный остаток LC-PUFA является остатком омега-3 или омега-6 жирной кислоты. В одном следующем конкретном воплощении указанная LC-PUFA является DHA или АА.
В еще одном воплощении R4 является остатком LC-PUFA. В другом воплощении указанный остаток LC-PUFA является остатком омега-3 или омега-6 жирной кислоты. В одном следующем конкретном воплощении указанная LC-PUFA является DHA или АА.
В одном конкретном воплощении, по меньшей мере, около 2 масс.% содержащейся в рецептуре LC-PUFA находится в конъюгированном состоянии с, по меньшей мере, одним фосфолипидом. В еще одном конкретном воплощении, по меньшей мере, около 5 масс.% содержащейся в рецептуре LC-PUFA находится в конъюгированном состоянии с, по меньшей мере, одним фосфолипидом. В еще одном следующем конкретном воплощении, по меньшей мере, около 10 масс.% содержащейся в рецептуре LC-PUFA находится в конъюгированном состоянии с, по меньшей мере, одним фосфолипидом. В другом воплощении, по меньшей мере, около 20 масс.% содержащейся в рецептуре LC-PUFA находится в конъюгированном состоянии с, по меньшей мере, одним фосфолипидом. В еще одном воплощении, по меньшей мере, около 50 масс.% содержащейся в рецептуре LC-PUFA находится в конъюгированном состоянии с, по меньшей мере, одним фосфолипидом.
В одном воплощении, по меньшей мере, 1% присоединенной LC-PUFA конъюгировано в положении sn-2 указанного, по меньшей мере, одного фосфолипида. В следующем воплощении, по меньшей мере, около 2% присоединенной LC-PUFA конъюгировано в положении sn-2 указанного, по меньшей мере, одного фосфолипида. В другом воплощении, по меньшей мере, около 33% присоединенной LC-PUFA конъюгировано в положении sn-2 указанного, по меньшей мере, одного фосфолипида. В следующем воплощении, по меньшей мере, около 40% присоединенной LC-PUFA конъюгировано в положении sn-2 указанного, по меньшей мере, одного фосфолипида. В еще одном воплощении, по меньшей мере, около 45% присоединенной LC-PUFA конъюгировано в положении sn-2 указанного, по меньшей мере, одного фосфолипида. В другом воплощении, по меньшей мере, около 50% присоединенной LC-PUFA конъюгировано в положении sn-2 указанного, по меньшей мере, одного фосфолипида. В еще одном следующем воплощении, по меньшей мере, около 60% присоединенной LC-PUFA конъюгировано в положении sn-2 указанного, по меньшей мере, одного фосфолипида. В другом воплощении, по меньшей мере, около 70% присоединенной LC-PUFA конъюгировано в положении sn-2 указанного, по меньшей мере, одного фосфолипида.
В другом воплощении общее количество фосфолипидов составляет в композиции, по меньшей мере, около 0,1%. В еще одном воплощении общее содержание в композиции фосфолипидов составляет, по меньшей мере, около 0,5%. В следующем воплощении общее содержание в композиции фосфолипидов составляет, по меньшей мере, около 1%. В еще одном воплощении общее содержание в композиции фосфолипидов составляет, по меньшей мере, около 2%. В еще одном воплощении общее содержание в композиции фосфолипидов составляет, по меньшей мере, около 5%. В следующем воплощении общее содержание в композиции фосфолипидов составляет, по меньшей мере, около 7%. В одном следующем воплощении общее содержание в композиции фосфолипидов составляет, по меньшей мере, около 10%. В следующем воплощении общее содержание в композиции фосфолипидов составляет, по меньшей мере, около 15%. В следующем воплощении общее содержание в композиции фосфолипидов составляет, по меньшей мере, около 20%. В следующем воплощении общее содержание в композиции фосфолипидов составляет, по меньшей мере, около 35%. В одном следующем воплощении общее содержание в композиции фосфолипидов составляет, по меньшей мере, около 50%.
В следующем воплощении указанный триглицерид и/или указанный фосфолипид являются полученными из, по меньшей мере, одного содержащего лецитин сырьевого материала, выбранного из группы, состоящей из растительных, морских и выращиваемых в водной среде организмов.
В одном аспекте настоящего изобретения обеспечивается фармацевтическая композиция, содержащая композицию настоящего изобретения.
Подходящими способами введения композиций по изобретению являются пероральное, буккальное, подъязычное, с помощью зонда для искусственного кормления, топическое, трансдермальное или парентеральное (включая подкожное, внутримышечное, внутривенное и внутрикожное) введение. В одном конкретном воплощении соединения могут вводиться перорально.
Точная дозировка и режим приема композиции обязательным образом будут зависеть от достигаемого терапевтического или питательного эффекта и могут изменяться в зависимости от конкретной рецептуры, способа введения, а также возраста и состояния конкретного субъекта, которому предполагается осуществить введение композиции.
Настоящее изобретение, таким образом, также предоставляет фармацевтические композиции изобретения в смеси с фармацевтически приемлемыми вспомогательными средствами и, возможно, другими терапевтическими средствами. Вспомогательные средства должны быть «приемлемыми» в том смысле, чтобы быть совместимыми с другими ингредиентами композиции и не быть вредными для их реципиентов.
В одном воплощении фармацевтическая композиция содержит, кроме того, по меньшей мере, один фармацевтически активный компонент.
Композиции изобретения могут готовиться любым известным в области фармацевтики способом. Такие способы включают этап приведения ингредиентов в контакт с каким-либо вспомогательным средством. Вспомогательное средство(-а), которое также называют добавочным ингредиентом(-ами), включает обычные в данной области средства, такие как носители, наполнители, связующие компоненты, растворители, дезинтегрирующие агенты, смазочные материалы, красители, ароматизирующие вещества, антиоксиданты и увлажнители.
Подходящие для перорального приема фармацевтические композиции могут быть представлены в виде дискретно дозируемых единиц, таких как пилюли, таблетки, драже или капсулы, или в виде порошков или гранул, или же в форме раствора или суспензии.
Композиции, подходящие для парентерального введения, включают водные и неводные стерильные инъекционные растворы. Композиции могут быть представлены в контейнерах, содержащих однократные дозы, или в предназначенных для многократного приема, например, в виде закупоренных пузырьков и ампул, и могут храниться в сублимированном (лиофилизированном) состоянии, требующем лишь добавления перед применением стерильного жидкого носителя, например, воды. Для трансдермального введения могут быть предусмотрены, например, гели, пластыри или аэрозоли.
Изобретение, кроме того, обеспечивает коммерческую упаковку для приготовления рецептуры, содержащую: (а) композицию согласно изобретению, которая при введении субъекту, например, улучшает, поддерживает или лечит состояния, связанные с умственным и физическим развитием младенца; (b) возможно, по меньшей мере, одно из физиологически приемлемого белка, углевода, витамина, минерала, аминокислоты, нуклеотида и активной или неактивной добавки; (с) возможно, по меньшей мере, одно из физиологически приемлемого носителя или растворителя для переноса составной части(-ей), обозначенной в (а) и (b); (d) устройство и емкости для смешивания составных частей, обозначенных в (а), (b) и/или (с); и (е) инструкции по применению, такие как, но не ограничиваясь касающимися хранения, приготовления рецептуры для введения, требуемых разбавлений, дозировок, частоты введения и т.п.
Коммерческая упаковка в соответствии с изобретением может наряду с инструкциями по применению также содержать и композицию изобретения в готовой форме. Дозировки обычно определяются в соответствии с возрастом, массой, полом и состоянием субъекта, в соответствии с надлежащей медицинской практикой, известной лечащему врачу и другому медицинскому персоналу.
Для того чтобы получить желательную рецептуру изобретения, композиция изобретения может быть смешана с другими компонентами, такими как, но не ограничиваясь, источником белка, источником углеводов, минеральными веществами, витаминами, нуклеотидами, аминокислотами и, возможно, по меньшей мере одним из носителя, растворителя, добавки или инертного наполнителя, каждый из которых является подходящим для потребления и/или введения млекопитающему и является фармацевтически приемлемым.
В одном аспекте настоящего изобретения обеспечивается питательная композиция, содержащая композицию изобретения.
Питательная композиция для целей настоящего изобретения может быть любой питательной композицией, включая, но не ограничиваясь, заменителем жиров женского молока, смесью для питания младенцев, молочным продуктом, мороженым, печеньем, соевым продуктом, выпечным, хлебобулочным, мучным кондитерским изделием, соусом, супом, пищевым полуфабрикатом, замороженным пищевым продуктом, приправой, кондитерским изделием, маслом и жиром, маргарином, спредом, начинкой, блюдом из зернового продукта, быстрорастворимым продуктом, продуктом для детского питания, продуктом для питания младенцев, батончиком, закусочным продуктом, конфетой и шоколадным продуктом.
В другом аспекте настоящего изобретения обеспечивается нутрицевтическая композиция, содержащая композицию изобретения.
Нутрицевтическая композиция для целей настоящего изобретения может быть любым нутрицевтиком, который может быть любым материалом, который может рассматриваться как пищевой продукт или часть пищевого продукта и обеспечивает медицинскую пользу или пользу для здоровья, включая профилактику и лечение заболеваний. Такие нутрицевтические композиции включают, но не ограничиваются, добавками к продуктам, пищевыми добавками, диетическими добавками, пищевыми продуктами, созданными методами генетической инженерии, такими как, например, овощные или растительные продукты, и пищевыми продуктами, подвергнутыми технологической обработке, такими как зерновые продукты, супы и напитки, стимулирующие функциональные продукты и продукты функционального питания.
В еще одном следующем аспекте изобретения обеспечиваются функциональные продукты питания, содержащие композицию изобретения.
Для целей настоящего изобретения функциональные продукты питания могут быть любыми функциональными продуктами питания, включая, но не ограничиваясь, молочным продуктом, мороженым, печеньем, соевым продуктом, выпечным, хлебобулочным, мучным кондитерским изделием, соусом, супом, пищевым полуфабрикатом, замороженным пищевым продуктом, приправой, кондитерским изделием, маслом и жиром, маргарином, спредом, начинкой, зерновым продуктом, быстрорастворимым продуктом, продуктом для детского питания, продуктом для питания младенцев, батончиком, закусочным продуктом, конфетой и шоколадным продуктом.
В следующем аспекте изобретения обеспечиваются содержащие композицию изобретения продукты для питания младенцев.
Для целей настоящего изобретения подразумевается охват категорией младенцев как человека, так и младенцев любого млекопитающего. Категория младенцев для целей настоящего изобретения охватывает, но не ограничивается любыми младенцами, такими как новорожденные, недоношенные младенцы и младенцы, рожденные в срок, глубоко недоношенные младенцы, младенцы с очень низкой массой тела при рождении (VLBW) или крайне низкой массой тела при рождении (ELBW), в частности, с общей недоразвитостью, например, желудочно-кишечного тракта или любыми другими факторами риска для здоровья, известными специалистам в данной области.
В еще одном аспекте изобретения обеспечивается способ улучшения, стимуляции или поддержания развития у младенца познавательных функций, вкключающий введение указанному младенцу композиции изобретения.
Выражение «улучшение, стимуляция или поддержание» для целей настоящего изобретения предназначается для охвата увеличения, развития, поддержания, совершенствования, сохранения, удержания, сбережения или подкрепления любой желательной связанной с развитием функции у младенца млекопитающего.
Такие связанные с развитием функции включают, но не ограничиваются, развитием у младенца познавательных функций, развитием у младенца мозга и сетчатки глаза, развитием у младенца остроты зрения, ослаблением интенсивности перекисного окисления липидов у младенца, качеством роста младенца, развитием у младенца центральной нервной системы (CNS) и т.д.
Термин «развитие у младенца познавательных функций» для целей настоящего изобретения охватывает, но не ограничивается развитием таких функций и способностей, как интеллект, творческий потенциал (генерирование и открытость по отношению к новым идеям, способность воспринимать новые взаимосвязи), память (кодирование, хранение, извлечение), исполнительные функции (в отношении новизны, планирования и. внедрения, контроля выполнения, активности, торможения несущественной для данной задачи информации), познавательные ресурсы (скорость обработки информации, емкость кратковременной памяти, объем функции внимания), внимание, обучаемость, восприятие, деятельность, планирование, психические образы и способность решать проблемы.
Известный способ оценки когнитивного развития у младенца заключается в оценке индекса умственного развития младенца (MDI) в соответствии со шкалой психического развития Бейли (Bayley, N. The Bayley Scales of Infant Development II. New York: New York Psychological Corp., 1993).
В одном следующем аспекте изобретения обеспечивается способ улучшения, стимуляции или поддержания развития у младенца мозга и сетчатки глаза, включающий введение указанному младенцу композиции изобретения.
Термин «развитие у младенца мозга и сетчатки глаза» для целей настоящего изобретения охватывает, но не ограничивается такими процессами, которые приводят к развитию с течением времени мозга и сетчатки глаза от состояния их образования до зрелой структуры. Результаты развития мозга обуславливают координацию и контроль физической активности и интерпретирование поступающей от органов чувств информации (такой, как, например, зрительная, слуховая, обонятельная и т.д.).
В еще одном аспекте изобретения обеспечивается способ улучшения, стимуляции или поддержания развития у младенца остроты зрения, включающий введение указанному младенцу композиции изобретения.
Термин «развитие у младенца остроты зрения» для целей настоящего изобретения предназначается для охвата способности глаза различать мелкие детали или небольшие расстояния, оцениваемой каким-либо подходящим в данной области способом, включая электроретинографию. «Повышенная острота зрения» относится к любому улучшению способности глаза различать мелкие детали или небольшие расстояния, оцениваемому каким-либо подходящим в данной области способом.
Посредством еще одного из своих аспектов настоящее изобретение обеспечивает способ снижения у младенцев перекисного окисления липидов, вкючающий введение указанному младенцу композиции изобретения.
Термин «снижение перекисного окисления липидов у младенцев» для целей настоящего изобретения предназначается для охвата улучшения, профилактики, замедления окислительной деградации липидов, содержащих любые количества двойных связей углерод - углерод, и предотвращения воспалений.
Следующим аспектом изобретения обеспечивается способ улучшения, стимуляции или поддержания качества роста младенца посредством введения указанному младенцу композиции изобретения.
Термин «качество роста младенца» для целей настоящего изобретения предназначается для охвата увеличения массы тела, изменений длины и окружности головы и других дополнительных показателей физиологического развития, получаемых по контрольным данным роста и с помощью методик исследования состояния здоровья, известных специалистам в данной области.
В еще одном аспекте изобретения обеспечивается способ улучшения, стимуляции или поддержания развития у младенца центральной нервной системы (CNS), включающий введение указанному младенцу композиции изобретения.
Термин «развитие у младенца CNS» для целей настоящего изобретения охватывает, но не ограничивается такими процессами, которые приводят с течением времени к развитию центральной нервной системы от состояния ее образования до зрелой структуры и функционирования.
В еще одном следующем аспекте изобретения обеспечивается способ усиления кишечного всасывания омега-3 и/или омега-6 жирных кислот у здоровых, у имеющих нарушения в состоянии здоровья и у недоношенных детей, включающий введение указанному младенцу композиции изобретения.
Термин «усиление кишечного всасывания омега-3 и/или омега-6 жирных кислот» для целей настоящего изобретения охватывает, но не ограничивается такими процессами, которые приводят к улучшению и увеличению поглощения из кишечного содержимого питательных веществ омега-3 и/или омега-6 жирных кислот.
В другом аспекте изобретения обеспечивается способ улучшения, стимуляции или поддержания у младенца зрелости кишечника, включающий введение указанному младенцу композиции изобретения.
Термин «улучшение, стимуляция или поддержание зрелости кишечника у младенцев» для целей настоящего изобретения предназначается для охвата, например, стимуляции нормального роста и созревания желудочно-кишечного тракта, восстановления или поддержания желудочно-кишечной функции, стимуляции роста ворсинчатого эпителия, стимуляции пролиферации тонкой и толстой кишки у здорового млекопитающего с тем, чтобы, например, сделать возможным увеличение поглощения питательных веществ.
Изобретение, кроме того, касается применения композиции изобретения для приготовления фармацевтической или нутрицевтической композиции, предназначаемых для терапии младенцев.
В одном воплощении композиция изобретения готовится на основе натурального, синтетического или полусинтетического сырья. В следующем конкретном воплощении источником указанного натурального сырья является любой из растительного, животного или микробиологического источника. В еще одном следующем воплощении изготовление указанной липидной композиции включает ферментативный катализ.
В другом воплощении композиция изобретения может синтезироваться посредством экстракции полярным растворителем из источника, представленного морскими, растительными, животными или микробиологическими организмами. Подходящие пути синтеза композиции изобретения описаны в издании под редакцией Bernard F. Szuhaj "Lecithins: Sources Manufacture and uses" (1989), включенном здесь посредством ссылки.
В одном воплощении изобретения фармацевтическая или нутрицевтическая композиция находится в расфасованной согласно дозировке форме.
В одном воплощении композиция предмета изобретения содержит, кроме того, по меньшей мере, один триглицерид формулы I, в котором, по меньшей мере, 30 масс.% общего содержания пальмитиновой кислоты конъюгировано в sn-2 положении.
В другом воплощении композиция по изобретению содержит, кроме того, (смешана с) по меньшей мере, один триглицерид формулы I, имеющий следующий профиль содержания конъюгированных жирных кислот:
жирные кислоты С8:0 - 0-10% общего количества жирных кислот;
жирные кислоты С10:0 - 0-10% общего количества жирных кислот;
жирные кислоты С12:0 - 0-22% общего количества жирных кислот;
жирные кислоты С14:0 - 0-15% общего количества жирных кислот;
15-55% общего количества жирных кислот, приходящегося на жирные кислоты С16:0, из которых, по меньшей мере, 30% конъюгировано в sn-2 положении триглицерида;
жирные кислоты С18:0 - 1-7% общего количества жирных кислот;
жирные кислоты С18:1 - 20-75% общего количества жирных кислот;
жирные кислоты С18:2 - 2-40% общего количества жирных кислот;
жирные кислоты С18:3 - 0-8% общего количества жирных кислот; и другие жирные кислоты, представленные уровнями менее 8% от общего содержания жирных кислот.
Для целей настоящего изобретения термин «ацильная группа» относится к органическому радикалу, обозначаемому как -C(=O)R, где R выбирается из остатка насыщенной, мононенасыщенной и полиненасыщенной жирной кислоты.
Для целей настоящего изобретения термин «жирная кислота» предназначается для охвата карбоновых кислот с неразветвленным алифатическим остатком (цепочкой), обычно имеющих между 4 и 28 атомами углерода, которые являются либо насыщенными, либо ненасыщенными с одной ненасыщенной связью (мононенасыщенные жирные кислоты), или двумя, или большим количеством ненасыщенных связей (полиненасыщенные жирные кислоты). Следует заметить, что когда, по меньшей мере, одна ненасыщенная связь ненасыщенной жирной кислоты является, по меньшей мере, одной двойной связью, указанная, по меньшей мере, одна двойная связь может быть либо в цис-конфигурации, либо в транс-конфигурации.
Неограничивающие примеры насыщенных жирных кислот, которые могут использоваться в настоящем изобретении, включают: масляную кислоту (бутановая кислота, С4:0), капроновую кислоту (гексановая кислота, С6:0), каприловую кислоту (октановая кислота, С8:0), каприновую кислоту (декановая кислота, С10:0), лауриновую кислоту (додекановая кислота, С12:0), миристиновую кислоту (тетрадекановая кислота, С14:0), пальмитиновую кислоту (гексадекановая кислота, С16:0), стеариновую кислоту (октадекановая кислота, С18:0), арахиновую кислоту (эйкозановая кислота, С20:0), бегеновую кислоту (докозановая кислота С22:0).
Неограничивающие примеры моно-ненасыщенных жирных кислот, которые могут использоваться в настоящем изобретении, включают: миристолеиновую кислоту (ω-5, С14:1), пальмитолеиновую кислоту (ω-7, С16:1), олеиновую кислоту (ω-9, С18:1) и эруковую кислоту (ω-9, С22:1).
Термин «длинноцепочечная полиненасыщенная жирная кислота (LC-PUFA)» для целей настоящего изобретения предназначается для охвата жирных кислот с неразветвленной алифатической цепочкой, имеющих, по меньшей мере, 18 атомов углерода и, по меньшей мере, две ненасыщенных связи.
Неограничивающими примерами LC-PUFA являются альфа-линоленовая кислота (ALA, ω-3, С18:3), эйкозапентаеновая кислота (ЕРА, ω-3, С20:5), докозагексаеновая кислота (DHA, ω-3, С22:6), докозапентаеновая кислота (DPA, ω-3, 22:5), линолевая кислота (LA, ω-6, С18:2), арахидоновая кислота (АА, ω-6, С20:4).
Термин «омега-3 жирная кислота» для целей настоящего изобретения предназначается для охвата карбоновых кислот с длинной неразветвленной алифатической цепочкой, которые являются полиненасыщенными и у которых первая двойная связь углерод-углерод находится в со-3 положении (то есть при третьем с конца алифатической цепочки атоме углерода). Неограничивающие примеры омега-3 жирных кислот, которые могут использоваться в композиции изобретения, включают: альфа-линоленовую кислоту (ALA, ω-3, С18:3), эйкозапентаеновую кислоту (ЕРА, ω-3, С20:5), докозагексаеновую кислоту (DHA, ω-3, С22:6) и докозапентаеновую кислоту (DPA, ω-3, 22:5).
Термин «омега-6 жирная кислота» для целей настоящего изобретения предназначается для охвата карбоновых кислот с длинной неразветвленной алифатической цепочкой, которые являются полиненасыщенными и у которых первая двойная связь углерод-углерод находится в ω-6 положении (то есть при шестом с конца алифатической цепочки атоме углерода). Неограничивающие примеры омега-6 жирных кислот, которые могут использоваться в композиции изобретения, включают: линолевую кислоту (LA, ω-6, С18:2) и арахидоновую кислоту (АА, ω-6, С20:4).
Изобретение, кроме того, описано в следующих примерах, которые ни в коем случае не предназначены для ограничения объема изобретения, представленного в формуле изобретения.
Примеры
Пример 1. Приготовление липидных фракций, используемых для приготовления композиций (смесей) изобретения.
Липидная фракция 1: экстракция биомассы с высоким содержанием арахидоновой кислоты.
В 1 литре питательной среды во встряхиваемой колбе емкостью 2 литра была выращена культура микроорганизма Mortierella alpina, штамм АТСС32222. Среда для выращивания основывалась на глюкозе (30 г/л), используемой в качестве источника углерода, и экстракте дрожжей (15 г/л) в качестве источника азота. Помимо этого, были добавлены следующие компоненты: однозамещенный фосфат калия КH2РO4 (7 г/л), двузамещенный фосфат натрия Na2HPO4 (2 г/л), сульфат магния MgSO4·7H2O (1,5 г/л), CaCl2·2H2O (0,1 г/л), FеСl3·6H2О (8 мг/л), ZnSO4·7H2O (1 мг), CuSO4·5H2O (0,1 мг/л), Со(NO3)2·6Н2O (0,1 мг/л), MnSO4·5H2O (0,1 мг/л). После 8 дней ферментации при 28°С биомасса была отфильтрована, промыта дистиллированной водой и высушена в вакуумной печи при 25°С с получением 18 г сухой биомассы.
Липидная фракция 2: обогащение липидной фракции 1
Высушенная биомасса липидной фракции 1 была подвергнута экстрагированию смешиванием со 100 мл смеси гексана и этанола (80:20 по объему) в инкубаторе-встряхивателе при 200 об/мин в течение 2 часов при 40°С. Биомасса была отфильтрована и промыта. Фильтрат испарялся под пониженным давлением с получением 5,1 г липидной фракции.
Липидная фракция 3: очистка фосфолипидов, обогащенных ARA
В качестве исходного материала для получения чистой фосфолипидной фракции по существу использовалось масло, полученное в процессе приготовления липидной фракции 2.10 г масла были растворены в 30 мл абсолютированного этанола и загружены в стеклянную колонку, заполненную 200 г диоксида кремния (Merck 60). Через колонку было пропущено около 1 литра абсолютированного этанола и исходящий раствор непрерывно анализировался методом TLC (тонкослойная хроматография) до тех, пока из сорбента не начинала выходить чистая фракция фосфолипидов. Была выполнена дальнейшая промывка колонки пропусканием около 3 литров 96% этанола (4% воды) с увеличением температуры до 60°С для большего извлечения фосфолипидной фракции.
Эта фракция собиралась отдельно и испарялась под пониженным давлением с получением около 0,3 г чистых фосфолипидов.
Липидная фракция 4: экстракция липидной фракции из биомассы Schizochytrium sp 50 г биомассы морской микроскопической водоросли Schizochytrium sp было подвергнуто экстрагированию смешиванием с 250 мл 96% этанола (содержащего 4% воды) в инкубаторе-встряхивателе при 200 об/мин в течение 2 часов при температуре 40°С. Биомасса была отфильтрована и промыта. Фильтрат испарялся под пониженным давлением с получением 8,7 г масла.
Липидная фракция 5: селективное экстрагирование липидной фракции с высоким содержанием триглицеридов.
20 г биомассы микроскопической водоросли Schizochytrium sp было подвергнуто экстрагированию смешиванием с помощью магнитной мешалки со 100 мл ацетона в течение 2 часов при комнатной температуре. Биомасса была отфильтрована и промыта. Фильтрат испарялся под пониженным давлением с получением 7,7 г масла.
Липидная фракция 6: селективное экстрагирование липидной фракции с высоким содержанием фосфолипидов.
Биомасса, полученная в процессе приготовления липидной фракции 5 экстракцией ацетоном, была подвергнута дополнительной экстракции с помощью 100 мл смешанного растворителя гексан: этанол (80:20 по объему) в инкубаторе-встряхивателе при 200 об/мин в течение 2 часов при температуре 40°С. После фильтрации и испарения фильтрата было получено 0,6 г пастообразного материала.
Липидная фракция 7: очистка фосфолипидов, обогащенных DHA В качестве исходного материала для процесса очистки фосфолипидов, такого, как описан при получении липидной фракции 3, было использовано 10 г пастообразного материала, по существу полученного при приготовлении липидной фракции 6. Из порции в 10 г было получено 0,6 г чистой фракции фосфолипидов.
Липидная фракция 8: промышленное производство липидной фракции, обогащенной фосфолипидами.
1000 кг рыбной кормовой муки, полученной из сельди, было подвергнуто экстрагированию с помощью 4000 литров смеси этанол: вода (80:20 по объему) в течение 2 часов при температуре 40°С в реакторе объемом 5000 литров, оборудованном мешалкой якорного типа. Биомасса была отфильтрована в корзиночной центрифуге диаметром 1,5 м и промыта. Фильтрат был испарен под вакуумом с помощью испарителя периодического действия емкостью 3000 л, оборудованного рубашкой, для подогрева горячей водой и мешалкой пропеллерного типа. Полученный пастообразный материал был повторно растворен в гексане, снова отфильтрован через рукавный фильтр и подвергнут испарению в том же испарителе с получением 46 кг очень вязкой липидной фракции.
Способы для определения содержания липидных фракций:
1. Определение качественного и количественного состава жирных кислот.
Готовились метиловые эфиры жирных кислот щелочным метилированием в присутствии метилата натрия, растворенного в метаноле, и экстрагировались гексаном. Состав жирных кислот анализировался введением метиловых эфиров в газовый хроматограф, оснащенный капиллярной колонкой и пламенно-ионизационным детектором. Параметры газового хроматографа (HP) были настроены следующим образом: - ПЕЧЬ: начальная температура - 110°С, конечная температура - 250°С, продолжительность работы - 41,50 мин;
- ПЕРЕДНЕЕ ВПУСКНОЕ УСТРОЙСТВО: начальная температура - 350°С, давление - 13,83 фунтов на квадратный дюйм, коэффициент деления потока - 24,988:1, скорость разделенного потока - 39,8 мл/мин, суммарный поток - 43,4 мл/мин, тип газа -азот;
- ПЕРЕДНЕЙ ДЕТЕКТОР: температура - 250:С, скорость потока водорода - 40,0 мл/мин;
- Поток воздуха - 400,0 мл/мин.
Определение количественного состава метиловых эфиров было выполнено в сравнении с внутренним стандартом С23:0.
2. Определение качественного и количественного содержания фосфолипидов. Содержание фосфолипидов измерялось методами31Р-ЯМР (ядерный магнитный резонанс на ядрах31Р) или HPTLC (высокоэффективная тонкослойная хроматография).31Р-ЯМР является признанным и широко используемым способом для измерения содержания фосфолипидов (Analytical Biochemistry, том 232, выпуск 1, ноябрь 1995, страницы 1-6; Journal of Lipid Research, том 27, 1986, 386).
Метод HPTLC состоит в нанесении содержащего фосфолипиды образца на пластину с диоксидом кремния и обеспечении подъема по пластине фронта растворителя, представляющего смесь хлороформ: ацетон: метанол: уксусная кислота: вода=11:6,4:5:2,4:1 (по объему). После завершения подъема растворителя пластина высушивается и проявляется смесью подкисленного CuSO4. Количественное определение выполнялось сканированием пластины на длине волны 274 нм в сравнении со смесью с известным содержанием фосфолипидов.
3. Определение качественного и количественного содержания триглицеридов. Определение количественного содержания триглицеридов было выполнено введением образца в газовый хроматограф, оборудованный капиллярной колонкой и пламенно-ионизационным детектором. Газовый хроматограф был оснащен колонкой модели Agilent J&W DB-IHT и настраивался со следующими параметрами:
- ПЕЧЬ: начальная температура 160°С, конечная температура 350°С, продолжительность работы 29,50 мин;
- ПЕРЕДНЕЕ ВПУСКНОЕ УСТРОЙСТВО: начальная температура - 350°С, давление - 13,83 фунтов на квадратный дюйм, коэффициент деления потока - 24,988:1, скорость разделенного потока - 39,8 мл/мин, суммарный поток - 43,4 мл/мин, тип газа -азот;
- ПЕРЕДНЕЙ ДЕТЕКТОР: температура - 350°С, скорость потока водорода - 40,0 мл/мин;
- Поток воздуха - 400,0 мл/мин.
4. Анализ композиции представленных в фосфолипидах жирных кислот.
Композиция этерифицированных в фосфолипиды жирных кислот анализировалась двухстадийным способом. Анализируемые фосфолипиды очищались на пластине тонкослойной хроматографией (TLC) с помощью той же самой смеси растворителей, что и в способе 2, смывались с диоксида кремния с помощью толуола и преобразовывались в метиловые эфиры, следуя методике 1.
5. Анализ локализации жирных кислот в молекуле.
Анализ распределения жирных кислот фосфолипидов по месту их локализации выполнялся с использованием многостадийной методики, начинающейся с селективного гидролиза sn-2 жирной кислоты фосфолипазой А2 (PLA2). Образующаяся 2-лизофосфолипидная фракция очищалась на пластине с диоксидом кремния, преобразовывалась в метиловые эфиры и анализировалась с помощью газового хроматографа согласно описанной выше методике.
Таблица 1 дает подробное представление композиций нескольких липидных препаратов, содержащих триглицериды и фосфолипиды, предназначенные для применения при приготовлении композиций предмета изобретения.
NM=не измерялось
Общий процент содержания LC-PUFA представляет сумму выраженных в массовых процентах содержаний жирных кислот С18:2, С18:35 С20:3, С20:4, С20:5 и С22:6.
Процентная доля LC-PUFA в PL (фосфолипиды) по отношению к общему количеству LC-PUFA вычислялась как (масс.% LC-PUFA в PL) / (масс.% общее содержание LC-PUFA)∗100.
Процентная доля LC-PUFA в sn-2 положении фосфолипидов по отношению к общему количеству LC-PUFA в фосфолипидах вычислялась как (% LC-PUFA в sn-2 от общего количества жирных кислот в sn-2 положении) / (общее количество LC-PUFA в фосфолипидах)∗100.
Процентная доля LC-PUFA в sn-2 положении фосфолипидов по отношению к общему количеству LC-PUFA в фосфолипидах, превышающая 50, основывается не на измеренной, а на расчетной величине.
Композиции (смеси) изобретения, содержащие масла, обогащенные LC-PUFA (таблица 2), готовились смешиванием друг с другом липидных фракций 2-8 (таблица 1).
Смеси изобретения могут далее возможно смешиваться с жировой смесью, такой как, но не ограничиваясь ею, описанная в PCT/IL2008/001311 жировая смесь, обогащенная sn-2 пальмитиновой кислотой (таблица 5).
Компоненты липидных фракций 4 и 6 перед использованием в операции смешивания возможно проводятся через ряд стадий очистки, включая рафинирование гидратацией, отбеливание и дезодорацию.
NC=не вычислялось.
Общий процент содержания LC-PUFA представляет сумму выраженных в массовых процентах содержаний жирных кислот С18:2, С18:3, С20:3, С20:4, С20:5 и С22:6.
Процентная доля LC-PUFA в PL (фосфолипиды) по отношению к общему количеству LC-PUFA вычислялась как (масс.% LC-PUFA в PL) / (масс.% общее содержание LC-PUFA)∗100.
Процентная доля LC-PUFA в sn-2 положении фосфолипидов по отношению к общему количеству LC-PUFA в фосфолипидах вычислялась как (% LC-PUFA в sn-2 от общего количества жирных кислот в sn-2 положении) / (общее количество LC-PUFA в фосфолипидах)∗100.
Соотношение ARA: DHA вычислялось как С20:4 (массовая процентная доля от общего количества жирных кислот) / С22:6 (массовая процентная доля от общего количества жирных кислот).
Пример 2. Смесь для питания младенцев.
Таблица 3 представляет примеры известных жировых композиций смесей для питания младенцев (две первые колонки таблицы 3) и пример жировой композиции смеси для питания младенцев в соответствии с изобретением (третья колонка таблицы 3).
Таблица 4 представляет примеры известных жировых композиций смесей для питания младенцев (две первые колонки таблицы 4) и следующий пример жировой композиции смеси для питания младенцев в соответствии с изобретением (третья колонка таблицы 4). Эта жировая композиция изобретения готовилась, например, смешиванием смеси 5 из таблицы 2 с описанной в PCT/IL2008/001311 жировой смесью, обогащенной sn-2 пальмитиновой кислотой.
Таблица 5 представляет профиль содержания жирных кислот в композициях (смесях) изобретения (таблица 2), смешанных с описанной в PCT/IL2008/001311 жировой смесью, обогащенной sn-2 пальмитиновой кислотой.
Таблица 6 представляет смесь для питания младенцев на основе молока в соответствии с изобретением, а таблица 7 представляет смеси для питания младенцев на основе сои в соответствии с настоящим изобретением.
Рецептуры этих композиций смесей для питания младенцев были разработаны в соответствии с:
1. Koletzko В. и др. Global Standard for the Composition of Infant Formula:
Recommendations of an ESPGHAN Coordinated International Expert Group.Journal of Pediatric Gastroenterology and Nutrition 41 (5):584-599 (2005).
2. Alles M. и др. Current trends in the composition of infant milk formulas. Current Paediatrics 14 (1):51-63 (2004).
3. Mathews A. Comparison of Triglycerides and Phospholipids as Supplemental Sources of Dietary Long-Chain Polyunsaturated Fatty Acids in Piglets. J Nutr. 132:3081-3089 (2002).
Таким образом готовилась смесь для питания младенцев, содержащая белки, углеводы, жиры, минеральные вещества, витамины и т.д., приводящая к получению пищевого продукта, обеспечивающего младенца основными питательными веществами, также обнаруживаемыми в женcком молоке. 1 литр воды, подвергнутой обработке обратным осмосом (RO), был залит в мешалку с высокими сдвиговыми усилиями и нагрет до 70°С. Мешалка включалась на высокой скорости и постепенно добавлялось 480 г лактозы. Скорость мешалки снижалась и добавлялось 250 г жировой смеси (например, жировая смесь, по существу описанная в PCT/IL2008/001311). После чего было добавлено 140 г обезжиренного молока, 90 г концентрата сывороточного белка и 20 г смеси минеральных веществ, витаминов и микроэлементов. К полученной смеси было добавлено 20 г липидной композиции изобретения (таблица 2), обогащенной LC-PUFA. Полученная смесь пропускалась под давлением через гомогенизатор и затем подвергалась распылительной сушке с получением около 1 кг сухого порошка. Так как жировая смесь смеси для питания младенцев далее смешивалась со смесью композиции изобретения, обогащенной LC-PUFA, композиция жирных кислот в смеси для питания младенцев получалась как комбинация композиции жирных кислот жировой смеси и смеси композиции изобретения, обогащенной LC-PUFA.
TG=триглицериды.
PL=фосфолипиды.
ND=не обнаружено.
ND=не обнаружено.
Таблица 5 описывает жировые фракции, содержащие жировые смеси из таблицы 2.
Жиры 1-6 из таблицы 5 получены из смесей 1, 2, 4, 5, 8 и 9 таблицы 2 и, кроме того, содержат, по меньшей мере, один триглицерид формулы I, который имеет следующий профиль конъюгированных жирных кислот:
жирные кислоты С8:0 - 0-10% общего количества жирных кислот;
жирные кислоты С 10:0 - 0-10% общего количества жирных кислот;
жирные кислоты С 12:0 - 0-22% общего количества жирных кислот;
жирные кислоты С14: 0 - 0-15% общего количества жирных кислот;
15-55% общего количества жирных кислот, приходящегося на жирные кислоты С16:0, из которых, по меньшей мере, 30% конъюгировано в sn-2 положении триглицерида;
жирные кислоты С18:0 - 1-7% общего количества жирных кислот;
жирные кислоты С18:1 - 20-75% общего количества жирных кислот;
жирные кислоты С18:2 - 2-40% общего количества жирных кислот;
жирные кислоты С18:3 - 0-8% общего количества жирных кислот;
и другие жирные кислоты, представленные уровнями менее 8% от общего содержания жирных кислот.
NC=не вычислялось.
Управляя уровнями содержания жировой смеси и смеси композиции изобретения, обогащенной LC-PUFA, могут готовиться смеси для питания младенцев, предназначаемые для воспроизведения различных периодов грудного вскармливания.
Пример 3. Действие содержащихся в смеси для питания младенцев конъюгированных с DHA и АА фосфолипидов на развитие познавательных способностей и остроту зрения.
Исследование включало три группы младенцев, получавших три вида смесей для питания младенцев, которые отличались только по их жировому содержанию LC-PUFA (таблица 3). Группа I получала стандартную смесь для питания младенцев без добавок DHA и АА.
Группа II получала смесь для питания младенцев, дополненную стандартной добавкой DHA и АА (то есть такой, в которой DHA и АА конъюгированы только с триглицеридами).
Группа III получала смесь для питания младенцев, дополненную в соответствии с настоящим изобретением, в частности, DHA и АА, конъюгированными с триглицеридами и фосфолипидами (то есть смесью конъюгированных с триглицеридами и фосфолипидами DHA и АА, в которой соотношение конъюгированных триглицеридов и фосфолипидов составляло 1:1).
Оценка когнитивного развития младенцев осуществлялась в соответствии со шкалой Bayley (по существу как описано в публикации Pinelli J и др. Adv Neonatal Care 3(2):76-87 (2003)). Острота зрения младенцев измерялась с помощью испытания для проверки остроты зрения, по существу описанного в публикации Innis SM. J Pediatr. 139(4):532-8 (2001)). Оба испытания были адаптированы к возрасту младенцев. На протяжении 6 месяцев кормления рецептурами испытания выполнялись при начальном обследовании и в ходе исследования приблизительно каждые один-два месяца. Младенцы в третьей группе (получавшие смесь для питания младенцев, содержащую DHA и АА, конъюгированные с триглицеридами и фосфолипидами согласно изобретению) продемонстрировали лучшее когнитивное развитие и остроту зрения по сравнению с младенцами в двух других группах.
Пример 4. Действие содержащихся в рационе питания конъюгированных с фосфолипидами DHA и АА на развитие познавательных способностей в экспериментальной модели на животных.
Жирная кислота (FA) докозагексаеновая кислота (DHA, 22:6n-3) в больших количествах содержится в мембранных фосфолипидах центральной нервной системы и сетчатки. На развитие познавательной функции указывают нейронные проводящие пути, такие как вовлеченные в процессы обучения, запоминания, пространственного обучения и т.д. В этом исследовании была выполнена систематическая оценка психического развития и этапных моментов в развитии когнитивных способностей у детенышей животных. Анализы включали отслеживание физического развития и созревания и оценку неврологических рефлексов.
План исследования.
Животные получали различные диеты и исследовались проявления и характеристики их нервных рефлексов после рождения. План исследования осуществлялся в соответствии с публикацией Kiss и др., Development of Neurological Reflexes and Motor Coordination in Rats Neonatally Treated with Monosodium Glutamate, Neurotoxicity Research, 2005, том 8(3,4). стр.235-244.
Рационы кормления.
Животные получали диеты, по существу описанные в таблице 3 или таблице 4.
Группа I: контрольная диета, обычная пища.
Группа II: синтетический рацион, источник жиров которого обогащен DHA и АА, этерифицированными только в триглицериды (TG).
Группа III: синтетический рацион: источник жиров обогащен DHA и АА, этерифицированными в триглицериды (TG) и фосфолипиды (PL) (например, жировые смеси 1-9 из таблицы 2).
Рост.
До возраста в 3 недели в ежедневном режиме осуществлялась регистрация масса тела, а затем выполнялась еженедельно. Длина тела (от кончика носа до анального отверстия) измерялась еженедельно.
Нервные признаки и рефлексы.
Изучение психо-поведенческого развития начиналось в первый день после рождения и испытания проводились ежедневно до послеродового дня 21. Выполнялись наблюдения созревания физических показателей, таких как раскрытие глаз, прорезывание резцов и разворачивание ушей.
Детеныши проверялись на следующие нервные признаки и рефлексы.
1. Выпрямительный рефлекс: крысы помещались в положение лежа на спине и регистрировалось время в секундах, требовавшееся им для переворота в положение лежа на животе и приведения всех четырех лап в контакт с поверхностью.
2. Отрицательный геотаксис: животные помещались в положение вниз головой на наклонной доске (45°) длиной 30 см. Задние конечности детенышей располагались в середине доски. Отслеживался день, в который они начинали разворачиваться и лезть вверх по доске, достигая передними конечностями ее верхнего края. Со дня проявления отрицательного геотаксиса время в секундах достижения верхнего края доски регистрировалось ежедневно.
3. Сенсорные рефлексы: ватным тампоном слегка касались уха и века и регистрировался первый день появления рефлекторного отдергивания уха и смыкания век.
4. Размещение конечностей: животные помещались в подвешенном состоянии, касаясь тыльной частью передней лапы и задней лапой края скамьи, на которой они висели, замечался первый день, когда они взбирались и устанавливали на скамье лапы.
5. Хватание конечностями: к передним и задним конечностям прикасались тонким стержнем и регистрировался первый день схватывания стержня.
6. Ходьба: животные помещались в центре белого бумажного круга диаметром 13 см и регистрировался день, когда они начинали выходить из круга обеими передними конечностями. Со дня проявления такого действия время выхода из круга в секундах регистрировалось ежедневно.
7. Звуковой испуг: отслеживался первый день проявления реакции вздрагивания на хлопающий звук.
В заключение, результаты показывают, что кормление животных рационом, обогащенным композицией изобретения, усиливает развитие нервной системы.
Пример 5. Действие содержащихся в рационе питания конъюгированных с фосфолипидами DHA и АА на сетчатую оболочку глаза в экспериментальной модели на животных.
Жирная кислота (FA) докозагексаеновая кислота (DHA, 22:6n-3) в больших количествах содержится в мембранных фосфолипидах центральной нервной системы и сетчатки. Сигнальная трансдукция сопряженных с G-белком рецепторов (GPCR) является общим сигнальным мотивом в нейронных проводящих путях, таких как вовлекаемые в процессы обучения, запоминания, распознавания по обонятельным признакам, пространственное обучение и острота зрения.
План исследования соответствовал приведенному в публикации Niu и др., 2004, Reduced G Protein-coupled Signaling Efficiency in Retinal Rod Outer Segments in Response to n-3 Fatty Acid Deficiency, J. Biol. Chem., том 279, выпуск 30, 31098-31104.
План исследования.
Полученные животные находились в состоянии отлучения от грудного вскармливания (возраст 3 недели). Переставшие получать грудное вскармливание самки рандомизированным образом были разделены на группы с различным рационом с тем ограничением, что обе группы имели одинаковую среднюю массу тела; животные распределялись по группам так, чтобы средний вес животных в обеих группах был одинаковым. Самки в обеих группах с различными рационами спаривались, потомство сортировалось, а самки в период лактации содержались на их соответствующих диетах. В возрасте 21 дня потомство было в течение ночи адаптировано к темноте и умерщвлено декапитацией под тусклым красным светом.
Рационы кормления.
Животные получали диеты, по существу описанные в таблице 3 или таблице 4:
Группа I: контрольная диета, обычная пища.
Группа II: синтетический рацион, источник жиров которого обогащен DHA и АА, эстерифицированными только в триглицериды (TG).
Группа III: синтетический рацион с источником жиров, обогащенным DHA и АА, этерифицированными в триглицериды (TG) и фосфолипиды (PL) (см., например, жировые смеси 1-9 из таблицы 2).
Сетчатка глаза.
Изучался выделенный у получавших различные диеты крыс сопряженный с G-белком рецептор (GPCR), передающий сигналы в мембраны наружного сегмента палочек (ROS) сетчатки. Передача сигналов посредством GPCR оценивалась на различных этапах:
активации родопсина, взаимодействия родопсин-трансдуцин, cGMP (циклический 3′,5′-аденозинмонофосфат) активности фосфодиэстеразы и образования метародопсина II (МII) и комплекса MII-Gt.
Кроме того, определялась композиция жирных кислот в сетчатке.
Кормление животных рационом, обогащенным композицией изобретения, приводит к улучшению передачи сигналов во внешнем сегменте палочек сетчатки и повышению содержания LC-PUFA в сетчатке.
Пример 6. Действие содержащихся в рационе питания конъюгированных с фосфолипидами DHA и АА на сетчатую оболочку глаза и остроту зрения в экспериментальной модели на животных.
С помощью электроретинографии измерялись электрические отклики различных типов клеток сетчатки, включая зрительные рецепторы (палочки и колбочки), внутренние клетки сетчатки (биполярные и амакринные клетки) и клетки ганглия. В процессе снятия показаний глаза подвергались воздействию стандартизированных стимулов и отображался возникающий сигнал, демонстрирующий динамику изменения амплитуды сигнала (напряжение).
План исследования соответствовал приведенному в публикации Kraft и др., 1987, The Rat Electroretinogram in Combined Zinc and Vitamin A Deficiency, Investigative Ophthalmology & Visual Science.
План исследования.
Для оценки функции сетчатки животные содержались при тусклом освещении, получая различные диеты, и у них снимались скотопические электроретинограммы ().
Рационы кормления.
Животные получали диеты, по существу описанные в таблице 3 или таблице 4.
Группа I: контрольная диета, обычная пища.
Группа II: синтетический рацион, источник жиров которого обогащен DHA и АА, эстерифицированными только в триглицериды (TG).
Группа III: синтетический рацион с источником жиров, обогащенным DHA и АА, этерифицированными в триглицериды (TG) и фосфолипиды (PL) (см., например, жировые смеси 1-9 из таблицы 2).
Получаемые с помощью скотопической электроретинографии снимались у животных в течение эксперимента через равномерные интервалы времени. Перед получением животные адаптировались к темноте в течение минимального периода в 12 часов. Для выполнения записи ERG в передней камере глаза размещался стандартный игольчатый электрод для EEG (электроэнцефалограмма), а в коже головы около верхнего века подкожно устанавливался электрод сравнения. Глаз подвергался воздействию единичных стимулирующих вспышек возрастающей интенсивности. ERG отображалась на осциллоскопе и записывалась на магнитную ленту.
Животные из группы III, получавшие диету, обогащенную композицией изобретения, продемонстрировали более высокую чувствительность сетчатки.
Пример 7. Действие содержащихся в рационе питания конъюгированных с фосфолипидами DHA и АА на рост, а также развитие мозга и ЦНС в экспериментальной модели на животных.
Мозг млекопитающих имеет особенно высокое содержание длинноцепочечных полиненасыщенных жирных кислот (PUFA), главным образом докозагексаеновой кислоты (DHA) [22:6(n-3)] и арахидоновой кислоты (АА) [20:4(n-6)]. В экспериментальной модели на животных исследовалось действие употребляемого материнским организмом рациона с DHA и АА на композицию миелина у детенышей крыс. Пищевые липиды играют важную роль в синтезе миелина, в частности, во время периода максимальной миелинизации. Исследование проводилось во время периода максимальной миелинизации, который у детенышей крыс совпадает с появлением способности слышать.
План исследования соответствовал приведенному в публикации Haubner и др., 2007, The Effects of Maternal Dietary Docosahexaenoic Acid Intake on Rat Pup Myelin and the Auditory Startle Response, Dev Neurosci 29:460-67.
План исследования.
Были получены беременные самки с заданным сроком беременности в два дня. После прибытия самкам были распределены по группам, получавшим различную диету со свободным доступом к пище и воде. Свежий корм предоставлялся самкам на протяжении всего времени беременности и лактации. День родов определяется как постнатальный день (PND) 0. В исследование были включены самки из групп каждой диеты и их рандомизированный помет. Детеныши были отлучены от грудного вскармливания в PND 21 и затем получали соответствующие материнские диеты до PND 24, когда они были умерщвлены посредством декапитации. У детенышей каждой пищевой группы извлекались головной мозг и мозжечок и анализировались на содержание жирных кислот.
Рационы кормления.
Животные получали диеты, по существу описанные в таблице 3 или таблице 4.
Группа I: контрольная диета, обычный корм для крыс.
Группа II: синтетический рацион, источник жиров которого обогащен DHA и АА, эстерифицированными только в триглицериды (TG).
Группа III: синтетический рацион с источником жиров, обогащенным DHA и АА, этерифицированными в триглицериды (TG) и фосфолипиды (PL) (см., например, жировые смеси 1-9 из таблицы 2).
Биохимические анализы.
С помощью газожидкостной хроматографии определялась композиция жирных кислот в полученных из диет общих липидных экстрактах. Готовились гомогенаты мозговой ткани, полученной от всех детенышей в PND 24, и выделялся миелин. В полученном из мозга общем липидном экстракте определялась композиция жирных кислот миелина.
Группа III, получавшая диету, обогащенную композицией изобретения, продемонстрировали наиболее высокие уровни содержания DHA и АА в миелине детенышей.
Пример 8. Действие содержащихся в рационе питания DHA и АА, конъюгированных с фосфолипидами, на композицию жирных кислот в крови и мозге модельных животных.
При условии того, что члены семейств (n-3) и (n-6) конкурируют за одни и те же десатуразные ферменты, действие добавок PUFA из одного семейства на накопление в ткани PUFA из другого семейства могут являться важным фактором, который следует принимать в рассмотрение при определении оптимальной для неврального развития пищевой композиции PUFA. Поэтому посредством применения модели искусственного выращивания, предназначенной для прямого кормления детенышей крыс экспериментальными рецептурами в период быстрого мозгового развития, предусматривается точный контроль как относительного, так и абсолютного количества конкретной пищевой PUFA. Кроме того, этот способ делает возможным прямую подачу рациона детенышам во время периода мозгового развития, который примерно соответствует третьему триместру и раннему постнатальному периоду у людей или раннему грудному возрасту у недоношенных детей.
План исследования соответствовал приведенному в публикации Ward и др., 1998, Long-Chain Polyunsaturated Fatty Acid Levels in Formulae Influence Deposition of Docosahexaenoic Acid and Arachidonic Acid in Brain and Red Blood Cells of Artificially Reared Neonatal Rats, The Journal of Nutrition том 128 No. 12 декабрь, стр.2473-2487.
План исследования.
Были получены беременные самки со сроком беременности 10-12 дней и размещены индивидуальным образом со свободным доступом к питанию и водопроводной воде. Потомство животных с заданным сроком беременности при необходимости в течение 24 часов после рождения сортировалось и в качестве субъектов исследования отбирались приблизительно одинаковые количества мужских и женских особей. Детеныши рандомизированным образом распределялись по группам с различной диетой. С 5 по 18 день жизни, представляющих период быстрого мозгового развития, им скармливались заменители молока с или без DHA и/или АА.
Рационы кормления.
Животные получали диеты, по существу описанные в таблице 3 или таблице 4.
Группа I: контрольная диета, обычный корм для крыс.
Группа II: синтетический рацион, источник жиров которого обогащен DHA и АА, эстерифицированными только в триглицериды (TG).
Группа III: синтетический рацион с источником жиров, обогащенным DHA и АА, этерифицированными в триглицериды (TG) и фосфолипиды (PL) (см., например, жировые смеси 1-9 из таблицы 2).
Методика искусственного выращивания.
В день 27 после оплодотворения (приблизительно день 5 после рождения) детеныши анестезировались и им через рот, вниз по пищеводу и наружу через стенку желудка вводилась гастростомическая трубка. Детеныши размещались индивидуальным образом и получали одну из экспериментальных диет через трубку. Каждый день все детеныши взвешивались для оценки величины прироста. Получавшим грудное вскармливание детенышам из контрольной группы гастростома не накладывалась, а в день гастростомии они передавались для выкармливания самкам-кормилицам. В день 40 после оплодотворения (приблизительно день 18 после родов) животные умерщвлялись, кардиальной пункцией у них отбиралась кровь, извлекался мозг и разделялся на FB (передний мозг) и СВ (мозжечок).
Биохимические анализы.
Исследовалась композиция жирных кислот как в крови, так и в мозге с тем, чтобы изучить взаимосвязь между композициями мозга и эритроцитов (RBC). Мозг разделялся на передний мозг (FB) и мозжечок (СВ), поскольку у крыс связанные с развитием явления, пренатально происходящие в FB, постнатально в большой степени происходят СВ. Поэтому пищевые рационы, которые оказывают специфические эффекты на быстро развивающуюся ткань, должны в течение раннего постанатального периода производить у крыс более значительное действие на СВ, чем на FB. Группа III, получавшая диету, обогащенную композицией изобретения, продемонстрировали наиболее высокие уровни содержания DHA и АА в крови и мозге, что говорит о более эффективном кишечном всасывании.
Реферат
Изобретение относится к области детского питания. Предложена композиция, не являющаяся женским грудным молоком, содержащая, по меньшей мере, один триглицерид, по меньшей мере, один фосфолипид, по меньшей мере, одну длинноцепочечную полиненасыщенную жирную кислоту (LC-PUFA), арахидоновую кислоту и докозагексаеновую кислоту. При этом, по меньшей мере, около 1% LC-PUFA конъюгировано в композиции с указанным, по меньшей мере, одним фосфолипидом; LC-PUFA в содержащей арахидоновую кислоту (АА) и докозагексаеновую кислоту (DHA) композиции конъюгированы с триглицеридами и с фосфолипидами при массовом содержании в композиции АА, превышающем массовое содержание DHA. Предложены функциональный продукт питания, смесь для питания младенцев, фармацевтическая и нутрицевтическая композиции, содержащие вышеуказанную композицию. Предложены также способы улучшения, стимуляции или поддержания развития у младенца остроты зрения; снижения у младенца перекисного окисления липидов; улучшения, стимуляции или поддержания качества роста младенца; улучшения, стимуляции или поддержания у младенца зрелости кишечника, включающие введение указанному младенцу вышеназванной композиции. Изобретение позволяет обеспечить улучшенную композицию заменителя женского молока, обладающую способностью оказывать вышеназванные полезные эффекты, связанные с развитием младенца. 10 н. и 15 з.п. ф-лы, 7 табл., 8 пр.
Формула

где R1, R2 и R3 могут быть одинаковыми или различными и каждый из них независимо выбирается из Н или ацильной группы, при этом ацильная группа выбирается из остатков насыщенной жирной кислоты, мононенасыщенной жирной кислоты и длинноцепочечной полиненасыщенной жирной кислоты (LC-PUFA);
указанный, по меньшей мере, один фосфолипид является соединением формулы II:
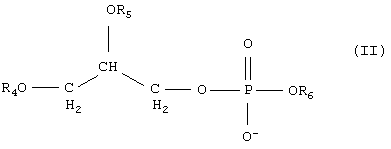
где каждый из R4 и R5 является заместителем, независимо принимающим значения R1, R2, R3, и где
R6 выбирается из холина, инозитола, этаноламина и серина;
где, по меньшей мере, около 1% LC-PUFA конъюгировано в композиции с указанным, по меньшей мере, одним фосфолипидом; LC-PUFA в содержащей арахидоновую кислоту (АА) и докозагексаеновую кислоту (DHA) композиции конъюгированы с триглицеридами и с фосфолипидами при массовом содержании в композиции АА, превышающем массовое содержание DHA.
жирные кислоты С 8:0 - 0-10% общего количества жирных кислот;
жирные кислоты С 10:0 - 0-10% общего количества жирных кислот;
жирные кислоты С 12:0 - 0-22% общего количества жирных кислот;
жирные кислоты С 14:0-0-15% общего количества жирных кислот;
15-55% общего количества жирных кислот, приходящегося на жирные кислоты С 16:0, из которых, по меньшей мере, 30% конъюгировано в sn-2 положении триглицерида;
жирные кислоты С 18:0 - 0-7% общего количества жирных кислот;
жирные кислоты С 18:1 - 20-75% общего количества жирных кислот;
жирные кислоты С 18:2 - 2-40% общего количества жирных кислот;
жирные кислоты С 18:3 - 0-8% общего количества жирных кислот; и другие жирные кислоты, представленные уровнями менее 8% от общего содержания жирных кислот.

Комментарии