N-ацилированное соединение арилпиррола, способ борьбы с насекомыми, способ получения n-ацилированных соединений арилпиррола - RU2099326C1
Код документа: RU2099326C1
Чертежи


Описание
Изобретение относится к новым N-ацилированным соединениям
арилпирролов общей формулы

в которой x представляет собой Cl, Br,
Y представляет собой Cl, Br или трифторметил,
L представляет собой водород или галоген, M и Q каждый независимо представляет водород или галоген,
R представляет собой C1-C4 -алкил; C3-C6 - алкенил,
C3-C6 циклоалкил; фенил, не обязательно замещенный 1 2 атомами галогена, одной C1-C4-алкильной группой, трифторметилом, нитро, феноксигруппу или фурил.
Получение N-ацилированных соединений арилпиррола предусматривает ацилирование арилпиррола общей формулы /II/
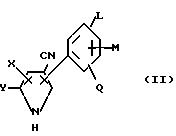
где L, M, Q, W, X, Y и R имеют значения, описанные для формулы I выше.
Еще одна
предпочтительная группа соединений данного изобретения имеет структуру формулы II, где W представляет собой CN, X представляет H, F, Cl, Br или трифторметил; Y представляет H, Cl, Br или трифторметил;
L представляет собой H, Cl, F или Br; M и Q каждый независимо представляет собой H, галоген или трифторметил; и R представляет собой фенил, не обязательно замещенный одним-тремя атомами галогена,
одной-тремя /1-4/C алкильными группами, одной-двумя /1-4/C алкоксигруппами, или одной фенокси, /1-4/C-алкилтио, триалкилсилильной, /1-4/C алкилсульфинильной, /1-4/C алкилсульфонильной,
карбо-/1-4/C-алкокси, карбокси, трифторметильной, CN, NO2, ди/1-4/-C алкил/-амино или /1-4/C алканоиламиногруппой,
1-нафтил или 2-нафтил, или 2-, 3- или 4-пиридил, не обязательно
замещенный одним-тремя атомами галогена, гетероароматическим 5-членным кольцом, содержащим атома кислорода, азота или серы и не обязательно замещенным одним-тремя атомами галогена.
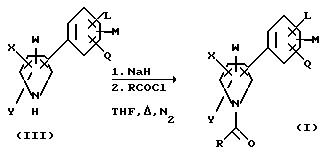
Получение N-ацилированных арилпирролов изобретения обычно предусматривает ацилирование арилпиррола, имеющего структуру формулы III:

где L, M, Q, W, X и Y имеют значения, описанные для формулы I выше.
Ацилирование арилпиррола формулы III может достигаться с помощью реакции указанного арилпиррола формулы III с гидридом щелочного металла или трет-бутилатом щелочного металла, и ацилирующим агентом, имеющим структуру: RCOCl, где R имеет значения, описанные выше.
При реакции гидрид щелочного металла или трет-бутилат щелочного металла обычно диспергируется в безводном органическом растворителе, таком, как тетрагидрофуран, диметоксиэтан, диметилформамид,
диметилсульфоксид, или аналогичные, и образованная таким образом смесь затем нагревается до температуры дефлегмации. Реакционная смесь затем охлаждается обычно до температуры между 20oC и
30oC, и к указанной смеси добавляется ацилирующий агент RCOCl, где R имеет значения, описанные выше. После этого образованная таким образом смесь нагревается до температуры дефлегмации до
тех пор, пока не образуется N-ацилированный арилпиррол. Реакции предпочтительно проводятся в атмосфере инертного газа, такого, как азот или аргон. Реакции могут быть проиллюстрированы следующим
образом:
N-Ацилированные арилпирролы формулы I данного изобретения являются эффективными для борьбы с широким разнообразием разрушительных вредителей растений, которые поражают все типы растительности, включая полевые сельско-хозяйственные культуры, фуражные культуры, хлопок, тыквенные, злаковые, декоративные, капустные культуры, кустарники и аналогичные.
Среди этих разрушительных вредителей находятся насекомые и акарины, которые питаются листвой, стеблями, плодами, цветами и соком растений. Эти насекомые и акарины обычно относятся к отрядам: Колеоптера, Диптера, Тизаноптера, Гомоптера, Гименоптера, Лепидоптера и Ортоптера. Другими вредителями, которые являются разрушительными для жизни растений, но легко уничтожаются N-ацилированными арилпирролами формулы I данного изобретения, являются почвенные вредители, такие как нематоды, корневые черви, проволочники и аналогичные, которые поражают и разрушают корневую систему растений, и моллюски, особенно класса гастропода /брюхоногих/, которые включают слизней, каури, блюдечки и улиток, которые обладают прожорливым аппетитом и поедают сеянцы растений, особенно декоративных. Кроме того, было найдено, что N-ацилированные арилпирролы данного изобретения имеют дополнительное преимущество, выраженное в том, что они могут также использоваться для борьбы с грибковыми организмами и защиты растений от разрушительного действия грибковых болезней.
Для достижения уничтожения указанных выше вредителей и/или обеспечения защиты растений от поражения ими было найдено, что N-ацилированные арилпирролы данного изобретения могут приготавливаться в форме водных или жидких препаративных форм и применяться к растениям и/или почве, в которой они произрастают, в виде водного или жидкого спрея или препарата для орошения, содержащего примерно от 10 част./млн. до 10000 част./млн. и предпочтительно примерно от 50 до 4000 част./млн. N-ацилированного арилпиррола формулы I. Эти жидкие композиции обычно применяются в количестве, достаточном для обеспечения примерно от 0,1 кг/га до 4, 0 кг/га активного ингредиента к месту обработки.
Они могут также приготавливаться в виде твердых препаративных форм, таких как прессованные компактные гранулы, дусты, дустовые концентраты и препараты в виде приманок, которые могут применяться к почве, в которой находятся растения, подлежащие защите, или, в случае дустов или дустовых концентратов, они могут применяться по отношению к листве растений.
Водные или жидкие композиции, полезные при применении на практике настоящего изобретения, могут первоначально формулироваться в виде твердого или жидкого концентрата, который диспергируется в воде или другом недорогом жидком разбавителе, обычно на месте обработки, для применения путем опрыскивания или орошения.
Концентраты, полезные для приготовления спреев или препаратов для орошения, могут иметь форму смачиваемого порошка, эмульгируемого концентрата, водного текучего или диспергируемого в воде гранулярного препарата.
Типичная препаративная форма суспензионного концентрата может приготавливаться путем измельчения вместе примерно 5 25% по весу N-ацилированного арилпиррола формулы I, примерно 3 20% по весу анионного поверхностно-активного агента, такого как додецилбензолсульфокислота, примерно 1 5% по весу неионного поверхностно- активного вещества, такого как блок-сополимер окиси этилена, имеющий около 8 -11 молей этоксилирования, примерно 1 5% по весу конденсата алкилфенола и окиси полиэтилена с 9 10 молями этоксилирования и, сколько необходимо до 100% с нефтяным ароматическим растворителем.
Предпочтительную группу окисноэтиленовых/окиснопропиленовых блок-сополимеров для использования в композициях данного изобретения представляют бутил-омега-гидроксиполи/оксипропилен/-блокполимер с поли /оксиэтиленом/, имеющий средний молекулярный вес в интервале 2400 3500, причем альфа-бутил-омега гидрокси-окисноэтиленовоокиснопропиленовые блоксополимеры, имеющие HLB 12 и вязкость при 25oC 2000 сПз: /Токсимул 8320, Степан Кемикал Ко./ являются наиболее предпочтительными представителями данного класса эмульгаторов.
Предпочтительными конденсаторами алкилфенола и окиси полиэтилена для использования в композициях данного изобретения являются нонилфенолэтоксилаты, причем наиболее предпочтительным представителем данного класса эмульгаторов является нонилфенолэтоксилат /9 10 молей окиси этилена/ /FLO MO® 9N, ДеСото, Инк. Селлер Кемикал Див./.
К числу
предпочтительных нефтяных ароматических растворителей, полезных при приготовлении суспензионных концентратов, содержащих N-ацилированные арилпирролы формулы I настоящего изобретения, относятся:
1/ Смесь ароматических углеводородов /C9-C12 ароматика, интервал перегонки 183 210oC/ /Ароматик® 150, Эксон/
2/ смесь ароматических
углеводородов /C8-C9 ароматика, интервал перегонки 155 173oC /Ароматик® 100, Эксон/
3/ смесь ароматических углеводородов /C10
-C13 ароматика, интервал перегонки 226 279oC/ /Ароматик® 200/
4/ смесь ароматических углеводородов /C8-C9 ароматика, т.кип. 148,
9oC / ТЕННЕКО® Т500/100/ ароматическая углеводородная смесь / ТЕННЕКО® Т400/ углеводородная смесь/, /интервал перегонки 177-277oC / HAN® Эксон/
5/ ароматическая углеводородная смесь /интервал перегонки 210 - 288oC/ ПАНАСОЛ® AN-3N, Амоко/
6/ ароматическая углеводородная смесь
/интервал перегонки 179 - 210oC/ /Шелл ЦИКЛО СОЛ® 63/.
Текучие препаративные формы могут приготавливаться с помощью смешения примерно 5 50% и
предпочтительно примерно 10 25% по весу N-ацилированного арилпиррола формулы I с примерно 2 3% по весу нафталинсульфоновым конценсатом, примерно 0,1 0,5% по весу неионного
нонилфеноксиполиэтоксиэтанола, примерно 0,1 0,5% ксантановой смолы, примерно 0,1 0,5% разбухающей глины, такой, как бентонит, примерно 5 10% по весу пропиленгликоля, примерно 0,1 0,5% по весу
силиконового пеногасителя, примерно 0,1 0,3% по весу водного диспропиленгликолевого раствора 1,2-бензизотиазолин-3-она /консерванта/ и с водой в количестве, сколько необходимо до 100%
Смачиваемый порошок может приготавливаться с помощью совместного измельчения примерно 5 25% по весу N-ацилированного арилпиррола формулы I, примерно 3 15% по весу анионного поверхностно-активного
агента, такого, как додецилбензосульфоновая кислота, примерно 3 10% неионного окисноэтиленового блоксополимера, примерно 1 3% по весу нонилфенолэтоксилата, имеющего 8 11 молей этоксилирования, и
примерно 47 -88% по весу инертного твердого разбавителя, такого, как монтмориллонит, аттапульгит, диатомовая земля, тальк или аналогичные.
В дополнение к суспензионным концентратам могут также приготавливаться и использоваться для защиты растений от поражений вредителями, упомянутыми выше, водные текучие препараты и смачиваемые порошки, описанные здесь выше, другие готовые препаративные формы, такие как вододиспергируемые гранулы, эмульгируемые концентраты и прессованные гранулярные препаративные формы.
С точки зрения полезности и практического применения благодаря различным ацилированным инсектицидным пирролам, описанным здесь, может достигаться ряд преимуществ. В одном случае такая N-дериватизация ведет к улучшенной растворимости продукта в органических растворителях, обеспечивая таким образом большую легкость изготовления препаративных форм продукта для применения. В тех случаях, когда исходный пиррол или почти или совсем не проявляет фитотоксичности по отношению к сельскохозяйственным культурам, почти не нужно уделять внимание гидролитической стабильности получающегося производного, если стабильность дает возможность приготовления препаративной формы в неводной среде, а стабильность при смешении в емкости является достаточно длительной, чтобы обеспечить возможность применения. Такой случай, например, имеет место с соединением А. В данном случае соединение для растений не причиняет вреда. Однако, вследствие плохих свойств растворимости А, как проиллюстрировано ниже, труден для приготовления препаративной формы. Когда, однако, А ацетилируется, давая В, растворимость в органических растворителях улучшается, предоставляя при этом химикам, изготавливающим препаративные формы, более широкое поле деятельности в подборе подходящего носителя для применения продукта. Такие препаративные формы могут диспергироваться в воде, как это имеет место в обычной практике, и применяться успешно, даже хотя ацетилированный пиррол В в большой степени превращается опять в исходный А, если он остается в течение нескольких дней в гомогенной смеси с водой и смешиваемым растворителем, таким как ацетон.
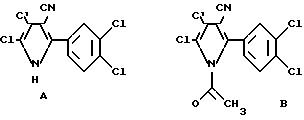
Если пиррол, такой как А, бензоилируется, давая продукт С, свойства растворимости опять-таки улучшаются. Кроме того, однако, в то время как и А и С имеют сравнимую инсектицидную активность против личиночных стадий южной совки и табачной совки, С, как было найдено, также эффективно против двупятнистого паутинного клещика при концентрации 100 част./млн. Это является противоположностью соединению А, которое не обладает активностью даже при 300 част./ млн. Было найдено также, что бензоилированные пирролы, такие как С, обладают гораздо большей гидролитической стабильностью, чем соединения, производимые из алифатических карбоновых кислот. Данная отличительная черта почти не имеет никакого значения, когда исходный пиррол является нефитотоксичным, и небольшое количество исходного соединения, образуемого при гидролизе, не будет причинять вреда растениям, подвергаемым защите от насекомых. Однако в ряде случаев мы нашли пирролы, которые являются высоко активными против насекомых, но они являются вредными для растений, для защиты которых они разработаны. Примером является соединение D, высоко- эффективный инсектицид широкого спектра действия, который не может использоваться вследствие того, что причиняет серьезный вред растениям. Поскольку даже незначительные концентрации данного пиррола в препаративной форме являются неприемлемыми, производное должно быть нефитотоксичным и гидролитически стабильным. В данном случае бензоилированный продукт E дает безопасный для растений продукт. Опасность гидролитического образования на месте фитотоксичного исходного соединения является очень слабой, поскольку, как было найдено, E имеет период полураспада в гомогенной водно-ацетонитрильной смеси, измеряемой годами. В данном случае добавляется также благоприятное свойство пониженной токсичности к млекопитающим, которая для исходного соединения D составляет 31 мг/кг по сравнению с 54 мг/кг для соединения E, представляющими дозу, требуемую для уничтожения 50% мышей при оральном введении.

Эти и другие преимущества данного изобретения могут стать более очевидными на основании примеров, представленных ниже. Эти примеры даются лишь для иллюстрации, но не предназначены для ограниченного изобретения.
Пример 1.
Получение 1-бензоил-4-бром-2-хлор-5/п-хлорфенил/пиррол-3-карбонитрила

К суспензии гидрида натрия /0,21 г 60% дисперсии, 5,3 ммоль/ в 50 мл тетрагидрофурана в 100 мл одногорлую круглодонную колбу, снабженную конденсатором и вводом азота, добавляется порциями 4-бром-2-хлор-5/п-хлорфенил/пиррол-3-карбонитрил /1,0 г, 3,2 ммоль/. Реакция осуществляется в течение 15 мин при комнатной температуре перед добавлением с помощью пипетки гексаметилфосфорамида /НМРА/ /3 мл/ с последующим добавлением сразу же бензоилхлорида /0,75 г, 5,4 ммоль/. После этого реакционная смесь нагревается до температуры дефлегмации в течение 17 ч и оставляется охлаждаться. Вращательное испарение дает сырое полутвердое вещество, к которому добавляется 15 мл диэтилового эфира и 15 мл воды. Энергичное перемешивание на протяжении 20 мин с последующим вакуумным фильтрованием приводит в результате к выделению продукта в виде желтого твердого вещества /1,0 г, 2,4 ммоль, 75%/, т. пл. 179 181oC.
Пример 2.
Получение 1-бензоил-4-бром-2-/п-хлорфенил/-5-/трифторметил/-пиррол-3-карбонитрила

В 250 мл круглодонную колбу, снабженную магнитной мешалкой и конденсатором с приемником азота, добавляется 0,60 г гидрида натрия /60%/. Гидрид натрия промывается приблизительно 50 мл гексанов, гексаны декантируются и заменяются 75 мл тетрагидрофурана /ТГФ/. После добавления ТГФ имеет место некоторое выделение пузырьков газа, следовательно, ТГФ является не совсем безводным. Колба охлаждается на водно-ледяной бане и добавляется порциями 2,04 г 4-бром-2-/хлорфенил/-5-/трифторметил/-пиррол-3-карбонитрила с выделением водорода. Реакционная смесь нагревается с обратным холодильником в течение 20 мин, охлаждается до приблизительно комнатной температуры, а затем добавляется 2,3 мл бензоилхлорида, и реакционная смесь нагревается на протяжении ночи с обратным холодильником. Реакционная смесь охлаждается и выливается в приблизительно 100 мл холодной воды и экстрагируется 100 мл эфира. Эфирный экстракт промывается 100 мл воды, 10 мл насыщенного бикарбоната натрия, сушится над K2CO3, фильтруется и концентрируется на вращательном испарителе при пониженном давлении. Избыток бензоилхлорида удаляется с помощью перегонки с использованием аппарата кугельрора при 100oC при -5 мм рт. ст. Затем остаток нагревается с обратным холодильником в 100 мл гексанов и фильтруется теплым для удаления большей части непрореагировавшего 4-бром-2-/п-хлорфенил/-5-/трифторметил/пиррол-3-карбонитрила. Реакционный продукт затем хроматографируется на силикагельной колонке мгновенной хроматографии размером приблизительно 1" х 12" при элюировании 10% этилацетата и 90% гексанов. Затем 100 мл фракции собираются и фракции N 3 и N 4 объединяются и концентрируются на вращательном испарителе при пониженном давлении. Затем добавляется 50 мл гексанов, смесь нагревается с обратным холодильником для превращения продукта в раствор и раствору дают возможность медленно кристаллизоваться на протяжении ночи. После фильтрования выделяется 1,58 г белых кристаллов 1-бензоил-4-бром-/п-хлорфенил/-5-/трифторметил/пиррол-3-карбонитрила. Точка плавления 105 107oC.
Пример 3.
Получение
4-бром-2-/п-хлорфенил/-1-пивалоил-5-/трифторметил/-пиррол-3-карбонитрила
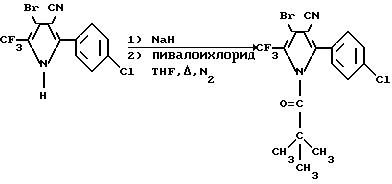
В 250 мл круглодонную колбу, снабженную магнитной мешалкой и конденсатором с вводом азота, добавляется 1,0 г гидрида натрия /60%/. Гидрид натрия промывается приблизительно 50 мл гексанов, гексаны затем декантируются и заменяются 75 мл тетрагидрофурана /ТГФ/. Имеет место некоторое выделение пузырьков газа после добавления ТГФ, что говорит о том, что ТГФ является не совсем безводным. Колба охлаждается на водно-ледяной бане и порциями добавляется 4,08 г 4-бром-2-/п-хлорфенил/-5-/трифторметил/пиррол-3-карбонитрила с выделением водорода. Реакционная смесь нагревается с обратным холодильником в течение 20 мин, охлаждается приблизительно до комнатной температуры, а затем добавляется 5,0 мл пивалоилхлорида, и реакционная смесь нагревается с обратным холодильником на протяжении ночи. О ходе реакции судят по данным анализа HPLC аликвоты вещества. HPLC указывает на то, что реакция прошла примерно на 20% до завершения. Затем добавляется 2 мл гексаметилформамида /HMPA/ для ускорения реакции и реакционная смесь снова нагревается с обратным холодильником на протяжении ночи. Реакционная смесь охлаждается и выливается приблизительно в 100 мл холодной воды и экстрагируется 100 мл эфира и 100 мл гексанов. Органический слой промывается три раза 100 мл воды, затем 100 мл насыщенного хлористого натрия, сушится над карбонатом калия, фильтруется и концентрируется на вращательном испарителе при пониженном давлении. Затем к остатку добавляется 100 мл гексанов. Смесь нагревается с обратным холодильником, охлаждается, а затем фильтруется, давая 3,54 г рыжевато-коричневого порошка. Порошок кристаллизуется два раза из 50 мл метилциклогексанов, давая 2,75 г 4-бром-2-/п-хлорфенил/-1-пивалоил-5-/трифторметил/пиррол-3-карбонитрила в виде рыжевато-коричневых игл, т. пл. 177 183o C.
Следуя описанной выше процедуре, но заменяя 4-бром-2-/п-хлорфенил/-5-/трифторметил/пиррол-3-карбонитрил соответствующим арилпирролом и пивалоилхлорид соответствующим ацилгалогенидом RCOCl, получают следующие соединения.
4-бром-2-/п-хлорфенил/-1 метакрилоил-5-/трифторметил/пиррол-3-карбонитрил, т. пл. 132,5 134oC,
4-бром-2-/п-хлорфенил/-1-о-толуоил-5-/трифторметил/пиррол-3-карбонитрил, т. пл. 131,5 134,5oC,
4-бром-1-/м-хлорбензоил/-1-/п-хлорфенил/-5-/трифторметил/-пиррол-3-карбонитрил, т.
пл. 88 90oC,
4-бром-2-/п-хлорфенил/-1-/2-фуроил/-5-/трифторметил/пиррол-3-карбонитрил, т. пл. 152 156oC,
4-бром-2-/п-хлорфенил/-1-п-толуоил-5-/трифторметил/пиррол-3-карбонитрил, т. пл. 113 116,5oC,
4-бром-2-/п-хлорфенил/-5-/трифторметил/-1-/ α,α,α
-трифтор-п-толуоил/-пиррол-3-карбонитрил, т. пл. 110 118oC,
4-бром-2-/п-хлорфенил/-1-/п-нитробензоил/-5-/трифторметил/-пиррол-3-карбонитрил, т. пл. 128 132oC,
фенил 3-бром-5-/п-хлорфенил/-4-циано-2-/трифторметил/-пиррол-1-карбоксилат, т. пл. 116 120oC,
4-бром-1-/п-хлорбензоил/-2-/п-хлорфенил/-5-/трифторметил/-пиррол-3-карбонитрил, т. пл.
115 117oC,
4-бром-2-/п-хлорфенил/-1-/циклогексилкарбонил/-5- /трифторметил/пиррол-3-карбонитрил, т. пл. 141 142oC,
4-бром-2-/п-хлорфенил/-1-пивалоил-5- /трифторметил/пиррол-3-карбонитрил, т. пл. 177 183oC,
1-ацетил-4,5-дихлор-2-/3,4-дихлорфенил/пиррол-3-карбонитрил, т. пл. с разл. 150oC,
фенил 2,3-дибром-4-циано-5-/a,α,α трифтор-п-толил/пиррол-3-карбоксилат, т.пл. 148 149oC,
4-бром-2-/п-хлорфенил-/1-/1-нафтоил-5-/трифторметил/пиррол-3-карбонитрил, т. пл. 101 108oC,
4-бром-2-/п-хлорфенил/-1-/м-фторбензоил/-5-/трифторметил/-пиррол-3-карбонитрил, т. пл.
111 118oC.
4-бром-2-/п-хлорфенил/-1-/3,4-дихлорбензоил/-5-/трифторметил/пиррол-3-карбонитрил, т. пл. 135 144oC,
1-бензоил-4,5-дихлор-2-/3,
4-дихлорфенил/пиррол-3-карбонитрил, т. пл. 141 144oC,
4-бром-1-/п-трет-бутилбензоил/-2-/п-хлорфенил/-5-/трифторметил/пиррол-3-карбонитрил, т. пл. 113 115oC, или
1-бензоил-4-бром-2-/п-бромфенил/-5-/трифторметил/пиррол-3-карбонитрил, т. пл. 112 117oC.
Пример 4/
Инсектицидная и акарицидная оценка N-ацилированных
арилпирролов.
В этих опытах проводится оценка с использованием технического материала, растворенного в 50/50 ацетоно-водных смесях. Все концентрации, приведенные здесь, даются по
активному ингредиенту. Все испытания проводятся в лаборатории, поддерживаемой при температуре примерно 27oC. Применяемая система оценок является следующей:
Система оценок
0 отсутствие эффекта
1 10 25% уничтожение
2 26 35% уничтожение
3 36 45% уничтожение
4 46 55% уничтожение
5 56 65% уничтожение
6 66 75%
уничтожение
7 76 85% уничтожение
8 86 99% уничтожение
9 100% уничтожение
Когда с использованием одного и того же соединения проводится два или более испытаний,
сообщаются средние результаты испытаний.
Виды испытываемых насекомых и акарид, использованных при настоящей оценке наряду с конкретными процедурами испытаний, приводятся ниже.
Heliothis virescens, 3-я возрастная стадия, табачная совка.
Семядоли хлопка погружаются в испытываемый раствор и оставляются подсохнуть в вытяжном шкафу. Когда они высыхают, каждая разрезается на четвертинки, и десять кусочков помещаются индивидуально в 30 мл пластиковые медицинские чашечки, содержащие кусочек влажного зубного тампона длиной 5 7 мм. В каждую чашку добавляется одна гусеница третьей возрастной стадии и чашка закрывается картонной крышечкой. Обработка сохраняется в течение 3 дней, прежде, чем производится подсчет смертности и оценка уменьшения повреждения от поедания.
Spodoptera eridania, 3-я возрастная стадия, южная совка.
Лист лимской фасоли, достигший длины 7 8 см, погружается в испытываемый раствор с перемешиванием в течение 3 с и помещается в вытяжной шкаф для просыхания. Затем лист помещается в чашку Петри размером 100х10 мм, содержащую влажную фильтровальную бумагу на дне и 10 гусениц 3-й возрастной стадии. Чашка выдерживается в течение 5 дней, прежде чем производятся наблюдения для определения смертности, уменьшения питания или каких-либо нарушений нормальной линьки.
Spodoptera eridania, 7-дневный остаток.
Растения, обработанные в описанном выше опыте, содержатся в теплице в течение 7 дней при освещении лампами высокой интенсивности. Эти лампы увеличивают вдвое эффект яркого солнечного дня в Нью-Джерси в июне и сохряняются на протяжении 14-часового светового дня. Спустя 7 дней, собираются образцы листвы и производится оценка, как в описанном выше опыте.
Diabrotic undecimpunctata howardi, 3-я возрастная стадия южная блошка длинноусая.
Один куб. см тонкодисперсного талька помещается в стеклянную банку с завинчивающейся крышкой с широким отверстием емкостью 30 мл. 1 мл соответствующего ацетонового раствора помещается с помощью пипетки на тальк так, чтобы получить дозу 1,25 и 0,25 мг активного ингредиента на банку. Банки оставляются стоять под действием мягкого воздушного потока до тех пор, пока ацетон не выпарится. Высушенный тальк разрыхляется, добавляется 1 куб. см семян проса в качестве корма для насекомых, и в каждую банку добавляется 25 мл влажной почвы. Банка закрывается крышкой, и содержимое тщательно смешивается с помощью вихревого смесителя. После этого в каждую банку добавляется десять блошек 3-й возрастной стадии и банки закрываются неплотно для обеспечения воздухообмена для личинок. Опыт с обработкой продолжается в течение 6 дней прежде, чем производится подсчет для определения смертности. Недостающие личинки считаются мертвыми, поскольку они быстро разлагаются и их невозможно обнаружить. Концентрации, используемые в данном опыте, соответствуют приблизительно 50 и 10 кг/га соответственно.
Tetranychus urtical /Р-устойчивый штамм/, 2-пятнистый паутинный клещик.
Растения лимской фасоли с поперечными листьями, развившимися до 7 -8 см, отбираются и обрезаются, при этом оставляется одно растение на горшок. Отрезается небольшой кусочек листа, взятого от основной колонии, и помещается на каждый лист опытных растений. Это проделывается примерно за 2 ч до обработки, чтобы дать возможность клещам передвигаться по опытному растению и отложить яички. Размер отрезанного кусочка варьируется, чтобы получить примерно 100 клещиков на лист. В конце обработки кусочек листа, использованный для переноса клещей, удаляется и отбрасывается. Растения, зараженные клещами, погружаются в испытываемый раствор на 3 с с перемешиванием и оставляются в вытяжном шкафу для подсыхания. Растения сохраняются в течение 2 дней прежде, чем производится оценка уничтожения взрослых особей с использованием первого листа. Второй лист сохраняется на растении еще в течение 5 дней прежде, чем производятся наблюдения для определения уничтожения яичек и/или вновь вылупившихся нимф или бабочек.
Empoasca abrupta, взрослые особи, западная картофельная цикадка.
Лист лимской фасоли длиной около 5 см погружается в испытываемый раствор на 3 с с перемешиванием и помещается в вытяжной шкаф для сушки. Лист помещается в чашку Петри размером 100х10 сс, содержащую на дне влажную фильтровальную бумагу. В каждую чашку добавляется примерно 10 взрослых цикадом, и опыт с обработкой длится в течение 3 дней прежде, чем производится подсчет погибших.
Blattella germanica, остаток испытания, взрослые самцы пруссаков.
1 мл ацетонового раствора 1000 част./млн. испытываемого материала помещается медленно с помощью пипетки на дно чашки Петри размером 150х150 мм так, чтобы обеспечить по возможности равномерное покрытие. После того, как осадок высохнет, в каждую чашку помещается 10 взрослых самцов пруссаков и накладывается крышечка. Подсчет смертности производится спустя 3 дня.
В этих оценках X опыт был не завершен, опыт нельзя было провести, пустое место означает, что опыт не проводился, и звездочка данные еще не сообщены.
Полученные данные приводятся в табл. 1 ниже.
Оцениваемые соединения в этих опытах
включают:
1/ 1-бензоил-4-бром-2-/п-хлорфенил/-5-трифторметил/-пиррол-3-карбонитрил, т. пл. 105 107oC,
2/ 4-бром-2-/п-хлорфенил/-1-метакрилоил-5- /трифторметил/пиррол-3-карбонитрил, т. пл. 132,5 134oC,
3/ 4-бром-2-/п-хлорфенил/-1-о-толуоил-5-/трифторметил/ пиррол-3-карбонитрил, т.
пл. 131,5 134,5oC,
4/ 4-бром-1-/м-хлорбензоил/-1-/п-хлорфенил/-5-/трифторметил/-пиррол-3-карбонитрил, т.пл. 88 90oC,
5/ 4-бром-2-/п-хлорфенил/-1-/2-фуроил/-5- /трифторметил/пиррол-3-карбонитрил, т. пл. 152 156oC,
6/ 4-бром-2-/п-хлорфенил/-1-п-толуоил-5-/трифторметил/ пиррол-3-карбонитрил, т. пл.
113 116,5oC,
7/ 4-бром-2-/п-хлорфенил/-5-/трифторметил/-1-/a,α,α-трифтор-п-толуоил/-пиррол-3-карбонитрил, т. пл. 110 118oC.
8/ 4-бром-2-/п-хлорфенил/-1-/п-нитробензоил/-5-/трифторметил/-пиррол-3-карбонитрил, т. пл. 128 132oC,
9/ фенил 3-бром-5-/п-хлорфенил/-4-циано-2-/трифторметил/ пиррол-1-карбоксилат,
т. пл. 116 120oC,
10/ 4-бром-1-/п-хлорбензоил/-2-/п-хлорфенил/-5-/трифторметил/-пиррол-3-карбонитрил, т. пл. 115 117oC,
11/ 4-бром-2-/п-хлорфенил/-1-/циклогексилкарбонил/-5- /трифторметил/пиррол-3-карбонитрил, т. пл. 141 142oC,
12/ 1-бензоил-4-бром-2-хлор-5-/п-хлорфенил/пиррол-3-карбонитрил, т. пл.
179 181oC,
13/ 4-бром-2-/п-хлорфенил/-1-пивалоил-5- /трифторметил/пиррол-3-карбонитрил, т. пл. 177 183oC,
14/ 1-ацетил-4,5-дихлор-2-/3,
4-дихлорфенил/пиррол-3-карбонитрил, т. пл. с разл. 150oC,
15/ фенил 2,3-дибром-4-циано-5-/a,α,α-трифтор-п-толил/пиррол-3-карбоксилат, т. пл. 148 -149oC,
16/ 4-бром-2-/п-хлорфенил/-1-/1-нафтоил-5-/ трифторметил/пиррол-3-карбонитрил, т. пл. 101 108oC,
17/ 4-бром-2-/п-хлорфенил/-1-/м-фторбензоил/-5-/трифторметил/-пиррол-3-карбонитрил, т. пл. 111 118oC.
18/ 4-бром-2-/п-хлорфенил/-1-/3,
4-дихлорбензоил/-5-/трифторметил/пиррол-3-карбонитрил, т. пл. 135 144oC,
19/ 4-бром-1-/п-трет-бутилбензоил/-2-/п-хлорфенил/-5-/трифторметил/пиррол-3-карбонитрил, т. пл. 113 115,
5oC, или
20/ 1-бензоил-4-бром-2-/п-бромфенил/-5-/трифторметил/пиррол-3-карбонитрил, т. пл. 112 117oC.
Для оценки и сравнения активности полностью замещенных пиррольных соединений изобретения и известных неполностью замещенных пиррольных соединений был проведен следующий эксперимент.
Эксперимент A.
Инсектицидная оценка.
Готовят растворы с помощью растворения испытуемого соединения в смеси 50/50 ацетон/вода. Приведенные концентрации получены путем последующего разбавления испытуемого раствора смесью 50/50 ацетон/вода.
Spodoptera eridania личинки 3-й возрастной стадии, совка южная.
Лист лимской фасоли Siera размером 7 8 см в длину погружают в испытуемый раствор при перемешивании на 3 с и помещают в чехол для сушки. Затем лист помещают в чашку Петри 100x10 мм, содержащую на дне увлажненную фильтровальную бумагу и десять гусениц на 3-й стадии развития. Чашку выдерживают в течение 5 дней перед наблюдением и подсчитывают смертность, пониженное питание или какое-либо вмешательство в нормальную линьку.
Полученные данные приведены в табл. II и III с использованием системы оценки, приведенной ниже.
Система оценки смертности
0 нет эффекта 5 56 65%
1 10 25% 6 66 75%
2 26 35% 7 76 85%
3
36 45% 8 86 99%
4 46 55% 9 100%
Соединения изобретения являются 1-ацилпиррольными соединениями, которые являются полностью замещенными в пиррольном кольце. Соединения, описанные в
известном уровне техники, являются неполностью замещенными в пиррольном кольце. Из приведенных выше данных четко видно, что соединения изобретения обладают неожиданно высокой инсектицидной активностью
по сравнению с известными соединениями.
1-Бензоил-2,5-дибром-4-(2,3,4-трифторфенил)пиррол-3-карбонитрил

1Н ЯМР
δ 7,06 7,24: H1 и H2
d 7,55 7,84: H3 H7
19F ЯМР
d -130: F1 и F2
d -158: F3
ИК
2234 см-1: CN
1733 см-1: C=0
1-Бензоил-4-дибром-2-(2, 4-дифторфенил)-5-(трифторметил)пиррол-3-карбонитрил
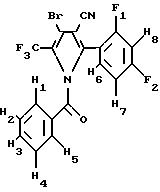
1Н ЯМР
δ 7,1 8, 1: ароматические водороды; H1 H8
d 2,49: ДМСО
d 3,33: H2O
19F ЯМР
d -54,2: F1 и F2
ИК
2240 см-1: CN
1740 см-1: C=0м
Реферат
Использование: в качестве вещества, обладающего инсектицидной активностью, сельское хозяйство, химические способы защиты растений. Сущность: продукт формулы (I), указанный в описании, где X -Cl, Br, Y-Cl, Br, CF3, L-H, галоген, M и Q каждый независимо представляет H или галоген, R-C1-C4-алкил, C3-C6-алкенил; C3-C6-циклоалкил; фенил, возможно замещенный 1 - 2 атомами галогена, одним C1-C4-алкилом, CF3, NO2; фенокси или фурил. Реагент I: арилпиррол, реагент II: гидрид щелочного металла, реагент III: карбонилхлорид RCOCl. Способ борьбы с насекомыми заключается в обработке их или мест их обитания соединением формулы (I) в эффективном количестве. 2 с. и 6 з.п. ф-лы, 3 табл.
Формула

в которой X Cl, Br;
Y Cl, Br или трифторметил;
L водород или галоген;
M и Q каждый независимо водород или галоген;
R С1 С4-алкил; С3 С6-алкенил, С3 С6-циклоалкил, фенил, необязательно замещенный 1 2 атомами галогена, одной С1 С4 алкильной группой, трифторметилом, нитро; феноксигруппа или фурил.
4-бром-2-(п -хлорфенил)-1-метакрилоил-5-(трифторметил)пиррол-3-карбонитрил,
4-бром-2-(п-хлорфенил)-1-о-толуоил -5-(трифторметил)пиррол-3-карбонитрил,
4-бром-1-(м -хлорбензоил)-1-(п-хлорфенил)-5-(трифторметил)-пиррол-3-карбонитрил,
4-бром-2-(п-хлорфенил)-1-(2-фуроил)-5 -(трифторметил)пирол-3-карбонитрил,
4-бром-2-(п-хлорфенил)-1-п -толуоил-5-(трифторметил)пирол-3-карбонитрил,
4-бром-2-(п -хлорфенил)-5-(трифторметил)-1-(α,α,α - трифтор-п-толуоил)пиррол-3-карбонитрил,
4-бром-2-(п -хлорфенил)-1-(п-нитробензоил)-5-(трифторметил)пиррол-3-карбонитрил,
фенил 3-бром-5-(п-хлорфенил)-4-циано -2-(трифторметил)-пиррол-1-карбоксилат,
4-бром-1-(п -хлорбензоил)-2-(п-хлорфенил)-5-(трифторметил)пиррол-3-карбонитрил,
4-бром-2-(п-хлорфенил)-1-(циклогексилкарбонил)-5 -(трифторметил)-пиррол-3-карбонитрил,
4-бром-2-(п-хлорфенил)-1-пивалоил-5-(трифторметил) -пиррол-3-карбонитрил,
1-ацетил-4,5-дихлор-2-(3,4 -дихлорфенил)пиррол-3-карбонитрил, фенил 2, 3-дибром-4 циано-5-(α,α,α-трифтор-п-толил)-пиррол-1-карбоксилат,
4-бром-2 -(п-хлорфенил)-1-(3,4-дихлорбензоил)-(трифторметил)-пиррол-3 -карбонитрил,
4-бром-1-(п-трет-бутилбензоил)-2-(п-хлорфенил) -5-(трифторметил)-пиррол-3-карбонитрил.

в которой L, M, Q, X и Y имеют значения, определенные выше,
с избытком гидрида щелочного металла в присутствии безводного тетрагидрофурана с образованием первой смеси, добавляют соответствующим образом замещенный карбонилхлорид структуры RCOCl, где R имеет указанные выше значения, с образованием N-ацилированного арилпиррола.

Комментарии