Способ получения лактамов - SU1750423A3
Код документа: SU1750423A3
Описание
Изобретение относится к способу получения нйаых химических соединений , а именно лактамов общей формулы
О
.-. л i
.N-(CHrirrS-R tCHzV,
где R - С2-С12 алкил; т 1 или 3; п - 2 - 10,
которые увеличивают проницаемость и проходимость лекарственных веществ и могут найти применение в медицине в качестве промоторов абсорбции .
Целью изобретения является разработка на основе известных методов способа получения новых соединений, обладающих ценными фармакблогически- ми свойствами.
Изобретение иллюстрируется следующими примерами.
и
1 iT
|Јь
К ICO
I
00
Пример 1. В смесь 0,44 г 60%-ного гидрида натрия и 50 мл сухого толуола по каплям добавляли раствор 0,85 г 2-пирролидона в толуоле , выдержали при температуре кипения с обратным холодильником в течение 1 ц, после чего ввели 5,6 г 1,2-дибромэтана, а затем прокипятили с обратным холодильником в течени 12 ч, в р-езультате чего получили реакционную смесь,, Приготовленную таким образом реакционную смесь промыли водой, высушили, отогнали из нее путем перегонки под пониженным давлением растворитепь и подвергли перегонке с получением 1,60 г светло- желтого 1- (2-бромэтил)-2-пирролидона
Полученный таким образом 1-(2- бромэтил)-2-пирролидон добавили в смесь 1,45 г н-децилмеркаптана с 1,40 г 1,8-диазадицикло (5,4,0)унде- цена-7 (ДДУ) и 50 мл бензола, после чего всю массу выдержали с перемешиванием при комнатной температуре в течение 10 ч, подвергли экстракционной обработке этилацетатом, промыли водой, высушили, освободили от растворителя путем перегонки под пониженным давлением, а затем перегнали , получив 2,17 г бесцветного (децилтио)-этил -азациклопентан 2-она„
Заключительную операцию перегонки провели с помощью роторного испарителя с вращающейся стеклянной трубкой GTO-250R.
Таким образом было получено бесцветное соединение, характеризующееся следующими показателями.
Внешний вид: бесцветное прозрачное маслоподобное вещество.
Температура колонки: 130 - 135 С при остаточном давлении 0,2 мм рт. ст.
Данные элементного анализа для C(6H3,NOS:
Вычислено , %: С 67,31; Н 10,94; N 4,91.
Найдено, %: С 67,21; Н 10,76; N А,88.
Пример2. В смесь 1,32 г СО -ного гидрида натрия и 100 мл сухого толуола по каплям ввели раствор 3, 39 г азациклогептан-2-она в толуоле, выдерживали при температуре кипения с обратным холодильником в течение 1 ч, после чего ввели 22,0 г 1,6-дибромгексана, а затем прокипятили с обратным холодильником в те- чение 12 ч, в результате чего получили реакционную смесь. Приготовленную таким образом реакционную смесь промыли водой, высушили, освободили от растворителя путем перегонки под пониженным давлением, после чего перегнали с получением
6,62 г светло-желтого 1-(6-бромгек- сил)-азациклогептан-2-она.
Полученный таким образом 1-(6- бромгексил)-азациклогептан-2-он добавили в смесь 6,2k г н-пентилмер5 каптана с 5,47 г 1, 8-диазадицикло (5,4,0)ундецена-7 (ДДу) и 10° мл бензола, после чего всю массу выдерживали с перемешиванием при 40 - 60°С в течение 10 ч, подвергли экст0 ракционной обработке этилацетатом, промыли водой, высушили, освободили от растворителя путем перегонки под пониженным давлением, а затем перегнали с получением 6,69 г бесцветного
5 1-Јб-(пентилтио)-гексигД-азациклогеп- тан-2-она.
Таким образом было получено бесцветное соединение, характеризующееся следующими показателями.
0 Внешний вид: бесцветный прозрачный маслоподобный продукт.
Температура колонки: 146 - 150 С лри остаточном давлении 0 ,5 мм рт .ст. Данные элементного анализа
5 для С17Н„МОЗ:
Вычислено,%: С 68,1/; Н 11,10; N 4,68.
НайденоД: С 68.20; Н 11,29; N 4.75. ПримерЗ. В смесь 0,44 г
0 60%-ного гидрида натрия с 50 мл бензола по каплям ввели раствор 0,85 г 2-пирролидона в бензоле, прокипятили с обратным холодильником в течение 1 ч, после чего ввели 7,32 г
5 1,6-дибромгексана, а затем всю массу дополнительно прокипятили с обратным холодильником в течение 18 ч, в результате чего образовалась реакционная смесь„ Приготовленную таким обра0 зом реакционную смесь промыли водой, высушили, освободили от растворителя перегонкой под пониженным давлением а затем подвергли перегонке, получив 1,98 г светло-желтого 1-(6-бромгек5 сил)2-пирролидона.
Полученный таким образом 1-(6- бромгексил)-2-пирролидон добавили . в смесь 0,94 г н-гексилмеркаптана с 1,33 г 1,8-диазадицикло (5,4,0)ун
ь17
децена-7 (ЛДУ) и 50 мл бензола, пос- ле чего всю массу выдержали при комнатной температуре с перемешиванием в течение 15 ч, подвергли экстракционной обработке этилацетатом , промыли водой, высушили, освободили от растворителя отгонкой под пониженным давлением, а затем подвергли перегонке, получив 2,13 г бесцветного (гексилтио)-гексил азациклопентан-2-она.
Таким образом было получено бесцветное соединение, характеризующеес следующими показателями.
Внешний вид: бесцветный прозрачный маслоподобный продукт,
Температура колонки: 129 - 133°С при остаточном давлении 0,2 мм рт.ст
Данные элементного анализа для С{бН3; NOS:
Вычислено,: С ь7,31; И 10,94; N 4,91. Найдено,: С 67,39; Н 10,82; N 4, 86.
Пример. В смесь О, и г 60%-ного гидрида натрия с 50 мл бензола по каплям ввели раствор 1,13 г азациклогептан-2-она в бензоле, выдержали с кипячением с обратным хо
лодильником в течение 1 ч, после чего ввели 6,06 г 1 ,3-дибромпропана, а затем дополнительно прокипятили в течение 15 ч с обратным холодильником с получением реакционной смеси . Полученную таким образом реакционную смесь промыли водой, высушили , освободили от растворителя его отгонкой под пониженным давлением а затем подвергли перегонке, получив 1,76 г светло-желтого 1-(3 бром- пропил)-азациклогептан-2-она.
Полученный таким образом 1-(3 бромпропил)-азациклогептан-2-он добавили в смесь 0,99 г н-гептилмеркал- тана с 1,26 г 1,8-диазадицикло(5, 4,0)ундецена-7 (ЛДУ) и 50 мл бензола после чего всю массу с перемешиванием при комнатной температуре в течение 12 ч, подвергли Экстракционной обработке этилацетатом, промыли водой, высушили, освободили от растворителя его отгонкой под пониженным давлением, а затем перегнали, получив 1,91 г бесцветного (геп тилтио)-пропил -азадициклогептаи-2- она.
Таким образом было получено соединение , характеризующееся следующими показателями.
0
5
0
5
Внешний вид: бесцветный прозрачный маслоподобный продукт. ,
Температура колонки: 130 - 134 С при остаточном давлении 0,2 мм рт,ст
Данные элементного анализа для C16H32NOS:
Вычислено,%: 6,31; И 10, N 4,91 Найдено,%: С 67,22; Н 11,15; N 4,88,
Пример5. В смесь 0,44 г 60 %-ного гидрата натрия с 50 мл сухого толуола по каплям ввели раствор 1, 13 г азациклогептан-2-она в толуоле , прокипятили с обратным холодильником в течение 1 ч, после чего ввели 6,90 г 1,5-дибромпентанз, а затем вновь прокипятили в течение 17 ч с обратным холодильником, в результате чего получили реакционную смесь. Полученную таким образом реакционную смесь промыли водой, высушили , освободили от растворителя его отгонкой под пониженным давлением , а затем перегнали, получив 2,Об г светло-желтого 1 - (5-бромпентил)- азациклогептан-2-она,
Полученный таким образом 1-(5 Ьромпентил)-азациклогептан-2-он добавили в смесь 1,59 г н-додецил - 0 меркаптана с 1,32 г 1,8-диазацикло(5, 4,0)ундецена-7 (ЛДУ) и 50 мл бензола, после чего всю массу выдержали с перемешиванием при комнатной температуре в течение 10 ч, подвергли экст- 5 ракционной обработке этилацетатом, промыли водой, высушили, освободили от растворителя его отгонкой под пониженным давлением, а затем перегнали , получив 2,57 г бесцветного 0 (додецилтио)-пентил -азадицик- логептан-2-она.
Таким образом было получено бесцветное соединение, характеризующееся следующими показателями, 5 Внешний вид: бесцветный прозрачный маслоподобный продукт.
Температура колонки: 172 - 177 С при остаточном давлении 0,2 мм рт.ст.
Ланне элементного анализа
0 для C23M4SNOS
Вычислено,%: С 72,00; П 11,82;
N 3,65.
Найдено Д: С 72,13; Н 11,62; N 3,66
Примерб. В смесь 0,44 г 60%-ного гидрида натрия и 50 мл сухого толуола по каплям ввели раствор 1,13 г азациклогептан-2-окэ в толуоле, прокипятили с обратным хо5
лодильником в течение 1 ч, после чего ввели 9,00 г 1,10-дибромдека- на, а затем дополнительно прокипятили с обратным холодильником а те- мение 12ч, в результате чего полумили реакционную смесь Полученную таким образом реакционную смесь промыли водой, высушили, освободили от растворителя его отгонкой под пониженным давлением, а затем перегнали , получив 2,79 светло-желтого 1 - (10-бромдецил)-ззациклогептан-2-он
Полученный таким образом 1-(10- бромдецил)-азациклогептан 2-он до- бавили в смесь 0,76 г н-бутилмер- каптана с 1,41 г 1 , 8-диазадицикло(5, 4,0)ундецена-7 (ЛДУ) и 50 мл бензола после чего всю массу выдержали с перемешиванием при комнатной температу ре в течение 15 ч, подвергли экстракционной обработке этилацетатом, промыли водой, высушили, освободили от растворителя его отгонкой под пониженным давлением, а затем перегна- ли, получив 2,50 г бесцветного 1- j 0-(бутилтио)-децил -аза циклогеп- тан-2-она.,
Таким образом было получено бесцветное соединение, характеризующе- ecq следующими показателями.
Внешний вид: бесцветный прозрачный маслоподобный продукт.
Температура колонки: 162 - 1б7°С при остаточном давлении 0,5 мм рт.ст
Данные элементарного анализа для
Вычислено, С 70,32; Н 11,51; N 4,10. Найдено,: С 70,57; Н 11,42; N 4,31
Примеры 7- 48. Соединения общей формулы I получены аналогично примерам 1 - 6. В табл„1 указаны значения радикалов R, m и п,а также температура колонки.
П р и м е р 49. Приготовлена пробная мазь, имеющая следующий состав , вес.%:
Кетопрофен5,О
Пропиленгликоль 3,0 Изопропилмиристат 2,0 Белый вазелин37,0
Соединение I (пример 37) 3,0 Пример 50. Приготовлен пробный раствор (линимент), имеющий следующий состав, вес.%:
КетопроАен
Этанол
2,8 47,1
Очищенная вода 4/,1 Соединение I (пример 12) 3,0
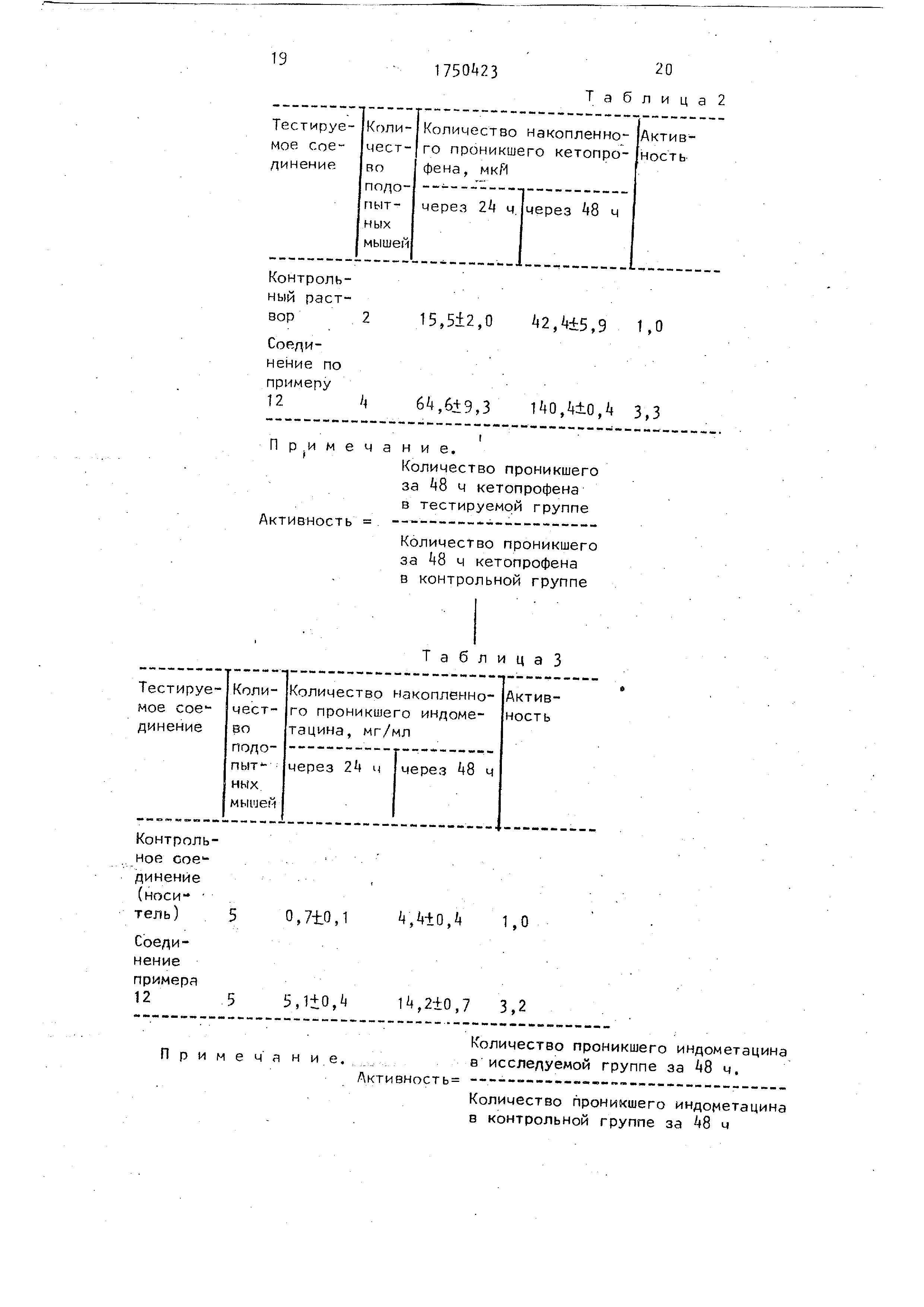
Исследовано воздействие соединена I на подкожное проникновение кето- профена с использованием шкуры со спины безволосой мыши (женская особь каждая в возрасте 9 недель), с помощью метода диффузии клеток, который состоит во введении 0,5 мл указанног тестируемого раствора донору с последующим определением количества кетопрофена, проникшего в слой рецепторов (методом жидкостной хроматографии - жидкостной хроматографии высокого давления). Для сравнения повторили описанный эксперимент, за исключением того, что вместо тестируемого раствора, содержащего соединение I, ввели контрольный раствор, не содержащий соединение I. Результаты представлены в табл.2.
Как видно из табл.2, добавление соединения I оказывает стимулирующее воздействие на проникновение кетопрофена ,
П р и м е р 51. Приготовили аэрозольный раствор следующего состава, вес.:
КетопросЬен1,0
Изопропилмирустат 1,0 Этанол20,0
Флеон75,О
Соединение I (пример 12) 3,0 П р и м е р 52. Приготовили гидрофильную мазь следующего состава, весД:
Индометацин1 ,0
Белый вазелин25,0
Стеариновый спирт 20, 0 Поопиленгликоль 12,0 НСО-604,0
Метил-п-оксибензокис- лота (пропил-п-окси- бензокислота0,1
Очищенная вода 34,8 Соединение I (пример 12) 3,0 Активность соединения I определял с помощью метода диффузии клеток так же, как в примере 50, за исключением того, что тестируемое соединение заменили указанной тестируемой мазью. Результаты представлены в табл.3.
Как видно из табл.3, проникновени индометацина способствует добавление соединения согласно изобретению.
-
Примеры. Приготовили голевую мазь следующего состава, вес.
Индометацин1,0
Диизопропиловаякислота 1,1
Этанол 8,0
Очищенная вода 6,9
Соединение Т (пример 12) 3,0 Активность соединения определяли с помощью метода диффузии клеток та же, как в примере 50, за исключение того, что вместо испытываемого раствора брали указанную мазь. Результаты приведены в табл..
- .
Как следует из табл.ч, проникновение индометацина в значительной степени усиливается при добавлении соединения I.
П р и м е р 5 Приготовили крем следующего состава, вес.%:
Преднизолон3,0
Триэтаноламин0,1
Глицерин , 3,0 Моностзрилглицерин ,0 Стеариновая кислота 15,0 Очищенная вода , 69,9 Соединение I (пример 12) 5,0 П р и м е р 55. Приготовили мазь следующего состава, вес.%:
Динатрий хромгликат 1,0 Полиэтилен гликоль 000 3,0 Иетиловйй спирт 5,0 Полисорб т5,0
Изопропйлмиристат 5,0 Пропиленгликоль 15,0 Полиэтиленгликоль 300 23, 0 Соединение I (пример 57) 3,0 П р и м е р 56. Приготовили раствор следующего состава, вес.%: Пиндололt ,0
Пропиленгликоль 6, 5 Этанол 6,5
Соединение I, представленное в табл.5. 3.0 Были сформированы группы по четыре мужских особи крыс вида Wistnr- Strain весом 200 - 250 г в каждой, у которых шкуру на спине выбрили электробритвой.
Каждым из испытываемых растворов (содержат пиндоло-препараты) обработали выбритую шкуру на спине крыс одной из групп в количестве 150 мкл /2,,5 см2 и затем заклеили этот участок. Через 3 ч после обработки у подопытных крыс взяли кровь для
()
определения с помощью жидкостной хромлтогрл ии с высоким давлением концентрации пиндолола в сыворотке Результаты представлены в табл.5.
Для сравнения описанный опыт повторили , ла исключением того, что использовали контрольный рагтвор, который отличался от тестируемого толь ф ко тем, что не содержал соединений I. Проделали также сравнительный эксперимент с использованием сравнительного раствора, который отличался от тестируемого только тем, что сое1 , динение I заменили сравнительным соединением. Результаты представлены в табл.5.
Как видно из табл.5, соединение 20 i в тестируемом растворе в значительной степени способствует подкожной абсорбции пиндолола в сравнении с контрольной группой, а также удовлетворительно воздействует на абсорбцию 25 пиндолола по сравнению со сравнительным соединением. Кроме того, на спинном участке шкуры, обработанном тестируемым соединением с содержанием соединения I, не выступило ни- 30 чего необычного, такого как эритема или отек.
П р и м е р 57. Приготовили тестируемый раствор следующего состава, весД:
j5 Пиндолол0,
Этанол- 8.3
ВодаJ+8,3
Соединение I (пример 12) 3,0 Активность соединения согласно 40 изобретению определяли с помощью метода диффузии клеток таким же способом, как в примере 50, за исключением того, что указанный тестируемый раствор использовали вместо 45 раствора, испытываемого в примере 50. Результаты представлены в табл.6.
Как видно из табл.6, соединение I оказывает значительное способст- 50 вующее проникновению пиндолола действие по сравнению с контрольной группой, а также показывает удовлетворительную активность в сравнении со сравнительным соединением. 5 П р и м е р 58. Приготовили акриловую ленту следующего состава, вес Д:
Пиндолол1,2
Никазол TS-W 37,68
11
Лимонная кислота 0,6 Соединение I (пример 12) 0,72 Активность этого соединения определяли с помощью метода диффузии клеток так же, как в примере 50, за исключением того, что на поверхность шкуры нанесли ленту размером 0 ,785 см2 (включающую 0,8 мг пиндолола).
Результаты представлены в табл.7, Как видно из табл.7, проникновени через кожу пиндолола из тестируемой ленты улучшилось в результате добавления соединения I.
П р и м е р 59. Приготовили контрольный и тестируемый растворы состава, приведенного в табл.8.
8 опытах использовали несколько групп крыс, в каждой из которых было по четыре мужских особи крыс Wistar-Strain весом 200 - 250 г, которым не давали пищу в течение 2k ч. Каждый из контрольных растворов А и В и тестируемый раствор наносили на выбритую шкуру на спине крыс одно группы в количестве 175 мкл/2, 5 5(2,5 см2 и затем эти участки заклеили . Указанным крысам подкожно ввели 20%-ную глюкозу. Через 2 ч после введения глюкозы у крыс взяли кровь и исследовали ее на содержание в ней глюкозы.
Для сравнения указанный опыт повторили , за исключением того, что в испытываемый раствор вместо соединения по примеру 12 ввели азон.
Еще для сравнения кровь крыс одной группы, которая подверглась только голоданию в течение 2k ч (далее нормальная группа), исследовали на содержание глюкозы в крови. Далее группы крыс, которым ввели контрольный раствор А, контрольный раствор В и тестируемый раствор, названы контрольная группа А, контрольная группа В и тестируемая группа соответственно . Результаты опытов представлены в табл.9.
Как видно из табл.9, контрольная группа В (в которой использован один глибенкламид) не оказывает какого- либо воздействия на гипоглицеминовую активность по сравнению с контрольной группой В, в то время как тестируемая группа (в которой использоваю но соединение I) оказывает значительное воздействие на усиление абсорб , ь
1750 231;
ции глибенкламида, в результате чего глибенкламид абсорбируется подкожно и понижается уровень глюкозы. Кроме того, соединение I оказывает более сильное воздействие на способствование абсорбции по сравнению с азо
5
0
5
0
5
0
5
50
Ь5
нательного соединения.
П р и м е р 60. Приготовили тестируемую эмульсию следующего состава, вес.%:
Глибенкламид1,0
Моноолеоилглицеринпило- глутаминовый эфир 47, 0 Очищенная вода 7,0 Соединение I (пример 12) 5,0 П р и м е р 61. Приготовили тестируемый раствор следующего состава, вес.%:
5-фторурацил (5-Fu) 1,8 Этанол 7,6
Вода(7,6
Соединение I (пример 12) 3,0 Активность соединения определяли с помощью метода диффузии клеток так же, как в примере 50, за исключением того, что описанным тестируемым раствором заменили раствор, использованный в примере 50.
Результаты приведены в табл.10. Как видно из табл.10, добавление соединения I значительно увеличивает проникновение 5-Fu по.сравнению с контрольным, а сравнительные соединения не проявляют никакой активности .
П р и м е р 62. Приготовили тестируемый раствор следующего состава, вес.%:
Фенол красный0,07
Очищенная вода 96,93 Соединение I, представленное в табл.11 3,0 Исследовали воздействие соединения
1на подкожное проникновение фенола красного, который трудно проникает под кожу, с использованием обезволо- шенной шкуры на спине женских особей мышей (в возрасте 9 недель) и с помощью метода диффузии клеток, который включал добавление 0,5 мл раствора хлористого натрия, содержащего
2мМ фенола красного, донору, после чего определяли количество фенола i красного, проникшего в слой рецепторов с помощью быстродействующего денситометра (559 нм)0 Результаты представлены в табл.11.
Как видно из табл.11, использование соединения I в тестируемом растворе приводит к значительному усилению абсорбции фенола красного по сравнению с контролем и наблюдается удовлетворительное усиливающее воздействие по сравнению со сравнительными соединениями.
П р и м е р 63. Приготовили тестируемый раствор следующего состава, вес.:
Препарат из табл.12 1,0 Этанол 8, 0
Очищенная вода 8,0 Соединение I (пример 12) 3,0 Активность препарата определяли по методу диффузии клеток так же, ка в примере 50, за исключением того, что вместо тестируемого раствора по примеру 50 использовали указанный тестируемый раствор, и количества различных препаратов, проникших через кожный барьер измеряли стандартными способами. Результаты (средние значения 2-7 кожных клеток) приведены в табл 12„
Как видно из табл.12, использование соединений I приводит к значительному увеличению проникновения различных препаратов.
П р и м е р . Приготовили свечи состава, указанного в табл.13, и испытали их в нормальной, контрольной и тестируемой группах, каждая из которых включала 5 мужских особей кроликов весом 2,5 - 3,5 кг.
Эти три вида свечей вводили в ректум кроликам в количестве 0,3 г свечей/кг соответственно. Затем через ушную вену через определенные интервали времени у кроликов взяли кровь для определения содержания глюкозы в ней методом глюкоз-оксида- зы. Для сравнения этот опыт повторили , за исключением того, что соединение по примеру 12 заменили на Азон. Результаты представлены в виде изменения уровня глюкозы в крови по отношению к первоначальному уровню до введения свечей в табл.1.
Как видно из табл. И, в контрольной группе (ввели только инсулин) не видно воздействия на уровень глюкозы в крови по сравнению с нормальной группой. С другой стороны, в тестируемом группе (использовано
соединение примера 12) заметна значительная iипоглицеминовая активность в крови и, кроме того, не наблюдается никакого ранящего воздействия на слизистую оболочку той части рек- тума, в которую введена свеча.
П р и м е р 65, Приготовили свечи с антибиотиками состава, приведенного в табл.15, и исследовали их действие в контрольной и тестируемой группах. Каждая группа включала по 5 мужских особей кроликов весом 2,5 - 3,5 кг каждый.
15
Каждый из кроликов был лишен пищи в течение 2k ч перед опытом. Эти два вида свечей вводили в ректум кроликам в количестве 0,3 г свечей/кг соответственно . После этого через ушную вену у кроликов брали кровь и методом жидкостной хроматографии с высоким давлением определяли концентрацию антибиотика в сыворотке.
Результаты представлены в табл.1б„
Как видно из табл.1б, соединение по изобретению в значительной степени способствует абсорбции в ректу- ме обоих антибиотиков.
П р и м е р 66. Приготовили свечи следующего состава, в.ес.%: Препарат, представленный в табл.171 ,7
Витепсол Н-1Ь96,0
Соединение I (пример 12) 3,0 Повторили опыт примера 65, за исключением того, что использовали указанные свечи и в Каждой группе было 3 - кролика. Результаты представлены в табл.17.
Как видно из табл.17, соединение по изобретению значительно увеличивает ректальную абсорбцию индомета- цина и .
Пример 67. В качестве одного из тестов на соединениях I на их локальную токсичность был проведен
основной тест на раздражение кожи с использованием в качестве объектов кроликов. Более конкретно, на коротковолосую шкурку спины японских кроликов массой 2,5 - 3,0 кг каждый
положили липкий пластырь, предназначенный для испытаний партии, на который по каплям нанесли 100 мл 3%-ного испытательного раствора каждого из соединений примеров 12, 37, ,
57 и 73 в 10П мл полиэтиленгликоля 300, и затем плотно прикрепили его к спинном шкурке на 2А м. Реакцию раздражения спинной шкурки этих кроликов оценивали 3 раза, через 2, 8 и /2 ч после снятия пластыря, используя способ, соответствующий методу Драмяа,
Для сравнения выполнили описанную процедуру за исключением того, что
вместо испытательного раствора использовали контрольный раствор (только полиэтиленгликоль) и была выполнена еще одна процедура, где соединение I было заменено сравнительным соединением Дзон в указанном 3%-ном испытательном растворе.
Результаты приведены в табл.18, в которой общая оценка представлена следующим уравнением:

















Реферат
Изобретение касается замещенных лактамов, в частности получения соединений общей формулы I: К-3-/СН2)п-ьт-С(0)-(СНД,-(СНг)т, где R Сг -С1г-алкил, m 1 или 3. п 2-10, которые увеличивают проницаемость и проходимость веществ, что может быть использовано в медицине. Цель - создание новых более активных, малотоксичных веществ указанного класса. Синтез ведут реакцией соединений формулы II: NH-C(0)-(CHZ)2-(CH2)m с гидридом натрия в инертном органическом растворителе при кипении с последующей обработкой полученного Na-coe- динения сначала дибромидом ф-лы III: Br(CH2)n-Br, а затем тиолом ф-лы IV: R-SH в присутствии 1,8-диазоби- цикло (5,4,0) ундецена-7 при 20 - 60°С. Новые вещества малотоксичны и усиливают фармакологические эффекты широкого диапазона лекарственных веществ. 19 табл. (л С

Формула


Комментарии