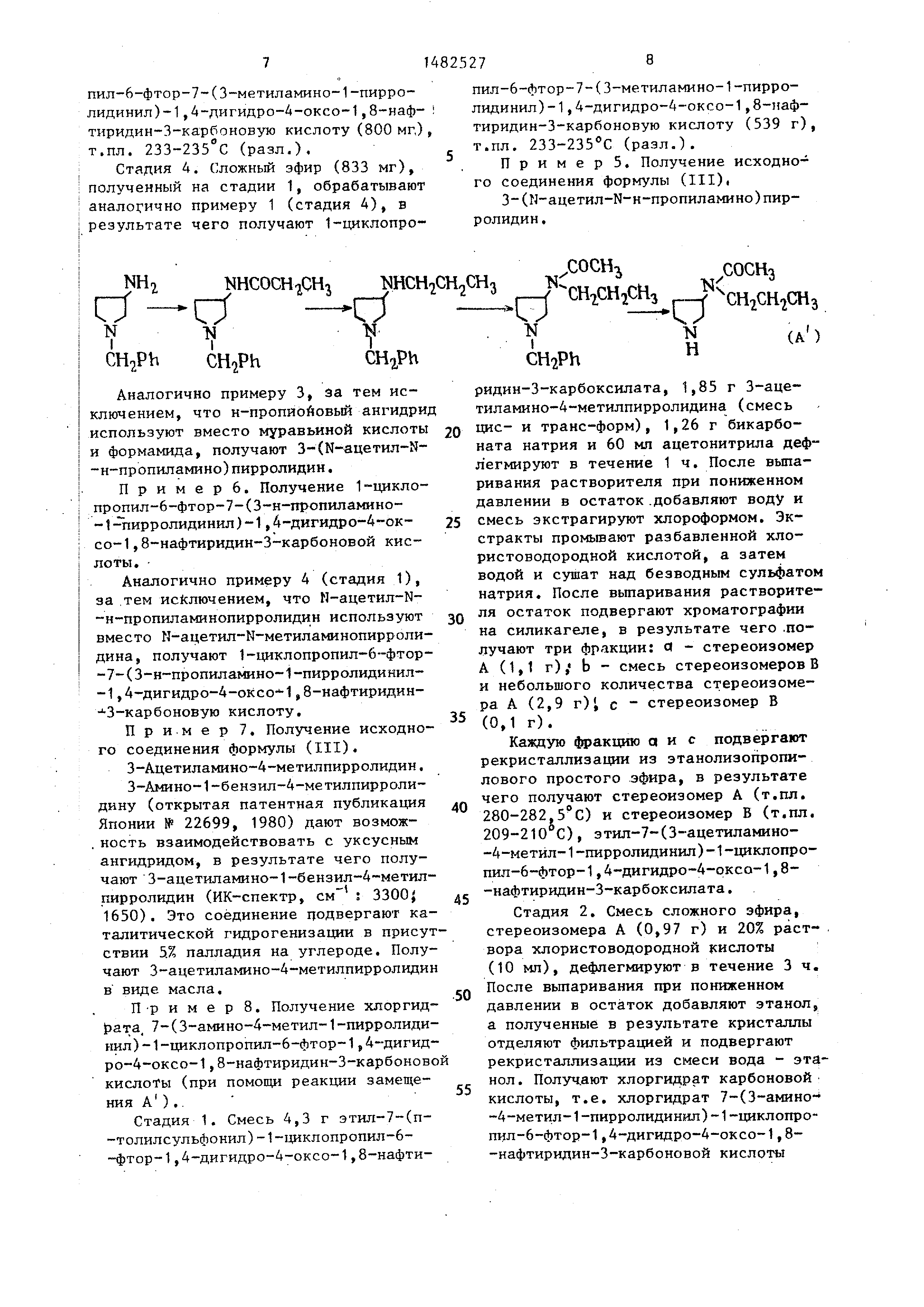
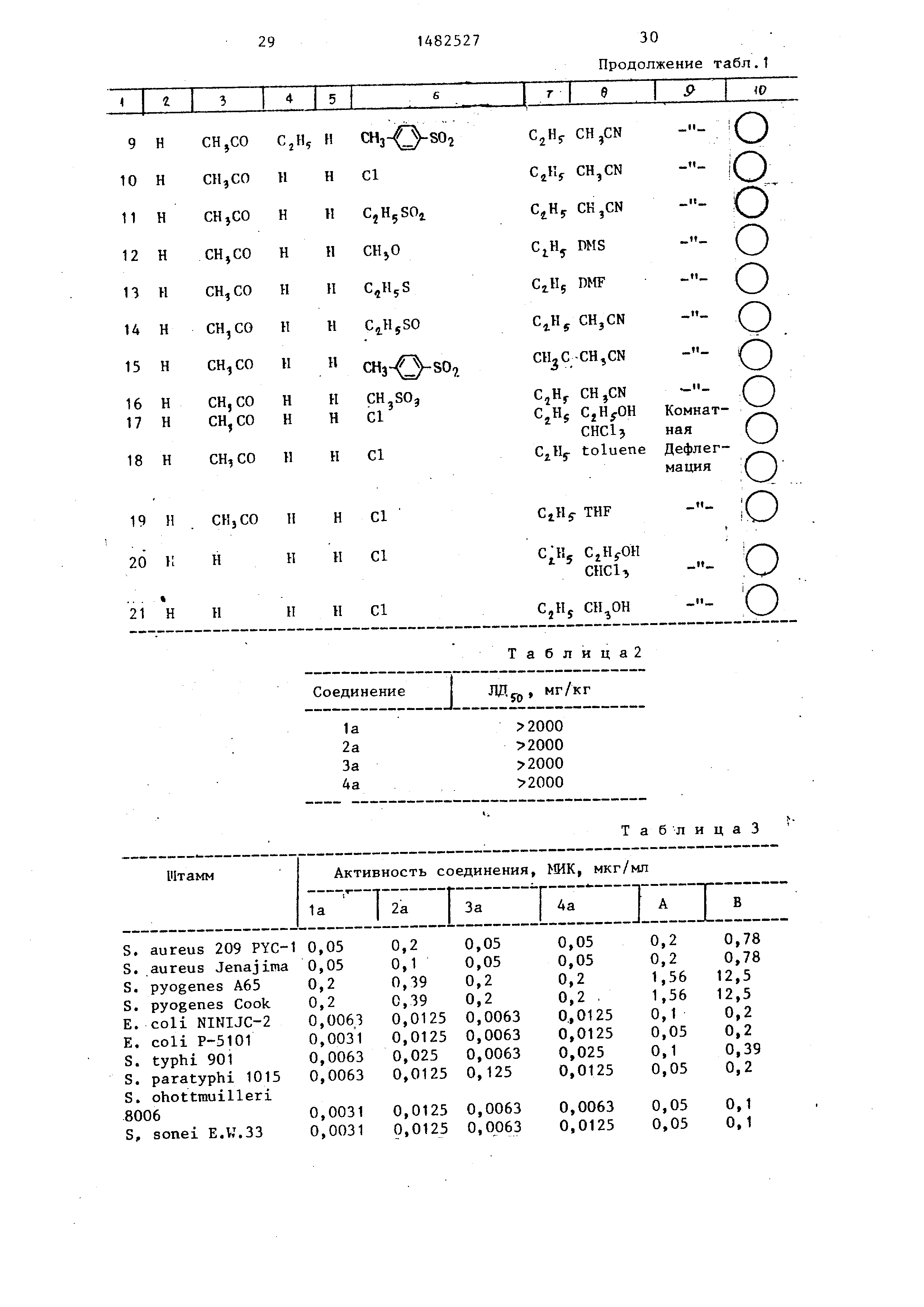
Аналогично примеру 3, за тем исключением , что н-пропйоновый ангидрид
используют вместо муравьиной кислоты и формамида, получают 3-(М-ацетил-Я- -н-пропиламино)пирролидин.
Пример 6. Получение 1 цикло- пропил-6-фтор-7-(3-н-пропиламино-
-1-пирролидинил)-1,4-дигидро-4 ок- со-1,8-нафтиридин-З-карбоновой кислоты .
Аналогично примеру 4 (стадия 1), за тем исключением, что Н-ацетил-N-
-н-пропиламинопирролидин используют вместо К-ацетил-М-метиламинопирроли-
дина, получают 1-циклопропил-6--фтор- -7-(3-н-пропиламино-1-пирролидинил-
-1,4-дигидро-4-оксо-Ч ,8-нафтиридин- З-карбоновую кислоту.
Пример 7. Получение исходного соединения формулы (III).
3-Ацетиламино-4-метилпирролидин. 3-Амино-1-бензил-4-метилпирроли- дину (открытая патентная публикация
Японии № 22699, 1980) дают возмож- . ность взаимодействовать с уксусным
ангидридом, в результате чего получают 3-ацетиламино-1-бензил-4-метил-
пирролидин (ИК-спектр, s 3300J 1650). Это соединение подвергают каталитической
гидрогенизации в присутствии 5% палладия на углероде. Получают З-ацетиламино-4-метилпирролидин
в виде масла.
Пример 8. Получение хлоргид-
рата, 7-(З-амино-4-метил-1-пирролиди- нил)-1-циклопропил-6-фтор-1,4-дигид-
ро-4-оксо-1,8-нафтиридин-З-карбоново кислоты (при помощи реакции замещения А1 ) .
Стадия 1. Смесь 4,3 г этил-7-(п- -толилсульфонил)-1-циклопропил-6-
-фтор-1,4-дигидро-4-оксо-1,8-нафти0
5
0
5
0
5
0
5
ридин-3-карбоксилата, 1,85 г 3-аце- тиламино-4-метилпирролидина (смесь
цис- и транс-форм), 1,26 г бикарбоната натрия и 60 мл ацетонитрила деф-
л егмируют в течение 1 ч. После выпаривания растворителя при пониженном
давлении в остаток добавляют воду и смесь экстрагируют хлороформом. Экстракты
промывают разбавленной хлористоводородной кислотой, а затем водой и сушат над безводным сульфатом
натрия. После выпаривания растворителя остаток подвергают хроматографии
на силикагеле, в результате чего .получают три фракции: о - стереоизомер
А (1,1 г),« b - смесь стереоизомеров В и небольшого количества стереоиэоме-
раА (2,9 г)1 с стереоизомер В (0,1 г).
Каждую фракцию а и с подвергают
рекристаллизации из этанолизопропи- лового простого эфира, в результате
чего получают стереоиэомер А (т.пл. 280-282,5°С) и стереоизомер В (т.пл.
209-210 С), этил-7-(3-ацетиламино- -4-метил-1-пирролидинил)-1-циклопро-
пил-6-фтор-1,4-дигидро-4-оксо-1,8- -нафтиридин-3-карбоксилата.
Стадия 2. Смесь сложного эфира, стереоизомера А (0,97 г) и 20% раствора хлористоводородной кислоты
(10 мл), дефлегмируют в течение Зч. После выпаривания при пониженном
давлении в остаток добавляют этанол, а полученные в результате кристаллы
отделяют фильтрацией и подвергают рекристаллизации из смеси вода - этанол
. Получают хлоргидрат карбоновой кислоты, т.е. хлоргидрат 7-(3-амино-ф
-4-метил-1-пирролидинил)-1-циклопро- пил-6-фтор-1,4-дигидро-4-оксо-1,8-
-нафтиридин-3-карбоновой кислоты
(0,57 г), соответствующий стереоизо- меру А, т.пл. 234-23Я°С (разл.).
ЯМР (ОгО),Р : 1,32 (311,д, J - 7 Гц СН)-, 7,42 (1Н, д, J 13 Гц, Су-Н); 8,АО (1Н,с,С4-Н).
Стадия 3. Фракцию Ь, полученную на стадии 1 (2,9 г), обрабатывают
аналогично стадии 2. Получают хлор- гидрат 7-(3-амино-4-метил-1-пирроли-
динил)-1-циклопропил-6-фтор-1,4-ди- гидро-4-оксо-1,8-нафтиридин-З-карбо-
новой кислоты (2,02 г), т.пл. 270- 278°С (разл.).
ЯМР (D40), У : 1,32 (ЗН, д, J 7 Гц, С1Ц), 7,38 (1Н, д, Jf 13 Гц, C5-H)J 8,41 (1Н, с, Сг-Н).
Полученное соединение является смесью стереоизомеров А (6%) и В
(94%) хлоргидратов карбоновой кислоты , при этом для исследования используют
методы жидкостной хроматографии под высоким давлением.
Пример 9. Получение исходного соединения формулы (III).
З-Ацетиламино-2-метилпирролидин.
3-Амино-1-бензил-2-метилпирроли-
дину (открытая патентная публикация Японии № 22699, 1980) дают возможность
взаимодействовать с уксусным ангидридом, в результате чего получают 3-ацетиламино-1-бензил-2-метил-
пирролидин, т.пл. 51-54 С. Это соединение подвергают каталитической
гидрогенизации в присутствии 5% палладия на углероде, получая 3-ацетил-
амино-2-метилпирролидин в виде масла
Пример 10. Получение хлоргидрата
7-(3-амино-2-метил-1-пирролиди- нил)-1-циклопропил-6-фтор-1,4-дигид-
ро-Д-оксо-1,8-нафтиридин-З-карбоно- вой кислоты (реакция замещения А ).
Аналогично примеру 8,(стадия 1), за тем исключением, что 3-ацетилами-
но-2-метилпирролидин используют вместо З-ацетиламино-4-метилпирролидина
получают хлоргидрат 7-(3-амино-2-ме- тил-1-пирролидинил)-1-циклопропил-
-6-фтор-1,4-дигидро-4-оксо-1,8-наф- тиридин-3-карбоновой кислоты, стерео
изомер А (3/2 гидрат), т.пл. 215- 217°С.
ЯМР стереоизомера A (NaOD - ),
8: 1,03 (ЗН; д, J 6 Гц, СИ,); 7,63 (1Н, д, J 13 Гц, С,-Н); 8,32 (1Н, с, Сг-Н).
Получают также смесь стереоизомеров А и В (3/2 гидрат), т.пл. 276-
280°С (разл.), причем А:В 1:4, что
5
0
5
0
5
0
5
0
5
устанавливают методом жидкостной хроматографии
при высоком давлении.
ЯМР стереоизомера В (NaOD - ),
5 8: 1,17 (ЗН, д, J 6 Гц, СИ,), 7,75 (1Н, д, J 13 Гц, ); 8,33 (111, с, С4-Н).
Пример 11. Получение исходного соединения формулы (III): 4-Ацетиламино-2-метилпирролидин.
Аналогично примеру 9, за тем исключением , что 4-амино-1-бензил-2-ме-
тилпирролидин используют вместо 3-амино-1-бензил-2-метилпирролидина,
получают 4-ацетиламино-2-метилпирро- лидин.
Пример 12. Получение хлоргид-1
рата 7-(4-амино-2-метил-1-пирролидинил ) - 1-циклопропил-6-фтор-1,4-дигид-
ро-4-оксо-1,8-нафтиридин-З-карбоно- вой кислоты (при помощи реакции замещения А ) .
Аналогично примеру 8 (стадия 1), за тем исключением, что 4-ацетилами-
но-2-метилпирролидин используют вместо З-ацетиламино-4-метилпирролидина,
получают хлоргидрат 7-(4-амино-2-ме- тил-1-пирролидинил)-1 -циклопропил-
-6-фтор-1,4-дигидро-4-оксо-1,8-нафти- ридин-3-карбоновой кислоты, стерео-
изомер А (5/4 гидрат), т.пл. 263- 267°С (разл.).
ЯМР стереоизомера A (NaOD - ) , J: 1,29 (ЗН, д, J 6 Гц, СИ,), 7,74
(111, д, J 13 Гц, Су-Н); 8,39 (1Н, с, С2-Н).
Получают также смесь стереоиэоме- ров А и В (2 гидрат), т.пл. 205-
208°С и 241-244°С (разл.), причем А:В 3:2, что устанавливают методами
жидкостной хроматографии при высоком давлении.
ЯМР стереоизомера В (NaOD - D20), fl: 1,28 (ЗН, д, J 6 Гц, СН,У, 7,70
(1Н, д, J 13 Гц, С5-Н), 8,39 (1Ы, с, С4-Н).
Пример 13. Получение исходного
материала формулы (III).
3-Ацетиламино-З-метилпирролидин.
1-Бензил-З-пирролидину дают возможность взаимодействовать с йодидом
метилмагния, в результате чего получают 1-бензил-3-окси-З-метилпирроли-
дин в виде масла, т.кип. 106°С (0,5 мм рт.ст.). Это соединение обрабатывают
смесью ацетонитрила и концентрированной серной кислоты при охлаждении
льдом, получая 3-ацетиламино- 1-бензил-3-метилпирролидин, т.пп.
105-106°C. Это соединение подвергают каталитической гидрогенизации в
присутствии 5% палладия на углероде, и получают З-ацетиламино-3-метилпир- ролидин в виде масла.
Пр-имер 14. Получение хлор- гидрата 7-(З-амино-3-метил-1-пирро-
лидинил)-1-циклопропил-6-фтор-194-ди- гидро-4-окоо-1,8-нафтиридин-З-карбо-
новой кислоты (реакция замещения А1).
Аналогично примеру 8 (стадия 1),
за тем исключением, что 3-ацетилами- но-3-метилпирролидин используют вмес
CHi NHCHO СН3 МНСН3
О - ч
N
CH2Ph СНгРИ
CH,Ph
Аналогично примеру 3, за тем исключением , что 3-амино- 1-бензил-4-ме
тилпирролидин (открытая патентная публикация Японии №.22699, 1980) ис-
пользуют вместо З-амино-1-бензилпир- ролидина, получают 3-(М-ацетил-Н-ме- тиламино)-4-метилпирролидин.
Пример 16. Получение хлоргид рата 1-циклопропил-6-фтор 7-(4-ме-
тил-3-метиламино-1-пирролидинил)-1, 4-дигидро-4-оксо-1,8-нафтиридин-З-
-карбоновой кислоты (при помощи реакции замещения А ).
Аналогично примеру 8 (стадия 1) за тем исключением, что 3-(М-ацетил
-N-метиламино)-4-метилпирролидин используют вместо 3-ацетиламино-4-ме-
тилпирролидина, получают хлоргидрат 1--циклопропил-6-фтор-7-(4-метил-3-ме
тиламино-1-пирролидинил)-1,4-дигид- ро-4-оксо-1,8-нафтиридин-З-карбоно-
вой кислоты (5/4 гидрат), т.пл. 258- 277°С (разл.).
ЯМР (NaOD - ВгО), 8 : 1,07 (ЗН, д, J 7 Гц, СН)} 2,34 (ЗН, с, J, СН) 7,52 (1Н, д, J 13 Гц, Су-Н).
Пример 17. Получение исходного соединения формулы (III).
З-Ацетиламино-4-этилпирролидин.
Аналогично примеру 7, за тем исключением
, что 3 амино-1-бензил-4- -этилпирролидин используют вместо 3-амино-1-бензил-4-метилпирролидина,
получают З-ацетиламино-4-этилпирро-
ЛИДИИ.
Пример 18. Получение хлоргидрата 7-(3-амино-4-этил-1-пирролидито З-ацетиламино-4-метилпирролидина, получают хлоргидрат 7-(3-амино-3-ме-
тил-1-пирролидинил)-1-циклопропил-6- -фтор-1,4-дигидро-4-оксо-1,8-нафти-
ридин-3-карбоновой кислоты (5/4 гидрат ), т.пл. 285-287°С (разл.).
ЯМР (D40),5: 1,74 (ЗН, с, СН,), 7,45 (1Н, д, J 13 Гц, Cf-H){ 8,42 (1И, с, С4-Н).
Пример 15. Получение исходного соединения формулы (III).
3-(Н-Ацетил-М-метиламино)-4-метш1- пирролидин.
СН3 СН3 N C°°CH3
+
N CH2Ph
k
N
Н
нил)-1-циклопропил-6-фтор-1,4-дигид-
ро-4-оксо-1,8-нафтиридин-З-карбоно- вой кислоты (при помощи реакции замещения А).
Аналогично примеру 8 (стадия 1), за тем исключением, что 3-ацетилами-
но-4-этилпирролидин используют вместо З-ацетиламино-4-метилпирролидина,
получают хлоргидрат 7-(3-амино-4- -этил-1-пирролидинил)-1-циклопропил-
-6-фтор-1,4-дигидро-4-оксо-1,8-нафти ридин-3-карбоновой кислоты, т.пл. 232-237°С (разл.).
ЯМР (NaOD - ПаО), J : 0,95 (ЗН, т, J « 7 Гц, -CHjp-CH,); 1,66 (2Н, кв.,
J 7 Гц, -СНгСНз); 7,55 (1Н, д, J 13 Гц, Cf-H), 8,33 (1Н, с, Сг-Н)
Пример 19. Получение исходного соединения формулы (II).
Этил-7-хлор-1-циклопропил-6-фтор- -1,4-дигидро-4-оксо-1,8-нафтиридин- -3-карбоксилат.
I
Стадия 1. 2,6-Дихлор-5-фторникоти- нонитрил (60 г) в концентрированной
серной кислоте нагревают до 65-75 С и выдерживают при этой температуре
в течение 1 ч. В реакционную смесь добавляют воду, а затем эту смесь нагревают
до 100-110°С и выдерживают при этой температуре в течение 2 ч,
в результате чего получают 2,6-ди- хлор-5-фторникотиновую кислоту (59,8 г), т.пл. 155-156°С.
Стадия 2. Полученное соединение обрабатывают тионилхлоридом, получая
2,6-дихлор-5-фторникотиноилхлорид (47,5 г) в виде масла.
Стадия 3. В сухом простом эфире полученному соединению дают возможность взаимодействовать с диэтилэток
симагниймалонатом, в результате чего получают диэтил-2,6-дихлор-6-фторни-
котиноил-малонат в виде масла. В полученное масло добавляют воду и каталитическое
количество п-толуол(моно) сульфокислоты, затем смесь нагревают
до 140°С и выдерживают при этой температуре в течение 2 ч, в результате
чего получают этил-3-(2,6-дихлор-5- -фторпиридин-3-ил)-3-оксопропионат (46 г), т.пл. 69-70°С.
Стадия 4. Полученное соединение (40 г) обрабатывают этилортоформиато
и уксусным ангидридом, в результате чего получают этил-2-(2,6-дихлор-5-
-фторникотиноил)-3-этоксиакрилат (42 г) в виде масла.
Стадия 5. Полученному соединению в этаноле дают возможность взаимодействовать
с циклопропиламином, в результате чего получают этил-2-(2,6- -дихлор-5-фторникотиноил)-3-циклопро
пиламиноакрилат (42,4 г), т.пл. 129- 130°С.
Стадия 6. В сухом диоксане полученному соединению (21 г) дают воз-
можность взаимодействовать с трет,- бутилатом калия, в результате чего
получают этил-7-хлор-1-циклопропил- -6-фтор-1,4-дигидро-4-оксо-1,8-наф-
тиридин-3-карбоксилат (17,5 г), - т.пл. 176-у8°С.
Исходный материалы формулы (II), которые имеют какие-либо заместители
(-COOY) в третьей позиции своего кольца нафтиридина, отличные от -СООСгНу, также могут быть получены
при помощи описанных процедур.
Пример 20. Получение исходного
соединения формулы (II).
Этил-7-хлор-1-циклопропил-6-фтор-
-1,4-дигидро-4-оксо-1,8-нафтиридин- -3-карбокснлат,
В сухом диоксане 2,6-дихлор-5- -фторннкотиноилхлориду, полученному
по примеру 19 (стадия 2), дают воз- можность взаимодействовать с этил-(Ь-
циклопропиламиноакрилатом в присутствии триэтиламина, в результате чего получают этил-2-(2,6-дихлор-
-5-фторникотиноил)-3-циклопропилами- ноакрилат, т.пл. 129-130°С.
Это соединение обрабатьшают в сухом диоксане трет.-бутилатом калия, в результате чего получают этил-7-
-хлор-2-циклопропил-6-фтор-1 4-дигид- ро-4-оксо-1,8-нафтиридин-З-карбокси-
лат, т.пл. 176-178 С,.
Исходные материалы формулы (II),
которые имеют какие-либо заместители (-COOY) в третьей позиции своего кольца нафтиридина, отличные от
-COOC Hj, могут быть также получены при помощи описанных процедур.
Пример 21. Получение хлоргидрата 7-(3-амино-1-пирролидинил)-1- -циклопропил-6-фтор-1,4-ДИГИДРО-4-ОК-
со-1,8-нафтиридин-З-карбоновой кислоты (при помощи реакции замещения А ).
Смесь этил-7-хлор-1-циклопропил- -6-фтор-1,4-дигидро-4-оксо-1,8-нафти-
ридин-3-карбоксилата (1,24 г), 3-аце- тиламинопирролидина (563 мг), бикарбоната
натрия (437 мг) и ацетонитри- ла (40 мл) дефлегмируют в течение
30 мин. После выпаривания до сухого состояния при пониженном давлении в
остаток добавляют воду. Полученные в результате кристаллы отделяют фильтрацией
и подвергают их рекристаллизации из смеси этанол - изопропило- вый простой эфир, получая этил-7-
-(3-ацетиламино-1-пирролидинил)-1-ЦИКЛОПрОПИЛ-6-фТОр-1 ,4-ДИГИДРО-4-ОКсо-1
,8-нафтиридин-З-карбоксилат (1,5 г), т.пл. 246-248вС.
В табл. 1 представлены данные условий проведения реакций по примерам 1-21.
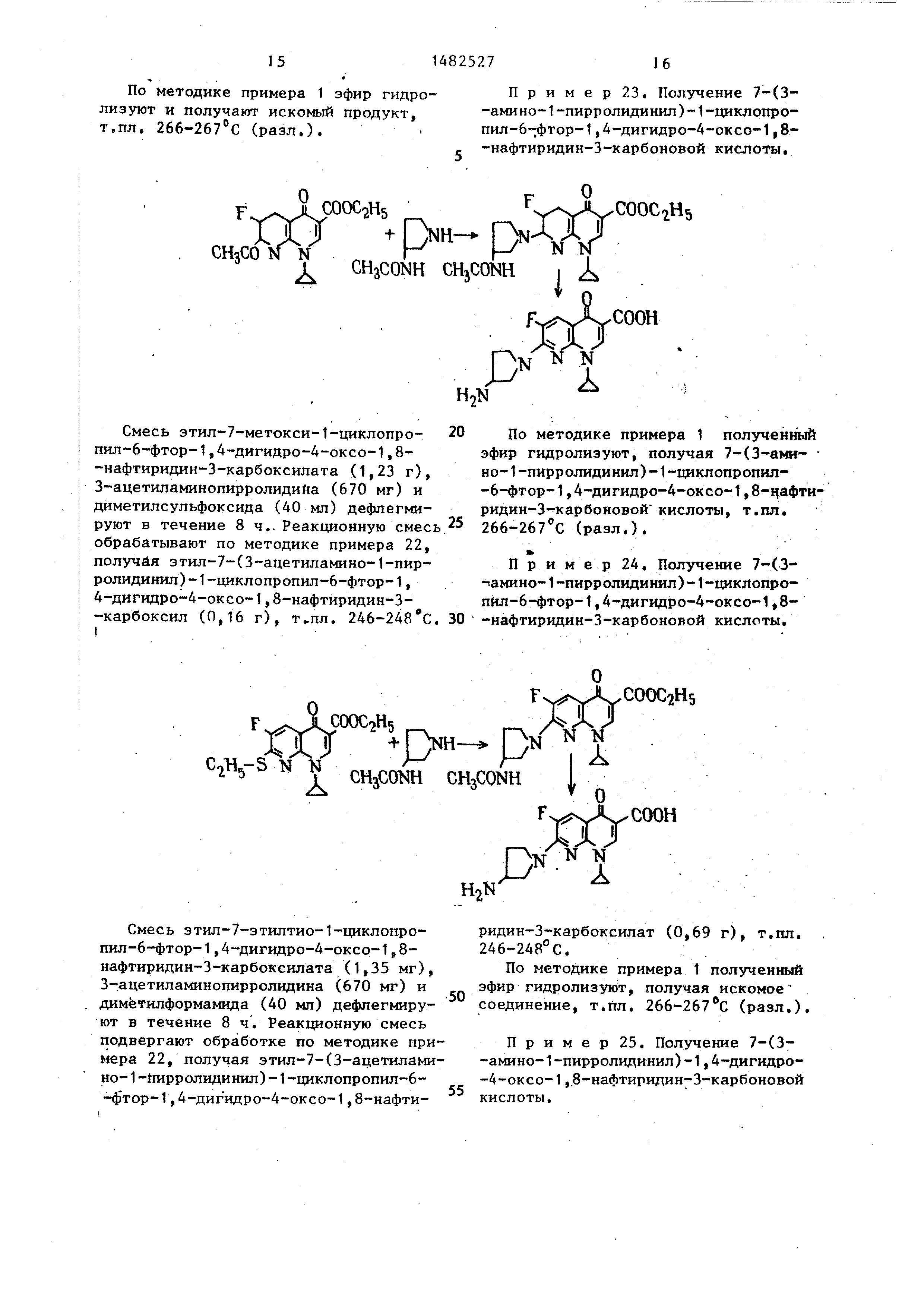
Пример 22. Получение 7-(3- -амино-1-пирролидинил)-1-циклопро- пил-6-фтор-1,4-дигидро-4-оксо-1,8-
-нафтиридин-3-карбоновой кислоты (при помощи реакции замещения А ).
Смесь этил-7-этилсульфонил 1-цик- лопропил-6-фтор-1,4-дигидро-4-ок-
со-1,8-нафтиридин-З-карбоксилата (1,47. г), 3-ацетиламинопирролидина
(670 мг), триэтиламина (522 мг) и ацетонитрила (40 мл) дефлегмируют в
течение 1 ч. После выпаривания до сухого состояния при пониженном давлении
в остаток добавляют воду. Полученные в результате кристаллы отделяют
фильтрацией и подвергают их рекристаллизации из смеси этанол - изо-
пропиловый простой эфир, получая . этил-7-(3-ацетиламино-1-пирролиди-
нил)-1-циклопропил-6-фтор-1,4-дигид- ро-4-оксо-1,8-нафтиридин-З-карбокси-
лат (1,29 г), т.пл. 246-248°С.
По методике примера 1 эфир гидролиз уют и получают искомый продукт, т.пл. 266-267°С (разл.).
О
О
Р 1 соос2н5Fv sAv
JgQr , p.- ХХХ
A СНЈОЩ CH3CONH I А
Смесь этил-7-метокси-1-циклопро- пил 6-фтор-1,4-дигидро-4-оксо-1,8-
-нафтиридин-3-карбоксилата (1,23 г), 3-ацетиламинопирролидина (670 мг) и
диметилсульфоксида (40 мл) дефлегми- руют в течение 8 ч.. Реакционную смесь
обрабатывают по методике примера 22, получая этил-7-(3-ацетиламино-1-пирролидинил
) -1-циклопропнл-6-фтор-1, 4-ДИГИДРО-4-ОКСО-1,8-нафтиридин-З- -карбоксил (0,16 г), . 246-248 с.
N N
А
Гх ДуСООСаНз
к РЛ
CHjCOKH CH3CONH |
,-v
if +RNH
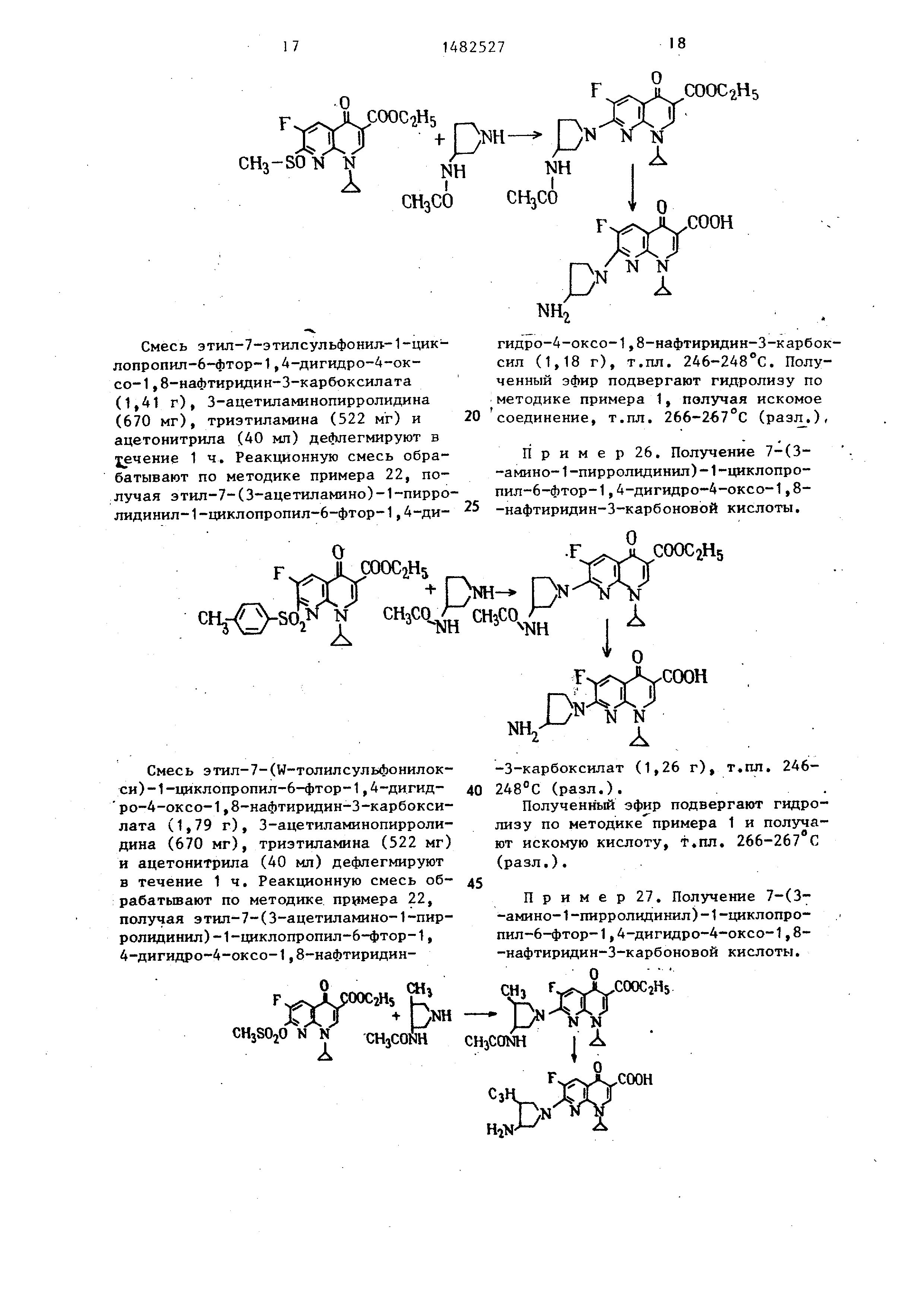
Смесь этил-7-этилтио-1-циклопро- пил-6-фтор-1,4-дигидро-4-оксо-1,8-
нафтиридин-3-карбоксилата (1,35 мг), 3-ацетиламинопирролидина (670 мг) и
димётилформамида (40 мл) дефлегмиру- ют в течение 8 ч. Реакционную смесь
подвергают обработке по методике примера 22, получая этил-7-(3-ацетилами-
но-1-пирролидинил)-1-циклопропил-6- -ф тор-1,4-дигидро-4-оксо-1,8-нафтиП р и м е р 23. Получение 7-(3- -амино-1-пирролидинил)-1-циклопро- пил-6-фтор-1,4-дигидро-4-оксо-1,8-
нафтиридин-3-карбоновой кислоты
О
Av
Х
COOC2H5
F ycooH
По методике примера 1 полученный эфир гидролизуют, получая 7-(3-ами-
но-1-пирролидинил)-1-циклопропил- -6-фтор-1,4-дигидро-А-оксо-1,8-цафти-
ридин-3-карбоновой кислоты, т.пл. 266-267°С (разл.).
Пример 24. Получение 7-(3- -;амино-1 -пирролидинил) -1 -циклопро-
пйл-6-фтор-1,4-дигидро-4-оксо-1,8- -нафтиридин-3-карбоновой кислоты.
О
HoN
A
ридин-3-карбоксилат (0,69 г), т.пл. 246-248°С.
По методике примера 1 полученный эфир гидролизуют, получая искомое
соединение, т.пл. 266-267вС (разл.).
Пример 25. Получение 7-(3-
-амино-1-пирролидинил)-1,4-дигидро- -4-оксо-1,8-нафтиридин-З-карбоновой кислоты.
0F.JICOOC2H5
роос2н5rvAAjT
-i- JNH- LJN N N
NHNHI
CH3COCH3COI 0
FxJsi.COOH
JJ
pr«i
шг
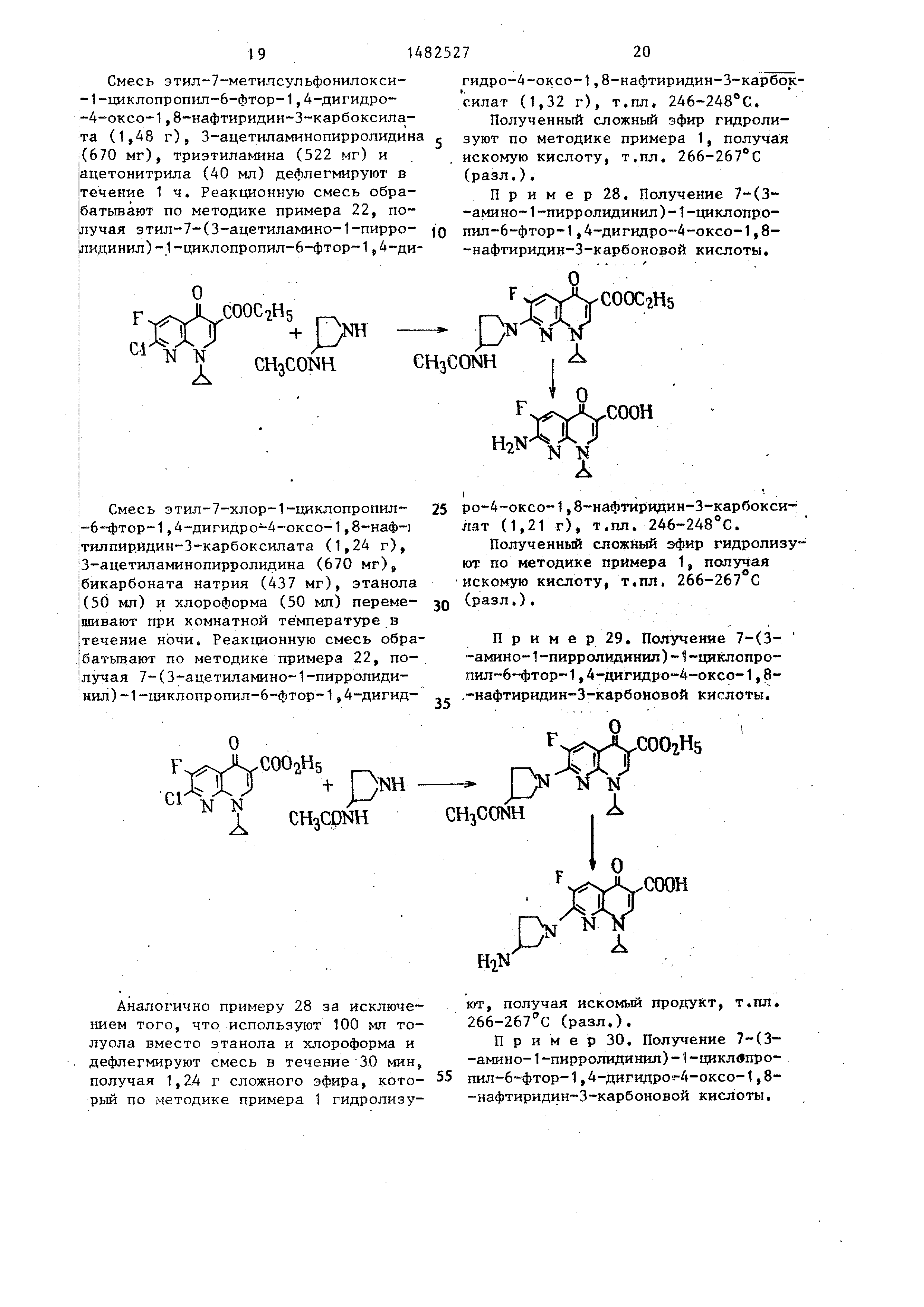
Смесь этил-7-этилсульфонил--1-цик- лопропил-6-фтор-1,4-дигидро-4-ок- со-1,8-нафтиридин-З-карбоксилата
(1,41 г), 3-ацетиламинопирролидина (670 мг), триэтиламина (522 мг) и
ацетонитрила (40 мл) дефлегмируют в речение 1 ч. Реакционную смесь обрабатывают
по методике примера 22, получая этил-7-(3-ацетиламино)-1-пирро лидинил-1-циклопропил-6-фтор-1,4-ди-
СООСгН5
DNHI ГН.1
- Г
I CH CHjCO
Смесь этил-7-(W-толилсульфонилок- си)-1-циклопропил-6-фтор-1,4-дигид-
ро-4-оксо-1,8-нафтиридин-З-карбоксилата (1,79 г), 3-ацетиламинопирролидина
(670 мг), триэтиламина (522 мг) и ацетонитрила (40 мл) дефлегмируют
в течение 1 ч. Реакционную смесь обрабатывают по методике примера 22,
получая этил-7-(3-ацетиламино-1-пирролидинил ) - 1 -циклопропил-6-фтор- 1 ,
4-дигидро-4-оксо-1,8-нафтиридин йсУ000
CH3S0204N N ШзС
А
СНг
PNH
Ш3СОКН
гидро-4-оксо-1,8-нафтиридин-З-карбок- сил (1,18 г), т.пл. 246-248°С. Полученный
эфир подвергают гидролизу по методике примера 1, получая искомое
соединение, т.пл. 266-267°С (раэл.),
Пример 26. Получение 7-(3-
-амино-1-пирролидинил)-1-циклопро- пил-6-фтор-1,4-дигидро-4-оксо-1,8-
-нафтиридин-3-карбоновой кислоты.
COOCZHS
DNHI
ГН.1
CHjC
FviOVCOOH
пОЭСУ
ш N I
-3-карбоксилат (1,26 г), т.пл. 246248°С (разл.).
Полученный эфир подвергают гидролизу по методике примера 1 и получают
искомую кислоту, т.пл. 266-267 С (разл.).
Пример 27. Получение 7-(3-
-амино-1-пирролидинил)-1-циклопро- пил-6-фтор-1,4-дигидро-4-оксо-1,8-
-нафтиридин-3-карбоновой кислоты.
ЈООС2Н5
-C %-COWI
CH3CONHI A
Смесь этил-7-метилсульфонилокси- -1-циклопропил--6-фтор-1,4-дигидро-
-4-ОКСО-1,8-нафтиридин-З-карбоксила- та (1,48 г), 3-ацетиламинопирролидина
(670 мг), триэтиламина (522 мг) и |ацетонитрила (40 мл) дефлегмируют в
течение 1 ч. Реакционную смесь обрабатывают по методике примера 22, получая
этил-7-(3-ацетиламино-1-пирролидинил ) -1-циклопропил-6-фтор-1,4-ди
О
rxv
1 N К
А
,СООС2Н5
СН3СОШ
О
F Y Vy С00ед
rv. А. A J
-- /Ъ N N
CH3CONH|
«г О
Fv 4-COOH
«2N N N
А
Смесь этил-7-хлор-1-циклопропил-
-6-фтор-1,4-дигидро-4 оксо-1,8-наф-1 тилпиридин-3-карбоксилата (1,24 г),
3-ацетиламинопирролидина (670 мг), бикарбоната натрия (437 мг), этанола
(50 мл) и хлороформа (50 мл) перемешивают при комнатной температуре в
течение ночи. Реакционную смесь обра- |батьшают по методике примера 22, по-
лучая 7-(З-ацетиламино-1-пирролидинил ) -1-циклопропил-6-фтор-1,4-дигидFYWC°°2H5 ГЛ
XX У + Пш
ЪГ N
CH3CDNH
С1
Аналогично примеру 28 за исключением
того, что используют 100 мл толуола вместо этанола и хлороформа и
дефлегмируют смесь в течение 30 мин, получая 1,24 г сложного эфира, кото-
рый по методике примера 1 гидролизу
гидро-4-оксо-1,8-нафтиридин-3-карбок-
силат (1,32 г), т.пл. 246-248°С.
Полученный сложный эфир гидроли-
зуют по методике примера 1, получая искомую кислоту, т.пл. 266-267еС (разл.).
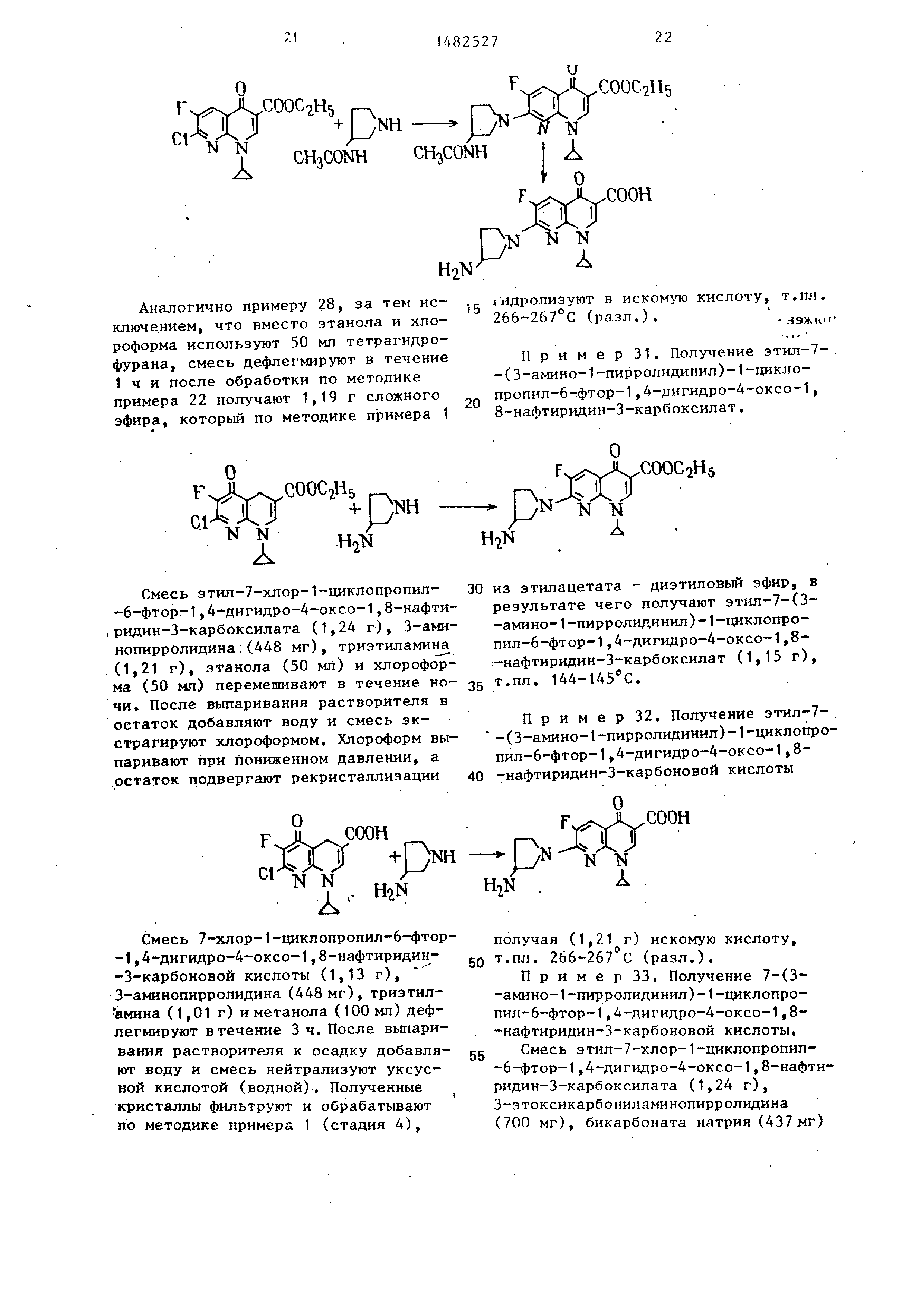
П р и м е р 28. Получение 7-(3- -амино-1-пирролидинил)-1-циклопро- пил-6-фтор-1,4-дигидро-4-оксо-1,8-
-нафтиридин-3-карбоновой кислоты.
Г
О
F Y Vy С00ед5
rv. А. A J
ро-4-оксо-1,8-нафтиридин-3-карбокси лат (1,21 г), т.пл. 246-248°С.
Полученный сложный эфир гидролизу- ют по методике примера 1, получая
искомую кислоту, т.пл. 266-267 С
(разл.).
Пример 29. Получение 7-(3- -амино-1-пирролидинил)-1-циклопро- пил-6-фтор-1,4-дигидро-4-оксо-1,8-
-нафтиридин-3-карбоновой киглоты.
CH3CONH
P.VV
-СООгН5
стон
А
ют, получая искомый продукт, т.пл. 266-267°С (разл.).
П р и м е р 30, Получение 7-(3- -амино-1-пирролидинил)-1-циклвпро-
пил 6-фтор-1,4-дигидро-4-оксо-1,8- -нафтиридин-3-карбоновой кислоты.
.СООС2Н5
Р
:ш - Г}1 3
CHaCONH СНЭСОШ| А
Аналогично примеру 28, за тем ис- 1(. идропизуют в искомую кислоту, т.пл.
266-267°С (разл.).
ключением, что вместо этанола и хлороформа используют 50 мл тетрагидро-
фурана, смесь дефлегмируют в течение 1 ч и после обработки по методике
примера 22 получают 1,19 г сложного
266-267°С (разл.).
20
Пример 31. Получени -(3-амино-1-пирролидинил)-1
пропил-6-фтор-1,4-ригидро-4
эфира, который по методике примера 1 8-нафтиридин-З-карбоксилат.
FvVvrCOOC2H5
Р™
N ҐH2N
A.
Смесь этил-7-хлор-1-циклопропил-
-6-фтор-1,4-дигидро-4-оксо-1,8-нафти- ридин-3-карбоксилата (1,24 г), 3-ами-
нопирролидина (448 мг), триэтиламина. (1,21 г), этанола (50 мл) и хлороформа
(50 мл) перемешивают в течение ночи . После выпаривания растворителя в
остаток добавляют воду и смесь экстрагируют хлороформом. Хлороформ выпаривают
при пониженном давлении, а остаток подвергают рекристаллизации
О
rJL Р1ХХ7
NN
А
соон
С1
+PNH
H2N
Смесь 7-хлор-1-циклопропил-6-фтор -1,4-дигидро-4-оксо-1,8-нафтиридин- -3-карбоновой кислоты (1,13 г),
3-аминопирролидина (448мг), триэтил- амина (1,01 г) и метанола (100мл) дефлегмируют
в течение 3 ч. После выпаривания растворителя к осадку добавляют воду и смесь нейтрализуют уксусной
кислотой (водной). Полученные кристаллы фильтруют и обрабатывают по методике примера 1 (стадия 4),
СООС2Н5
соон
H2N
р
идропизуют в искомую кислоту, т.пл.
266-267°С (разл.).
Пример 31. Получение этил-7-
-(3-амино-1-пирролидинил)-1-цикло- пропил-6-фтор-1,4-ригидро-4-оксо-1,
8-нафтиридин-З-карбоксилат.
о
H2N
Fv: 1V COOC2H5
I J
1/N-N К
А
из этилацетата - диэтиловый эфир, в
результате чего получают этил-7-(3 -амино-1-пирролидинил)-1-циклопро-
пил-6-фтор-1,4-дигидро-4-оксо-1,8- -нафтиридин-3-карбоксилат (1,15 г),
т.пл. 144-145еС.
Пример 32. Получение этил-7-
-(3-амино-1-пирролидиннл)-1-циклопропил-6-фтор-1 ,4-дигидро-4-оксо-1,8-
-нафтиридин-3-карбоновой кислоты
О
с:
N N
Л
соон
получая (1,21 г) искомую кислоту,
т.пл. 2Ь6-267 С (разл.).
Пример 33. Получение 7-(3- -амино-1-пирролидинил)-1-циклопро- пил-6-фтор-1,4-дигидро-4-оксо-1,8-
-нафтиридин-3-карбоновой кислоты.
Смесь этил-7-хлор-1-циклопропил-
-6-фтор-1,4-дигидро-4-оксо-1,8-нафтн- ридин-3-карбоксилата (1,24 г),
3-этоксикарбониламинопирролидина (700 мг), бикарбоната натрия (437 мг)
и 40 мл ацетонитрила кипятят с обратным холодильником в течение 30 мин.
После выпаривания досуха при пониженном давлении к остатку добавляют во-
ду. Осадок отфильтровывают. Суспензию полученного таким образом соединения
в 10%-ной гидроокиси натрия (20 мл) кипятят с обратным холодильником в
течение 5 ч при перемешивании. Полу- jg ченный раствор охлаждают и устанавливают
рН 7-8 10%-ной уксусной кислотой . Осадок собирают, промывают водой и сушат до получения 7-(3-ами-
но-1-пирролидинил)-1-циклопропил- 15 6-фтор-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновой
кислоты (710 мг),
т.пл. 266-267 С (разл.).
П р и м е р 34. Получение 7(3-амино-1-пирролидинил )-1-циклопро- 20 пил-6-фтор-1,4-дигидро-4-оксо-1,8-
-нафтиридин-3-карбоновой кислоты., . Смесь этил-7-хлор-1.-циклопропил-
-6-фтор-1,4-дигидро-4-оксо-1,8-наф- тиридин-3-карбоксилата (1,24 г), 25
3-трифторацетиламинопирролидина (2,18 г) и 50 мл ацетонитрила кипятят
с обратным холодильником в течение 1 ч. После выпаривания досуха
при пониженном давлении к остатку до-™ бавляют воду. Остаток собирают. Смесь
полученного таким образом соединения и 4%-ной гидроокиси натрия (40 мл)
нагревают при 40-50 С в течение 1 ч при перемешивании, а затем охлаждают
, устанавливают рИ раствора 7-8 10%-ной уксусной кислотой. Осадок
собирают, промывают водой и сушат до получения 7-(3-амино-1-пирролидинил)-
-1-циклопропил-6-фтор-1„4-дигидро- -4-оксо-1,8-нафтиридин-З-карбоновой
кислоты (765 мг), т.пл. 266-267 С (разл.).
П р и м е р 35. Получение 7-(3-
-амино-1-пирролидинил)-1-циклопро- пил-6-фтор-1,4-дигидро-4-оксо-1,8- нафтиридин-3-карбоновой кислоты.
Смесь этил-7-хлор-1-циклопропил- -6-фтор-1,4-дигидро-4-оксо-1,8-наф-
тиридин-3-карбоксилата (1,24 г), .-бутоксикарбониламинопирроли- дина (820 мг), триэтиламина (530 мг)
и 50 мл ацетонитрила кипятят с обратным холодильником в течение 1 ч. После
выпаривания при пониженном давлении к остатку- добавляют воду. Осадок
собирают. Полученное таким образом соединение растворяют в трифторуксус-
ной кислоте (30 мл). После перемеши35
45
50
0
5
5
5
0
вания при комнатной температуре в течение 1 ч растворитель удаляют при
пониженном давлении и к остатку добавляют воду, рН суспензии устанавливают
7-8 20%-ной гидроокисью натрия . Осадок собирают, промывают водой и сушат до получения 7-(3-ами-
но-1-пирролидинил)-1-циклопропил-6- -фтор-1,4-дигидро-4-оксо-1,8-нафтиридин-З-карбоновой
кислоты (990 мг), т.пл. 266-267°С (разл.).
П р и м е р 36. Получение 7-(3- -амино-1-пирролидинил)-1-циклопро- пил-6-фтор-1,4-дигидро-4-оксо-1,8-
-нафтиридин-3-карбоновой кислоты.
Смесь этил-7-хлор-1-циклопропил-
6-фтор-1,4-дигидро-4-оксо-1,8-наф- тиридин-3-карбоксилата (1,24 г),
3-бензиламинопирролидина (1,06 г), триэтиламина (610 мг) и ацетонитрила
(50 мл) кипятят с обратным холодильником в течение 1 ч. После выпаривания
досуха при пониженном давлении остаток смешивают с водой, устанавливают
рН 7-8 уксусной кислотой, а затем охлаждают. Осадок собирают, промывают
и сушат. Полученный твердый продукт растворяют в ледяной уксусной
кислоте (20 мл). Полученный раствор интенсивно перемешивают при 50-55° С
с 5% палладия на угле (200 мг) в атмосфере водорода. После окончания
поглощения водорода полученную смесь фильтруют для удаления катализатора
и полученный фильтрат концентрируют в вакууме досуха при пониженном давлении
. Остаток разбавляют водой, устанавливают рН 7,5-8 10%-ным водным
аммиаком. Осадок собирают, промывают и сушат до получения 7-(3-амино-1-
-пирролидинил)-2-циклопропил 6-фтор- -1,4-дигидро-4-оксо-1,8-нафтиридин-
-3-карбоновой кислоты (875 мг), т.пл. 266-267°С (разл.).
П р и м е р 37. Получение 7-(3- -амино-1-пирролидинил)-1-циклопро-
пил-6-фтор-1,4-дигидро-4-оксо-1,8- -нафтиридик-3-карбоновой кислоты.
Смесь этил-7-хлор-1-циклопропил- 6-фтор-1,4-дигидро-4-оксо-1,8-наф-
тиридин-3-карбоксилата (1,24 г), 3-триэтиламинопирролидина (1,97 г),
триэтиламина (610 мг) и смесь хлороформа и этанола 1:1 (50 мл) перемешивают
в течение ночи при комнатной температуре. Реакционную смесь концентрируют
досуха при пониженном давлении . Остаток смешивают с водой
ных концентрациях, самцам мышей (dd )
(50 мл) и уксусной кислотой (5 мл).
Полученный твердый продукт собирают, промывают последовательно водой и
этанолом и сушат. Смесь полученного таким образом соединения и 30%-ной
уксусной кислоты (35 мл) перемешивают при 30 С в течение 2 ч. Реакционную
смесь фильтруют до удаления нерастворимой твердой части, а затем
полученный фильтрат концентрируют досуха при пониженном давлении. Остаток
смешивают с водой и устанавливают рН 7-8 10%-ным водным аммиаком. Осадок собирают, промывают и сушат
до получения 7-(3-амино-1-пирролиди- нил)-1-циклопропил-6-фтор-1,4-дигид-
ро-4-оксо-1,8-нафтиридин-З-карбоно- вой кислоты (810 мг), т.пл.266-267°С (разл.).
П р и м е р 38 (острая токсичность ) . Растворы, содержащие каждое
из соединений: 1а - 7-(3-амино-1-пир ролидинил)-1-циклопропил-6-фтор-1,4-
-дигидро-4-oKco-l,8-нафтиридин-З-кар боковой кислоты гидрохлориду 2а -
1-циклопропил-6-фтор-7-(3-метилами- но-1-пирролидинил)-1,4-дигидро-4-ок-
со-1,8-нафтиридин-З-карбоновой кислоты гидрохлорид; За - 7-(3-амино-4-ме
тил-1-пирролидинил)-1-циклопропил- -6-фтор-1,4-дигидро-4-оксо-1,8-нафтиридин-З-карбоновой
кислоты гидрохлорид , полученный по примеру 4 (стадия 3), 4а - 7-(3-амино-3-метил-1-
-пирролидинил)-1-циклопропил-6-фтор- -1,4 дигидро-4-оксо-1,8-нафтиридин-
-3-карбоновой кислоты гидрохлорид, предлагаемого изобретения в различорально вводят
в дозе 0,1 мл на 10 г живого веса.
Количество погибших мышей подсчитывают
через 7 дн и среднюю летальную дозу (, мг/кг) рассчитывают по методу Behrens - Kaerber.
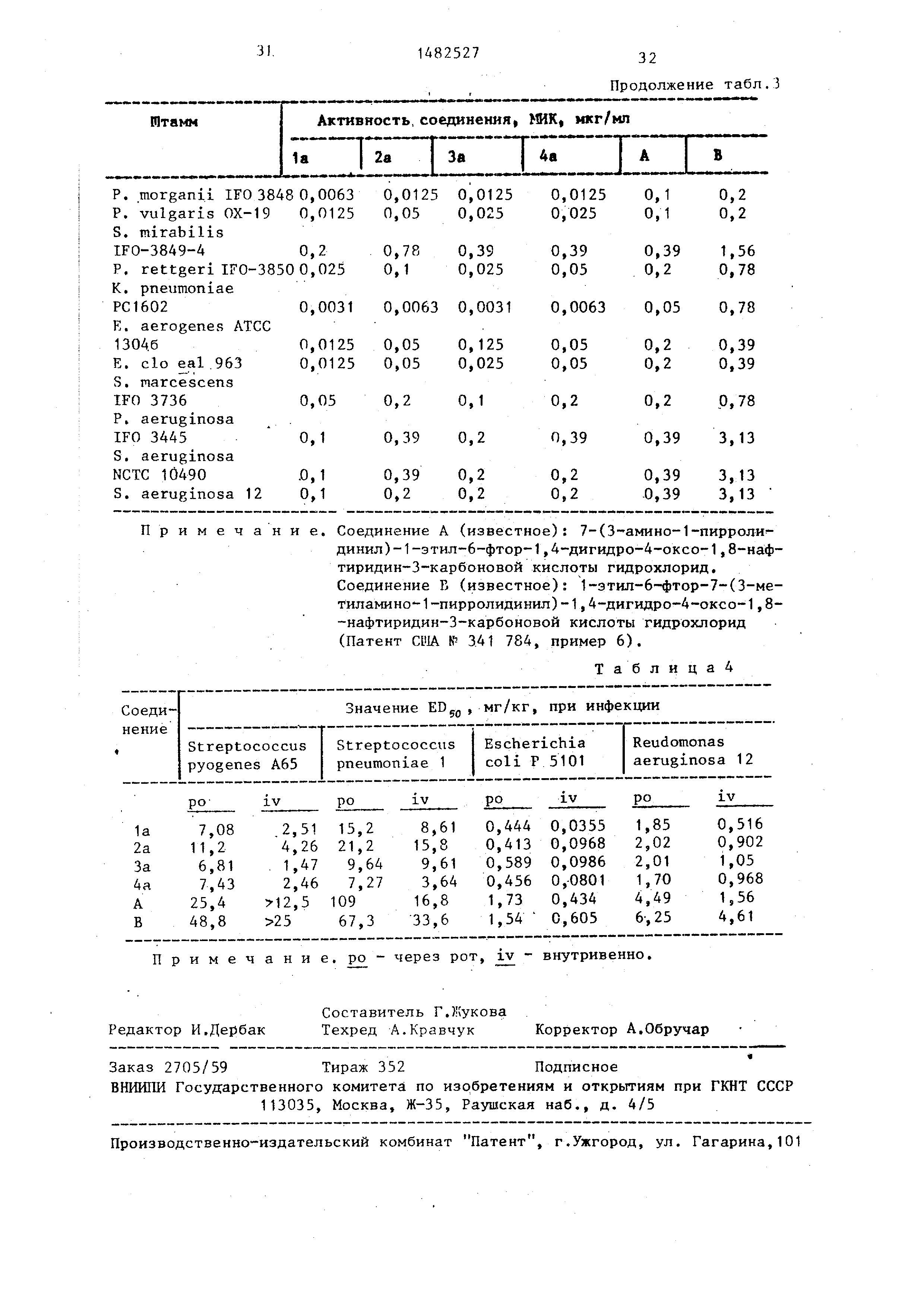
Полученные результаты острой токсичности представлены в табл. 2.
Из результатов, представленных в табл. 2, видно, что соединения 1а,
2а, За и 4а обладают низкой токсичностью при оральном введении.
Антибактерицидная активность in vitro при испытании в стеклянной посуде
показана в табл. 3. Минимальные ингибирующие концентрации (КИК, мкг/
/мл) вычисляют для свободного основания . МИК определяют по способу разбавления агара, рекомендованному
0
5
5
Японским обществом хемотерапии (Chemotherapy , 29, 1, 76, 1981).
Действенность против инфекционных заболеваний, относящихся к организму
в целом, при испытании на живом организме (мышь) показана в табл. 4.
Каждое из соединений растворяют в деионизированной воде. Каждый раствор
скармливают через рот (ро) или вводят мыши внутривенно (iv).
Мышей заражают каждым из испытуемых организмов при описанных условиях
. Среднюю эффективную дозу (ED50) вычисляют посредством неподкупного
анализа, причем значения EDn (мг/кг) вычислены, считая на свободное основание .
Условия эксперимента следующие.
Берут мышей-самцов (ddy-S), весящих
около 20 г.
Вводят инфекцию
Streptococcus pneumoniae I: внут- рибрюшинная. инфекция 3 х 103 клетками
для 1 мыши, суспендированными в сердечно-мозговой вытяжке}
Streptococcus pyogenes A65: вкут- рибрюшкнная инфекция 3x10 клетками
для 1 мыши, суспендированными в о сердечно-мозговой вытяжке t
Escherichia coli P-5101: внутри- брюшинная инфекция 9 х 10 клетками
для 1 мыши, суспендированными в трип- то-соевом бульоне с 4% муцина;
Pseudomonas aeraginosa 12: внутри- брюшинная инфекция 5 х 103 клетками
для 1 мыши, суспендированными в трип- то-соевом бульоне с 4% муцина.
Лекарственное лечение.
В случае Streptococcus pneumoniae
I - четырехкратно - сразу же после инфекции, затем через 6, 24 и 30 ч.
В случае других организмов - дважды, сразу же после заражения, затем через 6 ч после заражения.
Проводят наблюдение: через 14 дн в случае Streptococcus pneumoniae и
через 7 дн в случае других организмов .
5
0
5
Формула изобретения
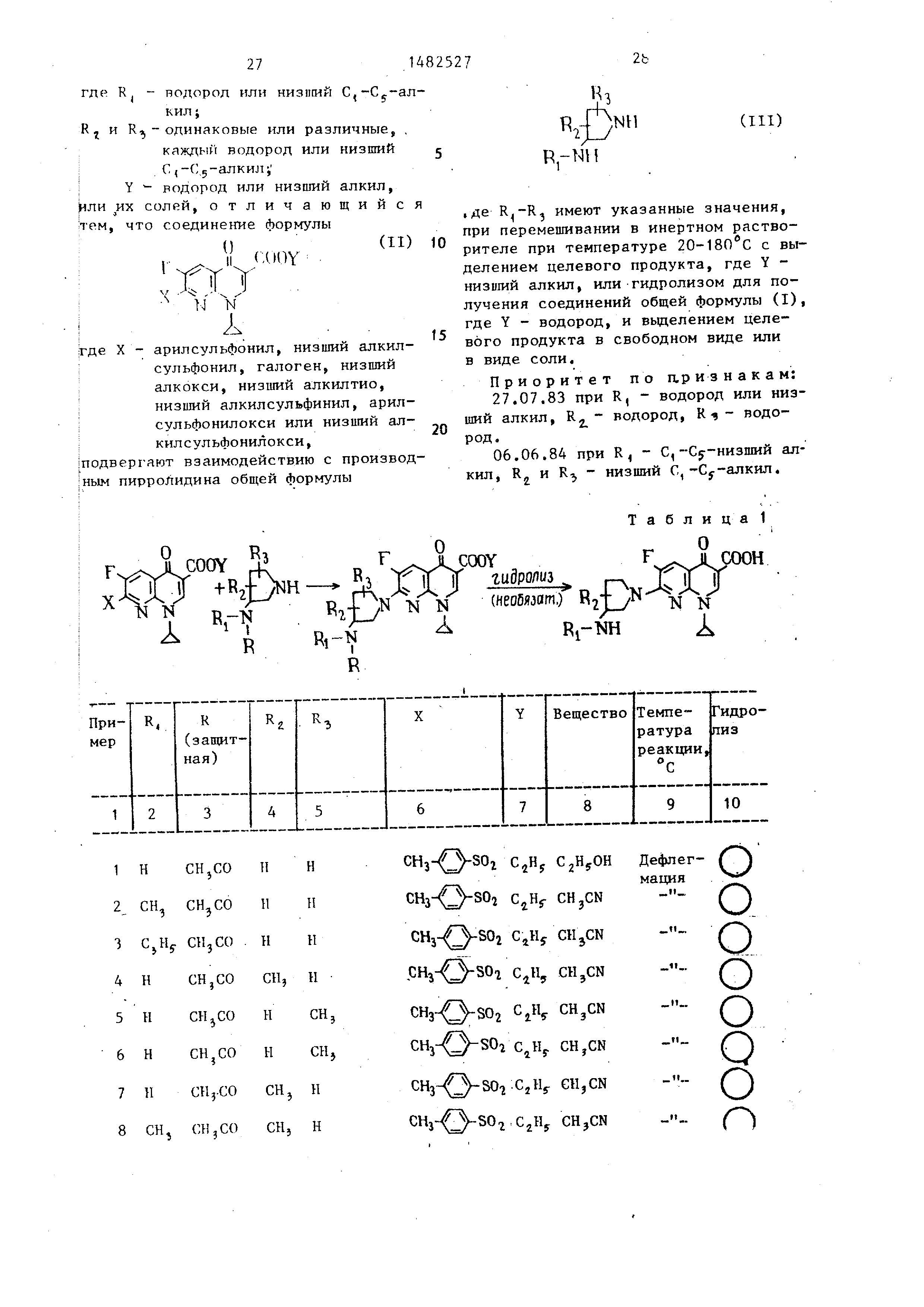
Способ получения производных 1,8- -нафтиридина общей формулы
(I)
55
27148252
где R( - водород или низший С,-С5-алкил j г и Ч одинаковые или различные,
каждый водород или низший с С ,-С 5-ал к ил;
Y - водород или низший алкил,
или ИУ. солей, отличающийся тем, что соединение формулы
2t
«з
TU A,NH
2
R.-Nl I
(in)
,де имеют указанные значения,
У «ЛЮУ
Т У
х Vv
1
где X - арилсульфонил, низший алкил- сульфонил, галоген, низший
алкокси, низший алкилтио, низший алкилсульфинил, арил- сульфонилокси или низший алкил
сульфонилокси, подвергают взаимодействию с производным пирроЛидина общей формулы
, . при перемешивании в инертном растворителе при температуре 20-180°С с выделением
целевого продукта, где Y - низший алкил, или гидролизом для получения соединений общей формулы (I),
где Y - водород, и выделением целевого продукта в свободном виде или в виде соли.
Приоритет по П.Р и з н а к а м: 27.07.83 при R, - водород или низший
алкил, R - водород, R - - водо15
род.
06.06.84 при R, - С,-€5-низший алкил , Кг и R - низший С,-Су-алкил.
О
+ R,
%
оо
COOY
- и. и / гидрат in,
В,тЛг «2ркNV
A RrNHi
COOY lЈF WV
;хйг
-- RI-N
1 H
CH}CO HH
2 CH, H II
3 CjHy CHjCO H H
4H CH,CO CH, И
5H
6H
7H CH, H
8CH, CH,CO СИ, Н
CHjCO H CH3
H CHj
CH3-O S°1 С2НУ С2Н5ОН Дефлег- С
МЯТТМП 3Jr
CH3CN CII3CN
C1H5 CH5CN
( Cjlly CH3CN CH3-Q -S07 c4Hr CH,CN
сн3- -5о-г CjHj. eii,cN
CHi-O S° C2H СНЭСК
2t
(in)
,де имеют указанные значения,
род.
06.06.84 при R, - С,-€5-низший алкил , Кг и R - низший С,-Су-алкил.
Таблица 1
о
in,
кNV
;хйг
Продолжение табл.1
Примечание. Соединение А (известное): 7-(3-амино-1-пирролидинил )-1-этил-6-фтор-1,4-дигидро-4-оксо-1,8-наф-
тиридин-3-карбоновой кислоты гидрохлорид. Соединение В (известное): 1-этил-6-фтор-7-(3-ме-
тиламино-1-пирролидинил)-1,4-дигидро-4-оксо-1,8- -нафтиридин-3-карбоновой кислоты гидрохлорид
(Патент США IP 341 784, пример 6).
Таблица4
ро
IV
ро
IV
Примечание, ро- через рот, iv - внутривенно.
Редактор И.Дербак
Составитель Г.Жукова
Техред А.Кравчук
Продолжение табл.3
ро
IV
ро
iv











Комментарии