Способ и препарат для лечения или профилактики тревожности или нейрогенеза - RU2606841C2
Код документа: RU2606841C2
Чертежи

Описание
Предпосылки изобретения
Настоящее изобретение относится к применению препарата, особенно питательного препарата, для профилактики или лечения тревожности у индивидуума, особенно у индивидуума с депрессией, и депрессии. Более конкретно, настоящее изобретение относится к применению препарата, особенно питательного препарата, для профилактики или лечения тревожности или депрессии у индивидуума, не отвечающего на терапию SSRI. Кроме того, изобретение относится к применению препарата, особенно питательного препарата, для регуляции нейрогенеза.
Тревожность и депрессия ассоциированы с нарушениями серотонинергической системы [1-3]. Серотонинергическая система является очень сложной, состоящей из 14 подтипов рецепторов, но существует один переносчик, ответственный за обратный захват 5-HT; переносчик 5-HT (5-HTT) [4]. Таким образом, изменения экспрессии и/или функции 5-HTT оказывают значительное влияние на наличие 5-HT во внеклеточном пространстве, настроения и эмоционального контроля. Одним из примеров является (короткий; s) вариант полиморфной по длине области переносчика серотонина (5-HTTLPR) с низкой активностью у людей, хорошо известный по своей ассоциации с личностными чертами, родственными тревожности [5], и повышенному риску депрессии в отношении стресса на ранних этапах жизни [6, 7]. Эти поведенческие проявления коррелируют с гиперреактивностью миндалевидного тела, гиперперфузией миндалевидного тела и гиппокампа и изменениями объема [8, 9]. Возможно, "выигрыш в функции" в этих лимбических центрах приводит к снижению стрессоустойчивости [10]. Генотип 5-HTTLPR также влияет на снижение объема гиппокампа, что, как правило, наблюдают при длительных эпизодах большого депрессивного расстройства, хотя сохраняется некоторая двусмысленность относительно точной природы этого эффекта [9, 11, 12].
Исследования с использованием мета-анализа показали, что склонные к депрессии носители короткого (s)-аллеля 5-HTTLPR относительно плохо отвечают на SSRI, лекарственные средства выбора при лечении депрессии [13]. SSRI могут проявлять свои антидепрессантные эффекты посредством изменений нейрогенеза в гиппокампе взрослых [14], по-видимому, опосредованного изменениями передачи сигнала 5-HT1A, вызываемых длительным лечением SSRI [15]. Известно, что новые нейроны интегрируются в существующие проводящие нейронные пути и участвуют в опосредуемом гиппокампом обучении и эмоциональном контроле [16, 17]. Ассоциация между s-аллелем и нейрогенезом подлежит оценке, но концепция "выигрыша в функции" указывает на то, что механизмы действия SSRI по-разному работают у носителей s-аллеля.
В настоящей заявке мы, главным образом, демонстрируем возможность лечения симптомов депрессии у индивидуума, не отвечающего на терапию SSRI, с использованием лечебного питания. Интересно, что диета является не только важным фактором образа жизни, вовлеченным в этиологию и лечение депрессивных и сопутствующих нарушений, но также показано, что различные питательные вещества могут влиять на некоторые из механизмов, участвующих в патогенезе депрессии, и механизмы, лежащие в основе действия антидепрессантов, таких как SSRI. Например, дефицит омега-3-полиненасыщенных жирных кислот (ω-3-PUFA) может оказывать отрицательный эффект на серотонинергическую нейротрансмиссию [18], в то время как добавление питательных веществ, изменяющих структуру фосфолипидов мембраны нейрона и композицию жирных кислот, может влиять на свойства мембраны [19], что может облегчать передачу сигнала нейронов посредством повышения загруженности ионных каналов [20] или улучшать передачу сигнала 5-HT посредством повышения плотности рецепторов 5-HT1A [21] и аффинности связывания [22]. Аналогично, некоторые питательные вещества являются известными предшественниками и кофакторами, необходимыми для синтеза нейромедиаторов и мембран нейронов. Дополнительно, питательные вещества, такие как ω-3-PUFA, связаны с изменениями гиппокампального нейрогенеза у крыс и мышей [23-27], хотя точные механизмы, регулирующие такой нейрогенез, все еще являются предметом обсуждения.
Учитывая эпидемиологические данные, демонстрирующие, что потребление с пищей питательных веществ, таких как ω-3-PUFA и витамины группы B, ассоциировано с риском депрессивных расстройств [28-30], полагают, что добавление этих питательных веществ может помогать снижать ассоциированные симптомы. Однако к настоящему времени исследования добавок с отдельными питательными веществами не продемонстрировали их четких преимуществ в отношении снижения риска заболевания или помощи в симптоматической терапии. Как бы то ни было, питательные компоненты могут обладать терапевтическим потенциалом, о чем свидетельствует то, что потребление ω-3-PUFA в сочетании с антидепрессантами улучшает исход у пациентов с рецидивирующим униполярным депрессивным расстройством [31]. Кроме того, показано, что комбинированное введение конкретных питательных веществ повышает их эффективность в отношении снижения подобных депрессии симптомов [32], позволяя предполагать потенциальное синергическое действие.
Т.к. некоторые питательные вещества могут помочь компенсировать некоторые из дефицитов, наблюдаемых у носителей s-аллеля, и т.к. комбинированное введение таких питательных веществ может являться более эффективным, чем отдельное лечебное питание для снижения подобных депрессии симптомов [32], мы выдвинули гипотезу, что, в частности, диета, включающая введение комбинации ω-3-PUFA с фосфолипидами и витаминами группы B, может оказывать положительное воздействие на носителей аллеля 5-HTTLPR-s. Для проверки этой гипотезы мы использовали самок крыс, нокаутных по гену переносчика серотонина (5-HTT-/-), и контрольных крыс дикого типа (5-HTT+/+). Как и мыши 5-HTT-/-, и люди-носители s-аллеля, эти животные демонстрировали повышенную тревожность и подобные депрессии симптомы (обзор см. в Kalueff et al. [33]). Более высокая распространенность депрессии среди женщин по сравнению с мужчинами [34] являлась обоснованием выбора самок крыс для настоящего исследования. После содержания на смешанной диете PUFA или контрольной диете животных подвергали серии поведенческих тестов с измерением тревожности (приподнятый крестообразный лабиринт, выработка реакции страха) или подобных депрессии симптомов (тест "социального взаимодействия", тест принудительного плавания). Нейробиологическую корреляцию эффектов генотипа и диеты изучали с использованием иммуногистохимического окрашивания на маркер нейрогенеза даблкортин (DCX) [35]. Кроме того, мы измеряли объем гиппокампа, который может быть поражен при тяжелой депрессии.
Как применяют в настоящем описании, "или" также предназначено для включения "и". Таким образом, выражение "A или B" включает 3 варианта: A, B и "A и B", если A и B не являются взаимоисключающими.
Предшествующий уровень техники
В EP 1275399 B1 и EP 1275399 B1 (оба Nutricia NV) описывают использование препарата по изобретению для применения в профилактике и лечении сосудистых нарушений и конкретных ассоциированных с ними состояний, таких как биполярная или униполярная депрессия, и для лечения депрессий, связанных с тревожностью. Как описано, композиция является эффективной, т.к., в общем случае, оказывает действие на функцию внутренней оболочки сосуда и эндотелиальных клеток, что важно для влияния на этиологию и развитие широкого спектра сосудистых нарушений и некоторых других вторичных нарушений, в частности, депрессии.
Описание изобретения
К настоящему времени авторы настоящего изобретения обнаружили препарат для лечения депрессии и тревожности, в частности, не связанных с сосудистыми нарушениями, являющийся эффективным по причине своего действия на серотонинергическую систему, в частности компоненты серотонинергической системы 5-HTT и 5-HTTLPR.
Таким образом, настоящее изобретение относится к препарату, подходящему для профилактики или лечения депрессии или тревожности у индивидуума, содержащему следующие компоненты:
a) по меньшей мере одну ω-3-полиненасыщенную жирную кислоту (PUFA);
b) по меньшей мере два фосфолипида, выбранных из группы, состоящей из фосфатидилсерина, фосфатидилинозитола, фосфатидилхолина и фосфатидилэтаноламина или любой их смеси; и
c) одно или несколько соединений, являющихся факторами в метаболизме серотонина, выбранных из витаминов группы B и триптофана.
Предпочтительно, указанный индивидуум представляет собой млекопитающего, более предпочтительно - человека.
Подробное описание изобретения
Комбинированное введение этих компонентов приводит к профилактике и лечению тревожности или депрессии, в частности, на уровне серотонинергической системы.
Компонент a)
Компонент a) содержит по меньшей мере одну ω-3-полиненасыщенную жирную кислоту (PUFA). Жирная кислота может являться свободной жирной кислотой, но, предпочтительно, связана с подходящим остовом, например, триглицеридом. Она также может находиться в форме фосфолипидов, как описано ниже.
Обнаружено, что если используют смесь ω-3- и ω-6-полиненасыщенных жирных кислот (PUFA), такую смесь необходимо включать при соотношении ω-3-жирных кислот к ω-6-жирным кислотам приблизительно от 2,5 до 5,5 масс./масс.
Предпочтительными ω-3-PUFA являются эйкозапентаеновая кислота (EPA) и докозагексаеновая кислота (DHA). Лучшие результаты получали при включении DHA и EPA в приблизительно эквимолярных количествах, например, в соотношении DHA и EPA от 0,5 до 2 масс./масс. Предпочтительными ω-6-PUFA являются дигомо-гамма-линоленовая кислота (DHGLA) и арахидоновая кислота (AA). Их необходимо включать в количестве приблизительно одной четвертой количества EPA и DHA, например, в соотношении [DHA + EPA] и [DHGLA + AA] от 2,5 до 5,5, предпочтительно - 3,3-4,7 масс./масс. Суточная доза совокупности EPA+DHA+DHGLA+AA, предпочтительно, составляет по меньшей мере 120 мг, более предпочтительно - по меньшей мере 350 мг. Суточная доза препарата, в частности, содержит от 20 до 2000 мг, предпочтительно - от 50 до 1000 мг EPA, от 50 до 2000 мг, предпочтительно - от 200 до 1000 мг DHA и от 50 до 2000 мг, предпочтительно - от 100 до 1000 мг DHGLA. Дополнительными PUFA, которые могут присутствовать, являются линоленовая и α-линолевая кислота. Однако, соотношение общего количества EPA+DHA+DHGLA+AA и общего количества линоленовой и α-линолевой кислот должно составлять более 0,1 масс./масс., предпочтительно - более 0,2, наиболее предпочтительно - более 0,4.
Компонент b)
Компонент b) содержит по меньшей мере два фосфолипида, выбранных из группы, состоящей из фосфатидилсерина, фосфатидилинозитола, фосфатидилхолина и фосфатидилэтаноламина.
Предпочтительно, указанные фосфолипиды являются фосфатидилхолином и фосфатидилэтаноламином. Предпочтительно, компонент b) содержит по меньшей мере три различных фосфолипида, выбранных из группы, состоящей из фосфатидилсерина, фосфатидилинозитола, фосфатидилхолина и фосфатидилэтаноламина. Более предпочтительно, компонент b) содержит фосфатидилхолин, фосфатидилэтаноламин и фосфатидилсерин. Функцию этого компонента можно рассматривать как обеспечение прямого источника фосфолипидов нервной клетки (составных элементов) для синтеза нейронов (нейрогенеза). Особенно предпочтительно включать смесь фосфолипидов, особенно пару остатков холина/этаноламина с одной стороны и пару остатков серина/инозитола с другой стороны. Для лучших результатов соотношение (фосфатидилхолина или фосфатидилэтаноламина) и (фосфатидилсерина или фосфатидилинозитола) должно составлять 0,5-20 (масс./масс.). В суточной дозе необходимо вводить по меньшей мере 0,2 г и предпочтительно - более 1 г фосфолипидов, например, 4 г. Если продукт предназначен для использования пациентами, страдающими тревожностью и симптомами депрессии, общее количество фосфатидилсерина на суточную дозу продукта должно составлять по меньшей мере 0,1 г для лучших результатов и предпочтительно - более 0,5 г. Другой предпочтительной характеристикой предпочтительных фосфолипидов является остаток PUFA. Предпочтительно использовать фосфолипиды, являющиеся источником PUFA, как описано выше, для компонента a). Например, их можно получать способами переэтерификации, известными в данной области, с использованием, например, смесей исходных фосфолипидов и ингредиентов, богатых конкретными PUFA. Использование этих конкретных фосфолипидов обеспечивает высокую активность наряду с относительно стабильным продуктом. В препаратах для перорального использования не требуется использования высокоорганизованных липидных компонентов, таких как сфингомиелины, из-за высоких уровней метаболизма этого типа соединений в желудочно-кишечном тракте, эпителиальных клетках желудочно-кишечного тракта и печени. Кроме того, другие липиды, по-существу, не содержащие DHA, EPA, DHGLA или AA, такие как нейтральные триглицериды, предпочтительно не включать в фосфолипидный компонент или включать в относительно низких общих количествах, например, менее чем 40%, и, в частности, менее 5% липидного компонента. Фосфолипиды можно получать из яичного желтка или сои, например, соевый лецитин, и выделять с использованием способов, известных в данной области, например, экстракцией ацетоном, и, необязательно, последующей хроматографией или адсорбционными способами. При необходимости фосфолипидный компонент также может состоять из смесей синтетических фосфолипидов и (экстрактов) фосфолипидов природного происхождения.
Компонент c)
Компонент c) содержит по меньшей мере одно соединение, являющееся фактором в метаболизме серотонина.
В одном из вариантов осуществления компонент c) содержит по меньшей мере один или несколько витаминов группы B, выбранных из группы пиридоксина (B6), фолиевой кислоты/фолата (B11), тиамина (B1), рибофлавина (B2), никотиновой кислоты (B3), пантотеновой кислота (B5), кобаламина (B12) и витамина H.
Предпочтительно, компонент c) содержит по меньшей мере пиридоксин (витамин B6). Витамин B6 способствует продукции серотонина. Недостаточность этого витамина группы B снижает продукцию серотонина и влияет на настроение и аппетит. Витамин B6 необходимо включать в количестве более 2 мг, в частности, более 2,5 мг на суточную дозу.
Предпочтительно, компонент c) содержит, по меньшей мере, фолиевую кислоту (витамин B11), в частности, в количестве по меньшей мере 200 мкг и наиболее предпочтительно - более 400 мкг на суточную дозу. Термин фолиевая кислота также предназначен для включения ее физиологических эквивалентов, таких как ее фармацевтически приемлемые соли, 5-метилтетрагидрофолат и его полиглутаматная форма, т.к. они существуют в природе. Наиболее предпочтительно включать, по меньшей мере, витамин B6 и фолиевую кислоту, вместе с тем, что наибольшая часть популяции будет получать пользу при одновременном включении этих компонентов.
В одном из вариантов осуществления компонент c) содержит триптофан. Триптофан повышает уровни триптофана в крови, а затем и уровни в головном мозге, что повышает продукцию триптофана.
Соединение d)
Помимо компонентов a)-c), описываемых выше, препарат по изобретению, необязательно, может содержать дополнительный компонент d), благоприятный для профилактики или лечения тревожности, особенно, у индивидуумов с депрессией, и депрессии, и для стимуляции нейрогенеза. Кроме того, с учетом описания EP 1275399 B1 и EP 1275399 B1, в большинстве случаев можно получать комбинированный эффект на серотонинергическую систему и функцию внутренней оболочки и эндотелиальных клеток.
Компонент d) может содержать соединение, являющееся фактором метаболизма метионина. Общий метаболизм метионина (TMM) описывают в EP 0891719. Известно, что правильное функционирование TMM является обязательным для эндогенного биосинтеза многих ключевых соединений, таких как S-аденозилметионин (для креатина, карнитина и т.д.) и глутатиона. Компонент d) может содержать по меньшей мере одно соединение, выбранное из группы, состоящей из фолиевой кислоты, витамина B12, витамина B6, магния и цинка. Еще более предпочтительно, если этот компонент содержит все элементы указанной выше группы. Компонент дополнительно может содержать SAMe (S-аденозилметионин), холин, бетаин или медь. Если компонент d) содержит цинк и медь, соотношение массы цинка и меди составляет от 5 до 12. Можно включать холин или бетаин.
Компонент d) может содержать цитрат. Цитрат также предназначен для включения лимонной кислоты. Продукты по изобретению должны иметь pH от 3,0 до 7,5 и, предпочтительно, от 5 до 7. Цитрат необходимо вводить в количестве от 0,5 до 30 г, предпочтительно - от 1,5 до 10 г на суточную дозу, например, более 2,4 г. В литературе по биохимии описывают, что лимонная кислота, а также некоторые другие соединения, поставляют восстановительные эквиваленты в цитозоль и участвуют в цикле Кребса, таким образом, поставляя NADH и энергию в митохондрии. В течение длительного времени также известно, что лимонная кислота помогает регулировать гликолиз ингибированием реакции фосфофруктокиназы по механизму обратной связи. Для правильного функционирования эндотелиальных клеток сосудов важно одновременно иметь достаточные общие количества АТФ и восстановительных эквивалентов в форме NADPH, доступного в цитозоле этих клеток, и цитрат может способствовать этому, и более эффективно, чем его функциональные аналоги, такие как промежуточные соединения цикла Кребса, такие оксалоацетат, яблочная кислота или фумарат.
Компонент d) может содержать гуперзин A или его функциональные аналоги, особенно в тех продуктах, которые предназначены для использования в профилактике и лечении синдрома деменции, особенно в тех фазах заболевания, когда сильно нарушен метаболизм ацетилхолина. Гуперзин A необходимо включать в количествах от 0,04 до 2, предпочтительно - от 0,07 до 1, наиболее предпочтительно - от 0,08 до 0,5 мг на суточную дозу. В качестве аналога также можно использовать экстракт конкретных трав, таких как Huperzia serrata, при стандартизации содержания и чистоты гуперзина A. Можно использовать количество такого экстракта от 0,04 до 20 мг, предпочтительно - от 0,07 до 2 мг на суточную дозу. Также можно использовать липофильные производные гуперзина A, например, получаемые модификацией первичных и/или вторичных аминогрупп.
Компонент d) может содержать одно или несколько соединений из карнитина, витамина B1, витамина B5 и кофермента Q10 или их функциональных аналогов. В одном из вариантов осуществления компонент d) может содержать одно или несколько соединений из карнитина и кофермента Q10 или их функциональных аналогов. В качестве функциональных эквивалентов карнитина можно упомянуть его фармацевтически приемлемые соли или алканоил- и ацилкарнитины [ацетил-L-карнитин], являющиеся особенно подходящими, или их смеси. Карнитин, преимущественно, включают в продукты, предназначенные для использования для пациентов, страдающих синдромами деменции. В этих продуктах предпочтительно в качестве источника карнитина используют липофильные производные. Наиболее предпочтительно использовать ацетил-L-карнитин. Этот компонент поставляет ацетильные группы в головной мозг для биосинтетических целей. Карнитин необходимо включать в количестве от 0,1 до 3 г, предпочтительно - от 0,2 до 1 г на суточную дозу. Витамин B5 можно включать, например, в виде пантотената кальция или другой стабильной формы. Предпочтительные дозировки составляют от 8 до 80 мг, предпочтительно - от 12 до 40 мг на суточную дозу продукта.
Компонент d) может содержать липофильный источник тиамина, такой как бенфотиамин, аллитиамин, фурсултиамин или октотиамин, особенно в случае препаратов, предназначенных для использования в лечении или профилактике дальнейшего прогрессирования синдромов деменции. Дегенерацию церебральной функции у людей, наблюдаемую при болезни Паркинсона и болезни Хантингтона, можно замедлять препаратами по изобретению. В препараты для этих типов индивидуумов также предпочтительно включать, соответственно, таурин и гамма-аминомасляную кислоту или их производные, такие как пирацетам. Если включают кофермент Q10, количество может составлять от 0,8 до 200 мг и предпочтительно - от 5 до 70 мг. Количества могут являться настолько низкими в результате положительного воздействия фосфолипидов (компонента b) на функцию мембраны.
Компонент d) может содержать соединение, обладающее антиоксидантными свойствами. Такое соединение можно выбирать из группы витамина C, витамина E, липоевой кислоты, солей селена и каротиноидов.
Компонент d) может содержать экстракт гинкго билоба. Этот экстракт получают из листьев, и он богат флавоноидами и особенно терпеноидами, в частности, гинкголидами. Например, вероятно, экстракт, содержащий по меньшей мере 4% гинкголидов является эффективным.
Предпочтительно, препарат по изобретению содержит указанные выше компоненты в количестве выше рекомендуемого суточного потребления. Суточная доза препарата по изобретению предпочтительно содержит:
- по меньшей мере 120 мг длинноцепочечных полиненасыщенных жирных кислот;
- по меньшей мере 200 мг фосфолипидов;
- по меньшей мере 200 мкг фолиевой кислоты; и
- по меньшей мере 0,5 г цитрата.
Более предпочтительно, препарат по изобретению содержит на суточную дозу:
- по меньшей мере 20 мг, предпочтительно - по меньшей мере 50 мг эйкозапентаеновой кислоты (EPA)
- по меньшей мере 50 мг, предпочтительно - по меньшей мере 200 мг докозагексаеновой кислоты (DHA)
- по меньшей мере 50 мг, предпочтительно - по меньшей мере 100 мг арахидоновой кислоты (AA)
- по меньшей мере 200 мг, предпочтительно - по меньшей мере 1000 мг фосфатидилсерина (PS)
- по меньшей мере 200 мкг, предпочтительно - по меньшей мере, 400 мкг фолиевой кислоты
- по меньшей мере 100 мг, предпочтительно - по меньшей мере 200 мг магния
- по меньшей мере 5 мг, предпочтительно - по меньшей мере 10 мг цинка
- по меньшей мере 2 мг, предпочтительно - по меньшей мере 2,5 мг витамина B6
- по меньшей мере 2 мкг, предпочтительно - по меньшей мере 4 мкг витамина B12
- по меньшей мере 1,0 г, предпочтительно - по меньшей мере 1,5 г цитрата.
Препарат по изобретению может являться фармацевтическим препаратом, а также питательным препаратом.
В частности, в случае питательной композиции, которая может являться пищей или напитком, общее количество содержащегося в ней препарата по изобретению, соответственно, представляет собой количество для получения суточной дозы за один прием.
Как применяют в настоящем описании, термин "прием" означает количество пищи или напитка, поглощаемое взрослым человеком в норме с приемом пищи за один раз, и может находиться в диапазоне, например, приблизительно от 1 г (например, nutritional shot) до приблизительно 500 г.
В одном из аспектов настоящего изобретения препарат по изобретению (т.е. содержащий компоненты a), b), c) и, необязательно, d)) можно использовать в фармацевтической композиции, содержащей один или несколько фармацевтически приемлемых носителей.
Фармацевтическая композиция, предпочтительно для энтерального использования, может представлять собой твердый или жидкий галеновый препарат. Примерами твердых галеновых препаратов являются таблетки, капсулы (например, твердые или мягкие желатиновые капсулы), пилюли, саше, порошки, гранулы и т.п., содержащие активный ингредиент вместе с общепринятыми галеновыми носителями. Можно использовать любой общепринятый носитель. Носитель может являться органическим или неорганическим инертным носителем, подходящим для перорального введения. Подходящие носители включают воду, желатин, гуммиарабик, лактозу, крахмал, стеарат магния, тальк, растительные масла и т.п. Кроме того, можно добавлять добавки, такие как ароматизаторы, консерванты, стабилизаторы, эмульгаторы, буферы и т.п., согласно общепринятой практике получения фармацевтических составов. В то время как отдельные активные ингредиенты, соответственно, вводят в одной композиции, их также можно вводить в отдельных единицах дозирования.
Если композиция является фармацевтическим составом, такой состав может содержать суточную дозу в одной или нескольких единицах дозирования. Единица дозирования может находиться в жидкой форме или в твердой форме, где в последнем случае суточную дозу можно предоставлять в одной или нескольких твердых единицах дозирования, например, в одной или несколько капсулах или таблетках.
В другом аспекте настоящего изобретения препарат по изобретению (т.е. содержащий компоненты a), b), c) и, необязательно, d)) можно составлять как питательную композицию, содержащую по меньшей мере один компонент, выбранный из группы жиров, белков и углеводов. Следует понимать, что питательная композиция отличается от фармацевтической композиции наличием питательных веществ, обеспечивающих питание индивидуума, которому вводят композицию, в частности, наличием белка, жира, легкоусваиваемых углеводов и пищевых волокон. Она может дополнительно содержать ингредиенты, такие как минеральные вещества, витамины, органические кислоты и ароматизаторы. Хотя в литературе часто используют и термин "нутрицевтическая композиция", он означает питательную композицию с фармацевтическим компонентом или фармацевтическим назначением. Таким образом, питательная композиция по изобретению также может означать нутрицевтическую композицию.
Преимущественно, питательная композиция по изобретению может содержать белок, предпочтительно интактный белок. Белки делают возможным производство вкусных продуктов. В частности, белок будет полезен для пожилых людей, т.к. он усиливает их двигательные навыки. Предпочтительно, питательная композиция по изобретению содержит белок молока. Предпочтительно, питательная композиция по изобретению содержит белок, выбранный из группы, состоящей из сывороточного белка молока, казеина или казеината. Предпочтительно, питательная композиция по изобретению содержит казеинат, более предпочтительно - питательная композиция по изобретению содержит по меньшей мере 70% по массе, более предпочтительно - по меньшей мере, 90% по массе казеина и/или казеината с учетом общего белка.
Предпочтительно, белки включают в интактной (негидролизованной) форме для получения вкусного продукта. Такие белки с высокой молекулярной массой повышают вязкость подвергнутого термообработке жидкого продукта по сравнению с гидролизованными формами. С использованием способов по изобретению авторы настоящего изобретения смогли получить приемлемый продукт с хорошими вкусовыми качествами и ограниченной вязкостью, кроме того, избегая осаждения.
Предпочтительно, питательная композиция по изобретению содержит от 0,2 до 16 граммов белка на 100 мл, предпочтительно - от 0,2 и 10 граммов белка на 100 мл, более предпочтительно - от 1 до 6 граммов белка на 100 мл, более предпочтительно - от 2 и 5 граммов белка на 100 мл.
Преимущественно, питательная композиция по изобретению может содержать жир, содержащие жир компоненты, иные, чем указанные в качестве компонента a). Учитывая тип жира, возможен широкий выбор при условии, что жир является жиром пищевого качества. Жир может являться твердым, полутвердым или жидким (маслом) при комнатной температуре (25°C).
Жир может включать один или несколько среднецепочечных триглицеридов (MCT), один или несколько длинноцепочечных триглицеридов или любую комбинацию двух типов. В частности, MCT можно выбрать из MCT, имеющих триглицеридную цепь, составляющую 6, 7, 8, 9 или 10 атомов углерода в длину. Как правило, LCT составляют по меньшей мере 12 атомов углерода в длину.
MCT являются благоприятными, т.к. они легко абсорбируются и метаболизируются. Кроме того, использование MCT будет снижать риск мальабсорбции питательных веществ.
Источники LCT, такие как рапсовое масло, в самом общем случае - рапсовое масло с низким содержанием эруковой кислоты, подсолнечное масло, кукурузное масло, пальмоядровое масло, кокосовое масло, пальмовое масло или их смеси являются предпочтительными т.к. они обеспечивают больше энергии на единицу жира.
В конкретном варианте осуществления жир содержит от 30 до 60% по массе животного или водорослевого жира, от 40 до 70% по массе растительного жира и, необязательно, от 0 до 20% по массе MCT с учетом общего жира питательной композиции по изобретению. Предпочтительно, животный жир не содержит или содержит низкое общее количество молочного жира, т.е. меньше 6% по массе, в частности, меньше 3% по массе. В частности, может присутствовать смесь, содержащая одно или несколько масел, выбранных из группы кукурузного масла, жир яйца, каноловое масло и рыбьего жира. Предпочтительным источником нерастительных жиров являются жиры яйца, рыбий жир и масла водорослей. Рыбий жир является источником DHA и/или EPA, присутствующих в питательной композиции по изобретению. Для желаемого вкуса концентрация жира предпочтительно составляет 25% по массе или менее, более предпочтительно - 15% по массе или менее.
Преимущественно, питательная композиция по изобретению содержит один или несколько легкоусваиваемых углеводов. Легкоусваиваемые углеводы положительно влияют на рабочие навыки индивидуума и усиливают благоприятный эффект питательной композиции по изобретению. Общее количество легкоусваиваемых углеводов составляет предпочтительно от 25 до 80% по массе в пересчете на сухое вещество, предпочтительно - от 40 до 80% по массе. В случае жидкой питательной композиции по изобретению композиция предпочтительно содержит от 1 до 50 граммов легкоусваиваемых углеводов на 100 мл жидкого продукта, более предпочтительно - от 5 до 30 граммов на 100 мл, более предпочтительно - от 10 до 30 граммов легкоусваиваемых углеводов на 100 мл.
Примерами легкоусваиваемых углеводов являются легкоусваиваемые пентозы, легкоусваиваемые гексозы и легкоусваиваемые олигосахариды, например, легкоусваиваемые дисахариды и легкоусваиваемые трисахариды. Более конкретно, один или несколько легкоусваиваемых углеводов можно выбирать из группы галактозы, маннозы, рибозы, сахарозы, трегалозы, палатинозы, лактозы, мальтодекстрозы, мальтозы и глюкозы.
Необязательно, питательная композиция по изобретению содержит один или несколько неперевариваемых углеводов (пищевые волокна), такие как олигосахариды. Как применяют в настоящем описании, термин олигосахариды, в частности, относится к сахаридам, содержащим от 3 до 25 моносахаридных единиц на молекулы. В частности, олигосахариды можно выбирать из группы фруктоолигосахаридов (FOS), галактоолигосахаридов (GOS), транс-галактоолигосахаридов (TOS), ксилоолигосахаридов (XOS), олигосахаридов сои и т.п. Кроме того, необязательно, в композицию по изобретению можно включать высокомолекулярные соединения, такие как инулин, резистентный крахмал и т.п. В дополнительном варианте осуществления настоящего изобретения композиция по изобретению содержит смесь нейтральных и кислых олигосахаридов, таких как описываемые в WO 2005/039597 (N.V. Nutricia); композиции, описываемые в этом описании включены в настоящее описание в качестве ссылки.
Кроме того, в частности, может присутствовать один или несколько из следующих компонентов: таурин, цистеин, марганец, молибден, цинк, селен, магний, хром, железо, медь, витамин A, витамин B1, витамин B2, витамин B3, витамин B5, витамин B6, фолиевая кислота, витамин B12, витамин C, витамин D, витамин E и биотин.
Питательную композицию для применения по изобретению, в частности, можно выбирать из группы спредов; йогуртов, жидкостей, порошков, сладких кремов, мороженого, масла и других молочных продуктов; молочных продуктов-заменителей; фруктовых напитков; десертов, сладостей, концентратов, паштетов, соусов, гелей, эмульсий и печенья.
Предпочтительно, питательная или нутрицевтическая композиция по изобретению является жидкостью, предпочтительно, жидкой питательной композицией на основе молока для медицинских целей.
Предпочтительно, жидкая питательная композиция по изобретению имеет плотность энергии от 80 до 450 ккал на 100 мл композиции, более предпочтительно - от 90 до 250 ккал на мл жидкой питательной композиции. В частности, это считают благоприятным, т.к. индивидуумы, страдающие невропатиями или неврологическими проблемами, часто испытывают проблемы с питанием. Как правило, нарушаются их сенсорные способности и/или мышечный контроль, а также в некоторых случаях их стремление использовать надлежащее питание. Часть этих пациентов может испытывать общую потерю аппетита, и относительно большая часть этой группы пациентов не имеет полноценного питания. Жидкую питательную композицию относительно легко вводить, и, при наличии энергетической ценности в определенном диапазоне, такие люди могут относительно легко получать достаточное количество калорий.
Предпочтительно, жидкие питательные композиции обладают длительным сроком хранения. Однако повышение срока хранения термической обработкой часто приводит к дестабилизации продуктов и/или вкусовых качеств, приводя к получению нежелательного продукта. Питательную композицию по изобретению можно подвергать термической обработке без значительных неблагоприятных воздействий на вкусовые качества. Таким образом, питательную композицию по изобретению, предпочтительно, подвергают термообработке, более предпочтительно - композицию подвергают стерилизации. В предпочтительном варианте осуществления питательную композицию по изобретению подвергают обработке сверхвысокой температурой (UHT-обработке). Такую UHT-обработку, предпочтительно, используют поточно, т.е. до наполнения упаковки единицы жидким конечным продуктом.
Медицинское применение
Препараты по изобретению можно использовать для профилактики или лечения тревожности у индивидуума, особенно у индивидуума с депрессией, и депрессии, особенно у индивидуума, не отвечающего на терапию SSRI, и особенно у индивидуума, которому не ставили диагноз сосудистое нарушение, такой как атеросклероз, облитерирующий атеросклероз, стенокардия, инфаркт миокарда, инсульты, тромбоз, M. Burger, варикозное расширение вен, тромбофлебит, болезнь Рейно, гиперхолестеринемия, гиперлипидемия, повышенное артериальное давление, временные нарушения, связанные с ишемией, тромбоз вен, послеродовой тромбоз и облитерирующий тромбоангиит. Когда речь идет о профилактике и лечении тревожности или депрессии, следует понимать, что предотвращают и лечат одну из основных причин (серотонинергическая система), или симптомы указанных состояний, или оба, в частности, ослабляют, снижают или устраняют симптомы.
Описание чертежей
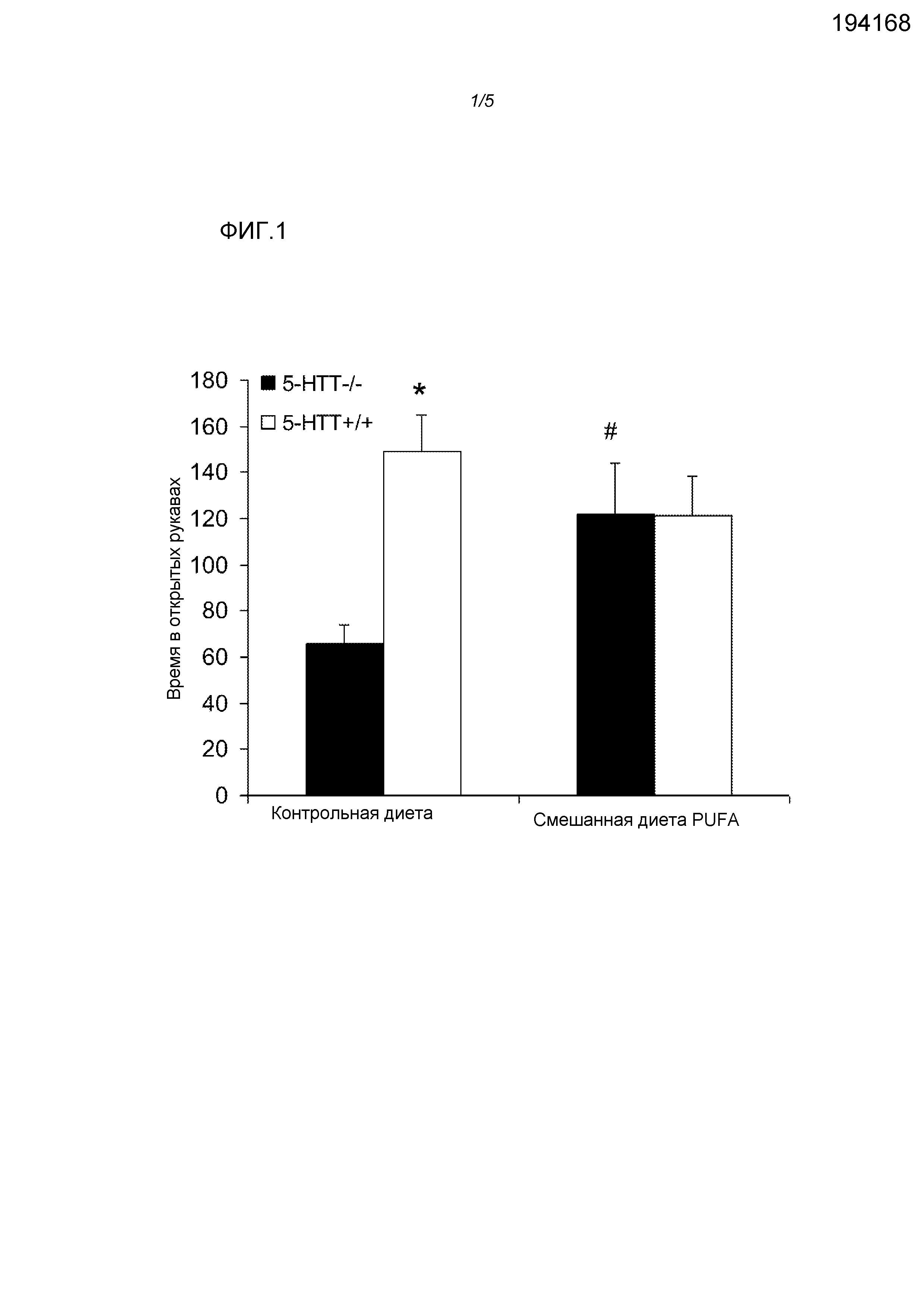
Фигура 1: Эффекты использования диеты у крыс 5-HTT-/- и 5-HTT+/+ при проведении тестов на приподнятом крестообразном лабиринте. Смешанная диета PUFA снижала повышенные уровни тревожности, наблюдаемые у крыс 5-HTT-/-. *p<0,05 крысы 5-HTT-/- по сравнению с крысами 5-HTT+/+ на контрольной диете; # p<0,05 крысы 5-HTT-/- на контрольной диете по сравнению с крысами на смешанной диете PUFA.
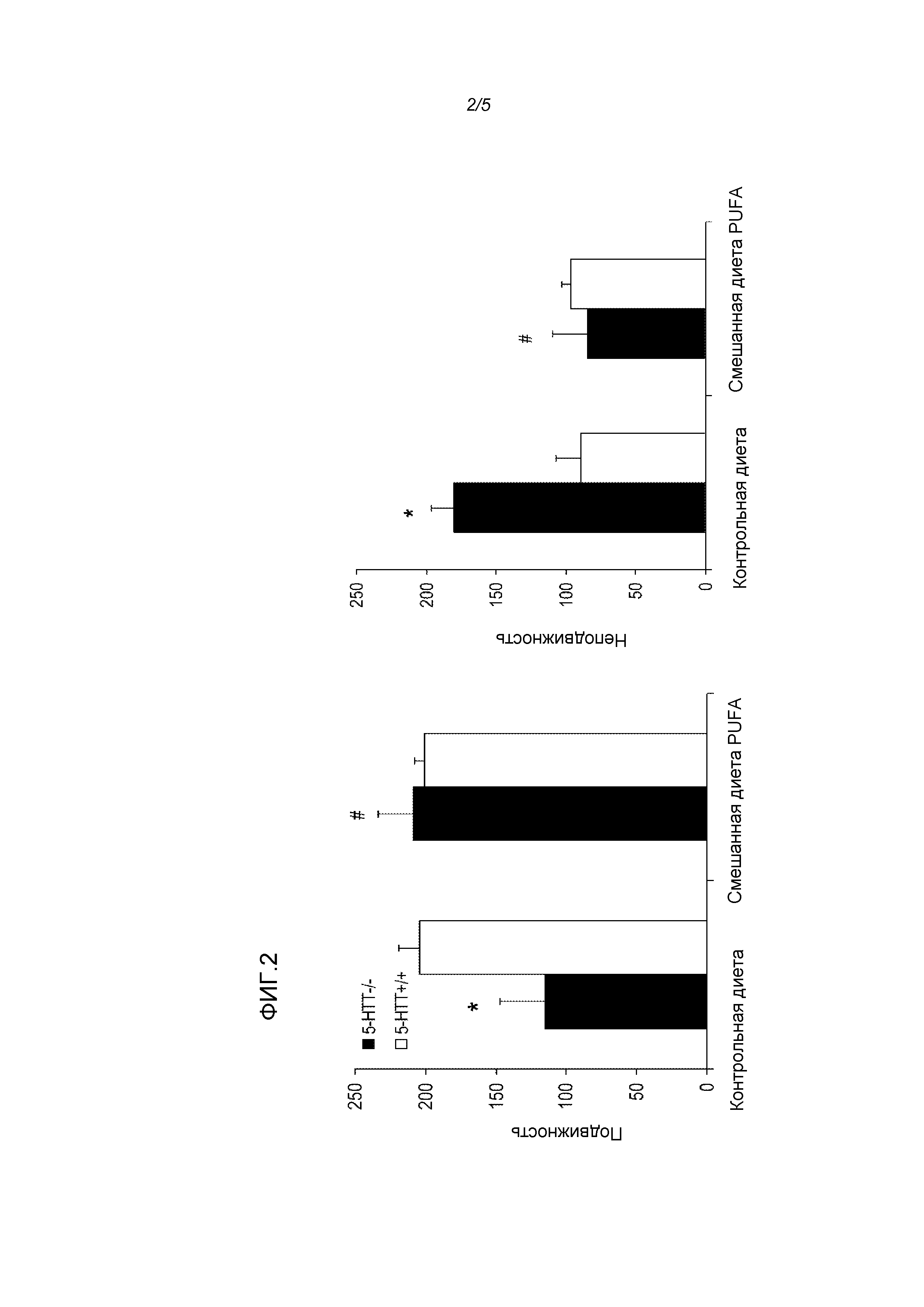
Фигура 2: Эффекты использования диеты у крыс 5-HTT-/- и 5-HTT+/+ на измерение подвижности (слева) и неподвижности (справа) в тесте принудительного плавания при депрессии. Смешанная диета PUFA снижала подобное депрессии поведение (сниженная подвижность/повышенная неподвижность), наблюдаемое у крыс 5-HTT-/-. * p<0,05 Крысы 5-HTT-/- по сравнению с крысами 5-HTT+/+ на контрольной диете; # p<0,05 5-HTT-/- крысы на контрольной диете по сравнению с крысами на смешанной диете PUFA.
Фигура 3: Эффекты использования диеты у крыс 5-HTT-/- и 5-HTT+/+ в тесте "социального взаимодействия". Смешанная диета PUFA улучшала социальное поведение у крыс 5-HTT-/-, о чем свидетельствует увеличение времени контакта (сверху слева) и нормализация самостоятельного ухода (внизу слева). * p<0,05 крысы 5-HTT-/- по сравнению с 5-HTT+/+ на контрольной диете; # p<0,05 крысы 5-HTT-/- на контрольной диете по сравнению с крысами на смешанной диете PUFA.
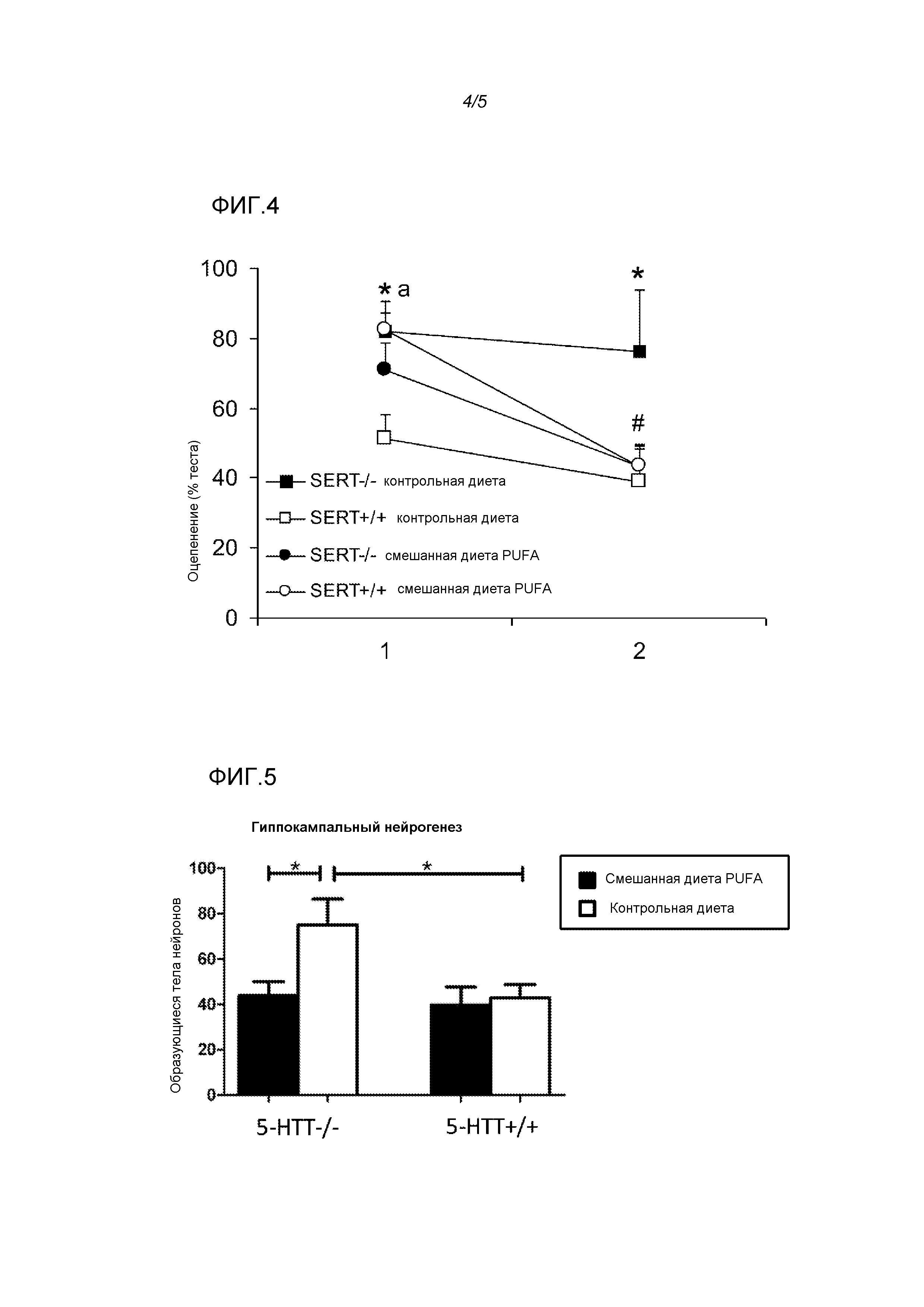
Фигура 4: Эффекты использования диеты у крыс 5-HTT-/- и 5-HTT+/+ на снижение условно-рефлекторного страха. Смешанная диета PUFA улучшала низкую скорость снижения страха, наблюдаемого у крыс 5-HTT-/-. * p<0,05 Крысы 5-HTT-/- по сравнению с 5-HTT+/+ на контрольной диете; # p<0,05 Крысы 5-HTT-/- на контрольной диете по сравнению с крысами на смешанной диете PUFA; p<0,05 крысы 5-HTT+/+ на контрольной диете по сравнению с крысами на смешанной диете PUFA.
Фигура 5: Эффекты использования диеты у крыс 5-HTT-/- и 5-HTT+/+ на гиппокампальный нейрогенез, выражаемый как образующиеся тела нейронов, определяемые при окрашивании DCX. Смешанная диета PUFA нормализовала аномальный нейрогенез, наблюдаемый у крыс 5-HTT-/-. * p<0,05 для указанных сравнений.
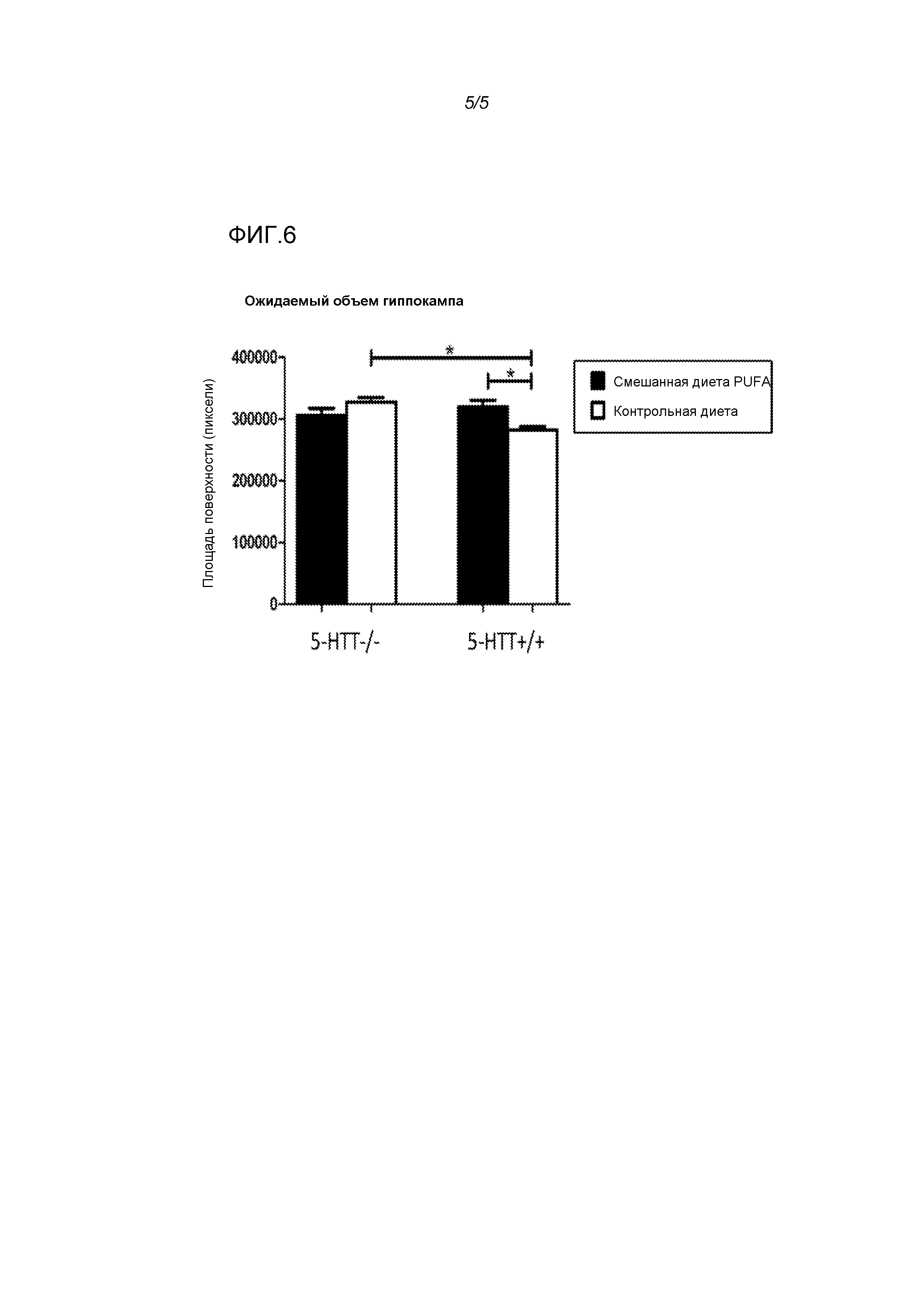
Фигура 6: Эффекты использования диеты у крыс 5-HTT-/- и 5-HTT+/+ на ожидаемый объем гиппокампа. Смешанная диета PUFA повышала объем гиппокампа у крыс 5-HTT+/+. * p<0,05 для указанных сравнений.
Экспериментальная часть
МАТЕРИАЛЫ И СПОСОБЫ
Животные
Крыс, нокаутных по гену переносчика серотонина (Slc6a41Hubr), получали посредством ENU-индуцированного мутагенеза [36]. Экспериментальных животных получали при скрещивании гетерозиготных крыс, нокаутных по гену переносчика 5-HT (5-HTT+/-), подвергнутых ауткроссингу с коммерческими крысами Wistar дикого типа (Harlan, Ter Horst, The Netherlands) в течение по меньшей мере восьми поколений. Всех животных держали по двое на клетку при температуре (21±1°C) в камере с регулируемой влажностью (относительная влажность 45-60%), и они имели неограниченный доступ к воде и пище на всем протяжении эксперимента. Поддерживали светотемновой цикл 12/12 часов с включением света с 08:00 a.m. по 20:00 p.m. Все эксперименты одобрены Committee for Animal Experiments of the Radboud University Nijmegen Medical Centre, Nijmegen, The Netherlands, и предпринимали все попытки для минимизации страданий животных и снижения количества используемых животных.
Диеты
С возраста 65 дней животных держали на контрольной диете или смешанной диете PUFA в течение 3 месяцев (Research Diet Services, Wijk bij Duurstede, The Netherlands). Обе диеты основаны на AIN-93M [37], изокалорийны и идентичны в отношении содержания белков, углеводов, волокон и минеральных веществ. Различия между диетами представлены в таблице 1. В отличие от контрольной диеты, смешанная диета PUFA обеспечивала комбинацию ω-3-PUFA (рыбий жир), фосфолипидов (соевый лецитин) и повышенные уровни витаминов группы B (пиридоксина (витамина B6) и фолиевой кислоты (витамина B11).
Поведение
Приподнятый крестообразный лабиринт
Лабиринт конструировали из поливинилхлорида. Его поднимали на высоту 50 см, и он имел два открытых (50×10) и два закрытых рукава (50×10×40), расположенных таким образом, что рукава одного типа находятся напротив друг друга. Интенсивность освещения, измеряемая в открытых рукавах, составляла 80 лк. Самок крыс тестировали, как описано выше [38]. Крыс помещали в центр лабиринта перед одним из открытых рукавов в течение периода свободного передвижения 5 мин. Движения и положение животных записывали и регистрировали автоматически с использованием программного обеспечения Ethovision® 3.1 (Noldus Information Technology BV, Wageningen, The Netherlands). Результаты выражали как среднее время, проведенное в открытых рукавах.
Тест принудительного плавания
Использовали цилиндрические стеклянные емкости (50 см в высоту × 18 см в диаметре), наполненных до глубины 30 см водой температурой 22 (+/-1)°C. Самок крыс тестировали, как описано выше [38]. Вкратце, после 15-минутного испытания в воде в день 1 животных тестировали через 24 часа в цилиндрах с водой в течение 5 мин. Движения крыс снимали на видео для отдельного измерения продолжительности неподвижности (с). Поведенческую неустойчивую "неподвижность" определяли следующим образом: осуществление движений в течение по меньшей мере 2 секунд или осуществление только тех движений, которые необходимы для держания носа выше воды. Активное лазание, ныряние и плавание вдоль стены оценивали как подвижность (с).
Тест "социального взаимодействия"
Социальное взаимодействие измеряли в тестовой клетке (50×50×75 см ((д × ш × в)) с акриловыми пластиковыми стенками, наполненной древесными опилками (2 см). Экспериментальную комнату освещали флуоресцентной красной лампой 25 Вт, смонтированной на 60 см выше тестовой клетки. За 24 часа до теста самок крыс приучали к тестовой клетке в течение 10 мин. Пары для социального взаимодействия составляли таким образом, что обе крысы подходили по генотипу и диете; крыс из одного помета или исходной клетки не ставили в пару. В день теста тестовые пары изолировали на 2 часа до теста для повышения степени социального поведения и затем тестировали в течение 15 мин. Поведение животных записывали на видео. Экспериментатор не знал о генотипе и диетической группе животных. С использованием программы Observer 4.0 (Noldus Information Technology, Wageningen, The Netherlands) оценивали частоты и продолжительность следующего поведения: контакт: обнюхивание или облизывание любой части тела тестового партнера; самостоятельный уход: облизывание передней лапы, умывание морды, почесывание, уход за телом и чистка гениталий; следование/преследование: движение в направлении или преследование удаляющегося тестового партнера; отсутствие контакта: ни одного из этих типов поведения. Поведение оценивали на отдельных животных. Животные использовали однократно.
Выработка и угасание реакции страха по Павлову
Выработку реакции проводили в самодельной камере с прозрачными стенками и полом из металлических прутьев. Камеру монтировали сверху клетки. После приучения к камере животных подвергали сессии выработки реакции, состоящей из периода адаптации 120 сек, трех парных (различные интервалы между стимулами 60-120 сек) вызывающих реакцию стимулов (CS) (звук 30 сек, 80 дБ, 3 кГц) и безусловного стимула (US) (электроболевое раздражение лап 1 сек, 0,6 мА), при которых US присутствовал в течение последних 2 сек CS (собственная программа замораживания). После 120 сек периода закрепления без стимулов крыс возвращали в их исходную клетку. Через 24 часа исходное CS-воспроизведение и последующее CS-угасание (тест 1) измеряли в новых условиях (белые стены и твердый непрозрачный пол из плексигласа) не в той комнате, которую использовали для выработки реакции. После 120 сек периода адаптации крысы получали пять 30-секундных CS стимулов (различные интервалы между стимулами 60-120 сек). Эту же процедуру повторяли через 24 (тест 2) и 48 (тест 3) часов для оценки угасания. Оцепенение (отсутствие видимого движения за исключением дыхания) оценивал опытный наблюдатель, не знавшим об условиях обработки, с использованием Observer 4.0 (Noldus Information Technology). В каждой сессии суммировали оцепенение и выражали оцепенение при угасании в тестах 2 и 3 как % оцепенения в течение теста 1.
Иммуногистохимия
Иммуноокрашивание
Способ взят из [38, 39]. Наркотизированных крыс транскардиально перфузировали 0,1M PBS, pH 7,3, а затем 400 мл 4% параформальдегида, разведенного в 0,1M PB, pH 7,2. Затем головной мозг вынимали из черепа и фиксировали в течение ночи в 4% параформальдегиде при 4°C. Перед получением срезов головной мозг подвергали криопротекции 30% сахарозой в 0,1 M PB. Срезы головного мозга толщиной 40 мкм получали на замораживающем микротоме и собирали в 6 параллельных сериях в 0,1 M PBS, содержащем 0,1% азид натрия. Для каждого окрашивания использовали одну серию от каждой крысы. Свободно плавающие срезы три раза промывали в PBS и предварительно инкубировали с 0,3% пергидролем (30% H2O2, Merck, Darmstadt, Germany) в течение 30 мин. После трехкратного промывания в PBS срезы предварительно замачивали в течение 30 мин в среде для инкубации, состоящей из PBS с 0,1% бычьим сывороточным альбумином и 0,5% Triton X-100. Срезы инкубировали с антителом козла против DCX (к концевому C-18 эпитопу; 1:3000; Santa Cruz Biotechnology Inc, Santa Cruz, CA, USA) в течение ночи при комнатной температуре на шейкере. Срезы инкубировали в течение 90 мин при комнатной температуре с антителами осла против кролика (1:1500 в среде для инкубации, Jackson ImmunoResearch Laboratories, West Grove, PA, USA) и в течение 90 мин при комнатной температуре с ABC-elite, разведенном 1:800 в PBS (Vector Laboratories, Burlingame, CA, USA). Между инкубациями срезы три раза промывали PBS. Комплекс DCX-антитела и пероксидазы визуализировали с использованием окрашивания тетрагидрохлоридом 3,3'-диаминобензидина (DAB). Срезы инкубировали в течение 10 мин в растворе хромогена, состоящем из 0,02% DAB и 0,03% Ni-сульфата аммония в 0,05M Трис-буфере (pH 7,6), и затем в течение 10 мин в растворе хромогена, содержащем 0,006% пероксида водорода. Это приводит к иссиня-черному окрашиванию. Затем срезы три раза промывали в PBS и помещали на покрытые желатином и хромовыми квасцами предметные стекла, высушивали в течение ночи в сушильной печи при 37°C, дегидрировали в серии этанола повышающейся концентрации, очищали ксилолом, заключали в Entellan (Merck) и покрывали покровным стеклом.
Количественный анализ
Количество DCX-иммуноположительных клеток подсчитывали с использованием программного обеспечения Stereo Investigator (MicroBrightfield Inc, Williston, VT, USA). Клетки подсчитывали в гиппокампе на срезах в стереотаксических координатах брегма -3,30 мм, -3,80 мм и -4,16 мм при 20-кратном увеличении. Результаты для каждого субъекта выражали как общее количество клеток, подсчитанных на этих трех срезах и сложенных вместе. Объем гиппокампа оценивали с использованием фотографий гиппокампа в стереотаксических координатах брегма -3,30 мм при 2,5-кратном увеличении. С использованием общедоступного программного обеспечения для обработки изображений ImageJ мы последовательно рисовали контур вокруг гиппокампа, площадь поверхности которого вычисляли.
Статистический анализ
Данные представляли в виде среднего ± стандартная ошибка среднего (S.E.M.). Весь статистический анализ осуществляли с использованием Statistical Package для Social Sciences версии 16.0 для Windows (SPSS Inc., Chicago, IL, USA). Данные анализировали с использованием двусторонней ANOVA или ANOVA повторных измерений (воспроизведение угасания страха) с использованием генотипа и диеты в качестве межсубъектных факторов. Значимые взаимосвязи генотипа и диеты дополнительно анализировали с использованием критерия Стьюдента. Значения вероятности p<0,05 считали значимыми. NS=не значимо.
РЕЗУЛЬТАТЫ
Смешанная диета PUFA проявляет анксиолитические свойства у крыс 5-HT-/- в приподнятом крестообразном лабиринте
С помощью двустороннего ANOVA выявляли эффект генотипа (F(3,16)=9,69, p<0,01) и взаимосвязь генотипа и диеты (F(3,36)=9,77, p<0,01) в течение времени, проведенного в открытых рукавах, но не наблюдали основного эффекта диеты (F(3,36)=0,93, NS) (фигура 1). Крысы 5-HTT-/- на контрольной диете проводили значимо меньше времени в открытых рукавах крестообразного лабиринта, чем крысы 5-HTT+/+ (t(8)=4,2, p<0,005). Смешанная диета PUFA повышала время, проводимое в открытых рукавах в группе 5-HTT-/- (t(8)=3,2, p<0,05), одновременно не оказывая эффекта на крыс 5-HTT+/+ (p>0,05).
Смешанная диета PUFA проявляет подобные антидепрессантам свойства у крыс 5-HTT-/- в тесте принудительного плавания
При оценке плавательного поведения (подвижности) в тесте принудительного плавания мы наблюдали достоверные эффекты генотипа (F(3,12)=5,41, p<0,05) и диеты (F(3,12)=6,90, p<0,05) и взаимосвязь генотипа и диеты (F(3,12)=9,15, p<0,05) (фигура 2a). Отмечали значимо большее время подвижности для крыс 5-HTT+/+ по сравнению с крысами 5-HTT-/-, обе группы на контрольной диете (t(7)=4,7, p<0,01). Среди крыс 5-HTT-/- значимое повышение времени подвижности обнаруживали в группе смешанной диеты PUFA по сравнению с группой контрольной диеты (t(5)=3,3, p<0,05); этот эффект диеты обнаруживали у крыс 5-HTT+/+ (p>0,05). Величины эффекта для времени, проведенного на плаву (неподвижность), в общем, являлись схожими. Таким образом, обнаруживали эффекты генотипа (F(3,12)=6,54, p<0,05), диеты (F(3,12)=7,90, p<0,05) и взаимосвязи генотипа и диеты (F(3,12)=8,74, p<0,05) (фигура 2b). Эти эффекты являлись результатом значимого снижения времени неподвижности у крыс 5-HTT+/+ по сравнению с крысами 5-HTT-/- на контрольной диете (t(7)=4,0, p<0,01) и значимого различия между крысами 5-HTT-/- на смешанной диете PUFA по сравнению с крысами 5-HTT-/- на контрольной диете (t(5)=3,4, p<0,05) без различия между крысами 5-HTT+/+ на контрольной и смешанной диете PUFA (p>0,1).
Смешанная диета PUFA усиливает социальное поведение у крыс 5-HTT-/-
При анализе общего времени, проводимого в контакте с тестовым партнером в тесте "социального взаимодействия", мы обнаружили взаимосвязь генотипа и диеты (F(3,12)=14,27, p<0,005) (фигура 3A). Кроме того, обнаруживали эффект диеты (F(3,12)=5,32, p<0,05), но не основной эффект генотипа (F(3,12)=0,01, NS). Крысы 5-HTT+/+ на контрольной диете проводили значимо больше времени в контакте, чем крысы 5-HTT-/- на контрольной диете в течение этого теста (t(6)=4,8, p<0,005). Кроме того, смешанная диета PUFA значимо повышала время контакта при носительстве генотипа 5-HTT-/- (t(6)=3,8, p<0,01). Не было значимого различия времени контакта между группами контрольной и смешанной диеты PUFA для крыс 5-HTT+/+ (p>0,05). Ни один из этих эффектов ни обнаруживали для неконтактного параметра (генотип (F(3,12)=4,56, NS); диета (F(3,12)=0,24, NS); взаимосвязь генотипа и диеты: (F(3,12)=2,67, NS)) (фигура 3B).
При сравнении времени, проводимого за самостоятельным уходом, мы обнаруживали взаимосвязь генотипа и диеты (F(3,12)=10,98, p<0,01), эффект диеты (F(3,12)=6,99, p<0,05) и эффект генотипа (F(3,12)=14,90, p<0,005) (фигура 3C). Крысы 5-HTT+/+ тратили больше времени на уход по сравнению с крысами 5-HTT-/-, когда и тех, и других держали на контрольной диете (t(6)=6,6, p<0,005). При сравнении крыс 5-HTT-/- на смешанной диете PUFA с соответствующими крысами на контрольной диете выявили, что последняя группа тратит значимо больше времени на самостоятельный уход (t(6)=4,2, p<0,005). Этот эффект диеты не наблюдали у животных 5-HTT+/+ (p<0,05).
Смешанная диета PUFA облегчает угасание страха у крыс 5-HTT-/-
С помощью ANOVA повторных измерений времени, проведенного в оцепенении, выраженного как % оцепенения в течение исходного теста воспроизведения (тест 1), выявляли взаимосвязь генотипа и диеты (F(3,12)=5,06, p<0,05) и эффект генотипа (F(3,12)=5,06, p<0,05), но не диеты (F(3,11)=0,25, NS) (фигура 4). Таким образом, смешанная диета PUFA облегчала угасание страха у крыс 5-HTT-/-, в ином случае демонстрирующих угасание страха. Эффект диеты у крыс 5-HTT+/+ (t(6)=3,5, p<0,05) отсутствовал в течение теста 3 (t(6)=2,3, NS), в то время как эффект генотипа у животных на контрольной диете в течение теста 2 (t(7)=2,7, p<0,05) поддерживался на всем протяжении теста 3 (t(7)=2,9, p<0,05). Кроме того, эффект диеты у крыс 5-HTT-/- наблюдали только в течение теста 3 (тест 2: t(6)=0,93, NS; тест 3: t(6)=2,4, p<0,05).
Смешанная диета PUFA нормализует гиппокампальный нейрогенез у крыс 5-HTT-/-
Гиппокампальный нейрогенез показал взаимосвязь генотипа и диеты (F(3,31)=4,51, p<0,05) (фигура 5), а также основной эффект диеты (F(3,31)=6,42, p<0,05). Не обнаруживали эффект генотипа (F(3,31)=3,93, NS). Животные 5-HTT-/- демонстрировали большее иммуноокрашивание DCX, чем крысы 5-HTT+/+, когда и тех, и других держали на контрольной диете (t(15)=2,42, p<0,05). При сравнении эффектов диеты у животных 5-HTT-/- обнаруживали значимое снижение DCX-иммуноположительных гиппокампальных нейронов у животных на смешанной диете PUFA (t(17)=3,38, p<0,005). У животных 5-HTT+/+ диета не оказывала эффекта на нейрогенез (t(15)=0,32, NS).
Смешанная диета PUFA сглаживает различия объема гиппокампа между крысами 5-HTT+/+ и 5-HTT-/-
Объем гиппокампа демонстрировал взаимосвязь генотипа и диеты (F(3,31)=6,52, p<0,05) (фигура 6). Не обнаруживали достоверных эффектов диеты (F(3,31)=1,42, NS) или генотипа (F(3,31)=1,37, NS). Объем гиппокампа являлся большим у крыс 5-HTT-/- по сравнению с крысами 5-HTT+/+ (t(15)=2,98, p<0,001), и наблюдали значимое увеличение гиппокампа у крыс 5-HTT+/+ в результате использования смешанной диеты PUFA (t(14)=3,05, p<0,001). Животные с обоими генотипами на смешанной диете PUFA не отличались по объему гиппокампа (t(16)=0,84, NS).
ОБСУЖДЕНИЕ
Мы исследовали эффекты смешанной диеты PUFA на животных, о которых известно, что они проявляют повышенные уровни тревожности, а также подобные депрессии симптомы. В настоящем исследовании крысы 5-HTT-/- проявляли повышенные уровни тревожности, о чем свидетельствует снижение времени, проводимого в открытых рукавах приподнятого крестообразного лабиринта, и более медленное угасание условнорефлекторного страха. Аналогично, в настоящем исследовании крысы 5-HTT-/- проявляли подобное депрессии поведение, о чем свидетельствует повышение неподвижности в тесте принудительного плавания [38] и снижение социального поведения [40, 41]. В соответствии с предыдущими наблюдениями на другой модели депрессии на животных [32], родственной болезни Альцгеймера, снижали подобные депрессии симптомы у крыс 5-HTT-/- с помощью смешанной диеты PUFA, включающей ω-3-PUFA, фосфолипиды и витамины группы B. Кроме того, в настоящее время мы впервые показали, что одинаковое лечебное питание полностью сглаживает тревожность у этих животных. Индуцируемые диетой изменения поведения сопровождались нормализацией гиппокампального нейрогенеза у крыс 5-HTT-/- и повышением объема гиппокампа у крыс дикого типа. Представленные данные позволяют предполагать, что можно использовать комбинированное введение ω-3-PUFA, фосфолипидов и витаминов группы B для лечения и тревожности, и депрессии, и оно может помочь нормализовать аномалии нейрогенеза в головном мозге.
Поведенческие тесты
Как ожидали и демонстрировали ранее, животные 5-HTT-/- проводили значимо меньше времени в открытых рукавах приподнятого крестообразного лабиринта, и не удавалось погасить условнорефлекторный страх [42]. Эти поведенческие проявления соответствовали повышенной тревожности, отчаяния, сниженной коммуникабельности и подобной PTSD (посттравматическому стрессовому расстройству) эмоциональности, соответственно, и являются хорошо задукоментированными свойствами большого депрессивного расстройства, а также других аффективных расстройств [43-48]. Любопытно, что, в то время как крысы 5-HTT-/- не отвечали на SSRI [41], смешанная диета PUFA облегчала эти симптомы до такой степени, что поведение крыс 5-HTT-/- и 5-HTT+/+ являлось неотличимым. Эти данные позволяют предполагать, что смешанная диета PUFA может служить альтернативой лечению тревожности и подобных депрессии симптомов у не отвечающих на терапию SSRI индивидуумов, в частности, отличающихся наследственным снижением функции 5-HTT.
Особый интерес представляют данные о том, что смешанная диета PUFA значимо повышает общее время, проводимое в контакте с незнакомым партнером в течение теста "социального взаимодействия", у животных 5-HTT-/-. Сниженное социальное взаимодействие крыс 5-HTT-/- связывают с повышением риска развития аутизма [48, 49]. В связи с этим, наши данные соответствуют обнаруженному ранее положительному воздействию лечения ω-3-PUFA у детей, страдающих аутизмом [50]. Хотя остается определить, являлись ли индивидуальные различия отвечаемости на это лечение связанными с генотипом 5-HTTLPR, пути, участвующие в улучшении социального поведения в результате пролонгированного введения ω-3-PUFA, могут являться схожими.
Нейрогенез
Аналогично данным о поведении, смешанная диета PUFA эффективно корректировала гиппокампальный нейрогенез у крыс 5-HTT-/-, возвращая общее количество DCX-иммунореактивных нейронов к уровню, обнаруживаемому у крыс 5-HTT+/+. В то время как результаты очень схожи, DCX имеет несколько ключевых преимуществ по сравнению с "золотым стандартом" бромдезоксиуридином (BrdU): он не требует ни окрашивания для вторичного маркера для определения нейронов, ни инъекции мутагенного вещества живым животным. Подтверждали роль DCX в качестве маркера нейрогенеза [35, 51].
Наблюдение о том, что DCX-иммунореактивность повышалась у крыс 5-HTT-/- и снижалась у этих животных смешанной диетой PUFA, является парадоксальным, учитывая сообщения о том, что ухудшение симптомов депрессии сопровождается снижением объема гиппокампа, и что успешное лечение SSRI ассоциировано с 5HT1A-зависимым повышением гиппокампального нейрогенеза [14]. Мы выдвигали ряд гипотез относительно этой разобщенности между гиппокампальным нейрогенезом и снижением симптомов депрессии:
1] Хотя у грызунов 5-HTT-/- может снижаться аффинность к рецептору 5HT1A [33, 41], возможно, что передача сигнала 5HT1A все еще является более высокой у грызунов с недостаточностью 5-HTT по сравнению с животными 5-HTT+/+ по причине повышенных уровней внеклеточного 5-HT [33, 41]. Т.к. повышенная передача сигнала 5HT1A может участвовать в гиппокампальном нейрогенезе, это может объяснять повышенный нейрогенез, наблюдаемый у крыс 5-HTT-/-. Реверсирование этого явления в результате смешанной диеты PUFA соответствует опубликованным данным о повышении связывания рецептора 5HT1A после мульти-нутриентного лечебного питания [21]. Предположительно, существует оптимальный уровень передачи сигнала 5-HT1A для регуляции гиппокампального нейрогенеза, и смешанная диета PUFA может помочь восстанавливать ее.
2] Эффекты ω-3-PUFA на нейрогенез у крыс 5-HTT-/- также можно объяснять сосудистыми изменениями. Т.е. s-аллель 5-HTTLPR является фактором риска развития сосудистых заболеваний, и пациенты с депрессией, несущие s-аллель, отличаются сосудистыми аномалиями [53]. Ишемические состояния в конкретных условиях могут повышать уровень нейрогенеза, что наблюдают у восстанавливающихся после инсульта пациентов. Прием ω-3-PUFA может оказывать положительные эффекты на сосудистые параметры, такие как перфузия головного мозга, таким образом, возможно, снижая уровни индуцируемого ишемией гиппокампального нейрогенеза. Улучшение сосудистых состояний может улучшать выживаемость новых нейронов, позволяя им интегрироваться в существующие системы нейронов, и участвовать в улучшении настроения и когнитивной деятельности. Оценка эффекта диетического лечения на перфузию головного мозга и выживание и интеграцию новых нейронов у крыс 5-HTT-/- может пролить больше света на любую возможную связь между этими параметрами.
3] Крысы 5-HTT-/- демонстрируют снижение общего количества нейротрофического фактора головного мозга (BDNF) в гиппокампе и префронтальной коре [54]. Это означает, что снижается выживание гиппокампальных нейронов, т.к. полагают, что они тесно связаны [55]. Возможно, снижение BDNF приводит к нарушению выживания новых нейронов, снижая эффективность нейрогенеза. Повышенная пролиферация нейронов у крыс 5-HTT-/-, наблюдаемая в настоящем исследовании, может отражать компенсаторный механизм. Т.к. известно, что добавление ω-3-PUFA повышает уровень гиппокампального BDNF [56-58], выживание нейронов может улучшаться, снижая потребность в дополнительном нейрогенезе. В связи с этим, Wellman et al. [42] предполагают, что нарушение угасания страха у мышей 5-HTT-/- вызвано нарушением модуляторной функции префронтальной коры в отношении активности миндалевидного тела. Это частично компенсируется удлинением дендритов, происходящих из инфралимбической коры, хотя этого не достаточно для нормализации нарушенного ответа угасания условнорефлекторного страха у животных 5-HTT-/-. Исследование способности этих новых нейронов выживать и интегрироваться в существующие нейронные сети может оказаться полезным в тестировании этой гипотезы.
В заключение, комбинированное введение ω-3-PUFA, фосфолипидов и витаминов группы B оказывает глубокий антидепрессантный и анксиолитический эффект у крыс 5-HTT-/-, а также нормализующий эффект на повышенный нейрогенез, наблюдаемый при этом генотипе. Хотя механизмы, регулирующие это положительное воздействие, требуют дальнейшего исследования, результаты настоящего исследования позволяют четко рассматривать это лечебное питание как возможное терапевтическое воздействие для пациентов. В частности, учитывая сходства между грызунами 5-HTT-/- и s-аллельным вариантом 5-HTTLPR [33, 59], и исследования с использованием мета-анализа, демонстрирующие, что носители s-аллеля, в общем, плохо отвечают на терапию SSRI [13, 60], наши результаты могут иметь эвристическую ценность для лечения SSRI-резистентных пациентов, отличающихся носительством s-аллеля 5-HTTLPR.
Ссылки






Реферат
Группа изобретений относится к применению препарата, в частности питательного препарата, для профилактики или лечения тревожности у индивидуума, который характеризуется снижением функции гена переносчика серотонина. Предложено применение препарата для производства продукта, который содержит: a) по меньшей мере одну ω-3-полиненасыщенную жирную кислоту (PUFA); b) по меньшей мере два фосфолипида, выбранных из фосфатидилсерина, фосфатидилинозитола, фосфатидилхолина и фосфатидилэтаноламина или любой их смеси; и c) одно или несколько соединений, являющихся факторами метаболизма серотонина, выбранных из витамина группы B и триптофана. Также предложено применение препарата для производства продукта того же состава для регуляции нейрогенеза у индивидуума, который характеризуется снижением функции гена переносчика серотонина. Технический результат состоит в эффективности лечения тревожности и подобных депрессивных симптомов у заявленной группы пациентов, которые не отвечают на терапию селективными ингибиторами обратного захвата серотонина (SSRI). 2 н. и 18 з.п. ф-лы, 6 ил., 1 табл.

Комментарии