Способ получения производных бензамида,их гидрохлоридов или оптических изомеров - SU1241986A3
Код документа: SU1241986A3
Описание
Изобрет.ение относится к оргггнн- ческой химии, а именно к способу получения пр.оизводных бензамида общей формулы
Ег ОА:,
/Ч 1
f У СОБНСН, .
«i 0 „i/
где R4 и Ri - водород, галоген, низший алки|1;
RJ - низший алкил, бензил, незамещенный или замещенный фтором; А - водород, низший алкил; А 2. водород, низший алкил; ацил 5 причем если А,; и А один и тот же пртз ший алкил и RJ - этил, то R или Ra или R/; и R 1 - низший алкил, или их гидрохлоридов или оптических изомеров 5 которые могут найти,применение в фармацевтической промышленности .
Целью изобретения является разработка способа получения соединений формулы (I)5 которые обладают высокой терапевтической активностью,
. Предлагаемый способ основан на широко известной реакции конденсации галоидангидрида карбоновой кислоты с аминогр уппой.
Реакдию предпочтительно проводят в среде пригодного растворителя, ка- npiTMep простого диэтилового эфира, ацетона; метилзтилкетона, хлороформа или толуола, при температуре от до те мпературы кипения реакционной смеси.
Изобретение иллюстрируется сле- дую1П ими примерами.
Пример 1 , К-этил--2-(2--аце-- ток си 3-бромо-6-метоксибенз амид оме-- тил)пирролидин 24,6 г (0,1 моль) 3 бром-2 окси-6 метоксибензойной кислоты растворяют в 50 мл аиетангид рида, после чего добавляют несколько капель концентрированной серной кислоты и смесь нагревают при 60 С в течение 20 ч. После охлаждения добав ляют примерно 100 мг бикарбоната натрия и затем ледяную воду. Растворители упаривают под понюкенным давлением . Остаток кристаллизует из простого диизопропилового эфира. Получают 345,5 г (85%) желаемой ацетоксм- кислоты с т. пл. 146-147 С.
1986 2
5,8 г (20 ммоль) ацетокси-кислоты ))астворяют в 30 мл тионилхлорида. Рас гвор перемешивакзт при комнатной темггерат ре 13 течение 20 ч. Растворитель упаривают и из остатка два раза отгоняют сухой толуол. Получаемый хлорангидрид кислоты (6 г) не- поср€;дственно применяют на следующей стадии (.е, без предварительной о очистки) ,
Этот хлорангидрид кислоты растворяют в 50 мл jcyxoro толуола и к по- л учаемсму раствору д,обавляют 2,6 г (20 ммоль) ; этил--2-(аминометил)пир .; ролидина в И) мл сухого толуола при ком1-1атной температуре. Смесь перемешивают в течегше н очи. Осадок фильт- LiyioT и промыЕ1ают сухим толуолом и су дат. Получе1емый сырой гидрохлорид
;.Q амика перекр РЕСталлизовывают из аце- тонг. Получают 7,2 г (83%) указан- к-ого прорукт в виде белого кристаллического г игрохлорида с т. пл, ч р а S л о ,j с
5 Пример 2, 3-{-)-5-бром-3- -зтил-Р1-( 1 -этил-2-пирролидинилме- тил)-2-окси-6-метоксибензамид.
10 I (0,036 моль) 5-бром-З-этил- - 2--о к ск-б-меток сибензойной кислоты
-;,j растворяют в 300 мл толуола, После добевления 8 мл (0,10 моль) тионил- клорида 17 0,3 мл ди1 1етилформамида ijcaKu,HOKKyio смесь нагревают при 3 течение 1 ч. Растворитель упаривают и остаток растворяют в 200 мл хлороформа. Затем медленно добавляют оаствор 6,1 г (Оэ047 моль) S-(-)- -амипометил-Н-э тил-пирролидкна в 100 мл хлороформа. Через 30 мин упа- 5ива)от растворитель и остаток экстрагируют два раза 100 мл 1 NHC1 и дза раза промывают 75 мл простого зфира. После нейтрализации концентрированным аммиаком и экстракции хлористьгм метиленом получают 14 г указанного соединения в качестве шсла, :к:оторое переводят в тартрат путем растворения в 100 мл этанола и до(5авления раствора 5 г ( + ) - вин- iioj i кислоты в 150 мл 96%-ного этано- - л;;,. После охлаждения получают 14 г (72%) соли с т. пл, 143-145°С.
П р и к ер 3. R(H-)-3-6poM-N- -j j, 1 - (4--фторфенил)метил-2-пирролиди- килиметилJ-2-oкcи-6 мeтoкcибeнзaмид,
55 О,,67 г (0,0027 моль)3-бром-6-ме- токсисалипиловой кислоты растворяют Б 25 мл толуола и 0,2 мл диметил- формс.мид,а5 добавляют 0,96 г
3 .
(0,0081 моль) тионилхлорида и смесь перемешивают при в течение 45 мин. После упаривания растворителя при 50 С в вакууме получают соответствующий хлорангидрид в виде мае- ла, который р астворяют в 10 мл хлороформа и получаемый раствор каплями добавляют к раствору-R (+)(4- -фторбензил)-2-аминометилпирролидина в 15 мл хлороформа. Рй акционную смес перемешивают при 45®С в течение 1 ч. Расх воритель упаривают, остаток обрабатывают 50 мл 0,2 м аммиака и продукт дважды экстрагируют 100 мл простого эфира. После сушки над суль фатом натрия и упаривания растворителя получают 1,23 г сырого бензамида в виде масла. Гидрохлорид осаждают из простого эфира и перекристалли- зовывают из этанола.
Выход: 0,80 г (77%), т. пл. 219°С (разл.).
(а)|°- 93 (,59, СНСЗз).
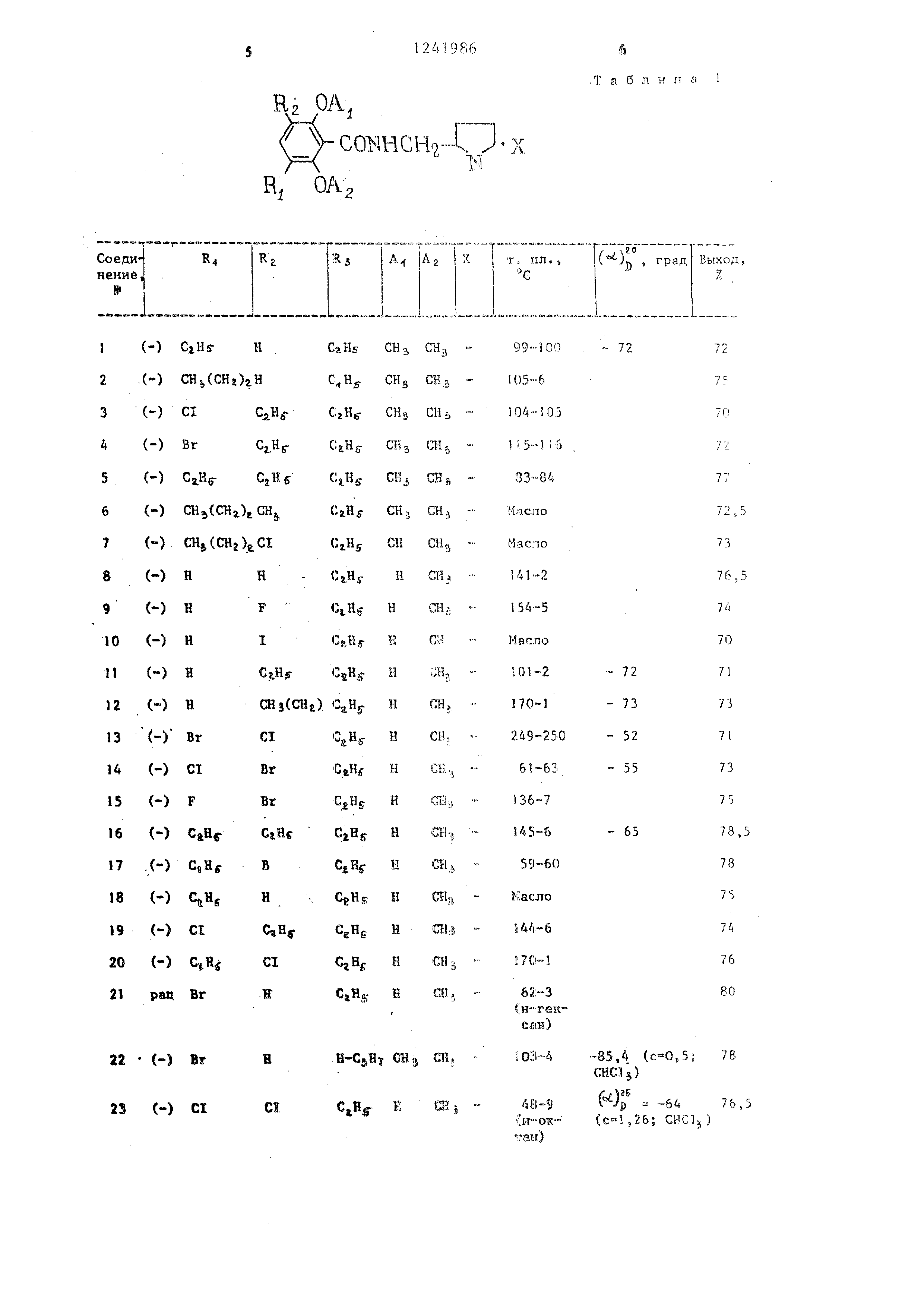
Аналогично примерам 1 - 3 получают указанные в табл. 1 соединения. При этом свободное состояние получают путем растворения соли в воде с последуиш;ей обработкой раствором гидроокиси натрия.
Используемое условное сокращение рац. означает рацемат.
Опыты проводились на крысах весом 22:275 г. Крысы находились в клетках размером 40 х 25 х 30 см и за их поведением наблюдали по ис- течение 5, 20, 40 и 60 мин после дачи апоморфина. Исследуемые соединения впрыскивались за 60 мин до дачи гидрохлорида апоморфина (1 мг/кг), который впрыскивался подкожно в за- тыпок. Та.кая доза и форма дачи позволяют получить достоверный ответ при одновременных незначительных изменениях интенсивности ответа. Кроме того , подкожная дача апоморфина поз- воляет также достичь достоверной гиперактивности. Непосредственно после впрыскивания указанных соединений в клетках помещали по одному животному. Стереотипность определя- лась двумя методами. Один метод заключался в определении интенсивности стереотипности в соответствии со следующей шкалой:
О нет изменения проведения по сравнению с контролью (солевой раствор) или спокойное поведение;
19864
1периодическое обнюхивание;
2непрерывное обнюхивание;
3непрерывное обнюхиваниеj жевание , лизание, кусание.
Другой метод заключался в определении числа.животных, проявляющих гиперактивность, вызываемую апоморфи ном. Калодая группа состояла из 6 - 8 животных. Контрольные опыты (дача солевого pacTBojJa) проводились одновременно . Согласно первому методу ЭДрэ представляет собой дозу, которая снижает рштенсивность стереотипности -на 5% по истечении 60 мин, а согласно второму методу ЭД,р представляет собой дозу, которая снижает число проявляющих гиперактивность живот-.- ных на 50% по истечении 60 мин. Дозы определялись по кривым дозы и реакции (лог.), причем учитывались наименьшие квадраты реакций на 4 - 6 -доз при 6-8 животных на каждую . дозу.
Результаты опытов сведены в табл. 2. Новые соединения сравнивались с сульпиридом, К-этил-2-(3- -сульфониламино-6-метоксибензамидо- метил)-пирролидином. По данным табл. 2 видно, что новые соединения являются активными ингибиторами рецепторов допамина в мозге. Благодаря антагонизму относительно стереотипности и гиперактивности, вызываемых апоморфином, новые соединения вероятно будут блокировать рецепторы допамина -в стриатумной и краевой структурах . Кроме того, они проявляют лучшую антипсихотическую активность, чем известное средство. Так как между блокадой апоморфина и клинической ацуипсихотической активностью существует тесная связь, новые соединения вероятно будут проявлять высокую антипсихотическую активность при их применении в медицине.
Новые соединения также сравнивались с сульпиридом после орального введения. Опыты проводились в соответствии с описанными методами.
Результаты опытов сведены в табл. 3.
Как видно по данным табл. 3, суль- пирид больше не проявляет активности тогда как новые соединения еще проявляют активность после орального введения .
ЬСОБНСН - J X
Е
R ОАг
.Т а 6 л и л а
Е
(-)С1
рац.Бг
(-)Вг
(-)Вг
НС НуCHj Н
НС,%CjH Н
$
вC HSСНх я
Соединение,
Продолжение табл.
(спека- нне) кяе)
CI 00.-5,4 (2Х эта- 76
нол) рН 10,3
83-33.573,5
(этанол)
74-6-66,7 (U аце- 72
тона)
Спегсанне -8,6 (2% ) 80 через ке- xoTQpoe. время
С л м ц а 2
Блокада апоморфнна ЭП кмоль/кг пнутрибрюгаи 1но
Стереотип- Гиперактнв- ность I ность
Сульпирид (известный ) 586
124198610
Т а б л и ц а 3




Реферат
Способ получения производных бензамида общей формулы R2 ОА, V /I (оУ-сшнси -ч/ УЧ . ) - . R, ОАг R, где R и RJ - водород, галоген, низший алкил; . R - низший алкил, бензил незамещенный или замещенный фтором; А - водород, низший алкил; А г. водород, низший алкил, ацил, причем если А и А один и тот же низший алкил, R этил, то или R, или R и R 2 - низший алкил, их гидрохлоридов или оптических изомеров , отличающийся тем, что соединение общей формулы где Rx(, R 2, А и Аг имеют указанные значения, взаимодействует с соединением общей формулы СО С .H2-N-CHi-O N 3 где R3 имеет указанные значения, С последующим выделением целевого продукта в свободном виде или в виде гидрохлорида, или оптического изомера . ьо UD 00 О ы

Формула


Комментарии