Способ получения цефалоспоринов - SU727147A3
Код документа: SU727147A3
Описание
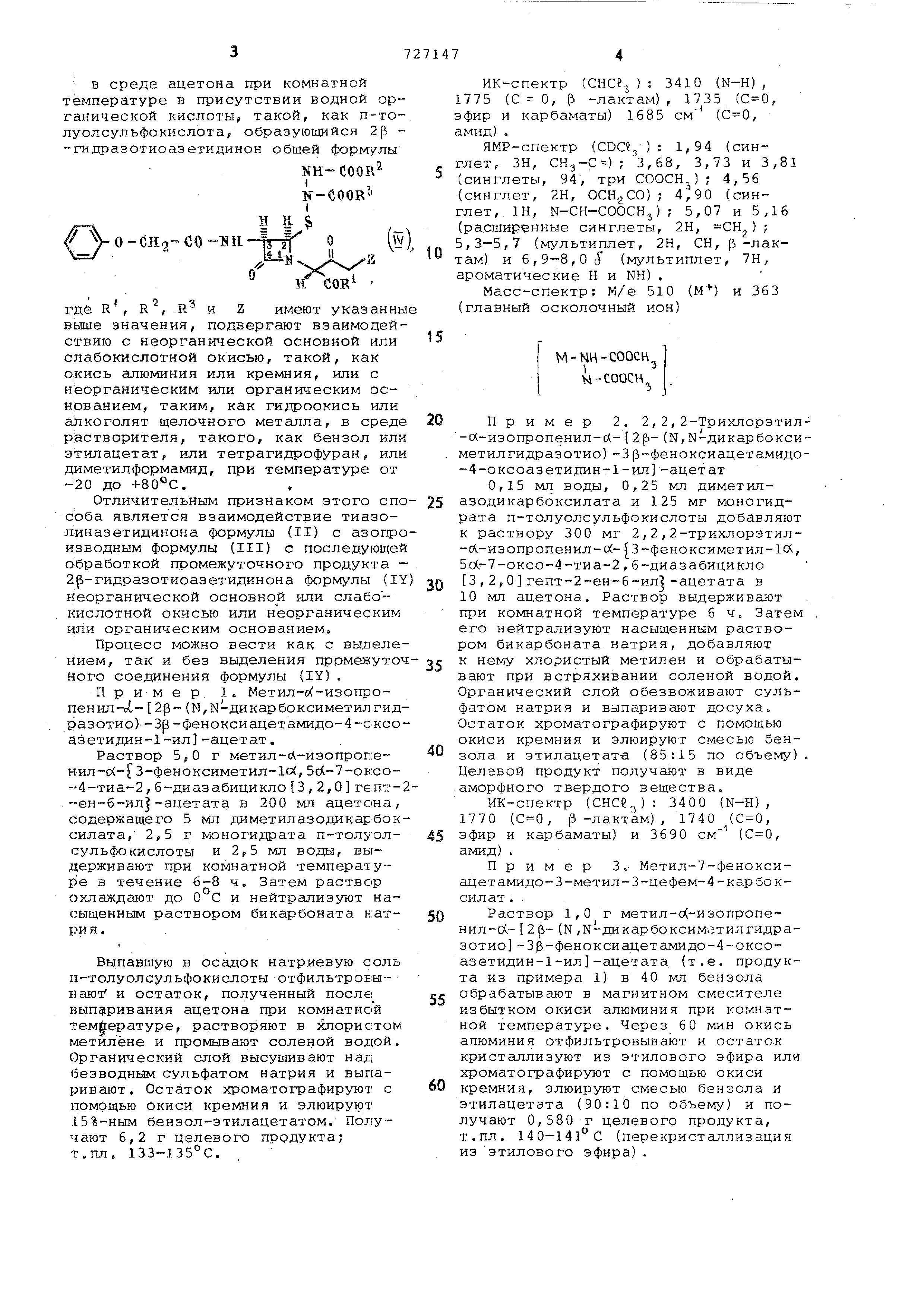
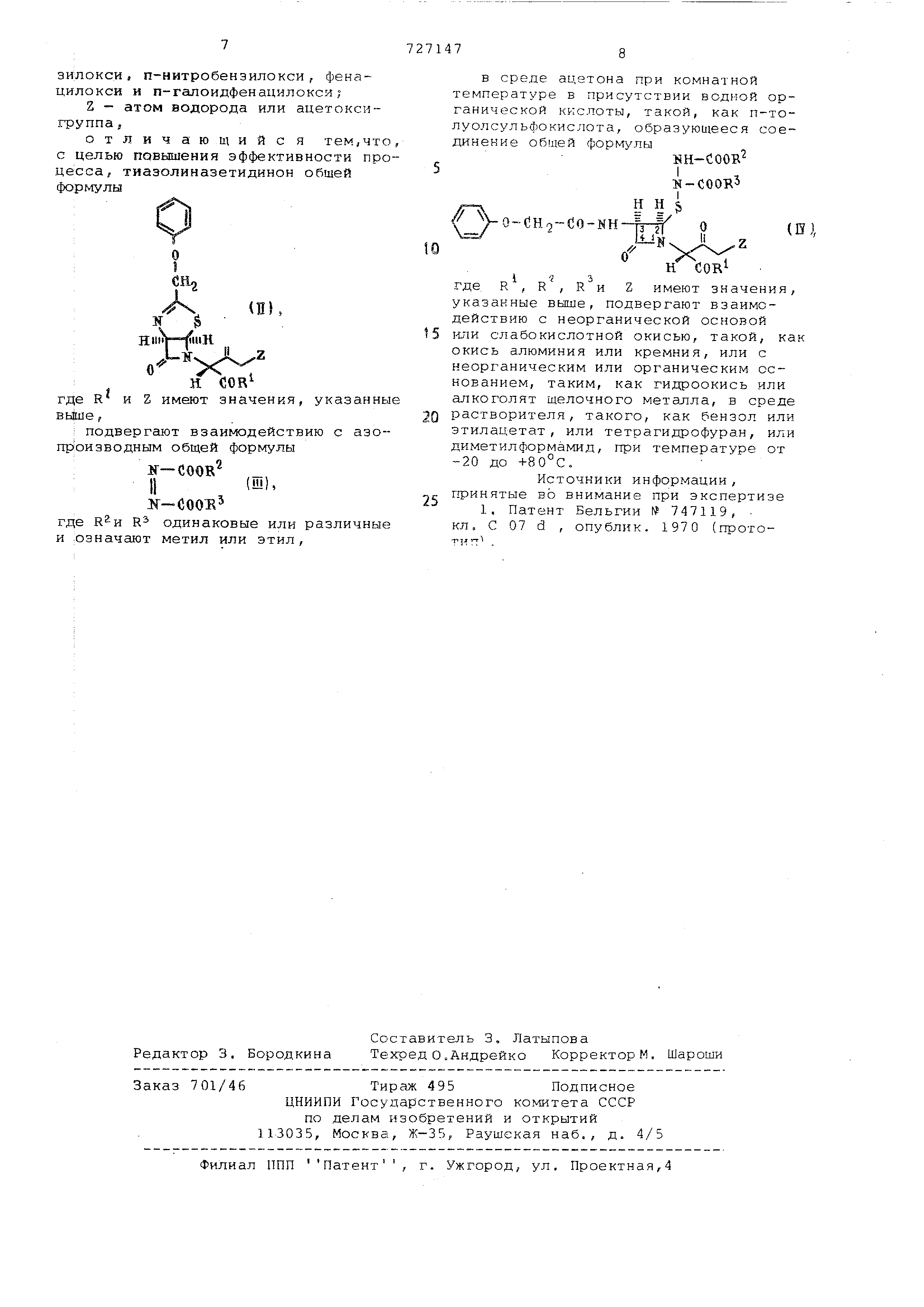
: В среде ацетона при комнатной температуре в присутствии водной органической кислоты, такой, как п-толуолсульфокислота , образующийся 2р -гидразотиоаэетидинон общей форм;улы :NH-COOR I, If-COORI н н. $ Vo-CH -co-BK-frfl « н где R, R , R и Z имеют указанны выше значения, подвергают взаимодей ствию с неорганической основной или слабокислотной окисью, такой, как окись алюминия или кремния, или с неорганическим или органическим основанием , таким, как гидроокись или ahкоголят щелочного металла, в сред растворителя, такого, как бензол или этилацетат, или тетрагидрофуран, или диметилформамид, при температуре от -20 до +80С., Отличительным признаком этого сп соба является взаимодействие тиазолиназетидинона формулы (II) с азопр изводным формулы (III) с последующе обработкой промежуточного продукта 2 -гидразотиоазетидинона формулы (I неорганической основной или слабо-кислотной окисью или неорганическим или органическим основанием. Процесс можно вести как с выд.еле нием, так и без выделения промежуто ного соединения формулы (IY), Пример, 1. Метил-е изопропенил о (,- 2р (N,N-дикapбoкcимeтилгид разотио)-Зр-феноксиацетамидо-4-оксо азетидин-1-ил -ацетат. Раствор 5,0 г метил-Л-изопропенил-с - 3-феноксиметил-1с(, 5d-7-oKco -4-тиа-2,6-диазабицикло 3,2,0 гепт .-ен-б-ил -ацетата в 200 мл ацетона, содержащего 5 мл диметилазодикарбок силата, 2,5 г моногидрата п-толуолсульфокислоты и 2,5 мл воды, выдерживают при комнатной температуре в течение 6-8 ч. Затем раствор охлаждают до 0°С и нейтрализуют насыщенным раствором бикарбоната катрия .. Выпавшую в осадок натриевую соль п-толуолсульфокислоты отфильтровывают и остаток, полученный после выпаривания ацетона при комнатной температуре, растворяют в хлористом метилене и промывают соленой водой. Органический слой высушивают над безводным сульфатом натрия и выпаривают . Остаток хроматографируют с помощью окиси кремния и элюируют 15%-ным бензол-этилацетатом. Получают 6,2 г целевого продукта; т.пл. 133-135°С. ИК-спектр (СНСе ): 3410 (N-H), 1775 (С О, р -лактам) , 1735 (, фир и карбаматы) 1685 см (, мид). ЯМР-спектр (): 1,94 (синглет , ЗН, СНз-С) ; 3,68, 3,73 и 3,81 (синглеты, 94, три СООСН); 4,56 (синглет, 2Н, OCHgCO); 4,90 (синглет , 1Н, N-CH-COOCH,,) ; 5,07 и 5,16 (расширенные синглеты, 2Н, 5,3-5,7 (мультиплет, 2Н, СН, р-лакам ) и 6,9-8,0(5 (мультиплет, 7Н, ароматические Н и NH). Масс-спектр: М/е 510 (М) и 363 (главный осколочный ион) M-NH-COOCH, н-соосн„ Пример 2. 2,2,2-Трихлорэтил- (Х-изопропенил-л- 2р- (Ы,Ы-дикарбоксиметилгидразотио )-Зр-феноксиацетамидо-4-оксоазетидин-1-ил -ацетат 0,15 мл воды, 0,25 мл диметилазодикарбоксилата и 125 мг моногидрата п-толуолсульфокислоты добавляют к раствору 300 мг 2,2,2-трихлорэтил-Л-изопропенил-й- 3-феноксиметил-1сх, 5с(,-7-оксо-4-тиа-2 , 6-ди аз а бицикл о 3,2,0 гепт-2-ен-6-ил -ацетата в 10 мл ацетона. Раствор выдерживают при комнатной температуре 6 ч Затем его нейтрализуют насыщенным раствором бикарбоната натрия, добавляют к нему хлористый метилен и обрабатывают при встряхивании соленой водой. Органический слой обезвоживают сульфатом натрия и выпаривают досуха. Остаток хроматографируют с помощью окиси кремния и элюируют смесью бензола и этилацетата (85:15 по объему). Целевой продукт получают в виде аморфного твердого вещества. ИК-спектр (СНСе,:): 3400 (N-H) , 1770 (, р -лактам), 1740 (, эфир и карбаматы) и 3690 см (, амид). Пример 3. Метил-7-феноксиацетамидо-3-метил-З-цефем-4-карбоксил ат . . Раствор 1,0 г метил-о(-изопропенил-с (.- 2 ji- (N ,N-дикapбoкcим.втилгидpaзотио 3 -феноксиацетамидо-4-оксоазетидин-1-ил -ацетата (т.е. продукта из примера 1) в 40 мл бензола обрабатывают в магнитном смесителе избытком окиси алюминия при комнатной температуре. Через 60 мин окись апюминия отфильтровывают и остато.к кристаллизуют из этилового эфира или хроматографируют с помощью окиси кремния, элюируют смесью бензола и этилацетата (90:10 по объему) и получают 0,580 г целевого продукта, т.пл. 140-141°С (перекристаллизация из этилового эфира). Пример 4. Метил-7-фенсксиацетамидо-З-метил-З-цефем-4-карбокси лат. Раствор 400 мг продукта, получен ного по примеру 1, в 30 мл этилацетата обрабатьовают в магнитном смеси теле избытком окиси кремния и нагре вают с обратным холодильником 48 ч. Фильтрат после удаления окиси кремния выпаривают досуха и остаток кри таллизуют или хроматографирутот с помощью окиси кремния. Получают 180, мг целевого продукта т.пл. 141- 142С, Пример 5. Метил-7-феноксиацетамидо-З-метил-З-цефем-4-карбоксилат , 0,8 мл 30%-ного водного раствора гидроокиси калия добавляют при пере мешивании в магнитном смесителе и при комнатной температуре к раствору 510 мг продукта, полученного по при меру 1, в 20 мл бензола. Перемешивание продолжают 30 мин, а затем отделяют органический слой, промыВсзют его подкисленной водой и высу шивают. Остаток кристаллизуют из этилового эфира и получают 310 мг целевого продукта, т .пл. 141-142С. Пример 6. 2,2,2-Трихлорэтил-7-феноксиацетамидо-3-метил-З-цефем-4-карбоксилат . Раствор 250 г 2,2,2-трикпорэтил- (Х-изопропенил-й- (К,Ы-дикарбокси метилгидразотио)-3 -феноксиацетамид -4-оксоазетидин-1-ил ацетата в 150 бензола обрабатывают в магнитном см сителе при комнатной температуре из бытком окиси алюминия. После выдерж в течение 60 мин, раствор фильтруют и хромат о графируют с помощью окиси кремния, элюируя смесью бензола и этилацетата (93:7 по объему). Получ 150 мг целевого продукта, т.пл. 116- 117°С. Пример 7. Метил-7-феноксиацетамидо-3-метил-З-цефем-4-карбоксилат . В этом примере описан способ перехода от соединения формулы (II) к соединению формулы (I) без выделе ния соединения формулы (IY). Раствор 500 мг метил-Л-изопропеНИЛ- (Х- (5-феноксиметил-1Л, 5сА-7-оксо-4-тиа-2 ,6-диазабицикло 3,2,0 гепт-2-ен-6-ил )-ацетата в 25 мл ацетона содержащего 0,5 мл диметилазодикарбоксилата , 250 мл моногидрата п-толуолсульфокислоты и 0,25 мл воды, выдерживают при комнатной температу ре 6 ч. После охлаждения раствор ней трализуют насыщенным раствором бикарбоната натрия и экстрагируют при встряхивании бензолом и соленой водой . Органический слой высушивают над безводным сульфатом натрия, затем добавляют окись алюминия и пере мешивают магнитной мешалкой в течение 60 мин при комнатной температуре Далее раствор фильтруют, из фильтрата выпаривают бензол и остаток кристаллизуют из этилового эфира. Получают 350 мг целевого соединения, т.пл. 140-143С. Пример 8. Метил-7-феноксиацетамидо-З-метил-З-цефем-4-карбоксилат . Раствор 750 мг метил-о(.-изопропенил-о (- {3-феноксиметил-1СХ,5сХ-7-оксо-4-тиа-2 ,6-диазабицикло 3,2,0 гепт-2-ен-6-ил )-ацетата в 35 мл ацетона, содержащего 0,75 мл диметилазодикарбоксилата , 375 мг моногидрата п-толуолсульфокислоты и 0,375 мл воды, выдерживают 6 ч при комнатной температуре . После охлаждения до раствор нейтрализуют насыщенным раствором бикарбоната натрия, добавляют воду и экстрагируют бензолом. Органический слой высушивают и добавляют 1,2 мл 30%-ного раствора гидроокиси калия при перемешивании магнитной мешалкой и при комнатной температуре . После выдержки в течение 30 мин отделяют органический слой , промывают его подкисленной водой и водой и сушат над безводным сульфатом натрия . Остаток после выпаривания кристаллизуют из этилового эфира и получают 540 мг целевого продукта, т.пл. 141-142°С. Пример 9. Кетил-7-феноксиацетамидо-З-метил-З-цефем-4-карбоксилат (см.примерЗ). Раствор 1,0 г продукта, полученного по примеру 1, в 10 МП безводного тетрагидрофурана добавляют к суспензии 5 эквивалентов метилата лития в 30 мл безводного тетрагидрофурана при -40°С и полученную смесь перемешивают в течение 1 ч.После нейтрализации уксусной кислотой раствор нагревают до комнатной температуры , нейтрализуютводным раствором бикарбоната натрия и экстрагируют этилацетатом. Органический слой промывают водой, сушат над безводным сульфатом натрия и выпаривают в вакууме растворитель. Получают метил-7-феноксиацетамидо-3-метил-З-цефем-4-карбоксилат , который кристаллизуют из ДИЭТРШОВОГО эфира . Формула изобретения Способ получения цефалоспоринов общей формулы Н Н. -СН2-СО-КН-f- S -xi-«y H,-z(i) wI i где R выбран из группы, состоящей из алкокси., имеющей 1-4 атома углерода , трихлорэтокси, п-метоксибензипокси , п-нитробенэилокси, фенацилокси и п-галоидфенацилокси
Z - атом водорода или ацетоксигруппа ,
отличаю щийс я тем,что, с целью повышения эффективности процесса , тиазолиназетидинон общей формулы
(П
§
хЧ
Л
о
И COR
LT fifia
,t
где R
и Z имеют значения, вьЕие
; подвергают взаимодействпр (оизводным общей формулы
Ж-COOR
(1),
1г-СООЕ
где R одинаковые или различные и .означают метил или этил.
в среде ацетона при комнатной температуре в присутствии водной органической кислоты, такой, как п-толуолсульфокислота , образующееся соединение общей формулы
SH-COOB
2 -COOR5
н н 5,
.. У-О-СН -СО-МН-
(D
О
COR
1
R
где R , R , R и Z имеют значения, указанные выше, подвергают взаимодействию с неорганической основой юти слабокислотной окисью, такой, ка окись алюминия или кремния, или с неорганическим или органическим основанием , таким, как гидроокись или алкоголят щелочного металла, в среде растворителя, такого, как бензол или этилацетат , или тетрагидрофуран, или диметилформамид, при температуре от -20 до +80°С.
Источники информации, принятые во внимание при экспертизе
1. Патент Бельгии № 747119, . кл. С 07 d , опублик. 1970 (прото


Реферат

Формула


Комментарии