Способ получения сульфинилхлоридов - SU644383A3
Код документа: SU644383A3
Описание
(54) СПОСОБ ПОЛУЧЕНИЯ СУЯЬФИНйЛХЛОРШОВ



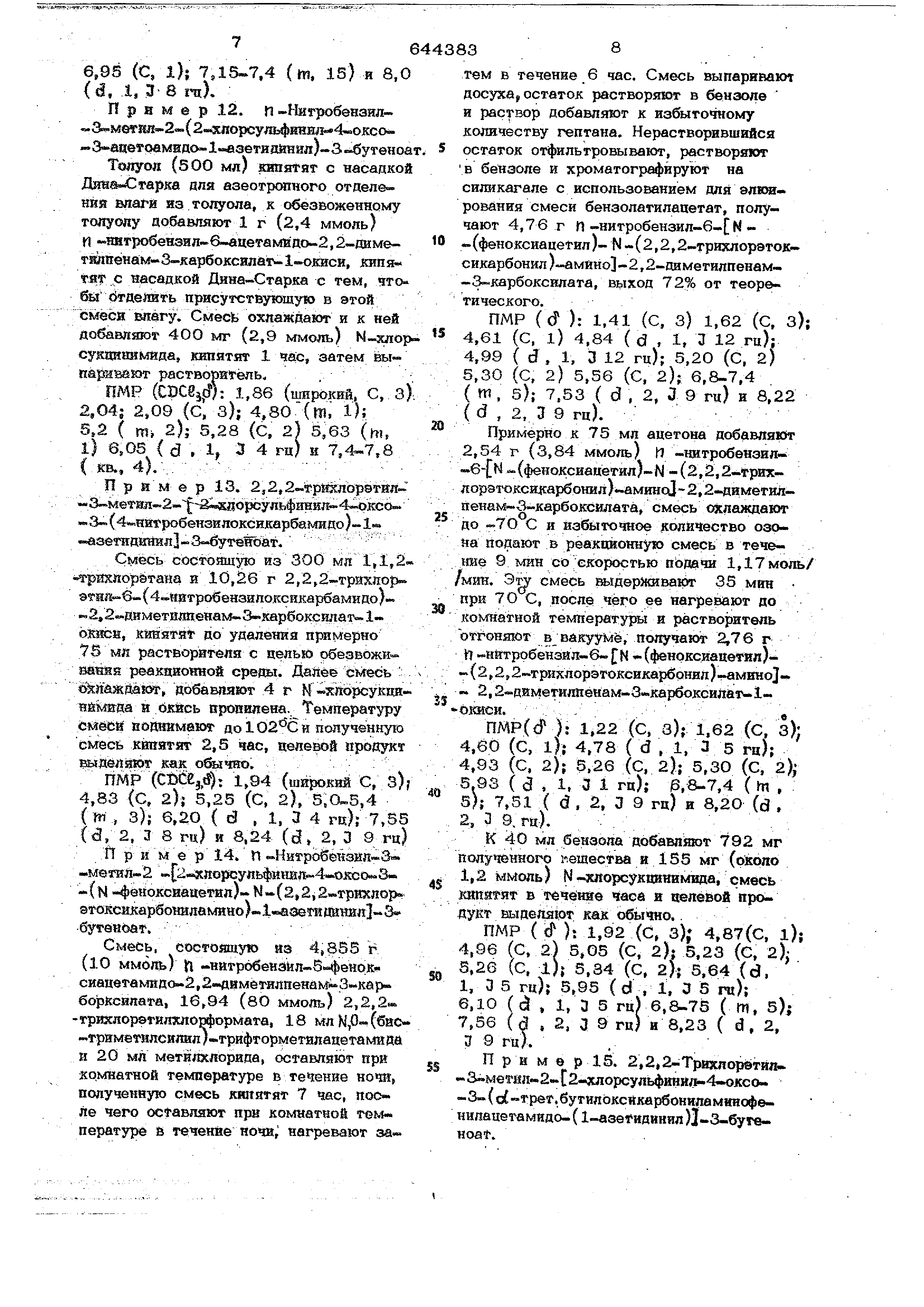
Реферат

Формула
- - -1, - , .
Изобретение относится к способу
получения не сшсеаншлх в литератур сульфяяилхлоридов обшей формулы
Н, .SOCl
ТJ э
Q« 1
о COOKg
.
где 4f - имидогруппа формулы R
О
где Bj- алювглен 1,2-фенш1ен или группа формулы ,
где R -.водород, алкил , феноксиметйл , тиенилметил, бензил, бензил оксн, 4-нитробензилоксн,.
токсибенаплокси, о{.-(грет бутилокснкарбонш1амино )-«бензнл нли вмидазолв динильная группа формулы
О
RS
Йб1 -}-С%
СНз
где фенил, незамещенный или аамещент
.1й одним или двумя атомами гало reHa,Rg - нигрозо- или ацетильная груп на йлн rpymia формулы
о
а.
Hi
в,с о
алкил , галоидалкил С С , алкожсй Q-С )й 2,2,2.трихлор
эгоксигрупна, й - имеет вышеуказанное значение, Hg - анкил , беи«
зил, й- нитробензйл, бензгидри, 2,2,2трнхлорэтил , KOTojaie могут найти примевенне
в качестве промежуточных соединений в синтезе биологически адтив ных сое/шнёний.
Известен способ получения cyль4StшЯ хлорааов обшей 1,
где 1 фталимидогруппа, заключах щийся в том, что пенициллинсульфоксид
формулы СНз 00COOR подвергают взаимодействию с хлористым
сульфурилом в четыреххлористом углеро Де 1. Однако этот способ нб применим для
получения сульфинилхлоридов обшей формулы I, содержащих в положении 6 радикалы , отличные от фталимидного.
Цель изобретения - способ получения сульфинилхлоридов обшей формулы I, обладающих ценными свойствами;
Это. достигается предлагаемым способом получения сульфинилхлоридов обшей
формулы 1, СОСТО5ПЦИМ в том, что пенициллинсульфоксид обшей формулы Д. /
0 GOOB. 2 где ( и имеют вышеуказанное значение
, подвергают взаимодействий с М -галогенируюатим агентом в безводном
инертном растворителе при температуре 75-135 С. В качестве N -галогенирующего агента предпочтительно
используют N -хлорсукцинимид, N -Зсл фталимид или N-хлор-N-метил-ц-толуолсульфамид
. В качестве растворите- ля предпочтительно используют ароматический углеводород или галогенирован
ный углеводород. Пример. Метил-3-метил 2- ( 2-гслорсульфинил-4-оксо- 3-фталими до
-2-азетидинил)«-3-бутеноат. Раствор, состоящий из 18,8 г (50 ммоль) метил-6-1( -фталймидо-2
,2-Диметилпенам-З-карбоксилат 1-окиси и 6,7 г {5О ммоль) N -хлорсу
циниимида в 1000 мл сухого четыреххлористого углерода, кипятят 70 мин, затем охлаждают, промывают водой
и соляп«ым раствором, сушат сульфатом Магния, затем раствор выпаривают и
получают 19,5 г (95%) целевого про дукта, представляющего собой бесцвет ное твердое вешество.
ПМР (CDCe,); 1,97 (широкий С,з 3,86 (C,3)j 5,05 (широкий С,2); 5,2 ( d , 1; 02 гц),: 5,77 ( , 1, Л 4 гц
5,9 ( d , 1, 04 rii) и 7,83 ( п, 4 П р и м е р 2. Я -Иитробензил-3метил-2-
(2-хлорсульфинил-4-оксо- 3фта лими до-1-азетн днни л)-3-бутеноат. Раствор, состоящий из 49,7 г
р,1 моль) П -нитробенаил-6- N-фтаимидо-2 ,2-димeтилпeнaм-3-кapбoкcиaт l-oкиcи
и 13,4 г (О,1 моль) N лорсукцйнимида в 1,5 л 1,2 Ш1Хлортана кипятят 7 О мин, затем смесь охаждают
, промывают йодой и соляным acTBopoMj сушат сульфатом магния. Раствор затем выпаривают, остаток суат
в вакууме 3 ч, получают 52 г цеевого продукта. ПМР (013Сез,с): 1,97 (С,3); 5,05 (
С, 1)5,4 (С,2); .5,76 (d,l, Об гц); 5,91 ( d , 1, 3 5 гц); 7,83 ( т, 8),
П р и м е р. 3. h Нитробензил-Зметил- 2- ( 2-х лорсульфинкл-4-оксо-. 3феноксиацетамидо-1 азетйдинил
)-3бутеноат . . Раствор, состоящий из 500 мг
(l ммоль) П-нитробензил-6-Ы-феноксиацетами до 2,2-диметилпена.м- 3 карбоксипаг -1-окйси
и 134 г (l ммоль) N-хлорсукцйнимида в 4О мл сухого 1,1,2-трихлорэтана, кипятят 9О мин,
затем смесь охлаждают, промывают водой и соляным раствором и далее раствор
выпаривают в вакууме, получают продукт с. выходом блигзким теоретическому.
ПМр (CDCe3,cf): 1,9.1 (широкий С,з), 4,53 (с, 2) 5,О5 (широкий С, l);
5,23 (m, 2) 5,33 (с, 2) 5,57 (d, 1, D 4,5 гц) 6,18 (d, 1, 3 4,5 гц) и 6,9 - 8,r(m, 9).
П р и м е р 4. П -Нитробензил-3-метил-2- ( 2-хлорсульфинил-4-оксо-3
-феноксиацегами до- 1-азоти динил )- 3-бугеноат . Смесь, состояшую из 6 г (12 ммоль)
Н -нитробензил-6-феноксиацетамидо-2 ,2-диметилпенам-3-карбоксипаг-1-.
-о.киси в 50 мл сухого толуола кипятят 10 мин с использованием насадки Дина-Старка
с целью удаления следов воды . После отгонки всей воды добавляют 1,8 г N -хлорсукиинимида и кипятят
90 мин. Эту -смесь охлаждают до 50 С и выпаривают.., . П р и м е р 5. П -Нитробензил-3-метил-2-
(2-хлорсульфинил 4-6ксо-3-форма ми до 1 -азети дин;ш )- 3 -бутеноат.
Раствор, состойший из 1,43 г пнитробензил-6-формамиао-2 ,2-диметилпенам-3 карбой:силат-1-окиси
и 5ОО мг N -хлорсукцйнимида в 4бо мл 1,1,2трихлорэтана кипятят 90 мин, зйтем
охлаждают, промывают водой и соляны раствором, сушат сульфатом магния н
далее выпаривают растворитель. ПМР (): 1,91 (широкий С, 5.03(широкий С, l); 5,20 (m, 2);
5,34 (с, 2); 5,62 (d, 1, 3 4,5 гц); 6,12 и 6,3 ( КБ, 1, 3 4,5 гц) и 7.4--8,4 ( т, 4).
П р и м е р 6; 2,2,2-трихлорэтил- .3-метил-2-.(2-хлорсульфинил 4-оксск-3-фенилацетамидо 1-ацетидинш1
)3бутеноат . Раствор, состоящий из 500 мг
2,2,2-.трихлорэгил-6-фенилацетами до-2 ,2-диметилпенам-З-карбоксилат- 1-.ок
си и 134 мг N -хлорсукциниимида В 40 мл толуола кипятят .90 Mmi, затем смесь охлаждают, промывают водой и
соляным раствором, сушат сульфатом магния и выпаривают растворитель, получают
целевой продукт в вйде бесцвет ной пены. ПМР (cf ): 1,90 (с, а); 3,55 (С,
2); 4,8 ( Гй, 2); 4,95 (d 1, 5 4.5гц); 5,03 - 5,21 (т, З); 5,65 и 5,70 ( KB, 1, 34,5 гц); 7,3 (С, 5)
и 7,5 (cl,NH , Л . 10 гц). П р и м е р 7. Метил-З-метил-2
- {2 хлорсульфинил-4-оксо- 3- ( 2,2-ди«метйл 3 нитрозо-5 .oкcO 4 фeнилимидa-
зoлидин l-ил)-l-aзeтидинилЗ-3-.бyтeноат , К 55 мл сухого бензола, который
был дополнительно высушен с помощью азеогропной отгонки влаги, добавляют
0,896 г (2 ) метил 6-.(2,2-.дйметил-3-нитрозо-5-оксо-4-фенилимидазолидйн- -ил )-2,2-диметилпенам-3-кар
боксйлат-1-окиси и 0,536 г (4 ммоля N -хлорсукцинимида, кипятят в течение часа в атмосфере азота,
После отгонки растворителя получаю целевой продукт. Пример 8. Метнл 3.метил 2-
(2 хлорсульфинил 4-оксо-3-фталимидо -1-азетидинил) - 3-бутеноат. К 300 мл четыреххлористого угле
рода добавляют;- 3,7 г (Ю ммоль) метил-6-фталимидО 2,2-дйметилпенам -3-карбоксилат-1-окиси и 2,2 г
(Ю ммоль) N-хлор-N-метил- И толуолсульфбнамида , кипятят 9О мин, охлаждают до комнатной темгюратуры,
промывают водой и соляным раствором, сушат сульфатом магния, выпаривают в
вакууме, получают целевой продукт. ПМР (CDCEj cf): 2,0 (с, 3, аллкловый СК ) 3,84 (Ci 3, C igcлoжный
Эфир); 5,1 (с, 2 виниловый CHg ); 5,2 (С, 1, С4-Н ) и 5,6-6.0 (т, 2,
С - Н и С - Н). Пример 9. П -Нитробензил-3
ме ТШ1-2- ( 2-хл орсульфинил-4 оксо- 3 феноксиаиетамидо-1-азетидиш1л )-3-бутеноат . .
К 15О мл дистиллированного и пропущенного через молекулярное сито (цеолит) толуола добавляют 3 г
(б ммоль) П -нитробензил-6-феноксиацетамидо-2 ,2-димeтилпeнaм-3-кapбoкcилaт-l-oкиcи
и 1,3 (б ммоль) N-хлор-М-метил- п-толуолсульфонамкда, кипятят 60 мин, охлаждают до комнатной
температуры, промывают водой и соляным раствором, сушат сульфатом магния и выпаривают в вакууме досуха.
ПМР (С1)Сез,): 1,88 (С, 3 аллиловый CHji ); 5,0 (с, 2 виниловый СН) и 5,12 (с, 1 аллиловый Н).
Пример 1О. п-Нитробензил-Зт-метил-2- (2-хлорсульфинип-4-оксо- 3-
-феноксиацетамидо-1-азетидинил)-3-бутёноат . 425 мл толуола нагревают с насадкой
Дина-Старка для азеотропного удаления влаги, которая может присутствовать
в толуоле, всего отгоняют 25 мл толуола. К оставшейся части толуола
добавляют 1О г (20 ммоль) h-нитробензил-6-феноксиацетамидо-2 ,2- диметилпенам-З карбоксилат-1-окиси
, причем температуру реакционной смеси поддерясивают несколько ниже температуры
.ки1Еения, отгоняют 2ОО мл толуола и добавляют 4 г (22 ммоль) N-хлорфталимида
, полученный раствор добавляют к раствору пенициллинсульфоксидэфира в течение ЗО мин, кипятят
55 MiiHj целевой продукт выдел;яют как обычно. Пример 11- Бензгидрил-З-метил-2-
(2-хлорсульфинил-4-оксо-3-феноксиацетамидо-1 азетидинил )-3-бутеноат .
К 80О мл толуола добавляют 20 г бензги дрил-6-феноксиацетамидо-2,2-диметилпёнам-З-карбоксилат-1-окиси
, кипятят с насадкой Дина-Старка отгоняют 10О мл толуола. К полученной
таким образом смеси добавляют 13,2 г М -хлорсукцининмида, кипятят 1,5 час, получают целевой продукт.
ПМР (CDCe,c): 1,88 (С, з); 4,53 (С, 2); 4.90 (С, l) 5.14 (С, 2); 5.54 (с, l); 6,24 (d, 1, J 4 гц);
6,95 (С, l); 7,15-7,4 (m, IS) и 8,0 (d, 1, 3 8 га).
Пример 12. n )бвнзйл 3«м© чш-2 .(2..сшорсу/шфйнил-4 оксо. 3«-адбгоамндо-1«азетидйнал)-3.Йутвноа
Толуол (SOO мл) кипятят с насадкой Дина Сгарка для азеотропного отделений влаги из толуола, к обезвоженному
толуолу добавляют 1 г (2,4 ммоль) П -янтробензйл-6 ацегамвдо-2,2-Ш1метвйнёнам З-карбоксялат-1-окиси
, JKHHHtsf с насадкой Дина-Старка с тем, чтобы бТдейить присутствующую в этой
смеси влагу. Смесь охлаждают и к ней добавдяют 400 мг (2,9 ммоль)
сукаинимйда, KHRHTsiT 1 час, затем выпаривают растворитель,, ПМР (CDCgj c): 1,86 (широкий. С, з)
2,О4; 2,09 (С, з); 4,80(№. D 5.2 ( т; 2); 5,28 (С, 2) 5,63 (пь 1) 6,05 (d . 3 4 ГЦ и 7,4-7,8
( JCB., 4).-.. -: V- П р а м е р 13. 252,2 р1алор9Тйл 3 метйя 2- --31«йорсульфннй; -4- )
,3 (4.Н;В робензилоксикарбамидо)-1. -азетидййнп - З- утеЙоат. Смесь состоящую из 300 мл 1,1,2
рйхяорётана и 10,26 г 2,2,2 тр ахпор .(4 Нйтро6ензилоксйкарбамидо)
.2,2 Дйметиш1енам 3 карбоксштат 1бКйСй , КйНйтяТ до удаления примерно
75 мл растворителя с целью обезвоживаний реакаионной среды. Дайеб Ьмесь
«йспаждакут, добавпяют 4 г N ХйорсуккиййШйа и ОКИСЬ пропилена. Температуру
«смеси новнймают до 102-С и полученную смесь RmtHTsjT 2,5 час, целевой ирояукт ШЯёйяют как .:
ПМР (CUCej tJ): 1,94 (ши{юкай с, з) 4,83 (с. 2); 5,25 (С, 2), 5.0.5,4
( m , з); 6,20 ( d . 1, 3 4 гц),- 7,55 (а, 2, 1 8 гц) и 6,24 (а 2, 3 9 гц)
И р и мер 14. П .Нитр зёекзип-3 «метий-2 2«кйорйульфи1тл 4-оксо.3-.
-См -4вноксиааетнл)-М-.(2,2,2 трюслорг этоксшсарбонияамнно) 1« азетй датил - 3 бутеабат.
Смесь, состоящую аз 4,855 г (Ю ммоль) h -нйтр6бензйл-5-феноК
сиацвтамйДо-2,2-двметилпенам 3 карборксилата , 16,94 (8О ммоль) 2,2,2i«.
-трвхлорэтйлхлорформата, 18 млМ,0-(бас триметилсилид)-.трифторметйлаиетамида
н 20 мл метияхлорида, оставляют при кцмнатной температуре в течение ноте,
полученную смесь кипятят 7 час, после чего оставляют при коьгаатной температуре
S течение ночи, нагревают затем в течение 6 час. Смесь выпаривают
досуха,остаток растворяют в бензоле и раствор добавляют к избыточному
количеству гептана. Нерастворившийся остаток отфильтровывают, растворяют в бензоле и хроматогр йруют на
силикагале с использованием для элнжрования смеси бензолатилапетат, получают 4,76 г П -нитробензил-6- N
(феноксиацетил)- N - ( 2,2,2-трихлорэто№сикарбонил )-амйно -2,2-диметилпенам-З-карбоксилата
, выход 72% от теоретического . ПМР (cf ): 1,41 (с, з) 1,62 (с, з);
4,61 (с, 1) 4,84 ( d , 1, 3 12 гц); 4,99 ( d, 1, 3 12 гц); 5,20 (С, 2) 5,30 (с, 2) 5,56 (С, 2); 6,8-7,4
( W , 5)j 7.53 ( d , 2, 3 9 гц) и 8,22 ( d , 2,39 гц). ; Примерно к 75 мл ацетона добавляют
2,54 г (3,84 ммоль) И -нитробензил 6- Н- .(феноксиаиётил)-М -(2,2,2-тршслорзгоксщсарбониЛ
)« aMnHcj - 2,2-диметиЛпенам 3-карбоксилата , смесь охлаждают до -70 С и избыточное количество озойа
подают в реакционную смесь в течение 9 мин со скоростью пЬдачи 1,17 моль/
мин. Эту смесь выдерНсивают 35 мин при 7 о с, после чего ее нагревают до
комнатной температуры и растворитель отгоняют в вакууме, получают 2,76 г
ft нйтррбензйл-6- Н ч-(фeнpкcиaцeтил) ( 2,2, 2-трихлорэтоксикарбрнил) г мино}-
2,2«-дйметилпенам-.3 «карбоксилат-1ЪКНСИ ... - .- в ПМР(5 ): 1,22 (с, з); 1,62 (С, з);
4,60 (С, 1); 4,78 ( d , 1, 3 5 гц); 4,93 (с, 2); 5,26 (С, 2); 5,ЗО (С, 2)f
593 (а , 1. 5 1 гц); Э.8-7,4 ( Itt , 5); 7,51 ( d , 2. 3 9 гц) и 8,20 (d , 2, 3 9. га).
к 40 мл бензола добавляют 792 мг полученного iieiaecTBa и 155 мг (piKono
1,2 ммоль) N -хлорсукшпшмвда, смесь кипйтят в тёЧёиве Часй в целевой продукт выделяют как обычно..
ПМР ( ): 1,92 (С, з); 4,87(С, l); 4,96 (С, 2) 5,05 (с, 2); 5,23 (С, 2)j
5,26 (с, l){ 5,34 (с, 2); 5,64 (d, 1, а 5 гц) 5,95 (d , 1, 3 5 гц);
6,10 (d , 1, 3 5 ГЦ) 6,8-75 (т, 5); 7,56 (d . 2, 3 9 гц) и 8,23 ( d, 2, 3 9 гц).
П р н м в р 15. 2,2,2-Трихлорётйп -3 метйл 2 С2-хлорсульфинИ№-4-оксо-3-
( ot-трет, бутил окслкарбониламвнофенилацетамидо- (1-азеТйдинил )}-3-бутеHoat .
Раствор 2,85 г (5 ммоль ) 2,2,2трихлорэтиЛ -6- ( оС -трет.бутилоксикарбо
ниламинофенилацетамидо)-2,2-диметил- пенам-3-дарбоксилаг-1-оксиаа в 175 м
толуола сушат азеотропной отгонкой примерно 50 мл толуола. К обезвоженному раствору добавляют 0,685 г
(5,5 ммоль) Н -хлорсукцинимида, кипятят в течение 7 О мин, охлаждают до
комнатной температуры, фильтруют, выпаривают растворитель в вакууме досуха и получают цг левой продукт.
ПМР (): 1,4О (С. 9, трет,бутил ), 1,95 (с, 3 СН (СН) 4,82 (широкий С, 2,-сложи.эфир, СН)}
5,20 ( W , 3, СН(СН СН СООСН ССвз ); 5,38 ( с , 1, 3 4,5 г азетидйнон Cg Н), 5,80 ( Ш, 1, азетидинон
Сз, -.Н)и 7,34 (с, 5 Агн). Пример 6, 2,2,2 Трихлорэтил-3-метил-2- 2-хлорсульфинил-4-оксо-3-
(2-тиенилацетамидо)-1-« зе5гщини; и -3-бутеноат. Раствор 3,5 г 2,2,2-трихлорэтии-6
(2-триенилакетамидо)-.2,2-диметилпенам-З-карбоксилат-1-оксида в 350м толуола сушат азеотропной отгонкой
10О мл толуола из смеси, затем охлаждают и добавляпот 1 г N-хлорсукцинимида , кипятят в течение 5О мйн,
охлаждают и фильтруют, целевой продукт выделяют.как обычно. ПМР (CDCEg, d );1,87 (с, 3,
СН(СЮ -СТ, 3,82 С, -2 боковая цепь CHj); 4,80 ( d , 2, 3 13 ГЦ - 5,18 (т, 3, -.CH(CHj)CH2; 5,50
(d , 1, 3 4,5 ГЦ, азетидинон Cg-H) и 6,05 ( И1 , Ij азетидинон С,,-Н). Формула изобретени
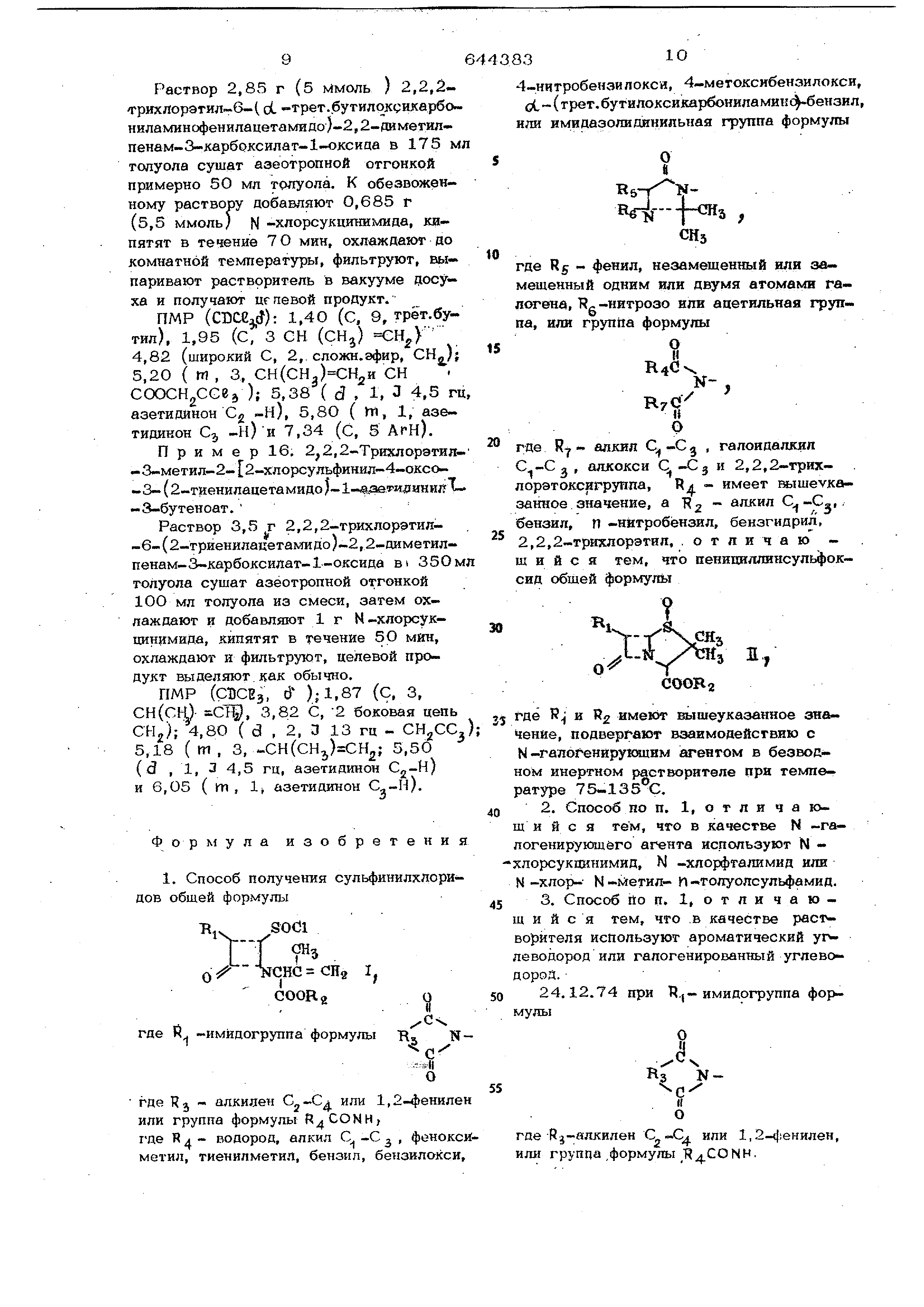
1. Способ получения сульфинилхлсридов обшей формулы Б.SOC1
0/-сне СНг I, COORgО где к. -имидогруппа формулы В. N где Rj лкилен С,,--С или 1,2-4 ениле или группа формулы ,
где R 4 водород, алкил С -С фонокс метил, тиенилметил, бензил, бензилокси 4-нитробензилокси, 4-метоксибензилокси, оС (трет.бутилоксикарбониламинф ензил,
или кмидазолидинильная группа формулы где Rj - фенил, незамещенный или замещенный
одним или двумя атомами галогена , TRg-нитрозо или ацетильная группа , или групйа формулы
где RY -t 3 галоидалкил , алкокси Cj-Cg и 2,2,2-трих- . лорэтоксигруппа, R - имеет вышеуказанное
значение, а - алкил С.-С™,. f, э бензил, П -нйтробёнзил, бензгидрил,
2,2,2-трИ7слорэтил, .отличаю ш и и с я тем, что пенициллинсульфоксид обшей формулы
%-Г-ЧРН, оу- Y 1, СООВз
где R и Rg имеют вышеуказанное значение , подвергают взаимодейсгвию с
N-гало енйрукнцнм агентом в безводном инертном растворителе при температуре 75-135 с.
2. Способ по п. 1, о г л и ч а юи и с я тем, что в качестве N -га-
логенирующёго агента используют N лорсукцинимид , N -хлорфталимид или
N-хлор- Ы-мети№-h-толуолсульфамид. 3. Способ по гг. 1, о т л и ч а ю Ц
и и с я тем, что ,в качестве расрворйтеля используют ароматический уг
еводород или галогенированный углевоород . 24.12.74 при Т1.,-имидргруппа форулы
Вя Nгде fJj-алкилен с С или 1,2- }1енилен,
или группа формулы H4C:ONH. водород, алкил , феноксякютил
. бензил, бензилокся, 4-нитробензялокси , 4-метоксибензилокси, тиенил
метвл, oL- - (трет, бутилокси карбониламидо ) бензил или имиоазолидинильная групаа формутл
ст R€i-|-СНз, CHj гае -фейил, незамещенный или замещенный
одним или двумя атомами галоf&aet , R -нитрозо- или ацетильная груп6 312 па, -апанп . бензил, П-нитробензил , бензгидрил, 2,2,2-трихлор9тил.
19.11,75 при R -группа где R имеет вышеуказанное значение, R.J -аллшл С,-С,, галоидалкил ,
ашсскси С -С или 2,2,2-.трихлоратокси группа.




Комментарии