Амиды 4-оксоазетидин-2-сульфокислот и их соли, способ их получения - RU2124003C1
Код документа: RU2124003C1
Чертежи
Описание
Изобретение относится к новым амидам 4- оксоазетидин-2-сульфокислот и их солям, к способу их получения. Указанные соединения могут найти применение для изготовления лекарственных средств.
В ряде публикаций уже описывались некоторые 4- оксоазетидин-сульфокислоты [(Chemistry in Britain (1983) 302]. Наиболее известны среди них 4-оксоазетидин-1-сульфокислоты. К ним причисляют также бета-лактамантибиотик азтреонам (Drugs of the Future 8 (1983) 295).
Известны далее некоторые 4-оксоазетидин-2- сульфокислоты, которые получают расщеплением бициклических молекул [Angew. Chem. 95 (1983) 912] или окислением соответствующих производных 4-оксоазетидин-2-сульфиновых кислот [патентная заявка Югославии Р-240/91; патентная заявка Югославии Р-1390/91 и патентная заявка EU 92 10 23 35.4/92].
Известны также некоторые производные 4-оксоазетидин-2-сульфокислот, как, например, хлориды этих кислот [заявка ФРГ 2556071/76], их эфиры [Croat. Chem. Acta 62 (1989) 521 - 527] и их тиоэфиры [Journ. Chem. Soc. Chem. Commun. 23 (1972) 1304 - 1305].
Согласно собственной информации заявителя касательно уровня техники амиды 4-оксоазетидин-2-сульфокислот и их соли на сегодняшний день еще не известны.
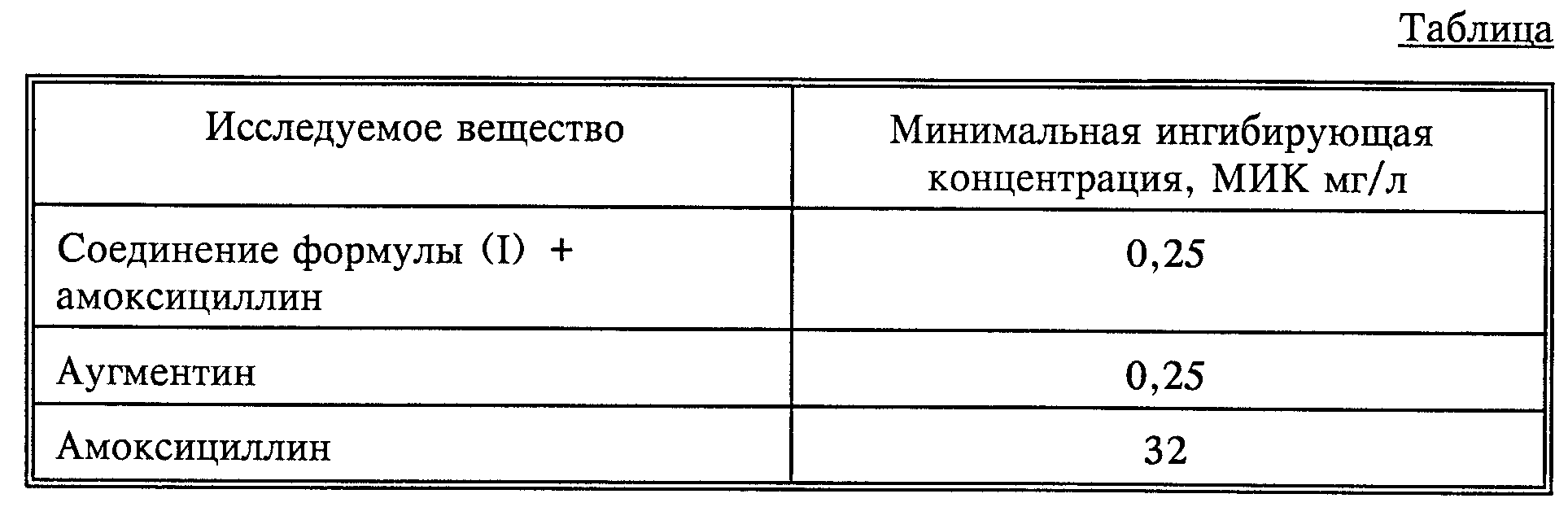
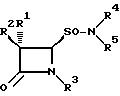
Предметом изобретения являются новые амиды
4-оксоазетидин- 2-сульфокислот и их соли общей формулы 1
где
R1 обозначает водород, галоген;
R2 обозначает водород, галоген, NH2, фенил-CH2CONH, фенил-OCH2CONH, фталимидо, o-MeNHCOC6H4CONH, 3-о-хлорфенил-5-метилизоксазол-4- илкарбониламино;
R3 обозначает водород, Me2C= C-COOMe, H2C=C(Me)-CH-COOMe, Me2C=C-COOCH2-фенил, H2C=C(Me)-CH-COOCH2C6H4NO2-п, Me2C=C-COOCH2C6H4NO2-п,
Me2C=C-COOCH2C6H4Me-м, H2C=C(Me) -CH-COOCH2C6H4Me-м, Me2C=C-COOH;
R4 обозначает водород или натрий;
R5 обозначает алкил, бензил, 5-метилизоксазолил, 3,4-диметилизоксазолил и 2-фенилпиразолил.
Предпочтительными соединениями являются следующие:
соединение, в котором
R1 обозначает водород, R2 обозначает водород, R3 обозначает Me2C= C-COOCH2-фенил, R4 обозначает водород и R5 обозначает
бензил;
соединение, в котором R1 обозначает водород, R2 обозначает водород, R3 обозначает Me2C=C-COOCH2-фенил, R4 обозначает
натрий и R5 обозначает бензил;
соединение, в котором R1 обозначает водород, R2 обозначает водород, R3 обозначает водород, R4 обозначает
водород и R5 обозначает бензил;
соединение, в котором R1 обозначает бром, R2 обозначает водород, R3 обозначает Me2C=C-COOCH2
-фенил, R4 обозначает водород и R5 обозначает бензил;
соединение, в котором R1 обозначает водород, R2 обозначает бром, R3 обозначает
Me2C=C-COOCH2-фенил, R4 обозначает водород и R5 обозначает бензил;
соединение, в котором R1 обозначает бром, R2 обозначает
бром, R3 обозначает Me2C=C-COOCH2-фенил, R4 обозначает водород и R5 обозначает бензил;
соединение, в котором R1 обозначает
бром, R2 обозначает бром, R3 обозначает Me2C=C-COOCH2-фенил, R4 обозначает натрий и R5 обозначает бензил;
соединение, в
котором R1 обозначает водород, R2 обозначает водород, R3 обозначает Me2C=C-COOCH2-фенил, R4 обозначает водород и R5
обозначает 5-метилизоксазол-З-ил;
соединение, в котором R1 обозначает водород, R2 обозначает водород, R3 обозначает Me2C=C- COOCH2-фенил,
R4 обозначает натрий и R5 обозначает 5-метилизоксазол-З-ил;
соединение, в котором R1 обозначает бром, R2 обозначает бром, R3 обозначает
Me2C= C-COOCH2-фенил, R4 обозначает водород и R5 обозначает 5-метилизоксазол-З-ил;
соединение, в котором R1 обозначает водород, R2 обозначает водород, R3 обозначает Me2C=C-COOCH2-фенил, R4 обозначает водород и R5 обозначает 3,4-диметилизоксазол-5-ил;
соединение, в котором R1 обозначает водород, R2 обозначает водород, R3 обозначает Me2C=C-COOCH2-фенил, R4 обозначает натрий и R5 обозначает 3,4-диметилизоксазол-5-ил;
соединение, в котором R1 обозначает водород, R2 обозначает водород, R3 обозначает Me2C=C-COOCH2-фенил, R4 обозначает водород и R5 обозначает 2-фенилпиразол-З-ил;
соединение, в котором R1 обозначает водород, R2 обозначает водород, R3 обозначает Me2C=C-COOCH2-фенил, R4 обозначает натрий и R5 обозначает 2-фенилпиразол-3-ил;
соединение, в котором R1 обозначает
водород, R2 обозначает фенил-OCH2CONH, R3 обозначает Me2C=C-COOMe, R4 обозначает водород и R5 обозначает бензил;
соединение,
в котором R1 обозначает водород, R2 обозначает фенил-OCH2CONH, R3 обозначает H2C= C(Me)-CH-COOMe, R4 обозначает водород и R5
обозначает 5-метилизоксазол-З-ил;
соединение, в котором R1 обозначает водород, R2 обозначает фенил-OCH2CONH, R3 обозначает Me2C=C-COOMe,
R4 обозначает водород и R5 обозначает 5-метилизоксазол-З-ил;
соединение, в котором R1 обозначает водород, R2 обозначает фталимидо, R3
обозначает H2C=C(Me)-CH-COOCH2C6H4NO2-п, R4 обозначает водород R5 обозначает 5-метилизоксазол-З-ил;
соединение, в
котором R1 обозначает водород, R2 обозначает фталимидо, R3 обозначает Me2C= C-COOCH2C6H4NO2-п, R4
обозначает водород и R5 обозначает 5-метилизоксазол-З-ил;
соединение, в котором R1 обозначает водород, R2 обозначает фенил-CH2CONH, R3
обозначает водород, R4 обозначает водород и R5 обозначает бензил;
соединение, в котором R1 обозначает водород, R2 обозначает фенил-CH2
CONH, R3 обозначает Me2C=C-COOCH2C6H4NO2-н, R4 обозначает водород и R5 обозначает 5-метилизоксазол-З-ил;
соединение, в котором R1 обозначает водород, R2 обозначает фенил-CH2CONH, R3 обозначает Me2C=C-COOH, R4 обозначает водород и R5 обозначает 5-метилизоксазол-З-ил;
соединение, в котором R1 обозначает водород, R2 обозначает водород, R3 обозначает Me2C=C- COOH, R4 обозначает водород и R5 обозначает бензил;
соединение, в котором R1 обозначает водород, R2 обозначает
З-о-хлорфенил- 5-метилизоксазол-4-илкарбониламино, R3 обозначает H2C= C(Me)-CH-COOCH2C6H4Me-м, R4 обозначает водород и R5
обозначает 5-метилизоксазол-З-ил;
соединение, в котором R1 обозначает водород, R2 обозначает З-о-хлорфенил-5-метилизоксазол-4-илкарбониламино, R3 обозначает
Me2C=C-COOCH2C6H4Me-м, R4 обозначает водород и R5 обозначает 5- метилизоксазол-З-ил;
соединение, в котором R1
обозначает водород, R2 обозначает фталимидо, R3 обозначает Me2C= C-COOH, R4 обозначает водород и R5 обозначает 5-метилизоксазол-З-ил;
соединение, в котором R1 обозначает водород, R2 обозначает аминогруппу, R3 обозначает Me2C=C-COOCH2C6H4NO2-п,
R4 обозначает водород и R5 обозначает 5-метилизоксазол-З-ил;
соединение, в котором R1 обозначает водород, R2 обозначает o-MeNHCO-C6H4CONH, R3 обозначает Me2C-COOCH2C6H4NO2-п, R4 обозначает водород и R5 обозначает метил;
соединение, в котором R1 обозначает водород, R2 обозначает o-MeNHCO- C6H4CONH, R3 обозначает H2C=C(Me)-CH-COOCH2C6H4NO-п, R4 обозначает водород и R5 обозначает метил;
соединение, в котором R1 обозначает водород, R2 обозначает o-MeNHCO- C6H4CONH, R3 обозначает Me2C=C-COOH, R4 обозначает водород и R5 обозначает метил;
соединение, в котором R1 обозначает
водород, R2 обозначает фенил-CH2CONH, R3 обозначает Me2C=C-COOH, R4 обозначает водород и R5 обозначает бензил;
соединение, в
котором R1 обозначает водород, R2 обозначает фенил-CH2CONH, R3 обозначает Me2C=C-COOCH2C6H4NO2-п,
R4 обозначает водород и R5 обозначает бензил;
соединение, в котором R1 обозначает водород, R2 обозначает фенил- CH2CONH, R3
обозначает Me2C=C-COOCH2C6H4NO2-п, R4 обозначает водород и R5 обозначает метил;
соединение, в котором R1
обозначает водород, R2 обозначает фенил-CH2CONH, R3 обозначает Me2C=C-COOH, R4 обозначает водород и R5 обозначает метил;
соединение, в котором R1 обозначает водород, R2 обозначает водород, R3 обозначает Me2C= C-COOH, R4 обозначает водород и R5 обозначает
5-метилизоксазол-З-ил;
соединение, в котором R1 обозначает бром, R2 обозначает бром, R3 обозначает Me2C=C-COOH, R4 обозначает водород и
R5 обозначает бензил;
соединение, в котором R1 обозначает водород, R2 обозначает фенил- OCH2CONH, R3 обозначает Me2C=C-COOH,
R4 обозначает водород и R5 обозначает 5-метилизоксазол-З-ил.
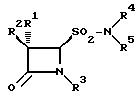
Другим предметом настоящего изобретения является способ получения новых амидов
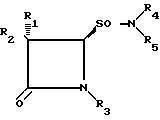
4-оксоазетидин-2-сульфокислот общей формулы I и их солей, в которой приведенные радикалы имеют указанное выше значение, путем окисления амидов 4-оксоазетидин-2-сульфиновых кислот общей формулы II
где
R1 обозначает водород или галоген;
R2 обозначает водород, галоген, фенил-CH2CONH, фенил-OCH2CONH, фталимидо, o-MeNHCOC6H4CONH, 3-о-хлорфенил-2- метилизоксазол-4-илкарбониламино;
R3 обозначает Me2C= C-COOMe, H2C=C(Me)-CH-COOMe, Me2C=C-COOCH2-фенил, H2C= C(Me)-CH- COOCH2C6H4NO2-п, Me2C = C-COOCH2C6H4NO2-п, Me2C = C -COOCH2C6H4Me-м, H2C = C(Me) -CH-COOCH2C6H4Me-м;
R4 обозначает водород;
R5 обозначает алкил, бензил, 5-метилизоксазол, 3,4-диметилизоксазолил и 2-фенилпиразолил.
Окисление осуществляют с помощью известных средств, используемых обычно в органической химии при проведении окислительных реакций, как, например, перекись водорода, перацетуксусная кислота, м-хлорпербензойная кислота и перманганат калия, в кислой либо нейтральной, водной либо водно-органической среде и в диапазоне температур от 0 до 100oC. Все реакции осуществляют в обычных условиях и при обычных молярных соотношениях. Обработку реакционной смеси и выделение продукта осуществляют по обычной методике. В зависимости от типа окислителя, молярных соотношений и температуры реакции получают различные производные амидов 4-оксоазетидин-2-сульфокислот, описание которых приводится в нижеследующих примерах. В зависимости от вида обработки и выделения амиды 4-оксоазетидин-2-сульфокислот можно получать в качестве свободных амидов или их неорганических солей. Амино- и карбоксизащитные группы в случае необходимости отщепляют по обычным известным методам.
Сульфинамиды общей формулы II получают взаимодействием соответствующих сульфинилхлоридов с аминами аналогично тому, как это описано в патенте США N 4052387 (1977). Сульфинилхлориды получают in situ, исходя из пенициллинсульфоксидов [см. патент США N 4081440 (1978)] или исходя из сульфиновой кислоты [см. Croat. Chem. Acta 62 (1989) 521].
Новые соединения по изобретению могут найти применение в качестве промежуточных продуктов при получении различных аналогов бета-лактамов, прежде всего новых бициклических систем.
Соединения по изобретению могут также использоваться в качестве активных веществ при изготовлении препаратов противомикробного действия.
Пример 1.
(2R, 3R) 1-(1'-метилоксикарбонил-2'-метилпроп- 1'-енил)-2- бензиламиносульфонил-3-феноксиацетамидо-4-оксоазетидин.
Раствор метилового эфира (5R,6R) 6- феноксиацетамидопеницилланат-сульфоксида
(1,9 г, 5 ммоль) в безводном толуоле (215 мл) обрабатывают окисью кальция (1,65 г, 28,4 ммоль) и N- хлорсукцинимидом (0,85 г, 6,4 ммоль) и реакционную смесь перемешивают в потоке азота при температуре
кипения в течение 1,5 ч. Затем смесь охлаждают до 0oC, обрабатывают бензиламином (2,26 г, 21 ммоль) и продолжают перемешивать еще в течение 2 ч. После этого реакционную смесь фильтруют,
маточный раствор промывают водой (2•90 мл), сушат (Na2SO4), фильтруют и концентрируют в вакууме. Остаток элюируют на силикагельной колонке с помощью смеси растворителей
метиленхлорид/метанол (20:1). Полученную смесь (1,8 г, 74,4%) из эпимерных (2R,3R) 1-(1'-метилоксикарбонил-2'-метилпроп-1'-енил)-2-бензиламиносульфинил - 3-феноксиацетоамидо-4-оксоазетидинов [изомер в
избытке1H-ЯМР (CDCl3) δ: 2,13 и 2,26 (6H, 2s, CMe), 3,75 (3H, s, OMe), 4,13 - 4,50 (5H, m, CH2N, CH2O, SNH), 4,95 (1H, d, J 5,0 Гц, C2H),
5,87 (1H, dd, J 5,0 и 10,0 Гц, C3H), 6,75 - 7,37 (5H, m, C6H5O), 8,47 (1H, d, J 10,0 Гц, CONH) част./млн] растворяют в метиленхлориде (35 мл) и муравьиной кислоте (7
мл), обрабатывают 30%-ным водным раствором H2O2 (28 мл) и перемешивают реакционную смесь в течение 6 ч при комнатной температуре. Органический экстракт отделяют, промывают водой,
сушат (Na2SO4), фильтруют и концентрируют. Остаток представляет собой пенообразный продукт (1,98 г, 95%):
Rf O,55 (CH2Cl2:MeOH=20:1)
ИК (KBr): 3420 - 3230 m, 1785s, 1735m, 1690s, 1605m, 1530s, 1495m, 1440m, 1370m, 1335m, 1225s, 1162s, 1065s, 995w см-1;
1H-ЯМР (CDCl3) δ: 2,09 и 2,
25 (6H, 2s, CMe), 3,69 (3H, s, OMe), 4,09 - 4,41 (5H, m, CH2N, CH2O, SNH), 4,80 (1H, d, J 5,3 Гц, C2H), 5,83 (1H, dd, J 10,8 Гц, C3H), 6,87 - 7,44 (5H, m,
C6H5O), 7,77 (1H, d, J 10,8 Гц, CONH) част./млн.
Пример 2.
(2R, 3R)
1-(1'-метилоксикарбонил-2'-метилпроп-2'-енил)-2-[(5'- метилизоксазол-3'-ил)аминосульфонил]-3-феноксиацетамидо-4- оксоазетидин/
Meтиловый эфир (5R,6R)
6- феноксиацетамидопеницилланат-сульфоксида (1,9 г, 5 ммоль) подвергают взаимодействию с N-хлорсукцинимидом, как это указано в примере 1, после чего вместо бензиламина обрабатывают
3-амино-5- метилизоксазолом (2,06 г, 21 ммоль). После перемешивания и обработки реакционной смеси выделяют эпимерную смесь из (2R,3R)
1-(1'- метилоксикарбонил-2'-метилпроп-2'-енил)-2-[(5'-метилизоксазол-3'- ил)-аминосульфинил] -3-феноксиацетамидо-4-оксоазетидинов. После концентрирования толуолового раствора кристаллизуется эпимер с
т. пл. 185 - 190oC. [1H-ЯМР (CDCl3) δ: 1,99 (3H, s, Me), 2,15 (3H, s, Me-изоксазол), 3,85 (3H, s, OMe), 4,43 (2H, bs, OCH2), 5,05 (1H, s, NCHCO), 5,
09 и 5,27 (2H, 2bs, =CH2), 5,37 (1H, d, J 4,5 Гц, C2H), 5,79 (1H, s, CH-изоксазол), 5,84 (1H, dd, J 4,5 и 9,5 Гц, C3H), 6,95 - 7,34 (5H, m, C6H5
O), 7,70 (1H, d, J 9,5 Гц, CONH) 8,29 (1H, s, SNH) част. /млн; анализ C21H23O8N4S; факт. : C, 52,42; H, 5,82; N, 12,02; S, 6,34%; рассч. : C, 52,93; H, 5,08;
N, 11,76; S, 6,73%]. После отсасывания кристаллы растворяют в метиленхлориде и муравьиной кислоте и окисление осуществляют с помощью перекиси водорода, как упомянуто в примере 1, в результате чего
получают пенообразный продукт:
Rf 0,20 (CH2Cl2:MeOH = 20:1);
ИК (KBr): 3400 - 3000 m, 1795vs, 1690m, 1620m, 1605m, 1535 - 1494s, 1465m, 1440m, 1245s,
1165s см-1;
1H-ЯМР (CDCl3 δ: 1,91 (3H, s, Me), 2,18 (3H, s, Me-изоксазол), 3,79 (3H, s, OMe), 4,44 (2H, bs, OCH2), 4,90 (1H, s, NCHCO), 5,00
и 5,17 (2H, 2bs, = CH2), 5,46 (1H, d, J 5,0 Гц, C2H), 6,01 (1H, dd, J 5,0 и 10,3 Гц, C3H), 6,82 - 7,41 (5H, m, C6H5O), 7,75 (1H, d, J 10,3 Гц,
CONH) част./млн.
Пример 3.
(2R, 3R)-1-(1'- метилоксикарбонил-2'-метилпроп-1'-енил)-2-[ (5'-метилизоксазол-3'-ил)аминосульфонил]-3-феноксацетамидо-4-оксоазетидин.
Полученный согласно примеру 2 сульфинамид (т. пл. 185 - 190oC) растворяют в метиленхлориде и затем перемешивают с триэтиламином в течение 2 ч при комнатной температуре. После
обработки реакционной смеси посредством хроматографии на силикагельной колонке получают (2R,3R)
1-(1'-метилоксикарбонил-2'-метилпроп-1'-енил)-2-[(5'- метилизоксазол-3'-ил)-аминосульфинил]-3-феноксиацетамидо-4- оксоазетидин с 80%-ным выходом:
1H-ЯМР (CDCl3 δ:
2,06 и 2,19 (6H, 2s, CMe2), 2,25 (3H, s, Me-изоксазол), 3,76 (3H, s, OMe), 4,31 и 4,40 (2H, ABq, J 15,0 Гц, OCH2), 5,34 (1H, d, J 5,0 Гц, C2H), 5,80 (1H, s,
CH-изоксазол), 5,60 (1H, dd, J 5,0 и 8,8 Гц, C3H), 6,84 - 7,32 (5H, m, C6H5O-), 7,92 (1H, d, J 8,8 Гц, CONH), 8,43 (1H, s, SNH-), част. /млн], который затем окисляют с
помощью перекиси водорода, как это указано в примере 1. В результате получают пенообразный продукт с 85%-ным выходом:
Rf 0,24 (CH2Cl2 : MeOH= 20:1);
ИК (KBr): 1790s, 1735m, 1700s, 1620m, 1540 - 1495s, 1465m, 1440m, 1380m, 1230s, 1165 см-1;
1H-ЯМР (CDCl3) δ: 2,09 и 2,22 (6H, 2s, CMe2), 2,26
(3H, s, Me-изоксазол), 3,71 (3H, s, OMe), 4,46 и 4,57 (2H, ABq, J 15,0 Гц, OCH2), 4,57 (1H, s, SNH), 5,54 (1H, d, J 5,2 Гц, C2H), 6,07 (1H, s, CH-изоксазол), 6,06 (1H, dd, J 5,2
и 10,4 Гц, C3H), 6,95 - 7,37 (5H, m, C6H5O), 7,76 (1H, d, J 10,4 Гц, CONH), част./млн.
Пример 4.
(2R, 3R)
1-(1'-п-нитробензилоксикарбонил-2'- метилпроп-2'-енил)-2-[(5'-метилизоксазол-3'-ил)-аминосульфонил] -3-фталимидо-4-оксоазетидин/
п-Hитробензиловый эфир (5R,6R)
6-фталимидопеницилланат-сульфоксида (1,5 г, 3 ммоль) подвергают взаимодействию с N-хлорсукцинимидом (0,4 г, 3 ммоль), как указано в примере 1, после чего обрабатывают 3- амино-5-метил-изоксазолом (1,
18 г, 12 ммоль) и реакционную смесь перемешивают в течение 4 ч при 10oC. Толуоловый раствор декантируют, промывают водой, сушат, фильтруют и концентрируют в вакууме. Посредством
хроматографии на силикагельной колонке в системе растворителей метиленхлорид/этилацетат (4:1) получают 0,88 г (2R, 3R)
1-(1'-п-нитробензилоксикарбонил-2'-метилпроп-2'-енил)-2- [(5'-метилизоксазол-3'-ил)аминосульфинил]-3-фталимидо-4- оксоазетидина [1H-ЯМР (CDCl3) δ: 1,90 (3H, s, Me), 2,27
(3H, s, Me-изоксазол), 4,76 (1H, bs, NCHCO), 4,92 и 5,06 (2H, 2bs, =CH2, 5,25 (2H, bs, OCH2), 5,67 (1H, d, J 5,4 Гц, C2H), 6,09 (1H, d, J 5,4 Гц, C3H), 7,20
(1H, bs, CH-изоксазол), 7,52 и 8,20 (4H, 2d, J 9,04 Гц, C6H4NO2), 7,71- 7,95 (4H, m, фталимидо), и 8,05 (1H, bs, SNH) част. /млн] . Взаимодействием с перекисью
водорода (12 мл, 30%-ный водный раствор) в метиленхлориде (15 мл) и муравьиной кислоте (2 мл), как указано в примере 1, получают 0,63 г сульфонамида:
Rf 0,58 (CH2Cl2:MeOH = 9:1);
ИК (KBr): 1805s, 1790s, 1735vs, 1615m, 1525m, 1475m, 1390s, 1350s, 1270w, 1170w, 1110w, 720m см-1;
1H-ЯМР (CDCl3) δ: 2,02
(3H, s, Me), 2,22 (3H, s, Me-изоксазол), 4,98 (1H, s, NCHCO), 5,09 - 5,35 (4H, m, =CH2, OCH2), 5,57 (1H, d, J 4,5 Гц, C2H), 5,76 (1H, d, J 4,5 Гц, C3H), 5,
97 (1H, s, CH-изоксазол), 7,51 и 8,15 (4H, 2d, J 8,4 Гц, C6H4NO2), 7,69 - 8,05 (4H, m, фталимидо) част./млн.
Пример 5.
(2R, 3R) 2-бензиламиносульфонил-3-фенилацетамидо-4-оксоазетидин.
п-Hитробензиловый эфир (5R,6R) 6- фенилацетамидопеницилланат- сульфоксида (2,10 г, 4,3 ммоль) подвергают взаимодействию с
N-хлорсукцинимидом (0,72 г, 5,4 ммоль), как описано в примере 1, и затем с помощью бензиламина (1,5 мл) получают эпимерную смесь из (2R,3R) 1-(1'-п-нитробензилоксикарбонил-2'-метилпроп-1'-енил)
-2-бензиламиносульфинил-3-фенилацетамидо-4-оксоазетидинов (1,78 г, 69,4%); [эпимер в избытке1H-ЯМР (ДМCO-d6) δ:2,11 и 2,25 (6H, 2s, CMe2), 3,53 (2H, s, CH2CO), 3,81 - 4,36 (3H, m, SNHCH2), 4,78 (1H, d, J 5,4 Гц, C2H), 5,24 (2H, bs, OCH2), 5,70 (1H, d, J 5,4 и 9,0 Гц, C3H), 6,65 (1H, d, J 9,0 Гц, CONH),
7,07 - 7,35 (10H, m, 2C6H5), 7,44 и 8,17 (4H, 2d, J 9,0 Гц, C6H4NO2) част./млн]. Продукт растворяют в этилацетате (25 мл) и 80%-ной уксусной
кислоте (25 мл), после чего в течение 1 ч при температуре 0oC добавляют по каплям водный 4%-ный раствор перманганата калия (50 мл). Затем по каплям добавляют 30%-ный раствор перекиси
водорода до исчезновения перманганатовой окраски. Органический экстракт отделяют, промывают водным раствором NaHCO3 и водой, сушат (Na2SO4) и концентрируют в вакууме.
Посредством хроматографии на силикагельной колонке и элюирования в системе растворителей метиленхлорид/этилацетат (4:1) выделяют 0,3 г (23,5%) сульфонамида с т.пл. 135 - 137oC:
Rf 0,92 (n-BuOH:HOAc:H20=4:1:1);
ИК (KBr): 3360m, 3290m, 1770vs, 1655s, 1515m, 1320s, 1135s, 720s см-1;
1H-ЯМР (ДМСО-d6) δ
: 3,56 (2H, bs, CH2CO), 4,15 - 4,20 (2H, m, NCH2), 4,85 (1H, d, J 4,7 Гц, C2H), 5,57 (1H, dd, J 4,7 и 9,5 Гц, C3H), 7,25 и 7,38 (10H, 2bs, 2C6
H5), 7,87 - 7,93 (1H, m, SNH), 8,49 (1H, d, J 9,5 Гц, CONH), 9,24 (1H, bs, N1H) част./млн;
анализ C18H19N3O4S
факт.:
C 57,70, H 5,90, N 11,74, S 8,47%
рассч.: C 57,89, H 5,13. N 11,25, S 8,59%.
Пример 6.
(2R, 3R) 1-(1'-карбокси-2'-метилпроп-1'-енил)-2-[(5'- метилизоксазол-3'-ил)аминосульфонил]-3-фенилацетамидо-4 -оксоазетидин.
п-Hитробензиловый эфир (5R,6R) 6-фенилацетамидопеницилланат- сульфоксида (3,0 г, 6,2 ммоль) подвергают взаимодействию с N-хлорсукцинимидом (1,0 г, 7,5 ммоль), как указано в примере 1, после чего обрабатывают З-амино-5-метилизоксазолом (2,4 г, 25 ммоль) и реакционную смесь перемешивают в течение 3 ч при 5oC. Толуоловый раствор декантируют, промывают водой, сушат и концентрируют в вакууме. В результате получают 1,43 г (2R,3R) 1-(1'-п-нитробензилоксикарбонил-2'-метилпроп-2'-енил)-2- [(5'-метилизоксазол-3'-ил)-аминосульфинил] -3- фенилацетамидо-4-оксоазетидина [т. пл. 157 - 160oC;1H-ЯМР (CDCl3) δ: 1,93 (3H, s, Me), 2,35 (3H, s, Me-изоксазол), 3,61 (2H, s, CH2CO), 4,94 (1H, bs, NCHCO), 5,07 и 5,19 (2H, 2bs, =CH2, 5,13 (1H, d, J 4,8 Гц, C2H), 5,28 (2H, bs, OCH2), 5,57 (1H, bs, CH-изоксазол), 5,77 (1H, dd, J 4,8 и 9,0 Гц, C3H), 7,22 (5H, bs, C6H5), 7,44 (1H, d, J 9,0 Гц, CONH), 7,49 и 8,21 (4H, 2d, J 8,8 Гц, C6H4NO2) част./млн], который при перемешивании в триэтиламине и метиленхлориде трансформируется в (2R,3R) 1-(1'-п-нитробензилоксикарбонил-2'-метилпроп-1'-енил)-2- [(5'-метилизоксазол-3'-ил)аминосульфинил] -3- фенилацетамидо-4-оксоазетидин [1H-ЯМР (CDCl3) δ: 2,18 и 2,22 (6H, 2s, CMe2), 2,34 (3H, s, Me-изоксазол), 3,61 (2H, s, CH2CO), 5,11 (1H, d, J 4,9 Гц, C2H), 5,25 (2H, s, OCH2), 5,64 (1H, dd, J 5,0 и 8,4 Гц, C3H), 5, 63 (1H, s, CH-изоксазол), 7,24 (5H, s, C6H5), 7,26 (1H, d, J 8,4 Гц, CONH), 7,47 и 8,18 (4H, 2d, J 8,5 Гц, C6H4NO2) част./млн]. Полученный сульфинамид с помощью перекиси водорода, как указано в примере 1, окисляют до (2R,3R) 1-(1'-п- нитробензилоксикарбонил-2'-метилпроп-1'-енил)-2-(5'- метилизоксазол-3'-ил)аминосульфонил-3-фенилацетамидо-4- оксоазетидина.
[Rf 0,57 (CH2Cl2 : MeOH=8:1) ИК (KBr) 3680 - 2500m, 1785s, 1730m, 1665s, 1615m, 1520s, 1350s, 1215m, 1160m см-1;1H-ЯМР (CDCl3) δ: 1,99 и 2,15 (6H, 2s, CMe2, 2,28 (3H, s, Me-изоксазол), 3,59 (2H, s, CH2CO), 5,19 (2H, s, OCH2), 5,44 (1H, d, J 5,3 Гц, C2H), 5,81 (1H, s, CH-изоксазол), 5,84 (1H, dd, J 5,3 и 9,9 Гц, C3H), 6,84 (1H, d, J 9,9 Гц, CONH), 7,28 (5H, s, C6H5), 7,45 и 8,17 (4H, 2d, J 8,9 Гц, C6H4NO2) част./млн]. Затем полученный сульфонамид (0,35 г, 0,6 ммоль) растворяют в метаноле (25 мл) и гидрируют в течение 2 ч при давлении 2,4 бара с помощью 10%-ного палладия на угле (50 мл). После этого реакционную смесь фильтруют и маточный раствор концентрируют в вакууме. Остаток растворяют в метиленхлориде (20 мл) и воде (20 мл) и добавкой гидрокарбоната натрия устанавливают на значение pH 8,5. Затем водный экстракт отделяют, выделяют путем встряхивания со свежим метиленхлоридом, добавляют новую порцию метиленхлорида (15 мл) и добавками соляной кислоты устанавливают значение pH 2,2. Органический экстракт отделяют, сушат (Na2SO4), фильтруют и концентрируют в вакууме. В результате получают 0,14 г (52,4%) целевого продукта.
Rf 0,48 (CH2Cl2:MeOH=3:2);
ИК (KBr): 3660
- 2300bm, 1790s, 1680bs, 1620s, 1465m, 1270m, 1165m, 930w см-1;
1H-ЯМР (CDCl3) δ: 1,93 и 2,07 (6H, 2s, CMe2), 2,35 (3H, s, Me-изоксазол), 3,
67 (2H, s, CH2CO), 5,68 (1H, d, J 5,2 Гц, C2H), 6,0 (1H, dd, J 5,2 и 9,3 Гц, C3H), 6,12 (1H, s, CH-изоксазол), 6,63 (1H, d, J 9,3 Гц, CONH), 7,27-7,31 (5H, m, C6H5) част./млн.
Пример 7.
(2R, 3R) 1-(1'-м- метилбензилоксикарбонил-2'-метилпроп-2'-енил)-2-[ (5'-метилизоксазол- 3'-ил)аминосульфонил] -3-[(3'-о-хлорфенил-5'-метилизоксазол-4'- ил)карбоксамидо]-4-оксоазетидин.
м-Meтилбензиловый эфир (5R,6R)
6-(3'-о-хлорфенил-5'-метилизоксазол-4'-ил)- карбоксамидопеницилланатсульфоксида (2,0 г, 3,6 ммоль) подвергают взаимодействию с N-хлорсукцинимидом, как указано в примере 1, после чего добавляют
3-амино-5-метилизоксазол (1,1 г, 11 ммоль) и реакционную смесь перемешивают в течение 3 ч при комнатной температуре. Затем смесь фильтруют, маточный раствор экстрагируют с помощью воды (3•60
мл), сушат (Na2SO4), фильтруют и концентрируют в вакууме. В результате получают эпимерную смесь (1,92 г) из (2R, 3R)
1-(1'-м- метилбензилоксикарбонил-2'-метилпроп-2'-енил)-2-[(5'- метилизоксазол-3'-ил)аминосульфинил]-3-[(3'-о-хлорфенил-5'- метилизоксазол-4'-ил)карбоксамидо] -4-оксоазетидинов [Rf 0,40 и 0,
26 в метиленхлориде/этилацетате (4: 1)] . Продукт растворяют в метиленхлориде и уксусной кислоте и окисляют перекисью водорода, как описано в примере 1. Сырой продукт хроматографируют на силикагельной
колонке и путем элюирования с помощью смеси растворителей метиленхлорид/этилацетат. В результате получают 0,62 г (44%) сульфонамида:
Rf 0,55 (CH2Cl2
:MeOH=10:1);
ИК (KBr): 3405w, 1795vs, 1745s, 1680vs, 1620s, 1520s, 1465s, 1385m, 1340m, 1265m, 1160m, 770m см-1;
1H-ЯМР (CDCl3 δ:1,79 (3H, s,
Me), 2,31 (3H, s, фенил-Me), 2,35 и 2,72 (6H, 2s, 2Me-изоксазол), 4,85 (1H, s, NCHCO), 4,90 и 5,10 (2H, 2s, =CH2), 5,08 и 5,13 (2H, ABq, J 12,0 Гц, OCH2), 5,44 (1H, d, J 5,0 Гц,
C2H), 5,95 (1H, dd, J 5,0 и 9,6 Гц, C3H), 6,04 (1H, s, CH-изоксазол), 6,37 (1H, d, J 9,6 Гц, CONH), 7,01- 7,26 и 7,41 - 7,55 (8H, 2m, 2C6H4) част./млн.
Пример 8.
(2R) 1-(1'-бензилоксикарбонил-2'-метилпроп-1'-енил)-2-бензиламино- сульфонил-3,3-дибромо-4-оксоазетидин/
Бензиловый эфир (5R) 6,
6-дибромопеницилланат-сульфоксида (7,0 г, 15 ммоль) подвергают взаимодействию с N-хлорсукцинимидом, как указано в примере 1, после чего реакцию продолжают осуществлять с помощью бензиламина (4 мл, 37,
5 ммоль). Затем реакционную смесь отсасывают, маточный раствор промывают водой, сушат (Na2SO4), фильтруют и концентрируют в вакууме. Сырой продукт хроматографируют на
силикагельной колонке путем элюирования с помощью растворителей метиленхлорид/этилацетат (6: 1), в результате чего получают 3,08 г (36%) (2R)
1-(1'- бензилоксикарбонил-2'-метилпроп-1'-енил)-2-бензиламиносульфинил-3,3- дибром-4-оксоазетидина [1H-ЯМР (CDCl3) d: 1,84 и 2,26 (6H, 2s, CMe2), 3,68 - 4,40 (3H, m,
SNHCH2), 5,07 и 5,24 (2H, ABq, J 12 Гц, OCH2, 5,09 (1H, s, C2H), 7,10 - 7,30 (10H, m, 2C6H5) част./млн], который окисляют в хлороформе
м-хлорпербензойной кислотой (1,2 г, 6 ммоль). Далее реакционную смесь перемешивают сначала в течение 20 мин при -10oC, а затем в течение 1 ч при комнатной температуре. После этого
обрабатывают 1 М раствором бисульфита натрия (36 мл, 6 ммоль), органический слой отделяют, промывают водой, сушат (Na2SO4), фильтруют и концентрируют в вакууме. Остаток
растворяют в метиленхлориде и пропускают через силикагельную колонку, в результате чего получают 2,1 г (59%) белого кристаллического продукта с т.пл. 120 - 122oC:
Rf 0,
88 (CH2Cl2/EtOAc=4:l);
ИК (KBr): 3250vs, 1780vs, 1730vs, 1640s, 1444vs, 1370b, 1255s, 1200s, 1165vs, 1055vs, 755vs, 700vs см-1;
1H-ЯМР
(CDCl3) δ: 2,09 и 2,28 (6H, 2s, CMe2), 4,09 (2H, d, J 5,8 Гц, NCH2фенил), 4,63 (1H, t, J 5,8 Гц, SNH), 5,08 и 5,34 (2H, ABq, J 11,7 Гц, OCH2), 5,32
(1H, s, C2H), 7,29 - 7,35 (10H, m, 2C6H5), част./млн.
Пример 9.
(2R) 1-(1'-бензилоксикарбонил-2'-метилпроп-1'-енил)-2- [(5'-метилизоксазол-3'-ил)аминосульфонил]-3,3-дибромо-4-оксоазетидин.
а) Бензиловый эфир (5R) 6,6-дибромопеницилланат-сульфоксида (7,0
г, 15 ммоль) подвергают взаимодействию с N-хлорсукцинимидом, как указано в примере 1, затем обрабатывают 3-амино-5-метилизоксазолом (4,47 г, 45 ммоль) и реакционную смесь перемешивают в течение 3 ч
при 20oC. Осадок отсасывают, сушат, растворяют в метиленхлориде (30 мл) и перемешивают с триэтиламином (1,5 мл) в течение 1 ч при 20oC. Затем реакционную смесь промывают 0,1 H
соляной кислотой (значение pH 1-2) и водой, органический экстракт сушат (Na2SO4), фильтруют и концентрируют в вакууме. Полученный остаток представляет собой 1,85 г (2R)
1-(1'-бензилоксикарбонил-2'-метилпроп- 1'-енил)-2-[(5'-метилизоксазол-3'- ил)аминосульфинил] -3,3-дибромо-4- оксоазетидина [т.пл. 58 - 60oC; Rf 0,51 (CH2Cl2
: EtOAc=4:l);1H-ЯМР (CDCl3) δ: 1,88 и 2,13 (6H, 2s, CMe2), 2,31 (3H, s, Me-изоксазол), 5,13 (2H, s, OCH2), 5,56 (1H, s, C2H), 5,67 (1H, s,
CH- изоксазол), 7,35 (5H, s, C6H5) и 8,32 (1H, s, SNH) част. /млн] , который окисляют м-хлорпербензойной кислотой, как описано в примере 8. Сырой продукт хроматографируют на
силикагельной колонке путем элюирования с помощью смеси растворителей метиленхлорид/этилацетат (4:1), в результате чего получают белый кристаллический продукт (52,6%) с т.пл. 168 - 170o
C:
Rf O,25 (CH2Cl2:EtOAc=4:1);
ИК (KBr): 3160m, 1780vs, 1765vs, 1625s, 1500s, 1395vs, 1383s, 1220s, 1175vs см-1;
1H-ЯМР
(CDCl3) δ:2,06 и 2,15 (6H, 2s, CMe2), 2,37 (3H, s, Me-изоксазол), 5,05 (2H, s, OCH2), 5,70 (1H, s, C2H), 6,07 (1H, s, CH-изоксазол), 7,31 (5H, s,
C6H5) част./млн.
б) Полученный по описанному выше способу сульфинамид (0,85 г, 1,5 ммоль) растворяют в метиленхлориде (5 мл) и муравьиной кислоте (5 мл) и окисляют перекисью водорода (0,56 мл) в течение 1 ч при температуре кипения. Охлажденную реакционную смесь обрабатывают водой, органический слой отделяют, взбалтывают с 5%-ным раствором NaHCO3 и водой, сушат (Na2SO4), фильтруют и концентрируют. В результате получают продукт, идентичный получаемому по способу а).
Пример 10.
(2R) 1-(1'-карбоксил-2'-метилпроп-1'-енил)-2- бензиламиносульфонил-3,3-дибромо-4-оксоазетидин.
Охлажденную льдом суспензию из трихлорида алюминия (0,4 г, 3 ммоль) в метиленхлориде (15 мл)
обрабатывают в потоке азота раствором из (2R) 1-(1'-бензилоксикарбонил-2'-метилпроп-1'-енил)-2- бензиламиносульфонил-3,3-дибромо-4-оксоазетидина (0,59 г, 1 ммоль) и анизола (0,65 г, 6 ммоль) в
метиленхлориде (15 мл) и перемешивают в течение 30 мин при комнатной температуре. Затем реакционный раствор обрабатывают этилацетатом (15 мл) и 0,1 H хлористоводородной кислотой (5 мл). После этого
слои разделяют и этилацетатный слой экстрагируют с помощью 5%-ного раствора гидрокарбоната натрия (2•20 мл). Затем слои повторно разделяют. Водный экстракт с помощью 0,1 H хлористоводородной
кислоты устанавливают на значение pH 1, обрабатывают свежим этилацетатом (20 мл) и хлоридом натрия и выделяют путем тщательного встряхивания. Этилацетатный слой отделяют, повторно промывают насыщенным
соляным раствором, после чего сушат и концентрируют в вакууме. В результате получают 0,49 г (98%) целевого продукта с т.пл. 47 - 50oC:
Rf O,66 (EtOAc:MeOH=3:l);
ИК (пленка): 3300m, 2960-2930m, 1805vs, 1700s, 1625m, 1425m, 1350s, 1160s см-1;
1H-ЯМР (ДМСO-d6) δ:1,98 и 2,23 (6H, 2s, CMe2), 4,09 и 4,20
(2H, ABX, J 5,7, 6,0 и 15,2 Гц, CH2фенил), 5,51 (1H, s, C2H), 7,29 - 7,39 (5H, m, C6H5), 8,49 (1H, dd, J 5,7 и 6,0 Гц, NH), 13,5 (1H, b, COOH) част./млн.
Пример 11.
(2R) 1-(1'- карбоксил-2'-метилпроп-1'-енил)-2-бензиламиносульфонил-4 - оксоазетидин.
(2R)
1-(1'-бензилоксикарбонил-2'-метилпроп-1'-енил)-4- оксоазетидин- 2-сульфиновую кислоту (3,23 г, 10 ммоль) растворяют в тионилхлориде (20 мл) и раствор перемешивают в течение 1 ч при 25oC.
Избыток тионилхлорида концентрируют при пониженном давлении до образования маслянистого остатка, после чего его растворяют в метиленхлориде (50 мл), раствор охлаждают до 10oC и при
перемешивании и охлаждении обрабатывают 5%-ным раствором бензиламина в метиленхлориде до получения значения pH 7 и при этой температуре продолжают перемешивать еще в течение 30 мин. Осажденную
солянокислую соль бензиламина отсасывают и промывают метиленхлоридом. Маточный раствор обрабатывают водой (50 мл), смесь подкисляют 10%-ной соляной кислотой до значения pH 1,3 и слои растворяют, далее
органический слой повторно промывают водой, сушат над сульфатом натрия и упаривают до сухого состояния. В результате получают смесь (3,85 г, 93%) из эпимерных (2R)
1-(1'-бензилоксикарбонил-2'- метилпроп-1'-енил)-2- бензиламиносульфинил-4-оксоазетидинов с Rf-значением 0,64 и 0,72 (CH2Cl2/EtOAc= 2: 1), которые разделяют посредством
хроматографии на силикагельной колонке. [Субстанция с Rf-значением 0,64: ИК (CH2Cl2): 3020vs, 2980s, 1760vs, 1700m, 1415m, 1260vs, 1210s, 1070m, 900s, см-1;
1H-ЯМР (CDCl3) δ: 1,95 и 2,24 (6H, 2s, CMe2), 3,11 (1H, dd, J 5,0 и 15,3 Гц, α C3H), 3,39 (1H, dd, J 2,6 и 15,3 Гц β C3H), 4,0 - 4,3 (3H, m, SNHCH2), 4,77 (1H, 2d, J 2,6 и 5,0 Гц, C2H), 5,08 и 5,29 (2H, ABq, J 12,0 Гц, CH2фенил), 7,32 (10H, s, 2C6H5)
част./млн; [субстанция с Rf-значением 0,72:
ИК (CH2Cl2): 3025vs, 2980s, 1755vs, 1700m, 1420m, 1260vs, 1210s, 1075m, 900s см-1;
1
H-ЯМР (CDCl3) δ : 2,08 и 2,21 (6H, 2s, CMe2), 2,94 и 3,16 (2H, 2d, J 3,2 и 4,7 Гц, β C3H и α C3H), 4,19 (3H, b, NHCH2), 4,77
(1H, dd, J 3,2 и 4,7 Гц, C2H), 5,06 и 5,28 (2H, ABq, J 12,3 Гц, CH2фенил), 7,32 (10H, s, 2C6H5) част. /млн] . Сульфинамид (1,65 г, 4 ммоль) подвергают
взаимодействию с 10 перманганатом калия, как указано в примере 5. После непродолжительного присутствия окраски, обусловленной использованием перманганата калия, реакция заканчивается. В результате
получают 1,32 г (77%) (2R) 1-(1- бензилоксикарбонил-2'-метилпроп-1'-енил)-2-бензиламиносульфонил- 4 -оксоазетидина, который очищают посредством хроматографии на силикагельной колонке путем элюирования
с помощью смеси растворителей CH2CI2/EtOAc (2:1). [Rf0,62 (бензол/ЕtOАс=2:1); т.пл. 92 - 94oC;
ИК (KBr): 3300vs, 1775vs, 1650vs, 1430m, 1350s,
1335s, 1290vs, 1200m, 1150s, 1070w см-1;
1H-ЯМР (CDCl3) δ: 2,05 и 2,23 (6H, 2s, CMe2), 3,16 (2H, d, J 3,8 Гц, α C3H и
β C3H), 4,08 (2H, d, J 5,9 Гц, NCH2), 4,50 (1H, t, J 5,0 Гц, NH), 4,89 (1H, t, J 3,8 Гц, C2H), 5,09 и 5,18 (2H, ABq, J 12,0 Гц, CH2фенил), 7,25 и 7,
34 (10H, 2s, 2C6H5)част./млн].
Полученный сульфонамид (0,4 г, 1,16 ммоль) аналогично тому, как это описано в примере 6, гидрируют и обрабатывают, в результате
чего получают 0,36 г кислоты:
Rf 0,88 (n-BuOH:HAc:H20=4:1:1);
ИК (KBr): 3260s, 1760vs, 1700s, 1630m, 1430m, 1330s, 1170s, 1070m см-1;
1H-ЯМР
(CDCl3) δ : 2,09 и 2,26 (6H, 2s, CMe2), 3,17 (2H, d, J 4,1 Гц, C3H), 4,26 (2H, s, NCH2), 4,98 (1H, t, J 4,1 Гц, C2H), 7,30 (5H, s, C2H) част./млн.
Пример 12.
(2R) 2-бензиламиносульфонил-4-оксоазетидин.
a) (2R) 1-(1'-метилоксикарбонил-2'-метилпроп-1'-енил)-4- оксоазетидин-2-сульфиновую кислоту (5,0 г, 20 ммоль) растворяют в тионилхлориде (20 мл) и обрабатывают, как это описано в примере 11. В результате получают смесь (5,4 г, 80,4%) из эпимерных (2R) 1-(1'- метилоксикарбонил-2'-метилпроп-1'-енил)-2-бензиламиносульфинил-4- оксоазетидинов с Rf-значениями 0,20 и 0,27 (CH2Cl2/EtOAc= 2:1), которые разделяют посредством хроматографии на силикагельной колонке: [субстанция с Rf-значением 0,20: ИК (CH2Cl2): 3200 - 3300m, 2930m, 1760vs, 1715s, 1220s, 1080s см-1;1H-ЯМР (CDCl3) δ: 1,99 и 2,23 (6H, 2s, CMe2), 3,17 (1H, dd, J 5,0 и 15,2 Гц, α C3H), 3,46 (1H, dd, J 2,6 и 15,2 Гц, β C3H), 3,75 (3H, s, OCH3), 4,15 - 4,30 (1H, b, NH), 4,23 (2H, s, CH2фенил), 4,92 (1H, 2d, C2H, J 2,6 и 5,0 Гц), 7,31 (5H, s, C6 H5) част./млн; субстанция с Rf-значением 0,27: ИК (CH2Cl2): 3300m, 2950m, 1775vs, 1720s, 1360s, 1220s, 1080s см-1;1H-ЯМР (CDCl3) δ: 2,07 и 2,20 (6H, 2s, CMe2), 2,97 (1H, dd, J 3,1 и 15,5 Гц, β C3H), 3,25 (1H, dd, J 5,0 и 15,5 Гц, α C3H), 3,73 (3H, s, OCH3 ), 4,15 - 4,33 (1H, b, NH), 4,26 (2H, s, CH2фенил), 4,83 (1H, 2d, J 3,1 и 5,0 Гц, C2H), 7,32 (5H, s, C6H5) част./млн]. Сульфинамид (3,36 г, 10 ммоль) подвергают взаимодействию с перманганатом калия, как описано в примере 5. Маслянистый продукт (2,5 г) обрабатывают простым эфиром (30 мл) и полученную желатинообразную массу перемешивают при комнатной температуре в течение 8 ч. Осажденный кристаллический продукт отсасывают и промывают простым эфиром. т.пл. 111 - 130oC, Rf 0,10 (бензол/ЕtOAс= 3:1); ИК (KBr): 3300vs, 1790vs, 1740vs, 1430s, 1330s, 1300s, 1120s, 1070s см-1;1H-ЯМР (ДМСО-d6) δ: 2,96 (3H, dd, J 2,1 и 15,2 Гц, β C3H), 3,29 (1H, dd, J 4,7 и 15,2 Гц, α C3H), 4,23 (2H, d, J 5,9 Гц, NCH2), 4,71 (1H, dd, J 2,1 и 4,7 Гц, C2H), 7,33 (5H, s, C6H5), 7,96 (1H, t, J 5,9 Гц, SNH), 8,92 (1H, s, N2H) част./млн.
б) (2R) 1-(1'- бензилоксикарбонил-2'-метилпроп-1'-енил)-2- бензиламиносульфонил-4- оксоазетидин (получение, как описано в примере 11) аналогично способу а) подвергают взаимодействию с перманганатом калия, в результате чего получают идентичный продукт.
Пример 13.
(2R) 1-(1'- карбоксил-2'-метилпроп-1'-енил)-2-[(5'-метилизоксазол-3'- ил)аминосульфонил]-4-оксоазетидин.
(2R) 1-(1'-бензилоксикарбонил-2'-метилпроп-1'-енил) -4- оксоазетидин-2-сульфиновую кислоту (3,23 г, 10 ммоль) растворяют в тионилхлориде (10 мл). Раствор перемешивают в течение 1 ч при 25oC. Избыток тионилхлорида концентрируют при пониженном давлении до образования маслянистого остатка. Затем этот остаток растворяют в метиленхлориде (50 мл), обрабатывают З-амино-5-метилизоксазолом (2,94 г, 30 ммоль) и перемешивают в течение 3 ч при комнатной температуре. Далее реакционную смесь обрабатывают водой (50 мл) и с помощью 10%-ной соляной кислоты устанавливают на значение pH 1,5. Затем слои разделяют. Органический слой повторно промывают водой (50 мл). После этого органический слой повторно обрабатывают водой (50 мл) и с помощью насыщенного раствора гидрокарбоната натрия устанавливают на значение pH 8,0. Слои разделяют, органический слой повторно промывают водой, сушат над сульфатом натрия и упаривают до сухого состояния. В результате получают смесь (3,80 г, 92,6%) эпимерных (2R) 1-(1'- бензилоксикарбонил-2'-метилпроп-1'-енил)-2-[(5'-метилизоксазол-3'- ил)аминосульфинил]-4-оксоазетидинов с Rf-значениями 0,29 и 0,35 (CH2Cl2/EtOAc= 2:1), которые разделяют посредством хроматографии на силикагельной колонке.
[Субстанция с Rf-значением 0,29: ИК (CH2Cl2): 1780vs, 1720m, 1620s, 1465s, 1360s, 1290m,
1215s, 1100s, 1080m см-1;
1H-ЯМР (CDCl3) δ: 1,98 и 2,20 (6H, 2s, CMe2), 2,34 (3H, s, Me-изоксазол), 3,28 (1H, dd, J 4,7 и 15,5 Гц, α
C3H), 3,54 (1H, dd, J 2,6 и 15,5 Гц, β C3H), 5,06 (1H, dd, J 2,6 и 4,7 Гц, C2H), 5,19 (2H, s, CH2фенил), 5,82 (1H, s, CH-изоксазол), 7,33 (5H, s,
C6H5), 8,40 (1H, s, NH) част./млн;
субстанция с Rf-значением 0,35; ИК (CH2Cl2): 1780vs, 1725m, 1630s, 1470s, 1360m, 1290m, 1220s, 1100s
см-1;
1H-ЯМР (CDCl3) δ: 2,09 и 2,24 (6H, 2s, CMe2), 2,36 (3H, s, Me-изоксазол), 3,04 (1H, dd, J 2,9 и 15,5 Гц, β C3H), 3,30
(1H, dd, J 5,0 и 15,5 Гц, α/ C3H), 5,11 (1H, dd, J 2,9 и J 5,0 Гц, C2H), 5,21 (2H, s, CH2фенил), 5,80 (1H, s, CH-изоксазол), 7,26 (5H, s) част./млн].
Раствор из сульфинамида (4,03 г, 10 ммоль), м-хлорпербензойной кислоты (4,30 г, 25 ммоль) и этилацетата (50 мл) перемешивают в течение 24 ч при комнатной температуре. После окончания реакции по каплям добавляют водный раствор тиосульфата натрия (15 ммоль) и продолжают перемешивать еще в течение 30 мин. Затем реакционную смесь с помощью 5%-ного водного раствора гидрокарбоната натрия устанавливают на значение pH 8,5 и слои разделяют. Водный компонент насыщают хлоридом натрия и экстрагируют с помощью этилацетата (3•30 мл). Соединенные органические слои промывают соленой водой (30 мл), сушат над сульфатом натрия и упаривают до сухого состояния. В результате получают 3,5 г (79%) сырого продукта в виде натриевой соли. После растворения сырого продукта в воде и подкисления 10%-ным раствором соляной кислоты до значения pH 2,0 получают (2R) 1-(1'- бензилоксикарбонил-2'-метилпроп-1'-енил)-2-[(5'-метилизоксазол-3'- ил)аминосульфонил]-4-оксоазетидин [т.пл. 141 - 143oC (кристаллизация из простого эфира); Rf 0,40 (CH2Cl2:EtOAc = 2:1); ИК (KBr): 3200s, 1790vs, 1720vs, 1620s, 1465s, 1395s, 1300s, 1175s см-1;1H-ЯМР (CDCl3) δ: 2,02 и 2,14 (6H, 2s, CMe2), 2,37 (3H, s, Me-изоксазол), 3,32 (2H, d, J 3,5 Гц, α C3H и β C3H), 5,10 (2H, s, CH2фенил), 5,28 (1H, t, J 3,5 Гц, C2H), 6,10 (1H, s, CH-изоксазол), 7,25 (5H, s, C6H5) част./млн.
Анализ: C19H21
N3O6S; факт.: C, 54,21; H, 5,34; N, 9,96, S, 8,23%;
рассч.: C, 54,41, H, 5,05, N, 10,02, S, 7,64%].
Полученный сульфонамид (419 мг, 1 ммоль) гидрируют и
обрабатывают, как это было описано в примере 6. В результате получают 227 мг (69%):
Rf 0,91 (n-BuOH:HAc:H20=4:1:1);
ИК (KBr): 3600 - 3000b, 3175s, 1795s, 1760s,
1680vs, 1620vs, 1520m, 1470vs, 1400vs, 1310s, 1270m, 1180vs, 1080m, 1045m см-1;
1H-ЯМР (ДМСO-d6) δ: 1,89 и 2,13 (6H, 2s, CMe2), 2,35 (3H, s,
Me-изоксазол), 3,21 (1H, dd, J 1,8 и 15,3 Гц, β C3H), 3,55 (1H, dd, J 4,5 и 15,3 Гц, α C3H), 5,34 (1H, dd, J 1,8 и 4,5 Гц, C2H), 6,07 (1H, s,
CH-изоксазол), 11,32 (1H, bs, NH), 13,05 (1H, b, COOH) част./млн.
Пример 14.
(2R) 1-(1'- бензилоксикарбонил-2'-метилпроп-1'-енил)-2-[(3', 4'-диметилизоксазол- 5'-ил)аминосульфонил]-4-оксоазетидин.
(2R) 1-(1'-бензилоксикарбонил-2'-метилпроп-1'-енил)-4- оксоазетидин-2-сульфиновую кислоту (3,23 г, 10 ммоль) растворяют в тионилхлориде (10 мл). Раствор перемешивают в течение 1 ч при 25oC. Избыточный тионилхлорид концентрируют при пониженном давлении до образования маслянистого остатка. Затем полученный после концентрирования остаток растворяют в метиленхлориде (50 мл), обрабатывают 5-амино-3,4-диметилизоксазолом (3,78 г, 30 ммоль) и проводят дальнейшую переработку, как указано в примере 13. В результате получают смесь (3,20 г, 76,7%) из эпимерных (2R) 1-(1'- бензилоксикарбонил-2'-метилпроп-1'-енил)-2-[(3', 4'- диметилизоксазол-5'-ил)аминосульфинил]-4-оксоазетидинов с Rf - значениями 0,31 и 0,38 (CH2Cl2/EtOAc= 2:1), которую разделяют посредством хроматографии на силикагельной колонке [субстанция с Rf-значением 0,31: ИК (KBr): 1790vs, 1730m, 1710s, 1650s, 1370m, 1300m, 1225vs, 1100m см-1;1H-ЯМР (CDCl3) δ: 1,82, 1,97, 2,16, 2,20 (12H, 4s, 4Me), 3,17 (1H, d, J 4,1 Гц, α C3H), 3,45 (1H, d, J 3,2 Гц, β C3H), 5,04 (1H, dd, J 3,2 и 4,1 Гц, C2H), 5,24 (2H, s, CH2фенил), 7,35 (5H, s, C6H5), 7,87 (1H, s, NH) част./млн; субстанция с Rf-значением 0,38; ИК (KBr): 1785vs, 1730s, 1700s, 1650s, 1370m, 1300m, 1230s, 1100s см-1;1H-ЯМР (CDCl3) δ: 1,81, 2,10, 2,17, 2,24 (12H, 4s, 4Me), 3,09 (1H, d, J 2,9 Гц, β C3H), 3,34 (1H, d, J 5,0 Гц, α C3H), 5,05 (1H, dd, J 2,9 и 5,0 Гц, C2H), 5,20 - 5,30 (3H, m, CH2фенил и NH), 7,35 (5H, s, C6H5) част./млн].
Раствор из сульфинамида (4,17 г, 10 ммоль), мета-хлорбензойной кислоты (4,3 г, 25 ммоль) и этилацетата (50 мл) перемешивают при комнатной
температуре в течение 24 ч и обрабатывают далее, как это было описано в примере 13. В результате получают 3,2 г (70%) продукта в виде натриевой соли с т.пл. 160oC:
Rf 0,
44 (EtOAc);
ИК (CH2Cl2): 1790vs, 1730m, 1365s, 1220s, 1170s, 1070m см-1;
1H-ЯМР (CDCl3) δ: 1,90, 2,03, 2,21, 2,23 (12H,
4s, 4Me), 3,29 (2H, d, J 4,0 Гц, α C3H и β C3H), 5,17 (1H, t, J 4,0 Гц, C2H), 5,24 (2H, s, CH2фенил), 7,35 (5H, s, C6H5)
част./млн.
Пример 15.
(2R) 1-(1'-бензилоксикарбонил-2'-метилпроп-1'-енил)-2- [(2'-фенилпиразол-3'-ил)аминосульфонил]-4-оксоазетидин.
(2R)
1-(1'-бензилоксикарбонил-2'-метилпроп-1'-енил)-4-оксоазетидин-2- сульфиновую кислоту (10 ммоль) растворяют в тионилхлориде (3,23 г, 10 мл) и обрабатывают, как это описано в примере 13, причем вместо
З-амино-5-метилизоксазола добавляют 2-фенил-З-аминопиразол (4,77 г, 30 ммоль). В результате получают смесь (4,04 г, 86%) из эпимерных (2R)
1-(1'-бензилоксикарбонил-2'-метилпроп-1'-енил)-2-[(2'- фенилпиразол-3'-ил)аминосульфинил]-4-оксоазетидинов с Rf-значениями 0,44 и 0,50 (CH2Cl2/EtOAc= 2:1), которые
разделяют посредством хроматографии на силикагельной колонке [субстанция с Rf-значением 0,44: ИК (KBr): 1780vs, 1720s, 1600m, 1500s, 1455m, 1360m, 1290m, 1215vs, 1080m см-1;1H-ЯМР (CDCl3) δ: 1,93 и 2,16 (6H, 2s, CMe2), 2,96 (1H, dd, J 4,9 и 15,3 Гц, α C3H), 3,07 (1H, dd, J 2,5 и 15,3 Гц, β C3H), 4,79
(1H, dd, J 2,5 и 4,9 Гц, C2H), 5,14 (2H, s, CH2фенил), 6,22 и 7,57 (2H, 2d, J 1,9 Гц, =CH-CH=), 7,26-7,45 (10H, m, 2C6H5) част./млн; субстанция с Rf-значением 0,50:ИК (KBr): 1780vs, 1720s, 1600m, 1500s, 1455m, 1385m, 1360m, 1290m, 1220s, 1100s, 1070m см-1;1H-ЯМР (CDCl3) δ: 2,01 и 2,13 (6H, 2s,
CMe2), 2,80 (1H, dd, J 2,3 и 15,5 Гц, β C3H), 2,92 (1H, dd, J 5,3 и 15,5 Гц, α C3H), 4,80 (2H, b, C2H), 5,09 и 5,18 (2H, ABq, J 12,4 Гц,
CH2фенил), 6,21 и 7,58 (2H, 2d, J 1,6 Гц =CH-CH=), 7,20 - 7,40 (10H, m, 2C6H5) част. /млн. Раствор из сульфинамида (4,64 г, 10 ммоль), м-хлорпербензойной кислоты (4,3
г, 25 ммоль) и
этилацетата (50 мл) перемешивают в течение 24 ч при комнатной температуре и обрабатывают, как это было описано в примере 13. В результате получают 3,4 г (67%) продукта в виде натриевой
соли:
Rf 0,47 (EtOAc);
ИК (CH2Cl2): 3340w, 1785s, 1725m, 1700m, 1500s, 1390s, 1360s, 1290m, 1215s, 1170s, 1075m см-1;
1
H-ЯМР (CDCl3) δ: 1,96 и 2,16 (6H, 2s, CMe2), 2,88 (1H, dd, J 5,2 и 15,5 Гц, α C3H), 3,00 (1H, dd, J 2,3 и 15,5 Гц, β C3H), 4,92 (1H, dd,
J 2,3 и 5,2 Гц, C2H), 5,07 и 5,18 (2H, ABq, J 12,1 Гц, CH2фенил), 6,20 и 7,56 (2H, 2d, J 1,7 Гц, =CH-CH=), 7,20-7,40 (10H, m, 2C6H5) част./млн.
Пример 16.
(2R, 3R) 1-(1'-м- метилбензилоксикарбонил-2'-метилпроп-1'-енил-2-[(5'-метилизоксазол- 3'-ил)аминосульфонил] -3-[(3'-о-хлорфенил-5'-метилизоксазол-4'- ил)карбоксамидо]-4-оксоазетидин.
Эпимерную смесь из сульфинамидов (2,24 г), полученную по способу, описанному в примере 7, растворяют в метиленхлориде (10 мл) и перемешивают с триэтиламином (0,48 мл) в течение 2 ч при комнатной температуре. Затем экстрагируют сначала с помощью 0,1 H соляной кислоты (5 мл), а потом с помощью воды (10 мл), после чего органический экстракт сушат (Na2SO4), фильтруют и концентрируют в вакууме. В результате получают 2,23 г (99,5%) сырого продукта, из которого посредством хроматографии на силикагельной колонке и элюирования с помощью смеси растворителей CH2Cl2/EtOAc получают (2R,3R) 1-(1'-м-метилбензилоксикарбонил-2'-метилпроп-1'-енил)-2- [(5'-метилизоксазол-3'-ил)аминосульфинил] -3-[(3'-о-хлорфенил-5'- метилизоксазол-4'-ил)карбоксамидо]-4-оксоазетидин.
[Rf 0,21 (CH2Cl2/EtOAc= 4: 1); т.пл. 94-96oC;1H-ЯМР (CDCl3) δ: 1,95 и 2,22 (6H, 2s, CMe2, 2,33 и 2,35 (6H, 2s,
2Me-изоксазол), 2,77 (3H, s, Me-фенил), 4,96 (1H, d, J 4,5 Гц, C2H), 5,13 (2H, bs, OCH2), 5,61 (1H, dd, J 4,5 и 8,5 Гц, C3H), 5,72 (1H, s, CH-изоксазол), 6,69 (1H, d,
J 8,5 Гц, CONH), 7,04 - 7,55 (8H, m, 2C6H5) част./млн], который затем окисляют с помощью перекиси водорода, как описано в примере 1. В результате получают сульфонамид с 85,8%-ным
выходом:
Rf 0,55 (CH2Cl2:MeOH=10:1);
ИК (пленка): 3410w, 3160vw, 3070vw, 1795vs, 1735w, 1685bs, 1620s, 1640m, 1580bs, 1420w, 1300m, 1270m, 1220m,
1170m, 1120m, 1060m, 770m, 740m см-1;
1H-ЯМР (CDCl3) δ:1,94 и 2,11 (6H, 2s, CMe2), 2,26 и 2,33 (6H, 2s, 2Me-изоксазол), 2,72 (3H, s,
Me-фенил), 5,01 (2H, bs, OCH2), 5,36 (1H, d, J 5,0 Гц, C2H), 5,71 - 5,92 (2H, m, C3H и CH-изоксазол), 6,41 (1H, d, J 10 Гц, CONH), 7,01 - 7,62 (8H, m, 2C6
H4) част./млн.
Пример 17.
(2R, 3R) 1-(1'-карбоксил-2'-метилпроп-1'-енил)-2-[(5'-метилизоксазол- 3'-ил)аминосульфонил]-З-фталимидо-4-оксоазетидин.
а) Полученный согласно примеру 4 (2R,3R) 1-(1'-п- нитробензил-оксикарбонил-2'-метилпроп-2'-енил)-2-[(5'-метилизоксазол- 3'-ил)аминосульфинил] -3-фталимидо-4-оксоазетидин растворяют в
метиленхлориде и перемешивают с триэтиламином, в результате чего получают (2R,3R) 1-(1'-п-нитробензилоксикарбонил-2'-метилпроп-1'- енил)-2-[(5'-метилизоксазол-3'-ил) аминосульфинил]-3-фталимидо- 4
- оксоазетидин [1H-ЯМР (CDCl3) δ: 2,14 (6H, bs, CMe2), 2,31 (3H, s, Me-изоксазол), 5,08 и 5,23 (2H, ABq, J 13,5 Гц, OCH2), 5,58 (1H, d, J 5,4 Гц,
C2H), 5,71 (1H, bs, CH-изоксазол), 6,0 (1H, d, J 5,4 Гц, C3H), 7,45 и 8,16 (4H, 2d, J 9,0 Гц, C6H4NO2), 7,70-7,94 (4H, m, фталимидо) част. /млн] ,
из которого путем окисления перекисью водорода, как это указано в примере 1, получают (2R,3R)
1-(1'-п- нитробензилоксикарбонил-2'-метилпроп-1'-енил)-2-[(5'-метилизоксазол- 3'- ил)аминосульфонил]-З-фталимидо-4-оксоазетидин [Rf 0,60 (CH2Cl2:MeOH=9:1); ИК (KBr):
1790bs, 1730vs, 1615m, 1520m, 1465m, 1385s, 1350m, 1290w см-1;1H-ЯМР (CDCl3) δ: 2,12 и 2,26 (6H, 2s, CMe2), 2,32 (3H, s, Me-изоксазол), 5,21 (2H, bs,
OCH2), 5,73 (1H, d, J 5,4 Гц, C2H), 5,83 (1H, d, J 5,4 Гц, C3H), 6,05 (1H, bs, CH-изоксазол), 7,50 и 8,18 (4H, 2d, J 9,0 Гц, C6H4NO2),
7,60 - 7,86 (4H, m, фталимидо) част./млн]. Cульфонамид (840 мг, 1,38 ммоль) растворяют в метаноле (25 мл), гидрируют и обрабатывают, как это было указано в примере 6. Перемешиванием органического
экстракта при комнатной температуре выделяют кислоту (490 мг, 75%) с т.пл. 160 - 165oC:
ИК (KBr): 3515m, 3200m, 1795s, 1780s, 1735vs, 1685m, 1625m, 1525w, 1475m, 1415m, 1390vs,
1310w, 1180m см-1;
1H-ЯМР (ДМCO-d6) δ: 2,17 (6H, s, CMe2), 2,27 (3H, s, Me-изоксазол), 3,31 (2H, bs, SNH, COOH, HOH), 5,68 (1H, d, J 4,9 Гц,
C2H), 5,82 (1H, d, J 4,9 Гц, C3H), 5,89 (1H, s, CH-изоксазол), 7,92 (4H, s, фталимидо) част./млн.
б) Полученный согласно примеру 4 сульфонамид (0,63 г) растворяют в метиленхлориде (10 мл) и при 10oC в течение 5 ч перемешивают с триэтиламином (0,1 г). Посредством хроматографии на силикагельной колонке из концентрированного остатка получают 0,57 г сульфонамида, который идентичен описанному в а) и из которого путем гидрогенолиза получают кислоту.
Пример 18.
(2R, 3R) 1-(1'-п-нитробензилоксикарбонил-2'-метилпроп-1' -енил)-2-[(5'-метилизоксазол-3'-ил)аминосульфонил]-3-амино-4- оксоазетидин.
Полученный согласно примеру 17 сульфонамил подвергают взаимодействию сначала с сульфидом натрия, затем с
дициклогексилкарбодиимидом и в заключение с метилгидразином, как это описано в Croat. Chem. Acta 49 (1977) 779. В результате получают пенообразный продукт, благодаря которому происходит положительная
нингидриновая реакция:
Rf 0,48 (CH2Cl2:MeOH= 9:1);
ИК (KBr): 1785s, 1735m, 1710m, 1620m, 1525s, 1465w, 1400w, 1150s, 1300w, 1275w, 1220m, 1165m
см-1;
1H-ЯМР (CDCl3) δ: 2,13 и 2,25 (6H, 2s, CMe2), 2,39 (3H, s, Me-изоксазол), 4,66 (1H, d, J 5,2 Гц, C2H), 5,21 (1H, d, J 5,2 Гц,
C3H), 5,22 и 5,29 (2H, ABq, J 12,8 Гц, OCH2), 6,12 (1H, s, CH-изоксазол), 7,49 и 8,22 (4H, 2d, J 8,5 Гц, C6H4NO2) част./млн.
Пример 19.
(2R, 3R) 1-(1'-карбонил-2'-метилпроп-1'-енил)-2-метиламиносульфонил-3-о- метиламинокарбонилфенилкарбоксамидо-4-оксоазетидин.
п-Hитробензиловый эфир (5R,6R) 6-фталимидопеницилланат-сульфоксида (1,5 г, 3 ммоль) подвергают взаимодействию с N-хлорсукцинимидом (0,4 г, 3 ммоль), как указано в примере 1, после чего реакционный раствор охлаждают до 5o C и обрабатывают метиламином (1 мл) в толуоле (4 мл). Затем реакционную смесь перемешивают в течение 3 ч при 5oC и концентрируют в вакууме. Остаток суспендируют в метиленхлориде (15 мл), нерастворимые компоненты отсасывают и маточный раствор концентрируют в вакууме. В результате получают эпимерную смесь из 1,53 г (2R,3R) 1-(1 '-п-нитробензилоксикарбонил- 2'-метилпроп-1'-енил)-2-метиламиносульфинил-3-о- метиламинокарбонилфенилкарбоксамидо-4-оксоазетидина [ИК (пленка): 3250bm, 3065w, 2950w, 1780s, 1730sh, 1715vs, 1650m, 1605w, 1525s, 1350s, 1295m, 1220m, 1185s, 1060m, 855w, 820w, 740m см-1], который окисляют перекисью водорода, как указано в примере 1. В результате получают 1,23 г (2R,3R) 1-(1'- п-нитробензилоксикарбонил-2'-метилпроп-1'-енил)-2- метиламиносульфонил-3-о-метиламинокарбонилфенилкарбоксамидо-4- оксоазетидина [Rf0,81 (CH2Cl2:MeOH = 9:1);1H-ЯМР (CDCl3) δ: 2,15 и 2,31 (6H, 2s, CMe2), 2,86 (3H, d, J 4,5 Гц, CONMe), 2,98 (3H, d, J 4,9 Гц, SO2NMe), 5,16 (1H, d, J 4,9 Гц, C2H), 5,31 и 5,38 (2H, ABq, J 13,2 Гц, OCH2), 5,94 (1H, dd, J 4,9 и 10,4 Гц, C3H), 6,38 (1H, m, SO2NH), 6,97 (1H, d, J 10,4 Гц, CONH), 7,18 (1H, q, J 4,9 Гц, CONH), 7,44 - 7, 52 (4H, m, OCC6H4CO), 7,54 и 8,25 (4H, 2d, J 8,7 Гц, C6H4NO2) част./млн], из которого путем гидрогенолиза, как это описано в примере 17, получают кислоту (0,68 г) с т.пл. 142oC (разложение).
ИК (KBr): 3410m, 3370m, 3170m, 2960m, 1785vs, 1720s, 1680s, 1615s, 1600w, 1560w, 1515m, 1440w, 1415w, 1375w, 1330s, 1315s, 1285s,
1210s, 1185w, 1155w, 1080m, 735m, 700m см-1;
1H-ЯМР (ДMCO-d6) δ: 2,01 и 2,19 (6H, 2s, CMe2), 2,64 (3H, d, J 4,5 Гц, CONMe), 2,75 (3H, d, J 4,
7 Гц, SO2NMe), 5,24 (1H, d, J 5,0 Гц, C2H), 5,65 (1H, dd, J 5,0 и 8,7 Гц, C3H), 7,17 (1H, q, J 4,7 Гц, SO2NH), 7,48 - 7,56 (4H, m, C6H4
), 8,38 (1H, q, J 4,5 Гц, CONH), 9,07 (1H, d, J 8,7 Гц, CONH) част./млн.
Пример 20.
(2R,3R) 1-(1'- карбоксил-2'-метилпроп-1'-енил)-2-бензиламиносульфонил-3- фенилацетамидо-4-оксоазетидин.
п-Hитробензиловый эфир (5R, 6R)-фенилацетамидопеницилланат-сульфоксида (3,0 г, 6,2
ммоль) подвергают взаимодействию с N-хлорсукцинимидом (1,0 г, 7,5 ммоль), как это указано в примере 1, после чего обрабатывают бензиламином (1,3 мл, 12,4 ммоль) и реакционную смесь перемешивают в
течение 2 ч при 5oC. Толуоловый раствор декантируют, промывают водой, сушат и концентрируют в вакууме. За счет добавок этилацетата получают (2R,3R)
1-(1'-п-нитробензилоксикарбонил-2'-метилпроп-2'-енил)-2- бензиламиносульфинил-3-фенилацетамидо-4-оксоазетидин, который отсасывают (1,82 г) [1H-ЯМР (CDCl3) δ: 1,91 (3H, s,
Me), 3,48 (2H, s, CH2CO), 3,95 - 4,32 (3H, m, SNHCH2), 4,80 - 5,14 (4H, m, NCHCO=СH2, C2H), 5,26 (2H, bs, OCH2), 5,87 (1H, dd, J 5,0 и 9,8 Гц,
C3H), 6,52 (1H, d, J 9,8 Гц, CONH), 7,12-7,37 (10H, m, 2C6H5), 7,47 и 8,22 (4H, 2d, J 8,8 Гц, C6H4NO2) част./млн], с помощью
триэтиламина в метиленхлориде изомеризуют в (2R, 3R) 1-(1'-п-нитробензилоксикарбонил- 2'-метилпроп-1'-енил)-2-бензиламиносульфинил- 3-фенилацетамидо-4-оксоазетидин (1,66 г) и окисляют перекисью
водорода, как это указано в примере 1. В результате получают (2R, 3R) 1-(1'-п-нитробензилоксикарбонил- 2'- метилпроп-1'-енил)-2-бензиламиносульфонил-3-фенилацетамидо- 4-оксоазетидин (1,57 г):
Rf0,60 (CH2Cl2/EtOAc=4:1);1H-ЯМР (CDCl3 δ: 2,06 и 2,24 (6H, 2s, CMe2), 3,59 - 3,98 (5H, m, CH2CO, SNHCH2
), 4,67 (1H, d, J 5,0 Гц, C2H), 5,21 (2H, bs, OCH2), 5,73 (1H, dd, J 5,0 и 10,3 Гц, C3H), 6,68 (1H, d, J 10,3 Гц, CONH), 7,00 - 7,36 (10H, m, 2C6H5), 7,42 и 8,19 (4H, 2d, J 8,8 Гц, C6H4NO2 част. /млн] , который затем, как указано в примере 6, гидрируют. В результате выделяют 0,91 г продукта:
Rf0,38 (CH2Cl/MeOH=4:1);
ИК (пленка): 3500 - 2300bm, 1785s, 1740 - 1600bs, 1525m, 1340s, 1270m, 1210m, 1160s, 1070m, 740m, 705s см-1;
1H-ЯМР
(CDCl3) δ: 2,07 и 2,25 (6H, 2s, CMe2), 3,56 и 3,64 (2H, ABq, J 14,8 Гц, CH2CO), 3,98 - 4,02 (3H, m, SNHCH2), 4,94 (1H, d, J 5,2 Гц, C2H),
5,84 (1H, dd, J 5,2 и 10,3 Гц, C3H), 6,77 (1H, d, J 10,3 Гц, CONH), 7,11-7,37 (10H, m, 2C6H5) част./млн.
Пример 21.
(2R, 3R) 1-(1'-карбоксил-2'-метилпроп-1'-енил)-2-метиламиносульфонил-3 -фенилацетамидо-4-оксоазетидин.
п-Hитробензиловый эфир (5R,6R) 6-фенилацетамидопеницилланат-сульфоксида (3,0 г, 6,2 ммоль) подвергают взаимодействию с N- хлорсукцинимидом (1,0 г, 7,5 ммоль), как это указано в примере 1, после чего обрабатывают метиламином (1 мл) и реакционную смесь перемешивают в течение 2 ч при 5oC. Затем осадок отсасывают, маточный раствор промывают водой, сушат и концентрируют в вакууме. После хроматографии на силикагельной колонке получают (2R,3R) 1-(1'- п-нитробензилоксикарбонил-2'-метилпроп-1'-енил)-2- метиламиносульфинил-3-фенилацетамидо-4-оксоазетидин (1,63 г).
1H-ЯМР (CDCl3) δ: 2,12 и 2,26 (6H,
2s, CMe2), 2,47 (3H, d, J 5,4 Гц, NMe), 3,63 (2H, ABq, J 14,9 Гц, CH2CO), 4,68 (1H, d, J 5,0 Гц, C2H), 5,28 (2H, s, OCH2), 5,80 (1H, dd, J 5,0 и 9,9 Гц,
C3H), 7,19 (1H, d, J 9,9 Гц, CONH), 7,26 - 7,38 (5H, m, C6H5), 7,50 и 8,24 (4H, 2d, J 8,7 Гц, C6H4NO2) част./млн], который затем
окисляют перекисью водорода, как указано в примере 1. В результате получают (2R, 3R) 1-(1'-п-нитробензилоксикарбонил-2'-метилпроп-1-енил) -2-метиламиносульфонил-3-фенилацетамидо-4-оксоазетидин (0,98
г)
[ИК (KBr): 3460 - 3140bw, 1785s, 1730m, 1700 - 1675bm, 1610w, 1525s, 1350s, 1220m, 1155m, 1070m, 850w см-1;
1H-ЯМР (CDCl3) δ: 2,09 и 2,26
(6H, 2s, CMe2), 2,46 (3H, d, J 5,0 Гц, NMe), 3,17 (1H, q, 5,0 Гц, SNH), 3,55 и 3,69 (2H, ABq, J 14,5 Гц, CH2CO), 4,97 (1H, d, J 5,0 Гц, C2H), 5,27 и 5,33 (2H, ABq, J
13,2 Гц, OCH2), 5,80 (1H, dd, J 5,2 и 10,3 Гц, C3H), 6,58 (1H, d, J 10,3 Гц, CONH), 7,32-7,51 (5H, m, C6H5), 7,50 и 8,23 (4H, 2d, J 8,7 Гц, C6
H4NO2) част./млн]. Полученный сульфонамид гидрируют, как это указано в примере 6, и образовавшуюся в результате гидрогенолиза кислоту (0,43 г) выделяют:
ИК (KBr): 3660
- 2440bm, 1785s, 1740 - 1620bm, 1335m, 1160m, 1075w, 740w, 705w см-1;
1H- ЯМР (CDCl3) δ:2,07 и 2,25 (6H, 2s, CMe2), 2,53 (3H, d, J 4,5 Гц,
NMe), 3,63 (2H, ABq, J 15,1 Гц, CH2CO), 4,16 (1H, m, SNH), 5,24 (1H, d, J 5,2 Гц, C2H), 5,88 (1H, dd, J 5,2 и 10,3 Гц, C3H), 6,84 (1H, d, J 10,3 Гц, CONH), 7,26 - 7,40
(5H, m, C6H5) част./млн.
Пример 22.
(2R, 3R) 1-(1'-карбоксил-2'-метилпроп-1'-енил)-2-[(5'-метилизоксазол-3-ил) аминосульфонил]-3-феноксиацетамидо-4-оксоазетидин.
п-Hитробензиловыйэфир (5R,6R) 6- феноксиацетамидопеницилланатсульфоксида (5,0 г, 10 ммоль) подвергают взаимодействию с N-хлорсукцинимидом (1,7 г, 13 ммоль), как указано в примере 1, после чего обрабатывают 3- амино-5-метилизоксазолом (4,1 г, 40 ммоль) и реакционную смесь перемешивают в течение 2 ч при 0oC. Толуоловый раствор декантируют, промывают водой, сушат и концентрируют в вакууме. В результате получают эпимерную смесь (5,0 г, 83,6%), состоящую из (2R,3R) 1-(1'-п-нитробензилоксикарбонил-2'-метилпроп-2'-енил) -2-[(5 -метилизоксазол-3'-ил)-аминосульфинил] -3-феноксиацетамидо-4-оксоазетидинов; [преобладающий эпимер с т. пл. 196 - 198oC; ИК (KBr): 3310w, 1775s, 1755m, 1665m, 1625m, 1520s, 1350s, 1240m, 1170m, 1100s, 915w, 855w, 755wc с-1;1H-ЯМР (CDCl3) δ: 2,02 (3H, s, Me), 2,25 (3H, s, Me-изоксазол), 4,45 и 4,54 (2H, ABq, J 15,1 Гц, OCH2CO), 5,07 (1H, bs, NCHCO), 5,07 и 5,19 (2H, 2bs, =CH2), 5,39 (1H, d, J 5,1 Гц, C2H), 5,35 (2H, bs, OCH2), 5,76 (1H, bs, CH-изоксазол), 5,85 (1H, dd, J 5,0 и 9,0 Гц, C3H), 6,91- 7,36 (5H, m, C6H5), 7,49 (1H, d, CONH), 7,49 и 8,21 (4H, 2d, J 8,8 Гц, C6H4NO2 част./млн] .
Полученную эпимерную смесь окисляют, как это указано в примере 1, перекисью водорода и подвергают изомеризации с помощью триэтиламина в метиленхлориде, в результате чего получают 3,5 г (68,2%) (2R,3R) 1-(1'-п-нитробензилоксикарбонил-2'-метилпроп-1'-енил) -2-(5'-метилизоксазол-3'-ил)-аминосульфонил-3- феноксиацетамидо-4-оксоазетидина.
Rf 0,67 CH2Cl2/MeOH = 9:l);
ИК (KBr): 3410 - 2700m, 1795s,
1735m, 1700s, 1620m, 1525s, 1500m, 1465m, 1400m, 1355s, 1300m, 1220s, 1165m, 1065 - 1110m см-1;
1H-ЯМР (CDCl3) δ:2,11 и 2,20 (6H, 2s, CMe2),
2,24 (3H, s, Me-изоксазол), 4,35 и 4,50 (2H, ABq, J 15,1 Гц, OCH2CO), 5,26 (2H, s, OCH2), 5,59 (1H, d, J 5,2 Гц, C2H), 6,00 (1H, s, CH-изоксазол), 6,03 (1H, dd, J 5,2
и 10,5 Гц, C3H), 6,90 - 7,35 (5H, s, OC6H5), 7,52 и 8,22 (4H, 2d, J 8,8 Гц, C6H4NO2) част./млн].
Затем полученный
сульфонамид (0,56 г, 0,91 ммоль) подвергают гидрогенолизу, как это указано в примере 6, и выделяют 0,23 г (52,5%) целевого продукта:
Rf-значение 0,35 (CH2Cl2
/MeOH = 1,5:1,0);
ИК (KBr): 3600 - 2400bm, 1795s, 1700bs, 1620m, 1500 - 1550s, 1235s, 1170s, 1065 - 1090m, 940m см-1;
1H-ЯМР (CDCl3) δ: 2,05 и
2,19 (6H, 2s, CMe2), 2,27 (3H, s, Me-изоксазол), 4,50 и 4,59 (2H, ABq, J 15,0 Гц, OCH2CO), 5,78 (1H, d, J 4,8 Гц, C2H), 6,09 (1H, dd, J 4,8 и 10,5 Гц, C3H),
6,23 (1H, s, CH-изоксазол), 6,91 - 7,40 (5H, m, OC6H5), 7,78 (1H, d, J 10,5 Гц, CONH) част./млн.
Cоединение формулы (1), полученное в соответствии с примером 13 (R1=H, R2= H, R3= Me2C= C-COOH, R4=H, R5 - 5-метилизоксазолил-3-ил), в сочетании с амоксициллином в массовом соотношении 1: 2 испытывали на ингибирующее действие по отношению к S. aureus Pliva 7667R. Аналогичные испытания проводили с аугментином (клавулановая кислота + амоксициллин в массовом соотношении 1:2) и с амоксициллином. Результаты, представленные в таблице, подтверждают, что заявленные соединения проявляют антибактериальную активность, аналогичную клавулановой кислоте.
Все охватываемые формулой (1) соединения, независимо от заявленных значений радикалов, обладают антибактериальной активностью примерно одинакового уровня.
Показатель острой токсичности LD50 (испытания были проведены на мышах) находится в диапазоне 3700 - 4600 мг/кг.
Реферат
Сущность: соединения формулы I, где R1 - водород или галоген; R2 - водород, галоген, NH2, фенил-CH2CONH, фенил-OCH2CONH, фталимидо,
O-MeNHCOC6H4CONH, 3-о-хлорфенил-5-метилизооксазол-4-илкарбониламино; R3 - водород, Me2C= C-COOMe, H2C= C(Me)-CH-COOMe, Me2C=
C-COOCH2-фенил, H2C=C(Me)-CHCOOCH2C6H4NO2-п, Me2C=CCOOCH2C6H4NO2-п, Me2C=CCOOCH2C6H4Me-м,
H2C=C(Me)-CH-COOCH2C6H4Me-м, Me2C=C-COOH; R4 - водород или натрий;
R5 - алкил, бензил, 5-метилизоксазол, 3,4-диметилизоксазолил и 2-фенилпиразолил и их соли, обладающие антибактериальной активностью. Соединения I получают окислением амидов сульфиновых
кислот формулы II. 2 с. и 37 з.п.ф-лы, 1 табл.
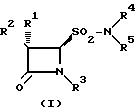
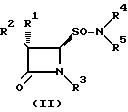
Формула
где - R1 водород, галоген;
R2 - водород, галоген, NH2 , фенил - CH2CONH, фенил - OCH2CONH, фталимидо, o-MeNHCOC6H4CONH, 3-o-хлорфенил-5-метилизоксазол-4-илкарбониламино;
R3 - водород, Me2C=C-COOMe, H2C=C(Me)-CH-COOMe, Me2C=C-COOCH2 - фенил, H2C=C(Me)-CH-COOCH2C6H4NO2-п, Me2C=C-COOCH2C6H4NO2-п, Me2C=C-COOCH2C6H4Me-м,
H2C=C(Me)-CH-COOCH2 C6H4Me-м, Me2C=C-COOH;
R4 - водород или натрий;
R5 - алкил, бензил, 5-метилизоксазолил, 3,4-диметилизоксазолил и 2-фенилпиразолил
и их соли.
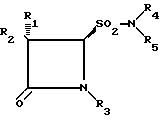
где R1 водород, галоген;
R2 - водород, галоген, фенил - CH2CONH, фенил - OCH2CONH, фталимидо, o-MeNHCOC6H4 CONH, 3-o-хлорфенил-2-метилизоксазол-4-илкарбониламино;
R3 - Me2C= C-COOMe, H2C= C(Me)-CH-COOMe, Me2C=C-COOCH2 - фенил, H2C= C(Me)-CH-COOCH2C6H4NO2-п, Me2C= C-COOCH2C6H4NO2-п, Me2C=C-COOCH2C6 H4Me-м,
H2C=C(Me)-CH-COOCH2C6H4Me-м;
R4 - водород и
R5 - алкил, бензил, 5-метилизоксазолил, 3, 4-диметилизоксазолил и 2-фенилпиразолил,
окисляют с помощью известных средств, используемых обычно в органической химии при проведении окислительных реакций, как, например, перекись водорода, перацетуксусная кислота, м-хлорпербензойная кислота и перманганат калия, в кислой либо нейтральной, водной либо водно-органической среде и в диапазоне температур от 0 до 100oC и затем, в случае необходимости, осуществляют удаление защитных групп, обработку реакционной смеси и выделение продукта по обычной методике.

Комментарии