4-оксоазетидин-2-сульфоновые кислоты или их соли в качестве промежуточных продуктов в синтезе бета-лактамовых антибиотиков и способ их получения - RU2043988C1
Код документа: RU2043988C1
Описание
Изобретение относится к новым 4-оксоазетидин-2-сульфоновым кислотам и их солям, к способу их получения и применению при получении лекарственных препаратов или в качестве активных компонентов таких препаратов.
Известны многочисленные представители моноциклических 4-оксоазетидин-1-сульфоновых кислот и их производных [1] включая важный лактамовый
антибиотик [2]
Известны также некоторые 4-оксоазетидин-2-сульфоновые кислоты, полученные путем трансформации бициклических молекул [3]
В литературе отсутствуют данные о
4-оксоазетидин-2-сульфоновых кислотах и их солях, способе их получения и применении, являющихся предметом изобретения.
Целью изобретения являются новые 4-оксоазетидин-2-сульфоновые
кислоты и их соли общей формулы
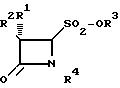
R1 атом водорода, галогена или фенилацетамидо-группа;
R2 атом водорода, галогена, фенилацетамидо-, феноксиацетамидо-, фталимидо- и 5-метил-3-о-хлорфенилизоксазол-4- карбоксамидо-группа;
R3 атом водорода, щелочной металл, щелочноземельный металл, группа четвертичного аммония;
R4 атом водорода, SO2O
Кроме того, предметом изобретения является способ получения новых 4-оксоазетидин-2-сульфоновых кислот и их солей общей формулы I, в которой радикалы имеют указанные
определения, заключающийся в том, что 4-оксоазетидин-2-сульфиновые кислоты и их производные формулы II
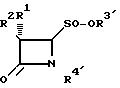
R1 атом водорода, галогена или фенилацетамидо-группа;
R2 атом водорода, галогена, фенилацетамидо-, феноксиацетамидо-, фталимидо- или 5-метил-3-о-хлорфенилизоксазол-4-карбоксамидо-группа;
R3'- атом водорода, щелочного или щелочно-земельного металла, алкил, аралкил или арил;
R4'- атом водорода, (СН3)2С=С-СООСН3, (СН3)2С=С-СООСН2Ph, (CH3)2C=C-COOCH2-C6H4-NO2-п или (CH3)2C=C-COOCH2-C6H4-CH3-м, окисляют перекисью водорода, перуксусной или м-хлорпербензойной кислотой или перманганатом калия в кислой или нейтральной, водной или водно-органической среде при температуре 0-80оС и, при желании, полученный продукт формулы II, у которого R3 означает алкил, аралкил или арил, а радикалы R1, R2 и R4 имеют приведенные определения, подвергают гидролизу в кислой или слабощелочной, водной или водно-органической, или органической среде, с добавкой неорганических солей или органических оснований, и, при желании, полученный продукт формулы II, у которого R3означает атом водорода, а радикалы R1, R2 и R4 имеют приведенные значения, подвергают реакции диспропорционирования и окисления в кислой или нейтральной, водной или водно-органической среде путем контактирования в течение длительного времени с атмосферным воздухом при комнатной температуре и, наконец, полученные продукты переводят при желании в их соли. Исходные соединения формулы (II) могут быть легко получены известным способом.
4-Оксоазетидин-2-сульфоновые кислоты в соответствии с изобретением выделяют из реакционной смеси обычными методами в виде свободных кислот или солей неорганических или органических кислот.
Новые соединения формулы (I) могут использоваться в качестве исходных или промежуточных соединений при получении различных бета-лактамовых аналогов, в частности ряда монобактама или карбапенема, некоторые из которых являются хемотеравпетическими агентами.
Предметом изобретения является также применение новых соединений формулы (I) в композициях, обладающих антимикробной активностью, или в качестве компонентов, проявляющих синергетическую активность в комбинации с другими антимикробными агентами.
П р и м е р 1. (2R, 3R)-3-фталиимидо-1-(1'-п-нитробензилоксикарбонил-2'-метил- проп-1'-eнил)-4-оксоазетидин-2-сульфоновая кислота.
а). Метиловый эфир 3-фталимидо-1-(1'-п-нитробензилоксикарбонил-2'-метилпро- п-1'-енил)-4- оксо-азетидин-2-сульфиновой кислоты (1230 мг, 2,33 ммоль) растворяли в этилацетате (30 мл) и воде (12 мл), добавляли к полученному раствору 80%-ную уксусную кислоту (0,3 мл) и затем при 5оС добавляли по каплям в течение 80 мин 14 мл водного раствора KMnO4 (560 мг, 3,5 ммоль). После добавления воды (30 мл) к смеси добавляли по каплям 30%-ную Н2О2 (около 7 мл) до исчезновения окраски. Органический слой отделяли и после добавления раствора NaHCO3 (250 мг, 3 ммоль) в воде перемешивали смесь при 50оС. Затем ее упаривали в вакууме досуха и остаток растворяли в воде и элюировали на Dowex 50. Полученный элюат лиофилизировали, получая в результате 941 мг (76,3%) хлопьевидного остатка.
Rf 0,51 (EtoAc:HAc:H2O 10:2:1).
ИК (KBr): 3700-3200 bm, 1790 c, 1770 c, 1725 Vs, 1520 м, 1395 с, 1350 м, 1215 м, 1040 W (см-1).
1Н ЯМР (ДМСО-d6) δ: 2,33 (c, 2 CH3), 4,81 (д, С2Н, J 5,4 Гц), 4,97 (с, SO2OH + HOH), 5,44 (д, СН3, J 5,4 Гц), 5,50 (с, ОСН2), 7,81 и 8,35 (2д, С6Н4NO2), 7,97 (c, Pht) (ppm)
b). Метиловый эфир
3-фталимидо-1-(1'-n-ниробензилоксикарбонил-2'-метилпроп-1'-енил)-4-оксоазети дин-кислоты (480 мг, 0,88 ммоль) растворяли в метиленхлориде (10 мл), добавляли к раствору триэтиламин (200 мг, 1,98 ммоль)
и перемешивали смесь в течение 4 ч при 5оС. После упаривания досуха остаток растворяли в воде и элюировали на Dowex 50. Элюат лиофилизировали, получая в результате хлопьевидный продукт,
аналогичный продукту, получение которого описано в пункте а).
П р и м е р 2. (2R,
3R)-3-фенилацетамидо-1-(1'-n-нитробензилоксикарбонил-2'-метилпроп- 1'-енил)-4-оксоазетидин-2-сульфоновая кислота
а). Метиловый эфир
3-фенилацетамидо-1-(1'-n-нитробензилоксикарбонил-2'-метилпроп-1'-енил)- 4-оксоазетидин-2-сульфоновой кислоты (400 мг, 0,78 ммоль) растворяли в метиленхлориде (15 мл) и муравьиной кислоте (1,3 мл),
после чего к раствору добавляли при комнатной температуре 30%-ную перекись водорода (4,8 мл). Реакционную смесь перемешивали в течение 2 ч при 40оС, после чего добавляли к ней метиленхлорид
(20 мл) и воду (15 мл). Органический слой отделяли, промывали водой (1 х 15 мл), высушивали (Na2SO4), фильтровали и упаривали в вакууме досуха. Остаток растворяли в этилацетате
(10 мл) и после добавления к раствору триэтиламина (100 мг, 1 ммоль) перемешивали смесь в течение 1,5 ч при комнатной температуре. После этого ее упаривали в вакууме, остаток растворяли в воде (10 мл),
элюировали на Dowex 50 и лиофилизировали. Остаток 213 мг (52,6%) представлял собой сырой продукт, который перекристаллизовывали из этилацетата. Т.пл. 164-166оС.
Rf 0,58
(CH2Cl2:CH3OH 4:1)
ИК (KBr): 3700-3150 Bm, 3360 c, 1765 c, 1755 c, 1710 c, 1680 м, 1660 м, 1520 с, 1350 с, 1220 Vs, 1040 c (см-1)
1Н ЯМР (ДМСО-d6) δ: 2,04 (c, CH3), 2,18 (c, CH3), 3,52 (c, CH2CO), 4,59 (д, С2Н, J 5,4 Гц), 5,33 (с, О-СН2), 5,37 (кв,
С3Н, J 5,4 и 10,1 Гц), 6,44 (шир. с, SO2OH), 7,27 (c, C6H5), 7,67 и 8,23 (2д, С6Н4-NO2, J 8,6 Гц) и 8,0 (д, NHCO, J 10,1
Гц), (ppm)
b). Метиловый эфир 3-фенилацетамидо-1-(1'-n-нитробензилоксикарбонил-2-метилпроп-1'-енил)- 4-окосазетидин-2-сульфоновой кислоты (240 мг, 0,45 ммоль) растворяли в метиленхлориде (5
мл), добавляли к раствору триэтиламин (68 мг, 0,67 ммоль) и реакционный раствор перемешивали в течение часа. После этого его упаривали в вакууме, остаток растворяли в воде (10 мл), элюировали на Dowex
50 и лиофилизировали. Полученный остаток был идентичен продукту, полученному по способу в соответствии с пунктом а). Выход: 180 мг (77,8%).
П р и м е р 3. Натриевая соль (2R, 3R)-3-фенилацетамидо-4-оксазетидин-2-сульфоновой кислоты.
Метиловый эфир 3-фенилацетамидо-1-(1'-n-нитробензилоксикарбонил-2-метилпроп-1'-енил)- 4-оксоазетидин-2-сульфиновой кислоты (3, 00 г, 5,82 ммоль) растворяли в этилацетате (40 мл), охлаждали раствор до 0оС и после добавления к нему 80%-ной уксусной кислоты (40 мл) и по каплям водного раствора перманганата калия (75 мл, 18,98 ммоль) при перемешивании в течение 40 мин, перемешивали смесь в течение еще 20 мин. После этого к ней добавляли по каплям раствор 30%-ной перекиси водорода (2,5 мл), в результате чего происходило исчезновение окраски перманганата. После добавления этилацетата (50 мл) и хлорида натрия до насыщения водного раствора смесь перемешивали в течение 30 мин при комнатной температуре. Органический экстракт отделяли, а водный слой подвергали экстракции этилацетатом (40 мл). Органические экстракты объединяли, высушивали (Na2SO4), фильтровали и упаривали в вакууме досуха. После добавления к остатку этилацетата суспензию перемешивали в течение 2 ч при 5оС и отсасывали выпадающие кристаллы. Выход: 640 мг (35,9%). Т.пл. 205-207оС.
Rf 0,61 (н-BuOH:HAc:H2O 4:1:1)
ИК (KBr): 3310 м, 3325 м, 1760 Vs, 1640 c, 1525 c, 1260 c, 1205 c, 1070 c (см-1)
1Н ЯМР (ДМСО-d6
) δ: 3,59 (c, CH2CO), 4,39 (д, С2Н, J 5,0 Гц), 5,40 (кв, С3Н, J 5,0 и 10,2 Гц), 7,38 (с, С6Н5), 7,93 (д, NHCO, J 10,2 Гц), 8,88 (шир. с.
N1H) (ppm)
Рассчитано: a 7,51%
Найдено: a 7,68%
П р и м е р 4. Тетрабутиламмониевая соль (2R,3R)-3-фенилацетамидо-4-оксо-азетидин-2-сульфоновой кислоты.
Натриевую соль 3-фенилацетамидо-4-оксоазетидин-2-сульфоновой кислоты (100 мг, 0,33 ммоль) и гидросульфат тетрабутиламмония (120 мг, 0,35 ммоль) растворяли в смеси CH2Cl1 (10 мл) и Н2О (10 мл) и перемешивали раствор в течение 2 ч при комнатной температуре. Органический экстракт отделяли, а водный слой дважды подвергали экстракции CH2Cl2 порциями по 10 мл. Объединенные органические экстракты высушивали (Na2SO4), фильтровали и упаривали в вакууме. Остаток 100 мг (57,6%) представлял собой целевой продукт.
Rf 0,58 (CH2Cl2:CH3OH 4:1)
ИК (KBr): 3325 w, 2960 c, 2880 м, 1770 Vs, 1680 c, 1520 м, 1225 с, 1200 с (см-1).
1Н
ЯМР (CDCl3) δ: 1,03: 1,54 (28H, м), 3,12-3,30 (8Н, м), 3,59 (с, СН2СО), 4,58 (д, С2Н, J 5,3 Гц), 5,63 (кв, С3Н, J 5,3 и 10,5 Гц), 7,30 (с, С6Н5), 7,76 (д, CONH, J 10,0 Гц), 8,20 (д, N1H, J 8,0 Гц) (ppm)
П р и м е р 5. Тетрабутиламмониевая соль (2R,3R)-3-фенилацетамидо-4-оксоазетидин-1,2-дисульфоновой
кислоты.
К смеси комплекса пиридина и трехокиси серы (85 мг, 0,54 ммоль) и триэтиламина (0,12 мл) в метиленхлориде (10 мл) добавляли метиловый эфир (2R, 3R)-3-фенилацетамидо-4-оксоазетидин-2-сульфоновой кислоты. Реакционный раствор перемешивали в течение 2 ч при комнатной температуре в токе азота и затем выливали в 1 М раствор КН2РО4 (10 мл). Водный слой отделяли, промывали метиленхлоридом (10 мл) и перемешивали с раствором гидросульфата тетрабутиламмония (180 мг, 0,54 ммоль) в метиленхлориде (30 мл) в течение 2 ч при комнатной температуре. Органический экстракт отделяли, водный слой промывали метиленхлоридом (2 х 10 мл). Объединенные органические экстракты высушивали (Na2SO4), фильтровали и упаривали.
Остаток: 140 мг целевого продукта (30,6%). Rf 0,56 (CH2Cl2:MeOH 4:1)
ИК (CH2Cl2): 3400w, 2920 c, 2850 c, 1775 c, 1675 c,
1510 м, 1220 с, 885 (см-1)
1Н ЯМР (CDCl3) δ: 1,00-1,65 (56H, м), 3,13-3,23 (16Н, м), 3,56 (с, СН2СО), 4,54 (д, С2Н, J 5,0 Гц), 5,
60 (кв. С3Н, J 5,0 и 10,3 Гц), 7,27 (с, С6Н5), 7,73 (д, CONH, J 10,3 Гц) (ppm).
П р и м е р 6. Тетрабутиламмониевая соль (2R, 3S)-3-фенилацетамидо-4-оксоазетидин-2-сульфоновой кислоты.
Метиловый эфир (2R, 3S)-3-фенилацетамидо-1-(1'-нитробензилоксикарбонил-2'- метилпропил- 1'-енил)-4-оксоо-азетидин-2-сульфоновой кислоты (515 мг, 1 ммоль) растворяли в этилацетате (10 мл), охлаждали раствор до 0оС, добавляли к нему 80%-ный раствор уксусной кислоты (6,8 мл) и по каплям в течение часа при интенсивном перемешивании 4%-ный раствор KMnO4 (11,8 мл, 3 ммоль). После этого к нему по каплям добавляли 30%-ный раствор Н2О2 до обесцвечивания. К обесцвеченному реакционному раствору добавляли этилацетат (20 мл) и NaCl до насыщения водного раствора, после чего перемешивали смесь в течение еще 30 мин при комнатной температуре. Органический экстракт отделяли, водный раствор один или более раз подвергали экстракции этилацетатом (20 мл), объединенные органические экстракты высушивали (Na2SO4), фильтровали упаривали досуха. После добавления смеси этилацетата и метанола получали суспензию, которую фильтровали и остаток на фильтре растворяли в воде (10 мл). Раствор пропускали через Dowex 50. Полученный водный раствор (20 мл) перемешивали в течение 2 ч с гидросульфатом тетрабутиламмония в CH2Cl2(20 мл) (170 мг, 0,5 ммоль). Органический экстракт отделяли, а водный слой подвергали экстракции CH2Cl2 (2 x 10 мл). Объединенные органические экстракты высушивали фильтровали и упаривали. Выход: 94 мг (18%). Rf 0,51 (CH2Cl2:MeOH 4:1). ИК (KBr): 3320W, 2950 c, 2920 c, 1765 c, 1675 c, 1520 м, 1220 с, 1190 с (см-1).
П р и м е р 7. (2R,3R)-3-Феноксиацетамид-4-оксоазетидин-2-сульфоновая кислота.
Метиловый эфир 3-феноксиацетамидо-1-(1'-метилоксикарбонил-2'-метилпроп-1'-енил)-4- оксоазетидин-2-сульфиновой кислоты (4,1 г, 10 ммоль) растворяли в этилацетате (100 мл) и 80%-ной уксусной кислоте (40 мл) и при 0оС добавляли к полученному раствору по каплям 4%-ный водный раствор KMnO4(150 мл, 6 г, 38 ммоль) в течение 60 мин. Суспензию перемешивали в течение еще 60 мин при 0оС. После добавления воды (20 мл) к ней добавляли по каплям 30%-ную Н2О2 до исчезновения окраски. Органический слой отделяли, высушивали над Na2SO4 и упаривали при пониженном давлении до получения твердого остатка. В результате получали 3,9 г твердого материала, к которому добавляли метанол (30 мл) и после перемешивания в течение 60 мин отфильтровывали твердый осадок. Выход: 0,96 г (32%). Т.пл. 225-230оС (с разложением).
Rf 0,45 (н-BuOH:HAc:H O 4:1:1)
ИК (KBr): 3330-3315 м, 1750 Vs, 1655 c, 1595 м, 1495 м, 1525 м, 1245-1195 с, 1060 с, 750 М (см-1)
1Н ЯМР (ДМСО-d6)
δ: 4,31 (д, С2Н, J 4,98 Гц), 4,50 (с, ОСН2), 5,35 (кв. С3Н, J 4,98 и 9,96 Гц), 7,02-7,40 (м, С6Н5О), 8,58 (д, NH-CO, J 9,96 Гц), 8,82 (с,
N1H) (ppm)
П р и м е р 8. (2R,3R)-3-Феноксиацетамидо-1-(1'-метилоксикарбонил-2'-метилпроп-1'-енил)- 4-оксоазетидин-2-сульфоновой кислоты.
Маточный раствор после
выделения твердого материала при осуществлении процесса по способу в соответствии с примером 7 упаривали досуха при пониженном давлении. После добавления к твердому остатку метанола (5 мл) и ацетона
(30 мл) смесь перемешивали в течение 60 мин. Твердый материал отфильтровывали, растворяли в воде (10 мл) и раствор пропускали через Dowex 50. Элюат лиофилизировали. Выход: 1,32 г (32%), Rf 0,70
(н-BuOH:HAc:H2O4:1:1)
ИК (KBr): 3350 м, 1780 с, 1705 с, 1600, 1540 м, 1500 м, 1440 м, 1390 W, 1230 c, 1035 м (см-1)
1Н ЯМР (ДМСО-d6)
δ: 2,11 (c, CH3), 2,28 (c, CH3), 3,82 (c, -OCH3) 4,67 (c, OCH2), 4,7 (д, СН2, J 5,6 Гц), 5,37 (с, SO2OH + HOH), 5,57 (кв, С3Н, J 5,6 Гц и 8,8 Гц), 7,02-7,52 (м, С6Н5О) и 8,83 (д, NH, J 8,8 Гц) (ppm).
П р и м е р 9. Тетрабутиламмониевая соль (2R, 3R)-3-феноксиацетамидо-4-оксоазетидин-2-сульфоновой кислоты.
(2R, 3R)-3-Феноксиацетамидо-4-оксоазетидин-2-сульфоновую кислоту (0,3 г, 1 ммоль) растворяли в воде (10 мл) и добавляли к раствору гидросульфат тетрабутиламмония (0,34 г, 1 ммоль) и метиленхлорид (10 мл). Смесь перемешивали в течение 3 ч при комнатной температуре. Органический слой отделяли, промывали водой (10 мл) и упаривали при пониженном давлении. Выход: 0,39 г (72%). Rf 0,80 (СH2Cl2:MeOH 4:1).
ИК (парафиновое масло): 3350-3110 м, 3000-2850 с, 1680 с, 1600, 1530 м, 1495 с, 1460 м, 1380 м, 1225 Vs, 1185 c, 1060 c, 1010 м (см-1).
Результаты анализа из расчета на формулу C27H47N2O6S (541,736)
Рассчитано, C 59,84; H 8,74; N 7,76; S 5,92
Найдено, C 59,81; H 9,98; N 7,81; S 5,06
1Н ЯМР (ДМСО-d6) δ: 1,00-1,84 (м, 28 Н), 3,20-3,5 (м, 8Н), 4,46 (д,
С2Н, J 5,3 Гц), 4,62 (с, ОСН2), 5,47 (кв, С3Н, J 5,3 Гц и 10,25 Гц), 7,02-7,53 (м, С6Н5О), 8,7 (д, NHCO, J 10,25 Гц) и 8,95 (с, N1H)
(ppm).
П р и м е р 10. (2R,3R)-3-(3'-о-хлорфенил-5'-метилизоксазол-4'-карбоксамидо)-1-(1'-м-метилбе нзил-1'-енил)-4-оксоазетидин-2-сульфоновая кислота.
а). Метиловый эфир 3-(3'-o-хлорфенил-5'-метилизоксазол-4'-карбоксамидо)-1-(1'-м- метилбензилоксикарбонил-2'-метилпроп-1'-енил)-4-оксоазетидин-2-сульфиновой кислоты (703 мг, 1,2 ммоль) растворяли в CHCl3 (8 мл) и добавляли к полученному раствору при перемешивании раствор м-хлорпербензойной кислоты (414 мг, 2,4 ммоль) в CHCl3 (5 мл). Ракционную смесь перемешивали при комнатной температуре в течение 10 ч, после чего обрабатывали насыщенным водным раствором NaHCO3 (10 мл) и водой. Органический слой упаривали при пониженном давлении до образования пенообразного твердого продукта. Путем хроматографии на силикагелевой колонке с использованием в качестве подвижной фазы растворителей, метиленхлорида и метанола, выделяли 438 мг (65,4%) соответствующей сульфоновой кислоты с Rf 0,42 (CH2Cl2:MeOH 4:1), Т.пл. 178-182оС.
ИК (KBr): 3700-3150 bc, 1780 c, 1600 c, 1610 м, 1530 м, 1400 W, 1295 W, 1220 Vs, 1040 м, 770 м (см-1)
1Н ЯМР (CDCl3) δ: 1,62 и 1,82 (2с, (СН3)2), 2,04 (с, СН3 изоксазол), 2,31 (с, СН3, -Ph), 2,71 (c, в SO3H), 4,40
(д, J 6 Гц, С2Н), 4,48 (с, СН2), 4,89 (дд, J 6 и 8 Гц, С3Н), 6,04 (д, J 8 Гц, NH), 6,18-6,31 (м, Ph), 6,40-6,62 (м, Ph-изоксазол).
b). Готовили раствор метилового эфира 3-(3'-о-хлорфенил-5'-метилизоксазол-4'-карбоксамидо)-1-(1'-м- метилбензиоксикарбонил-2'-метилпроп-1'-енил)-4-оксоазетидин-2-сульфиновой кислоты (1,85 г, 3 ммоль) в уксусной кислоте (26 мл), к которому добавляли Н2О2 (6,6 мл, 60 ммоль) и перемешивали смесь при комнатной температуре в течение 15 ч. После этого реакционную смесь выливали в холодную воду (100 мл) и нейтрализовали полученный раствор (рН около 5) путем добавления к нему твердого NaHCO3, а затем подвергали его экстракции метиленхлоридом (2 х 100 мл). Органические экстракты объединяли и упаривали при пониженном давлении до получения пенообразного твердого вещества. Путем хроматографии на колонке, заполненной силикагелем, с использованием в качестве подвижной фазы смеси растворителей, метиленхлорида и метанола, получали 1,160 г (77,5%) соединения, идентичного продукту, полученному с помощью описанного в пункте а) способа.
с). Метиловый эфир (3'-o-хлорфенил-5'-метилизоксазол-4'-карбоксамидо)-1-(1'-м- метилбензилоксикарбонил-2'-метилпроп-1'- енил)-4-фоксоазетидин-2-сульфиновой кислоты (1,030 г, 1,8 ммоль) растворяли в этилацетате (10 мл) и добавляли к полученному раствору уксусную кислоту (1,2 мл). При перемешивании к нему добавляли по каплям при 10оС 4%-ный водный раствор KMnO4 до появления розовой окраски. Раствор затем обесцвечивали путем добавления к нему Н2О2 и разделяли слои. После промывки насыщенным раствором NaHCO3 и водой органический слой упаривали при пониженном давлении до образования вязкой, почти бесцветной жидкости. После разделения компонентов на силикагелевой колонке с использованием в качестве подвижной фазы смеси растворителей, метиленхлорида и метанола, получали 180 мг (21%) вещества, идентичного соединению, полученному по способу, описанному в пункте а).
П р и м е р 11. Натриевая соль 2R-1-(1'-бензилоксикарбонил-2'-метилпроп-1'-енил)- 4-оксоазетидин-2-сульфоновой кислоты.
Метиловый эфир 2R-1-(1'-бензилоксикарбонил-2'-метилпроп-1'-енил)-4-оксоазетидин-2-сульфонов ой кислоты (2,585 г, 7,32 ммоль) растворяли в этилацетате (40 мл) и добавляли к полученному раствору воду (40 мл). Смесь перемешивали при кипячении в течение 5 ч. Затем ее охлаждали и разделяли органический и водный слои. Водный слой еще раз подвергали экстракции этилацетатом (30 мл). К водному слою добавляли этилацетат (30 мл) и устанавливали его рН с помощью твердого гидрокарбоната натрия равным 7,5. Затем к реакционной смеси добавляли до насыщения хлорид натрия, слои разделяли и водный слой снова подвергали экстракции этилацетатом (2 х 20 мл). Объединенные этилацетатные вытяжки промывали насыщенным водным раствором хлорида натрия (20 мл), высушивали безводным сульфатом натрия и упаривали досуха. Полученную в виде остатка полукристаллическую массу суспендировали в эфире (30 мл), отсасывали образующиеся кристаллы и промывали их эфиром. В результате получали 2,200 г гигроскопического продукта.
Rf 0,62 (н-бутанол:уксусная кислота:вода 4:1:1)
Т.пл. 220-225oC
ИК (KBr) V: 1765 Vs, 1710 c, 1390 c, 1225 Vs, 1045 c (см-1)
1Н ЯМР (ДМСО-d6) δ: 1,97 и 2,13 (2с, С(СН3)2), 2,83 (дд, J C3-H, J 14,7 Гц и J 2, Гц), 3,00 (дд, α С3-Н, J 14,7 Гц и J 5,3 Гц), 3,30-3,70 (в, Н2О), 4,37 (дд, С2-Н, J 2,5 Гц
и J 5,3 Гц), 5,15 и 5,21 (2д, CH2Ph, J 12,6 Гц), 7,33-7,40 (м, С6Н5).
П р и м е р 12. Метиловый эфир 2R-1-(1'-бензилоксикарбонил-2'-метилпроп-1'-енил)- 4-оксоазетидин-2- сульфоновой кислоты (2,500 г, 7,08 ммоль) и воду (40 мл) интенсивно перемешивали при температуре кипения до образования прозрачного раствора (около 30 мин). После добавления к раствору этилацетата смесь обрабатывали таким же образом, как это описано в примере 11. Выход: 2,000 г целевого продукта.
П р и м е р 13. Смесь этилового эфира 2R-1(1'-бензилоксикарбонил-2'-метилпроп-1'-енил)-4-оксоазетидин-2-сульфоново й кислоты (367 мг, 1 ммоль) и воды (10 мл) интенсивно перемешивали при температуре кипения до образования прозрачного раствора. После добавления к охлажденному раствору этилацетата смесь обрабатывали таким же образом, как это описано в примере 11. Выход: 210 мг целевого продукта.
П р и м е р 14. Третбутиловый эфир 2R-1-(1'-бензилоксикарбонил-2'-метилпроп-1'-этил)-4-оксоазетидин-2-сульфонов ой кислоты (395 мг, 1 ммоль) перемешивали с водой (10 мл) и далее проводили процесс таким же образом, как это описано в примере 11. Выход: 180 мг целевого продукта.
П р и м е р 15. Метиловый эфир 2R-1-(1'-бензилоксикарбонил-2'-метилпроп-1'-енил)- 4-оксоазетидин-2-сульфоновой кислоты (1,450 г, 4,1 ммоль) выдерживали в контакте с воздухом при комнатной температуре. Образующийся продукт растворяли в смеси этилацетата (20 мл) и воды (20 мл) и далее проводили процесс таким же образом, как это описано в примере 11. Выход: 640 мг целевого продукта.
П р и м е р 16. 2R-1-(1'-Бензилоксикарбонил-2'-метилпроп-1'-енил)-4-оксоазетидин-2-сульфинов ую кислоту (3,085 г, 9,55 ммоль) растворяли в этилацетате (20 мл), добавляли к полученному раствору 85%-ную м-хлорбензойную кислоту (2,464 н, 12,2 ммоль) и перемешивали смесь в течение 4 ч при комнатной температуре. Затем к ней добавляли по каплям, в течение 15 минут, приготовленный заранее раствор сульфита натрия (1,203 г, 9,55 ммоль) в воде (20 мл). Реакционную смесь перемешивали в течение еще 30 минут, после чего слои разделяли и водный слой еще раз подвергали экстракции этилацетатом (20 мл). Объединенные этилацетатные экстракты промывали водой (20 мл). После добавления этилацетата (30 мл) и объединенным водным слоям рН смеси с помощью твердого гидрокарбоната натрия устанавливали равным 7,5 и далее процесс проводили таким же образом, как это описано в примере 11. Выход: 2,300 г целевого продукта.
П р и м е р 17. Раствор 2R-1-(1'-бензилоксикарбонил-2'-метилпроп-1'-енил)-4-оксоазетидин-2-сульфинов ой кислоты (2,180 г, 6,75 ммоль) в бензоле (20 мл) кипятили в течение 2 ч. Реакционную смесь затем упаривали досуха в вакууме, создаваемом водоструйным насосом. Сухой остаток растворяли в смеси воды (20 мл) и этилацетата (20 мл). Слои разделяли и водный слой обрабатывали таким же образом, как это описано в примере 16. Выход: 512 мг целевого продукта.
П р и м е р 18. 2R-1-(1'-Бензилоксикарбонил-2'-метилпроп-1'-енил)-4-оксоазетидин-2-сульфонов ая кислота.
Натриевую соль 2R-1-(1'-бензилоксикарбонил-2'-метилпроп-1'-енил)-4-оксоазетидин-2-сульфонов ой кислоты (1,080 г, 3 ммоль) растворяли в воде (5 мл) и раствор пропускали через Dowex 50WX 8. Кислую фракцию лиофилизировали, получая в результате остаток в виде маслянистой жидкости. Выход: 980 мг.
Rf 0,62 (н-BuOH:HAc:H2O 4:1:1)
ИК (пленка) V: 3450 c, 1760 Vs, 1715 c,
1395 W, 1220 Vs, 1040 c (см-1)
1Н ЯМР (ДМСО-d6) δ: 2,08 и 2,25 (2с, С(СН3)2), 2,91 (дд,β С3-Н, J 14,7 Гц и J 2,3
Гц), 3,14 (дд, α С3-Н, J 14,7 Гц и J5,0 Гц), 4,50 (дд, С2-Н, J 2,3 Гц и J 5,0 Гц), 5,10 (шир.с. SO2OH и Н2О), 5,15 и 5,21 (2д, СН2, Ph, J
12,6 Гц), 7,49 (м, С6Н5) (ppm).
П р и м е р 19. Метиловый эфир 2R-1(1'-бензилоксикарбонил-2'-метилпроп-1'-енил)- 4-оксоазетидин-2-сульфоновой кислоты (0,200 г, 0, 566 моль) суспендировали в воде (5 мл) и интенсивно перемешивали суспензию при температуре кипения до получения прозрачного раствора, который затем подвергали экстракции метиленхлоридом (2 х 5 мл). Водную фазу упаривали в вакууме, создаваемом водоструйным насосом, с добавлением абсолютного этанола. Выход: 193 мг целевого продукта.
П р и м е р 20. 2R-4-оксоазетидин-2-сульфоновая кислота.
Натриевую соль 2R-1-(1'-бензилоксикарбонил-2'-метилпроп-1'-енил)-4-оксоазетидин-2-сульфонов ой кислоты (1,500 г, 4,15 ммоль) растворяли в воде (30 мл), охлаждали раствор до 0оС и при этой температуре добавляли к нему по каплям водный раствор перманганата калия до появления стабильной, характерной для перманганата фиолетовой окраски. Кислотность реакционной смеси в процессе добавления перманганата с помощью уксусной кислоты поддерживали в пределах рН, равного 5-6. Выпадающий осадок диоксида марганца отсасывали и промывали водой. Прозрачный бесцветный водный раствор упаривали досуха в вакууме при добавлении абсолютного этанола. К остатку еще раз добавляли абсолютный этанол (30 мл). Осадок отсасывали и промывали абсолютным этанолом. Остаток растворяли в воде (20 мл) и раствор пропускали через колонку, заполненную Do wex 50 WX 8 и лиофилизировали. Лиофилизированный остаток суспендировали в этилацетате (20 мл). Этилацетат отделяли декантацией, а кристаллическую массу промывали этилацетатом (2 х 10 мл). Полученные кристаллы высушивали в вакууме, создаваемом водоструйным насосом. В результате получали 480 мг сильно гигроскопического продукта белого цвета.
Rf 0,45 (н-бутанол:уксусная кислота:вода 4:1:1)
1H ЯМР (ДМСО-d6) δ: 2,82 (дд, β С3-Н, J
14,5 Гц и J 1,9 Гц), 3,07 (дд, α С3-Н, J 14,5 Гц и J 50 Гц), 3,37 (шир. с. SO2OH и Н2О), 4,20 (дд, С2-Н, J 1,9 Гц и J 5,0 Гц), 3,37 (с, NH) (ppm).
П р и м е р 21. Метиловый эфир 2R-4-оксоазетидин-2-сульфоновой кислоты (1,650 г, 10 ммоль) суспендировали в воде (20 мл) и суспензию кипятили до образования прозрачного водного раствора, который подвергали экстракции этилацетатом (2 х 10 мл) и лиофилизировали. Остаток обрабатывали таким же образом, как это описано в примере 20. Выход: 120 мг целевого продукта.
П р и м е р 22. Натриевая соль 2R-3,3-дибром-1-(1'-бензилоксикарбонил-2'-метилпроп-1'-енил)-4- оксоазетидин-2-сульфоновой кислоты.
После добавления к раствору 2R-3, 3-дибром-1-(1'-бензилоксикарбонил-2'-метилпроп-1'-енил)-4- оксоазетидин-2-сульфоновой кислоты (3,128 г, 6,5 ммоль) в хлороформе (30 мл) 85%-ной м-хлорпербензойной кислоты (1,31 г, 6,5 ммоль) реакционную смесь перемешивали в течение 20 мин при -10оС. Перемешивание продолжали в течение еще часа при комнатной температуре и после добавления к смеси 1 М раствора бисульфита натрия (30 мл, 30 ммоль) разделяли органический и водный слои и хлороформную фазу упаривали досуха. Остаток суспендировали в воде (4,0 мл) и осадок отсасывали. К водному фильтрату добавляли этилацетат (30 мл) и с помощью твердого гидрокарбоната натрия устанавливали рН 7,5-8. После добавления хлорида натрия до насыщения слои разделяли и водную фазу снова подвергали экстракции этилацетатом (2 х 20 мл). Объединенные этилацетатные фазы энергично встряхивали с насыщенным водным раствором хлорида натрия в делительной воронке, высушивали безводным сульфатом натрия и упаривали досуха. В результате получали 1,379 г гигроскопического целевого продукта.
Rf 0,70 (этилацетат: метанол 3:1).
ИК (пленка) V: 3500 шир.с. 1795 Vs, 1710 c, 1635 м, 1390 W, 1370 W, 1220 Ws,
1050 c (см-1)
1Н ЯМР (CDCl3) δ: 1,99 и 2,11 (2с, С(СН3)2)), 5,20 (с, CH2Ph), 5,27 (c, C2-H) и 7,31 (с, С6Н5) ppm.
П р и м е р 23. Тетрабутиламмониевая соль 2R-3,3-дибром-1-(1'-бензилоксикарбонил-2'-метил-проп-1'-енил)-4- оксоазетидин-2-сульфоновой кислоты.
Натриевую соль 2R-3,3-дибром-1-(1'-бензилоксикарбонил-2'-метилпроп-1'-енил)- 4-оксоазетидин- 2-сульфоновой кислоты (0,259 г, 0,5 ммоль) растворяли в воде (10 мл), добавляли к полученному раствору гидросульфат тетрабутиламмония (0,169 г, 0,5 ммоль), растворенный в метиленхлориде (10 мл) и перемешивали смесь в течение часа при комнатной температуре. Метиленхлоридный слой отделяли, а водный еще раз подвергали экстракции метиленхлоридом (2 х 15 мл). Объединенные органические фазы высушивали безводным сульфатом натрия и упаривали досуха. В результате получали 0,281 г целевого продукта в виде маслянистой жидкости.
Rf 0,70 (этилацетат:метанол 3:1)
ИК (пленка) V: 3600-3330 в, 1790 Vs, 1730 c, 1615 м, 1465 с, 1370 Vs, 1225 Vs, 1050 c (см-1)
1Н ЯМР (CDCl3) δ: 0,85-1,60 (м, 28 Н), 2,10 и 2,19 (2с, С(СН3)2) 3,12-3,18 (м, 8Н), 5,01 (дд, CH2Ph), 5,25 (c, C2-H) и 7,29-7,31 (м,
С6Н5) ppm.
П р и м е р 24. 2R-3,3-Дибром-1-(1'-бензилоксикарбонил-2'-метилпроп-1'-енил)-4- оксоазетидин-2-сульфоновая кислота.
Натриевую соль 2R-3, 3-дибром-1-(1'-бензилоксикарбонил-2'-метилпроп-1'-енил)- 4-оксоазетидин- 2-сульфоновой кислоты (0,519 г, 1 ммоль) растворяли в воде (10 мл) и полученный раствор пропускали через Dowex 50WX8. После лиофилизации кислых фракций получали 0,376 г гигроскопического белого порошкообразного продукта.
Rf 0,70 (этилацетат:метанол 3:1)
ИК (пленка) V: 3600-3300 в, 1797 Vs, 1735 c,
1710 (c, 1395 c, 1370 c, 1220 Vs, 1050 c (см-1)
1Н ЯМР (ДМСО-d6) δ: 2,09 и 2,30 (2с, С(СН3)2), 3,80 (с, SO2OH и Н2О), 4,98 (с, С2-Н), 5,29 (дд, СН2Ph) и 7,50 (С6Н5) ppm.
П р и м е р 25. Метиловый эфир 2R-3, 3-дибром-1-(1'-бензилоксикарбонил-2'-метилпроп-1'-енил)-4- оксоазетидин-2-сульфоновой кислоты (0,511 г, 1 ммоль) растворяли в метиленхлориде (10 мл), добавляли к полученному раствору триэтиламин (0,28 мл, 2 ммоль) и перемешивали смесь в течение 4 ч при комнатной температуре. Затем ее упаривали досуха, остаток растворяли в воде (10 мл) и раствор пропускали через Dowex 50 WX8. Кислый элюат лиофилизировали. Выход: 0,346 г целевого продукта.
П р и м е р 26. Метиловый эфир 2R-3,3-1-(1'-бензилоксикарбонил-2'-метилпроп-1'-енил)-4-оксоазетидин-2- сульфоновой кислоты (0,511 г, 1 ммоль) растворяли в смеси воды (25 мл) и этилацетата (25 мл) и перемешивали полученный раствор в течение 4 ч при температуре кипения. Водный и органический слои разделяли и из водного слоя проводили экстракцию этилацетатом (3 х 25 мл), высушивали органическую фазу безводным сульфатом натрия и упаривали досуха. В результате получали 0,474 г пенообразного продукта, который подвергали очистке на колонке, заполненной силикагелем 60 F, используя в качестве подвижной фазы смесь этилацетата и метанола в соотношении 3:1. Остаток после упаривания растворяли в воде (10 мл) и раствор пропускали через Dowex 50WX8. Кислую фракцию лиофилизировали. В результате получали 0,195 г целевого продукта.
П р и м е р 27. 2R-3,3-Дибром-4-оксоазетидин-2-сульфоновой кислоты.
Натриевую соль 2R-3,3-дибром-1-(1'-бензилоксикарбонил-2'-метилпроп-1'-енил)- 4-оксоазетидин-2-сульфоновой кислоты (0,519 г, 1 ммоль) растворяли в воде (5 мл), охлаждали раствор до 0-5оС, после чего добавляли к нему по каплям водный раствор (4%-ный) перманганата калия до появления устойчивой розовой окраски. Раствор фильтровали через диатомовую землю и фильтрат пропускали через Dowex 50WX8. Кислые фракции лиофилизировали. В результате получали 0,231 г гигроскопического продукта.
Rf 0,45 (этилацетат:метанол 3:1)
ИК (пленка) V: 3600-3300 в, 1775 Vs, 1725 c,
1200 c (см-1)
1Н ЯМР (ДМСО-d6) δ: 5,27 (c, CH2-H) и 9,66 (с, NH) ppm.
П р и м е р 28. Натриевая соль 2R, 3S-3-бром-1-(1'-бензилоксикарбонил-2'-метилпроп-1'-енил)-4-оксоазетидин- 2-сульфоновой кислоты. 2R,3S-3-Бром-1-(1'-бензилоксикарбонил-2'-метилпроп-1'-енил)-4-оксоазетидин- 2-сульфиновой кислоты (0,201 г, 0,5 ммоль) растворяли в хлороформе (5 мл), раствор охлаждали до -10оС, добавляли к нему 85%-ную хлорпербензойную кислоту (0,1 г, 0,5 ммоль) и перемешивали в течение 20 мин, а затем в течение еще часа при комнатной температуре. После добавления 1 М раствора бисульфита натрия (3 мл, 3 ммоль) органический и водный слои разделяли и хлороформный слой упаривали досуха. К остатку добавляли воду (1,5 мл), отсасывали осадок, к водной части добавляли этилацетат (5 мл) и с помощью твердого гидрокарбоната натрия устанавливали ее рН, равным 7,5-8. Затем водную фракцию насыщали хлоридом натрия и разделяли водный и органический слои. Водный слой снова подвергали экстракции этилацетатом (3 х 5 мл). Объединенные этилацетатные экстракты промывали насыщенным раствором хлорида натрия и упаривали досуха. В результате получали 0,07 г белого пенообразного целевого продукта.
Rf 0,68 (этилацетат:метанол 3:1)
1Н ЯМР (ДМСО-d6) δ
: 2,10 и 2,30 (2С, С (СН3)2), 4,62 (д, СН2-Н, J 1,8 Гц), 4,93 (д, С3-Н, J 1,8 Гц), 5,31 (с, СН2Ph) и 7,20 (м, С6Н5) ppm.
П р и м е р 29. 2R,3S-3-Бром-1-(1'-бензилоксикарбонил-2'-метилпроп-1'-енил)-4- оксоазетидин-2-сульфоновой кислоты.
Натриевую соль 2R, 3S-3-бром-1-(1'-бензилоксикарбонил-2'-метилпроп-1'-енил)-4-оксоазетидин- 2-сульфоновой кислоты (50 мг) растворяли в воде (5 мл) и полученный раствор пропускали через колонку, заполненную Dowex 50WX8. Кислые фракции лиофилизировали. В результате получали 38 мг гигроскопического вещества.
Rf 0,68 (этилацетат:метанол 0 3:1)
ИК (пленка V: 3600-3300 в, 1790 Vs, 1730 c, 1705 c,
1630 W, 1395 м, 1370 с, 1330 с, 1220 Vs, 1035 c (см-1)
1Н ЯМР (ДМСО-d6) δ: 1,96 и 2,17 (2с, С(СН3)2), 4,50 (д, С2-Н, J
1,2 Гц), 4,84 (д, С3-Н, т, J 1,2 Гц), 5,18 (с, СН Ph) и 7,36 (с, С6Н6) ppm.
П р и м е р 30. К раствору метилового эфира 2R-3, 3-дибром-1-(1'-бензилоксикарбонил-2'-метилпроп-1'-енил)-4-оксоазетидин- 2-сульфоновой кислоты (0,1 г, 0,2 ммоль) в изопропаноле (5 мл) добавляли AgNO3 (0,135 г, 0,8 ммоль) и перемешивали смесь при температуре кипения в токе азота. Через час раствор фильтровали через диатомовую землю и фильтрат упаривали досуха. К остатку добавляли метиленхлорид (5 мл) и выпадающий осадок отсасывали, а фильтрат еще раз упаривали досуха. Полученный остаток подвергали очистке на колонке с Dowex 50WX8 и кислую фракцию лиофилизировали. Сырой продукт пропускали через колонку, заполненную силикагелем, используя в качестве подвижной системы смесь этилацетата и метанола (3:1). В колонке удерживалась фракция с Rf 0,68.
П р и м е р 31. 2R, 3R-3-Бром-1-(1'-бензилоксикарбонил-2'-метилпроп-1'-енил)-4- оксоазетидин-2-сульфоновой кислоты.
Путем элюирования сырого продукта в соответствии с примером 30 с помощью смеси растворителей этилацетат-метанол (3:1) выделяли продукт с Rf 0,63.
ИК (пленка) V: 3600-3300 в, 1790 Vs, 1730 c, 1705 c, 1630 W, 1395 м, 1370 с, 1300 с, 1220 Vs, 1035 c, 700 м (см-1).
1Н ЯМР (ДМСО)-d6) δ: 1,98 и 2,14 (2с, С(СН3)2), 4,64 (д, С2-Н, J 5,3 Гц), 5,18 (с, CH2Ph), 5,34 (д, С3 -Н, J 5,3 Гц) и 7,36 (с, С6Н5) ppm.
Реферат
Использование: в качестве промежуточных продуктов в синтезе бета-лактамовых антибиотиков. Сущность изобретения: продукт 4-оксоазетидин-2-сульфоновые кислоты общей формулы I, где R1 - означает атом водорода, галогена или фенилацетамидогруппу; R2 атом водорода, галогена, фенилацетамидо-, фенокесиацетамидо-, фталимидо- или 5-метил-3- о хлорфенилизоксазол -4- карбоксамидо- группы; R3 атом водорода, щелочного или щелочноземельного металла, группа четвертичного аммония, R4 водород, SO2O-N+Bu4-n (CH3)2C=C-COOCH3 (CH3)2C=COOCH2-C6H4-CH3-m (CH3)2C=C-COO-CH2-Ph (CH3)2C=C-COOCH2-C6H4-NO2-n или их соли, а также способ их получения. Структура формулы I
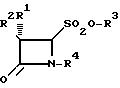
Формула
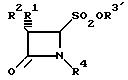
где R1 атом водорода, галогена, фенилацетамидогруппа;
R2 атом водорода, галогена, фенилацетамидо-, феноксиацетамидо-, фталимидо-, 5-метил-3-о-хлорфенилизоксазол-4-карбоксамидогруппы;
R3 атом водорода, щелочного или щелочноземельного металла, группа четвертичного аммония;
R4 атом водорода, SO2O-N+Bu4-н, (CH3)2 C=C COOCH3, (CH3)2 C=C-COO-CH2-Ph, (CH3)2 C=C-COOCH2-C6H4-NO2-н,(CH3)2 C=COOCH2-C6H4-CH3-м, или их соли, в качестве промежуточных продуктов в синтезе бета-лактамовых антибиотиков.
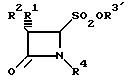
где R1 атом водорода, галогена, фенилайетамидгруппа;
R2 атом водорода, галогена, фенилацетамидо-, феноксиацетамидо-, фталимидо-, 5-метил-3-ок-хлорфенилизоксазол-4-карбоксимидогруппы;
R3′ атом водорода, щелочного или щелочноземельного металла, алкил, аралкил или арил;
R4 атом водорода, (СН3)2С=С-СООСН3, (СН3)2С=С-СООСН2-Рh, (СН3)2С=СООСН2-С6Н4-NО2=н, (СН3)2С=С-СООСН2-С6Н4-СН3-м, подвергают окислению перекисью водорода, перуксусной кислотой, м-хлорпербензойной кислотой или перманганатом калия в кислой или нейтральной, водной или водно-органической среде при 0 80oС и, при желании, полученный продукт указанной формулы II, у которого R3 алкил, аралкил или арил, а R1, R2 и R4 имеют указанные значения, подвергают гидролизу в кислой или слабощелочной, водной или водно-органической или органической среде с добавкой неорганических солей или органических оснований и, при желании, полученный продукт указанной формулы II, у которого R3 атом водорода, а R1, R2 и R4 имеют указанные значения, подвергают реакции диспропорционирования и окисления в кислой или нейтральной, водной или водно-органической среде путем контактирования в течение 2 10 ч с атмосферным воздухом при комнатной температуре с последующим выделением целевого продукта в свободном виде или в виде соли.
12.02.91 при R1 водород, фенилацетамид; R2 фенилацетамид, феноксиацетамид, фталимид, 5-метил-3-о-хлорфенил-изоксазол-4-карбоксамид; R3 водород, натрий, тетрабутиламмоний; R4 водород, SO2O-N+Bu4-н-, (СН3)2С=С-СООСН3, (СН3)2С=С-СООСН2-С6Н4-pNO2, (СН3)2С=С-СООСН2-С6Н4 СН3.

Комментарии