Способ получения (3-циано-1h-индол-7-ил)[4-(4-фторфенетил)пиперазин-1-ил] метанона и его солей - RU2295519C2
Код документа: RU2295519C2
Описание
Изобретение касается способа получения (3-циано-1Н-индол-7-ил)[4-(4-фторфенетил)пиперазин-1-ил]метанона формулы I

и его солей, и промежуточных соединений для синтеза.
Соединение (3-циано-1Н-индол-7-ил)[4-(4-фторфенетил)пиперазин-1-ил]метанон и соответствующие физиологически приемлемые соли неожиданно имеют селективное сродство к 5-HT2A рецепторам. В частности, они являются селективными антагонистами 5-НТ2А.
Антагонисты 5-НТ2А проявляют клиническую антипсихотическую активность с отсутствием или минимальными побочными эффектами и соответственно рассматриваются как антипсихотические агенты, которые имеют несколько побочных эффектов. Кроме того, они могут быть использованы при лечении неврологических расстройств, относящихся к расстройствам в серотонинергической передаче, таким как депрессия, состояния беспокойства, тревожные состояния, обсессивно-компульсивные расстройства, боль, нарушения сна, бессонница, расстройства аппетита, такие как нервная анорексия, повышенное чувство голода, поведенческая реакция, обусловленная зависимостью, зависимость от некоторых наркотических препаратов, таких как ЛСД (диэтиламид лизергиновой кислоты) и МДМА (метилендиоксиамфетамин, "экстази"), кардиоваскулярные расстройства, такие как различные стенокардии, синдром Райнауда, синдром перемежающейся хромоты, кардиологические или периферические васкулярные спазмы, фибромиалгия, сердечная аритмия и тромбозы, так как вещества ингибируют агрегацию тромбоцитов. В комбинации с классическими или атипичными нейролептиками могут подавлять побочные эффекты, вызванные нейролептиками. Вещества также могут использоваться при лечении глаукомы, поскольку снижают внутриглазное давление. Вещества могут быть использованы для уменьшения токсических симптомов, вызванных ядами, например эрговалином.
Кроме того, соединения могут быть использованы в качестве активных ингредиентов медикамента для лечения людей и в ветеринарной практике. Кроме того, они могут быть использованы как промежуточные соединения для получения других активных ингредиентов медикамента.
(3-Циано-1Н-индол-7-ил)[4-(4-фторфенетил)пиперазин-1-ил]метанон и его соли являются очень высокоперспективным медикаментами и способ их получения является чрезвычайно интересным.
Следовательно, целью представленного изобретения была разработка нового и эффективного варианта синтеза антагонистов рецептора 5-НТ2А.
Кроме того, изобретение касается способа получения (3-циано-1Н-индол-7-ил)[4-(4-фторфенетил)пиперазин-1-ил]метанона формулы I

и его солей, характеризующегося тем, что
(1) сложный эфир индола формулы II

в которой R представляет собой алкильную группу, которая имеет от 1 до 6 атомов углерода, или арилалкил,
подвергают формилированию,
(2) формил сложного эфира формулы III

в которой R является таким, как определено выше,
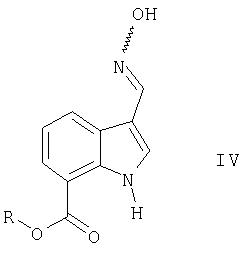
полученный на стадии (1) вводят во взаимодействие с гидроксиламином с образованием производного оксима формулы IV
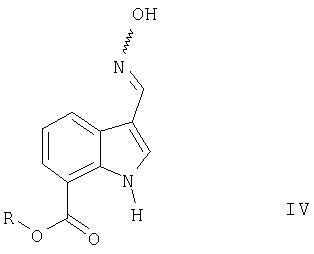
в которой R является таким, как определено выше,
(3) оксим формулы IV превращают в сложный эфир цианоиндола формулы V

в которой R имеет одно из значений, приведенных выше,
(4) сложный эфир формулы V подвергают омылению с получением 3-циано-1Н-индол-7-карбоновой кислоты,
(5) 3-циано-1Н-индол-7-карбоновую кислоту вводят во взаимодействие с 1-[2-(4-фторфенил)этил]пиперазином или его солями с получением соединения формулы I и
(6) полученное основание формулы I превращают в одно из его солей путем обработки кислотой.
Заместитель R в формулах II-VI представляет собой алкильную группу, которая имеет от 1 до 6 атомов углерода, или арилалкильную группу.
Алкильная группа предпочтительно имеет 1, 2, 3 или 4 атома углерода и, следовательно, представляет собой, например, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил или трет-бутил, кроме того, также пентил, 1-, 2- или 3-метилбутил, 1,1-, 1,2- или 2,2-диметилпропил, 1-этилпропил, гексил, 1-, 2-, 3-или 4-метилпентил, 1,1-, 1,2-, 1,3-, 2,2-, 2,3- или 3,3-диметилбутил, 1- или 2-этилбутил, 1-этил-1-метилпропил, 1-этил-2-метилпропил, 1,1,2- или 1,2,2-триметилпропил, более того, трифторметил или пентафторэтил.
Арилалкил представляет собой альтернативно -(СН2)о-Ar, где Ar является предпочтительно фенилом или нафтилом, и о может быть 0, 1 или 2. Арилалкил представляет собой, в частности, бензил, фенилэтил или нафтилметил, особенно предпочтительно бензил.
R представляет собой предпочтительно метил или этил, особенно предпочтительно этил.
Сложные эфиры индола формулы II являются коммерчески доступными или могут быть получены с помощью известных методов синтеза. Их можно получить, например, исходя из 3-метил-2-нитробензойной кислоты, которая является коммерчески доступной, с помощью следующих реакций:
(1) эстерификации 3-метил-2-нитробензойной кислоты,
(2) реакции с N,N-диметилформамидацеталем с получением эфира 3-(2-диметиламиновинил)-2-нитробензойной кислоты и
(3) последующей реакции замыкания цикла, катализируемой палладием, с получением сложного эфира индола формулы II.
Пригодными сложными эфирами индола формулы II являются, в частности, метиловый эфир 1Н-индол-7-карбоной кислоты, этиловый эфир 1Н-индол-7-карбоной кислоты, трет-бутиловый эфир 1Н-индол-7-карбоной кислоты и бензиловый эфир 1Н-индол-7-карбоной кислоты. Синтез в соответствии с изобретением особенно предпочтительно проводят, используя этиловый эфир 1Н-индол-7-карбоной кислоты.
Пригодными N,N-диметилформамидацеталями являются, например, N, N-диметилформамид бис[2-(триметилсилил)этил]ацеталь, N,N-диметилформамиддибензилацеталь, N,N-диметилформамиддибутилацеталь, N,N-диметилформамид-ди-трет-бутилацеталь, N,N-диметилформамиддиэтилацеталь, N,N-диметилформамиддиизопропилацеталь, N,N-диметилформамиддиметилацеталь, N,N-диметилформамиддинеопентилацеталь, N,N-диметилформамиддипропилацеталь и N,N-диметилформамидэтиленацеталь. Особое предпочтение отдается N,N-диметилформамиддиэтилацеталю и N,N-диметилформамиддиметилацеталю.
Реакцию циклизации, катализируемую палладием, проводят аналогично методу Леймгрубера-Батчо (Leimgruber-Batcho) [Clark R.D. et al, Heterocycles, 1984, 22, 195-221, Batcho D. et al, Organic Synthesis, 1985, 63, 214-225].
Условия проведения реакции являются известными из литературы. Однако также можно использовать другие методики получения соединений формулы II, известные из литературы, и которые не были раскрыты здесь более детально (лит.: Губен-Вейль, Методы органической химии (Houben-Weyl, Methoden der Organ. Chemie, Georg-Thieme-Verlag, Stuttgart)).
Формилирование соединения формулы II, которое дает формил сложного эфира формулы III, в котором R имеет одно из значений, приведенных выше, проводят аналогично методу Вильсмеера-Хаака (Vilsmeyer-Haack) [Jutz С. et al., Iminium Salts in Organic Chemistry. Part I, New York, John Wiley & Sons Inc., 1976, pp.234 ff, pp.237 ff]. Реакцию предпочтительно проводят в апротонном полярном растворителе и температура реакции находится в интервале от 0 до 50°С и с нагреванием от 100 до 130°С. Особенно предпочтительными растворителями являются диметилформамид (ДМФА) и смеси ДМФА с ароматическими углеводородами, такими как бензол, толуол или ксилен, или с дополнительными амидами, такими как N-метилпирролидон (NМП).
Формилирование особенно предпочтительно проводят в ДМФА в присутствии POCI3.
Пригодными сложными эфирами формилиндола формулы III являются, в частности, 7-метоксикарбонил-3-индолкарбоксальдегид, 7-этоксикарбонил-3-индолкарбоксальдегид, 7-трет-бутоксикарбонил-3-индолкарбоксальдегид и 7-бензилоксикарбонил-3-индолкарбоксальдегид. Синтез в соответствии с изобретением особенно предпочтительно проводят, используя 7-этоксикарбонил-3-индолкарбоксальдегид.
Оксимирование соединений формулы III, как описано выше, проводят в стандартных условиях (лит.: Куртц П., Губен-Вейль, Методы органической химии (Kurtz P., Houben-Weyl, Methoden der Organ. Chemie, Vol. VIII, Georg-Thieme-Verlag, Stuttgart)).
Оксимирование особенно предпочтительно проводят в полярных апротонных растворителях, таких как ДМФА, бензол, толуол, ксилен или NМП, при температуре в интервале от 0 до 50°С, в частности при комнатной температуре.
Получение сложных эфиров цианоиндола формулы V, как описано выше, проводят путем обработки кислотой. Пригодными кислотами являются, например, неорганические кислоты, такие как хлороводородная кислота, серная кислота или фосфорная кислота, или органические кислоты, такие как муравьиная кислота, уксусная кислота, п-толуолсульфоновая кислота или метансульфоновая кислота. Реакцию особенно предпочтительно проводят в высококипящих апротонных растворителях, таких как ДМФА или НМП, или их смесях с апротонными растворителями, при температуре в интервале от 20 до 100°С, в частности при 50°С.
В особом воплощении способа стадии (1)-(3) проводят in situ, то есть в одном реакторе аналогично методике Лейбшера (Liebscher J. et al, Z. Chem. 1983, 23, 214-215), без выделения промежуточных продуктов. Однореакторный способ обеспечивает лучшие выходы по сравнению с постадийным синтезом.
Омыление соединений формулы V с получением 3-циано-1Н-индол-7-карбоновой кислоты проводят, используя стандартные условия (лит.: Губен-Вейль, Методы органической химии (Houben-Weyl, Methoden der Organ. Chemie, Georg-Thieme-Verlag, Stuttgart)).
Омыление особенно предпочтительно проводят, используя КОН в метаноле при комнатной температуре.
Как альтернатива химического омылению расщепление сложных эфиров также можно провести энзиматически с помощью эстераз. Пригодными эстеразами являются, например, эстераза Bacillus sp., эстераза Bacillus stearothermophilus, эстераза Candida lipolytica, эстераза Mucor miehei, эстераза печени лошадей, эстераза Saccaromyces cerevisiae, эстераза печени свиней, эстераза Thermoanaerobium brockii и изоферментная 1 эстераза печени свиней. Эстеразы также могут быть использованы в иммобилизированной форме. Коммерческими иммобилизированными эстеразами являются, например, эстераза печени свиней (RLE), иммобилизированная на Eupergit® С или на оксиранакриловых шариках. Энзиматические реакции предпочтительно проводят в водных буферных системах, но могут также присутствовать другие растворители, в частности спирты, такие как этанол.
Взаимодействие 3-циано-1H-индол-7-карбоновой кислоты с 1-[2-(4-фторфенил)этил]пиперазином или одной из его солей, в частности с дигидрохлоридом 1-[2-(4-фторфенил)этил]пиперазином, проводят с помощью методик, известных из литературы для ацилирования аминов [Губен-Вейль, I.c., Том 15/11, страницы 1-806 (1974)]. Однако также можно проводить взаимодействие соединений в присутствии инертного растворителя. Примерами пригодных растворителей являются углеводороды, такие как бензол, толуол и ксилен; кетоны, такие как ацетон и бутанон; спирты, такие как метанол, этанол, изо-пропанол и н-бутанол; простые эфиры, такие как тетрагидрофуран (ТГФ) и диоксан; амиды, такие как диметилформамид (ДМФА) или N-метилпирролидон; нитрилы, такие как ацетонитрил, при желании также смеси этих растворителей с другими или смеси с водой. Может быть благоприятно прибавление кислотосвязывающего агента, например гидроксида, карбоната или бикарбоната щелочного или щелочноземельного металла или другой соли слабой кислоты и щелочных или щелочноземельных металлов, предпочтительно калия, натрия или кальция, или прибавление органического основания, такого как триэтиламин, диметиланилин, пиридин или хинолин, или избытка производного пиперазина. В зависимости от используемых условий температура реакции находится в интервале от приблизительно 0 до 150°С, обычно в интервале от 20 до 130°С.
Вместо 3-циано-1Н-индол-7-карбоновой кислоты также можно использовать производные этой кислоты, предпочтительно предварительно активированную карбоновую кислоту или соответствующий галоидангидрид карбоновой кислоты, симметричный или смешанный ангидрид или активный сложный эфир 3-циано-1Н-индол-7-карбоновой кислоты. Радикалы этого типа для активирования карбоксильной группы в типичных реакциях ацилирования описаны в литературе (например, в стандартных работах, таких как Губен-Вейль, Методы органической химии (Houben-Weyl, Methoden der organischen Chemie, Georg-Thieme-Verlag, Stuttgart). Активированные сложные эфиры преимущественно получают in situ, например, путем прибавления HOBt или N-гидроксисукцинимида.
Соединение 1-[2-(4-фторфенил)этил]пиперазин и его соли известны и могут быть получены с помощью общеизвестных методик, которые известны специалисту в данной области. Описание получения приведено, например, в DE 2855703.
Полученное основание формулы I можно преобразовать в ассоциированную кислотно-аддитивную соль, используя кислоту. Пригодными кислотами для этой реакции являются кислоты, которые дают физиологически приемлемые соли. Таким образом, можно использовать неорганические кислоты, например серную кислоту, галогенводородные кислоты, такие как хлороводородная кислота или бромоводородная кислота, фосфорные кислоты, такие как ортофосфорная кислота, азотную кислоту или сульфаминовую кислоту, кроме того, органические кислоты, более детально, алифатические, алициклические, аралифатические, ароматические или гетероциклические моноосновные или полиосновные карбоновые, сульфоновые или серные кислоты, например муравьиная кислота, уксусная кислота, пропионовая кислота, пивалиновая кислота, диэтилуксусная кислота, малоновая кислота, янтарная кислота, пимелиновая кислота, фумаровая кислота, малеиновая кислота, молочная кислота, винная кислота, яблочная кислота, бензойная кислота, салициловая кислота, 2-фенилпропионовая кислота, лимонная кислота, глюконовая кислота, аскорбиновая кислота, никотиновая кислота, изоникотиновая кислота, метан или этансульфоновая кислота, этандисульфоновая кислота, 2-гидроксиэтансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, нафталинмоно- и -дисульфоновая кислоты и лаурилсерная кислота.
В предпочтительном воплощении получение соли проводят в смеси растворителей ацетон/вода с соотношением компонентов от 5:1 до 4:1 путем высаждения хлороводородной кислотой (37%). Получают гидрохлорид (3-циано-1Н-индол-7-ил)[4-(4-фторфенетил)пиперазин-1-ил]метанона.
В следующем воплощении способа в соответствии с изобретением сложный эфир цианоиндола формулы V может реагировать непосредственно, без предварительного омыления до 3-циано-1Н-индол-7-карбоновой кислоты, с 1-[2-(4-фторфенил)этил]пиперазином или его соответствующей солью с помощью химического или биохимического аминолиза.
Химический аминолиз может быть проведен, например, с помощью метода Menger F.M. et al., J. Am. Chem. Soc. 1969, 91, 5346-9. Биохимический аминолиз может быть проведен, например, с помощью реакции соединения формулы V с 1-[2-(4-фторфенил)этил]пиперазином или одной из его соответствующих солей в присутствии липазы или антитела. Биохимический аминолиз может быть проведен, например, с помощью метода Gotor V. et al., Bioorg. Med. Chem. 1999, 7, 2189-2197.
Поэтому изобретение также касается способа получения (3-циано-1H-индол-7-ил)[4-(4-фторфенетил)пиперазин-1-ил]метанона формулы I

и его солей, характеризующийся тем, что
(1) сложный эфир индола формулы II

в которой R представляет собой алкильную группу, которая имеет от 1 до 6 атомов углерода, или арилалкил,
подвергают формилированию,
(2) формил сложного эфира формулы III

в которой R является таким, как определено выше,
полученный на стадии (1) вводят во взаимодействие с гидроксиламином с образованием производного оксима формулы IV

в которой R является таким, как определено выше,
(3) оксим формулы IV превращают в сложный эфир цианоиндола формулы V

в которой R имеет одно из значений приведенных выше,
(4) сложный эфир формулы V превращают в соединение формулы I путем аминолиза, используя 1-[2-(4-фторфенил)этил]пиперазин или одну из его солей, и
(5) полученное основание формулы I превращают в одно из его солей путем обработки кислотой.
В следующем воплощении способа в соответствии с изобретением 3-циано-1Н-индол-7-карбоновую кислоту можно получить путем галогенирования сложного эфира индола формулы II

как описано выше с получением соединения формулы VI
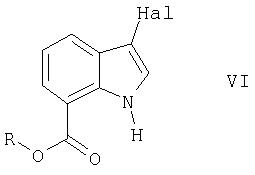
в которой R представляет собой алкильную группу, которая имеет от 1 до 6 атомов углерода или арилалкил и
Hal представляет собой CI, Br или l,
с последующим цианированием.
Галогенирование соединений формулы II, как описано выше, проводят, используя стандартные условия (лит.: Губен-Вейль, Методы органической химии (Houben-Weyl, Methoden der organischen Chemie, Georg-Thieme-Verlag, Stuttgart)) или аналогично Heterocycles, 1986, 24, 2879-85, там же, 1989, 29, 1663-7; J. Am. Chem. Soc. 1985, 107, 2943-5; J. Org. Chem. 1993, 58, 2058-60, или J. Chem. Soc., Perkin Trans. 1, 1989, 2009-15. Бромирование или йодирование 3-положения индола может быть проведено аналогично методике Bocchi et al. Synthesis 1982, 1096-1097.
Примерами пригодных растворителей для галогенирования являются углеводороды, такие как бензол, толуол и ксилен; галогенированные углеводороды, такие как дихлорметан и хлороформ; кетоны, такие как ацетон и бутанон; спирты, такие как метанол, этанол, изопропанол и н-бутанол; простые эфиры, такие как тетрагидрофуран (ТГФ) и диоксан; амиды, такие как диметилформамид (ДМФА) и N-метилпирролидон; нитрилы, такие как ацетонитрил, и при желании смеси этих растворителей с другими растворителями.
Соединениями, полученными в соответствии с изобретением путем галогенирования, являются метиловый эфир 3-хлор-1Н-индол-7-карбоной кислоты, метиловый эфир 3-бром-1H-индол-7-карбоной кислоты, метиловый эфир 3-йод-1Н-индол-7-карбоной кислоты, этиловый эфир 3-хлор-1H-индол-7-карбоной кислоты, этиловый эфир 3-бром-1Н-индол-7-карбоной кислоты, этиловый эфир 3-йод-1Н-индол-7-карбоной кислоты, трет-бутиловый эфир 3-хлор-1H-индол-7-карбоной кислоты, трет-бутиловый эфир 3-бром-1Н-индол-7-карбоной кислоты, трет-бутиловый эфир 3-йод-1Н-индол-7-карбоной кислоты, бензиловый эфир 3-хлор-1Н-индол-7-карбоной кислоты, бензиловый эфир 3-бром-1Н-индол-7-карбоной кислоты и бензиловый эфир 3-йод-1Н-индол-7-карбоной кислоты. Особенно пригодным в соответствии с изобретением является использование этилового эфира 3-бром-1Н-индол-7-карбоной кислоты или этилового эфира 3-йод-1Н-индол-7-карбоной кислоты.
Замещение галогена в соединениях формулы VI на цианогруппу проводят аналогично методу Cassar L. et al., Adv. Chem. Ser. 1974, 132, 252-73, с никелевым катализатором или аналогично способу Sakamoto Т. et al, J. Chem. Soc., Perkin Trans. 1 1999, 16, 2323-2326, или Chatani N. et al, J. Org. Chem. 1986, 51, 4714-16, с палладиевым катализатором.
Цианогруппу особенно предпочтительно вводят, используя палладиевый катализатор.
Поэтому изобретение также касается способа получения (3-циано-1H-индол-7-ил)[4-(4-фторфенетил)пиперазин-1-ил]метанона формулы I

и его солей, характеризующийся тем, что
(1) сложный эфир индола формулы II

в которой R представляет собой алкильную группу, которая имеет от 1 до 6 атомов углерода, или арилалкил, подвергают галогенированию,
(2) галоген в сложном эфире формулы VI

в которой R и Hal являются такими, как было определено выше,
полученном на стадии (1), замещают цианогруппой с одновременным омылением до 3-циано-1Н-индол-7-карбоновой кислоты,
(3) 3-циано-1H-индол-7-карбоновую кислоту вводят во взаимодействие с 1-[2-(4-фторфенил)этил]пиперазином или его солью с получением соединения формулы I, и
(4) полученное основание формулы I превращают в одну из его солей путем обработки кислотой.
Следующий аспект изобретения касается соединений формулы IV

в которой R представляет собой алкильную группу, которая имеет от 1 до 6 атомов углерода, или арилалкил,
и их солей.
Алкил и арилалкил имеют одно из значений, указанных выше.
Соединения формулы IV могут существовать в двух изомерных формах, соединения формулы IVa и IVб. Основная формула IV охватывает индивидуальные изомеры формул IVa и IVб, также как и их смеси


в которой R имеет одно из значений, приведенных выше.
Предпочтительными соединениями формулы IV являются
метиловый эфир 3-гидроксиимино-1Н-индол-7-карбоной кислоты,
этиловый эфир 3-гидроксиимино-1Н-индол-7-карбоной кислоты,
трет-бутиловый эфир 3-гидроксиимино-1Н-индол-7-карбоной кислоты и
бензиловый эфир 3-гидроксиимино-1Н-индол-7-карбоной кислоты,
куда включены обе Z- и Е-формы и их смеси.
Особенно предпочтительными соединениями формулы IV являются
этиловый эфир (Z)-3-гидроксиимино-1Н-индол-7-карбоной кислоты,
этиловый эфир (Е)-3-гидроксиимино-1Н-индол-7-карбоной кислоты и E/Z смеси.
Соли соединений формулы IV можно получить с помощью методов, описанных выше для соединений формулы I.
Соединения формулы IV являются ценными промежуточными соединениями в синтезе (3-циано-1Н-индол-7-ил)[4-(4-фторфенетил)пиперазин-1-ил]метанона и его солей, как описано выше.
Следующий аспект изобретения касается соединений формулы V

в которой R представляет собой алкильную группу, которая имеет от 1 до 6 атомов углерода или арилалкил, и их солей.
Алкил и арилалкил имеют одно из значений, указанных выше.
Предпочтительными соединениями формулы V являются
метиловый эфир 3-циано-1Н-индол-7-карбоной кислоты,
этиловый эфир 3-циано-1Н-индол-7-карбоной кислоты,
трет-бутиловый эфир 3-циано-1Н-индол-7-карбоной кислоты и
бензиловый эфир 3-циано-1Н-индол-7-карбоной кислоты, и их соли.
Процесс согласно изобретению особенно предпочтительно проводят, используя этиловый эфир 3-циано-1Н-индол-7-карбоной кислоты.
Соли соединений формулы V можно получить с помощью методов, описанных выше для соединений формулы I.
Соединения формулы V являются ценными промежуточными соединениями в синтезе (3-циано-1Н-индол-7-ил)[4-(4-фторфенетил)пиперазин-1-ил]метанона и его солей, как описано выше.
Изобретение так же касается 3-циано-1Н-индол-7-карбоновой кислоты и ее солей.
Следующий аспект изобретения касается соединений формулы VI

в которой R представляет собой алкильную группу, которая имеет от 1 до 6 атомов углерода, или арилалкил, и
Hal представляет собой Cl, Br или, I,
и ее солей.
Алкил и арилалкил имеют одно из значений, указанных выше.
Предпочтительными соединениями формулы VI являются
метиловый эфир 3-бром-1Н-индол-7-карбоной кислоты,
этиловый эфир 3-бром-1Н-индол-7-карбоной кислоты,
трет-бутиловый эфир 3-бром-1Н-индол-7-карбоной кислоты и
бензиловый эфир 3-бром-1H-индол-7-карбоной кислоты,
метиловый эфир 3-йод-1Н-индол-7-карбоной кислоты,
этиловый эфир 3-йод-1Н-индол-7-карбоной кислоты,
трет-бутиловый эфир 3-йод-1Н-индол-7-карбоной кислоты и
бензиловый эфир 3-йод-1Н-индол-7-карбоной кислоты и их соли.
Процесс согласно изобретению особенно предпочтительно проводят, используя этиловый эфир 3-бром-1H-индол-7-карбоной кислоты или этиловый эфир 3-йод-1Н-индол-7-карбоной кислоты.
Соли соединений формулы VI можно получить с помощью методов, описанных выше для соединений формулы I.
Соединения формулы VI являются ценными промежуточными соединениями в синтезе (3-циано-1Н-индол-7-ил)[4-(4-фторфенетил)пиперазин-1-ил]метанона и его солей, как описано выше.
Даже без приведенных далее деталей, допускают, что специалист в данной области будет способен оценить приведенное выше описание в наиболее широких границах. Следовательно, предпочтительные воплощения должны рассматриваться только как наглядное описание, которое абсолютно не предназначено каким либо образом для ограничения.
Все температуры выше и ниже приведены в °С. В приведенных далее примерах термин "обычная переработка" означает, что, если необходимо, добавляют воду, рН, если необходимо, доводят до значения в интервале от 2 до 10, в зависимости от строения конечного продукта, смесь экстрагируют этилацетатом или дихлорметаном, фазы разделяют, органическую фазу сушат над сульфатом натрия и упаривают, и продукт очищают с помощью хроматографии на силикагеле и/или с помощью кристаллизации.
Пример 1.
1.1. Метиловый эфир 3-формилиндол-7-карбоной кислоты
2,9 мл оксихлорида фосфора медленно прибавляют к 7 мл N,N-диметилформамида в атмосфере азота (формилирующий раствор). 5 г (0,029 моль) метилового эфира индол-7-карбоной кислоты растворяют в 7 мл ДМФА и медленно прибавляют к формилирующему раствору, при этом температуре не дают подняться выше приблизительно 30°С. Потом смесь нагревают при 100°С на протяжении одного часа. После охлаждения смесь выливают в воду и нейтрализуют, используя раствор гидроксида натрия и выпавшие кристаллы отфильтровывают с отсасыванием, т.пл. 154°С. Выход 5,3 г (89,9% от теории).
1.2. Метиловый эфир 3-(гидроксииминометил)индол-7-карбоной кислоты
5 г метилового эфира 3-формилиндол-7-карбоной кислоты (0,024 моль) прибавляют к раствору 0,03 моль гидрохлорида гидроксиламмония в диметилформамиде. Реакционную смесь нагревают при 125°С на протяжении одного часа и подвергают обычной переработке, получая 5,1 г метилового эфира 3-(гидроксииминометил)индол-7-карбоной кислоты, т.пл. 224-226°С.
1.3. Метиловый эфир 3-цианоиндол-7-карбоной кислоты
5 г метилового эфира 3-(гидроксииминометил)индол-7-карбоной кислоты суспендируют в 20 мл толуола, прибавляют 1 мл сульфонилхлорида и смесь кипятят с обратным холодильником на протяжении одного часа. Выпаривание и экстракция этилацетатом дает 4,5 г метилового эфира цианоиндол-7-карбоной кислоты, т.пл. 212°С.
1.4. 3-Цианоиндол-7-карбоновая кислота
4,5 г (0,022 моль) метилового эфира цианоиндол-7-карбоной кислоты суспендируют в 100 мл метанола и при комнатной температуре прибавляют раствор 30 мл раствора гидроксида натрия (w=32%) в 30 мл воды. Перемешивание на протяжении ночи дает фактически прозрачный раствор, который фильтруют и выпаривают. К полученному остатку прибавляют воду до образования прозрачного раствора и рН смеси доводят до 2, используя концентрированную хлороводородную кислоту с охлаждением льдом. Белые кристаллы отфильтровывают с отсасыванием и сушат на протяжении 2 часов при пониженном давлении, получая 4 г 3-цианоиндол-7-карбоновой кислоты (97,7% от теории); т.пл. 317,5-318,5°С.
1.5. 7-{4-[2-(4-Фторфенил)этил]пиперазин-1-карбонил}-1Н-индол-3-карбонитрил
5 г (0,027 моль) 3-цианоиндол-7-карбоновой кислоты растворяют в 40 мл горячего N-метилпирролидона, раствор охлаждают до 40°С и прибавляют 7,6 г (0,027 моль) N,N-карбонилдиимидазола. Смесь перемешивают при комнатной температуре на протяжении последующего часа. Позже прибавляют суспензию дигидрохлорида 1-(2-(4-фторфенил)этил)пиперазина в 40 мл N-метилпирролидона. Через 5 минут образуется прозрачный раствор и только после этого выпадают белые кристаллы. Смесь перемешивают на протяжении ночи при комнатной температуре. Кристаллы отфильтровывают с отсасыванием, промывают и сушат, получая 5 г 7-{4-[2-(4-фторфенил)этил]пиперазин-1-карбонил}-1Н-индол-3-карбонитрила в виде свободного основания, которое имеет температуру плавления 192,0-193,5°С.
Химические названия 7-{4-[2-(4-фторфенил)этил]пиперазин-1-карбонил}-1H-индол-3-карбонитрил и (3-циано-1Н-индол-7-ил)[4-(4-фторфенетил)пиперазин-1-ил]метанон являются синонимами.
1.6. Гидрохлорид 7-{4-[2-(4-фторфенил)этил]пиперазин-1-карбонил}-1H-индол-3-карбонитрила
2,1 г свободного основания, полученного в соответствии с 1.5 нагревают в 50 мл ацетона и прибавляют воду до образования прозрачного раствора. Потом при перемешивании прибавляют смесь 0,6 мл хлороводородной кислоты (w=37%) и 1,2 мл ацетона. Смесь впоследствии выпаривают до половины объема на роторном испарителе. Образовавшийся гидрохлорид отфильтровывают с отсасыванием, промывают ацетоном и простым диэтиловым эфиром и сушат, получая 1,6 г гидрохлорида 7-{4-[2-(4-фторфенил)этил]пиперазин-1-карбонил}-1H-индол-3-карбонитрила (69% от теории), интервал разложения 314-319°С.
Пример 2.
2.1. Метиловый эфир 3-цианоиндол-7-карбонон кислоты
9,1 г фосфорилхлорида прибавляют к 30 мл диметилформамида, охлаждаемого льдом, при температуре реакционной смеси 20-30°С. По каплям прибавляют раствор 8 г метилового эфира индол-7-карбоной кислоты в диметилформамиде, при этом температура поднимается до 40°С. После одного часа при 125°С, все еще горячий раствор по каплям прибавляют к раствору 6,3 г хлорида гидроксиламмония в 40 мл диметилформамида и смесь перемешивают при 120°С на протяжении последующих 15 минут. Смесь выливают в воду, экстрагируют этилацетатом, фильтруют сквозь слой нейтрального оксида алюминия и упаривают, получая 4,5 г метилового эфира 3-цианоиндол-7-карбоной кислоты, который имеет температуру плавления в интервале 212-213,5°С (48, 9% от теории).
Далее реакцию проводят аналогично примеру 1.4.-1.6.
Пример 3.
3.1. Этиловый эфир 3-броминдол-7-карбоной кислоты
12 г пербромида гидробромида пиридина прибавляют к раствору 5 г этилового эфира индол-7-карбоной кислоты в 50 г пиридина. Реакционную смесь нагревают до 30-50°С и перемешивают до завершения реакции (от приблизительно 3 до 10 часов). В реакционную смесь добавляют 50 г льда и дважды экстрагируют 100 мл МТБЭ (метил-трет-бутиловым эфиром). Растворитель выпаривают в роторном испарителе и остаток, представляющий собой этиловый эфир 3-броминдол-7-карбоной кислоты, выделяют перекристаллизацией из толуола.
3.2. 3-Цианоиндол-7-карбоновая кислота
7 г этилового эфира 3-броминдол-7-карбоной кислоты растворяют в 70 г NМП и прибавляют 4 г CuCN. Смесь нагревают до 100-140°С при перемешивании. Через 3 часа смесь подвергают обычной переработке, получая 3-цианоиндол-7-карбоновую кислоту.
Далее реакцию 3-цианоиндол-7-карбоновой кислоты проводят аналогично примеру 1.5.-1.6.
Пример 4.
4.1. Взаимодействие метилового эфира 3-циано-1Н-индол-7-карбоновой кислоты (соединение формулы V) с дигидрохлоридом 1-[2-(4-фторфенил)этил]пиперазина
Синтез. В атомосфере азота к 1,9 г метилового эфира 3-циано-1Н-индол-7-карбоновой кислоты добавляют 2,7 г дигидрохлорида 1-[2-(4-фторфенил)этил]пиперазина, 30 г N-метилпирролидона и 3,25 г трет-бутилата калия. После нагревания в течение 24 часов при температуре 130°С реакционную смесь охлаждают.
Выделение. После фильтрования и добавления воды продукт экстрагируют МТВ-эфиром. После отгонки растворителя получают (3-циано-1Н-индол-7-ил)[4-(4-фторфенетил)пиперазин-1-ил]метанон формулы I. Полученное основание растворяют в тетрагидрофуране и обрабатывают водным раствором соляной кислоты с получением суспензии гидрохлорида (3-циано-1Н-индол-7-ил)[4-(4-фторфенетил)пиперазин-1-ил]метанона в растворителе. Целевой продукт выделяют в виде твердого вещества и сушат.
4.2. Взаимодействие метилового эфира 3-циано-1Н-индол-7-карбоновой кислоты (соединение формулы V) с 1-[2-(4-фторфенил)этил]пиперазином (свободное основание)
Синтез. В атмосфере азота к 200 мл толуола добавляют 1,2 г дигидрохлорида 1-[2-(4-фторфенил)этил]пиперазина и 20 мл 32%-ного раствора гидроксида натрия и перемешивают при температуре 35°С в течение 30 минут. Водную фазу отделяют. К толуольной фазе добавляют 20 г сульфата натрия и перемешивают в течение 10 минут. Толуольную фазу, которая содержит 1-[2-(4-фторфенил)этил]пиперазин в виде свободного основания, отделяют и используют для проведения аминолиза. К раствору свободного основания в атмосфере азота добавляют 0,855 г метилового эфира 3-циано-1Н-индол-7-карбоновой кислоты и 1,84 г бис-(триметилсилил)литиумамида, после этого полученную реакционную смесь перемешивают в течение 24 часов при температуре 130°С и затем охлаждают до температуры 20°С.
Выделение. Выделение целевого продукта проводят в соответствии с описанной выше в примере 1 методикой.
Реферат
Изобретение относится к способу получения нового (3-циано-1H-индол-7-ил)(4-(4-фторфенетил)пиперазин-1-ил]метанона формулы I

или его физиологически приемлемых солей, который заключается в том, что
(1) сложный эфир индола формулы II

в которой R означает C1-С6алкил, подвергают формилированию,
(2) формил сложного эфира формулы III

в которой R является таким, как определено выше,
полученный на стадии (1) вводят во взаимодействие с гидроксиламином с образованием производного оксима формулы IV

в которой R является таким, как определено выше,
(3) оксим формулы IV превращают в сложный эфир цианоиндола формулы V

в которой R определен выше,
(4) сложный эфир формулы V подвергают омылению с получением 3-циано-1Н-индол-7-карбоновой кислоты,
(5) 3-циано-1Н-индол-7-карбоновую кислоту вводят во взаимодействие с 1-[2-(4-фторфенил)этил]пиперазином или его солями с получением соединения формулы I и
(6) полученное основание формулы I превращают в одну из его физиологически приемлемых солей путем обработки кислотой.
4 н. и 7 з.п. ф-лы.
Формула









Документы, цитированные в отчёте о поиске
4-пиримидин- или пиридинильные производные индол-3-ил-алкилпиперазинов, фармацевтическая композиция

Комментарии