Производные 4-арил-1-(инданметил или дигидробензотиофенметил)пиперидина, - -тетрагидропиридина или пиперазина и фармацевтическая композиция - RU2142458C1
Код документа: RU2142458C1
Чертежи



Описание
Изобретение относится к новому классу производных 4-арил-1-(инданметил, дигидробензофуранметил или дигидробензотиофенметил)пиперидина, -тетрагидропиридина или -пиперазина, действующих на центральные серотонинергические рецепторы. Поэтому эти метиламиновые соединения полезны при лечении некоторых психических и неврологических заболеваний.
Несколько из предшествующего уровня техники известно небольшое число производных аминометилиндана, -дигидробензофурана и -дигидробензотиофена.
Так, в патенте EP 0281261 описаны производные 1-аминометилиндана, 3-аминометилбензофурана и 3-аминометилбензотиофена с гидроксигруппой или замещенной гидроксигруппой в 6-положении (индан) или 5-положении (бензофуран, бензотиофен). Установлено, что эти соединения показывают центральную допаминовую агонистическую активность, в частности, оказывают влияние на пресинаптические допаминовые рецепторы.
В патенте США N 4500543 речь идет о некоторых соединениях 1-аминометилфталана, которые демонстрируют адренергические действия и в соответствии с этим антигипертензивные свойства и свойство уменьшать частоту сердечных сокращений. К указанному патенту относятся в основном соединения, имеющие заместители в 5-, 6- и/или 7-положении.
В EP 0325963 A1 описаны, среди других соединений, класс производного 1-аминометилиндана, в которых аминометильная группа может содержать 1-пирролилметильную группу, которая замещена тиенилом или фенилом. Как заявлено, соединения являются α2 антагонистами, используемыми при лечении депрессии, метаболических нарушений, глаукомы, мигрени и гипертензии.
Кроме того, в EP 0490772 A1 описан класс 4-бензофуранил- или 4-бензодиоксанил-1-инданилметилпиперазиновых производных, являющихся 5-HT1A лигандами.
EP 0428437, главным образом, касается очень широкого класса 1,2-бензоизоксазольных производных, включая некоторые 3-[1-[(1-инданил)метил]-1,2-бензоизоксазолы. Однако только одно такое соединение показано в примерах, но и в этом случае не приводится никаких данных, указывается, что соединения показывают допаминовую и серотониновую антагонистическую активность.
Патент США N 3886168 относится к производным 1-[(индан-1-ил)-метил]пиперидина, имеющим антигипертензивную активность.
Известно, что соединения, являющиеся лигандами для различных подтипов серотонинового рецептора, обладают различными действиями. Что касается 5-HT2A рецептора, который ранее обозначали как 5-HT2 рецептор, то сообщаются о его следующих действиях.
Показано, что ритансерин, являющийся антагонистом 5-HT2A (Meert, T.F., Janssen, P. A. Drug. Dev. Res. 1989, 18, 119), эффективен при лечении состояния страха и депрессии, предположительно, посредством улучшения качества сна. Кроме того, установлено, что селективные, центрально действующие 5-НТ2A антагонисты, проявляют действие в отношении негативных симптомов шизофрении и уменьшают экстрапирамидальные побочные действия, вызванные лечением классическими нейролептиками у пациентов, страдающих шизофренией (Gelders, Y.G., British J. Psychiatry, 1989, 155 (suppl. 5), 33). Наконец, селективные 5-НТ2A антагонисты могли бы быть эффективными при профилактике и при лечении мигрени, поскольку известно, что 5-HT задействован в приступе мигрени. Связи между 5-HТ и приступами мигрени разные, и они предполагают ряд механизмов, при помощи которых может быть вовлечен 5-HТ (Scrip Report; "Migraine-Current trends in research and treatment" 8 PJB Publication Ltd.; May 1991).
Серотониновый 5-HT2A антагонист, MDL 100 907 (Sorensen, S.M. et al., J. Pharmacol. Exp. Ther. 1993, 266, 684-691) и некоторые производные в ряду 1-фелининдолов (WO 93/12790) и 3-фенилиндольные производные (WO 93/14758) показали антипсихотическую активность на животных моделях с указанием отсутствия предрасположенности к экстрапирамидальным побочным эффектам (ЭПП, EPS).
Клинические исследования известных 5-HT1A частичных агонистов, таких как, например, буспирон, 8-[4-[4-(2-пиримидил)-1-пиперазинил-]-бутил]-8-азаспиро[4,5] декан-7, 9-дион, гепирон, 4,4-диметил-1-[4-[4-(2-пиримидил)-1-пиперазинил] бутил] -2,6-пиперидиндион, и ипсапирон, 2-[4-[4-(2-пиримидил)-1-пиперазинил] бутил] -1,2-бензотиазол-3-(2H)-он-1,1-диоксид, показали, что 5-HT2A частичные агонисты полезны при лечении расстройств, связанных со страхом, таких как генерализованное расстройство, связанное с тревогой, расстройство, вызванное паникой, и расстройство, вызванное компульсивной обсессией (Glitz, D. A., Pohl, R., Drugs 1991, 41, 11). Доклинические исследования показали, что, кроме того, полные агонисты используются при лечении вышеупомянутых родственных страху расстройств (Schipper, Human Psychopharmacol., 1991, 6, S53).
Кроме того, существует доказательство как клиническое, так и доклиническое в поддержку положительного воздействия 5-HT1A частичных агонистов при лечении депрессии, нарушений мотивационного контроля и злоупотребления алкоголем (van Hest, Psychopharmacol., 1992, 107, 474; Schipper et al., Human Psychopharmacol., 1991, 6, S53; Cervo et al., Eur. J. Pharm., 1988, 158, 53; Glitz, D.A., Pohl, R., Drugs 1991, 41, 11; Grof et al., Int, Clin. Psychopharmacol. , 1993, 8, 167-172; Ansseau et al., Human Psychopharmacol., 1993, 8, 279-283).
5-HT1a агонисты и частичные агонисты ингибируют вызванную изоляцией агрессию у мышей-самцов, указывая на то, что эти соединения полезны при лечении агрессии (Sanchez et al., Psychopharmacology, 1993, 110, 53-59).
Кроме того, 5-HT1A лиганды, как сообщается, проявляют антипсихотическое действие на животных моделях (Wadenberg and Ahlenius, J. Neural. Transm., 1991, 83, 43; Ahlenius, Pharmacol & Toxicol., 1989, 64, 3; Lowe et al., J. Med. Chem. , 1991, 34, 1860; New et al., J. Med. Chem., 1989, 32, 1147; и Martin et al., J. Med. Chem., 1989, 32, 1052).
Кроме того, недавние исследования показали, что 5-HT1A рецепторы важны в серотонинергической модуляции, вызванной галоперидолом каталепсии (Hicks, Life Science 1990, 47, 1609, Wadenberg et al., Pharmacol. Biochem. & Behav. 1994, 47, 509-513), что дает возможность предположить, что 5-HT1A агонисты полезны при лечении ЭПП (EPS) (экстрапирамидальных побочных эффектов), вызванных обычными антипсихотическими средствами, такими как галоперидол.
Кроме того, 5-HT1A агонисты проявляют нейрозащитные свойства на моделях грызунов с локальной и глобальной церебральной ишемией и поэтому они могут быть полезны при лечении состояний ишемической болезни (Prehn, Eur. J. Pharm., 1991, 203, 213).
Представлены фармакологические исследования, которые показали, что 5-HТ1A антагонисты полезны при лечении старческого слабоумия (Bowen et al., Trends Neur. Sci. 1992, 15, 84).
Как на животных моделях, так и при клинических испытаниях, было показано, что 5-HT1A агонисты оказывают антигипертензивное действие через центральный механизм (Saxena and Villalon, Trends Pharm. Sci. 1990, 11, 95; Gillis et al., J. Pharm. Exp. Ther. 1989, 248, 851). Поэтому 5-HT1A лиганды могут быть полезны при лечении сердечно-сосудистых нарушений.
Ингибиторы 5-HT обратного поглощения (reuptake) являются хорошо известными антидепрессантными лекарственными средствами.
Поскольку классы соединений, являющиеся лигандами 5-HT1A и 5-HT2A рецепторов и ингибиторами 5-HT обратного поглощения, обладают различной активностью на различных животных моделях, демонстрирующих антиксиолитическое и противоагрессивное действие (Perregaard et al., recent Developments in Anxioolytics. Current in Therapeutic Patents 1993, 1, 101-128), и/или на моделях, демонстрирующих действие при других психических нарушениях, то можно было бы также успешно лечить сложные состояния страха, депрессии или другие психические заболевания с помощью лекарственного средства, которое имеет комбинированные серотонинергические действия.
Было установлено, что некоторые новые 4-арил-1-(инданметил, дигидробензофуранметил или дигидробензотиофенметил)пиперидины, -тетрагидропиридины или -пиперазины эффективно взаимодействуют с центральными серотонинергическими рецепторами, в частности с 5-HT1A и/или 5-HT2A рецепторами.
В соответствии с этим данное изобретение относится к новым соединениям формулы
I
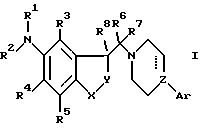
где один из X и Y представляет CH2, а другой выбран из группы, состоящей из CH2, О и S;
пунктирная линия, исходящая от Z, указывает на необязательную связь; когда связь не указана, Z является N, CH или COH, а когда связь указана, Z является C;
Ar представляет фенил, 2-тиенил, 3-тиенил, 3-фуранил, 3-фуранил, 2-пиримидил, 1-индолил, 2-индолил, 3-индолил, 1-индол-2-онил, 3-индол-2-онил, 2- или 3-бензофуранил, 2- или 3-бензотиофенил, 1-нафтил или 2-нафтил, причем каждый произвольно замещен галогеном, низшим алкилом, низшей алкокси, низшей алкилтио, гидрокси, низшим алкилсульфонилом, циано, трифторметилом, трифторметилсульфонилокси, циклоалкилом, циклоалкил-низшим алкилом, нитро, амино, низший алкиламино, ди-низший алкиламино, ациламино или C1-2 алкилендиокси;
R1 представляет водород, низший алкил, низший алкенил, низший алкинил, циклоалк(ен)ил, циклоалк(ен) ил-низший алк(ен/ин)ил, арил-низший алкил, ацил, тиоацил, низший алкилсульфонил, трифторметилсульфонил, арилсульфонил,
R1 является группой R9VCO-, где V представляет O или S и R9 представляет низший алкил, циклоалкил, циклоалкил-низший алкил или арил, или
R1 является группой R10R11NCO- или R10R11 NCS-, где R10 и R11 являются независимо водородом, низшим алкилом, циклоалкилом, циклоалкил-низшим алкилом или арилом, или R10 и R11 вместе с N-атомом, с которым они связаны, образуют пирролидинильную, пиперидинильную или пергидроазепиновую группу;
R2 представляет водород, низший алкил, циклоалкил или циклоалкил-низший алкил;
или R1 и R2 вместе с N-атомом, с которым они связаны, образуют группу

в которой Q есть С=O, C=S или CH2; T есть NH, S, O или CH2; m равно 1-4, включительно;
R3-R5 представляют независимо водород, галоид, низший алкил, низший алкилкарбонил, фенилкарбонил, галоген, замещенный фенилкарбонил, низший алкокси, низший алкилтио, гидрокси, низший алкилсульфонил, циано, трифторметил, циклоалкил, циклоалкил-низший алкил или нитро;
R6 и R7 являются каждый водородом или низшим алкилом, или они связаны вместе с образованием 3-7-членного карбоциклического кольца;
R8 является водородом или низшим алкилом;
причем любая присутствующая алкил, циклоалкил или циклоалкилалкильная группа произвольно замещена одной или двумя гидроксигруппами, которые, кроме того, необязательно этерифицированы алифатической или ароматической карбоновой кислотой: и любой присутствующий арильный заместитель необязательно замещен галогеном, низшим алкилом, низшей алкокси, низшей алкилтио, гидрокси, низшим алкилсульфонилом, циано, трифторметилом, трифторметилсульфонилокси, циклоалкилом, циклоалкил-низшим алкилом или нитро;
и их фармацевтически приемлемым солям присоединения кислоты.
Установлено, что соединения по данному изобретению проявляют сильное сродство к 5-HT1A рецепторам и/или к 5-HT2A рецепторам. Помимо действия на эти подтипы рецепторов, некоторые из данных соединений также проявляют действие, ингибирующее 5-HT обратное поглощение.
Соответственно этому соединения по данному изобретению, как полагают, являются полезными при лечении позитивных и негативных симптомов шизофрении, других психозов, состояний страха, таких как заболевания, вызванные состоянием страха, состоянием паники, и навязчивых компульсивных заболеваний, депрессии, злоупотребления алкоголем, заболеваний, связанных с мотивационным контролем, агрессии, побочных действий, вызванных обычными антипсихотическими средствами, состояний ишемической болезни, мигрени, старческого слабоумия и сердечно-сосудистых заболеваний, и для улучшения сна.
В другом аспекте изобретение обеспечивает фармацевтическую композицию, по крайней мере одно указанное выше соединение формулы I или его фармацевтически приемлемую соль присоединения кислоты или пролекарство в терапевтически эффективном количестве или сочетании с одним или более фармацевтически приемлемыми носителями или разбавителями.
В следующем аспекте данное изобретение относится к применению соединения формулы I, указанного выше, или его соли присоединения кислоты или пролекарства для получения фармацевтического препарата для лечения вышеупомянутых нарушений.
Соединения общей формулы (I) могут существовать в виде их оптических изомеров, и такие оптические изомеры также входят в объем изобретения.
Пролекарства соединений общей формулы (I) также входят в объем изобретения.
Термин циклоалкил обозначает карбоциклическое кольцо, имеющее 3-8 углеродных атомов включительно, или бициклический или трициклический карбоцикл, такой как адамантил.
Термин низший алкил относится к неразветвленной и разветвленной алкильной группе, имеющей от одного до шести углеродных атомов включительно, такой как метильная, этильная, 1-пропильная, 2-пропильная, 1-бутильная, 2-бутильная, 2-метил-2-пропильная и 2-метил-1-пропильная. Термин низший алкокси, низший алкилтио, низший алкилсульфонил, низший алкиламино, низший алкилкарбонил и т.д. обозначают такие группы, в которых алкильная группа представляет собой низшую алкильную группу, как указано выше. Аналогично низший алкенил и алкинил соответственно обозначают группы, имеющие от двух до шести углеродных атомов включительно. Предпочтительными группами являются группы, имеющие вплоть до четырех углеродных атомов.
Термин арил относится к моно- или бициклической карбоциклической или гетероциклической ароматической группе, такой как фенил, индолил, тиенил, пиримидил, оксазолил, изоксазолил, тиазолил, изотиазолил, имидазолил, бензофуранил, бензотиенил, пиридил, нафтил и фуранил, в частности фенил, пиримидил, индолил и тиенил.
Галоген означает фтор, хлор, бром или иод.
Используемый здесь термин ацил относится к формильной, низший-алк(ен/ин)илкарбонильной, арилкарбонильной, арил-низший алк(ен/ин)илкарбонильной, циклоалкилкарбонильной или циклоалкил-низший алк(ен/ин)илкарбонильной группе.
Термин тиоацил означает соответствующую ацильную группу, в которой карбонильная группа замещена тиокарбонильной группой.
Выражение алк(ен/ин)ил означает, что группа может быть алкильной, алкенильной или алкинильной группой.
В формуле I X предпочтительно представляет собой CH2 или S, и Y, предпочтительно, является CH2 и, наиболее предпочтительно, они оба являются CH2.
R1 предпочтительно представляет ацил, низший алкил, низшую алкокси, группу R10R11NCO- или R10R11NCS-, в которой R10 является водородом, низшим алкилом, циклоалкилом, циклоалкил-низшим алкилом или арилом и R11 является водородом или низшим алкилом, или R10 и R11 вместе с N-атомом, с которым они соединены, образуют пирролидинил, пиперидинил или пергидроазепиновую группу. Наиболее предпочтительно R1 представляет формил, ацетил, метиламинокарбонил, метиламинтиокарбонил, диметиламинокарбонил, диметиламинотиокарбонил, метилсульфонил, аминокарбонил, циклопропилкарбонил, метил, пирролидинилкарбонил или 4-фторфениламинокарбонил.
R2 представляет предпочтительно водород или низший алкил, наиболее предпочтительно водород или метил, или R1 и R2 соединены вместе, образуя 5-7-членное незамещенное кольцо лактама или пирролидинил, пиперидинил или пергидроазепин.
R3-R5 представляют предпочтительно водород, фтор, хлор, бром, метил, трифторметил или ацетил, и R6-R8 являются предпочтительно все водородом.
Наконец, Ar является предпочтительно фенилом, 3-индолилом, 1-индолилом, или пиримидилом или фенилом, 3-индолилом, 1-индолилом или пиримидилом, замещенным галоидом.
Предпочтительным подклассом соединений являются соединения, в которых R1 является ацетилом и R2 является H и, в частности, такие соединения, в которых Ar являются индолилом или фенилом, замещенным галоидом, особенно хлором. Если Ar является 3-индолилом, то он предпочтительно замещен в 6-положении, и если он является фенилом, то он предпочтительно замещен в 4-положении.
Другим предпочтительным подклассом соединений изобретения являются те, в которых R1 является группой R10R11 NCO- или R10R11NCS-, в которой R10 является водородом или низшим алкилом, циклоалкилом, циклоалкил-низшим алкилом или арилом, и R11 является водородом или низшим алкилом, и R2 является водородом.
В еще одном предпочтительном подклассе соединений R1 представляет водород, низший алкил или низший алкилсульфонил, в частности метил или метилсульфонил, и R2 представляет водород или низший алкил, в частности метил, или R1 и R2 соединены вместе, образуя пирролидиноновое кольцо или пирролидинильное кольцо.
Предпочтительными соединениями являются:
1-(6-Ацетиламиноиндан-1-илметил)-4-(4-фторфенил)пиперидин.
(+)-1-(6-Ацетиламиноиндан-1-илметил)-4-(4-фторфенил)пиперидин.
(-)-1-(6-Ацетиламиноиндан-1-илметил)-4-(4-фторфенил)пиперидин.
1-(6-Ацетиламино-5-фториндан-1-илметил)-4-(4-фторфенил)пиперидин.
1-(6-Ацетиламино-4-фториндан-1-илметил)-4-(4-фторфенил)пиперидин.
1-(6-Ацетиламино-4-броминдан-1-илметил)-4-(4-фторфенил)пиперидин.
1-(6-Ацетиламино-4-нитроиндан-1-илметил)-4-(4-фторфенил)пиперидин.
1-(6-Ацетиламино-4-цианоиндан-1-илметил)-4-(4-фторфенил)пиперидин.
1-(6-Ацетиламино-5-хлориндан-1-илметил)-4-(4-фторфенил)пиперидин.
1-(6-Ацетиламино-5-броминдан-1-илметил)-4-(4-фторфенил)пиперидин.
1-(6-Ацетиламино-5-цианоиндан-1-илметил)-4-(4-фторфенил)пиперидин.
1-(6-Ацетиламино-7-хлориндан-1-илметил)-4-(4-фторфенил)пиперидин.
1-(6-Ацетиламино-7-фториндан-1-илметил)-4-(4-фторфенил)пиперидин.
1-(5-Ацетил-6-ацетиламиноиндан-1-илметил)-4-(4-фторфенил)пиперидин.
1-(6-Ацетиламино-1-метилиндан-1-илметил)-4-(4-фторфенил)пиперидин.
1-(6-Ацетиламиноиндан-1-илметил)-4-(3-фторфенил)пиперидин.
1-(6-Ацетиламиноиндан-1-илметил)-4-(2-фторфенил)пиперидин.
1-(6-Ацетиламиноиндан-1-илметил)-4-(4-метилфенил)пиперидин.
1-(6-Ацетиламиноиндан-1-илметил)-4-(4-диметиламинофенил)пиперидин.
1-(6-Ацетиламиноиндан-1-илметил)-4-(4-аминофенил)пиперидин.
1-(6-Ацетиламиноиндан-1-илметил)-4-(3-трифторметилфенил)пиперидин.
1-(6-Ацетиламиноиндан-1-илметил)-4-(4-фторфенил)пиперидин.
1-(5-Ацетиламино-2, 3-дигидробензотиофен-3-илметил)-4-(4-фторфенил) пиперидин.
1-(6-Ацетиламино-1, 3-дигидробензофуран-1-илметил)-4-(4-фторфенил) пиперидин.
1-(6-Ацетиламиноиндан-1-илметил)-4-(4-хлорфенил)пиперазин.
1-(6-Ацетиламиноиндан-1-илметил)-4-(3-хлорфенил)пиперазин.
1-(6-Ацетиламиноиндан-1-илметил)-4-(2-хлорфенил)пиперазин.
1-(6-Ацетиламиноиндан-1-илметил)-4-(4-трифторметилсульфонилоксифенил) пиперазин.
1-(6-Ацетиламиноиндан-1-илметил)-4-(3,4-дихлорфенил)пиперазин.
1-(6-Ацетиламиноиндан-1-илметил)-4-(3,4-дихлорфенил)пиперидин.
1-(6-Ацетиламиноиндан-1-илметил)-4-(2-метоксифенил)пиперазин.
1-(6-Ацетиламиноиндан-1-илметил)-4-(4-фторфенил)-1,2,3,6- тетрагидропиридин.
1-(6-Ацетиламиноиндан-1-илметил)-4-(4-хлорфенил)-1,2,3,6- тетрагидропиридин.
1-(6-Ацетиламиноиндан-1-илметил)-4-(2-пиримидил)пиперидин.
1-(6-Ацетиламиноиндан-1-илметил)-4-(2-пиримидил)пиперазин.
1-(6-Ацетиламиноиндан-1-илметил)-4-(2-пиридинил)пиперазин.
1-(6-Ацетиламиноиндан-1-илметил)-4-(3-тиенил)пиперидин.
1-(6-Ацетиламиноиндан-1-илметил)-4-(2-тиенил)пиперидин.
1-(6-Ацетиламиноиндан-1-илметил)-4-(3-тиенил)пиперазин.
1-(6-Ацетиламиноиндан-1-илметил)-4-(1-нафтил)пиперидин.
1-(6-Ацетиламиноиндан-1-илметил)-4-(2-нафтил)пиперидин.
1-(6-Бутаноиламиноиндан-1-илметил)-4-(4-фторфенил)пиперидин.
1-(6-Формиламиноиндан-1-илметил)-4-(4-фторфенил)пиперидин.
1-(6-Формиламиноиндан-1-илметил)-4-(4-фторфенил)пиперазин.
4-(4-Фторфенил)-1-(6-метансульфониламиноиндан-1-илметил)пиперидин.
1-(6-Циклопропилкарбониламиноиндан-1-илметил)-4-(4-фторфенил) пиперидин.
1-(6-Циклопентилкарбониламиноиндан-1-илметил)-4-(4-фторфенил)пиперидин.
4-(4-Фторфенил)-1-(6-метиламинокарбониламиноиндан-1-илметил)пиперидин.
1-(6-(4-Фторфенил)аминокарбониламиноиндан-1-илметил] -4-(4-фторфенил) пиперидин.
4-(4-Фторфенил)-1-(6-метиламинотиокарбониламиноиндан- 1-илметил)пиперидин.
1-(6-Диметиламинокарбониламиноиндан-1-илметил)-4-(4-фторфенил)пиперидин.
1-(6-Диметиламинотиокарбониламиноиндан-1-илметил)-4-(4-фторфенил) пиперидин.
4-(4-Фторфенил)-1-[6-(1-пирролидинил)карбониламиноиндан-1-илметил] пиперидин.
1-(6-Аминокарбониламиноиндан-1-илметил)-4-(4-фторфенил)пиперидин.
1-(6-Этоксикарбониламиноиндан-1-илметил)-4-(4-фторфенил)пиперидин.
1-[6-(N, N-диметиламино)индан-1-илметил]-4-(4-фторфенил)пиперидин.
3-[1-(5-Ацетиламино-2, 3-дигидробензотиофен-3-илметил)пиперидин-4-ил] - 5-хлоро-1H-индол.
3-[1-(5-Ацетиламино-2,3-дигидробензотиофен-3-илметил)-1,2,3,6- тетрагидропиридин-4-ил]-5-хлоро-1H-индол.
3-[1-(6-Ацетиламиноиндан-1-илметил)пиперидин-4-ил]-5-фторо-1H-индол.
3-[1-(6-Ацетиламино-2,3-дигидробензотиофен-3-илметил)-1,2,3, 6- тетрагидропиридин-4-ил]-5-фторо-1H-индол.
3-[1-(6-Ацетиламиноиндан-1-илметил)-1,2,3, 6-тетрагидропиридин-4-ил] -6- хлоро-1H-индол.
3-[1-(6-Ацетиламиноиндан-1-илметил)пиперидин-4-ил]-6-хлоро-1H-индол.
3-[1-(6-Ацетиламиноиндан-1-илметил)пиперидин-4-ил] -6-хлоро-1- метил-1H-индол.
1-[1-(6-Ацетиламиноиндан-1-илметил)пиперидин-4-ил]-6-хлоро-1H-индол.
1-[1-(6-Ацетиламиноиндан-1-илметил)пиперидин-4-ил]-5-хлоро-1H-индол.
3-[1-(6-Ацетиламиноиндан-1-илметил)-1,2,3,6-тетрагидропиридин-4-ил] -5- хлоро-1H-индол.
4-(4-Фторфенил)-1-[6-(1-пирролидин-2-онил)индан-1-илметил)пиперидин.
4-(4-Фторфенил)-1-[6-(1-пиперидин-2-онил)индан-1-илметил)пиперидин.
1-[6-(4-Фторфениламино)индан-1-илметил]4-(4-фторфенил)пиперидин.
3-[1-(6-Ацетиламиноиндан-1-илметил)пиперидин-4-ил]-6-хлоро-бензотиофен.
3-[1-(6-Ацетиламиноиндан-1-илметил)-1,2,3,6-тетрагидропиридин-4-ил] -6- хлоро-бензотиофен.
3-[1-(6-Ацетиламиноиндан-1-илметил)пиперидин-4-ил]-5-хлоро-бензотиофен.
2-[1-(6-Ацетиламиноиндан-1-илметил)пиперидин-4-ил]-6-хлоро- бензотиофен.
3-[1-(6-Ацетиламиноиндан-1-илметил)пиперидин-4-ил]-6-хлоро-бензофуран.
3-[1-(6-Ацетиламиноиндан-1-илметил)пиперидин-4-ил] -6-хлоро-1H-индол-2-он.
3-[1-(6-Ацетиламиноиндан-1-илметил)пиперидин-4-ил] -6-хлоро-метил-1H-индол-2-он.
3-[1-(6-Ацетиламиноиндан-1-илметил)-1,2,3,6-тетрагидропиридин-4-ил] -6- хлоро-1-метил-1H-индол-2-он.
2-[1-(6-Ацетиламиноиндан-1-илметил)пиперидин-4-ил]-6-хлоро-1H-индол.
1-[1-(6-Ацетиламиноиндан-1-илметил)пиперидин-4-ил] -5-хлоро-1H-индол-2-он.
3-[1-(6-Метиламинокарбониламиноиндан-1-илметил)пиперидин-4-ил] -5-хлоро-1H-индол.
3-[1-(6-Метиламинокарбониламиноиндан-1-илметил)-1,2,3, 6- тетрагидропиридин-4-ил]-6-хлоро-1H-индол.
1-(6-Ацетиламиноиндан-1-илметил)-4-(4-бромфенил)пиперидин.
1-(6-Ацетиламиноиндан-1-илметил)-4-гидрокси-(4-хлорфенил) пиперидин.
1-(6-Ацетиламиноиндан-1-илметил)-4-(3-трифторметил-4-хлорфенил)пиперазин.
1-(6-Ацетиламиноиндан-1-илметил)-4-(2-хлор-3-тиенил)пиперидин.
1-(6-Ацетиламиноиндан-1-илметил)-4-(4-хлор-2-тиенил)пиперидин.
1-(6-Ацетиламиноиндан-1-илметил)-4-(3, 4-метилендиоксифенил)пиперидин.
1-(6-Ацетиламиноиндан-1-илметил)-4-(3,4-метилендиоксифенил)пиперазин.
1-(6-Метиламинокарбиноламиноиндан-1-илметил)-4-(3, 4-метилендиоксифенил) пиперазин.
1-(6-Ацетиламиноиндан-1-илметил)-4-гидрокси-4-(3-трифторметил-4- хлорфенил)пиперидин.
1-(6-Ацетиламиноиндан-1-илметил)-4-ацетилокси-4-(3-трифторметил-4- хлорфенил)пиперидин.
5-хлоро-1-[1-(6-метиламинокарбиноламиноиндан-1-илметил)пиперидин-4-ил] - 1H-индол.
Соли присоединения кислоты по изобретению представляют собой фармацевтически приемлемые соли соединений формулы I, образованные с нетоксичными кислотами. Примерами таких органических солей являются соли с малеиновой, фумаровой, бензойной, аскорбиновой, эмбоновой (embonic), янтарной, щавелевой, бис-метиленсалициловой, метансульфоновой, этансульфоновой, уксусной, пропионовой, винной, салициловой, лимонной, глюконовой, молочной, яблочной, миндальной, коричной, цитраконовой, аспарагиновой, стеариновой, пальмитиновой, итаконовой, гликолевой, п-аминобензойной, глутаминовой, бензолсульфоновой и теофеллин уксусной кислотами, а также 8-галотеофиллинами, например 8-бромотеофиллином. Примерами таких неорганических солей являются соли с хлористоводородной, бромистоводородной, серной, сульфоминовой (sulfamic), фосфорной и азотной кислотами.
Фармацевтические композиции по данному изобретению или фармацевтические композиции, получаемые в соответствии с этим изобретением, могут вводиться любым подходящим путем, например перорально, в виде таблеток, капсул, порошков, сиропов и т.д., или парентерально в виде растворов для инъекции. Для получения таких композиций могут быть использованы способы, хорошо известные в данной области, и могут быть использованы любые фармацевтически приемлемые носители, разбавители, наполнители или другие обычно используемые в данной области техники вспомогательные вещества.
Удобно, чтобы соединения данного изобретения вводились в виде единичной лекарственной формы, содержащей указанные соединения в количестве от около 0,01 до 100 мг.
Суммарная суточная доза обычно находится в пределах около 0,05-500 мг, и, наиболее предпочтительно, от около 0,1 до 50 мг активного соединения изобретения.
Кроме того, изобретение относится к способу получения
новых 4-арил-1-[аминоиндан, дигидробензофуран и дигидробензотиофен)метил] пиперидинов,
-тетрагидропиридинов или -пиперазинов формулы I, включающему:
а) взаимодействие аминопроизводного
следующей формулы II
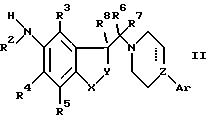
где R2-R3, X, Y, Z, Ar и пунктирная линия такие, как определено ранее, с реагентом формулы R1'-гал или R1'-OCOR, и в этих формулах гал есть галоид, R есть алкил, арил или алкокси и R1 является ацилом, тиоацилом, группой R9VCO-, или группой R10R11NCO- или R10 R11NCS-, где R9, V, R10 и R11 являются такими, как определено выше, за исключением того, что ни R10, ни R11 не могут быть водородом, или с низшим алкилсульфонилгалогенидом, трифторметилсульфонилгалогенидом, или изоцианатом, или тиоизоцианатом формулы R10-N=C=O или R10-N=C=S, где R10 является таким, как определено выше;
б) для того чтобы получить соединение формулы I, в котором R1 представляет низший алк(ен/ин)ил, циклоалк(ен)ил-низший алк(ен)ил или арил-низший алкил, алкилирование аминопроизводного формулы II алкилирующим агентом, таким как алкилгалогенид R1'-гал, мезилат R1''OSO2CH3 тозилат R1''OSO2C2H4-CH3, или сходным алкилирующим реагентом с подходящими отщепляемыми группами, причем R1 представляет низший алкил, низший алкенил, низший алкинил, циклоалк(ен)ил, циклоалк(ен)ил-низший алк(ен/ин)ил или арил-низший алкил;
в) восстановление двойной связи тетрагидрапиридинилов производных следующей формулы III

где R1-R8, X, Y и Ar такие, как определено ранее; или
г) алкилирование арилпиперазина, арилпиперидина или арилтетрагидропиридина формулы V алкилирующим производным формулы IV

где R1-R8, X, Y, Z, Ar и пунктирная линия такие, как определено ранее, и W есть отщепляемая группа, такая как, например, галоген, мезилат или тозилат; или
д) для того, чтобы получить соединения формулы I, в котором заместители R1 и R2 вместе составляют кольцо, замыкание цикла (циклизация) производного формулы VI
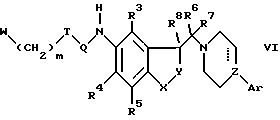
где R3 -R8, X, Y, Z, Ar, m, Q, T и пунктирная линия, такие как определено ранее, и W есть отщепляемая группа, такая как, например, галоид, мезилат или тозилат; или
е) для того, чтобы получить соединение формулы I, в котором R1 представляет низший алк(ен/ин)ил, циклоалк(ен)ил, циклоалк(ен)ил-низший алк(ен)ил или арил низший алкил, восстановление карбонильной группы амидного производного следующей формулы VII:

где R2-R8, X, Y, Z, Ar и пунктирная линия такие, как определено ранее, и R1''' является такой группой, что группа R1'''CH2 составляет низший алк(ен/ин)ил, циклоалк(ен)ил, циклоалк(ен)ил-низший алк(ен)ил или арил-низший алкил, охватываемый определением R1; или
ж) введение заместителя R3, R4 или R5 путем взаимодействия соединения следующей формулы VIII

где одна из R3'-R5' является водородом и две другие являются соответствующими R3, R4 или R5, как определено ранее, и R1, R2, R6-R8, X, Y, Z, Ar и пунктирная линия такие, как определено ранее, с реакционноспособным реагентом, таким как галоид или галогенирующий агент, сульфирующий агент, нитрующий агент, или реакционно-способным агентом, генерирующим ионы карбония (RCO+, R), в котором R представляет алкил алкинил, арил циклоалкил, или циклоалк(ен/ин)ил; или
з) восстановление двойной связи в соединении следующей формулы IX
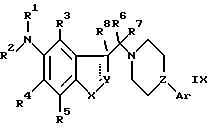
где R1-R8, X, Y, Z и Ar такие, как определено ранее, и одна из двух пунктирных линий обозначает двойную связь; или
и) восстановление амидного карбонила в соединении следующей формулы X:

где R1-R5, R8, X, Y, Z, Ar и пунктирная линия такие, как определено ранее,
после чего соединение формулы I выделяют в виде свободного основания или его фармацевтически приемлемой кислой соли присоединения.
Взаимодействие согласно способу а) осуществляют при низкой температуре (например, ниже комнатной температуры) в инертном растворителе, таком как ацетон, дихлорметан, тетрагидрофуран или диметоксиэтан, когда используют реакционно-способные хлорангидриды карбоновых кислот, изоцианаты или изотиоцианаты. Формилированные амины получают из соответствующих аминов путем реакции в муравьиной кислоте, с эфирами муравьиной кислоты или путем взаимодействия со смешанным ангидридом муравьиной кислоты, получаемом in situ. Обычно температуры реакций находятся между 0oC и температурой кипения формильных соединений предшественников.
Алкилирование согласно способам б) и г) обычно проводят путем кипячения с обратным холодильником в подходящем растворителе, таком как ацетон, метилизобутилкетон, тетрагидрофуран, диоксан, этанол или 2-пропанол в присутствии основания, такого как триэтиламин или карбонат калия.
Восстановление двойных связей согласно способам в) и з) обычно проводят путем каталитического гидрирования при низком давлении (< 3 атм) в аппарате Парра (Paar), или путем использования восстанавливающих агентов, таких как диборан, в инертных растворителях, таких как тетрагидрофуран, диоксан или диэтиловый эфир.
Восстановление согласно способам е) и и) обычно проводят путем использования LiAlH4, AlBH3 или диборана в инертном растворителе, таком как тетрагидрофуран, диоксан или диэтиловый эфир, при комнатной температуре или при слегка повышенной температуре.
Галогенирование согласно способу ж) обычно проводят используя хлор, бром или N-хлорсукцинимид, N-бромсукцинимид или другую галогенсодержащую молекулу-предшественник, обычно в присутствии катализатора, такого как Fe ионы или минеральная кислота.
1-Незамещенные 4-арилпиперазины формулы V (Z=N) либо коммерчески доступны, либо они могут быть синтезированы из соответствующих анилинов и N',N'-бис(2-хлорэтил)амина при кипячении c обратным холодильником в высококипящих растворителях, как например хлорбензол, обычно в течение 2-3 дней согласно способам, описанным Martin et al., J. Med. Chem. 1989, 32 1052-1056.
4-Арилпиперидины формулы V (Z= CH) либо коммерчески доступны, либо их получают, как описано, например, в Пат. США N 2891066; McElvain et al., J. Amer. Chem. Soc. 1950, 72, 3134; Bally et al., Chem. Ber. 1887, 20, 2590. Соответствующие 4-арил-1,2,3, 6-тетрагидропиридины формулы V (Z=C) получает из N-защищенных 4-пиперидинов путем добавления соответствующим образом замещенных ариллитийгалогенидов или арилмагнийгалогенидов с последующим катализируемым кислотой водным элиминированием. Наконец, N-защитную группу (карбамат, бензил, сульфонил, ацетил) удаляют обычным способом.
Синтез 3-(4-пиперидинил)-1H-индолов и 3-(1,2, 3,6-тетрагидропиридин-4-ил) 1-индолов описан в экспериментальном разделе.
Ключевые промежуточные продукты, такие как 1-инданкарбоновая кислота (V. Asham and W.H. Linnell, J. Chem. Soc. 1954, 4691-4693, Hansen et al., Helv. Chim. Acta 1982, 33, 325-343) и 5-нитро-3-бензотиофенкарбоновая кислота (заявка на Евр. Пат. EP N 88-301073 CA (110 (9); 75302у) и ссылки, цитированные в ней) получают согласно хорошо известным в литературе процедурам.
ЭКСПEPИМЕНТАЛЬНЫЙ РАЗДЕЛ
Ниже данное изобретение дополнительно иллюстрируется примерами, которые, однако, не
следует рассматривать как ограничивающие изобретение.
Во всех примерах температуры плавления определяют на Buchi SMP-20 приборе. Температуры плавления даны некорректированными.1H ЯМР спектры записаны на спектрометре 250 МГц Bruker AC 250. В качестве растворителей использовали дейтерированный хлороформ (99,8% D) и диметилсульфоксид (99,9% D). ТМС использовали в качестве внутреннего стандарта. Значения химических сдвигов выражены в м.д. Использовали следующие аббревиатуры для множества ЯМР-сигналов: с= синглет, д=дублет, т=триплет, к=квартет, кв=квинтет, г=гептет, дд= дублет дублетов, дт=дублет триплетов, дк=дублет квартетов, тт=триплет триплетов, м=мультиплет.
Пример1
6-Нитро-1-инданкарбоновая кислота, 1a
Раствор
1-инданкарбоновой кислоты (30 г), полученной по способу Hansen et al. ,
Helv. Chim. Acta 1982, 325-343, в дихлорметане (50 мл) смешивают с концентрированной серной кислотой (300 мл) при -10o
C. Смесь 100% NHO3 (11,4 г) и концентрированной H2SO4 (96 мл) добавляют по каплям при энергичном перемешивании ниже -10oC. После перемешивания в течение
одного часа при 10oC смесь выливают на лед. Экстракция
этилацетатом (2 x 300 мл), сушка (безв. MgSO4) и, наконец, испарение органического растворителя дает 42 г названного
соединения. Т. пл.: 126-130oC.
5-Нитро-3-бензотиофенкарбоновую кислоту получают из 3-бромо-5-нитробензотиофена через соответствующее производное 3-цианобензотиофена согласно EP пат. N 88-301073 (CA110(9): 75203у (1988), J. Amer. Chem. Soc. 1948, 70,1955 и J. Chem. Soc. (с) 1967, 1899.
Пример 2 (способ "и")
1-(6-Аминоиндан-1-илметил)-4-(4-фторфенил)пиперидин, 2a.
Диметилформамид (ДМФ, 1 мл) добавляют к раствору 6-нитро-1-инданкарбоновой кислоты, 1а (13 г) и тионилхлорида (18 мл) в дихлорметане (125 мл). Смесь кипятят с обратным холодильником в течение 4 ч. Добавляют толуол и летучее вещество испаряют в вакууме. Полученный таким образом хлорангидрид карбоновой кислоты растворяют в дихлорметане (100 мл) и добавляют по каплям к раствору 4-(4-фторфенил)пиперидина (19,5 г) и триэтиламина (7 мл) в дихлорметане (100 мл) при 0-5oC. Смесь перемешивают при комнатной температуре в течение дополнительных 1,5 ч. Добавляют воду, органическую фазу отделяют, промывают соляным раствором, сушат (безв. MgSO4), фильтруют и дихлорметан испаряют в вакууме, получая неочищенное производное 6-нитроиндан-1-карбоксамида в виде масла (35 г). Очистка колоночной хроматографией на силикагеле (элюируют смесью 1:1 этилацетата и гептана) дает 12 г чистого карбоксамида в виде масла. Все это масло растворяют при кипячении с обратным холодильником в 90% этаноле (350 мл). Fe-порошок (10 г) и концентрированную водную HCl (1 мл) последовательно добавляют маленькими порциями в течение 10 мин. Полученную смесь кипятят с обратным холодильником в течение еще 2,5 ч. Неорганические соли отфильтровывают, пока смесь еще горячая, и этанол испаряют в вакууме. Добавляют разбавленный водный NH4OH до достижения pH > 9. Экстракция этилацетатом (2 x 200 мл) и обработка органической фазы, как упомянуто выше, дает 8 г производного 6-аминоиндан-1-карбоксамида. Т. пл. 144-145oC. К суспензии LiAlH4 (2,7 г) в сухом тетрагидрофуране (ТГФ, 125 мл) добавляют по каплям раствор всего карбоксамида в ТГФ (125 мл). Смесь нагревают при слабом кипении с обратным холодильником в течение 2 ч. После охлаждения до 10oC воду (10 мл) и 15%-ный водный раствор NaOH осторожно добавляют, чтобы разрушить избыток LiAIH4. Неорганические соли отфильтровывают и тщательно промывают ТГФ. Объединенные ТГФ растворы выпаривают, получая 6,5 г названного соединения 2a в виде масла. Хлористоводородную соль кристаллизуют из 2-пропанола. Т. пл. 198-201oC.
1H ЯМР (ДМСО-d6): δ 1,85-2,40 (м, 6H); 2,60-2,90 (м, 3H); 3,00-3,15 (м, 3H); 3,35 (широкий с, 3H), 3,45-3,60 (м, 2H); 3,65-3,75 (м, 1H); 6,45 (д, 1H); 6,50 (с, 1H); 6,95 (д, 1H); 7,15 (т, 2H); 7,25-7,35 (м, 2H).
Аналогичным способом получают следующие анилиновые
производные:
1-(6-Аминоиндан-1-илметил)-4-(2-метоксифенил)пиперазин, 2б в виде масла,
1-(6-Аминоиндан-1-илметил)-4-(2-хлорфенил)пиперазин, 2в в виде масла,
1-(6-Аминоиндан-1-илметил)-4-(3-хлорфенил)пиперазин, 2г в виде масла,
1-(6-Аминоиндан-1-илметил)-4-(4-хлорфенил)пиперазин, 2д, т. пл.: 98-109oC,
1-(5-Амино-2,
3-дигидробензотиофен-3-илметил)-4-(4-фторфенил)- пиперидин, 2е в виде масла,
1-(6-Аминоиндан-1-илметил)-4-(4-фторфенил)-1,2,3,6-тетрагидропиридин, 2ж, т. пл.: 78-84oC,
1-(6-Аминоиндан-1-илметил)-4-(3,4-дихлорфенил)пиперазин, 2з, Т. пл. : 156-158o
C (промыт диэтиловым эфиром).
1H ЯМР (CDCl3): δ 1,70-1,90 (м, 1H);
2,20-2,30 (м, 1H); 2,45 (дд, 1H); 2,55-2,75 (м, 6H); 2,75-2,90 (м, 2H); 3,20 (т, 4H); 3,
20-3,35 (м, 1H); 3,55 (широкий с, 2H); 6,50 (дд, 1H); 6,70-6,80 (м, 2H); 6,90-7,00 (м, 2H); 7,25 (д, 1H);
1-(6-Аминоиндан-1-илметил)-4-(3,4-метилендиоксифенил)пиперазин, 2и в виде масла
1-(6-Аминоиндан-1-илметил)-4-гидрокси-4-(3-фторметил-4-хлорфенил)пиперидин, 2к в виде масла
1-(6-Аминоиндан-1-илметил)-4-(4-метилфенил)пиперидин, 2л в виде масла
1-(6-Аминоиндан-1-илметил)-4-(4-хлорфенил)-1,2,3,6-тетрагидропиридин, 2м в виде масла.
Пример 3 (способ
"и")
1-(6-Аминоиндан-1-илметил)-4-(4-фторфенил)пиперазин, 3а.
1-Инданкарбоновую кислоту (20 г), ДМФ (2 мл) и тионилхлорид (53 г) в дихлорметане (250 мл) кипятят с обратным холодильником в течение 4 ч. Летучее вещество испаряют в вакууме и оставшийся тионилхлорид удаляют испарением с толуолом в вакууме. Оставшийся хлорангидрид карбоновой кислоты растворяют в дихлорметане (200 мл) и добавляют по каплям к раствору 1-(4-фторфенил)пиперазина (58 г) в дихлорметане (200 мл) при 0-5oC. После перемешивания в течение 1,5 ч при комнатной температуре органическую фазу промывают последовательно водой и соляным раствором и, наконец, после обработки органической фазы, как указано выше, получают 66 г неочищенного карбоксимида. Очистка колоночной хроматографией на силикагеле (элюируют смесью 1:1 этилацетат/гептан) дает 36 г кристаллического продукта с т. пл. 119-124oC. Весь этот продукт растворяют в концентрированной H2SO4 (170 мл) при -10oC. Смесь 100% HNO3 (6,9 г) в концентрированной H2SO4 (55 мл) добавляют по каплям при энергичном перемешивании ниже -10oC. Смесь перемешивают в течение еще одного часа при -5oC. Смесь выливают на лед (500 г) и добавляют смесь 1:1 дихлорметана и этилацетата (300 мл). Органическую фазу отделяют и промывают разбавленным раствором Na2CO3 (2 x 200 мл) и соляным раствором (200 мл). Обработка органической фазы, как указано выше, дает 35 г неочищенного производного 6-нитроиндан-1-карбоксамида в виде масла. Неочищенный продукт растворяют в 90% этаноле при кипячении. Fe-порошок (31,5 г) и концентрированную водную HCl (3,1 мл) добавляют последовательно небольшими порциями в течение 30 мин. Полученную смесь кипятят с обратным холодильником в течение еще 2,5 ч. Неорганические соли отфильтровывают, пока смесь еще горячая, и этанол испаряют в вакууме. Добавляют разбавленный водный NH4OH до достижения pH > 9. Экстракция дихлорметаном (2 x 200 мл) и обработка органической фазы, как указано выше, дают 31 г кристаллического производного 6-аминоиндан-1-карбоксамида. Т. пл. 143-149oC. К суспензии LiAlH4 (10,4 г) в сухом ТГФ (400 мл) добавляют по каплям раствор всего карбоксамида в ТГФ (400 мл). Смесь нагревают при слабом кипении с обратным холодильником в течение 2,5 ч. После охлаждения до 15oC осторожно добавляют воду (40 мл) и 15%-ный водный раствор NaOH (10,4 мл), чтобы разрушить избыток LiAlH4. Неорганические соли отфильтровывают и тщательно промывают ТГФ. Объединенные ТГФ растворы испаряют, получая 23,7 г названного соединения 3а в виде масла.
Пример 4 (способ а)
1-(6-Ацетиламиноиндан-1-илметил)-4-(4-фторфенил)пиперидин, 4а.
К раствору 1-(6-аминоиндан-1-илметил)-4-(4-фторфенил)пиперидина, 2а (6,5 г) и триэтиламина (3 мл) в дихлорметане (150 мл), охлажденного до 0oC, добавляют по каплям раствор ацетилхлорида (1, 7 г) в дихлорметане (50 мл). Смесь перемешивают в течение одного часа при комнатной температуре. Добавляют воду (500 мл), органическую фазу отделяют, промывают соляным раствором (2 x 50 мл) и, наконец, обрабатывают, как указано выше. Выделенный таким образом названный продукт очищают колоночной хроматографией на силикагеле (элюируют смесью этилацетат/гептан/триэтиламин 75:25:4). Перекристаллизация из диэтилового эфира дает 7,7 г чистого названного соединения 4а. Т. пл. 159-162oC.
1H ЯМР (CDCl3): δ 1,70-1,90 (м, 5H); 2, 00-2,15 (м, 1H); 2,15 (с, 3H); 2,20-2,30 (м, 1H); 2,35-2,50 (м, 2H); 2,60 (дд, 1H); 2,70-2,90 (м, 2H); 2,95-3,15 (м, 2H); 3,45 (кв, 1H); 6,95 (т, 2H); 7,05-7,25 (м, 5H); 7,55 (с, 1H).
Соответствующим способом получают следующие ациламино, тиоациламино и сульфониламино производные:
1-(6-Ацетиламиноиндан-1-илметил)-4-(4-фторфенил)пиперазин 4б, т. пл. 179-187oC
(этанол).
1H ЯМР (ДМСО-d6): δ 1,70-1,85 (м, 1H); 2,00 (с, 3H); 2, 10-2,25 (м, 1H); 2,35 (дд, 1H); 2,50-2,60 (м, 5H); 2,65-2,90 (м, 2H); 3,10 (т, 4H); 3,35 (кв, 1H); 6,90-7,10 (м, 5H); 7,30 (д, 1H); 7,60 (с, 1H); 9,75 (с, 1H).
1-(6-Ацетиламино-2, 3-дигидробензотиофен-3-илметил)-4-(4-фторфенил)пиперидин 4в, т. пл. 140-142oC (промыт диэтиловым эфиром).
1H ЯМР (ДМСО-d6): δ 1,55-1,75 (м, 4H); 1,95 (с, 3H); 1,90-2,05 (м, 1H); 2,05-2,20 (дт, 1H); 2,35 (дд, 1H); 2,40-2,55 (м, 3H); 2,95 (д, 1H); 3,15 (д, 1H); 3,20-3,35 (м, 1H); 3,45 (т, 1H); 3,55-3,70 (м, 1H); 7,05-7,15 (м, 3H); 7,25-7,35 (м, 3H); 7,65 (с, 1H); 9,85 (с, 1H).
1-(6-Ацетиламиноиндан-1-илметил)-4-(4-хлорфенил)пиперазин 4г, т. пл. 191-194oC (ацетон).
1H ЯМР (CDCl3 ): δ 1,80-1,95 (м, 1H); 2,10 (с, 3H); 2, 20-2,35 (м, 1H); 2,45 (дд, 1H); 2,60-2,70 (м, 5H); 2,80-2,95 (м, 2H); 3,15 (т, 4H); 3,35 (кв, 1H); 6,85 (д, 2H); 7,05-7,25 (м, 5H); 7,55 (с, 1H).
1-(6-Ацетиламиноиндан-1-илметил)-4-(3-хлорфенил)пиперазин 4д, т. пл. 176-178oC (ацетон).
1H ЯМР (CDCl3): δ 1,75-1,90 (м, 1H); 2,15 (с, 3H); 2, 20-2,35 (м, 1H); 2,45 (дд, 1H); 2,60-2,75 (м, 5H); 2,75-2,95 (м, 2H); 3,20 (т, 4H); 3,35 (кв, 1H); 6,80 (д, 2H); 6,85 (с, 1H); 7,10-7,30 (м, 4H); 7,55 (с, 1H).
1-(6-Ацетиламиноиндан-1-илметил)-4-(2-хлорфенил)пиперазин, гидрохлорид, 4е, т. пл. 195-203oC (ацетон).
1H ЯМР (ДМСО-d6): δ 2,00 (с, 3H); 2,00-2, 15 (м, 1H); 2,30-2,45 (м, 1H); 2,75-2,95 (м, 2H); 3,20-3,80 (м, 11H); 7,05-7,40 (м, 5H); 7,45 (д, 1H); 7,65 (с, 1H); 10,00 (с, 1H); 10,95 (широкий с, 1H).
1-(6-Ацетиламиноиндан-1-илметил)-4-(2-метоксифенил)пиперазин, оксалат, 4ж, т. пл. 210-213oC (ацетон/этанол 1:1).
1H ЯМР (ДМСО-d6): δ 1,85-2,00 (м, 1H); 2,05 (с, 3H); 2,25-2,40 (м, 1H); 2,65-3,05 (м, 3H); 3,25 (широкий с, 8H); 3,45-3,60 (м, 1H); 3,80 (с, 3H); 6,85-7,05 (м, 4H); 7,15 (д, 1H); 7,30 (д, 1H); 7,60 (с, 1H); 9,90 (с, 1H).
1-(6-Ацетиламиноиндан-1-илметил)-4-(4-фторфенил)-1,2,3,6- тетрагидропиридин 4з, т. пл. 156-161oC (промыт диэтиловым эфиром).
1H ЯМР (CDCl3): δ 1,80-1,95 (м, 1H); 2,15 (с, 3H); 2,20-2,35 (м, 1H); 2,45-2,60 (м, 3H); 2,65-3,00 (м, 5H); 3,20 (широкий с, 2H); 3,30-3,45 (м, 1H); 6,05 (широкий с, 1H); 6,95 (т, 2H); 7,15 (д, 1H); 7,15-7,25 (м, 2H); 7,35 (дд, 2H); 7,50 (с, 1H).
4-(4-Фторфенил)-1-(6-метансульфониламиноиндан-1-илметил) пиперидин 4и, т. пл. 152-155oC (диэтиловый эфир).
1 H ЯМР (CDCl3): δ 1,70-1.,90 (м, 5H); 2,00-2,20 (м, 2H); 2,20-2,35 (м, 1H); 2,40-2,70 (м, 3H); 2,75-2,95 (м, 2H); 3,00 (с, 3H); 3,10 (т, 2H); 3,25-3,45 (м, 1H); 6,70 (широкий с, 1H); 6,90-7,05 (м, 3H); 7,15-7,25 (м, 3H); 7,35 (с, 1H).
1-(6-Циклопропилкарбониламиноиндан-1-илметил)-4- (4-фторфенил)пиперидин 4к, т. пл. 134-140oC (диэтиловый эфир).
1H ЯМР (CDCl3): δ 0,75-0,90 (м, 2H); 1,05-1,15 (м, 2H); 1,45-1,60 (м, 1H); 1,75-1,95 (м, 6H); 2,00-2,15 (м, 2H); 2,20-2,35 (м, 1H); 2,35-2,50 (м, 2H); 2,65 (дд, 1H); 2,70-2,95 (м, 2H); 3,00-3,15 (м, 2H); 3,35 (кв, 1H); 6,95 (т, 2H); 7,05-7,25 (м, 4H); 7,40 (широкий с, 1H); 7,65 (широкий с, 1H).
1-(6-Циклопропилкарбониламиноиндан-1-илметил)-4- (4-фторфенил)пиперидин 4л, т. пл. 177-178oC (диэтиловый эфир).
1H ЯМР (CDCl3): δ 1,50-1,70 (м, 2H); 1,70-1,95 (м, 11H); 2,00-2,15 (м, 2H); 2,20-2,35 (м, 1H); 2,35-2,50 (м, 2H); 2,60-2,75 (м, 2H); 2,75-2,95 (м, 2H); 2,95-3,15 (м, 2H); 3,35 (кв, 1H); 6,95 (т, 2H); 7,10-7,25 (м, 5H); 7,65 (с, 1H).
1-(6-Этилоксикарбониламиноиндан-1-илметил)-4-(4-фторфенил)-пиперидин, фумарат, 4м, т. пл. 191-193oC (этанол/ацетон 2:1)
1H ЯМР (ДМСО-d6
):
δ 1,15 (с, 3H); 1,70-1,90 (м, 5H); 2,10-2,30 (м, 3H); 2,40-2,90 (м, 5H); 3,10-3,20 (м, 2H); 3,25-3,35 (м, 1H); 4,15 (к, 1H); 6,60 (с, 1,5H); 7,00-7,15 (м, 4H); 7,35 (дд, 2H); 7,55 (с, 1H);
9,45
(с, 1H).
4-(4-Хлорфенил)-1-(6-метансульфониламиноиндан-1-илметил)- 1,2,3,6-тетрагидропиридин, оксалат 4н, т.пл. 176-178oC (из этанола).
1H ЯМР (ДМСО-d6): δ 1,90-2,00 (м, 1H); 2,30-2,40 (м, 1H): 2,95 (с, 3H); 2,65-3,10 (м, 5H); 3,20-3,30 (м, 3H); 3,50-3,60 (м, 1H); 3,75 (широкий с, 2H); 6,25 (широкий с, 1H); 7,05 (дд, 1H); 7, 15-7,25 (м, 2H); 7,45 (д, 2H); 7,55 (д, 2H); 9,60 (широкий с, 1H).
1-(6-Ацетиламиноиндан-1-илметил)-4-(4-метилфенил)пиперидин 4о, т. пл. 173-175oC (промыт диэтиловым эфиром).
1H ЯМР (CDCl3): δ 1,70-1,95 (м, 5H); 2,10 (с, 3H); 2,20-2,30 (м, 1H); 2,30 (с, 3H); 2,35-2,50 (м, 2H); 2,65 (дд, 1H); 2,70-2,90 (м, 2H); 3,00-3,15 (м, 2H); 3,35 (кв, 1H); 7,05-7,25 (м, 6H); 7,50 (с, 1H); 7,55 (с, 1H).
1-(6-Ацетиламиноиндан-1-илметил)-4-(3,4-дихлорфенил)пиперазин 4п, т. пл. 160-163oC (промыт диэтиловым эфиром).
1H ЯМР (CDCl3): δ 1,80-1,90 (м, 1H); 2,10 (с, 3H); 2,15-2,30 (м, 1H); 2,45 (дд, 1H); 2,55-2,70 (м, 5H); 2,70-3,00 (м, 2H); 3, 20 (т, 4H); 3,35 (кв, 1H); 6,25 (дд, 1H); 6,95 (д, 1H); 7,10 (д, 1H); 7,20 (д, 1H); 7,25 (д, 1H); 7,40 (широкий с, 1H); 7,60 (с, 1H).
1-(6-Ацетиламиноиндан-1-илметил)-4-(4-хлорфенил)-1,2,3, 6- тетрагидропиридин, оксалат 4р, т. пл. 223-226oC (из ацетона).
1H ЯМР (ДМСО-d6): δ 1, 80-1,95 (м, 1H); 2,05 (с, 3H): 2,20-2,40 (м, 1H); 2,65-3, 00 (м, 5H); 3,15-3,30 (м, 3H); 3,50-3,60 (м, 1H); 3,70 (широкий с, 2H); 6,25 (широкий с, 1H); 7,15 (д, 1H); 7,30 (д, 1H); 7,40 (д, 2H); 7,50 (д, 2H); 7,65 (с, 1H).
1-(6-Ацетиламиноиндан-1-илметил)-4-(3,4-метилендиоксифенил)пиперазин, 4с, т. пл. 188-189oC (промыт диэтиловым эфиром).
1H ЯМР (CDCl3): δ 1,70-1, 95 (м, 1H); 2,15 (с, 3H); 2,15-2,30, (м, 1H); 2,45 (дд, 1H); 2,60-2,70 (м, 5H); 2,70-2,90 (м, 2H); 3,10 (т, 4H); 3,40 (кв, 1H); 5,85 (с, 2H); 6,45 (дд, 1H); 6, 55 (д, 1H); 6,70 (д, 1H); 7,15 (д, 1H); 7, 20-7,35 (м, 2H); 7,55 (с, 1H).
1-(6-Ацетиламиноиндан-1-илметил)-4-гидрокси-4-(3-трифторметил- 4-хлорфенил)пиперидин, полуоксалат 4т, т. пл. 163-165oC (ацетон).
1H ЯМР (ДМСО-d6): δ 1,65-1,95 (м, 3H); 2,05 (с, 3H); 2,15-2,30 (м, 3H); 2,65-3,30 (м, 8H); 3,40-3,50 (м, 1H); 7,15 (д, 1H); 7,25 (д, 1H); 7,70-7,85 (м, 3H); 8,00 (с, 1H).
Пример 5 (способ а)
4-(4-Фторфенил)-1-(6-метиламинокарбониламиноиндан-1-илметил) пиперидин, 5а.
1-(6-Аминоиндан-1-илметил)-4-(4-фторфетил)-пиперидин, 2a (3 г) растворяют в дихлорметане (140 мл) и добавляют метилизоцианат (0,53 г). Раствор кипятят с обратным холодильником в течение 4 ч. Дихлорметан испаряют и оставшееся не очищенное названное соединение очищают колоночной хроматографией на силикагеле (элюируют 4%-ным триэтиламином в этилацетате). Очищенное названное соединение 5а кристаллизуют из диэтилового эфира. Выход 0,8 г, т. пл. 170-173oC.
1H ЯМР (CDCl3): δ 1,70-1,90 (м, 5H); 2,00-2,15 (м, 2H); 2,20-2,35 (м, 1H); 2, 35-2,55 (м, 2H); 2,60 (дд, 1H); 2,80 (д, 3H); 2,75-2,95 (м, 2H); 3,05 (широкий д, 2H); 3,30 (кв, 1H); 4,95 (к, 1H); 6,55 (с, 1H); 6,90-7,00 (м, 3H); 7,10-7,25 (м, 3H); 7,35 (с, 1H).
Аналогичным способом получают следующие производные мочевины или тиомочевины.
1-[6-(4-Фторфенил)аминокарбониламиноиндан-1-илметил] -4-(4-фторфенил)пиперидин, 5б, т. пл. 235-238oC (CH2Cl2).
1H ЯМР (ДМСО-d6): δ 1,55-1,80 (м, 5H); 2,20-2,30 (м, 3H); 2,35 (дд, 1H); 2,45-2,60 (м, 2H); 2,60-2,85 (м, 2H); 3, 05 (широкий д, 2H); 3,30 (кв, 1H); 7,05-7,15 (м, 6H); 7,25-7,35 (дд, 2H); 7,40-7,50 (дд, 2H); 7,55 (с, 1H); 8,50 (с, 1H); 8,65 (с, 1H).
4-(4-Фторфенил)-1-(6-метиламинотиокарбониламиноиндан-1-илметил)пиперидин, 5в, т. пл. 181-183oC (этанол/ацетон, 1:1).
1H ЯМР (ДМСО-d6): δ 1,70-1, 90 (м, 5H); 2,15-2,95 (м, 8H); 2,90 (д, 3H); 3,20-3,30 (м, 2H); 3,40 (кв, 1H); 6,20 (с, 2H); 7, 05-7,20 (м, 4H); 7,30 (дд, 2H); 7,40 (с, 1H); 7,80 (широкий с, 1H); 9,60 (широкий с, 1H).
1-(6-Метиламинокарбониламиноиндан-1-илметил)-4-(3,4-метилендиоксифенил) пиперазин, полуоксалат 5г, т. пл. 132-133oC (ацетон).
1H ЯМР (ДМСО-d6): δ 1,70-1,85 (м, 1H); 2,15-2,30 (м, 1H); 2,60 (д, 3H); 2,70-3,00 (м, 3H); 3,20 (м, 4H); 3,35-3,46 (м, 1H); 5,90 (с, 2H); 6,00-6,10 (м, 1H); 6,40 (дд, 1H); 6,70 (д, 1H); 6,80 (д, 1H); 7,05 (д, 1H); 7,10 (д, 1H); 7,45 (с, 1H); 8,40 (с, 1H).
Пример 6 (способ а)
1-(6-Диметиламинокарбониламиноиндан-1-илметил)-4-(4-фторфенил) пиперидин, 6а.
1-(6-Аминоиндан-1-илметил)-4-(4-фторфенил)пиперидин, 2а (3 г) растворяют в ТГФ (50 мл) и добавляют триэтиламин (2 г). При 5oC добавляют по каплям диметилкарбамоилхлорид (1 г) в ТГФ (15 мл). По завершении добавления смесь кипятят с обратным холодильником в течение 1,5 ч. ТГФ испаряют. Добавляют воду и экстракция дихлорметаном (2 x 50 мл) и обработка, как указано выше, объединенных органических фаз дают сырой названный продукт, который очищают колоночной хроматографией на силикагеле (элюируют 4%-ным триэтиламином в смеси 1: 1 этилацетата и гептана). Очищенное названное соединение 6а кристаллизуют из диэтилового эфира.
Выход: 1,4 г, т.пл. 141-144oC.
1H ЯМР (CDCl3): δ 1,65-2,55 (м, 10H); 2,70 (дд, 1H); 2,70-2,95 (м, 2H); 2,95-3,05 (м, 1H); 3,05 (с, 6H); 3,15 (широкий д, 1H); 3,35 (кв, 1H); 6,25 (с, 1H); 6, 95-7,25 (м, 6H); 7,45 (с, 1H).
Аналогичным образом получают следующие
производные мочевины и тиомочевины:
1-(6-Диметиламинотиокарбониламиноиндан-1-илметил)-4-(4-фторфенил)
пиперидин, 6б, т. пл. 175-180oC (промыт диэтиловым эфиром).
1H ЯМР (CDCl3): δ 1,65-1,95 (м, 5H); 2,00-2,15 (м, 2H); 2,20-2,35 (м, 1H); 2,35-2,55 (м, 2H); 2,60 (дд, 1H); 2,70-2,90 (м, 2H); 3,05-3,15 (м, 2H); 3,85 (с, 6H); 3,40 (кв, 1H); 6,95-7,10 (м, 4H); 7,15-7,30 (м, 4H).
4-(4-Фторфенил)-1-[6-(1-пирролидиния)карбониламиноиндан-1- илметил] пиперидин, 6в, т. пл. 190-193oC (промыт диэтиловым эфиром).
1H ЯМР (CDCl3): δ 1,65-2,55 (м, 14H); 2,65 (дд, 1H); 2,75-2,90 (м, 2H); 3,00 (широкий д, 1H); 3,15 (широкий д, 1H); 3,35 (кв, 1H); 3,45 (т, 4H); 6,15 (с, 1H); 6,95 (т, 2H); 7,00-7,10 (м, 2H); 7,20 (дд, 2H); 7,50 (с, 1H).
Пример 7 (способ a)
1-(6-Аминокарбониламиноиндан-1-илметил)-4-(4-фторфенил) пиперидин,
гемифумарат, 7а.
Раствор изоцианата калия (1,5 г), растворенного в дихлорметане (20 мл), охлаждают до 5oC и добавляют по каплям раствор трифторуксусной кислоты (1,9 г) в дихлорметане (20 мл). К образовавшейся смеси добавляют по каплям раствор 1-(6-аминоиндан-1-илметил)-4-(4-фторфенил)пиперидина, 2а (3 г) в дихлорметане (10 мл). Температуре дают возможность подняться до комнатной температуры. После перемешивания в течение еще 3 ч, смесь выливают на лед (500 г) и добавляют разбавленный водный NH4OH до достижения pH > 9. Органическую фазу отделяют и обрабатывают, как указано выше. Сырой названный продукт очищают колоночной хроматографией на силикагеле (элюируют 4%-ным триэтиламином в смеси 1: 3 этанол/этилацетат). Очищенный продукт (2 г) растворяют в ацетоне (20 мл) и добавляют к раствору фумаровой кислоты (0, 6 г) в этаноле (20 мл). Высадившуюся соль гемифумарата отфильтровывают и сушат. Выход 1,6 г, т. пл. 172-174oC.
1H ЯМР (ДМСО-d6): δ 1,65-1,90 (м, 5H); 2,10-2,35 (м, 3H); 2,45-2,90 (м, 5H); 3,10-3,25 (м, 2H); 3,45 (кв, 1H); 6,85 (с, 2H); 6,60 (с, 1H); 7,00-7,15 (м, 4H); 7,30 (дд, 2H); 7,45 (с, 1H); 8,45 (с, 1H).
Пример 8
5-Хлор-3-(1,2,3,6-тетрагидропиридин-4-ил)-1H-индол, 8а.
Смесь 5 хлоро-1H-индола (25 г), пиперидин-4-он, гидрата, гидрохлорида (71 г), и гидроксида калия (38 г) в этаноле (450 мл) кипятят c обратным холодильником в течение 6 ч. После охлаждения неорганические соли отфильтровывают и этанол испаряют в вакууме. К оставшемуся маслу добавляют соляной раствор (500 мл) и этилацетат (2 x 200 мл). Органическую фазу отделяют и обрабатывают, как указано выше. Выход неочищенного названного продукта: 45 г (полукристаллический).
Соответствующим способом получают следующие 3-(1,2,3,6-тетрагидропиридин-4-ил)-1H-индолы.
6-Хлор-3-(1,2,3,6-тетрагидропиридин-4-ил)-1H-индол, 8б.
5-Фтор-3-(1,2,3,6-тетрагидропиридин-4-ил)-1H-индол, 8в.
Пример 9
5-Хлор-3-(4-пиперидинил)-1H-индол, 9а.
Неочищенный 5-хлор-3-(1,2,3, 6-тетрагидропиридин-4-ил)-1H-индол, 8а (26 г) растворяют в ледяной уксусной кислоте (330 мл) и добавляют PtO2 (0,7 г). Смесь гидрируют в аппарате Парра при 3 атм в течение 5 ч. Катализатор отфильтровывают и избыток уксусной кислоты удаляют в вакууме. Добавляют воду и pH доводят до > 9 путем добавления разбавленного водного NH4OH. Экстракция этилацетатом (2 x 200 мл) и обработка объединенных органических фаз дает 19 г неочищенного названного соединения в виде вязкого масла.
Соответствующим способом получают следующие 3-(4-пиперидинил)-1H-индолы.
6-Хлор-3-(4-пиперидинил)-1H-индол, 9б.
5-Фтор-3-(4-пиперидинил)-1H-индол, 9в.
Пример 10
3-[1-(5-Амино-2,
3-дигидробензотиофен-3-илметил)пиперидин-4-ил] -5-хлор-1H-индол, 10a.
5-Нитро-3-бензотиофенкарбоновую кислоту 1б (20 г) превращают в соответствующий хлорангидрид карбоновой кислоты, как в примере 2. Хлорангидрид кислоты растворяют в ТГФ (200 мл) и по каплям добавляют в раствор 5-хлоро-3-(4-пиперидинил-1H-индола, 9а (19 г) и триэтиламина (10 мл) в ТГФ (200 мл) при 0-5o C. Смесь перемешивают в течение ночи при комнатной температуре. ТГФ выпаривают. К оставшемуся маслу добавляют воду. Экстракция дихлорметаном (2 x 100 мл) и обработка органических экстрактов приводит к получению неочищенного амида 5-нитро-3-бензотиофенкарбоновой кислоты, который последовательно очищают колоночной хроматографией на силикагеле (элюируют смесью этилацетат/гептан 1: 1). Выход 6,6 г, т.пл. 243-250oC. Весь амид растворяют в 90%-ном этаноле при кипячении с обратным холодильником. Fe-порошок (5 г) и концентрированную водную HCl добавляют последовательно небольшими порциями в течение 10 мин. Полученную смесь кипятят с обратным холодильником в течение еще 2,5 ч. Неорганические соли отфильтровывают, и этанол испаряют в вакууме. Добавляют воду к оставшемуся маслу и доводят pH до > 9 добавлением разбавленного водного NH4OH. Экстракция дихлорметаном (2 x 100 мл) и последующая обработка органической фазы дает 4 г амида 5-амино-3-бензотиофенкарбоновой кислоты в виде масла. Все это масло растворяют в метаноле (100 мл), добавляют 0,5 г Mg стружки. При нагревании до 35oC начинается экзотермическая реакция. Mg стружки добавляют небольшими порциями (3 x 0,5 г), поддерживая температуру ниже 45oC. Наконец смесь выливают в водный раствор NH4Cl и добавляют концентрированную водную HCl (1 мл). Экстракция дихлорметаном (2 x 50 мл) и обработка органических экстрактов, как указано выше, приводит к получению 2 г амида 5-амино-2,3-дигидробензотиофен-3- карбоновой кислоты в виде масла. К суспензии LiAlH4 (0,6 г) в сухом ТГФ (50 мл) добавляют по каплям раствор всего карбоксамида в ТГФ (50 мл). Смесь нагревают при слабом кипячении с обратным холодильником в течение 2 ч. После охлаждения до 10oC воду (2,4 мл) и 15%-ный водный раствор NaOH осторожно добавляют, чтобы разрушить избыток LiAlH4. Неорганические соли отфильтровывают и тщательно промывают ТГФ. Объединенные ТГФ растворы выпаривают, получая 1,9 г 3-[1-(5-амино-2, 3-дигидробензотиофен-3-илметил) пиперидин-4-ил] -5-хлор-1H-индола в виде масла.
Аналогичным
способом получают следующие производные анилина:
3-[1-(5-амино-2,
3-дигидробензотиофен-3-илметил)- 1,2,3,6-тетрагидропиридин-4-ил]-5-хлор-1H-индол, 10б в виде масла;
3-[1-(5-амино-2,
3-дигидробензотиофен-3-илметил)-1,2,3,
6-тетрагидропиридин-4-ил]-5-фтор-1H-индол, 10в в виде масла.
Соответствующие 1-(6-аминоиндан-1-илметил)-замещенный 4-(3-индолилпиперидины и
4-(3-индолил)-1,2,3,6-тетрагидропиридины
получают из соответствующих 1-инданкарбоксамидов, которые последовательно подвергают нитрованию в 6-положение, восстановлению нитрозаместителя и
восстановлению карбонильной группы карбоксамида.
Последовательность реакций в общих чертах описана в примере 3. Получают следующие производные индана:
3-[1-(6-Аминоиндан-1-илметил)пиперидин-4-ил]-5-фтор-1H-индол, 10г в виде масла;
3-[1-(6-Аминоиндан-1-илметил)пиперидин-4-ил]-6-хлор-1H-индол, 10д в виде масла;
3-[1-(6-Аминоиндан-1-илметил)-1,2,3,6-тетрагидропиридин-4-ил] -5-хлор-1H-индол, 10е в виде масла;
3-[1-(6-Аминоиндан-1-илметил)-1,2,3,6-тетрагидропиридин-4-ил] -6-хлор-1H-индол, 10ж в виде
масла;
1-[1-(6-Аминоиндан-1-илметил)пиперидин-4-ил]-5-хлор-1H-индол, 10a в виде масла.
Пример 11
3-[1-(5-Ацетиламино-2,
3-дигидробензотиофен-3-илметил)-пиперидин-4-ил] -5-хлоро-1H-индол, оксалат, 11а.
К раствору 3-[1-(5-Амино-2, 3-дигидробензотиофен-3-илметил-4-ил] -5-хлор-1H-индол, 10а (1,9 г) и триэтиламина (2 мл) в дихлорметане (50) мл), поддерживаемого при 0oC, добавляют по каплям раствор ацетилхлорида (0,4 г) в дихлорметане (10 мл). Смесь перемешивают при комнатной температуре в течение 2 ч. Добавляют воду и органическую фазу обрабатывают, как указано выше. Неочищенное названное соединение очищают колоночной хроматографией на силикагеле (элюируют 4%-ным триэтиламином в этилацетате). Выход 0,8 г. Оксалатную соль названного соединения кристаллизуют из 1:1 смеси ацетона и этанола. Т. пл. 168-174oC.
1H ЯМР (ДМСО-d6): δ 2,00 (с, 3H); 1,95-2,15 (м, 4H); 2,85-3,25 (м, 5H); 3,40-3,50 (м, 2H); 3,55-3,70 (м, 2H); 3,90-4,00 (м, 1H); 7, 00-7,40 (м, 6H); 7,70 (с, 1H); 7,70 (широкий с, 2H); 9,95 (широкий с, 1H); 11, 10 (широкий с, 1H).
Аналогичным способом получают следующие производные индола.
3-[1-(5-Ацетиламино-2,3-дигидробензотиофен-3-илметил)-1,2,3, 6-тетрагидропиридин-4-ил]-5-хлор-1H-индол, оксалат, 11б. т. пл. 214-216oC (этанол).
1H ЯМР (ДМСО-d6): δ 2,00 (с, 3H); 2,75 (широкий с, 2H); 2, 95-3,40 (м, 5H); 3,50-3,80 (м, 3H); 3,95 (широкий с, 1H); 6,15 (широкий с, 1H); 7,15 (т, 2H); 7,25 (д, 1H); 7,45 (д, 1Н); 7,60 (с, 1H); 7,65 (с, 1H); 7,85 (с, 1H); 9,95 (с, 1H); 11,50 (с, 1H).
3-[1-(6-Ацетиламиноиндан-1-илметил)пиперидин-4-ил] -5-фтор- 1H-индол, оксалат, 11в, т.пл. 145-149oC (ацетон).
1H ЯМР (ДМСО-d6): δ 2, 70-2,90 (м, 2H); 2,95-3,20 (м, 3H); 3,35 (д, 1H); 3,50-3,80 (м, 3H); 6,95 (дт, 1H); 7,15 (д, 1H); 7,25 (с, 1H); 7,30 (д, 1H); 7,40 (дд, 1H); 7,45 (дд, 1H); 7,70 (с, 1H); 9,95 (с, 1H); 11,05 (с, 1H).
3-[1-(5-Ацетиламино-2,3-дигидробензотиофен-3-илметил)-1,2,3,6- тетрагидропиридин-4-ил]-5-фтор-1H-индол, оксалат, 11г, т.пл. 155-165oC (ацетон).
1H ЯМР (ДМСО-d6): δ 2,00 (с, 3H); 2,75 (широкий с, 2H); 2,95-3,45 (м, 5H); 3,50-3,80 (м, 3H); 3,95 (широкий с, 1H); 6,15 (широкий с, 1H); 6,95 (т, 1H); 7,20 (д, 1H); 7,30 (д, 1H); 7,45 (м, 1H); 7,55-7,70 (м, 3H); 9,95 (с, 1H); 11,45 (с, 1H).
3-[1-(6-Ацетиламиноиндан-1-илметил)-1,2,3, 6-тетрагидропиридин-4-ил] -6-хлор-1H-индол, оксалат полугидрат 11д, т.пл. 151-164oC (ацетон).
1H ЯМР (ДМСО-d6): δ 1,95-2,10 (м, 1H); 2,00 (с, 3H); 2,30-2,45 (м, 1H); 2,70-2,90 (м, 4H); 3,15 (т, 1H): 3,35-3,50 (м, 3H); 3,55-3,70 (м, 1H); 3,95 (широкий с, 2H); 6,15 (с, 1H); 7,05 (дд, 1H); 7,15 (д, 1H); 7,25 (д, 1H); 7,45 (д, 1H); 7,55 (д, 1H); 7,60 (с, 1H); 7,85 (д, 1H); 9,95 (с, 1H); 11,55 (с, 1H).
3-[1-(6-Ацетиламиноиндан-1-илметил)пиперидин-4-ил] -6-хлор- 1H-индол, оксалат, 11е, т.пл. 122-130oC (ацетон).
1H ЯМР (ДМСО-d6): δ 1,90-2,15 (м, 6H); 2,00 (с, 3H); 2,25-2,40 (м, 1H); 2,70-3,10 (м, 6H); 3,35 (д, 1H); 3,45-3,65 (м, 2H); 7,00 (дд, 1H); 7,15-7,25 (м, 2H); 7,30 (д, 1H); 7,40 (с, 1H); 7,60-7,70 (м, 2H); 9,90 (с, 1H); 11,05 (c, 1H).
3-[1-(6-Ацетиламиноиндан-1-илметил)-1,2,3,6-тетрагидропиридин-4-ил] -5-хлор-1H-индол, оксалат 11ж, т.пл. 220-223oC (ацетон/этанол 5:1).
1H ЯМР (ДМСО-d6): δ 1,95-2,10 (м, 1H); 2,00 (с, 3H); 2,30-2,45 (м, 1H); 2,70-2,95 (м, 4H); 3,10 (т, 1H); 3,30-3, 45 (м, 3H); 3,55-3,70 (м, 1H); 3,85 (широкий с, 2H); 6,15 (с, 1H); 7, 10-7,20 (м, 2H); 7,30 (д, 1H); 7,45 (д, 1H); 7,60-7,70 (м, 2H); 7,85 (с, 1H); 9,90 (с, 1H); 11,50 (с, 1H).
3-[1-(6-Ацетиламиноиндан-1-илметил)пиперидин-4-ил]-5-хлор-1H-индол, 11з, т.пл. 189-191oC (этилацетат).
1H ЯМР (CDCl3): δ 1,80-2,00 (м, 1H); 2, 05-2,40 (м, 7H); 2,20 (с, 3H); 2,50 (дд, 1H); 2,65 (дд, 1H); 2,80-2,95 (м, 2H); 3,15 (широкий т, 2H); 3,35 (кв, 1H); 4,20-4,30 (м, 1H); 6,45 (д, 1H); 7,20-7,35 (м, 4H); 7,30-7,40 (м, 2H); 7,60 (д, 1H); 7,70 (широкий с, 1H).
Пример 12 (способ е)
4-(4-Фторфенил)-1-[6-(1-пирролидин-2-онил)индан-1-илметил] пиперидин, фумарат, 12а.
К раствору 1-(6-аминоиндан-1-илметил)-4-(4-фторфенил)пиперидина, 2а (3 г) и триэтиламина (2 мл) в дихлорметане (50 мл) при 0oC добавляют по каплям раствор хлорангидрида 4-хлормасляной кислоты (1,4 г) в дихлорметане (15 мл). Наконец смесь перемешивают в течение 5 ч при комнатной температуре. Добавляют охлажденный льдом разбавленный водный раствор NaOH и органическую фазу последовательно обрабатывают, как указано выше. Сырой 1-[6-(4-хлорбутаноиламино)индан-1-илметил] -4-(4-фторфенил)пиперидин очищают колоночной хроматографией на силикагеле (элюируют 4%-ным триэтиламином в 1:3 смеси этилацетата и гептана). Выход кристаллического продукта: 2,4 г с т. пл. 129-135oC (промытый диэтиловым эфиром). Раствор выделенного таким образом производного 4-хлорбутаноила (1 г) и трет-бутоксида калия (0,4 г) в сухом ТГФ (40 мл) кипятят с обратным холодильником в течение 2 ч. ТГФ испаряют в вакууме. Добавляют разбавленный водный NH4OH и дихлорметан и органическую фазу затем обрабатывают, как указано выше. Оставшееся масло (1 г) растворяют в ацетоне (10 мл) и добавляют к горячему раствору фумаровой кислоты (0,3 г) в этаноле (15 мл). После охлаждения в холодильнике на протяжении ночи высадившуюся фумаратную соль отфильтровывают и сушат. Выход 0,7 г, т. пл. 177-179oC.
1H ЯМР (ДМСО-d6): δ 1,70-1, 90 (м, 5H); 2,10 (кв, 2H); 2,20-2,40 (м, 3H); 2,45-2,65 (м, 4H); 2,70-2,95 (м, 3H); 3,20 (широкий т, 2H); 3,40 (кв, 1H); 3,70-3,90 (м, 2H); 6,60 (с, 2H); 7,15 (т, 2H); 7,20 (д, 1H); 7,30 (дд, 2H); 7, 40 (дд, 1H); 7,65 (с, 1H).
Пример 13
(+)-6-Hитро-1-инданкарбоновая кислота, 13а.
Раствор 6-нитро-1-инданкарбоновой кислоты (1a) (96 г) и бруцин гидрата (200 г) нагревают в ацетоне (1,25 л) до тех пор, пока не получат прозрачный раствор. Раствор оставляют на ночь в холодильнике. Высадившуюся соль бруцина отфильтровывают. Выход: 159,1 г. Перекристаллизацией из 2-пропанола получают 103 г чистой соли бруцина (+)-6-Нитро-1-инданкарбоновой кислоты. Соль растворяют в воде и добавляют разбавленную хлористоводородную кислоту. Экстракция диэтиловым эфиром и обработка, как указано выше, дает 29,8 г названного соединения 13а. Т.пл. 92-94oC [α]D= +83,3o (с = 1, метанол).
Пример 14
(+)-1-(6-Ацетиламиноиндан-1-илметил)-4-(4-фторфенил)пиперидин,
14а.
(+)-Энантиомер соединения 4а получают из (+)-6-нитро-1-инданкарбоновой кислоты, 13а согласно способам в примерах 2 и 4. Т. пл. 145-146oC.
1 H ЯМР (CDCl3): δ 1,70-1,90 (м, 5H); 2,00-2,15 (м, 1H); 2,15 (с, 3H); 2,20-2,30 (м, 1H); 2,35-2,50 (м, 2H); 2,60 (дд, 1H); 2,70-2,90 (м, 2H); 2,95-3,15 (м, 2H); 3,45 (кв, 1H); 6,95 (т, 2H); 7,05-7,25 (м, 5H); 7,55 (с, 1H). [α]D= +24,3o (c = 1, метанол).
Пример 15
3-[1-(6-Ацетиламиноиндан-1-илметил)-1,2,3,
6-тетрагидропиридин-4-ил] -6-хлоро-1-метил-1H-индол, 15а.
3-[1-(6-Нитроиндан-1-илкарбонил)-1,2,3,6-тетрагидропиридин-4-ил] -6-хлоро-1H-индол (23 г), полученный согласно способу в примере 10, растворяют в сухом ДМФ (300 мл) и добавляют трет-бутоксид калия (7,3 г) при 10oC. По каплям добавляют в течение 30 мин метилиодид (23,2 г). Смесь оставляют на ночь при комнатной температуре. Добавляют воду и диэтиловый эфир и органическую фазу обрабатывают, как указано выше. Неочищенный N-метилированный индол очищают колоночной хроматографией на силикагеле (элюируют смесью 1:1 этилацетата и гептана). Выход 2,75 г. Восстановление нитрогруппы Fe в 90%-ном подкисленном этаноле с последующим восстановлением карбонильной группы амида и, наконец, ацилирование анилиновой группы согласно способу в примерах 10 и 11 дает названное соединение 15а. Т. пл. 189-193oC, промыто диэтиловым эфиром).
1 H ЯМР (CDCl3): δ 1,80 (широкий с, 1H); 1,80-1,95 (м, 1H); 2,10 (с, 3H); 2,25-2,40 (м, 1H); 2,50-2,60 (м, 3H); 2,70-2,95 (м, 5H); 3,25 (широкий с, 2H); 3,40 (кв, 1H); 3,70 (с, 3H); 6, 15 (широкий с, 1H); 7,00 (с, 1H); 7,10 (дд, 1H); 7,15 (д, 1H); 7,20-7,30 (м, 3H); 7,50 (с, 1H); 7,80 (д, 1H).
Каталитическое гидрирование соединения 15а согласно способу в примере 9
дает:
3-[1-(6-ацетиламиноиндан-1-илметил)пиперидин-4-ил] -6-хлор-1-метил-1H-индол, оксалат 15б, т. пл. 202-205oC (ацетон).
1H ЯМР (ДМСО-d6): δ 1,90-2, 15 (м, 5H); 2,00 (с, 3H); 2,30-2,40 (м, 1H); 2,70-3,15 (м, 6H); 3,35 (д, 1H); 3,50-3,70 (м, 2H); 3,75 (с, 3H); 7,00 (дд, 1H); 7,10-7,30 (м, 3H); 7,55 (д, 1H); 7,65 (с, 1H); 7,65 (д, 1H); 9,90 (с, 1H).
Пример 16 (способ f)
4-(4-Фторфенил)-1-(6-метиламиноиндан-1-илметил)пиперидин, 1,5 оксалат 16а.
К раствору 4-(4-фторфенил)-1-(6-метиламиноиндан-1-илметил)пиперидина, 2а (4 г) и триэтиламина (3 мл) в дихлорметане добавляют по каплям при 0-5oC раствор этил хлорформиатя (1,5 г) в дихлорметане (15 мл). Смесь перемешивают при комнатной температуре в течение 2 ч и выливают в насыщенный соляный раствор (500 мл). Органическую фазу отделяют и обрабатывают, как описано, ранее. Выход этил карбамата в виде масла 4,3 г. К суспензии LiAlH4 (1,2 г) в сухом диэтиловом эфире (20 мл) при 5oC добавляют по каплям раствор всего этил карбамата в сухом ТГФ (25 мл). Смесь перемешивают в течение еще одного часа при 5oC и, наконец, при комнатной температуре в течение 5 ч. Избыток LiAlH4 разрушают осторожным добавлением воды и разбавленного водного раствора NaOH (6 мл). Высадившиеся неорганические соли отфильтровывают и растворители испаряют в вакууме. Сырое названное соединение очищают колоночной хроматографией на силикагеле (элюируют смесью 1:1 гептана и этилацетата). Выход 1,5 г в виде масла, 1,5 г оксалатной соли 16а кристаллизуют из смеси 1:1 ацетона и этанола. Т. пл. 84-86oC.
1H ЯМР (ДМСО-d6): δ 1,75-2,10 (м, 5H); 2,20-2,40 (м, 1H); 2,60 (с, 3H); 2,60-2,90 (м, 3H); 3,00-3,15 (м, 3H); 3,40-3,80 (м, 4H); 6,40 (дд, 1H); 6,50 (д, 1H); 6,95 (д, 1H); 7,15 (т, 2H); 7,35 (дд, 2H).
Пример 17
5-Хлор-1-(4-пиперидинил)-1H-индол, 17a.
К раствору 5-хлор-1H-индола (20 г) в N-метил-2-пирролидоне (450 мл) добавляют карбонат калия (82 г), CuBr (7,5 г) и Cu бронза (3 г). Смесь нагревают до 140oC и (добавляют) 4-бромпиридин, гидрохлорид (22 г). Смесь нагревают в течение 1 ч при 150oC и добавляют еще 4-бромпиридин, гидрохлорид (15 г). Эту процедуру повторяют дважды и смесь, наконец, нагревают в течение ночи при 150oC. После охлаждения высадившиеся неорганические соли отфильтровывают. Добавляют воду (2 л), этилацетат (500 мл) и разбавленный водный аммиак (500 мл). Нерастворившееся вещество отфильтровывают и отбрасывают. Органическую фазу обрабатывают, как указано ранее, получая 34 г 5-хлор-1-(4-пиридил)-1H-индол с т. пл. 153-155oC. Весь продукт без дальнейшей очистки растворяют в диметоксиэтане (350 мл) при 60-70oC. Добавляют метилиодид (14 мл) и смесь кипятят с обратным холодильником в течение 7 ч. После охлаждения высадившуюся кватернизованную соль пиридиния отфильтровывают и промывают диметоксиэтаном. Выход 32 г. Т. пл. 257-260oC. Всю соль пиридиния суспендируют в этаноле (450 мл) и воде (50 мл). Добавляют NaBH4 (16 г) небольшими порциями на протяжении 1,5 ч при перемешивании. После перемешивания в течение еще 1,5 ч большую часть этанола испаряют в вакууме при комнатной температуре. Добавляют этилацетат (300 мл) и воду (500 мл) и органическую фазу обрабатывают, как указано ранее. Выход 5-хлор-1-(1-метил-1,2,3, 6-тетрагидро-4-пиридинил)-1H-индола; 17 г в виде масла. К раствору производного тетрагидропиридинила (15 г) в ледяной уксусной кислоте (150 мл) добавляют PtO2 и смесь гидрируют в аппарате Парра при 3 атм в течение 7 ч. Катализатор отфильтровывают, большую часть уксусной кислоты испаряют в вакууме и, наконец, неочищенный 5-хлоро-1-(1-метил-4-пиперидинил)-1H-индол экстрагируют этилацетатом из щелочного водного раствора. Выход 13 г в виде масла. Всю оставшуюся воду в этом неочищенном продукте (10 г) удаляют перегонкой с толуолом. Наконец, масло растворяют в 1,1, 1-трихлорэтане (200 мл). При кипячении с обратным холодильником добавляют по каплям 2,2,2- трихлорэтилхлорформиат (6,5 мл), растворенный в 1,1,1-трихлорэтане (20 мл). Смесь кипятят с обратным холодильником еще в течение 2 ч, добавляют карбонат натрия (2 г) и продолжают кипячение в течение 0,5 ч. После охлаждения смесь фильтруют через силикагель (элюируют дихлорметаном). Выход 10 г неочищенного производного карбамата. К раствору карбамата (6 г) в 90%-ной водной уксусной кислоте (110 мл) добавляют тонко измельченный порошок Zn (12 г) небольшими порциями при 45oC в течение 1 ч. Смесь нагревают еще в течение часа при 50oC. Zn-соли отфильтровывают и большую часть уксусной кислоты испаряют в вакууме. Оставшееся масло растворяют в воде (200 мл) и этилацетате (200 мл). pH водной фазы доводят до pH > 9 добавлением разбавленного водного аммиака. Органическую фазу, наконец, обрабатывают, как указано ранее, получая 3,5 г неочищенного названного продукта 17а в виде масла, которое используют без дальнейшей очистки для получения соединения 10з.
Пример 18
1-(6-Ацетиламиноиндан-1-илметил)-4-ацетилокси-4-(3-трифторметил-4-хлорфенил)пиперидин, 18а.
К раствору 1-(6-аминоиндан-1-илметил)-4-гидрокси-4-(3-трифторметил-4-хлорфенил) пиперидина, 2к, (6,7 г) и триэтиламина (4 мл) в дихлорметане (100 мл) добавляют по каплям при 0-5oC раствор хлорацетилхлорида (2,6 мл) в дихлорметане (50 мл). Смесь перемешивают на протяжении ночи при комнатной температуре. Добавляют воду и доводят pH до > 9. Органическую фазу отделяют и обрабатывают, как указано ранее. Сырой продукт очищают колоночной хроматографией на силикагеле (элюируют 4%-ным триэтиламином в этилацетате). Выход чистого 18а 6,2 г в виде масла.
Пример 19
5-Хлоро-1-[1-(6-метиламинокарбониламиноиндан-1-илметил)-пиперидин-4-ил]
-1H-индол,
19а.
К раствору 1-[1-(6-аминоиндан-1-илметил)пиперидин-4-ил]-5-хлоро-1H-индола, 108 (0,9 г) в дихлорметане (10 мл) добавляют метилизоцианат (0,2 мл). Смесь перемешивают при комнатной температуре в течение 16 ч. Дихлорметан испаряют. После добавления этилацетата названное соединение 19а кристаллизуют. Кристаллический продукт отфильтровывают и сушат на протяжении ночи при 80oC в вакууме. Выход 0,6 г. Т. пл. 193-195oC.
1H ЯМР (ДМСО-d6): δ 1,70-1,85 (м, 1H); 1,90-2,35 (м, 7H); 2,35-2,85 (м, 4H); 2,65 (д, 3H); 3, 05-3,15 (м, 2H), 3,25, (кв, 1H); 4,35-4,45 (м, 1H); 5,95 (дт, 1H); 6,45 (д, 1H); 7,00-7,20 (м, 3H); 7,50-7,65 (м, 4H); 8,35 (с, 1H).
Фармакологические испытания
Соединения
изобретения были испытаны согласно хорошо известным и надежным способам. Хорошо известный MDL100,907, антагонист 5-HT2A, и хорошо известный буспирон, антагонист 5-HT1A
, включены
в тесты в качестве ссылочных соединений. Испытания были проведены как указано ниже и их результаты даны в таблице.
Ингибирование3H-8-OH-DPAT связывания с серотониновыми 5-HT1A рецепторами в головном мозге крысы in vitro.
С помощью этого способа определяют in vitro ингибирование лекарственными средствами связывания 5-HT1A агониста3H-8-OH-DPAT (1 нМ) с 5-HT1A рецепторами в мембранах из головного мозга крысы минус мозжечок. Таким образом, это является тестом на сродство к 5-HT1A рецептору. Тест проводят, как описано Hyttel et al., Drug. Dev. Res. 1988, 15-389-404.
Ингибирование связывания3H-Кетансерина с 5-HT2 рецепторами в коре головного мозга крысы in vitro.
С помощью этого способа определяют in vitro ингибирование лекарственными средствами связывания3H-Кетансерина (0,5 нМ) с 5-HT2A рецепторами в мембранах крысы. Этот способ описан J. Hyttel, Pharmacology & Toxicology, 61, 126-129, 1987.
Помимо вышеупомянутых тестов соединения по данному изобретению были испытаны в отношении сродства к допаминовому D2 рецептору путем определения их способности ингибировать связывание3H-спироперидола с D2 рецепторами по способу Hyttel et al., J. Neurochem., 1985, 44, 1615. Кроме того, они были испытаны в отношении их ингибирующего действия 5-HT повторного поглощения путем измерения их способности ингибировать поглощение3 H-серотонина в синапсомах головного мозга крысы in vitro по способу, описанному Hyttel and Larsen, Acta Pharmacol. Tox., 1985, 56, suppl. 1, 146-153.
В целом соединения данного изобретения, как установлено, сильно ингибируют как связывание третированного 8-гидрокси-2-дипропиламинотетралина (8-OH-DPAT) с 5-HT1A рецепторами, так и связывание3 H-кетансерина с 5-HT2A рецепторами in vitro. Некоторые соединения связывают только один из двух подтипов серотонинового рецептора, 5-HT1A или 5-HT2A. В дополнение к этим воздействиям ряд соединений, как доказано, обладают дополнительным преимуществом сильного ингибирующего действия 5-HT повторного поглощения. Так, например, соединения, в которых R1 является ацетилом, R2 является H и Ar представляет 3-индолил, замещенный галоидом в 6-положении или 5-положении, или соединения, в которых Ar является фенилом, замещенным Cl в 4-положении, демонстрируют IC50 значения в более низкой наномолярной области (1-65 нМ).
В соответствии с этим соединения по изобретению, как полагают, являются полезными для лечения позитивных и негативных симптомов шизофрении, других психозов, состояний страха, таких как заболевания, вызванные состоянием страха, состоянием паники, и навязчивых компульсивных заболеваний, депрессии, злоупотребления алкоголем, заболеваний, связанных с мотивационным контролем, агрессии, побочных действий, вызванных обычными антипсихотическими средствами, состояний ишемической болезни, мигрени, старческого слабоумия и сердечно-сосудистых нарушений, и для улучшения сна.
Примеры приготовления лекарственного средства.
Фармацевтические формуляции изобретения могут быть получены обычными для данной области способами.
Например, таблетки могут быть получены путем смешения активного ингредиента с обычными адъювантами и/или разбавителями и затем прессования смеси в обычной таблетирующей машине. Примерами адъювантов или разбавителей являются: кукурузный крахмал, картофельный крахмал, тальк, стеарат магния, желатин, лактоза, смолы, и т.п. Некоторые другие адъюванты или добавки, обычно используемые для таких целей, такие как красители, отдушки, консерванты и т. д. , могут быть использованы при условии, что они совместимы с активными ингредиентами.
Растворы для инъекций могут быть получены путем растворения активного ингредиента и возможных добавок в части раствора для инъекции, предпочтительно стерильной воде, доведения раствора до требуемого объема, стерилизации раствора и заполнения подходящих ампул или флаконов. Может быть добавлена любая подходящая добавка, обычно используемая в данной области, такая как тонизирующие агенты, консерванты, антоксиданты, и т.д.
Типичными примерами рецептов формуляции изобретения являются следующие.
1) Таблетки, содержащие 5,0 мг соединения 4а в расчете на свободное основание:
Соединение 4а - 5,0 мг
Лактоза - 60 мг
Кукурузный крахмал - 30 мг
Гидроксипропилцеллюлоза - 2,4 мг
Микрокристаллическая целлюлоза - 19,2 мг
Натрий кроксамелоза Тип А - 2,4 мг
Стеарат магния - 0,84 мг
2) Таблетки, содержащие 0,5
мг
соединения 4г в расчете на свободное основание:
Соединение 4a - 0,5 мг
Лактоза - 46,9 мг
Кукурузный крахмал - 23,5 мг
Повидон - 1,8 мг
Микрокристаллическая
целлюлоза - 14,4 мг
Натрий кроксамелоза Тип А - 1,8 мг
Стеарат магния - 0,63 мг
3) Сироп, содержащий на 1 мл:
Соединение 11e - 25 мг
Сорбит - 500 мг
Гидроксипропилцеллюлоза - 15 мг
Глицерин - 50 мг
Метил-парабен - 1 мг
Пропил-парабен - 0,1 мг
Этанол - 0,005 мл
Отдушка - 0,05
мг
Сахарин
натриум - 0,5 мг
Вода - До 1 мл
4) Раствор для инъекций, содержащий на 1 мл:
Соединение 4a - 0,5 мг
Сорбит - 5,1 мг
Уксусная кислота
- 0,08 мг
Вода для инъекции - До 1 мла
Реферат
Описываются новые производные 4-арил-1-(инданметил или дигидробензотиофенметил)пиперидина, -тетрагидропиридина или пиперазина формулы I, где значения R1-R8, Ar, X, Y, Z указаны в п.1 формулы, действующие на центральные серотонинергические рецепторы. Они находят применение в виде фармацевтических композиций при лечении некоторых психических и неврологических заболеваний. 2 с. и 9 з.п.ф-лы, 1 табл.

Формула
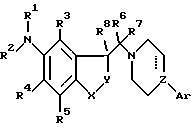
где один из X и Y представляет CH2, а другой выбран из группы, включающей CH2 и S;
пунктирная линия, исходящая от Z, указывает на необязательную связь; когда связь не указана,
Z представляет N, CH или COH, причем группа OH может быть необязательно этерифицирована, а когда связь указана, Z представляет С;
Ar представляет фенил, 1-индолил, 2-индолил, 3-индолил, 1-индол-2-онил, 3-индол-2-онил, 1-нафтил или 2-нафтил, причем каждый необязательно замещен галоидом, низшим алкилом, низшим алкокси, трифторметилом или C1-C2-алкилендиокси;
R1 представляет водород, низший алкил, ацил, низший алкилсульфонил;
R1 является группой R9VCO, где V представляет O и R9 представляет низший алкил, циклоалкил, циклоалкил-низший алкил или фенил, или
R1 является группой R10R11NCO или R10R11NCS, где R10 и R11 являются, независимо, водородом, низшим алкилом, циклоалкилом, циклоалкил-низшим алкилом или фенилом или R10 и R11, вместе с N-атомом, к которому они присоединены, образуют пирролидинильную группу;
R2 представляет водород, низший алкил;
или R1 и R2, вместе с N-атомом, с которым они связаны, образуют группу

где Q представляет C=O или CH2;
T представляет NH или CH2;
m = 1-4 включительно;
R3 - R5 представляют, независимо, водород, галоид, низший алкил, циклоалкил-низший алкил или нитро;
R6 и R7 являются, каждый, водородом или низшим алкилом или они связаны вместе с образованием 3-7членного карбоциклического кольца;
R8 является водородом или низшим алкилом,
причем любая присутствующая алкильная, циклоалкильная или циклоалкилалкильная группа необязательно замещена одной или двумя гидроксигруппами и любой присутствующий фенильный заместитель в R9, R10 или R11 необязательно замещен галогеном, низшим алкилом, низшим алкокси,
и его фармацевтически приемлемая соль присоединения кислоты.

Комментарии