Производные циклопропил-β-аминокислоты - RU2312853C2
Код документа: RU2312853C2
Описание
Настоящее изобретение относится к новым производным циклопропил-β-аминокислоты, фармацевтическим композициям, содержащим указанные соединения, и применению указанных композиций для лечения различных расстройств центральной нервной системы и прочих нарушений. Производные циклопропил-β-аминокислоты по настоящему изобретению проявляют активность как альфа-2-дельта-лиганды (α2δ-лиганд). Такие соединения обладают сродством к α2δ-субъединице кальциевого канала. Такие соединения упоминаются также в литературе как аналоги гамма-аминомасляной кислоты (GABA).
Некоторые альфа-2-дельта-лиганды известны. Габапентин, циклический альфа-2-дельта-лиганд, имеется в настоящее время в продаже (Neurontin®, Warner-Lambert Company) и широко используется клинически для лечения эпилепсии и невропатической боли. Такие циклические альфа-2-дельта-лиганды описаны в патенте США № 4024175, опубликованном 17 мая 1977 г., и патенте США № 4087544, опубликованном 2 мая 1978 г. Другие серии альфа-2-дельта-лигандов описаны в патенте США № 5563175, опубликованном 8 октября 1996 г., патенте США № 6316638, опубликованном 13 ноября 2001 г., предварительной патентной заявке США 60/353632, поданной 31 января 2002 г., европейской патентной заявке EP 1112253, опубликованной 4 июля 2001 г., PCT-патентной заявке WO 99/08671, опубликованной 25 февраля 1999 г., и PCT-патентной заявке WO 99/61424, опубликованной 2 декабря 1999 г. Указанные патенты и патентные заявки полностью включены в описание в качестве ссылок.
Настоящее изобретение относится к производным циклопропил-β-аминокислоты формулы I
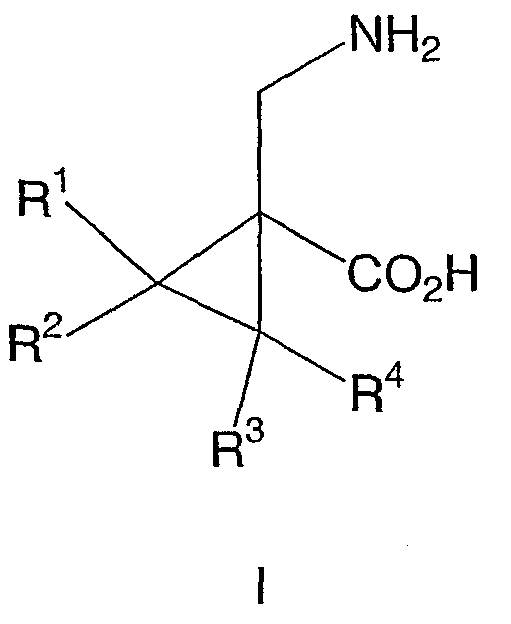
где R1 и R2 выбирают независимо из группы, включающей водород, (C1-C10)-линейный или разветвленный алкил, (C1-C10)-линейный или разветвленный алкоксиалкил, фенил-(C1-C3)-линейный или разветвленный алкил и фенил-(C1-C3)-линейный или разветвленный алкоксиалкил, где указанные фенильные группы, необязательно, могут быть замещены одним или двумя заместителями, независимо выбираемыми из галогена или (C1-C3)-алкила;
либо R1 и R2, вместе с углеродом, к которому присоединены, образуют циклопентильный, циклогексильный или циклогептильный цикл, который, необязательно, может быть замещен одним или двумя заместителями, независимо выбираемыми из группы заместителей, перечисленных в приведенном выше определении R1 и R2; и
R3 и R4 выбирают независимо из водорода и метила;
и фармацевтически приемлемым солям указанных соединений.
Предпочтительные варианты осуществления настоящего изобретения включают следующие соединения и фармацевтически приемлемые соли указанных соединений:
1-аминометилспиро[2.4]гептан-1-карбоновая кислота;
1-аминометилспиро[2.5]октан-1-карбоновая кислота;
1-аминометилспиро[2.6]нонан-1-карбоновая кислота;
1-аминометил-5-метилспиро[2.4]гептан-1-карбоновая кислота;
1-аминометил-2-метилспиро[2.6]нонан-1-карбоновая кислота;
1-аминометил-2,2-диметилциклопропанкарбоновая кислота;
1-аминометил-2,2-ди-н-пропилциклопропанкарбоновая кислота;
1-аминометил-2-изопропилциклопропанкарбоновая кислота;
1-аминометил-2-циклопропилциклопропанкарбоновая кислота;
1-аминометил-2-изобутилциклопропанкарбоновая кислота;
1-аминометил-2-(1-этилпропил)циклопропанкарбоновая кислота;
1-аминометил-2-циклогексилциклопропанкарбоновая кислота и
1-аминометил-2-(2-фенетил)циклопропанкарбоновая кислота.
Конкретными примерами вариантов осуществления настоящего изобретения являются следующие соединения и фармацевтически приемлемые соли указанных соединений:
1-аминометилспиро[2.3]гексан-1-карбоновая кислота;
1-аминометилспиро[2.7]декан-1-карбоновая кислота;
1-аминометил-5, 6-диметилспиро[2.4]гептан-1-карбоновая кислота;
1-аминометил-5-метилспиро[2.5]октан-1-карбоновая кислота;
1-аминометил-5,7-диметилспиро[2.5]октан-1-карбоновая кислота;
1-аминометил-2,2-диметилспиро[2.6]нонан-1-карбоновая кислота;
1-аминометил-2,2-диэтилциклопропанкарбоновая кислота;
1-аминометил-2, 2-ди-н-бутилциклопропанкарбоновая кислота;
1-аминометил-2,2-диизобутилциклопропанкарбоновая кислота;
1-аминометил-2-н-пропилциклопропанкарбоновая кислота;
1-аминометил-2-(2-метилбутил)циклопропанкарбоновая кислота;
1-аминометил-2-(2,2-диметилбутил)циклопропанкарбоновая кислота;
1-аминометил-2-(2-метилпентил)циклопропанкарбоновая кислота;
1-аминометил-2-(2,2-диметилпентил)циклопропанкарбоновая кислота;
1-аминометил-2-(3-этилпентил)циклопропанкарбоновая кислота;
1-аминометил-2-(4-этилгексил)циклопропанкарбоновая кислота;
1-аминометил-2-(1-метилциклопропилметил)циклопропанкарбоновая кислота;
1-аминометил-2-(1-этилциклопропилметил)циклопропанкарбоновая кислота;
1-аминометил-2-(1-пропилциклопропилметил)циклопропанкарбоновая кислота;
1-аминометил-2-(2-метилгексил)циклопропанкарбоновая кислота;
1-аминометил-2-(2, 2-диметилгексил)циклопропанкарбоновая кислота;
1-аминометил-2-(2,6-диметилгептил)циклопропанкарбоновая кислота;
1-аминометил-2-(3,7-диметилоктил)циклопропанкарбоновая кислота;
1-аминометил-2-н-бутилциклопропанкарбоновая кислота;
1-ааминометил-2-циклобутилциклопропанкарбоновая кислота;
1-аминометил-2-циклопентилциклопропанкарбоновая кислота;
1-аминометил-2-циклогептилциклопропанкарбоновая кислота;
1-аминометил-2-циклопропилметилциклопропанкарбоновая кислота;
1-аминометил-2-циклогексилметилциклопропанкарбоновая кислота;
1-аминометил-2-(2-циклогексилэтил)циклопропанкарбоновая кислота;
1-аминометил-2-фенилциклопропанкарбоновая кислота;
1-аминометил-2-бензилциклопропанкарбоновая кислота;
1-аминометил-2-(2-фторфенил)циклопропанкарбоновая кислота;
1-аминометил-2-(3-фторфенил)циклопропанкарбоновая кислота;
1-аминометил-2-(4-фторфенил)циклопропанкарбоновая кислота;
1-аминометил-2-(2, 3-дифторфенил)циклопропанкарбоновая кислота;
1-аминометил-2-(2,4-дифторфенил)циклопропанкарбоновая кислота;
1-аминометил-2-(2,5-дифторфенил)циклопропанкарбоновая кислота;
1-аминометил-2-(2,6-дифторфенил)циклопропанкарбоновая кислота;
1-аминометил-2-(3,5-дифторфенил)циклопропанкарбоновая кислота;
1-аминометил-2-(2-фторбензил)циклопропанкарбоновая кислота;
1-аминометил-2-(3-фторбензил)циклопропанкарбоновая кислота;
1-аминометил-2-(4-фторбензил)циклопропанкарбоновая кислота;
1-аминометил-2-(2,3-дифторбензил)циклопропанкарбоновая кислота;
1-аминометил-2-(2,4-дифторбензил)циклопропанкарбоновая кислота;
1-аминометил-2-(2, 5-дифторбензил)циклопропанкарбоновая кислота;
1-аминометил-2-(2,6-дифторбензил)циклопропанкарбоновая кислота;
1-аминометил-2-(3,5-дифторбензил)циклопропанкарбоновая кислота;
1-аминометил-2-[2-(2-фторфенил)этил]циклопропанкарбоновая кислота;
1-аминометил-2-[2-(3-фторфенил)этил]циклопропанкарбоновая кислота;
1-аминометил-2-[2-(4-фторфенил)этил]циклопропанкарбоновая кислота;
1-аминометил-2-[2-(2,3-дифторфенил)этил]циклопропанкарбоновая кислота;
1-аминометил-2-[2-(2, 4-дифторфенил)этил]циклопропанкарбоновая кислота;
1-аминометил-2-[2-(2,5-дифторфенил)этил]циклопропанкарбоновая кислота;
1-аминометил-2-[2-(2, 6-дифторфенил)этил]циклопропанкарбоновая кислота;
1-аминометил-2-[2-(3,5-дифторфенил)этил]циклопропанкарбоновая кислота;
1-аминометил-2-метоксиметилциклопропанкарбоновая кислота;
1-аминометил-2-феноксиметилциклопропанкарбоновая кислота;
1-аминометил-2-бензилоксиметилциклопропанкарбоновая кислота;
1-аминометил-2-(2-метоксиэтил)циклопропанкарбоновая кислота;
1-аминометил-2-(2-феноксиэтил)циклопропанкарбоновая кислота;
1-аминометил-2-(2-бензилоксиэтил)циклопропанкарбоновая кислота;
1-аминометил-2-(3-метоксипропил)циклопропанкарбоновая кислота;
1-аминометил-2-(3-феноксипропил)циклопропанкарбоновая кислота;
1-аминометил-2-(3-бензилоксипропил)циклопропанкарбоновая кислота;
1-аминометил-2, 2-бисметоксиметилциклопропанкарбоновая кислота;
1-аминометил-2,2-бисфеноксиметилциклопропанкарбоновая кислота;
1-аминометил-2,2-бисбензилоксиметилциклопропанкарбоновая кислота;
1-аминометил-2,2-бис-(2-метоксиэтил)циклопропанкарбоновая кислота;
1-аминометил-2,2-бис-(2-феноксиэтил)циклопропанкарбоновая кислота;
1-аминометил-2,2-бис-(2-бензилоксиэтил)циклопропанкарбоновая кислота;
1-аминометил-2,2-бис-(3-метоксипропил)циклопропанкарбоновая кислота;
1-аминометил-2, 2-бис-(3-феноксипропил)циклопропанкарбоновая кислота и
1-аминометил-2,2-бис-(3-бензилоксипропил)циклопропанкарбоновая кислота.
Термин "низший алкил", как он использован в описании, означает, если не оговорено особо, линейную или разветвленную алкильную группу или алкильный радикал с 1-6 атомами углерода, и включает метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, н-гексил и тому подобное.
Термин "алкил", как он использован в описании, если не оговорено особо, включает насыщенные одновалентные углеводородные радикалы, имеющие линейные, разветвленные или циклические группы или комбинации указанных групп. Примеры алкильных групп включают, не ограничиваясь, метил, этил, пропил, изопропил, бутил, изо-, втор- и трет-бутил, пентил, гексил, гептил, 3-этилбутил, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, норборнил и тому подобное.
Термин "циклоалкил", если не оговорено особо, означает насыщенные одновалентные карбоциклические группы с 3-8 углеродами и могут быть выбраны из группы, включающей циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил.
Термин "алкокси", если не оговорено особо, означает "алкил-O", где "алкил" принимает вышеуказанные значения. Примеры алкоксигрупп включают, не ограничиваясь, метокси, этокси, пропокси, бутокси и пентокси.
Термин "один или более заместителей", как использован в описании, означает ряд заместителей в количестве от одного до максимального числа заместителей, возможных с учетом количества доступных для связывания участков.
Термин "галоген", как он использован в описании, если не оговорено особо, включает фтор, хлор, бром и иод.
Соединения формулы I могут содержать хиральные центры и, следовательно, могут существовать в различных энантиомерных и диастереомерных формах. Отдельные изомеры могут быть получены известными способами, такими как оптическое разделение, оптически селективное взаимодействие или хроматографическое разделение с получением конечного продукта или промежуточного соединения. Настоящее изобретение касается всех оптических изомеров и всех стереоизомеров соединений формулы I, как в виде рацемических смесей, так и индивидуальных энантиомеров и диастереомеров указанных соединений, и их смесей, и всех фармацевтических композиций и способов вышеуказанной терапии, включающих или проводимых с применением, соответственно, указанных соединений и композиций. Отдельные энантиомеры соединений формулы I могут обладать преимуществами, по сравнению с рацемическими смесями указанных соединений, в терапии различных нарушений и состояний.
Поскольку соединения формулы I по настоящему изобретению являются основными соединениями, то такие соединения способны к образованию широкого ряда различных солей с разнообразными неорганическими и органическими кислотами. Поскольку такие соли должны быть фармацевтически приемлемыми для введения животным, на практике часто требуется первоначально выделять основное соединение из реакционной смеси в виде фармацевтически неприемлемой соли и затем просто превращать в соединение в форме свободного основания путем обработки со щелочным реагентом, после чего превращать свободное основание в фармацевтически приемлемую кислотно-аддитивную соль. Форма свободного основания соединения может быть восстановлена путем контактирования полученной таким образом кислотно-аддитивной соли с основанием и выделением соединения в форме свободного основания общепринятым способом. Формы свободного основания соединений, полученных согласно способу по настоящему изобретению, несколько отличаются от соответствующих форм кислотно-аддитивных солей по некоторым физическим свойствам, таким как растворимость, кристаллическая структура, гигроскопичность и тому подобное, но с другой стороны, формы свободного основания соединений и соответствующие формы кислотно-аддитивных солей эквивалентны для целей настоящего изобретения.
Фармацевтически приемлемые кислотно-аддитивные соли основных соединений, пригодные в способе по настоящему изобретению, включают нетоксичные соли, образованные с неорганическими кислотами, такими как хлористоводородная, азотная, фосфорная, серная, бромистоводородная, иодистоводородная, фтористоводородная, фосфористая и тому подобное, а также нетоксичные соли, образованные с органическими кислотами, такими как алифатические моно- и дикарбоновые кислоты, фенилзамещенные алкановые кислоты, гидроксиалкановые кислоты, алкандионовые кислоты, ароматические кислоты, алифатические и ароматические сульфоновые кислоты и прочие. Таким образом, такие соли включают сульфат, пиросульфат, бисульфат, сульфит, бисульфит, нитрат, фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат, хлорид, бромид, иодид, ацетат, трифторацетат, пропионат, каприлат, изобутират, оксалат, малонат, сукцинат, суберат, себацинат, фумарат, малеат, манделат, бензоат, хлорбензоат, метилбензоат, динитробензоат, фталат, бензолсульфонат, толуолсульфонат, фенилацетат, цитрат, лактат, малат, тартрат, метансульфонат и тому подобное. Кроме того, рассматриваются соли аминокислот, такие как аргинат и тому подобное и глюконат, галактуронат (см., например, Berge S.M. et al. "Pharmaceutical Salts", J. of Pharma. Sci., 1977; 66:1).
Когда соединения формулы I по настоящему изобретению являются кислотными соединениями, все такие соединения способны образовывать большое количество различных солей с различными неорганическими или органическими основаниями. Фармацевтически приемлемая основно-аддитивная соль кислотного соединения, пригодного в способе по настоящему изобретению, может быть получена при контактировании соединения в форме свободной кислоты с нетоксичным катионом металла, таким как катион щелочного или щелочноземельного металла, или с амином, в особенности, органическим амином. Примеры подходящих катионов металлов включают катион натрия (Na+), катион калия (K+), катион магния (Mg2+), катион кальция (Ca2+) и тому подобное. Примерами подходящих аминов служат N,N'-дибензилэтилендиамин, хлорпрокаин, холин, диэтаноламин, дициклогексиламин, этилендиамин, N-метилглюкамин и прокаин (см., например, Berge, выше, 1977). Основно-аддитивная соль кислотного соединения, пригодного в способе по настоящему изобретению, может быть получена при контактировании соединения в форме свободной кислоты с достаточным для получения соли общепринятым способом количеством требуемого основания. Соединение в форме свободной кислоты может быть восстановлено путем осуществления контактирования полученной таким образом солевой формы с кислотой и выделением соединения в форме свободной кислоты общепринятым способом. Соединения в форме свободной кислоты, полезные в способе по настоящему изобретению, несколько отличаются от соответствующих форм солей по некоторым физическим свойствам, таким как растворимость, кристаллическая структура, гигроскопичность и тому подобное, но, с другой стороны, соли эквивалентны соответствующей свободной кислоте для целей настоящего изобретения.
Настоящее изобретение также включает меченные изотопом соединения, которые идентичны соединениям, определяемым формулой I, но с учетом того, что один или более атомов заменены на атом, имеющий атомную массу или массовое число, отличное от атомной массы или массового числа, обычно существующих в природе. Примеры изотопов, которые могут входить в соединения по настоящему изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора и хлора, такие как2H,3H,13C,11C,14C,15N,18О,17O,31P,32P,35S,18F и36Cl, соответственно. Соединения по настоящему изобретению, соответствующие пролекарства и фармацевтически приемлемые соли указанных соединений или указанных пролекарств, содержащие вышеупомянутые изотопы и/или другие изотопы других атомов, входят в рамки объема настоящего изобретения и приложенных пунктов. Некоторые изотопно меченные соединения по настоящему изобретению, например, те, в которые включены радиоактивные изотопы, такие как3H и14C, полезны в испытаниях на распределение в тканях лекарства и/или субстрата. В особенности предпочтительны изотопы трития, т.е.3H, и углерода-14, т.е.14C, по причине легкости их получения и возможности обнаружения. Кроме того, замещение тяжелыми изотопами, такими как дейтерий, т.е.2H, может обеспечивать некоторые терапевтические преимущества, связанные с большей метаболической устойчивостью, например, повышенное время полужизни in vivo или пониженные потребности в лекарственном средстве, и, следовательно, может быть в некоторых случаях предпочтительным.
Некоторые соединения, пригодные в способе по настоящему изобретению, могут существовать как в несольватированных формах, так и в сольватированных формах, включая гидратированные формы. Обычно сольватированные формы, включая гидратированные формы, эквивалентны несольватированным формам и рассматриваются как входящие в объем настоящего изобретения.
Эффективность перорально вводимого лекарственного средства определяется эффективным переносом лекарственного средства через эпителий слизистой оболочки и стабильностью указанного средства в энтерогепатической циркуляции. Лекарственные средства, эффективные после парентерального введения, но менее эффективные после перорального введения, либо те, для которых время полужизни в плазме считается слишком коротким, могут быть химически модифицированы в форму пролекарства.
Пролекарство представляет собой химически модифицированное лекарственное средство, которое может являться биологически неактивным на своем участке действия, но может быть подвергнуто разложению или модификации до исходной биологически активной формы под действием одного или более ферментативных или других процессов in vivo.
Такое химически модифицированное лекарство, или пролекарство, должно иметь отличный от исходного лекарства фармако-кинетический профиль, обеспечивающий более легкое всасывание через эпителий слизистой оболочки, лучшее солеобразование и/или большую растворимость, лучшую системную стабильность (за счет увеличения времени полужизни в плазме, например). Такими химическими модификациями могут служить, например:
1) сложноэфирные или амидные производные, которые могут быть расщеплены, например, эстеразами или липазами. В случае сложноэфирных производных, сложный эфир получают из карбокислотной группы молекулы лекарства известными способами. В случае амидных производных, амид может быть получен из карбокислотной группы или аминогруппы молекулы лекарства известными способами;
2) пептиды, которые могут распознаваться специфическими или неспецифическими протеиназами (пептид может быть связан с молекулой лекарства посредством образования амидной связи с аминогруппой или карбокислотной группой молекулы лекарства известными способами);
3) производные, которые аккумулируются на участке действия в результате мембранной селекции пролекарственной формы или модифицированной пролекарственной формы; или
4) любая комбинация по пп.1-3.
Текущими исследованиями в экспериментах на животных показано, что пероральное всасывание некоторых может быть усилено за счет получения "слабой" четвертичной соли, поскольку, в отличие от нормальных четвертичных солей, например,R-N+(CH3)3, указанная соль может высвобождать активное лекарство при гидролизе.
"Слабые" четвертичные соли обладают полезными физическими свойствами по сравнению с основным лекарством или соответствующими солями. Растворимость в воде может быть повышенной по сравнению с другими солями, такими как гидрохлорид, но более важное значение здесь может иметь повышенное всасывание лекарственного средства из кишечника. Повышенное всасывание, вероятно, обусловлено тем фактом, что "слабая" четвертичная соль обладает поверхностно-активными свойствами и способна к образованию мицелл и ионизированных ионных частиц с желчными кислотами и т.д., которые могут более эффективно проникать сквозь эпителий кишечника. Пролекарство, после всасывания, быстро гидролизуется с высвобождением активного исходного лекарства.
Пролекарства соединений формулы I входят в объем настоящего изобретения. Пролекарства и слабые лекарственные формы известны из уровня техники (Palomino E., Drugs of the Future, 1990; 15(4):361-368) и включены в описание в качестве ссылки.
Некоторые из соединений по настоящему изобретению могут существовать как в несольватированных формах, так и в сольватированных формах, включая гидратные формы. Как правило, сольватированные формы, включая гидратные формы, эквивалентны несольватированным формам и рассматриваются как входящие в объем настоящего изобретения.
Настоящее изобретение также относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I, или фармацевтически приемлемой соли указанного соединения, и фармацевтически приемлемый носитель.
Настоящее изобретение относится также к способу лечения нарушений или состояний, выбранных из приведенной группы, таких как обмороки, эпилепсия, асфиксия, общая аноксия, гипоксия, травма спинного мозга, травматическое повреждение головного мозга, травма головы, ишемия головного мозга, приступ (включая тромбоэмболический приступ, фокальную ишемию, глобальную ишемию, кратковременные приступы церебральной ишемии и другие проблемы сосудов головного мозга, связанные с церебральной ишемией, такие как у пациентов, подвергнутых каротидной эндартерэктомии или в целом другим хирургическим операциям на сосудах либо диагностическим хирургическим вмешательствам на сосудах, таким как ангиография), спазм, вызванный тиосемикарбазидом, спазм, вызванный кардиазолом, и нарушения сосудов головного мозга, вызванные острым или хроническим цереброваскулярным нарушением, таким как церебральный инфаркт, субарахноидальное кровоизлияние или церебральная эдема, у млекопитающего, включающего введение нуждающемуся в таком лечении млекопитающему терапевтически эффективного количества соединения формулы I или фармацевтически приемлемой соли указанного соединения.
Настоящее изобретение относится также к способу лечения нарушений или состояний, выбранных из приведенной группы, таких как относящиеся к иннервации сердца нарушения, такие как потеря сознания вследствие иннервации сердца, нейрогенный обморок, каротидный синус, связанный с гиперчувствительностью, нейроваскулярный синдром и аритмии, включая аритмии, вторичные по отношению к желудочно-кишечным заболеваниям, у млекопитающего, включающего введение нуждающемуся в таком лечении млекопитающему терапевтически эффективного количества соединения формулы I или фармацевтически приемлемой соли указанного соединения.
Настоящее изобретение также относится к способу лечения нарушения или состояния, выбранного из приведенной группы, такого как острая боль, хроническая боль, боль, возникающая в результате повреждения мягкой ткани и периферического повреждения, такого как острая травма; постгерпетическая невралгия, затылочная невралгия, невралгия тройничного нерва, сегментарная или межреберная невралгия и другие невралгии; боль, связанная с остеоартритом и ревматоидным артритом; мышечно-скелетная боль, такая как боль, связанная с растяжениями сухожилия, растяжениями связок и травмой, такой как перелом костей; спинальная боль, боль в результате поражения центральной нервной системы, такая как боль, вызванная поражением спинного мозга или мозгового ствола; боль в нижнем отделе спины, ишиас, зубная боль, болевые мышечно-лицевые синдромы, боль, вызванная эпизиотомией, подагрическая боль и боль при ожогах; глубоко локализирующаяся и висцеральная боль, такая как боль в области сердца; мышечная боль, глазная боль, воспалительная боль, лицевая боль в области рта, например, одонталгия; боль в области живота и гинекологическая боль, например, дисменорея, родовые схватки и боль, связанная с эндометриозом; соматогенная боль; боль, связанная с поражением нерва и разрушением корней зубов, такая как боль, связанная с периферическими поражениями нерва, например, ущемлением нерва и разрывами плечевого сплетения; боль, связанная с ампутацией конечности, тригеминальной невралгией, невромой или васкулитом; диабетическая невропатия, вызванная химиотерапией невропатия, острая герпетическая и постгерпетическая невралгия; атипичная лицевая боль, невропатическая боль в нижнем отделе спины и арахноидит, тригеминальная невралгия, затылочная невралгия, сегментарная или межреберная невралгия, вызванные ВИЧ невралгии и связанные со СПИДом невралгии и другие невралгии; аллодиния, гипералгезия, боль при ожогах, идиопатическая боль, боль, вызванная химиотерапией; затылочная невралгия, психогенная боль, разрыв плечевого сплетения; боль, вызванная синдромом усталых ног; боль, связанная с камнями желчного пузыря; боль, связанная с хроническим алкоголизмом или гипотиреозом, или уремией, или витаминной недостаточностью; невропатическая и не невропатическая боль, вызванная карциномой, часто называемая онкологической болью, фантомная боль в ампутированных конечностях, функциональная боль в области живота, головная боль, включающая мигрень, сопровождающуюся предвестником эпилептического припадка, мигрень, не сопровождающуюся предвестником эпилептического припадка, и другие сосудистые головные боли, острую или хроническую головную боль при напряжении, синусную головную боль и гистаминовую головную боль; височно-нижнечелюстная боль и боль в области гайморовой пазухи; боль, вызванная анкилозирующим спондилитом; боль, вызванная усиленными сокращениями мочевого пузыря; послеоперационная боль, боль от шрама и хроническая не невропатическая боль, такая как боль, связанная с ВИЧ, артралгия, васкулит и фибромиалгия, у млекопитающего, включающего введение нуждающемуся в таком лечении млекопитающему терапевтически эффективного количества соединения формулы I или фармацевтически приемлемой соли указанного соединения.
Настоящее изобретение также относится к способу лечения нарушения или состояния, выбранного из приведенной группы, такого как расстройства настроения, такие как депрессия или, точнее, депрессивные нарушения, например, глубокое депрессивное нарушение, тяжелые униполярные повторяющиеся приступы глубокой депрессии, дистимическое нарушение, депрессивный невроз и невротическая депрессия, меланхолическая депрессия, включающая анорексию, потерю в весе, бессонницу, раннее утреннее пробуждение или психомоторную заторможенность, атипичная депрессия (или реактивная депрессия), включающая повышенный аппетит, гиперсомнию, психомоторное возбуждение или раздражительность; не поддающаяся лечению депрессия; сезонные эмоциональные нарушения и педиатрическая депрессия; предменструальный синдром, предменструальное дисфорическое расстройство, приливы, биполярные расстройства или маниакальная депрессия, например биполярное расстройство I, биполярное расстройство II и циклотимическое расстройство; сезонные эмоциональные нарушения, расстройство поведения и дезадаптивное поведение; вызванные стрессом соматические нарушения и тревожные состояния, такие как тревожное расстройство в детском возрасте, паническое расстройство с наличием или отсутствием боязни открытых пространств, боязнь открытых пространств без истории панического расстройства, специфические фобии (например,специфическая боязнь животных), социальное тревожное расстройство, социофобия, обсессивно-компульсивное расстройство, стрессовые нарушения, включающие посттравматический стресс и острый стресс, и генерализованное тревожное расстройство, у млекопитающего, включающего введение нуждающемуся в таком лечении млекопитающему терапевтически эффективного количества соединения формулы I или фармацевтически приемлемой соли указанного соединения.
Настоящее изобретение также относится к способу лечения нарушения или состояния, выбранного из приведенной группы, такого как пограничное личностное нарушение; шизофрения и другие психические расстройства, например, шизофреноподобные расстройства, шизоаффективные расстройства, бредовые расстройства, кратковременные психические расстройства, общие психические нарушения, психические расстройства, вызванные общим состоянием здоровья, психические расстройства, сопровождающиеся бредом или галлюцинациями, индивидуальная реальность, вызванная психическим расстройством, психотические приступы тревожности, тревожность, связанная с психозом, психические расстройства настроения, такие как тяжелое глубокодепрессивное нарушение; расстройства настроения, связанные с психическими расстройствами, такими как острый маниакальный синдром и депрессия, вызванная биполярным расстройством, расстройства настроения, связанные с шизофренией и расстройства поведения, связанные с умственной отсталостью, у млекопитающего, включающего введение нуждающемуся в таком лечении млекопитающему терапевтически эффективного количества соединения формулы I или фармацевтически приемлемой соли указанного соединения.
Настоящее изобретение также относится к способу лечения нарушения или состояния, выбранного из приведенной группы, такого как нарушения сна, такие как бессонница (например,первичная бессонница, включающая психофизиологическую и идиопатическую бессонницу, вторичная бессонница, включающая бессонницу, вторичную по отношению к синдрому усталых ног, болезни Паркинсона или другому хроническому расстройству, и временная бессонница), сомнамбулизм, депривация сна, нарушения сна, характеризующиеся быстрым движением глазных яблок, временная остановка дыхания во время сна, гиперсомния, парасомния, нарушения цикла сна-бодрствования, нарушение суточного ритма организма, нарколепсия, нарушения сна, вызванные посменной работой или нерегулярной работой, недостаточное качество сна по причине сокращения медленноволнового сна, вызванного лекарственной терапией или другими причинами, и другие нарушения сна, у млекопитающего, включающего введение нуждающемуся в таком лечении млекопитающему терапевтически эффективного количества соединения формулы I или фармацевтически приемлемой соли указанного соединения.
Настоящее изобретение также относится к способу увеличения продолжительности медленноволнового сна и усиления секреции гормона роста у человека, включающего введение нуждающемуся в таком лечении человеку терапевтически эффективного количества соединения формулы I или фармацевтически приемлемой соли указанного соединения.
Настоящее изобретение также относится к способу лечения нарушения или состояния, выбранного из приведенной группы, такого как респираторные заболевания, в частности респираторные заболевания, связанные с избыточной секрецией слизи, такие как хроническая непроходимость дыхательных путей, бронхопневмония, хронический бронхит, муковисцидоз, синдром расстройства дыхания у взрослых и бронхоспазм; кашель, судорожный кашель, кашель, вызываемый ангиотензин-конвертирующим ферментом (ACE), туберкулез легких, аллергии, такие как экзема и ринит; контактный дерматит, атопический дерматит, крапивница и другие экзематоидные дерматиты; зуд, зуд, связанный с гемодиализом; воспалительные заболевания, такие как воспалительная болезнь кишечника, псориаз, остеоартрит, поражение хрящей (например, повреждение хрящей в результате физической активности или остеоартрита), ревматоидный артрит, псориатический артрит, астма, зуд и солнечный ожог; и нарушения, связанные с гиперчувствительностью, такие как гиперчувствительность к сумаху ядовитому, у млекопитающего, включающего введение нуждающемуся в таком лечении млекопитающему терапевтически эффективного количества соединения формулы I или фармацевтически приемлемой соли указанного соединения.
Настоящее изобретение также относится к способу лечения нарушения или состояния, выбранного из приведенной группы, такого как нейродегенеративные расстройства, такие как болезнь Паркинсона (PD), болезнь Хангтинтона (HD) и болезнь Альцгеймера (AD); делирий, деменции (например, сенильная деменция по типу болезни Альцгеймера, сенильная деменция, мультиинфарктная деменция, деменция, вызванная ВИЧ-1, комплекс СПИД-ассоциированной деменции (ADC), деменции, вызванные травмой головы, болезнью Паркинсона, болезнью Хангтинтона, болезнью Пика, болезнью Крейтцфельда-Якоба либо множественными этиологиями), амнестические нарушения, другие когнитивные расстройства или нарушения памяти и поведенческие симптомы деменции, у млекопитающего, включающего введение нуждающемуся в таком лечении млекопитающему терапевтически эффективного количества соединения формулы I или фармацевтически приемлемой соли указанного соединения.
Настоящее изобретение также относится к способу лечения нарушения или состояния, выбранного из приведенной группы, такого как синдром Дауна; синдром Шегрина, гипертензия, гематопоэз, послеоперационная неврома, доброкачественная гипертрофия предстательной железы, периодонтальное нарушение, геморрой и анальные трещины, бесплодие, симпатическая рефлекторная дистрофия, гепатит, теналгия, сопровождающая гиперлипидемию, расширение кровеносных сосудов, фиброзирующие и коллагеновые болезни, такие как склеродермия и эозинофильный фасциолез; и вазоспастические болезни, такие как стенокардия, мигрень и болезнь Рейно, у млекопитающего, включающего введение нуждающемуся в таком лечении млекопитающему терапевтически эффективного количества соединения формулы I или фармацевтически приемлемой соли указанного соединения.
Настоящее изобретение также относится к способу лечения нарушения или состояния, выбранного из приведенной группы, такого как глазные заболевания, такие как синдром сухих глаз, конъюнктивит, весенний конъюнктивит и тому подобное; и офтальмические состояния, связанные с клеточной пролиферацией, такие как пролиферативная витреоретинопатия, у млекопитающего, включающего введение нуждающемуся в таком лечении млекопитающему терапевтически эффективного количества соединения формулы I или фармацевтически приемлемой соли указанного соединения.
Настоящее изобретение также относится к способу лечения нарушения или состояния, выбранного из приведенной группы, такого как аутизм, синдром дефицита внимания с гиперактивностью (ADHD), ангиогенез (например,применение для подавления ангиогенеза), синдром Рейтера и артропатия, у млекопитающего, включающего введение нуждающемуся в таком лечении млекопитающему терапевтически эффективного количества соединения формулы I или фармацевтически приемлемой соли указанного соединения.
Настоящее изобретение также относится к способу лечения нарушения или состояния, выбранного из приведенной группы, такого как нарушения, вызванные зависимостью от приема веществ, выбираемых из группы, включающей спирт, амфетамины (или амфетаминподобные вещества), кофеин, каннабис, кокаин, галлюциногенные вещества, летучие препараты для ингаляции и аэрозольные пропелленты, никотин, опиоиды, производные фенилглицидина, седативные средства, снотворные средства и анксиолитики, указанные нарушения, вызванные зависимостью от приема веществ, включают зависимость и злоупотребление, интоксикацию, абстиненцию, делирий, вызванный интоксикацией, и абстинентный делирий; и нарушения, связанные с привыканием, включающие поведение, состоящее в пристрастии к злоупотреблению (например, пристрастие к азартным играм и другое поведение, обнаруживающее склонность к пагубным привычкам), у млекопитающего, включающего введение нуждающемуся в таком лечении млекопитающему терапевтически эффективного количества соединения формулы I или фармацевтически приемлемой соли указанного соединения.
Настоящее изобретение также относится к способу лечения нарушения или состояния, выбранного из приведенной группы, такого как синдром Дауна; демиелинизирующие заболевания, такие как рассеянный склероз (MS) и боковой амиотрофический склероз (ALS), у млекопитающего, включающего введение нуждающемуся в таком лечении млекопитающему терапевтически эффективного количества соединения формулы I или фармацевтически приемлемой соли указанного соединения.
Настоящее изобретение также относится к способу лечения нарушения или состояния, выбранного из приведенной группы, такого как распространяющееся нарушение развития, фибромиалгия, инфекции, вызванные вирусом иммунодефицита человека (ВИЧ); ВИЧ-энцефалопатия; диссоциативные нарушения, такие как дисморфические расстройства организма; нарушения, связанные с приемом пищи, такие как анорексия и булимия; неспецифический язвенный колит; болезнь Крона, синдром раздраженной толстой кишки; хронический панкреатит, синдром хронического переутомления; синдром внезапной смерти внешне здорового ребенка (SIDS); гиперактивный мочевой пузырь; гиперактивный мочевой пузырь с симптомами со стороны нижних мочевыводящих путей; хронический цистит; вызванный химиотерапией цистит; кашель, судорожный кашель, кашель, вызываемый ангиотензинконвертирующим ферментом (ACE), зуд, икота, предменструальный синдром, предменструальное дисфорическое расстройство, аменорейные расстройства, такие как десменорея; симпатическая рефлекторная дистрофия, такая как синдром плечо/рука; плазменная экстравазация, возникающая в результате цитокин-химиотерапии; расстройства функции мочевого пузыря, такие как хронический цистит, гиперрефлексия детрузора мочевого пузыря, воспаление мочевыводящих путей и недержание мочи, включающее неотложное недержание мочи, гиперактивность мочевого пузыря, недержание мочи при напряжении и смешанное недержание; фиброзирующие и коллагеновые болезни, такие как склеродермия и эозинофильный фасциолез; нарушения кровообращения, вызванные расширением кровеносных сосудов и вазоспастическими нарушениями, такими как стенокардия и болезнь Рейно; нарушения половых функций, включающие преждевременную эякуляцию и нарушение эректильной функции у мужчин, у млекопитающего, включающего введение нуждающемуся в таком лечении млекопитающему терапевтически эффективного количества соединения формулы I или фармацевтически приемлемой соли указанного соединения.
Настоящее изобретение также относится к способу лечения нарушения или состояния, выбранного из приведенной группы, такого как нарушения движений, такие как первичные нарушения движений, акинезия, дискинезия (например, семейная пароксизмальная дискинезия, поздняя дискинезия, тремор, хорея, миоклонус, тики и другая дискинезия) спастические состояния, синдром Туретта, синдром Скотта, параличи (например, паралич Белла, церебральный паралич, родовой паралич, паралич плечевого сплетения, прогрессивная мышечная атрофия, ишемический паралич, прогрессирующий бульбарный паралич и другие параличи), акинетически ригидный синдром; экстрапирамидальные нарушения движений, такие как вызванные приемом лекарственных средств нарушения движения, например, вызванный нейролептиками паркинсонизм, нейролептический злокачественный синдром, вызванная нейролептическими средствами острая дистония, вызванная нейролептическими средствами острая акатизия, вызванная нейролептическими средствами поздняя дискинезия и вызванный приемом лекарственных средств постуральный тремор; синдром усталых ног и нарушения движений, вызванные болезнью Паркинсона или болезнью Хангтинтона, у млекопитающего, включающего введение нуждающемуся в таком лечении млекопитающему терапевтически эффективного количества соединения формулы I или фармацевтически приемлемой соли указанного соединения.
Настоящее изобретение также относится к способу лечения нарушения или состояния, выбранного из приведенной группы, такого как синдромы масталгии, укачивание в транспорте, системная красная волчанка и иммунные дисфункции (например,стресс, вызванный иммунными дисфункциями, такими как идиопатические иммунные дисфункции, постинфекционные иммунные дисфункции, иммунные дисфункции после удаления опухоли молочной железы, синдром стресса у свиней, транспортная лихорадка крупного рогатого скота, конская пароксизмальная мерцательная аритмия, родовая дисфункция у кур, стресс, приводящий к рыскающему передвижению овец, и стрессовое поведение собак при взаимодействии человек/животное), у млекопитающего, включающего введение нуждающемуся в таком лечении млекопитающему терапевтически эффективного количества соединения формулы I или фармацевтически приемлемой соли указанного соединения.
Настоящее изобретение также относится к способу лечения нарушения или состояния, выбранного из приведенной группы, такого как желудочно-кишечные (GI) расстройства, включающие воспалительные желудочно-кишечные нарушения, такие как воспалительные болезни кишечника, нарушения, вызванные helicobacter pylori и болезнями GI тракта, такие как гастрит, проктит, гастродуоденальные язвы, пептические язвы, диспепсия, нарушения, связанные с нейронным регулированием внутренних органов, неспецифический язвенный колит, болезнь Крона, синдром раздраженной толстой кишки и рвота, включающая послеоперационную тошноту и послеоперационную рвоту, и включающая острую, замедленную и предупреждающую рвоту (рвота включает рвоту, вызванную химиотерапией, облучением, токсинами, вирусными или бактериальными инфекциями, беременностью, вестибулярными нарушениями, например, укачиванием в транспорте, вертиго, головокружением и болезнью Меньера, хирургической операцией, мигренью, изменениями внутричерепного давления, гастро-эзофагеальным рефлюкс-нарушением, изжогой, чрезмерным излишеством в употреблении пищи или напитков, повышенной кислотностью желудка, изжогой или отрыжкой, изжогой, например, эпизодической, ночной или вызванной пищей изжогой, и диспепсией), у млекопитающего, включающего введение нуждающемуся в таком лечении млекопитающему терапевтически эффективного количества соединения формулы I или фармацевтически приемлемой соли указанного соединения.
Настоящее изобретение также относится к способу лечения нарушения или состояния, выбранного из приведенной группы, такого как новообразования, включая опухоли молочной железы, желудочные карциномы, желудочные лимфомы, нейроганглиобластомы и мелкоклеточные карциномы, такие как мелкоклеточная карцинома легкого, у млекопитающего, включающего введение нуждающемуся в таком лечении млекопитающему терапевтически эффективного количества соединения формулы I или фармацевтически приемлемой соли указанного соединения.
Вышеуказанные способы упоминаются также в описании под общим названием "способы по изобретению".
Термин "лечение", как использован в описании, означает реверсирование, облегчение, торможение развития или предупреждение нарушения или состояния, по отношению к которому применяется данный термин, или предупреждение симптомов такого состояния или нарушения. Термин "лечить", как использован в описании, означает действие, выполняемое с целью осуществления лечения, где "лечение" имеет значение, непосредственно указанное выше.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Соединения по настоящему изобретению могут быть получены, как указано на следующих реакционных схемах и в описании. На приведенных ниже реакционных схемах и в последующем описании значения R1-R4 соответствуют приведенным выше, если не оговорено особо.
Схема 1

Согласно схеме 1, соединение формулы 1 подвергают взаимодействию с соединением формулы R4R3NO2 в присутствии 1,8-диазабицикло[5.4.0]ундец-7-ена (DBU), в ацетонитрильном растворителе, или в присутствии карбоната калия в этанольном растворителе, что дает соответствующее соединение формулы 2. Предпочтительно, используют один эквивалент DBUна пять эквивалентов R4R3NO2. Данное взаимодействие обычно осуществляют при температуре приблизительно от 60°C до 80°C, предпочтительно около 60°C. Взаимодействие полученного соединения формулы 2 с триэтиламином в этанольном растворителе, при давлении газообразного водорода в пределах приблизительно от 1 атмосферы до 5 атмосфер, предпочтительно, порядка 1 атмосферы, в присутствии никеля Ренея, при температуре приблизительно от 20°С до 60°C, предпочтительно при температуре, близкой к комнатной, дает соответствующее соединение формулы 3.
Соединение формулы 3 может быть превращено в требуемое соединение формулы 1 путем осуществления взаимодействия с хлористоводородной кислотой (HCl), предпочтительно 3н HCl, при температуре приблизительно от 80°C до температуры кипения реакционной смеси, предпочтительно, при температуре, близкой к кипению флегмы.
Схема 2 иллюстрирует предпочтительный способ синтеза соединения формулы I, где R1 и R2, вместе с углеродом, к которому присоединены, образуют циклопентильное, циклогексильное или циклогептильное кольцо.
Схема 2

Согласно схеме 2 в соединениях формулы 2, 3, 4 и 5, n равно 1, 2 или 3, и цикл, содержащий (CH2)n, может быть, необязательно, замещен одним или двумя заместителями, выбираемыми из группы заместителей, приведенных выше в определении R1 и R2. Соединения формулы 2 могут быть превращены в соответствующие соединения формулы 3 с использованием способа, описанного выше и представленного на схеме 1, для получения соединения формулы 2 (схема 1) из соединения формулы 1 (схема 1). Взаимодействие соединений формулы 3 с гексагидратом хлорида кобальта и боргидридом натрия в этаноле или смеси низшего спирта и воды, при температуре приблизительно от 0°C до 40°C, дает соответствующие соединения формулы 4. Предпочтительно использовать два эквивалента гексагидрата хлорида кобальта и 10 эквивалентов боргидрида натрия и осуществлять взаимодействие в метаноле при температуре, близкой к комнатной.
Целевое соединение формулы 1A может быть затем получено осуществлением взаимодействия соответствующего соединения формулы 4 с гидроксидом лития в метаноле или другом низшем спирте, например, этаноле или н-бутаноле, при температуре приблизительно от 50°C до 70°C, предпочтительно, при температуре кипения с обратным холодильником, что приводит к образованию соответствующих карбоксилатов лития, и последующим осуществлением взаимодействия полученных карбоксилатов с сильной минеральной кислотой. Предпочтительно, карбоксилаты превращают в соответствующие кислоты in situ путем охлаждения реакционной смеси до температуры приблизительно в пределах от 0°C до 25°C и добавлением достаточного количества хлористоводородной кислоты до получения pH смеси порядка 5,5.
Схема 3
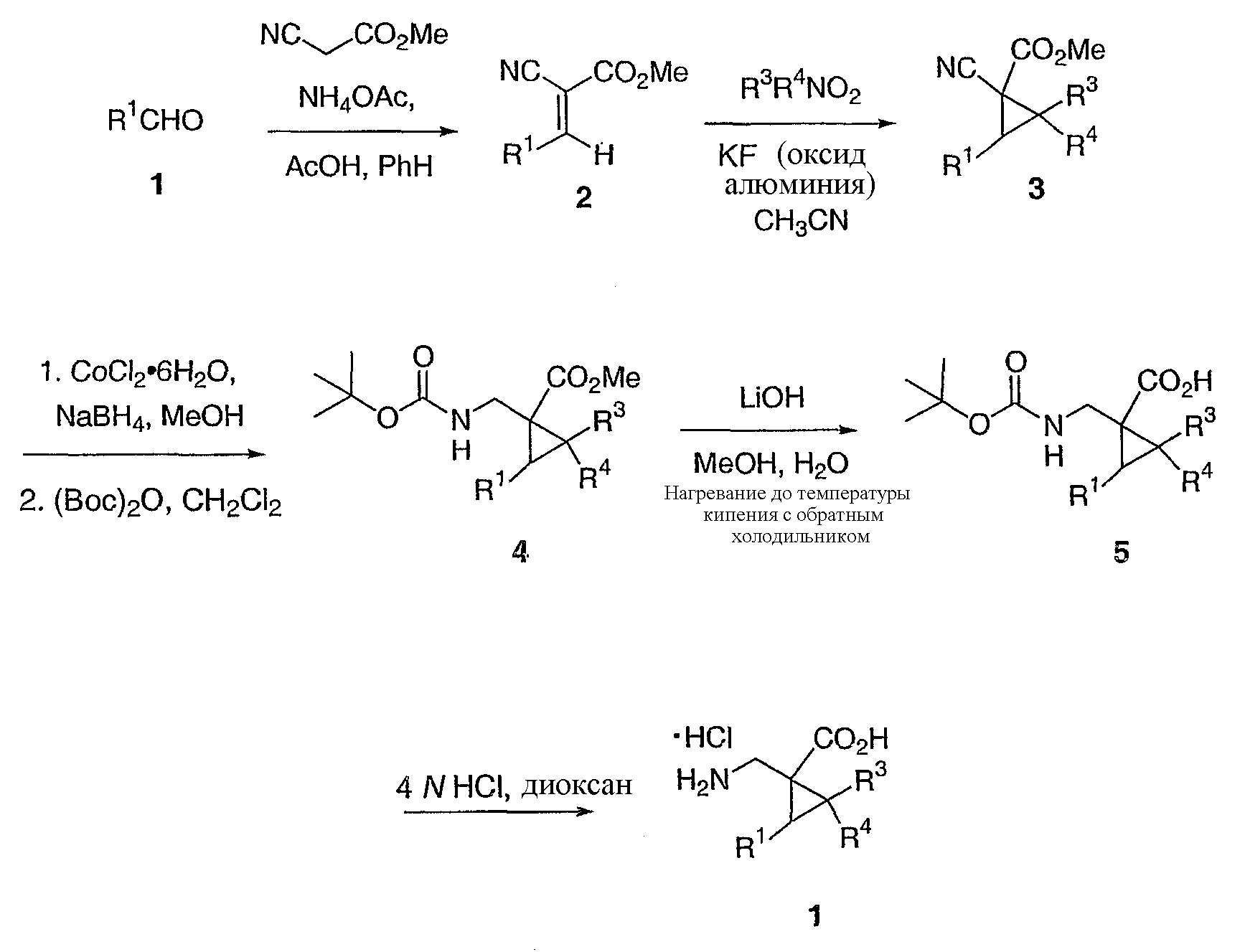
Согласно схеме 3, альдегид формулы 1 превращают в сложный эфир формулы 2 путем взаимодействия указанного соединения с соединением формулы NCCH2CO2CH3, ацетатом аммония и ледяной уксусной кислотой в бензоле при температуре приблизительно от 40°C до температуры кипения, предпочтительно, при температуре, близкой к температуре кипения. Взаимодействие соединения формулы 2 с соединением формулы R3 R4NO2, в ацетонитрильном растворителе, в присутствии фторида калия или катализатора на основе оксида алюминия, при температуре приблизительно от 40°C до температуры кипения, предпочтительно, при температуре, близкой к температуре кипения, дает соответствующие соединения формулы 3.
Сложные эфиры формулы 3 могут быть затем превращены в соответствующие аминозащищенные сложные эфиры формулы 4 использованием следующего двухстадийного способа. Сначала соединения формулы 3 подвергают взаимодействию с гексагидратом хлорида кобальта и боргидридом аммония в этаноле или смеси низшего спирта и воды, при температуре приблизительно от 0°C до 40°C, для превращения цианогруппы в метиламиногруппу. Предпочтительно использовать два эквивалента гексагидрата хлорида кобальта и 10 эквивалентов боргидрида натрия и осуществлять взаимодействие в метаноле при температуре, близкой к комнатной. Аминогруппу полученного соединения защищают затем, осуществляя взаимодействие такого соединения с ди-трет-бутилдикарбонатом в дихлорметане. Последнее взаимодействие также обычно проводят при температуре приблизительно от 0°C до 40°C и, предпочтительно, осуществлять взаимодействие при температуре, близкой к комнатной.
Целевые соединения формулы I могут затем быть получены из соответствующих соединений формулы 5 с использованием способа, хорошо известного специалистам в данной области. Например, взаимодействием соединения формулы 5 с соответствующей кислотой, такой как хлористоводородная кислота, в диоксане, диэтиловом эфире или низшем спиртовом растворителе, или трифторуксусная кислота, что дает соответствующие кислотно-аддитивные соли соединений формулы I. Соединения формулы I могут быть получены из соответствующих кислотно-аддитивных солей, как указано выше, в разделе "сущность изобретения".
Схема 4

Согласно схеме 4 соединения формулы 2 могут быть получены из соответствующих кетонов формулы 1 путем взаимодействия кетонов с соединением формулы CNCH3CO2Bn, где Bn означает бензил, (бензилцианоацетат) в уксуснокислом растворителе, в присутствии пиперидина, пирролидина или ацетата аммония, предпочтительно, пиперидина, при температуре приблизительно от 0°C до комнатной температуры, предпочтительно, при температуре, близкой к комнатной. Взаимодействие соединения формулы 2 с соединением формулы R3R4NO2 в присутствии 1,8-диазабицикло[5.4.0]ундец-7-ена (DBU), в ацетонитрильном растворителе, или в присутствии карбоната калия в этанольном растворителе, дает соответствующие соединения формулы 3. Предпочтительно используют один эквивалент DBU на пять эквивалентов R4R3 NO2. Данное взаимодействие обычно осуществляют при температуре приблизительно от 60°C до 80°C, предпочтительно, при температуре около 60°C.
Целевые кислоты формулы I могут быть получены из соответствующих сложных бензиловых эфиров формулы 4 использованием стандартных способов, хорошо известных специалистам в данной области. Например, посредством гидрирования при осуществлении взаимодействия соединений формулы 4 с газообразным водородом, при использовании давления газообразного водорода в пределах 1-5 атмосфер, предпочтительно, порядка 1 атмосферы, и катализатора, представляющего собой палладий-на-угле, или другого подходящего катализатора гидрирования, в метанольном или этанольном растворителе, при температуре приблизительно от 0°C до комнатной температуры, предпочтительно, при температуре, близкой к комнатной.
Все, что требуется для практического применения способа по настоящему изобретению, это ввести соединение формулы I или фармацевтически приемлемую соль указанного соединения в количестве, которое является терапевтически эффективным для лечения одного или более вышеупомянутых нарушений или состояний. Такое терапевтически эффективное количество составляет обычно приблизительно от 1 до 300 мг/кг массы тела пациента в сутки. Характерные дозы для взрослого пациента при нормальной массе составляют приблизительно от 10 до 5000 мг/сутки. При клиническом нормировании регулятивные органы, такие как, например, Food and Drug Administration ("FDA") в США, могут выдавать предписание относительно заслуживающего особого внимания терапевтически эффективного количества.
При определении практикующим врачом или ветеринаром, сколько составляет эффективное количество или терапевтически эффективное количество соединения формулы I, или фармацевтически приемлемой соли указанного соединения, предназначенное для лечения одного или более вышеуказанных нарушений или состояний согласно способу по изобретению, практикующим врачом или ветеринаром обычно принимается во внимание ряд факторов: опубликованные клинические исследования, возраст пациента, пол, масса тела и общее состояние, а также тип и степень излечиваемого состояния или нарушения и использование пациентом других лекарственных препаратов, если таковые применяются. По существу, вводимая доза может быть в пределах вышеуказанных концентраций либо может выходить за указанные пределы, т.е.быть ниже либо выше указанных пределов, в зависимости от потребностей конкретного пациента, тяжести излечиваемого состояния и конкретного используемого терапевтического состава. Установление точной дозы для конкретной ситуации относится к области компетенции лечащего врача или ветеринара. Как правило, лечение может быть начато с использованием меньших дозировок альфа-2-дельта-лиганда, которые ниже оптимальных для конкретного пациента. После чего дозировку можно понемногу увеличивать до достижения оптимального эффекта для данного случая. Для удобства, по желанию, общая суточная доза может быть подразделена на отдельные дозы и введена порциями в течение суток.
Фармацевтические композиции соединения формулы I или фармацевтически приемлемой соли указанного соединения получают, формулируя активное соединение в стандартную лекарственную форму с фармацевтическим носителем. Отдельными примерами стандартных лекарственных форм являются таблетки, капсулы, пилюли, порошки, водные и неводные растворы и суспензии для перорального приема и парентеральные растворы, выпускаемые в контейнерах, содержащих либо одну, либо несколько большее число стандартных доз, которые могут быть подразделены на отдельные дозы.
Некоторыми примерами подходящих фармацевтических носителей, включая фармацевтические растворители, являются желатиновые капсулы; сахара, такие как лактоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; производные целлюлозы, такие как натрийкарбоксиметилцеллюлоза, этилцеллюлоза, метилцеллюлоза и фталат ацетатцеллюлозы; желатин; тальк; стеариновая кислота; стеарат магния; растительные масла, такие как арахисовое масло, хлопковое масло, кунжутное масло, оливковое масло, кукурузное масло и масло какао; пропиленгликоль, глицерин; сорбит; полиэтиленгликоль; вода; агар; альгиновая кислота; изотонический раствор и растворы фосфатных буферов; а также другие совместимые вещества, обычно используемые в фармацевтических составах.
Композиции в соответствии с изобретением могут также содержать другие компоненты, такие как красители, корригенты и/или консерванты. Такие вещества, если присутствуют, обычно используются в сравнительно небольших количествах. Композиции могут, если требуется, также содержать другие терапевтические средства, обычно используемые для лечения излечиваемого нарушения или состояния.
Процентное содержание активных ингредиентов в вышеуказанных композициях можно варьировать в широких пределах, но с практической точки зрения, желательно, чтобы указанные ингредиенты присутствовали в концентрации, составляющей, по меньшей мере, 10% в твердой композиции и, по меньшей мере, 2% в исходной жидкой композиции. Наиболее удовлетворяющими требованиям являются те композиции, в которых возможно большая доля активного ингредиента, например, до приблизительно 95%.
В таблетках активный компонент смешивают с носителем, обладающим необходимыми связывающими свойствами в подходящих пропорциях, и прессуют, придавая нужную форму и размер.
Предпочтительно порошки и таблетки содержат приблизительно от пяти до семидесяти процентов активного соединения. Подходящими носителями являются карбонат магния, стеарат магния, тальк, сахар, лактоза, пектин, декстрин, крахмал, желатин, трагакантовая камедь, метилцеллюлоза, натрийкарбоксиметилцеллюлоза, низкоплавкий воск, масло какао и тому подобное. Подразумевается, что термин "получение препарата" включает формулирование активного соединения с инкапсулирующим материалом в качестве носителя, обеспечивающим капсулу, в которой активный компонент, в присутствии или в отсутствие других носителей, окружен носителем, таким образом тесно связанным с активным соединением. Подобным включением получают крахмальные облатки и лепешки. Таблетки, порошки, капсулы, пилюли, крахмальные облатки и лепешки могут быть использованы в качестве твердых лекарственных форм, пригодных для перорального приема.
Для получения суппозиториев низкоплавкий воск, такой как смесь глицеридов жирных кислот или масло какао, сначала расплавляют и гомогенно диспергируют в этом воске активный компонент, например, перемешиванием. Расплавленную гомогенную смесь затем заливают в формы подходящего размера и дают охладиться и, таким образом, затвердеть.
Препараты в жидкой форме включают растворы, суспензии и эмульсии, например, водные растворы или растворы в водном пропиленгликоле. Жидкие препараты для парентеральной инъекции могут быть формулированы в виде раствора в водном растворе полиэтиленгликоля.
Водные растворы, пригодные для перорального употребления, могут быть получены растворением активного компонента в воде и добавлением, по необходимости, подходящих красителей, корригентов, стабилизаторов и загустителей.
Водные суспензии, пригодные для перорального употребления, могут быть получены диспергированием тонко измельченного активного компонента в воде с вязким материалом, таким как природные или синтетические камеди, смолы, метилцеллюлоза, натрийкарбоксиметилцеллюлоза и другие хорошо известные суспендирующие средства.
Также изобретение охватывает препараты в твердой форме, которые предназначены для превращения, незадолго перед употреблением, в препараты жидкой формы для перорального приема. Такие жидкие формы включают растворы, суспензии и эмульсии. Эти препараты могут содержать, в дополнение к активному компоненту, красители, корригенты, стабилизаторы, буферные растворы, искусственные и натуральные подсластители, диспергирующие средства, загустители, солюбилизаторы и тому подобное.
Фармацевтический препарат предпочтительно выпускается в стандартной лекарственной форме. В такой форме препарат подразделен на стандартные дозы, содержащие соответствующие количества активного компонента. Стандартная лекарственная форма может представлять собой препарат в упаковке, упаковка содержит дискретные количества препарата, такие как расфасованные таблетки, капсулы и порошки в пузырьках или ампулах. Также стандартная лекарственная форма может представлять собой капсулы, таблетку, крахмальную облатку или лепешку, либо может состоять из целого ряда любых из указанных форм в фасованном виде.
Степень связывания α2δ-субъединицы может быть установлена посредством испытания методом радиолигандного связывания с использованием [3H]-габапентина и α2δ-субъединицы, полученной из ткани головного мозга свиньи, как описано в N.S. Gee et al., J. Biol. Chem., 1996, 271:5879-5776.
Соединения по изобретению демонстрируют хорошее сродство к связыванию α2δ-субъединицы. Габапентину (Neurontin®) в этом испытании отвечает значение порядка 0,10-0,12 мкМ. Поскольку соединения по настоящему изобретению также связывают субъединицу, следует ожидать, что эти соединения должны обладать фармакологическими свойствами, сопоставимыми с габапентином. Например, в качестве средств против конвульсий, состояния тревоги и боли.
Для определения сродства соединений по настоящему изобретению к связыванию α2δ-субъединицы может быть использовано испытание методом радиолигандного связывания с применением [3H]-габапентина и α2δ-субъединицы, полученной из ткани головного мозга свиньи (См., Gee, Nicolas S. et al. "The novel anticonvulsant drug, gabapentin (Neurontin), binds to the α2δ subunit of a calcium channel". J. Biol. Chem. (1996), 271(10), 5768-76). В приведенном выше испытании соединение, указанное в заголовке примера 1, имеет IC50, равное 0,037 мкМ, указанное в заголовке примера 3, имеет IC50, равное 0,34 мкМ, и соединение, указанное в заголовке примера 6, имеет IC50, равное 0,89 мкМ.
Активность соединений по настоящему изобретению in vivo может быть установлена с использованием моделей гипералгезии на животных (См. Sluka, K., et al. 2001, "Unilateral Intramuscular Injections Of Acidic Saline Produce A Bilateral, Long-Lasting Hyperalgesia", Muscle Nerve 24: 37-46; Dixon, W., 1980, "Efficient analysis of experimental observations". Ann Rev Pharmacol Toxicol 20:441-462; Randall L.O. and Selitto J.J., "A Method For Measurement Of Analgesic Activity On Inflamed Tissue," Arch. Int. Pharmacodyn., 1957; 4:409-419; Hargreaves K., Dubner R., Brown F., Flores C, and Joris J. "A New And Sensitive Method For Measuring Thermal Nociception In Cutaneous Hyperalgesia". Pain. 32:77-88, 1988), модели тревожного состояния на животных (Vogel JR, Beer B, and Clody DE, "A Simple And Reliable Conflict Procedure For Testing Anti-Anxiety Agents", Psychopharmacologia 21: 1-7, 1971).
Следующие примеры иллюстрируют получение соединений по настоящему изобретению. Температуры плавления приведены без учета поправок. Данные ЯМР приведены в миллионных долях и по отношению к дейтерий-блокирующему сигналу используемого для проб растворителя.
ПРИМЕРЫ
Пример 1
ГИДРОХЛОРИД 1-АМИНОМЕТИЛСПИРО[2.5]ОКТАН-1-КАРБОНОВОЙ КИСЛОТЫ
A. Этиловый эфир 1-цианоспиро[2.5]октан-1-карбоновой кислоты
К раствору этилового эфира цианоциклогексилиденуксусной кислоты (1,37 г, 7,09 ммоль) в 30 мл ацетонитрила добавляют нитрометан (1,92 мл, 35,5 ммоль), с последующим добавлением 1,8-диазабицикло[5.4.0]ундец-7-ена (DBU) (1,06 мл, 7,09 ммоль), что приводит к образованию оранжевого раствора. Реакционную смесь перемешивают в течение 2,5 часов, затем распределяют между диэтиловым эфиром (Et2O) и 1н. хлористоводородной кислотой (HCl) (водной). Фазы разделяют и органическую фазу промывают насыщенным раствором соли, сушат над сульфатом магния (MgSO4) и концентрируют. Флэш-хроматография остатка (смесь 5% этилацетат (EtOAc)/гексаны) дает 1,1 г (75%) этилового эфира 1-цианоспиро[2.5]октан-1-карбоновой кислоты в виде бесцветного масла.1H ЯМР (CDCl3) δ 4,22 (м, 2H), 1,77 (д, J=5,1 Гц, 1H), 1,42-1,72 (м, 10H), 1,40 (д, J=5,1 Гц, 1H), 1,30 (т, J=7,1 Гц, 3H).13C ЯМР δ 166,40, 118,60, 62,72, 40,20, 34,67, 29,01, 28,75, 25,69, 25,54, 25,28, 24,66, 14,38. LRMS: m/z 208,0 (М+1), ИК: 2239, 1732 см-1. Анал. рассчит. для C12H17 NO2: C, 69,54; H, 8,27; N, 6,76. Найдено: C, 69,41; H, 8,33; N, 6,75.
B. Этиловый эфир 1-аминометилспиро[2.5]октан-1-карбоновой кислоты
К раствору этилового эфира 1-цианоспиро[2.5]октан-1-карбоновой кислоты (7,1 г, 34,2 ммоль) в 95 мл этанола (EtOH) добавляют триэтиламин (5,0 мл) и никель Ренея (4,0 г). Смесь гидрируют на вибраторе Парра при 48 фунт/кв.дюйм в течение 70 часов, фильтруют и концентрируют. Флэш-хроматография остатка (5→10→15% смесь MeOH/метиленхлорид (CH2Cl2)) дает 5,0 г (69%) этилового эфира 1-аминометилспиро[2.5]октан-1-карбоновой кислоты в виде бесцветного масла.1H ЯМР δ 4,15 (кв, J=7,1 Гц, 2H), 3,23 (д, J=13,9 Гц, 1H), 2,65 (д, J=13,9 Гц, 1H), 1,41-1, 57 (м, 10H), 1,24 (м, 4H), 0,53 (д, J=4,9 Гц, 1H).
С. Гидрохлорид 1-аминометилспиро[2.5]октан-1-карбоновой кислоты
К этиловому эфиру 1-аминометилспиро[2.5]октан-1-карбоновой кислоты (5,0 г, 23,7 ммоль) добавляют 50 мл 3н. HCl (водной) и смесь нагревают до температуры кипения с обратным холодильником в течение 72 часов.1 H ЯМР-анализ сырого продукта свидетельствует о протекании гидролиза на 50%. Раствор концентрируют, и остаток тщательно промывают Et2O для удаления исходных веществ до получения тонкодисперсного белого твердого вещества. Объединенные твердые продукты вновь промывают Et2O (3·15 мл), получая белое как мел твердое вещество. Небольшую часть полученной партии продукта перекристаллизовывают из смеси MeOH/EtOAc, получая 0,17 г (3,3%) 1-аминометилспиро[2.5]октан-1-карбоновой кислоты в виде бесцветного твердого вещества, т.пл. >250°C (разл.):1H ЯМР (D2O) δ 3,37 (д, J=13,4 Гц, 1H), 2,83 (д, J=13,4 Гц, 1H), 1,21-1,33 (м, 10H), 0,99 (д, J=5,1 Гц, 1H), 0,47 (д, J=5,1 Гц, 1H). Анал. рассчит. для C10H17NO2·HCl: C, 54,67; H, 8,26; N, 6,37. Найдено: C, 54,77; H, 8,41; N,6,31. Получают также продукт второго сбора (0,34 г, 6,6%). Анал. рассчит. для C10H17 NO2·HCl: C, 54,67; H, 8,26; N, 6,37. Найдено: C, 54,71; H, 8,42; N, 6,22. Et2O-промывные воды концентрируют, получая гидрохлорид этилового эфира 1-аминометилспиро[2.5]октан-1-карбоновой кислоты в виде бесцветного твердого вещества, т.пл. 118-120°C:1H ЯМР (CDCl3) δ 8,39 (уш.с, 3H), 4,23 (м, 2H), 3,66 (м, 1H), 3,31 (м, 1H), 1,85 (м, 1H), 1,65 (м, 1H), 1,42-1,54 (м, 9H), 1,28 (т, J=7,1 Гц, 3H), 1,03 (д, J=5,4 Гц, 1H). Анал. рассчит. для C12H21NO2·HCl: C, 58,17; H, 8, 95; N, 5,65. Найдено: C, 58,31; H, 8,87; N, 5,51.
Следующие соединения получают по методике, описанной в примере 1.
Пример 2
ГИДРОХЛОРИД 1-АМИНОМЕТИЛСПИРО[2.4]ГЕПТАН-1-КАРБОНОВОЙ КИСЛОТЫ
1H ЯМР (D2O) δ 3,31 (д, J=13,7 Гц, 1H), 2,87 (д, J=13,9 Гц, 1H), 1,65 (м, 1H), 1,49 (м, 5H), 1,37 (д, J=4, 6 Гц, 1H), 1,31 (м, 1H), 1,03 (м, 1H), 0,92 (д, J=4,6 Гц, 1H). LRMS: m/z 167,9 (М-1).
Пример 3
ГИДРОХЛОРИД 1-АМИНОМЕТИЛСПИРО[2.6]НОНАН-1-КАРБОНОВОЙ КИСЛОТЫ
Т.пл.>195°C (разл.).1H ЯМР (D2O) δ 3,60 (д, J=13,4 Гц, 1H), 2,83 (д, J=13,7 Гц, 1H), 1, 34-1,64 (м, 12H), 1,27 (д, J=4,9 Гц, 1H), 0,76 (д, J=5,1 Гц, 1H).
Пример 4
1-АМИНОМЕТИЛ-2-МЕТИЛСПИРО[2.6]НОНАН-1-КАРБОНОВАЯ КИСЛОТА
(получена через циклопропанирование с нитроэтаном):1H ЯМР (D2O) δ 3,27 (д, J=13,7 Гц, 1H), 2,87 (д, J=13,7 Гц, 1H), 1,27-1,46 (м, 12H), 0,90 (д, J=6,6 Гц, 3H), 0,66 (м, 1H). LRMS: m/z 210,1 (М-1). Анал. рассчит. для C12H21NO2: C, 68,21; H, 10,02; N, 6,63. Найдено: C, 67,65; H, 10,31; N, 6,57.
Пример 5
1-АМИНОМЕТИЛСПИРО[2.4]ГЕПТАН-1-КАРБОНОВАЯ КИСЛОТА
A. Метиловый эфир цианоциклопентилиденуксусной кислоты
К раствору циклопентанона (84,1 г, 1 моль) в сухом бензоле (100 мл) добавляют метилцианоацетат (99,1 г, 1 моль), ацетат аммония (10 г) и ледяную уксусную кислоту (20 мл). Реакционную смесь нагревают до температуры кипения с обратным холодильником, используя реактор Дина-Старка, в течение 12 часов и оставляют охлаждаться до комнатной температуры. Избыток растворителей удаляют в вакууме и остаток растворяют в EtOAc (400 мл). Органический слой промывают водой, сушат (Na2SO4) и упаривают, получая продукт в виде светло-желтого масла. Дальнейшая очистка светло-желтого масла путем перегонки (10 мм Hg, 140-145°C) дает метиловый эфир цианоциклопентилиденуксусной кислоты (130 г, 79%) в виде бесцветного масла:1H ЯМР (300 МГц, CDCl3) δ 1,80 (м, 4H), 2,80 (т, 2H), 3,0 (т, 2H), 3,80 (с, 3H);13C ЯМР (75 МГц, CDCl3) δ 25,4, 26,9, 35,8, 38,1, 52,5, 100,7, 115,8, 162,6, 188,3.
B. Метиловый эфир 1-цианоспиро[2.4]гептан-1-карбоновой кислоты
К раствору метилового эфира цианоциклопентилиденуксусной кислоты (20,8 г, 126 ммоль) в ацетонитриле (500 мл) добавляют нитрометан (34 мл, 630 ммоль, 5 экв.) с последующим добавлением по каплям 1,8-диазабицикло[5.4.0]ундец-7-ена (DBU) (18,8 мл, 126 ммоль). При добавлении DBU реакционный раствор изменяет цвет на оранжевый. Реакционную смесь перемешивают при комнатной температуре в течение 16 часов. Добавляют еще одну порцию DBU (1 мл) и перемешивают в течение 1 часа. Реакционную смесь распределяют между диэтиловым эфиром (1 л) и 1н. HCl (400 мл), и слои разделяют. Органический слой промывают 1н. HCl (2·300 мл), насыщенным раствором соли (2·200 мл), сушат над сульфатом натрия, фильтруют и упаривают. Остаток очищают хроматографией на колонке, заполненной силикагелем путем мокрой набивки, элюируя смесью 4-6% этилацетат/гексанов. Соответствующие фракции объединяют и упаривают, получая 14,0 г (62%) метилового эфира 1-цианоспиро[2.4]гептан-1-карбоновой кислоты в виде прозрачного масла:1H ЯМР (300 МГц, CDCl3) δ 1,64 (д, J=5,0 Гц, 1H), 1,70-1,88 (м, 7H), 2,14 (д, J=5,0 Гц, 1H), 2,1-2,19 (м, 1H), 3,82 (с, 3H); МС (APCI) m/z 180 [М+H]+.
C. Метиловый эфир 1-аминометилспиро[2.4]гептан-1-карбоновой кислоты
К раствору метилового эфира 1-цианоспиро[2.4]гептан-1-карбоновой кислоты (3,45 г, 19,3 ммоль) в метаноле (240 мл) добавляют гексагидрат хлорида кобальта (COCl2 -6H2O) (9,16 г, 38,5 ммоль), получая раствор, окрашенный в темно-пурпуровый цвет. Боргидрид натрия (7,30 г, 193 ммоль) добавляют порциями за период 10 минут, принимая меры предосторожности по регулированию выделения водорода с учетом, что реакция является экзотермической, и получают черный раствор. После завершения добавления реакционную смесь перемешивают в течение 30 минут в атмосфере азота. Реакцию гасят осторожным добавлением 0,5н. HCl (1,3 л). Раствор подщелачивают (pH˜9) добавлением концентрированного гидроксида аммония. Смесь экстрагируют этилацетатом (4·400 мл). Объединенные органические слои сушат над сульфатом натрия, фильтруют и упаривают, получая 3,07 г (87%) метилового эфира 1-аминометилспиро[2.4]гептан-1-карбоновой кислоты в виде желтого масла:1H ЯМР (300 МГц, CDCl3) δ 0,74 (уш.д, 1H), 1,4-1,7 (м, 10H), 1,9 (м, 1H), 2,58 (д, J=13,8 Гц, 1H), 3,16 (д, J=13,8 Гц, 1H), 3,48 (с, 3H); МС (APCI) m/z 184 [М+H]+ .
D. 1-Аминометилспиро[2.4]гептан-1-карбоновая кислота
К раствору метилового эфира 1-аминометилспиро[2.4]гептан-1-карбоновой кислоты (3,40 г, 18,6 ммоль) добавляют метанол (75 мл) и водный гидроксид лития (LiOH-H2O) (1,55 г, 37,1 ммоль). Смесь нагревают до температуры кипения с обратным холодильником в атмосфере азота в течение 48 часов. Растворитель удаляют выпариванием при пониженном давлении, и остаток растворяют в воде (50 мл). При охлаждении на ледяной бане добавляют концентрированную HCl (˜2,5 мл) до достижения значения pH, равного 6. Белый осадок отделяют фильтрованием и сушат в вакууме, получая 1,22 г (39%) 1-аминометилспиро[2.4]гептан-1-карбоновой кислоты в виде не совсем белого твердого вещества: т.пл. 231-235°C (разложение);1H ЯМР (300 МГц, D2O) δ 0,78 (д, J=4,7 Гц, 1H), 1,32 (д, J=4,7 Гц, 1H), 1,40 (м, 1H), 1,54-1,77 (м, 7 H), 2,86 (д, J=13,2 Гц, 1H), 3,43 (д, J=13,2 Гц, 1H); МС (APCI) m/z 170 [М+H]+, Анал. Рассчит. для C9H15NO2-1,1H2O: C, 57,18; H, 9,17; N, 7,41. Найдено: C, 57,38; H, 8,82; N, 7,09.
Пример 6
ГИДРОХЛОРИД 1-АМИНОМЕТИЛ-2-ИЗОБУТИЛЦИКЛОПРОПАНКАРБОНОВОЙ КИСЛОТЫ
A. Этиловый эфир 1-циано-2-изобутилциклопропанкарбоновой кислоты
К раствору этилового эфира 2-циано-5-метилгекс-2-еновой кислоты (0,74 г, 4,08 ммоль) в 16 мл ацетонитрила добавляют нитрометан (1,11 мл, 20,4 ммоль), с последующим добавлением DBU (0,61 мл, 4,08 ммоль), что приводит к образованию оранжевого раствора. Реакционную смесь нагревают до 60°C в течение 16 часов, затем охлаждают и распределяют между Et2O и 1н. HCl (водн.). Фазы разделяют и органическую фазу промывают насыщенным раствором соли, сушат (MgSO4) и концентрируют. Флэш-хроматография остатка (5→10% EtOAc/гексаны) дает 0,56 г (70%) этилового эфира 1-циано-2-изобутилциклопропанкарбоновой кислоты в виде светло-желтого масла.1H ЯМР (CDCl3) δ 4,22 (м, 2H), 1,75-1,90 (м, 3H), 1,63 (м, 1H), 1,36 (м, 2H), 1,30 (т, J=7,3 Гц, 3H), 0,95 (м, 6H).13C ЯМР δ 168,25, 117,72, 62,94, 39,12, 30,25, 28,12, 25,66, 22,63, 22,40, 19,56, 14,30. LRMS: m/z 196,0 (М+1). Анал. рассчит. для C11H17NO2: C, 67,66; H, 8,78; N, 7,17. Найдено: C, 67,32; H, 8,74; N, 7,32.
B. Этиловый эфир 1-аминометил-2-изобутилциклопропанкарбоновой кислоты
К раствору этилового эфира 1-циано-2-изобутилциклопропанкарбоновой кислоты (0,41 г, 2,10 ммоль) в 45 мл EtOH добавляют триэтиламин (5,0 мл) и никель Ренея (1,0 г). Смесь гидрируют на вибраторе Парра при 48 фунт/кв.дюйм в течение 18 часов, фильтруют и концентрируют. Флэш-хроматография остатка (5→10% смесь MeOH/CH2Cl2 дает 0,11 г (26%) этилового эфира 1-аминометил-2-изобутилциклопропанкарбоновой кислоты в виде бесцветного масла.1H ЯМР δ 4,10 (кв, J=7,1 Гц, 2H), 2, 90 (д, J=14,2 Гц, 1H), 2,76 (д, J=14,2 Гц, 1H), 1,63 (м, 1H), 1,52 (м, 2H), 1,34 (м, 1H), 1,22 (т, J=7,1 Гц, 3H), 1,04 (м, 1H), 0,90 (м, 6H), 0,49 (м, 1H).13C ЯМР δ 175,51, 60,75, 42,42, 37,92, 30,61, 29,04, 26,46, 22,91, 22,63, 21,31, 14,49.
С. Гидрохлорид 1-аминометил-2-изобутилциклопропанкарбоновой кислоты
К этиловому эфиру 1-аминометил-2-изобутилциклопропанкарбоновой кислоты (0,1 г, 0,50 ммоль) добавляют 10 мл 3н. HCl (водной) и смесь нагревают до температуры кипения с обратным холодильником в течение 60 часов.1H ЯМР-анализ сырого продукта свидетельствует о протекании гидролиза на 100%. Раствор фильтруют еще горячим через слой стекловолокна и концентрируют. Твердый остаток промывают Et2 O (2·3 мл), получая 86 мг (100%) гидрохлорида 1-аминометил-2-изобутилциклопропанкарбоновой кислоты в виде бесцветного твердого вещества, т.пл. >220°C (разл.):1H ЯМР (D2O) δ 3,34 (д, J=13,7 Гц, 1H), 2,83 (д, J=13,9 Гц, 1H), 1,57 (м, 1H), 1,47 (м, 1H), 1,37 (м, 1H), 1,30 (м, 1H), 1,00 (м, 1H), 0,72 (м, 7H), LRMS: m/z 169,9 (М-1). Анал. рассчит. для C9H17NO2·HCl: C, 52,05; H, 8,74; N,6,74. Найдено: C, 50,32; H, 8,15; N, 6,53.
Пример 7
ГИДРОХЛОРИД 1-АМИНОМЕТИЛ-2-ИЗОПРОПИЛЦИКЛОПРОПАНКАРБОНОВОЙ КИСЛОТЫ
A. Метиловый эфир 2-циано-4-метилпент-2-еновой кислоты
К раствору изобутиральдегида 1 (18,2 мл, 200 ммоль) в сухом бензоле (20 мл) добавляют метилцианоацетат (18 мл, 200 ммоль), ацетат аммония (2 г) и ледяную уксусную кислоту (4 мл). Реакционную смесь перемешивают при 60°C в течение 30 минут и дают охладиться до комнатной температуры. Избыток растворителей удаляют в вакууме и остаток растворяют в EtOAc (200 мл). Органический слой промывают водой, сушат над сульфатом натрия и упаривают, получая метиловый эфир 2-циано-4-метилпент-2-еновой кислоты в виде светло-желтого масла. Дальнейшая очистка светло-желтого масла путем перегонки (7 мм Hg) дает продукт 2 (27, 4 г, 56%) в виде бесцветного масла:1H ЯМР (300 МГц, CDCl3) δ 1,16 (д, J=6,6 Гц, 6H), 2,96-3,04 (м, 1H), 3,87 (с, 3H), 7,47 (д, J=10,5 Гц, 1H).
B. Метиловый эфир 1-циано-2-изопропилциклопропанкарбоновой кислоты
К раствору метилового эфира 2-циано-4-метилпент-2-еновой кислоты (10,5 г, 68,3 ммоль) в сухом ацетонитриле (60 мл) добавляют нитрометан (5,5 мл, 103 ммоль) и порциями вносят нанесенный на оксид алюминия фторид калия (40 мас.%, 22 г). Реакционную смесь перемешивают при нагревании до температуры кипения с обратным холодильником в течение 2 часов и охлаждают до комнатной температуры. Твердое вещество удаляют фильтрованием через короткий слой целита и промывают ацетонитрилом. Избыток растворителя удаляют в вакууме, и остаток вновь растворяют в диэтиловом эфире. Эфирный слой промывают водой, насыщенным раствором соли, сушат над сульфатом натрия (Na2SO4) и концентрируют в вакууме. Сырой продукт очищают флэш-хроматографией на колонке, используя смесь гексаны/EtOAc (8:2) в качестве элюента, что дает метиловый эфир 1-циано-2-изопропилциклопропанкарбоновой кислоты (7,7 г, 68%) в виде бесцветного масла:1H ЯМР (300 МГц, CDCl3) δ 1,13 (т, J=7,2 Гц, 6H), 1,39-1,45 (м, 2H), 1,65-1,74 (м, 1H), 1,81 (дд, J=4,4, 8,9 Гц, 1H), 3,81 (с, 3H);13C ЯМР (75 МГц, CDCl3) δ 19,6, 21,8, 21,9, 25,3, 31,2, 39,3, 53,7, 117,6, 168,7.
C. Метиловый эфир 1-(трет- бутоксикарбониламинометил)-2-изопропилциклопропанкарбоновой кислоты
К раствору метилового эфира 1-циано-2-изопропилциклопропанкарбоновой кислоты (7,7 г, 46,1 ммоль) и гексагидрата хлорида кобальта (21,9 г, 92,2 ммоль) в MeOH (560 мл) добавляют порциями натрийборгидрид (NaBH4) (17,4 г, 461 ммоль). Образовавшийся черный осадок перемешивают в течение 1 часа при комнатной температуре и гасят 0,5н. HCl (200 мл). После растворения черного осадка избыток растворителя удаляют и водный слой подщелачивают добавлением 2н. гидроксида натрия (NaOH). Щелочной раствор медленно добавляют к раствору ди-трет-бутилдикарбоната (20,1 г, 92,2 ммоль) в дихлорметане (400 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи, и органический слой отделяют и промывают насыщенным раствором соли, и сушат (Na2SO4). Упаривание избытка растворителя с последующей очисткой остатка колоночной хроматографией при использовании смеси гексаны/EtOAc (9:1) в качестве элюента дает метиловый эфир 1-(трет-бутоксикарбониламинометил)-2-изопропилциклопропанкарбоновой кислоты (10,9 г, 88%) в виде бесцветного масла:1H ЯМР (300 МГц, CD3OD) δ 0,76 (м, 1H), 0,97 (д, J=6,3 Гц, 3H), 1,05 (д, J=6,3 Гц, 3H), 1,26-1,31 (м, 3H), 1,43 (с, 9H), 3,23 (д, J=14,3 Гц, 1H), 3,57 (д, J=14,3 Гц, 1H), 3,69 (с, 3H);13C ЯМР (75 МГц, CD3OD) δ 20,5, 23,4, 23,6, 29,2, 38,1, 41,1, 53,0, 80,5, 158,5, 177,1; МС (APCI) m/z 172 [М+H-100(Boc)]+.
D. 1-( трет-Бутоксикарбониламинометил)-2-изопропилциклопропанкарбоновая кислота
К раствору метилового эфира 1-(трет-бутоксикарбониламинометил)-2-изопропилциклопропанкарбоновой кислоты (10,9 г, 40,2 ммоль) в MeOH (320 мл) добавляют раствор гидроксида лития (LiOH) (4,2 г, 100 ммоль) в воде (98 мл). Реакционную смесь нагревают до температуры кипения с обратным холодильником в течение 3 часов и охлаждают до комнатной температуры. Избыток растворителя удаляют и остаток растворяют в воде (100 мл). Водный раствор промывают диэтиловым эфиром, подкисливают до pH 3 с помощью 2н. HCl и экстрагируют EtOAc (2·150 мл). Объединенную органическую фазу промывают насыщенным раствором соли, сушат (Na2SO4) и выпариванием растворителя получают 1-(трет- бутоксикарбониламинометил)-2-изопропилциклопропанкарбоновую кислоту (9,0 г, 87%) в виде бесцветного масла:1H ЯМР (300 МГц, CD3OD) δ 0,72 (м, 1H), 0,99 (д, J=6,2 Гц, 3H), 1,06 (д, J=6,2 Гц, 3H), 1,28-1,36 (м, 3H), 1,42 (с, 9H), 3,23 (д, J=14,3 Гц, 1H), 3,54 (д, J=14,3 Гц, 1H);13C ЯМР (75 МГц, CD3OD) δ 20,0, 23,0, 23,3, 28,8, 30,2, 37,6, 40, 8, 80,2, 158,1, 178,5; МС (APCI) m/z 258 [М+H]+.
E. Гидрохлорид 1-аминометил-2-изопропилциклопропанкарбоновой кислоты
К раствору 1-( трет-бутоксикарбониламинометил)-2-изопропилциклопропанкарбоновой кислоты (2,05 г, 8,0 ммоль) в сухом 1,4-диоксане (40 мл) добавляют 4н. HCl (40 мл, в 1,4-диоксане). Реакционную смесь перемешивают при комнатной температуре в течение ночи и добавляют диэтиловый эфир (100 мл). Белый твердый продукт собирают и сушат, получая гидрохлорид 1-аминометил-2-изопропилциклопропанкарбоновой кислоты (1,35 г, 88%): т.пл.: 245-246°C;1H ЯМР (300 МГц, D2O) δ 0,94 (д, J=6,5 Гц, 3H), 0,96 (м, 1H), 1,05 (д, J=6,4 Гц, 3H), 1,23-1,31 (м, 1H), 1,49-1,59 (м, 2H), 2,85 (д, J=13,7 Гц, 1H), 3,83 (д, J=13,7 Гц, 1H);13C ЯМР (75 МГц, D20) δ 22,3, 23,9, 27,8, 30,8, 39,6, 41,7, 179,6; МС (APCI) m/z 158 [М+H]+. Анал. рассчит. для C8 H15NO2·HCl: C, 49,61; H, 8,33; N, 7,23; Cl, 18,31. Найдено: C, 49,76; H, 8,44; N, 7,11; Cl, 18,48.
Пример 8
1-АМИНОМЕТИЛ-2,2-ДИПРОПИЛЦИКЛОПРОПАНКАРБОНОВАЯ КИСЛОТА
A. Бензиловый эфир 2-циано-3-пропилгекс-2-еновой кислоты
К смеси 4-гептанона (2,0 мл, 14,3 ммоль) и бензилцианоацетата (2,51 г, 14,3 ммоль) при 0°C добавляют уксусную кислоту (0,08 мл, 1,43 ммоль), затем пиперидин (0,14 мл, 1,43 ммоль), по каплям. Ледяную баню убирают и перемешивание продолжают в течение 10 мин. Добавляют дополнительное количество уксусной кислоты (0,08 мл) и пиперидина (0,14 мл), с последующим добавлением высушенных в горячем сушильном шкафу молекулярных сит 4Å, для равномерного перемешивания. Смесь перемешивают в течение 1 ч, затем распределяют между EtOAc и насыщенным бикарбонатом натрия (NaHCO3) (водным). Фазы разделяют и органическую фазу промывают насыщенным раствором соли, сушат (MgSO4) и концентрируют, получая 1,03 г (27%) бензилового эфира 2-циано-3-пропилгекс-2-еновой кислоты в виде бесцветного масла.1H ЯМР (CDCl3) δ 7,35 (м, 5H), 5,24 (с, 2H), 2,71 (м, 2H), 2,52 (м, 2H), 1,60 (м, 2H), 1,49 (м, 2H), 1,00 (т, J=7,3 Гц, 3H), 0,95 (т, J=7,3 Гц, 3H).13C ЯМР δ 182,46, 161,72, 135,37, 128,83, 128,58, 128,21, 115,87, 104,77, 67,26, 40,77, 35,80, 22,36, 21,86, 14,54, 14,32. LRMS: m/z 272,1 (М+1), ИК (без растворителя) 2223, 1729 см-1. Анал. рассчит. для C17H21NO2: C, 75,25; H, 7,80; N,5,16. Найдено: C, 75,44; H, 7,80; N,5,22.
B. Бензиловый эфир 1-циано-2,2-дипропилциклопропанкарбоновой кислоты
К раствору бензилового эфира 2-циано-3-пропилгекс-2-еновой кислоты (0,91 г, 3,35 ммоль) в 50 мл ацетонитрила добавляют нитрометан (0,91 мл, 16,77 ммоль) с последующим добавлением DBU (0,50 мл, 3,35 ммоль), что приводит к получению оранжевого раствора. Реакционную смесь перемешивают при комнатной температуре в течение 16 часов, затем распределяют между Et2O и 1н. HCl (водным). Фазы разделяют и органическую фазу промывают насыщенным раствором соли, сушат (MgSO4) и концентрируют. Флэш-хроматография остатка (5→10% смесь EtOAc/гексаны) дает 0,71 г (81%) бензилового эфира 1-циано-2,2-дипропилциклопропанкарбоновой кислоты в виде светло-желтого масла.1H ЯМР (CDCl3) δ 7,35 (м, 5H), 5,21 (дд, J=18,3, 12,4 Гц, 2H), 1,79 (д, J=5,1 Гц, 1H), 1,74 (м, 1H), 1,52 (м, 3H), 1,43 (д, J=5,1 Гц, 1H), 1,36 (м, 3H), 1,04 (м, 1H), 0,95 (т, J=7,1 Гц, 3H), 0,73 (т, J=7,1 Гц, 3H).13C ЯМР δ 166,40, 135,22, 128,81, 128,69, 128,48, 118,60, 68,23, 41,26, 36,45, 30,27, 29,76, 24,91, 19,74, 19,65, 14,22, 14,10. ИК (без растворителя) 2240, 1734 см-1 . Анал. рассчит. для C18H23NO2: C, 75,76; H, 8,12; N, 4,91. Найдено: C, 75,38; H, 8,02; N, 4,97.
C. 1-Аминометил-2, 2-дипропилциклопропанкарбоновая кислота
К раствору бензилового эфира 1-циано-2,2-дипропилциклопропанкарбоновой кислоты (0,35 г, 1,79 ммоль) в 16 мл MeOH-HCl добавляют диоксид платины (PtO2) (0,035 г). Смесь гидрируют на вибраторе Парра при 48 фунт/кв.дюйм в течение 21 часа. Смесь фильтруют и концентрируют. Флэш-хроматография остатка на силикагеле (0,25:1,25:3,5 смесь концентрированный гидроксид аммония (NH4OH) (водный):MeOH:CH2Cl2), с последующей ионообменной хроматографией на смоле DOWEX-50WX8-100, дают 0,09 г (18%) 1-аминометил-2,2-дипропилциклопропанкарбоновой кислоты в виде бесцветного твердого вещества, т.пл. 255-257°C:1H ЯМР (CD3OD) δ 3,26 (д, J=12,9 Гц, 1H), 3,03 (д, J=12,9 Гц, 1H), 1,69 (м, 1H), 1,56 (м, 2H), 1,28-1,50 (м, 4H), 1,26 (д, J=4,4 Гц, 1H), 1,17 (м, 1H), 0,93 (т, J=7,3 Гц, 3H), 0,85 (т, J=7,3 Гц, 3H), 0,54 (д, J=4,6 Гц, 1H). LRMS: m/z 198,1 (М-1). Анал. рассчит. для C11H21NO2: C, 66,29; H, 10,62; N, 7,03. Найдено: C, 66,39; H, 10,79; N, 7,05.
Следующие соединения получают по методике, описанной в приведенном выше примере 8.
Пример 9
1-АМИНОМЕТИЛ-5-МЕТИЛСПИРО[2.4]ГЕПТАН-1-КАРБОНОВАЯ КИСЛОТА (ДИАСТЕРЕОМЕРНАЯ СМЕСЬ)
Т.пл. 249°C (разл). LRMS: m/z 182,1 (M-1).
Пример 10
1-АМИНОМЕТИЛ-2,2-ДИМЕТИЛЦИКЛОПРОПАНКАРБОНОВАЯ КИСЛОТА
Т.пл. 254-256°C.1H ЯМР (CD3OD) δ 3,12 (с, 2H), 1,26 (д, J=4,6 Гц, 1H), 1,22 (с, 3H), 1,21 (с, 3H), 0,53 (д, J=4,6 Гц, 1H). LRMS: m/z 141,9 (М-1).
Пример 11
1-АМИНОМЕТИЛ-2-(1-ЭТИЛПРОПИЛ)ЦИКЛОПРОПАНКАРБОНОВАЯ КИСЛОТА
A. Бензиловый эфир 2-циано-4-этилгекс-2-еновой кислоты
К смеси 2-этилбутиральдегида (2,0 мл, 16,2 ммоль) и бензилцианоацетата (2,85 г, 16,2 ммоль) при 0°C добавляют уксусную кислоту (0,1 мл, 1,62 ммоль), затем пиперидин (0,16 мл, 1,62 ммоль), по каплям. Ледяную баню убирают и перемешивание продолжают в течение 10 мин. Добавляют дополнительное количество уксусной кислоты (0,1 мл) и пиперидина (0,16 мл), с последующим добавлением высушенных в горячем сушильном шкафу молекулярных сит 4Å, для равномерного перемешивания. Смесь перемешивают в течение 1,5 ч, затем распределяют между EtOAc и насыщенным NaHCO3 (водным). Фазы разделяют и органическую фазу промывают насыщенным раствором соли, сушат (MgSO4) и концентрируют, получая 3,96 г (95%) бензилового эфира 2-циано-4-этилгекс-2-еновой кислоты в виде бесцветного масла.1H ЯМР (CDCl3) δ 7,39 (м, 6H), 5,28 (с, 2H), 2,60 (м, 1H), 1,62 (м, 2H), 1,40 (м, 2H), 0,88 (т, J=7,6 Гц, 6H).13C ЯМР δ 168,69, 161,40, 135,01, 128,90, 128,82, 128,50, 114,11, 109,94, 68,07, 46,35, 27,30, 11,95. ИК (без растворителя) 2233, 1729 см-1. LRMS: m/z 256,1 (М-1). Анал. рассчит. для C16 H19NO2: C, 74,68; H, 7,44; N, 5,44. Найдено: C, 74,75; H, 7,52; N, 5,50.
B. Бензиловый эфир 1-циано-2-(1-этилпропил)циклопропанкарбоновой кислоты
К раствору бензилового эфира 2-циано-4-этилгекс-2-еновой кислоты (3,76 г, 14,6 ммоль) в 80 мл ацетонитрила добавляют нитрометан (3,95 мл, 73 ммоль), с последующим добавлением DBU (2,18 мл, 14,6 ммоль), что приводит к получению оранжевого раствора. Реакционную смесь нагревают до 60°C в течение 16 часов, затем охлаждают и распределяют между Et2O и 1н. HCl (водным). Фазы разделяют и органическую фазу промывают насыщенным раствором соли, сушат (MgSO4) и концентрируют. Флэш-хроматография остатка (5→10% смесь EtOAc/гексаны) дает 2,63 г (66%) бензилового эфира 1-циано-2-(1-этилпропил)циклопропанкарбоновой кислоты в виде светло-желтого масла.1H ЯМР (CDCl3) δ 7,35 (м, 5H), 5,22 (м, 2H), 1,86 (дд, J=9,0, 4,6 Гц, 1H), 1,72 (м, 1H), 1,45-1,57 (м, 4H), 1,42 (дд, J=8,3, 4,6 Гц, 1H), 1,14 (м, 1H), 0,93 (м, 6H).13C ЯМР δ 168,21, 135,12, 128,88, 128,73, 128,16, 117,77, 68,25, 42,41, 36,72, 26,18, 25,97, 25,20, 19,33, 11,19, 10,84. LRMS: m/z 272,1 (М+1). ИК (без растворителя) 2245, 1734 см-1. Анал. рассчит. для C17H21NO2: C, 75,25; H, 7, 80; N,5,16. Найдено: C, 75,44; H, 7,83; N, 5,22.
С. 1-Аминометил-2-(1-этилпропил)циклопропанкарбоновая кислота
К раствору бензилового эфира 1-циано-2-(1-этилпропил)циклопропанкарбоновой кислоты (1,76 г, 6,5 ммоль) в 25 мл ТГФ добавляют 20% Pd/C (0,2 г). Смесь гидрируют на вибраторе Парра при 48 фунт/кв.дюйм в течение 3 часов.1 H ЯМР-анализ подтверждает, что бензиловый эфир расщепился полностью. Смесь фильтруют и добавляют концентрированную хлористоводородную кислоту (2 г) наряду с PtO2 (0,42 г) и смесь гидрируют в течение еще 16 часов до полного восстановления нитрила. Смесь фильтруют и концентрируют. Флэш-хроматография остатка на силикагеле (0,25:1,25:3,5 смесь концентрированного NH4OH (водного):MeOH:CH2Cl2) с последующей ионообменной хроматографией на смоле DOWEX-50WX8-100 дает 0,13 г (11%) 1-аминометил-2-(1-этилпропил)циклопропанкарбоновой кислоты в виде бесцветного твердого вещества, т.пл. 255-257°C:1H ЯМР (D2O) δ 3,53 (д, J=13,2 Гц, 1H), 2,50 (д, J=13,2 Гц, 1H), 1,30 (м, 3H), 1,08-1,23 (м, 4H), 0,74 (т, J=7,6 Гц, 3H), 0,65 (т, J=7,6 Гц, 3H), 0,54 (м, 1H). LRMS: m/z 184,1 (М-1). Анал. рассчит. для C10H19NO2: C, 64,83; H, 10,34; N,7,56. Найдено: C, 64,84; H, 10,69; N, 7,44.
Указанные в заголовках примеров 12 и 13 соединения получают по методике, описанной в приведенном выше примере 11.
Пример 12
1-АМИНОМЕТИЛ-2-ИЗОПРОПИЛЦИКЛОПРОПАНКАРБОНОВАЯ КИСЛОТА
1H ЯМР (D2O) δ 3,64 (д, J=13,7 Гц, 1H), 2,66 (д, J=13,7 Гц, 1H), 1,36 (м, 2H), 1,08 (м, 1H), 0,86 (д, J=6,3 Гц, 3H), 0,76 (м, 1H), 0,75 (д, J=6,6 Гц, 3H).
Пример 13
1-АМИНОМЕТИЛ-2-ЦИКЛОГЕКСИЛЦИКЛОПРОПАНКАРБОНОВАЯ КИСЛОТА
Т.пл. 270°C (разл.).1H ЯМР (CD3OD) δ 3,56 (д, J=12,7 Гц, 1H), 2,55 (д, J=12,7 Гц, 1H), 1,59-1,81 (м, 6H), 1,38 (м, 1H), 1,10-1,25 (м, 6H), 0,49 (м, 1H). LRMS: m/z 198,1 (М+1).
Пример 14
ГИДРОХЛОРИД 1-АМИНОМЕТИЛСПИРО[2.5]ОКТАН-1-КАРБОНОВОЙ КИСЛОТЫ
A. Метиловый эфир цианоциклопентилиденуксусной кислоты
К раствору циклопентанона (84,1 г, 1 моль) в сухом бензоле (100 мл) добавляют метилцианоацетат (99,1 г, 1 моль), ацетат аммония (10 г) и ледяную уксусную кислоту (20 мл). Реакционную смесь нагревают до температуры кипения с обратным холодильником, используя прибор Дина-Старка, в течение 12 часов и оставляют охлаждаться до комнатной температуры. Избыток растворителей удаляют в вакууме и остаток растворяют в EtOAc (400 мл). Органический слой промывают водой, сушат (Na2SO4) и упаривают, получая продукт в виде светло-желтого масла. Дополнительная очистка светло-желтого масла перегонкой (10 мм Hg, 140-145°C) дает метиловый эфир цианоциклопентилиденуксусной кислоты (130 г, 79%) в виде бесцветного масла:1H ЯМР (300 МГц, CDCl3) δ 1,80 (м, 4H), 2,80 (т, 2H), 3,0 (т, 2H), 3,80 (с, 3H);13C ЯМР (75 МГц, CDCl3) δ 25,4, 26,9, 35,8, 38,1, 52,5, 100,7, 115,8, 162,6, 188,3.
B. Метиловый эфир 1-цианоспиро[2.4]гептан-1-карбоновой кислоты
К раствору метилового эфира цианоциклопентилиденуксусной кислоты (20,8 г, 126 ммоль) в ацетонитриле (500 мл) добавляют нитрометан (34 мл, 630 ммоль, 5 экв.) с последующим добавлением по каплям 1,8-диазабицикло[5.4.0]ундец-7-ена (DBU) (18,8 мл, 126 ммоль). Реакционный раствор при добавлении DBU приобретает оранжевую окраску. Реакционную смесь перемешивают при комнатной температуре в течение 16 часов. Добавляют еще одну порцию DBU (1 мл) и перемешивают в течение 1 часа. Реакционную смесь распределяют между диэтиловым эфиром (1 л) и 1н. HCl (400 мл) и слои разделяют. Органический слой промывают 1н. HCl (2·300 мл), насыщенным раствором соли (2·200 мл), сушат над сульфатом натрия, фильтруют и упаривают. Остаток очищают хроматографией на колонке, заполненной силикагелем путем мокрой набивки, элюируя смесью 4-6% этилацетат/гексаны. Соответствующие фракции объединяют и упаривают, получая 14,0 г (62%) метилового эфира 1-цианоспиро[2.4]гептан-1-карбоновой кислоты в виде прозрачного масла:1H ЯМР (300 МГц, CDCl3) δ 1,64 (д, J=5,0 Гц, 1H), 1,70-1,88 (м, 7H), 2,14 (д, J=5,0 Гц, 1H), 2,1-2,19 (м, 1H), 3,82 (с, 3H); МС (APCI) m/z 180 [М+H]+.
C. Метиловый эфир 1-аминометилспиро[2.4]гептан-1-карбоновой кислоты
К раствору метилового эфира 1-цианоспиро[2.4]гептан-1-карбоновой кислоты (3,45 г, 19,3 ммоль) в метаноле (240 мл) добавляют CoCl2-6H2O (9,16 г, 38,5 ммоль), получая раствор, окрашенный в темно-пурпурный цвет. Боргидрид натрия (7,30 г, 193 ммоль) добавляют порциями за период 10 минут, принимая меры предосторожности по регулированию выделения водорода с учетом, что реакция является экзотермической, и получают черный раствор. После завершения добавления реакционную смесь перемешивают в течение 30 минут в атмосфере азота. Реакцию гасят осторожным добавлением 0,5н. HCl (1,3 л). Раствор подщелачивают (pH˜9) добавлением концентрированного гидроксида аммония. Смесь экстрагируют этилацетатом (4Ч400 мл). Объединенные органические слои сушат над сульфатом натрия, фильтруют и упаривают, получая 3,07 г (87%) метилового эфира 1-аминометилспиро[2.4]гептан-1-карбоновой кислоты в виде желтого масла:1H ЯМР (300 МГц, CDCl3) δ 0,74 (уш.д, 1H), 1,4-1,7 (м, 10H), 1,9 (м, 1H), 2,58 (д, J=13,8 Гц, 1H), 3,16 (д, J=13,8 Гц, 1H), 3,48 (с, 3H); МС (APCI) m/z 184 [М+H]+.
D. 1-Аминометилспиро[2.4]гептан-1-карбоновая кислота
К раствору метилового эфира 1-аминометилспиро[2.4]гептан-1-карбоновой кислоты (3,40 г, 18,6 ммоль) добавляют метанол (75 мл) и LiOH-H2O (1,55 г, 37,1 ммоль). Смесь нагревают до температуры кипения с обратным холодильником в атмосфере азота в течение 48 часов. Растворитель удаляют выпариванием при пониженном давлении и остаток растворяют в воде (50 мл). При охлаждении на ледяной бане добавляют концентрированную HCl (˜2,5 мл) до достижения значения pH, равного 6. Белый осадок отделяют фильтрованием и сушат в вакууме, получая 1,22 г (39%) 1-аминометилспиро[2.4]гептан-1-карбоновой кислоты в виде не совсем белого твердого вещества: т.пл. 231-235°C (разложение);1H ЯМР (300 МГц, D2O) δ 0,78 (д, J=4,7 Гц, 1H), 1,32 (д, J=4,7 Гц, 1H), 1,40 (м, 1H), 1,54-1,77 (м, 7H), 2,86 (д, J=13,2 Гц, 1H), 3,43 (д, J=13,2 Гц, 1H); МС (APCI) m/z 170 [М+H]+. Анал. рассчит. для C9H15NO2-1,1 H2O: C, 57,18; H, 9,17; N, 7,41. Найдено: C, 57,38; H, 8,82; N, 7,09.
E. Метиловый эфир цианоциклогексилиденуксусной кислоты
К раствору циклогексанона (84,1 г, 1 моль) в сухом бензоле (100 мл) добавляют метилцианоацетат (99,1 г, 1 моль), ацетат аммония (10 г) и ледяную уксусную кислоту (20 мл). Реакционную смесь нагревают до температуры кипения с обратным холодильником, используя прибор Дина-Старка, в течение 12 часов и оставляют охлаждаться до комнатной температуры. Избыток растворителей удаляют в вакууме, и остаток растворяют в EtOAc (400 мл). Органический слой промывают водой, сушат над сульфатом натрия и упаривают, получая метиловый эфир цианоциклогексилиденуксусной кислоты в виде светло-желтого масла. Дополнительная очистка светло-желтого масла перегонкой (10 мм Hg, 150-155°C) дает продукт, представляющий собой указанное в заголовке соединение (110 г, 61%) в виде бесцветного масла:1H ЯМР (300 МГц, CDCl3) δ 1,70-1,85 (м, 6H), 2,70 (т, 2H), 3,00 (т, 2H), 3,80 (с, 3H);13C ЯМР (75 МГц, CDCl3) δ 25,9, 28,6, 28,9, 31,9, 37,2, 52,8, 101,9, 115,8, 162,7, 180,8.
F. Метиловый эфир 1-цианоспиро[2.5]октан-1-карбоновой кислоты
К раствору метилового эфира цианоциклогексилиденуксусной кислоты (20,0 г, 112 ммоль) в ацетонитриле (400 мл) добавляют нитрометан (30 мл, 558 ммоль), с последующим добавлением по каплям DBU (16,9 мл, 113 ммоль) в течение 5 минут. Раствор, который из прозрачного становится оранжевым, перемешивают при комнатной температуре в течение 5,5 часов. Раствор разбавляют диэтиловым эфиром (1 л), промывают 1н. HCl (2·250 мл) и затем насыщенным раствором соли (2·250 мл). Органический слой сушат над сульфатом натрия, фильтруют и упаривают. Остаток очищают хроматографией на колонке, заполненной силикагелем путем мокрой набивки (6,5·40 см), элюируя смесью 95:5 гексаны/этилацетат. Соответствующие фракции объединяют и упаривают, получая 18,6 г (86%) метилового эфира 1-цианоспиро[2.5]октан-1-карбоновой кислоты в виде прозрачного масла:1H ЯМР (300 МГц, CDCl3) δ 1,35 (м, 1H), 1,49 (д, J=5,0 Гц, 1H), 1,5-1,75 (м, 9H), 1,82 (д, J=5,0 Гц, 1H), 3,83 (с, 3H).
G. Метиловый эфир 1-(трет- бутоксикарбониламинометил)спиро[2.5]октан-1-карбоновой кислоты
К раствору метилового эфира 1-цианоспиро[2.5]октан-1-карбоновой кислоты (18,6 г, 96,2 ммоль) в метаноле (480 мл) добавляют CoCl2-H2O (22,8 г, 96,2 ммоль), что придает темно-пурпуровую окраску. Боргидрид натрия (14,5 г, 385 ммоль) добавляют порциями за период 10 минут, при охлаждении на ледяной бане, что дает окрашенный в черный цвет раствор. Спустя 40 минут реакцию гасят осторожным добавлением 2н. HCl. pH доводят до 9 с помощью 2н. NaOH и раствор экстрагируют CH2Cl2 (4 раза). К объединенному органическому слою добавляют насыщенный раствор карбоната калия и ди-трет-бутилдикарбонат (26,2 г, 120 ммоль). Спустя 1 час слои разделяют. Органический слой сушат над сульфатом натрия, фильтруют и упаривают, получая 35,7 г (>100%) метилового эфира 1-(трет-бутоксикарбониламинометил)-спиро[2.5]октан-1-карбоновой кислоты в виде не совсем белого твердого вещества. Продукт используют на следующей стадии без дополнительной очистки.
H. 1-(трет-Бутоксикарбониламинометил)спиро[2.5]октан-1-карбоновая кислота
К раствору сырого метилового эфира 1-(трет-бутоксикарбониламинометил)спиро[2.5]октан-1-карбоновой кислоты (35,0 г, ˜96,2 ммоль) добавляют LiOH-H2O (12,3 г, 294 ммоль), с последующим добавлением воды (75 мл). Смесь нагревают до температуры кипения с обратным холодильником. Спустя 48 часов добавляют дополнительную порцию LiOH-H2O (6,15 г, 146 ммоль) и нагревают до температуры кипения с обратным холодильником еще 24 часа. Растворитель удаляют при неполном вакууме. Остаток распределяют между водой и диэтиловым эфиром. Водный слой подкисливают до pH 2-3 с помощью водного HCl при охлаждении на ледяной бане, что приводит к появлению CH2Cl2-слоя. Слои разделяют и водный слой экстрагируют CH2Cl2(3 раза). Объединенные органические слои сушат над сульфатом натрия, фильтруют и упаривают, получая 17,0 г (63%, 2 этапа) 1-(трет-бутоксикарбониламинометил)спиро[2.5]октан-1-карбоновой кислоты в виде не совсем белого твердого вещества.
I. Гидрохлорид 1-аминометилспиро[2.5]октан-1-карбоновой кислоты
К раствору 1-(трет- бутоксикарбониламинометил)спиро[2.5]-октан-1-карбоновой кислоты (200 мг, 0,706 ммоль) в 1,4-диоксане (3 мл) добавляют 4н. HCl в 1,4-диоксане (3 мл). Реакционную смесь перемешивают в течение 18 часов при комнатной температуре. Добавляют диэтиловый эфир (20 мл) и осадок отделяют вакуумным фильтрованием. Твердый продукт сушат в вакуумном сушильном шкафу при 48°C, получая 133 мг (86%) гидрохлорида 1-аминометилспиро[2.5]октан-1-карбоновой кислоты в виде белого твердого вещества: т. пл. 240-242°С;1H ЯМР (300 МГц, D2O) δ 0,92 (д, J=5,2 Гц, 1H), 1, 40 (д, J=5,2 Гц, 1H), 1,4-1,6 (м, 10H), 3,12 (д, J=14,0 Гц, 1H), 3,61 (д, J=14,0 Гц, 1H); МС (APCI) m/z 184 [М+H]+. Анал. рассчит. для C10H17NO2-HCl: C, 54, 67; H, 8,26; N, 6,38; Cl, 16,14. Найдено: C, 54,91; H, 8,36; N, 6,25; Cl, 15,99.
Пример 15
ГИДРОХЛОРИД 1-АМИНОМЕТИЛ-2-ИЗОБУТИЛЦИКЛОПРОПАНКАРБОНОВОЙ КИСЛОТЫ
A. Метиловый эфир 2-циано-4-метилпент-2-еновой кислоты
К раствору изобутиральдегида (18,2 мл, 200 ммоль) в сухом бензоле (20 мл) добавляют метилцианоацетат (18 мл, 200 ммоль), ацетат аммония (2 г) и ледяную уксусную кислоту (4 мл). Реакционную смесь перемешивают при 60°C в течение 30 минут и оставляют охлаждаться до комнатной температуры. Избыток растворителей удаляют в вакууме и остаток растворяют в EtOAc (200 мл). Органический слой промывают водой, сушат над сульфатом натрия и упаривают, получая метиловый эфир 2-циано-4-метилпент-2-еновой кислоты в виде светло-желтого масла. Дополнительная очистка светло-желтого масла перегонкой (7 мм Hg) дает продукт 2 (27,4 г, 56%) в виде бесцветного масла:1H ЯМР (300 МГц, CDCl3) δ 1,16 (д, J=6,6 Гц, 6H), 2,96-3,04 (м, 1H), 3,87 (с, 3H), 7,47 (д, J=10,5 Гц, 1H).
B. Метиловый эфир 1-циано-2-изопропилциклопропанкарбоновой кислоты
К раствору метилового эфира 2-циано-4-метилпент-2-еновой кислоты (10,5 г, 68,3 ммоль) в сухом ацетонитриле (60 мл) добавляют нитрометан (5,5 мл, 103 ммоль) и порциями вносят нанесенный на оксид алюминия фторид калия (40 мас.%, 22 г). Реакционную смесь перемешивают при нагревании до температуры кипения с обратным холодильником в течение 2 часов и охлаждают до комнатной температуры. Твердое вещество удаляют фильтрованием через короткий слой целита и промывают ацетонитрилом. Избыток растворителя удаляют в вакууме и остаток вновь растворяют в диэтиловом эфире. Эфирный слой промывают водой, насыщенным раствором соли, сушат (Na2SO4) и концентрируют в вакууме. Сырой продукт очищают флэш-хроматографией на колонке, используя смесь гексаны/EtOAc (8:2) в качестве элюента, что дает метиловый эфир 1-циано-2-изопропилциклопропанкарбоновой кислоты (7,7 г, 68%) в виде бесцветного масла:1H ЯМР (300 МГц, CDCl3) δ 1,13 (т, J=7,2 Гц, 6H), 1,39-1,45 (м, 2H), 1,65-1,74 (м, 1H), 1,81 (дд, J=4,4, 8,9 Гц, 1H), 3,81 (с, 3H);13C ЯМР (75 МГц, CDCl3) δ 19,6, 21,8, 21,9, 25,3, 31,2, 39,3, 53,7, 117,6, 168,7.
С Метиловый эфир 1-(трет- бутоксикарбониламинометил)-2-изопропилциклопропанкарбоновой кислоты
К раствору метилового эфира 1-циано-2-изопропилциклопропанкарбоновой кислоты (7,7 г, 46,1 ммоль) и гексагидрата хлорида кобальта (21,9 г, 92,2 ммоль) в MeOH (560 мл) добавляют порциями NaBH4 (17,4 г, 461 ммоль). Образовавшийся черный осадок перемешивают в течение 1 часа при комнатной температуре и реакцию гасят 0,5н. HCl (200 мл). После растворения черного осадка избыток растворителя удаляют и водный слой подщелачивают добавлением 2н. гидроксида NaOH. Щелочной раствор медленно добавляют к раствору ди-трет-бутилдикарбоната (20,1 г, 92,2 ммоль) в дихлорметане (400 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи и органический слой отделяют и промывают насыщенным раствором соли и сушат (Na2SO4). Упаривание избытка растворителя с последующей очисткой остатка колоночной хроматографией при использовании смеси гексан/EtOAc (9:1) в качестве элюента дает метиловый эфир 1-(трет-бутоксикарбониламинометил)-2-изопропилциклопропанкарбоновой кислоты (10,9 г, 88%) в виде бесцветного масла:1H ЯМР (300 МГц, CD3OD) δ 0,76 (м, 1H), 0,97 (д, J=6,3 Гц, 3H), 1,05 (д, J=6,3 Гц, 3H), 1,26-1,31 (м, 3H), 1,43 (с, 9H), 3,23 (д, J=14,3 Гц, 1H), 3,57 (д, J=14,3 Гц, 1H), 3,69 (с, 3H);13C ЯМР (75 МГц, CD3OD) δ 20,5, 23,4, 23,6, 29,2, 38,1, 41,1, 53,0, 80,5, 158,5, 177,1; МС (APCI) m/z 172 [М+H-100(Boc)]+.
D. 1-(трет- Бутоксикарбониламинометил)-2-изопропилциклопропанкарбоновая кислота
К раствору метилового эфира 1-(трет-бутоксикарбониламинометил)-2-изопропилциклопропанкарбоновой кислоты (10,9 г, 40,2 ммоль) в MeOH (320 мл) добавляют раствор LiOH (4,2 г, 100 ммоль) в воде (98 мл). Реакционную смесь нагревают до температуры кипения с обратным холодильником в течение 3 часов и охлаждают до комнатной температуры. Избыток растворителя удаляют и остаток растворяют в воде (100 мл). Водный раствор промывают диэтиловым эфиром, подкисливают до pH 3 с помощью 2н. HCl и экстрагируют EtOAc (2·150 мл). Объединенную органическую фазу промывают насыщенным раствором соли, сушат (Na2SO4) и выпариванием растворителя получают 1-(трет- бутоксикарбониламинометил)-2-изопропилциклопропанкарбоновую кислоту (9,0 г, 87%) в виде бесцветного масла:1H ЯМР (300 МГц, CD3OD) δ 0,72 (м, 1H), 0,99 (д, J=6,2 Гц, 3H), 1,06 (д, J=6,2 Гц, 3H), 1,28-1,36 (м, 3H), 1,42 (с, 9H), 3,23 (д, J=14,3 Гц, 1H), 3,54 (д, J=14,3 Гц, 1H);13C ЯМР (75 МГц, CD3OD) δ 20,0, 23,0, 23,3, 28,8, 30,2, 37,6, 40, 8, 80,2, 158,1, 178,5; МС (APCI) m/z 258 [М+H]+.
E. Гидрохлорид 1-аминометил-2-изопропилциклопропанкарбоновой кислоты
К раствору 1-( трет-бутоксикарбониламинометил)-2-изопропилциклопропанкарбоновой кислоты (2,05 г, 8,0 ммоль) в сухом 1,4-диоксане (40 мл) добавляют 4н. HCl (40 мл, в 1,4-диоксане). Реакционную смесь перемешивают при комнатной температуре в течение ночи и добавляют диэтиловый эфир (100 мл). Белый твердый продукт собирают и сушат, получая гидрохлорид 1-аминометил-2-изопропилциклопропанкарбоновой кислоты (1,35 г, 88%): т. пл. 245-246°С;1H ЯМР (300 МГц, D2O) δ 0,94 (д, J=6,5 Гц, 3H), 0,96 (м, 1H), 1,05 (д, J=6,4 Гц, 3H), 1,23-1,31 (м, 1H), 1,49-1,59 (м, 2H), 2,85 (д, J=13,7 Гц, 1H), 3,83 (д, J=13,7 Гц, 1H);13C ЯМР (75 МГц, D2O) δ 22,3, 23,9, 27,8, 30,8, 39,6, 41,7, 179,6; МС (APCI) m/z 158 [М+H]+. Анал. рассчит. для C8 H15NO2-HCl: C, 49,61; H, 8,33; N, 7,23; Cl, 18,31. Найдено: C, 49,76; H, 8,44; N, 7,11; Cl, 18,48.
F. Метиловый эфир 2-циано-5-метилгекс-2-еновой кислоты
К раствору изовалеральдегида (86,1 г, 1 моль) в сухом бензоле (100 мл) добавляют метилцианоацетат 2 (99,1 г, 1 моль), ацетат аммония (10 г) и ледяную уксусную кислоту (20 мл). Реакционную смесь перемешивают при 0°C в течение 1 часа и оставляют охлаждаться до комнатной температуры. Избыток растворителей удаляют в вакууме и остаток растворяют в EtOAc (400 мл). Органический слой промывают водой, сушат над сульфатом натрия и упаривают, получая продукт в виде светло-желтого масла. Дополнительная очистка светло-желтого масла перегонкой (10 мм Hg) дает 100 г (60%) метилового эфира 2-циано-5-метилгекс-2-еновой кислоты в виде бесцветного масла:1H ЯМР (300 МГц, CDCl3) δ 1,00 (д, J=6,7 Гц, 6H), 1, 91 (м, 1H), 2,47 (дд, J=7,9, 6,8 Гц, 2H), 3,89 (с, 3H), 7,69 (т, J=8,0 Гц, 1H).
G. Метиловый эфир 1-циано-2-изобутилциклопропанкарбоновой кислоты
К раствору метилового эфира 2-циано-5-метилгекс-2-еновой кислоты (20,2 г, 121 ммоль) в сухом ацетонитриле (110 мл) добавляют нитрометан (9,8 мл, 181 ммоль) и порциями вносят нанесенный на оксид алюминия фторид калия (40 мас.%, 39,3 г). Реакционную смесь перемешивают при нагревании до температуры кипения с обратным холодильником в течение 2 часов и охлаждают до комнатной температуры. Твердое вещество удаляют фильтрованием через короткий слой целита и промывают ацетонитрилом. Избыток растворителя удаляют в вакууме и остаток вновь растворяют в диэтиловом эфире. Эфирный слой промывают водой, насыщенным раствором соли, сушат (Na2SO4) и концентрируют в вакууме. Сырой продукт очищают флэш-хроматографией на колонке, используя смесь гексаны/EtOAc (8:2) в качестве элюента, что дает 15 г (69%) метилового эфира 1-циано-2-изобутилциклопропанкарбоновой кислоты в виде бесцветного масла:1H ЯМР (300 МГц, CDCl3) δ 0,98 (д, J=2,9 Гц, 3H), 1,00 (д, J=3,0 Гц, 3H), 1,35-1,42 (м, 2H), 1,65 (м, 1H), 1,79-1,94 (м, 3H), 3,81 (с, 3H);13C ЯМР (75 МГц, CDCl3) δ 19,3, 22,3, 22,4, 25,5, 27,9, 30,1, 39,0, 53,4, 117,3, 168,5.
H. Метиловый эфир 1-(трет-бутоксикарбониламинометил)-2-изобутилциклопропанкарбоновой кислоты
К раствору метилового эфира 1-циано-2-изобутилциклопропанкарбоновой кислоты (13,0 г, 71,8 ммоль) и гексагидрата хлорида кобальта (34,2 г, 144 ммоль) в MeOH (800 мл) добавляют порциями NaBH4 (27,2 г, 718 ммоль). Образовавшийся черный осадок перемешивают в течение 1 часа при комнатной температуре и гасят 0,5н. HCl (400 мл). После растворения черного осадка избыток растворителя удаляют и водный слой подщелачивают добавлением 2н NaOH. Щелочной раствор медленно добавляют к раствору ди-трет-бутилдикарбоната (31,4 г, 144 ммоль) в дихлорметане (600 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи и органический слой отделяют и промывают насыщенным раствором соли и сушат (Na2SO4). Упаривание избытка растворителя с последующей очисткой остатка колоночной хроматографией при использовании смеси гексаны/EtOAc (9:1) в качестве элюента дает 16 г (78%) метилового эфира 1-(трет-бутоксикарбониламинометил)-2-изобутилциклопропанкарбоновой кислоты в виде бесцветного масла:1H ЯМР (300 МГц, CDCl3) δ 0,75 (м, 1H), 0,93 (т, J=6,5 Гц, 6H), 1,20-1,28 (м, 1H), 1,37 (дд, J=3,8, 8,5 Гц, 1H), 1,44 (с, 9H), 1,51-1,58 (м, 2H), 1,64-1,70 (м, 1H), 3,33-3,46 (м, 2H), 3,67 (с, 3H), 5,27 (м, 1H);13C ЯМР (75 МГц, CDCl3) δ 21,1, 22,4, 22,9, 26,7, 28,6, 28,7, 28,9, 37,8, 40,2, 52,1, 79,1, 156, 1, 175,8; МС (APCI) m/z 186 [М+H-100(Boc)]+.
I. 1-(трет-Бутоксикарбониламинометил)-2-изобутилциклопропанкарбоновая кислота
К раствору метилового эфира 1-(трет-бутоксикарбониламинометил)-2-изобутилциклопропанкарбоновой кислоты (9,1 г, 31,9 ммоль) в MeOH (260 мл) добавляют раствор LiOH (3,34 г, 79,7 ммоль) в воде (80 мл). Реакционную смесь нагревают до температуры кипения с обратным холодильником в течение 3 часов и охлаждают до комнатной температуры. Избыток растворителя удаляют и остаток растворяют в воде (100 мл). Водный раствор промывают диэтиловым эфиром, подкисливают до pH 3 с помощью 2н. HCl и экстрагируют EtOAc (2·150 мл). Объединенную органическую фазу промывают насыщенным раствором соли, сушат (Na2SO4) и выпариванием растворителя получают 8,4 г (97%) 1-(трет-бутоксикарбониламинометил)-2-изобутилциклопропанкарбоновой кислоты в виде бесцветного масла:1H MMR (300 МГц, CD3OD) δ 0,71 (дд, J=4,0, 6,4 Гц, 1H), 0,95 (т, J=6,4 Гц, 6H), 1,35 (м, 1H), 1,43 (с, 1H), 1,49-1,55 (м, 1H), 1,64-1,69 (м, 2H), 3,23 (д, J=14,2 Гц, 1H), 3,40 (д, J=14,2 Гц, 1H).
J. Гидрохлорид 1-аминометил-2-изобутилциклопропанкарбоновой кислоты
К раствору 1-(трет- бутоксикарбониламинометил)-2-изобутилциклопропанкарбоновой кислоты (2,8 г, 10,3 ммоль) в сухом 1,4-диоксане (60 мл) добавляют 4н. HCl (40 мл, в 1,4-диоксане). Реакционную смесь перемешивают при комнатной температуре в течение ночи и добавляют диэтиловый эфир (100 мл). Белый твердый продукт собирают и сушат, получая 1,6 г (76%) гидрохлорида 1-аминометил-2-изобутилциклопропанкарбоновой кислоты: т.пл. 254-255°С;1H ЯМР (300 МГц, D2O) δ 0,95 (т, J=6,2 Гц, 6H), 0,96 (м, 1H), 1,21-1,28 (м, 1H), 1,51-1,80 (м, 4H), 3,06 (д, J=13,8 Гц, 1H), 3,58 (д, J=13, 8 Гц, 1H);13C ЯМР (75 МГц, D2O) δ 21,7, 21,9, 22,2, 25,3, 28,1, 28,6, 37,1, 40,2, 178,1; МС (APCI) m/z 172 [М+H]+. Анал. рассчит. для C9H17NO2-HCl: C, 52,05; H, 8,74; N, 6,74. Найдено: C, 52,10; H, 8,73; N, 6,67.
Реферат
Настоящее изобретение относится к новым производным циклопропил-β-аминокислоты формулы (I),

где R1 и R2 выбирают независимо из группы, включающей водород, (C1-С10)-линейный или разветвленный алкил; либо R1 и R2, вместе с углеродом, к которому присоединены, образуют циклопентильный, циклогексильный или циклогептильный цикл, который, необязательно, может быть замещен одним или двумя заместителями, независимо выбираемыми из группы заместителей, перечисленных в приведенном выше определении R1 и R2; и R3 и R4 выбирают независимо из водорода и метила; фармацевтическим композициям, содержащим указанные соединения, и применению указанных композиций для лечения различных расстройств центральной нервной системы и прочих нарушений. Производные циклопропил-β-аминокислот по настоящему изобретению проявляют активность как альфа-2-дельта-лиганды (α2δ-лиганды). Такие соединения обладают сродством к α2δ-субъединице кальциевого канала. 3 н. и 1 з.п. ф-лы.
Формула


Комментарии