Саможелирующиеся альгинатные системы и их применение - RU2393867C2
Код документа: RU2393867C2
Чертежи




Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к альгинатным системам, которые имеют отсроченный процесс гелеобразования, и к компуазозициям, устройствам, наборам и способам изготовления и применения указанных систем.
УРОВЕНЬ ТЕХНИКИ
Данная заявка притязает на приоритет в отношении предварительной заявки США № 60/617852, озаглавленной «Self-Gelling Alginate Systems and Uses Thereof», поданной 12 октября 2004 г., которая включена в настоящий документ в виде ссылки.
Альгинаты представляют собой гидрофильные морские биополимеры, обладающие уникальной способностью образовывать термостабильные гели, которые могут формироваться и отверждаться при физиологически значимых темпуазературах. Альгинаты представляют собой семейство неразветвленных двойных сополимеров остатков β-D-маннуроновой кислоты (М) и α-L-глюкуроновой кислоты (G), соединенных 1-4 гликозидной связью. Относительное количество двух мономеров уроновой кислоты и последовательность их расположения в полимерной цепи широко варьирует в зависимости от природы альгината. Альгинат представляет собой структурный полимер морских бурых водорослей, таких как Laminaria hyperborea, Macrocystis pyrifera, Lessonia nigrescens и Ascophyllum nodosum. Альгинат также вырабатывают некоторые бактерии, такие как Pseudomonas aeruginosa, Azotobacter vinelandii и Pseudomonas fluorescens (WO04011628 A1).
Альгинатные гели образуются, когда двухвалентный катион формирует ионные связи с отрицательно заряженной группой из G остатка каждого из двух различных альгинатных полимеров, в результате чего два полимера оказываются поперечно сшитыми. Образование множества поперечных связей между многочисленными альгинатными полимерами приводит к образованию матрикса, который представляет собой структуру альгинатного геля.
Альгинатные гели могут представлять собой гидрогели, т.е. поперечно сшитые альгинатные полимеры, которые содержат большие количества воды, не растворяясь. Биополимерные гели, такие как альгинатные гидрогели, являются привлекательными кандидатами для тканевой инженерии и других биомедицинских целей. Благодаря этому, а также способности образовывать гели в физиологических условиях, альгинаты широко используются и изучаются для целей инкапсуляции и в качестве биоструктурного материала. Включение клеток в альгинатные гранулы является широко использующейся методикой. Также было показано, что альгинаты представляют собой полезный материал для других типов биологических структур, включая тканевую инженерию, и в качестве каркасов для регенерации нервов.
Существуют различные способы изготовления альгинатных гидрогелей. Наиболее распространенным способом является способ диализа/диффузии, при котором альгинатный раствор желируют диффузией гелеобразующих ионов из внешнего резервуара. Указанный способ обычно используют для изготовления альгинатных гелевых гранул, а также для пищевых целей. Изготовление альгинатных микрогранул представляет собой быстрый процесс, ограничиваемый диффузией гелеобразующих ионов в гелевую сеть. Хотя данный процесс хорошо подходит для заключения клеток в микрогранулы, он менее пригоден для изготовления других форм или структур. Для изготовления гелевых структур больших размеров диффузионные гелеобразующие системы могут иметь ограниченные возможности. Это происходит потому, что быстрый процесс гелеобразования ограничивает время, необходимое для придания формы гелевой структуре.
Задержку процесса гелеобразования можно использовать для инъецирования растворов в организм и/или для примешивания клеток или другого биологического материала к гелевому матриксу до формирования геля. Таким образом, альтернативные способы были разработаны для изготовления других типов биосовместимых альгинатных гелевых структур. Скорость гелеобразования можно уменьшить с помощью действующих изнутри гелеобразующих систем, из которых гелеобразующие ионы высвобождаются внутри формирующегося геля более медленно. Это описывается как затвердевание геля изнутри. Обычно для действующей изнутри гелеобразующей системы кальциевую соль с ограниченной растворимостью или компуазлексированные ионы Са2+смешивают с альгинатным раствором, в котором ионы кальция медленно высвобождаются. Сульфат кальция используют в носителях для доставки клеток на основе альгината для тканевой инженерии. Высвобождение кальция и кинетику гелеобразования также можно контролировать путем использования кальциевых солей с рН-зависимой растворимостью и добавления медленно действующей кислоты, такой как D-глюконо-δ-лактон (GDL). При изменении рН ионы кальция высвобождаются. Также липосомы, содержащие кальций, используют в качестве контролируемой альгинатной гелеобразующей системы. Альгинатные гелевые системы, основанные на внутреннем гелеобразовании, могут иметь более определенный и ограниченный источник поступления гелеобразующих ионов в противоположность диффузионным системам, в которых ионы кальция диффундируют в альгинатный раствор с образованием насыщенного кальцием геля.
Современные способы изготовления альгинатных гелевых структур имеют ограничения. Некоторые технологии пригодны лишь для изготовления гелей ограниченных размеров и форм. В зависимости от использования могут иметь место проблемы, связанные с контролем кинетики гелеобразования. В некоторых случаях в гелях присутствуют нежелательные материалы, поскольку указанные материалы представляют собой остатки и побочные продукты механизмов гелеобразования, которые контролировались химическими средствами. В некоторых случаях для гелеобразования требуются нефизиологические значения рН, и подобные условия могут представлять ограничения для использования указанных способов. Таким образом существует потребность в других гелеобразующих системах и компуазозициях.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к наборам для изготовления альгинатного геля. Наборы включают в себя первый контейнер, содержащий растворимый альгинат, и второй контейнер, содержащий частицы нерастворимый альгинат/гелеобразующий ион.
Настоящее изобретение относится также к компуазозициям для изготовления альгинатных гелей. Компуазозиции включают непосредственно растворимый альгинат и частицы нерастворимый альгинат/гелеобразующий ион.
Настоящее изобретение относится также к способам дозирования саможелирующейся альгинатной дисперсии. Способы заключаются в формировании дисперсии частиц нерастворимый альгинат/гелеобразующий ион в растворе растворимого альгината и дозировании дисперсии, посредством чего дисперсия формирует альгинатный гелевый матрикс.
Настоящее изобретение относится также к способам дозирования саможелирующейся альгинатной дисперсии индивидууму. Способы заключаются в формировании дисперсии частиц нерастворимый альгинат/гелеобразующий ион в растворе растворимого альгината и дозировании дисперсии индивидууму, посредством чего дисперсия формирует альгинатный гелевый матрикс в теле индивидуума.
Настоящее изобретение относится также к способам дозирования саможелирующейся альгинатной дисперсии индивидууму для применения в качестве материала для увеличения объема ткани, для применения в процедуре эмболизации сосудов, применения для профилактики образования спаек после оперативного вмешательства, для применения в процедуре обработки ран, применения для лечения диабета и применения для лечения артрита.
Настоящее изобретение относится также к способам применения импуазлантируемого альгинатного геля. Способы заключаются в формировании саможелирующегося альгината путем дозирования саможелирующейся альгинатной дисперсии и после образования геля импуазлантирования импуазлантируемого альгинатного геля индивидууму.
Настоящее изобретение относится также к способам изготовления импуазлантируемых устройств.
Настоящее изобретение относится также к альгинатным гелям, имеющим толщину более 5 мм и гомогенную сеть альгинатного матрикса.
Настоящее изобретение относится также к альгинатным гелям, имеющим толщину более 5 мм и не содержащим один или более из сульфатов, цитратов, фосфатов, лактатов, EDTA или липидов.
Настоящее изобретение относится также к импуазлантируемым устройствам, включающим гомогенное альгинатное гелевое покрытие.
Настоящее изобретение относится также к способам пломбирования или восстановления костно-хрящевых дефектов, возникающих в результате остеоартрита, путем дозирования саможелирующейся альгинатной дисперсии, которая содержит хондроциты, в организм индивидуума или путем импуазлантации биологически совместимого матрикса, который содержит хондроциты, в организм индивидуума.
Настоящее изобретение относится также к способам лечения диабета путем дозирования саможелирующейся альгинатной дисперсии, которая содержит инсулинпродуцирующие клетки или многоклеточные агрегаты, в организм индивидуума или путем импуазлантации биологически совместимого матрикса, который содержит инсулинпродуцирующие клетки или многоклеточные агрегаты, в организм индивидуума.
Настоящее изобретение относится также к способам улучшения жизнеспособности панкреатических островков или других клеточных агрегатов или ткани после выделения и во время хранения и транспортировки путем инкорпорирования островков или клеточных агрегатов или ткани в саможелирующуюся альгинатную дисперсию.
Настоящее изобретение относится также к сверхчистым частицам нерастворимый альгинат/гелеобразующий ион и способам их изготовления.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фигура 1 содержит данные реометрических измерений. Осцилляционные измерения осуществляли с использованием реометра Physica MCR300. Показаны модули хранения в зависимости от времени гелей со следующими различными концентрациями альгината кальция (Protaweld TX 120) (концентрации в смеси/геле): 1,0% альгинат кальция, смешанный с 1,0% альгинатом натрия, и 1,5% альгинат кальция, смешанный с 1,0% альгинатом натрия, и 2,0% альгинат кальция, смешанный с 1,0% альгинатом натрия. В качестве альгината натрия использовали Protanal SF 120.
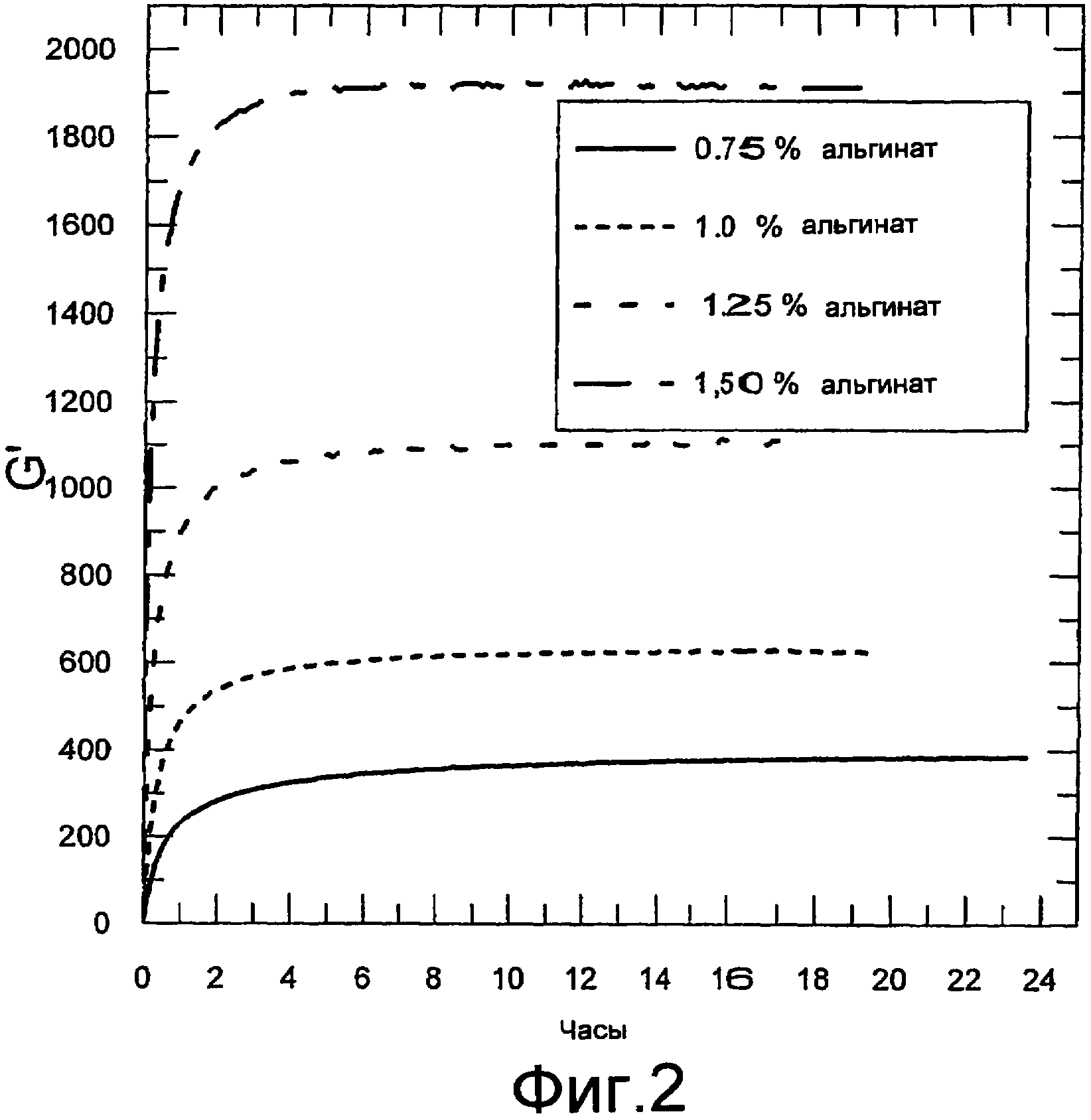
Фигура 2 содержит данные реометрических измерений. Осцилляционные измерения осуществляли с использованием реометра Physica MCR300. Показаны модули хранения в зависимости от времени гелей, изготовленных смешиванием равных количеств альгината натрия (Protanal SF 120) и альгината кальция (Protaweld TX 120) со следующими концентрациями в геле: 0,75%, 1%, 1,25% или 1,5% альгината натрия и альгината кальция.
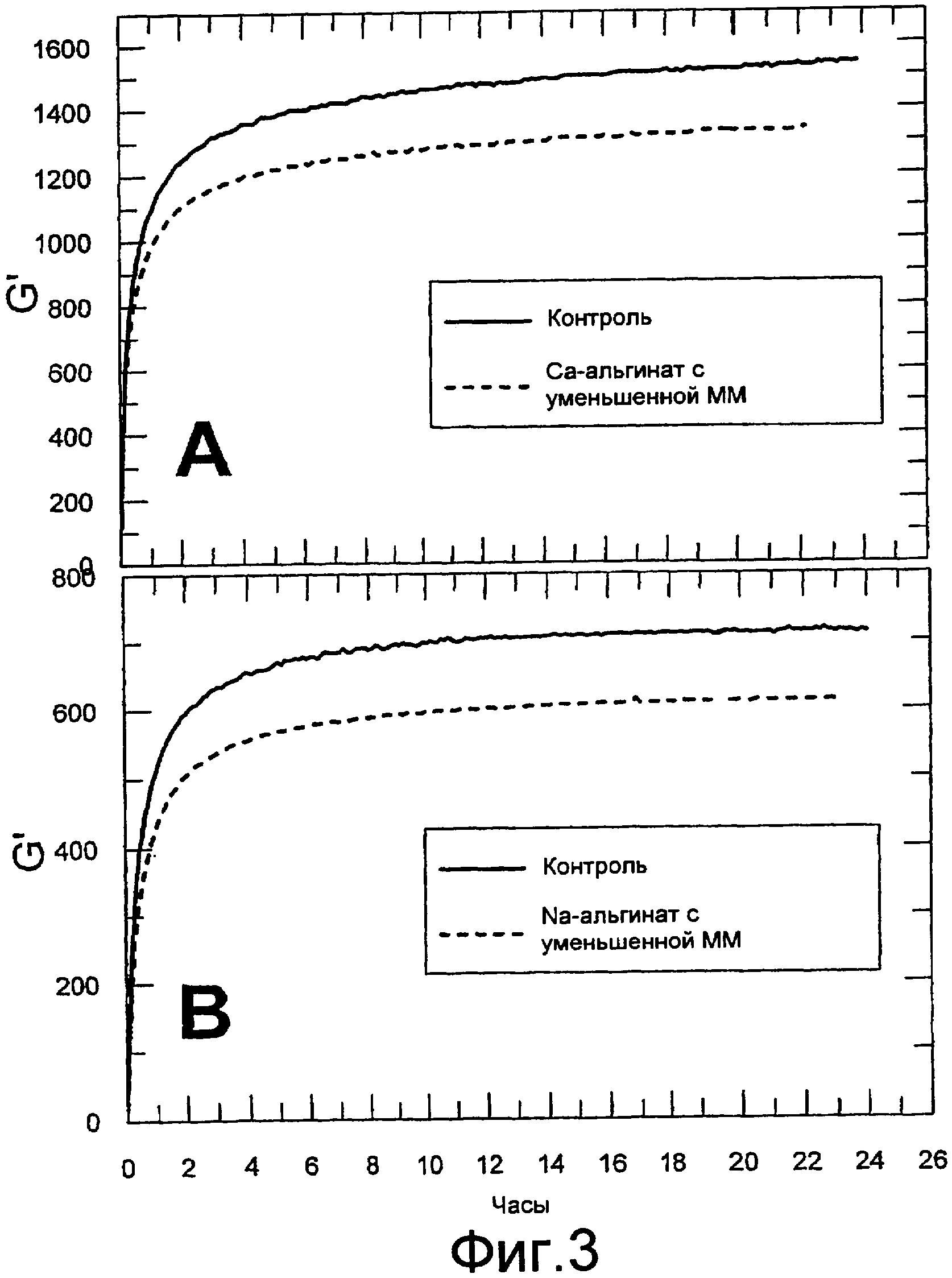
Фигура 3 содержит данные реометрических измерений. Осцилляционные измерения осуществляли с использованием реометра Physica MCR300. Показаны модули хранения в зависимости от времени гелей, содержащих альгинаты кальция (часть А) и альгинаты натрия (часть В) с различными молекулярными массами. Гели на графике А содержат 1% альгината натрия и 1,5% альгината кальция, а гели на графике В содержат 1% альгината кальция и 1% альгината натрия. В графике А использовали следующие альгинаты: Альгинат кальция: Protaweld TX 120 и Protaweld TX 120, разлагавшийся в течение 33 дней при 60°С. Вязкость (1% раствора при 20°С) двух Са-альгинатов, измеренная как у альгината натрия, составляла 270 и 44 , соответственно. Альгинат натрия: Protanal SF 120. В графике В использовали следующие альгинаты: Альгинат кальция: Protaweld TX 120. Альгинат натрия: Protanal SF 120 и Protanal SF/LF. Вязкость (1% раствора при 20°С) альгинатов натрия составляла 95 и 355 , соответственно.
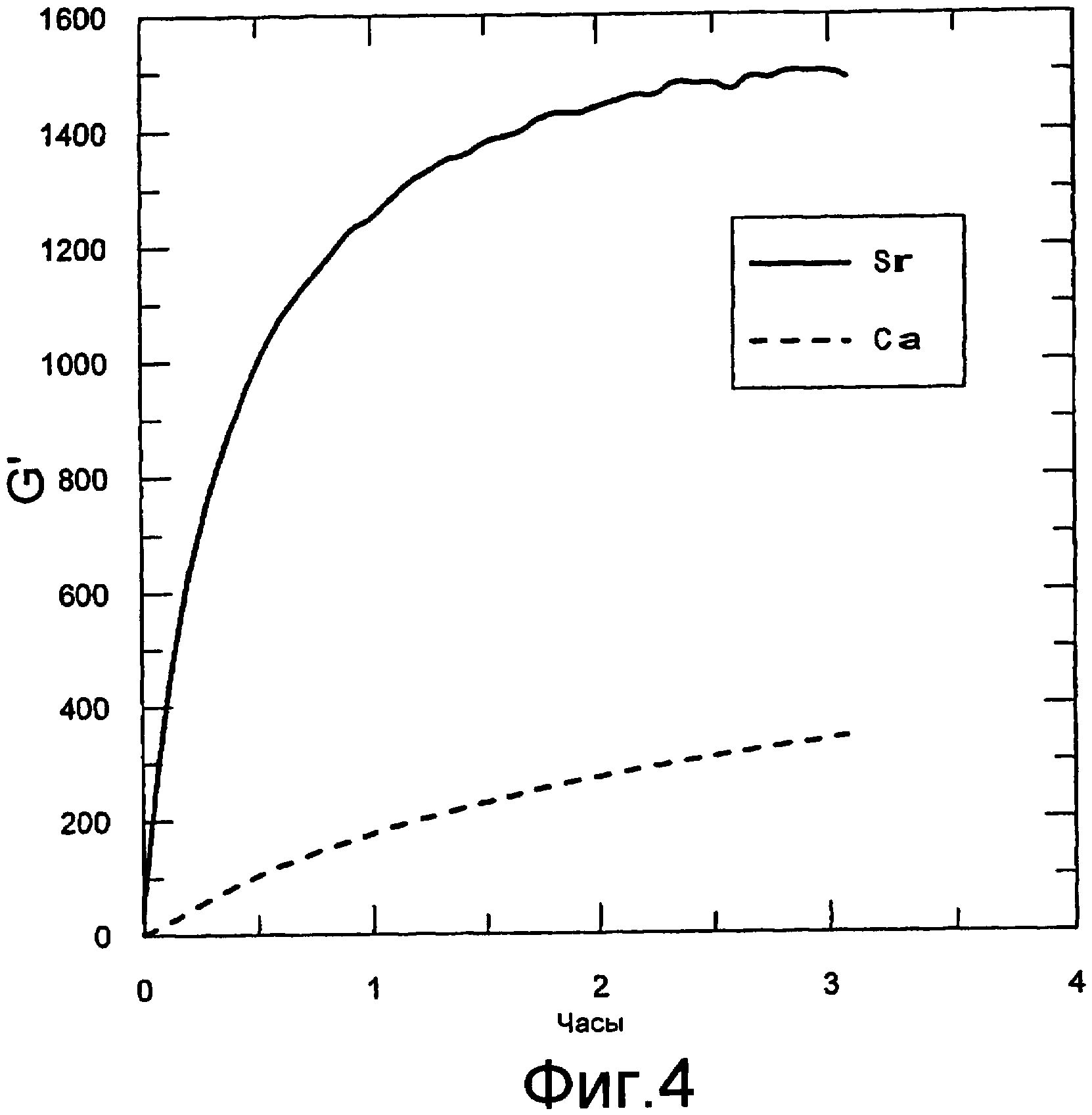
Фигура 4 содержит данные реометрических измерений. Осцилляционные измерения осуществляли с использованием реометра Physica MCR300. Показаны модули хранения в зависимости от времени гелей, изготовленных с использованием стронция или кальция в качестве гелеобразующих ионов. Количество альгината натрия (Protanal SF 120) и альгината стронция/кальция доводили до 0,75% содержания в геле для каждого. Использовавшийся альгинат кальция получали смешиванием альгиновой кислоты (продукт процесса FMC) (65,2 г) с карбонатом кальция (35,32 г) в лабораторной месилке в течение 1 часа, затем сушкой и размалыванием. Использовавшийся альгинат стронция получали смешиванием альгиновой кислоты (продукт процесса FMC) (65,2 г) с карбонатом стронция (52,10 г) в лабораторной мешалке в течение 1,5 часов, затем сушкой и размалыванием.
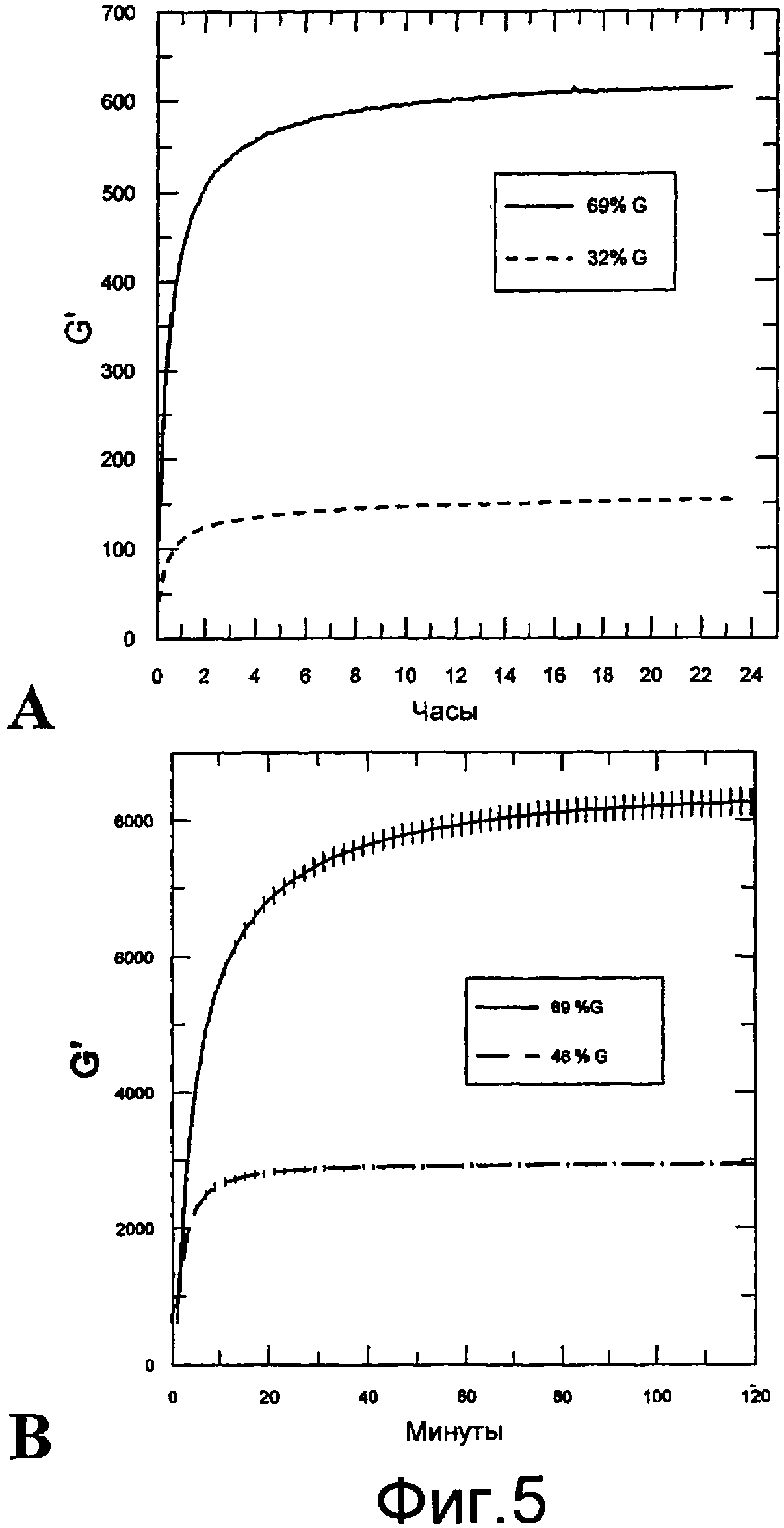
Фигура 5 содержит данные реометрических измерений. Осцилляционные измерения осуществляли с использованием реометра Physica MCR300. Показаны модули хранения в зависимости от времени гелей, содержащих альгинат натрия с высоким и низким содержанием гулуроновой кислоты. На фигуре 5, часть А, количество использовавшихся альгината кальция (Protaweld TX 120) и альгината натрия доводили до 1,0% содержания в геле. Использовали альгинаты натрия Protanal SF 120 (69% G) и Protanal HF 60D (32% G, ММ: 119 000). На фигуре 5, часть В, 5,5% альгината стронция (пример 14) смешивали с 1,25% альгинатом натрия в соотношении 1:4 (конечная концентрация альгината составляла 2,1%). Использовали альгинаты натрия PRONOVA UP 100G (69% G, ММ: 122 000) и PRONOVA UP 100M (46% G, ММ: 119 000). Подбирали как можно более сходные ММ (и вязкость) двух партий альгината натрия. Каждая кривая на фигуре 5, часть В, представляет собой среднее от трех независимых измерений (кривых) со стандартной ошибкой среднего, показанной для каждого пункта.
Фигура 6 показывает стабильность и биоразлагаемость альгинатных гелей, изготовленных с различным содержанием ионов кальция и хранившихся в течение 6 месяцев в физиологических условиях. Гелевые диски изготавливали смешиванием автоклавированной дисперсии альгината кальция (Protaweld TX 120) и стерильного профильтрованного альгината натрия (PRONOVA UP LVG) до конечной концентрации 1,0% каждого альгината и дисперсию желировали в двух чашках Петри. Гелевые диски в одной чашке (маркировка V) промывали 50 мМ хлоридом кальция в течение 10 минут после застудневания, а затем в обе чашки добавляли среду для культивирования клеток (DMEM с добавлением 10% FBS). Чашки хранили в стерильных условиях в СО2-термостате и среду регулярно меняли три раза в неделю. Размеры самого большого гелевого диска в каждой чашке сначала были одними и теми же. Показанные фотографии были сделаны спустя шесть месяцев.
Фигура 7 показывает данные экспериментов с использованием клеток, заключенных в саможелирующийся альгинат. Фигура 7, часть А, показывает мышиные миобласты С2С12 через 45 дней после заключения в саможелирующийся альгинатный гель. Гель изготавливали и хранили, как описано на фигуре 6, но с включенными клетками. Фотография была сделана с использованием флюоресцентного микроскопа после окрашивания клеток кальцеином (Molecular Probes, L-3224) как маркером жизнеспособности клеток. Просветленные области и пятна показывают наличие жизнеспособных клеток. Жизнеспособные клетки располагаются внутри и на поверхности гелевой конструкции. Фигура 7, часть В, показывает человеческие хондроциты, заключенные в саможелирующийся альгинатный гель. Гель изготавливали из 5 мл смешанного саможелирующегося геля PRONOVA SLG 20 и альгината кальция (пример 14), содержавшего человеческие хондроциты. Через три дня после застудневания гели нарезали на 600 мкм среды с использованием вибратома. Гелевые срезы хранили в ростовой среде для клеток в СО2-термостате, а фотография была сделана спустя шесть месяцев. Фотография была сделана с использованием флюоресцентного микроскопа после окрашивания клеток кальцеином (Molecular Probes, L-3224) на предмет жизнеспособности и ясно показывает наличие большого количества жизнеспособных клеток (просветленные участки).
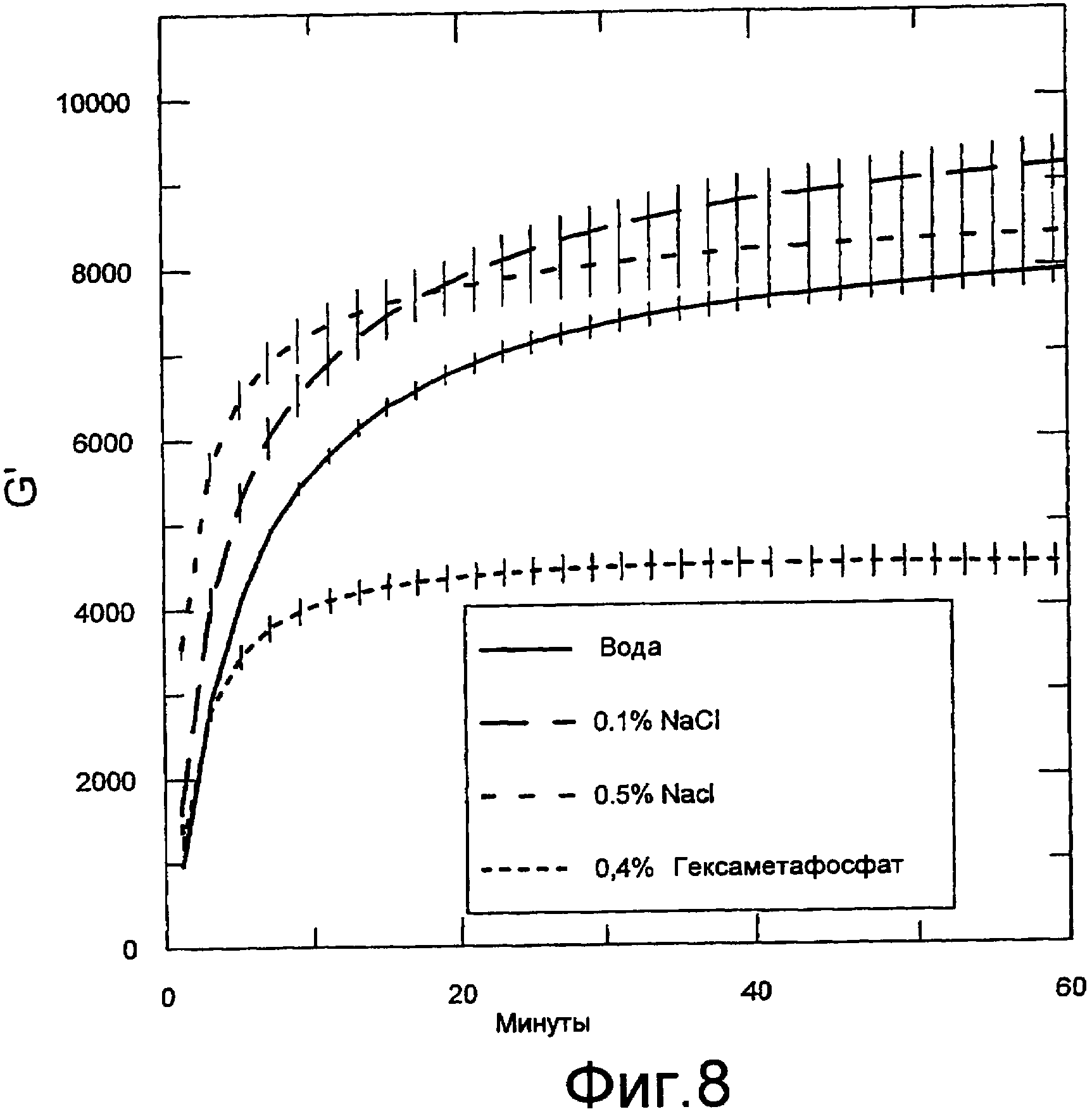
Фигура 8 содержит данные реометрических измерений. Осцилляционные измерения осуществляли с использованием реометра Physica MCR300. Показаны модули хранения в зависимости от времени гелей, содержащих 1,25% альгината натрия (PRONOVA UP 100G) в смеси с 5,5% альгинатом стронция (пример 14) в соотношении 4:1 (конечная концентрация альгината составляла 2,1%) в присутствии или в отсутствии хлорида натрия или гексаметафосфата натрия. Каждая кривая представляет собой среднее от трех независимых измерений (кривых) со стандартной ошибкой среднего, показанной для каждой точки.
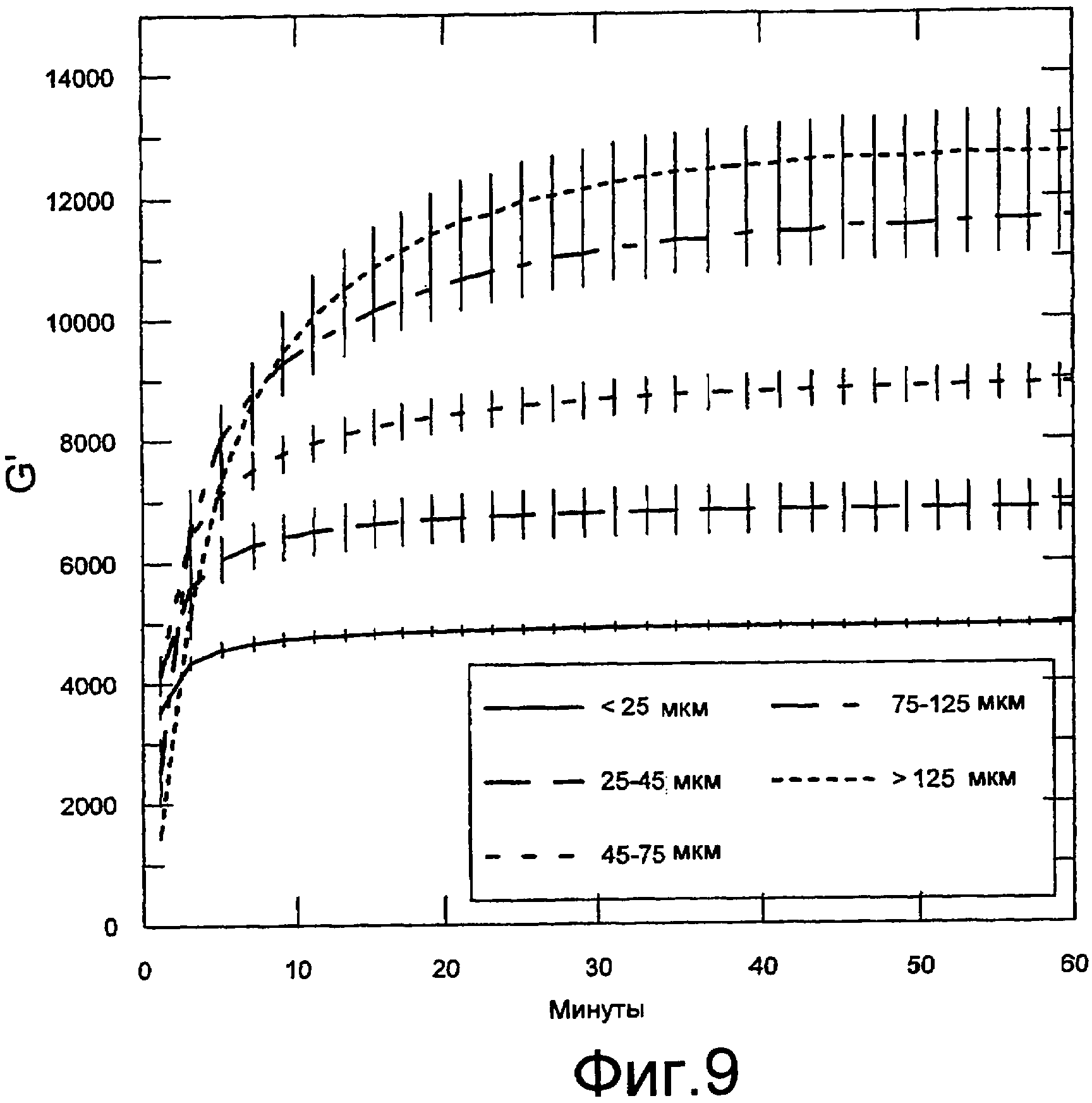
Фигура 9 содержит данные реометрических измерений. Осцилляционные измерения осуществляли с использованием реометра Physica MCR300. Показаны модули хранения в зависимости от времени гелей, содержащих 1,25% альгината натрия (PRONOVA UP 100G) в смеси с 5,5% альгинатом кальция (пример 14), изготовленным с различными размерами частиц в соотношении 4:1 (конечная общая концентрация альгината составляла 2,1%). Различные размеры частиц получали размалыванием лиофилизированного альгината кальция и просеиванием с получением указанных размеров. Каждая кривая представляет собой среднее от трех независимых измерений (кривых) со стандартной ошибкой среднего, показанной для каждой точки.
Фигура 10 содержит данные реометрических измерений. Осцилляционные измерения осуществляли с использованием реометра Physica MCR300. Показаны модули хранения в зависимости от времени гелей, содержащих 1,25% альгината натрия (PRONOVA UP LVG) в смеси с 10% альгинатом кальция (пример 14), при различных темпуазературах в соотношении 9:1 (конечная концентрация альгината составляла 2%).
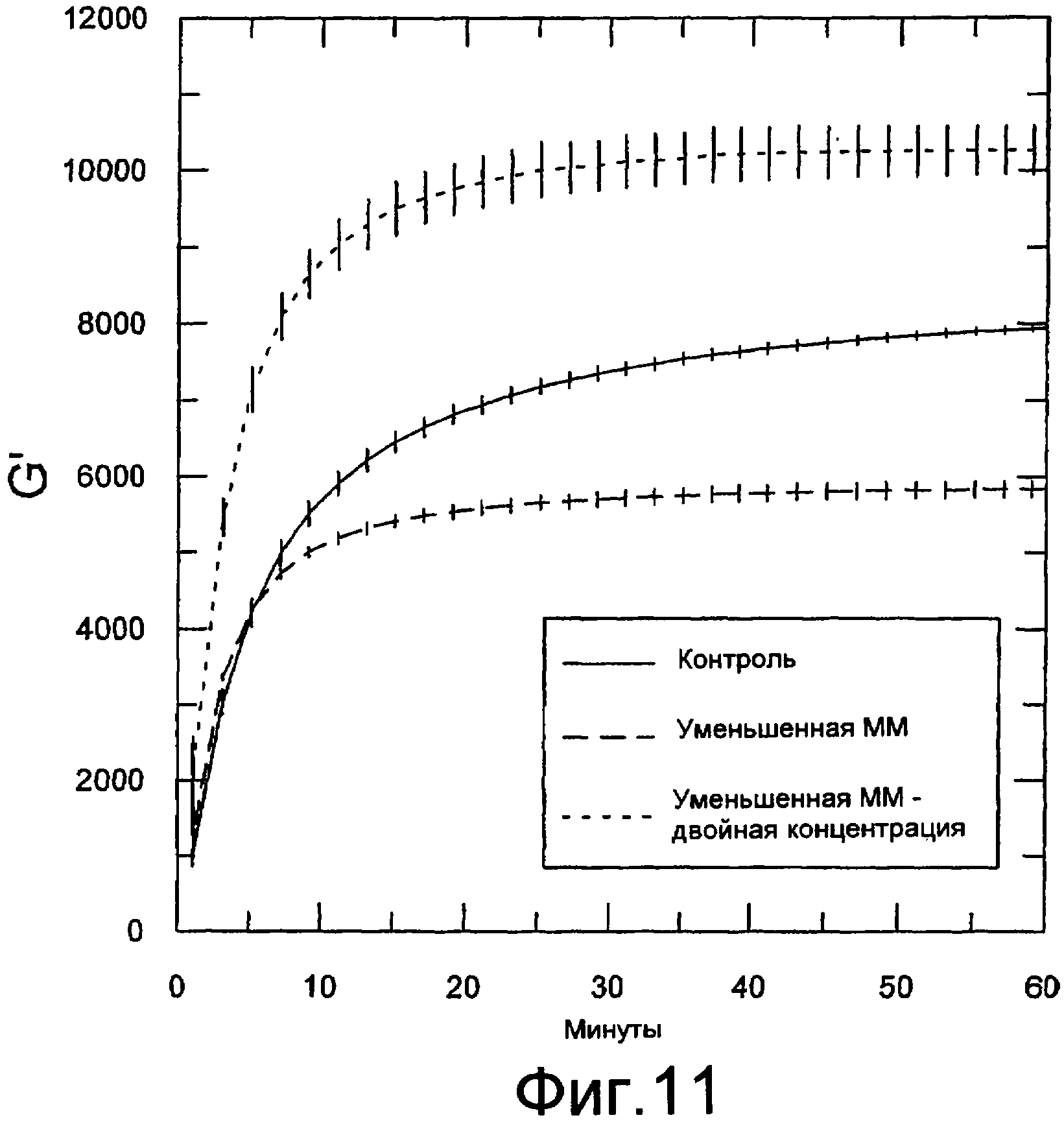
Фигура 11 содержит данные реометрических измерений. Осцилляционные измерения осуществляли с использованием реометра Physica MCR300. Показаны модули хранения в зависимости от времени гелей, содержащих альгинат натрия с различными молекулярными массами. Гель содержит 1,25% альгината натрия (PRONOVA UP 100G), неразложившегося (контроль), или ту же партию альгината, подвергнувшегося разложению. Был изготовлен также гель из разложившегося альгината натрия с концентрацией 2,5% (верхняя кривая). Во всех случаях альгинаты натрия смешивали с 5,5% альгинатом стронция (пример 14) в соотношении 4:1. Каждая кривая представляет собой среднее от трех независимых измерений (кривых) со стандартной ошибкой среднего, показанной для каждой точки.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Разработана альтернативная альгинатная гелеобразующая система. Указанная система используется в многочисленных биомедицинских целях, а также в других областях. Система может включать в себя альгинат и гелеобразующие ионы, которые имеют высокую степень биологической совместимости. Система предусматривает варьирование времени гелеобразования и прочности геля в зависимости от потребностей конкретного применения. Система обеспечивает гелеобразование без изменений рН, связанных с другими системами, и требует минимального количества компуазонентов.
Система включает в себя два компуазонента: один представляет собой растворимый альгинат; другой представляет собой частицы нерастворимый альгинат/гелеобразующий ион. Когда компуазоненты объединяют в присутствии растворителя с получением дисперсии, начинает формироваться альгинатный гель по мере того, как гелеобразующий ион частиц начинает поперечную сшивку альгинатных полимеров из частиц и растворимых альгинатных полимеров в растворе. Два компуазонента можно смешивать путем перемешивания или использования подходящего перемешивающего устройства. Кинетика гелеобразования компуазозиции зависит от нескольких факторов, включая: концентрацию растворимого альгината в растворе, концентрацию частиц нерастворимого альгината в дисперсии, содержание гелеобразующего иона по отношению к альгинату, наличие негелеобразующих ионов или других углеводов, темпуазературу, размер частиц нерастворимый альгинат/гелеобразующий ион, содержание клеток, многоклеточных агрегатов, тканей или других биологических материалов, которые должны быть помещены в гель или присутствуют во время гелеобразования (наличие примесей), и типы использующихся альгинатов, а также процесс изготовления частиц нерастворимого альгината и постпроизводственную обработку альгинатных исходных материалов. Данная альгинатная система, таким образом, может быть широко адаптирована для каждой конкретной цели. Для помещения клеток, многоклеточных агрегатов, тканей или других биологических материалов в формирующийся гель, растворитель, альгинатный раствор или дисперсию можно предварительно смешивать с материалом, который должен быть в него заключен.
Дисперсию можно дозировать индивидууму в виде жидкости/взвеси в тот участок, в котором желательно получить альгинатный гелевый матрикс. Образование альгинатного геля, инициированное, когда растворимый альгинат и частицы нерастворимого альгината/гелеобразующего иона смешали в присутствии растворителя, продолжается и альгинатный гель затвердевает in situ. Используемый в настоящем документе термин «саможелирующийся» относится к процессу гелеобразования, который наблюдается, когда растворимый альгинат и частицы нерастворимый альгинат/гелеобразующий ион смешивают в присутствии растворителя. «Саможелирующийся альгинат» представляет собой альгинатную дисперсию или гель, который включает в себя или образован растворимым альгинатом и частицами нерастворимый альгинат/гелеобразующий ион в растворителе.
Компуазоненты, использующиеся в системе, можно содержать перед употреблением в любой из нескольких форм. Например, растворимый альгинат можно содержать в растворе или в виде порошка. В некоторых вариантах осуществления настоящего изобретения растворимый альгинат можно содержать в виде порошка, который немедленно растворяется, такого как лиофилизированный порошок. Подобно этому частицы нерастворимый альгинат/гелеобразующий ион можно содержать в виде дисперсии или в виде порошка.
Альгинатные полимеры или их комбинации, используемые в растворимом альгинате, могут быть одними и теми же или отличаться от альгинатных полимеров или их комбинаций в частицах нерастворимый альгинат/гелеобразующий ион.
Концентрация альгината, как растворимого альгината, так и альгината в форме частиц нерастворимый альгинат/гелеобразующий ион, в дисперсии по отношению к количеству растворителя влияет на время гелеобразования, порозность, стабильность и биоразлагаемость, прочность и эластичность гелей, и можно изготавливать гели, обладающие конкретными свойствами, с использованием конкретных соотношений растворимого альгината и частиц нерастворимый альгинат/гелеобразующий ион с растворителем. Обычно, чем ниже концентрация альгината (для данного соотношения растворимого альгината и нерастворимого альгината), тем более биоразлагаемым будет гель. В некоторых вариантах осуществления настоящего изобретения можно использовать приблизительно 0,5%, 0,75%, 1%, 1,25%, 1,5%, 2%, 2,5%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10% или более альгината (растворимого альгината и альгината в форме частиц нерастворимый альгинат/гелеобразующий ион).
Относительная концентрация растворимого альгината по отношению к альгинату в форме частиц нерастворимый альгинат/гелеобразующий ион в дисперсии влияет на время гелеобразования, размер пор, прочность и эластичность гелей, а также стабильность и биоразлагаемость, и можно изготавливать гели, обладающие конкретными свойствами, с использованием конкретных соотношений растворимого альгината и частиц нерастворимый альгинат/гелеобразующий ион. В некоторых вариантах осуществления настоящего изобретения концентрация растворимого альгината приблизительно равна концентрации альгината в форме частиц нерастворимый альгинат/гелеобразующий ион (1:1). В некоторых вариантах осуществления настоящего изобретения концентрация альгината в форме частиц нерастворимый альгинат/гелеобразующий ион в два раза превышает концентрацию растворимого альгината (2:1). В некоторых вариантах осуществления настоящего изобретения концентрация альгината в форме частиц нерастворимый альгинат/гелеобразующий ион составляет половину от концентрации растворимого альгината (1:2). В некоторых вариантах осуществления настоящего изобретения концентрация альгината в форме частиц нерастворимый альгинат/гелеобразующий ион относится к концентрации растворимого альгината как 1 к 0,7 (1:0,7). Обычно, чем меньше наличие гелеобразующего иона, тем более биоразлагаемым будет гель. Можно применять уменьшение концентрации нерастворимого альгината/гелеобразующего иона в системе, чтобы создавать гели с более низкой стабильностью и более высокой биоразлагаемостью, связанных с тем, что гелевая сеть является менее насыщенной ионами, обеспечивающими поперечную сшивку. Саможелирование вносит поправку в изготовление гелей с более низкими концентрациями гелеобразующего иона, чтобы получать гели, особенно хорошо подходящие для таких целей, где требуется биологическое разложение. В некоторых предпочтительных вариантах осуществления настоящего изобретения отношения альгинатов в частицах нерастворимый альгинат/гелеобразующий ион и растворимого альгината составляют 5:1, 4:1, 3:1, 2:1, 1:1, 1:2, 1:3, 1:4 или 1:5.
Относительное содержание мономеров G и М в альгинатных полимерах влияет на размер пор, стабильность и биоразлагаемость, прочность и эластичность гелей. Альгинатные полимеры имеют различные вариации общего содержания М и G, и относительное содержание последовательных структур также широко варьирует (G-блоки, М-блоки и MG перемежающиеся последовательности), как и длина последовательностей по ходу полимерной цепи. Обычно, чем ниже содержание G по сравнению с содержанием М в используемых альгинатных полимерах, тем более биоразлагаемым будет гель. Гели с высоким содержанием G в альгинате обычно имеют большие размеры пор и являются более прочными по сравнению с гелями с высоким содержанием М в альгинате, у которых размеры пор меньше, а прочность ниже. В некоторых вариантах осуществления настоящего изобретения один или более из альгинатных полимеров альгинатного матрикса содержат более 50% α-L-гулуроновой кислоты. В некоторых вариантах осуществления настоящего изобретения один или более из альгинатных полимеров альгинатного матрикса содержат более
60% α-L-гулуроновой кислоты. В некоторых вариантах осуществления настоящего изобретения один или более из альгинатных полимеров альгинатного матрикса содержат от 60% до 80% α-L-гулуроновой кислоты. В некоторых вариантах осуществления настоящего изобретения один или более из альгинатных полимеров альгинатного матрикса содержат от 65% до 75% α-L-гулуроновой кислоты. В некоторых вариантах осуществления настоящего изобретения один или более из альгинатных полимеров альгинатного матрикса содержат более 70% α-L-гулуроновой кислоты. В некоторых вариантах осуществления настоящего изобретения один или более из альгинатных полимеров альгинатного матрикса содержат более 50% С-5 эпимера β-D-маннуроновой кислоты. В некоторых вариантах осуществления настоящего изобретения один или более из альгинатных полимеров альгинатного матрикса содержат более 60% С-5 эпимера β-D-маннуроновой кислоты. В некоторых вариантах осуществления настоящего изобретения один или более из альгинатных полимеров альгинатного матрикса содержат от 60% до 80% С-5 эпимера β-D-маннуроновой кислоты. В некоторых вариантах осуществления настоящего изобретения один или более из альгинатных полимеров альгинатного матрикса содержат от 65% до 75% С-5 эпимера β-D-маннуроновой кислоты. В некоторых вариантах осуществления настоящего изобретения один или более из альгинатных полимеров альгинатного матрикса содержат более 70% С-5 эпимера β-D-маннуроновой кислоты. Процедуры получения уроновых блоков описаны в патенте США № 6121441. G-блоковые альгинатные полимеры и их применение в качестве модуляторов свойств альгинатных гелей описаны в патенте США № 6407226. Некоторые предпочтительные варианты осуществления настоящего изобретения, 30% G, 35% G, 40% G, 45% G, 50% G, 55% G, 60% G, 65% G, 70% G, 75% G, 80% G или 85% G.
Средняя молекулярная масса альгинатных полимеров влияет на время гелеобразования, размер пор, прочность и эластичность гелей. Альгинатные полимеры могут иметь средние молекулярные массы от 2 до 1000 кДа. Молекулярная масса альгинатов может влиять на гелеобразование и окончательные свойства геля. Обычно, чем ниже молекулярная масса используемого альгината, тем более биоразлагаемым будет гель. Альгинатные полимеры или их комбинации, используемые в компуазонентах растворимого альгината, могут быть одними и теми же или отличаться от полимеров или их комбинаций, используемых в частицах нерастворимый альгинат/гелеобразующий ион. В некоторых вариантах осуществления настоящего изобретения альгинатные полимеры альгинатного матрикса имеют среднюю молекулярную массу от 5 до 350 кДа. В некоторых вариантах осуществления настоящего изобретения альгинатные полимеры альгинатного матрикса имеют среднюю молекулярную массу от 2 до 100 кДа. В некоторых вариантах осуществления настоящего изобретения альгинатные полимеры альгинатного матрикса имеют среднюю молекулярную массу от 50 до 500 кДа. В некоторых вариантах осуществления настоящего изобретения альгинатные полимеры альгинатного матрикса имеют среднюю молекулярную массу от 100 до 1000 кДа. В некоторых вариантах осуществления настоящего изобретения разработаны гели, имеющие высокую степень биоразлагаемости. Соответственно, гели, содержащие меньше альгината, меньше гелеобразующего иона, альгинаты с более низким содержанием G и более низкими молекулярными массами, можно изготавливать с использованием более низких лимитов указанных параметров, как описано в настоящем документе, чтобы получать гели с более высокой степенью биоразлагаемости.
Альгинат может обладать вязкостью в 1% растворе, измеренной при 20 градусах Цельсия, от 25 до 1000 и в некоторых вариантах осуществления настоящего изобретения, предпочтительно, от 50 до 1000 (1% раствор, 20°С).
В некоторых вариантах осуществления настоящего изобретения предпочтительно, чтобы способы изготовления частиц нерастворимый альгинат/гелеобразующий ион обеспечивали продукты со стехиометрическим количеством (100% насыщение) гелеобразующего иона. Использование указанных стехиометрических солей сообщает саможелирующимся альгинатным системам более высокую воспроизводимость. В некоторых вариантах осуществления настоящего изобретения предпочтительно, чтобы способ изготовления частиц нерастворимый альгинат/гелеобразующий ион обеспечивал продукты с субстехиометрическим количеством (< 100% насыщение) указанного гелеобразующего иона. Использование указанных субстехиометрических солей сообщает саможелирующимся альгинатным системам биоразлагаемость.
В некоторых вариантах осуществления настоящего изобретения альгинат представляет собой сверхчистый альгинат. Сверхчистый альгинат является коммерчески доступным, например, из различных морских водорослей, таких как Laminaria Hyperborea. Коммерческие кальциевые соли альгиновой кислоты обычно производят с использованием процессов, при которых кальций добавляют к альгиновой кислоте в твердой фазе простым смешиванием и перемешиванием компуазонентов. Примерами коммерчески доступных кальциевых солей альгиновой кислоты являются Protaweld (от FMC BioPolymer) и Kelset от ISP Corporation. Частицы нерастворимый альгинат/гелеобразующий ион можно изготавливать с использованием сверхчистого альгината путем изготовления альгинатного геля с использованием сверхчистого альгината и гелеобразующего иона, отмывания от натриевых и других ионов, которые присутствовали в сверхчистом альгинате, сушки геля для удаления воды и изготовления частиц из высушенного геля. В некоторых вариантах осуществления настоящего изобретения частицы нерастворимый альгинат/гелеобразующий ион представляют собой стехиометрические соли. Частицы нерастворимый альгинат/гелеобразующий ион предпочтительно имеют высокую чистоту и особое, постоянное и обычно однородное содержание гелеобразующего иона, такого как, например, кальций или стронций, барий, цинк, железо, марганец, медь, свинец, кобальт, никель или их комбинации, таким образом, чтобы скорость гелеобразования и прочность геля можно было обеспечить с более высокой степенью предсказуемости. Нерастворимые соли альгиновой кислоты с щелочноземельными металлами, такие как, например, альгинат кальция или альгинат стронция (в зависимости от используемого гелеобразующего иона), или нерастворимые соли альгиновой кислоты с переходными металлами (такие как соли с гелеобразующими ионами меди, никеля, цинка, свинца, железа, марганца или кобальта) можно изготавливать с использованием известного и заранее определенного количества ионов щелочных металлов путем осаждения из растворов. В некоторых вариантах осуществления настоящего изобретения коммерчески доступный альгинат натрия сначала используют для изготовления раствора альгината натрия. Необязательно, натриевую соль, такую как карбонат натрия, можно включать в раствор альгината натрия. Соль, содержащую желательный гелеобразующий ион для частицы нерастворимый альгинат/гелеобразующий ион, такую как, например, соль кальция или соль стронция, такую как хлорид кальция или хлорид стронция, используют для изготовления раствора. Раствор альгината натрия объединяют, предпочтительно медленно, с раствором гелеобразующего иона. Предпочтительно, объединенные растворы непрерывно перемешивают во время процесса смешивания. Нерастворимый альгинат, такой как, например, альгинат кальция или альгинат стронция (в зависимости от используемого гелеобразующего иона), выпадает в осадок из объединенных растворов. Осажденный нерастворимый альгинат затем следует удалить из раствора и повторно отмывать, например, 2-10 раз очищенной водой, чтобы удалить все растворимые ионы. Удаление растворимых ионов подтверждается, например, тестированием проводимости нерастворимого альгината в очищенной воде по сравнению с проводимостью очищенной воды. После отмывания нерастворимый альгинат можно высушить, например, в условиях вакуума. Высушенный альгинат можно размалывать и в некоторых вариантах осуществления настоящего изобретения сортировать по размеру частиц.
В некоторых вариантах осуществления настоящего изобретения альгинат является стерильным. В некоторых предпочтительных вариантах осуществления настоящего изобретения альгинат представляет собой стерильный сверхчистый альгинат. Условия, которые часто используются для стерилизации материала, могут изменить альгинат, например уменьшить молекулярную массу. В некоторых вариантах осуществления настоящего изобретения стерильный альгинат изготавливают с использованием стерилизационных фильтров. В некоторых вариантах осуществления настоящего изобретения альгинат имеет уровень эндотоксина <25 ЭЕ/грамм.
В некоторых вариантах осуществления настоящего изобретения альгинатный матрикс может быть покрыт поликатионным полимером, подобным полиаминокислотному полимеру или хитозану, после формирования гелевого матрикса. В некоторых вариантах осуществления настоящего изобретения поликатионным полимером является полилизин. В некоторых вариантах осуществления настоящего изобретения полилизин связан с другой частью, и полилизин, таким образом, используется для облегчения связи указанной части с гелем. Примеры частей, связанных с гелем с использованием поликатионных полимеров, включают, например, лекарственные средства, пептиды, контрастные реагенты, лиганды, связывающиеся с рецепторами, или другие детектируемые метки. Некоторые конкретные примеры включают фактор роста эндотелия сосудов (VEGF), фактор роста эпидермиса (EGF), трансформирующий фактор роста (TGF) и морфогенный белок костей (BMP). Лекарственные средства могут включать противораковые химиотерапевтические агенты, такие как таксол, цисплатин и/или другие производные, содержащие платину. Углеводные полимеры могут включать гиалуронан, хитозан, гепарин, ламинарин, фукоидан, хондроитинсульфат. В некоторых вариантах осуществления настоящего изобретения используемые альгинаты представляют собой модифицированные альгинатные полимеры, такие как химически модифицированный альгинат, в котором один или более полимеров связаны с другим альгинатным полимером. Примеры указанных модифицированных альгинатных полимеров можно найти в патенте США № 6642363, который включен в настоящий документ в качестве ссылки.
В некоторых вариантах осуществления настоящего изобретения альгинатный полимер может включать неальгинатную часть, такую как, например, лекарственное средство, пептид, контрастный реагент, лиганд, связывающийся с рецепторами, или другую детектируемую метку. В одном варианте осуществления настоящего изобретения альгинатный полимер включает пептид RDG (Arg-Asp-Gly), радиоактивную часть (например,131I) или рентгеноконтрастное вещество. Другие примеры частей, связанных с альгинатными полимерами, включают, например, лекарственные средства, пептиды, контрастные реагенты, лиганды, связывающиеся с рецепторами, или другие детектируемые метки. Некоторые конкретные примеры включают фактор роста эндотелия сосудов (VEGF), фактор роста эпидермиса (EGF), трансформирующий фактор роста (TGF) и морфогенный белок костей (BMP). Лекарственные средства могут включать противораковые химиотерапевтические агенты, такие как таксол, цисплатин и/или другие производные, содержащие платину. Углеводные полимеры могут включать гиалуронан, хитозан, гепарин, ламинарин, фукоидан, хондроитинсульфат.
Растворимый альгинат может представлять собой соль, такую как, например, Na+-альгинат, К+-альгинат, PEG-альгинат (полиэтиленгликоль-альгинат), NH4-альгинат или их комбинации.
В некоторых вариантах осуществления настоящего изобретения растворимый альгинат является лиофилизированным или каким-либо другим способом обезвоженным. Лиофилизированный растворимый альгинат является «быстрорастворимым». «Быстрорастворимый» альгинат растворяется в воде менее чем за одну минуту, предпочтительно менее чем за 30 секунд, более предпочтительно менее чем за 15 секунд. «Легкорастворимый» альгинат растворяется более чем за одну минуту и обычно за несколько минут.
Гелеобразующие ионы, используемые в частицах нерастворимый альгинат/гелеобразующий ион, влияют на кинетику гелеобразования, прочность и эластичность геля. Гелеобразующие ионы оказывают влияние также на рост клеток. Гелеобразующие ионы, используемые в частицах нерастворимый альгинат/гелеобразующий ион, могут представлять собой Ca++, Sr++, Ba++, Zn++, Fe++, Mn++, Cu++, Pb, Co, Ni или их комбинации.
Компуазлексы нерастворимый альгинат/гелеобразующий ион представляют собой частицы. Частицы обычно не являются волокнистыми на основе соотношения L/D, когда форма частиц характеризуется наибольшим измерением (L) и наименьшим измерением (D). Неволокнистое соотношение L/D составляет менее 10, предпочтительно менее 5, предпочтительно менее 2. L/D 10 или более представляет собой укороченное волокно. Нерастворимый альгинат/гелеобразующий ион можно поддерживать в виде дисперсии или в сухой форме. В первом случае дисперсию можно смешивать с раствором, содержащим растворимый альгинат, или с быстрорастворимым альгинатом, чтобы образовывалась дисперсия частиц нерастворимый альгинат/гелеобразующий ион в растворе, содержащем растворимый альгинат. Если частицы нерастворимый альгинат/гелеобразующий ион находятся в сухой форме, их можно смешивать с сухим быстрорастворимым альгинатом и впоследствии с раствором для формирования дисперсии частиц нерастворимый альгинат/гелеобразующий ион в растворе, содержащем растворимый альгинат, или сухие частицы нерастворимый альгинат/гелеобразующий ион можно объединять с раствором, содержащим растворимый альгинат, для формирования дисперсии нерастворимый альгинат/гелеобразующий ион в растворе, содержащем растворимый альгинат.
Перемешивание, которое наблюдается при смешивании компуазонентов для формирования дисперсии, приводит к распределению твердых частиц в растворе. Полученная таким образом дисперсия может быть в форме взвеси, которую можно выливать, инъецировать или каким-либо другим способом саможелировать в матрице или полости для получения формы указанной матрицы или полости.
После получения дисперсии частиц нерастворимый альгинат/гелеобразующий ион в растворе, содержащем растворимый альгинат, ее дозировано помещают в определенное место, в котором наблюдается саможелирование с образованием альгинатного геля. В некоторых вариантах осуществления настоящего изобретения дисперсию дозировано помещают в определенное место in vivo. В некоторых вариантах осуществления настоящего изобретения дисперсию дозировано помещают в определенное место определенного организма. В некоторых вариантах осуществления настоящего изобретения дисперсию дозировано помещают в матрицу или иной контейнер или на поверхность.
Концентрация гелеобразующих ионов, используемых в частицах нерастворимый альгинат/гелеобразующий ион, влияет на кинетику гелеобразования, прочность и эластичность геля. Чем выше концентрация гелеобразующих ионов, тем выше прочность геля. Прочность геля является самой высокой, когда гель насыщен гелеобразующими ионами. Напротив, чем ниже концентрация гелеобразующих ионов, тем ниже прочность геля и выше степень биоразлагаемости.
Размер частиц нерастворимый альгинат/гелеобразующий ион может влиять на кинетику гелеобразования и конечные свойства геля. Чем меньше размер частиц, тем быстрее завершается гелеобразование. Частицы большего размера дают более прочные гели. Размеры частиц можно контролировать, например, просеиванием частиц нерастворимый альгинат/гелеобразующий ион через фильтры различных размеров таким образом, что частицы могут находиться в заранее определенных пределах размеров. В некоторых вариантах осуществления настоящего изобретения частицы имеют размеры <25 мкм, 25-45 мкм, 45-75 мкм, 75-125 мкм или >125 мкм.
Используемым растворителем может являться, например, вода, физиологический раствор, раствор сахара, культуральная клеточная среда, раствор, такой как раствор лекарственного средства, белка или нуклеиновой кислоты, суспензия, такая как клеточная суспензия, липосомы или суспензия контрастного реагента.
Сформированный альгинатный гидрогель может включать, например, лекарственные средства, молекулы нуклеиновой кислоты, клетки, многоклеточные агрегаты, ткани, белки, ферменты, липосомы, контрастный реагент или биологически активный материал. Примерами биологически активного материала являются гиалуронат и хитозан. Контрастные реагенты включают тантал и гадолиний. Некоторые конкретные примеры белков включают фактор роста эндотелия сосудов (VEGF), фактор роста эпидермиса (EGF), трансформирующий фактор роста (TGF) и морфогенный белок костей (BMP). Лекарственные средства могут включать противораковые химиотерапевтические агенты, такие как таксол, цисплатин и/или другие производные, содержащие платину. Углеводные полимеры могут включать гиалуронан, хитозан, гепарин, ламинарин, фукоидан, хондроитинсульфат.
Клетки, которые можно использовать в гелях, включают нерекомбинантные и рекомбинантные клетки. В некоторых вариантах осуществления настоящего изобретения, в которых клетки инкапсулированы в альгинатном матриксе, инкапсулированные клетки представляют собой клетки млекопитающих, предпочтительно человеческие клетки. В некоторых вариантах осуществления настоящего изобретения, в которых инкапсулированные клетки представляют собой непролиферирующие клетки, непролиферирующие клетки могут быть выбраны из группы, состоящей из панкреатических островков, печеночных клеток, нервных клеток, клеток почечной коры, клеток сосудистого эндотелия, тиреоидных и паратиреоидных клеток, клеток надпочечников, тимических клеток, клеток яичников и хондроцитов. В некоторых вариантах осуществления настоящего изобретения, в которых инкапсулированные клетки представляют собой пролиферирующие клетки, пролиферирующие клетки могут представлять собой стволовые клетки, клетки-предшественники, пролиферирующие клетки конкретных органов, фибробласты и кератиноциты или клетки, полученные из установившихся клеточных линий, таких как, например, клеточные линии 293, MDCK и С2С12. В некоторых вариантах осуществления настоящего изобретения инкапсулированные клетки содержат экспрессирующий вектор, который кодирует один или более белков, которые экспрессируются при культивировании клеток. В некоторых вариантах осуществления настоящего изобретения белок представляет собой цитокин, фактор роста, инсулин или ингибитор ангиогенеза, такой как ангиостатин или эндостатин, другие терапевтические белки или другие терапевтические молекулы, такие как лекарственные средства. Белки с более низкой ММ, менее приблизительно 60-70 кДа, являются особенно хорошими кандидатами благодаря порозности гелевой сети. В некоторых вариантах осуществления настоящего изобретения клетки присутствуют в виде многоклеточных агрегатов или ткани.
Саможелирующиеся альгинаты можно использовать для изготовления альгинатных гелей более 5 мм с однородной альгинатной сетью. В некоторых вариантах осуществления настоящего изобретения однородный альгинатный гель превышает 10 мм. Гели, образованные с использованием способов диффузии, обычно представляют собой неоднородные альгинатные гели более 1 мм. В предпочтительных вариантах осуществления настоящего изобретения однородный альгинатный гель, образованный саможелированием альгинатного геля, не содержит сульфатов, цитратов, фосфатов (TSPP: тетранатриевый пирофосфат и полифосфат используют в пищевом производстве для альгинатных пудингов и т.п.), лактатов, EDTA (этилендиаминтетрауксусной кислоты) и липидов как в липосомах, используемых для инкапсулирования гелеобразующего иона.
Существует множество видов применения саможелирующегося альгината. В некоторых вариантах осуществления настоящего изобретения саможелирующийся альгинат используют в продуктах питания. Саможелирующиеся альгинаты, которые являются особенно подходящими для продуктов питания, которые изготавливают в виде жидкой/суспензионной смеси с другими пищевыми ингредиентами и разливают в емкости. Емкостью, предпочтительно, является форма, в которой гелевый/пищевой продукт затвердевает с образованием твердого или полутвердого продукта указанной формы. Можно изготавливать конфеты, съедобные украшения, пудинги и другие формованные пищевые продукты.
В некоторых вариантах осуществления настоящего изобретения саможелирующиеся альгинаты используют в биомедицинских целях. Биологически совместимые саможелирующиеся альгинаты можно применять местно. Биологически совместимые саможелирующиеся альгинаты являются особенно подходящими для таких биомедицинских целей, при которых желательным является, чтобы гелевый матрикс соответствовал пространству in situ таким образом, чтобы саможелирующийся альгинат можно было дозировать в виде дисперсии в то место, в которое желательно поместить матрикс. Дисперсия заполняет полость или пространство в форме жидкости/взвеси и затвердевает, образуя твердое вещество внутри полости или пространства. Альтернативно, дисперсию можно наносить местно, где ее можно распределить до затвердевания. В некоторых вариантах осуществления настоящего изобретения саможелирующиеся альгинаты используют для изготовления матриц, которым можно придавать конкретные формы путем изготовления жидкой/суспензионной смеси, которую помещают в форму, где она затвердевает, образуя твердое вещество указанной формы, а также для изготовления матриц с инкапсулированными клетками, подходящих для замещения тканей или органов.
Разработаны альгинатные саможелирующиеся системы, которые являются контролируемыми, биологически совместимыми и особо разработанными для гелеобразования in situ с импуазлантационными целями. Разработаны растворы, которые можно легко использовать для инъекций или наносить другими способами на поверхность или внутрь тела, которые затвердевают, образуя твердые гелевые матрицы. Посредством смешивания альгината в присутствии растворителя с источником гелеобразующих ионов, в котором гелеобразующие ионы находятся в связанном состоянии внутри гелевой сети нерастворимой частицы, гелеобразующий материал может дозировано вводиться в виде жидкости и затвердевать, принимая желательную форму в течение определенного интервала времени. Раствор за определенное время затвердевает и образует гель. Компуазозиция является биологически совместимой, поскольку изменения рН и присутствие токсических соединений исключаются. Существенные отклонения от биологических величин рН являются излишними.
В некоторых вариантах осуществления настоящего изобретения саможелирующийся альгинат используют в биомедицинских целях, таких как придание тканям объема, как при лечении проблем рефлюкса (т.е. для лечения недержания мочи, проблем почечного рефлюкса или пищеводного рефлюкса), эмболизация, как при лечении доброкачественных или злокачественных опухолей, противоспаечное лечение в качестве послеоперационных процедур и лечение ран. Современную технологию можно использовать в разнообразных целях, включая конструирование тканей ex vivo или in vivo, поскольку клетки и другие биоматериалы можно примешивать в гелеобразующую систему, создавая таким образом биологический искусственный внеклеточный матрикс, служащий основой для клеток или ткани. Согласно некоторым видам использования можно импуазлантировать биологически совместимые твердые депо, которые постепенно высвобождают активные ингредиенты, такие как белки и лекарственные средства.
Саможелирующийся альгинат является особенно пригодным в качестве материала, придающего объем тканям, поскольку его можно вводить в место, которое является труднодоступным, и дозировано вводить в виде жидкой взвеси, чтобы обеспечить более полное, по сравнению с другими типами импуазлантатов, соответствие полости. Дисперсию можно вводить в количестве, достаточном для замещения и поддержки других тканей или органов тела, и после образования гель in situ создает структуру для поддержания и поддержки других тканей или органов. Саможелирующийся альгинат может содержать компуазоненты, которые делают его весьма подходящим для целей придания объема тканям. Например, использование стронция в качестве гелеобразующего агента приводит к образованию геля, который ингибирует избыточный рост клеток и образование нежелательной ткани.
Саможелирующийся альгинат является особенно пригодным для процедур эмболизации, поскольку его можно вводить в кровеносный сосуд, который является труднодоступным, и дозировано вводить в виде жидкой взвеси, чтобы обеспечить более полное, по сравнению с другими типами средств закрытия, такими как швы, соответствие внутренней части кровеносного сосуда и более полный и эффективный его блок. Дисперсию можно вводить в количестве, достаточном для блокирования кровообращения после образования геля in situ. Саможелирующийся альгинат может содержать компуазоненты, которые делают его весьма подходящим для целей эмболизации. Например, компуазоненты можно выбирать на предмет обеспечения относительно быстрого затвердевания и высокой прочности. Саможелирующийся альгинат, используемый для целей эмболизации, может содержать контрастные реагенты для мониторирования его наличия и локализации.
Саможелирующийся альгинат является особенно пригодным для противоспаечного лечения в качестве послеоперационных процедур, поскольку его можно наносить на область хирургического вмешательства в виде жидкой взвеси, чтобы обеспечить полное покрытие подвергшихся воздействию поверхностей непосредственно в местах разрезов или вблизи от них. Саможелирующийся альгинат может содержать компуазоненты, которые делают его весьма подходящим для целей противоспаечного лечения. Например, использование стронция в качестве гелеобразующего агента приводит к образованию геля, который ингибирует избыточный рост клеток и образование нежелательной ткани.
Саможелирующийся альгинат является особенно пригодным для лечения ран, поскольку его можно наносить на поверхность раны в виде жидкой взвеси, чтобы обеспечить полное покрытие подвергшихся воздействию поверхностей. Помимо этого, саможелирующийся альгинат можно вводить внутрь в область раны, например, в виде жидкой взвеси. Дисперсию можно вводить в количестве, достаточном для заполнения внутренней полости, после чего образование геля in situ будет закрывать любые внутренние раны и предотвращать кровопотерю вследствие внутреннего кровотечения. Саможелирующийся альгинат может содержать компуазоненты, которые делают его весьма подходящим для целей лечения ран. Например, можно включать в его состав компуазоненты, способствующие свертыванию крови, а также антисептические и антибиотические компуазозиции.
Саможелирующийся альгинат является особенно пригодным для изготовления тканевых конструкций ex vivo или in vivo. Клетки или другие биоматериалы можно примешивать в гелеобразующую систему, создавая таким образом биологический искусственный внеклеточный матрикс, служащий основой для клеток или ткани. Дисперсию можно вводить in situ в виде жидкой взвеси в то место, в котором ткань/клетка может функционировать для достижения терапевтического эффекта. Примеры тканевых конструкций включают кость, хрящ, соединительную ткань, мышцу, печень, сердечную ткань, ткань поджелудочной железы и кожу. Примерами указанных конструкций могут быть препараты, содержащие секретирующие инсулин клетки, для лечения диабета, компуазозиции, содержащие хондроциты для восстановления дефектных суставов, и клетки для лечения болезни Паркинсона. Указанные клетки можно инкорпорировать в жидкую взвесь и дозировано вводить в то место, в котором после образования геля они будут существовать и функционировать внутри биологически совместимого альгинатного матрикса. Гель можно использовать также в качестве иммунного барьера, защищающего заключенные в нем клетки от иммунной системы хозяина. Саможелирующийся альгинат также можно использовать для инкапсулирования клеток ex vivo, причем гель можно формировать в соответствии с предназначенной целью. В некоторых вариантах осуществления настоящего изобретения саможелирующийся альгинат можно использовать для инкапсулирования клеток, таких как клетки кожи, и изготавливать искусственную кожу подобно той, которую используют для лечения ожоговых больных и других пациентов, нуждающихся в пересадке кожи или имеющих обширные заживающие раны. В некоторых вариантах осуществления настоящего изобретения саможелирующиеся альгинаты можно использовать для инкапсулирования клеток ex vivo и формирования матриц, которые можно импуазлантировать.
Лечение диабета может включать изготовление биологически совместимого матрикса, содержащего инсулинпродуцирующие клетки, путем изготовления дисперсии, содержащей частицы нерастворимый альгинат/гелеобразующий ион и инсулинпродуцирующие клетки в растворе растворимого альгината, и введения дисперсии в участок тела индивидуума, где образуется биологически совместимый матрикс. Участок тела индивидуума может представлять собой полость или структуру, импуазлантированную индивидууму. Дисперсию можно помещать в форму, структуру или контейнер, где она образует биологически совместимый матрикс, который импуазлантируют в организм индивидуума. Инсулин, вырабатываемый клетками в матриксе, секретируется клетками и высвобождается из матрикса в организм индивидуума, где он функционирует для облегчения симпуазтомов диабетического состояния. В некоторых вариантах осуществления настоящего изобретения инсулинпродуцирующие клетки представляют собой клетки панкреатических островков. В некоторых вариантах осуществления настоящего изобретения инсулинпродуцирующие клетки представляют собой рекомбинантные клетки, полученные для экспрессии и секреции инсулина.
Саможелирующийся альгинат является особенно пригодным для изготовления устройств с покрытием, таких как устройства для импуазлантации. В некоторых вариантах осуществления настоящего изобретения устройство выбрано из группы, состоящей из стента, сердечного водителя ритма, катетера, импуазлантируемого протеза, хирургического винта, хирургической проволоки, импуазлантата для придания объема тканям, импуазлантата, подавляющего эзофагеальный рефлюкс, импуазлантата, подавляющего недержание мочи, импуазлантата, подавляющего почечный рефлюкс, контейнера, подходящего для содержания клеток, которые депонируются на внешней поверхности и/или инкапсулируются в альгинатный матрикс, такого как твердое устройство или микрокапсула, импуазлантата молочной железы, импуазлантата подбородка, импуазлантата щеки, импуазлантата грудной клетки, импуазлантата ягодицы и зубного импуазлантата. Покрытие из саможелирующегося альгината обеспечивает эффективное покрытие вне зависимости от формы. Использование стронция в качестве гелеобразующего иона является особенно подходящим для ингибирования избыточного роста клеток после импуазлантации.
Саможелирующиеся альгинаты можно использовать для изготовления матриц, которые можно импуазлантировать. Указанным матрицам можно придавать конкретные формы путем изготовления жидкой/суспензионной смеси, которую разливают в форму, где она затвердевает с образованием твердого продукта указанной формы. Матрицы, изготовленные для импуазлантации, могут содержать биологически активные агенты и/или клетки. Гели можно изготавливать и импуазлантировать хирургическим путем, наносить местно или в орган через внешние отверстия.
Согласно некоторым вариантам осуществления настоящего изобретения разработаны наборы для изготовления альгинатного геля. Наборы могут содержать первый контейнер, содержащий растворимый альгинат, и второй контейнер, содержащий частицы нерастворимый альгинат/гелеобразующий ион. Отдельные контейнеры могут представлять собой отделения объединенной контейнерной системы.
В некоторых вариантах осуществления настоящего изобретения наборы включают растворимый альгинат в форме раствора. В некоторых вариантах осуществления настоящего изобретения наборы включают растворимый альгинат, не содержащий растворителя. В некоторых вариантах осуществления настоящего изобретения наборы включают дополнительный контейнер, содержащий растворитель.
В некоторых вариантах осуществления настоящего изобретения наборы включают частицы нерастворимый альгинат/гелеобразующий ион в форме порошка. В некоторых вариантах осуществления настоящего изобретения наборы включают частицы нерастворимый альгинат/гелеобразующий ион в форме дисперсии.
В некоторых вариантах осуществления настоящего изобретения наборы включают дополнительный контейнер, содержащий лекарственное средство, пептид, белок, клетку, поддающуюся обнаружению метку или контрастный реагент. В некоторых вариантах осуществления настоящего изобретения наборы включают лекарственное средство, пептид, белок, клетку, поддающуюся обнаружению метку или контрастный реагент, включенные в контейнер, содержащий раствор или порошок растворимого альгината, и/или в контейнер, содержащий порошок или дисперсию частиц нерастворимый альгинат/гелеобразующий ион.
Согласно некоторым вариантам осуществления настоящего изобретения разработаны компуазозиции для изготовления геля. Компуазозиция включает быстрорастворимый альгинат и частицы нерастворимый альгинат/гелеобразующий ион. Компуазозиция может дополнительно содержать лекарственное средство, пептид, белок, поддающуюся обнаружению метку или контрастный реагент. Компуазозиция может представлять собой компуазонент в наборе. Подобный набор может дополнительно содержать контейнер с растворителем.
Наборы предпочтительно содержат инструкции по применению.
В некоторых вариантах осуществления настоящего изобретения наборы содержат смешивающее устройство. Смешивающие устройства могут представлять собой часть контейнера или контейнерной системы. В некоторых вариантах осуществления настоящего изобретения смешивающее устройство содержит клапанную систему, которая позволяет дисперсии проходить из одного контейнера в другой контейнер для облегчения смешивания.
В некоторых вариантах осуществления настоящего изобретения наборы содержат дозирующее устройство. Дозирующее устройство может представлять собой аппликатор в соединении со смешивающим устройством и/или контейнером, приспособленным для содержания дисперсии. В некоторых вариантах осуществления настоящего изобретения дозирующее устройство содержит катетер. В некоторых вариантах осуществления настоящего изобретения дозирующее устройство содержит шприц.
ПРИМЕРЫ
Пример 1: Гелеобразование при различных концентрациях кальция
В данном эксперименте гели изготавливали смешиванием раствора альгината натрия (Protanal SF 120) и дисперсии альгината кальция (Protaweld TX 120). Количество альгината кальция изменялось (1,0%, 1,5% или 2% в геле), в то время как количество альгината натрия оставалось постоянным (1% в геле). Затвердевание саможелирующейся системы с течением времени измеряли реометром Physica MCR300 (система измерения: РР50, зубчатая; темпуазература: 20°С; интервал: 1 мм; частота: 1 Гц; деформация: 0,005). Раствор и дисперсию смешивали непосредственно перед добавлением 3 мл образца в реометр и осцилляционный тест осуществляли в течение 18-24 часов.
Как показано на фигуре 1, прочность геля быстро возрастала в течение первых 1-2 часов, а затем изменение прочности геля уменьшалось, по мере того как гель демонстрировал тенденцию к стабилизации. Данные показывают также, что прочность геля возрастала при более высоких концентрациях кальция.
Пример 2: Гелеобразование при различных концентрациях альгината
Альгинатные саможелирующиеся системы изготавливали смешиванием раствора альгината натрия (Protanal SF 120) и суспензии альгината кальция и измерения производили, как описано в примере 1. Осцилляционные измерения осуществляли в течение 18-24 часов. Использовали равные количества альгината натрия (Protanal SF 120) и альгината кальция (Protaweld TX 120). Количество альгината натрия и альгината кальция, каждое, доводили до 0,75%, 1%, 1,25% и 1,5% в конечном геле соответственно (фигура 2). Кинетика гелеобразования имела сходный образец во всех четырех случаях. Однако, как в примере 1, прочность геля отчетливо возрастала с повышением концентраций альгината.
Пример 3: Гелеобразование с использованием альгинатов различной молекулярной массы
В данном эксперименте сравнивали кинетику гелеобразования с использованием альгинатов натрия и кальция различной молекулярной массы (фигура 3). Образец альгината (Protaweld TX 120) с уменьшенной ММ получали повышением темпуазературы в течение нескольких дней (фигура 3, часть А). Сравнивали также альгинаты натрия Protanal SF 120 и Protanal SF/LF с различными ММ (фигура 3, часть В). Реологические измерения осуществляли, как описано в примере 1, а данные представлены на фигуре 3. Как показано на фигуре, процесс гелеобразования отчетливо зависел от молекулярной массы альгината - как альгината натрия, так и альгината кальция. В обоих случаях прочность геля возрастала быстрее с использованием высокомолекулярного альгината, а также достигала более высокого уровня.
Подобно тому, что можно видеть на фигуре 3, фигура 11 также показывает гелеобразование образца альгината натрия (PRONOVA UP G100) с уменьшенной ММ, полученного с использованием повышения темпуазературы. Однако в данном случае гелеобразование инициировали смешиванием с альгинатом стронция. Как показано на фигуре 11, процесс гелеобразования отчетливо зависел от молекулярной массы альгината, поскольку прочность геля достигала более высокого уровня при использовании высокомолекулярного альгината. Данные фигуры 11, где использовали альгинат кальция или альгинат стронция при стехиометрии со 100% насыщением, также показывают, что повышение концентрации альгината может компуазенсировать уменьшение ММ в отношении прочности геля.
Пример 4: Гелеобразование с различными гелеобразующими ионами
В данном эксперименте альгинат кальция или стронция смешивали с альгинатом натрия (Protanal SF 120). Альгинаты кальция и стронция получали смешиванием альгиновой кислоты с карбонатом кальция. Реологические измерения осуществляли, как описано в примере 1, а данные представлены на фигуре 4. Количество альгината натрия и альгината стронция/кальция, каждое, доводили до 0,75% в геле. Очевидно, что использование стронция в качестве гелеобразующего иона обеспечивало более прочную структуру геля, а также более быструю кинетику гелеобразования.
Пример 5: Гелеобразование с различным содержанием гулуроновой кислоты
Поскольку известно, что содержание гулуроновой кислоты в альгинатах оказывает большое влияние на прочность альгинатных гелей, изучали эффект использования альгинатов натрия (Protanal SF 120 и Protanal HF 60D) с различным содержанием гулуроновой кислоты. На фигуре 5, часть А, показаны модули хранения в зависимости от времени для гелей, содержащих альгинат натрия с высоким или низким содержанием гулуроновой кислоты. На обеих кривых систему желировали смешиванием с дисперсией альгината кальция (Protaweld TX 120) с высоким содержанием гулуроновой кислоты. Количество использовавшихся альгината кальция и альгината натрия доводили до 1,0% содержания в геле каждого. Измерения осуществляли, как описано в примере 1. Очевидно, что использование альгината натрия с высоким содержанием гулуроновой кислоты увеличивает прочность геля системы, хотя в обоих случаях использовали альгинат кальция с высоким содержанием гулуроновой кислоты. На фигуре 5, часть В, альгинат стронция (продукт процесса FMC с высоким содержанием гулуроновой кислоты примера 14) также смешивали с альгинатами натрия с высоким и низким содержанием гулуроновой кислоты. Использовали альгинаты натрия PRONOVA UP 100G (69% G, ММ: 122 000) и PRONOVA UP 100M (46% G, ММ: 119 000). Подбирали похожие ММ (и вязкость) двух серий альгината натрия (как можно более сходные). Как ясно показывают приведенные данные, также при использовании альгината стронция в качестве источника гелеобразующих ионов использование альгината натрия с высоким содержанием гулуроновой кислоты увеличивало прочность геля по сравнению с альгинатом натрия с низким содержанием гулуроновой кислоты.
Пример 6: Стабильность гелей, изготовленных с различным содержанием кальция в физиологических условиях
В данном примере изучали стабильность и биоразлагаемость альгинатных гелей, изготовленных с различным содержанием ионов кальция (фигура 6). Гелевые диски изготавливали смешиванием альгината кальция (Protaweld TX 120), автоклавированного для стерильности, и стерильного профильтрованного альгината натрия (PRONOVA UP LVG) до конечной концентрации 1,0% и 0,7% соответственно. Дисперсии желировали в двух чашках Петри. Гелевые диски в одной чашке (маркировка V) после первоначального застудневания промывали 50 мМ хлоридом кальция в течение 10 минут, а затем в обе чашки добавляли среду для культивирования клеток (DMEM с добавлением 10% FBS). Среду в чашках затем заменяли свежей средой регулярно три раза в неделю и чашки хранили в стерильных условиях в СО2-термостате при 37°С. Исходные размеры самого большого гелевого диска в каждой чашке были одними и теми же. Спустя шесть месяцев главная фракция геля, не промывавшегося кальцием, как показано на фигуре 6, исчезала, в то время как гелевые диски, промывавшиеся дополнительным количеством кальция, показывали маленькое изменение размера или отсутствие изменения размера с течением времени. Это ясно показывает, что альгинатный гель, изготовленный с ограниченным содержанием кальция, может сильно деградировать при физиологических условиях.
Пример 7: Удерживание клеток
Инкапсулирование клеток в альгинатных микрогранулах представляет собой широко используемую технологию, которая в настоящее время разрабатывается для различных биомедицинских целей. Альгинатные гранулы используются как «биологическая фабрика» для терапевтических веществ. Альгинатный гель позволяет осуществляться притоку незаменимых питательных веществ, таких как кислород и глюкоза, и истечению желательных терапевтических молекул и отходов. Путем использования реактивных клеток, подобных островковым клеткам, «биологическая фабрика» реагирует на потребности организма-хозяина. Однако гелевой сети необходимо защищать удерживаемые клетки от иммунной системы хозяина, что крайне важно при импуазлантации чужеродных клеток в организм. Было, однако, показано, что клетки можно более удачно удерживать в других альгинатных структурах, отличных от микрогранул.
Показано также влияние геля на клетки, заключенные в саможелирующемся альгинатном матриксе по настоящему изобретению (фигура 7). В одном из экспериментов (фигура 7, часть А) мышиные миобластные клетки С2С12 смешивали с раствором альгината PRONOVA UP MVG перед смешиванием с автоклавированной дисперсией альгината кальция (Protaweld TX 120). Смесь, содержавшую клетки и 0,7% альгината натрия и 1,0% альгината кальция, инъецировали в чашки Петри и отливали из нее диски. Спустя несколько минут гель промывали 50 мМ хлоридом кальция в течение 10 минут с целью предотвратить деградацию геля (см. пример 6), а затем к гелю добавляли клеточную ростовую среду (DMEM с 10% FBS). Альгинатный гель/клеточную культуру хранили в СО2-термостате при 37°С в стерильных условиях и среду меняли регулярно три раза в неделю. Спустя 45 дней культивирования жизнеспособные клетки выявляли под микроскопом после окрашивания кальцеином. Для визуализации живых клеток использовали флюоресцентный микроскоп.
На фигуре 7, часть А, показано присутствие жизнеспособных клеток как снаружи, так и внутри геля. В силу разной фокусировки микроскопа на различных частях геля различные пятна на картинке видны более или менее четко. Многочисленные жизнеспособные клетки или малые клеточные колонии можно видеть внутри геля в виде малых просветленных пятен. Большая просветленная область, покрывающая большую часть картинки, показывает жизнеспособные клетки, которые проникли на поверхность геля и там размножились. Указанная часть поверхности геля полностью покрыта клетками, растущими в виде монослоев. Некоторое количество клеточных агрегатов, однако, также присутствует в других областях.
В другом эксперименте (фигура 7, часть В) человеческие хондроциты заключали в саможелирующийся альгинатный гель. В данном случае гель изготавливали из 5 мл смешанного саможелирующегося геля PRONOVA SLG 20 (лиофилизированные стерильные альгинаты низкой вязкости с высоким содержанием гулуроновой кислоты) и альгината кальция (продукт процесса FMC, пример 14), содержавшего человеческие хондроциты. Через три дня после затвердевания гели нарезали на 600 мкм среды с использованием вибратома. Гелевые срезы хранили в ростовой среде для клеток в СО2-термостате, а фотография была сделана спустя шесть месяцев. Фотография была сделана с использованием флюоресцентного микроскопа после окрашивания клеток кальцеином на предмет жизнеспособности. Фотография ясно показывает наличие большого количества жизнеспособных клеток. Альгинатная гелевая сеть, таким образом, должная быть хорошим матриксом для поддержания клеток в течение длительного периода времени. В заключение, данные отчетливо показывают, что гель может являться биологически совместимым матриксом для клеток и клеточного роста.
Был изготовлен также ряд различных альгинатных образцов, содержавших человеческие хондроциты. В данном случае были выбраны более высокомолекулярные альгинаты, чтобы сохранить прочность геля при низких концентрациях гелеобразующего иона и альгината. Альгинаты представляли собой PRONOVA SLG 100 и PRONOVA SLM 100 (лиофилизированные стерильные альгинаты высокой вязкости с высоким и низким содержанием гулуроновой кислоты, соответственно). Хондроциты смешивали с 2% раствором альгинатов в клеточной среде. Альгинатные/клеточные суспензии затем держали около получаса, чтобы высвободились пузырьки воздуха перед дальнейшим использованием. Клеточные суспензии смешивали с нерастворимыми стерильными альгинатами кальция или стронция (продукт процесса FMC из примера 14 во флаконах, содержавших 5 мл 10% альгинатной дисперсии, всего 0,5 мг альгината). Каждый флакон нерастворимого альгината содержал магнит для перемешивания и использовался после открывания в тот же день. Нерастворимые продукты также размалывали и просеивали с целью контролирования размеров частиц и были изготовлены как альгинаты стронция или кальция с высоким или низким содержанием гулуроновой кислоты. Смешивание альгинатной/клеточной суспензии и дисперсии нерастворимого альгината осуществляли в малых объемах в маленьких пробирках. Дисперсии нерастворимых альгинатов подвергали постоянному магнитному перемешиванию, когда из флаконов отбирали желательные объемы. Различные образцы смешивали, как описано в таблице 1, приведенной ниже.
Гелевые системы, содержащие клетки (исходные концентрации в скобках)
После первоначального гелеобразования в смеси в течение нескольких минут маленькие кусочки гелей хранили в культуральной клеточной среде в СО2-термостате и проверяли жизнеспособность клеток с помощью окрашивания кальцеином (как описано ранее) спустя неделю. В данном исследовании наблюдалась хорошая жизнеспособность клеток во всех образцах альгинатный гель/клетки. Альтернативно, образцы альгина/хондроциты можно изготовить in situ. В зависимости от целей использования различные саможелирующиеся компуазозиции можно адаптировать для конкретного применения. Гель может содержать клетки непосредственно, но также может содержать микрогранулы или другие биологические структуры, содержащие клетки. Компуазозицию можно инъецировать до того, как завершится гелеобразование, но можно также позволить гелю затвердевать ex vivo как полностью, так и частично до импуазлантации. Кроме того, гель можно изготавливать более или менее прочным или пористым, чтобы позволить или не позволить клеткам пролиферировать внутри геля, чтобы адаптировать к окружающей среде или обеспечить иммунологическую защиту. В зависимости от типа гелеобразующего иона и типа альгината гель можно составить таким образом, чтобы он был менее привлекательным для избыточного роста клеток. Также гелевую структуру можно изготовить более или менее биоразлагаемой, используя низкое содержание кальция (как показано в примере 6 и на фигуре 6), низкомолекулярный альгинат или низкие концентрации альгинатов. Гель можно также смешивать с другими биополимерами, такими как гиалуронат или хитозан, для улучшения его свойств. Можно также придать гелю дополнительную прочность с использованием дополнительного количества кальция в конструкции посредством подходящей процедуры пропитки или распыления.
Пример 8: Системы с контролируемым высвобождением
Была показана пригодность альгината в системах с контролируемым высвобождением для доставки лекарственных средств или других терапевтических молекул. Тип гелевых препаратов, которые показаны в настоящем документе, можно также использовать сходным образом, и они имеют преимущества в различных компуазозициях. Одним примером является использование биоразлагаемых гелей, т.е. использование низкой концентрации гелеобразующих ионов с целью ограничения периода лечения. При лечении пациентов со злокачественными опухолями заполняющий пространство гель, содержащий лекарственные средства или радиоактивные изотопы, можно использовать во время оперативных вмешательств с целью профилактики рецидива заболевания. После того как активные вещества высвободятся или после того как радиоактивность исчезнет, может быть желательным, чтобы гель растворился и экскретировался из организма. Саможелирующиеся альгинатные компуазозиции с контролируемой доставкой можно, разумеется, также инъецировать непосредственно в организм без каких бы то ни было хирургических процедур, а раствор гель/альгинат можно также использовать для пероральной доставки лекарственных средств. В настоящее время для перорального использования известно использование альгината в компуазозициях в качестве средства против рефлюкса. Таким образом, возможно также, что альгинатные саможелирующиеся компуазозиции будут применяться сходным образом.
Пример 9: Применение в области тканевой инженерии
Заключение клеток в альгинатный гель, описанный в настоящем документе, также можно использовать для изготовления импуазлантируемых «биологических фабрик», экскретирующих активные вещества для лечения ряда заболеваний. Однако заключение клеток в альгинатный гель можно также использовать в области тканевой инженерии. Для целей тканевой инженерии необходим рост клеток внутри или на трехмерных конструкциях и, таким образом, для подобных целей необходимы хорошие материалы. Отсроченное высвобождение поперечно сшивающих ионов позволяет формовать суспензию гелеобразующий ион/альгинат с получением сложных геометрических конструкций до начала затвердевания. В условиях ex vivo указанные альгинатные структуры можно использовать в качестве ростового субстрата при разработке тканей или искусственных органов. Клетки растут на поверхности гранул из альгинатного геля, поскольку поверхность геля может являться ростовым субстратом для клеток. Рост клеток на альгинатных гелях, как было установлено, зависит от используемого альгината и гелеобразующих ионов. Настоящую саможелирующуюся компуазозицию можно использовать для создания множества слоев клеток, растущих внутри или на поверхности альгинатных пластин или гелевых структур другой формы. Кроме того, альгинатный гель можно позднее удалять с помощью обработки цитратом, фосфатами или другими хелатирующими гелеобразующие ионы агентами. Это дает возможность комбинировать несколько клеточных слоев при конструкции тканей или органов. Несколько типов клеток внутри или на поверхности гелевых структур можно объединять, если это желательно для разработки конструкции.
Регенерация нервов является интересным примером применения альгината в целях тканевой инженерии. Заполнение искусственных нервных каналов саможелирующимся альгинатом может быть пригодным для создания конструкций с улучшенной направляемостью и биологической совместимостью для отрастания нерва. Указанная система может обеспечивать более высокую гибкость и улучшенный контроль по сравнению с формовочными процессами и улучшенные свойства структуры по сравнению с другими методиками.
Инъецируемые альгинатные/клеточные суспензионные системы также можно доставлять в дефектные или поврежденные участки ткани даже без хирургического вмешательства. Для указанных целей весьма важным может быть наличие определенного времени для работы, чтобы придать материалу форму до того, как он затвердеет. Однако скорость гелеобразования также требуется разумная, чтобы можно было избежать проблем, связанных с длительным временем ожидания для пациента, или проблем, связанных с нанесением геля/раствора. Саможелирующуюся систему, как показано в настоящем документе и как описано ранее, можно адаптировать к различным периодам времени для гелеобразования и к различным свойствам прочности и стабильности. Указанная изменчивость может таким образом использоваться для адаптации к каждому типу инъекционных процедур. В качестве примера, восстановление дефектов хряща представляет собой возможную область применения саможелирующихся альгинатных структур. Было установлено, что альгинат является полезным биоматериалом для использования в тканевой инженерии хрящей, и было установлено, что альгинат может стимулировать образование хрящевой ткани. Таким образом, саможелирующиеся альгинатные растворы с хондроцитами или без хондроцитов или других клеток можно непосредственно инъецировать для лечения дефектов суставов. В настоящее время пациентов с остеоартритом также лечат с использованием «жидкостной терапии суставов», и в продаже имеются два продукта - гиалуронат натрия (Hyalgan) и hylan G-F 20 (Synvisc), которые, как полагают, действуют как смазывающие агенты, поставляя гиалуроновую кислоту, вещество, которое придает вязкость суставной жидкости. У некоторых людей облегчение боли продолжается от шести до 13 месяцев. Лекарственные средства оказались наиболее эффективными у людей с остеоартритом коленных суставов от мягкой до умеренной степени тяжести. Однако, поскольку известно, что гиалуроновая кислота разлагается в организме, использование других биополимеров, таких как альгинат, с меньшей биоразлагаемостью и хорошей биологической совместимостью имеет преимущества.
Альгинатные гидрогели можно лиофилизировать, или вода может быть удалена частично или полностью другими способами для создания биологических совместимых структур, таких как губки или волокна. Применение технологии, представленной в настоящем документе, использующей саможелирующиеся альгинатные системы, может также представлять собой стадию производства биологически совместимых губок или других структур, которые являются пригодными для тканевой инженерии или других целей.
Саможелирующиеся альгинатные компуазозиции можно использовать для нанесения покрытия на стенты или импуазлантаты или другие импуазлантационные устройства. В зависимости от типа альгинатной компуазозиции покрывающий слой можно изготавливать более или менее биоразлагаемым и обеспечивать большую или меньшую поддержку для врастания внутрь клеток хозяина или для роста клеток, добавленных в устройство.
Пример 10: Придание объема тканям
Альгинат можно доставлять в подслизистый слой, проксимальнее уретрального сфинктера, чтобы создать объем для лечения недержания мочи, и подобные процедуры уже выполняются в клиниках. Другим примером может быть доставка альгинатных компуазозиций в место соединения пищевода и желудка, чтобы способствовать лечению гастроэзофагеального рефлюкса. Высокая степень совместимости альгинатов делает применение инъецируемого раствора для косметических процедур привлекательной альтернативой по отношению к другим материалам.
Компуазозиции на основе саможелирующихся альгинатных систем можно использовать для создания инъецируемых растворов или паст с заранее определенным временем затвердевания с целью заполнения заранее определенного объема. Как отмечалось ранее, гелевые компуазозиции можно изготавливать более или менее биоразлагаемыми, что сообщает придающей объем компуазозиции желательные свойства.
Пример 11: Эмболизация кровеносных сосудов
Способы формирования эндоваскулярных окклюзий могут быть использованы для лечения таких состояний, как артериально-венозные пороки развития, аневризмы, избыточное кровоснабжение опухолей, борьба с массивными кровотечениями и другие состояния, которые требуют эмболизации для облегчения состояния. Некоторые эмболические системы включают применение полимерных растворов, которые начинают отверждаться или выпадать в осадок при контакте с кровью или другими жидкостями организма. Указанные системы, однако, сталкиваются с такой проблемой, как миграция полимерного раствора в нежелательные области организма, поскольку для затвердевания или осаждения твердого полимера требуется время. Миграция указанных систем полимерных растворов является особенно проблематичной, когда раствор инъецируют в «высокопроточные» области, такие как сосудистые системы. Волокна, которые образуют системы полимерных растворов, также создают проблемы, такие как недостаточно хорошая эмболизация, избыточная хрупкость или отсутствие биологической совместимости. Применение частиц или гранул PVA (поливинилового спирта) или желатиновых гранул, как было показано, является пригодным для эмболизации и в настоящее время осуществляется в клиниках.
Компуазозиции на основе альгинатов также предлагаются для использования в процедурах эмболизации. Было высказано предположение, что эндоваскулярные окклюзии можно индуцировать с использованием альгината кальция путем контролирования инъекций альгинатной жидкости и раствора хлорида кальция, которые встречаются и полимеризуются в участке внутри сосудистой системы, намеченной для окклюзии. По сравнению с указанными системами применение саможелирующихся альгинатных компуазозиций по настоящему изобретению имеет преимущества. Лечение можно осуществлять в виде однократных инъекций, а прочность самоотверждающейся компуазозиции можно подобрать таким образом, чтобы обеспечить лучшее контролирование системы. В частности, саможелирующиеся альгинатные компуазозиции являются полезными, когда необходимо контролировать время до гелеобразования и биоразлагаемости.
Пример 12: Противоспаечные компуазозиции
Образование спаек сопровождает хирургические вмешательства, травмы, инфекции и т.п. Спайки часто появляются после абдоминальных операций и представляют главную клиническую проблему, вызывающую кишечную непроходимость, бесплодие и боли. Попытки предотвратить или уменьшить образование спаек были почти абсолютно безуспешными; однако недавно разработанные механические барьеры, использующие различные биополимеры, продемонстрировали клинический прогресс в отношении профилактики образования спаек.
Компуазозиции на основе альгинатов также были предложены в качестве противоспаечных барьеров. Противоспаечные барьеры можно создать, используя саможелирующуюся альгинатную систему, представленную в настоящем документе. Компуазозицию раствора/геля предварительно смешивают непосредственно перед использованием и изготавливают ее с подходящей биоразлагаемостью. Компуазозиции указанных типов могут также содержать другие полимеры, лекарственные средства или другие вспомогательные соединения. Дополнительные полимеры можно использовать для улучшения свойств геля, среди прочего, для увеличения адгезии между гелевой структурой и тканью.
Пример 13: Компуазозиции для заживления ран
Альгинатные перевязочные материалы широко используются для лечения ран с отделяющимся эксудатом. Современные альгинатные продукты для заживления ран состоят из мягких нетканых волокон или тампуазонов. Альгинаты могут адсорбировать массы, во много раз превышающие их собственную массу, и образуют гель внутри раны для заполнения мертвого пространства и поддержания влажности среды. Было высказано предположение, что альгинаты могут влиять на процесс заживления раны посредством еще и других, неизвестных, механизмов, и было высказано предположение, что кальций, присутствующий в альгинатном перевязочном материале, может влиять на процесс заживления раны посредством влияния на определенные клетки.
Саможелирующиеся альгинатные структуры способны приспосабливаться к трехмерной структуре тканевой поверхности во время процессов заживления. Среди прочих можно добиться создания компуазозиций с более контролируемым и определенным содержанием кальция, а также структур с высокой степенью резорбтивности.
Пример 14: Изготовление нерастворимого альгината кальция
Альгинат кальция изготавливали с использованием сверхчистого (с пониженным содержанием эндотоксинов) коммерческого альгината. Помимо этого, содержание кальция имело стехиометрический характер. Конкретно, 60 г альгината натрия PRONOVA UP LVG (серия FP-008-04), имеющего молекулярную массу приблизительно 130 000, вязкость приблизительно 150 (1% раствор, 20°С), содержание гулуроната 64% и содержание эндотоксинов 260 ЭЕ/грамм, растворяли в 5 литрах очищенной воды. Добавляли 26 граммов карбоната натрия. 165 граммов дигидрата хлорида кальция сначала растворяли в 500 мл очищенной воды, а затем доводили величину рН до нейтральной с использованием азотной кислоты. Осторожно добавляли альгинатный раствор к раствору хлорида кальция при постоянном перемешивании. Выпавший в осадок альгинат кальция затем промывали 4-8 раз подряд очищенной водой до тех пор, пока проводимость не снижалась до уровня, аналогичного проводимости очищенной воды. Промытый альгинат кальция затем сушили в условиях вакуума, а затем размалывали. Нерастворимый альгинат стронция можно получить сходным образом с использованием соли стронция вместо хлорида кальция. Полученные нерастворимые альгинаты содержат контролируемые стехиометрические или субстехиометрические количества кальция или стронция, которые при использовании в гелеобразующих системах дают гели с более воспроизводимой консистенцией, чем у гелей, изготовленных с использованием нерастворимых альгинатов, полученных другими способами.
Пример 15: Гелеобразование в присутствии других ионов и агентов, связывающих кальций
В экспериментах заявители осуществляли осцилляционные измерения, как описано ранее (пример 1). Модуль хранения измеряли в зависимости от времени для гелей, содержавших 1,25% альгината натрия (PRONOVA UP 100G), смешанного с 5,5% альгинатом стронция (пример 14) в соотношении 4:1 (конечная концентрация альгинатов составляла 2,1%). Затвердевание геля измеряли в присутствии или отсутствии хлорида натрия или гексаметафосфата натрия (фигура 8). Изучали две различные концентрации хлорида натрия, и данные ясно показывают увеличение скорости гелеобразования при повышении концентрации ионов натрия. Присутствие агента, связывающего кальций, такого как гексаметафосфат натрия, также отчетливо изменяет кинетику гелеобразования и уменьшает конечную прочность геля. Таким образом, данные показывают, что присутствие негелеобразующих ионов, таких как натрий, или компуазлексирующих кальций соединений, таких как гексаметафосфат, можно использовать для модификации кинетики гелеобразования и конечных свойств геля.
Пример 16: Гелеобразование с частицами альгината кальция различных размеров
Во время процесса изготовления нерастворимых альгинатов можно контролировать размеры частиц конечного продукта. В данном примере заявители изготовили одну партию альгината кальция, который размалывали и просеивали через различные фильтры, чтобы отделить друг от друга частицы разных размеров. Когда осуществляли гелеобразование с частицами альгината стронция различных размеров и альгинатом натрия, в остальном в идентичных условиях, наблюдалась большая разница в процессе гелеобразования и конечных свойствах геля (фигура 9). В то время как гелеобразование было очень быстрым в случае более маленьких частиц, общее время гелеобразования было значительно более продолжительным в случае более крупных частиц, и они также давали гораздо более прочные гели. Однако в случае более маленьких частиц следует отметить, что некоторая деградация геля, вероятно, наблюдалась во время смешивания двух компуазонентов, поскольку скорость гелеобразования была очень высокой (в частности, для частиц менее 25 мкм). Указанный эффект, таким образом, также вносит свой вклад в различающуюся прочность конечного геля. Тем не менее, в заключение данные заявителей показывают, что размеры частиц необходимо принимать во внимание и можно активно использовать с целью получения желательных свойств.
Пример 17: Гелеобразование при различных темпуазературах
Заявители также изучали возможность активного использования подбора темпуазератур для контроля затвердевания гелевой системы. На фигуре 10 показаны реологические данные для смеси альгината кальция и альгината натрия при различных темпуазературах. Очевидно, что скорость гелеобразования снижалась при 10°С, а также возрастала при 37°С по сравнению с комнатной темпуазературой. Таким образом, данные показывают, что темпуазературу можно активно использовать для контроля кинетики гелеобразования. Среди прочего это можно активно использовать путем понижения темпуазературы, чтобы выиграть время для изготовления и обработки геля перед введением in vivo.
Пример 18: Гелеобразование с использованием ненасыщенных частиц альгината кальция или стронция
Изготавливали альгинаты кальция и альгинаты стронция, которые являлись стехиометрически ненасыщенными гелеобразующими ионами (менее 100% насыщения). Указанные частицы, в противоположность насыщенным частицам, регидратировались очень быстро при контакте с растворами, содержавшими воду. Ненасыщенные частицы, таким образом, можно использовать для формирования мгновенной гелевой структуры, состоящей из гелевых частиц (нетвердый гель). Хотя гелевая структура была непрочной, ей можно было легко придавать форму в течение длительного периода времени. Клетки или другие материалы можно было легко примешивать в гелевую структуру простым их добавлением в раствор, содержавший воду, до смешивания с порошком. Также другие частицы или материалы можно было примешивать в гелевую структуру путем предварительного смешивания с ненасыщенными частицами до добавления раствора, содержавшего воду. Одним примером является предварительное смешивание сухого альгината натрия, насыщенного нерастворимого альгината и ненасыщенного нерастворимого альгината до добавления раствора, содержащего воду. При контакте с водой указанная смесь, как ранее, будет давать гелевую структуру, мгновенно поглощающую воду, однако прочность геля также будет возрастать со временем, по мере того как частицы растворимого альгината и нерастворимого насыщенного альгината в геле постепенно начинают гидратироваться и давать гелеобразование после растворения. Компуазозиции, упомянутые в настоящем документе, использующие влагопоглощающие свойства ненасыщенных нерастворимых альгинатов, также могут использоваться в комбинации с клетками или другими материалами и могут быть очень полезными для тканевой инженерии и других целей.
Пример 19: FP-411-03, изготовление альгината кальция со стехиометрическим количеством кальция (100% насыщение), альгината с высоким содержанием G, с использованием карбоната натрия и азотной кислоты
50 граммов альгината натрия PRONOVA UP LVG, серия FP-008-04 (содержание гулуроновой кислоты 64%, молекулярная масса 130 000 г/моль, вязкость 1% раствора при 20°С 146 , содержание эндотоксинов 400 ЭЕ/грамм), растворяли в 3 литрах очищенной воды. Добавляли 15 граммов карбоната натрия. Добавляли раствор кальция, состоявший из 139 граммов CaCl2∙2Н2О, растворенных в 300 мл очищенной воды с добавлением 12 мл HNO3 (65%). Наблюдалось выпадение тонкого осадка. Проводимость указанного раствора составляла 55 мС/см. Осадок промывали несколько раз подряд (8 раз) очищенной водой до получения проводимости 0,08 мС/см. Осадок сушили в условиях вакуума.
Пример 20: FP-411-04, изготовление альгината кальция с субстехиометрическим количеством кальция (50% насыщение), альгината с высоким содержанием G, с использованием карбоната натрия и азотной кислоты
25 граммов PRONOVA UP LVG (описание дано в примере 19) растворяли в 1,5 литрах очищенной воды. Для расчета требующегося количества кальция 25 граммов альгината представляет 0,146 моль альгината (с использованием молекулярной массы мономера 171 г/моль). Используемый альгинат, PRONOVA UP LVG, серия FP-008-04, имеет содержание гулуроновой кислоты 64%, что дает 0,093 моль кальцийсвязывающих сайтов (0,146 моль альгината × 64% мономеров гулуроновой кислоты). Для 50% замещения кальцием требуется 0,0465 моль кальция (0,093/2=0,0465 моль). 0,0465 моль кальциевой соли, по расчету, составляет 6,84 грамма дигидрата (0,0465 моль × 147,02 г/моль (CaCl2∙2H2O)=6,84 г CaCl2∙2H2O. 6,84 г CaCl2∙2H2O растворяют в 150 мл очищенной воды и 6 мл HNO3 (65%). Добавляют 7,5 граммов карбоната натрия к альгинатному раствору. Наблюдается выпадение тонкого осадка. Проводимость указанного раствора составляет 8 мС/см. Осадок промывают несколько раз подряд (6 раз) до получения проводимости 0,4 мС/см. Осадок сушат в условиях вакуума.
Пример 21: FP-411-05, изготовление альгината стронция со стехиометрическим количеством стронция (100% насыщение), альгината с высоким содержанием G, с использованием карбоната натрия и азотной кислоты
47 граммов альгината натрия PRONOVA UP LVG, серия FP-008-04 (содержание гулуроновой кислоты 64%, молекулярная масса 130 000 г/моль, вязкость 1% раствора при 20°С 146 , содержание эндотоксинов 400 ЭЕ/грамм), растворяли в 3 литрах очищенной воды. Добавляли 15 граммов карбоната натрия. Добавляли раствор стронция, состоявший из 252 граммов SrCl2∙6Н2О, растворенных в 300 мл очищенной воды с добавлением 12 мл HNO3 (65%). Наблюдалось выпадение тонкого осадка. Проводимость указанного раствора составляла 78 мС/см. Осадок промывали несколько раз подряд (8 раз) очищенной водой до получения проводимости 0,0159 мС/см. Осадок сушили в условиях вакуума.
Пример 22: FP-411-06, изготовление альгината стронция с субстехиометрическим количеством стронция (50% насыщение), альгината с высоким содержанием G, с использованием карбоната натрия и азотной кислоты
23,3 грамма PRONOVA UP LVG (описание дано в примере 19) растворяли в 1,5 литрах очищенной воды. Для расчета требующегося количества кальция 23,3 грамма альгината представляет 0,136 моль альгината (с использованием молекулярной массы мономера 171 г/моль). Используемый альгинат, PRONOVA UP LVG, серия FP-008-04, имеет содержание гулуроновой кислоты 64%, что дает 0,087 моль кальцийсвязывающих сайтов (0,136 моль альгината × 64% мономеров гулуроновой кислоты). Для 50% замещения стронцием требуется 0,0435 моль стронция (0,087/2=0,0435 моль). 0,0435 моль стронциевой соли, по расчету, составляет 11,6 грамма гексагидрата (0,0435 моль × 266,62 г/моль (SrCl2∙6H2O)=11,6 г SrCl2∙6H2O. 11,6 г SrCl2∙6H2O растворяют в 150 мл очищенной воды и 6 мл HNO3 (65%). Добавляют 7,5 граммов карбоната натрия к альгинатному раствору. Наблюдается выпадение тонкого осадка. Проводимость указанного раствора составляет 22 мС/см. Осадок промывают несколько раз подряд (3 раза) до получения проводимости 0,6 мС/см. Осадок сушат в условиях вакуума.
Пример 23: FP-506-03, изготовление альгината стронция со стехиометрическим количеством стронция (100% насыщение), альгината с высоким содержанием М, без карбоната натрия и азотной кислоты
50 граммов альгината натрия PRONOVA UP LVM, серия FP-408-01 (содержание гулуроновой кислоты 44%, молекулярная масса 220 000 г/моль, вязкость 1% раствора при 20°С 127 , содержание эндотоксинов <25 ЭЕ/грамм), растворяли в 3 литрах очищенной воды. Добавляли раствор стронция, состоявший из 252 граммов SrCl2∙6Н2О, растворенных в 400 мл очищенной воды. Наблюдалось выпадение тонкого осадка. Проводимость указанного раствора составляла 43 мС/см. Осадок промывали несколько раз подряд (8 раз) очищенной водой до получения проводимости 0,143 мС/см. Осадок сушили в условиях вакуума, размалывали и фракционировали.
Пример 24: FP-505-05, изготовление альгината стронция со стехиометрическим количеством стронция (100% насыщение), альгината с высоким содержанием G, без карбоната натрия или азотной кислоты
50 граммов альгината натрия PRONOVA UP LVG, серия FP-408-02 (содержание гулуроновой кислоты 69%, молекулярная масса 219 000 г/моль, вязкость 1% раствора при 20°С 138 , содержание эндотоксинов <25 ЭЕ/грамм), растворяли в 3 литрах очищенной воды. Добавляли раствор стронция, состоявший из 252 граммов SrCl2∙6Н2О, растворенных в 400 мл очищенной воды. Наблюдалось выпадение тонкого осадка. Проводимость указанного раствора составляла 40 мС/см. Осадок промывали несколько раз подряд (7 раз) очищенной водой до получения проводимости 0,1 мС/см. Осадок сушили в условиях вакуума, размалывали и фракционировали.
Пример 25: FP-505-02, изготовление альгината кальция со стехиометрическим количеством кальция (100% насыщение), альгината с высоким содержанием М, без карбоната натрия и азотной кислоты
50 граммов альгината натрия PRONOVA UP LVM, серия FP-408-01 (содержание гулуроновой кислоты 44%, молекулярная масса 220 000 г/моль, вязкость 1% раствора при 20°С 127 , содержание эндотоксинов <25 ЭЕ/грамм), растворяли в 3 литрах очищенной воды. Добавляли раствор кальция, состоявший из 137 граммов CaCl2∙2Н2О, растворенных в 300 мл очищенной воды. Наблюдалось выпадение тонкого осадка. Проводимость указанного раствора составляла 45 мС/см. Осадок промывали несколько раз подряд (8 раз) очищенной водой до получения проводимости 0,0129 мС/см. Осадок сушили в условиях вакуума, размалывали и фракционировали.
Пример 26: FP-504-02, изготовление альгината кальция со стехиометрическим количеством кальция (100% насыщение), альгината с высоким содержанием G, без карбоната натрия и азотной кислоты
50 граммов альгината натрия PRONOVA UP LVG, серия FP-408-02 (содержание гулуроновой кислоты 69%, молекулярная масса 219 000 г/моль, вязкость 1% раствора при 20°С 138 , содержание эндотоксинов <25 ЭЕ/грамм), растворяли в 5 литрах очищенной воды. Добавляли раствор кальция, состоявший из 231 граммов CaCl2∙2Н2О, растворенных в 500 мл очищенной воды. Наблюдалось выпадение тонкого осадка. Проводимость указанного раствора составляла 43 мС/см. Осадок промывали несколько раз подряд (8 раз) очищенной водой до получения проводимости 0,0068 мС/см. Осадок сушили в условиях вакуума, размалывали и фракционировали.
Пример 27: Дополнительные примеры продуктов, изготовленных с различными стехиометрическими количествами кальция и стронция, а также вариации типа используемого альгината (с высоким содержанием гулуроната (G) или с высоким содержанием маннуроната (М)) представлены в таблице 2.
Реферат
Группа изобретений относится к медицине, точнее к биосовместимым альгинатным системам, имеющим отсроченный процесс гелеобразования. Предложены наборы и композиции для изготовления саможелирующегося альгинатного геля, содержащие стерильный водорастворимый альгинат и частицы стерильного водонерастворимого альгината с гелеобразующим ионом. Предложены способы дозирования саможелирующейся альгинатной дисперсии для получения саможелирующегося альгинатного геля. Способы могут включать дозирование дисперсии в организм индивидуума. Предложен альгинатный саможелирующийся гель, имеющий толщину более 5 мм и не содержащий один или более из сульфатов, цитратов, фосфатов, лактатов, EDTA или липидов. Предложены имплантируемые устройства, имеющие покрытие из однородного альгинатного геля. Предложены способы улучшения жизнеспособности панкреатических островков или других клеточных агрегатов или ткани после выделения и во время хранения и транспортировки. Группа изобретений обеспечивает создание альгинатной гелеобразующей системы, которая включает альгинат и гелеобразующие ионы, имеющие высокую степень биологической совместимости. Система обеспечивает гелеобразование без изменений pH, связанных с другими системами, и требует минимального количества компонентов. При этом система предусматривает варьирование времени гелеобразования и прочности геля в зависимости от потребностей конкретного применения. 24 н. и 38 з.п. ф-лы, 11 ил. 2 табл.
Формула
первый контейнер, содержащий стерильный водорастворимый альгинат; и второй контейнер, содержащий частицы стерильного водонерастворимого альгината с гелеобразующим ионом.
а) формирование дисперсии смешиванием i) раствора, содержащего стерильный водорастворимый альгинат, с частицами стерильного водонерастворимого альгината с гелеобразующим ионом, или ii) стерильного быстрорастворимого в воде альгината, частиц стерильного водонерастворимого альгината с гелеобразующим ионом и растворителя, и b) дозирование дисперсии, посредством чего дисперсия формирует альгинатный гелевый матрикс.
a) формирование дисперсии смешиванием i) раствора, содержащего растворимый альгинат, с частицами нерастворимого альгината с гелеобразующим ионом, или ii) быстрорастворимого альгината, частиц нерастворимого альгината с гелеобразующим ионом и растворителя, и
b) дозирование дисперсии индивидууму, посредством чего дисперсия формирует альгинатный гелевый матрикс.
растворения сверхчистого альгината натрия в воде и добавления натриевой соли;
растворения соли гелеобразующего иона в воде и доведения рН до нейтрального значения;
объединения альгинатного раствора с раствором хлорида кальция при непрерывном перемешивании;
сбора выпавшего в осадок нерастворимого альгината и промывания его водой до тех пор, пока его проводимость не снизится до уровня, аналогичного проводимости очищенной воды;
сушки промытого нерастворимого альгината: и
формирования частиц указанного сухого нерастворимого альгината.
растворения сверхчистого альгината натрия в воде и добавления карбоната натрия;
растворения дигидрата хлорида кальция в воде и доведения pH до нейтрального значения с использованием азотной кислоты;
объединения альгинатного раствора с раствором хлорида кальция при непрерывном перемешивании;
сбора выпавшего в осадок альгината кальция и промывания его водой до тех пор, пока его проводимость не снизится до уровня, аналогичного проводимости очищенной воды;
сушки промытого альгината кальция; и
размалывания сухого альгината кальция на частицы.

Комментарии