Продукт, содержащий глюкоманнан, ксантановую камедь и альгинат для лечения метаболических нарушений - RU2553348C2
Код документа: RU2553348C2
Чертежи













































Описание
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет согласно заявке №61/312,630, поданной 10 марта 2010 г., и заявке №61/357,658, поданной 23 июня 2010 г., содержания которых включены в данный документ в порядке ссылки в полном объеме.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к композициям пищевых волокон, продуктам лечебного питания, содержащим композиции пищевых волокон, и их использованию для задержки возникновения и/или снижения тяжести метаболического синдрома и диабета II типа.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Ожирение и метаболический синдром, условия, которые могут привести к развитию диабета II типа, становятся все более и более распространенным. Увеличение висцерального ожирения, сывороточной глюкозы и инсулиновых уровней, наряду с гипертензией и дислипидемией, представляют собой группу клинических состояний, которые вместе называются метаболическим синдромом (E.J. Gallagheretal., Endocrinol. Metab. Clin. NorthAm. 37:559-79 (2008)). Было установлено, что данные состояния являются результатом увеличивающейся резистентности клеток к инсулину, а во многих случаях данные симптомы являются предшественником диабета II типа. В настоящее время существуют споры касательно точных диагностических показателей, которые идентифицируют метаболический синдром, и лекарственные препараты для его лечения не были одобрены, несмотря на то что для связанной дислипидемии и гипертензии назначается специальное лечение при помощи лекарственных средств. Диабет II типа обычно лечится при помощи разных лекарственных препаратов для регулирования сахара, содержащегося в крови, а в более тяжелых случаях инсулиновыми инъекциями. Однако питание и потеря веса играют главную роль в корректировании многих метаболических нарушений, связанных с метаболическим синдромом и диабетом II типа (Yipetal., ObesityRes. 9:341S-347S (2001)). Исследование показало, что люди, страдающие метаболическим синдромом, подвергаются на 50% большему риску перенесения тяжелого коронарного приступа (D.E. Moller etal., Annu. Rev. Meet. 56:45-62 (2005)). В связи с этим любые снижения веса, инсулина натощак и глюкозы принесут значительную пользу для здоровья тех людей, которые пострадали от этого недуга.
Известно, что употребление продуктов с высокогликемическим индексом приводит к перееданию и ожирению (Ludwig etal., Pediatrics 103(3):Е26 (1999)). Следовательно, предпочтительно, чтобы любое вещество, используемое в управлении диабетического или преддиабетического состояний, а также потери веса, имело низкий гликемический индекс. Наиболее предпочтительно, если такие вещества будут снижать гликемический индекс продуктов.
Снижение употребления углеводов также необходимо для успешного управления диабетическими состояниями. Консультирование касательно питания приносит пользу, но диабетики испытывают большее чувство голода, поскольку они испытывают более частые состояния гипогликемии (Strachan et al., Physiol. Behav. 80(5): 675-82 (2004)). Более того, терапии, понижающие уровни глюкозы в крови у диабетических пациентов, часто связываются с нежелательным побочным воздействием увеличения массы тела (Schultesetal., J. Clin. Endochnol. Metabol. 88(3): 1133-41 (2003)). Сообщалось о том, что диеты с высоким содержанием растворимого волокна могут снизить риск диабета посредством повышенной чувствительности к инсулину (Ylonen etal., Diabetes Care 26: 1979-85 (2003)). Это может произойти вследствие возможной роли пищевого волокна в регулировании сахара в крови. Также сообщалось о том, что высоковязкая пища вызывает большее насыщение по сравнению с низковязкой пищей (Marciani et al., Am. J. Physiol. Gastrointest. Liver Physiol. 280:01227-33 (2001)).
Таким образом, существует потребность в композициях пищевых волокон, которые помогают управлять метаболическим синдромом, включая диабетические состояния, посредством понижения уровней сахара в крови и способствования насыщению. Настоящее изобретение направлено на это и другие потребности.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном аспекте в изобретении предложен продукт лечебного питания, разработанный для предупреждения, лечения или уменьшения интенсивности одного или нескольких симптомов, связанных с метаболическим заболеванием или расстройством. Продукт лечебного питания в соответствии с данным аспектом изобретения содержит композицию полисахаридного пищевого волокна высокой вязкости, содержащую смесь волокна («VFB») высокой вязкости или его комплекс («VFC»), содержащий примерно от 48% примерно до 90% (в/в) глюкоманнана, примерно от 5% примерно до 20% (в/в) ксантановой камеди и примерно от 5% примерно до 30% (в/в) альгината и по меньшей мере один макроэлемент, выбранный из группы, состоящей из белка, углевода и жира.
В другом аспекте в настоящем изобретении предложен способ приготовления пищевого продукта лечебного питания, содержащий стадию добавления эффективного количества композиции пищевого волокна высокой вязкости, содержащей смесь волокна высокой вязкости (VFB) или его комплекса («VFC»), содержащего глюкоманнан, ксантановую камедь и альгинат, в пищевой продукт лечебного питания. В некоторых воплощениях изобретения пищевой продукт лечебного питания разрабатывается для предупреждения, лечения или уменьшения интенсивности одного или нескольких симптомов, связанных с метаболическим заболеванием или расстройством. В некоторых воплощениях изобретения композиция пищевого волокна, добавляемая в пищевой продукт лечебного питания, содержит примерно от 48% примерно до 90% (в/в) глюкоманнана, примерно от 5% примерно до 20% (в/в) ксантановой камеди и примерно от 5% примерно до 30% (в/в) альгината.
В другом аспекте в настоящем изобретении предложен способ предупреждения, лечения или уменьшения интенсивности одного или нескольких симптомов, связанных с метаболическим заболеванием или расстройством. Способ, в соответствии с данным аспектом изобретения, включает введение человеку, который в этом нуждается, примерно от 25 мг/кг/день примерно до 1000 мг/кг/день композиции высоковязкого полисахаридного пищевого волокна, содержащей смесь вязкого волокна (VFB) или его комплекс (VFC), содержащий примерно от 48% примерно до 90% (в/в) глюкоманнана, примерно от 5% примерно до 20% (в/в) ксантановой камеди и примерно от 5% примерно до 30% (в/в) альгината, эффективной в течение промежутка времени, эффективного для предупреждения, лечения или уменьшения интенсивности одного или нескольких симптомов, связанных с метаболическим заболеванием или расстройством у субъекта.
Еще в одном аспекте в настоящем изобретении предложен способ уменьшения интенсивности по меньшей мере одного симптома, связанного с прогрессированием резистентности к инсулину у млекопитающего, страдающего заболеванием или подвергающегося риску развития диабета II типа. Способ в соответствии с данным аспектом изобретения содержит введение млекопитающему, который в этом нуждается, примерно от 25 мг/кг/день примерно до 1000 мг/кг/день композиции полисахаридного пищевого волокна высокой вязкости, содержащей смесь волокна (VFB) высокой вязкости или его комплекс (VFC), содержащий примерно от 48% примерно до 90% (в/в) глюкоманнана, примерно от 5% примерно до 20% (в/в) ксантановой камеди и примерно от 5% примерно до 30% (в/в) альгината, в течение периода, составляющего по меньшей мере две недели.
Еще в одном аспекте в настоящем изобретении предложен способ определения компонентных Сахаров в образце, содержащем по меньшей мере один полисахарид. Способы в соответствии с данным аспектом изобретения содержат: (а) гидролиз образца, содержащего по меньшей мере один полисахарид с помощью кислоты с целью получения гидролизата; (b) разделение продуктов гидролиза в гидролизате при помощи хроматографического способа; (с) обнаружение продуктов гидролиза, разделенных на стадии (b); и (d) сравнение продуктов гидролиза, обнаруженных на стадии (с) с одним или несколькими эталонными стандартами с целью определения компонентных Сахаров в образце.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
Вышеизложенные аспекты и многие присущие преимущества данного изобретения станут более понятными, поскольку их лучше понимать, исходя из нижеследующего подробного описания в сочетании с прилагаемыми чертежами, на которых:
ФИГУРА 1А графически изображает воздействие диетического питания, содержащего VFC, целлюлозу или инулин, на массу тела (г) с течением времени в ходе восьминедельного исследования на диабетических крысах Цукера, как описано в примере 1;
ФИГУРА 1 В графически изображает воздействие диетического питания, содержащего VFC, целлюлозу или инулин, на употребление продуктов питания (г/день) с течением времени в ходе 8-недельного исследования на диабетических крысах Цукера, как описано в примере 1;
ФИГУРА 2А графически изображает воздействие диетического питания, содержащего VFC, целлюлозу или инулин, на уровни глюкозы в крови натощак (мг/дл) с течением времени в ходе 8-недельного исследования на диабетических крысах Цукера, как описано в примере 1;
ФИГУРА 2В графически изображает воздействие диетического питания, содержащего VFC, целлюлозу или инулин, на уровни сывороточного инсулина натощак (нг/мл) с течением времени в ходе 8-недельного исследования на диабетических крысах Цукера, как описано в примере 1;
ФИГУРА 2С графически изображает воздействие диетического питания, содержащего VFC, целлюлозу или инулин, на уровни глюкозы в крови не натощак (мг/дл) с течением времени в ходе 8-недельного исследования на диабетических крысах Цукера, как описано в примере 1;
ФИГУРА 2D графически изображает воздействие диетического питания, содержащего VFC, целлюлозу или инулин, на показатели оценки гомеостатической модели (НОМА) натощак (мг*Ед/мл2) с течением времени в ходе 8-недельного исследования на диабетических крысах Цукера, как описано в примере 1;
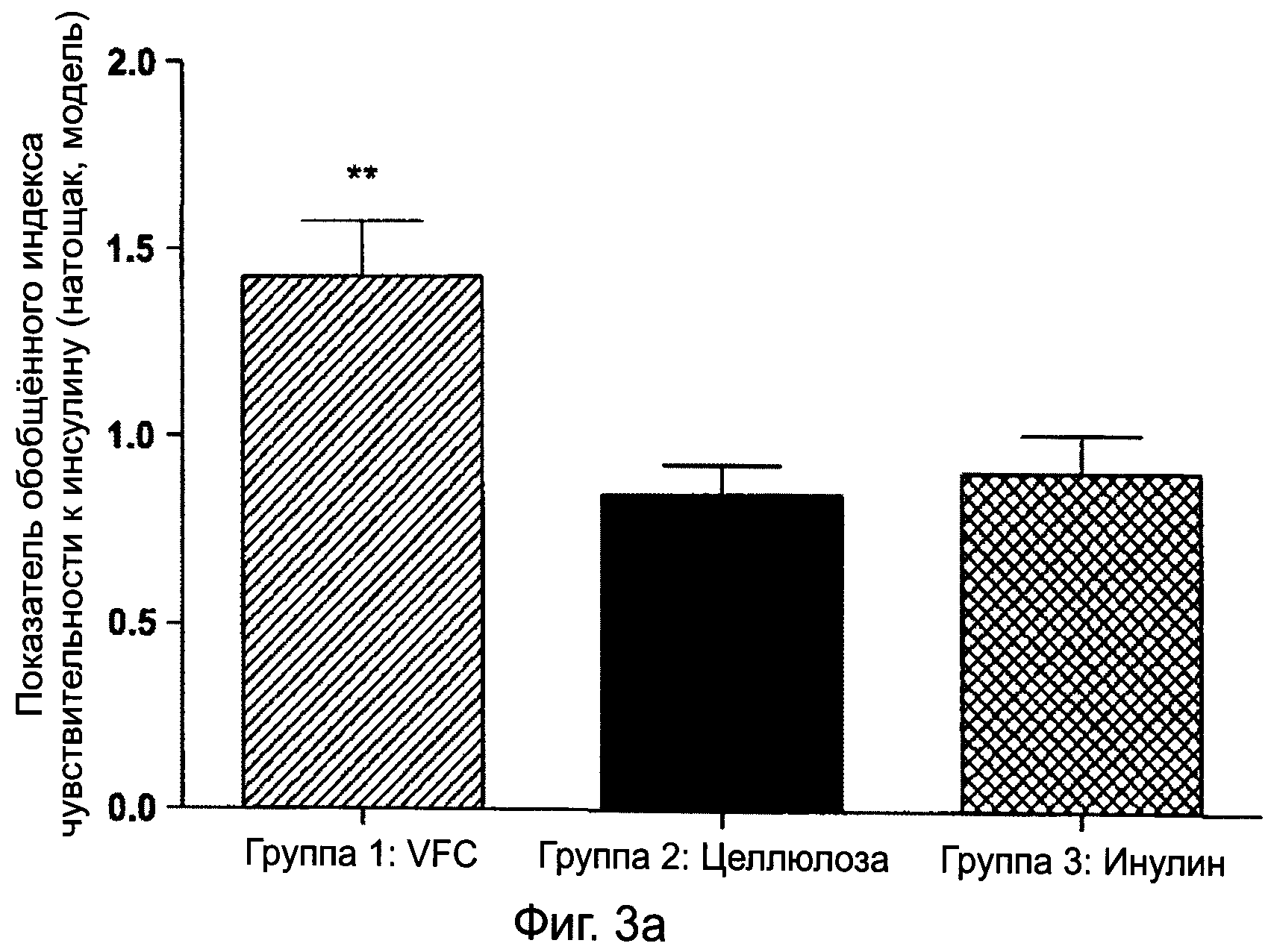
ФИГУРА 3А графически изображает показатели обобщенного индекса чувствительности к инсулину (CISI) касательно диабетических крыс Цукера в состоянии натощак, получавших питание, содержащее VFC, целлюлозу или инулин, в ходе 8-недельного исследования, как описано в примере 1;
ФИГУРА 3В графически изображает показатели обобщенного индекса чувствительности к инсулину (CISI) касательно диабетических крыс Цукера в состоянии не натощак, получавших питание, содержащее VFC, целлюлозу или инулин, в ходе 8-недельного исследования, как описано в примере 1;
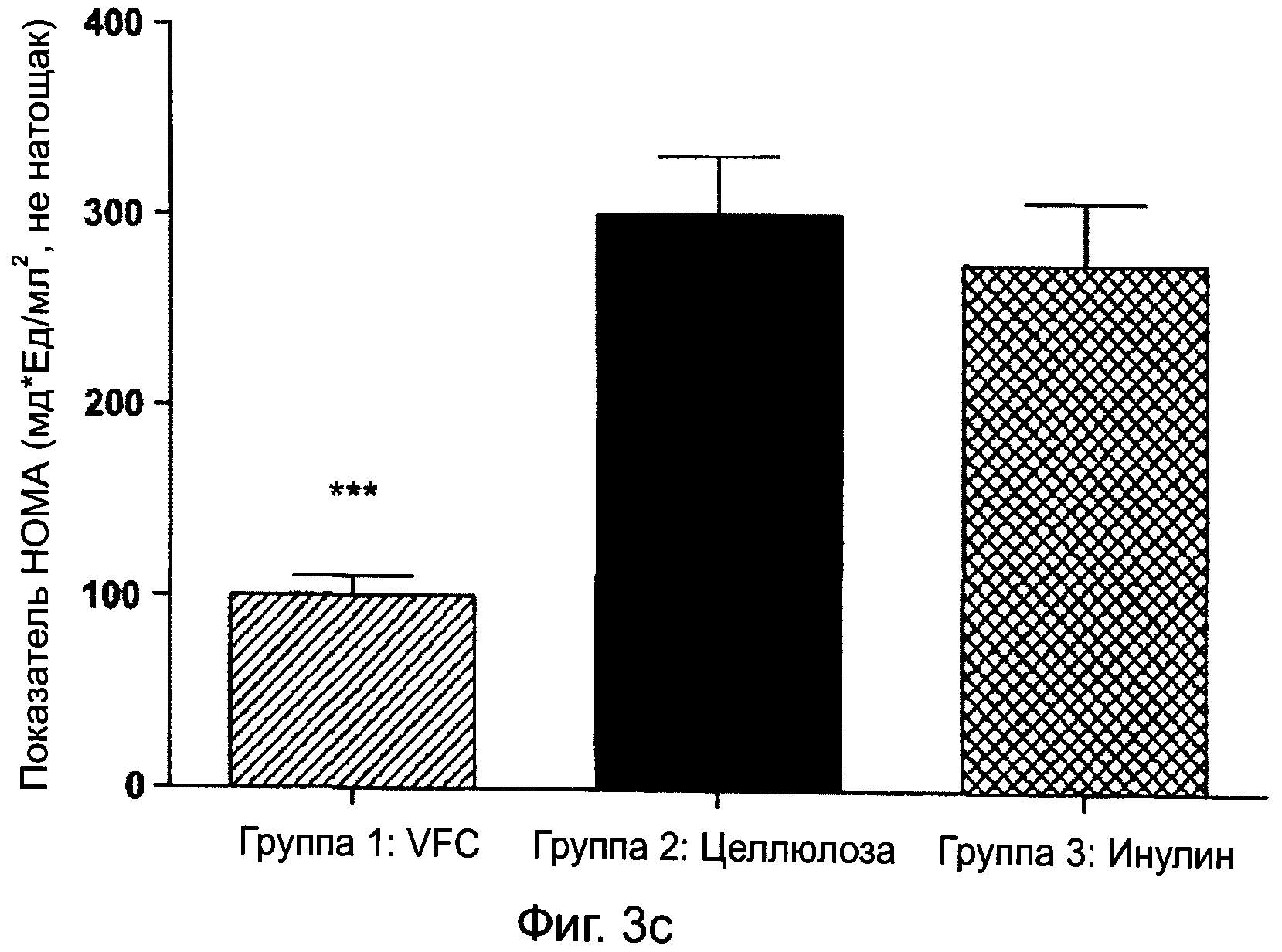
ФИГУРА 3С графически изображает показатели НОМА касательно диабетических крыс Цукера в состоянии не натощак, получавших питание, содержащее VFC, целлюлозу или инулин, в ходе 8-недельного исследования, как описано в примере 1;
ФИГУРА 4 графически изображает уровень сывороточных триглицеридов, измеренный у диабетических крыс Цукера в состоянии натощак, получавших питание, содержащее VFC, целлюлозу или инулин, в ходе 8-недельного исследования, как описано в примере 1;
ФИГУРА 5А графически изображает воздействие диетического питания, содержащего VFC, целлюлозу или инулин, на диабетических крыс Цукера через 8 недель на дилатацию почечного канальца на основании гистологического показателя, составляющего 0-5, где 5 является самым тяжелым показателем, как описано в примере 1;
ФИГУРА 5В графически изображает воздействие диетического питания, содержащего VFC, целлюлозу или инулин, на диабетических крыс Цукера через 8 недель на дегенерацию/регенерацию почечного канальца на основании гистологического показателя, составляющего 0-5, где 5 является самым тяжелым показателем, как описано в примере 1;
ФИГУРА 5С графически изображает воздействие диетического питания, содержащего VFC, целлюлозу или инулин, на диабетических крыс Цукера через 8 недель на мезангиальное расширение почки на основании гистологического показателя, составляющего 0-5, где 5 является самым тяжелым показателем, как описано в примере 1;
ФИГУРА 6 графически изображает процент области иммунореактивного инсулина панкреатического островка, присутствующий у диабетических крыс Цукера, получавших питание, содержащее VFC, целлюлозу или инулин, в конце 8-недельного исследования, что определено окрашиванием при помощи антикрысиного инсулинового антитела, как описано в примере 1;
ФИГУРА 7А графически изображает гистологический показатель касательно инфильтратов мононуклеарных воспалительных клеток панкреатического островка, присутствующих у диабетических крыс Цукера, получавших питание, содержащее VFC, целлюлозу или инулин, в конце 8-недельного исследования на основании гистологического показателя, составляющего 0-5, где 5 является самым тяжелым показателем, как описано в примере 1;
ФИГУРА 7В графически изображает гистологический показатель касательно клеточной дегенерации панкреатического островка, присутствующей у диабетических крыс Цукера, получавших питание, содержащее VFC, целлюлозу или инулин, в конце 8-недельного исследования на основании гистологического показателя, составляющего 0-5, где 5 является самым тяжелым показателем, как описано в примере 1;
ФИГУРА 7С графически изображает гистологический показатель касательно количества фиброза панкреатического островка, присутствующего у диабетических крыс Цукера, получавших питание, содержащее VFC, целлюлозу или инулин, в конце 8-недельного исследования на основании гистологического показателя, составляющего 0-5, где 5 является самым тяжелым показателем, как описано в примере 1;
ФИГУРА 8А графически изображает воздействие диетического питания, содержащего VFC, целлюлозу или инулин, на диабетических крыс Цукера через 8 недель на стеатоз печени, как измерено посредством редуцированного окрашивания Суданом черным на основании гистологического показателя, составляющего 0-5, где 5 является самым тяжелым показателем, как описано в примере 1;
ФИГУРА 8В графически изображает воздействие диетического питания, содержащего VFC, целлюлозу или инулин, на диабетических крыс Цукера через 8 недель на гепатическую микровезикулярную вакуолизацию на основании гистологического показателя, составляющего 0-5, где 5 является самым тяжелым показателем, как описано в примере 1;
ФИГУРА 8С графически изображает воздействие питания, содержащего VFC, целлюлозу или инулин, на диабетических крыс Цукера через 8 недель на гепатическую макровезикулярную вакуолизацию на основании гистологического показателя, составляющего 0-5, где 5 является самым тяжелым показателем, как описано в примере 1;
ФИГУРА 9 графически изображает воздействие VFC или целлюлозы на увеличение массы тела и сывороточные триацилглицерины (TAG) у крыс Спрага-Доули, получавших сахарозу, в ходе 43-недельного исследования, как описано в примере 2;
ФИГУРА 10А графически изображает воздействие VFC или контроля (сухое обезжиренное молоко) на уровни PYY в плазме касательно всех здоровых взрослых участников исследования в течение 3-недельного периода исследования (V1=начало исследования 0 день; V2=14 день; V3=21 день), как описано в примере 4;
ФИГУРА 10В графически изображает воздействие VFC или контроля (сухое обезжиренное молоко) на уровни PYY в плазме у здоровых взрослых участников исследования с BMI<23 в течение 3-недельного периода исследования (V1=начало исследования 0 день; V2=14 день; V3=21 день), как описано в примере 4;
ФИГУРА 10С графически изображает воздействие VFC или контроля (сухое обезжиренное молоко) на уровни грелина натощак у здоровых взрослых участников исследования в течение 3-недельного периода (V1=начало исследования 0 день; V2=14 день; V3=21 день), как описано в примере 4;
ФИГУРА 11А графически изображает сравнение кривой течения негранулированной VFB (называемой трехкомпонентной смесью 1 («ТМ1») и обработанного (например, гранулированного) VFC (PGX®) при 0,5% (в/в), как описано в примере 6;
ФИГУРА 11 В графически изображает сравнение кривой течения негранулированной VFB (называемой трехкомпонентной смесью 1 («ТМ1») и обработанного (например, гранулированного) VFC (PGX®) при 0,2% (в/в), как описано в примере 6;
ФИГУРА 11С графически изображает сравнение кривой течения негранулированной VFB (называемой трехкомпонентной смесью 1 («ТМ1») и обработанного (например, гранулированного) VFC (PGX®) при 0,1% (в/в), как описано в примере 6;
ФИГУРА 12А графически изображает сравнение степенной K негранулированной VFB (TM1), обработанного (например, гранулированного) VFC (PGX®) и ксантановой камеди, как описано в примере 6;
ФИГУРА 12В графически изображает сравнение степенной η негранулированной VFB (TM1), обработанного (например, гранулированного) VFC (PGX®) и ксантановой камеди, как описано в примере 6;
ФИГУРА 13А графически изображает кривую течения коньяк глюкоманнана при 0,1%, 0,2% и 0,5% (в/в), как измерено при температуре 25°С, как описано в примере 6;
ФИГУРА 13В графически изображает кривую течения ксантановой камеди при 0,1%, 0,2% и 0,5% (в/в), как измерено при температуре 25°С, как описано в примере 6;
ФИГУРА 13С графически изображает кривую течения альгинат натрия при 0,1%, 0,2% и 0,5% (в/в), как измерено при температуре 25°С, как описано в примере 6;
ФИГУРА 14А графически изображает кривую течения ненагретых водных растворов (0,5% концентрация) трехкомпонентных смесей, содержащих коньяк глюкоманнан, ксантановую камедь и альгинат натрия, содержащих коньяк глюкоманнан (КМ) и ксантановую камедь (XG) в постоянном соотношении (KM:XG=4,12:1) и переменные количества альгинат натрия (0%, 2%, 5%, 8%, 11%, 13%, 17%, 21%, 24%, 27%, 30% и 33%), измеренные при температуре 25°С, как описано в примере 6;
ФИГУРА 14В графически изображает кривую течения водных растворов (0,5% концентрация), нагреваемых в течение 1 часа трехкомпонентных смесей, содержащих коньяк глюкоманнан, ксантановую камедь и альгинат натрия, содержащих коньяк глюкоманнан (КМ) и ксантановую камедь (XG) в постоянном соотношении (KM:XG=4,12:1) и переменные количества альгинат натрия (0%, 2%, 5%, 8%, 11%, 13%, 17%, 21%, 24%, 27%, 30% и 33%), измеренные при температуре 25°С, как описано в примере 6;
ФИГУРА 14С графически изображает кривую течения водных растворов (0,5% концентрация), нагреваемых в течение 4 часов трехкомпонентных смесей, содержащих коньяк глюкоманнан, ксантановую камедь и альгинат натрия, содержащих коньяк глюкоманнан (КМ) и ксантановую камедь (XG) в постоянном соотношении (KM:XG=4,12:1) и переменные количества альгинат натрия (0%, 2%, 5%, 8%, 11%, 13%, 17%, 21%, 24%, 27%, 30% и 33%), измеренные при температуре 25°С, как описано в примере 6;
ФИГУРА 15А графически изображает зависимость К пропорционально альгинат натрию в смеси касательно ненагретых или нагретых (один час) 0,5% водных растворов смесей коньяк глюкоманнана, ксантановой камеди и альгинат натрия в постоянном соотношении KM:XG (4,12:1) и переменные количества альгината (от 0% до 33%), как описано в примере 6;
ФИГУРА 15В графически изображает зависимость n пропорционально альгинат натрию в смеси касательно ненагретых и нагретых (один час) 0,5% водного раствора смесей коньяк глюкоманнана, ксантановой камеди и альгинат натрия в постоянном соотношении KM:XG (4,12:1) и переменные количества альгината (от 0% до 33%), как описано в примере 6;
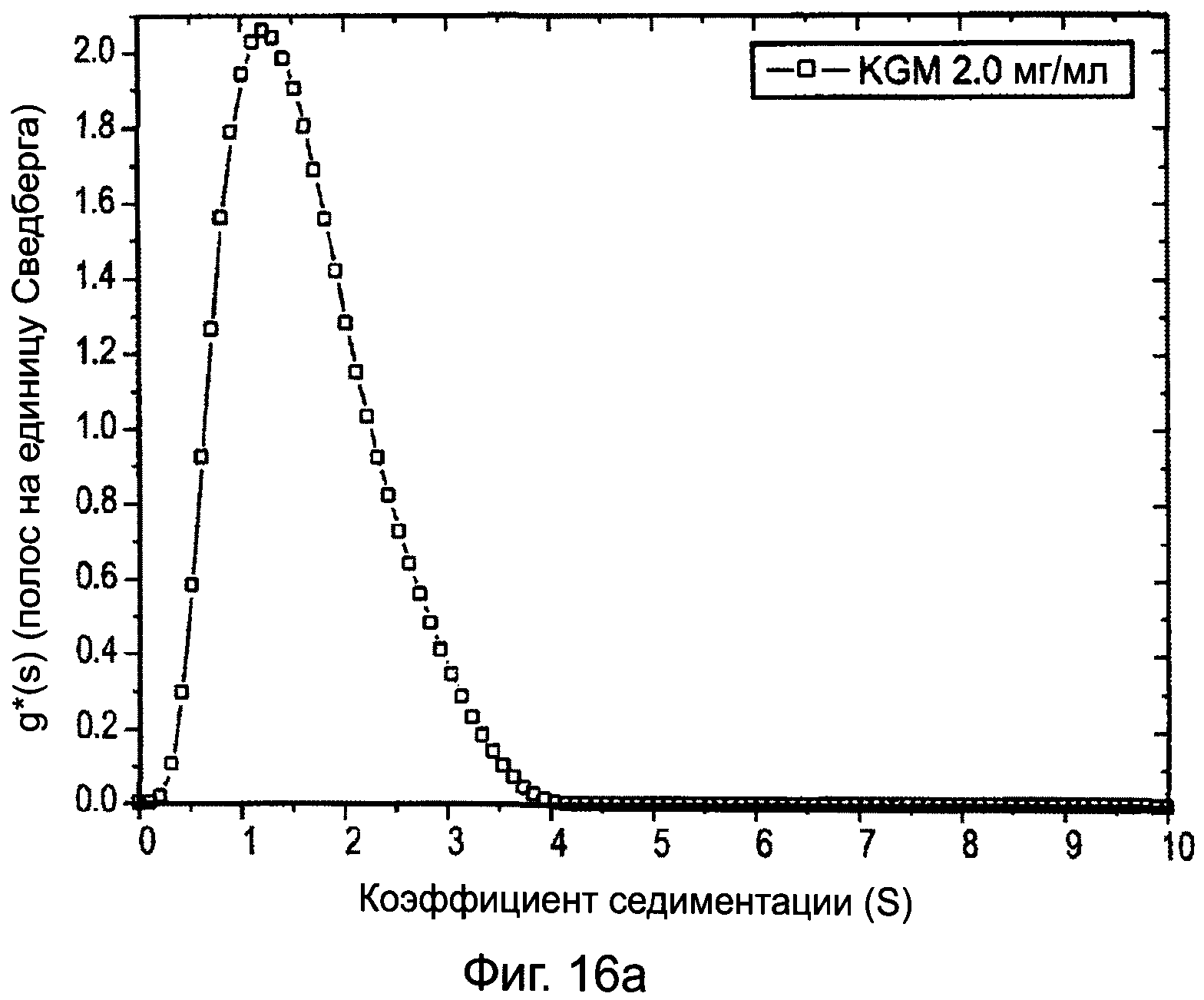
ФИГУРА 16А графически изображает распределение концентрации кажущейся седиментации g*(s) vs s касательно глюкоманнана при концентрации нагрузки 2 мг/мл и I=0,0, при скорости вращения ротора 45 ООО оборотов в минуту, температуре = 20,0°С. Ордината выражается в полосах на Сведберг (S) и абсцисса в единицах Сведберга, как описано в примере 6;
ФИГУРА 16 В графически изображает распределения концентрации кажущейся седиментации g*(s) vs s касательно альгинат натрия при концентрации нагрузки 2 мг/мл и I=0,0, при скорости вращения ротора 45 ООО оборотов в минуту, температуре = 20,0°С. Ордината выражается в полосах на Сведберг (S) и абсцисса в единицах Сведберга, как описано в примере 6;
ФИГУРА 16С графически изображает распределения концентрации кажущейся седиментации g*(s) vs s касательно ксантана при концентрации нагрузки 2 мг/мл и I=0,0, при скорости вращения ротора 45 ООО оборотов в минуту, температуре = 20,0°С. Ордината выражается в полосах на Сведберг (S) и абсцисса в единицах Сведберга, как описано в примере 6;
ФИГУРА 17А графически изображает распределения концентрации кажущейся седиментации касательно необработанной/негранулированной VFB (называемой «ТМ1») с ионными силами 0-0,2 М, как описано в примере 6;
ФИГУРА 17 В графически изображает распределения концентрации кажущейся седиментации касательно необработанной/негранулированной VFB (называемой «ТМ1») с ионными силами 0-0,01 М, как описано в примере 6;
ФИГУРА 17С графически изображает распределения концентрации кажущейся седиментации касательно обработанного/гранулированного VFC (PGX®) с ионными силами 0-0,01 М, как описано в примере 6;
ФИГУРА 17D графически изображает распределения концентрации кажущейся седиментации касательно обработанного/гранулированного VFC (PGX®) с ионными силами 0-0,2 М, как описано в примере 6;
ФИГУРА 18А графически изображает воздействие ионной силы (выраженной в единицах молярной концентрации М) на количество материала с коэффициентом седиментации > 3,5S касательно необработанной/негранулированной VFB (ТМ1), как описано в примере 6;
ФИГУРА 18В графически изображает воздействие ионной силы (выраженной в единицах молярной концентрации М) на количество материала с коэффициентом седиментации > 3,5S касательно обработанного/гранулированного VFC (PGX®), как описано в примере 6;
ФИГУРА 19А графически изображает распределения коэффициента седиментации касательно ненагретых смесей, содержащих постоянное соотношение глюкоманнана:ксантана (KM:XG=4,12:1) и изменяющиеся концентрации альгината (от 0% до 33%), как описано в примере 6; и
ФИГУРА 19В графически изображает распределения коэффициента седиментации касательно нагретых (1 или 4 часа) смесей, содержащих постоянное соотношение глюкоманнана: ксантана (KM:XG=4,12:1) и изменяющиеся концентрации альгината (от 0% до 33%), как описано в примере 6.
ПОДРОБНОЕ ОПИСАНИЕ
В настоящем изобретении предложены пищевые добавки, продукты лечебного питания и эффективные способы задержки возникновения, замедления прогрессирования и/или уменьшения интенсивности по меньшей мере одного из симптомов метаболического заболевания или расстройства, такого как метаболический синдром, диабет I типа, диабет II типа, панкреатическое заболевание и/или гиперлипидемия.
В данном контексте термин «метаболический синдром» относится к одному или нескольким из нижеследующих симптомов: увеличение висцерального ожирения, сывороточной глюкозы и инсулиновых уровней, наряду с гипертензией и дислипидемией (E.J.Gallagher et al., Endocrinol. Metab. Clin. NorthAm. 37:559-79 (2008)). Метаболический синдром - это название группы симптомов, которые возникают вместе и связываются с повышенным риском развития ишемической болезни сердца, инсульта и диабета II типа. Симптомы метаболического синдрома включают в себя избыточный вес вокруг талии (центральное или абдоминальное ожирение), высокое кровяное давление, высокие триглицериды, резистентность к инсулину, низкий холестерин липопротеинов высокой плотности (HDL) и повреждение тканей, вызываемое высокой глюкозой. Считается, что резистентность к инсулину является основной причиной метаболического синдрома.
В данном контексте термин «уменьшение интенсивности по меньшей мере одного из симптомов метаболического заболевания или расстройства» включает в себя симптоматическую терапию для ослабления, снятия или маскирования симптомов заболевания или расстройства, а также терапию для предупреждения, понижения, прекращения или обращения вспять прогрессирования тяжести состояния или симптомов, подлежащих лечению. В связи с этим термин «лечение» включает в себя медицинское терапевтическое лечение установленного состояния или симптомов и/или профилактический прием лекарственного препарата, при необходимости.
В данном контексте термин «лечащий» также охватывает, в зависимости от состояния субъекта, который в этом нуждается, предупреждение метаболического заболевания или расстройства или предупреждение одного или нескольких симптомов, связанных с патологией метаболического заболевания или расстройства, включая возникновение метаболического заболевания или расстройства или любых симптомов, связанных с ними, а также снижение тяжести метаболического заболевания или расстройства или предупреждение рецидива одного или нескольких симптомов, связанных с метаболическим заболеванием или расстройством.
В данном контексте термин «продукт лечебного питания» относится к продукту, который разработан для употребления или энтерального введения под наблюдением врача, и который предназначается для специальной диетотерапии заболевания или состояния, для которого отличительные пищевые потребности, основанные на признанных научных принципах, устанавливаются посредством медицинской оценки.
В данном контексте термин «глюкоманнан» относится к водорастворимому пищевому волокну с остатками β-(1,4)-связанной D-маннозы и β-(1,4)-связанной D-глюкозы в соотношении примерно 3:1 и разным α-связанным концевым группам галактозы. Его обычно извлекают из корня коньячного растения Amorphophallus konjac, но его также можно извлечь из других растительных источников.
В данном контексте термин «ксантановая камедь» относится к гетерополисахариду, содержащему глюкозу, маннозу, калий или глюкуронат натрия, ацетат и пируват.
В данном контексте термин «альгинат» относится к смешанному полимеру маннуроновой кислоты и гулуроновой кислоты.
В данном контексте термин «смесь волокна» относится к смеси волокон.
В данном контексте термин «смесь вязкого волокна» («VFB») относится к смеси глюкоманнана, ксантановой камеди и альгината.
В данном контексте термин «комплекс вязкого волокна» («VFC») относится к взаимодействующей матрице трех компонентов глюкоманнана, ксантановой камеди и альгината, в которой компоненты обрабатываются способом (например, гранулирование), который допускает их взаимодействие с целью создания нового ингредиента, а не смеси трех отдельных компонентов посредством создания вторичных и третичных взаимодействий (зоны соединений и сети) между сырьевыми ингредиентами, которые предупреждают отдельные компоненты от проявления свойств, которые каждый из них показывал бы в своем чистом состоянии.
Продукты лечебного питания
В одном аспекте в настоящем изобретении предложены продукты лечебного питания, разработанные для предупреждения, лечения или уменьшения интенсивности одного или несколько симптомов, связанных с метаболическим заболеванием или расстройством, таким как метаболический синдром, диабет I типа или диабет II типа, экзокринная недостаточность поджелудочной железы, включая пациентов, страдающих от хронического панкреатита и/или гиперлипидемии. Продукт лечебного питания в соответствии с данным аспектом изобретения содержит композицию высоковязкого полисахаридного пищевого волокна, содержащую смесь вязкого волокна (VFB) или его комплекс (VFC), содержащий примерно от 48% примерно до 90% (в/в) глюкоманнана, примерно от 5% примерно до 20% (в/в) ксантановой камеди и примерно от 5% примерно до 30% (в/в) альгината, и по меньшей мере один макроэлемент, выбранный из группы, состоящей из белка, углевода и жира.
Как описано в заявке на патент США, находящейся на рассмотрении, №11/400,768, поданной 7 апреля 2006 года, и в заявке на патент США, находящейся на рассмотрении, №11/830,615, поданной 30 июля 2007 года, содержание которых включено в данный документ в порядке ссылки, была разработана композиция высоковязкого полисахаридного пищевого волокна, содержащая смесь волокна (VFB) или его комплекс (VFC), производимый посредством объединения примерно от 48% примерно до 90% (в/в) глюкоманнана, примерно от 5% примерно до 20% (в/в) ксантановой камеди и примерно от 5% примерно до 30% (в/в) альгината, продаваемая под названием «PolyGlycopleX®» или «PGX®», которая обладает очень высокой водоудерживающей способностью и гелеобразующим свойством. Составляющие полисахаридные компоненты данной композиции волокна дополняют друг друга и действуют синергитически с целью создания сильных взаимодействий, которые приводят к уровню вязкости, который в три - пять раз является более высоким, чем любой другой известный в настоящее время полисахарид. Как описано в примерах 5 и 6 в данном документе, было определено, что после обработки (например, гранулирования) три компонента - глюкоманнан, ксантановая камедь и альгинат - взаимодействуют с целью создания нового ингредиента (комплекса («VFC»)), а не смеси 3 отдельных компонентов посредством создания вторичных и третичных взаимодействий (зон соединений и сетей) между сырьевыми ингредиентами, которые предупреждают отдельные компоненты от проявления свойств, которые каждый из них показывал бы в своем чистом состоянии.
Данная композиция высоковязкого пищевого волокна вызывает значительное увеличение вязкости содержимого желудочно-кишечного тракта при более низком гравиметрическом количестве, чем гравиметрическое количество, которое было бы необходимо с другими растворимыми волокнами. Данное высококонцентрированное свойство позволяет данной композиции волокна вызывать значительные физиологические эффекты при дозах, которые являются значительно более низкими, чем другие растворимые волокна, делая ее, таким образом, более удобной для включения значимых количеств данного материала в продукты питания.
В одном воплощении изобретения полисахариды, используемые в производстве смеси вязкого волокна (VFB), обрабатываются посредством гранулирования с целью производства взаимодействующей матрицы трех компонентов (то есть комплекса (VFC)). В данном контексте «гранулирование» относится к любому процессу увеличения размера, в котором маленькие частицы собираются вместе в более большие, постоянные скопления. Гранулирование можно осуществить посредством перемешивания в оборудовании для смесительных операций посредством уплотнения, экструдирования или глобулирования. Композиции пищевых волокон можно гранулировать при использовании разных размеров ячеек сита. Термин «ячейка сита» относится к размеру частицы, что определено ее способностью проходить через экран, имеющий отверстия заданных размеров. Размеры ячеек сита, используемые в данном документе, представляют собой эквиваленты Тайлера, как изложено в таблице 21-12 Chemical Engineers Handbook (5-ое издание, издательство Perry & Chilton). Чем больше гранулирование (то есть чем меньше размер ячейки сита) композиции/комплекса пищевого волокна, тем больше времени требуется для получения необходимой вязкости. В некоторых воплощениях композиция/комплекс пищевого волокна гранулируется при использовании объединенного размера ячейки сита посредством отделения гранулированных материалов по размеру их частиц, затем повторно объединяя отделенные гранулы с одним размером частиц для получения заданного профиля вязкости. Например, объединенный размер ячейки сита, составляющий от 30 до 60, получается посредством объединения гранул, составляющих 30 меш (примерно 600 микронов), гранул, составляющих примерно 40 меш (примерно 400 микронов), и гранул, составляющих примерно 60 меш (250 микронов).
Пропорции глюкоманнана, ксантановой камеди и альгината в смеси/комплексе вязкого пищевого волокна (VFB/C), характерные для продукта лечебного питания, могут составлять примерно от 48% примерно до 90% глюкоманнана (например, примерно от 60% примерно до 80% или примерно от 60% примерно до 90%, или примерно от 65% примерно до 75%, или примерно от 50% примерно до 80%, или примерно от 50% примерно до 70%, или примерно 70%), примерно от 5% примерно до 20% ксантановой камеди (например, примерно от 10% примерно до 20% или примерно от 11% примерно до 13%, или примерно от 13% примерно до 17%, или примерно 13%, или примерно 17%) и примерно от 5% примерно до 30% альгината (например, примерно от 10% примерно до 20% или примерно от 13% примерно до 17%, или примерно 13%, или примерно 17%). В некоторых воплощениях изобретения пропорции глюкоманнана, ксантановой камеди и альгината в пищевых композициях, содержащихся в продукте лечебного питания, составляют примерно 70% глюкоманнана, примерно от 13% примерно до 17% ксантана и примерно от 13% примерно до 17% альгината.
В некоторых воплощениях изобретения продукты лечебного питания разрабатываются с целью обеспечения общего суточного потребления человеком от 1,0 г до 100 г смеси вязкого волокна или его комплекса (VFB/C), содержащего примерно от 48% примерно до 90% (в/в) глюкоманнана, примерно от 5% примерно до 20% (в/в) ксантановой камеди и примерно от 5% примерно до 30% (в/в) альгината (VFB/C), например, примерно от 5 г примерно до 50 г VFB/C в день, например, примерно от 10 г примерно до 35 г VFB/C в день, примерно от 12 г до 35 г VFB/C в день или, например, примерно от 15 г до 35 г VFB/C в день, например, примерно от 20 г до 35 г VFB/C в день, например, примерно от 12 г примерно до 25 г VFB/C в день, например, примерно от 15 г примерно до 25 г VFB/C в день. В некоторых воплощениях изобретения продукты лечебного питания разрабатываются с целью обеспечения ежедневной дозы VFB/C человеку, составляющей примерно от 25 мг/кг/день примерно до 1000 мг/кг/день, например, примерно от 50 мг/кг/день примерно до 600 мг/кг/день, например, примерно от 100 мг/кг/день примерно до 500 мг/кг/день, например, примерно от 200 мг/кг/день примерно до 400 мг/кг/день.
Продукты лечебного питания изобретения могут дополнительно содержать дополнительные компоненты, например, белки или аминокислоты, углеводы, липиды, витамины, минералы и кофакторы, натуральные и искусственные ароматизаторы, красители или другие красящие добавки и консерваторы. Термин «витамины» включает в себя, помимо прочего, тиамин, рибофлавин, никотиновую кислоту, пантотеновую кислоту, пиридоксин, биотин, фолиевую кислоту, витамин В12, липоевую кислоту, аскорбиновую кислоту, витамин А, витамин D, витамин Е и витамин К. В термин «витамины» также включаются кофакторы и коферменты, например, коферменты, включающие в себя тиаминпирофосфаты (ТРР), флавинмононуклеотид (FMM), флавинадениндинуклеотид (FAD), никотинамидадениндинуклеотид (NAD), никотинамидадениндинуклеотидфосфат (NADP), кофермент А (СоА), пиридоксальфосфат, биоцитин, тетрагидрофолиевую кислоту, кофермент В, липоиллизин, 11-цис-ретинал и 1,25-дигидроксихолекалциферол. Термин «витамины» также включает в себя холин, карнитин, а также альфа, бета и гамма-каротины. Термин «минералы» относится к неорганическим веществам, металлам и тому подобному, необходимым для рациона питания, включающий в себя, помимо прочего, кальций, железо, цинк, селен, медь, йод, магний, фосфор, хром, марганец, калий и тому подобное, а также их смеси. Минерал может быть в виде соли, оксида или хелатной соли.
В некоторых воплощениях изобретения продукты лечебного питания изобретения дополнительно содержат один или несколько липидов. В контексте в соответствии с данным воплощением изобретения липид определятся как вещество, например жир, масло или воск, которое растворяется в спирте, но не в воде. В данном контексте термины «жир» и «масло» используются взаимозаменяемо и содержат жирные кислоты. В некоторых воплощениях изобретения липид для использования в композиции содержит жир, выбранный из группы, состоящей из молочного жира (например, молочный жир, жир масла), животного жира (например, лярд) или растительного жира (например, кокосовое масло, масло какао, пальмовое масло или маргарин).
В некоторых воплощениях изобретения липид для использования в продуктах лечебного питания изобретения содержит пищевое масло или смесь масел. Такие масла включают в себя растительные масла (например, каноловое масло, соевое масло, пальмоядровое масло, оливковое масло, сафлоровое масло, подсолнечное масло, масло из льняного семени (льняное масло), кукурузное масло, хлопковое масло, арахисовое масло, ореховое масло, миндальное масло, виноградное масло, масло первоцвета вечернего, кокосовое масло, масло бурачника, масло черной смородины); масла из продуктов моря (например, рыбий жир и жир из печени рыб) или их смеси.
В некоторых воплощениях изобретения липид для использования в продуктах лечебного питания изобретения содержит масла, содержащие среднецепочечные триглицериды, например кокосовое масло, пальмоядровое масло и масло, или среднецепочечные триглицериды в очищенном виде.
В некоторых воплощениях изобретения в продуктах лечебного питания изобретения предложен единственный источник калорий или питательных веществ для пациента. В некоторых воплощениях изобретения продукт лечебного питания в соответствии с изобретением разрабатывается для предоставления первоисточника волокна в питании человека. В некоторых воплощениях изобретения продукт лечебного питания в соответствии с изобретением разрабатывается для предоставления единственного источника волокна в питании человека и маркируется и/или вводится врачом соответствующим образом.
Продукты лечебного питания, которые употребляются как часть полного, сбалансированного питания, обычно разрабатываются с целью замещения одного или нескольких приемов пищи в течение дня, сокращая тем самым количество потребляемых волокон из обычных продуктов. Ввиду того, что продукты лечебного питания вводятся под наблюдением врача, маловероятно, что пациенты будут потреблять дополнительные пищевые добавки, содержащие волокно.
Продукты лечебного питания настоящего изобретения предназначаются для использования отдельной популяцией пациентов, которые находятся на лечении и под наблюдением врача. Продукты лечебного питания изобретения можно вводить млекопитающим, например, человеку, страдающему заболеванием или с повышенным риском развития метаболического состояния, с целью предупреждения, лечения или уменьшения интенсивности одного или нескольких симптомов, связанных с метаболическим заболеванием или расстройством, таким как метаболический синдром (также известный, как синдром Х и синдром резистентности к инсулину), диабет I типа, диабет II типа, ожирение, неалкогольный стеатогепатоз (жировая дистрофия печени), панкреатическое заболевание и гиперлипидемия, как далее описано в данном документе.
В некоторых воплощениях изобретения продукт лечебного питания изобретения вводится субъекту, нуждающемуся в этом по меньшей мере один раз в день. В некоторых воплощениях изобретения продукт лечебного питания изобретения вводится два раза в день, предпочтительно один раз утром и один раз днем/вечером. Обычный режим лечения касательно продуктов лечебного питания будет продолжаться по меньшей мере от двух недель до восьми недель или дольше. В зависимости от таких факторов, как медицинские состояния, подлежащие лечению и реакция пациента, режим лечения можно продлить до тех пор, пока у пациента не уменьшится интенсивность по меньшей мере одного симптома заболевания или расстройства. Продукт лечебного питания настоящего изобретения обычно будет употребляться двумя порциями в день в качестве заменителя пищи или закуски между приемами пищи. В некоторых воплощениях изобретения продукт лечебного питания изобретения вводится субъекту в качестве единственного источника пищи от трех до четырех раз в день, как часть контролируемого с медицинской точки зрения режима питания с очень низким содержанием калорий. Типовое использование питания с очень низким содержанием калорий применяется при лечении ожирения для достижения быстрой потери веса и снижения кардиометаболических факторов риска.
Способы приготовления продуктов лечебного питания
В другом аспекте в настоящем изобретении предложен способ приготовления продукта лечебного питания, содержащий стадию добавления эффективного количества композиции пищевого волокна, содержащей вязкую смесь волокна (VFB) или его комплекс (VFC), содержащий глюкоманнан, ксантановую камедь и альгинат, в продукт лечебного питания. В некоторых воплощениях изобретения способ приготовления продукта лечебного питания содержит стадию добавления эффективного количества композиции пищевого волокна, содержащей комплекс волокна (VFC), созданный из вязкой смеси волокна (VFB), содержащей глюкоманнан, ксантановую камедь и альгинат, в продукт лечебного питания.
В некоторых воплощениях изобретения продукт лечебного питания разрабатывается для предупреждения, лечения или уменьшения интенсивности одного или нескольких симптомов, связанных с метаболическим заболеванием или расстройством. В некоторых воплощениях изобретения композиция пищевого волокна, добавляемая в продукт лечебного питания, содержит смесь волокна (VFB) или комплекс волокна (VFC), созданный из смеси волокна (например, гранулированная VFB), содержащей примерно от 48% примерно до 90% (в/в) глюкоманнана (например, примерно от 60% примерно до 80% или примерно от 60% примерно до 90%, или примерно от 65% примерно до 75%, или примерно от 50% примерно до 80%, или примерно от 50% примерно до 70%, или примерно 70%), примерно от 5% примерно до 20% (в/в) ксантановой камеди (например, примерно от 10% примерно до 20% или примерно от 11% примерно до 13%, или примерно от 13% примерно до 17%, или примерно 13%, или примерно 17%) и примерно от 5% примерно до 30% (в/в) альгината (например, примерно от 10% примерно до 20% или примерно от 13% примерно до 17%, или примерно 13%, или примерно 17%). В некоторых воплощениях изобретения пропорции глюкоманнана, ксантановой камеди и альгината в смеси волокна или в комплексе волокна, созданном из смеси волокна, в композиции пищевого волокна, которая добавляется в продукт лечебного питания, содержится примерно 70% глюкоманнана, примерно от 13% примерно до 17% ксантана и примерно от 13% примерно до 17% альгината.
В некоторых воплощениях изобретения количество композиции пищевого волокна, содержащей вязкую смесь волокна (VFB) или его комплекс (VFC), добавляемое в продукт лечебного питания, разработанное для лечения или предупреждения метаболического заболевания или расстройства, составляет примерно от 5% примерно до 20% от общего веса продукта лечебного питания. В некоторых воплощениях изобретения количество композиции пищевого волокна или его комплекса (VFB/C), добавляемое в продукт лечебного питания, содержит примерно от 1 г до 100 г в день, например, от 5 г примерно до 50 г в день, примерно от 10 г до 35 г в день, например, примерно от 12 г до 35 г в день, например, примерно от 15 г до 35 г в день, например, примерно от 20 г до 35 г в день, например, примерно от 12 г примерно до 25 г в день, например, примерно от 15 г примерно до 25 г в день, на основании употребления двух порций в день. Продукты лечебного питания изобретения обычно употребляются по меньшей мере один раз в день, предпочтительно два или три раза в день. Продукт лечебного питания в соответствии с данным изобретением предназначается для орального введения.
Композицию пищевого волокна, содержащую смесь волокна или его комплекс, можно совмещать с любым типом продукта лечебного питания, включая твердые, жидкие или полутвердые продукты лечебного питания. Типовые твердые продукты лечебного питания включают в себя, помимо прочего, зерновые культуры (например, рис, злаки (горячие или холодные)), мюсли, овсянку, хлебобулочные изделия (например, хлеб, печенья, кексы, пироги и другие), макаронные изделия (включающие в себя лапшу, изготовленную из риса или других зерновых культур), мясо (например, домашняя птица, говядина, баранина, свинина, морепродукты) и молочные продукты (например, молоко, йогурт, сыр, мороженое и масло). Типовые жидкие или полужидкие продукты лечебного питания включают в себя, помимо прочего, напитки заменители пищи, фруктовые соки, супы (включающие в себя сухие суповые смеси), пищевые добавки и фруктовые напитки.
Композицию пищевого волокна, содержащую смесь волокна или его комплекс, можно добавлять в продукт лечебного питания до употребления при использовании любого пригодного способа. Например, композицию пищевого волокна можно запекать в продукте лечебного питания, можно смешивать с продуктом лечебного питания или побрызгать на продукт лечебного питания.
Продукты лечебного питания изобретения упаковываются в стандартные дозы с маркировкой, четко указывающей, что продукт предназначается для использования в управлении течением специального метаболического заболевания или расстройства под наблюдением врача.
Способы предупреждения, лечения или уменьшения интенсивности одного или нескольких симптомов, связанных с метаболическим заболеванием или расстройством
В другом аспекте в настоящем изобретении предложен способ предупреждения, лечения или уменьшения интенсивности одного или нескольких симптомов, связанных с метаболическим заболеванием или расстройством, таким как метаболический синдром, диабет I типа, диабет II типа, ожирение, неалкогольный стеатогепатоз (жировая дистрофия печени), панкреатическое заболевание и гиперлипидемия. Способ в соответствии с данным аспектом изобретения содержит введение человеку, нуждающемуся в этом, эффективной дозы высоковязкой композиции полисахаридного пищевого волокна, содержащей вязкую смесь волокна (VFB) или его комплекс (VFC), содержащий примерно от 48% примерно до 90% (в/в) глюкоманнана (например, примерно от 60% примерно до 80% или примерно от 60% примерно до 90%, или примерно от 65% примерно до 75%, или примерно от 50% примерно до 80%, или примерно от 50% примерно до 70%, или примерно 70%), примерно от 5% примерно до 20% (в/в) ксантановой камеди (например, примерно от 10% примерно до 20% или примерно от 11% примерно до 13%, или примерно от 13% примерно до 17%, или примерно 13%, или примерно 17%) и примерно от 5% примерно до 30% (в/в) альгината (например, примерно от 10% примерно до 20% или примерно от 13% примерно до 17%, или примерно 13%, или примерно 17%). В некоторых воплощениях изобретения пропорции глюкоманнана, ксантановой камеди и альгината в смеси волокна или в его комплексе, составляют примерно 70% глюкоманнана, примерно от 13% примерно до 17% ксантана и примерно от 13% примерно до 17% альгината.
В некоторых воплощениях изобретения способ содержит введение композиции пищевого волокна, содержащей вязкую смесь волокна (VFB) или его комплекс (VFC, например, гранулированная VFB), содержащий примерно от 48% примерно до 90% (в/в) глюкоманнана, примерно от 5% примерно до 20% (в/в) ксантановой камеди и примерно от 5% примерно до 30% (в/в) альгината, человеку, нуждающемуся в этом, в дозе, составляющей от 1,0 г до 100 г VFB/C в день, например, примерно от 5 г примерно до 50 г VFB/C в день, например, примерно от 10 г примерно до 35 г VFB/C в день, примерно от 12 г до 35 г VFB/C в день или, например, примерно от 15 г до 35 г VFB/C в день, например, примерно от 20 г до 35 г VFB/C в день, например, примерно от 12 г примерно до 25 г VFB/C в день, например, примерно от 15 г примерно до 25 г VFB/C в день.
В некоторых воплощениях изобретения способ содержит введение смеси пищевого волокна (VFB) или его комплекса (VFC) млекопитающему, например человеку, нуждающемуся в этом, в дозе, составляющей примерно от 25 мг/кг/день примерно до 1000 мг/кг/день, например, примерно от 50 мг/кг/день примерно до 600 мг/кг/день, например, примерно от 100 мг/кг/день примерно до 500 мг/кг/день, например, примерно от 200 мг/кг/день примерно до 400 мг/кг/день, в течение периода времени, эффективного для предупреждения, лечения или уменьшения интенсивности одного или нескольких симптомов, связанных с метаболическим заболеванием или расстройством у субъекта.
В некоторых воплощениях изобретения композиция пищевого волокна, содержащая смесь волокна (VFB) или его комплекс (VFC), вводится субъекту в виде продукта лечебного питания, как описано в данном документе. В некоторых воплощениях изобретения композиция пищевого волокна вводится субъекту, нуждающемуся в этом по меньшей мере один раз в день. В некоторых воплощениях изобретения композиция пищевого волокна изобретения вводится два раза в день, предпочтительно один раз утром и один раз днем/вечером. Обычный режим лечения в соответствии с данным аспектом изобретения будет продолжаться по меньшей мере от двух недель до 16 недель или дольше. В зависимости от таких факторов, как медицинские состояния, подлежащие лечению, и реакция пациента, режим лечения можно продлить до тех пор, пока у пациента не уменьшится интенсивность по меньшей мере одного симптома метаболического заболевания или расстройства.
В одном варианте осуществления в настоящем изобретении предложен способ уменьшения интенсивности по меньшей мере одного симптома, связанного с прогрессированием резистентности к инсулину у человека, страдающего заболеванием или с повышенным риском развития диабета II типа. Способ в соответствии с данным аспектом изобретения содержит введение человеку, нуждающемуся в этом, примерно от 25 мг/кг/день примерно до 1000 мг/кг/день (например, от 100 мг/кг/день до 500 мг/кг/день или от 350 мг/кг/день примерно до 450 мг/кг/день) высоковязкой композиции полисахаридного пищевого волокна, содержащей смесь волокна или его комплекс (VFB/C), содержащий примерно от 48% примерно до 90% (в/в) глюкоманнана, примерно от 5% примерно до 20% (в/в) ксантановой камеди и примерно от 5% примерно до 30% (в/в) альгината, в течение периода времени эффективного для уменьшения интенсивности по меньшей мере одного симптома прогрессирования резистентности к инсулину, например, снижение уровней глюкозы в крови. В некоторых воплощениях изобретения способ содержит введение композиции пищевого волокна в течение периода времени, составляющего по меньшей мере от двух недель до 16 недель или дольше.
Согласно Американской ассоциации изучения сердечных заболеваний и Национальному институту болезней сердца, легких и крови диагностируется наличие метаболического синдрома при наличии у субъекта трех или нескольких нижеследующих признаков: кровяное давление равное или выше, чем 130/85 миллиметров ртутного столба; сахар (глюкоза) в крови равный или выше, чем 100 мг/дл; большая окружность талии (мужчины: 40 дюймов или больше; женщины: 35 дюймов или больше); низкий холестерин липопротеинов высокой плотности (HDL) (мужчины: ниже 40 мг/дл; женщины: ниже 50 мг/дл); или триглицериды, равные или выше, чем 150 мг/дл. Следовательно, в некоторых воплощениях изобретения способ уменьшения интенсивности по меньшей мере одного симптома, связанного с прогрессированием резистентности к инсулину у человека, страдающего заболеванием или с повышенным риском развития диабета II типа, содержит введение субъекту эффективного количества VFB/C в течение периода времени эффективного для (1) снижения сахара (глюкозы) в крови у субъекта до уровня ниже 100 мг/дл; (2) уменьшения окружности талии ниже 40 дюймов для мужчин или ниже 35 дюймов для женщин; и/или (3) снижения уровня триглицеридов до уровня, равного или меньше, чем 150 мг/дл.
Как описано в примерах 1-4 эффективность VFC (например, гранулированная VFB) демонстрируется для уменьшения интенсивности развития и прогрессирования ранней стадии метаболического синдрома у млекопитающих, включая способность замедлять прогрессирование повреждения органов, индуцированного глюкозой, снижать накопление липидов в печени, сохранять панкреатические бета-клетки и повышать чувствительность к инсулину по сравнению с контрольной группой.
Способы анализа образца, содержащего, по меньшей мере, один полисахарид.
В еще одном аспекте в настоящем изобретении предложен способ определения компонентных Сахаров в образце, содержащем по меньшей мере один полисахарид, такой как композиция пищевого волокна, содержащая смесь волокна или его комплекс. Способы в соответствии с данным аспектом изобретения содержат: (а) гидролиз образца, содержащего по меньшей мере один полисахарид при помощи кислоты с целью получения гидролизата; (b) разделение продуктов гидролиза в гидролизате при помощи хроматографического способа; (с) обнаружение продуктов гидролиза, разделенных на стадии (b); и (d) сравнение продуктов гидролиза, обнаруженных на стадии (с) с одним или несколькими эталонными стандартами с целью определения компонентных Сахаров в образце.
В некоторых воплощениях изобретения образец содержит по меньшей мере одно пищевое волокно. В некоторых воплощениях изобретения образец содержит альгинат натрия. В некоторых воплощениях изобретения образец содержит смесь волокна или его комплекс, содержащий альгинат, глюкоманнан и ксантановую камедь.
Гидролиз
В соответствии со способами данного аспекта изобретения образец, содержащий по меньшей мере один полисахарид, гидролизируется при помощи кислоты с целью получения гидролизата. В некоторых воплощениях изобретения кислота, используемая для гидролизирования образца, представляет собой трифторуксусную кислоту (TFA).
В некоторых воплощениях изобретения образец содержит альгинат, смешанный полимер маннуроновой кислоты и гулуроновой кислоты. В таких воплощениях изобретения стадию гидролиза образца, содержащего альгинат, осуществляют в условиях подходящих для высвобождения и сохранения L-гулуроновой кислоты, а также D-маннуроновой кислоты. Например, в одном воплощении первичный гидролиз альгиновой кислоты можно осуществить при помощи 95% серной кислоты при температуре 3°С в течение 14 часов или при помощи 80% серной кислоты при комнатной температуре в течение 14 часов, как описано Фишером и Дорфелем. В соответствии с такими воплощениями до перемешивания в альгиновой кислоте минеральная кислота охлаждается до температуры от -10°С до -5°С. Вязкая масса тщательно перемешивается во избежание образования комочков. Затем смесь разбавляется при помощи дробленого льда и воды, пока раствор серной кислоты не составит примерно 0.5N. Раствор затем нагревается в течение шести часов на кипящей водяной бане, затем нейтрализуется при помощи карбоната кальция. После фильтрации и промывания осадка сульфат кальция, вода для промывания ярко-желтого фильтрата концентрируется, затем проходит через катионообменную колонну и концентрируется при сниженном давлении до жидкого сиропа. После дополнительной медленной концентрации в дессикаторе и иннокуляции с D-маннофурануронолактоном при температуре плавления 191°С некоторое количество лактона кристаллизируется из сиропа, но только, если гидролизованная альгиновая кислота содержит больше D-маннуроновой кислоты, чем L-гулуроновой кислоты. После удаления кристаллического D-маннуронолактона, оставшийся D-маннуронолактон и L-гулуроновая кислота разделяются посредством хроматографических способов, как описано в данном документе.
В другом варианте осуществления стадия гидролиза образца, содержащего альгинат, содержит использование трифторуксусной кислоты (TFA). TFA обладает преимуществом перед минеральными кислотами, являясь достаточно летучей, допуская свое удаление посредством лишь лиофилизации гидролизата. Например, гидролиз в 2М TFA при температуре 100°С под азотом в течение периода времени, составляющего примерно от восьми часов примерно до 18 часов, оказался пригодным альтернативным вариантом гидролизу в 1М H2SO4 при одинаковых условиях. (Hough et al.). Следует отметить, что времени гидролиза, составляющего 6-8 часов, обычно достаточно для разрушения полисахаридов, состоящих из нейтральных Сахаров, однако наличие осадков уроновой кислоты в существенной пропорции создает дополнительную трудность, которая заключается в том, что связи гликозидуроновой кислоты, в общем, являются намного более устойчивыми к кислотному гидролизу, чем другие гликозидные связи. Для полисахаридов, таких как капсульные полисахариды бактерий, содержащих уроновую кислоту в пределах примерно от 16% до 30% моль, гидролиз в 2М TFA при температуре 100°С под азотом в течение 18 часов оказался удовлетворительным в некоторых случаях (Hough et al.). Однако при наличии остатков сахара особенно подверженных разрушению кислотой (например, D-рибоза, D-ксилоза или L-рамноза), время гидролиза предпочтительно ограничивается до восьми часов с последующей корректировкой аналитических результатов касательно оставшегося сахара, связанного с уроновой кислотой, пропорция альдобиуроновой кислоты в гидролизате установлена посредством гельпроникающей хроматографии на туго перекрестно-сшитом геле.
В некоторых воплощениях изобретения стадия гидролиза образца, содержащего альгинат, осуществляется посредством инкубации образца с TFA в течение периода времени, составляющего примерно от 48 до 72 часов при температуре, варьирующейся примерно от 95°С примерно до 110°С. Как описано в примере 6, настоящими изобретателями было определено, что гидролиз при помощи TFA течение 72 часов был эффективным для гидролитического высвобождения Сахаров из образца, содержащего альгинат, например образец, содержащий VFB/C.
Хроматографическое разделение гидролизата
В соответствии со способами данного аспекта изобретения продукты гидролиза в гидролизате затем разделяют при помощи хроматографического способа, например тонкослойной хроматографии, газовой хроматографии (GLC) или жидкостной хроматографии (LC), включая использование материалов обращенных фаз С18. В некоторых воплощениях изобретения хроматографический способ способен отделять нейтральные сахара от уроновых кислот, например, с помощью хроматографии Dionex.
Продукты гидролиза, разделенные посредством хроматографического способа, обнаруживаются и сравниваются с одним или несколькими эталонными стандартами для определения компонентных Сахаров в образце. Типичные детекторы, подходящие для обнаружения Сахаров, включают в себя импульсный амперометрический детектор Dionex или испарительный детектор светорассеяния (ELSD), или масс-спектрометр, соединенный с системой высокоэффективной жидкостной хроматографии (HPLC). Эталонные стандарты, например образцы с известными компонентами, можно использовать в качестве контрольных образцов параллельно с образцом для испытания. В качестве альтернативного варианта эталонным стандартом могут быть известные характеристики одного или нескольких определенных компонентных Сахаров (например, время удерживания/высота/относительная область) в эталонном образце, анализируемым посредством определенного хроматографического способа, как описано в примере 5.
В некоторых воплощениях изобретения способ в соответствии с данным аспектом изобретения содержит гидролизирование образца, содержащего по меньшей мере один полисахарид, такой как альгинат, при помощи TFA; разделение продуктов гидролиза в гидролизате при помощи хроматографического способа, такого как система HPLC с колонкой С18; обнаружение продуктов гидролиза при помощи детектора, такого как ELSD или масс-спектрометра; и сравнение обнаруженных продуктов с одним или несколькими эталонными стандартами для определения компонентных Сахаров в образце.
Нижеследующие примеры лишь изображают рассматриваемое ниже наилучшее техническое осуществление изобретения, их не следует толковать, как ограничивающие изобретение.
ПРИМЕР 1
Данный пример описывает воздействия композиции пищевого волокна, содержащей гранулированную смесь вязкого волокна (также называемую комплексом вязкого волокна (VFC), продаваемым под названием PolyGlycopleX (PGX®)) на резистентность к инсулину, массу тела, жизнеспособность панкреатических β-клеток и липидный профиль у диабетических крыс Цукера.
Обоснование: Самец диабетической крысы Цукера (ZDF) (ZDF/Crl-Leprfa/fa) был выбран в качестве животной модели для использования в данном исследовании, поскольку данная животная модель считается превосходной моделью гипертрофического ожирения с сопутствующим диабетом II типа и/или сниженной чувствительности к инсулину в раннем возрасте (С.Daubioul etal., J. Nutr. 132:967-973 (2002); J.M.Lenhard et al., Biochem. & Biophys. Res. Comm. 324:92-97 (2004); J.N.Wilson, Atherosclerosis 4:147-153 (1984)). ZDF являются мутантами, у которых отсутствуют мозговые лептиновые рецепторы. Лептин представляет собой белок, секретируемый жировой тканью, который сигнализирует подавление аппетита. Следовательно, у данных мутантных крыс отсутствует обратная сигнализация снижения аппетита или индуцирования насыщения. Крысы ZDF употребляют пищу с очень высокими скоростями и очень быстро становятся тучными. Данная модель, следовательно, имитирует людей, которые являются тучными от переедания. Как только крысы ZDF становятся тучными, они быстро становятся нечувствительными к инсулину, точно так же как человек (также называемый метаболическим синдромом). Крысы ZDF также являются гиперлипидемическими, данная крысиная модель продемонстрировала себя в качестве хорошей модели для метаболического синдрома у людей. С течением времени диабет в модели ZDF прогрессирует подобно прогрессированию у людей, становясь цветущим при потери популяции панкреатических β-клеток (клетки, секретирующие инсулин). Белки становятся гликозилированными из-за избытка глюкозы, приводя к проблемам функционирования органов у ZDF и человека, особенно почек. Высокие уровни глюкозы вызывают гликирование белков, приводя к диабетической нефропатии и васкулярному повреждению. В данном исследовании использовались ZDF в раннем возрасте (пять недель от роду) без высокожирного питания с целью определения возможности задержки возникновения и/или снижения тяжести диабета при введении гранул комплекса вязкого волокна (VFC).
Стандартным маркером степени глюкозного повреждения белков является гликозилированный гемоглобин (HbA1 с), который повышен у ZDF, который в настоящее время является одним из самых важных маркеров для одобрения лекарственных препаратов для человека. Измерение альбумина в моче также является стандартным маркером диабетического повреждения почки. Согласно руководству управления по контролю за продуктами и лекарствами (FDA) по лечению диабета необходим гликемический контроль и уменьшение повреждения тканей, вызываемого высокой глюкозой.
Способы Пища для крыс с повышенным содержанием волокон
Гранулы комплекса вязкого волокна (VFC) (коньяк/ксантан/альгинат (70:13:17) (то есть смесь волокна была обработана посредством гранулирования с целью создания комплекса, продаваемого под названием PGX®) были включены в основную пищу крыс (D11725: Research Diets, Нью-Брансуик, Нью-Джерси). Альтернативное питание, использованное в данном исследовании, включало другие виды волокон, как показано ниже в ТАБЛИЦЕ 1. Все питание было разработано для того, чтобы быть максимально изоэнергетическим, обеспечивая разное энергетическое содержание каждого источника волокна (питание, содержащее VFC и инулин, обеспечило 3,98 ккал/г, а целлюлоза обеспечила 3,90 ккал/г).
Целлюлоза была выбрана в качестве основного эталонного волокна, которое является нерастворимым и не поддается сбраживанию и считается инертным эталонным соединением (J.W.Anderson etal, J. Nutr. 124: 78-83 (1994). Инулин представляет собой фруктозный полимер растительного происхождения, который является водорастворимым и неперевариваемым и который показал эффективность в некоторых исследованиях касательно снижения липидов и гликемического контроля в некоторых исследованиях; но результаты являются изменчивыми (смотрите Р.Rozan etal., Br. J. Nutr. 99: 1-8 (2008). Количество фруктозных или глюкозных остатков (степень полимеризации «DP») инулина составило 99,9% s 5 со средней DP, составляющей s 23.
Дизайн исследования
Тридцать (30) самцов крыс ZDF/Crl-Leprfa/fa получены от Чарльз Ривер (Charles River) (Кингстон, Нью-Йорк) в возрасте пяти недель. Животных поместили отдельно в подвешенные сетчатые клетки из проволоки, которые соответствовали размеру, рекомендованному в последнем Guide for the Care and Use of Laboratory Animals, DHEW (NIH). Все исследования были утверждены Eurofins Institutional Animal Use and Care Committee (Комитет). В комнате, где содержались животные, регулировалась температура и влажность, был обеспечен 12-часовой цикл дня и ночи, поддерживалась чистота и отсутствовали вредители. Животные проходили акклиматизацию в течение одной недели после прибытия, и животные имели доступ к пище и воде ad libitum.
После адаптации крыс в случайном порядке определили в одну из трех групп на основании первоначальной глюкозы в крови и массы тела. Каждой группе крыс давали один тип пищи, содержащий VFC (продаваемый под названием PGX®), целлюлозу или инулин (Raftiline® HP, инулин, полученный из цикория), все по 5% (в/в), как показано выше в ТАБЛИЦЕ 1, в течение периода времени, составляющего 8 недель. Основные процедуры наблюдения проводились в ходе 8-недельного исследования, включая измерение веса пищи три раза в неделю, еженедельное измерение массы тела и забор образцов крови на содержание глюкозы и инсулина. Следует отметить, что анализ глюкозы не натощак начался на 3 неделю в то время, как анализ натощак начался в 1 неделю. У животных в состоянии не натощак инсулин измерялся только в последний момент времени. Анализ состояния не натощак был добавлен в исследование вследствие наблюдения больших воздействий VFC на стабилизацию уровней глюкозы, несмотря на то, что волокно физически присутствовало в желудочно-кишечном тракте, вероятно вследствие того, что крысы Цукера непрерывно ели днем и ночью. У животных в состоянии натощак сывороточные триглицериды измерялись в ходе исследования, тогда как у животных в состоянии не натощак было сделано только конечное измерение (IDEXX, Норт Графтон, Массачусетс).
Для всех исследований заборы образцов крови на содержание глюкозы и инсулина производились примерно в одно время суток (середина утра). Исследование завершилось проведением двух оральных тестов на толерантность к глюкозе с интервалом в одну неделю и вскрытием.
Измерения
Нижеследующие измерения проводились в ходе 8-недельмого исследования:
Прием пищи: До и после введения экспериментальной пищи вес пищи измерялся 3 раза в неделю.
Масса тела измерялась один раз в неделю. Содержание глюкозы в крови и инсулин: До и с еженедельными интервалами после введения экспериментальной пищи забор крови производился посредством ретроорбитального кровотечения после ночного голодания. Заборы образцов крови на содержание глюкозы и инсулина производились один раз в неделю примерно в одно время суток (середина утра). Небольшое количество анализировалось при помощи портативного глюкометра. После извлечения образца для инсулинового анализа, 1 мл подвергался свертыванию; 0,5 мл сыворотки извлекалось и анализировалось на содержание триглицеридов. Заборы дополнительных образцов производились посредством хвостового надреза, когда животные получали доступ к пище. Содержание глюкозы в крови измерялось при использовании глюкометра Bayer Ascensia Elite Glucometer (Bayer Health Care, Тарритаун, Нью-Йорк). Содержание инсулина измерялось при использовании ELISA (Ani Lytics, Гейтерсберг, Мэриленд).
Оральные тесты на толерантность к глюкозе (OGTTs) Через 9 недель и через 10 недель исследование завершилось проведением двух оральных тестов на толерантность к глюкозе (OGTTs) на крысах в состоянии натощак и не натощак, OGTT не натощак проводился последним. Исходный образец крови для инсулинового анализа и измерения глюкозы был взят для OGTTs натощак и не натощак. Исходный образец крови для окончательного OGTT не натощак также использовался для клинического биохимического анализа крови, как описано ниже.
OGTT для животных в состоянии натощак и не натощак индуцировался посредством орального лечения глюкозой (2 г/кг глюкозы, посредством принудительного питания). Заборы образцов крови производились через 30, 60, 90 и 120 минут после нагрузки глюкозой и анализировались на содержание глюкозы и инсулина. По завершении второго теста на толерантность к глюкозе крыс умертвили посредством передозировки изофлюрана и соответствующие органы извлекли для проведения гистопатологического анализа.
Показатели оценки гомеостатической модели (НОМА) были рассчитаны в ходе исследования, как мг глюкозы x инсулин (Ед/мл2). Это общепринятый надежный способ демонстрации изменений в резистентности к инсулину, где более низкие показатели НОМА представляют большие снижения в периферической резистентности к инсулину. Показатели обобщенного индекса чувствительности к инсулину (CISI) касательно исследований орального теста на толерантность к глюкозе (OGTT) также были рассчитаны при использовании нижеследующей формулы:
Данный показатель CISI учитывает амплитуду колебаний глюкозы и область под кривой с более высоким показателем, показывающим улучшенную чувствительность к инсулину.
Исходный образец крови для инсулинового анализа и измерения глюкозы был взят для OGTTs натощак и не натощак. Исходный образец крови для окончательного OGTT (не натощак) также использовался для клинического биохимического анализа крови, включающего в себя: электролиты, азот мочевины крови (BUN), креатинин, щелочную фосфатазу, аспартатаминотрансферазу (ALT), аланинаминотрансферазу (AST), билирубин (прямой + непрямой) и общий холестерин плазмы (анализ проводился при помощи IDEXX, Норт Графтон, Массачусетс).
Сывороточные триглицериды: У животных в состоянии натощак сывороточные триглицериды измерялись в ходе исследования, тогда как у животных в состоянии не натощак было сделано только конечное измерение (анализ проводился при помощи IDEXX, Норт Графтон, Массачусетс).
Клинический биохимический анализ крови: Исходный образец крови для окончательного OGTT не натощак использовался для клинического биохимического анализа крови, включающего в себя электролиты, азот мочевины крови (BUN), креатинин, щелочную фосфатазу, аспартатаминотрансферазу (ALT), аланинаминотрансферазу (AST), билирубин (прямой + непрямой) и общий холестерин плазмы (анализ проводился при помощи IDEXX, Норт Графтон, Массачусетс).
Анализ тканей: Одну долю печени, одну почку и поджелудочную железу зафиксировали в 10% нейтральном буферном формалине (NBF). Поджелудочную железу переместили в 70% этанол через 24 часа. Ткани обработали и заделали в парафин. Печень и почку секционировали с диаметром примерно 5 микронов и окрасили при помощи гематоксилина и эозина (Н&Е). Поджелудочную железу последовательно секционировали два раза с диаметром примерно 5 микронов, а срезы окрасили при помощи Н&Е или иммуногистохимического окрашивания при помощи мышиного антитела против крысиного инсулина (1:300 кроличий анти-крысиный инсулин, Cell Signaling Technology, Данверс, Массачусетс).
Иммуногистохимия:
Иммуногистохимия осуществлялась, как изложено ниже. Изотипическое контрольное антитело (нормальный кроличий IgG, R&D Systems, Миннеаполис, Миннесота) использовалось для оценки общего уровня неспецифичного окрашивания и окрашивания фона. После депарафинизации проводилось восстановление антигена при использовании раствора Declere® (Cell Marque™ Corporation, Роклин, Калифорния) в течение 15 минут при температуре 120°C, с последующим использованием горячего раствора Declere® в течение 5 минут при комнатной температуре. Эндогенная пероксидазная активность подавлялась посредством инкубации в 3% перекиси водорода в деионизированной воде в течение 10 минут. Срезы инкубировались в течение 20 минут в 5% нормальной сыворотке козла. Затем срезы инкубировались с первым антителом в течение 60 минут, с последующей инкубации в течение 30 минут в биотинилированном козлином анти-кроличьим антителе. Затем срезы инкубировались в АВС Elite Reagent® (Vector, Бурлингем, Калифорния) в течение 30 минут. В конце образцы инкубировались в диаминобензидине в течение 5 минут с последующим гематоксилиновым контрастным окрашиванием.
После вскрытия дополнительная доля печени подверглась мгновенному замораживанию, была заделана в ОСТ и секционирована с диаметром 5 мкм и окрашена при помощи судана черного для анализа содержания липидов (свободные жирные кислоты и триглицериды).
Все срезы, окрашенные при помощи Н&Е, были оценены на предмет морфологических изменений, относящихся к обычно наблюдаемым изменениям у ZDF, например, увеличение тубулярной дилатации и увеличение тубулярной дегенерации в почке, клеточная дистрофия панкреатического островка и стеатоз печени. Данные изменения были классифицированы полуколичественно по шкале от 0 до 5 в зависимости от определения степени тяжести, где 5 является самым тяжелым показателем.
Срезы печени, окрашенные при помощи Судана черного, были оценены и классифицированы полуколичественно на наличие вакуолей положительных к Судану черному по шкале от 0 до 5, где 5 является самым тяжелым показателем.
Процент островковой области с клетками положительными к инсулину был измерен на срезах поджелудочной железы, иммуногистохимически окрашенных при помощи антиинсулинового антитела. Данное измерение проводилось морфометрически. Десять островков на поджелудочную железу были обозначены вручную ветеринарным патологом. Области положительные к инсулиновому окрашиванию в пределах данных островков были обозначены аналогичным образом, и процент островковых областей положительных к инсулину был рассчитан при использовании программного обеспечения обработки изображений ImagePro®Plus.
Статистические способы:
Многократно собираемые количественные данные были проанализированы посредством двустороннего дисперсионного анализа повторных измерений (ANOVA). Значимые эффекты повлекли за собой апостериорное сравнение при использовании критериев множественных сравнений Бонферрони, как описано в Motulsky H., Intuitive Biostatistics, NY, University Press (1995).
Химические анализы инсулина, холестерина и крови, измеренные только в конце исследования у крыс в состоянии не натощак, были проанализированы посредством одностороннего ANOVA. Значимые эффекты повлекли за собой апостериорные сравнения при использовании критериев множественных сравнений Дуннета (МСТ), как описано в Motulsky H., Intuitive Biostatistics, NY, University Press (1995). Неколичественные или дискретные данные (например, гистологические показатели) были проанализированы посредством критерия Крускала-Уоллиса, как описано Motulsky H., Intuitive Biostatistics, NY, University Press (1995). Значимые эффекты повлекли за собой апостериорные сравнения при использовании МСТ Дуннета.
Результаты
Масса тела и употребление пищи
ФИГУРА 1А графически изображает воздействие диетического питания, содержащего VFC, целлюлозу или инулин, на массу тела (г) с течением времени в ходе 8-недельного исследования на диабетических крысах Цукера. Как показано на ФИГУРЕ 1А, увеличение массы тела относительно времени было снижено у крыс, получавших VFC, по сравнению с животными, получавшими целлюлозу, или животными, получавшими инулин, начиная с 1 недели. В начале исследования все диабетические крысы Цукера имели похожие массы тел (примерно 160 г). В течение следующих трех недель крысы, получавшие пищу, содержащую целлюлозу или инулин, прибавили в среднем примерно 40 г по сравнению с крысами, получавшими пищу, содержащую VFC. Значимые различия между крысами, получавшими VFC, по сравнению с питанием, содержащим целлюлозу или инулин, наблюдались, начиная с 1 недели по 8 неделю (Символ "***" указывает на то, что p<0,001, МСТ Бонферрони). Значимые различия не наблюдались между крысами, получавшими питание, содержащее инулин и целлюлозу.
ФИГУРА 1 В графически изображает воздействие диетического питания, содержащего VFC, целлюлозу или инулин, на употребление пищи (г/день) с течением времени в ходе 8-недельного исследования на диабетических крысах Цукера. Как показано на ФИГУРЕ 1 В, употребление пищи было значительно снижено у крыс, получавших VFC, в течение первых трех недель (символ "*" указывает на то, что p<0,05 через 1 неделю; символ "***" указывает на то, что p<0,001 через 2 недели; и символ "**" указывает на то, что p<0,01 через 3 недели). Употребление пищи в группе VFC оставалось более низким в течение оставшегося протокола, хотя через 4 недели исследования уровни больше статистически не отличались от двух других групп. Значимые различия не наблюдались между крысами, получавшими питания, содержащие инулин и целлюлозу.
Крысы, получавшие пищу, содержавшую VFC, обычно съедали 20-23 г/день (сделана поправка на рассыпание; равная примерно 70-85 ккал/день). Крысы, получавшие пищу, содержавшую целлюлозу или инулин, обычно съедали 21-27 г/день (сделана поправка на рассыпание; равная примерно 75-100 ккал/день).
Таким образом, данные результаты демонстрируют, что увеличение массы тела относительно времени обычно наблюдаемое в крысиной модели ZDF, было значительно снижено у животных, получавших VFC.
Гликемический контроль: содержание сахара в крови и метаболизм
ФИГУРЫ 2A-D графически изображают воздействие диетического питания, содержащего VFC, целлюлозу или инулин, на глюкозу в крови натощак (ФИГУРА 2А), сывороточный инсулин натощак (ФИГУРА 2В), глюкозу в крови не натощак (ФИГУРА 2С) и показатели гомеостатической модели (НОМА) натощак (ФИГУРА 2D) у крыс ZDF с течением времени в ходе 8-недельного исследования. Как показано на ФИГУРЕ 2А, значения глюкозы в крови у крыс в состоянии натощак не были в значительной степени повышены ни у одной из крыс, наблюдались незначительные увеличения значений глюкозы касательно крыс, получавших VFC (символ "*" указывает на то, что p<0,05 через 3 и 6 недель).
Как показано на ФИГУРЕ 2В, уровни сывороточного инсулина у крыс в состоянии натощак были снижены у крыс, получавших VFC, в ходе периода исследования, а уровни сывороточного инсулина были снижены до статистически значимых уровней, начиная через пять недель (символ "***" указывает на то, что p<0,001 через 4 недели).
Как показано на ФИГУРЕ 2С, значения глюкозы в крови у крыс в состоянии не натощак были значительно снижены у крыс, получавших VFC, начиная примерно через пять недель (символ "***" указывает на то, что p<0,0001 через 5 недель) по сравнению с крысами, получавшими целлюлозу и инулин.
Как показано на ФИГУРЕ 2D, у крыс, получавших VFC, значительно снижены показатели НОМА, начиная через пять недель исследования (символ "*" указывает на то, что p<0,05), через 5-7 недель (p<0,05) и 8 недель (символ "**" указывает на то, что Р<0,01).
В общем, при условиях натощак (то есть животных исследовали утром примерно через 16 часов без доступа к пище), крысы ZDF сохраняли существенно более низкие концентрации глюкозы в крови по сравнению с концентрациями глюкозы в крови, наблюдаемыми при условиях кормления (не натощак) (сравните ФИГУРУ 2А с ФИГУРОЙ 2С). Как показано на ФИГУРЕ 1А, для всех групп в состоянии натощак значения глюкозы в крови обычно наблюдались в пределах между 95 мг/дл и 145 мг/дл, что считается незначительно диабетическим с незначительными различиями, наблюдаемыми между группами, получавшими VFC, целлюлозу или инулин.
Как показано на ФИГУРЕ 2В, при условиях натощак, крысы, получавшие питание, содержащее VFC, сохраняли гораздо более устойчивые концентрации сывороточного инсулина, чем крысы, получавшие пищу, содержавшую целлюлозу или инулин. Как показано на ФИГУРЕ 2В, уровни сывороточного инсулина натощак были снижены у крыс ZDF, получавших VFC, в ходе периода исследования, значительные снижения наблюдались, начиная через пять недель, и сохранялись значительными через 8 недель (p<0,001 через 4 недели, как указано символом "***"). Значимые различия не наблюдались между крысами, получавшими диеты, содержащие инулин и целлюлозу.
Резистентность к инсулину в ходе данного исследования у крыс в состоянии натощак была оценена посредством расчета оценки гомеостатической модели (НОМА). Как показано на ФИГУРЕ 2D, показатели НОМА увеличились в ходе исследования для всех групп, но значительно ниже в отношении крыс, получавших питание, содержащее VFC, чем в отношении крыс, получавших целлюлозу или инулин. Значимые различия между VFC по сравнению с целлюлозой или инулином наблюдались через 5, 6 и 7 недель (p<0,05, как указано символом "*") и через 8 недель (p<0,01, как указано символом "**"). Значимые различия не наблюдались между крысами, получавшими питание, содержащее целлюлозу или инулин.
ФИГУРА 3А графически изображает показатели обобщенного индекса чувствительности к инсулину (CISI) касательно диабетических крыс Цукера в состоянии натощак, получавших питания, содержащие VFC, целлюлозу или инулин, в ходе 8-недельного исследования. Как показано на ФИГУРЕ 3А, показатели CISI, рассчитанные касательно теста OGTT на животных в состоянии натощак, были значительно более высокими (p<0,01, указанный символом "**") касательно животных, получавших VFC, дополнительно демонстрируя улучшенную чувствительность к инсулину для данной группы VFC по сравнению с группами, получавшими целлюлозу и инулин.
ФИГУРА 3В графически изображает показатели обобщенного индекса чувствительности к инсулину (CISI) касательно диабетических крыс Цукера в состоянии не натощак, получавших питание, содержащее VFC, целлюлозу или инулин, в ходе 8-недельного исследования. Как показано на ФИГУРЕ 3В, животные в состоянии не натощак, получавшие VFC, показали значительно более высокий показатель CISI (p<0,001, указанный символом "***"), следовательно, более высокую чувствительность к инсулину по сравнению с группами, получавшими целлюлозу и инулин. Максимальные уровни глюкозы наблюдались через 30 минут после глюкозотолерантного теста, группа VFC имела значительно более низкое максимальное значение по сравнению с другими двумя группами.
Как показано на ФИГУРЕ 2С, при условиях не натощак (кормления) (то есть животных исследовали утром с непрерывным доступом к пище в течение последних 24 часов), крысы, получавшие питание, содержащее VFC, сохраняли более низкие уровни глюкозы в крови по сравнению с крысами, получавшими питание, содержащее целлюлозу или инулин, в ходе всех недель исследования. Исследование глюкозы в крови началось во время третьей недели исследования и продолжилось до восьмой недели. Исследование глюкозы животных в состоянии кормления было добавлено в протокол исследования при условии, что значения глюкозы в состоянии натощак были очень близки к нормальному диапазону, не привязываясь к какой-либо определенной теории, полагается, что многие из механистических действий VFC включают в себя его прямой контакт с пищей.
Несмотря на то, что при условиях кормления инсулин был измерен только в последний момент, наблюдалась улучшенная чувствительность к инсулину, похожая на чувствительность к инсулину, наблюдаемую у животных в состоянии натощак при измерении в последний момент времени. Как показано на ФИГУРЕ 2С, реакция на глюкозу в крови в состоянии кормления была значительно снижена у животных, получавших VFC (p<0,001, как указано символом "***"), по сравнению с животными, получавшими инулин или целлюлозу. Значимые различия не наблюдались между крысами, получавшими питание, содержащее инулин и целлюлозу.
ФИГУРА ЗС графически изображает показатели НОМА, рассчитанные в отношении диабетических крыс Цукера в состоянии не натощак, получавших питание, содержащее VFC, целлюлозу или инулин, для последнего забора крови 8-недельного исследования. Как показано на ФИГУРЕ 3С, показатель НОМА оказался значительно более низким в группе, получавшей VFC (p<0,001) по сравнению с группами, получавшими целлюлозу и инулин. Как отмечалось выше, более низкие показатели НОМА представляют более значительные снижения периферической резистентности к инсулину.
Липидный профиль
Сывороточные триглицериды измерялись у животных в состоянии натощак (измерялись в течение всего исследования) и не натощак (измерялись только в конце 8-недельного исследования). ФИГУРА 4 графически изображает уровень сывороточных триглицеридов, измеренный у диабетических крыс Цукера в состоянии натощак, получавших питание, содержащее VFC, целлюлозу или инулин, с течением времени в ходе 8-недельного исследования. Как показано на ФИГУРЕ 4 касательно животных в состоянии натощак, животные, получавшие VFC, показали раннее и значительное понижающее воздействие на триглицериды по сравнению с группами, получавшими инулин и целлюлозу. Через 2-3 недели сывороточные триглицериды понизились во всех группах, животные, получавшие целлюлозу, имели более низкие триглицериды по сравнению с животными, получавшими инулин и VFC. Как показано ниже в ТАБЛИЦЕ 2, у животных в состоянии не натощак, как измерено в конце исследования, сывороточные триглицериды были похожи в отношении животных, получавших VFC и целлюлозу, а у животных, получавших инулин, оказались значительно более низкие уровни триглицеридов, чем у других двух групп.
В конце 8-недельного исследования был измерен холестерин плазмы в исходном образце, полученном от животных в состоянии кормления до проведения последнего OGTT. Как показано ниже в ТАБЛИЦЕ 2, животные были гиперхолестеринемическими и VFC значительно снизил уровни холестерина более чем на половину по сравнению с группами, получавшими целлюлозу и инулин.
Наиболее уязвимые органы: гистологическая оценка печени, поджелудочной железы и почек Несмотря на то, что вышеописанные данные касательно глюкозы и инсулина показывают улучшенную чувствительность к инсулину и гликемический контроль при лечении VFC, был проведен анализ тканей для оценки воздействия VFC на уменьшение степени повреждения органов, например, почки. Почка особенно известна чувствительностью к диабетической нефропатии, которая вероятно связана с гипергликемией и гликированием. Для всех измеренных тканей степень повреждения была оценена, как индикатор способности лечения VFC задерживать прогрессирование диабета и/или уменьшать интенсивность симптомов, связанных с диабетом.
Почка
Все срезы диабетической ткани почки, окрашенные при помощи Н&Е, были оценены на предмет морфологических изменений, связанных с морфологическими изменениями, обычно наблюдаемыми у ZDF, включающими в себя увеличение тубулярной дилатации и увеличение тубулярной дегенерации/регенерации. Некоторые параметры ренальной патологии показали различия между диабетическими крысами Цукера (ZDF), получавшими питание, содержащее VFC и крысами ZDF, получавшими пищу, содержащую инулин или целлюлозу.
ФИГУРА 5А графически изображает воздействие питания, содержащего VFC, целлюлозу или инулин, на диабетических крыс Цукера через восемь недель на ренальную тубулярную дилатацию на основании гистологического показателя от 0 до 5, где 5 является самым тяжелым показателем. Как показано на ФИГУРЕ 5А, тубулярная дилатация была оценена, как отсутствующая у крыс ZDF, получавших VFC. Для сравнения тубулярная дилатация присутствовала у крыс ZDF, получавших целлюлозу и инулин. Показатели, приведенные на ФИГУРЕ 5А, показали значительный лечебный эффект (p<0,001, указанный символом "*") между группами, получавшими VFC и целлюлозу или инулин. Значимые различия не наблюдались в объеме тубулярной дилатации между животными, получавшими инулин и целлюлозу.
ФИГУРА 5В графически изображает воздействие диетического питания, содержащего VFC, целлюлозу или инулин, на диабетических крыс Цукера через восемь недель на ренальную тубулярную дегенерацию/регенерацию на основании гистологического показателя от 0 до 5, где 5 является самым тяжелым показателем. Как показано на ФИГУРЕ 5В, крысы, получавшие питание, содержащее VFC, показали средний показатель тубулярной дегенерации/регенерации, составляющий 0,1, показатель которой составляет 1 (минимальная тяжесть) для одной крысы и 0 (в пределах нормальных границ) для других 9 крыс в группе. Для сравнения средний показатель для крыс, получавших питание, содержащее целлюлозу или инулин, составил 1,0, как дополнительно показано в ФИГУРЕ 5В. Лечебный эффект VFC на снижение тяжести тубулярной дегенерации/регенерации был значимым (p<0,01, указанный символом "**") со значимым различием, наблюдаемым между группами, получавшими VFC в сравнении с целлюлозой или инулином.
ФИГУРА 5С графически изображает воздействие диетического питания, содержащего VFC, целлюлозу или инулин, на диабетических крыс Цукера через 8 недель на ренальное мезангиальное расширение на основании гистологического показателя от 0 до 5, где 5 является самым тяжелым показателем. Как показано на ФИГУРЕ 5С, оценка клубочкового мезангиального расширения показала более низкие показатели касательно группы, получавшей питание, содержащее VFC по сравнению с питанием, содержащим целлюлозу или инулин. Несмотря на то, что показатели касательно мезангиального расширения достигли общей статистической значимости (p<0,05), единственными парами лечебных групп, которые значительно отличились при апостериорном исследовании, были группы, получавшие питание, содержащее VFC и инулин (p<0,05, указанный символом "*"), с сильной тенденцией к снижению по сравнению с целлюлозным питанием.
Поджелудочная железа
ФИГУРА 6 графически изображает процент области иммунореактивного инсулина панкреатического островка, присутствующей у диабетических крыс Цукера, получавших питание, содержащее VFC, целлюлозу или инулин, в конце 8-недельного исследования, как определено окрашиванием при помощи анти-крысиного инсулинового антитела. Как показано на ФИГУРЕ 6, крысы, получавшие питание, содержащее VFC, сохранили более высокую область инсулиновой иммунореактивности, рассчитанную как процент общей островковой области (то есть более большая масса панкреатических бета-клеток), как измерено посредством инсулиновой иммуногистохимии по сравнению с крысами, получавшими питание, содержащее целлюлозу или инулин. Анализ ANOVA показал значимый лечебный эффект (p<0,0001, указанный символом "***"), тогда как апостериорное исследование показало различия между крысами, получавшими питание, содержащее VFC и целлюлозу (p<0,001). Различия между животными, получавшими питание, содержащее инулин и целлюлозу, не наблюдались. Важно отметить, что данные, объединенные с данными, показывающими более низкие концентрации сывороточного инсулина натощак (ФИГУРА 2В) и большую чувствительность к инсулину (ФИГУРЫ 3В), указывают на то, что диабетические крысы Цукера, получавшие питание, содержащее VFC, сохраняют значительно большую резервную мощность к секреции инсулина по сравнению с крысами, получавшими питание, содержащее целлюлозу или инулин.
ФИГУРА 7А графически изображает гистологический показатель касательно инфильтратов мононуклеарных воспалительных клеток панкреатического островка, присутствующих у диабетических крыс Цукера, получавших питание, содержащее VFC, целлюлозу или инулин, в конце 8-недельного исследования на основании показателя от 0 до 5, где 5 является самым тяжелым показателем. Как показано на ФИГУРЕ 7А, различие в лечебном эффекте по показателям касательно наличия мононуклеарных инфильтратов островка не наблюдалось.
ФИГУРА 7В графически изображает гистологический показатель касательно клеточной дегенерации панкреатического островка, присутствующей у диабетических крыс Цукера, получавших питание, содержащее VFC, целлюлозу или инулин, в конце 8-недельного исследования на основании гистологического показателя от 0 до 5, где 5 является самым тяжелым показателем. Как показано на ФИГУРЕ 7В, показатели касательно дегенерации островковых клеток отсутствовали у крыс, получавших питание, содержащее VFC, и имели тенденцию к увеличению у крыс, получавших питание, содержащее целлюлозу или инулин; однако данные различия не достигли статистической значимости.
ФИГУРА 7С графически изображает гистологический показатель касательно количества фиброза панкреатического островка, присутствующего у диабетических крыс Цукера, получавших питание, содержащее VFC, целлюлозу или инулин, в конце 8-недельного исследования на основании гистологического показателя от 0 до 5, где 5 является самым тяжелым показателем. Как показано на ФИГУРЕ 7С, показатели касательно объема островкового фиброза имели тенденцию к снижению у крыс, получавших питание, содержащее VFC по сравнению с крысами, получавшими питание, содержащее целлюлозу или инулин; однако данные различия не достигли статистической значимости. Показатели касательно наличия кровотечения или гемосидерина обнаружили тенденцию к более низким показателям у крыс, получавших питание, содержащее VFC, но результаты не были статистически значимыми (данные не показаны).
Печень
ФИГУРА 8А графически изображает воздействие питания, содержащего VFC, целлюлозу или инулин, на диабетических крыс Цукера через восемь недель на стеатоз печени, как измерено посредством окрашивания Суданом черным, на основании гистологического показателя от 0 до 5, где 5 является самым тяжелым показателем. Как показано на ФИГУРЕ 8А, крысы, получавшие питание, содержащее VFC, показали небольшой стеатоз печени (измеренный окрашиванием Суданом черным), чем крысы, получавшие питание, содержащее целлюлозу или инулин. Согласно показателю от 0 (в пределах нормальных границ) до 5 (тяжелый), крысы, получавшие питание, содержащее VFC, в среднем получили 3,4. Это сравнивается с показателем 4,6 касательно крыс, получавших питание, содержащее целлюлозу, и 4,1 касательно крыс, получавших питание, содержащее инулин. Группы значительно отличались между крысами, получавшими питание, содержащее VFC, по сравнению с питанием, содержащим целлюлозу и инулин (p<0,01, как указано символом "**"). Значимые различия между крысами, получавшими питание, содержащее инулин и целлюлозу, не наблюдались.
Крысы, получавшие питание, содержащее VFC, также показали небольшую микровезикулярную вакуолизацию гепатоцитов по сравнению с крысами, получавшими питание, содержащее целлюлозу или инулин. ФИГУРА 8В графически изображает воздействие питания, содержащего VFC, целлюлозу или инулин, на диабетических крыс Цукера через 8 недель на гепатическую микровезикулярную вакуолизацию на основании гистологического показателя от 0 до 5, где 5 является самым тяжелым показателем. Как показано на ФИГУРЕ 8В, микровезикулярная вакуолизация была оценена как тяжелая у всех крыс, получавших питание, содержащее целлюлозу или инулин (средний показатель 4,6, высокий). Для сравнения крысы, получавшие питание, содержащее VFC, получили средний показатель 3,2 (легкий). МСТ Дуннета показал значимое различие между группами, получавшими питание, содержащее VFC и целлюлозу (p<0,001, как указано символом "**"), но не между группами, получавшими питание, содержащее инулин и целлюлозу.
ФИГУРА 8С графически изображает воздействие питания, содержащего VFC, целлюлозу или инулин, на диабетических крыс Цукера через восемь недель на гепатическую макровезикулярную вакуолизацию на основании гистологического показателя от 0 до 5, где 5 является самым тяжелым показателем. Как показано на ФИГУРЕ 8С, во всех лечебных группах макровезикулярная вакуолизация гепатоцитов была, как правило, менее выраженной по сравнению с микровезикулярной вакуолизацией гепатоцитов, что отражено в более низких показателях степени тяжести (сравните ФИГУРУ 8В с 8С). Несмотря на то что крысы, получавшие питание, содержащее инулин, показали тенденцию к снижению вакуолизации по сравнению с крысами, получавшими питание, содержащее целлюлозу, данное различие не было статистически значимым. Наблюдалось значимое различие между группами, получавшими питание, содержащее VFC, по сравнению с питанием, содержащим целлюлозу и инулин (p<0,001, как указано символом "***"). Значимые различия между группами, получавшими питание, содержащее инулин и целлюлозу, не наблюдались. Кистозная дегенерация гепатоцитов и фиброз также показали тенденцию к показателям меньшей степени тяжести у крыс, получающих питание, содержащее VFC, но она не достигла статистической значимости (данные не показаны).
Как показано ниже в ТАБЛИЦЕ 2, некоторые индикаторы клинической химии касательно гепатического повреждения показали значительные лечебные эффекты при помощи VFC. Ферменты печени аланинаминотрансфераза (ALT) и аспартатаминотрансфераза (AST) выделяются в кровь посредством гепатоцеллюлярного повреждения даже с интактными мембранами клеток. Крысы Спрага-Доули без явного заболевания печени имеют уровни ALT от 22 до 48 МЕ/Л (справочные данные IDEXX). Данные, показанные в ТАБЛИЦЕ 2, показали общие лечебные эффекты касательно уровней ALT и AST. Апостериорное исследование показало более низкие уровни ALT в крови у крыс, получающих питание, содержащее VFC, по сравнению с крысами, получающими питание, содержащее целлюлозу или инулин (p<0,05), и значительно более высокие уровни ALT в крови у крыс, получающих питание, содержащее инулин, по сравнению с крысами, получающими питание, содержащее целлюлозу (p<0,05).
AST в крови показала похожий характер результатов, как дополнительно показано в ТАБЛИЦЕ 2. Крысы Спрага-Доули без явного заболевания печени имеют уровни AST от 33 до 53 МЕ/Л (справочные данные IDEXX). Крысы, получающее питание, содержащее VFC, составили в среднем примерно 170 МЕ/Л, крысы, получающие питание, содержащее целлюлозу, составили в среднем примерно 870 МЕ/Л, тогда как крысы, получающие питание, содержащее инулин, составили в среднем 1010 МЕ/Л. Общий лечебный эффект был статистически значимым (p<0,0001), несмотря на то, что различие между группами, получавшими питание, содержащее инулин и целлюлозу, было незначимым, различие между группами, получавшими питание, содержащее VFC и целлюлозу, было значимым (p<0,001, МСТ Дуннета).
У крыс, получавших питание, содержащее VFC, были более низкие сывороточные уровни щелочной фосфатазы, чем у крыс, получавших питание, содержащее целлюлозу или инулин, как показано в ТАБЛИЦЕ 2. Нормальный диапазон касательно данного параметра у крыс Спрага-Доули при отсутствии известного заболевания печени или болезни костей составляет 0-267 МЕ/Л (справочные данные IDEXX). Как показано в ТАБЛИЦЕ 2, средние сывороточные уровни щелочной фосфатазы касательно крыс, получавших питание, содержащее VFC, находились в пределах данного нормального диапазона, тогда как средние показатели касательно крыс, получавших питание, содержащее целлюлозу или инулин, выходили за пределы нормального диапазона. Снижение щелочной фосфатазы между группами, получавшими питание, содержащее VFC, по сравнению с питанием, содержащим целлюлозу или инулин, было значимым (p<0,001). Более низкие сывороточные уровни щелочной фосфатазы при использовании VFC оказывают защитное воздействие на холестаз, тогда как увеличение ALT и AST указывает на гепатоцеллюлярное повреждение (D.S.Pratt etal., Harrison's Principles of Internal Medicine 15 th Edition, pp.1711-1715 (2001). Наоборот, глобулин и билирубин очищаются печенью, а повышения отражают нарушение функции печени.
Нормальный диапазон глобулина для крыс Спрага-Доули составляет 2,8-4,5 г/дл (справочные данные IDEXX). Как показано в ТАБЛИЦЕ 2, концентрации глобулина в среднем составляют 3,4 г/дл для крыс, получающих питание, содержащее VFC, и 4,0 и 3,9 г/дл для крыс, получающих питание, содержащее целлюлозу и инулин, соответственно. Эффект типа волокна был значимым (p<0,001) со значимым различием между группами, получавшими пищу, содержавшую VFC и целлюлозу (p<0,001, МСТ Дуннета), но не между группами, получавшими питание, содержащее инулин и целлюлозу. Аналогичным образом у крыс, получавших питание, содержащее VFC, общий билирубин (прямой и непрямой) в среднем составил 0,13 мг/дл, как показано в ТАБЛИЦЕ 2, тогда как у крыс, получавших питание, содержащее целлюлозу и инулин, в среднем составил 0,19 и 0,18 мг/дл, соответственно. Диапазон нормальных значений для крыс Спрага-Доули составляет 0-0,4 мг/дл (справочные данные IDEXX). Лечебные эффекты были статистически значимыми (1W ANOVA, F(2,28)=4,93, p<0,05) со значимым различием между группами, получавшими питание, содержащее VFC (p<0,05, МСТ Дуннета), но не между группами, получавшими питание, содержащее инулин и целлюлозу. Несмотря на то, что уровни глобулина и билирубина находились в пределах нормальных границ для всех групп, крысы, получавшие питание, содержащее VFC, показали значительно более низкие концентрации (p<0,001) двух аналитов по сравнению с другими группами, предполагая улучшенную функцию печени.
Нормальный диапазон значений для билирубина для крыс Спрага-Доули составляет 0-0,4 мг/дл (справочные данные IDEXX). Значимые различия в билирубине между лечебными группами не наблюдались. Альбумин, который синтезируется печенью, был похожим во всех лечебных группах.
Обсуждение результатов:
Данное исследование на модели диабетических крыс Цукера демонстрирует, что питание, содержащее VFC, значительно улучшает гликемический контроль, снижает повреждение почек, сохраняет панкреатические бета-клетки, улучшает чувствительность к инсулину и, следовательно, снижает общую нагрузку глюкозы у человека. Более того, снижение скорости прибавления массы тела примерно на 10% в ходе исследования наблюдалось у крыс, получавших питание, содержащее VFC, по сравнению с другим питанием, обогащенным волокнами. Это частично может обусловить снижением употребления пищи в ходе исследования, хотя сниженное употребление пищи было значимым только в течение первых трех недель исследования. Как дополнительно показано в примере 4, VFC также увеличивает секрецию GLP-1 и PYY, индуцирующего насыщение.
Количество гранул VFC, использованное в данном исследовании, составило 5% VFC, добавляемого в крысиную пищу. Как показано на ФИГУРАХ 1А и 1 В, употребление пищи в день касательно крыс, получавших VFC, в среднем составило примерно 22 г/день, следовательно, в 22 граммах 1,1 г VFC. Предположим, что средний вес крыс Цукера составляет примерно 300 г (смотрите ФИГУРУ 1А), доза в данном исследовании на кг составила примерно 3,66 г/д/кг. Предположим, что вес человека составляет примерно 60 кг, тогда данная доза будет эквивалентной примерно 219,6 г/день для человека. При использовании конверсии доз на основании площади поверхности тела в объем, составляющий от 0,1 до 0,15 крысиной дозы в дозу для человека, как описано Reagan-Shaw etal., FASEB Journal 22:659-661 (2007), можно перевести в диапазон доз для человека весом 60 кг, составляющий примерно от 22 граммов примерно до 33 граммов VFC в день или примерно от 366 мг/кг/день примерно до 550 мг/кг/день.
В данном исследовании у диабетических крыс Цукера в состоянии натощак (то есть животных исследовали утром примерно через 16 часов без доступа к пище) отсутствовали в значительной степени повышенные уровни глюкозы, вероятно, вследствие соответствующей компенсации, обеспечиваемой гиперинсулинемией, наблюдаемой как заболевание, только начинающее проявляться. У животных, находившихся без пищи в течение 16 часов, до исследования во всех диетических группах уровни инсулина были более высокими в группах, получавших целлюлозу и инулин, по сравнению с группой, получавшей VFC, что в сочетании с показателями НОМА и CISI свидетельствует о большей периферической резистентности к инсулину в группах, получавших инулин и целлюлозу по сравнению с животными, получавшими VFC. Следовательно, получается, что VFC необязательно должен присутствовать в кишечнике с целью улучшения чувствительности к инсулину. Не привязываясь к какой-либо определенной теории, улучшенная чувствительность к инсулину, наблюдаемая у животных, получавших VFC, которые находились без пищи в течение 16 часов до исследования, может обуславливаться увеличенной проглюкагоновой экспрессией (S.P.Massimino etal., J.Nutr. 128: 1786-1793 (1998); R.A.Reimer etal., Endocrinology 137:3948-3956 (1996)); или может обуславливаться повышающей регуляцией мышцы GLUT-4 (Y.J.Song et al., Clin. Exp.Pharm. Physiol. 27:41-45 (2000)).
Поскольку животные, находившиеся без пищи в течение 16 часов до исследования, были незначительно гипергликемическими, начиная через три недели исследования, уровень глюкозы в плазме также был измерен у крыс в состоянии не натощак (то есть постоянный доступ к пище до исследования). Было определено, что у животных, исследованных в состоянии не натощак, животные в группах, получавших целлюлозу и инулин, были гипергликемическими, тогда как у животных в группе, получавшей VFC, были уровни глюкозы, которые были снижены практически до недиабетических уровней. Уровни инсулина в состоянии не натощак были измерены только в конце исследования, и было установлено, что инсулин был значительно снижен у животных, получавших VFC, а показатели НОМА и CISI также показали улучшенную чувствительность к инсулину у животных, получавших VFC, по сравнению с другими группами.
Следовательно, принимая во внимание результаты того, что сывороточный инсулин был значительно снижен у животных, получавших VFC, в состоянии натощак и не натощак, и глюкоза в крови была значительно снижена у животных, получавших VFC, исследуемых в состоянии не натощак, следует, что лечение VFC диабетических крыс Цукера было эффективным для задержки раннего прогрессирования диабета.
Помимо улучшений гликемического контроля было определено, что у животных, получавших VFC, также было снижено повреждение органов по сравнению с животными, получавшими целлюлозу и инулин. Диабетическая нефропатия представляет собой клинически важное осложнение диабета, особенно утолщение клубочковой базальной мембраны и расширение мезангий и канальцев, и тубулярная дегенерация, возникающие вследствие метаболических расстройств и гемодинамических изменений (H.R.Brady and В.М.Brenner: Pathogenesis of Glomerular Injury, in Harrison's Principles of Internal Medicine 15 th ed., E.Braunwald etal., pp.1572-1580 (2001)). Интересно отметить, что в данном исследовании было определено, что значительное повреждение органов возникает очень быстро у молодых диабетических крыс Цукера с ранним возникновением диабета, несмотря на относительно легкую степень диабета. Важно отметить, что у животных, получавших VFC, наблюдалось наличие значительно большей плотности панкреатических β-клеток в конце 8-недельного исследования по сравнению с группами, получавшими инулин или целлюлозу. Эти данные указывают на то, что диабетические крысы Цукера, получавшие питание, содержащее VFC, в течение восьми недель сохранили значительно большую резервную мощность для секреции инсулина. Следует отметить, что наблюдалось сохранение панкреатических β-клеток касательно ингибиторов DPP IV, которые увеличивают уровни стимулятора секреции инсулина GLP-1, и в некоторых исследованиях при использовании ингибиторов DPP IV инсулин является более высоким, чем контроль в моделях диабета II типа, особенно постпрандиальные уровни инсулина (A.Viljanen etal., J. Clin. Endocrinol. Metab. 94:50-55 (2009)).
В модели диабетических крыс Цукера, использованной в данном исследовании, уровни глюкозы не натощак оказались достаточными для того, чтобы вызвать повреждение почки. Было определено, что в группе, получавшей VFC, ренальное повреждение было меньше, особенно касательно мезангиального расширения. Усиленный гликемический контроль во время нормального кормления и последующее снижение гликирования тканей, вероятно, послужили в качестве основного фактора в снижении ренального повреждения. Интересно отметить, что гистология показала, что VFC значительно защитил почки от повреждения гликированием, указывая на снижение общей нагрузки глюкозы и, следовательно, сниженное гликирование. FDA рассматривает сниженное гликирование как первичный маркер касательно анти-диабетических эффектов, а простое снижение глюкозы в крови больше не считается достаточным для одобрения лекарственных препаратов.
Касательно воздействия лечения VFC на сывороточный и гепатический липидный профили, холестерин плазмы был значительно снижен в группе, получавшей VFC. Воздействие на сывороточные уровни триглицеридов было более изменчивым. Тем не менее, гепатические липидные уровни (стеатоз) и гепатические измерения, например, сывороточный билирубин, ALT и AST, были значительно снижены в группе, получавшей VFC, что указывало на сниженное повреждение печени в группе, получавшей VFC. Более того, на основании гистологического анализа также было определено, что у животных, получавших VFC, были сниженные показатели гепатоцеллюлярного повреждения и сниженные сывороточные уровни щелочной фосфатазы, что может указывать на то, что у животных, получавших VFC, были сниженные холестазы, а также снижение стеатогепатоза, распространенного сопутствующего симптома метаболического синдрома (A.Viljanen et al., J.Clin. Endocrinol. Metab. 94:50-55 (2009)).
Следовательно, эффективность использования VFC демонстрируется у ZDF в отношении гликемического контроля, снижения повреждения почки и сохранения панкреатических бета-клеток. Как продемонстрировано в данном примере у крыс, получавших VFC, ренальное повреждение было меньше, особенно мезангиальное расширение. Усиленный гликемический контроль и последующее снижение гликирования тканей, вероятно, послужили в качестве основного фактора в снижении ренального повреждения. Следовательно, VFC можно использовать в качестве пищевой добавки для оказания помощи в уменьшении интенсивности развития и прогрессирования ранней стадии метаболического синдрома, включая способность замедлять прогрессирование повреждения органов, индуцированного глюкозой, накопление липидов в печени и ингибирование потери панкреатических бета-клеток.
ПРИМЕР 2
Данный пример описывает исследование, проведенное на крысиной модели с ожирением, индуцированным питанием с высоким содержанием сахарозы с целью определения воздействия композиции пищевого волокна, содержащей гранулированную смесь вязкого волокна (гранулы VFC) (также называемую комплексом волокна PolyGlycopleX (PGX®)) на панкреатическую дисрегуляцию, дислипидемию и ожирение.
Обоснование: Как описано в примере 1 новый, водорастворимый комплекс волокна, гранулы VFC, также называемые PolyGlycopleX® (PGX®) (изготавливаемые из коньяка маннана, ксантановой камеди и альгината для создания высоковязкого полисахаридного комплекса с высокими водоудерживающими и гелеобразующими свойствами), снижает массу тела и увеличивает чувствительность к инсулину у диабетических крыс Цукера. Однако воздействие гранул VFC, наблюдаемое на диабетических крысах Цукера касательно сывороточных триглицеролов (TAG), было изменчивым. Изменчивость разных волокон для снижения сывороточных уровней TAG наблюдалась в других исследованиях и может устанавливать связь между типом волокна и определенной животной моделью (W.U.Jie etal., Biomed. Environ. Sci. 10: 27-37 (1997); A.Sandberg etal., Am. J.Clin. Nutr. 60:751-756 (1994); R.Wood etal., Metab. Clin. Exp. 56:58-67 (2007); and N.M.Delzenne etal., J. Nutr. 129: 14673-14708 (1999)). Например, исследование, проведенное Мао-Ю и др., показало, что снижение TAG посредством неперевариваемых волокон зависит от тяжести увеличения TAG и устойчивости с течением времени (Z.Mao-Yu et al., Biomed. Environ. Sci. 3:99-105 (1990)).
Исследование, описываемое в данном примере, было проведено с целью определения воздействий гранулированного VFC (PGX®) на увеличение массы тела, сывороточные триглицеролы (TAG) и стеатоз печени у самцов крыс Спрага-Доули, получавших сахарозу, модель ожирения, индуцированного питанием (высокое содержание сахарозы 65% в/в), известная тем, что приводит к увеличению веса и устойчивым увеличениям печени и сывороточных уровней TAG, особенно в хроническом состоянии, что с большой точностью имитирует диабет II типа у человека (A.M.Gadja et al., An. Lab News У 3: 1-7 (2007); M. Hafidi et al., Clin. Exp.Hyperten. 28:669-681 (2006); и Р. Rozan etal., Br. J.Nutr. 98: 1-8 (2008)). Исследование, описываемое в данном примере, проводилось в течение 43 недель для того, чтобы захватить достаточную часть жизненного цикла крыс и максимизировать устойчивые увеличения сывороточных уровней TAG, которые являются характерной особенностью данной модели.
Способы
Пища для крыс с повышенным содержанием волокон:
Гранулы комплекса вязкого волокна (VFC) (коньяк/ксантан/альгинат (70:13:17) (то есть смесь волокна была обработана посредством гранулирования с целью создания комплекса, продаваемого под названием PGX®) были включены в основную пищу крыс (D11725: Research Diets, Нью-Брансуик, Нью-Джерси). Альтернативное питание, использованное в данном исследовании, включало другие виды волокон, как показано ниже в ТАБЛИЦЕ 3. Целлюлоза была выбрана в качестве основного эталонного волокна, которое является нерастворимым и не поддается сбраживанию и считается инертным эталонным соединением (J.W.Anderson et al., J.Nutr. 124: 78-83 (1994)).
Животная модель: Самец крысы Спрага-Доули (SD) был выбран потому, что крыса, получающая сахарозу, считается превосходной моделью гипертриглицеридемии при наличии нормального генетического фона (A.M.Gadja etal., An Lab News 13: 1-7 (2007)).
Дизайн исследования: 30 самцов крыс SD получены от Чарльз Ривер (Charles River) (Кингстон, Нью-Йорк) в возрасте шести недель. Животных поместили отдельно в подвешенные сетчатые клетки из проволоки, которые соответствовали размеру, рекомендованному в последнем Guide for the Care and Use of the Laboratory Animals, DHEW (NIH). В комнате, где содержались животные, регулировалась температура и влажность, был обеспечен 12-часовой цикл дня и ночи, поддерживалась чистота и отсутствовали вредители. Животные проходили акклиматизацию в течение четырех дней до проведения исследования.
Вода: Отфильтрованная вода из-под крана обеспечивалась ad libitum автоматической водораспределительной системой.
Пища: После адаптации крыс в случайном порядке определили в одну из двух групп с численностью в каждой группе п=10, в питание двух групп добавляли целлюлозу в объеме 5% (в/в) или 5% VFB (в/в) с 65% (в/в) сахарозы. Питание являлось почти изоэнергетическим, питание с содержанием целлюлозы составляет 3,90 ккал/г и питание с содержанием VFC составляет 3,98 ккал/г, общее содержание пищевых калорий составляет примерно 3902. Крысы получали питание с высоким содержанием сахарозы ad libitum с целлюлозой (начальная масса тела составлял 214,7±2,6 г) или VFB (начальный вес составлял 220,8±3,5 г) в течение 43 недель.
Измерения исследования: Употребление пищи (ежедневно), масса тела (еженедельно) и еженедельный забор образцов крови для измерения сывороточных триацилглицеринов (TAG) (анализируемые посредством IDEXX, Норт Графтон, Миннесота), глюкозы в крови (посредством глюкометра Acensia Elite Glucometer) и сывороточного инсулина (Ani Lytics, Гейтерсберг, Мэриленд) проводились в течение исследования. Исследование завершилось окончательным анализом крови с целью измерения гликирования гемоглобина и азота мочевины крови. Затем было проведено ограниченное вскрытие, как указано ниже. Одну долю печени подвергли мгновенной заморозке для анализа содержания липидов при использовании гистохимии Судана черного. Затем одну долю печени зафиксировали для окрашивания гематоксилином и эозином.
Статистические способы: Увеличение массы тела было проанализировано касательно статистически значимых различий при использовании повторных измерений ANOVA и одностороннего ANOVA касательно различий в увеличении веса в ходе исследования. Коэффициенты ошибок альфа касательно множественных сравнений контролировались при использовании поправки Бонферрони. Показатели гистологии были измерены при использовании критерия Крускала-Уолиса касательно непараметрических данных.
Результаты:
ФИГУРА 9 графически изображает воздействие гранулированного VFC (PGX®) или питания, содержащего целлюлозу, на увеличение массы тела и сывороточные триацилглицеролы (TAG) у крыс Спрага-Доули, получавших сахарозу, в ходе 43-недельного исследования (символ "*" указывает на то, что p<0,05; символ "**" указывает на то, что p<0,01; символ "***" указывает на то, что p<0,001). Первоначальные массы тел не отличались между группой, получавшей VFC (215±3 грамма), и группой, получавшей целлюлозу (221±3 г). Как показано на ФИГУРЕ 9, масса тела увеличилась с течением времени в двух группах вследствие питания, обогащенного сахарозой, однако увеличение веса было значительно ослаблено в группе, получавшей VFC, с момента начала исследования до 22 недели по сравнению с группой, получавшей целлюлозу (p<0,05). Повторные измерения показали значительное лечебное воздействие на увеличение веса (р=0,04) крыс, получавших VFC, показывающих сниженное увеличение веса. Несмотря на то, что окончательная масса тела не отличалась значительно между группами (р=0,20; 660±26 г касательно групп, получавших VFC и целлюлозу, соответственно), крысы VFC сохранили на 7% более низкую массу тела по завершению исследования. Употребление пищи касательно крыс, получавших VFC, было похожим на крыс, получавших целлюлозу (данные не показаны).
Как дополнительно показано на ФИГУРЕ 9, сывороточные уровни TAG были устойчивыми на ранней стадии исследования, но повышались с течением времени в группе, получавшей целлюлозу, до завершения исследования через 43 недели. Для сравнения крысы, получавшие VFC, показали значительно более низкие сывороточные уровни TAG по сравнению с группой, получавшей целлюлозу (p<0,01). Группа, получавшая VFC, имела исходные уровни TAG, которые незначительно отличались от исходных уровней TAG в группе, получавшей целлюлозу.
Крысы, получавшие диетическое питание, содержащее VFC, показали меньшую степень стеатоза печени (измеренного посредством окрашивания Суданом черным), чем крысы, получавшие питание, содержащее целлюлозу. Содержание липидов было определено посредством окрашивания срезов ткани печени при помощи Судана черного, срезы были оценены и классифицированы полуколичественно на наличие вакуолей положительных к Судану черному согласно показателю шкале от 0 до 5, где 5 является самым тяжелым показателем. Показатели степени тяжести составляли 3,9±0,3 для группы, получавшей целлюлозу, и 2,7±0,4 для группы, получавшей VFC, что значительно отличалось. Также наблюдалась устойчивая тенденция к снижению гепатоцеллюлярного повреждения у крыс, получавших VFC, по сравнению с крысами, получавшими целлюлозу, несмотря на то, что различие не было статистически значимым ([p<0,07 для макровезикулярной вакуолизации и p<0,11 для микровезикулярной вакуолизации, данные не показаны).
Уровни глюкозы в крови и инсулина наблюдались еженедельно в ходе всего исследования и не изменялись, что предполагается для данной животной модели (A.M. Gadja et al., An. Lab News 13:1-7 (2007)).
Обсуждение:
Как и предполагалось в данной модели ожирения, индуцированного питанием, крысы Спрага-Доули (SD), получавшие сахарозу, с течением времени быстро увеличили вес примерно к 18-25 недели, в это время стабилизировалась более медленная скорость увеличения веса. Как показано на ФИГУРЕ 9, во время периода быстрого увеличения веса, гранулы VFC значительно снизили изменения массы тела по сравнению с целлюлозой с более маленькими снижениями, наблюдаемыми во время фазы более медленного роста на последней стадии исследования (то есть более старые крысы). Как дополнительно показано на ФИГУРЕ 9 TAG плазмы превысили лишь исходный уровень у более старых крыс и VFC значительно притупил данное увеличение TAG. В соответствии с этими данными стеатоз печени был значительно снижен у животных, получавших VFC, как измерено посредством гистоморфометрии по сравнению с животными, получавшими целлюлозу.
Считается, что снижение веса у субъектов, употребляющих неперевариваемые волокна, связано с одним или несколькими нижеследующими условиями: сниженное употребление пищи, реакция измененного гормона, отвечающего за чувство насыщения, сниженное поглощение питательных веществ, являющееся осложнением замедления работы желудка и/или поглощения питательных веществ волокном (смотрите N.C.Howarth etal., Nutr. Rev. 59:163-169 (2001); A. Sandberg etal. Am. J.Clin. Nutr. 60:751-756 (1994); G.Grunberger et at., Diabet. Metab. Res. Rev. 23:56-62 (2006); and J.R.Paxman et al., Nutr. Res. 51: 501-505 (2008)). Интересно отметить, что в настоящем исследовании наблюдалось незначительное снижение употребления пищи, следовательно, данный фактор, вероятно, не способствовал наблюдаемому снижению веса у животных, получавших VFC. Не привязываясь к какой-либо определенной теории, возможно более медленное опорожнение желудка и сниженное поглощение питательных веществ, съеденной пищи, могут отвечать за снижение веса, что может обуславливаться увеличенной секрецией глюкагоноподобного белка (GLP-1) (N.N.Kok et al., J.Nutr. 128: 1099-1103(1998)).
Снижение TAG в печени или плазме стало предметом многих исследований касательно пищевых волокон, а результаты широко разнятся (W.U.Jie et al., Biomed. Environ Sci. 10:27-37 (1997); A. Sandberg et al., Am. J.Clin. Nutr. 60: 751-756 (1994); R.Wood et al., Metab. Clin. Exp. 56: 58-67 (2007); и N.M.Delzenne etal., J.Nutr. 129: 14678-14708 (1999); P.Rozan etal., Br. J.Nutr. 98: 1-8 (2008)). He все исследования показывают заметное снижение поглощения TAG с некоторыми различиями, наблюдаемыми между типами волокон. Например, исследование, проведенное Делзенне и Коком, показало, что олигофруктоза снизила стеатоз печени посредством снижения липогенеза у крыс, получавших фруктозу (N.M.Delzenne etal., J.Nutr. 129: 14678-14708 (1999)). Подобным образом, Кок и другие предполагают, что секреция GLP-1, индуцированная олигофруктозным волокном, также может отвечать за сниженный липогенез и мобилизацию жира (N.N.Kok etal., J. Nutr. 128: 1099-1103 (1998)). Не привязываясь к какой-либо определенной теории, вероятно, что сниженный липогенез и сниженное поглощение жира сыграли роль в снижениях TAG, наблюдаемых у животных, получавших VFC, в данном исследовании. Сниженное поглощение питательных веществ объясняет снижение увеличения веса, наблюдаемое при отсутствии снижения употребления пищи.
В заключение данное исследование демонстрирует, что гранулы VFC значительно понижают сывороточный TAG в крысиной модели Спрага-Доули (8D), получавшей сахарозу, который существующие лекарственные препараты не очень эффективно понижают. Сниженный стеатоз печени сравнивается со сниженными сывороточными TAG, и такие свойства делают гранулы VFC полезной пищевой добавкой для лечения пациентов с гиперлипидемией, а также другими аспектами метаболического синдрома, включая потерю веса.
ПРИМЕР 3
Данный пример описывает исследование касательно избыточности веса и ожирения у взрослых людей, демонстрируя воздействие композиции пищевого волокна, содержащей гранулированный комплекс вязкого волокна (гранулы VFC) (также называемый комплексом волокна PolyGlycoplex (PGX®)) на кратковременную потерю веса и связанные факторы риска.
Обоснование: В соответствии с последними данными, опубликованными Всемирной организацией здравоохранения, ожирение достигло глобальных масштабов эпидемии, где более 1 миллиарда взрослых человек с избыточным весом страдают от хронического расстройства (www.who.int, оценено 3/15/08). Ишемическая болезнь сердца и инсульт, резистентность к инсулину, (метаболический сидром), диабет II типа, гипертензия и рак представляют собой широко известные медицинские сопутствующие заболевания избыточной массы тела (K.Fukioka Obesity Res 10 (Supp 12): 116S-123S (2002)). Более того, последнее эпидемиологическое исследование подтвердило, что ожирение у взрослых людей связывается со значительным сокращением продолжительности жизни. Данное исследование показало, что некурящие 40-летние мужчина и женщина в среднем теряют 7,1 и 5,8 лет жизни, соответственно, вследствие ожирения (A.Peeters etal., Ann. Intern. Med. 138:24-32 (2003)). С учетом вышеприведенных факторов риска, существует множество терапевтических воздействий касательно избыточности веса/ожирения, которые включают в себя оперативное вмешательство, лечение лекарственными препаратами и изменение образа жизни, например питания и упражнения.
Важная диетическая стратегия любой программы контроля веса должна включать в себя употребление значительного количества продуктов питания с высоким содержанием волокон, особенно продуктов питания или пищевых добавок, содержащих вязкое растворимое волокно (K.M.Queenan et al., Nutr. J. (2007)). Подсчитано, что средний американец употребляет примерно 2,4 грамма вязкого растворимого волокна в день - половину от 5 до 10 граммов пищевого вязкого растворимого волокна, рекомендованного для ежедневного употребления (Т.А.Shamliyan et al., J.Family Practice 55: 761-69(2006)).
Из-за трудности получения идеальных количеств растворимого волокна через одно питание существует явная потребность в концентрациях растворимого волокна, которые можно использовать в качестве компонентов пищевого продукта или употреблять в качестве добавок для обеспечения стабильно высокого употребления растворимого волокна. Гранулированный VFC, также называемый PGX® (PolyGlycopleX®), представляет собой новый высоковязкий полисахаридный комплекс, который изготавливается посредством реагирования глюкоманнана, ксантановой камеди и альгината при использовании процесса, называемого EnviroSimplex®. Полученный полисахаридный комплекс (α-D-глюкуроно-α-D-манно-β-D-манно-β-D-глюкан), (α-L-гулуроно-β-D-маннуронан), β-D-глюко-β~-D-маннан,. α-D-глюкуроно-α-D-манно-β-D-манно-β-D-глюко), (α-L-гулуроно-β-D-маннуроно), β-D-глюко-β~-D-маннан представляет собой новую единицу, как продемонстрировано в структурном анализе, описанном в примерах 5 и 6, и обладает наивысшей вязкостью и водоудерживающей способностью любого известного в настоящее время волокна.
Данный пример описывает исследование, проведенное с целью изучения эффективности гранул VFC и незначительного изменения образа жизни на потерю веса, индекс массы тела (ВМ1), а также кардиометаболические факторы риска, включающие в себя холестерин, холестерин липопротеинов низкой плотности (LDL), липопротеин высокой плотности (HDL), триглицериды, инсулин натощак, глюкозу натощак и 2-часовой тест на толерантность к глюкозе в ходе 14-недельного промежутка времени у взрослых людей, страдающих избыточным весом или ожирением. Способы:
Участники: Всего 29 взрослых людей, ведущих сидячий образ жизни (23 женщины; 6 мужчин), в возрасте от 20 до 65 лет, с диапазоном индекса массы тела (BMI), составляющим примерно от 25 кг/м2 до 36 кг/м2, были приглашены для участия посредством размещения ряда объявлений в местных газетах. Субъекты предоставили письменное согласие до участия в данной программе. Анализ наблюдений был проведен в соответствии с нравственными нормами, изложенными в Хельсинкской декларации от 1975 года.
Антропометрические и другие измерения: У участников измеряли два раза в неделю рост (см), вес (килограммы) и объем талии и бедер (см) при использовании стандартной медицинской мерительной ленты. Объем талии и бедер проводился в соответствующих анатомических локализациях примерно 2,2 см выше пупка и вокруг бедер в большом вертеле у субъектов, носящих одноразовый бумажный халат. Процент содержания жира определялся при использовании биоэлектрического импедансного анализа (RJL Systems, Мичиган, США) на исходном уровне (до начала исследования) и каждые две недели после начала исследования. Компьютеризированный анализ импедансных данных был задействован с целью определения индекса массы тела (BMI) и процента содержания жира.
Питание и добавки: Каждый волонтер получил общие указания от врача касательно здорового питания, потери веса и упражнений. Более того, консультации касательно питания и упражнений проводились для группы каждые две недели в течение 14 недель. Особое внимание в данных лекциях уделялось не подсчету калорий, а в первую очередь концентрировалось на контроле за размером порций и каким образом поддерживать диету с низким содержанием жиров, низким гликемическим индексом. Общие рекомендации также были включены в данную программу, концентрируя внимание на разнообразии, типе и времени упражнений (например, силовые упражнения и кардиоваскулярная аэробная тренировка), которые усиливают общее снижение веса. Более того, субъектам предоставили гранулированный комплекс вязкого волокна (VFC) (гранулы коньяка/ксантана/альгината (70:13:17), также называемые комплексом волокна PolyGlycopleX (PGX®)), который можно добавлять в питье или продукты (например, нежирный йогурт).
Пять граммов гранул VFC необходимо было употреблять, запивая 500 мл воды за 5-10 минут до каждого приема пищи, от двух до трех раз в день в течение 14 недель, для ежедневного общего потребления от 10 до 15 граммов гранулированного VFC/день.
Забор крови и лабораторный биохимический анализ: Все лабораторные измерения проводились независимой лабораторией в Британской Колумбии, Канада. На исходном уровне (до начала исследования) субъектов попросили воздержаться от пищи в течение десяти часов до процедуры забора крови, которая включала в себя нижеследующие тесты: общий холестерин, триглицериды, HDL, LDL, глюкоза, инсулин и 2-часовой инсулин. Оральный тест на толерантность к глюкозе в объеме 75 граммов также был проведен в соответствии с критериями и процедурами, определенными лабораторией. Только люди с аберрантными факторами риска прошли повторное исследование при использовании вышеприведенных лабораторных параметров через 14 недель.
Статистический анализ: Компьютеризированный статистический анализ был проведен при использовании парного t-критерия с целью оценки нескольких типов переменных, включающих в себя рост, вес, BMI, % содержания жиров и разные лабораторные значения до и после лечения. Значимые результаты были получены от тех переменных, которые дали значение p<0,05.
Результаты:
Потеря веса и другие антропометрические параметры: В ходе 14 недель использования VFC наблюдались значительные снижения веса в группе (-5,79±3,55 кг), объема талии (-12,07±5,56 см), % содержания жиров (-2,43±2,39%) и BMI (-2,26±1,24 кг/м2). Полные результаты показаны ниже в ТАБЛИЦАХ 4 и 5.
Подобным образом оба пола индивидуально продемонстрировали значительные снижения в исследуемых переменных потери веса, как показано ниже в ТАБЛИЦЕ 6 и ТАБЛИЦЕ 7. Как показано ниже в ТАБЛИЦЕ 7, мужчины в среднем потеряли 8,30±2,79 кг в течение 14-недельного исследования (средняя потеря веса составляет 7,43%). Как показано в ТАБЛИЦЕ 6, женщины в среднем потеряли 5,14±3,49 кг в течение 14-недельного исследования (средняя потеря веса составляет 6%).
Уровни липидов: По сравнению с исходными значениями, полученными до начала исследования через 14 недель применения VFC у субъектов наблюдалось среднее понижение общих значений холестерина, составляющее 19,26% (n=17; p<0,05 с 0 недели), и среднее понижение значений холестерина липопротеинов низкой плотности, составляющее 25,51% (n=16; p<0,05 с 0 недели). Как показано в ТАБЛИЦЕ 8, также наблюдалась тенденция к снижению триглицерида и увеличению значений холестерина липопротеинов высокой плотности в данном исследовании, однако наблюдаемые различия не были статистически значимыми.
Инсулин и глюкоза натощак: Через 14 недель применения VFC у субъектов в данном исследовании произошло среднее снижение глюкозы натощак, составляющее 6,96% (n=20; p<0,05 с 0 недели), среднее отклонение 2-часовой толерантности к глюкозе, составляющее 12,05% (n=21; p<0,05 с 0 недели), и среднее снижение уровней инсулина натощак, составляющее 27,26% (n=17; p<0,05 с 0 недели), по сравнению с исходными измерениями, сделанными до начала исследования.
Анализ эффективности при использовании опросника, подлежащего самозаполнению: В опроснике, подлежащем самозаполнению, заполненный участниками в конце исследования, 97,7% пользователей VFC отметили, что у них была положительная реакция на продукт при сдерживании аппетита и голода.
Побочные эффекты испытуемого препарата: Использование VFC в основном хорошо переносилось участниками с второстепенными желудочно-кишечными симптомами (GI), содержащими большинство из всех заявленных жалоб. Шестьдесят восемь процентов отметили, что умеренные GI симптомы (например, газы, вздутие, запор, жидкий стул) прошли в течение примерно трех недель с момента приема VFC. У тридцати двух процентов участников были умеренные побочные эффекты GI в ходе программы, но они не были достаточно тяжелыми, чтобы прекратить применение. Последнее контролируемое исследование на толерантность VFC (PGX®) было проведено во Франции, которое также подтвердило эти последние данные (I.G.Carabin et al., Nutrition J. 8: 9 (2008)).
Обсуждение: Исследование касательно потери веса, контролируемое с медицинской точки зрения, описанное в данном примере, демонстрирует, что использование гранул VFC наряду с общими изменениями в питании и физической деятельности в течение 14-недельного периода времени, принесло пользу в изменении кардиометаболических факторов риска у субъектов с избыточным весом и ожирением. В общем, наблюдалось значительное снижение веса в группе (-5,79±3,55 кг), объемов талии (-12,07±5,56 см) и процента содержания жиров (-2,43±2,39%) от исходного уровня. Более того, данные последние физические изменения сравнивались со значительным понижением уровней LDL натощак (-25,51%), глюкозы натощак (-6,96%) и инсулина натощак (-27,26%) в течение относительно короткого промежутка времени, составляющего 14 недель.
Интересно отметить, что мужчины в среднем потеряли больше веса (-8,30±2,79 кг), чем женщины (-5,14±3,49 кг) в течение 14-недельного периода времени. Данное изменение можно приписать основным половым различиям, наблюдаемым в расходе энергии в состоянии покоя. Др. Роберт Ферраро и другие показали, что суточный расход энергии людей, ведущих сидячий образ жизни, примерно на 5 - 10% является более низким у женщин по сравнению с мужчинами после статистических корректировок касательно возраста, деятельности и композиционного анализа состава тела. (R. Ferraro et al, J. Clin. Invest. 90:780-784 (1992)).
Результаты, полученные посредством VFC в снижении массы тела (-5,79 кг), сравнимы с результатами тех людей, которые принимали орлистат, лекарственный препарат против ожирения (Xenical®, Alii®). Орлистат представляет собой ингибитор липазы, который снижает поглощение жира (J.B.Dixon et al., Aust. Fam. Physician 35:576-79 (2006)). В контролируемом исследовании 391 индивидуум с легкой и умеренной степенью избыточного веса, которые принимали лекарственный препарат орлистат в дозе, составляющей 60 мг, три раза в день в течение 16-недельного промежутка времени, потеряли 3,05 кг по сравнению с 1,90 кг в группе плацебо (J.W.Anderson et al., Ann. Pharmacother. 40:1717-23 (2006).
Использование VFC также привело к снижению других факторов риска, связанных с легкой и средней степенью ожирения. В общем наблюдалось значительное снижение уровней общего холестерина (-19,26%; -1,09 ммоль/л) и уровней холестерина LDL (-25,51%; -0,87 ммоль/л) по сравнению с исходными значениями (p<0,05) через 14 недель лечения VFC. Полученное снижение липидных значений при помощи VFC сравнимо с использованием ранней разработки статиновых препаратов, как ловастатин (Mevacor™). Например, одно исследование отметило, что в течение одного месяца начала лечения ловастатином, общий холестерин и холестерин LDL понизился на 19% и 27%, соответственно, у людей с повышенными уровнями холестерина (W.B.Kannel et al., Am. J.Cardiol. 66: 1B-10B(1990)).
Более того, как описано в примерах 1 и 2, использование VFC не только понижает уровни липидов крови, но также может использоваться с целью уменьшения интенсивности развития и прогрессирования ранней стадии метаболического синдрома. Увеличение висцерального ожирения, сывороточной глюкозы и уровней инсулина наравне с гипертензией и дислипидемией представляют собой группу клинических состояний, которые известны под общим названием метаболический синдром (E.J.Gallagher etal., Endocrinol. Metab. Clin. North Am. 37: 559-79 (2008)). Исследование показало, что люди, у которых есть метаболический синдром, на 50% подвергаются большему риску перенесения основного коронарного явления (D.E.Moller et al., Annu. Rev. Med. 56: 45-62 (2005)). В связи с этим любые снижения веса, инсулина натощак и глюкозы приносят значительную пользу для здоровья тех людей, которые страдают этим недугом.
В данном 14-недельном исследовании использование VFC привело к понижению уровней инсулина натощак с 89,41±44,84 пмоль/л до 65,04±33,21 пмоль/л (p<0,05). Снижение инсулина натощак отражает улучшение чувствительности к инсулину и может частично обуславливаться увеличенной активностью GLP-1 и сниженной постпрандиальной гипергликимией наравне с улучшениями чувствительности к инсулину, которая сопровождает потерю веса (смотрите G.Reaven etal., Recent Prog. Horm. Res. 59:207-23 (2004)).
Эти данные соответствуют результатам, полученным в исследовании диабетических крыс Цукера, описанном в примере 1, и предполагают, что терапевтическое использование VFC вместе с изменением образа жизни приносит практическую пользу людям, страдающим от ожирения и определенных кардиометаболических факторов риска. В отличие от других типов стандартных медицинских вмешательств, доступных для лечения ожирения и повышенных уровней холестерина, использование VFC связывается с минимальными побочными эффектами. Данный преимущественный профиль безопасности наравне с терапевтической эффективностью предполагает, что VFC следует рассматривать, как терапию первой линии для людей с избыточным весом/ожирением, повышенными уровнями холестерина и/или резистентностью к инсулину.
ПРИМЕР 4
Данный пример описывает исследование касательно здоровых взрослых людей с нормальным весом, показывающих увеличенные уровни PYY в плазме и увеличенные короткоцепочечные жирные кислоты (SCFA) в фекальной массе после добавления комплекса вязкого волокна (VFC) по сравнению с контрольными субъектами, получавшими сухое обезжиренное молоко.
Обоснование:
Многочисленные пищевые волокна, как было показано, имеют многочисленные преимущества для здоровья, включая усиление секреции гормонов желудочно-кишечного тракта, отвечающих за чувство насыщения, и улучшение функции кишечника (R.A.Reimer et al. Endocrinology 137: 3948-3956 (1996); Reimer and Russell, Obesity 16: 40-46 (2008); P.D.Cani etal., Br. J. Nutr. 92:521-526 (2004); T.C.Adam and R.S.Westererp-Plantenga, Br. J.Nutr. 93:845-851 (2005)). Глюкагоноподобный пептид-1 (GLP-1) и пептид YY (PYY) представляют собой анорексигенные пептиды, участвующие в снижении употребления пищи, тогда как грелин, единственный известный орексигенный пептид, связывается с чувством голода (Wren and Bloom, Gastroenterology 132: 2116-2130 (2007)).
Несмотря на то, что механизмы, регулирующие данную пользу пищевых волокон, полностью непонятны, считается, что производство короткоцепочечных жирных кислот (SCFA) опосредует некоторые воздействия. SCFA и главным образом ацетат, бутират и пропионат вырабатываются в толстой кишке посредством анаэробной ферментации сбраживаемых пищевых волокон, и связаны со стимуляцией гормонов, отвечающих за чувство насыщения, и модуляцией сывороточного холестерина.
Цель данного исследования заключалась в изучении уровней гормонов желудочно-кишечного тракта, отвечающих за чувство насыщения, GLP-1, PYY и грелин, а также концентрации SCFA в фекальной массе у здоровых субъектов после употребления VFC (PGX®) или контроля (сухое обезжиренное молоко) в течение 21 дня.
Способы:
Субъекты: Участники представляли собой здоровых, некурящих мужчин и женщин в возрасте от 18 до 55 лет с BMI между 18,5 и 28,4 кг/м2 (то есть нормальный вес).
Дизайн исследования: Рандомизированное, двойное слепое плацебоконтролируемое исследование было проведено, как указано ниже:
Участников в случайном порядке определили в две группы:
Группа 1 (n=27) употребляла испытуемый продукт гранулы комплекса вязкого волокна (VFC) (коньяк/ксантан/альгинат (70:13:17)) (то есть смесь волокна была обработана посредством гранулирования с целью создания комплекса, продаваемого под названием PGX®, поставляемого Inovobiologic Inc., Калгари, Канада).
Группа 2 (n=27) употребляла контрольный продукт (сухое обезжиренное молоко, которое было похоже по цвету и текстуре на испытуемый продукт).
Контрольный и испытуемый продукт предварительно были смешаны с 10 г продаваемого готового завтрака, производимого CRID Pharma, Франция, и упакованы с 135 мл имеющегося в продаже йогурта без добавок. Участники смешивали йогурт и предварительно смешанный продукт до проглатывания.
В течение первых семи дней исследования участники потребляли 2,5 г продукта (испытуемого или контрольного) два раза в день, как часть двух основных приемов пищи. В течение последних 14 дней исследования участники употребляли 5 г продукта (испытуемого или контрольного) два раза в день. На период продолжительности исследования участников проинструктировали касательно воздержания от употребления продуктов питания, обогащенных волокнами, и ограничения употребления пищевых волокон примерно до 10 г в день. За исключением предварительно смешанного продукта и йогурта все другие продукты покупались и готовились участниками, как обычное питание.
Оценки: Оценки участников проводили за четыре отдельных визита. Скрининговое обследование (визит 0, визит скринингового обследования, «V0») включало физический осмотр.
Образцы крови: Образец крови натощак брался в 1 визит, 0 день исследования (исходный уровень). Визит 2=семь дней исследования, через одну неделю употребления 5 г продукта. Визит 3=21 день исследования, через две недели употребления 10 г продукта. Во время каждого визита забор крови производился в трубку, обработанную EDTA с добавлением дипротина А (0,034 мг/мл крови; МР Biomedicals, Иллкирх, Франция) и центрифугированием при 3000 оборотов в минуту в течение 12 минут при температуре 4°С. Плазма хранилась при температуре -80°С до проведения анализа.
Сбор стула: Образцы кала были получены от субъектов на исходном уровне (V1, О день), через одну неделю употребления 5 г/д продукта (V2, 8 день ± 1) и через две недели употребления 10 г/д продукта (V3, 22 день ± 2). Субъекты собирали один образец кала в течение 48 часов до каждого запланированного визита. Примерно 5 г образца было отправлено для анализа на сухом льде.
Анализ плазмы крови:
GLP-1: Активный GLP-1 был определен количественно при использовании набора ELISA от LINCO research (Millipore, Ст.Чарльз, Миссури). Согласно производителю чувствительность анализа составляет 152 пМ для объема образца 100 мкл. Коэффициент вариации для внутреннего анализа составляет 8% и коэффициент вариации для серии анализов составляет 13% на 4пМ (Millipore, Ст.Чарльз, Миссури).
PYY и грелин: PYY и грелин были определены количественно при использовании наборов ELISA от Phoenix Pharmaceuticals, Inc. (Бурлингем, Калифорния). Чувствительность анализа касательно PYY составила 0,06 нг/мл и 0,13 нг/мл касательно грелина. Коэффициент вариации для внутреннего анализа составил < 5% для двух анализов и коэффициент вариации для серии анализов составил < 14% и < 9% касательно PYY и грелина, соответственно.
Инсулин: Инсулин был измерен при использовании набора ELISA от Milliport (Ст.Чарльз, Миссури). Чувствительность анализа составляет 2 мкЕд/мл с коэффициентом вариации для внутреннего анализа < 7% и коэффициентом вариации для серии анализов < 11,4%.
Статистический анализ: Результаты представлены как средняя ± стандартная погрешность средней величины (SEM). Уровни пептидов за три визита были проанализированы посредством повторных измерений ANOVA с поправкой Бонферрони [двухфакторный анализ со временем (V1, V2, V3) и питанием в качестве параметров]. Ассоциации между двумя параметрами были вычислены при использовании коэффициентов корреляции Пирсона. Оценка гомеостатической модели касательно резистентности к инсулину была рассчитана при использовании формулы [HOMA-IR=инсулин натощак (мкЕд/мл) Х глюкоза натощак (ммоль/л)/22,5]. Данные были проанализированы при использовании программного обеспечения SPSS v 16,0 (SPSS Inc., Чикаго, Иллинойс).
Анализ кала: Измерения SCFA были проведены согласно Ван Нуэнен и другим, Экология микроорганизмов в норме и при патологии 15:137-144 (2003). Вкратце, образцы кала были процентрифугированы и смесь муравьиной кислоты (20%), метанола и 2-этил масляной кислоты (внутренний стандарт, 2 мг/мл в метаноле) добавлена в чистый супернатант.0,5 мл образца было введено в колонку GC (Stabilwax-DA, длина 15 м, внутренний диаметр 0,53 мм, толщина фазы 0,1 мм; Varian Chrompack, Bergen op Zoom, Нидерланды) в газовой хроматографии Chrompack CP9001 при использовании автоматического пробоотборника. L- и D-лактат были определены ферментативным путем в чистом супернатанте посредством автоанализатора Cobas Mira plus (Roche, Алмере, Нидерланды). Уровень pH был измерен при использовании микроэлектрода. Сухое вещество было измерено посредством высушивания конечной навески до сухости при температуре 110°С в течение минимум 2 дней.
Статистический анализ. Результаты представлены как среднее значение ± стандартная ошибка среднего значения (SEM). SCFA во время трех визитов анализировались путем повторного проведения дисперсионного анализа (ANOVA) визитов (V1, V2, V3) как межсубъектных факторов и лечения, так и межгруппового фактора. Корреляцию между SCFA и другими оцениваемыми показателями (гормонами насыщения, глюкозой, инсулином и индексом инсулинорезистентности HOMA-IR) определяли с помощью корреляционного анализа Пирсона. Уровень статистической значимости был принят при P≤0.05.
Результаты:
54 субъекта (25 мужчин и 29 женщин) участвовали в исследовании и выполнили все 4 визита (V0-V3). Никто из субъектов не отказался от участия в исследовании, и продукт был хорошо переносим. Средний возраст контрольной группы, получавшей контрольный препарат (11 мужчин, 16 женщин), был равен 30,9±10,8, а исходный BMI - 22,8±2,4. В группе, получавшей исследуемый препарат (VFC), средний возраст был равен 32,3±10,3, а исходный BMI - 22,7±2,1. Не было никаких различий в базовых клинических и биохимических характеристиках между группами.
Значения массы тела, уровня глюкозы, инсулина и индекса инсулинорезистентности HOMA-IR во время V1, V2 и V3 представлены ниже в ТАБЛИЦЕ 9.
Величины представляют собой среднее значение ± стандартную ошибку среднего значения (SEM) (n=27/группа). Н/И - не измерялось. Когда пол был включен в качестве коварианта при повторных измерениях ANOVA, разница между визитами была значительной по индексу инсулинорезистентности HOMA-IR (р=0,024) для исследуемой группы.
Как было показано выше в ТАБЛИЦЕ 9, не было значимых изменений в массе тела между V1 и V3 в контрольной и исследуемой группах. Концентрация глюкозы в плазме натощак не отличалась во времени или между группами. Хотя было снижение уровня инсулина натощак на 14% между V1 и V3 в исследуемой группе (т.е. с PGX), эта разница статистически не отличалась от контрольной группы. Абсолютные и относительные изменения значений индекса инсулинорезистентности HOMA-IR были равны -0,04 или -3,6% в контрольной группе и -0,21 или -18,3% в исследуемой группе. Процентное снижение индекса инсулинорезистентности HOMA-IR было значительно больше в исследуемой группе, чем в контрольной (Р=0,03). Дисперсионный анализ повторных измерений показал Р=0,067 для эффекта от визита. Когда пол был включен в качестве коварианта при анализе повторных измерений, эффект от визита был статистически значим (Р=0,024). При раздельном анализе у мужчин было выявлено большее снижение значений индекса инсулинорезистентности HOMA-IR, чем у женщин (Р=0,042) между V1 и V3. Снижение индекса инсулинорезистентности HOMA-IR было одинаково для контрольной и исследуемой группы участников-мужчин (-0,36±0,20 и -0,31±0,18 соответственно). Однако у женщин результаты индекса инсулинорезистентности НОМА-IR были увеличены в контрольной группе (+0,18±0,17) и снижены в исследуемой группе (-0,08±0,19).
Не было достоверных различий в уровнях глюкагоноподобного пептида (GLP-1) натощак на протяжении визитов или между группами (данные не представлены).
ФИГУРА 10А графически показывает влияние контроля по сравнению с VFC на уровни пептида YY натощак у здоровых взрослых среди всех участников (п=54) во время V1 (0 день), V2 (14 день) и V3 (21 день). Значения являются средними ± стандартная ошибка среднего значения (SEM). Как показано на ФИГУРЕ 10А, анализ повторных измерений показал статистически значимый эффект от визита (Р=0,004) для уровней пептида YY натощак. Когда результаты, показанные в ФИГУРЕ 10А, были стратифицированы по BMI, участники с BMI<23 показали достоверную разницу в уровнях пептида YY, как эффект от визита (Р=0,03) и лечения (Р=0,037), что показано на ФИГУРЕ 10 В. Дисперсионный анализ показал значительно более высокий уровень пептида YY в исследуемой группе по сравнению с контрольной группой в конце исследования (Р=0,043). Следует отметить, что повышенные уровни пептида YY являются благоприятными, так как это анорексигенный гормон, который связан со снижением потребления пищи.
Как показано на ФИГУРЕ 10С, повторные измерения ANOVA показали значительный эффект от визита (Р<0,001) для общего уровня грелина натощак и лечения (р=0,037). Как показано в ФИГУРЕ 10С, снижение до 89,7±20,0 и 97,7±26,6 пкмоль/л наблюдалось в контрольной группе и исследуемой группе, получавшей VFC, соответственно.
Пептид YY отрицательно коррелировал с уровнем глюкозы в V2 (r=-0,27, Р=0,046). Существовали также значительные негативные корреляции между грелином и инсулином в V1 и V2 (r=-0,28, Р=0,038 и r=-0,31, Р=0,022, соответственно) и между грелином и индексом инсулинорезистентности HOMA-IR в V1 и V2 (r=-0,27, Р=0,052 и r=-0,28, Р=0,041, соответственно).
Фекальные SCFA и лактат:
Как показано ниже в ТАБЛИЦЕ 10, концентрации ацетата были значительно выше в группе с VFC (PGX®) по сравнению с контрольной (Р=0,01). Не существовало никаких различий в концентрации ацетата между группами в V1 (исходный уровень; р=0,286) или V2 (р=0,096), но концентрации были значительно выше с VFC (PGX®) по сравнению с контрольной группой в V3 (р=0,018). Не существовало никаких существенных различий в лечении между группами в концентрациях пропионата, бутирата, валерата, капроата или лактата. Анализ повторных измерений показал значительное влияние лечения (Р=0,03) на SCFA, которое было определено как более высокий уровень SCFA в V3 у субъектов, получавших VFC (PGX®), по сравнению с контролем (Р=0,06). Существовал значительный эффект от визита на pH кала (0,02) со снижением в обеих группах между V1 и V3.
Корреляции с гормонами насыщения, инсулином и глюкозой
Результаты анализа уровней в плазме грелина, пептида YY, GLP-1, инсулина, глюкозы и индекса инсулинорезистентности HOMA-IR приведены выше в ТАБЛИЦЕ 9. Как показано ниже в ТАБЛИЦЕ 10, имела место значительная отрицательная корреляция между грелином и пропионатом натощак в V3 (r=-0,29; Р=0,03). Изменение концентрации пропионата между исходным уровнем и последним визитом было рассчитано как V3-V1 и названо дельта пропионатом. Дельта пропионат был отрицательно ассоциирован с дельта инсулином (r=-0,26; Р=0,05) и дельта индексом инсулинорезистентности HOMA-IR (r=-0,25; Р=0,07).
Обсуждение
Анализ уровня пептида YY в плазме
Результаты исследования, описанные в данном примере, демонстрируют, что использование VFC повышает уровень пептида YY натощак по сравнению с контрольным продуктом, и они являются статистически значимыми у пациентов с BMI<23. Концентрация пептида YY в плазме, как правило, снижена у людей с избыточным весом и ожирением (R.L.Batterham etal., Nature 418: 650-654 (2002)), и это нарушение секреции пептида YY может способствовать развитию ожирения и/или препятствовать потере веса.
В то время как участники контрольной группы отметили умеренное снижение в уровне пептида YY в течение трехнедельного исследования, участникам, потреблявшие VFC, удалось сохранить, а тем, у которых BMI<23, фактически увеличить свой уровень пептида YY. Недавно было показано, что микробная ферментация пребиотиков у здоровых взрослых связана с увеличением выработки GLP-1 и пептида YY (P.D.Cani et al., Am. J. Clin. Nutr. (2009)). Было показано, что у грызунов короткоцепочечные жирные кислоты (SCFA), которые являются побочными продуктами микробной ферментации пищевых волокон, непосредственно стимулируют секрецию пептида YY (V.Dumoulin etal., Endocrinology 139:3780-3786 (1998)). Было показано, что коньяк глюкоманнан, один из исходных продуктов VFC, увеличивает концентрацию в фекалиях ацетата, пропионата и бутирата у людей (H.L Chen etal., J. Am. Coll. Nutr. 27:102-108 (2008)). Также было продемонстрировано, что вязкость волокон самостоятельно влияет на потребление пищи, и этот эффект может быть опосредован изменениями в высвобождении гормона насыщения.
Уровень грелина натощак был подавлен между 1 визитом (0 день) и 3 визитом (21 день) как в группе, потреблявшей исследуемый продукт, содержащий VFC, так и в группе потреблявшей контрольный продукт. Поскольку грелин стимулирует потребление пищи и способствует развитию ожирения (A.M.Wren et al., J.Clin. Endochnol. Metab. 86:5992-5995 (2001); M.Tschop etal., Nature 407: 908-913 (2000)), то соединения, которые ослабляют прогрессивный рост выработки грелина до приема пищи, являются привлекательными. В то время как снижение уровня грелина на 8 ммоль/л большее в группе VFC по сравнению с контрольной группой не было достоверно различным в этом исследовании, в других было продемонстрировано снижение уровня грелина натощак и связанного с едой при употреблении пищевых волокон (см., например, Parnell and Reimer, 2009). В то время как механизмы, с помощью которых пищевые соединения подавляют грелин, еще недостаточно известны, была выдвинута гипотеза о том, что скорость поглощения питательных веществ и осмолярность просвета кишечника могут играть определенную роль (Overduin etal., Endocrinology 746:845-850 (2005)). Далее в этой связи стоит отметить, что VFC имеет вязкость от 3 до 5 раз выше, чем у любых известных в настоящее время полисахаридов, и поэтому, вероятно, изменяет всасывание питательных веществ в кишечнике.
В этом исследовании не было обнаружено разницы в уровне GLP-1 натощак между двумя группами в течение трех недель. Это отсутствие изменений в уровне GLP-1 наблюдалось и с другими пищевыми волокнами (Т.С.Adam and R.S.Westererp-Plantenga, Br. J. Nutr. 93:845-851 (2005); K.S.Juntunen et al., Am. J.Clin. Nutr. 78: 957-964 (2003)).
Хотя концентрация глюкозы и инсулина у здоровых субъектов, которые участвовали в этом исследовании, была в пределах нормы, 14% снижение инсулина в течение исследования в исследуемой группе и 5,3 кратное большее снижение значений индекса инсулинорезистентности HOMA-IR в исследуемой группе по сравнению с контрольной группой может быть признаком соответствующего улучшения чувствительности к инсулину, что согласуется с результатами, полученными в примерах 1 и 3. Таким образом, это исследование демонстрирует, что VFC (PGX®) увеличивает уровень пептида YY натощак, пептида желудочно-кишечного тракта, участвующего в сокращении потребления пищи среди здоровых участников.
Анализ уровня SCFA в кале
Как описано выше, ферментируемые пищевые волокна снижают потребление энергии и увеличивают секрецию анорексигенных гормонов желудочно-кишечного тракта. Генерация SCFA от микробной ферментации пищевых волокон в дистальном отделе кишечника, как полагают, играет определенную роль в этом регулировании. Недавно Cani et al., Am J. Clin Nutr 90:1236-1243 (2009) продемонстрировали значительную корреляцию между выделением водорода с дыханием (мерой микробной ферментации в кишечнике) и уровнем GLP-1 в плазме, мощного инсулинотропного гормона, который также снижает потребление пищи. Настоящее исследование основывается на этих данных, демонстрируя значительное увеличение фекальной концентрации общего количества SCFA, ацетата в частности, у лиц, потреблявших до 10 г/сут нового функционального волоконного комплекса PGX®.
Ацетат, пропионат и бутират являются главными SCFA, образующимися в дистальных отделах кишечника. Рецепторы свободных жирных кислот (FFAR), с которыми взаимодействуют SCFA в кишечнике, были недавно идентифицированы как рецепторы свободных жирных кислот-2 (FFAR2) (также известных как GPR43 - G-белок сопряженный рецептор-43) и рецепторы свободных жирных кислот-3 (FFAR3) (также известных как GPR41 - G-белок сопряженный рецептор-41). См. Ichimura A. et al., Prostaglandins & Other Lipid Mediators 89:82-88 (2009). FFAR2 экспрессируется в энтероэндокринных клетках, которые вырабатывают пептид YY, что соответствует данным о том, что SCFA стимулируют высвобождение пептида YY (Ichimura et al., 2009). Было показано, что in vitro ацетат и пропионат подавляют липолиз в 3T3-L1 адипоцитах через активацию FFAR2 и снижают уровень свободных жирных кислот (СЖК) в плазме in vivo у мышей. См. Ge H et al., Endocrinology 149: 4519-4526 (2008). Повышение уровня СЖК было связано с инсулинорезистентностью и дислипидемией. Существуют также свидетельства того, что прием пропионата внутрь увеличивает количество лептина у мышей через FFAR3 (Ichimura et al., 2009). Учитывая, что лептин централизованно действует на сокращение потребления пищи, не исключено, что SCFA, вырабатываемые при микробной ферментации пищевых волокон, отчасти регулируют обмен веществ организма через FFAR2 и FFAR3.
Результаты этого исследования демонстрируют значительное увеличение ацетата и общих SCFA к концу третьей недели приема VFC (PGX®). Хотя не было никаких изменений в массе тела у наших испытуемых в течение трех недель приема пищевых добавок, есть возможность того, что потребление волокон PGX® в последней исследуемой дозе (10 г/сут), может привести к снижению жировой массы тела, как было показано с другими растворимыми волокнами, такими как олигофруктоза, в течение трех месяцев. (Parnell J.A. et al., Am J Clin Nutr 89:1751-1759 (2009). Отрицательная корреляция между пропионатом и грелином вписывается в общее снижение потребления пищи, связанное с пищевыми волокнами, в частности, с высокой вязкостью, такими как VFC (PGX®). Отрицательная корреляция между инсулином и индексом инсулинорезистентности HOMA-IR соответствует способности этих функциональных волокон улучшать общее метаболическое здоровье и снижать резистентность к инсулину.
В заключение отметим, что результаты этого примера показывают увеличение фекального ацетата у лиц, потребляющих умеренные дозы вязких и растворимых волокон, VFC (PGX®), в течение 3-недельного периода времени. SCFA, пропионат, отрицательно коррелировал с грелином, инсулином и индексом инсулинорезистентности HOMA-IR натощак. Насколько нам известно, это первый доклад, показывающий увеличение концентрации фекальных SCFA после приема VFC (PGX®), который предполагает, что его ферментация в толстой кишке может вызвать целый каскад физиологических эффектов, потенциально опосредованных через FFAR2 и FFAR3.
ПРИМЕР 5
Этот пример описывает анализ первичной структуры гранулированного вязкого волоконного комплекса (VFC) (коньяк/ксантан/альгинат (70:13:17) (т.е. смесь волокон была обработана путем грануляции с образованием комплекса, коммерческое название PGX®).
Обоснование:
Полисахариды являются естественными полимерами, состоящими из Сахаров (моносахаридов), связанных через их гликозидные гидроксильные группы. Они могут быть разветвленными или линейными, иметь очень высокую молекулярную массу от нескольких тысяч Дальтон до более двух миллионов. Первичная структура гранулированного VFC (70% коньяк маннан, 17% ксантановой камеди, 13% альгината натрия) была определена при помощи анализа метилирования, гидролиза и хроматографии и гидролиза и ЯМР-спектроскопии.
Коньяк глюкоманнан - частично ацетилированный (1,4)-β-D-глюкоманнан, полученный из клубней Amorphophallus konjac или корня Конняку (Bewley et at., 1985, Biochemistry of Storage Carbohydrates in Green Plants, Academic Press, New York, pp.289-304).
Ксантановая камедь представляет собой микробный полисахарид, вырабатываемый Xanthomonas campestris. Она обладает уникальными реологическими и гелеобразующими свойствами. Структура ксантана построена на целлюлозной основе β-(1,4)-связанных остатков глюкозы, которые имеют боковую трисахаридную цепь манноза-глюкуроновая кислота-манноза, связанную с каждым вторым остатком глюкозы в основной цепи. Некоторые концевые остатки маннозы имеют пировиноградокислые группы, а некоторые внутренние остатки маннозы - ацетильные группы (Andrew Т.R., ACS Symposium Series No. 45 (1977)).
Альгинат натрия представляет собой натриевую соль полисахарида, полученную из бурых водорослей (например, Laminaria hyperborea, Fucus vesiculosus, Ascophyllum nodosum). Химическая структура состоит из блоков (1,4) связанных-β-D-полиманнуроновой кислоты (поли М), (1,4) связанных-α-L-полигулуроновой кислоты (поли Г) и чередующихся блоков из двух уроновых кислот (поли МГ). Grasdalen, H., et al., Carbohydr Res 89: 179-191 (1981). Альгинаты образуют прочные гели с двухвалентными катионами металлов, для описания данной формы геля используется модель «упаковки для транспортировки яиц». См. Grant, G.T., et al., FEBS Lett 32:195-198 (1973).
Методы
Все полисахариды, используемые в этом Примере, были предоставлены InovoBiologic Inc (Калгари, Альберта, Канада). Отдельными полисахаридами были: коньяк глюкоманнан (партии №2538 и 2681); ксантановая камедь (партии №2504 и 2505); альгинат натрия (партии №2455, 2638 и 2639). Гранулированный VFC (PGX, партии №900495 и 2029070523) были произведены путем смешивания 70% коньяка-маннана, 17% ксантановой камеди и 13% альгината натрия) с добавлением от 30% до 60% (в процентах по массе) воды к VFB и последующим высушиванием добавленной воды применением тепла. Образцы той же тройной смеси (необработанная VFB) были взяты до обработки (например, грануляции); они упоминаются как трехкомпонентная смесь №1 (ТМ1, партии №900285, 900416 и 1112050809).
1. Анализ метилирования
Обоснование: Анализ при помощи метода газовой хроматографии и массовой спектрометрии частично метилировамных ацетатов альдитола использовался для выявления моносахаридных компонентов полисахаридов и положения связей (H. Bjorndal etal., Carbohydrate Research 5: 433-40 (1967)). Таким образом, анализ метилирования может выявить новые и неожиданные сахара, а также положения связей, которые были созданы в процессе добавления трех полисахаридов (коньяк маннана, ксантановой камеди и альгината) вместе и обработки их с помощью термического воздействия и процесса грануляции. Тем не менее, анализ метилирования не показывает, как сахара связаны друг с другом (α или β). Известно, что анализ метилирования является неудовлетворительным для анализа уроновых кислот (например, альгината натрия), которые не подвержены метилированию и устойчивы к гидролизу (Percival et al., Chemistry and Enzymology of Marine Algal Polysaccharides, Academic Press 101 (1967)). Поскольку альгинат натрия полностью состоит из уроновых кислот (маннуроновой и гулуроновой кислот), для анализа VFC необходимо было использовать дополнительные методы, которые включали гидролиз и анализ полученных нейтральных Сахаров и уроновых кислот путем высокоэффективной анионообменной хроматографии с импульсным амперометрическим детектированием (HPAEC-PAD) и 1Н ЯМР-спектроскопии, как описано ниже.
Методы:
Были проанализированы примеры, приведенные ниже в ТАБЛИЦЕ 11, которая включает в себя каждый отдельный компонент VFC (коньяк маннан, альгинат натрия, ксантановая камедь), негранулированную VFB (далее как «тройная смесь №1» или «ТМ1») и гранулированный VFC (далее как PGX®). Были взяты взвешенные количества каждого полисахарида и их тройные смеси, несколько капель диметилсульфоксида было добавлено до 450 мкг каждого образца. Образцы были полностью метилированы, используя гидроксид натрия (NaOH/иодистый метил (Mel)), образцы встряхивали, затем обрабатывали ультразвуком в общей сложности четыре раза в течение двух часов. Образцы очищались путем экстракции хлороформом, затем гидролизировались 2М трифторуксусной кислотой (TFA) в течение двух часов при 120°С и восстанавливались бор-дейтеридом натрия (NaBD4) в 2М NH4OH в течение двух часов при комнатной температуре. Борат, получавшийся при распаде бор-дейтерида, удаляли путем трехкратного добавления смеси метанола в ледяной уксусной кислоте (90:10) с последующей лиофилизацией. Затем образцы ацетилировались с использованием уксусного ангидрида (1 час при 100°С). Ацетилированные образцы очищались путем экстракции хлороформом.
Результаты анализа метилирования:
ТАБЛИЦА 11 дает сводку результатов, наблюдаемых в реконструированных ионных хроматограммах (не показано) анализа связей, проведенного на частично метилированных ацетатах альдитола (PMAAs), полученных из семи образцов. Как показано в таблице 11, образец альгината натрия дал только слабый сигнал для 4-связанной глюкозы. Сравнение сигналов, наблюдаемых в каждом образце полисахаридов, показывает, что компоненты, найденные в порошке коньяка маннана, соответствуют заявленной структуре, а именно глюкоза и манноза, связанные через 4 позицию с короткими терминальными боковыми цепями. Образец ксантановой камеди дал слабый сигнал на 2-связанную маннозу в дополнение к сильным сигналам на терминальную маннозу и/или терминальную глюкозу, а также 4-связанную глюкозу. Сигнал, извлеченный из сорбента на 14,65 минуте, показал характер фрагментации, соответствующий 3,4-связанной разветвленной гексозе. Все сигналы ксантановой камеди соответствовали заявленной структуре. Сигналы на приблизительно 14,65 минуте в ксантановой камеди и всех образцах VFC и VFB соответствовали 3,4-связанной точке разветвления гексозы, наблюдаемой в образце ксантановой камеди.
Таким образом, общий профиль передаваемых сигналов в образцах содержит компоненты, соответствующие коньяку маннану, а также содержит компоненты, которые могут быть отнесены к ксантановой камеди (точке разветвления). Эти результаты метилирования согласуются со следующими выводами. Во-первых, и негранулированная VFB (ТМ1), и гранулированный VFC (PGX®) содержат как коньяк маннана (4-связанную маннозу), так и ксантановую камедь (3,4-связанную разветвленную глюкозу). Другие метилированные сахара в спектре могут исходить от любого из этих биополимеров. Во-вторых, отсутствуют другие распространенные биополимеры (например, нет никаких доказательств присутствия галактоманна, каррагинана и т.п.), 6-связанная глюкоза (крахмал) и т.д. В-третьих, эти результаты не предоставляют никаких доказательств о сформированных новых сахаро-подобных структурах (например, нет масс, соответствующих другим сахарам, как в гранулированном VFC, так и в негранулированной VFB, которые бы имели аналогичные масс-спектры). В-четвертых, этот анализ не способен идентифицировать компонент альгината натрия в связи с тем, что исходные уроновые кислоты не метилируются (Percival etal., Chemistry and Enzymology of Marine Algal Polysaccharides, Academic Press 101 (1967)). Анализ альгината натрия проводится с помощью гидролиза и хроматографии и гидролиза и ЯМР-спектроскопии, как описано ниже.
2. Анализ гидролиза и метода газовой хроматографии и массовой спектрометрии (ГХ-МС)
Обоснование:
И ксантановая камедь, и альгинат натрия содержат уроновые кислоты, а именно глюкуроновую (ксантановая камедь) и маннуроновую и гулуроновую (альгинат натрия). Эти структурные особенности трудно определить из-за чрезвычайного гидролитического сопротивления уроновых кислот в полисахаридах, вызванного электроноакцепторной карбоксильной группой, что делает это очень трудно достижимым на первом этапе в кислотно-каталитическом гидролизе, а именно протонирования гликозидного атома кислорода (Percival etal., Chemistry and Enzymology of Marine Algal Polysaccharides, Academic Press 104 (1967)). Это приводит к высокой устойчивости данных полисахаридов к атаке. Методы гидролиза альгината натрия в уровне техники описывает обработку 90% H2SO4 в течение нескольких часов с последующим кипячением в течение 24 часов после разбавления (Fischer etal., Hoppe-Seyler's Z Physiol Chem 302:186 (1955)). В последнее время, однако, обнаружена и используется сильная летучая кислота, трифторуксусная кислота (TFA), которая гидролизирует очень устойчивые связи полиуронидов с дополнительным преимуществом летучести для облегчения удаления (L. Hough etal., Carbohydrate Research 21:9 (1972)).
Этот пример описывает новый аналитический метод, который был разработан для гидролиза VFB и VFC (также известного как «VFB/C») и характеристики всех продуктов гидролиза (глюкозы, маннозы, глюкуроновой кислоты, маннуроновой кислоты и гулуроновой кислоты) с помощью хроматографии и дополнительного использования ЯМР.
Методы:
Анализ метода ГХ-МС: Частично метилированные ацетаты альдитола (PMAAs) были разделены и идентифицированы с помощью газовой хроматографии и массовой спектрометрии (ГХ-МС). ГХ разделение проводилось с помощью DB5 колонки, ввода пробы непосредственно в колонку при 45°С и температурной программе в 1 мин при 40°С, затем 25°С/мин до 100°С, затем 8°С/мин до 290°С и, наконец, выдержкой при 290°С в течение 5 минут. МС идентификация проводилась с ионизационным напряжением 70 эВ в режиме сканирования в диапазоне масс 50-620 Дальтон с единичной резолюцией.
Частичный гидролиз Условия: Гидролиз: Условия были разработаны для гидролиза VFB/C трифторуксусной кислотой (TFA), который гидролизует полисахариды как можно полнее, не атакуя сахара до такой степени, что результаты могли бы быть замаскированы нежелательными продуктами распада.
TFA гидролиз проводился на 30-мг образцах, представленных в ТАБЛИЦЕ 11, которые были помещены в герметичные трубы с 2М TFA и нагреты до 100°С в течение 1 ч, 2 ч, 4 ч, 8 ч, 24 ч и 72 ч. Образцы вынимались из тепла в установленные сроки, TFA выпаривалась в сублимационной сушилке, а образец исследовался при помощи тонкослойной хроматографии (ТСХ) (растворитель:бутанол:этанол:вода, 5:3:2) на пластинах силикагеля (ТСХ силикагеле 60°F фирмы Merck). Пятна были визуализированы с использованием серной кислоты (5%) в метаноле. Было установлено, что наилучшие условия для гидролиза полисахаридов в VFB/C как можно полнее до составляющих Сахаров, без атаки Сахаров до такой степени, чтобы результаты могли быть замаскированы нежелательными продуктами распада, были 2М TFA инкубации в течение 72 ч при 100°С, отфильтрованы, высушены сублимацией x2. Результаты приведены в ТАБЛИЦЕ 12.
Результаты анализа гидролиза:
Хроматография:
После обнаружения условий гидролиза, который высвобождает составляющие сахара из трех полисахаридов, был разработан хроматографический метод, способный выделить оба нейтральных сахара (глюкозу, маннозу) из уроновых кислот (глюкуроновой кислоты, маннуроновой кислоты и гулуроновой кислоты).
Кислотная хроматография Dionex является хроматографическим методом, который широко использовался на сахарах и родственных соединениях. Этот метод определения намного более чувствителен по сравнению со многими методами, которые использовались в прошлом, такими как показатель преломления.
Методы:
Оборудование: Dionex ICS-3000 система ионообменной хроматографии со сдвоенным насосом, электрохимическим детектором, системой обработки данных Chromeleon.
Материалы: Вода (деионизированная и фильтрованная), гидроксид натрия (50% раствор, электрохимической квалификации ВЭЖК), ацетат натрия, безводный (299,5%).
Приготовление образцов: (концентрация ~0,02 мг/мл)
Образцы растворов были приготовлены в концентрации примерно 0,02 мг/мл из исходной концентрации в D2O 30 мг/мл (ЯМР образцы). Аликвоты (15 мкл) гидролизата и стандартного раствора растворили в деионизированной воде (30 мг/мл) и разбавили до 0,0225 мг/мл деионизированной водой для проведения анализа. Также были приготовлены стандартные растворы каждого из ожидаемых компонентов из трех полисахаридов: глюкозы и маннозы (из коньяка глюкоманнана и ксантановой камеди), глюкуроновой кислоты (из ксантановой камеди) и маннуроновой и гулуроновой кислот (из альгината натрия).
Образцы были введены в Dionex CarboPac PAl (250×4 мм) колонку с защитной колонкой (50×4 мм) при 30°С. Колонку элюировали с градиентом растворителя, образованного из А: деионизированной воды; Б: 50 ммоль ацетата натрия (безводного ≥ 99,5%) в 100 ммоль NaOH (электрохимической квалификации ВЭЖК) и В: 100 ммоль NaOH при скорости потока 1 мл в мин-1, как показано в ТАБЛИЦЕ 13.
Результаты хроматографического анализа:
ТАБЛИЦА 14 показывает результаты Dionex ионной хроматографии гидролизатов различных образцов волокон.
Как показано в ТАБЛИЦЕ 14, результаты анализа ГХ-МС показывают, что компоненты сахара и сахарных кислот были хорошо разделены за 35-минутное время записи. Как показано далее в ТАБЛИЦЕ 14, TFA гидролиз VFB/C дает уникальный профиль, в котором в следах Dionex отчетливо наблюдаются четыре моносахарида, а именно глюкоза, манноза, глюкуроновая кислота и маннуроновая кислота. Эти результаты соответствуют составу VFB/C, включающему коньяк глюкоманнан (манноза, глюкоза), ксантановую камедь (глюкоза, манноза, глюкуроновая кислота) и альгинат натрия (маннуроновая кислота и гулуроновая кислота).
ТАБЛИЦА 15 показывает моносахаридные компоненты различных коммерческих биополимеров, показывая, что VFC (PGX®) имеет уникальный профиль моносахаридных компонентов. Таким образом, эти результаты демонстрируют, что TFA гидролиз и ГХ-МС разделение могут быть использованы для того, чтобы отличить VFC от других комбинаций моносахаридов.
Таким образом, ГХ-МС анализ частично метилированных ацетатов альдитола коньяка глюкоманнана и ксантановой камеди продемонстрировал присутствие характерных Сахаров и связей, ожидаемых из своих известных первичных структур. Коньяк глюкоманнан дал ГХ пики, соответствующие 4-связанной глюкозе, 4-связанной маннозе и терминальной глюкозе и/или маннозе (в основном из боковых цепей). Ксантановая камедь дала сильные пики, соответствующие терминальной маннозе и/или глюкозе (из боковых цепей) и 4-связанной глюкозе (в основной цепи), плюс пик для 3,4-связанной гексозы (глюкозы) и слабый пик для 2-связанной маннозы (обе из боковых цепей). Практически все эти пики были также обнаружены в ГХ-МС анализе частично метилированных ацетатов альдитола ТМ1 и гранулированного VFC (PGX®), как показано в ТАБЛИЦЕ 11, показывая, что оба они содержат коньяк глюкоманнан и ксантановую камедь. Следовой пик элюирования на позиции 2-связанной маннозы от компонента ксантановой камеди был слишком слаб, чтобы присвоить ему массовый спектр, но сигналы во время удерживания на 12,47 и 14,65 минутах соответствуют терминальной маннозе и 3,4-связанной гексозе (глюкозе) ксантановой камеди, соответственно. Важно, что эти анализы не выявили каких-либо дополнительных неожиданных Сахаров или связей Сахаров в ТМ1 или гранулированном VFC (PGX®), которые могли бы исходить от других компонентов биополимеров или от любых новых Сахаров или связей Сахаров, которые могли бы сформироваться в процессе обработки. Как и ожидалось, ГХ-МС анализ частично метилированных ацетатов альдитола ТМ1 и гранулированного VFC был не в состоянии обнаружить компоненты альгината натрия.
Принимая во внимание высокоэффективную анионообменную хроматографию с импульсным амперометрическим детектированием (HPAEC-PAD), ТАБЛИЦА 14 показывает измеренное время удерживания стандартов, составляющих ожидаемые компоненты гидролиза ТМ1 и гранулированного VFC вместе с результатами хроматограммы, полученными от гидролизатов ТМ1 и гранулированного VFC. Как показано в ТАБЛИЦЕ 14, четыре из возможных компонентов (глюкоза, манноза, глюкуроновая кислота и маннуроновая кислота) были обнаружены в гидролизатах ТМ1 и гранулированного VFC. Пятый компонент, гулуроновая кислота, не была обнаружена при данном анализе, что, вероятно, связано с относительно низким содержанием альгината натрия в смесях. Не было обнаружено неожиданных компонентов гидролиза. Эти результаты согласуются с результатами, полученными при ГХ-МС анализе частично метилированных ацетатов альдитола, поддерживая вывод, что ТМ1 и гранулированный VFC содержат химически неизмененные коньяк глюкоманнан и ксантановую камедь. Кроме того, определение маннуроновой кислоты в гидролизатах предполагает дополнительное присутствие химически неизмененного альгината натрия.
3. Спектроскопия ядерного магнитного резонанса интактных или частично гидролизованных полимеров, мономерные стандарты
Обоснование:
Спектроскопия ядерного магнитного резонанса (ЯМР) является ценным инструментом для анализа органических молекул, так как спектры содержат огромное количество информации об их первичной структуре через расположение протонов (атомов водорода) в молекуле. Таким образом, на базовом уровне значение ЯМР спектров 1 Н заключается в предоставлении надлежащего уровня первичной структурной информации, которая может идентифицировать различные характеристики, используя хорошо установленные правила химических сдвигов и интегралов стандартных и неизвестных соединений в интересующей смеси. Углеводы имеют ряд характерных особенностей на ЯМР, что делает его полезным для анализа. Двумя основными особенности ЯМР спектров углеводов являются (I) так называемые «аномермые» резонансы, которые являются протонсвязанными с С1 в кольце сахара и обычно возникают в более низких полях, чем вторая особенность; (II) «оболочка кольца» протонов, связанных с оставшимся кольцом сахара. Например, для глюкозы альфа и бета аномерные резонансы соответствуют уровню 5,2 и 4,6 миллионной доли, соответственно, а оболочка кольца находится между 3,1 и 3,9 миллионными долями, соответственно.
Интересно, что уроновые кислоты обладают ЯМР спектрами, которые несколько отличаются от типичного спектра гексоз, описанного выше, а их резонансы скорее накладываются друг на друга в слегка более сильном поле, чем для глюкозы и маннозы (3,9-5,6 миллионных долей). Santi et al., 12th Int. Electronic Conf on Synthetic Organic Chemistry (ECSOC-12): 1-30 (2008). Таким образом, ЯМР спектры гидролизатов интересующих нас полисахаридов (например, VFB/C) могут быть использованы для определения отпечатков структурных единиц (глюкозы, маннозы, уроновой кислоты и др.) в полимерах.
В исследовании, описанном в данном примере, ЯМР спектры использовались для идентификации сложных смесей, которые получаются в результате гидролиза различных полисахаридов и VFB. Следует отметить, что все полисахариды не могут быть исследованы с помощью ЯМР на уровне полимеров из-за проблем с физическими характеристиками, такими как вязкость.
Методы:
Образцы каждого полисахарида и тройных смесей были частично гидролизованы 2М TFA при 100°С в течение четырех часов и 24 часов. Отфильтрованные образцы гидролизатов (30 мг) растворялись в D2O (1 мл) и подвергались сублимационной сушке перед повторным растворением в D2O и размещением в ампулах для ЯМР-спектроскопии. Стандартные растворы предполагаемых двух моносахаридов и трех уроновых кислот были приготовлены аналогичным образом.
Были получены ЯМР-спектры гидролизата и стандартных растворов при 298,1 К при помощи спектрометра Bruker 400 MHz Advance III с широкополосным автоматически настраиваемым многоядерным датчиком и устройством переменной температуры под управлением программного обеспечения Bruker Topsin. Для большинства образцов было выполнено 16 сканирований, кроме гулуроновой кислоты, которая получила 256 сканограмм.
Результаты анализа ЯМР:
1H ЯМР-спектры стандартных моносахаридов и уроновых кислот были хорошо разложены, а их характерные химические сдвиги были обнаружены в обоих гидролизатах ксантановой камеди и альгината натрия, а также в гидролизате VFC (PGX®) (данные не показаны). Химические сдвиги, наблюдавшиеся для глюкозы и маннозы от ксантановой камеди, были разложены на аномерные резонансы (4,6-5,2 м.д.) и на резонансы колец Сахаров (3-4 м.д.). Химические сдвиги, наблюдавшиеся для маннуроновой и гулуроновой кислот от альгината натрия, были ближе друг к другу (между 3,6-5,2 м.д.). Резонансы уроновых кислот, обнаруженные в гидролизате гранулированного VFC (PGX®), были явной комбинацией тех, которые были обнаружены в гидролизатах ксантановой камеди и альгината натрия, что также подтверждает присутствие химически неизмененного альгината натрия в гранулированном VFC (PGX®).
Таким образом, ЯМР спектры чистых стандартов, компонентов гидролизатов и гидролизатов VFC продемонстрировали, что VFC (PGX®) состоит из полисахаридов с неизмененными первичными структурными особенностями моносахаридных компонентов с неизмененными гликозидными связями.
Общие выводы:
Результаты, описанные в данном примере, продемонстрировали, что первичная химическая структура гранулированного VFC (PGX®) практически не изменилась в сравнении с предварительно смешанной, необработанной, негранулированной VFB (ТМ1). Как описано в этом примере, при помощи классического метода метилирования было показано, что компоненты коньяка глюкоманнана и ксантановой камеди содержали ожидаемые фрагменты и связи и что не было никаких необъяснимых дополнительных структурных компонентов, которые могли быть получены при смешивании или обработке компонентов VFB/C.
Поскольку альгинат натрия, один их компонентов VFB/C, устойчив к метилированию, дальнейшие методы были использованы для завершения структурного анализа, включая частичный гидролиз, хроматографию и ЯМР, чтобы получить дальнейшие свидетельства о неизменной природе первичной химической структуры VFB/C.
Таким образом, исследования, описанные в этом примере, подтверждают вывод о том, что гранулированный VFC (PGX®) химически не меняет своих первичных особенностей в процессе гранулирования.
ПРИМЕР 6
Этот пример описывает анализ реологических и макромолекулярных свойств гранулированного вязкого волоконного комплекса (VFC) (коньяк глюкоманнан/ксантан/альгинат (70:13:17)) гранул, (т.е. смесь волокон была подвергнута грануляции для образования комплекса, коммерческое название (PGX®). Результаты, описанные в данном примере, показывают, что взаимодействие происходит между компонентами гранулированного VFC на уровне полимеров для создания сетей и зон соединения с формированием нового полисахарида со следующей номенклатурой: α-D-глюкуроно-α-D-манно-β-D-манно-β-D-глюко), (α-L-гулуроно-β-D-маннуроно), β-D-глюко-β-D-маннан.
Обоснование:
Исследования, описанные в этом примере, проводились для изучения вопроса о том, содержит ли тройная гранулированная смесь VFB/C, включающая коньяк маннана, ксантановую камедь и альгинат натрия, сеть и зоны соединения с участием всех трех компонентов, что отражается на реологических свойствах раствора, которые являются уникальными для обработанного/гранулированного VFC по сравнению с необработанной/негранулированной VFB или отдельных его компонентов коньяка маннана, ксантановой камеди или альгината натрия. Наличие нековалентных макромолекулярных взаимодействий между тремя полисахаридами в гранулированном VFC (PGX®) в растворе было исследовано с использованием методов, описанных ниже. Поскольку парные взаимодействия между коньяком глюкоманнаном и ксантановой камедью ожидались из результатов исследования, описанного в примере 5, дальнейший анализ проводился специально для исследования любого участия третьего полисахарида, альгината натрия, в формировании возможных тройных связей.
1. Измерения реологических свойств
В первом исследовании реологические кривые были получены для ряда концентраций необработанного/негранулированного VFC (тройной смеси №1, именуемой «ТМ1») и гранулированного VFC (PGX®), и они сравнивались с реологическими кривыми для растворов каждого отдельного компонента VFB/C в тех же концентрациях для выявления синергетического эффекта в реологическом поведении водных растворов тройных смесей.
Подготовка образцов:
Отдельные полисахариды и тройные смеси были изучены в растворе деионизированной дистиллированной воды. Точные навески растворялись в концентрациях 0,1 г, 0,2 г и 0,5 г в 100 г воды (0,1%, 0,2% и 0,5%, соответственно) при 25°С и гидратировались в течение двух часов с перемешиванием, в котором навеска воды помещалась на магнитной мешалке и вихре, созданных до добавления образцов, которые были взвешены до четырех знаков после запятой, затем медленно налиты в центр вихря. Через два часа растворы перемешивались при помощи высокоскоростного миксера (мешалка IKA (15 тыс.оборотов в минуту)) в течение 1 минуты, чтобы убедиться, что все частицы материала были полностью перемешаны. Затем образцы дополнительно перемешивались в течение 1 часа перед тем, как стали считаться пригодными для анализа.
Измерение реологической кривой:
Реологические свойства раствора измеряли про помощи реометра Bohlin Gemini, используя С14 DIN 53019 концентрическую цилиндрическую измерительную систему при 25,0±0,1°С. Равновесные скорости сдвига измерялись для ряда постоянно применяемых касательных напряжений сдвига, возрастающих от 0,1 Па до 10 Па. Реологические свойства характеризовались первоначально с использованием реологических кривых вязкости по отношению к скорости сдвига.
Результаты:
ФИГУРЫ 13А, 13В и 13С наглядно иллюстрируют реологические кривые коньяка глюкоманнана, ксантановой камеди и альгината натрия соответственно при 0,1%, 0,2% и 0,5% в процентах по массе, измеренные при 25°С. Реологические кривые растворов отдельных полисахаридов, отображенные на ФИГУРАХ 13А-С, показывают, что ксантановая камедь является самым мощным загустителем (ФИГУРА 13 В), затем коньяк глюкоманнан (ФИГУРА 13А) и, наконец, альгинат натрия (ФИГУРА 13С). Небольшая разница в реологических свойствах была замечена между растворами разных партий образцов отдельных полисахаридов. Раствор ксантановой камеди имел наиболее обширные участки псевдопластичности во многих декадах скорости сдвига, где логарифмические участки были линейными.
ФИГУРЫ 11А-С наглядно иллюстрируют сравнение реологических кривых необработанного/негранулированного VFB (TM1) и гранулированного VFC (PGX®) при 0,5% (процентах по массе) (ФИГУРА 11А), 0,2% (процентах по массе) (ФИГУРА 11 В) и 0,1% (процентах по массе) (ФИГУРА 11С).
Данные, приведенные на ФИГУРАХ 11А-С, были далее рассмотрены путем приведения каждого реологического потока к степенной зависимости между вязкостью η и скоростью сдвига D следующим образом:
η=KDn-1
Где K - коэффициент консистенции (предоставляет общее значение толщины), и η - показатель текучести (указывающий на отклонение от ньютоновской вязкости), полученный из угловых коэффициентов соответственно логарифмического графика вязкости по отношению к скорости сдвига, которая является линейной для степенной жидкости. Значение К отражает общую консистенцию, а η показывает отклонение от ньютоновской вязкости (η=1). Ньютоновская жидкость обладает значением η равным 1 и, по мере снижения η ниже 1, вязкость жидкости все больше снижается при сдвиге.
Как показано на ФИГУРАХ 11А-С все образцы необработанной/негранулированной VFB (TM1) и гранулированного VFC (PGX®) дали очень похожие реологические кривые для каждой концентрации, свидетельствуя о том, что низкая активность воды при приготовлении или предыдущей выдержке заранее приготовленной смеси повлияла на свойства смесей. Следует отметить, что обработка проходила при гораздо более низкой общей активности воды, чем при термической обработке разбавленного раствора. Реологические кривые смесей VFB/C были ближе к кривым ксантановой камеди; они соответствовали степенному закону и показали значительную псевдопластичность, но величина вязкости и псевдопластичность при каждой концентрации были выше, чем у ксантановой камеди в отдельности. Это четко показано при помощи разниц в степенном законе K и η значений между растворами смесей VFB/C и ксантановой камеди, как показано на ФИГУРЕ 12А.
ФИГУРА 12А наглядно иллюстрирует сравнение степенного закона для K необработанной/негранулированной VFB (TM1), гранулированного VFC (PGX®) и ксантановой камеди. Как показано на ФИГУРЕ 12А, образцы необработанной/негранулированной VFB (TM1) и гранулированного VFC (PGX®) дали очень близкие значения K для каждой концентрации, а значение K увеличивалось по мере увеличения концентрации. Следует отметить, что более высокие значения K соответствовали большей вязкости, а более низкие значения η соответствовали большей степени псевдопластичности в диапазоне концентраций.
ФИГУРА 12В наглядно иллюстрирует сравнение степенного закона для η необработанной/негранулированной VFB (TM1), гранулированного VFC (PGX®) и ксантановой камеди. Как показано на ФИГУРЕ 12В, значения η были также одинаковы для всех образцов VFC при каждой концентрации, но указывали на возможное присутствие минимального значения η или максимального при степени снижения вязкости при сдвиге в диапазоне от 0,30 до 0,35%.
На основании пропорций, которые использовались для создания гранулированного VFC (70% коньяка глюкоманнана, 17% ксантановой камеди и 13% альгината натрия), можно было ожидать, что реологические свойства смеси будут в целом аналогичны 100% коньяку глюкоманнану, предполагая, что между полисахаридами нет взаимодействий. Однако, учитывая, что коньяк глюкоманнан является преобладающим полисахаридом в тройных смесях, а ксантановая камедь и альгинат натрия являются примесными компонентами, реологические свойства растворов необработанной/негранулированной VFB (TM1) и гранулированного VFC (PGX®) обеспечивают четкое указание на взаимодействие между полисахаридами в этих смесях.
Выводы:
Результаты сравнения реологических кривых гранулированного VFC (PGX®), показанные на ФИГУРЕ 11, с реологическими кривыми отдельных компонентов, показанными на ФИГУРАХ 13А-13С, показывают, что произошло взаимодействие между полисахаридами в гранулированном VFC, что привело к большему увеличению вязкостей и степеней псевдопластичности, чем можно было ожидать для конкретного тройного состава, присутствующего в необработанной/негранулированной VFB (TM1) или гранулированном VFC (PGX®). В целом реологические свойства образцов гранулированного VFC (PGX®) были ближе всего к ксантановой камеди, но удивительно, вязкости гранулированного VFC (PGX®) были выше, чем отдельно у ксантановой камеди. Это показано на ФИГУРАХ 12А и 12В, которые подчеркивают более высокие значения K, а ниже приблизительно 0,45% концентрации более низкие значения η для гранулированного VFC (PGX®) по сравнению с ксантановой камедью. Учитывая, что содержание ксантановой камеди в необработанной/негранулированной VFB (TM1) и гранулированном VFC (PGX®) составляет лишь 17%, а оставшиеся 83% составляют менее сильные загустители коньяк маннана и альгинат натрия, эти результаты являются наглядным свидетельством взаимодействия, которое произошло между полисахаридами в образцах гранулированного VFC (PGX®).
2. Исследование влияния концентрации альгината натрия и/или термической обработки
Были проведены дополнительные эксперименты для того, чтобы определить влияние различных концентраций альгината натрия и влияние термической обработки на реологические и макромолекулярные свойства VFB/C следующим образом.
Методы:
Были приготовлены смеси коньяка глюкоманнана, ксантановой камеди и альгината натрия. Смеси содержали коньяк глюкоманнан (КМ) и ксантановую камедь (XG) в постоянном соотношении (KM:XG=4,12:1) и различные количества альгината натрия (от А0 до А33) (0%, 2%, 5%, 8%, 11%, 13%, 17%, 21%, 24%, 27%, 30% и 33%). Все образцы были сначала приготовлены в виде сухих волоконных смесей двух (коньяк глюкоманнан и ксантановая камедь) или трех (коньяк глюкоманнан, ксантановая камедь и альгинат натрия) компонентов. Каждый образец (смесь) был взвешен до четырех знаков после запятой (сухим), тщательно перемешивался с помощью ручного шейкера и выдерживался при -19°С до необходимого времени. Водные растворы каждой смеси изготавливались в одной концентрации равной 0,5% путем добавления 5,0 г каждого из образцов (смесей) к 1 кг деионизированной воды, перемешивая при помощи магнитной мешалки (т.е. вихрь сначала создавался в деионизированной воде, а образцы затем медленно вливались в центр вихря) и оставлялись для гидратации до однородного состояния в течение четырех часов. Водные растворы смесей хранились при 5°С до приготовления образцов.
Термическая обработка
Затем были взято по 20 мл аликвот каждого раствора и обработаны следующим образом: (I) инкубированы при комнатной температуре (22°С) (без подогрева) или (II) нагреты до 90°С в сушильном шкафу с терморегулятором (образцы находились в запечатанных контейнерах, чтобы избежать потерь за счет испарения, и периодически встряхивались для обеспечения более полной гидратации) либо один час (А0Н до А33Н) либо четыре часа (А0Н4 до А33Н4).
Реологические кривые при 25°С водных растворов смесей коньяка глюкоманнана, ксантановой камеди и альгината натрия, содержащие коньяк глюкоманнан (KM) и ксантановую камедь (XG) в постоянном соотношении (KM:XG=4,12:1) и переменное количество альгината натрия (0%, 2%, 5%, 8%, 11%, 13%, 17%, 21%, 24%, 27%, 30% и 33%) измерялись в одной концентрации 0,5%. Как описано выше, растворы либо не нагревали, либо нагревали в течение одного часа или нагревали в течение четырех часов.
Результаты:
Реологические кривые (измеренные при 25°С) для не нагретых двухкомпонентных (А=0) и тройных смесей показаны на ФИГУРЕ 14А. Реологические кривые (измеренные при 25°С) для двухкомпонентных (А=0) и тройных смесей, которые нагревали в течение одного часа, показаны на ФИГУРЕ 14В. Реологические кривые (измеренные при 25°С) для двухкомпонентных и тройных смесей, которые нагревали в течение четырех часов, показаны на ФИГУРЕ 14С.
Как показано на ФИГУРЕ 14А, для ненагретых смесей, вязкость уменьшалась с увеличением содержания альгината натрия, что можно было бы ожидать, если бы два более сильных загустителя (KM и XG) были бы замещены более слабым загустителем альгинатом натрия.
Как показано на ФИГУРЕ 14В, для смесей, которые нагревали в течение одного часа, тройные смеси с более высоким содержанием альгината натрия сохраняют свою вязкость более высокой, по сравнению со смесями с тем же соотношением альгината, которые не нагревались (показано на ФИГУРЕ 14А). Как показано на ФИГУРЕ 14С, для смесей, которые нагревали в течение четырех часов, вязкости были аналогичны тем, которые наблюдались после нагревания в течение одного часа. Эти результаты показывают, что нагревание тройной смеси, содержащей альгинат натрия, привело к тройному взаимодействию между полисахаридами.
ФИГУРЫ 15А и 15В иллюстрируют зависимость K и η от доли альгината натрия в смеси для 0,5% водных растворов смесей коньяка глюкоманнана, ксантановой камеди и альгината натрия с постоянным соотношением KM:XG (4,12:1) и различным количеством альгината (от 0 до 33%). ФИГУРА 15А наглядно иллюстрирует зависимость степенного закона значения K для ненагретых и нагретых тройных смесей от содержания альгината. Реологические кривые для растворов тройных смесей, которые не были подвержены термической обработке, соответствовали степенному закону и преимущественно показали снижение вязкости с возрастанием содержания альгината натрия. Как показано на ФИГУРЕ 15А для ненагретых растворов, степенная зависимость значения K показала небольшой первоначальный рост с увеличением содержания альгината натрия, но за мим последовало значительное снижение. Как оказалось, максимальное значение K соответствовало содержанию альгината натрия от 3 до 5%. Как показано на ФИГУРЕ 15В значение η увеличивалось (по отношению к ньютоновской вязкости) с возрастанием содержания альгината натрия в смеси. Это указывает на переход от высокой вязкости и псевдопластичности бинарной смеси коньяка глюкоманнана и ксантановой камеди (без альгината натрия) к значительно более низкой вязкости и меньшей псевдопластичности тройной смеси при 33% содержании альгината натрия. Эти результаты показывают, что альгинат натрия действует как слабый загуститель.
Можно было бы ожидать снижения значения K и увеличения η выше примерно на 5% альгината натрия, как показано на ФИГУРЕ 15А и ФИГУРЕ 15 В, если два более мощных загустителя (коньяк глюкоманнан и ксантановая камедь) были бы заменены более слабым, менее псевдопластичным загустителем (альгинатом натрия). Как показано на ФИГУРЕ 15А, аналогичные данные были получены для растворов, которые нагревали в течение одного часа, указывая на начальное снижение значения К за счет термической обработки при содержании альгината натрия приблизительно менее 5%, но при 11% и выше снижение значения К было гораздо менее крутым, чем в растворах, которые не нагревали. Максимальное значение K пришлось на термически обработанные растворы с несколько более высоким содержанием альгината натрия от 8% до 11% в тройной смеси. Как показано на ФИГУРЕ 15В, значение η термически обработанных растворов оставалось низким и не изменялось во всем диапазоне содержания альгината натрия. Для ограниченного количества растворов, нагреваемых в течение четырех часов, K и η были сходны с полученными для аналогичных растворов, которые нагревали только в течение одного часа (данные не показаны).
Сводка результатов:
В целом, эти результаты показывают, что термическая обработка тройного раствора значительно увеличивает общий уровень макромолекулярных взаимодействий. В отличие от ситуации во время обработки, когда реологические свойства до и после обработки остаются одинаковыми, эти образцы подвергались термической обработке в разбавленных растворах и состояли из недавно смешанных компонентов. Так как значение К для растворов порошковых смесей, содержащих от 0% до около 5% альгината натрия, фактически снизилось после термической обработки, этот более высокий уровень взаимодействия вряд ли был опосредован усилением взаимодействия между коньяком глюкоманнаном и ксантановой камедью.
В целом, эти данные свидетельствуют о том, что после термической обработки смеси альгинат натрия либо восстановил и укрепил взаимодействия между коньяком глюкоманнаном и ксантановой камедью, либо сам был вовлечен во взаимодействие с двумя другими полисахаридами в растворе. Таким образом, эти результаты предполагают, что альгинат натрия может быть добавлен к глюкоманману и ксантановой камеди в количестве более 8% до 20% в сочетании с термической обработкой без значительного ущерба для реологии бинарной смеси.
3, Седиментация в аналитической ультрацентрифуге
Обоснование:
Неожиданно высокая вязкость VFC (коньяк/ксантан/алы-инат (70:13:17)) гранул (т.е. смесь волокон была обработана при помощи грануляции с образованием комплекса, коммерческое название PGX®), также известный как PolyGlycopleX® (α-D-глюкуроно-α-D-манно-β-D-манно-β-D-глюко), (α-L-гулуроно-β-D-маннуроно), β-D-глюко-β-D-маннан (PGX®) привела нас к исследованию гидродинамических свойств смесей коньяка глюкоманнана, ксантана и альгината, о чем свидетельствует их скорость седиментации в аналитической центрифуге, для того чтобы найти взаимодействия на молекулярном уровне, которые могут обеспечить молекулярную основу этих макроскопических наблюдений. В этом исследовании использовалась техника скорости седиментации в аналитической центрифуге в качестве датчика для исследования свойств смесей, в которых глюкоманнан был доминирующим компонентом, дополненный ксантаном и альгинатом.
Методы:
Полисахариды
Все полисахариды, использованные в исследовании, были поставлены InovoBiologic Inc, (Калгари, Альберта, Канада), а именно: коньяк глюкоманнан, партия №2538; ксантановая камедь, партия №2504, и альгинат натрия, партия №2455/2639. Полисахариды изучались как индивидуально, так и в составе тройных смесей, содержащих гранулированный VFC (упомянутый в настоящем исследовании как «PGX®») и негранулированную VFB (упомянутую в настоящем исследовании как «ТМ1»). Образцы растворялись в деионизированной дистиллированной воде, а затем диализировались в растворы с ионной силой 0,0001 М, 0,001 М, 0,01 М, 0,1 М и 0,2 М в фосфатно-хлоридном буфере при pH ~6.8. Ионные силы > 0,05 М были дополнены за счет добавления NaCl.
Аналитическое ультрацентрифугирование
Техника скорости осаждения в аналитической ультрацентрифуге была использована в качестве детектора для исследования взаимодействия. Это метод без использования растворов имеет преимущество перед другими методами, так как не нуждается в колонках, мембранных материалах, иных средах для разделения или иммобилизации, которые могли бы нарушить или помешать феноменам взаимодействия (S.E. Harding Analytical Ultracentrifugation Techniques and Methods, pp.231-252, Cambridge: Royal Society of Chemistry (2005)). Использовалась ультрацентрифуга Beckman XL-I, оснащенная преломляющей оптикой Рэлея. Данные были получены с помощью камеры на ПЗС. Первоначальное сканирование было выполнено при низкой скорости вращения ротора 3000 оборотов в минуту для контроля наличия частиц с очень высокой молекулярной массой (которые не были обнаружены), до корректировки скорости вращения до 45000 оборотов в минуту. Коэффициенты седиментации s были скорректированы для стандартных условий плотности и вязкости воды при 20,0°С для получения S20,w. Сканирование выполнялось с двухминутным интервалом в течение времени работы ~12 часов. Данные были проанализированы с точки зрения распределения коэффициента седиментации распределение g(s) по сравнению с s (см., например, S.E.Harding, Carbohydrate Research 34: 811-826 (2005)), используя «метод наименьших квадратов g(s)» алгоритм SEDFIT (Dam & Schuck, Methods in Enzymology 384:185 (2003)), основанный на конечно-элементном анализе методом Claverie etal., Biopolymers 14: 1685-1700 (1975). Анализ изменений в распределении коэффициента седиментации использовался для установления наличия взаимодействия. Суммарная нагрузочная концентрация 2,0 мг/мл либо 0,5% (0,5 г в 100 г воды) использовалась для контроля и смесей.
Результаты и обсуждение
Целостность реагентов
Коньяк глюкоманнан, ксантан и альгинат были сначала охарактеризованы при помощи аналитической ультрацентрифуги для установления их молекулярной целостности.
ФИГУРА 16 наглядно иллюстрирует кажущееся распределение по коэффициентам седиментации g*(s) по сравнению с коэффициентом седиментации (s) для глюкоманнана (ФИГУРА 16А), альгината натрия (ФИГУРА 16В) и ксантана (ФИГУРА 16С) при загрузочной концентрации 2 мг/мл и при 1=0,0. Скорость вращения ротора 45000 оборотов в минуту, температура = 20,0°С. По оси ординат отражает количество полосок на единицу Сведберга (S), а по абсциссе - единицы Сведберга.
ФИГУРА 17 наглядно иллюстрирует кажущееся распределение по коэффициентам седиментации для необработанной/негранулированной VFB (TM1) при ионных силах 0-0.2М (ФИГУРА 17А); TM1 при ионных силах 0-0,01 М (ФИГУРА 17В); гранулированного VFC (PGX®) при ионных силах 0-0,01 М (ФИГУРА 17С); и гранулированного VFC (PGX®) при ионных силах 0-0,02М (ФИГУРА 17D). Скорость вращения ротора 45000 оборотов в минуту, температура = 20,0°С.
ФИГУРА 18 наглядно иллюстрирует влияние ионной силы (выраженной в единицах молярной концентрации М) на количество материала с коэффициентом седиментации > 3,5S для необработанной/негранулированной VFB (TM1) (ФИГУРА 18А); или гранулированного VFC (PGX®) (ФИГУРА 18 В). Для облегчения логарифмической шкалы значение 1=0,00 представлено при 1=0,00001 М.
Унимодальные участки были замечены во всех случаях для кажущегося распределения по коэффициентам седиментации (ФИГУРЫ 16А, В, С). В этих условиях коньяк глюкоманнан обладает видимым средневзвешенным коэффициентом седиментации s20,w ~1,6S, альгинат ~1,3S и ксантан ~3,5S, где 1S=10-13 сек.
Формирование комплекса и влияние добавления электролита
Участки распределения по коэффициентам седиментации были затем созданы для следующих тройных смесей: необработанной/негранулированной/ненагретой VFB (ТМ1) (ФИГУРЫ 17А, В) и гранулированного/термически обработанного VFC (PGX®) (ФИГУРЫ 17С, D) в той же суммарной загрузочной концентрации, использованной для контроля (2 мг/мл), до максимума в 10S. Как наш критерий взаимодействия, мы оценивали количество материала с кажущимся коэффициентом седиментации больше, чем самый высокий из осаждающихся образцов контроля - ксантан: седиментация материала > 3,58 рассматривалась, как критерий взаимодействия продуктов.
ТАБЛИЦА 17 показывает концентрацию осаждающегося материала > 3.5S. Концентрация нагрузки на ячейку ультрацентрифуги в каждом случае была равной 2,0 мг/мл.
ТАБЛИЦА 17 показывает явное увеличение концентрации осаждающегося материала для смесей ТМ1 и гранулированного VFC по сравнению с отдельными компонентами, хотя есть еще значительная часть непрореагировавшего материала, особенно при низких коэффициентах седиментации (~2S). ФИГУРА 18 и ТАБЛИЦА 18 также демонстрируют влияние увеличения ионной силы на появление веществ с более высокой седиментацией.
ТАБЛИЦА 18 показывает результаты влияния ионной силы на ТМ1 (необработанный/негранулированный VFB). Концентрация нагрузки на ячейку ультрацентрифуги в каждом случае была равной 2,0 мг/мл.
ТАБЛИЦА 19 показывает результаты влияния ионной силы на PGX® (гранулированный VFC). Концентрация нагрузки на ячейку ультрацентрифуги в каждом случае была равной 2,0 мг/мл.
Видно, что для обеих гранулированных и негранулированных смесей значительное количество материала с более высокой седиментацией наблюдалось при ионной силе 0,01 М, выше которой появление такого материала подавлялось (ФИГУРЫ 18А, В). ФИГУРА 18А наглядно демонстрирует влияние ионной силы (выраженной в единицах молярной концентрации М) к количеству материала с коэффициентом седиментации > 3,58 для необработанной/негранулированной VFB (TM1). ФИГУРА 18В наглядно иллюстрирует влияние ионной силы (выраженной в единицах молярной концентрации М) к количеству материала с коэффициентом седиментации > 3,58 для гранулированного VFC (PGX®).
Распределение коэффициентов седиментации тройных смесей
Распределение коэффициентов седиментации для смесей, содержащих фиксированное соотношение глюкоманнана: ксантановой камеди и различные концентрации альгината (от 0% до 33%). Смеси были либо не нагреты (0), либо нагреты в течение одного часа (H1) или четырех часов (Н4).
Распределение коэффициентов седиментации определялось из образцов в деионизированной дистиллированной воде при общей концентрации нагрузки 5 мг/мл (0,5%). Результаты для ненагретых образцов показаны на ФИГУРЕ 19А. Результаты для нагретых образцов показаны на ФИГУРЕ 19В. Как показано на ФИГУРАХ 19А и В, в отсутствии альгината никаких существенных взаимодействий между продуктами бинарной смеси глюкоманнана: ксантановой камеди с преимущественным содержанием глюкоманнана не наблюдалось как для ненагретых образцов (АО), так и для нагретых в течение одного часа (А0Н1) или четырех часов (А0Н4) с распределением коэффициента седиментации, сходным с контрольным образцом глюкоманнана (см. Abdelhameed et al., Carbohydrate Polymers, 2010). Однако ситуация меняется в присутствии альгината. Как показано на ФИГУРЕ 19А, ненагретая тройная смесь показала некоторое взаимодействие при содержании альгината 13%, 17%, 21% и до 24%, основанное на появлении веществ с более высоким коэффициентом седиментации, но никакого существенного влияния альгината не наблюдалось при его концентрации выше 27%. Для нагретых образцов, как показано на РИСУНКЕ 19В, отмечалось образование комплексов при концентрации альгината около 8% в соответствии с реологическими измерениями. Следует отметить, что некоторые образцы с большим содержанием альгината, которые нагревались в течение часа, такие как А21Н1 (21% смесь альгината, нагреваемая в течение часа), А24Н1, А27Н1, А30Н1 и все образцы, которые нагревались в течение четырех часов и содержали альгинат, сформировали гели после процесса термической обработки и не могли быть проанализированы при помощи метода оценки скорости седиментации. Это предполагает наличие взаимодействия в оригинальных растворах достаточной силы, чтобы перевести их в состояние геля. В противоположность этому молекулярные взаимодействия в ненагретых растворах были недостаточными для формирования такого феномена гелеобразования.
Выводы
Смеси глюкоманнана, ксантана и альгината демонстрируют наличие продуктов взаимодействия, которые могут быть удалены путем добавления умеренного количества электролита. Эти наблюдения согласуются с взаимодействием в тройных смесях, которое может быть подавлено путем добавления поддерживающего электролита с ионной силой выше 0,01 М. Взаимодействие не является стехиометрическим, поскольку значительная часть материала осаждается при низких коэффициентах седиментации (<3,5S при рассмотренных выше условиях).
4. Сравнительное лечение VFC и альгинатом натрия с кальцием хлоридом
Обоснование:
Гранулированный VFC (PGX®) образует в воде растворы с высокой вязкостью, но не образует вязкий гель. Описанные выше результаты согласуются с образованием сложных взаимодействий трех компонентов (коньяка глюкоманнана, ксантановой камеди и альгината) на уровне полимеров. Для того чтобы определить может ли альгинат быть отделен от VFC, был проведен эксперимент для проверки возможности отделения альгината от VFC в растворе ионов кальция. Альгинаты известны тем, что имеют кальций опосредованное осаждение и гелеобразующие характеристики (K.Clare, "Algin," in Whistler R.L. and BeMiller J.N. Eds., Industrial Gums, Academic Press 116 (1993); A. Haug et al., Acta Chem. Scand. 19:341-351 (1965)). Чистые растворы альгината натрия реагируют сильно и мгновенно на добавление ионов кальция с образованием либо преципитатов, либо гелей в зависимости от режима добавления кальция (Clare et al. (1993); Haug et al. (1965)). Таким образом, в типичной реакции гелеобразования нерастворимая соль кальция, такая как безводный кальция дифосфат, добавляется в раствор альгината натрия с последующим добавлением медленно распадающейся кислоты, такой как глюконо дельтаацетон, которая вызывает медленное высвобождение ионов Ca++ с формированием однородного геля. Если, однако, ионы кальция Ca++ добавляются быстро, как в случае с хлористым кальцием, то происходит мгновенное выпадение осадка. Полигулуроновые сегменты молекулы альгината известны тем, что наиболее прочно связываются с ионами Ca++ (Kohn etal., Acta Chemica Scandinavica 22:3098-3102 (1968)), но если эти сегменты становятся менее доступными вследствие взаимодействия с одним или двумя другими полисахаридами, преципитация альгината кальция может быть ограничена.
Методы:
Аликвоты растворов необработанной VFB (TM1) и обработанного/гранулированного VFC (PGX®) в деионизированной дистиллированной воде при 0,5% (0,5 г в 100 г воды) были разбавлены до 0,1, 0,05 и 0,01% в процентах по массе. Для каждой концентрации в раствор добавили 5 мл 10% раствора CaCl2.2H2O и тщательно перемешивали до образования концентрации ионов Ca2+ 0,5%. Точно такое же добавление ионов Ca2+ было сделано к (1) параллельным сериям контрольных растворов чистого альгината натрия, содержащего те же самые концентрации альгината, как и в растворе необработанной VFB (TM1) и обработанного/гранулированного VFC (PGX®); и (2) растворы бинарных смесей либо коньяка глюкоманнана, либо ксантановой камеди с альгинатом натрия, содержащих те же концентрации альгината натрия (измеренные в г на 100 г воды) и те же относительные пропорции двух полисахаридов, как в 0,5% растворах необработанной VFB (TM1) и обработанного/гранулированного VFC (PGX®). Растворы выдерживали в течение 30 минут перед визуальным осмотром на наличие/отсутствие осадка. Результаты:
Результаты показаны ниже в ТАБЛИЦЕ 20.
Как показано в результатах, приведенных в ТАБЛИЦЕ 20, видно, что в присутствии 0,5% ионов Ca++, которые будут осаждать альгинат кальция до уровня не менее 0,0075%, нет никаких признаков высаживания в растворах гранулированного VFC (PGX®) до эквивалентного уровня альгината. Этот вывод согласуется с тем, что компоненты VFB/C взаимодействуют в растворе, формируя зоны соединений и сети (т.е. на вторичном и третичном уровне полисахаридной структуры), которые затем предохраняют отдельные компоненты от проявления способностей, которые они могли бы продемонстрировать в чистом виде. Осадки альгината кальция были сформированы в соответствующих растворах альгината натрия, кроме наиболее разведенного раствора, который содержал недостаточное количество альгината, чтобы быть осажденным 0,5% ионами Ca++.
Вывод:
В этом исследовании было показано поведение альгината в гранулированном VFC (PGX®), отсутствие высаживания или образования геля при быстром введении ионов кальция после добавлении кальция хлорида. В параллельном контрольном эксперименте кальций хлорид добавлялся к чистым растворам альгината натрия в снижающейся концентрации, что привело к мгновенному осадку альгината кальция, даже при очень низкой концентрации альгината. Эти результаты показывают, что полигулуроновые сегменты макромолекулы альгината, которые обычно прочно связываются с ионами Ca++ в растворе, были менее доступны (или недоступны) для такого взаимодействия в растворах VFB/C, где помимо альгината натрия присутствовали коньяк глюкоманнан и ксантановая камедь. Это может быть связано с этими сегментами в макромолекуле, которые менее доступны или недоступны для ионов Ca++ вследствие альтернативных взаимодействий с одним или двумя другими полисахаридами. Осадки альгината кальция наблюдались при добавлении ионов Ca++ к бинарным растворам либо коньяка глюкоманнана, либо ксантановой камеди с альгинатом натрия, которые предполагают, что для взаимодействия альгинат натрия нуждается в присутствии двух других полисахаридов.
Обсуждение общих результатов
Результаты первичного структурного анализа VFB/C, описанного в примере 5, показывают, что после грануляции первичные структуры компонентов полисахаридов, присутствующих в гранулированном VFC, остаются неизменными и что не возникает ковалентных взаимодействий ни до (ТМ1), ни после обработки, включающей термическую обработку (гранулированный VFC). Однако результаты анализа макромолекулярных ассоциаций, описанных в данном примере, показывают, что нековалентные взаимодействия происходят, что приводит к новому полисахаридному комплексу, который образуется в VFB/C на макромолекулярном уровне. Реологические исследования ясно показывают, что вязкости растворов как необработанной/негранулированной VFB (ТМ1), так и гранулированного VFC (PGX®) значительно выше, чем этого можно было бы ожидать от сочетания загущающих свойств индивидуальных полисахаридов в смеси. Общие реологические характеристики VFC в растворе ближе к отдельному раствору ксантановой камеди, но вязкость VFC даже выше, чем у ксантановой камеди. Учитывая, то, что конструкция VFC, исследуемая в данном примере (70% KM, 17% ксантана, 13% альгината натрия), содержит только 17% сильнейшего из загустителей, ксантановой камеди, и 83% более слабых загустителей, коньяка маннана (70%) и альгината натрия (13%), то можно было ожидать, что его реологические свойства в воде будут похожи на таковые у коньяка маннана. Однако было установлено, что реологические свойства раствора VFC были на самом деле ближе к таковым у ксантановой камеди, а его вязкости были даже выше, чем у ксантановой камеди.
Дальнейшие исследования реологии и седиментации растворов тройных смесей, содержащих переменное количество альгината, приготовленных в лаборатории, подтвердили взаимодействие трех компонентов, а термообработка растворов его усилила, особенно когда содержание натрия альгината в смеси было более 5%. Кроме того, эксперименты с добавлением ионов Ca++ показали, что для предотвращения осаждения альгината кальция необходимо присутствие двух других полисахаридов.
Эти результаты показывают, что в растворе альгинат натрия взаимодействует с коньяком глюкоманнаном и ксантановой камедью, создавая сети и зоны соединения, с образованием сложного полисахарида следующей номенклатуры: α-D-глюкуроно-α-D-манно-β-D-манно-β-O-глюко), (α-L-гулуроно-β-D-маннуроно), β-D-глюко-β-D-маннан.
Как описано в примерах 1-4, было установлено, что назначение гранулированного VFC (PGX®) является полезным для профилактики, лечения или облегчения одного или нескольких симптомов, связанных с нарушением обмена веществ или расстройством, таким как метаболический синдром, сахарный диабет I типа, диабет II типа, заболевание поджелудочной железы или гиперлипидемия, у субъекта, нуждающегося в этом.
В то время как иллюстративные варианты были проиллюстрированы и описаны, следует иметь в виду, что различные изменения могут быть сделаны без отступления от сущности и объема настоящего изобретения.
Реферат
Изобретение относится к фармацевтической промышленности и представляет собой лечебное питание для профилактики, лечения или облегчения одного или нескольких симптомов, связанных с нарушением обмена веществ или расстройством его обмена, содержащее композицию из полисахаридных пищевых волокон высокой вязкости, включающую вязкую смесь волокна или его комплекс, состоящий из от 48% до 90% в процентах по массе глюкоманнана, от 5% до 20% в процентах по массе ксантановой камеди и от 5% до 30% в процентах по массе альгината, а также, по крайней мере, один макроэлемент, выбранный из группы, состоящей из белка, углевода и жира, где лечебное питание составлено для обеспечения дозы композиции полисахаридного пищевого волокна высокой вязкости от 20 г/день до 35 г/день в течение периода времени, эффективного для профилактики, лечения и облегчения одного или нескольких симптомов, связанных с нарушением обмена веществ или его расстройством. Изобретение обеспечивает расширение арсенала средств, предотвращающих, облегчающих или лечащих одно или несколько симптомов, связанных с нарушением обмена веществ или заболеванием обмена веществ. 4 н. и 10 з.п. ф-лы, 6 пр., 20 табл., 48 ил.

Комментарии