Способ получения 9-деокси-9а-метилен-изостеров пгj @ или их лактонов - SU1360582A3
Код документа: SU1360582A3
Описание
эфиров; превращение соединения (I) в лактон и разделение смеси изомеров, Испытания соединений формулы (I) показывают , что они по противоязвенной
1
Изобретение относится к способам получения новых производных проста- циклина, в частности 9-деокси-9а-т4е- тилен-изо стеров ПП общей формулы
(снг))тг R/
- , с . -
(CH2)(CHi)t .
(I)
«t
tie
Рг У -СШг - - сНгЪгКв
где R.
D .один из
свободная или килзтерифицированная кар боксильная группа;
- группа -CHj-, -СН-ОН;
Rj
- водород, а другой - водород или гидроксил; из .
RJ- - водород или -алкил,
а другой - оксигруппа й из R - независимо водород, С -С алкил или фтор; X - группа (СН 2)т (где
или 1), или -0-; , Y - группа -CHz-CHj-, -С5С-;
р
- S.
н
(транс)
/или -NH-CO-;
т и т каждый равен 0; 1 или 2;
п О; I или 2; п 0; 1; 2 или 3 р О или 1; и q 1 или 2, причем сумма р + q является целым числом от 1 до 3;
RJ - водород, С,-С -алкил,
циклогексил, фенил, татра . гидрофурил или 2-фурил или их лактонов, обладающих ценными фармакологическими свойствами.
активности превосходят известные, т.е. эффективная доза составляет 55- 664 против 200 мкг/кг, 3 табл.
,
-
Цель изобретения - получение новых производных простациклинов, обладающих улучшенной противоязвенной и антиагрегационной активностью,
5/ Пример-,
Стадия А, 1,1 г (0,029 моль) бор-, .Гидрата натрия.добавляют при перемешивании в раствор 11,6 г (8,4 х X 10 моль) бицикло 3,3,01 окт-3, 7
О диона в 100 мл хлористого метилена и 100 мл этанола. Через 45 мин избыток реагента разлагают медленным добавлением 20 мл ацетона. Смесь нейтрализуют 1,4.мл уксусной кислоты и
упаривают в вакууме, до получения остатка , который затем помещают в воду и хлористый метилен. Органическую фазу упаривают досуха и фильтруют на .силикагеле (элюент: смесь гексана и
20 этилового эфира 70:30), в результате чего получают 9,1 г.7-оксибицикло 3,3,0 JoKTaH-3-она,
ИК-спектр (пленка), см 3400; . 1740,. .
Раствор этого соединения
(0,065 моль) в 27 мл безводного ди- метилформамида обрабатывают 12,8 г хлористого диметил-трет-бутилсилила (ДМТБ-силил или ДМБ-силил) и 8,85 г
30 имидазола. Полученную смесь нагрева-г ют до 60°С в течение 5 ч, охлаждают, разбавляют двумя объемами воды и экстрагируют этиловым эфиром (3x40 мл и 2x20 мл), Объединенные органичес35 кие экстракты промывают 5%-ным NaHCOg, а затем водой до полной нейтрализации и упаривают досуха, получая 15,8 г сырого продукта (выход 95%), После очистки на силикагеле полу40 чают 2,85 г 7-экзоокСибициклоГз,3,0 октан-3-он-7-ДМТБ-сш1илового простого эфира с т, пл, 40-42°С и 11,8 г 7-эндооксибицикло 3,3,0 октан-3-он- -7-ДМТБ-силилового простого эфира с
45 т. пл, 51-52 С, Раствор последнего . (11,8 г 4,63x10 моль) в 295 мл метилкарбоната () перемешивают с исключением воды в инертной атмосфере и осторожно обрабатывают 6,95 г 80%-ного гидрата натрия. Когда выделение водорода прекращается, реак- ционнуя смесь нагревают при 75-80 С в течение 40 мин. После охлаждения смесь разбавляют двумя объемами эти-
левого эфира и осторожно обрабатыва- ю подкисляют до рН 5,I и экстрагируют
ют 13 г ледяной уксусной кислоты. Затем отделяют органическую фазу буфером с рН 5,2-5,5 и водный слой экстрагируют этиловым эфиром. Объединенные органические экстракты сушат над NajSO и упаривают досуха, получая 12,82 г: d,l-2-экзoкapбoкcи- метил 7-эндооксибидикло 3,3,0 октан- .-3-он-7-ДМТБ-силилового эфира и 14,49 г (85 от теоретического) его 7-экзоизомера (карбоксиметил CHj-O- -СО-, часто называемый как метакси- карбонил),
После очистки на силикагеле (45 г/г, элюент: гексан - этиловый эфир 97:3) получают 10,81 г чистого продукта; ;,c(kc 254 ммк, 7000,
Исходя из 7-экзоизомера в соответствии с этой же методикой получают d,1-2-экзокарбоксиметил-7-эзокси- оксибицикло 3,3.0 октан-3-он-7-ДМТБ- . силиловый простой эфир; 254 ммк, 6500.
Стадия Б, Раствор (7,5 г) d,l-2- -экзокарбоксиметил-7-эндооксибицик- ло 3,3,0 октан-3-он-7-ДМТБ-силилово- го эфира в 75 мл дихлорметана и 75 мл этанола охлаждают до -20 С и обрабатывают при перемешивании 0,9 г боргидрида натрия. После перемешивания в течение 15 мин избыток реагента разлагают, добавляя 12 мл ацетона Температуру смеси доводят до 0°С,
этилацетатом. Упаривание органическо го слоя дает 5,1 г d,1-2-экзокарбок- си-3,7-эндодиоксибицикло ГЗ,3,0 JOK- тан-7-ДМТБ-силилового эфира. Раствор
15 этого соединения в 150 мл ацетонит- рила обрабатывают затем 2,81 г d-(+) -эфедрина. Через 4 ч при комнатной температуре получают 2,9 г соли, которую кристаллизуют дважды из ацето20 нитрила, получая 1,85 г d-(+)-эфeд-
риновой соли, (+)-2-экзокарбокси-3,7 -эндодиоксибицикло 3.3,0 октан-7- -даТБ-силилового эфира, 52°, Все маточные растворы собирают и упа
25 ривают досуха, получая остаток, который растворяют в воде и обрабатывают 0,68 г гидроокси натрия в воде, d-(+)-Эфедрин выделяют экстракцией бензолом, а раствор натриевой соли
30 подкисляют до рН 5 и экстрагируют этилацетатом. Органическую фазу упаривают досуха, получая остаток, который обрабатывают 2,2 г 1-эфедрина и после нескольких перекристаллиза-
25 ций получают 2,3 г 1-эфедриновой
соли (-)-2-экзокарбокси-3,7-эндо- I диоксибициклоГ3,3,0 октан-7-ДМТБ- силилового эфира, с/ J) -49.
Стадия В. Раствор (6,28 г) d,l40 3,7-эндодиок сибицикло 3.3,0 октан- -7-ДМТБ-силиловый эфир-2-экзокарбок- симетилового сложного эфира в 30 мл безводного хлористого метилена обрабатывают 2,19 г 2,3-дигидропирана и
40 3,7-эндодиок сибицикло 3.3,0 октан- -7-ДМТБ-силиловый эфир-2-экзокарбок- симетилового сложного эфира в 30 мл безводного хлористого метилена обрабатывают 2,19 г 2,3-дигидропирана и
добавляют 20 мл 20%-ного КН РО, растворитель выпаривают в вакууме и ос- 45 пара-толуолсульфокислоты и по- таток несколько раз экстрагируют этиловым эфиром. Объединенные органические экстракты промывают 5 мл воды и
лучают 3-тетрагидропираниловый (ТГП) эфир исходного 3-спирта, Спустя 3 ч при комнатной температуре реакционную смесь промывают 5%-ным NaHCOj (2x5 мл), Упаривая органическую фазу досуха, получают 8 г d,l-2-экзo- карбоксиметил-3,7-эндодиоксибицик- ло З . 3 , О октан-7-ДМТБ-силиловый эфир-3-ТГП-простой эфир, который СП затем сушат, помещая в безводный бензол (2x15 мл), и упаривают досуха. Этот продукт в 30 мл безводного этилового эфира по каплям добавляют через 15 мин к перемешиваемой суспенупаривают досуха, получая остаток, который кристаллизуют из н-гексана и получают 4,8 г d,1-2-экзо-(карбокси- метил) -3, 7-эндодиоксибицикло 3 .-3,0 октан-7-ДМТБ-силилового эфира, т, пл 68-70°С, Маточный раствор адсорбируют на 25 г силикагеля, элюируют смесью н-гептан - этиловый эфир 90:10.
Получают еще 2 г продукта, достаточно чистого, чтобы использовать его без дополнительной оггастки.
Раствор (6 г) б,1-2-экзокарбоксиметил-3 ,7-эндодиоксибицикло ГЗ.З. тан-7-ДМТБ-силилового эфира в 100 мл смеси метанол - вода 80:20 обрабатывают 2 г гидроокиси калия и нагревают до температуры кипения с обратным холодильником в течение 30 мин. После концентрирования в вакууме смесь
этилацетатом. Упаривание органического слоя дает 5,1 г d,1-2-экзокарбок- си-3,7-эндодиоксибицикло ГЗ,3,0 JOK- тан-7-ДМТБ-силилового эфира. Раствор
этого соединения в 150 мл ацетонит- рила обрабатывают затем 2,81 г d-(+)- -эфедрина. Через 4 ч при комнатной температуре получают 2,9 г соли, которую кристаллизуют дважды из ацетонитрила , получая 1,85 г d-(+)-эфeд-
риновой соли, (+)-2-экзокарбокси-3,7- -эндодиоксибицикло 3.3,0 октан-7- -даТБ-силилового эфира, 52°, Все маточные растворы собирают и упаривают досуха, получая остаток, который растворяют в воде и обрабатывают 0,68 г гидроокси натрия в воде, d-(+)-Эфедрин выделяют экстракцией бензолом, а раствор натриевой соли
подкисляют до рН 5 и экстрагируют этилацетатом. Органическую фазу упаривают досуха, получая остаток, который обрабатывают 2,2 г 1-эфедрина и после нескольких перекристаллиза-
ций получают 2,3 г 1-эфедриновой
соли (-)-2-экзокарбокси-3,7-эндо- диоксибициклоГ3,3,0 октан-7-ДМТБ- силилового эфира, с/ J) -49.
Стадия В. Раствор (6,28 г) d, ,7-эндодиок сибицикло 3.3,0 октан- -7-ДМТБ-силиловый эфир-2-экзокарбок- симетилового сложного эфира в 30 мл безводного хлористого метилена обрабатывают 2,19 г 2,3-дигидропирана и
пара-толуолсульфокислоты и по-
пара-толуолсульфокислоты и по-
лучают 3-тетрагидропираниловый (ТГП) эфир исходного 3-спирта, Спустя 3 ч при комнатной температуре реакционную смесь промывают 5%-ным NaHCOj (2x5 мл), Упаривая органическую фазу досуха, получают 8 г d,l-2-экзo- карбоксиметил-3,7-эндодиоксибицик- ло З . 3 , О октан-7-ДМТБ-силиловый эфир-3-ТГП-простой эфир, который затем сушат, помещая в безводный бензол (2x15 мл), и упаривают досуха. Этот продукт в 30 мл безводного этилового эфира по каплям добавляют через 15 мин к перемешиваемой суспензии 0,6 г LiAlH в 40 мл безводного этилового эфира, Перемеши-зание продолжают в течение 30 мин до разрушения избытка реагента осторожным добавлением 5 мл ацетона, а затем вод- ого насыщенного раствора этилового эфира, затем добавляют 10 г безводного сульфата натрия. Фильтрование органического раствора и упаривания IQ его досуха дает 7,2 г 3-ТГП-просто- го эфира, d,1-3,7-ЭНДОДИОКСИ-2-ЭКЗО- оксиметилбицикло t3,3,0 рктан-7-ДМТБ- силилового эфира, 370, .
Аналогично получают из оптически 15 активных исходных веществ следующие соединения:
,7-эндодиокси-2-экзооксиме- тилбицикло 3,3,0 октан-7 ДМТБ-силило- вый эфир-3-ТГП-простой эфир. 20
Энт-3,7 эндодиокси-2-экзодиокси- метилбицикло 3,3.0 октан-7-ДМТБ-си лиловый эфир-3-ТГП-простой эфир.
Если вместо 2,3-дигидропирана ис- польззпот 1,4-диокси-2-ен-, то полу- 25 чают соответствующие 3/2 -диоксанил (ДИОКС)-простые эфиры-.
Стадия Г, Раствор (3,8 г) d, 1-3,7- .эндодиоксибицикло 13,3,0 октан-2-эк- зо-карбоксимет-иловый сложный эфир-7- зо -ДМТБ-силильный простой эфир в 40 мл бензола обрабатывают сначала 3,66 г бензойной кислоты и 7,9 г трифенил-. фосфина, а затем при перемешивании . 5,30 г этил-азо-бис-карбоксилата в 5 мл бензола. После перемешивания в течение 40 мин органическую фазу промывают 2 н, серной кислотой (2x20 мл), а затем карбонатом натрия (3x15 мл) и водой до нейтральности, Упаривани- до ем досуха получают смесь d,l-2-3K3O- карбоксиметил-З-экзо-7-эндодиокси- бицикло 3,3,0 октан-7-ДМТБ-сш1иловый эфир-3-бензоата, ЯМР, с/ , ррт: 5,8 (Н, м,, 3-эндо); 3,32 (Н, д.д,, 2-эн- 45 до); 3,64 (ЗН, с,, COjCHj); 4,4 (Н, м., 7-эндо) и d,l-2-экзo-(кapбoкcи- метил)-7-эндооксибицикло З,3,03окт- -3 -ен-7-ДМТБ-сш1илового эфира, М 296,50
Неочищенный реакционный продукт растворяют в безводном метаноле, перемешивают в течение 3 ч и обрабатывают 0,5 г безводного карбоната калия . Упариванием досуха получают ос- gg таток, который помещают в этилацетат и насьгщенный , Органическую фа- sy промывают до нейтральности и рйвают досуха. Остаток адсорбируют
35
5
о о 5 0
g
5
на силикагеле и элюируют гексаном и i смесью гексан - этиловый эфир,;
Получают 1,0ld,l 2 кapбoкcимeтил 7-эндooкcибициклo р,3,OjoKT 3 eH 7 ДМТБ силилЬвого эфира, который растворяют в метаноле, обрабатывают 0,3 г 50%-ного Pd на CaCOj и гидрируют при комнатной температуре и нор мальном давлении, получая d,1-2-(кар- боксиметил)-7-эндооксибицикло ГЗ,3,0 3 октан-7-ДМТБ--г илиловый эфир, М 298,
2,01 г d,l-2-(карбоксиметил)-З- -экзо 7-зндодиоксибицикло 3,3, тан-2 7-ДМТБ -силилового эфира, который омьшяют аналогично стадии В 5%-ным карбонатом калия в смеси метанол - вода 80:20, получая d,l-2- -экзокарбокси-З-экзо-7-эндодиокси- бицикло 3,3,0 октан-7-ДМТБ-сш:иловый эфир, ,
Продукт затем разделяют на индивидуальные оптические антиподы (+) и (-) амфетамином.
Взаимодействием с эфирным диазо- метаном превращают- (+)-изомер 2--экзо- карбокси 3 экзо-7-эндодиоксибицикло 3,3,0 октан-7 ДМТБ-силилового эфира в его метиловое сложноэфирное производное . Взаимодействием с 2,3 дигид- ропираном с последующим восстановлением LiAeH в этиловом эфире получают (+)-3 экзо-7-эндодиокси-2-зкзо- оксиметилбицикло 3,3,0 октан 3-ТГП- эфир-7-ДМТБ-силиловый эфир, М 370, Аналогично получают (-)-энантиомеры и paцe шчecкиe смеси.
Стадия Д, Раствор (О,74)d,1-2- -экзооксиметил-3-экзо-ТП1-окси-7- -зндо-ДМТБ-силилоксибидикло 3,3,0 октана в 15 мл безводного хлористого метилена добавили к раствору 3,1 г реагент Коллинза в 40 мп безводного хлористого метилена при перемеши ва- нии и охлаждении до 0-5°С, После перемешивания в течение 15 мин полученную смесь фильтруют, получая проз- рачный раствор соответствующего d,1-2-экзоформильного производного, Затем органическую фазу нейтрализуют избытком водного раствора NaHjPO и выделяют. После сушки ее упаривают досуха, остаток очищают на силикагеле (злюент: смесь циклогек- сана и этилового эфира) и получают 0,81 г d,l-2-3K3ot3 -OKCo-HOH-l - -транс-1 -енил 3-экзо-ТГТ1-окси-7 -эндо-ДМТБ-сш1илоксибицик11о 3, 3,01октана , масло, 228 ммк, 8940.
Стадия Е. Раствор (1,05 г) d,l- --2 экзооксиметил 3 эндо--ТП1 окси 7- -эндр-ДМТБ-силилоксибициклоСЗ. 3. OloK тана из стадии В в 8 мл смеси бензол метилсульфоксид (ДМСО) 75:25 обрабатывают 0,89 г дициклогексил- карбодиимида, а затем при перемешивании I,42 МП раствора пиридинийтри™ фторацетата. После перемешивания в течение 3 ч добавляют 20 мл бензола и избыток карбодиимида гасят О,13 г щавелевой кислоты в, 3,8 мп воды. Бензольную фазу отделяют, промывают до нейтральности и концентрируют в вакууме, получая раствор 2-экзо-фор мил-3-эндо-ТП1-окси 7 эндо ДМТБ-си лилоксибициклоГЗ,3,0 октана (не выделялся ), Аналогично получают d,l- нат- и энантиоформильные производные .
Если по примерам 1 - .3 используют 7-экзооксибицикло СЗ.3.о октан-3 -он 7-ДМТБ силиловый эфир, получают 2-экзоформил-3-эндо-ТП1-окси-7-экзо- -ДМТБ-силилоксибицикло 3.3.0 октан.
Стадия Ж. 322 мг раствора (2-ок- со-гептш1)-диметилфосфоната в 5 мл бензола добавляют к суспензии 43,5м 80%-ного NaH в 10 мл бензола. Полученную смесь перемешивают до прекращения выделения водорода. В темноте добавляют 258 мг тонко измельченного N-бромсукцинимида, и перемешивание продолжают еще в течение 5 мин. Затем добавляют 0,37 г 2-экзоформил- 3 эндо ТП1 окси-7-ДМТБ-сш1Илокси- бицикло 3. 3.0 октана из .стадии Е в 5 мл бензола. Полученную смесь перемешивают еще в течение 15 мин, после чего реакционную смесь распределяют между бензолом и 15%-HMMNaH2P04 Органическую фазу сушат, концентрируют до небольшого объема, адсорбируют на силикагеле и элюируют смесью циклогексан - зтиловый эфир 80:20, получая 0,42 г 2-экзр- 2 -бром-3 - -оксо-окт- -транс-енил -3-эндо-ТГП -окси 7 эндо-ДМТБ-силилоксибицикло 3.3.0 октана, (. 251 ммк, 9250.
Если используют (2-оксо-ЗК--фтор- гептил)-диметилфосфонат, то получают
соответствунщее 2-экз о-(2 бром-3 - -оксо-4 R-фтор-окт-l -транс-енил)производное ,А 8940.
меок Макс
252 ммк,
0
5
5
0
5
0
5
0
5
Стадия 3. 0,3 г раствора (2--оксо -4-2 ) тетр агидрофурил бутил -диметил- фосфоната по каплям добавляют к перемешиваемой суспензии 36 мг 80%-ного гидрида натрия в 5 мп бензола. Перемешивание продолжают до прекращения выделения водорода, а затем добавляют раствор 0,37 г 2 экзоформш1- -З-зндо-ТГП-окси-7-зкзо-даТБ-силил- оксибициклоГЗ.3.0 октана из стадии Е. После перемешивания еще в течение 20 мин смесь помещают в бензол и 20%-ный водный мононатрийфосфат, Ор ганическую фазу отделяют, концентрируют до небольшого объема, адсорбируют на силикагеле и элюируют смесью бензол - этиловый эфир, получая 0,35 г 2-экзо-ГЗ -оксо-5 (2)-тетрагидрофу- рилпент-l -транс-енил 3 -эндо ТГП ок- си-7-экзо-ЛМТБ-силилоксибицикло 3.3.О октана, Л, 229 ммк, 8800,
Стадия И. При применении 2-экзо- формил-3-эндо ТГП-окси 7--эндо-ДМТБ- -силилоксибициклоСЗ.З.О октан в качестве 2-экзоформил-7-бициклопроиз- водного, использованного на стадии 3 и следующих фосфонатов: (2-оксо-геп- тил)-диметилфосфонат; (2-оксо октил)- диметилфосфонат; (2-оксо-38-метилгеп- тш1)-диметилфосфонат; (2-оксо-4-цик- логексилбутил)-диметилфосфонат; (2- -оксо 4-фенилбутил)-диметилфосфонат (2-оксо-З-м-трифторметилфеноксипро- пил)-диметилфосфонат; (2-оксо-З-ме- тил-3-бутоксибутил)-диметилфосфонат, получают следующие соединения:
3 Эндо-ТГП-окси-7 -экзо-ДМТБ-силил- окси 2-зкзо-(З -оксо-октан l -транс- -Г -енил)-бицикло 3, 3.0 октан, кс 228 ммк, 8700.
3-Экдо-ТП1-окси 7-зкзо-ДМТБ-си- лилокси-2-экзо-З -оксо-нон-l -транс- -1 -енил)-бицикло 3.3.0 октан, 228 ммк, 8950.
3-Эндо-ТГП-окси-7-экзо ДМТБ-силил- окси-2 экзо-(3 -оксо-4 S-метил-октан- -1 -транс-1 -енил)бидикло 3.3.0Jоктан , Л „д,, 228, .
3-Эндо-ТП1-окси 7-экзо-ДМТБ-силил окси 2 экзо-(3 -оксо-З -циклогексил- пент-1 -транс-l -енил)бицикло 3. 3.0 октан, (окс 228 ммк, i 9100.
З-Эндо-ТГП-окси-7-экзо-ДМТБ-силил- окси-2 экзо-(З -оксо-5 -фенкл-пент- -1 -транс-1 -енил)-бицикло 3. 3.0 октан ,Дд,акс 227 ммк, 14250.
2-ЗНДО-ТГП-ОКСИ-7-ЭКЗО-ДМТБ-СИЛШ1- ОКСИ-2-ЭКЗО-(3 -оксо-4 -м-трифторме913
тилфенокси-бут-l --транс- енил)-би цикло ГЗ.3.0 октан.
3 Зндо ТГ1Ьокси 7 экзо ДМТБ- Силил окси.2 э153о(3 -оксо-А-метил-Д - -бутокси- пент-1 енил)-бицикло 3, 3,0 октан.
Стадия К, Раствор (0,3 г) d,l-2 экзо--(2 -бром 3 оксо 4 К-фтор окт- l -транс-1 -енил)-3-эндо-ТГП-окси- -У-зндо-ДМТБ-силилоксибициклоГЗ. 3,0 октана из стадии Ж в 10 мл безводного зфира добавляют по каплям через 15 мин к 0,1 М раствору боргидрида цинка в этиловом зфире (10 мл). После перемешивания в течение 2 ч реакционную смесь гасят насыщенным раст вором .хлористого натрия и 2 н, серной кислотой. Эфирный слой отделяют
и промывают водой-, 5%-ным NaHCOg, а затем снова водой. После упаривания досуха получают смесь 3 S- и 3 R-OK сиспиртов, которую разделяют жидкост но-жидкостной хроматографией, используя в качестве растворителя изопро- пиловый эфир. Получают 0,11 г d,l- -экзо-(2 -бром-3 5-окси-4 К фтор- -OKT-l -транс-1 -енил)-3 эндо-ТГП- окси-7-эндо-ДМТБ силилокси-бицикло
+ г- 13,3,01октанаН-Н О-/} ОН(,0,,)
442,444 м/е, и 0,1 г 3 R-эпимера,
Стадия Л, Раствор (0,3 г) 2-экза- -(З -оксо-5 (2 )-тетрагидрофурил- -пент- 1 -транс-1 -енил)-3-эндо ТГП- -окси-У-экзо-ДМТБ-силилоксибицикло 3,3,0 октана из стадии 3 в 3 мл хлористого метилена и 3 мл этанола охлаждают до (-10) - (-15), а затем обрабатывают 25 мг NaBH, После пе ремешивания в течение 30 мин реакционную смесь гасят 1,5 мп ацетона и 3 мл насыщенного , упаривают в вакууме, а затем экстрагируют хлористым метиленом. Органическую фазу сушат над и упаривают досуха получая остаток, который очищают на силикагеле элюэнт: гексан - этиловый эфир,
Получают 0,1 г 2--экзо-(3 S-окси- -5 (2)-тетрагидрофурил-пент 1 - -транс-1 -енил)-3-эндо- ТГП-окси-7- -экзо--ДМТБ-силилоксибицикло 3. 3.0J октана и 0,11 г з к изомера, .
-О
+,г-и
М.)-0 374 м/е.
10
Стадия М, Аналогично стадиям К и Л, используя один из of - или /S -ненасыщенных кетонов, полученных на ста диях Ж, 3 и И, получ.ают следующие соединения;
3-Эндо-ТГП-окси-7 эндо-ДМТБ-силил- окси-2-экзо-(2 -бром-З S-окси-окт-Г - транс-1 -енил)-бнциклоГЗ,3,01октан, 0 - ,426 м/е
3 Эндо-ТГП-окси-7-эндо-ДМТБ-силил- окси-2-экзо-(3 Я-окси-окт- -транс- - 1 -енил)-бицикло 3, 3,0 jоктан,ГМ - HjO 1023 346 м/е
3-Эндо-ТГП окси-7-эндо ДМТБ-си- лилокси-2-экзо-(3 3-окси-4 -метил- oKT-l -транс-1 -енил)-бициклоГЗ, 3,0j октан, М -Н,0 - 102 360 м/е
З-Эндо-ТГП-окси-7-эндо-ДМТБ-силил- ОКСИ-2-ЭКЗО-(3.-окси-нон 1 -транс- 1 -енил)-бицикло 3,3,0 октан, - 102 360 м/е
З-Эндр-ТГП-7-эндо-ДМТБ-силилокси- -2-зкзо-(3 В-оксициклогексил-пент- -1 -транс-1 -енил)-бицикло 3,3 ,03ок5
0
5
тан, - 1021 386 м/е
5
0
5
3-Эндо-ТГП-окси-7-эндо-ДМТБ силил- ОКСИ-2-ЭКЗО-(3 8-окси-5 -фенил-пант- -l -транс-енил)-бицикло 3.3,0 октан, 0 - 102 380-м/е
3-Эндо-ТГП-окси-7-эндо-ДМТБ-силил окси 2-экзо-(3 5-окси-4 -м-трифторме- тилфенокси-бут-1 -енил)-бицикло 3,3,0 октан, - 102 450 м/е
. З-Эндо-ТГП-окси-7-эндо-ДМТБ-си- лилокси-2-экзо-(3 5-окси-4 -метил-4 - -бутокси-пент-l -транс-l -енил)-би- цикло 3,3,0 -октан, 102 396 м/е
3-Эндо-ТГП окси-7-эндо-ДМТБ-силил- окси-2-экзо-(2 -бром-З К-окси-окт- -1 -транс-1 -енил)-бицикло 3,3, тан, - 102J, 424,426 м/е
- 3-ЭНДО-ТП1-ОКСИ-7-ЭНДО-ДМТБ-СИЛИЛ- окси-2-экзо-(3 R-OKCH-OKi-l -транс- -l енш1)-бициклоt3,3,0Зоктан, - 102J 346
-ЩО
м/е
З-Эндо-ТГП-окси-7-эндо-ДМТБ-силил- окси-2-экзо-(3 Я-окси-4 3 метил-окт- -транс-1 -енил)-бицикло 3, 3,0j октан , - 102 360 м/е
З-Эндо-ТГП-окси-7-эндо-ДМТБ-силил- окси-2-экзо-(3 R-OKCH-HOH-l -транс- -1 енил)-бицикло 3,3,0 октан, -HiO - 102j 360 м/е
3-Эндо ТГП-окси 7-эндо-ДМТБ-силил- окси-2-экзо-(3 R--OKCH 5 -циклогексил- -пент-1 -транс- -енил)-бицикло СЗ,3,0 октан,ГмМ110 - 102} 386 м/е
З-Эндо-ТГП-окси-7-эндо-ДМТБ-силил- окси 2 экзо-(3 R-oKCH 5 -фенил-пент- -1 -транс- l -енил)-бицикло 3. 3. OJ октан , М/- - 102 380 м/е
З-Эндо-ТГП-окси-7-эндо-ДМТБ-силил- окси-2-экзо-(3 R-OKCH-4 м-трифторме- тилфенокси-бут-1 -транс- -енил)-бициклоГЗ .З.О октан, fM -HjO - 102 450 м/е
З- ндо-ТГП- окси-7-эндо-ДМТБ-силил ОКСИ--2-ЭКЗО-3 4-ОКСИ-4 -метил--4 -бу- токси-пент-l -транс-1 -енил)-бицик- .3.0:октан, Н О - 102 396
Стадия Н. Раствор (1,17 г) 2-эк- зо(3 S-OKCH-oKT-l -транс-l -енил)- -3-ЭНДО-ТГ11-ОКСИ-7-ЭНДО-ДМТБ-СИЛИЛ- оксибициклоГЗ.3,0 октана из стадии М в 12 мл безводного хлористого метилена обрабатывают 120 мл 2,3-дигидро пирана и 5 мг пара-толуолсульфокислоты . После выдержки в течение 4 ч при комнатной температуре органическую фазу промывают последовательно 5%-ным NaHCOj и водой, а затем упари вают досуха, получая 1,45 г сырого 2-экзо-(3 8-ТГП-окси-окт-1 -транс- - -енил)-эндо-ТП1-окси-7-эндо-ДМТБ- -силилоксибицикло 3.3,0 октана, Этот продукт растворяют в 12 мл ТГП и об- рабатывают 2 г тетрабутиламмонийфто- рида. Полученную смесь перемешивают в течение 12 ч при комнатной температуре и концентрируют до маленького объема, получая остаток,, который очи щают на силикагеле (элюент: этиловый эфир), что дает 920 мг 2-экзо-(35- -окси-окт-l -транс-1 -енил)-3-эндо- -7-эндо-диоксибицикло ГЗ.3,0}октан- -3,3 -бис-ТГП-эфира, ИК (пленка) 3400 см- .
Стадия О. Аналогично стадии Н с соединениями, полученными на стадиях К, Л, М получают следующие производные бицикло 3. 3.0,1 октан-3,3 - -бис-ТГП-эфира:
2-Экзо-(2 -бром-3 В-окси-4 -фтор- -окт-1 -транс-1 -енил)-3-эндо-7-эн- додиокси, ИК (пленка) 3400 см 2-Экзо- (2 -бром-З К-окси-4 К-фтор- -OKT-l -транс-1 -енил)-3-эндо-7-эн- додиокси, ИК (пленка) 3400 см
50
2-Экзо-(3 Я-окси-4 -метШ1-4-буток- си-пент-1 -транс-l -енил)-3-зндо-7- эндодиокси, ИК (пленка), см : 3400; .1250
2-Экзо-(3 Я-окси-4 -метил-4 -бу- токси-пент-Г -транс-1 -енил)-3-эндо- -7-эндодиокси,
Стадия И,
,Раствор (0,4 г) хромового ангидри2-Экзо- (3 5-окси-5 (2)-тетрагид- gg да добавляют при перемешивании к
4 мл пиридина. Когда образуется комплекс , смесь обрабатывают 0,36 г 2-эк- 30-(3 5-окси-5 (2)-тетрагидрофурил- -пент-l -транс-l -енил)-3-зндо-7-энрофурил-пент-1 -транс-1 -енил)-3-эн- до 7-зкзодиокси, ИК (пленка) 3400
2-Экзо(3 Я-окси-5 (2)-тетрагид- рофурил-пент-l -транс- -енил)-3-эн0
5
о 5 О -(-
40
45
50
до 7-экзодиокси, ИК (пленка), 3400; 1250
2-Экзо-(2 -бром-З 5-окси-окт-1 - -транс-l -енил)-3-эндо-7-эндодиокси, ИК (пленка), см : 3400; 1250
2-Экзо-(2 -бром-З R-OKCH-OKT-l - -транс-l -енил)-3-эндо-7-диокси, ИК (пленка), см У3400; 1250
2-Экзо-(З S-окси-окт-1 -транс-l - -енил)-3-зндо-7 диокси, ИК (пленка), см : 3400; 1250
2-Экзо-(3 К-окси-окт-1 -транс-l - -енил)-3-эндо-7-эндодиокси, ИК (пленка ), см 3400; 1250
2-Экзо-(3 8-окси-4 S-метил-окт- -l -транс-l -енил)-3-эндо-7 эндоди- окси, ИК (пленка), 3400; 1250
2-Экзо-(3 К-окси-4 S-метил-окт- -l -транс- -енил)-3-эндо-7-зндодиок- си, ИК (пленка), 3400; 1250
2-Экзо-(3 S-окси-нон- -транс- -енил)-3-зндо-7-эндодиокси, ИК (ппен- ка), см : 3400; 1250
2-Экзо-(3 К-окси-нон-1 -транс-l - -енил)-3-эндодиокси, ИК (пленка), 3400; 1250
2-Экзо-(3 5-окси-5 -циклогексил- -пент-1 -транс-l -енил)-3-эндо-7-эндодиокси , ИК (пленка), см : 3400; 1250
2-Экзо-(3 8-окси-5 -фенил-пент- -l -транс-l -енил)-3-эндо-7-эндодиок- си, ИК (пленка), см : 3400, 1250
2-Экзо-(3 Я-окси-5 -фенил-пент- -1 -транс-1 -енил)-3-эндо-7-эндоди- окси, ИК (пленка), 3400; 1250
2-Экзо-(3 5-окси-4 -мета-трифтор- метилфенокси-бут-1 -транс-l -енил)- -З-эндо-7-эндодиокси, ИК (пленка), 3400; 1250
2-Экзо-(3 Я-окси-4 -трифторметил- фенокси-бут-l -транс-l -енш1)-3-эн- ДО-7-ЭНДОДИОКСИ, ИК (пленка), 3400, 1250
2-Экзо-(3 Я-окси-4 -метШ1-4-буток- си-пент-1 -транс-l -енил)-3-зндо-7- эндодиокси, ИК (пленка), см : 3400; .1250
2-Экзо-(3 Я-окси-4 -метил-4 -бу- токси-пент-Г -транс-1 -енил)-3-эндо- -7-эндодиокси,
додиоксибициклоГЗ.3,0 октан-3,3 -бис-ТГП-простого эфира из части в 4 мл пиридина..Реакционную смесь оставляют а ночь при комнатной темпе- j ратуре, разбавляют 3 объемами бензо- па и фильтруют. Затем фильтрат упаривают до получения остатка, который распределяют между бензолом и 2 н, серной кислотой. Водную фазу повтор- ю но экстрагируют бензолом, промывают последовательно водой, NaHCO и водой и упаривают досуха, получая 0,31 г 2-экзо-(3 -окси 5 (2)тетра- гидрофурил пент-I -транс-1 -енил)- 15 -3-эндооксибицикло З,3,0Jоктан-7-он- -3,3 -бис-ТГП-простого эфира формулы (II), ИК (пленка), 1740; 1220
Пример 2, Перемепшваемый и 20 охлаждаемый (-10) - (6)°С раствор (0,8 г) .2-экзо-(3 8-окси-окт-1 - -транс-1 -енил)-3-эндо-7-эндодиокси- бицикло ГЗ.3,0}октан-3,3 -бис-ТГП-простого эфира по примерУ 1, стадия Н, 25 в 20 мл ацетона обрабатывают 1,6 мл реагента Джонса в течение 15 мин, После перемешивания в течение еще 15 мин добавляют 80 мл бензола. Органическую фазу отделяют, промывают ЗО 15%-ным водным (NH 4)2 4 ° ° н йтраль- ности, сушат и упаривают досуха, по- лучая 0,71 г 2-экзo-(3 s-oкcи-oкт- l -енил) -эндоокси бицикл о 3,3,0 ок2-Экзо- (3 8-окси-окт-1 -тр -енил), ИК (пленка) 1740 см
2-Экзо-(3 R-окси-окт- l -тр -енил), ИК (пленка) 1740
2-Экзо-(3 5-окси-4 s-метил -1 -транс-1 -енил), ИК (пленк 1740 СМ-;
2-Экзо-(3 К-окси-4 S-метил -1 -транс-1 -енил), ИК (пленк 1740 см-
2-Экзо-(3 S-окси-нон-l -тр -1 -енил), ИК (пленка) 1740 с
2-Экзо-(3 R-OKCH HOH-l -тр -енил), ИК (пленка) 1740 см2-Экзо- (3 8-окси-5 -циклог -пент-1 -транс-1 -енил) , ИК ( 1740 см2-Экзо- (3 К-окси-5 -циклог --пент- -транс-1 -енил) , ИК ( 1740 см2-Экзо- (3 5-окси-5 -фенил-1 -транс-1 -енил ) , ИК (гшенк 1740 см 2-Экзо-(3 К-окси-5 -фенил-1 -транс- -енил), ИК (пленк «,1740 см- . . ,
2-Зкзо- (3 S-oKCH-4 -м-триф . тилфенокси-бут-l -транс-1 -ен , ИК (гшенка) 1740 см 2-Экзо- (3 К-окси-4 -трифто :фенокси-бут-1 -транс-1 -енил) .(пленка) 1740 см2-Экзо- (3 8-окси-4 -метил40
45
тан-7-он-З, З -бис-тетр агидропиранило- -д токси-пент-1 -транс-1 -енил) , вого эфира, ИК (пленка) 1741 .
Пример 3. Используя любой и з способов: окисления, описанных в примере.1, стадия П, и примере 2, к триолам по примеру 1, стадия Н,. получают следующие 3-эндо-3 -диоксиби цикло tЗ,3,0 oктaн-7-oн-3,3 -биc-TПI- эфиpы:
2-Экзо- (2 -бром-3 Я-окси-4 R-фтор- -окт-1 -транс-1 -енил) , ИК (пленка) 1740 см2-Экзо- (2 -бром-3 - -о-кси-4 R- -фтор-окт-l -транс-1 -енил) , ИК (ппенка) 1740 см2-Экзо- (3 S-oкcи-5 Ч2)-тeтpa- гидpoфypил-пeнт-l -транс-l -енил) , ИК (пленка) 1740 см 2-Экзо- (3 R-OKCH-5 (2)-тетрагид- рофурил-пент-l -енил), ИК (пленка) 1740см2-Экзо- (2 -бром-3 8-окси-окт-1 - -транс-l -eHHjj), ИК (гшенка) 1740 см
2-Экзо-(2 -бром-З R-OKCH-oKT-l - , «-TpaHC-l -енил), ИК. (пленка) 1740см
(пленка) 1740
2-Экзо-(3 Я-окси-4 -метилтокси-пент-1 -транс-1 -енил ) , (гшенка) 1740 смПример 4, Раствор (2 d,l-2-3K3o-(3 -oKco-HOH-l -тр -енил)-3-зкзо-ТГП-окси-7-зндо -силилоксибициклоГЗ,3,0 октан мер 1, стадия Д, восстанавлив в смеси хлористый метил нол 0,17 г NaBH 4 по примеру 1 дия Л, и получают 2,01 г ё, (S,R)- окси-нон-l -транс-енил -3-экзо-ТГП-окси-7-зндо -силилоксибициклоСЗ,3,Оjоктан разделения З S-и 3 R-спиртов продукт подвергают взаимодейс в 30 мл хлористого метидена с 2,3-дигидропирана в присутств gg 25 мг пара-толуолсульфокислот лучая соответствующий d,1-зкз R)-oкcи-нон-1 -транс- -енил зо-окси 7-зндо-ДМТБ-силилокси .3,0 октан-3,3 -бис-ТГП-з
50
2-Экзо-(3 8-окси-окт-1 -транс-1 - -енил), ИК (пленка) 1740 см
2-Экзо-(3 R-окси-окт- l -транс-1 -енил), ИК (пленка) 1740
2-Экзо-(3 5-окси-4 s-метил-окт- -1 -транс-1 -енил), ИК (пленка) 1740 СМ-;
2-Экзо-(3 К-окси-4 S-метил-окт- -1 -транс-1 -енил), ИК (пленка) 1740 см-
2-Экзо-(3 S-окси-нон-l -транс- -1 -енил), ИК (пленка) 1740 см
2-Экзо-(3 R-OKCH HOH-l -транс-1 - -енил), ИК (пленка) 1740 см2-Экзо- (3 8-окси-5 -циклогексил- -пент-1 -транс-1 -енил) , ИК (гшенка) 1740 см2-Экзо- (3 К-окси-5 -циклогексил- --пент- -транс-1 -енил) , ИК (ппенка) 1740 см2-Экзо- (3 5-окси-5 -фенил пент- -1 -транс-1 -енил) , ИК (гшенка) 1740 см 2-Экзо-(3 К-окси-5 -фенилпент- -1 -транс- -енил), ИК (пленка) «,1740 см- . . ,
2-Зкзо- (3 S-oKCH-4 -м-трифторме- .тилфенокси-бут-l -транс-1 -енил), ,ИК (гшенка) 1740 см 2-Экзо- (3 К-окси-4 -трифторметил- :фенокси-бут-1 -транс-1 -енил) , ИК .(пленка) 1740 см2-Экзо- (3 8-окси-4 -метил 4 -буИК
токси-пент-1 -транс-1 -енил) ,
0
5
д токси-пент-1 -транс-1 -енил) ,
(пленка) 1740
2-Экзо-(3 Я-окси-4 -метил4 -бу- токси-пент-1 -транс-1 -енил) , ИК (гшенка) 1740 смПример 4, Раствор (2,1 г) d,l-2-3K3o-(3 -oKco-HOH-l -транс-if - -енил)-3-зкзо-ТГП-окси-7-зндо-ДМТБ- -силилоксибициклоГЗ,3,0 октана пример 1, стадия Д, восстанавливают при в смеси хлористый метилен - этанол 0,17 г NaBH 4 по примеру 1, стадия Л, и получают 2,01 г ё,1зкзо- (S,R)- окси-нон-l -трансl - -енил -3-экзо-ТГП-окси-7-зндо-ДМТБ- -силилоксибициклоСЗ,3,Оjоктана. Без разделения З S-и 3 R-спиртов зтот продукт подвергают взаимодействию в 30 мл хлористого метидена с 0,4 г 2,3-дигидропирана в присутствии g 25 мг пара-толуолсульфокислоты, получая соответствующий d,1-зкзо-ГЗ (S, R)-oкcи-нон-1 -транс- -енил -3-эк- зо-окси 7-зндо-ДМТБ-силилоксибицик- .3,0 октан-3,3 -бис-ТГП-зфир. Без
0
дальнейшей очистки этот продукт обрабатывают 2,5 М тетрабутилаамонийфто- рида в ТГФ для удаления силилового эфир а.
Полученный d,l-2-3K3o-(3(S,R)- -окси-нон 1 -транс- -енил)-3-экзо- -7-эндодиоксибицикло 3.3.0J октан- -З.З -бис-ТГП-эфир (1,660 г) затем окисляют смесью пиридинхромовый ангидрид , получая 1,25 г d,l-3K30- ГЗ ( ,К)-окси-нон-1 -транс-1 -енил - -З-экзо-оксибицикло 3.3,0 октан-7- ,3 -бис-ТГП-простого эфира, ИК (пленка) 1740 . .
П р и м е р 5.
Стадия А. Раствор (2,2 г) 3-эндо- оксибицикло 3.3.0 октан-7-она в 100 МП безводного бензола обрабатывают 4 мп этиленгликоля и 0,2 г моногидрата пара-толуолсульфокислоты и кипятят с обратным холодильником в течение 12 ч, отбирая воду, образуюг- щуюся в процессе реакции Затем добавляют 0,25 мл пиридина и полученную смесь охлаждают. Органическую фазу промывают водой, NaHCOj и затем снова водой и упаривают досуха, получая 2,32 г 3-эндооксибицикло 3.3,0 Токтан-7-он-7,7-этилендиокси- да, ИК (пленка) 3450 см
, отсутству- 1
Растнор (1,57 г) этого соедина- .ния в 3 мл диметилформамида обрабатывают 1,3 г ДМТБ-силилхлорида и 0,885 г имидазола, а затем выдержив ют при в течение 5 ч. После охлаждения добавляют воду, в результа те обычной обработки получают 2,3 г d,1-2-экзокарбоксиметил-З-эндоокси10 бицикло 3.3.0 октан-7-он-7,7-эти- лендиоксид-З-ДМТБ-силилового эфира, ИК (пленка) 1710 см . Последующим восстановлением LiAlH в безводном этиловом эфире по примеру 1, (ста15 дия В) получают d,1-3-эндоокси-2-эк зооксиметилбицикло 3,3.0}октан-7- -он-7,7-этилендиоксид-3-ЛМТБ-сили- ловый эфир, ИК (пленка) 3400 см . Стадия Б. Аналогично стадии А,
20 используя дитиоэтиленгликоль вместо этиленгликоля получают соответствую щие 7,7-этилендитиоаналоги.
Стадия В, 1.8 г d,1-эндоокси-2- -экзооксиметил-7,7-этилендиоксиби25 ЦиклоСЗ.3,0 октан-7-он-3-ДМТБ-си- лилового эфира окисляют по примеру (стадия Ж), в результате чего получают соответствующее 2-формильное производное. Затем его подвергают
30 взаимодействию с (2-оксо-гептил)- диметилфосфатом по примеру 1 (стадия 3), в результате чего получают 1,23 г d,1-3-эндоокси-2-экзо-(3- -оксо-окт- l -транс-1 -енил)-7,7-эти лендиоксибицикло 3,3.02октан-7-он35
MOkC
-З-ДМТБ-СИЛИЛОВОГО эфира 228 ммк, 8980. По примеру 1, стадия И, его восстанавливают бор- гидридом цинка в эфире, получая
ет абсорбция при 1745 см
Раствор этого продукта в 40 мл ацетона охлаждают до и обрабатывают при этой температуре 4,1 мл реагента Джона. Спустя 20 -мин при температуре избыток окислителя гасят 4 мл изопропилового спирта. Добавляют 150, мл бензола и бензольную фаз последовательно промешают 20%-HHM Q 1,22 г d, 1-3 зндоокси-2-экзо- 3 (S, (NH;f)5S04 водой, 5%-ным NaHCO и во-К)-окси-окт-1 -транс-l -енил -7,7дой . Упаривание досуха дает 2,1 г d,l-бициклo ГЗ,3,0 октан-3,7-дион- -7,7-этилендиоксида, т. пл, 40-42 С.
Аналогично примеру 1, стадия А, это соединение подвергают реакций с метилкарбонатом и получают d,1-2-эк- зокарбоксиметилбицикло Г3,3,0}октан-этилендиоксибицикло 3 .3,0}октан-7- -он-З-ДМТБ-силилввого эфира.
Раствор этого соединения в 25 мл д метанола обрабатывают Ю мл 1 и. при кипении с обратным холодильником в течение 50 мин. Метанол упаривают в вакууме, остаток экстра гируют этиловым эфиром, и органичес кую фазу упаривают досуха, получая 0,72 г неочищенного d,1-3-эндоокси- -2-экзо- з (8,Я)-окси-окт-1 -транс- -1 eнилj-биuиклo 3,3,0 октан-7-она, Индивидуальные изомеры выделяют хро матографически на силикагеле, используя в качестве элюента смесь ге сан - этиловый эфир, и затем превра щают в тетрагидропираниловые эфиры, обрабатывая 2,3-дигидропираном в хло
-3,7-дион-2-карбоксиметилэфир-7,7 254 ммк, 8
этштендиоксид, 7000,
По способу примера 1, стадия Б, раствор этого продукта в 20 мп CHjCij и 20 мл этанола восстанавливают NaBH при , получая 1,72 г d,l-2-экзo-кapбoкcимeтил-3-эндооксибицикло 3.3,0 октан-7-он-7,7-этилен- диоксида, ИК (пленка), см 3400; 1720
Растнор (1,57 г) этого соедина- .ния в 3 мл диметилформамида обрабатывают 1,3 г ДМТБ-силилхлорида и 0,885 г имидазола, а затем выдерживают при в течение 5 ч. После охлаждения добавляют воду, в результате обычной обработки получают 2,3 г d,1-2-экзокарбоксиметил-З-эндооксибицикло 3.3.0 октан-7-он-7,7-эти- лендиоксид-З-ДМТБ-силилового эфира, ИК (пленка) 1710 см . Последующим восстановлением LiAlH в безводном этиловом эфире по примеру 1, (стадия В) получают d,1-3-эндоокси-2-эк- зооксиметилбицикло 3,3.0}октан-7- -он-7,7-этилендиоксид-3-ЛМТБ-сили- ловый эфир, ИК (пленка) 3400 см . Стадия Б. Аналогично стадии А,
используя дитиоэтиленгликоль вместо этиленгликоля получают соответствующие 7,7-этилендитиоаналоги.
Стадия В, 1.8 г d,1-эндоокси-2- -экзооксиметил-7,7-этилендиоксибиЦиклоСЗ .3,0 октан-7-он-3-ДМТБ-си- лилового эфира окисляют по примеру 1 (стадия Ж), в результате чего получают соответствующее 2-формильное производное. Затем его подвергают
взаимодействию с (2-оксо-гептил)- диметилфосфатом по примеру 1 (стадия 3), в результате чего получают 1,23 г d,1-3-эндоокси-2-экзо-(3- -оксо-окт- l -транс-1 -енил)-7,7-эти- лендиоксибицикло 3,3.02октан-7-он
MOkC
-З-ДМТБ-СИЛИЛОВОГО эфира 228 ммк, 8980. По примеру 1, стадия И, его восстанавливают бор- гидридом цинка в эфире, получая
1,22 г d, 1-3 зндоокси-2-экзо- 3 (S, К)-окси-окт-1 -транс-l -енил -7,71 ,22 г d, 1-3 зндоокси-2-экзо- 3 (S, К)-окси-окт-1 -транс-l -енил -7,7
-этилендиоксибицикло 3.3,0}октан-7- -он-З-ДМТБ-силилввого эфира.
Раствор этого соединения в 25 мл метанола обрабатывают Ю мл 1 и. при кипении с обратным холодильником в течение 50 мин. Метанол упаривают в вакууме, остаток экстрагируют этиловым эфиром, и органическую фазу упаривают досуха, получая 0,72 г неочищенного d,1-3-эндоокси- -2-экзо- з (8,Я)-окси-окт-1 -транс- -1 eнилj-биuиклo 3,3,0 октан-7-она, Индивидуальные изомеры выделяют хро- матографически на силикагеле, используя в качестве элюента смесь гек- сан - этиловый эфир, и затем превращают в тетрагидропираниловые эфиры, обрабатывая 2,3-дигидропираном в хло17
ристом метилене по примеру 1, стадия Н. Таким же образом из 3 3-окси изомера получают соединение, идентич ное 2-экзо-(3 й-окси-окт-1 -транс- -1 -енил)-3-эндооксибициклоГЗ.3.01 октан-7-он-3}3 -бис-тетрагидропропи- раниловому эфиру, полученному по примеру 1, стадия П.
Аналогично получают все соединения формулы (I).
П р и.м е р 6. Омылением 4,8 г d,1-эндоокси-2-экзокарбоксиметиловый сложный эфир 7,7-зтилендиоксибицикло
3.3-.0 октан-7-она по примеру 5, ста-15 тат, .
1360582
тат и водную гидроокисью промывают на . . ром и упарив
1,92 г З-энд СЗ,3.0}октан хлористоводо
Реакция данн 10 ангидридом, го этоксикар новая/кислот доокси-2-экз амид)-бицикл
дия А, 100 мл 2,5-ного карбоната калия в смеси метанол - вода при кипячении с обратным холодильником в течение 40 мин и последующей обработкой по примеру 2, получают 4,02 г d,1-3-эндоокси-2-экзокарбок- сибицикло Г 3.3.0 J окт ан-7-он-7,7-эти- ендиоксида. Это соединение растворяют в 80 мл безводного тетрагидрофу- рана, охлаждают до и обрабатывают , добавляя по каплям 2,1 г три- этиламина в 12 мл безводного тетра- гидрофурана, поддерживая при этом температуру -10°С. После перемешивания в течение 1 ч при -10°С медленно добавляют 1,4 г азида натрия в 12 мл воды. Перемешивание продолжают еще в течение 25 мин. Затем реакционную смесь концентрируют в вакууме и разбавляют водой. Быстро выделяют фильтрованием 2-экзоазид и сушат его в вакууме.
Раствор 4,01 г этого соединения в 8 WI пиридина обрабатывают 4 уксусного ангидрида и выдерживают при 5-8°С в течение 24 ч. Затем реакционную смесь распределяют между ледяной водой, этиловым эфиром и 2 н. серной кислотой. Отделяют органический слой, промывают до нейтральности , сушат и упаривают досуха, получая 4,1 г 3-эндooкc -2-экзoaзидo (Ы,,-СО)бицикло 3.3,0 октан-7-он-3- -ацетат-7,7-этилендиоксида, ИК 2215 см
Аналогичн гептановой к ствующее 2
Приме
20 Стадия А, бицикло 4.3. в диметилкар ют к суспе ( 8б%-ная дис 25 ле, 42 г) в После прекра смесь нагрев 75-80 0, охл пературе, ра 30 и промывают NaHjPO, упа . 2-карбоксиме 4.3.0 нонан макс 252 м
Раствор э том метилене ( 1,2 л) охла ; ремешиванииСмесь пер 30 мин снова обрабатывают нагревают пр Р астворители
Остаток р ацетатом и в сушат и упар d,l-2 экзoкa бицикло 4.3. в виде триме ( 64 г), кото тетрагидрофу ют 2,3-дигид толу олсульфо чение 3 ч пр К реакционно
35
40
45
50
Этот продукт .суспендируют в уксусной кислоте (50 мл) и воде (8 мл) и полученную смесь нагревают при 40°С. Когда замечают вьщеление водорода, смесь нагревают до 60-70°С в течение
Остаток распределяют между этил ацетатом и водой, органическую фаз сушат и упаривают в вакууме, получ d,l-2 экзoкapбoкcимeтил-3 эндooкcи бицикло 4.3.0}нонан-7-ен, М -26-8, в виде триметилсилилового эфира (64 г), который растворяют в сухом тетрагидрофуране (ТГФ) и обрабатыв ют 2,3-дигидропираном (33 г) и пар толу олсульфокисл от ой (0,63 г) в те чение 3 ч при комнатной температур К реакционной смеси добавляют 0,4
50
„.55 2 ч, после чего избыток уксусной кис- .пиридина, а затем после охлаждения
лоты удаляют перегонкой с водяным паром . После охлаждения смесь экстрагируют смесью этиловый эфир - этилаце
15 тат, .
582 18
тат и водную фазу доводят до рН 9 гидроокисью натрия, 01елочную фазу промывают насыщенным солевым раствор- . .ром и упаривают досуха, получая
1,92 г З-эндоокси-2-экзоаминобицикло СЗ,3.0}октан-7-он-3-ацетата (т, пл, хлористоводородной соли 111-11 ) ,
Реакция данного амина со смешанным 10 ангидридом, полученным из хлористо- го этоксикарбонила и 25-окси-(гепта- новая/кислота)-2-ацетата дает 3-эн- доокси-2-экзо-(2 S-ацетоксигептано- амид)-бицикло ГЗ.3.0Joктaн-7-oн-3-aцe
Аналогично из 2-ацетат 2 R-окси- гептановой кислоты получают соответствующее 2 -ацетоксисоединение.
Пример 7.
Стадия А, Перемешиваемый раствор бицикло 4.3.0 нон 7 ен-3-она (90 г в диметилкарбрнате (350 мл) добавляют к суспензии гидрида натрия- (8б%-ная дисперсия в минеральном мас- ле, 42 г) в диметилкарбонате (550мл), После прекращения выделения водорода смесь нагревают в течение 4,5 ч при 75-80 0, охлаждают при комнатной температуре , разбавляют бензолом (2,7 л) и промывают 25%-ным водным раствором NaHjPO, упаривают досуха, получая .2-карбоксиметил (СН -0-СО)бицикла 4.3.0 нонан-7-ен-3 он (91 г), макс 252 ммк, Е 8200.
Раствор этого соединения в хлористом метилене (1,2 л) и этаноле (1,2 л) охлаждают при -20°С и при пе- ; ремешиванииобрабатывают NaBH404,4 г).
Смесь перемешивают в течение 30 мин снова при -20°С, затем ее обрабатывают уксусной кислотой (23 мл) , нагревают при комнатной температуре. Р астворители упаривают в вакууме.
Остаток распределяют между этил- ацетатом и водой, органическую фазу сушат и упаривают в вакууме, получая d,l-2 экзoкapбoкcимeтил-3 эндooкcи- бицикло 4.3.0}нонан-7-ен, М -26-8, в виде триметилсилилового эфира (64 г), который растворяют в сухом тетрагидрофуране (ТГФ) и обрабатывают 2,3-дигидропираном (33 г) и пара- толу олсульфокисл от ой (0,63 г) в течение 3 ч при комнатной температуре. К реакционной смеси добавляют 0,4 г
. пиридина, а затем после охлаждения
.пиридина, а затем после охлаждения
при, 0°С при перемешивании добавляют в течение 45 мин раствор 1,2 М ВНд в ТГФ. Перемешивание продолжают в
течение 1 ч при 0°С, затем добавляют воду для разложения оставшегося гидрида . При интенсивном перемешивании и при внешнем охлаждении при -5 - образовавшийся боран окисляют медпенным совместным добавлением 110 МП 0,3 М гидроокиси натрия и 110 перекиси водорода, поддерживая внутреннюю температуру . при 20-25 С. Смесь реакции окисления разбавляют бензолом (2 л) и спои разделяют. Водный слой экстрагируют бензолом (2x50 мп). Органические слои объединяют, последовательно промывают 1%-ным карбонатом натрия, насыщенным сульфитом натрия и насыщенным хлористым натрием, а затем сушат над MgSO. Упаривание- растворителей дает неочищенную смесь 7- и 8-оксисоединений, которые разделяют с помощью хроматографии на колонке SiOj (300 г), используя в качестве элюента этиловый эфир и получают соответственно d,l-2-3K3OMe- токсикарбонил-З-эндо-7-диоксибицик- поГ4.3.0 нонан-3-ТГП-эфир (24 г) , в виде триметилсилилового эфира, и соответствующее З-эндо-8-. диокси соединение (27 г) М -370, в виде триметилсилилового эфира.
Раствор 7-спирта (24 г) в сухом ДМФ (30 мл) обрабатывают ДМТБ-силил- хпоридом (15,8 г) и имидазолом (8,85 г) и затем нагревают в течение 5.ч при 60°С, охлаждают при комнатной температуре, разбавляют водой (90 мп), а затем экстрагируют этиловым эфиром.
Органические слои собирают, промывают водой и упаривают досуха, получая d, 1-2-экзокарбоксиметил-З-эн до-7-диоксибицикло 4.3.01нонан-3- -ТГП-(простой эфир)-7-ДМТБ-сш1ИЛОВЫй простой эфир, .
К перемешиваемому раствору этого соединения в сухом толуоле , (220 мп), охлажденному при -70°С, на пpoтяжeни 45 мин добавляют раствор 1,4 М диизо бутилалюминийгидрид (ДИБА) в толуоле поддерживая температуру (-70)-(-60) Перемешивание продолжают в течение 2ч, остаток гидрида разлагают, добавляя 2 М изопропиловый спирт в толуоле .
Реакционную смесь нагревают при
комнатной температуре и последовательно добавляют 30%-ный водный NaH4PO (60 мл) и NaiS04(50 г).
0
5
0
о
После фильтрования органическую фазу промывают водой и упаривают в вакууме , получая d,1-3-эндо-7 диокси-2- -экзоформилбициклоГ4,3.0 -3-ТГП- - (простой эфир)-7- Д1-1Б-силиловый прос- той эфир (, ), . Используя 8-оксисоединение, получают d,l- бицикло 4.3.0 нонан-3-эндо- 8-диокси- -2-экзокарбоксиметил-3 ТГП-эфир-8- -ДМБ-силиловый эфир, и d,l- -бицикло 4.3.О}нанан 3 эндо-8-диокси- -2-экзоформил-3 ТГП-эфир-8-ДМБ-сили- ловый эфир, М -382.
Стадия Б, Раствор (2-оксогептил)-. -диметилсульфоната (0,33 г) в сухом бензоле (5 мп) добавляют к перемешиваемой суспензии (80%-ная дисперсия в минеральном масле, 43,5 мг) в сухом бензоле (10 мл). Спустя 1 ч добавляют 260 мг N-бромсукцинамида, а затем, через 5 мин, раствор d,l- -бицикло 4.3.О нонан-3-эндо-8-диок- си-2-экзоформил-3-ТГП-эфир-8-ДМБ 5 силилового эфира (0,4 г) в 5 мл толуола .
Перемешивание продолжают в течение 15 мин, затем реакционную смесь промывают водным 15%-ным сушат и упаривают в вакууме, получая d,l-2-3K30-(2 -бром-З -OKCo-oKT-l - ,-транс-енил)-3-эндо-ТГП окси-8-ДМБ- -силилоксибицикло 4.3.0}нонан, 251 ммк, 5 8900,
Стадия В, Раствор (З-фенокси-2- -оксопропил)-диметилфосфоната (2,83 г) в бензоле (10 мп ) добавляют к перемешиваемой суспензии NaH (80%-ная дисперсия в минеральном масле, 0,33 г) в бензоле (50 мп), Перемешивание продолжают в течение 45 мин, затем добавляют раствор d,l-2-экзoфopмил-3- -эндо-ТГП-окси-7- ДМБ-силилоксибицик- .3,0 1нонана из стадии А (3,82) г в толуоле. Спустя 20 мин органическую фазу промывают водным 20%-ным NaH2P04 и водой, сушат и упаривают досуха, получая после фильтрования на SiO i (38 г) с применением смеси бензол - этиловый эфир в качестве элюента 3,97 г 2-экзо-(3 -оксо-4 -феноксилбут-1 -транс-енил)-3-эндо- -ТГП-ок си-7-ДМБ-силилоксибици кло Г4.3,0 нонана, м/е. Используя (5-циклогексил-2-оксобу- тш1)-диметилфосфонат и в качестве исходного материала - альдегиды получают 2-экзо-(3 -оксо-5 -циклоге:к- сил-пент-l -транс-енил)-3-эндо-ГТП0
5
0
5
-окси-7-ДМБ-силилоксибицикло 4,3,Oj нонан,/ 228, f 9300, и 2-эк- , зо-(3 оксо-5 -циклогексил-пент- -транс ещл)-3 эндо ТШ-окси-8-ДМБ- -силилоксибицикло 4.3.Oj нонан, 228,6 ммк, 9450.
Стадия Г, ДМБ-силил-эфир й/,/3-нена сыщенные кетоны, .полученные в соответствии со стадиями Б и В, подверга ют реакции следующим образом: восстанавливают их до аллильных спиртов; новую оксигруппу заицгщают в виде ТГП-эфира; ДМБ-силилэфирную защитную группу селективно удаляют, получая вторичный спирт, который окисляют до кетона; удаляют все остальные защитные группы; выделяют эпимерные аллиловые спирты с помощью высокоэффективной жидкостной хроматографии
-2
на SiOj , При работе в 2x10 молярной шкале осуществляют следующее:
а), Восстановление, 1x10 моль (0,32 г) NaBH4 добавляют к перемещи- ваемому раствору о/,/5-(ненасыщенный
кетон)-ДМБ-силилового эфира в смеси хлористый метилен - этанол (1:1) (180 мл), охлажденному при (-10) - (-15)°С, Спустя 30 мин оставшийся гидрид разлагают, добавляя ацетон (10 мл) и водный насыщенный . (25 мл). Растворители удаляют в вакууме , а остаток распределяют между водой и хлористым метиленом, Органический слой отделяют, сущат и упаривают досуха, получая смесь силиловых эфйров З З-, 3 R-аллиловых спиртов,
б), Защита аллиловых спиртов в виде ТГП-простых эфйров. Сырую смесь силиловых эфйров З S-, З R-аллиловых спиртов обрабатывают хлористым метиленом (30 мл) и к перемешиваемому раствору добавляют 2,3-дигидропиран (2 г) и паратолуолсульфокислоту (0,038 г). Реакция заверщается через 2 ч, причем ее прекращают, добавляя 0,5 мл пиридина, и растворители удаляют упариванием в вакууме, получая сырую смесь 3 S-, З R-ТГП-(простой эфир)-силиловых эфйров,
в). Десилилирование, Раствор полученного материала в сухомТГФ (80 мп) обрабатывают в течение 12 ч при комнатной температуре сухим тетрабутил- аммонийфторидом (14 г). После кон- ,центрирования ,в вакууме до небольшог объема, остаток абсорбируют на SiOj (40 г), последующим элюированием эти
5
0
ловым эфиром получают (вторичный спирт)-3 3-, 3 R-TГП пpocтыe эфиры,
г). Окисление, Дициклогексилкарбо- диимид (6,5 г), пиридин (1 мл) и трифторуксусную кислоту (0,5 мл) последовательно добавляют к перемешиваемому раствору (вторичный спирт)- , З К-ТГП-простого эфира в 60 мп смеси бензол - ДМСО 75:25, Спустя 4,5 ч реакционную смесь разбавляют 100 мл бензола и водным раствором щавелевой кислоты (3 г), Образовавшуюся дициклогексилмочевину отфильтровывают , органический слой промывают до нейтральности, сушат и упаривают досуха,
д,.е), Депиранилизация и хромато- графическое разделение. Раствор З S, 3 R-TГП(пp,ocтpй эфир)-кетонов в метаноле (30 мл) перемешивают при комнатной температуре в течение 3 ч с пара-толуолсульфокислотой (0,18 г); после добавления 0,5 мп пиридина его упаривают досуха. Остаток растворяют в смеси циклогексан - этилацетат (80:20) и вводят в высокоэффективный жидкостный хроматограф с получением следующих кетоспиртов:
2-Экз о--(2 -бром-З 8-окси-окт-1 - -транс-енил)-3-эндооксибицикло 4,3,0 нонан- 8-он, 340, 342 м/е.
2-Экзо(2 -бром-З R-oкcи-oкт-l - -транс-енил)-3-эндооксибициклоС4,3,OJ g нонан-8-он, М - , 342 м/е
2-Экзо-(3 3-окси-4 фенокси-бут- -l -транс-енил)-3-эндооксибицикло 4,3,0 нонан 7-он, М 460 м/е, в виде бис-триметилсилилового эфира
2-Экзо-(3 8-окси-4 -фенокси-бут5
0
0
5
0
5
-транс-енил)-3-эндооксибицикло 4,3,0 нонан-7-он, М 460 .м/е, в виде бис-триметилсилилового эфира
2-Зкзо-(З К-окси-5-циклогексил- -пент-1 -транс-енил)-3-эндооксиби- цикло 4,3,0 нонан-7-он,м - 302 м/е
2-Экзо-(З Я-окси-5-циклогексил- -пент-1 -транс-енил)-3-эндооксиби- цикло 4, 3,0 нонан-7-он, H20j 302 м/е
2-Зкзо-(3 3-окси-5-циклогексил- -пент-1 -транс-енил)-3-эндооксиби- цикло 4, 3,0 нонан-8-он, М - 302 м/е
2-Экзо-(3 Я-окси-5-циклогексил- -пент-l -транс-енил)-3-эндооксиби- цикло 4,3,0 нонан 8-он 302 м/е,
20
П р и м е р 8,
Стадия А. Этиленгликоль (15 мл) и пара-толуолсульфокислоту (0,9 г) добавляют к раствору 2-экзобром-3 -эндооксибицикло СЗ. 3.0 ге птан 6-она в бензоле и смесь кипятят с обратным холодильником в течение 12 ч, удаляя воду, которая образуется в процессе реакции, затем к смеси добавляют пи ю ридин (0,6 мл) и охлаждают до комнатной температуры. Органическую фазу промывают водой, 2,5%-ным водным NaHCOj и водой и сушат, Бензол. (100 мл) частично удаляют в вакууме, 5 затем смесь обрабатывают трибутил- оловогидридом (41 г) в атмосфере азота при 55°С в течение В ч. После охлаждения до комнатной температуры органическую фазу промывают насыщенным водным раствором NaH2P04, сушат и упаривают досуха. Очисткой полученного остатка на SiO (240 г) с злюентом бензол - этиловый эфир получают 14,9 г 3-эндооксибицикло 3.3. 25 гептан-6-он-6,6 этилендиоксида, ИК (пленка) 3460 см , М 242 м/е, в . виде триметилсилилового эфира.
Стадия Б, Перемешиваемый раствор. 3 эндооксиби.цикло 3.2.0 гептан-6-он- -6,6-этилендиоксида (12,75 г) из стадии А в бензоле (340 мл) и ДМСО (112 мп) обрабатывают дициклогексил- карбодиимидом (46,35 г), пиридином (5,9 г) и трифторуксусной кислотой (5,4 г). Спустя 6 ч полученную смесь разбавляют бензолом (600 мл) и водой (50 мл), фильтруют от дициклогек- силмочевины. Органическую фазу промывают водой, сушат над MgSO и упа- Q ривают досуха, получая бицикло 3.2.03 гептантЗ,6-дион-6,6-диэтилендиоксид, ИК (пленка) 1742 см М 168 м/е.
Раствор данного сырого продукта в диметилкарбонате (70 мп)добавляют к суспензии гидрида натрия (80% в ми нерапьном масле., 4 г) . Смесь перемешивают до прекращения выделения водорода при комнатной температуре, а затем нагревают в течение 40 мин при 75-80 0.
После охлаждения реакционную смесь разбавляют бензолом (359 мп) и уксусной кислотой (8,4 г), промывают водой , сушат и упаривают досуха, полу- gg чая смесь (1:1) d,l-2-экзo-кapбoкcи- -метил (СН -О-СО)-бицикло 3.2,0Згеп- тан-3,6-ДИОН-6,6-этилендиоксида, М 226 м/е .(р 0, q 1), и
30
35
45
50
d,1-4-экзокарбоксиметилбицикло ГЗ.2.OJ гептан-3,6-ДИОН-6,6-этилендиоксида, М 226 м/е (р 1 , q 0), которую разделяют с помощью хроматографии на SiO (, -свободное), используя в качестве элюента сме сь гекса- на и этилового эфира).
Стадия В. 2,5 г боргидрида натрия порциями добавляют к перемешиваемому раствору бицикло 4,3.0}нон-7-ен-3- -она (11,42 г) в 80 МП этанола. После дополнительного перемешивания в течение 2 ч добавляют 5 мл уксусной .кислоты и смесь упаривают досуха. Остаток распределяют между водой и CHjCl, и органический слой упаривают досуха. Раствор полученного бицик- .3,0 нон-7-ен-3-ола (11 г) в сухом ДМФ нагревают последовательно с ДМТБ-силилхлоридом (15,6 г) и ими- дазолом (10,85 г), нагревают при
60°С
в течение 6 ч, охлаждают и раз
бавляют 66 мл воды. После экстракции (с откачкой) этиловым эфиром и обычной обработки получают бицикло 4,3.0j нон-7-ен-З-окси-ДМБ-силиловый эфир (19,1 г). Его раствор в сухом ТГФ (100 мл), охлажденный до О., обрабатывают (при перемешивании в атмосфере азота) молярным раствором BHj в ТГФ (75 мл). Спустя 2 ч, в течение которых поддерживают температуру 25°С, добавляют 1 н. NaOH 25 мл) и 25 МП 30%-ной перекиси водорода. Смесь нагревают при в течение 2 ч, охлаждают и разбавляют бензолом (400 мл). Органический слой промывают 1%-ным , насьш енным раствором сульфита натрия, насьш1енным NaCl, сушат и упаривают досуха, получая смесь неочищенного бициклоГ4.3, нан-7, З-ДИОКСИ-ЗГ-ДМБ.-СИЛИЛОВОГО эфира и его 3,8-диоксиизомера (20,3 г), Раствор полученного спирта в смеси 75:25 бензол - ДМСО (150 мл) обрабатывают последовательно 16 г дицикло- гексилкарбодиимида, 2 мл пиридина и ;1 мл трифторуксусной кислоты при перемешивании . Через 5 ч смесь разбавляют бензолом (400 мл), водой (50 мл) и раствором щавелевой кислоты (6 г) в воде (75 мл) и после дополнительного перемешивания в течение 30 мин фильтруют. Органическую фазу промывают водой до нейтральности, получая смесь 3-оксибицикло 4,3.0 нонан-7- -он-ДМБ-силилового эфира и его 8-он- -изомера (18,25 г), растворяют в ме-.251360582
аноле (60 мп) и обрабатывают 1,8 г ара-толуолсульфокислоты. Через 12 ч месь обрабатывают 1,95 мл пиридина упарив,ают досуха. Остаток фильтру ,л о хл ох по ни р н ны ра ме ди в а л пр ю уп ру о -( си
10
15
20
25
ют на SiO- (элгоент: смесь этиловый -эфир этилацетат) и получают смесь соответствугацих 3-оксисбединений (10 г).
Раствор этой смеси в бензоле (50 мл) кипятят с обратным холодильником в присутствии сухого этилен- гликоля (5,2 г) и пара-толуолсульфокислоты (0,62 г), удаляя воду, образующуюся в процессе реакции. Через 14 ч добавляют 2 мл пиридина и органическую фазу охлаждают, промывают водой, 2%-ным и насыщенным NaCl до нейтральности. Упариванием растворителя получают смесь 3-окси- бицикло 4,3,О нонан-7-он-7,7 этилен- диоксида и -8-он-8,8-этилендиоксида, масло, ИК (пленка) 3400 , M 198 м/е.
Стадия Г, .Аналогично стадии Б из 14,85 г 3-зндооксибицикло 4,3, нан-7-он-7,7-этилендиоксида в результате процесса окисления получают 13,9 г бицикло 4,3,0 нонан-3,7-дион- -7,7-этилендиоксида, ИК ( пленка) 1740 см 196 м/е, а в процессе карбоксиметилирования получают 4,2 г d, 1-2-экзо-карбоксиметилбицикло 4.3,0 нонан 3,7-ДИОН-7,7-этилендиоксида, - М 254 м/е (р 1, q 2), и 4,8 г d,1-4-экзокарбоксиметилбицикло {4,3,0 нонан-3,7-дион-7,7-зтилендиоксида, называемого также d,l-2-3K30Kap6oK- симетилбицикло 4,3,О нонан-3,8-дион- -8,8-этилендиоксидом (р 2, q 1), M- 254 м/е.
Стадия Д, Аналогично стадии А 30 г 2-ацетоксипергидроазулен-6-она, также называемого 3-эндооксибицикло 5,. 3,0 декан-8-он-ацетат превращают в его этилендиоксид (29,1 г), Затем соединение омыляют, обрабатывая 2%-ным KjCOJ в водном метаноле, получая 3-зндооксибицикло 5,3,0)декан- -8-ОН-8,8-зтилендиоксид, который окисляют аналогично стадии Б и обрабатывают диметилкарбонатом, получая d,1-2-экзокарбоксиметилбицикло 5,3,0 декан-3,8 дион-8,8-этилендио.ксид
30
40
45
50
(21,2 г),,кс 254 нм, 7000,
Стадия Е, Бицикл о-/Ь-кето-( сложный зфир)-этилендиоксиды, полученные на . стадиях Б, Г и Д, восстанавливают следующим образом.
26
0
5
0
0
5
0
5
К перемешиваемому раствору бицик- ,ло-/5-кето-(сложный эфир)-этиленди- оксида (2,5x10 моль) в смеси 1:1 хлористый метилен - зтанол (50 мл), охлажденному до , добавляют порциями 0,9 r.NaBH, После дополнительного перемешивания в течение 30 мин при -20 С оставшийся гидрид разлагают, добавляя 12 мл ацетона. Реакционную Смесь нагревают до комнатной температуры, обрабатывают водным 20%-ным и, после удаления растворителя и разбавления водой (20 мл) ее экстрагируют хлористым метиленом. Органические фазы объединяют , промывают до нейтральности водой, сушат и упаривают досуха. Остаток уравновешивают обработкой абсолютным .метанолом (20 мл) и мети- латом натрия (0,54 г) в течение 12 ч при комнатной температуре, добавляют 0,59 г уксусной кислоты, затем упаривают растворители и экстрагируют хлористым метиленом, получая около 0,22x10 М следующих бицикло- -(-окси(сложный эфнр)-этш1ендиок- сидов:
d, 1-2 Э Зокарбоксиметил-3-зндо- бксибицикло 3,2,0 3 гептан-6-он-6,6- этилендиоксид, 300 м/е, в виде триметилсилилового эфира
d,1-4-Экзокарбоксиметил-З-зндо- оксибициКло 3,2,0 гептан-6-он-6,6- этилендиоксид, называемый также d,l-2-экcзoкapбoкcимeтил-3-зндo6кcи- бицикло 3,2,0}гептан-7-он-7,7-зтилен- диоксид, М - 300 м/е, в виде триметилсилилового зфира (ТМС)
d,l-2-Экзoкapбoкcимeтил-3-эндo- оксибицикло 4,3,0 нонан-7-он-7,7- зтилендиоксид, 328 м/е, в виде ТМС
d,1-2-Экзокарбоксиметил-2-зндо- оксибицикло 4,3,01нонан-8-он-8,8- зтилендиоксид,- М ,328 м/е, в виде триметилсилилового эфира
. d,l-2-Экзoкapбoкcимeтил-3-эндo- оксибицикло 5,3,0 декан-8-он-8,8- зтилендиоксид, М 342 м/е, в виде ТМС,
Далее раствор 2х10 М каждого из этих соединений в сухом хлористом метилене (25 мл) подвергают взаимодействию с 2,3-дигидропираном (2 г) и пара-толуолсульфокислотой (38 мг) 2х10 М в течение 2 ч при комнатной .температуре. Реакцию останавливают, добавляя 0,1 мл,пиридина, и смесь
упаривают досуха в вакууме, получая соответствугацие 3-ТГП-эфиры, которые используют без дальнейшей очистки.
Стадия Ж. З-Элдоокси-2-экзокар- боксиметиловые сложные эфиры и их 3-ТГП-простые эфиры, полученные на стадии Д восстанавливают, получая соответствующие 2-экзооксиметильные производные следующим образом: растг вор 2x20 М р кетоэфира (как спирта, так и 3-ТГП-простого эфира) в сухом этиловом эфире (25 мл)по каплям добавляют к перемащиваемой суспензии LiAlH (0,4) в сухом этиловом эфире (50 мя), После дополнительного пе ремещивания в течение 30 мин остаточный гидрид разлагают, добавляя ацетон (5 мл) и этиловый эфир, насыщенный водой. К смеси добавляют 12 г сухого MgS04, затем органическую фазу отфильтровывают и упаривают досуха . Получают 2-экзооксиметил-З- -эндооксипроизводные следующих сое- динений:
Бицикло Г3,2.02гептан-6 -он-6 ,6- этилендиоксид , М 342 м/е, в виде бис-ТМС
Бицикло 3.2.0 гептан-7-он-7,7- этилендиоксид , М 342 м/е, в виде бис-ТМС БициклоГ4 .3.0 нонан-7-он-7,7- этилендиоксид , М 370 м/е, в виде бис-ТМС
Бицикло 4.3.0 нонан-8-он-8,8- этилендиоксид , 370 мУе, в ни- де бис-ТМС Бицикло 5 .3.0 декан-8-он-8,8- этилендирксид, М 384 м/е, в виде бис-ТМСи их З-эндо-окси-ТГП-простые эфиры в рацемической форме (нат, энт) когда в процессе восстановления используют оптически активный материал, получающийся в результате оптического расщепления.
Стадия 3. Омьшен ием 2%-ным KjCOj в 80%7ном водном метаноле cj, 1-2-экзо- карбоксиметил-3-эндооксибицикло 4.3.0 JHOH ан-8-он-8,8-диэтилендиок- сида (4,5 г) получают 4,2 г свободной кислоты .
К раствору свободной кислоты (4,2 г) в 120 мл ацетонитрила до- б.авляют d(+)-эфедрин (1,3 г). После 4 ч выдержки при комнатной температуре кристаллизуется 2,8 г соли. После дальнейшей перекристаллизации из ацетонитрила получают 2,15 г d(+)эфедриновой соли (+)-3-эндоокси-2- -экзооксибицикло 4.3,0 нонан-8-он- -8,8-этилендиоксида. Все маточные
растворы соединяют, упаривают досуха; остаток растворяют в воде и обрабатывают 1 н. NaOH до щелочного рН (12-13), d(+)-эфедрин выделяют экстракцией эфиром, затем щелочной
водный раствор подкисляют рН 5, экстрагируют этилацетатом. Органический слой объединяют и упаривают досуха . Остаток разбавляют ацетонитри- лом, и процедуру повторяют, используя (-)-эфедрин, получая (-)-2-экзо- карбокси-3-эндооксибицикло 4,3, ;нан-8-он-8,8-этилендиоксид- -(-)- эфедриниевую соль. Каждую из солей отдельно растворяют в смеси вода оптически активное основание выделяют экстракцией этиловым эфиром, водную щелочную фазу подкисляют до рН 5-5,1 и экстрагируют этилацетатом, получая 2-экзокарбокси-3- Эндоокси- (+)-бицикло 4,3,0 нонан-8-он-8,8- этилендиоксид и 2-экзокарбокси-З-эн- доокси-(-)-бицикло 4,3,0 нонан-8-он- -8,8-этилендиоксид, которые превращают в сложные метиловые эфиры обработкой диазометаном.
Стадия И. Раствор 26 г ё,1-2-экзо- карбоксиметил-(СН5-СО-0)-3-эндоокси- бицикло 4.3,0 -7-он-7,7-этилендиок- сида в ацетоне (100 мл) кипятят с
обратным холодильником с 2 н. HjSO4 (20 мл) в течение 4 ч,
Ацетон упаривают в вакууме и водную фазу экстрагируют этилацетатом. Объединенные органические экстракты
промывают до нейтральности, сушат и упаривают, получая 21,2 г d,1-2-экзо- кар боксиметил-3-эндооксибицикло 4,3.OJ нонан-7-она. К раствору .jceTOHa в сухом ацетонитриле (250 мл) добавляют
12,1 г d,l-фeнил-l-этилaминa и растворитель медленно отгоняют, выделяя 50 мл за 30 мин. Смесь медленно охлаждают при комнатной температуре и затем после фильтрования собирают
12,12 г (+)-2-экзокарбоксиметил-3 -эндоокси-7,7-(1 -фенил-1 -этилиден- имин)-бицикло 4.3.0 нонана. Маточные растворы концентрируют далее, получая 6 г рацемичного , материала,
Дальнейшим концентрированием до- 80 мл получают 11,42 г (-)-2-экзокар- боксиметш1 3-эндоокси-7,7(1 -фенил- -l -этиллидениминобицикло 4.3, нана.
Отдельно два у иффовых основания расщепляют при кипячении с обратным холодильником в смеси метанол 2 н, (2рО-мл)80:20 в течение 2 ч. Растворитель упаривают в вакууме и по сле экстрагирования этилацетатом, объединенные органические фазы промывают до нейтральности, сушат и упаривают в вакууме, получая 8,1 г (+)-2 экзокарбоксиметил-3-эндоокси- бициклоГ4.3,0 нонан-7-она и 7,2 г (-) -2-экзoкapбoкcимвтил 3- Эндookcи- бицикл о 4,3,0 нонан У-она соответственно .
По этой методике все бицикло уЗ- -окси-(карбоноксиловый сложный эфир) этилендиоксиды стадии Е дают (+) и (-)-оптические изомеры 2-экзокар- боксиметил-3-эндооксипроизводных: бицикло 3,2.0 гептан-6-она, бицикло- 3,2,0 гептан-7-она, бицикло 4.3,0 нонан-7-она, бицикло 4,3,0 нонан- -8-она, бицикло 5.3,02декан-8-она.
Согласно стадии Г эти кетоны превращают в их эт илендаоксидные производные.
Стадия К, Если оптически активный исходный материал - производное 2-экзокарбоксиметил-3-эндооксиэти лендиокси, полученное на стадиях 3 или 4, и их З-ТГП-простые эфиры используют в процессе восстановле- ния, то получают соответствующие оптически активные 2-оксиметилпроиз- водные,
Стадия Л. Исходя иэ 2-экзооксиме- тил-ТГП-эфирных соединений стадий Ж и К получают соответствующие альдегиды окислением: 0,64 г дицикло- гексилкарбодиимида, 0,1 мл пиридина и 0,05 мл трифторуксусной кислоты последовательно добавляют к перемешиваемому раствору оксиметильного соединения (2x10 М) в смеси 75:25 бен- . зол ДМСО (6мл). Спустя 4,5 ч реакционную смесь разбавляют бензолом (20 мл) и водой (10 мл) и перемешивают в течение 30 мин.. Дициклогексилмочевину отфильтровывают . Органический слой промывают водой до нейтральности и концентрируют до 10 мл.
Получают раствор в сухом бензоле следуюпщх альдегидов:
2-Экзоформул-3- Эндо-ТП1-оксиби- цикло З,2.О гептан 6-он-6,6-этилен- диоксид, Н.- 102 108 м/е
2-Экзоформил-3-эндо-ТГП оксиби- цикло ГЗ.2,0 гептан-7-он-7,7-этш1ен- диоксид,ГМ - 102J 180 м/е 2 Зкзоформил 3-эндо-ТГП-оксиби- цикло 4,3,0 нонан-7-он-7,7-этилен- диоксид, ГМ - 102} 208 м/е
2-Экзоформил-З-эндо-ТГП-оксиби- циклои.З.О}нонан-8-он-8,8-этш1ен- диоксид, Н 102 208 м/е
2-Экзоформил-З-эндо-ТГП-оксиби- цикло 5,3,ОJдйкан-8-он-8,8-этилен- диоксид,М - 102j 222 м/е.
Эти соединения используют в сле- дующих реакциях Виттинга-Хорнера без дальнейшей очистки.
Стадия М, Раствор (2-оксо-гептил) диметилфосфоната (0,49 г) в 6 мл бен- зола добавляют по каплям к перемеши- ваемой суспензии NaH (80%-ная дисперсия в минеральном масле, 66 мг, 2,2x2 М) в 15 мл бензола. После дополнительного перемешивания в течение 45 мин добавляют раствор 2x10 М альдегида из стадии Л. Спустя еще 1ч реакцию останавливают, добавляя раствор уксусной кислоты в бензоле; органическую фазу промывают водой до нейтральности, сушат и упаривают досуха.
Остаток абсорбируют на SiOj, а .затем элюируют смесью циклогексан - этилацетат, получая следующие 2-экзо- -(3 оксо-окт-1 -транс-енил)- 3-эндо- окси-ТГП-простые эфиры:.
Бицикло З.2.о гептан-6-он-6,6- этилендиоксид, м - 1021 276 м/е
Бицикло 3,2,0 гептан-7-он-7,7- этилендиоксид, Гм - 102J 276 м/е Бицикло 4,3.0 нонан-7-он-7,7- этилендиоксид, 102 304 м/е
Бицикпо 4,3.OJ нонан-8-он-8,8- этилендиоксид, ГМ - I02J 304 м/е
Бицикло 5.3.0 декан-8 он-8,8- этилендйоксид, СМ - 102 318 м/е Стадия Н. Аналогично стадии М из различных диметилфосфонатов получают следующие о,/3 -ненасыщенные кето- ны:
а) при взаимодействия 2-экзофор- мил-3-эндо-ТП1-оксибицикло 3.2. ТИЛ-7-ОН-7,7-этилендиоксида (2 ) с 2-окса-3(5,К)-фторгептил) диметилфосфонатом (0,54 г) получают З-эндо-ТГП-окси-2-экзо- 3 -оксо- -4 ЧЛ,Я)-фтор-окт-) -транс-внил би- 1Д1КЛО 3. 2. OJ гептан-7-он-7, 7-эт -тен- диоксид (0,72 г),Д(.(кс 229 нм, g 9900 ,+98° (СНС1з);
10
20
б)при взаимодействии 2-формил- бицикло 3,2,0 гептан-6 он-6,6 этилен- диоксида (2x10 М) с (2 оксо-октил) диметилфосфонатом получают 3-эндо- -ТГП-окси 2-экзо(3 -оксо-нон-1 - -транс-енил)-бициклоСЗ,2,Оjгептан- -6-ОН-6,6-этилендиоксид,
228 нм, 9300, tM- - 02J 290 м/е;
в)при взаимодействии 2 формш1- бициклоГЗ,2,0 гептан-7-он-7,7-эти- лендиоксиальдегида с (2-оксо-4-фенил- бутил)диметилфосфонатом (0,565. г) получают .3-эндо-ТП1-окси-2-экзо-(3 - 15 окср-5 -фенилпент-1 -транс-енШ1)би- цикло Сз,2,0 J гептан-7-он 7,7-этилен- диоксид, 102 310 м/е;
г)при взаимодействии 2-формил - бицикло 4,3,0}нонан-7-он-7,7-этилен- диоксид с 0,52 г (2-оксо-38-метил- гептил) и с (2-оксо-ЗК-метил-гептил) диметилфосфонатом получают соответственно 2-экзо-(3 -оксо-Д S-MBTmi- -OKT-l -транс-енил)-3-эндо-ТГП-окси- бидикло 4.3,0}нонан 7-он-7,7-этилен- диоксид, CM - 102j 318 м/е, и 2-экзо (З -оксо-4 -метил-окт-1 - -транс енил)-3-эндо-ТГП-оксибидикпо Г4,3,ОЗионан-7-он-7,7-этштендиоксид, М - 1027 318 м/е.
Стадия О, Пиридингидробромидпер- бромид (CfHjN/HBr-Вг 2) 0,8 г ляют к перемешиваемому раствору 2- -экзо-СЗ -оксо-4 (К,8)-фтор-окт- -l транс-енил }-бициклоСЗ, 2,0J-3- -эндо-ГТП-оксигептан-7-он-7,7-этилен- диоксида из стадии Н в сухом пиридине (15 мп), После дополнительного перемешивания в течение 4 ч при ком- иатной температуре остаток отфильтровывают и органический элюат пределяют между льдом, 2 и, и этилацетатом. Органический слой последовательно промывают холодным 0,5 н, , рассолом (NaCl), 1%-ным карбонатом натрия и водой до нейтральности, получая 0,71 г -бром-4 ()-фторс оединения, которое является смесью 2-диастереоизо- мер ных и 4 R-произвбдных, С помощью высокоэффективной жидкости хроматографии на SiOi с элюентом этиловый эфир (85:15) получают изо д1С (кс 251 нм, f 9750,ГМ - - 102J 372, 374 м/е.
Используя на стадиях Н и О различные в/ ,э ненасыщенные кетоны, получают следующие соединения: 2-эКзо- -(2 -бром-3 -OKCo-HOH-l -транс-енил) - -3-эндо-ТГП-оксибицикло 13,2,0 Jгептан- -6-ОН-6,6-этилёндиоксид, 102J 368, 370 м/е и 2 экзо-(2 -бром- . -3 -оксо-окт-1 -транс-енил)-3-эндо- . -ТГП-окси-бицикло t4,3,0 нонан-7-он- -7,7-этилендиоксид, 102 382, 384 м/е.
Стадия П, Согласно стадиям М, Н, О получают 3-эндо-ТГП-окси-производ- ные следуннцих соединений:
2-Экзо-(3 S-oKCH-oKT-l -транс- -енил)-бицикло t3,2, OjrenTaH-6-он- -6,6-этш1ендиоксид,Гм 380 м/е
2-Экзо-(3 8 окси-окт-1 -транс- -енил)-бицикло ГЗ.2,02гептан-7-рн- -7,7-этилендиоксид, М 380 м/е 2-Экзо-ГЗ S-окси-окт-1 -транс- 25 -енилЦ-бицикпо 4,3,0 нонан-7-он- -7,7-этилендиоксид, М 408 м/е
2-Экзо- ( З 5-окси окт-1 -транс- -енил)-бицикло 4,3,0 нонан-8-он- -8,8-этилендиоксид, М 408 м/е
2-Экзо-(2 -бром-3 8-окси-4 К- -фтор-окт- -транс-енил)-бицикло . Сз.2,03 гептан-7-он-7,7-этилендиоксид ., 476, 478 м/е
2-Экзо-(2 -бром-З S ;:юкси-4 |5- фтор-окт 1 -транс-енил)-бицикло 3.2,0 гептан-7-он-7,7-этилендиок сид, М 476, 478 м/е
2-Экзо-(2 -бром-3 -5-окси-нон-1 - -транс-енил) -бицикло ГЗ, 2,0 гептан- -6-ОН-6 ,6-зтилендиоксид, 472, 474 м/е,
2-Экзо-(3 8-окси-нон-1 -транс- -екил)-бицикл о 2,0 гептан-6-он- -6,6-этш1ендиоксид, М 394 м/е
2-Экзо-(3 8-ОКСИ-5 -фенил-пент- -1 -транс-енил)-бицикло 3.2,03геп- тан-7-он-7,7-этилендиоксид, М 414 м/е
2-Экзо-(2 -бром-3 8-ОКСИ-ОКТ-1 - -транс-енил)-бицикло 4,3,OЗнoнaн- -7-oн-7,7-этилeндиoкcид, М 486, 488 м/е
30
40
45
50
2-Экзо-(3 8-окси-4 8-метил-окт- -1 -транс-енил)-бицикло С4,3,0j нонанмеры 0,22 г 3-ЭНДО-ТП1-ОКСИ-2-ЭКЗО- gg 7-он-7 7-этилендиоксид, М 422 м/е -(2 -бром-З -оксо-4 -фтор-окт-1 -. 2-Экзо-(3 8-окси-4 К-метил-окт-1 -транс-енил )-бицикло 3,2,0}гептан- -7-ОН-7,7-этилендиоксид, ( нм, 9830 и 0,19 г 4 8-фторизомера,
СЗ
-транс-енил)-бицикло 4,3.ОЗнонан-7- -он-7,7-этилендиоксид, М 422 м/е,
соответствующие 3 R-оксиизомеры каж0
0
5
д1С(кс 251 нм, f 9750,ГМ - - 102J 372, 374 м/е.
Используя на стадиях Н и О различные в/ ,э ненасыщенные кетоны, получают следующие соединения: 2-эКзо- -(2 -бром-3 -OKCo-HOH-l -транс-енил) - -3-эндо-ТГП-оксибицикло 13,2,0 Jгептан- -6-ОН-6,6-этилёндиоксид, 102J 368, 370 м/е и 2 экзо-(2 -бром- . -3 -оксо-окт-1 -транс-енил)-3-эндо- . -ТГП-окси-бицикло t4,3,0 нонан-7-он- -7,7-этилендиоксид, 102 382, 384 м/е.
Стадия П, Согласно стадиям М, Н, О получают 3-эндо-ТГП-окси-производ- ные следуннцих соединений:
2-Экзо-(3 S-oKCH-oKT-l -транс- -енил)-бицикло t3,2, OjrenTaH-6-он- -6,6-этш1ендиоксид,Гм 380 м/е
2-Экзо-(3 8 окси-окт-1 -транс- -енил)-бицикло ГЗ.2,02гептан-7-рн- -7,7-этилендиоксид, М 380 м/е 2-Экзо-ГЗ S-окси-окт-1 -транс- 5 -енилЦ-бицикпо 4,3,0 нонан-7-он- -7,7-этилендиоксид, М 408 м/е
2-Экзо- ( З 5-окси окт-1 -транс- -енил)-бицикло 4,3,0 нонан-8-он- -8,8-этилендиоксид, М 408 м/е
2-Экзо-(2 -бром-3 8-окси-4 К- -фтор-окт- -транс-енил)-бицикло . Сз.2,03 гептан-7-он-7,7-этилендиоксид ., 476, 478 м/е
2-Экзо-(2 -бром-З S ;:юкси-4 |5- фтор-окт 1 -транс-енил)-бицикло 3.2,0 гептан-7-он-7,7-этилендиок сид, М 476, 478 м/е
2-Экзо-(2 -бром-3 -5-окси-нон-1 - -транс-енил) -бицикло ГЗ, 2,0 гептан- -6-ОН-6 ,6-зтилендиоксид, 472, 474 м/е,
2-Экзо-(3 8-окси-нон-1 -транс- -екил)-бицикл о 2,0 гептан-6-он- -6,6-этш1ендиоксид, М 394 м/е
2-Экзо-(3 8-ОКСИ-5 -фенил-пент- -1 -транс-енил)-бицикло 3.2,03геп- тан-7-он-7,7-этилендиоксид, М 414 м/е
2-Экзо-(2 -бром-3 8-ОКСИ-ОКТ-1 - -транс-енил)-бицикло 4,3,OЗнoнaн- -7-oн-7,7-этилeндиoкcид, М 486, 488 м/е
0
0
5
0
7-он-7 7-этилендиоксид, М 422 м/е . 2-Экзо-(3 8-окси-4 К-метил-окт-1 СЗ
-транс-енил)-бицикло 4,3.ОЗнонан-7- -он-7,7-этилендиоксид, М 422 м/е,
соответствующие 3 R-оксиизомеры каждого из вышеприведенных соединений. Каждый из этих кеталей превращают в соответствующий кетон и одновременно удаляют защитную группу ТГП, получая таким образом соответствующее 3 окси- пр оизводное по следующему способу: раствор IxlO M бициклб-ТГП-окси-эти- лендиоксида в ацетоне (15 мл) кипятят с обратным холодильником с 1 н. щавелевой кислотой (Ю. мп) в течение 8 ч. Ацетон упаривают в вакууме и водную фазу экстрагируют этиловым эфиром. Объединенные экстракты после обычной обработки упаривают досуха, получая около (0,6-1)х10 М оксике- тона.
Пример 9. 5г с1,1-2 экзо- карбоксиметил-7-эндооксибицикло Гз. 3.0)октан-7-эндо-ДМТБ силилового ; эфира (по примеру 1, стадия Б) в 100 МП водного метанола омыляют 2 г КОН при температуре кипения с обратным холодильником. После удаления метанола в вакууме водный раствор калийной соли экстрагируют для удаления нейтральных примесей, подкисляют и экстрагируют этиловым эфиром. Последние экстракты объединяют и упаривают досуха, получая 4,5 г d,l- кислоту, которую затем разделяют на оптические антиподы (+) и (-) эфедрином .
1,32г (-)-7-эндооксибицикло 3.3.0J октан-7-ДМТБ-(силиловый простой эфир)- -2-экзокарбоксикислоты растворяют затем в 20 мл ТГФ и обрабатывают 10 МП 1 М BHi, в ТГФ. После 4 ч вы-, держки при комнатной температуре избыток реагента разлагают, осторожно добавляя 20 мл 1,5 н. NaOH. Затем ТГФ удаляют в вакууме и водную фазу экстрагируют этиловым эфиром. Объединенные органические экстракты промывают до нейтрализации и упаривают опуская обработку диазометаном,
досуха, получая 1,02 г (-)-7-эндо- -окси-2-экзооксиметилбицикло 3.3.Oj (ЭКтан-7-ДМТБ-силилового эфира, М 270 м/е.
Ллалогично получают (+)-изомер и рацемическую смесь.
Пример 10. В атмосфере инертн.ого газа перемешиваемую суспензию 0,4 г NaOH (75%-ная дисперсия в минеральном масле) в 13,5 мл ДМСО нагревают до 60-65 С в течение 4 ч. Затем смесь охлаждают до комнатной температуры и выдерживают при 20- , при этом последовatельно добав50
получают следующее соединения:
5 (c,t), 13t-lU, 158-Диокси-9а- -деокси-9 а-метилен 17-циклогексил-1 19, 20-.тринор-простацикл-5, 13-диено вая кислота, ЯМР (CDClj) РРм: 3, (Ш, м.); 4,03 (Ш, м.); 5,27 (Ш, щирокий т.); 5,5 (2Н, м.)
5 (c,t), nt-lU, 158-диокси-9а- -деокси-9а-метилен-17 (2 -тетрагидр gg фурил)-18,19,20-тринор-простацикл- -5,13-диёновая кислота, ЯМР(СОС1з) Л РРм: 3,60-4,24 (5Н, м.); 5,26 (Ш, т.); 5,53 (2Н, м.); 7,33 (ЗН, широкий с.)
0
5
0
5
0
5
0
ляют 2,6 г 4-карбоксибутилтрифенил- фосфонийбромида в 6 мл ДМСО и 0,85 г 2-экзо-(3 8-окси-нон-1 -транс-1 - -енил)-3-эндооксибициклоГЗ. 3.0 |октан- -7-ол-3,3 -биС-ТГД-простого эфира. После перемешивания в течение 3 ч смесь разбавляют 35 мл воды и водную фазу экстрагируют этиловым эфиром (5x12 мл) и смесью этиловый эфир - бензол (17x12 мп). Объединенные органические экстракты повторно экстрагируют 0,5 н. NaOH (13x15 мл) и водой до нейтрализации, а затем сливают . Объединенные водные щелочные экстракты подкисляют.до рН 5,3 и экстрагируют смесью 1:1 этиловый эфир - пентан. Промывают до нейтрализации, сушат над Na2SO;j и удаляют растворитель , после, чего получают 0,86 г 11,15-бис-ТГП-простого эфира 5,13t- -110 155-диокси-9а-деокси-9а-метилен- -20-метилпростациклин-5,13-(диеновой кислоты).
Полученный продукт затем эт ерифи- цируют обработкой диазометаном, и удаляют пиранильные защитные группы следующим образом.
Сложный метиловый эфир растворяют в безводном метаноле и обрабатывают раствором 10-i молярного эквивалента пара-толуолсульфокислоты. Спустя 4 ч пара-толуолсульфокислоту нейтрализуют пиридином и полученную смесь упаривают досуха. После очистки на силикагеле получают сложный метило- . вый эфир 5,13t-l lo/ 15S-диoкcи-9a-дe- oкcи-9a-мeтилeн-20-мeтшI-пpocтaцикл- -5, П-диеновой кислоты, HjOj 360, который затем разделяют на Iотдельные 5 с-, 131-и 5t-l3t-H3OMepM жидкостио-жидкостной хроматографией.
Используя аналогичную методику.
0
получают следующее соединения:
5 (c,t), 13t-lU, 158-Диокси-9а- -деокси-9 а-метилен 17-циклогексил-17, 19, 20-.тринор-простацикл-5, 13-диено- вая кислота, ЯМР (CDClj) РРм: 3,74 (Ш, м.); 4,03 (Ш, м.); 5,27 (Ш, щирокий т.); 5,5 (2Н, м.)
5 (c,t), nt-lU, 158-диокси-9а- -деокси-9а-метилен-17 (2 -тетрагидро- g фурил)-18,19,20-тринор-простацикл- -5,13-диёновая кислота, ЯМР(СОС1з), Л РРм: 3,60-4,24 (5Н, м.); 5,26 (Ш, т.); 5,53 (2Н, м.); 7,33 (ЗН, широкий с.)
35
5 (c,t), 13t-l lcx 15S-диoкcи-9a- -дeoкcи-9a-мeтилeн- 17 фенил-18, 19, 20- тринор простацикл-5, 13-диеновая кислота, ЯМР (CDCl), с/, ррм: 2,67 (2Н, т.); 3,68 (1Н, м.); 4,09 (1Н, м.); 5,26Ч1Н, широкий т.); 5,5 (2Н, м); 7,27 (5Н. с.)
5 (c,t), 13t-llof, 153-диокси-9а- -деокси-9а-метилён-1б-фенокси-17, 18 19, 20-тетранор простацикл- 5, новая кислота, ЯМР (CDClg), f, ppm: 3,78 (IH, м.); 3,98 (2Н, д.); 4,52 (1Н, м.); 5,25 (Ш, т.); 5,70 (2Н, м,); 5,75 (ЗН, широкий с) ; 6,80 7,45 (5Н, м.)
Аналогично получают 5t-llc/, 15S- -диокси-9а-деокси-9а-метилен-20-ме- тилпростацикл- 5 ен-1 3 иновую кислоту , ЯМР (CUCl) , с/, ppm: 0,90 (ЗН, т.); 4,00 (1Н, м.); 4,40 (Ш, т.); 5,30 (1Н, т.)иее 5с изрмер, ЯМР (СВС1з) f, ppm: 0,90 (ЗН, т.); 4,00 (Ш, м.) 4,40 (1Н, т.);. 5,27 (1Н, т.), атакже 5t-11 о/, 1 5К-диокси-9а-деокси-9а-мети лен-20-метилпростаци1сл-5 ен-1 3-ино- вую кислоту, ЯМР (CDC1 з), с/, ppm: 0,90 (ЗН, т.); 4,00 (Ш, м) ; 4,39 (Ш, т.); 5,30 (Ш, т.) и ее 5с- изомер, ЯМР (CDClg), (/, ppm: 0,90 (ЗН, т.); 4,00 (Ш, м.); 4,40 (Ш, т.); 5,28 (1Н, т.).
Пример 11, При перемешивании и охлаждении извне для поддер- жания реакционной температуры 20-22 раствор полученного трет-бутилатка- лия в 12 мл безводного ДМСО обрабатывают последовательно 1,8 г 4-карбо- ксибутилтрифенилфосфонийбромида в 10 мл ДМСО и 0,65 г 2-экзо-(2 -бром- -З 5-окси-окт-1 -транс- -енил)-3- -эндооксибицикло 3.3.0 Зоктан-7-он- -3,3 -бис-ТГП-простого эфира в 5 мл ДМСО, После перемешивания в течение 8 ч при комнатной температуре, полученную смесь разбавляют таким же количеством воды, подкисляют до рН 5 и экстрагируют смесью 1:1 этиловый зфир - пентан. Кислотные водные фазы сливают, Объединенные органические экстракты экстрагируют 0,8 н. NaOH (5x20 мп), а затем водой до нейтрализации. После слива органических фаз водные П1елочные экстракты подкисляют до рН 5 и экстрагируют сме- 2ью 1:1 этиловый эфир - пентан. Объединенный экстракт сушат над , фильтруют и обрабатывают эфирным диазометаном до желтого окрашивания.
1
15
20
, Q
, ; - 25
С
6058236
После выпаривания досуха получают сырой 1 lo/ , 155-диокси-9а-деокси-9а- -метиленпростацикл-5-ен-13 иновая кислота (сложный метиловый эфир)- -11, 15-бис-ТП1-простой эфир. После удаления пиральной защитной группы и последующего разделения жидкостно- жидкостной хроматографией получают сложный метиловый эфир 5с-11с/, 15S- -диокси-9а-деокси-9а-метиленпрпста- цикл-5-ен-13-иновой кислоты и 5t-reo- метрический изомер, СМ - 344 м,/е; Г - - 300 м/е; СМ - - м/е. Аналогично получают соединения по примеру 10.
Пример 12. При использовании по примерам 10 и 11 бицикло ГЗ.3,OJ октан-7-он-З,3 -бис-ТГП-прос- тых эфиров, полученных по примерам I (стадия 0) и 2-4, получают сложные метиловые эфиры следующих кислот:
5с, 13t-lla , 158-Диокси-9а-деокси- -9а-метиленпростапикл-5, 13-диеновая кислота, М - H,jO 346 м/е
5с - 11о, 158-Диокси-9а-деокси- -9а-метилен-16К-фторпростацикл-5-ен- -13-иновая кислота, 362 м/е
5с - 1Ы, 153-Диокси-9а-деокси- -9а,метилен-165-фторпростацикл-15- -ен-13-иновая кислота, - HjOj 362 м/е
5c-llof, 153-диокси-9а-деокси-9а- -метилен-17(2)-тетрагидрофурил-18, 19, 20-тринор-простацикл-5-ен-13-иновая кислота, - 386 м/е
5с-11й , 158-Диокси- 9а-деокси-9а- -метиленпростацикл-5-ен-13-иновая кислота, . H,jO 344 м/е
5с, 13t-llo , 1,58-Диокси-9а-деокси- -9а-метиленпростацикл-5,13-диеновая кислота, - 346 м/е
5с, 13t-llo/, Г58-Диокси-9а- дёокси- -9а-метилен-- 63-метилпростацикл-5,13 -диеновая кислота, М -Н50 -360 м/е
5с, 13t-11« , 15Я-Ди.окси 9а-деок- си-9а-метилен-2() -метилпростацикл-5, 13-диеновая кислота,fM -Hj 0 360 м/е
5с, l3t-lU, 15S-Диoкcи-9a-дeoк- cи-9a-мeтилeн-l 7-циклогексил-18, 19, 20-тринор-простацикл-5, 13-диеновая g кислота, ГКМ120 37. м/е
5с, 13t-lle, 15Б-Диокси-9а-деокси- 9а-метилен-17-фенш1-18,19,20-тринор- простацикл-5,1З-диеновая кислота, м/е и их 5-транс-гео-
30
35
40
45
50
13
37
метрические изомеры, в частности сложный метиловый эфир St-l-la, 15S- диокси 9а-деокси--9а-метиленпроста- цикл-5 ен -13-иновой кислоты и 15R- эпимеры обоих, в особенности сложный ме гиловый .эЛир 5t-llc/, 15Н-диокси- 9а-деокси-9а метиленпрос тацикл--5--ен- -13-иновой кислоты. Все сложные метиловые эфиры затем омьшяют, получая :свободные кислоты, в особенности 5t-l Ы, 158-диокси-9а деокси -9а-ме- ,тиленпростацикл -5-ен 13-иновую кислоту , ЯМР (CDClj), Л РРт: 0,90 (ЗН, т,); 4,00 (1Н, м); 4,40 (IH, широ- кий т.); 5,28 (1Н, иир окий т.); и 5t-1 Ы, 153-диокси-9а-1деокси-9а-ме- тиленпростацикл-3-ен-1З-иновую кислоту , ЯМР (CDC1.3),V, ppm: 0,90 (ЗН, т.); 4,00 (Ш, м.-); 4,39 ( 1Н, гшро- кий т.); 5,29 (1Н, широкий т.).
Пример 13. Раствор (0,45 г) 2-экзо-(З S-окси-окт-1 -транс-1 - -енил)-3-эндооксибицикло ГЗ,3,0 октан -7-он-3,3 -бис-ТГП-простого эфира в этилацетате гидрируют при температуре окружающей среды и нормальном давлении в присутствии 0,1 г 5%-ного Pd (CaCOj), до поглощения 1,01 эквивалента водорода. После фильтрования и выпаривания досуха получают 0,42 г 2-экзо(З В-оксиоктан-1 -ил- -3-эндо-оксибициклоГЗ,3,0 октан-7- -он-3,3 -бис-ТГП-простого эфира.Обработкой этого соединения реагентом Виттига, полученным из 4-карбокси- бутилфосфонийбромида по примерам 10-12 получают продукт, который эте- рифицируют диазометаном и депранили- зируют, в результате чего получают 0,12 г сложного метилового эфира По/ 15Б-диокси-9а-деоксиметиленпроста- цикл-5-еновой кислоты, м/е.
С помощью жидкостно-жидкостной хроматографии вьщеляют 5-цис- и 5- транс-геометрические изомеры.
Аналогично получают 5t-llo/, 15S- -диокси-9 а-деок си-9 а-метилен-2 0-э тил- простацикл-5-еновую кислоту, ЯМР { CDClj j, c/i, ppn: 0,91 (ЗН, т.); 2,35. (2Н, т.); 3,5-3,9 (2Н, м.);. 5,26 (1Н, т.); 5,6 (ЗН, пшрокий с).
Пример 14. Используя (З-карб- оксипропил)-фосфинийбромид вместо (4-карбоксибутил)-фосфонийбромида, аналогично примерам 12 и 13 получают: следующие кислоты:
1360582
38
5 0
5
0
5
0
5
0
g
5с, I3t-llo/, 153-Диокси-9а-деок- си-9а-метилен-2-нор-простацикл-5,13- -диеновая, м/е
5с-11 о1, 15В-Диокси-9а-деокси-9а- -метилен-2-нор-простацикл-5-еновая, м/е
5с-11« , 1 55-Диокси-9а-деокси-9а- -метилен-.-нор-простацикл-5-ей-13- -иновая, rM -H20J 316
Пример 15. Используя (5-карб- оксипентил)-фосфонийбромид по примерам 12 и 13 получают 5с, 13t-1Ы, 153-диокси-9а-дeoкcи-9a-мeтилeн-2- -агомо -простацикл-5, 13-диеновую кислоту , м/е, ГМ -СНз} 565 м/е, в виде трис-триметилсилиловых эфи- ров и 5,13t-ll-ci, 158-диокси-9а-деок- си-9а-метилен-20-метил-2-агомо-про- стацикл-5,13-диеновую кислоту, М 594 м/е, м/е, в виде трис-триметилсилиловых эфиров.
Пример 16. Раствор (0,37 г) сложного метилового эфира 5с, i3t- -1Ы, 153-диокси-9а-деокси-9а-мети- ленпростацикл-5,13-диеновой кислоты из примера 12 нагревают до . в 10 мл бензола с 250 мг 2,3-дихлор- -5,6-дицианобензохинона в течение 8 ч. Осадок удаляют фильтрованием. Бензольный раствор очищают на корот- .кой колонке из окиси алюминия, в .результате чего получают 0,29 г сложного метилового эфира 5с, 13t-ll 5 - -окси-15-оксо-9а-деокси-9а-метилен- простацикл-5,13-диеновой кислоты, M/e,CMMiiO 344 м/е.
Раствор- этого продукта в си этило вый эфир - толуол охлаждают до -20°С и обрабатывают 1,2 мл 1 М метилмагнийбромида в этиловом эфире. Спустя 2,5 ч при -20°С реакцию гасят раствором . Отделяют органическую фазу, уменьшают объем и очищают на силикагеле (элюент:смесь этиловый эфир - этиладетат),в результате чего получают 0,1 г сложного . метилового эфира 5с, 13t-11(/, 153-деокси-15-метил-9а-деокси-9а-ме- тиленпростаникл-5,13-диеновой кислоты , 360 м/е и 0,072 г 15R- -оксиэпимера.
Пример 17. Раствор 3-эндо-ок- си-2-экзо-(2 Я-ацетоксигептаноамидо)- -бицикло СЗ,3,0J октан-7-он-З-ацетата, М 367 м/е,,из примера .6 в .безводном диметилсульфоксиде подвергают взаимодействию с илидом формулы (ill), полученным из 4ткарбоксибутилтрифенилфосфонийбромида , и после омыления получают 5с, t-1Ы, 153-диокси -8а-деокси-9а-метилен - З-аза-1 4-ок- сопростадикл -5-еновую кислоту, 5ШР (СВС1з),с/ , ррт: 0,89 (ЗН, т.); 3,64 (Ш, м.); 3,97 (1Н, м.); 4,10 (1н, м.); 5,33 (1Н, вшрокий т.); 7,52 (1Н, широкий д.), которую подверга- ют хроматографии, получая 5с t-lM, 153-диокси-9а-деокси-9а-метилен-13 -аза-14-оксопростацикл-5--еновую кислоту- , м/е, в виде трис-три- метилсилилового эфира, ЯМР (свободная кислота) (CDClj-), с/, ррш: 0,89 (ЗН, т.); 3,64 (1Н, м,); 3,97 (IH, м); 4,10 (IH, м); 5,33 (1Н, широкий т.); 7,52 (Ш, широкий т.); ИК (чис- тьй), , см- : 3360, 3300, 1705, 1630
1545. Аналогично получают соответствующее 15К оксисоединение из 2К -ацет- окси исходного соединения примера 6. Пример 18. В атмосфере азота к.перемериваемому раствору трет-бу- тилаткалия (3,36 г), свежесублимиро- ванного, в сухом ДМСО (36 мл) добав- ляют 6,5 г 4-карбоксибутилтрифенил фосфонийбромида, получая темно-красный раствор илида. После добавления раствора 2-экзо-(З R-окси-4 )-фенок- си-бут- -транс-енил)-3-эндоокси- бицикло 4,3,()нонан-7-она (0,8 г) в 9 мл сухого JIJ ICO реакционную смесь перемеиивают в течение 5 ч при 2°С, охлаждают, разбавляют водой (50 мл), подкисляют до рН 5 и.экстрагируют этиловым зфиром ( мл).Водную фазу отбрасывают. Объединенные эфирные экстракты промьшают водой (Ю мл причем эту промывку сливают), и 0,5н. NaOH (Д 6 мл) и водой до нейтрализации . Объединенные щелочные экстракты подкисляют до рН 5 и экстрагируют этиловым эфиром. Органические фазы объединяют, сушат и упаривают досуха, в результате чего получают 5(Z,E), 13t-llo/, 15R-дйoкcи-9a- -деокси-9а-7-агомо-диметилен-16-фен- окси-17,18,19,20-тетранор-простацикл -5,13-диеновую кислоту (смесь 5с- и 5 -ге6метрических изомеров) , 400 м/е, м/е (Z и Е cooTB.eTCTB iTOT цис- и транс-).
Индивидуальные геометрические изомеры получают после хроматографи- ческого разделения на кислотной SiO,j (40 г на каждый 1 г кислоты), используя в качестве элюентов смесь циклогексан - этилацетат.
Пример 19, Используя кето- спирты по примеру 7, часть Г, анало- гично примеру 18, получают следующие простациклановые кислоты:
5c-13t-l Ы, 158-Диокси--9а-дёокси- -9а,7а-гомо-диметилен-16-фенокси-17, 18,19,20-тетранорпррстацикл-5,13-диеновая , М 400 м/е
5с, 13t-lЫ,.15Б-Диокси-9а-деок- си-7а-гомо-диметилен-17-циклогексил- -18,19,20-тринорпростацнкл-5,13-диеновая , м/е
5, 13tvl 1«, 155-Диокси-9а-деокси- -9а,7а-гомо-диметилен-16-фенокси-17, 18,19,20-тетранорпростацикл-5,13-диеновая , м/е
5t, 13t-no/, 15S-Диoкcи-9a-дeoк- cи-9a, 7а-гомо-диметш1ен-17-циклогек- сил-18,19,20-тринорпростацикл-5,13- -диеновая, М 404 м/е
Пример 20. Эфир1а.й раствор 5%-ного метилмагнийиодида (5 мл)до- бавляют к перемешиваемому раствору сложного метилового эфира 51,131-1Ы- -окси-15-оксо-9а-деокси-9а,7а-гомо- -диметш1енпростадикл-5,13-диеновой кислоты (0,4 г) в смеси 2:1 этиловый эфир - толуол (12-мл) и охлаждают до -30°С. После перемегггивания в течение еще 4 ч реакционную смесь нагревают до 0°С и оставшийся реагент разлагают, добавляя 20%-ный водный . Органический слой отделяют, промывают водой, сушат и после добавления пиридина (0,1 мл) упаривают досуха . Остаток, растврренный в сухом метаноле (10 мл), перемешивают с безводным (0,1 г) в течение 2 ч. Раствор фильтруют, упаривают в вакууме. Полученный сырой материал распределяют между этилацетатом и
20%-ным . Органический слой
после обработки концентрируют до не- большого объема; остаток абсорбируют на SiOj (20 г). Элюированием смесью 80:20 этиловый эфир - изопро- пиловый эфир получают сложный метиловый эфир 5i,13t-llo, 153-диокси- -15-метил-9а-деокси-9а,7а-гомо-ди- метиленпростацикл-5,13-диеновой кислоты м/е (0,1 г).
Свободные кислоты получают нагреванием с обратным холодильником ра- створа сложных метиловых эфиров в смеси 80:20 метанол - вода в присут ствии 2%-ного . Растворитель упаривают в вакууме. Остаток распределяют между этиловым эфиром и водои . Органические слои повторно экстрагируют (),5%-ным K-jCOj и сливают. Объединенные щелочные фазы подкисляют до j)H 6 и экстрагируют этиловым эфиром. Объединенные органические фазы промывают, сушат над M6S04 и упаривают досуха, в результате чего получают свободные кислоты.
Пример 21. При использовании этилмагнийбромида вместо метилмагний- иодида аналогично примеру 20 получают соответствующую 15-этилпростадик- ладиеновую кислоту.
П р и м е р 22. Раствор каждого из 3-эргдооксикетонов, полученных по
примеру 8, части П, в сухом ДМСО (2 мл) добавляют к раствору.илида, полученного следуювщм образом: в атмосфере азота к 15 мл ДМСО добавляют трет-бутилаткалия (1,35 г), а затем к нему добавляют 4-карбоксибутилтри- фенилфосфонийбромид (2,6 г), получая темно-красный р-аствор илида. После добавления оксикетона, реакдионную смесь нагревают при 40-42°С в течени 6ч, охлаждают, разбавляют водой (20 мл)., подкисляют до рН 5,1 и экстрагируют этиловым эфиром (5 мл) . Водную фазу сливают, в органические экстракты собирают, про- мывают водой (5 мл, причем эту промывку сливают) и экстрагируют 0,5н. NaOH ( мл) и водой до нейтрализации . Объединенные щелочные экстракты соединяют, подкисляют до рН 5 и экстрагируют этиловым эфиром. Объединенные органические экстракты промы - вают водой (2 мл), сушат над и упаривают досуха, получая смесь 5Z- и 5Е-КИСЛОТ.
Индивидуальные геометрические изомеры получают после хроматографи-
ческого
t разделения на БЮЛГе
- -IРе -свободный ), используя в качестве элюента смесь - этилацетат (SiOj 30 г на каждые 0,2. г кислоты).
Таким способом получают: 5t, ,13t-llo;, 158-Диокси-9а-деок- си-9а-нор-метиленпростацикл-5,13-диеновая , кислота, м/е, .j 537 м/е, .К -С5Н,481 (в виде трис-ТМС-эфира); ЖР (CDClj), с/, ррт 0,85 .(ЗН, т.); 3,00 (Ш, м);-3,6- 4,22 (2Н, м); 5,14 (IH, м.); 5,55 (2Н, м.);
5,13t-l 1 of, 1,55-Диокси-9а-дeoкcи- -9a-нop-мeтилeн-20-мeтилпpocтaцикл-5 13-диеновая кислота, М 566 м/е.
5
0
5
0
5
0
5
0
м/е.
5
м/е, rM -C HJJ 481 ,в виде трис ТМС эфира
5t-l 1с/, 155-Диокси-9а-деокси-9а- -нор-метилен-20-метилпростацикл-5- -ен-13-иновая кислота, М 564 м/е, м/е, м/е, в виде трис ТМС эфира
5t, 13t-l 1о, 158-Диокси-9а-деокси- -9а-метилен-7а-нор-метиленпроста- цикл-5,13-диеновая кислота, , в виде трис-ТЛС-эфира, ЯМР (CDCl) , ppm:0,89 (ЗН, т.); 3,33 (1Н, м;); 4,05 (2Н, м.); 5,15 (1Н, м.); 5,55 (2Н, м.)
5 (с ,t), 13t-1 1 я, 1 5В-диокси-9а-де- окси-9а-7а-гомо-диметиленпростацикл- -5,13-диеновая кислота, ЯМР (CDClj), (/ ,. ррп: 0,88 (ЗН, т.); 3,6-4,2 (2Н, м.);,5,31 (.1Н, м.);.5,55 (2Н, м.)
5t, 13t-1 1 с/, 158-Диокси-9а-деокси- -9а,7а-гомо-диметиленпростацикл-5, 13-диеновая кислота, м/е, ; M -H20J 346 м/е, м/е,
М -КгО-С5Ы,,275 м/е
5t-l1 d, 15S-Диoкcи-9a-дeoкcи-9a- -метилен-7а-нор-метилен-1 6S-фтор- простацикл-5-ен-13-иновая кислота, м/е
5t-l 1 , 15S-Диoкcи-9a-дeoкcи-9a- -метил ен-7а-нор-метилен-1 бЕ-фтор- простацикл-5-ен-13-иновая кислота , м/е
5t,13t-lЫ,15S-Диoкcи-9a-дeoкcи- -9а-метилен-7а-нор-метилен- 1 7-фенил- -18,19,20-тринорпростацикл-5,13-ди- еновая кислота, м/е
5t, 13t-l le/, 155-Диокси-9а-деокси- -9а,7а-гомо-диметш1ен-16-метилпро- стацикл-5,13-диеновая кислота, М 378 м/е, M -H20J 360 м/е 5t, 13t-l 1 о(, 15В-Диокси-9а-деокси- -9а-7а-гомо-диметилен-16-метилпро- стацикл-5,1 3-диеновая кислота, М 378 м/е, , м/е
5t-lЫ,153-Диокси-9а-деокси-9а, 7а-гомо-диметиленпростацикл-5-ен-13- -иновая кислота, м/е
5с, 13t-lЫ,15В-диокси-9а-деокси- -9а-нор-метиленпростацикл-5,13-диеновая кислота, мХЗЗб, CM -CjH-Н оУ 247 м/е
5с, 13t-llc, 153-Диокси-9а-деок- си-9а-нор-метилен-20-метилпростацикл- -5,13-диеновая кислота, м/е
5с-1 Id,153-Диокси-9а-деокси-9а-нор -метилен-20-метилпростацикл-5-ен-13- -иновая кислота,, м/е
5с, 13г-1Ы, ISS-flHOKCH-ga-fleoK- си-9а -метилен-7а-нор-метиленпроста- цикл-5,1 З-диеновая кислота, . О 318 м/е
5с, 13t-l Ы, 155-Диокси-9а-деокси- -9а,7а-гомо-диметиленпростацикл-5,-- 13-диеновая кислота, 364 м/е
5с-1Ы, 158-Диокси-9а-деокси-9а- -метш1ен-7а-нор-метилен-1б8-фтор- простацикл-5-ен-13-иновая кислота, м/е
5с-11 о , 15Б-Диокси-9а-деокси-9а - -метилен-7а-нор-метилен-1бК-фтор- простацикл-5-ен-13-уновая кислота, м/е
5с, nt-llof, 158-Диокси-9а-деок- си-9а-метйлен-7а -нор-метилен-17-фе- нил-18,19,20-тринор-простацикл-5, 13-диеновая кислота, 352 м/е
5с, 13t-llo(, 153-Диокси-9а-деок- си-9а,7а-гомо-диметилен-1бЗ-метил- простацикл-5,13-диеновая, кислота, м/е
5с, Bt-llc, 15S-Диoкcи-9a-дeoк- cи-9а, 7 а-гомо-диметилен-16-метилпро- стацикл-5,13-диеновая кислота, М 378 м/е
. 5с-1Ы, 15В-Диокси-9а-деокси-9а, 7а-гомо-диметиленпростацикл-5-ен- -13-иновая кислота, м/е . и их 15К-изомеры.
Пример 23. Раствор сложного метилового эфира 5, 13t-4R, 11W, 158 -окси-9а-деокси-9а-метиленпростацикл -5,13-диеновой кислоты в 5 мл этанол обрабатывают 0,05 г гидрата лития и 0,3 мл воды, а затем перемешивают при комнатной температуре в течение 6 ч. Удаление метанола под вакуумом, подкисление до рН 5,6 и быстрое экстрагирование этилацетатом дает 5, 1 3t-4R, 1 1 о , 158-триокси-9а-деокси- -9а-метиленпростацикл-5,13-диеновую кислоту. Обработкой перемешиваемого этилацетатного раствора 0,5 ч. поли- сиролсульфоновой смолы (в форме н- иона) дает 1,4- рлактон 5, 13t-4R, licit, 153-триокси-9а-деокси-9а-мети- ленпростацикл-5,13-диеновой кислоты, т.пл, 51-52 0, fy/-H20j 330 м/е.
По той же методике получают 1,4- пактоны следующих кислот:
5с, 13t-9a-Деокси-9а-метш1ен-4Б, 15Б-диокси-17-циклогексил-18,19,20- -ц -тринор-простацикл-5,13-диеновая кислота, м/е, ЯМР (CDCli), С/, ррп: 4,03 (1Н, .м.); 5,12
0
5
5
п
5 0 5 Q
g
(1Н, м.); 5,41 (1Н, м.); 5,56 (2Н, м.) .
5с, 13t-9а-Диокси-9а-метилен-4S, 15Б-диокси-16-фенокси-17,18,19,20-(- -тетранор-простацикл-5,13-диеновая кислота, ГМ -Н20: 350 м/е, -ЯМР (CDClj), V, ррга: 3,98 (2Н, д.); 4,52 (1Н, м.); 5,10.(1Н, м.); 5,42 ( 1Н, м.); 5,7 (2Н, м.); 6,80-7,45 (5Н,м.).
5с, 131-9а-Деокси-9а-метш1ен-4Е, 15Б-диокси-1б8-метилпростацикл-5,13- -диеновая кислота, K -H-20j 328 м/е
5с, 13t-9а-Деокси-9а-метилен-4К, 15Б-ДИОКСИ-1бБ-фторпростацикл-5,13- -диеновая кислота, M -ILO2 332 м/е, а также их 5-транс-геометрические изомеры в нат-, энант- и (1,1-формах.
П р и мер 24. Раствор 0,35 г. сложного метилового эфира 5с, 13t- -15S-OKCO-9а-деокси-9а-метиленпроста- цикл-5,13-диеновой кислоты в 10 мл смеси 2:1 этиловый эфир - толуол охлаждают до и при перемешивании обрабатывают 5 мл 5%-ного метилмаг- нийиодида в этиловом эфире. После перемешивания в течение 4 ч температуру смеси доводят до О С и реакхщю гасят 20%-ным водным хлористым аммонием . Затем органическую фазу промывают водой, бикарбонатом натрия и снова водой, сушат над Mg804, обрабатывают О,1 мл пиридина и упаривают в вакууме, получая смесь 15S- и 15R- спиртов. После разделения на силика- геле с использованием в качестве элю-: ента смеси 80:20 этиловый.эфир - изог пропиловый эфир получают 0,1 г сложного метилового эфира 5с, 13t-15S- -окси-9 а-деокси-9а-метилен- 15-т4етш1-j пррстацикла-5,13-диеновой кислоты, .203-344 м/е, ЯМР (CDClj), d, ppm: 0,88 (ЗН, т.); 1,14 (ЗК, с.); 3,66 ( ЗН, с.); 5;25 (Ш, широкий т.); 5,52 (2Н, м.); и 0,1 г 15R-H30Mepa.
П р и м е р 25. При перемешивании и наружном охлаждении для поддержания температуры реакции 20-22 С, последовательно добавляют дициклогек- силкарбодиимид (12,7), пиридин (665 мл) -и трифторуксусную кислоту (0,83 мл)к раствору 2-экзо-оксиметил- -3-эндооксибицикло 3,3,0 октан-7-он- -7,7-этилендиоксид-З-ТНР-эфира (12 г) в смеси бензол - ДМСО 75:25 (80 мл). Реакционную смесь разбавляют бензолом (50 мл), фильтруют, промывают водой До нейтрального состояния и сушат над сульфатом натрия. Раствори-
45
тели упаривают до небольшого объема (30 мл) и этот раствор добавляют при перемегаива нии к раствору фосфоната натрия, полученного путем добавления раствора 2-оксооктилдиметилфосфоната (rOjS г) в бензоле (30 мл) к суспензии 80%-ного гидрида натрия (1,35 г) в бензоле (125 мл). Через 15 мин реакция заканчивается. Реакционную смесь нагревают с уксусной кислотой (6 мл), промывают водой до нейтрального состояния, сушат над сульфатом натрия. Растворитель упаривают досу-
136058246
НИЛ ацетона при в вакууме водную суспензию экстрагируют этилацета- том. Органические экстракты собира ют, промывают солевым раствором, высушивают над NagRO и после упаривания растворителя остаток подвергают хроматографии на силикагельной колонке. После элюирования смесью н-гексан - этилацетат (50:50) получают следующие кетоспирты: 2-экзо- -(2 -бром-З R- окси-нон-l -транс-l - -енил)-3-эндооксибицикло СЗ,3,0J октан- 7-он (З.г) и 2-экзо-(2 -бром-3 R10
ха в вакууме, остаток хроматографиру- g -окси-нон-1 -транс-l -енил)-3-эндо-
ют на геле. Элюированием смесью н-,
гексан - этилацетат (80:20) получают
2-экзо-( 3 -OKCo-HOH-l -транс-l -
-енил)-3-эндооксибицикло 3,3.
тан-7-он-7,7-этилендиоксид-3-ТНР-эфир„„
(12,7 г) в. виде желтого масла, ИК
(четкий), :), cfi4 2970, 1690, 1670,
1625, ЯМР (CDClj), c/i , ppm: 0,88 (ЗН,
т.); 3,2-4,2 (7Н, м.); 4,60-4,75 (Ш,
м.); 6,18-6,20 (1Н, д.); 6,79-6,89
(1Н, дв. д.);
25
оксибициклоСЗ,3,0 октан-7-он (4,2 г).
В атмосфере инертного газа (Nj) к раствору трет-бутилаткалия (18 г) в сухом ДМСО (180 мл) добавляют 4- -карбоксибутилтрифенилфосфонийбромид (32,4 -г), получая красный раствор илида. Затем через 5 мин добавляют полученный ранее раствор 3 В-спирта (4,2 г). Реакционную смесь вьщержи- вают в течение 15 ч при перемешивании при комнатной температуре в атмосфере инертного газа. Реакционную смесь разбавляют избытком 30%-ного водного раствора 4 ( 350 мл) и экстрагируют этиловым эфиром (5 х50 мл). Эфирные экстракты объединяют , промывают рассолом (15 мл), затем экстрагируют 1 н. NaOH (5 15-мл) и промывают водой до нейтрализации промывных вод. Основные экстракты
К раствору этого соединения в сухом пиридине (100 мл) добавляют при перемешивании пиридинбромгидро- бромид (24 г). Через 1,30 ч смесь .разбавляют30%-ным водным раствором (500 мл) и экстрагируют этил ацетатом. Органические экстракты собирают и промывают до нейтрально с- ти, сушат над Na,jS04 и упаривают до сухого состояния в вакузпме. Остаток очищают на R.O геле (растворитель для элюирования: гексан - этилэфир 80:20), получая 2-экзо-( 2 -бром-З - -oKco-HOH-l -транс-1 -енил)-3-эндо- -оксибицикло 3,3.0 октан-7-он-7,7- -этилендиоксид-3-ТНР-эфир (13 г),ИК .(четкий), ), 2940, 1685, 1610.
Раствор полученного бромкетона j(l2,6 г) в метаноле (32 мп) прикапывают в раствор NaBK (4,2 г)в-мета-; ноле (65 мл) ,охлажденный до -20 С. Восстановление заканчивается за 1 ч. Затем реакционную смесь разбавляют избытком 30%-Кого водного раст вора NaH2P04 и экстрагируют этил- ацетатом. Органические экстракты собирают , промывают солевым раствором, высушивают над . Растворители вьшаривают досуха,в вакууме. Остаток (12 г) растворяют в ацетоне (100 мл) и затем обрабатьшают 1н. водным раст вором щавелевой кислоты (50 мл) в течение 12 ч при 40 С. После удале-
-окси-нон-1 -транс-l -енил)-3-эндо-
оксибициклоСЗ,3,0 октан-7-он (4,2 г).
В атмосфере инертного газа (Nj) к раствору трет-бутилаткалия (18 г) в сухом ДМСО (180 мл) добавляют 4- -карбоксибутилтрифенилфосфонийбромид (32,4 -г), получая красный раствор илида. Затем через 5 мин добавляют полученный ранее раствор 3 В-спирта (4,2 г). Реакционную смесь вьщержи- вают в течение 15 ч при перемешивании при комнатной температуре в атмосфере инертного газа. Реакционную смесь разбавляют избытком 30%-ного водного раствора 4 ( 350 мл) и экстрагируют этиловым эфиром (5 х50 мл). Эфирные экстракты объединяют , промывают рассолом (15 мл), затем экстрагируют 1 н. NaOH (5 15-мл) и промывают водой до нейтрализации промывных вод. Основные экстракты
объединяют, подкисляют до рН 5 и затем экстрагируют этиловым эфиром (, 1)10). Эти органические экстракты объединяют, проМ)тают рас-| солом, высушивают над .. и расторитель упаривают -досуха в вакууме. Остаток подвергают хроматографии на силикагельной колонке, используя- смесь этилэфир - уксусная кислота (100:0,5) в качестве элюента, в следующей последовательности:
5Q
55
5Z-ll.o, 153-диокси-9а-деокси-9а- .-метилен-20-метилпростацикл-5-ен-13- -иновую кислоту (1,21 г), ЯМР -- (CDClj), (f , ppn: 0,90 (ЗН,.т.); 4,00 (IH, мультиплет); 4,40 (IH, т.).; 3,27 (IH, т.); и 5Е-11о(, 153-диокси-9а- ;-деокси-9а-метилен-20-метилпроста- цикл-5-ен-13-иновую кислоту (1,84 г)
ИК (четкий),-J, см- 3350, 2115, 1705, ЯМР (CFjCO.D), с, ppm: 0,9 (ЗН, т.); 4,00 (1Н,,м.); 4,40 (Ш,- т.); 5,30 (Ш, т,.); 6,38 (ЗН, м.).
Аналогично исходя из спиртов,по-- лученных после проведения реакции Виттига с 4 карбоксибутилтрифенил фосфонийбромидом и хроматографичес- кого разделения на SiO, и исполь- зуя смесь этиловый эфир - уксусная кислота (99, 5:0,5), получают соединения:
5Z -11 V, 15R-Диoкcи -9a-дeoкcи-9a -мeтилeн-20-мeтилпpocтaцикл-5-eн-l 3- -иновая кислота (0,4 г), ЯМР (СБС1з) с/ , ррт: 0,90 (ЗН, т.); 4,00 (IH, м.) 4,40 (1Н, т.); 5,28 (IH, т.);
5Е-11 о(, 15Р.-Диокси-9а-деокси-9а - -метилен-20-метилпростацикл-5 ен-13- -иновая кислота (0,8 г), ЯМР (CDClj) ofl, ppm: 0,90 (ЗН, т,); 4,00 (IH, м.) 4,49 (1Н, т.); 5,30 (1Н, т.).
5(Z,Е)-158-окси-9а-деокси-9а-мети лен-20-метш1простацикл-5 ен-13 -ино- вая кислота, ЯМР ICDC1 ,), с/, ррт: 0,90 (ЗН, т.); 4,39 (1Н, т.); 5,22 (1Н, широкий т.); 6,75 (2н, широкий с.);
П р и м е р 26. Используя 2-оксо- нонилдиметилфосфонат вместо 2-оксо- октилдиметилфосфоната, получают следующие соединения:
5Z-11C/, 158-Лиокси-9а-деокси-9а- -иновая кислота СМ -Н20 358 м/е (М -2К20)340 м/ё, Ж-1Р (СВС1з), с/, ррт: 0,88 (ЗН, т.); 2,37 (2Ы, т.); 3,98 (1Н, м.); 4,40 (Ш, т.); 5,30 (1Н, широкий т.); 5,98 (ЗН, широкий с,)..
5Е-1Ы, 15Б-Диокси-9а-деокси-9а- -метилен-20-этилпростадикл-5-ен-13- -иновая кислота, м/е, 1М -2Н20 340 м/е, IP (CDClg), с/, ppm: 0,88 (ЗН, т.); 2,36 (2Н, т.); 3,98 (1Н, м.); 4,39 (IH, т.); 5,30 (1Н, широкий т.); 5,62 (ЗН, широкий и их 15R эпимеры:
5Z-1U, 15Е-Диокси-9а-деокси-9а- -метилен-20-эткппроста1 ;икл-5-ен-13- -иновая кислота, м/е, tl-l -2H20j 340 м/е
5Е -1 Ы, 15R-Диoкcи-9a-дeoкcи-9a- -мeтилeн-20-этилпpocтaцикл-5-eн-13- -шIoвaя кислота, к м/е CK -2HiO 340 м/е
П р и м е р 27. Раствор свежесуб- лимированного трет.-бутилаткалия (3 г) в безводном ДМСО (30 мл) последовательно обрабатьшают при ком- нагнои температуре в атмосфере азота 4-карбоксибутилтрифенилфосфоннй- бромидом (5,4 г) и раствором 2-экзо- -(3 R-ОКСИ-НОН-l -енил)-3-эндоокси-
бициклоГЗ,3,0}октан-7-она (600 мг) в ДМСО (5 мл). Реакционную смесь выдерживают в течение 15 ч при комнатной температуре в атмосфере азота и затем вливают в 30%-ный водный раствор NaHjPO. Водную смесь экстрагируют диэтиловым эфиром. Объединенные эфирные экстракты экстрагируют водным 1н. NaOH. Водный щелочной экстракт подкисляют затем до рН 5 и снова экстрагируют диэтиловым эфиром Органическую фазу промывают водой, сушат над безводным Са„ЯО( и упаривают досуха. Остаточное масло подвергают хроматографии на силикагельной колонке, используя смесь диэтилэфир (95,5) - уксусная кислота (0,5) в качестве растворителя для элюирова-- ния, получая 90 мг 5с-1 Ic/, 158-диок- си-9а-деокси-9а-метилен-20-метш1про- стацикл-5-ен-13-иновой кислоты, ЯМР (,(/ , ppm: 0,90 (ЗН, т.); 4,00 (1Н, м.); 4,40 (IH, т.); 5,27 (IH, т.); и 130 мг 5t-llrt , 15Я-диокси-9а- -деокси-9а-метилен-20-метилпроста- цикл-5-ен-13-иновой кислоты, ЯМР (CDCl,), /, ppm: 0,90 (ЗН, т.); 4,00 (1Н, м.); 4,40 (Ш, т.); 5,30 (1Н, т .).
Исходя из 2-экзо-(3 Н-окси-нон-1 -инил)-3-эндооксибицикло 3,3,0 октан-7-она получают 5с-По , 15Н-ди- окси-8а-деокси-9а-метилен-20-метил- простацикл-5-ен-иновую кислоту, ЯМР (CT),cf, ppm: 0,90 (ЗН, т.); 4,99 (1Н, м.); 4,40 (1Н, т.); 5,28 (1Н, т.) и 5t-llo , 15Н-диркси-9а -деокси- -9а-метилен-20-метилпростацикл-5-ен- -13-иновую кислоту, ЯМР (CDClj),/ , ppm: 0,90 (ЗН, т.); 4,00 (Ш, м.); 4,39(1Н, т.); 5,30 (Ш, т.).
Исходя из 2-ЭКЗО-(3)S-OKCH-OKT-
-1 -инил)-3-эндооксибицикло С3,3,07 октан-7-она и соответственно из его 3 Н-оксиизомера получают:
5с-1 1 о(, 153-Диокси-9а-деокси-9а- -метиленпростацикл-5-ен-13-иновую кислоту, ЯМР (СВСЗ-з), , ррт: 0,90 (ЗН, т.); 4,00 (Ш, м.); 4,39 ( Ш, широкий т.); 5,29 (1Н, широкий т1)
5t-l 1 о/, 15Б-Диокси-9а-деокси-9а- -метиленпростацикл-5-ен-13-иновую кислоту. ЯМР (CDCl),, ppm: 0,90 (ЗН, т.); 4,00 (1Н, м.); 4,40 (1Н, широкий т.); 5,28 (1Н, широкий т.);
5с-11 , 15Р-Диокси-9а-деокси-9а- -метш1енпростацикл-5-ен-13-иновую кислоту, ЯМР (CDCl), t, ppm: 0,90
(ЗН, т.); 4,00 (1Н, м.); 4,40 (1Н, широкий т.); 5,28 (Ш, широкий т.);
5t-l 1 d, 1 5Е-Диокси -9а-деокси-9а- -метиленпростацикл 5 ен -13--иновую кислоту, ЯМР (СБС1з),сГ, ррт: 0,90 ,(ЗН, т.)-, 4,00. (IK, м.); 4,39 (1Н, широкий т.);, 5,29 (IH, широкий т.)
П р и м е р 28. Процесс ведут аналогично примеру 23. Используя следуюпще фосфонаты:
2-Оксодёцилдиметилфосфонат
2 -Ок со из од ецилдиме тилфо сфон ат
2-Оксоундецилдиметилфосфонат
2-Оксоизоундецилдиметилфосфонат получают следующие соединения:
5Е-1 Ы, 153-Диокси 9а--деокси-9а- -метш1ен-20-н-пропилпростацикл-5-ен -13-иновая кислота, м/е ЯМР (CDClj), , ррт: 0,83 (ЗН, т.); 4,37 (1Н, т.); 5,28 (Ш, т.); 7,21 (ЗН, широкий)
5Z-1 1о, 153-Диокси -9а-деокси-9а- -метш1ен-20-Н -пропилпростацикл-5-ен- -.13-иновая кислота, м/е ЯМР (CDClj); с/ , ррт: 0,88 (ЗН, т.); 4,36 (Ш, т.); 5,23 (-IH, т.);.7,34 (ЗН, широкий)
5Е--1Ы, 158-Диокси-9а-деокси-9а- -метилен-20- изопропиленпростацикл-5- -ен-13-иновая кислота, ГМ -Н20 м/е, ЯМР (СВС1з ) , о , ррт: 0,86 (6Н, д.); 4,38 (1Н, т.); 5,24-(1Н, т.); 7,52 (ЗН, широкий) - 5t--llo(, 158-Диокси -9а-деокси-9а- -метилен-20-изопропилпростацикл-5- -ен-13-иновая кислота, М -Н203 372 м/е, ЯМР (СБС1.з), с/ , ррт: 0,85 (6Н, д.); 4,36 (1Н, т.); 6,24 (ЗН, широкий); 5,25 (Ш, т.)
5Е-11 о(, 158-ДиоксИ -9а -деокси-9а- -метилен-20-н-бутилпростацикл-5-еН - - П-иновая кислота, М 386 м/е, ЯМР (CDC1,), Д ррт: 0,89 ХЗН, т.); 4,39 (1Н, г.}-, 5,28 (Ш, т.); 7,88 (ЗН, широкий)
5Z-llo(, 158-Диокси-9а-деокси-9а- -метилен-20-н-бутилпростацикл-5-ен- -иновая кислота, М -Н5гО м/е, ЯМР (CDClj), ррт: 0,89 (ЗН, т.); 4,39 (Н, т.); 5,25 (Ш, т.); 6,70 (ЗН, широкий)
5Е-1 Ы, 15Б-Диокси-9а-деокси-9а- -метилен-20-изобутилпростацикл-5- -ен-иновая кислота, М -Н20 м/е ЯМР (CDCI.J), cf, ррт: 0,86 (, д,) 4,34 (1Н, т.); 5,26 ClH, т.У; 7,32 (ЗН, широкий)
5
5
о 0
5
n
g
5
5Z- По/, 158-Диокси-9а-деокси-9а- -метилен-20-изобутилпростацикл-5-ен- -13-иновая кислота, , , .ЯМР (CDCl,), f, ppm: 0,86 (6Н, д.); 4,32 (1Н, Ti); 5,27 (IH, т.); 6,54 . (ЗН, широкий) .
5Е-1Ы, 15Е-Диокси-9а-деокси-9а- -метилен-20-н-пропилпростацикл-5-ен- -13-иновая кислота, С M -Н,, 0, м/е ЯМР (СБС1з),сО, ррт: о,88 (ЗН, т.); 4,38 (Ш, т.): 5,26 (IH, т.); 6,26 (ЗН, широкий)
5Z-1 1 о(, 153-Диокси-9а-деокси-9а- -мётилен-2()-н-пропилпростацикл-5-ен- -13-иновая кислота, м/е , ЯМР (CDCl.a), f , ppm: 0,88 (ЗН, т.);
4.38Он, т.);- 5,24 (1Н, т.); 6,02 (ЗН, широкий)
5Е-11с/, .15Е-Диокси-9а-деокси-9а- -метилен-20-изопропилпростацикл-5- -ен-13-иновая кислота, .0 372 м/е, ЯМР (CDClj), , Ррт: (6Н, д.); 4,37 (1Н, т..); 5,27 ( 1Н, т.); 6,58 (ЗН, широкий)
5Z-11 , 15Е-Диокси-9а-деокси-9а- -метилен-20-изопропилпростацикл-5- -ен-13-иновая кислота, М -Н203 372 м/е, (СБС1з), «, Ррт: 0,86 (6Н, д.); 4,36 (Ш, т.); 5,27 (IH.j т.); 6,63 (ЗН, широкий)
5Е-1Ы, 15Е-Диокси-9а-деокси-9а- -метилен-20-н-6утилпростацикл-5-ен- -13-иновая кислота, м/е, ЯМР (CDClg), /, рри: 0,89 (ЗН, т.);
4.39(1Н, т.); 5,26 (Ш, т.); 6, 40 (ЗН, пдарокий)
5Z, 11 с, 15К-Днокси-9а-деокси-9а- -метилен-2()-н-бутилпростацикл-5-ен- - 13-иновая кислота, м/е, ЯМР (CDClj), c/ ,-ppm: 0,89 (ЗН, т.); 4,39 (1Н, т.); -5,25 (Ш, т.); 6,46 (ЗН, широкий)
5Е-11 о, 153- -Диокси-9а-деокси-9а- -метилен-20-иаобутилпростацикл-5-ен- -13-иновая кислота, tM -Hj01 386 м/е, ЯМР (CDCla), с, ррт: 0,86 (6Н, д.); 4,38 (Ш, т.); 5,25 ( 1Н, т.); 6,58 , (ЗН, широкий)
5Z-llc, 15Е-Диокси-9а-деокси-9а- -метилен-20-изобулитпростацикл-5-ен- -13-иновая кислота, м/е, ЯМР (СПС1з), сГ, ррт: 0,87 (6Н, д.); 4,37 (Ш, т.); 5,25 (1Н, т.); 6,04 (ЗН, широкий)
П р и м е- р 29. Используя 2-оксо- -3-R-метилгептилдиметилфосфонат и (1,1-2-экзооксиметил-3-эндооксибицик- ,3.0J октан-7гон-7,7-этилендиок-
сид-и-ТНР-эфир, после бромирования промежуточного (V,/3-ненасыщенного ке- тона гидротрибромидом пиридиния, восстановления с помощью NaBHq, удаления защитных групп и хроматографи- ческого разделения аналогично примеру 25 получают d,l-2-3K3o-(. -бром- -З В-окси-4 Н-метил-окт-Г -транс- - -енил)-3-эндооксибицикло 3,3,0 октан-ig -У-он, ЯМР (СБС.з),с/ , ррп: (ЗН, д.); 1,00 (ЗН, д.); 3,73 (1Н, д.); 5,83 (Ш, д.); 5,85 (1Н, д.), и его ЗВ-эпимер.
Метиловый эфир 5Z-llo/, 58-диок- си-9а-деокси-9а-метилен-1бБ-фторпрО стацикл-5-ен-13-иновой кислоты, M -H20J 362 м/е
Метиловый эфир 5Z-1Ы, 15К-диок- си-9а-деокси-9а-метилен-16Е-фтор11ро- стацикл-5-ен-13-иновой кислоты, м/е
Метиловый эфир 5E-11Z, 15 -диок- си -9а-деокси-9а-метилен-16R-фтop- пpocтaIl5икл-5-ен-13-нновой кислоты, , м/е
Метиловый эфир 5Z-1 1о/, 1 5Е-диок- Промежуточные продукты по примеру 15 си-9а-деокси-9а-метилен-1б8-фтор- 25 превращают в следующие соединения: . простацикл-5-ен-13-иновой кислоты.
d,l-5(Z,E-l Ы, 15S-Диoкcи-9a-дeoк- cи-9а-метилен-1бК-метилпростацикл-5- -ен-13-иноБая кислота, ЯМР (CDClj), , с/, ррт: 0,91 (ЗН, т.); 0,99 (ЗН,.д.); 3,98 (1Н, дд); 4,25 (Ш, м.); 5,25 (Ш, широкий т,) , . .
d,l-5(Z,E)- 1 с, 15К-Диокси-9а-де-; окси-9а-метилен-16К-метилпростацикл-
20
30
-5-ен-13-иновая кислота, ЯМР ( 25 М -Н-гО Зб м/е
, ррт: 0,97 (3Hi д.); 4,27 (Ш, широкий д.); 5,25 (Ш, широкий т.)
П р и м е р 30. d,l-16(R,B)-0Top- -20-метилкарбопростациклин rd,l-5E, 1ЗЕ-11 о(, 15В-диокси-9а-деокси-9а-ме- тилен-1fi(R,В)-фтор-20-метилпроста- цикл-5,13-диеновая кислота.
320 мг d,l-Зc(-oкcи-./5-(3 -S-oкcи- -4 -(К,8)-фтор-1 -транс-ноненил)-7- -оксобициклоГ3.3.02октана вводят в реакцию по примеру 11, получая 103 мг указанного соединения, а так-
,же его 5Z-изoмepoв dl-5Z, 13Е-1Ы, 153-диокси-9а-деокси-9а-метилен-16 (R,S)-фтор-20-метилпростацикл-5,13- -диеновой кислоты и 15К-9пимеров обоих соединений. Тонкослойная хроматография для этого соединения показала следующие результаты (диэтило вый эфир + .2% АсОН) :
0. м/е
Метиловый эфир 5E-llcf, 15Е-диок- си-9а-деокси -9 а-метилен-16Е-фторпро- стацикл-5-ен-13-иновой кислоты, СМ -Н2ПД 362 м/е
Метиловый эфир 5Е- Ы, 15Н-диок- си-9а-деокси-9а-метилен-1б8-фтдрпро- стацикл-5-ен-13-иновой кислоты.
Метиловый эфир 5Е-1Ы, 15К-диок:- си-9а-дeoкcи-9a-мeтилeн-16S-фтopпpo- cтa икл-5-ен-13-иновой кислоты, . м/е
После этого все метиловые зфиры подвергают рмылению, получая свободные кислоты.
Пример 32. В результате реакции 4-карбоксибутилтрифенилфосфо- нийбромида с соответствующими Зкс- 35 -окси-.й-( 2 -бром-З -окси-4 -фтор- -HOH-l -транс-Г -енил)-7-оксобицик - лоС3.3.0 октановыми щ оизводными в соответствии с примером 11, получают следующие соединения:
5(Z,E)-1 1с/, 15Б-Диокси-9а-деок- си-9 а-метилен-16 8-фтор-2 О-метилпро- стацикл-5-ен-13-иновая кислота, Ci)(,8 (1% СНС1з), ИК (пленка), смЛ 1710 (СООН); 2215 ,3360
40
45
UIH
ЯМР (СРС1з), , ррт: 0,89 (ЗН, т.); 3,77 (1К, м.); 4,0-4,3 (1,5Н, м.У; 4,67 (0,5Н, м.); Н в С, --50 Гц; 5,27 (1Н, т.).
П р и м е р 31. Аналогично приме- рам 10 и 11, используя соответствующие бициклоСЗ.З,0 октан-7-он-3,3 - -бис-ТНР-эфиры, полученные в примерах 1 (стадия II), 2-4, получают:
Метиловый эфир 5-Z-llo/, 158-ди- окси-9а-деокси-9а-метилен-16Е- фтор- простацикл-5-ен-13-иновой кислоты, СМ -МгО: 362 м/е
Метиловый эфир 5Z-llo/, 58-диок- си-9а-деокси-9а-метилен-1бБ-фторпрО стацикл-5-ен-13-иновой кислоты, M -H20J 362 м/е
Метиловый эфир 5Z-1Ы, 15К-диок- си-9а-деокси-9а-метилен-16Е-фтор11ро- стацикл-5-ен-13-иновой кислоты, м/е
Метиловый эфир 5E-11Z, 15 -диок- си -9а-деокси-9а-метилен-16R-фтop- пpocтaIl5икл-5-ен-13-нновой кислоты, , м/е
Метиловый эфир 5Z-1 1о/, 1 5Е-диок- си-9а-деокси-9а-метилен-1б8-фтор- простацикл-5-ен-13-иновой кислоты.
М -Н-гО Зб м/е
0. м/е
Метиловый эфир 5E-llcf, 15Е-диок- си-9а-деокси -9 а-метилен-16Е-фторпро- стацикл-5-ен-13-иновой кислоты, СМ -Н2ПД 362 м/е
Метиловый эфир 5Е- Ы, 15Н-диок- си-9а-деокси-9а-метилен-1б8-фтдрпро- стацикл-5-ен-13-иновой кислоты.
М -Н-гО Зб м/е
Метиловый эфир 5Е-1Ы, 15К-диок:- си-9а-дeoкcи-9a-мeтилeн-16S-фтopпpo- cтa икл-5-ен-13-иновой кислоты, . м/е
После этого все метиловые зфиры подвергают рмылению, получая свободные кислоты.
Пример 32. В результате реакции 4-карбоксибутилтрифенилфосфо- нийбромида с соответствующими Зкс- -окси-.й-( 2 -бром-З -окси-4 -фтор- -HOH-l -транс-Г -енил)-7-оксобицик - лоС3.3.0 октановыми щ оизводными в соответствии с примером 11, получают следующие соединения:
5(Z,E)-1 1с/, 15Б-Диокси-9а-деок- си-9 а-метилен-16 8-фтор-2 О-метилпро- стацикл-5-ен-13-иновая кислота, Ci)(,8 (1% СНС1з), ИК (пленка), смЛ 1710 (СООН); 2215 ,3360
(широкий, - С э ЯМР (CDClg), с/,
ОН.
ррш: 0,88 (ЗН., т.); 3,96 (Ш, кв.); 4,44 (Ш, д.); 4,5 (1Н, дв. м.);
5,22 (1Н, т,); 5,24 (Ш, т.)
5(г,Е)-1Ы, 15Н-Окси-9а-деокси -9а-метш1ен-1 бБ-фтор-20-метилпрос тацикл-5-ен-13-иновая кислота, ,9 (1,04% СНС1э), ИК (пленка ), 33,60 . широкий
.
ОН
2215 (), 1710 (СООН),.ЯМР (CDClg) / , ppm: 0,01 (ЗН, т.); 3,97 (IH, м.); 4,15 (1)2Н, м.(; 4,41 (1Н, м.); 4,69 (1)2Н, м.); 5,24 (Ш, м.)
5(Z,E )-1U, 158-Диокси-9а-деокси- г-9а- метилен-16К-фтор 20-метилпростз - цикл-5--ен--13 -иновая кислота, 42,2 (1,7% CHClj), ИК (пленка),
см- : 3360 (широкий, С :f ); 2215
iJn
(); 1710 (СООН), ЯМР ( CDC.1-j), с/ , рри: И,90 (ЗН, т.); 3,94 (1Н, м.); 4,21 (1)2Н, м.); 5,24 (Ш, м.); 5,5 (широкий с.);
5(Z,E)-ll-o , 15Е-Диокси--9а-деокси .-9а--метилен-1 бК-фтор-20-метилпрос та- цикл-5-ен 13-иновая кислота fo Jj) +77,5 (1,03% СНС1з), ИК (пленка),
л), см- : 3360 (Ctojj ); 2215 ();,
1710(СООН), ЯМР (CDClj), f, ppm: 0,91(ЗН, т.); 3,96 (1Н, м.); 4,17 (02Н, м.); 4,44 (IH, дв. м:); 5,24 (Ш, м.); 5,5 (широкий с.)
Пример 33. Сухой карбонат калия (0,26 г) добавляют к раствору 5 (Z ,Е) -1 1 с;, 153-диокси 9а диокси- 9а- метилен-20-метилпростацикл- 5 ен 13- -иновой-кислоты (0,5 г) и метилйоди- да (0,12 мл) в 3 мл сухого диметил- формамида. Полученную смесь переме - гаивают при комнатной температуре в течение 4 ч. После фильтрации от неорганического материала полученный органический раствор разбавляют во- дои (15 мл) и затем тщательно экстрагируют этиловьм эфиром. Эфирные экстракты собирают, промывают водой и упаривают досуха, получая сложный нетиловый эфир 5(Z,E)-1Ы,153-диокси- . -9а-деокси-9а-метилен-20-простацикл- -5-ен-13-иновой кислоты (0,42 г), ГК -Н-гО 358 м/е, ЯМР (CDCl,), сС, ppm: 0,89 (ЗН, т.); 3,67 (ЗН, с.); 3,95 (1Н, м.)-; 4,36 ( Ш, широкий т.) 5,25 (IH, широкий т.).
П р и м е р 34. В атмосфере инертного газа (азота) к раствору трет-бу- тилаткалия (18 г) в суком диметил- сульфоксидё (180 мл) добавляют 4- -карбоксибутилтрифенилфосфонийбромил (32.,4 г), получая красньй раствор или да. Затем через 5 мин добавляют раствор (+)-2-экзо-(2 -бром-З S-окси-нон- - 1 -транс-l -енш1)-3-эндооксибицикло t3,3,оЗоктан-7-она (4,2 г). .Реакционную смесь вьщерживают в течение 15 ч при перемешивании при комнатной температуре в атмосфере инертного газа, разбавляют избытком 30%-ного водного раствора NaHPO (примерно 350 мл) и затем экстрагируют этиловым эфиром ( мл). Эфирные экстракты объединяют , промывают рассолом(15 мл) и затем экстрагируют 1н. NaOH ( мл) и водой до нейтрализации остатков от промывания. Основные экстракты объедняют , подкисляют до рН 5 и затем экстрагируют этиловым эфиром (З 3() мл, U15 мл, 1«К) мл). . .
Органические экстракты объединяют промывают рассолом, суиат над сульфатом натрия.Растворитель упаривают в вакууме досуха, получая (+)-5(Z,E) -11о,15 Б-диокси-9а-деокси-9а-мети- лен-20-метилпростацикл-5-ен-13-ино- вую кислоту (2,3 г), ЯМР (CDClg), f, ppm: 0,90 (ЗН, т.); 4,00 (1Н,.м.); 4,40 (1Н, т.); 5,30 (1Н, т.).
Пример 35. К перемешанной смеси трет-бутилаткалия (2,0 г) и 4-карбоксибутилтрифенилфосфонийброми да (4,0 г) добавляют 10 мл безводного тетрагидрофурана. После перемешивания в атмосфере аргона в течение 10 мин к полученной суспензии илида добавляют по каплям раствор 3-оксо- -6-ЭКЗО-1 -транс-2 -f-poM-3 В-З 4 S- -окси-4 -метил-5 -2 -фурил-(пент-.1 - -енил)-7-эндооксибицикло f3.3.Oj октана (о,58 г) в тетрагидрофуране (5мл)
Полученную смесь перемешивают в течение 30 мин, вьшивают: в 100 мл 30%-ного водного раствора NaH,PO.
Отделенную органическую фазу упаривают досуха и остаток элюируют на силикагеле, получая 0,13 г 5(Z,E)- .-9а-деокси-9а-метилен-11 , 15Б-диок си-1бЗ-16-метил--17-(2 -фурил)-18,19, 20-тринор-простацикл-5-ен-13-иновой кислоты; ЯМР (90 МГц) CDClg), , грт 0,98 (д., ЗН); 2,69 (м.,..2Н); 3,96 (м., Ш); 4,26 (дв. д., 1Н); 5,23 (м., 1Н); 5,99 (д., 1Н); 6,24 (дв. д., 1Н); 7,26 (д., Ш).
Аналогично получают следующие соединения:
5(Z,Е)-1ЗЕ-9а-Деокси-9а-метилен- -1Ы, 58-диокси-1б8-16-метил-17-(2 - -фурил)-18,19,20-тринор-простацикл- -5,13-дир.новая кислота, ЯМР (90 МГц) ( С1)С1з), с/ , ppm: 0,96 (д. ЗН); 2,70 (м. , ЗН); 3,96 (м., Ш); 4,.12 (м., 1Н); 5,25 (т., 1Н); 5,53 (м., 2Н); 6,03 (д., 1Н); 6,31 (дв. д., 1Н); 7,34(д., 1Н) .
5( Z ,Е)-1 ЗЕ 9а -Де. а-метилен- -По/, 158-диокси-17 -(2 -фурил)-18,19 , йО-тринор-простацикл-З,13-диеновая кислота, ЯМР (90 МГц) (CDClj), f, ppm: 2,71 (т., 2Н); 3,70 (м., Ш); 4,08 (м., 1Н); 3,24 (т., 1Н); 3,33 (м., 2Н); 6,03 (д., IH); 6,29 (дв. д., Ш); 7,32 (д., 1Н):
Аналогично получают метиловые эфи- ры кислот, перечисленных в примере 33
Пример 37. Раствор метилового эфира ЗЕ-9а -деокси--9а-метилен-1 1, 135-диокси-20-метилпростацикл-3-ен- -П-иновой кислоты (1,2 г) в сухом тетрагидрофуране (8 мл) обрабатывают при перемешивании дигидропираном
3(7,Е)-9а-Деокси-9а--метилен-1 1с/, ю (0,88 мл) и п-толуолсульфокислотой 138-диокси-1б8-16-метил -17-(2 -фу- (7 мг) . Спустя 3 ч реакционную смесь
выливают в
рил) -18,19,20-тринор-простацикл -3 - -ен-13-иновая кислота, ЯМР (90 МГц) (СВС1з),с, ррт: 0,98 (д., ЗН); 2,68 (м., 2К); 3,96 (м., 1Н); 4,23 (дв. д., 1Н); 3,23 (м., 1Н); 3,99 (д., 1Н); 6,23 (дв. д., Ш); 7,26 (д., 1Н):
3 (Z ,Е) - 1 ЗЕ-9а-Деокси-9а-метилен- -По/, 1 ЗН-диокси-1 6S-1 6-метил-1 7- -(2 -фурил)-18,19,20-тринор-проста- цикл-3,13-дионовая кислота, ЯМР (90 МГц) (CDClg), о , ррп: 0,96 (д., ЗН); 2,71 (м., ЗН); 3,96. (м., 1Н);
.4,12 (м., 1Н); 3,24 (т., Н); 3,33 (м., 2Н); 6,03 (д., 1Н); 6,32 (дв. д., Ш); 7,34 (д., )Н)
3 (7j ,Е) -1 ЗЕ-9а-Деокси-9а -метилен- -1Ы, 13Е-диокси-17 -(2 -фурш1)-18,19, 20-тринор-простацикл-З,3-диеновая кислота, ЯМР .(90 МГц) ( CDC1 з), , ррт: 3,71 (т., 2Н) 3,71 (м., Ш); 4,08 (м., Н); 3,23 (т., 1Н); 3,33 (м., 2Н); 6,06 (д., lH)j 6,29 (дв. д., 1Н); 7,33 (д., 1Н).
П р и м е р 36. Сухой к.арбонат калия (0,28 г) добавляют к раствору 3(г,Е)-9а-деокси -9а-метилек-1 Ы, ЗS- -диoкcи-16S-16-мeтил-l 7-(2 -фурил)- -18, 19,20-тринор-простащ1кл-3 -ен-13- -иновой кислоты (0,3,г) и метилйоди- да (0,17 мл) в сухом диметилформами- де (3,3 мл). Смесь перемешивают при комнатной температуре в течение 4 ч. Неорганический материал отфильтровывают , а органический раствор разбавляют водой (20 мл) .и тщательно экст рагируют диэтиловым эфиром. Эфирные экстракты собирают, промывают водой и упаривают, получая метиловый эфир
40 мл 30%-ного водного ра- створа NaH,jPO и экстрагируют диэтиловым эфиром. Органические экстракты 15 собирают, промывают водой, сушат и упаривают досуха, получая ЗЕ-9а-де- окси-9а-метилен-1Ы, 13В-бис-(2 -тет- рагидропиранилокси) - 20-метилпроста- цикл-З-ен-13-иновую кислоту (1,9 г).
2 Этот продукт используют на следую щей стадии без дополнительной очистки . Кеочир;енное желтое масло растворяют в 30 мл толуола, охлаждают до и перемершвают в атмосфере ар гона. Добавляют д1ВАН (9,9 мл 1,2н. раствора в толуоле) по каплям. Образовавшийся в результате раствор перемешивают в течение 30 мин при -70°С. Реакционную смесь подогревают до
30
-40°С и перемешивают
течение
1 ч. Затем ее охлаждают до -7О С.Реакцию быстро гасят изопропанолом (З мл). Смесь обрабатывают 7 мл 30%-ного водного раствора .
35 Всю смесь оставляют нагреваться до комнатной температуры, фильтруют при отсасывании, и фильтрат упаривают досуха . Сырое вещество очищают на си ликагеле с использованием в качест
40 ве элюента смеси состоящей из н-гек- сана и этилацетата в соотношении 7:3, получая 1,482 г ЗЕ-1-нор-2-ок- симетил-9а-деоксй-метилен-1 1 « , 13S- -бис-(2 -тетрагидропиранилокси)-2045 -метштпростацикл-3-ен- 3-иновой кислоты . Это соединение (1,3 г) растворяют в 23 мл ацетона и затем добавляют 7,.3 мл 2 н. серной кислоты.
Полученный раствор перемешивают при
3(г,Е)-9а-деокси-9а-ме тил е н-Гы7 Т5В- 50 комнатной температуре. Ацетон отго- -диакси-1б8-16-метил-17-(2 -Аурил)- Р пониженном давлении, а вод- -18,9,20-тринор-простацикл-5 -еН 13- раствор экстрагируют этилацета- -иновой кислоты (0,43 г), ЯМР (90 МГц) «Рганический слой промывают (СПС1з), , ррт: 0,96 (д., ЗН); 2,70 ° раствором ( и рассо1-г ППМ м РЛ71ТТЯТ ИЯ ГТ Р РЧ ППГТМ чТХ/
(м., ЗК); 3,63 (с., ЗН); 3,97 (м., 1Н); 4,25(дв. д., 1Н); 3,23 (м., 1Н); 3,99 (д., 1Н); 6,25 (дв. д., 1Н); 7,26 (д., 1Н).
55 лом и сушат над безводным сульфатом натрия, фильтруют и упаривают досуха . Полученное светло-желтое масло подвергают очистке на силикагеле (элюент: смесь гексана и этилацетата
Аналогично получают метиловые эфи- ры кислот, перечисленных в примере 33.
Пример 37. Раствор метилового эфира ЗЕ-9а -деокси--9а-метилен-1 1, 135-диокси-20-метилпростацикл-3-ен- -П-иновой кислоты (1,2 г) в сухом тетрагидрофуране (8 мл) обрабатывают при перемешивании дигидропираном
выливают в
40 мл 30%-ного водного ра- створа NaH,jPO и экстрагируют диэтиловым эфиром. Органические экстракты собирают, промывают водой, сушат и упаривают досуха, получая ЗЕ-9а-де- окси-9а-метилен-1Ы, 13В-бис-(2 -тет- рагидропиранилокси) - 20-метилпроста- цикл-З-ен-13-иновую кислоту (1,9 г).
Этот продукт используют на следующей стадии без дополнительной очистки . Кеочир;енное желтое масло растворяют в 30 мл толуола, охлаждают до и перемершвают в атмосфере аргона . Добавляют д1ВАН (9,9 мл 1,2н. раствора в толуоле) по каплям. Образовавшийся в результате раствор перемешивают в течение 30 мин при -70°С. Реакционную смесь подогревают до
-40°С и перемешивают
течение
1 ч. Затем ее охлаждают до -7О С.Реакцию быстро гасят изопропанолом (З мл). Смесь обрабатывают 7 мл 30%-ного водного раствора .
Всю смесь оставляют нагреваться до комнатной температуры, фильтруют при отсасывании, и фильтрат упаривают досуха . Сырое вещество очищают на си ликагеле с использованием в качест
ве элюента смеси состоящей из н-гек- сана и этилацетата в соотношении 7:3, получая 1,482 г ЗЕ-1-нор-2-ок- симетил-9а-деоксй-метилен-1 1 « , 13S- -бис-(2 -тетрагидропиранилокси)-20-метштпростацикл-3-ен- 3-иновой кислоты . Это соединение (1,3 г) растворяют в 23 мл ацетона и затем добавляют 7,.3 мл 2 н. серной кислоты.
комнатной температуре. Ацетон отго- Р пониженном давлении, а вод- раствор экстрагируют этилацета- «Рганический слой промывают ° раствором ( и рассоППМ м РЛ71ТТЯТ ИЯ ГТ Р РЧ ППГТМ чТХ/
лом и сушат над безводным сульфатом натрия, фильтруют и упаривают досуха . Полученное светло-желтое масло подвергают очистке на силикагеле (элюент: смесь гексана и этилацетата)
получают 445 мг чистой 5Е-1-нор-2- оксиметил-9а деокси-9а-метилен 1 1 «, 155-диокси-20-метилпростацикл-5-ен-- 13-иноврй кислоты, ЯМР (90 МГц) CDC1, ), с/-, рри: 0,90 (ЗН, т.); ,60 (2Н,;т.); 3,94 (1Н, м.); 4,34 1Н, т.); 5,26 (1Н, широкий т.).
Аналогично получают следуюище соеинения:
5Z-1 -нор-2-Оксиметил-9а-деокси - -9а-метш1ен -1 1 с/, 15Б-диокси-20-ме- тилпростацикл-5-ен-13-иновая кислота , ЯМР (90 МГц) (CDClg), c/i, ррга: 0,90 (ЗН, т.); 3,60 (2Н, т.); 3,94 (Ш, м.); 4,34 (1Н, т.); 5,28 (IH, широкий т.)
5Е-1-нop-2-Oкcимeтил-9a -дeoкcи- 9a -мeтилeн-1 10, 15S-диокси-1бЗ-фтор 20-мвтилпростацикл -5-ен-13-иновая кислота, ЯМР (90 МГц) (CDCI j, f , ppm: 0,88 -(ЗН, т.); 3,58 (2И, т.); 3,96 (1Н, кв.); 4,44 (Ш, д.); 4,50 (1Н, дв. м.); 5,22 (1Н, широкий т.)
5Е-1-нор-2-Оксиметил-9а-деокси- -9 а-м е ти л ён-1 1 с(, 15 S-диок си-1бК-фтор- -20-метилпростацикл-5-ен-13-иновая кислота, ЯМР (90 МГц) (CDClj), tC , ppm: 0,88 (ЗН, т.); 3,58 (2Н, т.); 3,96 (1Н, кв.); 4,44 (1Н, д.); 4,50 (IH, дв. м.); 5,24 (1Н, широкий т.)
5Е-1-нор-2-Оксиметил-9а-деокси- -9а-метилен-1 1 с/, 158-диокси-1бЕ-фтор- -20-метилпростацикл-5-ен-13-иновая кислота, ЯМР (90 МГц) (CDC1 3) , с/, ppm: 0,90 (ЗН, т.); 3,61 (2К, т.); 3,94 (1Н, м.); 4,21 (l)2H, м. (Hj; 4,46(1Н, дв. д.); 4,72 (1)2Н, м. (Hj; 5,24 (Ш, м.)
5/J-1 -нор-2-Оксиметил-9а-деокси- -9а-метилен-11 о, 15S-диoкcи-16R-фтop- -20-мeтилпpocтaцикл -5-eн-13-инoвaя кислота, ЯМР (90 МГц) (CDCl), , ppm: 0,90 (ЗН, т.); 3,61 (2Н, т.); 3,94 (1Н, м.); 4,21(1)2Н, м. ( 4,46 (Ш, дв. д.); 4,72 (l)2H, м. (Н); 5,25 (1Н, м.)
II р и м е. р 38. К перемешиваемой смеси трет-бутилаткалия (0,450 г) и 4-(2 -тетрагидропиранилокси)-бутш1- трифеьшлфосфонийбромида (1,732 г) добавляют 8 мл безводного тетрагид- рофурана в атмосфере азота. Через 10 мин перемешивания при комнатной температуре суспензию илида охлаждают до U°C и обрабатывают (по каплям) раствором 0,527 г 3-оксо-6-экзо 1 - -транс-2 -бром-З 8-(2 -тетрагидро- пиранилоксинон- -енил J -7-эндо-(.
-тетрагидропиранилокси )-бицикло 3. J, Ojоктана в 5 мл тетрагидрофурана. Реакционную-смесь перемешивают при
в течение 30 мин, а затем реакцию гасят добавлением 10 мл 30%-но- го водного . Реакционную смесь разбавляют еще NaHjPO (200 мл) и экстрагируют этилацетатом. Отделен У органическую фазу промывают рассолом , сушат над сульфатом натрия и концентрируют в вакууме с получением желтого масла. Остаток хроматографи- руют на силикагеле (элюент: смесь диэтилового зфира и н-гексана 70:30), получая 0,541 г 5(Z,E)-l-Hop-2-(2- -тетрагидропираннлоксиметил)-9а-деок- си-9а-метилен- 1 1 , 15S-бис-2 -тетра- гидропиранилокси)-20-метилпростацикл--5-ен-13-йновой кислоты.
Это соединение (0,541 г) растворяют в 10 мл смеси уксусной кислоты, воды и тетрагидрофурана (20:10:5). Реакционную смесь перемешивают в те-
чение 18 ч при 25°С, разбавляют рассолом и экстрагируют этилацетатс м. Органическую фазу отделяют, сушат над и упаривают досуха. Остаток хроматографируют на силикагеле (элю-
ент: смесь этилацетат - гексан в соотношении 70:30), получая 0,285 г чис той 5(2,Е)-1-нор-2-оксиметил-9а-д е- окси-9а-метилен-По| , 158-диокси-20- -метш1простацикл-5-ен-13-иновой кислоты , ЯМР (90 МГц) (CDClj), У, ppm: 0,90 (ЗН, т.); 3,60 (2Н, т.); 3,94 (1Н, м.); 4,34 (1Н, т.); 5,25 (Ш, широкий т.).
Пример 39. В атмосфере азота
0,3 г 4-карбоксибутилтрифенилфосфо- нийбромида добавляют к смеси 0,15 г трет- бутилаткалия и 2 мл сухого ди- м етилсульфоксида. Смесь затем обрабатывают раствором 0,04 г З-оксо-6-экзо- (1 -транс-2 -бром-3 S-3 -окси-7 -цис-нон-1 ,7 -диенил)-7-эндооксибицикло 3 .3,0 октана в 2 мл диметилсульфоксида . Через 2 ч реакционную
смесь разбавляют водой, подкисляют
2 н. серной кислотой и экстрагируют диэтиловым эфиром.
Эфирную фазу экстрагируют 1 н. водным раствором гидроокиси натрия, водные щелочные экстракты собирают,
подкисляют до рН 5 и экстрагируют смесью н-пентана и диэтилового эфира в соотношении 20:80. Конечные органические экстракты собирают, про- мьшают водой, сушат и упаривают досуха , получая после очистки 3(Z,E)- -19г-9а-деокси-9а метилен--1 Ы, 15S- -диокси -20 метилпростацикл-5, ен-П-иновую кислоту (0,02 г), ЯМР
10
(90 МГц) (CDClj), , ррт: 3,94 (м.
1Н); А,38 (м., 1И); 5,10-5,50 (м.,
ЗН); 5,36 (иирокий с., ЗН); которую
хроматографируют на силикагеле (элю
ент: смесь этилацетата, н-гексана и.
уксусной кислоты 70:30:4i получая
0,006 г 5г -19г 9а -деокси-9а-метилен -11 о , 153-диокси-20-метилпростацикл-5Z-19г-диен-13-иновой КИСЛОТЫ , ЯМР
(90 МГц) (CDCl), (/, рри: 3,95 (м.
Ж); 4,39 (м., 1К); 5,10-5,50 (м.,
ЗНУ; 5,37 (широкий с., ЗН); и 0,011г
5Е-19г-9а-деокси-9а-метилен-11 о;, 15S -диокси-20-метилпростацикл-5 , 19-ди6Н-13-ИНОВОЙ кислоты, ЯМР .(90 МГц)
(CDClj), ,, ррт: 3,95 (м., 1Н); 4,39 20 15Е-диокси-1б8-16-метил-20-метилпро-.
(широкий т., 1Н); 5,0-5,6 (м., ЗН); стацикл-5,19-диен-13-иновая кислота.
15
-диен-13-иновая кислота, ЯМР (90 МГц) (CDClj), с/, ррп: 3,95 (м., 1Н); 4,38 (широкий т., 1Н); 5,0-5,6 (м., ЗН); 5,29 (иирокий с., ЗН)
5 (Z, Е) -197.-9а-Деокси-9а-метилен- - d, 15К-диокси- 6S-16-метил-20-ме- тилпростацикл-5,19-диен-13-иновая кислота, ЯМР (90 МГц) (CDCls), J, ppm: 0,95 (д., ЗН); 3,92 (м., 1Н); 4,38 (м., Ш); 5,10-5,50 (м., ЗН); 5,34 (широкий с,, ЗН)
5Z-19Z-9a-дeoкcи-9a-мeтилeн-lЫ, 15R-диокси-16S-16-метил-20-метилпро- стацикл-5,19-диен-13-иновая кислота, ЯМР (90 МГц) (CDClj), f, ррп: 0,96 (д., ЗН); 3,91 (м., 1Н); 4,38 (м., 1Н); 5,10-5,50 (м., ЗН); 5,35 (широкий с., ЗН)
5Е-1 9Z-9a-fleoKCH-9a-MeTmieH-l 1 of.
5,3 (широкий с., ЗН).
Аналогично получают следующие соединения :
5(Z,Е)-19Z 9a-Дeoкcи-9a-мeтилeн- -1 lof, 158-диокси-1бЗ-16-метш1-20-ме- тилпростацикл-5,19-диен-13-иновая кислота, ЯМР (90 МГц) (CDC1 ,) , , ррт: 0,95 (д., ЗН); 3,93 (м ., Ш); 4,38 (м., 1Н); 5,10-5,50 (м., ЗН); 5,35 (широкий с., ЗН)
5Z-19Z-9a -fleoKCH-9a-MeTmieH-l 1 с/, 1 бБ ДИокси-1 бВ-метил-20-мети.ппроста- цикл-5, 19-диен-13-иновая кислота, ЯМР (90 МГц) (CDC1 ), 5 РРк: 0,96 (д, ЗН); 3,92 (м., Ш); 4,38 (м., 1Н); 5,10-5,50 (м., ЗН); 5,36 (широкий с.э ЗН);
5E-19Z 9a-Дeoкcи-9a-мeтилeн-l 1 с, 158-диокси-16S-16-метил-20-метилпро- стацикл-5, 19-диен-13-иновая кислота , ЯМР (90 МГц) CCDClj), с/, ppm: 0,95-(д,,. 3,91 (м,, 1Н); 4,37 (м., 1Н); 5,10-5,50 (м,, ЗН); 5,34 (широкий с,, ЗН)
5(Z.,,E)-i9Z-9a-Дaoкcи-9a-мeтилeн- -11 d 5В-диокси-20-метилпростацикл- -5,19-диен-13-иновая кислота, ЯМР (90 МГц) (CDCls), .У , ррт: 3,94 (м., 1Н); 4,37 (м., Ш); 5,10-5,50 (м., ЗН); 5,37 (широкий с., ЗН)
5Z-19Z-9a-Дeoкcи-9a-мeтилeн-l 1 i, 15К-диокси-20-метилпростацикл-5,19- -диен-13-иновая кислота, ЯМР (90 МГц)
25
ЯМР (90 МГц) (СБС1з),, ррт: 0,94 (д., ЗН); 3,91 (м., 1Н;; 4,37 (м.,
1Н); 5,10-5,50 (м. , 3H)J 5,33 (широкий с., ЗН)
30
Пример 40, В атмосфере инерт- кого газа, перемешиваемую суспензию 0,4 г NaH (75%-ная дисперсия в минеральном масле) в 13,5 мл диметилсуль- фоксида нагревают до 60-65 С в течение 4 ч. Смесь охлаждают до комнатной температуры и вьщерживают при 20-22 С при этом последовательно добавляют 35 2,6 г 4-карбоксибутилтрифенилфосфо- нийбромида в 6 мл диметилсульфоксида и 0,8 г 2 -экзо-(3 8-ркси-окт-1 -инйл -3-эндооксибицикло 3.3,0 октан-7- он- -3,3 -бис-тетрагидропиранилового эфи-
40
ра.
После перемешивания в течение 3 ч смесь разбавляют 35 мл воды и водную фазу зкстрагируют этиловым .
45 эфиром ( мл), а затем смесью этилового эфира и бензола ( мл). Объединенный органический экстракт повторно экстрагируют 0,5 н. гидроокисью натрия ( мл),а затем во50 дои до нейтрализации, а затем удаляют. Объемный водный щелочной экстракт подкисляют до рН 5,3, экстрагируют смесью этилового эфира и пентана 1:1
и промывают до нейтрализации экстракта.
(CDCl,), ) ррга: 3,95 (м., 1Н); 4,38 р Сушат над сульфатом натрия и удаля- (м., Ш); 5,10-5,50 (м., ЗН); 5,36 ют растворитель. Получают 0,8 г Цв ,
15В-диокси-9а-деокси-9a-мeтшleнпpo- cтaцикл-5-ен-13-иновой кислотьг-11, 15-бис-тетрагидропиранилового эфира.
(широкий с., ЗН)
5E-19Z-9a-Дeoкcи-9a-мeтилeн-l i, 15К-диокси-20-метилпростацикл-5,19-
15Е-диокси-1б8-16-метил-20-метилпро-.
-диен-13-иновая кислота, ЯМР (90 МГц) (CDClj), с/, ррп: 3,95 (м., 1Н); 4,38 (широкий т., 1Н); 5,0-5,6 (м., ЗН); 5,29 (иирокий с., ЗН)
5 (Z, Е) -197.-9а-Деокси-9а-метилен- - d, 15К-диокси- 6S-16-метил-20-ме- тилпростацикл-5,19-диен-13-иновая кислота, ЯМР (90 МГц) (CDCls), J, ppm: 0,95 (д., ЗН); 3,92 (м., 1Н); 4,38 (м., Ш); 5,10-5,50 (м., ЗН); 5,34 (широкий с,, ЗН)
5Z-19Z-9a-дeoкcи-9a-мeтилeн-lЫ, 15R-диокси-16S-16-метил-20-метилпро- стацикл-5,19-диен-13-иновая кислота, ЯМР (90 МГц) (CDClj), f, ррп: 0,96 (д., ЗН); 3,91 (м., 1Н); 4,38 (м., 1Н); 5,10-5,50 (м., ЗН); 5,35 (широкий с., ЗН)
5Е-1 9Z-9a-fleoKCH-9a-MeTmieH-l 1 of.
стацикл-5,19-диен-13-иновая кислота.
25
ЯМР (90 МГц) (СБС1з),, ррт: 0,94 (д., ЗН); 3,91 (м., 1Н;; 4,37 (м.,
1Н); 5,10-5,50 (м. , 3H)J 5,33 (широкий с., ЗН)
Пример 40, В атмосфере инерт- кого газа, перемешиваемую суспензию 0,4 г NaH (75%-ная дисперсия в минеральном масле) в 13,5 мл диметилсуль- фоксида нагревают до 60-65 С в течение 4 ч. Смесь охлаждают до комнатной температуры и вьщерживают при 20-22 С при этом последовательно добавляют 2,6 г 4-карбоксибутилтрифенилфосфо- нийбромида в 6 мл диметилсульфоксида и 0,8 г 2 -экзо-(3 8-ркси-окт-1 -инйл -3-эндооксибицикло 3.3,0 октан-7- он- -3,3 -бис-тетрагидропиранилового эфи-
ра.
После перемешивания в течение 3 ч смесь разбавляют 35 мл воды и водную фазу зкстрагируют этиловым .
45 эфиром ( мл), а затем смесью этилового эфира и бензола ( мл). Объединенный органический экстракт повторно экстрагируют 0,5 н. гидроокисью натрия ( мл),а затем во50 дои до нейтрализации, а затем удаляют Объемный водный щелочной экстракт подкисляют до рН 5,3, экстрагируют смесью этилового эфира и пентана 1:1
Продукт растворяют в безводном метаноле и обрабатывают раствором И) М пара-толуолсульфокиспоты.Спустя 4 ч пяра-толуолсульфокислоту ней- трализук$т пиридином и смесь упаривают досуха. Очисткой на силикагеле получают 0,Д г 1 1 , 15S-диoкcи-9a-мeтилeн- пpocтaцикл-5-ен-1 3-иновой кислоты, ЯМР (CDCl,),. , ррт: 0,90 (ЗН, три- пл); 4,00 (1Н, м.); 4,40 (1Н, широкий , т.); 5,28 (1Н, широкий т.).
Предлагаемые соединения формулы (l) более стабильны в интервале, рН 0-11, в частности при физиологичес- :ких значениях рН, что приводит к более длительному действию и более по- стоянной биологической активности. Источником такой более высокой стабильности является отличающаяся химическая структура этих соединений по сравнению с природным простацикли- ном. В результате наличия гетероато- ма кислорода в 2-окса-бицикло 3.3.0J октановой системе природный проста
циклин является экзоциклическим еноль ным простым эфиром и поэтому чрезвы- чайно чувствителен к кислоте. Продукт взаимодействия с кислотой, 6-кето- ,. почти не имеет биологической активности, отличающей природный про- .стациклин. Соединения (l) не имеют кислорода в бициклической системе и, следовательно, не являются енольны- ми простыми эфирами, т.е. не отличаются такой высокой стабильностью,как природные производные, поэтому их мож можно принимать орально. Соединения формулы (l)c тройной связью в 13-14 положении (л -цепи или с защищающей группой, например -алкильной, или электроноакцепторной, например фтор около гидроксила в положении 15 (Н или Н.-гидроксил), являются более устойчивыми по отномению к ферментам (например, 15-ПГ-дегидрогена- за), вызывающим метаболическое разложение природного пр остациклина.
Фармакологические действия природного простадиклина: при ингаляции его больным астмой предотвращаются неспецифически вызванные (например, от капель воды или от усилия) бронхо- спазмы (S. Biahko et al J. Res Medi- .cal Science, 1978, 6, 256), вливании мужчинам проявляется гипотензивная и вазодиляторная активность, кроме того, предотвращается образование агрегаций кровяных телец и разрушаются эти агрегации (SzekeЪyet-
5
0
Res Coimn 1978, 10, 545), проявляется стимулируюр1;ее действие на. матку обезьян и женщин, а также лютеолитическая активность, обеспечивается зтцита слизистой оболочки желудка от образования язв, вызываемых нестероидными антивоспалитель- ными препаратами, например ацетилсалициловой кислотой (АСА) и индомета- хином.
Химическая нестабильность природного простациклина затрудняет применение его в фармацевтических целях. У соединений формулы (l) нежелательная химическая нестабильность ПГ1 отсутствует.
В -табл. 1 показано in vitro ин- гибирующее действие на аг-регацию кровяных телец, вызванную 1 мкм А в плазме , йбогащенной кровяными тельцами, и гипотензивное действие на анасте- зированных крыс двух соединений (l).
Таблица 1
Примечание: 1- ПП,; 2 - 5t, 13t-llo, 153-диокси-9а-деокси-9а- -метиленпростацикл-5,13-диеновая кислота; 3 - 5t, 13t-llo, 153-диокси- -9а-деокси-9а, 7а-гомо-диметиленпро- стацикл-5,13-диеновая кислота.
По сравнению с ПП при равных дозах антиагрегационной активности, лютеологическая активность in vitro у хомяков составляет 5 и, соответственно , в 3 раза вьше (сравнение с dl-5,13t-l 1 of, 158-диокси-9а-деокси- -9а-9в-диметилен-17-циклогексил-18, 19,20-тринор-простацикл-5,I3-диено- вой кислотой и 5с, 13t-llof, 155-ди- окси-9а-деокси-9а-, 7а-гомо-димети- лен-16-фенокси-17,18,19,20-тетранор- -простацикл-5,13-диеновой кислоты).
Противоязвенная активность соединения dl-5,13t-l 1 /, 158-диокси-9а-деок си-7-нор-метиленпростацикл-5,13-дие-
6313
новая кислота при равных дозах анти- аггрегационной активности более чем в Ю раз вьте, чем эта же активность
nrij.
В экспериментах способность инги- бировать, вызываемые этанолом желу- дочные язвы используют мужские особи крыс весом 190110 г, которых содержат на голодном пайке, но со свог бодным доступом к воде в течение 15 ч. Испытуемое соединение вводили зверькам параллельно за 5 мин до введения этанола (95°, 2 мл/кг перораль- но). Через 2 ч после введения этано- ла крыс умерщвляют путем шейной транс локации и обескровливания. Желудки, перехваченные зажимами в кардии и в сфинктере привратника, быстро извлекают , заполняют физиологическим раствором , погружают на 30 с в 0,4%-ный формалин, вскрывают вдоль большей кривизны и исследуют на выявление изъязвления согласно ппсале, приведенной в табл. 2.
Таблица 7. оценки желудочных язв Железистая часть) у крыс
тый застой
Соединение
64
Продолжение табл.2
Интенсивньй сосудистый застой и мелкое кровоизлияние Кровотечение в слизистой и под- слизистой, небольшай поверхностная эрозия, небольшие язвы числом менее 3
До 10 небольших язв мм) или 4-5 средних язв
До 15 небольших язв или 5-6 больпшх язв
До 10 больших язв плюс много небольших язв
Более 10 крупных язв плюс много мелких язв, прободные язвы
Дозировку, способную вызвать 50%-ное ингибирование,изъязвления
обозначают как ЕД. и ее значение выражают в /кг.
nrij, испытанное в виде натриевой соли в дозировках до 800 у/кг, не проявило зависящего от дозировки ин- гибирования защитного действия от вызванного этанолом изъязвления.
Испытанные карбопростациклиновые соединения (l) показали при различных дозировках очевидное ингибирова- ние вызываемого этанолом Iизъязвления. Значения ЕД оприведены в табл. 3,
Таблица 3
Ингибирование вызьгоаемого этанолом л ёлу- дочного изъязвления у крыс ЕДд,, T /Kri- через рот
































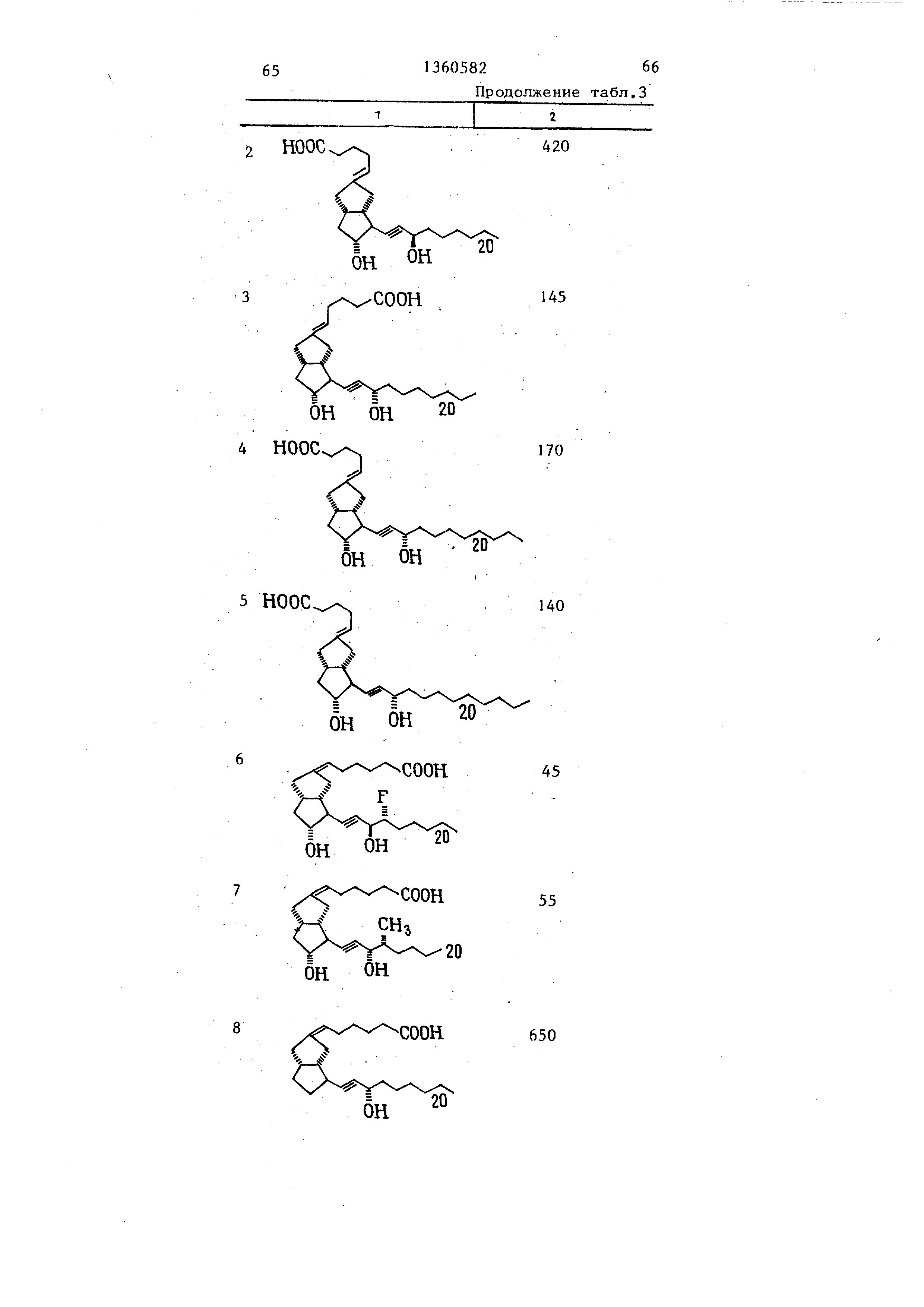

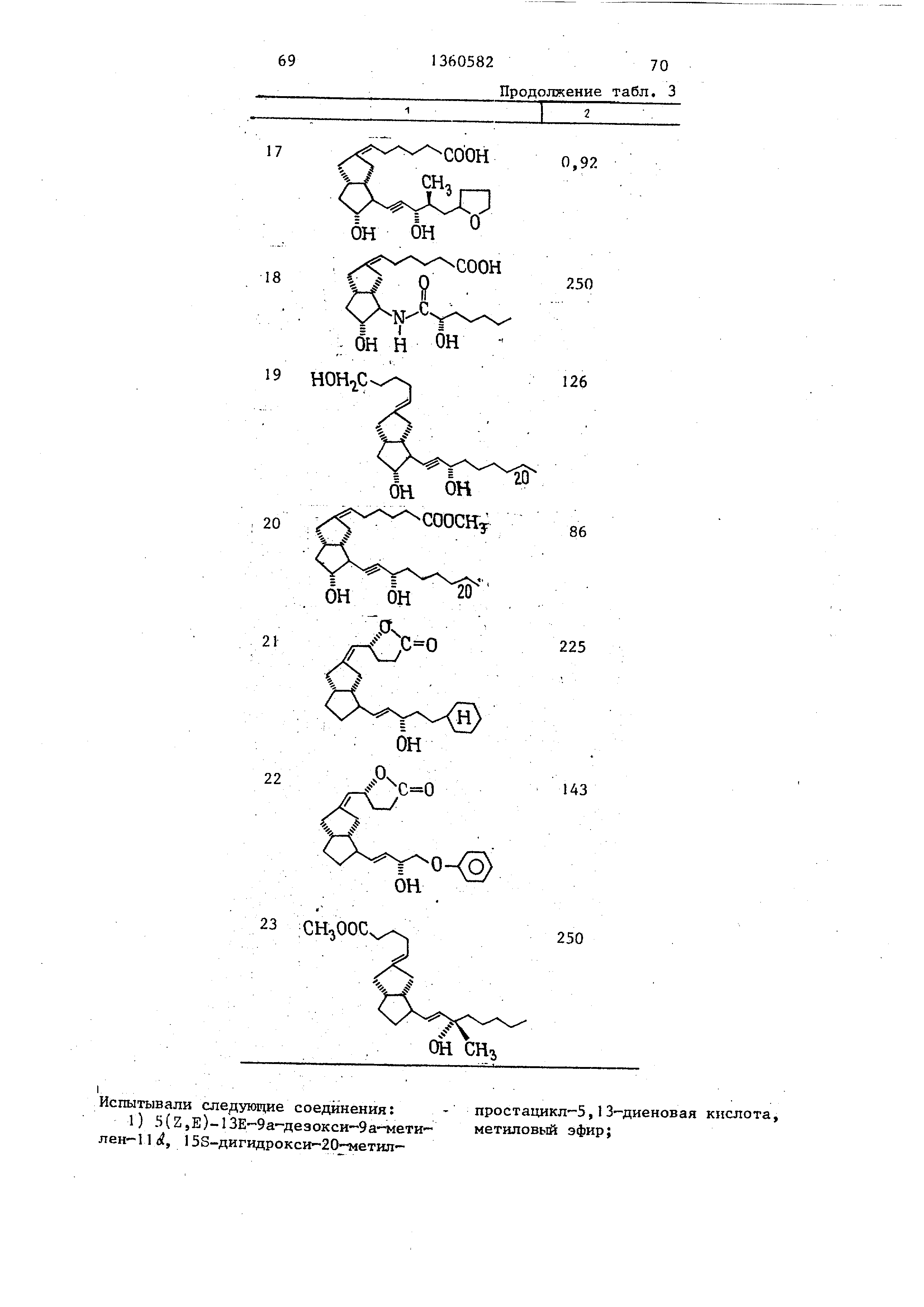


Реферат


Формула



Комментарии