Конъюгаты антагонистов интегрина для нацеленной доставки к клеткам, экспрессирующим lfa-1 - RU2624732C2
Код документа: RU2624732C2
Чертежи

















Описание
Настоящее изобретение относится к синтезу и взаимодействию эффективных и селективных низкомолекулярных антагонистов интегрина, содержащих подходящие линкеры и функциональные группы для химического взаимодействия с другими молекулами, содержащими реактивными нуклеофилами, такими как тиолы, таким образом, что между группировкой, которую нужно конъюгировать, и молекулярной частицей для нацеленной доставки образуется ковалентная связь. Низкомолекулярные антагонисты для нацеленной доставки связываются с когнатными рецепторными системами, поскольку являются антагонистами функционально-ассоциированного антигена лимфоцитов 1 (LFA-1; от англ. lymphocyte function associated antigen 1) и/или двойными антагонистами LFA-1/МАС-1 (мембраноатакующего комплекса; от англ. "membrane attack complex") к рецептору молекулы внеклеточной адгезии 1 (ICAM-1; от англ. "intercellular adhesion molecule-1"). Ковалентно связанная группировка включает низкомолекулярные терапевтические средства, полимеры, пептиды и олигонуклеотиды. Она включает 5ʹ-тиосодержащие олигонуклеотиды для образования производных 5ʹ-тио-миРНК (малых интерферирующих РНК) в качестве средств, обеспечивающих нацеленную доставку данных миРНК. Такие дериватизированные миРНК в сочетании с подходящими агентами трансфекции помогают при селективной доставке миРНК к клеткам, экспрессирующим такие рецепторы интегрина, предотвращая посредством этого экспрессию целевых генов за счет РНК интерференции (РНКи).
Функционально-ассоциированный антиген лимфоцитов 1, также известный как LFA-1, представляет собой интегрин, обнаруживаемый на всех Т-клетках, а также на В-клетках, макрофагах и нейтрофилах, и вовлечен в рекрутмент к сайту инфекции. Этот антиген связывается с ICAM-1 на антигенпрезентирующих клетках и функционирует как молекула адгезии. ICAM-1 (молекула внеклеточной адгезии 1), также известная как кластер дифференциации 54 (CD54; от англ. "Cluster of Differentiation 54"), представляет собой гликопротеин клеточной поверхности. Считают, что аберрантные уровни взаимодействий LFA-1/ICAM-1 являются действующими механизмами при воспалительных заболеваниях и расстройствах и, следовательно, антагонизм таких систем считают средством терапии. Таким образом, нацеленная доставка высокоаффинных малых молекул к этим системам может обеспечить средства для селективной доставки терапевтических средств, таких как миРНК, к клеточным системам, экспрессирующим рецептор ICAM-1.
РНК интерференция является хорошо известным процессом, при котором трансляции матричной РНК (мРНК) в белок препятствует ассоциирование или связывание комплементарных или частично комплементарных олигонуклеотидов, таких как малая интерферирующая РНК (миРНК), короткая шпилечная РНК (кшРНК), микроРНК или антисенс-олигонуклеотиды. миРНК представляют собой двунитевые молекулы РНК, длина которых находится в диапазоне 19-25 нуклеотидов, ассоциированные с группой белков в цитоплазме, известной как индуцированный РНК комплекс сайленсинга (RISC; от англ. "RNA-induced silencing complex"). RISC в конечном счете разделяет двунитевую миРНК, давая возможность одной нити связываться или ассоциироваться с комплементарным или частично комплементарным участком молекулы мРНК, после чего мРНК разрушается RISC, либо ее трансляция предотвращается иначе, следовательно, подавляя экспрессию кодируемого белка или генного продукта.
Одна из проблем при применении нуклеиновых кислот, таких как миРНК, в терапевтических областях применения (в частности, для системного введения людям) состоит в доставке нуклеиновых кислот: (1) в конкретные ткани-мишени или конкретные типы клеток и (2) в цитоплазму этих клеток (то есть, где присутствует мРНК и транслируется в белок). Проблема доставки отчасти основана на том факте, что нуклеиновые кислоты отрицательно заряжены и легко разрушаются (в частности, если они не модифицированы), эффективно фильтруются почками и сами по себе не могут легко транспортироваться в цитоплазму клеток. Таким образом, значительное количество исследований сосредоточено на решении проблемы доставки различными носителями и препаратами, включающими липосомы, мицеллы, пептиды, полимеры, конъюгаты и аптамеры. См. Ling et al., Advances in Systemic siRNA Delivery, Drugs Future 34(9): 721 (September 2009). Некоторые более перспективные носители для доставки включают применение липидных систем, включающих липидные наночастицы. См. Wu et al., Lipidic Systems for In Vivo siRNA Delivery, AAPS J. 11(4): 639-652 (December 2009); публикация международной заявки на патент № WO 2010/042877 авторов Hope et al. ("Improved Amino Lipids And Methods For the Delivery of Nucleic Acids"). Тем не менее, остается необходимость в дальнейшем усовершенствовании нацеленной доставки миРНК, а также других веществ, таких как малые молекулы, пептиды, другие нуклеиновые кислоты, флуоресцентные группировки и полимеры, к конкретным клеткам-мишеням и в цитоплазму таких клеток.
Изобретение относится к соединениям формулы I:
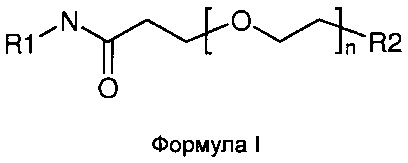
где R1, R2 и n являются такими, как определено в подробном описании и в формуле изобретения. В частности, настоящее изобретение относится к соединениям формулы I для улучшенной доставки конъюгированных группировок, таких как малые молекулы, пептиды, нуклеиновые кислоты, флуоресцентные группировки и полимеры, к клеткам-мишеням, экспрессирующим димер интегрина α4β1 (очень поздний антиген-4), димер αVβ3 или функционально-ассоциированный антиген лимфоцитов 1 (LFA-1), для различных терапевтических и других применений. Настоящее изобретение также относится к способам получения и применения таких соединений.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1а: В таблице 1 показана композиция одиночных и двойных нитей конкретной 5ʹ-дериватизированной миРНК.
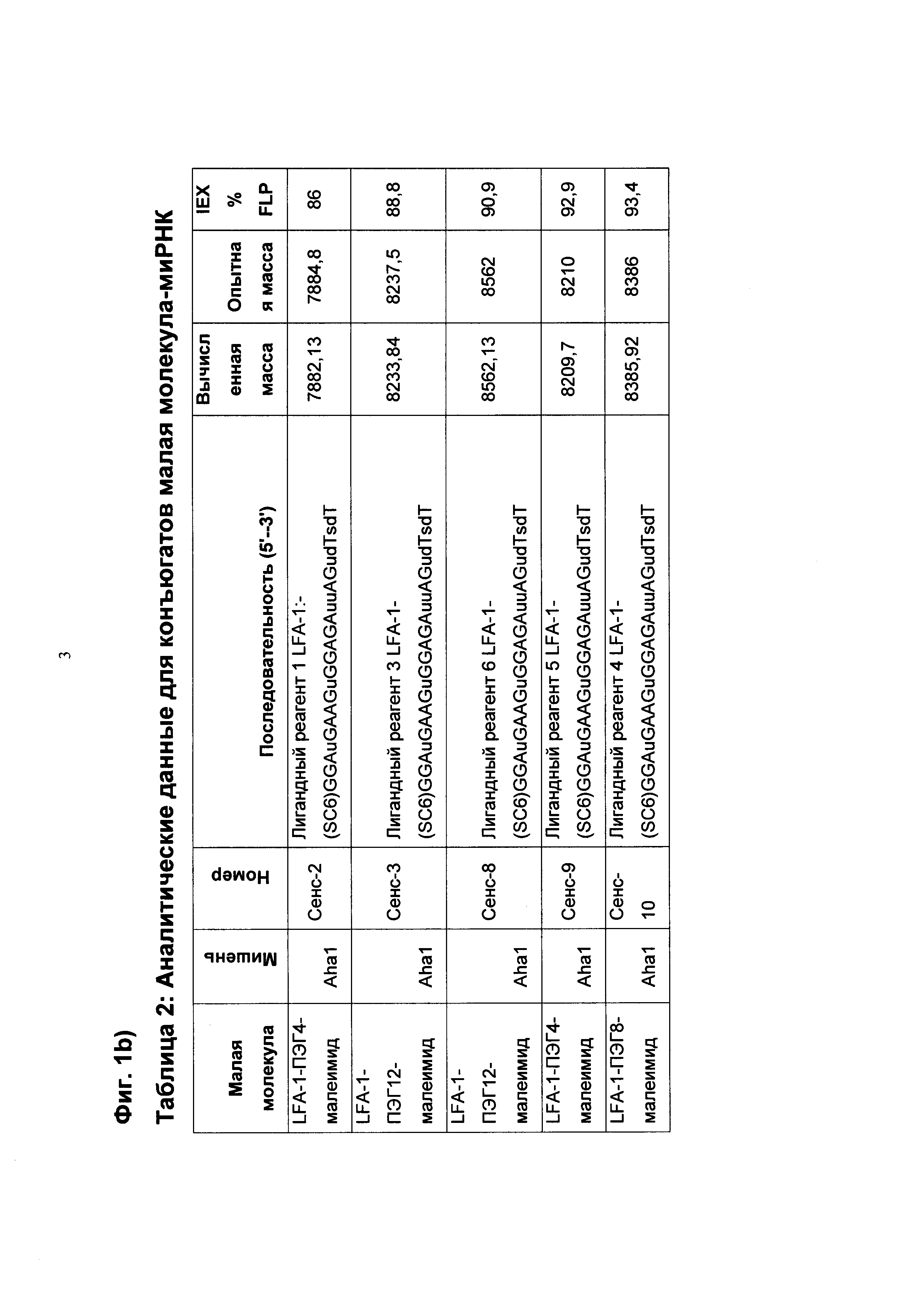
Фиг. 1b: В таблице 2 показаны аналитические данные для конъюгатов миРНК с малой молекулой.
Фиг. 1с: В таблице 3 показаны последовательности миРНК, где 5ʹ-антисмысловая нить дериватизирована Nu547.
Фиг. 1d: В таблице 4 показаны эффективности конъюгатов малой молекулы с миРНК в анализах антагонистов интегрина и данные константы диссоциации (КД) миРНК.
Фиг. 1е: В таблице 5 показана идентичность, характеризация и эффективности связывания реагентов, меченных изомером ФИТЦ.
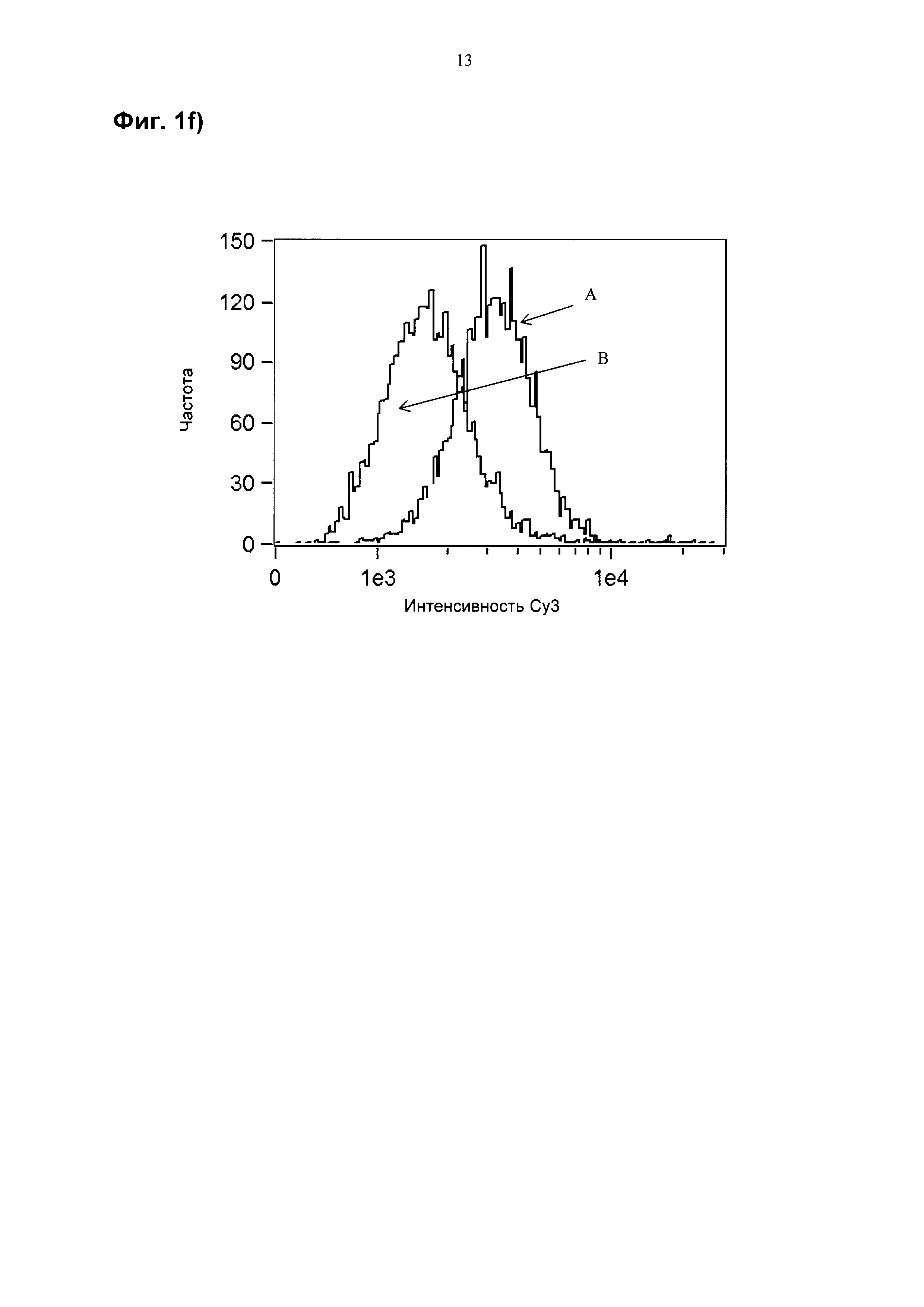
На фиг. 1f показана гистограмма ("В": Дуплекс-27 500 нМ и Пример 140 10 мкМ; "А": Дуплекс-27).
На фиг. 2 показано изображение захвата репрезентативной миРНК (Дуплекс-27 (500 нМ).
На фиг. 3 показаны изображения клеток Jurkat с ФИТЦ, конъюгированным с примером ФИТЦ-5 (ФИТЦ-меченым антагонистом LFA-1), при 10 мкМ.
На фиг. 4 показаны изображения клеток Jurkat с ФИТЦ, конъюгированным с примером ФИТЦ-14 (ФИТЦ-меченым антагонистом VLA-4) при 10 мкМ. На гистограмме показан сдвиг в присутствии дуплекса миРНК с элементом для нацеленной доставки к VLA-4. В присутствии антагониста VLA-4 примера 140 этот сдвиг сплюснут.
На фиг. 5 показано снижение экспрессии АНА1 в клетках H1299 при обработке дуплексами миРНК, дериватизированной на 5ʹ-смысловой нити малой молекулы для нацеленной доставки к интегрину. На оси у показан наблюдаемый уровень экспрессии АНА1. Более низкий столбик указывает на более высокую степень нокдауна (более высокую степень трансфекции миРНК); более высокий столбик на более низкую степень нокдауна (то есть на меньшую степень трансфекции миРНК). Дуплексы, изображенные синим цветом, имеют модификации для нацеленной доставки на 5ʹ-конце смысловой нити; дуплексы, изображенные розовым цветом, имеют модификации для нацеленной доставки на 5ʹ-конце смысловой нити, а также флуорофор Nu547, присоединенный к 5ʹ-концу антисмысловой нити.
На фиг. 6 показаны уровни экспрессии мРНК глицеральдегид-3-фосфатдегидрогеназы (GAPDH; от англ. "glyceraldehyde 3-phosphate dehydrogenase"), маркера здоровья клетки. Сходство уровней экспрессии для этих клеток, дериватизированных миРНК, с уровнями для обработанных плацебо и необработанных клеток является показателем отсутствия клеточной токсичности при данной концентрации и продолжительности обработки.
Если не указано иное, приведенные ниже специальные термины и выражения, используемые в описании и в формуле изобретения, определены, как описано ниже:
Термин "группировка" относится к атому или группе химически связанных атомов, присоединенной к другому атому или молекуле одной или более химических связей, образуя за счет этого часть молекулы. Например, переменные R1 и R2 формулы I относятся к группировкам, присоединенным к структуре, показанной в формуле I, ковалентной связью, где это указано.
Термин "конъюгированная группировка" относится к группировке, представляющей собой терапевтическое или полезное соединение, пептид, полимер, малую молекулу, флуоресцентную группировку, олигонуклеотид или нуклеиновую кислоту. Примеры включают лекарственные средства, терапевтические пептиды, антисенс-олигонуклеотиды, миРНК и флуоресцеинизотиоцианат (ФИТЦ).
Если не указано иное, термин "атом водорода" или "гидро" относится к группировке атома водорода (-Н), а не к Н2.
Термин "атом галогена" относится к группировке атома фтора, хлора, брома или йода.
Термин "алкил" относится к алифатической прямоцепочечной или разветвленной насыщенной углеводородной группировке, имеющей от 1 до 25 атомов углерода.
Термин "ТФУ" относится к трифторуксусной кислоте.
Если не указано иное, термин "соединение формулы" или "соединения формулы" означает любое соединение, выбранное из рода соединений, определенного формулой (включая любую фармацевтически приемлемую соль или сложный эфир любого такого соединения, если не отмечено иное).
Термин "фармацевтически приемлемые соли" относится к солям, сохраняющим биологическую эффективность и свойства свободных оснований или свободных кислот, которые не являются ни биологически, ни иначе нежелательными. Соли могут быть образованы с неорганическими кислотами, такими как соляная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота и тому подобное, предпочтительно соляная кислота, и с органическими кислотами, такими как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, малеиновая кислота, малоновая кислота, салициловая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, пара-толуолсульфоновая кислота, N-ацетилцистеин и тому подобное. Кроме того, соли могут быть получены путем присоединения неорганического основания или органического основания к свободной кислоте. Соли, образованные с неорганическим основанием, включают, но не ограничены ими, соли натрия, калия, лития, алюминия, кальция и магния и тому подобное. Соли, образованные от органических оснований, включают, но не ограничены ими, соли первичных, вторичных и третичных аминов, замещенных аминов, включающих природные замещенные амины, циклических аминов и основных ионообменных смол, таких как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин, лизин, аргинин, N-этилпиперидин, пиперидин, полиаминные смолы и тому подобное. В зависимости от паттернов замещения соединения по настоящему изобретению могут также существовать в виде цвиттерионов.
Соединения по настоящему изобретению могут находиться в форме фармацевтически приемлемых солей. Соединения по настоящему изобретению могут также находиться в форме фармацевтически приемлемых сложных эфиров (то есть метиловых и этиловых эфиров кислот формулы I, применяемых в качестве пролекарств). Соединения по настоящему изобретению могут быть также сольватированными, то есть гидратированными. Сольватацию можно осуществить в ходе процесса получения, либо она может происходить, например, вследствие гигроскопических свойств исходно безводного соединения формулы I (гидратация).
Соединения, имеющие одну и ту же молекулярную формулу, но различающиеся по природе или последовательности связывания их атомов или по расположению их атомов в пространстве, называют "изомерами". Изомеры, различающиеся по расположению их атомов в пространстве, называют "стереоизомерами". Диастереомеры представляют собой стереоизомеры, имеющие противоположную конфигурацию при одном или более хиральных центров, не являющиеся энантиомерами. Стереоизомеры, несущие один или более асимметрических центров, представляющие собой неналагаемые зеркальные отображения друг друга, называют "энантиомерами". Когда соединение имеет асимметрический центр, например, если атом углерода связан с четырьмя различными группами, возможна пара энантиомеров. Энантиомер может быть охарактеризован абсолютной конфигурацией его асимметрического центра или центров и описан на основании правил R- и S-последовательности Кана, Ингольда и Прелога или на основании способа вращения плоскости поляризованного света, и обозначен как правовращающий или левовращающий (то есть в виде (+) или (-)-изомеров соответственно). Хиральное соединение может существовать либо в виде отдельного энантиомера, либо в виде их смеси. Смесь, содержащая равные доли энантиомеров, называют "рацемической смесью".
Термин "терапевтически эффективное количество" означает количество соединения, эффективное для предупреждения, облегчения или ослабления симптомов заболевания или продления жизни субъекта, подлежащего лечению. Определение терапевтически эффективного количества находится в пределах компетенции специалиста в данной области техники. Терапевтически эффективное количество или дозировка соединения согласно данному изобретению может варьировать в широких пределах и может быть определено способом, известным в данной области техники. Такую дозировку регулируют на основании индивидуальных потребностей в каждом конкретном случае, включающем конкретное вводимое соединение (соединения), путь введения, состояние, подлежащее лечению, а также пациента, подлежащего лечению. Суточную дозу можно вводить в виде однократной дозы или в разделенных дозах, либо для парентерального введения ее можно вводить в виде непрерывной инфузии.
Термин "фармацевтически приемлемый носитель" подразумевает включение любого вещества и всех веществ, совместимых с фармацевтическим введением, включая растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические агенты и агенты, замедляющие всасывание, и другие вещества и соединения, совместимые с фармацевтическим введением. Применение этих веществ в композициях рассматривают в любом случае за исключением случаев, когда какая-либо традиционная среда или агент несовместимы с активным соединением. В композиции можно также включать дополнительные активные соединения.
Подробно настоящее изобретение относится к соединениям формулы I:
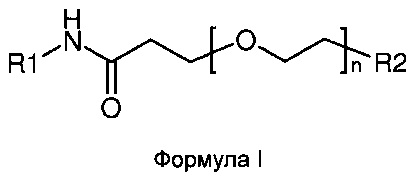
или к их фармацевтически приемлемым солям или сложным эфирам; где n равно 1-24, и где:
R1 выбран из группы, состоящей из следующих соединений:
(1) соединения формулы:

(2) соединения формулы:

(3) соединения формулы:
где Q представляет собой H или ОН;
R2 выбран из группы, состоящей из следующих соединений:
(1) соединения формулы:

(2) соединения формулы:

(3) соединения формулы:

(4) соединения формулы:

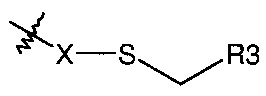
где R3 представляет собой конъюгированную группировку и X представляет собой либо атом серы, либо соединение формулы:

Как используют в приведенных выше структурах, символ


где X представляет собой соединение формулы:
то структура на основе формулы I представляет собой:

где R1, R3 и n являются такими, как определено в формуле I.
Настоящее изобретение также относится к способам получения и применения соединений формулы I, а также фармацевтических композиций, содержащих такие соединения. Соединения формулы I полезны при улучшении доставки малых молекул, белков, нуклеиновых кислот, полимеров, флуоресцентных маркеров и других веществ к клеткам-мишеням, экспрессирующим рецепторы ICAM-1. В конкретных воплощениях настоящее изобретение относится к композициям и препаратам, содержащим соединения формулы I, полезным при доставке миРНК в цитоплазму клеток-мишеней, экспрессирующих рецепторы ICAM-1, для ингибирования экспрессии определенных белков-мишеней посредством РНК интерференции.
В более конкретных воплощениях изобретение относится к применению соединений формулы I для получения препарата, способствующего доставке нуклеиновых кислот, таких как миРНК, к опухолевым клеткам и другим типам клеток, экспрессирующих рецепторы ICAM-1. Кроме того, применение соединений формулы I для синтеза препаратов доставки для лечения воспалительных и пролиферативных расстройств, таких как раки, составляет часть изобретения.
R1 представляет собой низкомолекулярные антагонисты интегрина для нацеленной доставки соединений формулы I к интегрину LFA-1, способствуя посредством этого их доставке к клеткам, экспрессирующим такие рецепторы.
В конкретных воплощениях изобретения низкомолекулярный антагонист интегрина для нацеленной доставки группировок R1, присоединен в таком положении, что сродство связывания этой малой молекулы с интегрином по существу не снижено относительно свободного низкомолекулярного антагониста интегрина. Группировки R1 формулы I нацелены на рецептор ICAM-1 (посредством антагонистов LFA-1 или двойных антагонистов LFA-1/MAC-1 к рецептору ICAM-1).
В конкретных воплощениях изобретения группировки R1 представляет собой антагонисты LFA-1 и/или двойные антагонисты LFA-1/MAC-1 или группировку для нацеленной доставки к рецептору ICAM-1 формулы:

или их фармацевтически приемлемую соль или сложный эфир.
В других воплощениях изобретения R1 представляет собой антагонисты LFA-1 и/или двойные антагонисты LFA-1/MAC-1 или группировку для нацеленной доставки к рецептору ICAM-1 формулы:
или их фармацевтически приемлемую соль или сложный эфир.
В других воплощениях изобретения R1 представляет собой антагонисты LFA-1 и/или двойные антагонисты LFA-1/MAC-1 или группировку для нацеленной доставки к рецептору ICAM-1 формулы:

или их фармацевтически приемлемую соль или сложный эфир, где Q представляет собой H или ОН.
R2 может представлять собой реакционные группировки, которые могут образовывать ковалентные связи с терапевтическими или другими полезными соединениями или конъюгированными группировками, обладающими сильной нуклеофильностью, такими как тиолсодержащие молекулы. Примеры таких реакционных группировок включают группировки, выбранные из группы, состоящей из следующих группировок:



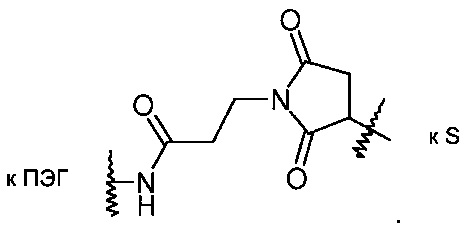
Альтернативно R2 может представлять собой группировку, которая уже присоединена к конъюгированной группировке, такой как терапевтическое или другое полезное соединение, белок или олигонуклеотид (R3). Более конкретно R2 может представлять собой группировку формулы:

где R3 представляет собой конъюгированную группировку и X представляет собой либо атом серы, либо соединение формулы:

В конкретных воплощениях изобретения R3 представляет собой олигонуклеотид. В более конкретных воплощениях изобретения R3 представляет собой 5ʹ-конец смысловой нити молекулы РНК, которая может существовать в виде одной нити или в дуплексе, таком как молекула миРНК. Такие молекулы миРНК, также известные как агенты РНКи, ингибируют экспрессию гена-мишени в клетке. В конкретных воплощениях изобретения R3 представляет собой молекулу миРНК, состоящую по существу из олигорибонуклеотидной нити длиной от 15 до 30 нуклеотидов, где 5ʹ конец смысловой олигорибонуклеотидной нити соединен с R2, как показано в приведенных выше структурах, и комплементарную по меньшей мере одному участку мРНК, соответствующей гену-мишени. В других воплощениях изобретения R3 представляет собой олигонуклеотид ДНК, присоединенный к его 5ʹ-концу. Такая дериватизированная ДНК может существовать в виде одной нити или в виде одной нити, гибридизованной с комплементарной нитью другого олигонуклеотида. Олигонуклеотидные нити могут быть либо немодифицированными, либо модифицированными для метаболической стабильности. Такие модификации включают, но не ограничены ими, замены в конкретных положениях на фосфате (например, фосфоротиоат) и 2ʹ-гидрокси (например, 2ʹ-O-метил и 2ʹ-фтор).
В конкретных воплощениях изобретения R2 формулы I представляет собой -X-S-CH2-R3, где R3 включает смысловую нить РНК, как показано ниже в формуле 5 (на основе формулы I):
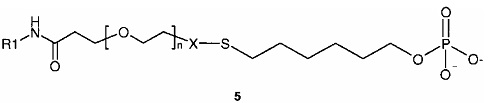
где R1, n и X являются такими, как определено в формуле I.
В других конкретных воплощениях изобретения смысловая нить может быть связана с антисмысловой нитью.
В других конкретных воплощениях изобретения R2 представляет собой -X-S-CH2-R3, где R3 представляет собой малую молекулу или белок, образуя посредством этого ковалентно связанную специфичную молекулу формулы I для нацеленной доставки.
В более конкретных воплощениях изобретения R2 представляет собой -X-S-CH2-R3, где R3 представляет собой терапевтическую малую молекулу или белок.
В других конкретных воплощениях изобретения R2 представляет собой -X-S-CH2-R3, где R3 представляет собой флуоресцентную группировку, полезную для визуализации этих связываний рецептора интегрина, используя методы клеточной микроскопии.
В других конкретных воплощениях изобретения R2 представляет собой -X-S-CH2-R3, где R3 представляет собой полимер, имеющий первичные реакционные сульфиды. Более конкретно R3 может представлять собой катионный полимер, полезный для комплексообразования и доставки миРНК к клеточным поверхностям и цитоплазматическим доменам клеток.
В более конкретных воплощениях изобретения настоящее изобретение направлено на соединения формулы I, где R3 представляет собой один из структурных изомеров флуоресцеинизотиоцианата (ФИТЦ), представленных ниже:


В других более конкретных воплощениях настоящее изобретение направлено на соединения формулы I, где R3 представляет собой один из структурных изомеров ФИТЦ-14, представленных ниже:
В других воплощениях настоящее изобретение направлено на соединение формулы I, где n равно 9-13, предпочтительно 12.
В более конкретных воплощениях настоящее изобретение направлено на соединение формулы I, выбранное из группы, состоящей из одного из следующих соединений (или его фармацевтически приемлемую соль или сложный эфир):
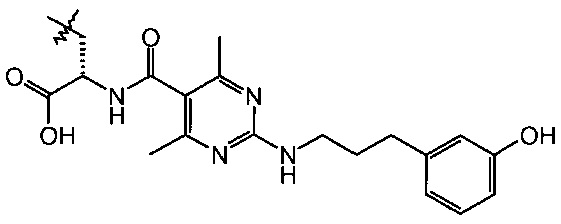
Лигандный реагент 1 LFA-1
(S)-3-{3-{2-[2-(2-{2-[3-(2,5-Диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси]-этокси}-этокси)-этокси]-пропиониламино}-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}амино)пропионовая кислота;
Лигандный реагент 2 LFA-1
(S)-3-{3-(2-{2-[2-(2-{2-[2-(2-{2-[3-(2,5-Диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси)-этокси]-этокси}-этокси)-этокси]-этокси}-этокси)-этокси]-пропиониламино}-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}амино)пропионовая кислота;
Лигандный реагент 3 LFA-1
(S)-3-{3-[2-(2-{2-[2-(2-{2-[2-(2-{2-[2-(2-{2-[3-(2,5-Диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси}-этокси)-этокси]-этокси}-этокси)-этокси]-этокси}-этокси)-этокси]-этокси}-этокси)-этокси]-пропиониламино}-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}амино)пропионовая кислота;
Лигандный реагент 4 LFA-1
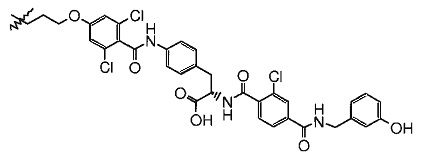
(S)-3-{4-[4-(3-(2-{2-[2-(2-{2-[2-(2-{2-этокси)-этокси]-этокси}-этокси)-этокси]-этокси}-этокси)-этокси]-амино-пропокси)-2,6-дихлор-бензоиламино]-фенил}-2-[2-хлор-4-(3-гидрокси-бензилкарбамоил)-бензоиламино]-пропионовая кислота-ПЭГ8;
Лигандный реагент 5 LFA-1
S)-2-[2-Хлор-4-(3-гидрокси-бензилкарбамоил)-бензоиламино]-3-(4-{2,6-дихлор-4-[3-(3-{2-[2-(2-{2-[3-(2,5-диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси}-этокси)-этокси]-этокси}-пропиониламино)-пропокси]-бензоиламино}-фенил)-пропионовая кислота;
Лигандный реагент 6 LFA-1
S)-2-[2-Хлор-4-(3-гидрокси-бензилкарбамоил)-бензоиламино]-3-(4-{2,6-дихлор-4-[3-(3-{2-[2-(2-{2-2-[2-(2-{2-2-[2-(2-{2-[3-(2,5-диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси}-этокси)-этокси]-этокси}-этокси}-этокси)-этокси]-этокси}-пропиониламино)-пропокси]-бензоиламино}-фенил)-пропионовая кислота;
Лигандный реагент 7 LFA-1
S)-2-[2-Хлор-4-(3-гидрокси-бензилкарбамоил)-бензоиламино]-3-(4-{2,6-дихлор-4-[3-(3-{2-[2-(2-{2-2-[2-(2-{2-[3-(2,5-диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси}-этокси)-этокси]-этокси]-этокси}-этокси)-этокси]-этокси}-пропиониламино)-пропокси]-бензоиламино}-фенил)-пропионовая кислота;
Лигандный реагент 8 LFA-1
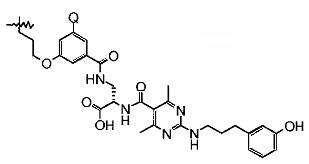
(S)-3-{[(3-{3-[3-(2-{2-[2-(2-{2-[2-(2-{2-[3-(2,5-Диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси}-этокси)-этокси]-этокси}-этокси)-этокси]-этокси}-этокси)-пропиониламино]-пропил-окси}-фенил)-карбонил]-амино}-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}-амино)-пропионовая кислота;
Лигандный реагент 9 LFA-1
(S)-3-{[(3-{3-[3-(2-{2-[2-(2-{2-[2-(2-{2-[3-(2,5-Диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси}-этокси)-этокси]-этокси}-этокси)-этокси]-этокси}-этокси)-пропиониламино]-пропил-окси}-5-гидрокси-фенил)-карбонил]-амино}-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}-амино)-пропионовая кислота;
Лигандный реагент 10 LFA-1
(S)-3-[({3-[3-(3-{2-[2-(2-{2-[3-(2,5-Диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси}-этокси)-этокси]-этокси}-пропиониламино)-пропил-окси]-5-гидрокси-фенил}-карбонил)-амино]-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}-амино)-пропионовая кислота.
Кроме того, настоящее изобретение относится к новым композициям и препаратам, содержащим соединения формулы I, для получения наночастиц при объединении с миРНК, приводящем в результате к улучшенной доставке нуклеиновых кислот, таких как миРНК, в цитоплазму клеток-мишеней, экспрессирующих комплексы LFA-1/ICAM-1. В конкретных воплощениях настоящее изобретение направлено на препарат миРНК, содержащий следующие ингредиенты: (1) соединение формулы I, где R2 включает олигонуклеотид 5ʹ-миРНК; и (2) поликатионный агент трансфекции.
Настоящее изобретение также относится к способам получения и применения таких соединений и композиций. Соединения формулы I полезны в качестве ингредиентов композиций или препаратов, улучшающих доставку лекарственных средств, нуклеиновых кислот или других терапевтических соединений к тканям или клеткам, экспрессирующим комплексы LFA-1/ICAM-1. В конкретных воплощениях настоящее изобретение относится к препаратам, содержащим соединения формулы I, полезным при доставке миРНК в цитоплазму клеток-мишеней, экспрессирующих комплексы LFA-1/ICAM-1, чтобы ингибировать экспрессию определенных белков посредством РНК интерференции. В более конкретных воплощениях настоящее изобретение относится к соединениям формулы I и композициям, содержащим такие соединения, которые могут эффективно доставлять миРНК к опухолевым клеткам и другим типам клеток, экспрессирующих рецепторы ICAM-1, для лечения рака или воспалительных заболеваний. Такие соединения и композиции более эффективны и проявляют улучшенную способность к нокдауну по сравнению с аналогичными препаратами, не содержащими соединения формулы I.
В одном воплощении изобретения предложено соединение формулы I:

или его фармацевтически приемлемая соль или сложный эфир; где n равно 1-24, и где:
R1 выбран из группы, состоящей из следующих соединений:
(1) соединения формулы:

(2) соединения формулы:

(3) соединения формулы:

где Q представляет собой H или ОН;
R2 выбран из группы, состоящей из следующих соединений:
(1) соединения формулы:

(2) соединения формулы:

(3) соединения формулы:

(4) соединения формулы:

где R3 представляет собой конъюгированную группировку и X представляет собой либо атом серы, либо соединение формулы:

В одном воплощении изобретения предложено соединение формулы I, где R1 представляет собой соединение формулы:
В одном воплощении изобретения предложено соединение формулы I, где R1 представляет собой соединение формулы:

В одном воплощении изобретения предложено соединение формулы I, где R1 представляет собой соединение формулы:

где Q представляет собой H или ОН.
В одном воплощении изобретения предложено соединение формулы I, где R1 представляет собой соединение формулы:

где Q представляет собой Н.
В одном воплощении изобретения предложено соединение формулы I, где R1 представляет собой соединение формулы:

где Q представляет собой ОН.
В одном воплощении изобретения предложено соединение формулы I, где R2 представляет собой соединение формулы:

В одном воплощении изобретения предложено соединение формулы I, где R2 представляет собой соединение формулы:

В одном воплощении изобретения предложено соединение формулы I, где R2 представляет собой соединение формулы:

В одном воплощении изобретения предложено соединение формулы I, где R2 представляет собой соединение формулы:

где R3 представляет собой одно- или двунитевой олигонуклеотид, и X представляет собой либо атом серы, либо соединение формулы:

В одном воплощении изобретения предложено соединение формулы I, где R2 представляет собой соединение формулы:

где R3 представляет собой одно- или двунитевой олигонуклеотид и X представляет собой атом серы.
В одном воплощении изобретения предложено соединение формулы I, где R2 представляет собой соединение формулы:

где R3 представляет собой молекулу миРНК, и X представляет собой либо атом серы, либо соединение формулы:

В одном воплощении изобретения предложено соединение формулы I, где R1 представляет собой соединение формулы:

где R2 представляет собой соединение формулы:

где R3 представляет собой молекулу миРНК и X представляет собой либо атом серы, либо соединение формулы:

В одном воплощении изобретения предложено соединение формулы I, где R1 соединение формулы:

где R2 представляет собой соединение формулы:

где R3 представляет собой молекулу миРНК и X представляет собой либо атом серы, либо соединение формулы:
В одном воплощении изобретения предложено соединение формулы I, где R1 представляет собой соединение формулы:
где Q представляет собой H или ОН,
где R2 представляет собой соединение формулы:
где R3 представляет собой молекулу миРНК, и X представляет собой либо атом серы, либо соединение формулы:

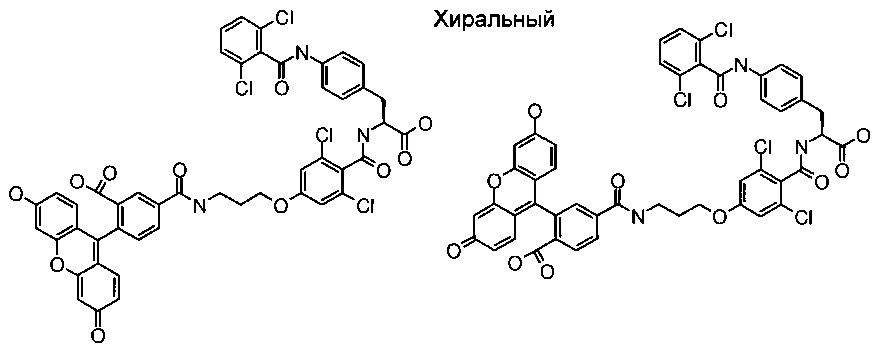
В одном воплощении изобретения предложено соединение формулы I, выбранное из группы, состоящей из следующих соединений:
(S)-3-{3-{2-[2-(2-{2-[3-(2,5-Диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси]-этокси}-этокси)-этокси]-пропиониламино}-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}амино)пропионовой кислоты; и
(S)-3-{3-(2-{2-[2-(2-{2-[2-(2-{2-[3-(2,5-Диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси)-этокси]-этокси}-этокси)-этокси]-этокси}-этокси)-этокси]-пропиониламино}-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}амино)пропионовой кислоты.
В одном воплощении изобретения предложено соединение формулы I, выбранное из группы, состоящей из следующих соединений:
(S)-3-{3-[2-(2-{2-[2-(2-{2-[2-(2-{2-[2-(2-{2-[3-(2,5-Диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси}-этокси)-этокси]-этокси}-этокси)-этокси]-этокси}-этокси)-этокси]-этокси}-этокси)-этокси]-пропиониламино}-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}амино)пропионовой кислоты; и
(S)-3-{4-[4-(3-(2-{2-[2-(2-{2-[2-(2-{2-этокси)-этокси]-этокси}-этокси)-этокси]-этокси}-этокси)-этокси]-амино-пропокси)-2,6-дихлор-бензоиламино]-фенил}-2-[2-хлор-4-(3-гидрокси-бензилкарбамоил)-бензоиламино]-пропионовой кислоты-ПЭГ8.
В одном воплощении изобретения предложено соединение формулы I, выбранное из группы, состоящей из следующих соединений:
S)-2-[2-Хлор-4-(3-гидрокси-бензилкарбамоил)-бензоиламино]-3-(4-{2,6-дихлор-4-[3-(3-{2-[2-(2-{2-[3-(2,5-диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси}-этокси)-этокси]-этокси}-пропиониламино)-пропокси]-бензоиламино}-фенил)-пропионовой кислоты; и
S)-2-[2-Хлор-4-(3-гидрокси-бензилкарбамоил)-бензоиламино]-3-(4-{2,6-дихлор-4-[3-(3-{2-[2-(2-{2-2-[2-(2-{2-2-[2-(2-{2-[3-(2,5-диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси}-этокси)-этокси]-этокси}-этокси}-этокси)-этокси]-этокси}-пропиониламино)-пропокси]-бензоиламино}-фенил)-пропионовой кислоты.
В одном воплощении изобретения предложено соединение формулы I, выбранное из группы, состоящей из следующих соединений:
S)-2-[2-Хлор-4-(3-гидрокси-бензилкарбамоил)-бензоиламино]-3-(4-{2,6-дихлор-4-[3-(3-{2-[2-(2-{2-2-[2-(2-{2-[3-(2,5-диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси}-этокси)-этокси]-этокси]-этокси}-этокси)-этокси]-этокси}-пропиониламино)-пропокси]-бензоиламино}-фенил)-пропионовой кислоты; и
(S)-3-{[(3-{3-[3-(2-{2-[2-(2-{2-[2-(2-{2-[3-(2,5-Диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси}-этокси)-этокси]-этокси}-этокси)-этокси]-этокси}-этокси)-пропиониламино]-пропил-окси}-фенил)-карбонил]-амино}-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}-амино)-пропионовой кислоты.
В одном воплощении изобретения предложено соединение формулы I, выбранное из группы, состоящей из следующих соединений:
(S)-3-{[(3-{3-[3-(2-{2-[2-(2-{2-[2-(2-{2-[3-(2,5-Диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси}-этокси)-этокси]-этокси}-этокси)-этокси]-этокси}-этокси)-пропиониламино]-пропил-окси}-5-гидрокси-фенил)-карбонил]-амино}-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}-амино)-пропионовой кислоты; и
(S)-3-[({3-[3-(3-{2-[2-(2-{2-[3-(2,5-Диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]-этокси}-этокси)-этокси]-этокси}-пропиониламино)-пропил-окси]-5-гидрокси-фенил}-карбонил)-амино]-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}-амино)-пропионовой кислоты.
В другом воплощении изобретения предложена фармацевтическая композиция, содержащая соединение формулы I и фармацевтически приемлемый носитель.
ОБЩИЙ СИНТЕЗ СОЕДИНЕНИЙ ПО ИЗОБРЕТЕНИЮ
Подходящие способы синтеза соединений формулы I представлены в примерах. В целом соединения формулы I могут быть получены согласно схемам, проиллюстрированным ниже. Если не указано иное, переменные n и R1 и R2 в приведенных ниже схемах определены так же, как определено для рода соединений формулы I.
Общий синтез конъюгирующих агентов, представляющих собой малеимид-(ПЭГ)n-антагонисты интегрина
Соединения, такие как 26 на схеме 1, имеющих различные длины ПЭГ, имеются в продаже (например, от фирмы Pierce Bioscience). Такие соединения могут быть также получены, например, путем ацилирования амино-концов ПЭГ-аминокислот 3-(2,5-диоксо-2,5-дигидро-пиррол-1-ил)-пропионовой кислотой в условиях образования амидной связи с последующим образованием реакционных сложных эфиров N-гидроксиянтарной кислоты путем взаимодействия N-гидроксиянтарной кислоты в условиях образования сложного эфира. Как показано на схеме 1, взаимодействие соединений 26 с соединениями, содержащими первичные или вторичные амины, такие как 27, проводят в апротонных или протонных растворителях в присутствии основных аминов, таких как диизопропилэтиламин (DIEA; от англ. "diisopropylethylamine), при комнатной температуре с образованием пэгилированных промежуточных соединений 28.

Соединения, такие как 29, на схеме 2, для которых R4 представляет собой тиоацетил или 2-дитиопиридил, и имеющие группировки ПЭГ различной длины, также имеются в продаже (например, от фирмы Pierce Bioscience). Взаимодействие соединений, имеющих структуру 29, с соединениями, содержащими первичные или вторичные амины, такими как 27, проводят в апротонных или протонных растворителях в присутствии основных аминов, таких как диизопропилэтиламин (DIEA), при комнатной температуре с образованием пэгилированных промежуточных соединений 30.

В качестве конкретного неограничивающего примера для данного изобретения промежуточное соединение 26 подвергают взаимодействию с 31 с получением малеимидного промежуточного соединения 32, как показано на схеме 3:

Подобным образом промежуточное соединение 26 можно подвергать взаимодействию с 33 с получением малеимидного промежуточного соединения 34, как показано на схеме 4:

Подобным образом промежуточное соединение 29 можно подвергать взаимодействию с 35 с получением промежуточного соединения 36, как показано на схеме 5, на которой R4 представляет собой либо тиоацетил, либо 2-дитиопиридил:

Подобным образом промежуточное соединение 29 можно подвергать взаимодействию с 37 с получением промежуточного соединения 38, как показано на схеме 6, на которой R4 представляет собой либо тиоацетил, либо 2-дитиопиридил:

Для соединений, имеющих общую структуру 26 или 29, различные длины ПЭГ доступны или могут быть легко получены специалистами в данной области техники; предпочтительно n=8-24. Эта тема всесторонне описана и рассмотрена в литературе (например, Chemistry for peptide and protein PEGylation, Advanced Drug Delivery Reviews Volume 54, Issue 4, 17 June 2002, Pages 459-476).
Промежуточное соединение 31 может быть синтезировано способом, подобным способу, описанному в литературе (например, Sidduri, A. et al. Bioorganic & Medicinal Chemistry Letters, 2002, 12, 2475-2478), как показано на схеме 7:


В частности, как показано на схеме 7, промежуточное соединение 41 было получено из имеющейся в продаже (S)-3-[4-нитрофенил]-2-трет-бутоксикарбониламино-пропионовой кислоты 40. Нитрогруппу имеющегося в продаже исходного вещества 40 в растворе метанола восстанавливают цинковой пылью в присутствии хлорида аммония, при комнатной температуре, в течение нескольких часов с получением в результате анилина 41. Другие способы восстановления нитрогруппы известны специалистам в данной области техники. Анилин 41 ацилируют производными бензоилгалогенида, такими как 2,6-дихлорбензоилхлорид 42, в апротонном растворителе, таком как дихлорметан, в присутствии основания, такого как диизопропилэтиламин, при комнатной температуре. Таким образом, получают амид 43. Защитную группу амина трет-бутилкарбонил (Boc) удаляют в соответствии со стандартными способами, известными специалистам в данной области техники, например, путем обработки раствором HCl в диоксане при комнатной температуре; в результате получают гидрохлорид 44. Гидрохлорид 44 обрабатывают условиями образования амидной связи (также известными специалистам в данной области техники) в присутствии известной 1-(2-азидо-этил)-циклопентанкарбоновой кислоты 45 с получением в результате ди-амида 46. Азидную группу промежуточного соединения 46 восстанавливают путем обработки триалкилфосфином в апротонном растворителе, таком как тетрагидрофуран, при комнатной температуре. Далее метиловый эфир омыляют путем обработки гидроксидом натрия в смеси растворителей, таких как этанол и тетрагидрофуран, при повышенной температуре, например, при 50°С, в течение 15 часов. Данный способ приводит в результате к образованию промежуточного соединения 31, которое может быть также представлено в виде цвиттериона.
Присоединение ПЭГ-группировки также возможно с промежуточным соединением 39, которое синтезируют, как показано на схеме 8. В частности, 3,5-дихлорфенол 47 защищают триизопропилсилилхлоридом в присутствии основания, такого как имидазол, в полярном апротонном растворителе, таком как ДМФ, перед взаимодействием с сильным основанием, таким как бутиллитий, в безводном тетрагидрофуране при низких температурах, таких как -78 градусов С.Полученный в результате литиевый комплекс гасят диоксидом углерода, добавленным в форме сухого льда, с получением в результате промежуточного соединения 48, производного бензойной кислоты. Затем промежуточное соединение 48 хлорируют с образованием ацилхлорида путем обработки в апротонном растворителе, таком как толуол, сульфонилхлоридом (SOCl2). Затем в это время ацилхлорид подвергают взаимодействию с гидрохлоридом амина 49 в присутствии основания, такого как диизопропилэтиламин (DIPEA), в апротонном растворителе, таком как дихлорметан (ДХМ), образуя таким путем промежуточное соединение 50. Силильную защитную группу промежуточного соединения 50 удаляют путем обработки тетрабутиламмония фторидом (TBAF) в протонном растворителе, таком как тетрагидрофуран, при комнатной температуре. Это фенольное промежуточное соединение подвергают взаимодействию в присутствии основания, такого как карбонат аммония (K2CO3), в апротонном растворителе, таком как диметилформамид (ДМФ), с 3-N-трет-бутил-карбамат-1-бромпропан. Таким образом, получают промежуточное соединение 52 и после удаления защиты трифторуксусной кислотой (ТФУ) и последующего гидролиза основанием, таким как гидроксид натрия, в протонном растворителе, таком как этанол, образуют промежуточное соединение 39:

Синтез дериватизирующих агентов антагонистов LFA-1
Малые молекулы для нацеленного взаимодействия LFA-1/ICAM, обеспечивающие посредством этого средства для нацеленной доставки к клеткам, экспрессирующим систему ICAM, показаны ниже на схемах 11, 12, 13 и 14. Как показано на схеме 11, образуют первичный амид сложного эфира 3-(3-метокси)-пропановой кислоты 70 и восстанавливают в стандартных условиях, известных специалистам в данной области техники. Отдельно образуют дигидропиримидин, используя реакцию Биджинелли с мочевиной, ацетальдегидом и этиловым эфиром 3-оксобутановой кислоты. Пиримидин этого продукта образуют путем обработки дигидропиримидинлм с 50% азотной кислотой с получением в результате этилового эфира 4,6-диметил-2-гидрокси-пиримидин-5-карбоновой кислоты.
Хлорид этого вещества образуют путем взаимодействия с POCl3 (оксихлоридом фосфора) с образованием соединения 72. Амин 71 подвергают взаимодействию с хлоридом 72, образуя сложный эфир вторичного амина 73. В этот момент метоксигруппу удаляют путем обработки кислотой Льюиса, такой как трибромид бора, в апротонном растворителе с образованием фенола 74. Этот фенол 74 омыляют в присутствии водного основания с последующим применением условий амидного сочетания в присутствии S-3-N-трет-бутил-карбамат-2-карбокси-диаминопропана гидрохлорида (H-DAP(Boc)OMe гидрохлорида), образуя в результате промежуточное соединение 77. Защитную группу Boc удаляют в стандартных условиях с последующим омылением метилового эфира с образованием малой молекулы 21 для нацеленной доставки к ICAM-1.
Схема реакций 11 для следующих примеров: Лигандный реагент 1 LFA-1, Лигандный реагент 2 LFA-1, Лигандный реагент 3 LFA-1:

Другие малые молекулы для нацеленного взаимодействия LFA-1/ICAM, обеспечивающие посредством этого средства для нацеленной доставки к клеткам, экспрессирующим систему ICAM, показаны ниже на схеме 12. В частности, 2,6-дихлор-4-триизопропилсиланилокси-бензойную кислоту 79 в апротонном растворителе, таком как толуол, обрабатывают хлорирующим реагентом тионилхлоридом в условиях кипячения с обратным холодильником. Затем после обработки ацилхлорид обрабатывают основанием, таким как диизопропилэтиламин, и метиловым эфиром (S)-3-(4-амино-фенил)-2-трет-бутоксикарбониламино-пропионовой кислоты 80, таким образом, образуя амин 81. Амино-защитную группу Boc удаляют в стандартных условиях, и полученный в результате первичный амин 83 подвергают сочетанию в стандартных условиях реакции образования амидной связи. Метиловый эфир соединения 84 описан в WO 01/58853; силильную защиту метилового эфира 84 выполняют с помощью стандартных условий, хорошо известных специалистам в данной области техники. После сочетания и удаления защиты амид 88 обрабатывают трет-бутиловым эфиром (3-бром-пропил)-карбаминовой кислоты. Защитную группу Boc удаляют в стандартных условиях с последующим омылением метилового эфира с образованием малой молекулы 22 для нацеленной доставки к ICAM-1.
Схема реакций 12 для следующих примеров: Лигандный реагент 4 LFA-1, Лигандный реагент 5 LFA-1, Лигандный реагент 6 LFA-1, Лигандный реагент 7 LFA-1

Подобным образом, получение других малых молекул, нацеливающие взаимодействие LFA-1/ICAM, обеспечивая посредством этого средства для нацеленной доставки к клеткам, экспрессирующим систему ICAM, показаны ниже на схеме 13. В частности, 3-гидроксиметилбензоат алкилируют трет-бутиловым эфиром (3-бром-пропил)-карбаминовой кислоты в основных условиях, например, в присутствии карбоната калия, в смеси растворителей, таких как ацетон и ДМФ, с получением в результате промежуточного соединения 91. Метиловый эфир соединения 91 омыляют, и полученную в результате карбоновую кислоту 92 подвергают сочетанию в стандартных условиях реакции образования амидной связи с промежуточным соединением 93 (Схема 11) с получением промежуточного соединения 94. Защитную группу Boc удаляют в стандартных условиях с последующим омылением метилового эфира с образованием ICAM-1-нацеливающей малой молекулы 96.
Схема реакций 13 для следующего примера: Лигандный реагент 8 LFA-1

Подобную последовательность реакций используют для образования соединения 102, как показано ниже на схеме 14, нацеливающего взаимодействие LFA-1/ICAM, обеспечивая посредством этого средства для нацеленной доставки к клеткам, экспрессирующим систему ICAM. Вместо 3-гидроксиметилбензоата в качестве исходного вещества используют исходное вещество 3,5-дигидроксиметилбензоат 97 в подобной последовательности с образованием промежуточного соединения 103, как также показано на схеме 14.
Схема реакций 14 для следующих примеров: Лигандный реагент 9 LFA-1, Лигандный реагент 10 LFA-1

ПОЛЕЗНОСТЬ
Соединения формулы I полезны при доставке конъюгированных группировок, таких как терапевтические средства, малые молекулы, пептиды, нуклеиновые кислоты, флуоресцентные группировки и полимеры, к клеткам-мишеням, экспрессирующим рецепторные комплексы интегрина LFA-1, для различных терапевтических и других применений. Соответственно, соединения формулы I можно применять для лечения различных заболеваний и состояний, обусловленных экспрессией или гиперэкспрессией LFA-1. Такие заболевания и состояния могут включать воспаление, рак и заболевания, связанные с метаболизмом.
В конкретных воплощениях настоящее изобретение включает способ лечения или предупреждения рака у млекопитающего (предпочтительно человека), нуждающегося в таком лечении, включающий введение терапевтически эффективного количества соединения формулы I. В следующем воплощении изобретения предложено применение соединения формулы I для лечения или профилактики воспаления, рака или метаболического заболевания или состояния. В следующем воплощении изобретения предложено применение соединения формулы I для получения лекарственного средства для лечения или профилактики воспаления, рака или метаболического заболевания или состояния.
Такие композиции можно вводить в соответствии с надлежащей медицинской практикой. Факторы, которые следует учитывать в данном контексте, включают конкретное расстройство, подлежащее лечению, конкретное млекопитающее, подлежащее лечению, клиническое состояние индивидуального пациента, причину расстройства, сайт доставки агента, способ введения, режим введения и другие факторы, известные практикующим врачам. "Эффективное количество" соединения, которое нужно вводить, определяется такими соображениями, как минимальное количество, необходимое для лечения или предупреждения заболевания или состояния (например, ингибирования экспрессии белка-мишени) и избегание нежелательной токсичности. Например, такое количество может быть ниже количества, токсичного для нормальных клеток или для млекопитающего в целом. Композиции, содержащие соединение формулы I по изобретению, можно вводить парентеральным, интраперитонеальным и внутрилегочным путем введения. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, интраперитонеальное или подкожное введение.
ПРИМЕРЫ
Изобретение будет понято более полно путем ссылки на приведенные ниже примеры. Тем не менее, их не следует истолковывать как ограничивающие объем изобретения.
Реагенты были приобретены у фирм Aldrich, Sigma и Pierce Bioscience или других поставщиков, как указано ниже, и использованы без дополнительной очистки. Очистку в масштабе от мультимиллиграммовых до мультиграммовых количеств проводили способами, известными специалистам в данной области техники, такими как элюирование с флэш-колонки силикагеля. Препаративные очистки на флэш-колонке в некоторых случаях также выполняли путем использования одноразовых предварительно упакованных миллиграммовых колонок силикагеля (RediSep), элюируя системой CombiFlash. Biotage™ и ISCO™ также представляют собой флэш-колоночные устройства, которые можно использовать в данном изобретении для очистки промежуточных соединений.
В целях оценки идентичности и чистоты соединения снимали спектры ЖХ/МС (жидкостной хроматографии/масс-спектроскопии), используя описанную ниже систему. Для измерения масс-спектров система состоит из спектрометра Micromass Platform II: ионизация электрораспылением (ЭР) в положительном режиме (диапазон масс: 150-1200 атомных единиц массы (а.е.м.)). Одновременное хроматографическое разделение было достигнуто с помощью следующей системы высокоэффективной жидкостной хроматографии (ВЭЖХ): колоночный картридж ES Industries Chromegabond WR С-18 3u 120Å (3,2×30 мм); подвижная фаза А: вода (0,02% ТФУ) и фаза В: ацетонитрил (0,02% ТФУ); градиент от 10% В до 90% В за 3 минуты; время уравновешивания 1 минута; скорость тока 2 мл/минута. В некоторых случаях использовали ацетат аммония при 20-миллимолярной концентрации в качестве модификатора для эффективной ионизации в процессе препаративной ВЭЖХ. В таких случаях выделяли соль аммония.
Для некоторых разделений может быть также полезно использование сверхкритической жидкостной хроматографией. Разделения с помощью сверхкритической жидкостной хроматографии выполняли, используя систему Mettler-Toledo Minigram при следующих типичных условиях: 100 бар, 30°С, элюирование при 2,0 мл/мин, колонка 12 мм AD с 40% МеОН в сверхкритическом жидком CO2. В случае аналитов с основными аминогруппами к метанольному модификатору добавляли 0,2% изопропиламин.
Соединения были охарактеризованы с помощью 1H-ЯМР, используя ЯМР спектрометр Varian Inova 400 МГц или ЯМР спектрометр Varian Mercury 300 МГц, а также с помощью масс-спектрометрии высокого разрешения, используя масс-спектрометр высокого разрешения Bruker Apex-ll 4.7Т FT. Конечные соединения были также охарактеризованы с помощью масс-спектрометрии высокого разрешения, используя масс-спектрометр LTQ CL Orbitrap, продаваемый фирмой Thermo Electron.


Синтез низкомолекулярных антагонистов LFA-1 и/или двойных антагонистов LFA-1/МАС-1
Антагонисты к рецептору ICAM-1 для применения в качестве нацеливающих агентов
ЧАСТЬ 1: ПРЕДПОЧТИТЕЛЬНЫЕ ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЯ
Получение 3-(3-метокси-фенил)-пропионамида

Раствор 3-(3-метокси-фенил)-пропионовой кислоты (15 г, 83,2 ммоль) и 4-метил-морфолина (10,1 мл, 91,56 ммоль) в ТГФ (150 мл) охлаждали до 0°С (баня лед-вода) и добавляли изопропилхлорформиат (1 M в толуоле, 91,6 мл, 91,56 ммоль) в течение 20 минут. Смесь перемешивали еще в течение 30 минут при 0°С с последующим добавлением по каплям 7 н. NH3/МеОН (24 мл, 168 ммоль). Смеси давали подогреться до комнатной температуры и перемешивали в течение 2 ч. Смесь гасили 10% водным K2CO3 и экстрагировали EtOAc. Органические экстракты объединяли, промывали водой и соляным раствором, высушивали над сульфатом натрия, фильтровали и выпаривали с получением желаемого амида (11,15 г, 75% выход). МС m/е 179,9 (М+Н+).
Получение 3-(3-метокси-фенил)-пропиламина
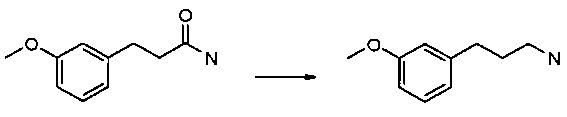
BH3 в ТГФ (2,2 г, 188 ммоль) добавляли при комнатной температуре к раствору 3-(3-метокси-фенил)-пропионамида (11,15 г, 62,26 ммоль) в ТГФ (100 мл). Раствор нагревали до образования флегмы в течение 4 ч, охлаждали до комнатной температуры и гасили МеОН (50 мл). Раствор нагревали до образования флегмы в течение 30 мин, концентрировали, обрабатывали водой и экстрагировали EtOAc. Экстракт промывали 10% водным K2CO3, водой и соляным раствором, высушивали над Na2SO4, фильтровали и выпаривали с получением соединения, указанного в заголовке (9,26 г, 90% выход). МС m/е 165,9 (М+Н)+.
Получение 4,6-диметил-2-гидрокси-1,6-дигидро-пиримидин-5-карбоновой кислоты этилового эфира

Смесь 3-оксобутановой кислоты этилового эфира (16,27 г, 125 ммоль), ацетальдегида (5,51 г, 125 ммоль), мочевины (7,51 г, 125 ммоль) и ледяной уксусной кислоты (20 капель) в этаноле (35 мл) нагревали до 90°С в течение ночи в колбе на 350 мл под давлением. Смесь разбавляли водой. Осадок собирали фильтрованием, промывали водой и высушивали на воздухе с получением желаемого продукта (17,68 г, 71% выход). МС m/е 198,8 (М+Н+).
Получение 4,6-диметил-2-гидрокси-пиримидин-5-карбоновой кислоты этилового эфира

4,6-Диметил-2-гидрокси-1,6-дигидро-пиримидин-5-карбоновой кислоты этиловый эфир (34,63 г, 174,7 ммоль) добавляли порциями к охлажденному во льду раствору 50% азотной кислоты (120 мл) в течение 5 минут. Раствор перемешивали при 0°C в течение 10 минут, наливали в ледяную воду (500 мл), нейтрализовали твердым K2CO3 и экстрагировали хлороформом. Объединенные органические слои промывали водой и соляным раствором, высушивали над Na2SO4, фильтровали и концентрировали с получением соединения, указанного в заголовке (21,9 г, 71% выход). МС m/е 197,1 (М+Н+).
Получение 2-хлор-4,6-диметил-пиримидин-5-карбоновой кислоты этилового эфира

К раствору POCl3 (106 мл) и DIEA (65 мл) добавляли 4,6-диметил-2-гидрокси-пиримидин-5-карбоновой кислоты этиловый эфир (21,9 мг, 111,6 ммоль). Смесь нагревали до 110°С в течение 2 ч. Избыток POCl3 и DIEA удаляли выпариванием при пониженном давлении. Остаток растворяли в EtOAc (1,2 л) и обрабатывали обесцвечивающим углеродом. После фильтрования раствор промывали 1 н. NaOH, водой и соляным раствором. Органический слой высушивали над Na2SO4, фильтровали и концентрировали. Неочищенный остаток очищали флэш-хроматографией с градиентом 0-30% EtOAc в гексане с получением желаемого продукта (9,33 г, 39% выход).
Получение 2-[3-(3-метокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбоновой кислоты этилового эфира

Смесь 3-(3-метокси-фенил)-пропиламина (2,31 г, 13,98 ммоль), 2-хлор-4,6-диметил-пиримидин-5-карбоновой кислоты этилового эфира (2 г, 9,32 ммоль) в EtOH (12 мл) подвергали микроволновой реакции при 160°С в течение 1,5 ч. Реакционную смесь охлаждали до комнатной температуры, гасили 10% K2CO3 и экстрагировали EtOAc. Органический слой промывали соляным раствором, высушивали над Na2SO4, фильтровали и концентрировали. Остаток очищали флэш-хроматографией с 30% EtOAc в гексане с получением желаемого продукта (2,42 г, 76% выход). МС m/е 344,1 (М+Н+).
Получение 2-[3-(3-гидрокси-фенил)-пропиламино)-4,-диметил-пиримидин-5-карбоновой кислоты этилового эфира
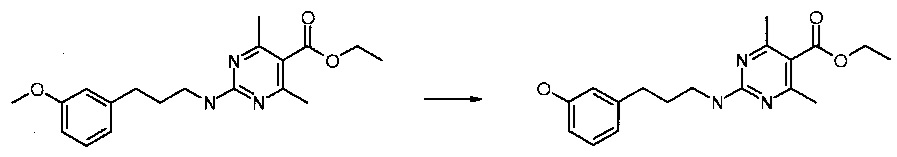
Раствор 2-[3-(3-метокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбоновой кислоты этилового эфира (2,42 г, 7,05 ммоль) в ДХМ (50 мл) охлаждали в бане лед-вода и добавляли по каплям BBr3/ДХМ (1 М, 14,1 мл, 14,1 ммоль). Полученному в результате раствору давали подогреться до комнатной температуры и перемешивали при комнатной температуре в течение 2 ч. Раствор гасили ледяной водой и экстрагировали ДХМ. Органические слои объединяли, промывали водой и соляным раствором, высушивали над MgSO4, фильтровали и концентрировали с получением желаемого продукта (2 г, 86% выход). МС m/е 330,1 (М+Н+).
Получение (S)-3-трет-бутоксикарбониламино-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил)-амино)-пропионовой кислоты метиловый эфир

Раствор 2-[3-(3-гидрокси-фенил)-пропиламино]-4,5-диметил-пиримидин-5-карбоновой кислоты этилового эфира (2,0 г, 6,0 ммоль) в диоксане (30 мл) обрабатывали раствором моногидрата гидроксида лития (6,3 г, 150 ммоль) в воде (30 мл). Смесь перемешивали при 90°С в течение 12 ч, затем охлаждали до комнатной температуры и гасили водным раствором гидросульфата калия для доведения pH примерно до 2-4. Полученный в результате раствор экстрагировали EtOAc. Органические экстракты объединяли, промывали соляным раствором, высушивали над сульфатом натрия, фильтровали и концентрировали с получением кислоты (1,76 г), которую не очищали, а непосредственно подвергали следующей стадии. К раствору 2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбоновой кислоты (1,76 г, 5,84 ммоль) в безводном ДМФ (60 мл) добавляли Et3N (2,5 мл, 7,0 ммоль), HBTU (2,66 г, 7,01 ммоль), НОВТ (0,95 г, 7,01 ммоль) и H-DAP(Boc)OMe гидрохлорид (1,79 г, 7,01 ммоль). Смесь перемешивали при комнатной температуре в течение 3 ч, разбавляли соляным раствором (200 мл) и экстрагировали этилацетатом. Объединенные органические слои промывали смесью 1:1 насыщенный раствор бикарбоната натрия/соляной раствор и соляным раствором, затем высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали флэш-хроматографией с градиентом 40-100% EtOAc в гексане с получением соединения, указанного в заголовке (2,66 г, 91% выход). МС m/е 501,9 (М+Н+).
Получение (S)-3-амино-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил)-амино)-пропионовой кислоты метилового эфира гидрохлорида

К раствору (S)-3-трет-бутоксикарбониламино-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}-амино)-пропионовой кислоты метилового эфира (2,66 г, 5,30 ммоль) в МеОН (10 мл) добавляли 4,0 M HCl в диоксане (20 мл). Через час смесь концентрировали и азеотропно перегоняли с МеОН. Продукт растирали с эфиром, фильтровали и промывали эфиром с получением соединения, указанного в заголовке (2,16 г, 93% выход). МС m/е 401,9 (М+Н+).
Получение (S)-3-амино-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}-амино)-пропионовой кислоты гидрохлорида; лиганд 1 LFA-1

S)-3-Амино-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}-амино)-пропионовой кислоты метилового эфира гидрохлорид (50 мг, 0,114 ммоль) добавляли к водному раствору LiOH (13 мг, 0,57 ммоль в 2 мл воды) и полученную в результате суспензию перемешивали при комнатной температуре в течение ночи. Затем реакционную смесь нейтрализовали 1 н. соляной кислотой и лиофилизировали. Это вещество использовали без какой-либо дополнительной очистки для следующей стадии.
Получение 3-(3-трет-бутоксикарбониламино-пропокси)-бензойной кислоты метилового эфира

3-Гидроксиметилбензоат (500 мг, 3,29 ммоль), (3-бром-пропил)-карбаминовой кислоты трет-бутиловый эфир (861 мг, 1,1 экв.) и карбонат калия (2,3 г, 5 экв.) объединяли в смеси ацетона (10 мл) и ДМФ (10 мл). Реакционную смесь перемешивали при 75°С в течение ночи. Нерастворимое вещество фильтровали и отбрасывали, и фильтрат концентрировали при пониженном давлении, разбавляли этилацетатом и промывали водой и соляным раствором с последующим высушиванием над безводным сульфатом натрия. В результате флэш-хроматографии на силикагеле, используя этилацетат и гексаны, получили 900 мг соединения, указанного в заголовке. ВРМС m/е 332,1466 (M+Na)+
Получение 3-(3-трет-бутоксикарбониламино-пропокси)-бензойной кислоты

К раствору 3-(3-трет-бутоксикарбониламино-пропокси)-бензойной кислоты метилового эфира (900 мг) в метаноле (3 мл) добавляли раствор LiOH (334 мг, 5 экв.) в воде (3 мл), и полученную в результате реакционную смесь перемешивали при 45°С в течение ночи. Затем реакционную смесь подкисляли 1 н. HCl до pH 3 и сразу экстрагировали этилацетатом. Органическую фазу промывали соляным раствором и высушивали над безводным сульфатом натрия. Затем ее концентрировали при пониженном давлении и кристаллизовали из этилацетата с получением 600 мг соединения, указанного в заголовке. ВРМС m/е 318,1311 (M+Na)+
Получение (S)-3-[3-(3-трет-бутоксикарбониламино-пропокси)-бензоиламино]-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}-амино)-пропионовой кислоты метилового эфира

К раствору 3-(3-трет-бутоксикарбониламино-пропокси)-бензойной кислоты (57 мг, 0,193 ммоль) в ДМФ (1 мл) добавляли HBTU (78 мг, 1,05 экв.), DIEA (172 мкл, 5 экв.) и (S)-3-амино-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}-амино)-пропионовой кислоты метилового эфира гидрохлорид (100 мг, 0,194 ммоль). Полученную в результате реакционную смесь перемешивали при комнатной температуре в течение 4 ч. Затем ее разбавляли этилацетатом, промывали водой и соляным раствором и высушивали над безводным сульфатом натрия. В результате флэш-хроматографии на силикагеле, используя метанол/метиленхлорид, получили 97 мг соединения, указанного в заголовке. ВРМС m/е 679,3447 (М+Н)+.
Получение (S)-3-[3-(3-амино-пропокси)-бензоиламино]-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил)-амино)-пропионовой кислоты метилового эфира гидрохлорида

Триметилсилилхлорид (177 мкл) добавляли к метанолу (2 мл), и полученную в результате смесь перемешивали при комнатной температуре в течение 5 мин. Затем ее добавляли к (S)-3-[3-(3-трет-бутоксикарбониламино-пропокси)-бензоиламино]-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}-амино)-пропионовой кислоты метиловому эфиру (94,6 мг, 0,139 ммоль), и полученную в результате реакционную смесь перемешивали при комнатной температуре в течение выходных дней. Затем ее концентрировали при пониженном давлении и растирали с диэтиловым эфиром с получением 84,8 мг соединения, указанного в заголовке. ВРМС m/е 579,2925 (М+Н)+.
Получение (S)-3-[3-(3-амино-пропокси)-бензоиламино]-2-((2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил)-амино)-пропионовой кислоты; Лиганд 2 LAF-1

(S)-3-[3-(3-Амино-пропокси)-бензоиламино]-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}-амино)-пропионовой кислоты метилового эфира гидрохлорид (82,6 мг, 0,134 ммоль) растворяли в метаноле (1 мл) и 2 M NaOH (336 мкл, 5 экв.) и полученную в результате реакционную смесь перемешивали при комнатной температуре в течение ночи. Затем ее нейтрализовали 1 н. HCl, лиофилизировали и использовали для следующей стадии без дополнительной очистки. МС m/е 565,5 (М+Н)+.
Получение 3-(3-трет-бутоксикарбониламино-пропокси)-5-гидрокси-бензойной кислоты метилового эфира

3,5-Дигидроксиметилбензоат (1,8 г, 10,7 ммоль), (3-бром-пропил)-карбаминовой кислоты трет-бутиловый эфир (1,3 г, 5,46 ммоль) и карбонат калия (1,5 г, 10,8 ммоль) объединяли в смеси ацетона (50 мл) и ДМФ (50 мл). Реакционную смесь перемешивали при 75°С в течение ночи. Неочищенную реакционную смесь концентрировали при пониженном давлении, разбавляли этилацетатом и промывали водой и соляным раствором с последующим высушиванием над безводным сульфатом натрия. В результате флэш-хроматографии на силикагеле, используя этилацетат и гексаны, получили 462 мг соединения, указанного в заголовке. ВРМС m/е 348,1417 (M+Na)+.
Получение 3-(3-трет-бутоксикарбониламино-пропокси)-5-гидрокси-бензойной кислоты

К раствору 3-(3-трет-бутоксикарбониламино-пропокси)-5-гидрокси-бензойной кислоты метилового эфира (1,2 г, 3,69 ммоль) в 2 M NaOH (9,2 мл, 5 экв.) добавляли воду (20 мл) и полученную в результате реакционную смесь перемешивали при комнатной температуре в течение ночи. Затем реакционную смесь нейтрализовали 1 н. HCl и сразу экстрагировали этилацетатом. Органическую фазу промывали соляным раствором и высушивали над безводным сульфатом натрия. Затем ее концентрировали при пониженном давлении с получением 1,0 г соединения, указанного в заголовке. МС m/е 211,8 (М+Н-Вос)+.
Получение 3-(3-трет-бутоксикарбониламино-пропокси)-5-гидрокси-бензойной кислоты 2,5-диоксо-пирролидин-1-илового эфира

К охлажденному раствору 3-(3-трет-бутоксикарбониламино-пропокси)-5-гидрокси-бензойной кислоты (500 мг, 1,606 ммоль) и N-гидроксисукцинимида (185 мг, 1 экв.) в ТГФ (20 мл) добавляли DCC (332 мг, 1 экв.). Охлаждающую баню удаляли через 1 ч. Нерастворимое вещество фильтровали и отбрасывали. Фильтрат концентрировали при пониженном давлении и неочищенное вещество очищали флэш-хроматографией на силикагеле, используя этилацетат и гексаны, с получением 602 мг соединения, указанного в заголовке. ВРМС m/е 431,1426 (M+Na)+.
Получение (S)-3-[3-(3-трет-бутоксикарбониламино-пропокси)-5-гидрокси-бензоиламино]-2-((2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил)-амино)-пропионовой кислоты метилового эфира
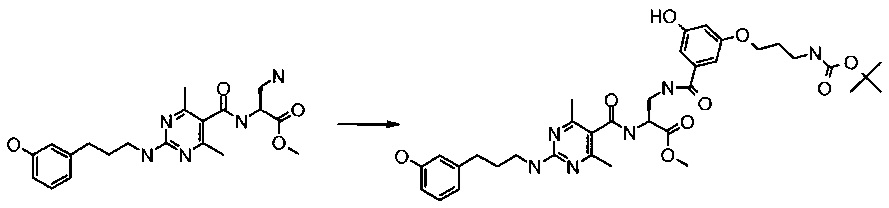
К раствору (S)-3-амино-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}-амино)-пропионовой кислоты метилового эфира гидрохлорида (476,4 мг, 0,924 ммоль) в ДМФ (5 мл) добавляли DIEA (321 мкл, 3 экв.) и 3-(3-трет-бутоксикарбониламино-пропокси)-5-гидрокси-бензойной кислоты 2,5-диоксо-пирролидин-1-иловый эфир (377 мг, 1 экв.). Полученную в результате реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Затем ее разбавляли этилацетатом и промывали водой и соляным раствором и высушивали над безводным сульфатом натрия. Неочищенное вещество очищали флэш-хроматографией на силикагеле, используя метанол/метиленхлорид, с получением 301 мг соединения, указанного в заголовке. ВРМС m/е 695,3395 (М+Н)+.
Получение (S)-3-[3-(3-амино-пропокси)-5-гидрокси-бензоиламино]-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил)-амино)-пропионовой кислоты метилового эфира гидрохлорида

Триметилсилилхлорид (548 мкл) добавляли к метанолу (5 мл), и полученный в результате раствор перемешивали при комнатной температуре в течение 1 мин. Затем добавляли (S)-3-[3-(3-трет-бутоксикарбониламино-пропокси)-5-гидрокси-бензоиламино]-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}-амино)-пропионовой кислоты метиловый эфир (299,6 мг, 0,431 ммоль), и перемешивание при комнатной температуре продолжали в течение ночи. Метанол удаляли при пониженном давлении, и остаток растирали с диэтиловым эфиром с получением 272 мг соединения, указанного в заголовке. ВРМС m/е 595,2875 (М+Н)+.
Получение (S)-3-[3-(3-амино-пропокси)-5-гидрокси-бензоиламино]-2-((2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил)-амино)-пропионовой кислоты; Лиганд 3 LFA-1

(S)-3-[3-(3-амино-пропокси)-5-гидрокси-бензоиламино]-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}-амино)-пропионовой кислоты метилового эфира гидрохлорид (100 мг, 0,158 ммоль) растворяли в смеси воды (1 мл) и метанола (1 мл), а затем добавляли 2 н. NaOH (400 мкл, 5 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Затем ее нейтрализовали 1 н. HCl, лиофилизировали и использовали для следующей стадии без дополнительной очистки. МС m/е 581,1 (М+Н)+.
Получение (S)-2-трет-бутоксикарбониламино-3-[4-(2,6-дихлор-4-триизопропилсиланилокси-бензоиламино)-фенил]-пропионовой кислоты метилового эфира

К раствору 2,6-дихлор-4-триизопропилсиланилокси-бензойной кислоты (50 мг, 0,138 ммоль) в толуоле (2 мл) добавляли тионилхлорид (50 мкл, 0,69 ммоль). Полученный в результате раствор кипятили с обратным холодильником в течение 2 ч. Затем тионилхлорид и толуол удаляли при пониженном давлении. Маслянистый остаток снова растворяли в метиленхлориде (3 мл) и охлаждали до 0°С. Затем добавляли DIEA (72 мкл, 0,414 ммоль) и (S)-3-(4-амино-фенил)-2-трет-бутоксикарбониламино-пропионовой кислоты метиловый эфир (43 мг, 0,145 ммоль) и полученную в результате реакционную смесь перемешивали при комнатной температуре в течение выходных дней. Неочищенное вещество очищали флэш-хроматографией на силикагеле, используя этилацетат и гексаны, с получением 87 мг соединения, указанного в заголовке. ВРМС m/е 661,2237 (M+Na)+.
Получение (S)-2-трет-бутоксикарбониламино-3-[4-(2,6-дихлор-4-гидрокси-бензоиламино)-фенил]-пропионовой кислоты метилового эфира

К раствору (S)-2-трет-бутоксикарбониламино-3-[4-(2,6-дихлор-4-триизопропилсиланилокси-бензоиламино)-фенил]-пропионовой кислоты метилового эфира (84,7 мг, 0,132 ммоль) в ТГФ (1 мл) добавляли TBAF (199 мкл 1 M раствора в ТГФ) и полученную в результате смесь перемешивали при комнатной температуре в течение ночи. Растворитель удаляли при пониженном давлении, и остаток после повторного растворения в этилацетате промывали водой и соляным раствором, а затем высушивали над безводным сульфатом натрия. Неочищенное вещество очищали флэш-хроматографией на силикагеле, используя этилацетат и гексаны, с получением 50,3 мг соединения, указанного в заголовке. ВРМС m/е 505,0903 (M+Na)+.
Получение (S)-2-амино-3-[4-(2,6-дихлор-4-гидрокси-бензоиламино)-фенил]пропионовой кислоты метилового эфира гидрохлорида

К раствору TMSCI (1,4 мл, 11,3 ммоль) в МеОН (15 мл) добавляли (S)-2-трет-бутоксикарбониламино-3-[4-(2,6-дихлор-4-гидрокси-бензоиламино)-фенил]-пропионовой кислоты метиловый эфир (548 мг, 1,13 ммоль) и полученную в результате смесь перемешивали при комнатной температуре в течение ночи. Неочищенную смесь концентрировали при пониженном давлении, и остаток растирали с диэтиловым эфиром с получением 379 мг соединения, указанного в заголовке. ВРМС m/е 383,0561 (М+Н)+.
Получение N-[3-(трет-бутил-диметил-силанилокси)-бензил]-2-хлор-терефталевой кислоты метилового эфира

Получение 2-хлор-N-(3-гидрокси-бензил)-терефталевой кислоты метилового эфира раскрыто в патенте WO 01/58853. 2-Хлор-N-(3-гидрокси-бензил)-терефталевой кислоты метиловый эфир (4,0 г, 12,54 ммоль), TBDMSCI (2,3 г, 15,0 ммоль) и имидазол (1,9 г, 27,6 ммоль) растворяли в ДМФ (80 мл) и перемешивали при комнатной температуре в течение ночи. Затем реакционную смесь разбавляли этилацетатом, промывали водой и соляным раствором, а затем высушивали над безводным сульфатом натрия. Неочищенное вещество очищали флэш-хроматографией на силикагеле, используя этилацетат и гексаны, с получением 5,0 г соединения, указанного в заголовке. МС m/е 433,9 (М+Н)+.
Получение N-[3-(трет-бутил-диметил-силанилокси)-бензил]-2-хлор-терефталевой кислоты

К раствору N-[3-(трет-бутил-диметил-силанилокси)-бензил]-2-хлор-терефталевой кислоты метилового эфира (4,9 г, 11,29 ммоль) в 1,2-дихлорэтане (80 мл) добавляли гидроксид триметилолова (20,4 г, 112,9 ммоль) и полученную в результате реакционную смесь перемешивали при 80°С в течение 8 ч. Растворитель удаляли при пониженном давлении и остаток растворяли в этилацетате. Затем остаток промывали водным раствором KHSO4, высушивали над безводным сульфатом натрия и фильтровали через слой силикагеля. Фильтрат концентрировали при пониженном давлении с получением 4,0 г соединения, указанного в заголовке. ВРМС m/е 420,1393 (М+Н)+.
Получение (S)-2-{4-[3-(трет-бутил-диметил-силанилокси)-бензилкарбамоил]-2-хлор-бензоиламино)-3-[4-(2,6-дихлор-4-гидрокси-бензоиламино)-фенил]-пропионовой кислоты метилового эфира

К раствору N-[3-(трет-бутил-диметил-силанилокси)-бензил]-2-хлор-терефталевой кислоты (103 мг, 0,246 ммоль) в ДМФ (2 мл) добавляли HBTU (103 мг, 0,271 ммоль), DIEA (128 мкл, 0,738 ммоль) и соль гидрохлорид (S)-2-амино-3-[4-(2,6-дихлор-4-гидрокси-бензоиламино)-фенил]пропионовой кислоты метилового эфира (103 мг, 0,246 ммоль). Полученную в результате реакционную смесь перемешивали при комнатной температуре в течение выходных дней. Затем ее разбавляли этилацетатом, промывали водой и соляным раствором. Неочищенное вещество очищали флэш-хроматографией на силикагеле, используя метанол/метиленхлорид, с получением 100 мг соединения, указанного в заголовке. ВРМС m/е 784,1776 (М+Н)+.
Получение (S)-3-{4-[4-(3-трет-бутоксикарбониламино-пропокси)-2,6-дихлорбензоиламино]-фенил)-2-[2-хлор-4-(3-гидрокси-бензилкарбамоил)-бензоиламино]-пропионовой кислоты метилового эфира

К раствору (S)-2-{4-[3-(трет-бутил-диметил-силанилокси)-бензилкарбамоил]-2-хлор-бензоиламино}-3-[4-(2,6-дихлор-4-гидрокси-бензоиламино)-фенил]-пропионовой кислоты метилового эфира (91,5 мг, 0,116 ммоль) в смеси ацетона (1 мл) и ДМФ (1 мл) добавляли карбонат калия (48 мг, 3 экв.) и (3-бром-пропил)-карбаминовой кислоты трет-бутиловый эфир (33 мг, 1,2 экв.). Полученную в результате реакционную смесь перемешивали при 75°С в течение ночи. Затем ее разбавляли этилацетатом и промывали водой и соляным раствором и высушивали над безводным сульфатом натрия. Неочищенное вещество очищали флэш-хроматографией на силикагеле, используя метанол/метиленхлорид, с получением 76,5 мг соединения, указанного в заголовке. ВРМС m/е 827,2016 (М+Н)+.
Получение (S)-3-(4-[4-(3-амино-пропокси)-2,6-дихлор-бензоиламино1-фенил}-[2-хлор-4-(3-гидрокси-бензилкарбамоил)-бензоиламино]-пропионовой кислоты метилового эфира гидрохлорида
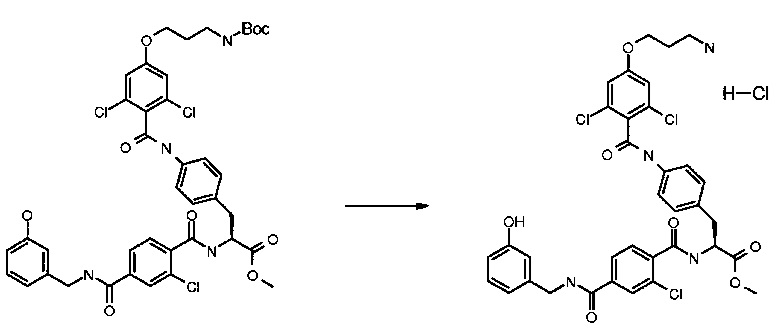
Триметилсилилхлорид (100 мкл, 10 экв.) добавляли к метанолу (2 мл). Через 5 мин полученный в результате раствор добавляли к (S)-3-{4-[4-(3-трет-бутоксикарбониламино-пропокси)-2,6-дихлорбензоиламино]-фенил}-2-[2-хлор-4-(3-гидрокси-бензилкарбамоил)-бензоиламино]-пропионовой кислоты метиловому эфиру (65,6 мг, 0,079 ммоль) и перемешивали при комнатной температуре в течение ночи. Неочищенную реакционную смесь концентрировали и растирали с диэтиловым эфиром с получением 60,4 мг соединения, указанного в заголовке. ВРМС m/е 727,1492 (М+Н)+.
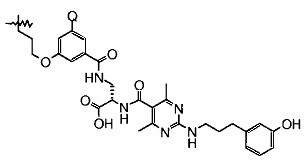
Получение (S)-3-(4-[4-(3-амино-пропокси)-2,6-дихлор-бензоиламино]-фенил)-2-[2-хлор-4-(3-гидрокси-бензилкарбамоил)-бензоиламино1-пропионовой кислоты; Лиганд 4 LFA-1

К раствору (S)-3-{4-[4-(3-амино-пропокси)-2,6-дихлор-бензоиламино]-фенил}-[2-хлор-4-(3-гидрокси-бензилкарбамоил)-бензоиламино]-пропионовой кислоты метилового эфира гидрохлорида (55 мг, 0,072 ммоль) в метаноле (1 мл) добавляли водный раствор 2 M NaOH (178 мкл, 5 экв.). Полученную в результате реакционную смесь перемешивали при комнатной температуре в течение ночи. Затем ее нейтрализовали 1 н. HCl, лиофилизировали и использовали для следующей стадии без дополнительной очистки. МС m/е 713,0 (М+Н)+.
Пример 1
Получение лигандного реагента 1 LFA-1

(S)-3-Амино-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}-амино)-пропионовой кислоты гидрохлорид (0,114 ммоль) растворяли в ацетонитриле (1 мл) и сложный эфир сукцинимидил-[(N-малеимидопропионамидо)-тетраэтиленгликоль] (58 мг, 0,114 ммоль) растворяли в 1 мл ДМСО и диизопропилэтиламине (40 мкл, 0,228 ммоль). Оба раствора объединяли и перемешивали при комнатной температуре в течение 30 мин. Необработанную реакционную смесь концентрировали при пониженном давлении и очищали сверхкритической жидкостной хроматографией (СЖХ) с получением 51 мг продукта, указанного в заголовке. ВРМС m/е 786,3665 (М+Н)+.
Пример 2
Получение лигандного реагента 2 LFA-1

Соединение, указанное в заголовке, было получено аналогично с (S)-3-амино-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}-амино)-пропионовой кислоты гидрохлоридом и сложным эфиром сукцинимидил-[(N-малеимидопропионамидо)-октаэтиленгликоль], как показано в Примере 1.
ВРМС m/е 984,4530 (M+Na)+
Пример 3
Получение лигандного реагента 3 LFA-1

Соединение, указанное в заголовке, было получено аналогично с (S)-3-амино-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}-амино)-пропионовой кислоты гидрохлоридом и сложным эфиром сукцинимидил-[(N-малеимидопропионамидо)-додекаэтиленгликоль], как показано в Примере 1.
ВРМС m/е 1138,5761 (М+Н)+
Пример 4
Получение лигандного реагента 4 LFA-1

К раствору (S)-3-{4-[4-(3-амино-пропокси)-2,6-дихлор-бензоиламино]-фенил}-2-[2-хлор-4-(3-гидрокси-бензилкарбамоил)-бензоиламино]-пропионовой кислоты (0,196 ммоль) в ДМСО (2 мл) добавляли DIEA (102 мкл, 3 экв.) и сложный эфир сукцинимидил-[(N-малеимидопропионамидо)-октаэтиленгликоль] (135 мг, 1 экв.). Полученную в результате смесь перемешивали при комнатной температуре в течение 1 ч. Неочищенное вещество очищали ВЭЖХ с получением 105 мг соединения, указанного в заголовке.
ВРМС m/е 1287,4077 (М+Н)+
Пример 5
Получение лигандного реагента 5 LFA-1
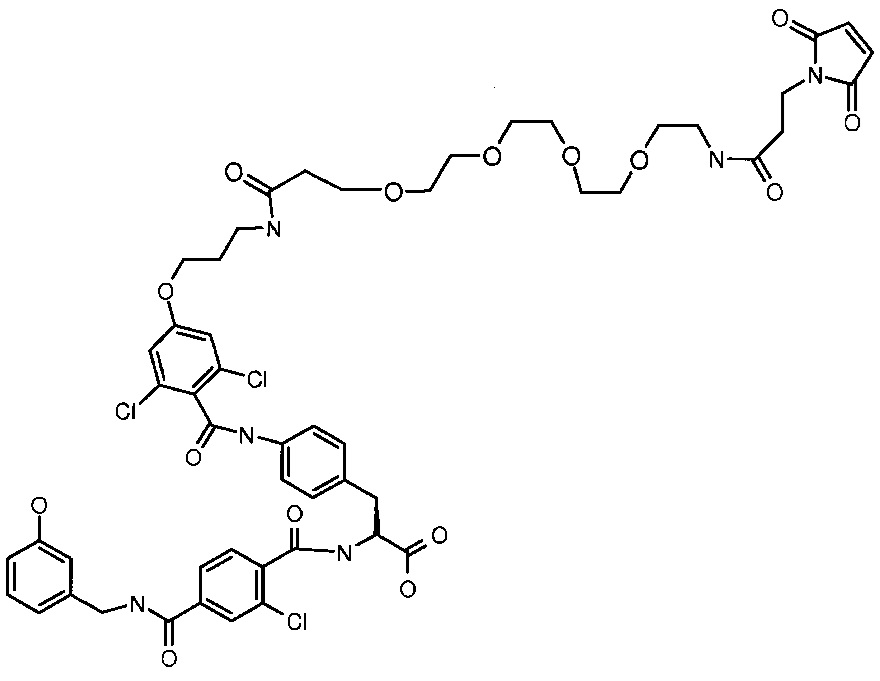
Соединение, указанное в заголовке, было получено аналогично с (S)-3-{4-[4-(3-амино-пропокси)-2,6-дихлор-бензоиламино]-фенил}-2-[2-хлор-4-(3-гидрокси-бензилкарбамоил)-бензоиламино]-пропионовой кислотой и сложным эфиром сукцинимидил-[(N-малеимидопропионамидо)-тетраэтиленгликоль], как показано в Примере 4.
ВРМС m/е 1111,3021 (М+Н)+
Пример 6
Получение лигандного реагента 6 LFA-1

Соединение, указанное в заголовке, было получено аналогично из (S)-3-{4-[4-(3-амино-пропокси)-2,6-дихлор-бензоиламино]-фенил}-2-[2-хлор-4-(3-гидрокси-бензилкарбамоил)-бензоиламино]-пропионовой кислоты и сложного эфира сукцинимидил-[(N-малеимидопропионамидо)-додекаэтиленгликоль], как показано в Примере 4.
ВРМС m/е 732,2595 (М+2Н)2+
Пример 7
Получение лигандного реагента 7 LFA-1

К раствору (S)-3-{4-[4-(3-амино-пропокси)-2,6-дихлор-бензоиламино]-фенил}-2-[2-хлор-4-(3-гидрокси-бензилкарбамоил)-бензоиламино]-пропионовой кислоты (0,131 ммоль) в ДМСО (2 мл) добавляли DIEA (46 мкл, 2 экв.) и 3-[2-(2-{2-[2-(2-{2-[2-(2-ацетилсульфанил-этокси)-этокси]-этокси}-этокси)-этокси]-этокси}-этокси)-этокси]-пропионовой кислоты 2,5-диоксо-пирролидин-1-иловый эфир (78 мг, 1 экв.). Полученную в результате смесь перемешивали при комнатной температуре в течение 1 ч. Неочищенное вещество очищали ВЭЖХ с получением 114 мг соединения, указанного в заголовке.
ВРМС m/е 1195,3511 (М+Н)+
Пример 8
Получение лигандного реагента 8 LFA-1

Соединение, указанное в заголовке, было получено аналогично с (S)-3-[3-(3-амино-пропокси)-бензоиламино]-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}-амино)-пропионовой кислотой и сложным эфиром сукцинимидил-[(N-малеимидопропионамидо)-октаэтиленгликоль], как показано в Примере 1.
ВРМС m/е 1139,5511 (М+Н)+
Пример 9
Получение лигандного реагента 9 LFA-1

Соединение, указанное в заголовке, было получено аналогично с (S)-3-[3-(3-амино-пропокси)-5-гидрокси-бензоиламино]-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}-амино)-пропионовой кислотой и сложным эфиром сукцинимидил-[(N-малеимидопропионамидо)-октаэтиленгликоль], как показано в Примере 1.
ВРМС m/е 1155,5448 (М+Н)+
Пример 10
Получение лигандного реагента 10 LFA-1
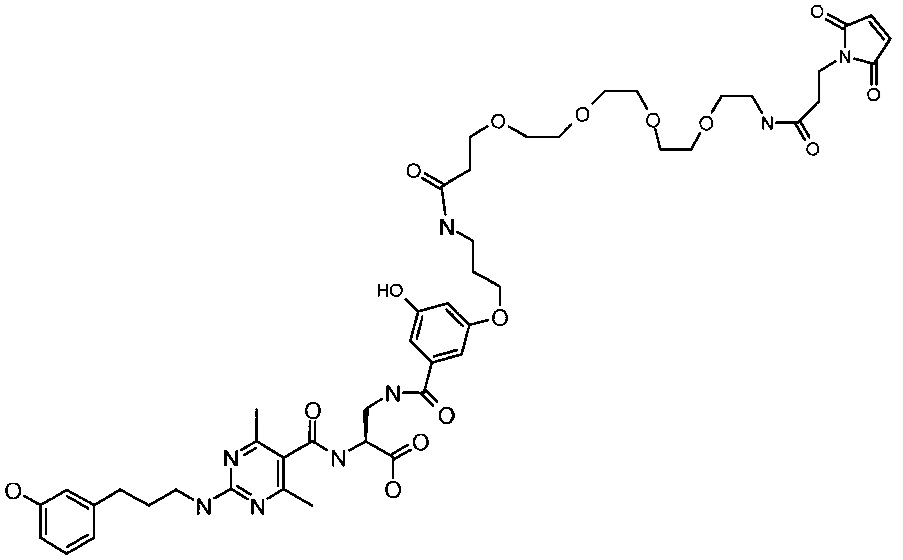
Соединение, указанное в заголовке, было получено аналогично с (S)-3-[3-(3-амино-пропокси)-5-гидрокси-бензоиламино]-2-({2-[3-(3-гидрокси-фенил)-пропиламино]-4,6-диметил-пиримидин-5-карбонил}-амино)-пропионовой кислотой и сложным эфиром сукцинимидил-[(N-малеимидопропионамидо)-тетраэтиленгликоль], как показано в Примере 1.
ВРМС m/е 979,4403 (М+Н)+
Получение реагентов для нацеленной доставки, меченых флуоресцеином (ФИТЦ) Реагенты для нацеленной доставки могут быть дериватизированы флуорофорами, которые могут быть полезны для исследования прослеживания их связывания с клетками, экспрессирующими рецепторы к малым молекулам для нацеленной доставки. Такие молекулы могут быть получены любым из двух способов или обоими способами. Во-первых, можно проводить взаимодействие целевых малеимидов с 2-[(5-флуоресцеил)аминокарбонил]этилмеркаптаном. Альтернативно можно проводить взаимодействие в одном сосуде лигандов для нацеленной доставки, представляющих собой низкомолекулярные антагонисты интегрина, с 2-[(5-флуоресцеил)аминокарбонил]этилмеркаптаном и бифункциональным реагентом ПЭГ, как показано на схемах 17 и 18.
Пример Способа а)
Получение (S)-N-[4-[3-[3-[2-[2-[2-[2-[2-[2-[2-[2-[2-[2-[2-[2-[3-(2,5-диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]этокси]этокси]этокси]этокси]этокси]этокси]этокси]этокси]этокси]этокси]этокси]этокси]-пропиониламино]пропокси]-фенил]-3-[2-[3-(гуанидино)-бензоиламино]-ацетиламино]-сукцинамовая кислота-ФИТЦ

К желтой суспензии (S)-N-[4-[3-[3-[2-[2-[2-[2-[2-[2-[2-[2-[2-[2-[2-[2-[3-(2,5-диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]этокси]этокси]этокси]этокси]этокси]этокси]этокси]этокси]этокси]этокси]этокси]этокси]-пропиониламино]пропокси]-фенил]-3-[2-[3-(гуанидино)-бензоиламино]-ацетиламино]-сукцинамовой кислоты (37,5 мг, 0,03 ммоль) и 2-[(5-флуоресцеил)аминокарбонил]этилмеркаптана (реагента ФИТЦ) (15,6 мг, 0,036 ммоль) в метаноле (5 мл) добавляли избыток DIPEA (38,7 мг, 52 мкл, 0,3 ммоль) при комнатной температуре в атмосфере азота. Полученную в результате светло-желтую суспензию перемешивали в течение 2 ч, и в это время анализ ЖХМС показал отсутствие исходного вещества. Затем избыток DIPEA удаляли в вакууме, и желаемый продукт выделяли очисткой с использованием ВЭЖХ с получением 25 мг (50% выход) производного (S)-N-[4-[3-[3-[2-[2-[2-[2-[2-[2-[2-[2-[2-[2-[2-[2-[3-(2,5-диоксо-2,5-дигидро-пиррол-1-ил)-пропиониламино]этокси]этокси]этокси]этокси]этокси]этокси]этокси]этокси]этокси]этокси]этокси]этокси]-пропиониламино]пропокси]-фенил]-3-[2-[3-(гуанидино)-бензоиламино]-ацетиламино]-сукцинамовой кислоты-ФИТЦ в виде коричневого твердого вещества.
ЭР(+)-ВРМС m/е вычислено для C80H104N10O28S (М+2Н)2+ 843,3444, наблюдали 843,3437.
Данные ЖХМС=М+Н, 1687,6
Пример способа b)

Стадия 1. Цистамина дигидрохлорид (68 мг, 0,301 ммоль) и DIEA (110 мкл, 2,1 экв.) растворяли в ДМФ (10 мл), после чего добавляли NHS-флуоресцеин, смесь 5- и 6-карбоксифлуоресцеина (300 мг, 0,634 ммоль) и полученную в результате реакционную смесь перемешивали в течение ночи при комнатной температуре. Затем ее разбавляли этилацетатом и промывали три раза водой и один раз соляным раствором. Экстракт высушивали над безводным сульфатом натрия, концентрировали при пониженном давлении, снова растворяли в небольшом количестве метанола и этилацетата, а затем растирали с диэтиловым эфиром с получением 140 мг аддукта флуоресцеин-цистамин в виде ярко-оранжевого твердого вещества.
Стадия 2. Аддукт флуоресцеин-цистамин (80 мг, 0,092 ммоль) растворяли в смеси 3:1 метанола и воды (4 мл) и добавляли ТСЕР гидрохлорид (80 мг, 3 экв.). Полученную в результате реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Продукт очищали ВЭЖХ с получением 78 мг продукта. ЖХМС (ИЭР) 435,0.
Получение конъюгатов малая молекула-ПЭГ, меченых флуоресцеином

Общий метод: К раствору лиганда (1 экв.) в ДМСО добавляли DIEA (2 экв.) и ММ(ПЭГ)4n (1 экв.). Полученную в результате реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Затем добавляли флуоресцеин с тиольной меткой (1 экв.), и реакционную смесь перемешивали дополнительно в течение 10 мин. Продукт очищали ВЭЖХ.
Методы присоединения низкомолекулярных лигандов для нацеленной доставки к интегрину к 5ʹ-тиол-миРНК-олигонуклеотидам
Получение миРНК
Синтез олигонуклеотидов
Олигорибонуклеотиды синтезировали в соответствии с фосфорамидитной технологией на твердой фазе, используя синтезатор ABI 394 (Applied Biosystems) в 10-микромолярном масштабе.
Последовательности:
Смысловая (сенс) нить GGAuGAAGuGGAGAuuAGudTsdT (SEQ ID NO. 1)
Антисмысловая (антисенс) нить ACuAAUCUCcACUUcAUCCdTsdT (SEQ ID NO.2)
Соответствующие миРНК направлены против гена домашнего хозяйства АНА1. Синтезы проводили на твердом носителе, изготовленном из стекла с контролируемым размером пор (CPG; от англ. "controlled pore glass",


Отщепление и удаление защиты олигомера, связанного с носителем
После окончания твердофазного синтеза высушенный твердый носитель переносили в пробирку на 15 мл и обрабатывали метиламином в метаноле (2 М, Aldrich) в течение 180 мин при 45°С. После центрифугирования супернатант переносили в новую пробирку на 15 мл, и CPG промывали 1200 мкл N-метилпирролидин-2-она (NMP, Fluka, Buchs, Switzerland). Промывку объединяли с метанольным раствором метиламина и добавляли 450 мкл триэтиламина тригидрофторида (TEA-3HF, Alfa Aesar, Karlsruhe, Germany). Эту смесь доводили до 65°С в течение 150 мин. После охлаждения до комнатной температуры добавляли 0,75 мл NMP и 1,5 мл этокситриметилсилана (Fluka, Buchs, Switzerland). Через 10 мин осажденный олигорибонуклеотид собирали центрифугированием, супернатант отбрасывали, и твердое вещество восстанавливали 1 мл буфера А (см. ниже).
Очистка олигорибонуклеотидов
Неочищенные олигорибонуклеотиды очищали сильной ионообменной (СИХ) ВЭЖХ, используя препаративную колонку 22×250 мм DNA Рас 100 (Dionex, Idstein, Germany) на системе АКТА Explorer (GE Healthcare). Буфер А состоял из 10 мМ NaClO4, 1 мМ этилендиаминтетрауксусной кислоты (ЭДТА), 10 мМ Трис, pH 7,4, 6 M мочевины и 20% ацетонитрила. Буфер В содержал 500 мМ NaClO4 в буфере А. Использовали скорость тока 4,5 мл/мин. Регистрировали следы УФ при 260 и 280 нм. Использовали градиент от 20%В до 45%В в течение 55 мин. Подходящие фракции объединяли и осаждали 3 M NaOAc, pH=5,2 и 70% этанолом.
Неочищенные олигомеры, меченные Nu547, очищали ВЭЖХ с обращенной фазой (ОФ-ВЭЖХ), используя колонку XTerra Prep МС С8 10×50 мм (Waters, Eschborn, Germany) на системе АКТА Explorer (GE Helthcare). Буфер А представлял собой 100 мМ триэтиламмония ацетат (Biosolve, Valkenswaard, The Netherlands), и буфер В содержал 50% ацетонитрил в буфере А. Использовали скорость тока 5 мл/мин. Регистрировали следы УФ при 260, 280 и 547 нм (в случае олигорибонуклеотида, меченного Nu547). Использовали градиент от 5% В до 60% В в пределах 58 объемов колонки (CV). Подходящие фракции объединяли и осаждали 3 M NaOAc, pH=5,2 и 70% этанолом.
Наконец, очищенный олигомер обессоливали с помощью эксклюзионной хроматографии на колонке, содержащей сефадекс G-25 (GE Healthcare). Концентрацию раствора определяли путем измерения поглощения при 260 нм в УФ-фотометре (Beckman Coulter, Krefeld, Germany). До отжига отдельных нитей хранили в виде замороженных растворов при -20°С.
Получение конъюгатов низкомолекулярной РНК
Малые молекулы, к которым присоединена малеимидная функциональная группа, ковалентно конъюгировали с РНК посредством тиоэфирной связи. Для выполнения этой химической реакции примерно 60 мг РНК, содержащей 5ʹ-дисульфидный линкер, восстанавливали в воде (5 мл) до соответствующего тиола, используя 1 мл ТСЕР (0,5 M в воде, получен от фирмы Sigma Aldrich). Как только аналитическая ионообменная ВЭЖХ показала завершение реакции (примерно 2 ч при комнатной температуре) РНК осаждали 30 мл смеси этанол/3 M NaOAc (pH 5,4) 32:1 (об/об) в течение ночи при -20°С. Осадок собирали центрифугированием и использовали для последующего конъюгирования с малой молекулой.
В характерной реакции конъюгирования 10 мг РНК растворяли в 2 мл натрийфосфатного буфера (0,1 М, pH 7,0). К этому раствору добавляли малую молекулу (0,12 мМ) в ACN/NMP 1:1 (об/об) в течение периода 5 минут. Как только ОФ ЖХ-ИЭР МС показала израсходование введенной РНК, смесь разбавляли водой (примерно 10 мл) и добавляли примерно 40 мл смеси этанол/3 M NaOAc (pH 5,4) 32:1 (об/об) для осаждения конъюгированной РНК в течение ночи при -20°С. Осадок собирали центрифугированием, растворяли в воде и при необходимости очищали ионообменной ВЭЖХ, следуя приведенному выше методу. Если конъюгат был достаточно чистым, реакционную смесь фильтровали через эксклюзионную колонку (Sephadex G-25, GE Healthcare).
Отжиг олигорибонуклеотидов с получением миРНК
Комплементарные нити подвергали отжигу путем объединения эквимолярных растворов. Смесь лиофилизировали и восстанавливали подходящим объемом буфера отжига (100 мМ NaCl, 20 мМ фосфат натрия, pH 6,8) до достижения желаемой концентрации. Этот раствор помещали в водяную баню при 95°С, которую охлаждали до кт в течение 3 ч. Таблица 3: информация о последовательности миРНК; строчные буквы: 2ʹ-ОМе нуклеотид; s: фосфоротиоатный линкер; dT: дезокситимидин; (C6SSC6): С-6 дисульфидный линкер; (Cy5): краситель цианин 5.
The following assay was conducted to assess effect of targeted molecules on the sLFA-1/ICAM-1 ELISA и Mac-1/ICAM-1 interactions.
Планшеты покрывали 50 мкл/лунка раствора 2,0 мкг/мл рецептора sLFA-1 или Мас-1 в буфере, содержащем двухвалентный катион (1 мМ MnCl2, 0,14 M NaCl, 20 мМ 4-(2-гидроксиэтил)-1-пиперазин этансульфоновая кислота (ГЭПЭС) pH 7,2) при 4°С в течение ночи. В каждую лунку добавляли двести пятьдесят микролитров блокирующего буфера (1% бычий сывороточный альбумин (БСА) в буфере, содержащем двухвалентный катион) на 1 час при 37°С. Планшеты промывали 3 раза отмывочным буфером (TBS/0,05% Твин-20/1 мМ MnCl2). Тестируемое соединение растворяли в ДМСО. Выполняли серию разведений 1:3 до достижения диапазона концентраций 0,45 нМ - 3 мкМ. В соответствующие лунки добавляли пятьдесят микролитров (0,5% БСА в буфере, содержащем двухвалентный катион)/1% ДМСО и 50 мкл тестируемых растворов и инкубировали в течение 1 часа. В соответствующие лунки добавляли пятьдесят мкл 5dICAM-Fc (27 нг/мл), и 50 мкл связывающего буфера добавляли в лунки неспецифического связывания, инкубировали в течение 2 часов и промывали. В каждую лунку добавляли сто мкл меченого антитела 1:4000 пероксидаза хрена (HRP)-коза против IgG человека, инкубировали в течение 1 часа и промывали. В каждую лунку добавляли сто мкл раствора 1:1 ТМВ и проявляли в течение 20 мин при комнатной температуре. Проявление цвета останавливали добавлением в каждую лунку 100 мкл H3PO4. Поглощение измеряли при 450 нм. Эти результаты представлены ниже в таблице 4 и 5.
Было определено, что контрольные соединения (142 и 143) имеют IC50 приблизительно 37 и 11 нМ соответственно. Рецепторы LFA-1 клеток были преимущественно связаны или ассоциированы с контрольным соединением.
Данные о проникновении в клетку и локализации производных малых молекул для антагонистов интегрина, ковалентно связанных с флуорофорами ФИТЦ и миРНК, для нацеленной доставки
Метод
Клетки AML MV4-11 в ростовой среде (RPMI 1640 с 10% фетальной бычьей сывороткой (ФБС)) инкубировали с Дуплексом-27 (500 нМ) в течение 1 часа при 37°С. Для определения связывания, не зависимого от VLA-4, соединение 140 (10 мкМ) инкубировали при одних условиях для блокирования связывания, зависимого от VLA-4. Затем после инкубации клетки дважды промывали D-ФСБ и фиксировали в 1% параформальдегиде в течение 10 минут. Захват миРНК анализировали с помощью визуализации проточной цитометрии, используя ImageStreamx (Aminis Corporation, Seattle). Результаты представлены в таблице А и на фиг.1-4.


Анализ миРНК с модифицированной 5ʹ-смысловой нитью для нокдауна мРНК АНА1 в клеточных системах

Обратная трансфекция: Клетки Н1299 трансфицировали указанной миРНК при конечной концентрации 50 нМ, используя реагент трансфекции DharmaFect-1 в количестве 0,15 мкл/лунка. Затем клетки высевали в 96-луночный планшет в количестве 5000 клеток/лунка и инкубировали при 37°С в течение 48 часов.
Эффективность нокдауна миРНК измеряли с помощью анализа с использованием разветвленных зондов ДНК, как описано поставщиком; результаты такого нокдауна представлены на фиг. 5. Относительную жизнеспособность клеток оценивали на основании абсолютной экспрессии GAPDH в одной и той же лунке (фиг. 6).
Если нет противоречащих указаний, все соединения в примерах были получены и охарактеризованы, как описано. Все патенты и публикации, цитируемые в настоящем описании, полностью включены в описание посредством ссылки.
Реферат
Изобретение относится к соединениям формулы I, где R1 выбирают из соединений (1), (2), (3), которые применяют для изготовления и доставки конъюгированных группировок, таких как малые молекулы, пептиды, нуклеиновые кислоты, флуоресцентные группировки и полимеры, сшитых с антагонистами интегрина LFA-1, для нацеленной доставки к клеткам, экспрессирующим LFA-1. 5 н. и 16 з.п. ф-лы, 6 ил., 1 табл., 10 пр.(1),(2)(3)
Формула
















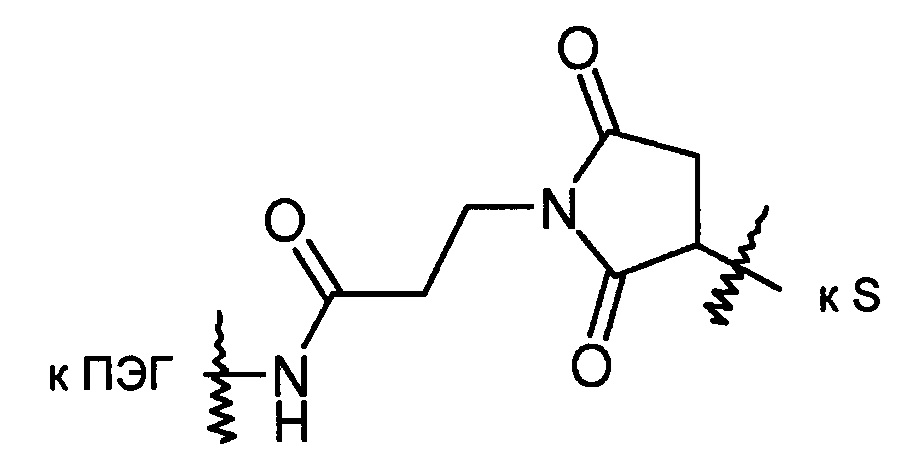
Документы, цитированные в отчёте о поиске
N-алканоилфенилаланиновые производные

Комментарии