Изомеры стевиол-гликозидов - RU2430102C1
Код документа: RU2430102C1
Чертежи




















Описание
Заявление об установлении приоритета.
Данная заявка устанавливает приоритет заявки на патент США, серийный №11/856274, зарегистрированной 17 сентября 2007 и озаглавленной "Изомеры стевиол-гликозидов" (№ Реестра патентных поверенных №056943.00381), полное раскрытие которой включено здесь посредством ссылки.
Область техники, к которой относится изобретение.
Данное изобретение относится к некоторым новым изомерам стевиол-гликозидов, пригодным для применения в качестве подсластителей, например, путем включения в пищевые и питьевые продукты.
Предшествующий уровень техники.
Из-за возрастающего внимания к отрицательному влиянию ожирения на здоровье в Соединенных Штатах и во всем мире увеличивается также рыночный спрос на пищевые и питьевые продукты с альтернативными питательными характеристиками, включая, например, сниженное или нулевое содержание калорий. Имеется рыночный спрос на замену высококалорийных подсластителей, обычно применяемых в пищевых и питьевых продуктах, таких как сахароза и кукурузный сироп с высоким содержанием фруктозы (КСВСФ), подсластителями, не обладающими питательными качествами. Например, предложены напитки диетической колы, подслащенные сильными подсластителями, не обладающими питательными качествами, таким как стевиол-гликозиды (стевиозид, ребаудиозид А и т.д.).
Стевиол-гликозиды являются соединениями, обладающими сладким вкусом, экстрагируемыми из растения стевии (Stevia rebaudiana Bertoni). Установлено, что обычно эти соединения включают стевиозид (4-13% от массы сухого вещества), стевиолбиозид (следовое количество), ребаудиозиды, включая ребаудиозид А (1-6%), ребаудиозид В (следовое количество), ребаудиозид С (1-2%), ребаудиозид D (следовое количество), и ребаудиозид Е (следовое количество), и дулькозид А (0,4-0,7%). Многие стевиол-гликозиды являются сильными подсластителями, не обладающими питательными качествами. Стевиол-гликозиды включают дитерпеновую сердцевину (формула I), замещенную в R1 и R2 различными комбинациями водорода, глюкозы, рамнозы и ксилозы.

Например, R1 может быть водородом, 1-β-D-глюкопиранозилом или 2-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, a R2 может быть водородом, 1-β-D-глюкопиранозилом, 2-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, 2,3-бис(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, 2-(1-α-L-рамнопиранозил)-1-(3-D-глюкопиранозилом, 2-(1-α-L-рамнопиранозил)-3-(1-(β-D-глюкопиранозил)-1-β-D-глюкопиранозилом или 2-(1-β-D-ксилопиранозил)-3-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом. Ребаудиозид А (в котором R1=1-β-D-глюкопиранозил, а R2=2,3-бис(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозил) примерно в 200-300 раз слаще сахарозы. Для пищевой промышленности представляют интерес стевиол-гликозиды в качестве альтернативных подсластителей. Однако прямая замена питательных подсластителей известными сильными подсластителями, не имеющими питательных качеств, создает проблемы посторонних привкусов, например, медленного развития, или горького, лакричного или затяжного послевкусия. Эти посторонние привкусы также возникают, когда стевиол-гликозиды применяют в пищевых и питьевых продуктах в качестве подсластителей, не имеющих питательных свойств. Таким образом, имеется потребность в дополнительных альтернативных подсластителях, не обладающих питательными качествами.
Таким образом, задачей по меньшей мере некоторых воплощений настоящего изобретения является обеспечение соединений, пригодных в качестве подсластителей. Задачей по меньшей мере некоторых воплощений изобретения является обеспечение питьевых или пищевых продуктов с альтернативными питательными характеристиками и вкусовыми свойствами. Имеются и другие задачи, черты и преимущества изобретения или конкретных воплощений изобретения, которые будут понятны для специалистов в данной области техники из следующего раскрытия и описания примерных воплощений.
Краткое изложение сущности изобретения.
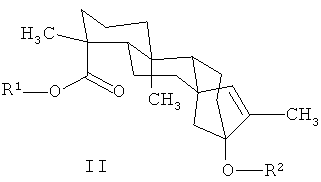
Раскрывается семейство новых изомеров стевиол-гликозидов. В этих изомерах экзо-циклическая двойная связь формулы I перемещена в эндо-циклическое положение внутри пятичленного кольца (см. формулу II). Эти соединения пригодны в качестве подсластителей, и могут быть включены как таковые в пищевые и питьевые продукты. В соответствии с первым аспектом изобретения обеспечивается соединение, имеющее формулу II
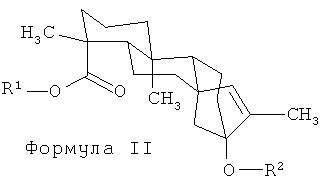
При этом R1 может быть водородом, 1-β-D-глюкопиранозилом или 2-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, a R2 может быть водородом, 1-β-D-глюкопиранозилом, 2-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, 2,3-бис(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, 2-(1-α-L-рамнопиранозил)-1-β-D-глюкопиранозилом, 2-(1-α-L-рамнопиранозил)-3-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом или 2-(1-β-D-ксилопиранозил)-3-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом. В некоторых примерных воплощениях соединение формулы II может быть выделено и очищено. Как применяется здесь, «выделено и очищено» означает, что чистота изомера стевиол-гликозида составляет по меньшей мере 90%.
В соответствии с другими аспектами обеспечивается питьевой продукт, включающий водосодержащую жидкость и соединение формулы II.
В соответствии с другими аспектами обеспечивается пищевой продукт, включающий пищевой компонент и соединение формулы II.
В соответствии с другим аспектом изобретения обеспечивается подсластитель, включающий соединение формулы П.
В соответствии с другим аспектом обеспечивается способ для приготовления соединений формулы II, включающий этапы обеспечения кислого водного раствора, включающего соединение формулы I, и нагревания кислого водного раствора до температуры в диапазоне от 30 до 90°C в течение периода времени более двух суток. В некоторых примерных воплощениях кислые водные растворы, включающие ребаудиозид А, нагревают до температуры в диапазоне от 40 до 50°C при pH в диапазоне 1,0-4,0 в течение периода времени более двух суток.
Краткое описание чертежей.
Фиг.1 является протонным ЯМР спектром ребаудиозида А.
Фиг.2 является протонным ЯМР спектром изо-ребаудиозида А.
Фиг.3 является наложением спектров из фиг.1 и 2.
Фиг.4 является ЭРИ масс-спектром ребаудиозида А.
Фиг.5 является ЭРИ масс-спектром изо-ребаудиозида А.
Фиг.6 является ВЭЖХ хроматограммой 10-недельной реакционной смеси, содержащей ребаудиозид А и изо-ребаудиозид А.
Фиг.7 является ЭРИ масс-спектром пика изо-ребаудиозида А из Фиг.6.
Фиг.8 является ВЭЖХ хроматограммой ребаудиозида А.
Фиг.9 является ВЭЖХ хроматограммой изо-ребаудиозида А.
Фиг.10 является ЭРИ масс-спектром пика ребаудиозида А из Фиг.8.
Фиг.11 является ЭРИ масс-спектром пика изо-ребаудиозда из Фиг.9.
Фиг.12 является ВЭЖХ хроматограммой 10-недельной реакционной смеси, обогащенной выделенным изо-ребаудиозидом А.
Фиг.13 является ЭРИ масс-спектром пика изо-ребаудиозида из Фиг.12.
Фиг.14 является изображением рентгеновской структуры кристаллов изо-ребаудиозида А.
Фиг.15 является изображением рентгеновской структуры кристаллов ребаудиозида А.
Фиг.16 является сравнением структур ребаудиозида А и изо-ребаудиозида А.
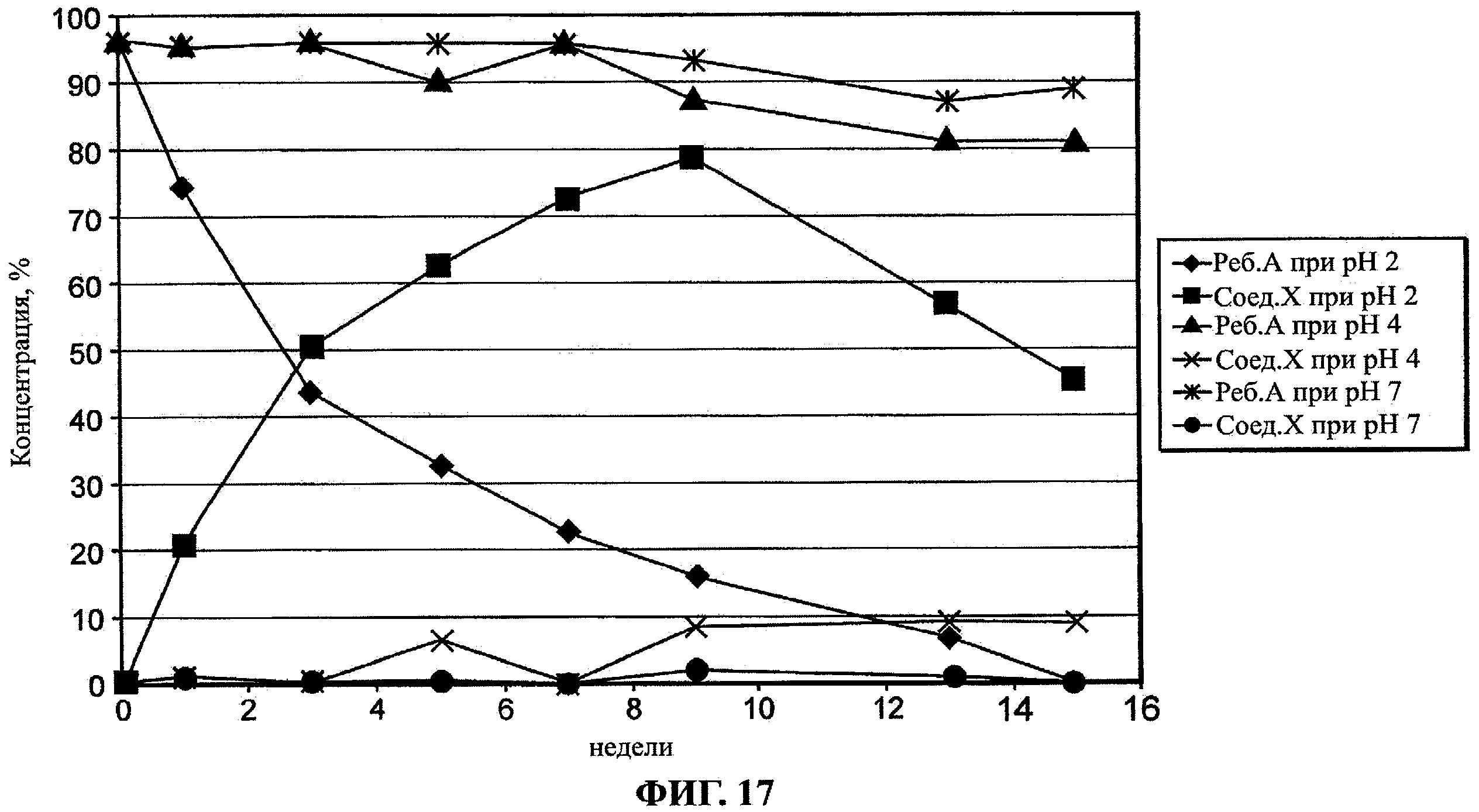
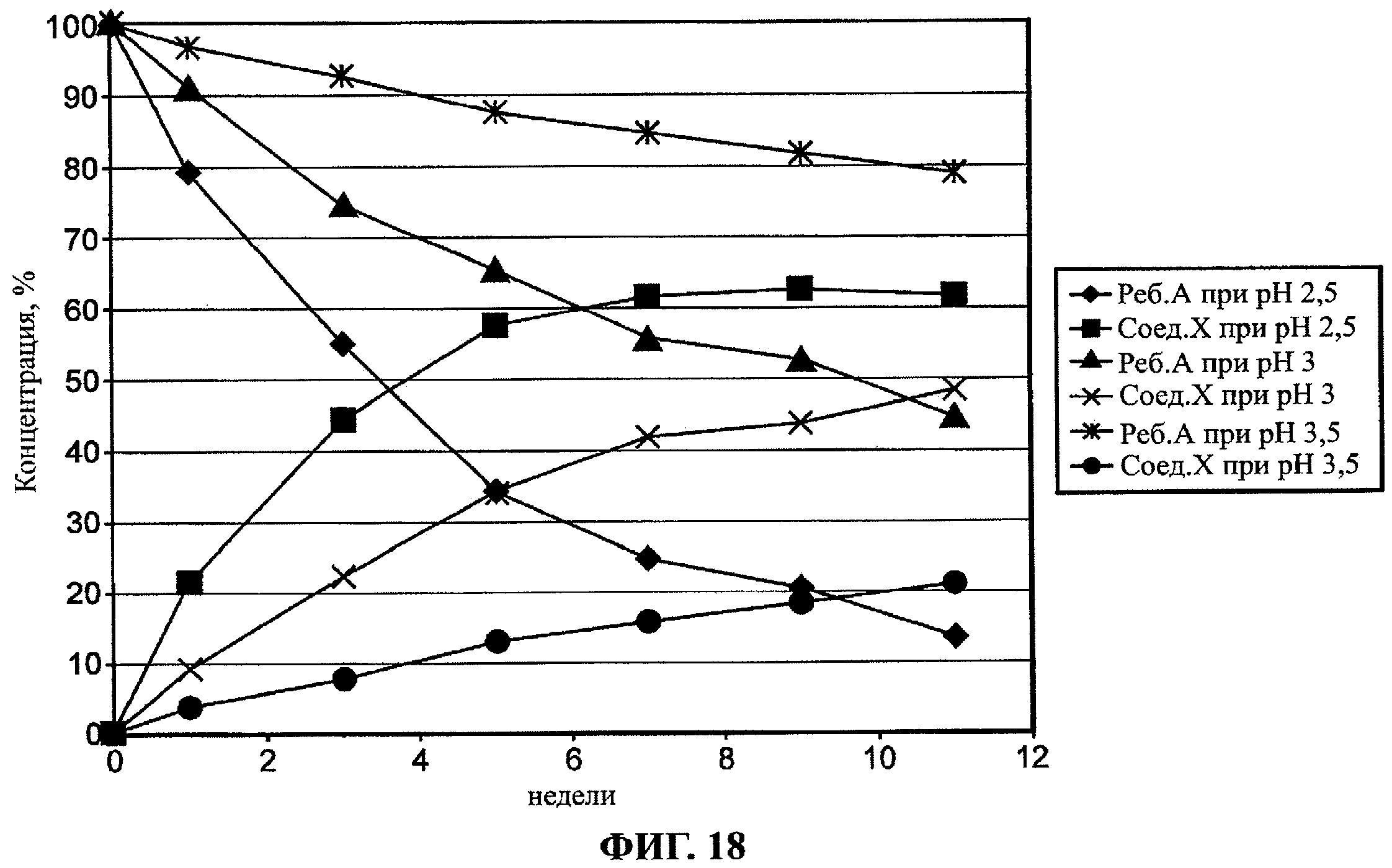
Фиг.17 и 18 показывают зависимость скорости синтеза изо-ребаудиозида А (Соед.Х) из ребаудиозида А (Реб.А) от рН.
Фиг.19 показывает зависимость скорости синтеза изо-ребаудиозида А (Соед.Х) из ребаудиозида А (Реб.А) от температуры.
Фиг.20 является протонным ЯМР-спектром ребаудиозида В.
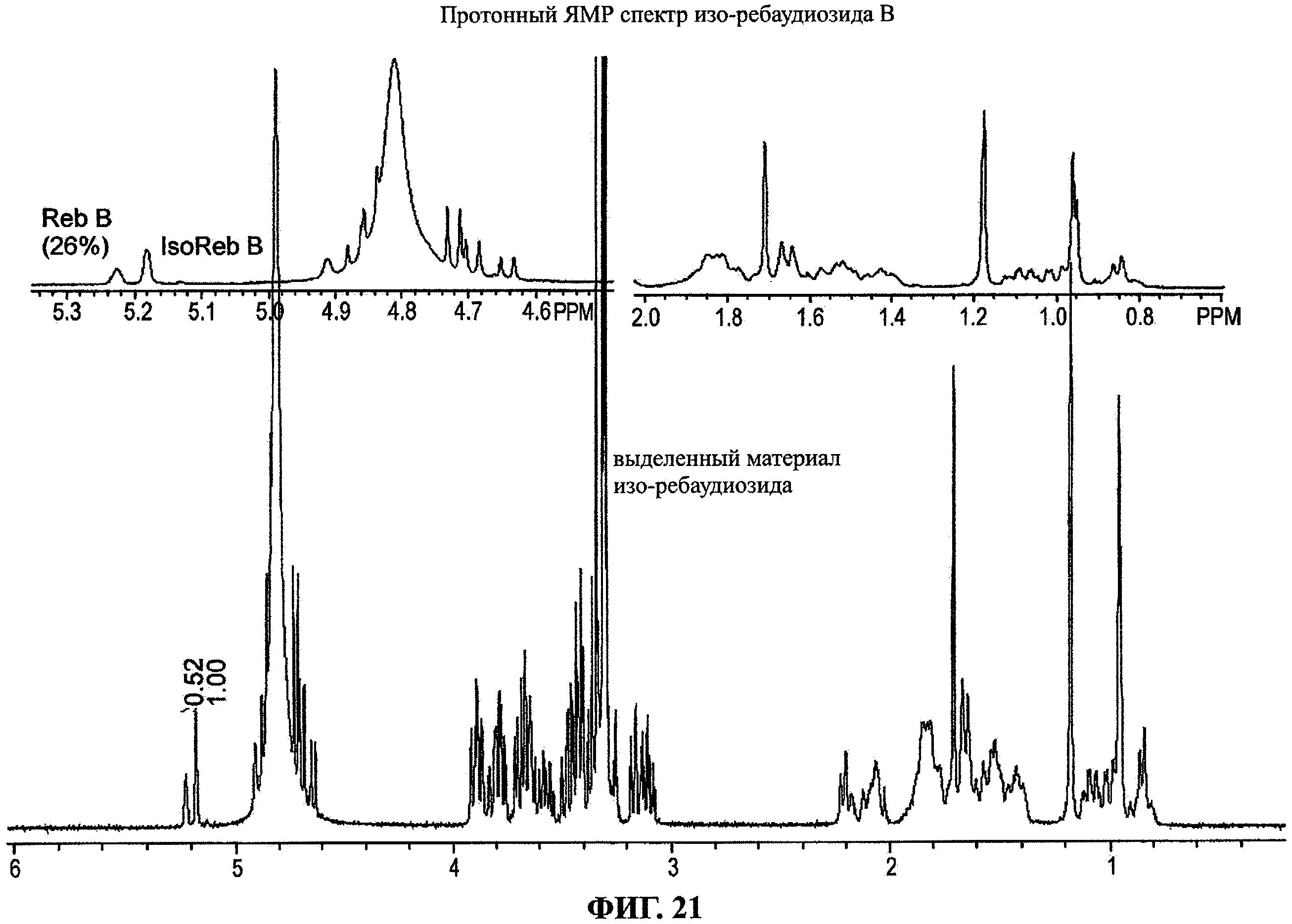
Фиг.21 является протонным ЯМР спектром изо-ребаудиозида В.
Фиг.22 является наложением спектров из Фиг.20 и 21.
Фиг.23 является наложением ВЭЖХ хроматограмм ребаудиозида В, изо-ребаудиозида В и 1:1 смеси двух соединений.
Подробное описание некоторых примерных воплощений.
В некоторых примерных воплощениях изомеры стевиол-гликозидов из настоящего изобретения могут быть определены общей формулой II

При этом R1 может быть водородом, 1-β-D-глюкопиранозилом или 2-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, a R2 может быть водородом, 1-β-D-глюкопиранозилом, 2-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, 2,3-бис(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, 2-(1-α-L-рамнопиранозил)-1-β-D-глюкопиранозилом, 2-(1-α-L-рамнопиранозил)-3-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом или 2-(1-β-D-ксилопиранозил)-3-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом. Некоторые примерные воплощения включают соединения формулы II, в которых R1 является 1-β-D-глюкопиранозилом, а R2 является 2,3-бис(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом (изо-ребаудиозид A), R1 является 1-β-D-глюкопиранозилом, а R2 является 2-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом (изо-стевиозид), R1 является водородом, а R2 является 2,3-бис(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом (изо-ребаудиозид В), R1 является водородом, а R2 является 2-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом (изо-стевиолбиозид), R1 является 1-β-D-глюкопиранозилом, а R2 является 1-β-D-глюкопиранозилом (изо-рубузозид), R1 является 1-β-D-глюкопиранозилом, а R2 является 2-(1-α-L-рамнопиранозил)-1-β-D-глюкопиранозилом (изо-дулькозид A), R1 является 1-β-D-глюкопиранозилом, а R2 является 2-(1-α-L-рамнопиранозил)-3-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозой (изо-ребаудиозид С), R1 является 2-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, а R2 является 2,3-бис(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом (изо-ребаудиозид D), R1 является 2-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, а R2 является 2-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом (изо-ребаудиозид Е), R1 является 1-β-D-глюкопиранозилом, а R2 является 2-(1-β-D-ксилопиранозил)-3-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом (изо-ребаудиозид F), R1 является водородом, а R2 является 1-β-D- глюкопиранозилом (изо-стевиолмонозид), или R1 является 1-β-D- глюкопиранозилом, а R2 является водородом (изо-стевиол II глюкозил эфир). Одно примерное воплощение включает соединение формулы II, в котором R1является 1-β-D-глюкопиранозилом, a R2 является 2,3-бис(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом. Это соединение имеет структуру, показанную в Формуле III ниже. Далее это соединение обозначается как изо-ребаудиозид А.
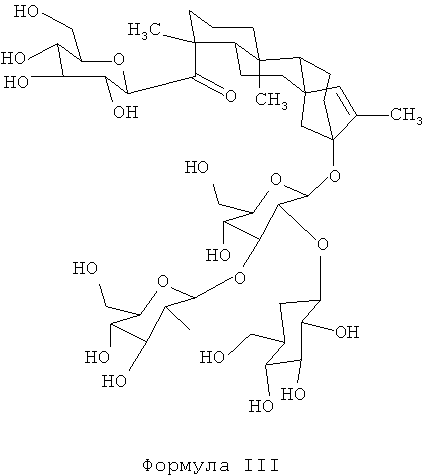
В некоторых примерных воплощениях изомеры стевиол-гликозидов, раскрытые здесь, могут быть приготовлены путем нагревания ребаудиозида А в водном растворе до температуры в диапазоне от примерно 30°C до примерно 90°C (например, 43°C, 65°C, 75°C, 85°C или в диапазоне от примерно 40°C до примерно 50°C) в сильно кислых условиях (например, при pH около 1,0-4,0, таких как примерно pH 2,0-2,5) в течение достаточного периода времени (например, более двух суток, то есть от двух суток до примерно 11 недель) для получения изо-ребаудиозида А (формула III). В некоторых примерных воплощениях по меньшей мере 1,0% по массе (например, по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 25%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 75%, по меньшей мере 90% по массе) от исходного материала ребаудиозида А превращается в изо-ребаудиозид А. Литературные данные позволяют предположить, что при сильно кислых условиях (pH 2,4-2,6) стевиозид или ребаудиозид А достаточно стабильны при 60°C, но подвергаются резким изменениям при 100°C, с получением побочных продуктов гидролиза, таких как глюкоза, стевиолбиозид (из стевиозида), ребаудиозид В (из ребаудиозида А), и неизвестных соединений, имеющих значительно удаленные от стевиозида или ребаудиозида А факторы удерживания при ТСХ или время удерживания при ВЭЖХ. Когда стевиозид подвергали воздействию высоких температур, также формировался изо-стевиол (формула IV) (S.S.Chang and J.M. Cook, J. Agric. Food Chem., 31, 409-412 (1983)).
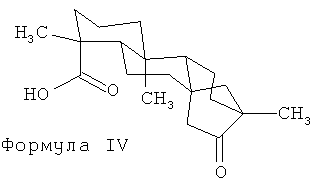
В других литературных источниках указано, что кислотно-катализируемый гидролиз стевиозида приводит к образованию изо-стевиола (М.Bridel and R.Lavieille, Journal de Pharmacie et de Chimie, 14, 321-32 и 369-379 (1931); J.R. Hanson and B.H. Oliverira, Natural Product Reports, 10, 301-309 (1993)). Было показано, что изо-стевиол является продуктом перегруппировки Вагнера-Меервейна, включающей инверсию D-кольца стевиола (формула I, в которой каждый из R1 и R2 является водородом). Таким образом, литературные данные свидетельствуют, что стевиол-гликозиды, например ребаудиозид А, подвергаются каждый кислотно-катализируемой изомеризации, с получением продукта, также содержащего изостевиол в качестве агликонового компонента.
Но удивительно, было установлено, что кислотная и тепловая обработка стевиол-гликозидов, например ребаудиозида А, в соответствии с настоящим изобретением, приводит к образованию изомеров стевиол-гликозидов Формулы II, например изо-ребаудиозида А (формула III), имеющих агликоновый компонент, который не является ни стевиолом, ни изо-стевиолом, но скорее новым агликоновым компонентом, имеющим перемещенную двойную связь по сравнению со стевиолом. Неожиданный агликоновый компонент из нового соединения далее называют изо-стевиолом II (см. формулу II). Когда R1 и R2 в Формуле II каждый является водородом, соединение называют изо-стевиолом II (формула V).

В некоторых примерных воплощениях изомеры стевиол-гликозидов, раскрытые здесь, могут быть гидролизованы для удаления глюкозных, рамнозных и/или ксилозных единиц. Таким образом, изомеры стевиол-гликозидов, например изо-ребаудиозиды A-F, изо-стевиозид, изо-дулькозид и т.д., могут быть гидролизованы при дальнейшей обработке нагреванием и кислотой в различные другие изомеры стевиол-гликозидов, например изо-стевиозид, изо-ребаудиозид В, изо-стеволбиозид, изо-рубузозид, изо-стевиолмонозид, изо-стевиол II глюкозил эфир и т.д. Таким образом, в качестве не ограничивающего примера ребаудиозид А может быть изомеризован путем обработки нагреванием и кислотой в изо-ребаудиозид А в качестве промежуточного продукта, который может быть гидролизован в изо-ребаудиозид В. В некоторых примерных воплощениях исходные материалы стевиол-гликозидов могут быть вначале гидролизованы для удаления одной или более глюкозной, рамнозной, и/или ксилозной единиц, а затем изомеризованы до изомеров стевиол-гликозидов. В качестве не ограничивающего примера ребаудиозид A может быть гидролизован путем обработки нагреванием и кислотой до ребаудиозида B в качестве промежуточного продукта, который может быть изомеризован до изо-ребаудиозида В.
В некоторых примерных воплощениях кислый водный раствор, имеющий pH в диапазоне 1,0-4,0 (например, в диапазоне 2,0-2,5) и включающий ребаудиозид А (т.е. соединение формулы I, в котором R1 является 1-β-D-глюкопиранозилом, a R2 является 2,3-бис(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом), нагревают до температуры в диапазоне от примерно 30°C до примерно 90°C (например, 43°C, 65°C, 75°C, 85°C или в диапазоне от примерно 40°C до примерно 50°C) в течение достаточного периода времени (например, более двух суток, то есть от двух суток до примерно 11 недель) до получения изо-ребаудиозида В (т.е. соединения формулы II, в котором R1 является водородом, a R2 является 2,3-бис(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом). В одном примерном воплощении при вышеуказанных условиях ребаудиозид А вначале превращается в изо-ребаудиозид А, который затем превращается в изо-ребаудиозид B. В другом примерном воплощении при вышеуказанных условиях ребаудиозид A превращается в ребаудиозид B, который затем превращается в изо-ребаудиозид B. В некоторых примерных воплощениях по меньшей мере 1,0% по массе (например, по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 25%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 75%, по меньшей мере 90% по массе) от исходного материала ребаудиозида A превращается в изо-ребаудиозид B.
В других примерных воплощениях каждый из изомеров стевиол-гликозидов, раскрытых здесь, может быть приготовлен путем обработки подходящего стевиол-гликозида, например соответствующего стевиол-гликозида, кислотой и нагреванием в соответствии со способом изобретения. А именно, стевиозид может быть нагрет в водном растворе до температуры в диапазоне от примерно 30°C до примерно 90°C (например, 43°C, 65°C, 75°C, 85°C или в диапазоне от примерно 40°C до примерно 50°C) в сильно кислых условиях (например, при pH около 1,0-4,0, то есть при pH около 2,0-2,5) в течение достаточного периода времени (например, больше двух суток, то есть от двух суток до примерно 11 недель) до получения соединения формулы II, в котором R1 является 1-β-D-глюкопиранозилом, a R2 является 2-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом (изо-стевиозида). В некоторых примерных воплощениях по меньшей мере 1,0% по массе (например, по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 25%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 75%, по меньшей мере 90% по массе) от исходного материала стевиозида превращается в изо-стевиозид. Подобным образом, ребаудиозид В может быть нагрет в водном растворе до температуры в диапазоне от примерно 30°C до примерно 90°C (например, 43°C, 65°C, 75°C, 85°C) или в диапазоне от примерно 40°C до примерно 50°C) в сильно кислых условиях (например, при pH около 1,0-4,0, то есть при pH около 2,0-2,5) в течение достаточного периода времени (например, больше двух суток, то есть от двух суток до примерно 11 недель) до получения соединения формулы II, в котором R1 является водородом, a R2 является 2,3-бис(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом (изо-ребаудиозида В). В некоторых примерных воплощениях по меньшей мере 1,0% по массе (например, по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 25%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 75%, по меньшей мере 90% по массе) от исходного материала ребаудиозида В превращается в изо-ребаудиозид В. Стевиолбиозид может быть нагрет в водном растворе до температуры в диапазоне от примерно 30°C до примерно 90°C (например, 43°C, 65°C, 75°C, 85°C) или в диапазоне от примерно 40°C до примерно 50°C) в сильно кислых условиях (например, при pH около 1,0-4,0, то есть при pH около 2,0-2,5) в течение достаточного периода времени (например, больше двух суток, то есть от двух суток до примерно 11 недель) до получения соединения из формулы II, в котором R1 является водородом, a R2 является 2-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом (изо-стевиолбиозида). В некоторых примерных воплощениях по меньшей мере 1,0% по массе (например, по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 25%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 75%, по меньшей мере 90% по массе) от исходного материала стевиолбиозида превращается в изо-стевиолбиозид. Рубузозид может быть нагрет в водном растворе до температуры в диапазоне от примерно 30°C до примерно 90°C (например, 43°C, 65°C, 75°C, 85°C) или в диапазоне от примерно 40°C до примерно 50°C) в сильно кислых условиях (например, при рН около 1,0-4,0, то есть при pH около 2,0-2,5) в течение достаточного периода времени (например, больше двух суток, то есть от двух суток до примерно 11 недель) до получения соединения формулы II, в котором R1 является 1-β-D-глюкопиранозилом, a R2 является 1-β-D-глюкопиранозилом (изо-рубузозида). В некоторых примерных воплощениях по меньшей мере 1,0% по массе (например, по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 25%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 75%, по меньшей мере 90% по массе) от исходного материала рубузозида превращается в изо-рубузозид. Стевиолмонозид может быть нагрет в водном растворе до температуры в диапазоне от примерно 30°C до примерно 90°C (например, 43°C, 65°C, 75°C, 85°C) или в диапазоне от примерно 40°C до примерно 50°C) в сильно кислых условиях (например, при pH около 1,0-4,0, то есть при рН около 2,0-2,5) в течение достаточного периода времени (например, больше двух суток, то есть от двух суток до примерно 11 недель) до получения соединения из формулы II, в котором R1 является водородом, a R2 является 1-β-D-глюкопиранозой (изо-стевиолмонозида). В некоторых примерных воплощениях по меньшей мере 1,0% по массе (например, по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 25%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 75%, по меньшей мере 90% по массе) от исходного материала стевиолмонозида превращается в изо-стевиолмонозид. Стевиол глюкозы эфир (Формула I, R1 является 1-β-D-глюкопиранозилом, a R2 является водородом) может быть нагрет в водном растворе до температуры в диапазоне от примерно 30°C до примерно 90°C (например, 43°C, 65°C, 75°C, 85°C) или в диапазоне от примерно 40°C до примерно 50°C) в сильно кислых условиях (например, при pH около 1,0-4,0, то есть при pH около 2,0-2,5) в течение достаточного периода времени (например, больше двух суток, то есть от двух суток до примерно 11 недель) до получения соединения формулы II, в котором R1 является 1-β-D-глюкопиранозой, a R2 является водородом (изо-стевиол II глюкозил эфира). В некоторых примерных воплощениях по меньшей мере 1,0% по массе (например, по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 25%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 75%, по меньшей мере 90% по массе) от исходного материала стевиол глюкозы эфира превращается в изо-стевиол II глюкозил эфир. Дулькозид А может быть нагрет в водном растворе до температуры в диапазоне от примерно 30°C до примерно 90°C (например, 43°C, 65°C, 75°C, 85°C) или в диапазоне от примерно 40°C до примерно 50°C) в сильно кислых условиях (например, при рН около 1,0-4,0, то есть при pH около 2,0-2,5) в течение достаточного периода времени (например, больше двух суток, то есть от двух суток до примерно 11 недель) до получения соединения формулы II, в котором R1 является 1-β-D-глюкопиранозилом, a R2 является 2-(1-α-L-рамнопиранозил)-1-β-D-глюкопиранозилом (изо-дулькозида А). В некоторых примерных воплощениях по меньшей мере 1,0% по массе (например, по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 25%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 75%, по меньшей мере 90% по массе) от исходного материала дулькозида А превращается в изо-дулькозид А. Ребаудиозид С может быть нагрет в водном растворе до температуры в диапазоне от примерно 30°C до примерно 90°C (например, 43°C, 65°C, 75°C, 85°C) или в диапазоне от примерно 40°C до примерно 50°C) в сильно кислых условиях (например, при pH около 1,0-4,0, то есть при pH около 2,0-2,5) в течение достаточного периода времени (например, больше двух суток, то есть от двух суток до примерно 11 недель) до получения соединения формулы II, в котором R1 является 1-β-D-глюкопиранозилом, a R2 является 2-(1-α-L-рамнопиранозил)-3-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозой (изо-ребаудиозида С). В некоторых примерных воплощениях по меньшей мере 1,0% по массе (например, по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 25%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 75%, по меньшей мере 90% по массе) от исходного материала ребаудиозида С превращается в изо-ребаудиозид С. Ребаудиозид D может быть нагрет в водном растворе до температуры в диапазоне от примерно 30°C до примерно 90°C (например, 43°C, 65°C, 75°C, 85°C) или в диапазоне от примерно 40°C до примерно 50°C) в сильно кислых условиях (например, при pH около 1,0-4,0, то есть при pH около 2,0-2,5) в течение достаточного периода времени (например, больше двух суток, то есть от двух суток до примерно 11 недель) до получения соединения формулы II, в котором R1 является 2-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, a R2 является 2,3-бис(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом (изо-ребаудиозида D). В некоторых примерных воплощениях по меньшей мере 1,0% по массе (например, по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 25%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 75%, по меньшей мере 90% по массе) от исходного материала ребаудиозида D превращается в изо-ребаудиозид D. Ребаудиозид Е может быть нагрет в водном растворе до температуры в диапазоне от примерно 30°C до примерно 90°C (например, 43°C, 65°C, 75°C, 85°C) или в диапазоне от примерно 40°C до примерно 50°C) в сильно кислых условиях (например, при pH около 1,0-4,0, то есть при pH около 2,0-2,5) в течение достаточного периода времени (например, больше двух суток, то есть от двух суток до примерно 11 недель) до получения соединения ормулы II, в котором R1 является 2-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, a R2 является 2-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом (изо-ребаудиозида Е). В некоторых примерных воплощениях по меньшей мере 1,0% по массе (например, по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 25%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 75%, по меньшей мере 90% по массе) от исходного материала ребаудиозида Е превращается в изо-ребаудиозид Е. Ребаудиозид F может быть нагрет в водном растворе до температуры в диапазоне от примерно 30°C до примерно 90°C (например, 43°C, 65°C, 75°C, 85°C, или в диапазоне от примерно 40°C до примерно 50°C) в сильно кислых условиях (например, при pH около 1,0-4,0, то есть при pH около 2,0-2,5) в течение достаточного периода времени (например, больше двух суток, то есть от двух суток до примерно 11 недель) до получения соединения формулы II, в котором R1 является 1-β-D-глюкопиранозилом, a R2 является 2-(1-β-D-ксилопиранозил)-3-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом (изо-ребаудиозида F). В некоторых примерных воплощениях по меньшей мере 1,0% по массе (например, по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 25%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 75%, по меньшей мере 90% по массе) от исходного материала ребаудиозида F превращается в изо-ребаудиозид F. Могут применяться другие способы синтеза, например, ферментативная изомеризация. Изомеры стевиол-гликозидов могут быть выделены и очищены, например, посредством хроматографии, перекристаллизации, и т.д.
Примеры кислот, подходящих для приготовления изомеров стевиол-гликозидов в сильно кислых условиях, включают неорганические кислоты, такие как фосфорная кислота, соляная кислота, азотная кислота, серная кислота и т.д., и/или органические кислоты, такие как лимонная кислота, яблочная кислота, виннокаменная кислота, молочная кислота, аскорбиновая кислота и т.д. Одну или более кислот и факультативно соответствующую соль кислоты (например, лимонную кислоту и цитрат) включают в реакционную смесь в количестве, достаточном, чтобы сделать реакционную смесь сильно кислой (например, чтобы достигнуть значения pH в диапазоне примерно 1,0-4,0, например pH 2,0-2,5). Может также применяться ферментативная изомеризация.
Стевиол-гликозиды формулы I, по одиночке или в виде смеси, могут иметь дополнительное число β-D-глюкопиранозильных единиц, ковалентно связанных 4→1 с существующими β-D-глюкопиранозильными единицами в R1 и/или R2 посредством реакций ферментативного трансглюкозилирования с крахмалом, приводя к получению комплексной смеси продуктов (См. Kazuhiro Ohtani and Kazuo Yamasaki, Chapter 7, "Method to improve the taste of the sweet principles of Stevia rebaudiana", p.145, в книге, озаглавленной "Stevia, The genus Stevia", под редакцией A. Douglas Kinghorn, Taylor & Francis, 2002). Эти ферментативно-модифицированные экстракты стевии коммерчески доступны для применения в качестве подсластителей в пищевых и питьевых продуктах. Изомеры стевиол-гликозидов формулы II могут быть подвергнуты тому же самому виду реакций ферментативного трансглюкозилирования, что приводит к получению комплексной смеси продуктов, пригодных для применения в качестве подсластителей для пищевых и питьевых продуктов. Также предполагается, что продукт ферментативного трансглюкозилирования стевиол-гликозидов формулы I может быть нагрет в водном растворе до температуры в диапазоне от примерно 30°C до примерно 90°C (например, в диапазоне от примерно 40°C до примерно 50°C, такой как 43°C) в сильнокислых условиях (например, при рН около 1,0-4,0, то есть при pH около 2,0-2,5) в течение достаточного периода времени (например, больше двух суток, то есть от двух суток до примерно 11 недель) до получения комплексной смеси продуктов, имеющих агликоновый компонент формулы II. Эти продукты изомеризации могут также быть пригодными в качестве подсластителей в пищевых и питьевых продуктах.
В некоторых примерных воплощениях изомеры стевиол-гликозидов, включающие по меньшей мере одно соединение формулы II, могут применяться в качестве сильного подсластителя, не обладающего питательными свойствами. Подсластители являются съедобными материалами, пригодными для потребления и для применения в пищевых и питьевых продуктах. Как применяется здесь, термин «съедобные материалы» означает пищевой или питьевой продукт, или ингредиент пищевого или питьевого продукта для употребления человеком или животным. Как применяется здесь, «подсластитель, не обладающий питательными качествами» является таким, который не содержит значительного количества калорий в типично применяемых количествах, например, добавляет менее 5 калорий на порцию 8 унций напитка для достижения эквивалента сладости сахара 10 Брикс. Как применяется здесь, «сильный подсластитель» обозначает подсластитель, который слаще сахара (сахарозы) по меньшей мере в два раза, то есть подсластитель, требующий на основе массы не более половины от массы сахара, необходимого для достижения эквивалентной сладости.
Например, сильный подсластитель может требовать менее одной второй от массы сахара для достижения эквивалентной сладости в напитке, подслащенном до уровня 10 градусов по шкале Брикса с сахаром.
В некоторых примерных воплощениях подсластитель может включать по меньшей мере один компонент формулы II, и факультативно уплотнитель, наполнитель, такой как декстроза, мальтодекстрин, эритритол, тагатоза, или смесь эритритола и тагатозы, полидекстроза и/или агент, препятствующий слипанию.
В некоторых примерных воплощениях один или более изомеров стевиол-гликозидов, раскрытых здесь, могут быть представлены в питьевом продукте в качестве подсластителя, не обладающего питательными свойствами. В некоторых примерных воплощениях питьевой продукт включает подсластитель изо-ребаудиозид А (т.е. соединение формулы II, в котором R1 является 1-β-D-глюкопиранозилом, a R2 является 2,3-бис(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом. В некоторых примерных воплощениях питьевой продукт включает по меньшей мере 0,005% по массе (например, по меньшей мере 0,01%, по меньшей мере 0,02%, по меньшей мере 0,03% по массе) изо-ребаудиозида А. В некоторых примерных воплощениях питьевой продукт включает подсластитель изо-ребаудиозид В (т.е. соединение формулы II, в котором R1 является водородом, a R2 является 2,3-бис(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом. В некоторых примерных воплощениях питьевой продукт включает по меньшей мере 0,005% по массе (например, по меньшей мере 0,01%, по меньшей мере 0,02%, по меньшей мере 0,03% по массе) изо-ребаудиозида В.
Примерные питьевые продукты включают водосодержащую жидкость и соединение формулы II, и включают напитки, например, такие как готовые к употреблению жидкие рецептуры, концентраты напитков и тому подобное. Напитки включают, например, газированные и негазированные безалкогольные напитки, напитки, приготовляемые автоматами, замороженные готовые к употреблению напитки, замороженные газированные напитки, жидкие концентраты, порошковые концентраты, кофейные напитки, чайные напитки, молочные напитки, ароматизированные воды, обогащенные воды, фруктовые соки, ароматизированные напитки с фруктовым соком, напитки с фруктовым ароматом, спортивные напитки, соевые напитки, овощные напитки, напитки на основе зерна (например, солодовые напитки), ферментированные напитки (например, йогурт и кефир, алкогольные напитки и смеси любых из них. Примеры источников фруктовых соков включают цитрусовые фрукты, например апельсины, грейпфруты, лимоны и лаймы, ягоды, например клюкву, малину, чернику и землянику, яблоки, виноград, ананасы, сливы, груши, персики, вишню, манго и гранат. Питьевые продукты включают бутылки, консервные банки, продукты в картонной упаковке и сироп для газированной воды.
Термины «концентрат для напитков» и «сироп» применяются взаимозаменяемо на протяжении данного описания. По меньшей мере некоторые примерные воплощения предлагаемых концентратов для напитков готовят с исходным объемом воды, к которому добавляют дополнительные ингредиенты. Композиции напитков полной крепости могут быть получены из концентрата для напитков путем добавления дополнительных объемов воды в концентрат. Обычно, например, напитки полной крепости могут быть приготовлены из концентратов путем объединения примерно 1 части концентрата примерно с 3-7 частями воды. В некоторых примерных воплощениях напиток полной крепости готовят путем объединения 1 части концентрата с 5 частями воды. В некоторых примерных воплощениях дополнительная вода, применяемая для получения напитков полной крепости, является газированной водой. В некоторых других воплощениях напиток полной крепости готовят непосредственно без образования концентрата и последующего разбавления.
В некоторых примерных воплощениях один или более изомеров стевиол-гликозидов, раскрытых здесь, могут присутствовать в виде подсластителя, не обладающего питательными качествами, в пищевом продукте. Пищевые продукты включают по меньшей мере один пищевой компонент, т.е. любой съедобный материал, пригодный для потребления человеком или животным, полностью или частично перевариваемый. Не ограничивающие примеры пищевых компонентов включают белки, углеводы, жиры, витамины, минералы и т.д. Пищевые продукты, включающие соединение формулы II, раскрытое здесь, включают, например, толокно, злаки, хлебобулочные изделия (например, булочки, крекеры, пирожные, шоколадные пирожные с орехами, хлеб и т.д.), закусочные пищевые продукты (например, картофельные чипсы, кукурузные чипсы, попкорн, питательные батончики, рисовые оладьи и т.д.), и другие пищевые продукты на основе зерновых. Любые варианты, альтернативы, версии и т.д., обсуждаемые где-либо в этом описании, применяются воплощениям продуктов питания данного изобретения.
Необходимо понять, что пищевые или питьевые продукты в соответствии с данным раскрытием могут иметь любую из многочисленных различных специфических рецептур или структур. Рецептура пищевого или питьевого продукта в соответствии с данным раскрытием может варьировать до определенной степени, в зависимости от таких факторов, как предназначенный для продукта сектор рынка, необходимые питательные характеристики, вкусовой профиль и тому подобное. Например, к рецептуре конкретного воплощения продукта питания или напитка обычно добавляются дополнительные ингредиенты, включая любые рецептуры продуктов питания и напитков, описанные здесь. Могут быть добавлены дополнительные подсластители (т.е. многие и/или другие). Подкислители, ароматизаторы, красители, электролиты, минералы, неминеральные питательные добавки, фруктовые соки или другие фруктовые продукты, вкусовые вещества, вещества, корригирующие вкус и запах, и тому подобные, усилители вкуса, буферные агенты, загустители, эмульгаторы, съедобные частицы, противопенные агенты, консерванты, газирующие агенты, и их смеси обычно могут добавляться к таким рецептурам для изменения вкуса, вкусового впечатления, питательных характеристик, функционального назначения и т.д. пищевого или питьевого продукта. Примеры неминеральных питательных дополнительных ингредиентов известны специалистам в данной области техники и включают, например, антиоксиданты и витамины, включая витамины A, D, Е (токоферол), С (аскорбиновую кислоту), В (тиамин), B2 (рибофлавин), B6, B12, и К, ниацин, фолиевую кислоту, биотин и их комбинации. Факультативные неминеральные питательные добавки обычно присутствуют в количествах, в целом принятых в надлежащей производственной практике. Примерные количества составляют от примерно 1% до примерно 100% РСП (рекомендуемого суточного потребления), если такое РСП установлено. В некоторых примерных воплощениях неминеральный питательный дополнительный ингредиент(ы) присутствует в количестве от примерно 5% до примерно 20% РСП, если установлено. Подходящие дополнительные и альтернативные ингредиенты станут понятны специалисту в данной области техники при оценке преимуществ данного изобретения.
Некоторыми примерными воплощениями газированных напитков, раскрытых здесь, являются газированные напитки с ароматом колы, которые типично включают газированную воду, соединение формулы II, экстракт ореха колы и/или другой ароматизатор колы, карамельный краситель, и подкислитель (например, фосфорную кислоту), и факультативно другие ингредиенты, такие как другие подсластители. Некоторыми другими примерными воплощениями газированных напитков, раскрытыми здесь, являются газированные напитки с ароматом цитрусовых (например, лимона-лайма, грейпфрута, лимона, лайма и т.д.), которые типично включают газированную воду, соединение формулы II, цитрусовый ароматизатор, подкислитель (например, лимонную кислоту), и факультативно другие ингредиенты, такие как красители и/или другие подсластители. В некоторых примерных воплощениях обеспечивается концентрат для напитка, включающий воду, соединение формулы II, ароматизатор со вкусом колы, карамельный краситель и подкислитель (например, фосфорную кислоту), и факультативно другие ингредиенты, такие как другие подсластители. В некоторых примерных воплощениях обеспечивается концентрат для напитка, включающий воду, соединение формулы II, цитрусовый ароматизатор, и подкислитель (например, лимонную кислоту), и факультативно другие ингредиенты, такие как красители и/или другие подсластители.
По меньшей мере в некоторых примерных воплощениях пищевых и питьевых продуктов, раскрытых здесь, могут быть включены дополнительные/другие подсластители, например подсластители, обладающие питательными качествами, или подсластители, не обладающие питательными качествами. Неограничивающие примеры подсластителей, обладающих питательными качествами, включают сахарозу, жидкую сахарозу, фруктозу, жидкую фруктозу, глюкозу, жидкую глюкозу, глюкозо-фруктозный сироп из природных источников, таких как яблоки, цикорий, агава, мед и т.д., например кукурузный сироп с высоким содержанием фруктозы, сироп цикория, сироп агавы, инвертный сахар, средний инвертный сахар, кленовый сироп, мед, патока из коричневого сахара, например тростниковая патока и патока из сахарной свеклы, сироп сорго, и смеси любых из них. Такие подсластители представлены по меньшей мере в некоторых примерных воплощениях в количестве от примерно 0,1% до примерно 20% по массе от итогового пищевого или питьевого продукта, в таком, как от примерно 6% до примерно 16% по массе, в зависимости от необходимого уровня сладости для итогового пищевого или питьевого продукта. Подсластители, обладающие питательными качествами, могут быть представлены в воплощениях концентрата для напитка до примерно 60% по массе концентрата для напитка.
Неограничивающие примеры сильных природных подсластителей, не обладающих питательными качествами, которые могут быть включены в пищевые и питьевые продукты, включают ребаудиозид А, стевиозид, другие стевиол-гликозиды, экстракты Stevia rebaudiana, Lo Han Guo (LHG), например, концентрат сока LHG или порошок LHG, тауматин, монеллин, браззеин, монатин, и смеси любых из них. LHG, если применяется, может иметь, например, содержание могрозида V от примерно 2 до примерно 99%. В некоторых примерных воплощениях обеспечивается пищевой или питьевой продукт, включающий смесь соединения формулы II и LHG с содержанием могрозида V по меньшей мере 30%. В некоторых примерных воплощениях LHG в смеси имеет содержание могрозида V примерно 45% плюс-минус 5%. В некоторых примерных воплощениях смесь, включающая LHG и соединение формулы II, обеспечивает по меньшей мере 10% сладости пищевого или питьевого продукта. В некоторых примерных воплощениях смесь обеспечивает от примерно 1/3 до примерно 2/3 сладости. Другие примеры подсластителей, не обладающих питательными качествами, включают сорбитол, маннитол, ксилитол, глицирризин, мальтитол, мальтозу, лактозу, ксилозу, арабинозу, изомальт, лактитол, трегалулозу, рибозу, фрукто-олигосахариды и смеси любых из них. Факультативно, подслащающий компонент может включать эритритол, тагатозу и смесь эритритола и тагатозы или полидекстрозу. В некоторых примерных воплощениях обеспечивается пищевой или питьевой продукт, включающий соединение формулы II и эритритол, или тагатозу, или смесь эритритола и тагатозы.
Неограничивающие примеры сильных искусственных подсластителей, которые могут быть включены в пищевые и питьевые продукты, включают подсластители на пептидной основе, например аспартам, неотам и элитам, и подсластители на непептидной основе, например натрий сахарин, кальций сахарин, ацесульфам (включая без ограничения ацесульфам калия), цикламат (включая без ограничения натрия цикламат и/или кальция цикламат), неогесперидин дигидрохалкон, сукралозу и смеси любых из них. Сильные подсластители, не обладающие питательными качествами, типично применяются на уровне миллиграмм на унцию пищевого или питьевого продукта в соответствии с их подслащивающей способностью, любыми применяемыми регулятивными нормами страны, в которой продается пищевой или питьевой продукт, необходимого уровня сладости пищевого или питьевого продукта, и т.д. Смеси любых из вышеуказанных обладающих и не обладающих питательными качествами подсластителей включены в объем раскрытого изобретения. Любой специалист в данной области техники может, учитывая преимущество данного изобретения, выбрать подходящие дополнительные или альтернативные подсластители для применения в различных воплощениях пищевых и питьевых продуктов, раскрытых здесь.
Специалисту в данной области техники понятно, что для удобства некоторые ингредиенты описаны здесь в некоторых случаях посредством ссылки на оригинальную форму ингредиента, в которой его добавляют в рецептуру питьевого продукта. Такая оригинальная форма может отличаться от формы, в которой ингредиент находится в итоговом пищевом или питьевом продукте. Так, например, в некоторых примерных воплощениях питьевых продуктов с колой из данного раскрытия, сахароза и жидкая сахароза обычно по существу будут однородно растворены и диспергированы в питьевом продукте. Таким же образом другие ингредиенты, идентифицированные как твердое вещество, концентрат (например, концентрат сока) и т.д., типично будут скорее однородно диспергированы в пищевом или питьевом продукте, а не останутся в их оригинальной форме. Таким образом, ссылка на форму ингредиента в пищевом или питьевом продукте должна считаться не ограничением формы ингредиента в пищевом или питьевом продукте, а скорее удобным средством описания ингредиента как изолированного компонента рецептуры продукта.
По меньшей мере в некоторых примерных воплощениях пищевые и питьевые продукты, раскрытые здесь, могут быть консервированы посредством пастеризации. Процесс пастеризации может включать, например, ультравысокотемпературную обработку (UHT) и/или высокотемпературную кратковременную обработку (HTST). UHT обработка включает обработку пищевого или питьевого продукта высокой температурой, такую как прямая инжекция пара или нагнетание пара, или непрямое нагревание в теплообменнике. В целом после завершения пастеризации продукта, продукт может быть охлажден, как требуется для конкретной композиции/конфигурации продукта и/или формы розлива в упаковку. Например, в одном воплощении пищевой или питьевой продукт подвергают нагреванию от примерно 85°C до примерно 121°C в течение короткого периода времени, например от 1 до 60 секунд, затем быстро охлаждают до примерно 2,2°C±2,8°C для охлажденных продуктов, до комнатной температуры для продуктов длительного хранения или охлажденных продуктов и примерно до 85°C±5,5°C для горячей расфасовки продуктов длительного хранения. Процесс пастеризации обычно проводят в закрытой системе, так чтобы не подвергать пищевой или питьевой продукт воздействию атмосферы или других возможных источников контаминации. Могут также применяться иные методики, чем пастеризация или стерилизация, например, такие как асептическая упаковка, туннельная пастеризация или автоклавирование. В целом способы туннельной пастеризации обычно включают применение низких температур в течение длительного времени, например около 71°C в течение 10-15 минут, а способы автоклавирования обычно включают применение, например, около 121°C в течение 3-5 минут при повышенном давлении, т.е. при давлении выше 1 атмосферы. В дополнение, процессы многократной пастеризации могут проводиться последовательно или параллельно, как необходимо для пищевого или питьевого продукта или ингредиентов.
Следующие примеры являются конкретными воплощениями настоящего изобретения, не предназначенными для его ограничения.
Пример 1.
Синтез изо-ребаудиозида А. Ребаудиозид А (0,5 г), растворенный в водном цитратном буферном растворе (pH около 2,0) прогревали в течение 10 недель примерно при 43,3°C. Затем реакционную смесь лиофилизировали и подвергали хроматографии на колонке с силикагелем (1×20 см), элюируя с системой растворителей из 70% ацетона, 15% триэтиламина и 15% воды. Были выделены две фракции, при этом фракция 2 содержала ребаудиозид А и изо-ребаудиозид А. После концентрирования из фракции 2 было выделено примерно 6 мг масла. Масло растворяли в D2O (0,6 мл) и оставляли при комнатной температуре примерно на три дня. Образовавшиеся прозрачные бесцветные игольчатые кристаллы (1-2 мг) были выделены для анализа.
Пример 2.
Анализ изо-ребаудиозида А.
Небольшое количество кристаллического продукта из примера 1 анализировали протонным ЯМР и сравнивали со спектром родоначального ребаудиозида A (D2O, 400 МГц1H-ЯМР). Два соединения не были идентичными, что указывало на то, что образовался новый изомер. Фиг.1 и 2 содержат спектры протонного ЯМР эталона ребаудиозида А и изо-ребаудиозида А соответственно. Фиг.3 показывает наложение двух спектров.
Образцы эталона ребаудиозида А и кристаллического продукта из примера 1 подвергали масс-спектральному анализу (в режиме определения положительных ионов ЭРИ). Оба соединения продемонстрировали ожидаемую молекулярную массу 966,5 а.е.м. для ребаудиозида А и сходный характер фрагментации. Фиг.4 и 5 демонстрируют масс-спектры ребаудиозида А и изо-ребаудиозида А соответственно.
Анализы проводили на С-18 обращенно-фазовой аналитической колонке (Alltima 2,1×250 мм) при скорости потока 0,250 мл/мин с детекцией при 210 нм и с испарительной детекцией светорассеяния (ELSD). Колонку предварительно уравновешивали водой, содержащей 0,1% трифторуксусную кислоту (растворитель А). Растворителем В был ацетонитрил, содержащий 0,1% трифторуксусную кислоту. Условиями градиента были:
Продукт из примера 1 вводили с водой (5 мкл), получив два пика в отношении 30:70, не разрешавшихся на базовой линии, меньший пик элюировался на 22,523 минутах, а больший пик элюировался на 22,680 минутах. Эталон ребаудиозида А анализировали посредством ВЭЖХ в тех же самых условиях, и подтвердили, что это пик, элюирующийся на 22,523 минутах. Тот же самый эталон ребаудиозида А, обогащенный небольшим количеством кристаллического продукта из примера 1, при анализе посредством ВЭЖХ показал пропорционально увеличенную площадь пика на 22,680 минутах.
Ребаудиозид А и его изомер разрешались на базовой линии при введении неочищенной 10-недельной реакционной смеси из примера 1 на ту же самую С-18 обращенно-фазовую колонку, при изократической элюции смесью, состоящей из 30:70 ацетонитрила : воды с 0,1% муравьиной кислотой, при скорости потока 0,25 мл/мин. Разрешение на базовой линии было также получено с применением 15-минутного градиента 95% воды к ацетонитрилу при скорости потока 0,25 мл/мин. В этих условиях ребаудиозид А элюировался примерно на 10,9 минутах, а изо-ребаудиозид А элюировался примерно на 12,2 минутах (фиг.6). Детекция посредством ЖХ/МС (ЭРИ-МС) выявила молекулярный ион 989 (М+23, Na аддукт-ион) для пика изо-ребаудиозида А на 12,2 минутах (фиг.7). Эталон ребаудиозида А и выделенный изо-ребаудиозид А анализировали отдельно посредством ЖХ/Мс. Эталон ребаудиозида А элюировался на 11,08 минутах (фиг.8), что соответствовало пику на 10,9 минутах на фиг.6, а выделенный изо-ребаудиозид А элюировался на 12,1 минутах (фиг.9), что соответствовало пику на 12,2 минутах на Фигуре 6. Как эталон, так и выделенный продукт имели молекулярный ион 989 (фиг.10 и 11, соответственно). 10-недельную реакционную смесь из примера 1, обогащенную выделенным изо-ребаудиозидом А, анализировали посредством ЖХ/Мс. Добавленный изо-ребаудиозид А совместно элюировался и повышал площадь пика на 12,2 минутах (фиг.12, сравните с фиг.6), а масс-спектр 12,2 минутного пика дал молекулярный ион 989 (фиг.13).
ЯМР, ВЭЖХ и масс-спектральные данные вместе однозначно подтвердили, что новое соединение изо-ребаудиозид А было химически отличающимся производным ребаудиозида А.
Пример 3.
Синтез изо-ребаудиозида А. Ребаудиозид А (5 г) растворяли в водном растворе цитратного буфера (pH 2, 100 мМ, 200 мл) и нагревали примерно до 75°C. Прогресс реакции контролировали посредством ВЭЖХ, и когда отношение изо-ребаудиозида А к ребаудиозиду А было больше 75% (72 часа), реакционную смесь испаряли до клейкого кристаллического твердого вещества. Смесь продуктов пропускали через кремниевую колонку (10×40 см), элюируя смесью ацетон : вода : триэтиламин (70:15:15) до получения прозрачного масла (примерно 1,0 г). Анализ посредством ВЭЖХ показал наличие ребаудиозида А и изо-ребаудиозида А вместе с большим количеством явно гидролизованного материала, соответствующего потере одного или более сахарных компонентов (например, изо-стевиозида, изо-ребаудиозида В, изо-рубузозида, изо-стевиолбиозида, изо-стевиолмонозида и т.д.).
Прозрачное масло растворяли в воде (3 мл) и отделяли посредством полупрепаративной ВЭЖХ (Alltech Alltima С-18 полупрепаративная колонка, 10×250 мм, скорость потока 5 мл/мин, состав растворителя 30% ацетонитрила в воде с 0,1% муравьиной кислотой). Были сделаны повторные введения, всего 15, собирали пики, элюировавшиеся на 13, 7 минутах, фракции объединяли и концентрировали до белого порошка (23 мг выделенного и очищенного изо-ребаудиозида А). Белый порошок вначале суспендировали в воде (2 мл) и центрифугировали. Осажденное твердое вещество растворяли в теплом ацетонитриле (200 мкл) с последующим добавлением воды (200 мкл) и выстаиванием при комнатной температуре в течение 5 суток, в течение которого медленно появлялись кристаллы в форме больших игл. Смесь подвергали рентгеновской кристаллографии без нарушения кристаллов. Кристаллы отделяли от жидкой части и два образца отдельно высушивали под вакуумом в течение трех суток. Высушенные кристаллы применяли для получения данных рентгеновской кристаллографии.
Была получена и разъяснена рентгеновская кристаллическая структура изо-ребаудиозида А (см. фиг.14). Для сравнения, рентгеновская кристаллическая структура была получена и разъяснена для эталона ребаудиозида А (фиг.15). Анализ посредством рентгеновской кристаллографии неожиданно показал, что трехмерная структура изо-ребаудиозида А имеет эндоциклическую двойную связь в пятичленном кольце с внешней метиловой группой, о чем свидетельствует более короткая связь между 15 и 16 углеродами. Кристаллическая структура ребаудиозида А показала ожидаемую экзоциклическую двойную связь, о чем свидетельствовала более короткая связь между 15 и 17 углеродом (см. фиг.16 для сравнения длины связей. Так удивительно было показано, что структура изо-ребаудиозида А является продуктом кислотно-катализируемой миграции двойной связи, а не продуктом перегруппировки Вагнера-Меервейна, как предполагалось на основании литературных данных, где при воздействии нагревания в кислых условиях стевиол превращался в изо-стевиол.
Пример 4.
Изо-ребаудиозид А из образца для рентгеновской кристаллографии из примера 3 был растворен в воде при концентрации 1000 ч./млн., и группой из пяти человек было установлено, что его интенсивность сладости подобна той, что имеет 7% раствор сахарозы; таким образом, было установлено, что его подслащающая эффективность в 70 раз больше, чем у сахарозы.
Пример 5.
Было проведено шесть реакций при идентичных условиях, таких как в примере 3, за исключением температуры: 43°C, 65°C, 75°C, 85°C, и 90°C, с последующей детекцией посредством ВЭЖХ-МС или УФ (210 нм). Отмечалось, что при повышенных температурах происходил значительный гидролиз большей части ребаудиозида А, с удалением одного или более сахарного компонента, как было определено посредством ВЭЖХ-МС на протяжении реакции.
Пример 6.
Были проведены два исследования зависимости синтеза изо-ребаудиозида А (Соед.X) из ребаудиозида А (Реб.А) от pH. Ребаудиозид А растворяли до одной и той же концентрации в серии водных растворов лимонной кислоты с различным значением pH. Растворы выдерживали при температуре 43°C в течение 11 недель. Одно исследование было проведено с растворами с pH 2,0; 4,0 и 7,0. Другое исследование было проведено с растворами с pH 2,5; 3,0 и 3,5. Результаты двух исследований показаны на фиг.17 и 18 соответственно, при этом Реб.А обозначает ребаудиозид А, а Соед.Х обозначает изо-ребаудиозид А. На фиг.17 концентрация изо-ребаудиозида А при pH 2 достигала пика на 9 неделе, а затем снижалась. Концентрация ребаудиозида А при рН 2 продолжала снижаться после 9 недели. Это указывало, что изо-ребаудиозид А сам деградирует/гидролизуется с образованием других изомеров стевиол-гликозидов, например изо-ребаудиозида В и т.д.
Пример 7.
Было проведено исследование зависимости синтеза изо-ребаудиозида А (Соед.Х) из ребаудиозида А (Реб.А) от температуры. Ребаудиозид А растворяли до одной и той же концентрации в серии водных растворов лимонной кислоты при рН 2,5. Каждый из растворов выдерживали при различной температуре (21°C, 32°C и 43°C) в течение 11 недель. Результаты исследования показаны на фиг.19.
Пример 8.
Изо-ребаудиозид А (Формула VI) синтезировали и очищали в соответствии с процедурой, описанной в примере 3, при условиях реакции, более благоприятных для образования изо-ребаудиозида В. Такие условия реакции включают более длительное время реакции и/или более высокую температуру реакции, чем те, что указаны в примере 3. Изо-ребаудиозид В очищали с помощью полупрепаративной ВЭЖХ, а очищенный изо-ребаудиозид В анализировали протонным ЯМР и сравнивали с ЯМР спектром контрольного образца ребаудиозида В (D2O, 400 МГц1Н-ЯМР). На фиг.20 и 21 показан протонный ЯМР спектр эталона ребаудиозида В и изо-ребаудиозида В соответственно, с увеличенными секциями для демонстрации подробностей. На фиг.22 показано наложение двух ЯМР спектров. На фиг.22 показаны два четко видимых различия между двумя соединениями. Спектр изо-ребаудиозида В имеет три синглетных сигнала метильных групп, в то время как спектр ребаудиозида В имеет только два. Кроме того, в алкенильном участке около 5,2 имп./мин двухпротонный алкенильный пик ребаудиозида В слегка смещается по сравнению с однопротонным пиком изо-ребаудиозида В.
Проводили анализы посредством обращено-фазовой аналитической хроматографии в соответствии с процедурой, указанной в примере 2. Фиг.23 демонстрирует наложение ВЭЖХ профилей для трех образцов: эталона ребаудиозида В, изо-ребаудиозида В и их 1:1 смеси. Фиг.23 показывает, что пики ребаудиозида В и изо-ребаудиозида В не разделяются на базовой линии в этих условиях, но являются различимыми. УФ-ВИЗ и масс-спектры являются по существу идентичными для двух соединений. Изо-ребаудиозид В, выделенный из реакционной смеси, как кажется, содержит примерно 26% ребаудиозида В при сравнении ВЭЖХ профилей и ЯМР спектров двух соединений.
Изобретение описано со ссылкой на предпочтительные воплощения. Очевидно, что после прочтения и осмысления предшествующего подробного описания, специалистами в данной области техники могут быть внесены модификации и изменения. Подразумевается, что изобретение должно истолковываться как включающее все такие модификации и изменения, в той мере, в какой они находятся в пределах объема пунктов формулы изобретения или их эквивалентов.
Реферат
Данное изобретение относится к соединениям формулы II ! ! где R1 может быть 1-β-D-глюкопиранозилом или 2-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, a R2 может быть водородом, 1-β-D-глюкопиранозилом, 2-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, 2,3-бис(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, 2-(1-α-L-рамнопиранозил)-1-β-D-глюкопиранозилом, 2-(1-α-L-рамнопиранозил)-3-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом или 2-(1-β-D-ксилопиранозил)-3-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом. Такие соединения могут быть использованы в качестве подсластителей, не обладающих питательными качествами, в пищевых и питьевых продуктах. Раскрываются также способы получения соединений формулы II. 6 н. и 29 з.п. ф-лы, 23 ил.
Формула
в котором R1 является l-β-D-глюкопиранозилом, или 2-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, a R2 является водородом, 1-β-D-глюкопиранозилом, 2-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, 2,3-бис(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, 2-(1-α-L-рамнопиранозил)-1-β-D-глюкопиранозилом, 2-(1-α-L-рамнопиранозил)-3-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, или 2-(1-β-D-ксилопиранозил)-3-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом.
водосодержащую жидкость, и
соединение по формуле II:

в котором R1 является 1-β-D-глюкопиранозилом, или 2-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, a R2 является водородом, 1-β-D-глюкопиранозилом, 2-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, 2,3-бис(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, 2-(1-α-L-рамнопиранозил)-1-β-D-глюкопиранозилом, 2-(1-α-L-рамнопиранозил)-3-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, или 2-(1-β-D-ксилопиранозил)-3-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом.
пищевой компонент, и
соединение по формуле II:

в котором R1 является водородом, 1-β-D-глюкопиранозилом, или 2-(l-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, a R2 является водородом, 1-β-D-глюкопиранозилом, 2-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, 2,3-бис(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, 2-(1-α-L-рамнопиранозил)-1-β-D-глюкопиранозилом, 2-(1-α-L-рамнопиранозил)-3-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, или 2-(1-β-D-ксилопиранозил)-3-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом.

в котором R1 является 1-β-D-глюкопиранозилом, или 2-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, a R2 является водородом, 1-P-D-глюкопиранозилом, 2-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, 2,3-бис(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, 2-(1-α-L-рамнопиранозил)-1-β-D-глюкопиранозилом, 2-(1-β-D-рамнопиранозил)-3-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, или 2-(1-β-D-ксилопиранозил)-3-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом.

в котором R1 является 1-β-D-глюкопиранозилом, или 2-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, a R2 является водородом, 1-P-D-глюкопиранозилом, 2-(1-P-D-глюкопиранозил)-1-β-D-глюкопиранозилом, 2,3-бис(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, 2-(1-α-L-рамнопиранозил)-1-β-D-глюкопиранозилом, 2-(1-α-L-рамнопиранозил)-3-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, или 2-(1-β-D-ксилопиранозил)-3-(1-β-D-копиранозил)-1-β-D-глюкопиранозилом, включающий этапы:
обеспечения кислого водного раствора соединения по формуле I:

в котором R1 является 1-β-D-глюкопиранозилом, или 2-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, a R2 является водородом, 1-β-D-глюкопиранозилом, 2-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, 2,3-бис(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, 2-(1-α-L-рамнопиранозил)-1-β-D-глюкопиранозилом, 2-(1-α-L-рамнопиранозил)-3-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, или 2-(1-β-D-ксилопиранозил)-3-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом; и
нагревания раствора до температуры в диапазоне от 30 до 90°С в течение периода времени более двух суток.

в котором R1 является 1-β-D-глюкопиранозилом, или 2-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, a R2 является 1-β-D-глюкопиранозилом, 2-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, 2,3-бис(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, 2-(1-α-L-рамнопиранозил)-1-β-D-глюкопиранозилом, 2-(1-α-L-рамнопиранозил)-3-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом, или 2-(1-β-D-ксилопиранозил)-3-(1-β-D-глюкопиранозил)-1-β-D-глюкопиранозилом.

Комментарии