Производные n-деацетилтиоколхицина и содержащие их фармацевтические композиции - RU2257379C2
Код документа: RU2257379C2
Описание
Данное изобретение относится к производным N-деацетилтиоколхицина или их изостерам формулы (I)
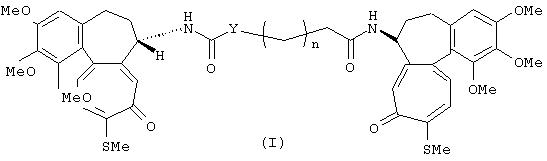
где:
n представляет целое число от 0 до 8;
Y представляет СH2 группу или, если n равно 1, может также быть группой NH.
Колхицины и тиоколхицины являются известными препятствующими росту соединениями, способными дестабилизировать микроканалы благодаря взаимодействию с тубулином.
Колхицин в настоящее время применяют в терапии подагры и родственных воспалительных заболеваний, но его применение ограничено острыми фазами из-за его высокой желудочно-кишечной токсичности.
Изучено большое число производных колхицина и тиоколхицина с точки зрения их возможного использования в качестве противоопухолевых медикаментов, но попытки исследований до сих пор были безуспешными вследствие очень ограниченных терапевтических показателей таких соединений.
Только одно производное колхицина, демеколцин, применяли в прошлом в клинике для лечения лейкемии, но со слабым успехом.
Обнаружено, что соединения формулы (I) оказывают антипролиферативное действие, в частности, на клетки, экспрессирующие фенотип MRD (резистентность ко многим лекарствам), с приблизительным отношением активности чувствительных клеток к активности резистентных клеток равном 1:1.
Соединения изобретения фактически обладают сильной антимитотической активностью и характеризуются благоприятным терапевтическим показателем, что делает их подходящими для терапевтического лечения различных форм опухолей, также как и дегенеративного ревматоидного артрита, заболевания, характеризующегося избыточной пролиферацией и аномальной миграцией лейкоцитов.
Соединения (I) имеют цитотоксичность, сравнимую с таковой наиболее эффективных противоопухолевых лекарственных средств, в то же время имея заметно более широкий спектр действия, в частности, против клеток, резистентных к известным лекарствам.
Соединения (I), где Y представляет СН2, получают реакцией N-деацетилтиоколхицина с реакционноспособными производными дикарбоновых кислот в сухих растворителях. Примерами подходящих реакционноспособных производных дикарбоновых кислот являются хлорангидриды, реакционноспособные ангидриды или сложные эфиры, в частности диэфиры N-гидроксиянтарной кислоты, получаемые реакцией указанной кислоты с N-гидроксисукцинимидом. Реакцию предпочтительно проводят в растворителях, таких как этиловый эфир, диоксан или тетрагидрофуран, в присутствии основания, например триэтиламина.
С другой стороны, соединения (I), где Y представляет NH и n равно 1, могут быть получены реакцией N-деацетилтиоколхицина с N-гидроксисукцинимидом в присутствии аминов и конденсирующих агентов, таких как дициклогексилкарбодиимид (ДЦГК), в подходящем апротонном растворителе, предпочтительно хлорированном углеводороде (метиленхлорид, хлороформ). Указанные соединения могут также быть получены в качестве побочных продуктов по реакции между N-гидроксисукциниловыми диэфирами дикарбоновых кислот и N-деацетилтиоколхицином.
Активность указанных соединений оценивали на широком спектре резистентных опухолевых клеток, экспрессирующих фенотип MRD; указанные соединения, в частности, показали активность на различных чувствительных (клеточных) линиях кишечника, экспрессирующих MRD.
Следующая таблица включает примеры активности этих двух соединений, по сравнению с биологической активностью тиоколхицина и таксола, взятых в качестве сравнительных соединений.
Цитотоксическую активность оценивали согласно М.С.Alley и др., Cfncer Research, 48, 589-601, 1998.
Вышеприведенные данные свидетельствуют о высокой цитотоксической активности соединений изобретения по отношению к обеим клеточным линиям и о различной резистентности клеточных линий к различным противоопухолевым лекарствам.
Таким образом, соединения изобретения применимы для лечения пролиферативных патологий и, в частности, опухолей различных органов, ревматоидного артрита или других дегенеративных патологий, где показаны антипролиферативное и противовоспалительное действия.
Для указанной цели соединения (I) вводят в форме фармацевтических композиций, пригодных для перорального, парентерального, подкожного или чрезкожного введения. Дозы соединений (I) находятся в интервале от 1 до 100 мг/м2 площади тела, в зависимости от пути введения. Соединения предпочтительно вводят перорально.
Примерами композиций являются капсулы, таблетки, ампулы, кремы, растворы, грануляты.
Следующие примеры более детально иллюстрируют изобретение.
ПРИМЕР 1
Получение соединений (I), где Y представляет СН2 и n равно 2 (тиокол 39)
100 мг N-деацетилтиоколхицина (мол.вес=373 г/моль, 0,27 ммоля) растворяют в 6 мл диоксана при комнатной температуре в атмосфере азота. Прибавляют 46 мг активированной адипиновой кислоты в виде N-гидроксисукцинилового диэфира (мол.вес=340 г/моль, 0,135 ммоля) и 40 мкл сухого триэтиламина (мол.вес=101 г/моль, d=0,726 г/мл, 0,27 ммоля). Смесь перемешивают при комнатной температуре в атмосфере азота 48 часов (контроль ТСХ: СНСl3:МеОН=95:5). Растворитель упаривают и продукт выделяют флэш-хроматографией на диоксиде кремния (элюент: СНСl3:МеОН=75:1).
Выход: 85%
ПРИМЕР 2
Получение соединения (I), где Y представляет NH и n равен 1 (тиокол 54)
Раствор 1 г деацетилтиоколхицина в 40 мл сухого СН2Сl2 объединяют с 154 мг N-гидроксисукцинимида, 276 мг ДЦГК и 476 мкл диизопропилэтиламина. Смесь кипятят с обратным холодильником под азотом по меньшей мере 2 дня. Ход реакции контролируют ТСХ (CH2Cl2-EtOH=95/5). Смесь концентрируют до небольшого объема и остаток извлекают этилацетатом. Продукт оставляют кристаллизоваться, затем очищают флэш-хроматографией (элюент AcOEt-гексан 7/3 или CH2Cl2-EtOH=95/5). Получают 500 мг продукта.
1Н-ЯМР (ДМСО-d6-300 МГц): 8,80 д; 7,82 шир.с; 7,75-7,60 с; 7,37; 7,18; 6,59% 4,66 м; 4,52 дд; 3,96 с ч.н.м.
13С-ЯМР (CDCl3): 182,5; 181, 9; 172,2; 158,0; 175,5; 157,1; 153,8; 153,7; 153; 152,3; 151,3; 151,2; 141,6; 141,5; 139,4; 139,3; 135,5; 135,5 д, 134,8; 134,7; 129,0; 128,4 (д).
Масс-спектр (m/z) 866,4 [(M+Na)+]
ПРИМЕР 3
Получение соединения (1), где Y означает СH2 и n равно 6 (тиокол 33)
200 мг N-деацетилтиоколхицина (мол. вес 373 г/моль, 0,54 ммоля) растворяют в 12 мл сухого диоксана при комнатной температуре в атмосфере азота. Прибавляют 91,8 мг активированной себациновой кислоты в виде N-гидроксисукцинилового диэфира (мол.вес=396 г/моль, 0,27 ммоля) и 75 мкл сухого триэтиламина (мол.вес=101 г/моль, d=0,726 г/мл, 0,54 ммоля). Смесь перемешивают при комнатной температуре в атмосфере азота 48 часов (контроль ТСХ: СНСl3:МеОН=95:5), затем через 20 часов нагревают до 50°С и растворитель упаривают. Сырой продукт реакции очищают флэш-хроматографией на диоксиде кремния (элюент: СНСl3:МеОН=40:1), получая 30 мг смеси целевого соединения (с Rf:=0,3) и соединения примера 2.
ПРИМЕР 4
Получение соединения (I), где Y представляет СН2 и n равно 0 (тиокол 43)
Способ А
190 мг N-деацетилтиоколхицина (мол.вес=373 г/моль, 0,512 ммоля) растворяют в 6 мл сухого диоксана при комнатной температуре в атмосфере азота. Прибавляют 80 мг активированной янтарной кислоты в виде N-гидроксисукцинилового диэфира (мол.вес=312 г/моль, 0,256 ммоля) и 70 мкл сухого триэтиламина (мол.вес=101 г/моль, d=0,726 г/мл, 0,512 ммоля). Смесь перемешивают при комнатной температуре в атмосфере азота 48 часов (контроль ТСХ: СНСl3:МеОН=95:5). Растворитель упаривают, остаток извлекают AcOEt для удаления остатков N-деацетилтиоколхицина и триэтиламина (продукт нерастворим).
Выход 45%
Способ В
100 мг N-деацетил-N-сукцинил-тиоколхицина (мол.вес=473 г/моль, 0,21 ммоля) растворяют в 8 мл сухого СН2Сl2 при комнатной температуре в атмосфере азота. Прибавляют 93 мг ВОР [гексафторфосфат бензотриазол-1-илокси-трис(диметиламино)-фосфония (мол.вес=442,3 г/моль, 0,21 ммоля) и 60 мкл сухого триэтиламина (мол.вес=101 г/моль, d=0,726 г/мл, 0,42 ммоля). Через 10 минут 80 мг N-деацетилтиоколхицина (мол.вес=101 г/моль, d=0,726 г/мл, 0,42 ммоля) прибавляют к смеси, которую перемешивают при комнатной температуре 48 часов (контроль ТСХ: CHCl3:MeOH=95:5), растворитель упаривают и остаток извлекают AcOEt для удаления остатков N-деацетилтиоколхицина и триэтиламина (продукт нерастворим).
Выход: 45%
Реферат
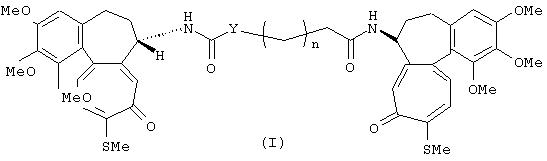
Настоящее изобретение относится к производным N-деацетилтиоколхицина формулы I

где n представляет целое число от 0 до 8; Y представляет СН2 группу или, если n равно 1, может также быть группой NH, которые обладают антипролиферативной активностью. Описаны также фармацевтические композиции на основе соединений формулы I. 2 н. и 2 з.п. ф-лы, 1 табл.
Формула

Комментарии