[(бензодиоксан, бензофуран или бензопиран)-алкиламино]-алкил-замещенные гуанидины в качестве селективных сосудосуживающих средств, способы их получения, промежуточное для них, фармацевтическая композиция и способ ее получения - RU2121999C1
Код документа: RU2121999C1
Чертежи











Описание
Изобретение относится к новым /бензодиоксин, бензофуран или
бензопиран/-алкил-замещенным гуанидинам формулы I

их фармацевтически приемлемым солям присоединения кислот и их стереохимически изомерным формам:
где
X обозначает O, CH2 или прямую связь;
R1 обозначает водород или C1-C6 - алкил;
R2 обозначает водород, C1-C6 - алкил, C3-C6 - алкенил или C3-C6 - алкинил;
R3 обозначает водород или C1-C6 - алкил; или
R2 и R3, взятые вместе, образуют двухвалентный радикал формулы -/CH2/m - где m = 4 или 5; или
R1 и R2, взятые вместе, образуют двухвалентный радикал формулы -CH=CH- или формулы /CH2/n-, где n = 2, 3 или 4; или
R3 может обозначать связь, когда R1 и R2, взятые вместе, образуют двухвалентный радикал формулы -CH=CH-CH=, -CH=CH-N= или -CH=N-CH=, где один или два атома водорода могут быть заменены галогеном, C1-C6-алкилом, C1-C6-алкоксилом, пиано-, аминогруппой, моно- или ди-/C1-C6-алкил/- аминогруппой, моно или ди-/C3-C6-циклоалкил/- аминогруппой, аминокарбонилом, /C1-C6-алкил>/- аминокарбониламиногруппой;
R4 обозначает водород или C1-C6 - алкил;
Alk1 обозначает двухвалентный C1-C3 - алкандиильный радикал,
A обозначает двухвалентный радикал формулы:

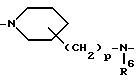

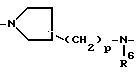

где каждый R5 обозначает водород или C1-C4- алкил;
R6 каждый обозначает водород или C1-C4- алкил;
Alk2 обозначает C2-C15 - алкандиил или C5-C7- циклоалкандиил; и каждый p = 0, 1 или 2; и
R7 и R8, каждый, независимо друг от друга, обозначают водород, галоген, C1-C6- алкил, гидроксил, C1-C6 - алкилокси, цианогруппу, амино- /C1-C6 -алкил, карбоксил, C1-C6 - алкил оксикарбонил, нитро-, аминогруппу, аминокарбонил, /C1-C6 -алкил/ - карбониламино; или моно- или ди-/C1-C6-алкил/ - аминогруппу;
при условии, что исключается [2-[/2,3 - дигидро-1, 4-бензодиоксин-2-ил/-метил]-амино]-этил-гуанидин.
Известны /EP N 3387771/ производные бензопирана, которые проявляют ингибиторную активность на реакцию Maillard и обладают противоокислительным действием.
Известен также arZneim-Forsch 25 /9/, с. 1404 /1975/ [2-[/2,3-дигидро-1,4-бензодиоксин-2-ил/-метил] -амино] -этил- гуанидин, использующийся для снижения уровня норадреналина В ВОИС- 83/03607 описывается некоторое число цианогуанидинов, обладающих антигипертензной и сосудорасширяющей активностью.
Задачей настоящего изобретения является создание новых соединений, обладающих селективной сосудосуживающей активностью, позволяющих формировать композиции для лечения состояний, связанных с расширением сосудов (гипотонии, венозной недостаточности и головной боли). Поставленная задача решается новыми соединениями общей формулы I.
Соединения формулы /1/, где R2, R3 или R6 обозначают водород, также могут существовать в их таутомерных формах. Такие формы входят в рамки настоящего изобретения.
В качестве используемого в вышеупомянутых определениях, галоген обозначает фтор, хлор, бром и йод; C1-C4-алкил обозначает с линейной и разветвленной цепью насыщенные углеводородные радикалы с 1-4 C-атомами, такие как, например, метил, этил, пропил, бутил, 1-метилэтил, 2-метилпропил, т.п.
C1 - C6-алкил обозначает C1-C4- алкил и его высшие гомологи с 5-6 C-атомами, такие как, например,
пентил, гексил, 1-метилбутил, и т.п.; C3-C6- алкенил обозначает с линейной и разветвленной цепью углеводородные радикалы, содержащие одну двойную связь и имеющие 3-6 C-атомов,
такие как например, 2-пропенил, 3-бутенил, 2-бутенил, 2-пентенил, 3-пентенил, 3-метил-2-бутенил, и т.п., причем атом углерода вышеупомянутого C3 - C6- алкенила, связанный с
атомом азота, предпочтительно насыщенный; C3- C6- алкинил обозначает с линейной и разветвленной цепью углеводородные радикалы, содержащие одну тройную связь и имеющие 3-6
C-атомов, такие как например, 2-пропинил, 3-бутинил, 2-бутинил, 2-пентинил, 3-пентинил, 3-гексинил, и т.п., причем атом углерода вышеупомянутого C3 - C6 - алкинильного радикала,
связанного с атомом азота, предпочтительно насыщенный, C3 - C6 - циклоалкил обозначает циклопропил, циклобутил, циклопентил и циклогексил;
C1 - C3
алкандиил обозначает двухвалентные, с линейной и разветвленной цепью насыщенные углеводородные радикалы с 1-3 C-атомами, такие как например, метандиил, 1,2-этандиил, 1:3-пропандиил, 1,2-пропандиил, и
т.п.; C2 - C15 - алкандиил обозначает двухвалентные, с линейной и разветвленной цепью, насыщенные углеводородные радикалы с 2-15 C-атомами, такие как, например, 1,2 - этандиил, 1,
3 - пропандиил, 1,4 - бутандиил, 1,5 - пентандиил, 1,6 - гександиил, 1,7 - гептандиил, 1,8 - октандиил, 1.9 - нонандиил, 1,10 - декандиил, 1,11 - ундекандиил, 1,12 - додекандиил, 1,13 - тридекандиил,
1,14 - тетрадекандиил, 1,15 - пентадекандиил, и их разветвленные изомеры; C5 - C7 - циклоалкандиил обозначает двухвалентные, циклические, насыщенные углеводородные радикалы,
такие как, например, 1,2-циклопентандиил, 1,3-циклопентадиил, 1,2-циклогександиил, 1,3-циклогександиил, 1,4-циклогександиил, 1,2-циклогептандиил, 1,3-циклогептандиил, 1,4-циклогептандиил.
Фармацевтически приемлемые соли присоединения кислот включают терапевтически активные нетоксичные формы солей присоединения кислот, которые способны образовывать соединения формулы /1/. Последние могут быть получены путем обработки основной формы соединений 1 соответствующими кислотами, как неорганические кислоты, например, как галогенводородные кислоты, например, соляная кислота, бромоводородная кислота и т.п.; серная кислота, азотная кислота, фосфорная кислота и т.п.; или органические кислоты, например, как уксусная, пропановая, гидроксиуксусная, 2-гидроксипропановая, 2-оксопропановая, щавелевая кислота, пропандикислота, бутандикислота, /Z/-2-бутендикислота, /E/-2-бутендикислота, 2-гидроксибутандикислота, 2,3-дигидросибутандикислота, 2-гидрокси-1,2, 3-пропантрикарбоновая кислота, метансульфокислота, этансульфокислота, бензолсульфокислота, 4-метил-бензолсульфокислота, циклогексансульфокислота, 2-гидроксибензойная кислота, 4-амино-2-гидрокси-бензойная кислота и тому подобные кислоты. Наоборот, солевая форма путем обработки с помощью щелочи может быть превращена в форму свободного основания.
Термин "соль присоединения" также включает гидратные формы и формы присоединения растворителя, которые способны образовывать соединения формулы /1/. Примерами таких форм являются, например, гидраты, алкоголяты и т.п.


где
R3 в особенности обозначает водород или метил.
Последние циклические составляющие могут быть незамещены или замещены, предпочтительно, галогеном, особенно йодом; C1-C6 - алкилом, особенно метилом C1 - C6 - алкоксилом, особенно метокси - группой, цианогруппой; аминогруппой; ди-/C1 - C6 -алкил/-аминогруппой, особенно диметиламиногруппой; или аминокарбонилом.
Представляющими интерес соединениями являются такие соединения формулы /I/, где Alk1 обозначает - CH2-CH2- или -CH2-, особенно - CH2-.
Также представляют интерес такие соединения формулы /I/, где R4 обозначает водород или C1-C4-алкил, особенно метил.
Далее, представляют интерес такие соединения формулы /I/, где X обозначает - CH2- и где R7 и R8, каждый, независимо друг от друга, обозначают водород; галоген, предпочтительно фтор, хлор или бром; C1-C6-алкил, предпочтительно метил, этил, пропил или бутил; C1 -C6-алкоксил, предпочтительно метоксигруппу; гидроксил; цианогруппу; аминогруппу; амино-/C1-C6/-алкил, предпочтительно аминометил; /C1-C6 -алкил/ - карбониламиногруппу, предпочтительно метилкарбониламиногруппу; или нитрогруппу.
Другими, представляющими интерес соединениями являются такие соединения формулы /I/, где X = 0
и где R7 и R8, каждый, независимо друг от друга, обозначают водород, галоген, предпочтительно фтор, хлор, бром;
C1-C6-алкил, предпочтительно метил
или этил; C1-C6-алкоксил, предпочтительно метоксигруппу; гидроксил; циано- или нитрогруппу.
Также представляющими интерес соединениями являются такие соединения, где X обозначает прямую связь и где R7 и R8, каждый, независимо друг от друга, обозначают водород; галоген, предпочтительно фтор, хлор или бром; или C1-C6 -алкил, предпочтительно метил или этил.
Особыми соединениями являются такие соединения формулы /I/, где A обозначает радикал формулы /а/; Alk2 обозначает C2-C15-алкандиил, особенно C2-C10-алкандиил, преимущественно C2-C6-алкандиил, предпочтительно 1,3-пропандиил; R5 обозначает водород или метил; и R6 обозначает водород или метил.
Далее, предпочтительными соединениями являются такие соединения формулы /I/, где A обозначает радикал формулы /b/ или /c/, "p" = 0, 1 или 2, особенно 0 или 1, предпочтительно 1; и где R5 и R6, каждый, независимо друг от друга, обозначают водород или метил.
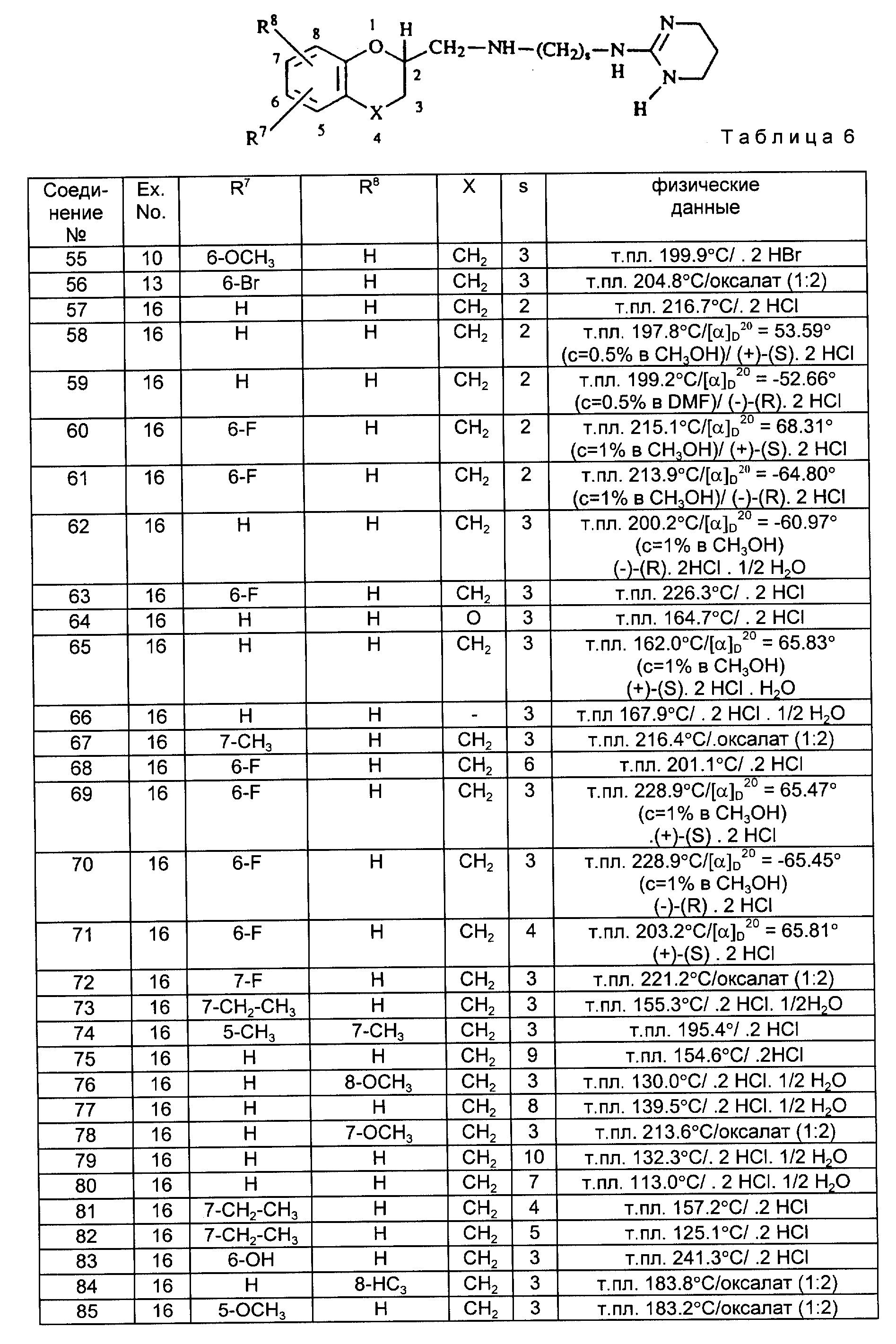
Особенно интересными являются такие
соединения, где абсолютная конфигурация атома углерода в положении 2 в формуле /I/, указанная с помощью звездочкой /x/, такая, как представлено в нижеприведенной формуле:
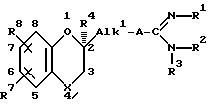
Особенно интересными соединениями являются такие, которые имеют заместители в 7- или 8-положении как определено в формуле /I/ бензодиоксановой, бензофурановой или бензопирановой составляющей.
Предпочтительными соединениями являются такие соединения формулы /I/, где X обозначает -CH2-; R7 и R8, каждый, независимо друг от друга, обозначают водород, галоген, C1-C4-алкил, C1-C4-алкоксил, гидроксил, или цианогруппу, особенно, когда замещена в 7- или 8-положении бензопирановая составляющая и где A обозначает радикал формулы /a/, где Alk2 обозначает C2-C10-алкандиил иил R5 и R6, каждый, независимо друг от друга, обозначают водород.
Наиболее предпочтительными соединениями являются N-[/3,4-дигидро-2H-1-бензопиран-2-ил/метил-] N'/1, 4,5,6-тетрагидро-2- пиримидинил/-1,3/-пропандиамин, его стереохимические изомеры, особенно R - изомер, и его фармацевтически приемлемые соли присоединения кислот.
Термин "стереохимически изомерные формы" обозначают все возможные изомерные формы, которые могут иметь соединения формулы /I/. Если не указано особенно, химическое название соединений означает смесь всех возможных стереохимически изомерных форм, причем вышеуказанные смеси включают все диастереомеры и энантиомеры основной молекулярной структуры. Преимущественно, стереогенные центры могут иметь R- или S-конфигурацию; заместители двухвалентных насыщенных циклических углеводородных радикалов могут иметь или цис-, или транс-конфигурацию и C3-C6-алкенильные радикалы могут иметь E или Z-конфигурации. Стереохимически изомерные формы соединений формы /I/ также входят в рамки настоящего изобретения.
Соединения формулы /I/ получают путем взаимодействия диамина формулы /II/, где A, R4, R7 и R8 имеют указанные в формуле /I/ значения, с реагентом формулы /III/, где R1, R2 и R3 имеют указанные в формуле /I/ значения, а W1 обозначает реакционно-способную удаляемую группу, такую, как, например, галоген, например, хлор, бром, алкоксил, например, метоксигруппа, этоксигруппа, и т. п.; арилоксигруппа, например, феноксигруппа и т.п.; алкилтиогруппа, например, метилтио-, этилтиогруппа и т.п.; арилтиогруппа, например, бензилтиогруппа, и т.п.

Вышеуказанную реакцию можно осуществлять путем перемешивания диамина формулы /II/ с реагентом формулы /III/ в соответствующем растворителе, таком, как, спирт, например, метанол, этанол, пропанол и т.п.; галогенированный углеводород, например, дихлорметан, трихлорметан и т.п. или простой эфир, например, диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, 1,4-диоксан и т. п. ; ароматический углеводород, например, бензол, толуол, ксилол и т.п. Для связывания кислоты, которая может образовываться в процессе реакции, необязательно можно добавлять основание, такое, как, например, карбонат щелочного металла, например, карбонат натрия или калия; кислый карбонат щелочного металла, например, кислый карбонат натрия или калия; соответствующее органическое основание, например, N,N-диэтилэтанамин, пиридин, N-/1-метилэтил/-2-пропанамин, и тому подобные основания. Повышенные температуры могут увеличивать скорость реакции. Предпочтительно реакции проводят при температуре кипения реакционной смеси с обратным холодильником.
Соединения формулы /I/ также можно получать путем восстановительного N-алкилирования аминопроизводного формулы /VI/ с помощью соответствующего альдегида формулы /V/, где "r"=0,1 или 2.

Вышеуказанную реакцию осуществляют путем перемешивания реагентов в соответствующем растворителе, таком, как, спирт, например, метанол, этанол, пропанол и т.п.; простой эфир, например, диэтиловый эфир, тетрагидрофуран, 1,4-диоксан и т. п. ; ароматический растворитель например, бензол, толуол, ксилол, и т. п. Необязательно можно использовать водопоглотитель, для удаления воды, образующейся в процессе протекания реакции. Полученный в результате имин затем можно восстанавливать путем каталитического гидрирования в присутствии соответствующего катализатора, такого, как, например, палладий-на-угле, палладий-на-сульфате бария, платина-на-угле, никель Ренея и т. п. в пригодном растворителе, таком, как спирт, например, метанол, этанол и т. п. ; простой эфир, например, тетрагидрофуран, 1,4-диоксан и т.п.; сложный эфир карбоновой кислоты, например, этилацетат, бутилацетат и т.п.; или карбоновая кислота, например, уксусная кислота, пропионовая кислота и т.п. Необязательно реакцию можно осуществлять при повышенных температурах и/или давлениях.
Промежуточный альдегид формулы /V/ можно получать путем восстановления ацильного производного формулы /V/, где "r" имеет указанное выше значение и V обозначает галоген, например, хлор, бром. Ацилгалогенид может быть получен путем взаимодействия кислоты формулы /IV/, где V=OH, с галогенирующим реагентом, таким, как тионилхлорид, трихлорид фосфора, трибромид фосфора, оксалилхлорид и т.п. Последняя реакция может быть осуществлена в избытке галогенирующего реагента или в соответствующих растворителях, таких, как, например, галогенированные углеводороды, например, как дихлорметан, хлороформ и т. п., ароматические углеводороды, например, как бензол, толуол, ксилол и т. п. ; простые эфиры, например, как диэтиловый эфир, тетрагидрофуран, 1,4-диоксан и т.п. или диполярные апротонные растворители, например, как N,N-диметилформамид, N, N-диметилацетамид, и т.п. Перемешивание и повышение температуры способствуют повышению скорости реакции.
Вышеуказанное восстановление ацилгалогенида формулы /IV/, например, можно осуществлять путем каталитического гидрирования в присутствии катализатора, такого, как палладий-на-угле, палладий-на-сульфате бария, платина-на-угле, и т. п.; в соответствующих растворителях, таких, как например, простые эфиры, например, диэтиловый эфир, тетрагидрофуран, 1,4-диоксан и т. п.; предпочтительно с примесью диполярного апротонного растворителя, такого, как, например, N, N-диметилформамид, N,N-диметил-ацетамид и т.п. Необязательно можно добавлять каталитический яд, такой, как тиофен, хинолин-сера и т. п. Последовательность реакций, исходя из промежуточного альдегида формулы /IV/, до получения соединений формулы /I/, можно осуществлять в одном резервуаре.
Соединения формулы /I/ также можно получать путем N-алкилирования амина формулы /VI/ с помощью промежуточного соединения формулы /VII/, где W2 представляет собой реакционноспособную удаляемую группу, такую, как, например, галоген, например, хлор, бром или йод, сульфонилоксигруппа, например, метансульфонилокси-, бензолсульфонилокси-, толуолсульфонилоксигруппа, и т.п. ; в соответствующих растворителях, таких, как кетоны, например, 2-пропанон, 2-бутанон, и т.п.; простые эфиры, например, диэтиловый эфир, тетрагидрофуран, 1,4-диоксан и т.п.; ароматические углеводороды, например, бензол, толуол и т.п.; диполярные апротонные растворители, например, N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид и т.п.

Перемешивание и нагревание могут увеличивать скорость реакции. Необязательно, для связывания образующейся во время протекания реакции кислоты можно добавлять пригодное основание, такое, как, например, карбонат щелочного металла, например, карбонат натрия, карбонат калия; кислый карбонат щелочного металла, например, кислый карбонат натрия, кислый карбонат калия, и т. п. соответствующее органическое основание, например, N,N-диэтилаэтанамин, пиридин и т.п.
Соединения формулы /I/, где A обозначает двухвалентный радикал формулы /a/ и R5 обозначает водород, причем вышеуказанные соединения обозначаются формулой /I-a/, могут
быть получены путем дебензилирования промежуточного соединения формулы /VIII/:
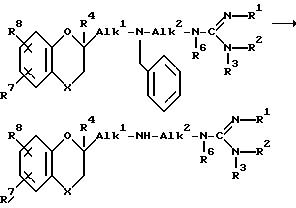
Вышеуказанное дебензилирование можно осуществлять согласно само по себе известным способам, таким, как каталитическое гидрирование при использовании соответствующих катализаторов, например, как платина-на-угле, палладий-на-угле, в соответствующих растворителях, таких, как спирты, например, метанол, этанол, -2-пропанол и т.п.; простые эфиры, например, диэтиловый эфир, тетрагидрофуран, диизопропиловый эфир и т.п. При необходимости можно применять повышенные температуры и давления.
Соединения формулы /I/, где R1 обозначает водород, причем вышеуказанные соединения представлены
формулой /I-b/, можно получать путем гидролиза промежуточных цианогуанидинов формулы /IX-a/:

Вышеупомянутый гидролиз можно осуществлять путем перемешивания промежуточного цианогуанидина формулы /IX-a/ в присутствии кислоты, такой, как, неорганическая кислота, например, соляная кислота, бромводородная кислота, серная кислота и т.п.; или органическая кислота, например, как уксусная кислота, муравьиная кислота, и т.п.; необязательно с примесью соответствующего растворителя, такого, как, спирт, например, метанол, этанол, пропанол и т.п. ; простой эфир, например, диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, 1,4-диоксан, и т.п. В процессе этого гидролиза может образовываться промежуточное соединение /IX-b/. Вышеупомянутое промежуточное соединение формулы /IX-b/ прежде можно выделить и далее гидролизовать с получением соединений формулы /I/.
Соединения формулы /I/ также можно превращать во всякие другие за счет превращений функциональной группы.
Например, соединения формулы /I/, где


Это восстановление можно осуществлять одновременно с дебензилированием, указанным выше в описании синтеза соединений формулы /I-a/.
Далее, соединения формулы /I/ с C3-C6-алкинильной группой или C3-C6-алкенильной группой можно превращать в соответствующие соединения с C1-C6-алкильной группой согласно известного рода способам гидрирования. Соединения формулы /I/ с цианогруппой можно превращать с соответствующие соединения, содержащие аминометильный заместитель, согласно известного рода способам гидрирования. Соединения с алкоксильным заместителем можно превращать в соединения с гидроксильной группой путем обработки алкокси-соединения с помощью соответствующего кислого /кислотного/ реагента, такого, как, например, галогенводородная кислота, например, бромводородная кислота, или трибромид бора, и т.п. Соединения, содержащие амино-заместитель, можно N-ацилировать или N-алкилировать согласно известного рода способам N-ацилирования или N-алкилирования.
Некоторые промежуточные и исходные материалы представляют собой известные соединения, которые можно получать в соответствии с известными методиками получения и, некоторые же промежуточные соединения являются новыми.
Промежуточные соединения формулы /II/, где A обозначает радикал формулы /a/ и R6 обозначает водород, причем вышеуказанные промежуточные соединения обозначаются формулой /II-a/, можно получать путем восстановления нитрила формулы /X/, где q=1-14, при известных условиях восстановления. Вышеупомянутое восстановление, например, можно осуществлять путем каталитического гидрирования при использовании соответствующего катализатора, такого, как, например, никель Ренея, палладий-на-угле, палладий-на-сульфате бария и т.п.; в соответствующем растворителе, таком, как спирт, например, метанол, этанол, пропанол и т.п.; простой эфир, например, диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, и т.п. или смесь таких растворителей.
Предпочтительно восстановление осуществляют в присутствии аммиака. При необходимости можно использовать высокие температуры или давления.

Вышеуказанное восстановление также можно осуществлять путем перемешивания нитрила с восстановителем, таким, как боран, литийалюминийгидрид, и т. п., в соответствующем растворителе, таком, как простой эфир, например, диизопропиловый эфир, тетрагидрофуран, 1,4-диоксан и т.п.; или углеводород, например, пентан, гексан и т.п.; ароматический растворитель, например, бензол, толуол, ксилол и т.п. При необходимости можно использовать повышенные температуры для увеличения скорости реакции.
Промежуточные соединения формулы /X/ можно получать путем взаимодействия амина формулы /XI/ с реагентом формулы /XII/, где W2 и q имеют вышеуказанное значение, в соответствующем растворителе, таком, как диполярный апротонный растворитель, например, N,N-диметилформамид, диметилсульфоксид, ацетонитрил и т.п.; ароматический растворитель, например, бензол, толуол, ксилол и т.п.; кетон, например, 2-пропанон, 4-метил-2-пентанон и т.п.; простой эфир, например, диэтиловый эфир, тетрагидрофуран, 1,4-диоксан и т.д.
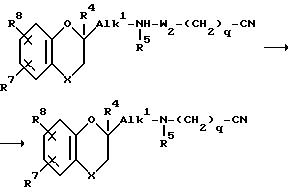
Для связывания кислоты, которая образуется в процессе протекания реакции, можно добавлять основание, как указано при получении соединения формулы /I/ из промежуточных соединений формулы /II/ и формулы /III/. Перемешивание и повышенные температуры могут повышать скорость реакции. R5 промежуточного амина может также обозначать бензил. Эту защитную группу затем можно удалять в более поздней стадии синтеза.
Для получения промежуточных соединений формулы /X/, где q=2, причем вышеуказанные промежуточные соединения обозначаются формулой /X-a/, алкилирование можно проводить перемешиванием амина формулы /XI/ с 2-пропеннитрилом в соответствующем растворителе, таком, как, спирт, например, метанол, этанол, пропанол и т.п.; простой эфир, например, диэтиловый эфир, тетрагидрофуран, 1,4-диоксан и т.п.
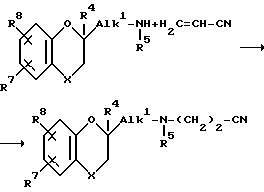
Повышенные температуры увеличивают скорость реакции. Предпочтительно реагенты перемешивают при температуре кипения с обратным холодильником реакционной смесью.
Промежуточные соединения формулы /XX-a/, где R4, R7, R8, X Alk1 имеют вышеуказанное значение и A обозначает двухвалентный радикал формулы /a/, /c/, /d/, /e/, и где R2 обозначает водород, C1-C6 - алкил, C3 - C6 - алкенил или C3-C6-алкинил, и R3 обозначает водород или C1-C6 - алкил, или R2 и R3, взятые вместе, образуют двухвалентный радикал формулы - /CH2/m - где m 4 или 5, являются новыми.
Промежуточные соединения формулы /IX-а/ можно получать путем взаимодействия промежуточного соединения формулы /II/ с реагентом формулы /XIII/, где W1 обозначает реакционноспособную удаляемую группу, как определено в формуле /III/.

Вышеуказанную реакцию можно осуществлять путем перемешивания реагентов в соответствующем растворителе, таком, как спирт, например, метанол, этанол и т.п.; галогенированный углеводород, например, дихлорметан, хлороформ, и т.п. ; ароматический растворитель, например, бензол, толуол, ксилол и т.п.; диполярный апротонный растворитель, например, N.N-диметилформамид, N.N-диметилацетамид и т.п. Необязательно, для связывания кислоты, которая образуется в процессе осуществления реакции, можно добавлять основание, как указано при получении соединений формулы /I/ из промежуточных соединений формулы /II/ и формулы /III/. Предпочтительно реакцию проводят при комнатной температуре.
Промежуточные соединения формулы /XIII/ можно получать путем взаимодействия цианамида формулы /XIV/, где W1 имеет указанное в формуле /III/ значение, в амином формулы /XV/.
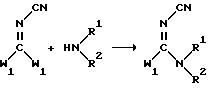
Вышеуказанную реакцию можно осуществлять путем перемешивания реагентов в инертном растворителе, таком, как, галогенированный углеводород, например, дихлорметан, хлороформ и т.п.; ароматический растворитель, например, бензол, толуол и т.п.; простой эфир, например, диэтиловый эфир, тетрагидрофуран, 1,4 - диоксан и т.п. Необязательно, для связывания образующейся в процессе реакции кислоты можно добавлять основание. Соответствующими основаниями являются карбонаты или кислые карбонаты щелочных или щелочноземельных металлов.
Например, как карбонат натрия, гидрокарбонат натрия, карбонат калия, и т.п. Повышенные температуры могут увеличивать скорость реакции.
Чистые стереохимически изомерные формы соединений настоящего изобретение можно получать известными способами.
Диастероизомеры можно разделять физическими методами разделения, такими, как селективная кристаллизация и хроматографические методы, например, как жидкостная хроматография. Энантиомеры можно отделять один от другого путем селективной кристаллизации их диастереоизомерных солей с оптически активными кислотами. Вышеупомянутые чистые стереохимически изомерные формы также можно получать из соответствующих чистых стереохимически изомерных форм соответствующих исходных материалов, при условии, что реакция протекает стереоспецифически. Предпочтительно, если желателен специфический стереоизомер, вышеуказанное соединение можно синтезировать путем стереоспецифических способов получения. В этих способах предпочтительно используют энантиомерно чистые исходные материалы. Стереохимически изомерные формы соединений формулы /I/ также являются предметом настоящего изобретения.
Соединения формулы /I/, их фармацевтически приемлемые соли присоединения кислот и их стереохимически изомерные формы обладают интересными фармакологическими свойствами: они проявляют 5 HT1 - и т.п. агонистическую активность. Соединения настоящего изобретения обладают сильной и селективной сосудосуживающей активность. Они пригодны для лечения состояний, которые связаны с расширением (кровеносных) сосудов. Например, они пригодны для лечения состояний, характеризующихся или ассоциированных с головными болями, например, как мигрень, сильная головная боль и головная боль, связанная с сосудистыми расстройствами. Эти соединения также пригодны для лечения венозной недостаточности и для лечения состояний, связанных с гипотонией.
Сосудосуживающую активность соединений формулы /I/ можно определять при использовании теста ин витро, как описанный в "Instantaneous chauges of alpha-adrenoreceptor offinity caused by moderate cooling in cauine cutaneous Veins /"Мгновенные изменения средства к альфа-адренорецептору, вызываемые умеренным охлаждением, в кожных кровеносных сосудах собаки"] в American Journal of Phusiology, 234/4/, H 330-H, 337, 1978, или в тесте, описанном в фармакологическом примере, где подобный серотонину ответ соединений настоящего изобретения испытывают на основных артериях поросят /pigs/ Новые промежуточные соединения формулы /IX-a/, как указанные выше, обладают подобной фармакологической активностью.
Принимая во внимание их полезные фармакологические свойства, являющиеся предметом изобретения соединения могут быть сформулированы в виде различных фармацевтических форм для целей введения. Для приготовления фармацевтических композиций настоящего изобретения, эффективное количество индивидуального соединения, в основной форме или в форме соли присоединения кислоты, в качестве активного ингредиента, комбинируют, при тщательном перемешивании, с фармацевтически приемлемым носителем, причем носитель в зависимости от желательной для введения формы препарата. Эти фармацевтические композиции желательно находятся в унитарной дозировочной форме, пригодной, предпочтительно, для введения орально, ректально /кишечно/, подкожно или путем парентеральной инъекции. Например, при приготовлении композиций в оральной дозировочной форме, могут быть использованы любые из обычных фармацевтических сред, такие как, например, вода, гликоли, масла, спирты и подобные, в случае оральных жидких препаратов, таких, как суспензия, сиропы, эликсиры и растворы; или твердые носители, такие как крахмалы, сахара, каолин, смазка, связующие, дезинтегрирующие агенты и подобные, в случае порошков, пилюль, капсул и таблеток. Вследствие легкости введения, таблетки и капсулы представляют собой наиболее предпочтительную оральную единичную дозировочную форму, в случае которой обычно применяют твердые фармацевтические носители. Для парентеральных композиций, носитель обычно включает стерильную воду, по крайней мере большей частью, хотя, например, для способствования растворимости могут быть включены другие ингредиенты. Например, можно приготовлять растворы для инъекций, в которых носителем является солевой раствор, глюкозный раствор или смесь солевого и глюкозного растворов. Также можно приготовлять суспензию для инъекции, для этого используют соответствующие жидкие носители, суспендирующие агенты и т.п. В пригодных для подкожного введения композициях носитель необязательно включает усиливающий пенетрацию агент и/или пригодный смачиватель, необязательно комбинированный с пригодными добавками любой природы в незначительных количествах, причем добавки не должны вызывать значительного вредного воздействия на кожу. Вышеуказанные добавки могут облегчать введение под кожу и/или могут быть полезны для приготовления желательных композиций. Эти композиции можно вводить разными путями, например, в виде трансдермального пластыря, в виде растирки, в виде мази. Особенно предпочтительно формулировать вышеуказанные фармацевтические композиции в единичной дозировочной форме для облегчения введения и единообразии дозировки. Единичная дозировочная форма, как используемая здесь в описании и формуле изобретения, относится к физически дискретным единицам, пригодным в качестве унитарных доз, причем каждая единица содержит заданное количество активного ингредиента в расчете на получение желательного терапевтического эффекта, в ассоциации с необходимым фармацевтическим носителем. Примерами таких единичных дозированных форм являются таблетки включая таблетки с насечками или таблетки в оболочке, капсулы, пилюли, упаковки порошков, облатки, растворы для инъекции или суспензии для инъекций, препараты для приема по полной чайной или столовой ложке, и т.п., и их отдельные множества.
Следовательно, соединения настоящего изобретения могут быть использованы в качестве лекарственных средств для лечения состояний, связанных с расширением сосудов, более конкретно гипотонии, венозной недостаточности и особенно головной боли, в том числе мигрени. Соединения изобретения также пригодны для лечение теплокровных животных, страдающих от состояний, связанных с расширением сосудов, таких, как гипотония, венозная недостаточность и особенно головная боль, в том числе мигрень, путем введения эффективного количества соединения формулы /I/, его фармацевтически приемлемой соли присоединения кислоты или его стереоизомерной формы. Специалист может легко определить эффективное количество из результатов теста, представленного ниже. Обычно предполагают, что эффективное количество должно составлять от 1 мкг/кг до 1 мг/кг веса тела, и, в особенности, 2-200 мкг/кг веса тела. Может быть пригодным введение необходимой дозы в виде двух, трех, четырех или более частичных доз в соответствующие интервалы времени в течение дня. Вышеуказанные частичные дозы могут быть сформулированы в виде единичных дозировочных форм, например, содержащих 0,005-20 мг и в особенности 0,1 - 10 мг активного ингредиента на единичную дозировочную форму.
Следующие примеры предназначены для иллюстрации и не ограничивают рамок изобретения во всех его аспектах.
Экспериментальная часть
A. Получение
промежуточных соединений
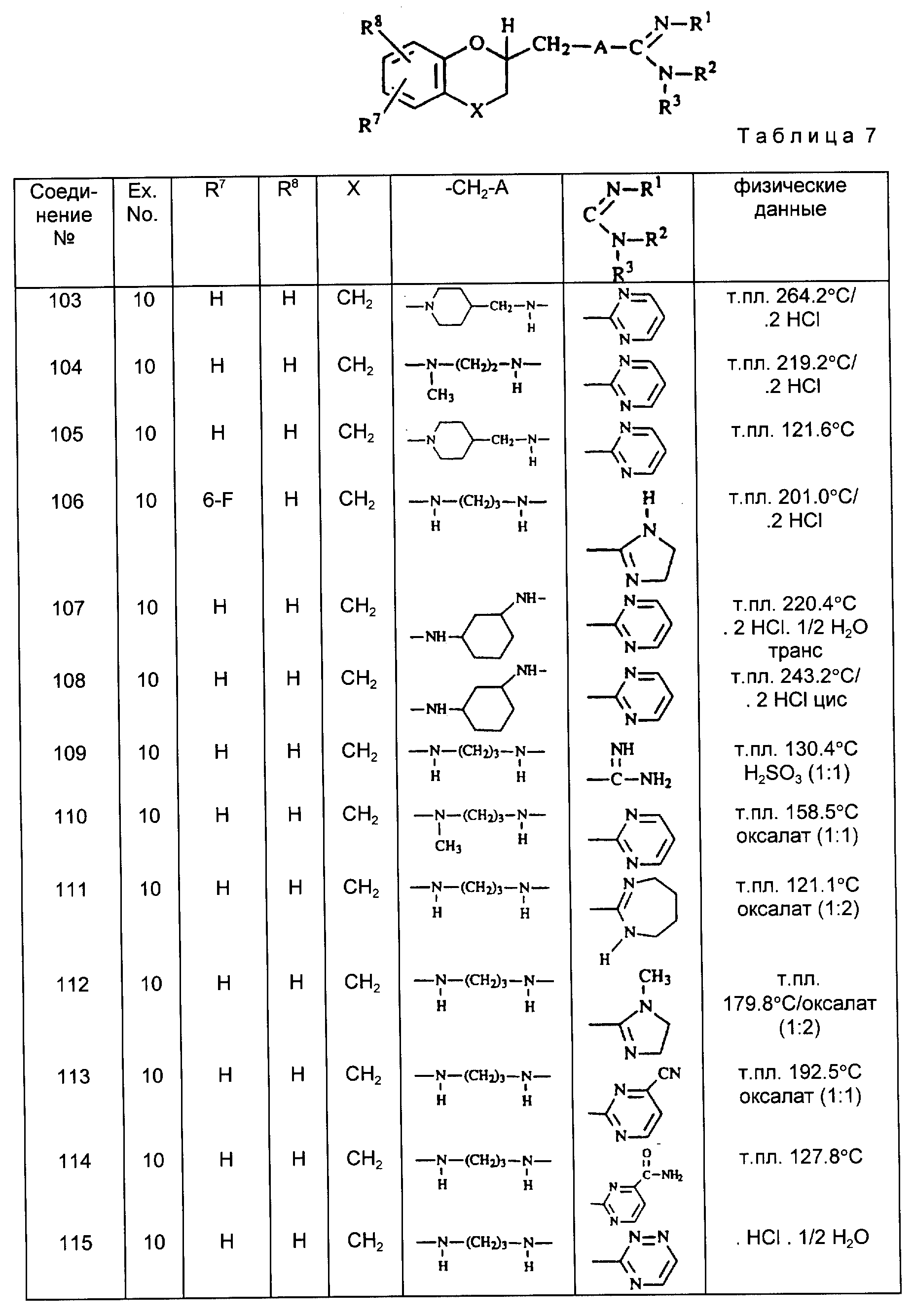
Пример 1.
a) К перемешиваемому и охлаждаемому (0oC) раствору 32,8 г 3,4-дигидро-2H-1-бензопиран-2-метанола в 71 мл пиридина и 135 мл бензола прикапывают раствор 41,9 г 4-метил-бензолсульфонилхлорида в 72,5 мл бензола. По окончании добавления перемешивание продолжают в течение 25 ч. Реакционную смесь промывают последовательно раствором соляной кислоты (10%-ным), водой и раствором карбоната натрия (10%-ным) органический слой сушат, отфильтровывают и выпаривают. Остаток очищают путем колоночной хроматографии [силикагель: CHCl3, 100%].
Элюент желательной фракции выпаривают, получая 28,3 г {3,4 - дигидро-2H-1-бензопиран-2-метил} -4-метилбензолсульфоната /сложный эфир/ в виде твердого остатка. Т.пл. 59,4oC (промежуточное соединение). Подобным образом также получают { 6-фтор-3,4-дигидро-2H-1-бензопиран-2-метил} -4- метилбензолсульфонат /сложный эфир/ (промежуточное соединение 2).
б) Смесь 7,7 г промежуточное соединение /1/, 5,3 г бензолметанамина, 5 г карбоната натрия и 250 мл 4-метил-пентанона перемешивают и кипятят с обратным холодильником, используя водоотделитель. Реакционную смесь охлаждают и промывают водой. Органическую фазу сушат, отфильтровывают и выпаривают. Остаток очищают путем колоночной хроматографии (силикагель, CHCl3 /CH3OH = 90; 10). Элюент целевой (желательной фракции выпаривают и остаток превращают в оксалат (соль) в этаноле. Соль отфильтровывают и суспендируют в 2-пропаноне. Продукт отфильтровывают и сушат, получая 1,16 г (19,5%) 3,4-дигидро-N-(фенилметил)-2H-1-бензопиран-2-метанамин-оксалат (1: 1) (промежуточное соединение 3).
Подобным образом также получают 2, 3-дигидро-N-(фенилметил)-1,4-бензодиоксин-2-метанамин (промежуточное соединение 4).
Пример 2. В европейском патенте 0145067 описывается синтез (+)-6-фтор-3, 4-дигидро-2H-1-бензопиран-2-карбоновой кислоты (промежуточное соединение 5).
a) К перемешиваемой и нагреваемой (+80oC) смеси 49,05 г промежуточного соединения /5/ и 244 мл толуола прикапывают, в течение 85 мин, 54 мл тионилхлорида. По окончании добавления, перемешивание продолжают в течение 2 ч при 80oC. После охлаждения до комнатной температуры, реакционную смесь выпаривают. Остаток обрабатывают толуолом и растворитель снова выпаривают, получая 60.4 г (100%) (+)-(S)-6-фтор-3,4-дигидро-2H-1-бензопиран-2-карбонил-хлорида в виде остатка (промежуточное соединение 6).
б) Смесь 46,9 г промежуточного соединения /6/ в 60 мл N,N-диметилацетамида и 350 мл диизопропилового эфира гидрируют в присутствии 3 г палладия-на-угле в качестве катализатора (10%) и 5 мл раствора тиофена в метаноле (4%-ного). После поглощения рассчитанного количества водорода катализатор отфильтровывают и фильтрат добавляют к смеси 25 г бензолметанамина, 20 г ацетата калия и 300 мл метанола. Эту смесь снова гидрируют в присутствии 3 г палладия-на-угле в качестве катализатора (10%-ного) и 3 мл раствора тиофена в метаноле (4%-ного). После поглощения рассчитанного количества водорода, катализатор отфильтровывают и фильтрат выпаривают. Остаток выливают в воду и раствор подщелачивают NaOH (50%-ного раствора).
Продукт экстрагируют
дихлорметаном и экстракт сушат, отфильтровывают и выпаривают. Остаток очищают путем колоночной хроматографии (силикагель; CH2Cl2/CH3OH = 95:5). Элюент целевой фракции
выпаривают и остаток превращают в гидрохлорид (соль) в 2-пропаноне путем добавления насыщенного HCl 2-пропанола. Соль отфильтровывают и сушат, получая 46,9 г (69,3%) гидрохлорида (+)-(S)-6-фтор-3,
4-дигидро-N-(фенилметил)-2H-1-бензопиран-2-метанамина. Т. пл. 210,7oC;
(α)= +92,63° (c = 0,1% в метаноле), (промежуточное соединение 7).
Подобным образом также получают:
(S)-3,
4-дигидро-N-(фенилметил)-2H-1-бензопиран-2-метанамин (промежуточное соединение 8);
(-) (R)-6-фтор-3,4-дигидро-N-(фенилметил)-2H-1-бензопиран-2-метанамин- гидрохлорид; т.пл. 210,4oC;
(α)
(R)-3,4-дигидро-N-(фенилметил)-2H-1-бензопиран-2-метанамин (промежуточное соединение 10);
(±)-3,4-дигидро-2-метил-N-(фенилметил)-2H-1-бензопиран-2-метанамин (промежуточное соединение
II).
в) Смесь 28 г промежуточного соединения /10/ и 300 мл метанола гидрируют в присутствии 2 г палладия-на-угле в качестве катализатора (10%-ного). После поглощения рассчитанного количества водорода, катализатор отфильтровывают и фильтрат выпаривают, получая 18,2 г (100%) (-) (R)-3,4-дигидро-2H-1-бензопиран-2-метанамина в виде неочищенного остатка (промежуточное соединение 12).
Подобным образом также получают:
(-)-2,3-дигидро-1,4-бензодиоксин-2-метанамин (промежуточное соединение 13);
(S)-3,4-дигидро-2H-1-бензопиран-2-метанамин
(промежуточное соединение 14);
(±)-6-фтор-3,4-дигидро-2H-1-бензопиран-2-метанамин (промежуточное соединение 15);
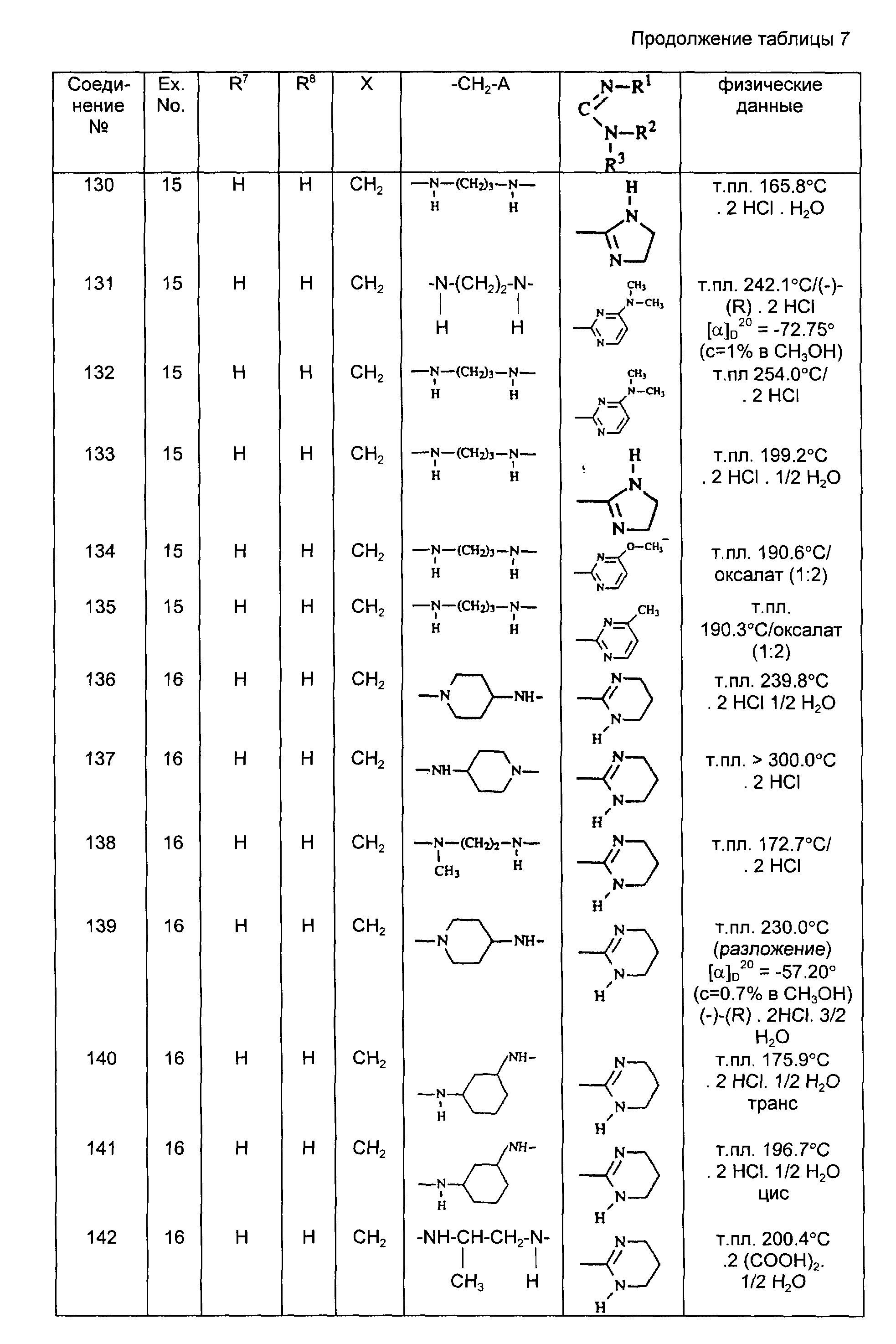
(±)-3,4-дигидро-6-метокси-2H-1-бензопиран-2-метанамин
(промежуточное соединение 16); и
(±)-3,4-дигидро-2H-1-бензопиран-2-метанамин (промежуточное соединение 17).
Пример 3.
а) Смесь 34 г (этил)-4-оксо-1-пиперидин-карбоксилата, 20 г 2-пиримидинамина, 8 капель уксусной кислоты и 103,5 мл толуола перемешивают в течение 28 ч при температуре кипения с обратным холодильником, используя водоотделитель. Реакционную смесь выпаривают, получая 50 г (этил)-4-(2-пиримидинилимино)-1-пиперидинкарбоксилата в виде остатка (промежуточное соединение 18).
б) К перемешиваемой и охлаждаемой (5-10oC) смеси 50 г промежуточного соединения (18) в 76 мл метанола порциями добавляют 7,5 г тетрагидробората натрия. По окончании добавления перемешивание продолжают сначала в течение 45 мин при комнатной температуре и затем в течение 3 ч при температуре кипения с обратным холодильником. После охлаждения реакционную смесь выливают в воду и продукт экстрагируют дважды бензолом. Объединенные экстракты промывают водой, сушат, отфильтровывают и выпаривают. Остаток отверждают в смеси диизопропилового эфира с 2-пропаноном. Продукт отфильтровывают и кристаллизуют из бензола, получая 7 г {этил}-4-(2-пиримидиниламино).-1-пиперидинкарбоксилата (промежуточное соединение 19).
в) Смесь 7 г промежуточного соединения /19/ и 80,5 мл раствора бромоводородной кислоты (48%-ного) перемешивают в течение 2 ч при температуре кипения с обратным холодильником. Реакционную смесь выпаривают и остаток обрабатывают водой. Все подщелачивают с помощью разбавленного раствора гидроксида натрия, при охлаждении на ледяной бане. Продукт экстрагируют дихлорметаном, и экстракт сушат, отфильтровывают и выпаривают. Остаток перемешивают в диизопропиловом эфире. Продукт отфильтровывают и превращают в гидрохлорид (соль) в 2-пропаноле. Соль отфильтровывают и кристаллизуют из этанола, получая 2 г полугидрата (± )-N-(4-пиперидинил)-2-пиримидинамин-дигидрохлорида. Т.пл. 268,5oC (промежуточное соединение 20).
Пример 4.
а) 3 мл N.N.N.-триметилбензолметанаминийгидроскида прикапывают к перемешиваемой смеси 60 г (±)-3,4-дигидро-N-(фенилметил)-2H-1-бензопиран-2-метанамина в 350 мл 2-пропеннитрила. После перемешивания в течение 4 дней при температуре кипения с обратным холодильником, реакционную смесь охлаждают и выливают в диэтиловый эфир. Все отфильтровывают через диатомовую землю и фильтрат выпаривают, получая 21 г (28,6%) (±)-3-[(3, 4-дигидро-2H-1-бензопиран-2-ил)-метил/(фенилметид)-амино] -пропаннитрила в виде неочищенного остатка (промежуточное соединение 21).
б) Смесь 21 г промежуточного соединения /21/ в 250 мл метанола гидрируют в присутствии 5 г никеля Ренея. После поглощения рассчитанного количества водорода, катализатор отфильтровывают и фильтрат выпаривают, получая 20 г (94%) (±)-N-/(3, 4-дигидро-2H-1-бензопиран-2-ил)метил/-N-(фенилметил)-1,3- пропандиамина в виде неочищенного остатка (промежуточное соединение 22).
в) Смесь 10 г промежуточного соединения /22/, 4,2 г 2-хлорпиридина, 6 г карбоната натрия и 100 мл этанола перемешивают и нагревают в течение 18 ч. Реакционную смесь охлаждают и растворитель выпаривают. Остаток обрабатывают водой и продукт экстрагируют диэтиловым эфиром. Экстракт сушат, отфильтровываютивыпаривают,получая11г(88,5%)(±)-N-/(3,4-дигидро-2H-1-бензопиран-2-ил)-метил/N-(фенилметил)-N'- (2-пиримидинил)-1,3-пропандиамина в виде неочищенного остатка (промежуточное соединение 23).
Подобным образом также получают (см. табл.1).

Пример 5.
а) К перемешиваемому раствору 6 г дифенилцианокарбонимидата в 50 мл дихлорметана при комнатной температуре добавляют порциями 2,1 г, пиперидина. Перемешивание продолжают в течение 30 минут при комнатной температуре. Реакционную смесь выпаривают и остаток кристаллизуют из диизопропилового эфира. Кристаллы отфильтровывают и сушат, получая 4,6 г (80%) [фенокси-(1-пиперицинил)-метилен]-цианамида. Т.пл. 85,7oC (промежуточное соединение 32).
Подобным образом также получают: O-фенил-N-циано-N, N-диметилкарбамимидат (промежуточное соединение 33).
б) Смесь 4,0 г (±)-N-/(3,4-дигидро-2H-1-бензопиран-2-ил)-метил/-1,3-пропандиамина, 4,2 г промежуточного соединения (32) и 100 мл метанола перемешивают в течение 3-х дней при комнатной температуре. Реакционную смесь выпаривают и остаток растворяют в дихлорметане. Раствор промывают водным раствором Na2CO3(15%-ным). Органический слой отделяют, сушат, отфильтровывают и выпаривают. Остаток очищают дважды путем колоночной хроматографии (силикагель, CH2Cl2/CH3OH = 95:5). Элюент целевой фракции выпаривают и остаток превращают в оксалат (соль) в 2-пропаноле. Соль отфильтровывают и перекристаллизуют из метанола. Кристаллы отфильтровывают и сушат, получая 1,02 г (12,7%) (±)-N-циано-N-{3-[(3,4-дигидро-2H-1-бензопиран-2-ил)-метил/амино]- пропил}-1-пиперидинкарбоксимидамид-оксалат (1:1). Т.пл. 176,0oC (промежуточное соединение 34).
Подобным образом также получают (см. табл.2).
Пример 6.
Смесь 3,1 г (±)-N'-циано-N-{-[/(3,4-дигидро-2H- 1-бензопиран-2-ил)-метил] -амино} -пропил-N'-этилгуанидина в растворе 10 мл соляной кислоты в 2-пропаноле и 50 мл метанола перемешивают и кипятят с обратным холодильником в течение 30 мин. Растворитель выпаривают. Остаток растворяют в воде и эту смесь подщелачивают с помощью водного (10%-ного) раствора NaOH. Полученную смесь экстрагируют метиленхлоридом. Органический слой отделяют, промывают водой, сушат над сульфатом магния, отфильтровывают и растворитель выпаривают. Остаток очищают путем колоночной хроматографии на силикагеле (элюирующее средство : CH2Cl2/CH3OH / (NH3) = 90:10. Чистые фракции собирают и растворитель выпаривают. Остаток растворяют в 2-пропаноле и превращают в гидрохлорид (соль) (1: 2) с помощью насыщенного HCl 2-пропанола. Соль отфильтровывают и перекристаллизуют из 2-пропанола. Кристаллы отфильтровывают и сушат, получая 2,95 г дигидрохлорида (±)-N'-{[/(3- -[/(3, 4-дигидро-2H-1-бензопиран-2-ил)-метил/- амино]-пропил/-амино]-(этиламино)-метилен}-мочевины.
Т.пл. 182,2oC (промежуточное соединение 51).
Подобным образом также получают дигидрохлорид (±)-N'-{[/(2-[/(3,4-дигидро-2H-1-бензопиран-2-ил)-метил/- амино]-этил/-амино]-(этиламино)-метилен} -мочевины.
Т.пл. 200,2oC (промежуточное соединение 52).
Пример 7.
а) Смесь 12,5 г 3,4-дигидро-N-(фенилметил)-2H-1-бензопиран-2- метанамина, 9 г 4-бромбутаннитрила, 200 мл N,N-диметилформамида и 10 мл N,N-диэтилэтанамина перемешивают в течение 72-х часов при комнатной температуре. Реакционную смесь выпаривают и остаток распределяют между диэтиловым эфиром и водой. Органический слой отделяют, сушат, отфильтровывают и выпаривают, получая 11 г. (68,7%) (±)-4-{ /(-3,4-дигидро-2H-1-бензопиран-2-ил)-метил/(фенилметил)- амино}-бутаннитрила (Промежуточное соединение 53).
б) Смесь 11 г промежуточного соединения (53) и 250 мл тетрагидрофурана гидрируют в присутствии 2 г никеля Ренея. После поглощения рассчитанного количества водорода, катализатор отфильтровывают и фильтрат выпаривают. Остаток распределяют между диэтиловым эфиром и водой. Органический слой отделяют, сушат, отфильтровывают и выпаривают, получая 10 г (90,6%) (±)-N-/(3, 4-дигидро-2H-1-бензопиран-2-ил)-метил/-N-(фенилметил)- 1,4-бутандиамина (промежуточное соединение 54).
в) Смесь 10 г. промежуточного соединения (54), 5,4 г 2-хлорпиримидина, 8 г карбоната натрия и 250 мл этанола перемешивают в течение 18 ч при температуре кипения с обратным холодильником. Реакционную смесь выпаривают и остаток распределяют между диэтиловым эфиром и водой. Органический слой отделяют,сушат,отфильтровываютивыпаривают,получая10,4г.(83,3%)(±)-N-/(3,4-дигидро-2H-1-бензопиран-2-ил)-метил/-N-(фенилметил)- N'-(2-пиримидинил)-1,4-бутандиамина (промежуточное соединение 55).
Подобным образом также получают (см. табл. 3)
Пример 8.
а) Смесь 18 г промежуточного соединения /12/ 60 г 2-пропеннитрила и 400 мл этанола перемешивают в течение 4 ч при температуре кипения с обратным холодильником. Реакционную смесь выпаривают и остаток сушат, получая 20 г (84%) (-) -(R) -3-{/(3, 4-дигидро-2H-1-бензопиран-2-ил)-метил/-амино}-пропаннитрила (промежуточное соединение 67).
б) Смесь 20 г промежуточного соединения /67/ и 300 мл метанола гидрируют в присутствии 5 г никеля Ренея. После поглощения рассчитанного количества водорода, катализатор отфильтровывают и фильтрат выпаривают, получая 21 г (100%) (-) (R)-N-/ (3,4-дигидро-2H-1-бензопиран-2-ил)-метил/-1, 3-пропандиамина и в виде неочищенного остатка (промежуточное соединение 68).
Подобным образом также получают (см. табл.4):

Пример 9.
а) К перемешиваемой смеси 38,6 г N.N-дибензил-N,-(3,4-дигидро-2H-1-бензопиран-2-ил)-1,2-этандиамина, 1,2 г N.-N диметил-4-пиридинамина и 300 мл ацетонитрила, при комнатной температуре, прикапывают раствор 24 г бис(1,1-диметилэтил)-дикарбоната в 50 мл ацетонитрила.
После перемешивания в течение 3 ч, реакционную смесь выпаривают и остаток разбавляют водой. Продукт экстрагируют диэтиловым эфиром и экстракт сушат, фильтруют и выпаривают, получая 50 г (100%) (±)-1, 1-диметилэтил-{2-/бис(фенилметил)-амино/-этил} /(3,4- дигидро-2H-1-бензопиран-2-ил)-метил/-карбамата в виде неочищенного остатка (промежуточное соединение 74).
б) Смесь 14,0 г промежуточного соединения /74/ и 150 мл метанола гидрируют в присутствии 2 г. палладия-на-угле (10%-ного) в качестве катализатора. После поглощения рассчитанного количества водорода, катализатор отфильтровывают и фильтр выпаривают. Остаток очищают путем колоночной хроматографии (силикагель; CH2Cl2/CH3OH (NH3) = 95:5).
Элюент целевой фракции выпаривают, получая 1,22 г. (±)-1,1-диметилэтил-(2-аминоэтил)-/X,4-дигидро-2H-1-бензопиран- 2-ил)-метил/-карбамата (промежуточное соединение 75).
в) К смеси 7,0 г промежуточного соединения /75/ и 100 мл хлороформа добавляют 3,3 г (диметил) цианокарбонимидодитионата. После перемешивания в течение 48 часов при температуре кипения с обратным холодильником, реакционную смесь выпаривают. Остаток очищают путем колоночной хроматографии (силикагель, CH2Cl2/CH3OH=99:1). Элюент целевой фракции выпаривают, получая 9,09 г. (96, 5%) (±)-1,1-диметилэтил-{ 2-[/(цианоимино)-(метилтио)-метил/- амино]-этил}-/(3,4-дигидро-2H-1-бензопиран-2-ил)-метил/-карбамата (промежуточное соединение 76).
г) К смеси 18 г промежуточного соединения /76/ и 150 мл этанола добавляют 40 мл водного (70%-ного) раствора этанамина. После перемешивания в течение 16 часов при температуре кипения с обратным холодильником, реакционную смесь выпаривают и остаток растворяют в дихлорметане. Раствор промывают водой, сушат, фильтруют и выпаривают. Остаток очищают путем колоночной хроматографии (силикагель, CH2 Cl2/CH3OH = 95:5). Элюент целевой фракции выпаривают и остаток осаждают из диизопропилового эфира, получая 13,9 г. (77,2%) (±)-1,1-диметилэтил-{ 2-[/цианоимино)(этиламино)-метил/-амино] этил}-/3,4-дигидро-2H-1-бензопиран-2-ил)-метил/-карбамата. Т.пл. 115,4oC (промежуточное соединение 77).
д) Смесь 6 г промежуточного соединения /77/, 20 мл насыщенного HCl 2-пропанола и 200 мл метанола перемешивают в течение 30 мин при температуре кипения с обратным холодильником. Реакционную смесь выпаривают и остаток кристаллизуют из метанола. Продукт отфильтровывают и промывают метанолом и диизопропиловым эфиром, получая 4,3 г. (73%) дигидрохлорида (±)-N-{[/(3, 4- 2-дигидро-2H-1-бензопиран-2-ил)-метил/-амино] -этил/- амино] -(этиламино)-метилен}мочевины. Т.пл. 200,2oC (промежуточное соединение 78).
Б. Получение целевых
продуктов
Пример 10. Смесь 7,4 г N1-/(3,4-дигидро-2H-1-бензопиран-2-ил)-метил/-1,2-этандиамина, 4,1 г хлорпиримидина, 4,2 г карбоната натрия и 50,6 мл этанола перемешивают в
течение 4 ч при температуре кипения с обратным холодильником. Реакционную смесь выпаривают. Остаток очищают путем колоночной хроматографии (силикагель, CHCl3/СH3OH=90:10).
Элюент целевой фракции выпаривают и остаток превращают в гидрохлорид (соль) в 2-пропаноле. Соль отфильтровывают и сушат в вакууме, получая 4,4 г. (33,3%) полугидрата (±)-N-/3, 4-дигидро-2H-1-бензопиран-2-ил)метил/-N'-(2- пиримидинил)-1,2-этандиамин-дигидрохлорида. Т. пл. 192,7oC (соединение 1).
Пример 11. Смесь 8,5 г 3,
4-дигидро-2H-бензопиран-2-карбонил-хлорида, 30 мл N, N-диметилацетамида и 100 мл диизопропилового эфира гидрируют в присутствии 2 г палладия-на-угле (10%-ного) в качестве катализатора и 2 мл (4%-ного)
раствора тиофена в метаноле. После поглощения рассчитанного количества водорода, катализатор отфильтровывают и фильтрат добавляют к смеси 5 г (±)-N1-(2-пиримидинил)-1,2-пропандиамина
и 150 мл метанола. Все гидрируют в присутствии 2 г палладия-на-угле (10%-ного) в качестве катализатора и 5 г ацетата калия. После поглощения рассчитанного количества водорода, катализатор
отфильтровывают и фильтрат выпаривают. Остаток растворяют в диэтиловом эфире, промывают водным раствором NaOH, сушат, фильтруют и выпаривают. Остаток превращают в оксалат (соль) (1:2) в
2-пропаноле.
Соль отфильтровывают и сушат в вакууме при 60oC, получая 8,7 г (55,1%) (±)-N1-/3,4-дигидро-2H-1-бензопиран-2-ил)метил/- N2-(2-пиримидинил)-1,
2-пропандиамин-оксалата (1:2). Т.пл. 150,2oC (соединение 119)
Пример 12. Смесь 4,8 г 6-бром-3,4-дигидро-2H-1-бензопиран-2- карбоксальдегида и 3,1 г. N-2-пиримидинил-1,
3-пропандиамина в 200 мл метанола гидрируют при использовании 2 г. платины на активированном угле (5%) в качестве катализатора в присутствии 2 мл раствора тиофена в метаноле (4%-ного).
После прекращения поглощения H2, катализатор отфильтровывают. Фильтрат выпаривают. Остаток растворяют в 2-пропаноле и превращают в соль щавелевой кислоты (1: 2). Соль отфильтровывают и перекристаллизуют из смеси этанола с водой. Кристаллы отфильтровывают и сушат, получая 2,7 г. (18,8%) (±)-N-/(6-бром-3,4-дигидро-2H-1-бензопиран-2-ил)-метил/-N'-(2- пиримидинил)-1, 3-пропандиамин-оксалата (1:2). Т.пл. 215,3oC (соединение 20).
Пример 13. Смесь 3 г N-2-пиримидинил-1,3-пропандиамина в 150 мл метанола и 10 мл раствора хлороводорода в 2-пропаноле гидрируют при использовании 2 г палладия на активном угле (5%) в качестве катализатора. После прекращения поглощения H2, катализатор отфильтровывают. К фильтрату добавляют раствор 4,8 г 6-бром-3,4-дигидро-2H-1-бензопиран-2-карбоксальдегида и 100 мл метанола. Добавляют 10 г ацетата калия и полученную смесь гидрируют при использовании 2 г платины на активном угле (5%) в качестве катализатора, в присутствии 2 мл раствора тиофена в метаноле (4%-ного). После прекращения поглощения H2, катализатор отфильтровывают. Растворитель выпаривают и остаток растворяют в смеси H2O/CH2Cl2. Этот раствор подщелачивают с помощью NaOH. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают. Остаток растворяют в 2-пропаноне и превращают в соль щавелевой кислоты (1:2). Соль отфильтровывают и высушивают. Полученную фракцию перекристаллизуют из смеси этанола с водой. Кристаллы отфильтровывают и высушивают, получая 3,5 г (31, 2%) (±)-N-/(6-бром-3,4-дигидро-2H-1-бензопиран-2-ил)-метил-/N'- (1,4,5,6-тетрагидро-2-пиримидинил)-1,3-пропандиаминоксалата (1: 2). Т. пл. 204,8oC (соединение 56).
Пример 14. Смесь 7,9 г {3,4-дигидро-2H-1-бензопиран-2-метил}- 4-метилбензолсульфоната (сложный эфир), 4,5 г N-(4-пиперидинил)-2-пиримидинамина, 5,3 г карбоната натрия и 100 мл 4-метил-2-пентанона перемешивают в течение ночи при температуре кипения с обратным холодильником. Реакционную смесь выпаривают и остаток разбавляют водой. Продукт экстрагируют дихлорметаном и экстракт высушивают, фильтруют и выпаривают. Остаток очищают путем колоночной хроматографии (силикагель, CH2Cl2/100%. Элюент целевой фракции выпаривают и остаток кристаллизуют из ацетонитрила. Продукт отфильтровывают и высушивают, получая 28 г. (98,8%) (±)-N{1-/(3,4-дигидро-2H-1-бензопиран-2-ил)-метил/ -4-пиперидинил}-2-пиримидинамина. Т.пл. 141,9oC (соединение 128).
Пример 15. Смесь 8,4 г (-)-(R)-N-(6-фтор-3,4-дигидро-2H-1- бензопиран-2-ил)-метил-N-фенилметил-N'-(2-пиримидинил)-1,2-этандиамина и 150 м метанола гидрируют в присутствии 2 г палладия-на-угле (10%) в качестве катализатора. После поглощения рассчитанного количества водорода катализатор отфильтровывают и фильтрат выпаривают. Остаток очищают путем колоночной хроматографии (силикагель, CH2Cl2/CH3OH = 90:10).
Элюент целевой фракции выпаривают и остаток кристаллизуют из диизопропилового эфира. Продукт отфильтровывают и сушат, получая 3,5 г (55,1%) (-)-(R)-N-/(6-фтор-3,4-дигидро-2H-1-бензопиран-2-ил)метил/- N'- -(2-пиримидинил)-1,2-этандиамина. Т.пл. 103,2oC.
(α)
Пример 16. Смесь 3,6 г полугидрата
(-)-(R)-N-/(3,4-дигидро-2H-1-бензопиран-2-ил)метил/-N'-(2- пиримидинил)-1,3-пропандиамин-дигидрохлорида в 150 мл метанола и 20 мл насыщенного HCl 2-пропанола гидрируют в присутствии 1,5 г
палладия-на-угле (2%) в качестве катализатора. После поглощения рассчитанного количества водорода катализатор отфильтровывают и фильтрат выпаривают. Продукт кристаллизуют из ацетонитрила,
отфильтровывают и высушивают, получая 2,7 г (74,0%) полугидрата (-)-(R)-N-/(3,4-дигидро-2H-1-бензопиран-2-ил)метил/-N'-(1,4,5,6- тетрагидро-2-пиримидинил)-1,3-пропандиамин-дигидрохлорида. Т. пл. 200,
2oC. (α)
Пример 17. Смесь 7,8 г N-(3,4-дигидро-2H-1-бензопиран-2-ил)- метил-N-фенилметил-N'-(2-пиримидинил)-1,3-пропандиамина, 200 мл метанола и 10 мл насыщенного HCl 2-пропанола гидрируют в присутствии 2 г палладия-на-угле (5%) в качестве катализатора. После поглощения рассчитанного количества водорода, катализатор отфильтровывают и фильтрат выпаривают. Остаток превращают в дигидрохлорид (соль) в 2-пропаноле путем добавления насыщенного хлороводородом 2-пропанола. Соль отфильтровывают и высушивают, получая 2,9 г (38,0%) (±)-N-/ (3,4-дигидро-2H-1-бензопиран-2-ил)-метил/-N'-(1,4, 5,6-тетрагидро-2 -пиримидинил)-1,3-пропандиамин-дигидрохлорида. Т.пл. 227,0oC (соединение 95).
Пример 18. Раствор 6,9 г (±)-N-/(3, 4-дигидро-6-метокси-2H-1-бензопиран-2-ил)-метил/ -N'-(2-пиримидинил)-1,3-пропандиамина в 50 мл дихлорметана прикапывают к смеси 150 мл раствора трибромида бора в дихлорметане (1 М) и 250 мл дихлорметане, перемешивают в атмосфере азота при 0oC.
Реакционную смесь перемешивают в течение 2 ч при комнатной температуре. Полученный осадок отфильтровывают и перемешивают в смеси 150 г льда, 42 г хлорида натрия и 175 мл NH4OH. Добавляют дихлорметан и все отфильтровывают через диатомовую землю. Слои разделяют и водный слой экстрагируют дихлорметаном. Объединенные органические слои сушат, фильтруют и выпаривают. Остаток очищают путем колоночной хроматографии (силикагель, CH2Cl2/CH3OH(NH3) = 95:5). Элюент целевой фракции выпаривают и остаток превращают в соль щавелевой кислоты в 2-пропаноне. Соль отфильтровывают и высушивают в вакууме при 60oC, получая 3,0 г (28,9%) (± )-3,4-дигидро-2-{ [/3-(2-пиримидиниламино)пропил/-амино} -2H-1-бензопиран-6-ол-оксалата (1: 2). Т. пл. 170,0oC (соединение 49).
Пример19. Смесь 2,6 г (± )-N''-циано-N-{3-[/(3,4-дигидро- 2H-1-бензопиран-2-ил)-метил/амино]пропил}-N-(1-метилэтил)-гуанидина в 20 мл 6 н. соляной кислоты перемешивают в течение 2 ч при температуре кипения с обратным холодильником. Реакционную смесь выпаривают и остаток растворяют в 10 мл метанола. Полученный раствор фильтруют и фильтрат выпаривают. Маслянистый остаток растворяют в 10 мл этанола. Смесь отфильтровывают и фильтрат выпаривают, получая 1,32 г (44,4%) дигидрохлорида (±)-N-{3-[/(3,4-дигидро-2H-1-бензопиран-2-ил)-метил/-амино] -пропил}-N-(1-метилэтил - гуанидина. Т.пл. 97,5oC (соединение 150).
Пример 20. 2,3 г (±)-N-/(6-фтор-3,4-дигидро-2H-1-бензопиран-2-ил)метил/ -1,3-пропандиамина и 1,6 г монохлорида йода растворяют в 50 мл уксусной кислоты. Полученный раствор перемешивают в течение ночи при кипячении с обратным холодильником. Растворитель выпаривают. Остаток очищают путем колоночной хроматографии на силикагеле (элюирующее средство: CH2Cl2/CH3OH = 99: 1 до 95:5). Собирают все целевые фракции и растворитель выпаривают. Остаток (50% чистоты) перекристаллизовывают из этанола. Кристаллы отфильтровывают и высушивают, получая 0,650 г (20,1%) моногидрохлорида (+)-N-/ (6-фтор-3,4-дигидро-2H-1-бензопиран-2-ил)-метил/-N'-(5-йод- 2-пиримидинил)-1,3-пропандиамина. Т.пл. 228,2oC (соединение 155).
Пример 21. Смесь 0,250 г палладия-на-активном угле, 10%-ного, в 50 мл метанола перемешивают в вакууме и продувают водородом. Добавляют 5 мл насыщенного HCl 2-пропанола. Затем прикапывают раствор 0,5 г полугидрата дигидрохлорида (±)-3,4-дигидро-2- {[/3-(2-пиримидиниламино)-пропил,-амино]-метил} -2H-1- бензопиран-6-карбонитрила в 5 мл метанола. Реакционную смесь гидрируют при перемешивании в течение 2 ч. После прекращения поглощения водорода, смесь отфильтровывают через дикалит. Остаток на фильтрате промывают с помощью метанола. Фильтрат выпаривают и остаток перемешивают в 10 мл CH3OH, отфильтровывают через складчатый бумажный фильтр и промывают с помощью 5 мл метанола. Фильтрат выпаривают. Остаток перемешивают в 10 мл, 2-пропанола, затем фильтруют через стеклянный фильтр. Остаток на фильтре высушивают, получая 0,427 г (82,2%). Т.пл. 240,1oC (соединение 102).
Пример 22. К 4,3 г (± )-метил-8-этинил-6-фтор-3,4-дигидро-2H-1-бензопиран-2-карбоксилата добавляют 50 мл толуола, затем выпаривают. Остаток растворяют в 100 мл толуола и этот раствор охлаждают до -70oC. Прикапывают раствор 25 мл гидро-бис-(2-метил-пропил)-алюминийгидрата в толуоле (20%). Реакционную смесь перемешивают в течение 1 ч при -70oC. Прикапывают 10 мл метанола и оставляют температуру повышаться до комнатной температуры. Реакционную смесь выливают в 150 мл воды и экстрагируют диэтиловым эфиром. Отделенный органический слой сушат, фильтруют и растворитель выпаривают. Остаток растворяют в метаноле и добавляют 1,95 г N-/2-пиримидинил/-1,3-пропандиамина.
Эту смесь гидрируют при комнатной температуре при использовании 1 г палладия-на-активном угле (10%) в качестве катализатора в присутствии 4 мл раствора тиофена (4%-ного). После прекращения поглощения водорода, катализатор отфильтровывают. Фильтрат выпаривают. Остаток очищают путем колоночной хроматографии на силикагеле /элюирующее средство : CH2Cl2/ CH3OH = 95:5 до 90:10/. Чистые фракции собирают и растворитель выпаривают. Остаток растворяют в 80 мл - 2-пропанола и превращают в соль щавелевой кислоты /1:1/. Соль отфильтровывают, промывают 2-пропанолом и диизобутиловым эфиром, затем сушат, получая 4,3 г /63,1%/ оксалата /1:2/ /± / -N-[/8-этил-6-фтор-3,4-дигидро-2H-1-бензопиран-2-ил/-метил] -N'-2- пиримидинил-1,3-пропандиамина. T. пл. 210,8oC (соединение 54).
Все перечисленные в таблицах 5-10 соединения получают согласно описанным в примерах 10-22 способам получения.
B. Фармакологический пример.
Пример 23. Извлеченные у поросят, анестезированных с помощью пентобарбитала натрия, сегменты основных артерий помещают в ванны для органов для регистрации изометрического растяжения. Препараты погружают в раствор Krebs-Henseleit. Раствор выдерживают при 37oC и насыщают смесью 95% O2 - 5% CO2. Препараты растягивают до тех пор, пока не достигнут стабильного основного растяжения 2 г.
Препараты подвергают сужению с помощью серотонина /3•10-7М/.
Реакцию на добавление серотонина измеряют и затем серотонин вымывают. Эту процедуру повторяют до тех пор, пока не достигнут стабильных реакций.
После этого в ванну для органа вводят испытуемое соединение и измеряют сужение препарата. Эту реакцию сужения выражают как процент от реакции на серотонин, предварительно измеренную.
ED50 - Значение (молярная концентрация) определяют как концентрацию, при которой испытуемое соединение вызывает 50% суживающей реакции, достигаемой с серотонином. Вышеуказанные ED50 - значения оценивают из экспериментов на трех различных препаратах.
В табл. 6 представлены ED50 - значения для соединений формулы /1/.
1. Примеры композиций
"Активный ингредиент" /А.И./ относится к соединению формулы /1/, его фармацевтически приемлемой соли присоединения кислоты или к
его стереохимически изомерной форме, а именно А. И. представляет собой соединение 62 (альнидитан).
Пример 24. Капли для введения перорально.
500 г А. И. растворяют в 0,5 л 2-гидроксипропановой кислот и 1,5 л полиэтиленгликоля при 60 - 80oC. После охлаждения до 30 - 40oC добавляют 35 л полиэтиленгликоля и смесь хорошо перемешивают. Затем добавляют раствор 1750 г натрий-сахарина в 2,5 л очищенной воды и при перемешивании добавляют 2,5 л придающего вкус какао и полиэтиленгликоль до общего объема 50 л, получая раствор для орального введения в виде капель, содержащий 10 мг/мл А.И. Полученный раствор заливают в пригодные емкости.
Пример 25. Раствор для введения перорально.
9 г {Метил}-4-гидроксибензоата и 1 г {пропил}-4-гидроксибензоата растворяют в 4 л кипящей очищенной воды. В 3 л этого раствора растворяют сначала 10 г 2,3-дигидрокси-янтарной кислоты и затем 20 г А.И. Последний раствор объединяют с остальной частью первого раствора и туда же добавляют 12 л 1,2,3-пропантриола и 3 л 70%-ного раствора сорбитола. 40 г натрий-сахарина растворяют в 0,5 л воды и добавляют 2 мл малиновой и 2 мл крыжовниковой эссенции. Последний раствор объединяют с первым раствором, добавляют воду до общего объема 20 л, получая оральновводимый раствор, содержащий 5 мг активного ингредиента на полную чайную ложку (5 мл). Полученный раствор заливают в пригодные емкости.
Пример 26. Капсулы.
20 г А.И., 6 г. лаурилсульфата натрия, 56 г крахмала, 56 г лактозы, 0,8 г коллоидального диоксида кремния и 1,2 г стеарата магния интенсивно смешивают друг с другом. Потом полученную смесь вносят в 1000 пригодных твердых желатиновых капсул, содержащих каждая 20 мг активного ингредиента.
Пример 27. Покрытые пленкой таблетки.
Приготовление сердцевины таблетки.
Смесь 100 г А.И., 570 г лактозы и 200 г крахмала хорошо перемешивают и затем увлажняют раствором 5 г додецилсульфата натрия и 10 г поливинилпирролидона примерно в 200 мл воды. Влажную порошкообразную смесь просеивают, высушивают и снова просеивают. Затем добавляют к ней 100 г микрокристаллической целлюлозы и 15 г гидрированного растительного масла. Все хорошо смешивают и прессуют в таблетки, получая 10000 таблеток, причем каждая содержит 10 мг активного ингредиента.
Покрытие
К раствору 10 г метилцеллюлозы в 75 мл денатурированного этанола добавляют раствор 5 г этилцеллюлозы в 150 мл дихлорметана.
После этого добавляют 75 мл дихлорметана и 2,5 мл 1,2,3 - пропантриола. Расплавляют 10 г полиэтиленгликоля и растворяют в 75 мл дихлорметана. Последний раствор добавляют к первому и затем добавляют 2,
5 г октадеканоата, 5 г поливинилпирролидона и 30 мл концентрированной суспензии пигмента и все гомогенизируют. Сердцевины таблеток покрывают с помощью этой полученной смеси в аппарате для покрытия.
Пример 28. Раствор для инъекции.
1,8 г (Метил)- 4 -гидроксибензоата и 0,2 г (пропил)-4-гидроксибензоата растворяют примерно в 0,5 л кипящей воды для инъекции. После охлаждения примерно до 50oC, все время перемешивая, добавляют 4 г молочной кислоты, 0,05 г пропиленгликоля и 4 г А.И. Раствор охлаждают до комнатной температуры и доливают дополнительно водой для инъекции до общего объема 1 л, получая раствор, содержащий 4 мг/мл А.И. Раствор стерилизуют путем фильтрации (U.S. P. XVII, с. 811) и разливают с стерильные емкости.
Пример 29. Свечи.
3 г А.И. растворяют в растворе из 3 г 2,3 - дигидрокси-янтарной кислоты в 25 мл полиэтиленгликоля 400. 12 г поверхностно-активного вещества (SPAN®) и триглицериды /Witepsol 555® / до общего количества 300 г расплавляют вместе. Последнюю смесь хорошо перемешивают с первым раствором. Эту полученную смесь выливают в формы при 37 - 38oC для получения 100 свечей, причем каждая содержит 30 мг/мл А.И.
Пример 30. Раствор для инъекции.
60 г А. И. и 12 г бензильного спирта хорошо смешивают и добавляют кунжутное масло до общего объема 1 л, получая раствор, содержащий 60 мг/мл А.И. Раствор стерилизуют и разливают в стерильные емкости.
Реферат
Изобретение
относится к сосудосуживающим /(бензодиоксан, бензофуран и бензопиран)-алкиламино/-алкил-замещенным гуанидинам формулы I, их фармацевтически приемлемым солям, или их стереохимическим изомерам, где X =
O, CH2 или прямая связь; R1 = H, C1-C4 алкил, R2 = H, C1-C6 алкил, C3-C6 алкенил, C3-C6 алкинил, R3 = H, C1-C4 алкил; или R2 и R1 взятые вместе, могут образовывать двухвалентный радикал формулы -/CH2/m-,
где m = 4 или 5; или R1 и R2, взятые вместе, могут образовывать двухвалентный радикал формулы -CH=CH- или формулы -/CH2/n-, где n = 2, 3 или 4; или R3 может обозначать связь, когда R1 и R2, взятые вместе, образуют двухвалентный радикал формулы -CH=CH-CH= -, -CH= CH-N= или -CH=N-CH=; где один или два водородных атома
замещены атомом галогена, C1-C6 алкоксигруппой, C1-C6 алкилом, CN, NH, моно- или ди(C1-C6 алкил) аминогруппой, аминокарбонилом, C1-C6 алкиламинокарбониламиногруппой, R4-H или C1-C6-алкил; Alk1 обозначает двухвалентный C1-C3-алкандиильный радикал,
A обозначает двухвалетный радикал формулы /a/, /b/, /c/, /d/, /e/, где каждый R5=H или C1-C4-алкил, где каждый R6=H или C1-C4-алкил,
Alk2 обозначает C2-C15-алкандиил или C5-C7-циклоалкандиил, и каждый "р" обозначает 0, 1, 2, R7 и R8 каждый независимо
является H, атомом галогена, C1-C6 алкилом, гидроксилом, C1-C6 алкилоксикарбонилом, C1-C6 алкоксигруппой, цианогруппой, амино C1-C6 алкилом, карбоксилом, нитро- или аминогруппой, аминокарбонилом, C1-C6 алкилкарбониламиногруппой или моно- или ди-(C1-C6
)алкиламиногруппой, при условии, что исключается /2-/ (2,3-дигидро-1,4-бензодиоксин-2-ил)-метил/-амино/-этил-гуанидин. Фармацевтические препараты, которые пригодны в качестве сосудосуживающих средств.
Описываются композиции, содержащие вышеупомянутые производные гуанидина в качестве активных ингредиентов, способы получения вышеуказанных производных гуанидина и новый П-цианогуанидин; промежуточные
соединения;






Формула

где X - O, CH или прямая связь;
R1 - H или C1-6 алкил;
R2 - H, C1-6 алкил, C3-6 алкенил или C3-6 алкинил;
R3 - H или C1-6 алкил; или
R2 и R3 - взятые вместе двухвалентный радикал (-CH2 -)m, где m = 4 или 5; или
R1 и R2 - вместе взятые двухвалентный радикал -CH=CH- -(CH2)n-, где n = 2, 3, 4; или R3 может быть связью, когда R1 и R2 взятые вместе образуют двухвалентный радикал -CH= CH-CH= , -CH=CH-N=, -CH=N-CH=, где один или два водородных атома замещены атомом галогена, C1-6 алкоксигруппой, C1-6 алкилом, CN, MH, моно- или ди(C1-6 алкил) аминогруппой, аминокарбонилом, C1-6 алкиламинокарбониламиногруппой;
R4 - H или C1-6 алкил;
Alk1 - бивалентный C1-3 алкандиил;
A - двухвалентный радикал формулы:
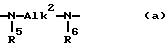



или

где R5 каждый H или C1-4 алкил;
R6 каждый H или C1-4 алкил;
Alk2 - C2-C15 алкандиил или C5-C7 циклоалкандиил;
p каждый = 0, 1, 2;
R7 и R8 каждый независимо является H, атомом галогена, C1-6-алкилом, гидроксилом, C1-6-алкоксигруппой, цианогруппой, амино C1-6-алкилом, карбоксилом, C1-C6 алкилоксикарбонилом, нитро- или аминогруппой, аминокарбонилом, C1-C6 алкилоксикарбониламиногруппой или моно- или ди(C1-C6) алкиламиногруппой, при условии, что исключен /2-/(2,3-дигидро-1, 4-бензодиоксин-2-ил) метил-(амино)этилгуанидин, или их фармацевтически приемлемые соли, или стереохимические изомеры.

где X, R4, R7, R8, A и Alk1 имеет вышеуказанные значения,
подвергают N-алкилированию действием реагента формулы III

где R1, R2, R3 имеет указанные в п.1 значения;
W1 - реакционноспособная удаляемая группа,
и при необходимости соединение формулы I-c:
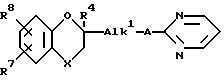
где X, R4, R7, R8, A и Alk1 имеют указанные в п.1 значения,
гидрируют с получением соединения формулы I-a

где X, R4, R7, R8, A и Alk1 имеют указанные в п.1 значения,
и при необходимости соединение формулы I переводят в фармацевтически приемлемую соль, или, наоборот, соль переводят в основание действием щелочи и/или получают его стереохимически изомерные формы.
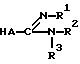
где A, R1, R2 и R3 имеют указанные в п.1 значения,
восстановительно N-алкилируют с помощью соответствующего альдегида формулы V
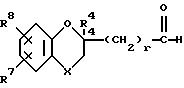
где X, R4, R7 и R8 имеют указанные в п.1 значения;
r - целое число, равное 0, 1 или 2.

где R1, R2, R3 и A имеют указанные в п.1 значения,
N - алкилируют с помощью соединения формулы VII

где X, R4, R7, R8 и Alk1 имеют указанные в п.1 значения;
W2 - реакционноспособная удаляемая группа.

где X, R1, R2, R3, R4, R6, R8, R7, Alk1 и Alk2 имеют указанные в п.1 значения,
отличающийся тем, что дебензилируют соединение формулы VIII
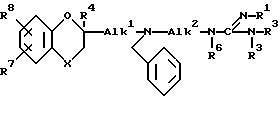
где X, R1, R2, R3, R4, R6, Alk1 и Alk2 имеют указанные в п.1 значения.
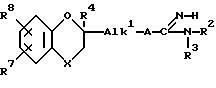
где X, R2, R3, R4, R7, R8, Alk1 и A имеют указанные в п.1 значения, гидролизом соединения формулы IX-a:

где X, R2, R3, R4, R7, R8 и Alk1 имеют указанные в п.1 значения.

или его фармацевтически приемлемые соли, или его стереохимически изомерные формы,
где X - O, CH2 или прямую связь;
R2 - водород, C1-C6-алкил, C3-C6-алкенил или C3-C6-алкинил;
R3 - водород или C1-C6-алкил; или
R2 и R3 - вместе могут образовывать двухвалентный радикал формулы -(CH2)m-, где m = 4 или 5;
R4 - водород или C1-C6-алкил;
Alk1 - двухвалентный C1-C3-алкандиильный радикал;
A - двухвалентный радикал формулы


где R5 - каждый водород или C1-C4-алкил;
где R6 - каждый водород или C1-C4-алкил;
Alk2 - C2-C15-алкандиил или C5-C7-циклоалкандиил;
p каждый = 0, 1 или 2;
R7 и R8 - каждый, независимо друг от друга, водород или галоген, C1-C6-алкил, гидроксигруппа, C1-C6-алкилокси-, цианогруппа, амино-(C1-C6)алкил, карбоксил, (C1-C6-алкил)-оксикарбонил, нитро-, аминогруппа, аминокарбонил, (C1-C6-алкил)-карбониламиногруппа или моно- или ди-(C1-C6-алкил)-аминогруппа,
в качестве промежуточного продукта для получения соединений формулы I-b.

Комментарии